Caderno de Respostas
|
|
|
- Olívia di Castro Beppler
- 6 Há anos
- Visualizações:
Transcrição
1 PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA OBQ-2017 FASE VI Caderno de Respostas Programa Nacional Olimpíadas de Química 1
2 Problema 1 12% do total Total Calcule os valores de r Gº, r Hº e r Sº para essa reação a 60 ºC. Cálculos: Quem calculou ΔH partindo do valor de ΔG à temperatura de 298,15 K fez uso de aproximações que levam a um valor diferente de ΔH. Nesse caso será considerado 2/3 do valor atribuído ao cálculo de ΔH no item (2/3 de 15 pontos, que equivale a 10 pontos). r Gº = 82,93 kj mol -1 r Hº = 50,69 kj mol -1 r Sº = -96,77 J K -1 mol -1 Programa Nacional Olimpíadas de Química 2
3 Calcule o ph da água líquida pura a 60 ºC. Cálculos: ph = 6, Sabendo que, a 25 ºC, k 1 = 1, dm 3 mol -1 s -1 e, determine o valor de k 2. Cálculos: k 2 = 2,5 x 10-5 s -1 Programa Nacional Olimpíadas de Química 3
4 Determine a expressão para variação de x com o tempo (dx/dt) em função de x e das concentrações das espécies no novo equilíbrio. Considere que o termo em x 2 é desprezível. Cálculos: dx/dt = [ ] [ ] Programa Nacional Olimpíadas de Química 4
5 O tempo de relaxação é definido como o tempo que o desvio da concentração de uma espécie em relação ao novo equilíbrio (x) leva para cair até 1/e do seu valor inicial. Determine o tempo de relaxação para a reação de neutralização. Cálculos: Diferentemente do item que pede a expressão para dx/dt, o item pede o tempo de relaxação, não a expressão. No enunciado da questão fala-se que o aumento de temperatura é tipicamente de 3 K a 10 K, o que não acarreta mudanças significativas nas constantes de velocidade e de equilíbrio. Portanto, as constantes a 25 ºC deveriam ter sido usadas, conforme foi trabalhado no problema preparatório e durante o curso. O estudante que chegou à expressão, mas não calculou o tempo de relaxação fará jus a 60 % do valor do item. Itens com erro de cálculo ou sem mudanças de base nos logaritmos terão como nota metade do valor do item. Itens sem os cálculos terão valor zerado. Programa Nacional Olimpíadas de Química 5
6 Problema 2 13% do total Total Para cada um dos semicondutores representados no diagrama acima, calcule o comprimento de onda máximo da radiação necessária para promover a excitação de elétrons entre os níveis HOMO/LUMO. TiO 2 E g = 3,2 ev E = hc/ = hc/e = ( 6, , ) / (3,2 1, ) = 3, m (387 nm) BiFeO 3 E g = 2,19 ev E = hc/ = hc/e = ( 6, , ) / (2,19 1, ) = 5, m (566 nm) Considere agora duas células fotoeletroquímicas para redução de metais, construídas como explicado acima e baseadas em eletrodos de TiO 2 ou BiFeO 3. Qual(is) célula(s) pode(m) operar através do uso de radiação ultravioleta? Qual(is) célula(s) pode(m) operar através do uso de radiação na região do visível ( nm)? Radiação Ultravioleta: Ambas as células, de TiO 2 e BiFeO 3. Os dois materiais podem ser excitados através do uso de radiação ultravioleta ( < 387 nm). Radiação na região do visível: Apenas a célula de BiFeO 3. Radiação de nm não possui energia suficiente para excitar elétrons entre os estados HOMO/LUMO do TiO 2, que necessita de maior energia e radiação de comprimento de onda máximo de 387 nm Considere que uma célula formada por TiO 2 no ânodo é submetida à radiação ultravioleta. Quais metais você espera que sejam reduzidos no cátodo? Chumbo e prata. Elétrons do HOMO são excitados para o LUMO, onde apresentam uma energia (potencial) de -0,3 ev. Eles elétrons podem ser transferidos para as espécies Pb 2+ e Ag +, que se encontram em níveis de energia inferiores (VEJA FIGURA ABAIXO) Considere que a célula formada por TiO 2 no cátodo é submetida à radiação na região do visível. Quais metais você espera que sejam reduzidos no cátodo? Nenhum. Não há excitação de elétrons do HOMO para o LUMO Considere que uma célula formada por BiFeO 3 no ânodo é submetida à radiação ultravioleta. Quais metais você espera que sejam reduzidos no cátodo? Apenas a prata. Radiação ultravioleta permite a excitação de elétrons do HOMO para o LUMO. Estes elétrons apresentam uma energia de +0,40 V e podem ser transferidos para os íons Ag + em solução, que se encontram em um nível de energia inferior (VEJA FIGURA ABAIXO). Programa Nacional Olimpíadas de Química 6
7 Considere que a célula formada por BiFeO 3 no ânodo é submetida à radiação na região do visível. Quais metais você espera que sejam reduzidos no cátodo? Apenas a prata. Radiação na região do visível possui energia suficiente para excitar os elétrons do HOMO para o LUMO. Estes elétrons apresentam uma energia de +0,40 V e podem ser transferidos para os íons Ag + em solução, que se encontram em um nível de energia inferior (VEJA FIGURA ABAIXO). Programa Nacional Olimpíadas de Química 7
8 Problema 3 12% do total Total Associe cada espécie química à sua respectiva representação (I, II, III, IV) no diagrama logaritmo. I. OH - II. ClO - III. HClO IV. H O ph da solução aquosa 0,01 mol L -1 de NaClO e as concentrações (mol L -1 ) de todas as espécies presentes. Pelo diagrama quando [HClO] = [OH - ] ph = 9,8. Outra resposta possível ph = 9,7 Concentrações das espécies no ph de 9,8 [HClO] = [OH - ] = 10-4,2 = 6, mol L -1 [H + ] = 1, mol L -1 [ClO - ] = mol L O ph ótimo para se obter a máxima capacidade de desinfecção. Pelo diagrama quando [HClO] = [ClO - ] ph = 7, A partir do balanço de cargas e balanço de massas calcule ph da solução de 0,01 mol L -1 de NaClO. Demonstre a validade da(s) aproximação(ões) efetuada(s), e considere erro máximo de 5%. NaClO = ClO - + Na + ClO - + H 2 O = HClO + OH - (K w / K a ) = [HClO]. [OH - ] / [ClO - ] H 2 O = H + + OH - K w = [OH - ].[H + ] Balanço de massas: 0,01 = [ClO - ] + [HClO] [Na + ] = 0,01 Balanço de cargas: [ClO - ] + [OH - ] = [H + ] + [Na + ] Combinando balanço de massas com balanço de cargas tem-se: [OH - ] = [H + ] + [HClO] Aproximação 1: em solução com ph > 7 [H + ] << [OH - ] A equação acima se reduz a: [OH - ] = [HClO] Aproximação 2: [HClO] << [ClO - ] Programa Nacional Olimpíadas de Química 8
9 O balanço de massas se reduz a: 0,01 = [ClO - ] Substituindo na expressão do K w /K a tem-se: (K w / K a ) = [OH - ] 2 / 0,01 [OH - ] = ( ,01 / ) 1/2 = 5, mol L -1 [H + ] = / 5, = 1, mol L -1 ph = 9,76 Teste para a aproximação 1: [H + ] / [OH - ] = 1, / 5, = => % portanto aproximação 1 é Válida Teste para aproximação 2: - [HClO] / [ClO - ] = K w / ([OH - ]. K a ) = / (5, ) = 0,0058 => 0,58% portanto aproximação 2 é Válida Calcule o volume (L) da solução aquosa 0,01 mol L -1 de NaClO que deverá ser adicionado a um reservatório cilíndrico de diâmetro 2,0 m contendo água até a altura de 2,5 m para que a concentração de NaClO seja de 1,0 mg L -1. Volume do reservatório cilíndrico = 3,14.r 2 h = 3,14x1x2,5 = 7,85 m 3 Concentração inicial do NaClO = 0,01 mol L -1 Concentração final do NaClO = 1,0 mg L -1 = 10-3 g L -1 MM = 22,99+35,45+16= 74,44 g mol -1 = 7850 L M = C(g/L) / MM = 10-3 / 74,44 = 1,34 x 10-5 mol L -1 Diluição sem desprezar o volume adicionado: M 1 V 1 = M 2 (V 2 + V 1 ) 0,01 x V 1 = ( V 1 ) x 1,34 x ,01V 1 = 0, ,34x10-5 V 1 V 1 = 10,56 L Outra resposta possível é: Diluição desprezando o volume adicionado: M 1 V 1 = M 2 V 2 0,01 x V 1 = 7850 x 1,34 x 10-5 V 1 = 10,54 L Programa Nacional Olimpíadas de Química 9
10 Problema 4 12% do total Total Escreva a equação química associada à linha, comum aos três diagramas, cujo potencial é independente do ph e possui valor de aproximadamente +2,25V Equação: A questão vale 14 pontos. A ausência dos indicadores de fase de agregação ou cargas ou índices descontam 2 pontos cada. A representação da oxidação (equação inversa) será aceita. Outras respostas serão avaliadas pelo corretor Escreva as expressões matemáticas (potencial em função do ph) para as linhas relacionadas à oxidaçãoredução da água. Identifique as regiões de estabilidade (abaixo da linha de redução, entre as linhas e acima da linha de oxidação) dos participantes das reações, ou seja, os gases oxigênio, hidrogênio e a água líquida. Linha de redução: Equação química Expressão matemática Linha de oxidação: Equação química Expressão matemática Abaixo da linha de redução: H 2 (g) Entre as linhas: H 2 O(l) Acima da linha de oxidação: O 2 (g) A questão vale 28 pontos. Cada equação química ou matemática vale 4 pontos. A ausência de dos indicadores de fase de agregação ou cargas ou índices descontam 1 pontos cada. A equação matemática somente será aceita completa. Cada espécie identificada corretamente na sua região de estabilidade vale 3 pontos. Outras respostas serão avaliadas pelo corretor. Programa Nacional Olimpíadas de Química 10
11 4.3. Diante da análise dos diagramas, assinale V para VERDADEIRO e F para FALSO nas seguintes afirmações abaixo: I- Os diagramas indicam que o aumento da fração molar do titânio promove uma maior estabilidade à corrosão da liga nitinol ( F ) II- O potencial do equilíbrio de dissolução da liga NiTi é cerca de -1,75 V, em condições ácidas ( V ) III- A corrosão das ligas nitinóis em meio ácido inicia pela dissolução do titânio seguida pela dissolução do níquel ( V ) IV- Os diagramas evidenciam que em meio neutro ou alcalino, quando o potencial é baixo, há a formação de diversos óxidos que provavelmente promovem passivação na liga ( V ) 4.4. A partir dos diagramas de Frost para o Titânio e o Níquel (em ph 0 e 14), mostrados abaixo, desenhe os diagramas de Latimer das espécies, incluindo todas as setas possíveis. (ATENÇÃO: Estime os potenciais, a partir dos gráficos com o auxílio de uma régua e utilize uma casa decimal) Titânio: ph = 0-0,9 V -1,2 V +0,1 V -0,4 V -1,6 V TiO 2+ Ti 3+ Ti 2+ Ti -0,2 V ph = 14-1,9 V -2,1 V -1,3 V -1,9 V -2,2 V TiO 2 Ti 2 O 3 TiO Ti -1,6 V Níquel: Programa Nacional Olimpíadas de Química 11
12 ph = 0 +0,7 V +1,7 V NiO 2 Ni 2+ -0,3 V Ni ph = 14-0,1 V -0,3 V +0,6 V +0,5 V -0,7 V NiO 2 Ni(O)OH Ni(OH) 2 Ni +0,6 V A questão vale 46 pontos. Os diagramas do Titânio valem 12 pontos cada. O primeiro diagrama do Níquel vale 10 pontos e o segundo 12 pontos. Cada potencial ou fórmula/íon errado desconta 2 pontos. Os valores de potencial são estimados pelo gráfico e assim serão consideradas variações de ± 0,2 V (na primeira casa decimal, como é solicitado). Outras respostas serão avaliadas pelo corretor. Programa Nacional Olimpíadas de Química 12
13 Problema 5 8% do total Total Determine a fórmula mínima do mineral perovskita. Fórmula mínima CaTiO Qual é o número de coordenação de cada átomo na estrutura, considerando apenas os primeiros vizinhos mais próximos, e os primeiros e segundos vizinhos mais próximos? Cálculos: Átomo No. Primeiros vizinhos No. Primeiros e segundos vizinhos Ca 12 (5%) 20 (5%) Ti 6 (5%) 14 (5%) O 2 (5%) 14 (5%) Calcule o valor da razão de raios iônicos na estrutura da perovskita. Cálculos: Programa Nacional Olimpíadas de Química 13
14 Calcule o parâmetro de rede (em Å) da célula unitária da perovskita. Cálculos: Resposta: 3,87 Å Calcule o raio iônico (em Å) do Ti nessa estrutura. Cálculos: Resposta: 0,54 Å Calcule a eficiência do empacotamento cristalino da célula unitária. (5 pontos) (5 pontos) (5 pontos) Programa Nacional Olimpíadas de Química 14
15 Calcule a densidade do mineral perovskita. (5 pontos) (5 pontos) (5 pontos) (2,5 pontos) ( ) (2,5 pontos) Programa Nacional Olimpíadas de Química 15
16 Preveja se o composto no qual B é o cátion Fe 2+ tem ou não a estrutura da perovskita., portanto FeTiO 3 não tem a estrutura da perovskita. Sim X Não Programa Nacional Olimpíadas de Química 16
17 Problema 6 7% do total Total Complete o quadro a seguir com as seguintes informações: configuração eletrônica do complexo segundo a TCC, energia de estabilização do campo cristalino (EECC, em função de o e P) e se ocorre ou não efeito Jahn-Teller (sim ou não). Complexo Configuração Eletrônica EECC Efeito Jahn-Teller WF 6 t 0 0 2g e g ReF 6 t 1 0 2g e g OsF 6 t 2 0 2g e g IrF 6 t 3 0 2g e g PtF 6 t 4 0 2g e g 0 Dq Não - 4Dq Sim - 8Dq Sim - 12Dq Não - 16Dq + P Sim Cada item terá valor de 1 ponto (TOTAL = 15 PONTOS). O cálculo da EECC em função de 10Dq ou 0 serão equivalentes, ou seja, o candidato não será penalizado. Caso o candidato não apresente os orbitais e g na configuração (uma vez que eles não estão ocupados por elétrons), ele não será penalizado Complete o quadro a seguir com as seguintes informações: fórmula do complexo, tipo de distorção (alongamento ou compressão), energia de estabilização do campo cristalino (EECC, em função de o, P, 1 e 2 ). Complexo Tipo de distorção EECC ReF 6 Compressão - 4Dq 2/3 2 OsF 6 Alongamento - 8Dq 2/3 2 PtF 6 Compressão - 16Dq + P 2/3 2 Cada item terá valor de 1 ponto (TOTAL = 9 PONTOS). Programa Nacional Olimpíadas de Química 17
18 6.3. Faça o diagrama de energia correspondente e calcule a EECC em função de e P. Indique se essa espécie é paramagnética ou diamagnética. Diagrama (6,0 PONTOS) EECC = 0 Dq (5,0 PONTOS) Complexo diamagnético. (5,0 PONTOS) Caso o candidato não preencha o diagrama com elétrons ele receberá 60% da nota. Caso o candidato apresente o diagrama de energia para o complexo tetraédrico, com a contagem de elétrons incorreta (8 elétrons), ele receberá 40% da nota Indique a cor do complexo e faça o respectivo diagrama de energia. Explique o motivo para a presença de uma banda alargada. O complexo será verde. (5,0 PONTOS) Diagrama (7,0 PONTOS) Justificativa: A banda associada à transição d-d é alargada porque há possibilidade de mais de uma transição eletrônica (por exemplo, d xz d z 2 e d xz d x 2 - y 2 ). Isso é evidenciado pelo diagrama de energia acima. Esse diagrama mostra que o complexo apresentará sua estrutura octaédrica distorcida (alongamento). (13,0 PONTOS) Caso o candidato apresente o diagrama da geometria octaédrica perfeita (incluindo os elétrons), ele terá 50% da nota. Caso o candidato não preencha o diagrama completo (incluindo a distorção) com elétrons ele receberá 60% da nota. Caso o estudante justifique com base no efeito Jahn-Teller, sem apresentar o diagrama adequado e as possíveis transições eletrônicas, ele terá 50% da nota. Caso o candidato apresente o diagrama de energia incorreto (compressão), mas explique a possibilidade de mais de uma transição eletrônica, ele receberá 60% da nota. Programa Nacional Olimpíadas de Química 18
19 6.5. Escreva a equação química balanceada, com os menores coeficientes estequiométricos inteiros, que representa o processo descrito. 2 Co(H 3 CCOO) 3 (aq) + 2 HBr(aq) 2 CoBr 2 (aq) + 2 H 3 CCOOH(aq) + Br 2 (l) (5,0 PONTOS) Caso o candidato não coloque os estados físicos adequados, ele perderá 1 ponto Faça o diagrama de energia que representa o desdobramento dos orbitais d para esse complexo em ambas as geometrias e indique se o mesmo é paramagnético ou diamagnético. Complexo paramagnético (5,0 pontos) Diagrama piramidal quadrada (10 pontos) Diagrama bipirâmide trigonal (15 pontos) Caso o candidato não preencha com elétrons, receberá 60% da nota. Caso o candidato não especifique os orbitais, ele perderá 1,0 ponto para cada orbital não especificado. Programa Nacional Olimpíadas de Química 19
20 Problema 7 12% do total Total Considerando que o composto D apresenta configuração absoluta R, desenhe as fórmulas estruturais, com as estereoquímicas corretas, para os compostos A, B, D, E e F Represente a fórmula estrutural e o mecanismo para a formação do intermediário C. Mecanismo: Programa Nacional Olimpíadas de Química 20
21 7.3. A reação do composto A com quantidade catalítica de OsO 4 e excesso de peróxido de hidrogênio resultou na formação de um par de diasteroisômeros G e H. Represente as fórmulas estruturais para esses compostos, indicando as configurações absolutas (R, S) de todos os centros assimétricos. Programa Nacional Olimpíadas de Química 21
22 Problema 8 12% do total Total Escreva as fórmulas estruturais dos produtos e dos reagentes A-J Na conversão de A em B qual outro reagente poderia ser utilizado em substituição ao (COCl) 2? Poderia ser utilizado cloreto de tionila Represente a fórmula do composto intermediário obtido pelo tratamento de 6 com MeONH 2.HCl e do composto resultante da reação de brometo de crotila com zinco. Compostos intermediários: Programa Nacional Olimpíadas de Química 22
23 8.4. Para o composto H represente as fórmulas dos dois isômeros e mostre as etapas do mecanismo de sua conversão em 13. Neste caso represente apenas o mecanismo para um dos isômeros. Mecanismo Programa Nacional Olimpíadas de Química 23
24 Problema 9 13% do total Total Escreva os equilíbrios ácido-base para adenina e uracila, mostrando a fórmula estrutural de cada espécie. Equilíbrios: Atribuição: Total: 10 pts A1 ou B1 ou C1 ou D1 para cada equilíbrio. A1-5 pts: cada equilíbrio escrito corretamente; B1-4 pts: cada equilíbrio parcialmente correto fórmula estrutural incompleta: omissão de insaturação ou átomos; C1-3 pts: cada equilíbrio parcialmente correto fórmula estrutural incompleta: omissão de insaturação e átomos; D1-2 pts: somente para adenina, se a protonação envolver os átomos de N3 ou N7. Somente para uracila, se a protonação envolver os átomos de O2 ou O4 e desde que a estrutura seja uma representação de Lewis correta Baseado nos valores de pk a para adenina e uracila, calcule em qual ph a interação entre as fitas poly(a) e poly(u) deve ser máxima. Cálculos: Programa Nacional Olimpíadas de Química 24
25 ph: 6,3 Atribuição: Total: 5 pts A1 + A2. A1-2 pts: desenvolvimento matemático correto na apresentação dos cálculos; A2-3 pts: indicação correta do valor de ph Escolha o valor de absorvância mais adequado no gráfico e calcule a absortividade molar de poly(u). Despreze nos seus cálculos o efeito da temperatura sobre a absortividade molar. A max = A poly(a) + A poly(u) A max = ε poly(a).b.c poly(a) + ε poly(u).b.c poly(u) C poly(a) = C poly(u) A max = ε poly(a).b.c poly(a) + ε poly(u).b.c poly(a) A max = C poly(a).(ε poly(a) + ε poly(u) ).b 1,491 = 1,96x10-6 M.(30x15,4x10 3 M.cm -1 + ε poly(u) ).1 cm ε poly(u) = 300 mm -1 cm -1 Resposta: 300 mm -1 cm -1 Atribuição: Total: 10 pts A1 + (A2 ou B2) + A3. A1-2 pts: escolha correta do valor de absorvância; A2-3 pts: desenvolvimento parcialmente correto dos cálculos; B2-6 pts: desenvolvimento totalmente correto dos cálculos; A3-2 pts: determinação correta do valor de ε poly(u) Calcule quantidade de luz transmitida em % pela fita dupla de poly(a).poly(u) nas condições apresentadas na Figura 2. A min = A 50% - (A max - A 50% ) = A poly(a).poly(u) A min = 1,253 - (1,491-1,253) = 1,015 A min = -logt 1,015 = -logt T = 0,0967 (9,67 %) Resposta: 9,67 % Atribuição: Total: 5 pts (A1 ou A2) + (B1 ou B2). A1-2 pts: desenvolvimento correto dos cálculos; A2-1 pts: A poly(a).poly(u) foi indicada corretamente, sem desenvolvimento dos cálculos; B1-3 pts: determinação correta da T (%); B2-2 pts: uso de absorvância errada para calcular T (%) Construa um diagrama de energia em concordância com a observação acima. Indique no diagrama as energias relacionadas as transições em H 2 O e D 2 O. Diagrama: Programa Nacional Olimpíadas de Química 25
26 Atribuição: Total: 5 pts A1 ou B1 ou C1. A1-5 pts: diagrama completo (pode exibir dois vales); B1-4 pts: um dos eixos, inclusive o seu título, foi suprimido; C1-3 pts: energias referentes às transições não foram mostradas Considerando os dados na Tabela 1, calcule a diferença de energia (ΔG o H2O - ΔG o D2O) em J.molécula -1 nas concentrações mais baixa e elevada de K +. [ ] [poly(a).poly(u)] = 1,96 x 10-5 M k B = 1,38 x J.K -1 Concentração mais baixa e mais alta na tabela abaixo: log[k + ] δt f ΔG o H2O - ΔG o D2O (J.molécula -1 ) -2,38 2,6-4,97 x ,18 0,3-5,73 x Atribuição: Total: 20 pts (A1 ou A2 ou A3) + (B1 ou B2). A1-15 pts: desenvolvimento correto dos cálculos; A2-10 pts: definição errônea do valor de Q, mas cálculos são desenvolvidos corretamente; A3-5 pts: desenvolvimento parcial e correto dos cálculos; B1-5 pts: valores corretos em J.molécula -1 ; B2-3 pts: valores corretos em J.mol -1. Programa Nacional Olimpíadas de Química 26
27 Determine a razão entre as constantes de força entre as concentrações mais baixa e elevada de K +. Valores provenientes da subquestão 9.4.1: log[k + ] δt f ΔG o H2O - ΔG o D2O (J.molécula -1 ) E o H2O - E o D2O -2,38 2,6-4,97 x ,97 x ,18 0,3-5,73 x ,73 x ( ) [ ( ) ] { [ ( ) ] } * + ( ) Atribuição: Total: 20 pts (A1 ou A2) + B1. A1-15 pts: desenvolvimento correto dos cálculos; A2-10 pts: desenvolvimento parcial e correto dos cálculos; B1-5 pts: baseado nos valores calculados na subquestão (podem diferir do indicado acima se a subquestão estiver parcialmente correta), realizar o cálculo correto do valor de Considere o dito acima e represente passo-a-passo a reação de enriquecimento da adenina com deutério. Mostre as fórmulas estruturais de todas as espécies e intermediários na reação. Resposta: Atribuição: Total: 5 pts (A1 ou B1 ou C1 ou D1). A1-5 pts: representação correta da reação; B1-4 pts: uso de um nucleófilo incorreto; C1-3 pts: reação via intermediário de adição para uma reação em meio alcalino; D1-2 pts: reação via intermediário de adição para uma reação em meio ácido. Programa Nacional Olimpíadas de Química 27
28 Sabendo que a frequência de estiramento de uma ligação C-H é 3000 cm -1, estime a constante de velocidade para a substituição de deutério por próton sob as mesmas condições. Cálculos: C-H C-T [ ] [ ] [ ] C-D [ ] Resposta: Atribuição: Total: 20 pts (A1 ou A2) + B1. A1-15 pts: desenvolvimento correto dos cálculos; A2-10 pts: desenvolvimento parcial e correto dos cálculos; B1-5 pts: valor correto de k D ; Programa Nacional Olimpíadas de Química 28
29 RESPOSTAS AOS RECURSOS ENCAMINHADOS CORREÇÃO SERÁ FEITA CONSIDERANDO AS ALTERAÇÕES A SEGUIR APRESENTADAS:
30 Problema Os valores de ΔG e ΔH foram corrigidos. Conforme dito no gabarito, item terá pontuação pela metade se o raciocínio estiver correto, mas houver erro de cálculo. Além disso, resposta sem unidade acarretará a perda de 1 ponto. Quem calculou ΔH partindo do valor de ΔG à temperatura de 298,15 K fez uso de aproximações que levam a um valor diferente de ΔH. Nesse caso será considerado 2/3 do valor atribuído ao cálculo de ΔH no item (2/3 de 15 pontos, que equivale a 10 pontos) Conforme dito no gabarito, item terá pontuação pela metade se o raciocínio estiver correto, mas houver erro de cálculo Diferentemente do item que pede a expressão para dx/dt, o item pede o tempo de relaxação, não a expressão. No enunciado da questão fala-se que o aumento de temperatura é tipicamente de 3 K a 10 K, o que não acarreta mudanças significativas nas constantes de velocidade e de equilíbrio. Portanto, as constantes a 25 ºC deveriam ter sido usadas, conforme foi trabalhado no
31 problema preparatório e durante o curso. O estudante que chegou à expressão, mas não calculou o tempo de relaxação fará jus a 60 % do valor do item.
32 Problema Aceitar também a resolução da questão por ph=pka, quando as concentrações do ácido e da base conjugada são iguais. RESP: Será considerado Considerar pontuação total para os estudantes que não explicitaram as porcentagens para cada aproximação. RESP: Será considerado se for feito todo o cálculo do erro sem entretanto passar o resultado para porcentagem. Se não for calculado o erro não será possível considerar.
33 Problema De fato a diferença entre a equação matemática (para a linha de redução) mostrada no recurso e aquela mostrada na chave de resposta ocorre apenas devido a uma aproximação na operação: que poderia ser realizada como, sendo o segundo termo aproximado para duas casas decimais. Deste modo, as duas respostas serão consideradas corretas, além de outras eventuais diferenças apenas por questões de aproximação.
34 Problema 5 Quanto as contestações e 5.2.4: As expressões sugeridas pelo contestador são claramente equivalentes àquelas já apresentadas no gabarito proposto. Sua utilização será pontuada de forma integral, desde que as quantidades solicitadas nas questões estejam calculadas de forma correta. Quanto à contestação 5.3.1: Ao contrário do que sugere a contestação, o enunciado da questão não impõe a condição de neutralidade estequiométrica entre os cátions (isto é, aquela segundo a qual a soma das cargas positivas deveria ser +6). A substituição do cátion Ti 4+ pelo cátion Fe 2+ é sim possível desde que a carga negativa extra seja compensada por vacâncias de ânions O 2-. Esse tipo de defeito é comum em estruturas derivadas da perovskita e foi discutido durante o curso de aperfeiçoamento. De fato, os estudantes parecem ter compreendido esse ponto já que a grande maioria deles fez uso de critérios geométricos e não estequiométricos para prever se a estrutura do novo composto seria ou não aquela da perovskita tradicional. Ressalto que o solicitado pela questão é, de fato, a substituição de B por Fe 2+, e não de A, como sugere a contestação. O composto formado seria então CaFeO3 (com vacâncias em sítios de O 2-, e com Fe de carga 2+) e não FeTiO3 (que apresenta a estrutura da perovskita). As referências citadas pelo contestador são irrelevantes para este problema pois analisam o composto CaFeO3 estequiométrico, ou seja aquele que apresenta íons Fe 4+, e não Fe 2+ conforme solicitado nessa questão. Ainda sim, CaFeO3 estequiométrico também apresenta distorções em relação à estrutura da perovskita. Por esses motivos acredito que a questão não apresenta os problemas relatados e portanto não deve ser anulada.
35 Problema Atribuir pontuação integral para os alunos que omitiram os orbitais e g na configuração eletrônica, já que estes estão vazios. O recorrente tem razão na argumentação apresentada. A pontuação integral será atribuída aos candidatos. Atribuir pontuação integral para os alunos que expressaram a EECC em função de o, ( resultado em Dq dividido por 10). O recorrente tem razão na argumentação apresentada. A pontuação integral será atribuída aos candidatos que expressarem o valor da EECC em função de 0 ou 10 Dq. 6.3 Considerar a pontuação do diagrama para os alunos que desenharam o diagrama tetraédrico, mas preencheram com 8 elétrons. No caso desse complexo, o candidato deve perceber que o centro metálico tem número de oxidação igual a zero, dessa forma, todos os elétrons de valência devem ser usados na representação do diagrama de energia. Dessa forma, o uso de apenas oito elétrons não é correto, uma vez que corresponderia à espécie Ni 2+. Por outro lado, o candidato que consegue identificar que o complexo deve apresentar geometria tetraédrica (em função da EECC = 0), terá valorização parcial da questão, mesmo apresentando o número de elétrons incorreto. Dessa forma, o candidato que apresentar o diagrama tetraédrico com oito elétrons receberá 40% da nota. 6.4 Considerar 50% da pontuação para os estudantes que colocaram apenas o diagrama de um complexo tetraédrico. O complexo dessa questão tem geometria octaédrica, logo, o gabarito deve ser mantido. 6.5 A equação balanceada é: 2Co(H 3 CCOO) 3(aq) + 6 HBr (aq) > 2CoBr 2(aq) + 6CH 3 COOH (aq) + Br 2(l) Considerar a representação OAc como equivalente à H 3 CCOO. O requerente tem razão na argumentação apresentada. O gabarito deve ser modificado e a equação deve ser apresentada como balanceamento correto. O uso da abreviação OAc para a espécie acetato também será considerada correta.
36 Problemas 7 e 8 Questão 7 Na resolução não constam as pontuações que devem ser obtidas por acertos parciais. A Olimpíada Internacional de Química não penaliza respostas posteriores devido a um erro anterior, caso as novas respostas sejam análogas às corretas, apesar do erro (dupla penalidade) Para as espécies B, D, E, F, considerar apenas as alterações reacionais realizadas, não levando em conta as porções erradas da molécula decorrente de passos anteriores, para se evitar a dupla penalização dos estudantes Para as espécies B, C, D, E, F, G, H, I e J, considerar apenas as alterações reacionais realizadas, não levando em conta as porções erradas da molécula decorrente de passos anteriores, para se evitar a dupla penalização dos estudantes. Não é o caso para os dois problemas. Devido aos diversos intermediários existentes nas reações o erro de uma estrutura não implica que o estudante não possa acertar as demais Foi colocado como resposta apenas a forma Piridona, pois esta é a única existente no presente caso. Quando pura, o composto existe totalmente (com base nos dados espectroscópicos) na forma PIRIDONA [1,2]. Entretanto, para fins de consideração da correção, foi considerada a outra forma tautomérica, uma vez que, embora não exista no presente caso, é uma possibilidade teórica e real para outras piridonas, em outras condições. Acrescenta-se que nas outras respostas, outras possibilidades de reagentes também foram consideradas, além das listadas no Gabarito. Isso foi feito pois para se realizar determinada transformação química, existem muitos reagentes que realizam a mesma transformação com graus variados de eficiência. 1. DONOHOE, J.T., JONES, C., BARBOSA L.C.A. Total Synthesis of (±)-Streptonigrin: De Novo Construction of a Pentasubstituted Pyridine using Ring-Closing Metathesis. J. Am. Chem. Soc.. v.133, p , DONOHOE, T.J.; JONES, C.R.; KORNAHRENS, A.F.; BARBOSA, L.C.A.; WALPORT, L.J.; TATTON, M.R.; O'HAGAN, M.; RATHI, A.H.; BAKER, D.B. Total Synthesis of the Antitumor Antibiotic (+)-Streptonigrin: First- and Second-Generation Routes for de Novo Pyridine Formation Using Ring-Closing Metathesis. J. Org. Chem., v. 78, p , 2013.
37 Problema 9 Observar no gabarito.
Caderno de Respostas
 PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA OBQ-2017 FASE VI Caderno de Respostas Programa Nacional Olimpíadas de Química 1 Problema 1 12% do total 1.1.1. 1.1.2. 1.2.1. 1.3.1.
PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA OBQ-2017 FASE VI Caderno de Respostas Programa Nacional Olimpíadas de Química 1 Problema 1 12% do total 1.1.1. 1.1.2. 1.2.1. 1.3.1.
Prova de conhecimento em Química Inorgânica DQ/UFMG
 CÓDIGO DO(A) CANDIDATO(A): Questão 2A. Faça o que se pede em cada um dos itens a seguir. a) Um grupo de pesquisadores estudou as estruturas moleculares de fluoretos da terceira série de transição: WF 6,
CÓDIGO DO(A) CANDIDATO(A): Questão 2A. Faça o que se pede em cada um dos itens a seguir. a) Um grupo de pesquisadores estudou as estruturas moleculares de fluoretos da terceira série de transição: WF 6,
Universidade Federal da Paraíba. Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química
 Universidade ederal da Paraíba Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA (PERÍODO 2019.1) DATA:
Universidade ederal da Paraíba Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA (PERÍODO 2019.1) DATA:
OBQ-2017 FASE VI. Caderno de Problemas
 PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA OBQ2017 FASE VI Caderno de Problemas Tabela Periódica com massas atômicas relativas 1 18 1 H 1.008 2 13 14 15 16 17 3 Li 6.94 11
PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA OBQ2017 FASE VI Caderno de Problemas Tabela Periódica com massas atômicas relativas 1 18 1 H 1.008 2 13 14 15 16 17 3 Li 6.94 11
Gabarito Prova de Conhecimentos em Química Mestrado/Doutorado 1/2018 PPGQ/IQ/UnB
 Gabarito Prova de Conhecimentos em Química Mestrado/Doutorado 1/2018 PPGQ/IQ/UnB Questão 1 - Em 1888, Rydberg mostrou que o espectro de linhas do átomo de hidrogênio poderia ser descrito pela expressão
Gabarito Prova de Conhecimentos em Química Mestrado/Doutorado 1/2018 PPGQ/IQ/UnB Questão 1 - Em 1888, Rydberg mostrou que o espectro de linhas do átomo de hidrogênio poderia ser descrito pela expressão
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC)/2015.2
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. (085)3366.9981 CEP 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. (085)3366.9981 CEP 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA
Classificação. Química Bioinorgânica 1º exame 14 de Junho de 2013 I II III IV V VI VII VIII
 Nº Nome Curso Química Bioinorgânica 1º exame 14 de Junho de 2013 Duração: 3 horas. Leia todo o enunciado antes de começar a responder. Justifique as respostas. RESPONDA APENAS NOS ESPAÇOS ASSINALADOS.
Nº Nome Curso Química Bioinorgânica 1º exame 14 de Junho de 2013 Duração: 3 horas. Leia todo o enunciado antes de começar a responder. Justifique as respostas. RESPONDA APENAS NOS ESPAÇOS ASSINALADOS.
PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA INSTRUÇÕES
 Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 2 o SEMESTRE DE 2017 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 2 o SEMESTRE DE 2017 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
P4 - PROVA DE QUÍMICA GERAL - 05/12/07
 P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA INSTRUÇÕES
 Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 1 o SEMESTRE DE 2018 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
Código do Aluno: PROVA DE CONHECIMENTO EM QUÍMICA INORGÂNICA 1 o SEMESTRE DE 2018 Leia atentamente a prova. INSTRUÇÕES DESLIGUE os seus aparelhos eletrônicos durante a prova (celular, tablet etc.). CANDIDATOS
EXAME DE CAPACIDADE IQ/USP 1 o SEMESTRE / 2010 PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA. Nome do Candidato: CADERNO DE QUESTÕES
 Uso SPG EXAME DE CAPACIDADE IQ/USP 1 o SEMESTRE / 2010 PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA Nome do Candidato: CADERNO DE QUESTÕES Instruções: Escreva seu nome de forma legível Das 10 (dez) questões
Uso SPG EXAME DE CAPACIDADE IQ/USP 1 o SEMESTRE / 2010 PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA Nome do Candidato: CADERNO DE QUESTÕES Instruções: Escreva seu nome de forma legível Das 10 (dez) questões
PROVA DE INGRESSO NO CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: segundo semestre de 2007
 UIVERSIDADE FEDERAL DO PARAÁ DEPARTAMETO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE IGRESSO O CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: segundo semestre de 2007 09 de Julho
UIVERSIDADE FEDERAL DO PARAÁ DEPARTAMETO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE IGRESSO O CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: segundo semestre de 2007 09 de Julho
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Olimpíada Brasileira de Química 2013 Fase VI
 Programa Nacional Olimpíadas de Química Olimpíada Brasileira de Química 2013 Fase VI PROBLEMA 1: Complexos de cobalto são muito usados nos conhecidos galinhos do tempo, que são bibelôs que mudam de cor,
Programa Nacional Olimpíadas de Química Olimpíada Brasileira de Química 2013 Fase VI PROBLEMA 1: Complexos de cobalto são muito usados nos conhecidos galinhos do tempo, que são bibelôs que mudam de cor,
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica
 Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica Avaliação para Seleção de Mestrado em Agroquímica - 2017.I Número ou código do(a) candidato(a): INSTRUÇÕES
Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica Avaliação para Seleção de Mestrado em Agroquímica - 2017.I Número ou código do(a) candidato(a): INSTRUÇÕES
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC) /2012.1
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 -- Tel. (085) 3366. 9981 FAX 3366.9978 CEP - 60.450-970 - Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 -- Tel. (085) 3366. 9981 FAX 3366.9978 CEP - 60.450-970 - Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO
Universidade Federal da Paraíba. Centro de Ciências Exatas e da Natureza Departamento de Química Programa de Pós-graduação em Química
 Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
GABARITO QUESTÕES - PARTE 1
 GABARIT QUESTÕES - PARTE ) ferro (II) e um ligante L formam um produto (FeL) que absorve em 50 nm. Nem o ferro (II) nem o ligante L absorvem em 50 nm. Uma solução contendo,59 0-4 mol.l - de ferro (II)
GABARIT QUESTÕES - PARTE ) ferro (II) e um ligante L formam um produto (FeL) que absorve em 50 nm. Nem o ferro (II) nem o ligante L absorvem em 50 nm. Uma solução contendo,59 0-4 mol.l - de ferro (II)
EXAME DE INGRESSO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 EXAME DE INGRESSO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2017 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. O exame dura 4 h. É expressamente proibido assinar
EXAME DE INGRESSO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2017 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. O exame dura 4 h. É expressamente proibido assinar
Bioquímica Inorgânica. 1º exame 18 de Junho de 2014
 Nº Nome Bioquímica Inorgânica 1º exame 18 de Junho de 2014 Duração: 3h00. Leia todo o enunciado antes de começar a responder. Justifique as respostas. RESPONDA APENAS NOS ESPAÇOS ASSINALADOS. I (1,5) Alguns
Nº Nome Bioquímica Inorgânica 1º exame 18 de Junho de 2014 Duração: 3h00. Leia todo o enunciado antes de começar a responder. Justifique as respostas. RESPONDA APENAS NOS ESPAÇOS ASSINALADOS. I (1,5) Alguns
SERVIÇO PÚBLICO FEDERAL MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE UBERLÂNDIA
 QUESTÕES 1 a 4 - OBRIGATÓRIAS 1ª Questão (7,5 pontos) obrigatória a) (2,5 pontos) b) Geometria molecular angular. (2,5 pontos) c) Na molécula de oxigênio (O 2 ) a ligação entre os oxigênios é dupla (ordem
QUESTÕES 1 a 4 - OBRIGATÓRIAS 1ª Questão (7,5 pontos) obrigatória a) (2,5 pontos) b) Geometria molecular angular. (2,5 pontos) c) Na molécula de oxigênio (O 2 ) a ligação entre os oxigênios é dupla (ordem
DESAFIO EM QUÍMICA 24/09/16
 DESAFI EM QUÍMICA 24/09/16 Nome: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPRTANTE: 1) Explique e justifique a resolução de todas questões e derivações. As respostas
DESAFI EM QUÍMICA 24/09/16 Nome: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPRTANTE: 1) Explique e justifique a resolução de todas questões e derivações. As respostas
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
Exame 2º Ano Modalidade B
 Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Avaliação para Seleção de Mestrado em Agroquímica I. Número ou código do(a) candidato(a): INSTRUÇÕES
 Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica Avaliação para Seleção de Mestrado em Agroquímica - 2012-I Número ou código do(a) candidato(a): INSTRUÇÕES
Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica Avaliação para Seleção de Mestrado em Agroquímica - 2012-I Número ou código do(a) candidato(a): INSTRUÇÕES
a. ( ) Zn sofre oxidação; portanto, é o agente oxidante.
 Rua Siqueira de Menezes, 406 Centro, Capela SE, 49700000, Brasil Exercício de revisão do 2º Ano Ensino Médio 3ª UNIDADE 1. Determine o Nox do elemento cloro nas espécies: a. Cl 2 Cl = 0 b. NaCl Cl = 1
Rua Siqueira de Menezes, 406 Centro, Capela SE, 49700000, Brasil Exercício de revisão do 2º Ano Ensino Médio 3ª UNIDADE 1. Determine o Nox do elemento cloro nas espécies: a. Cl 2 Cl = 0 b. NaCl Cl = 1
Universidade Federal da Paraíba. Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química
 Universidade ederal da Paraíba Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA (PERÍODO 218.2) DATA:
Universidade ederal da Paraíba Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA (PERÍODO 218.2) DATA:
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Nome.. nº Sala... Responder às perguntas 1, 2, 3, 4 na folha do enunciado
 Química II 1º Exame A 30 de Maio de 2014 Mestrado Integrado Eng. Química Mestrado Integrado Eng. Biológica Nome.. nº Sala... 1: 2: 3: 4: 5: 6: Total: Responder às perguntas 1, 2, 3, 4 na folha do enunciado
Química II 1º Exame A 30 de Maio de 2014 Mestrado Integrado Eng. Química Mestrado Integrado Eng. Biológica Nome.. nº Sala... 1: 2: 3: 4: 5: 6: Total: Responder às perguntas 1, 2, 3, 4 na folha do enunciado
PROVA DE INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROCESSO DE SELEÇÃO: 1 o semestre de 2019
 UNIVERSIDADE FEDERAL DO PARANÁ DEPARTAMENTO DE QUÍMICA PROVA DE INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROCESSO DE SELEÇÃO: 1 o semestre de 2019 11 de Fevereiro de 2019 INSTRUÇÕES: - Coloque
UNIVERSIDADE FEDERAL DO PARANÁ DEPARTAMENTO DE QUÍMICA PROVA DE INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROCESSO DE SELEÇÃO: 1 o semestre de 2019 11 de Fevereiro de 2019 INSTRUÇÕES: - Coloque
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 163/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 163/2017 Seleção para o 1º Semestre de 2018 16 de janeiro de 2018 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 163/2017 Seleção para o 1º Semestre de 2018 16 de janeiro de 2018 CADERNO DE QUESTÕES Tempo
B) (até três pontos) Para os pares de espécies apresentados em i, ii e iii tem-se, respectivamente, Al +, F - e Li.
 Química 1. Assunto: Item 1.3 do Programa de Química do Vestibular. A) (até sete pontos) A carga nuclear efetiva (Z ef ) pode ser definida como a atração que é efetivamente exercida pelo núcleo sobre os
Química 1. Assunto: Item 1.3 do Programa de Química do Vestibular. A) (até sete pontos) A carga nuclear efetiva (Z ef ) pode ser definida como a atração que é efetivamente exercida pelo núcleo sobre os
Desenhe a estrutura espacial do gás carbônico, da amônia, do metano, do etileno, do acetileno e do benzeno.
 Exemplos de Questões de Conteúdo Geral Questão 1 Responda os seguintes itens: a) Na classificação periódica, o elemento químico de configuração [Ar] 4s 2 3d 10 4p 5 está localizado em que período? Qual
Exemplos de Questões de Conteúdo Geral Questão 1 Responda os seguintes itens: a) Na classificação periódica, o elemento químico de configuração [Ar] 4s 2 3d 10 4p 5 está localizado em que período? Qual
MESTRADO EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC)/ Instruções gerais:
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. 85 3366 9981 CEP: 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA DE
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. 85 3366 9981 CEP: 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA DE
PROCESSO DE SELEÇÃO 2017 TURMA 2018 ANTES DE RESPONDER ÀS QUESTÕES DESTA PROVA, LEIA ATENTAMENTE ESTAS INSTRUÇÕES:
 Código do candidato PROCESSO DE SELEÇÃO 2017 TURMA 2018 ANTES DE RESPONDER ÀS QUESTÕES DESTA PROVA, LEIA ATENTAMENTE ESTAS INSTRUÇÕES: Escreva o seu código de identificação em todas as folhas de resposta
Código do candidato PROCESSO DE SELEÇÃO 2017 TURMA 2018 ANTES DE RESPONDER ÀS QUESTÕES DESTA PROVA, LEIA ATENTAMENTE ESTAS INSTRUÇÕES: Escreva o seu código de identificação em todas as folhas de resposta
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Prova de conhecimento em Química Inorgânica DQ/UFMG
 CÓDIGO DO(A) CANDIDATO(A): Questão 3A. Considere os íons complexos [Co(ox) 3] 3- (ox = oxalato, C 2O 4 2- ), [Co(en) 3] 3+ (en = etilenodiamina, H 2NCH 2CH 2NH 2), [Co(NH 3) 6] 3+ e [Co(OH 2) 6] 3+. Sabendo
CÓDIGO DO(A) CANDIDATO(A): Questão 3A. Considere os íons complexos [Co(ox) 3] 3- (ox = oxalato, C 2O 4 2- ), [Co(en) 3] 3+ (en = etilenodiamina, H 2NCH 2CH 2NH 2), [Co(NH 3) 6] 3+ e [Co(OH 2) 6] 3+. Sabendo
14ª LISTA - EXERCÍCIOS DE PROVAS - Eletroquímica
 Pg. 1/7 1 a Questão Considere a seguinte pilha, a 25 C. Sn(s) Sn 2+ (0,150 mol L -1 ) Pb 2+ (0,550 mol L -1 ) Pb(s) a) Calcule a variação de potencial, E, inicial da pilha. b) O que deve acontecer com
Pg. 1/7 1 a Questão Considere a seguinte pilha, a 25 C. Sn(s) Sn 2+ (0,150 mol L -1 ) Pb 2+ (0,550 mol L -1 ) Pb(s) a) Calcule a variação de potencial, E, inicial da pilha. b) O que deve acontecer com
OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela
![OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela](/thumbs/70/62007377.jpg) 1 Parte I Experimentos de combustão da vela I.1 Seria o consumo de oxigênio o fator determinante da subida do nível da água no Erlenmeyer no experimento I.1, ou há nos experimentos 1 e 2 evidências que
1 Parte I Experimentos de combustão da vela I.1 Seria o consumo de oxigênio o fator determinante da subida do nível da água no Erlenmeyer no experimento I.1, ou há nos experimentos 1 e 2 evidências que
EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2015 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. É expressamente proibido assinar ou fazer qualquer
EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2015 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. É expressamente proibido assinar ou fazer qualquer
Universidade Federal da Paraíba. Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química
 Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA (PERÍODO 2019.2) DATA:
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Programa de Pós-graduação em Química PROVA DE SELEÇÃO PARA INGRESSO NO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA (PERÍODO 2019.2) DATA:
PROCESSO DE SELEÇÃO: primeiro semestre de 2009
 UNIVERSIDADE FEDERAL DO PARANÁ DEPARTAMENTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE INGRESSO NO CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: primeiro semestre de 2009 Fevereiro
UNIVERSIDADE FEDERAL DO PARANÁ DEPARTAMENTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE INGRESSO NO CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: primeiro semestre de 2009 Fevereiro
Tabela Periódica dos Elementos
 MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DO PIAUÍ PRÓ-REITORIA DE ENSINO DE PÓS-GRADUAÇÃO CENTRO DE CIÊNCIAS DA NATUREZA Coordenação do Programa de Pós-Graduação em Química EXAME SELETIVO PARA INGRESSO
MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DO PIAUÍ PRÓ-REITORIA DE ENSINO DE PÓS-GRADUAÇÃO CENTRO DE CIÊNCIAS DA NATUREZA Coordenação do Programa de Pós-Graduação em Química EXAME SELETIVO PARA INGRESSO
EXAME DA FASE VI Gabarito Oficial
 PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA EXAME DA FASE VI Gabarito Oficial Considerações e retificações ao Gabarito Oficial do exame da Fase VI da Olimpíada Brasileira de
PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA OLIMPÍADA BRASILEIRA DE QUÍMICA EXAME DA FASE VI Gabarito Oficial Considerações e retificações ao Gabarito Oficial do exame da Fase VI da Olimpíada Brasileira de
PROFESSORA: Núbia de Andrade. Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
 GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE:3º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE:3º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
Penalização por descrever os procedimentos sem mostrar o fluxograma.
 Questão 1 1) [Ca 2+ ] = 0,1254 mol L -1 (esse valor corresponde ao volume de titulante igual a 30,00 ml, os valores calculados quando se considerou os volumes de 30,10 ml, 30,20 e 30,30 ml também foram
Questão 1 1) [Ca 2+ ] = 0,1254 mol L -1 (esse valor corresponde ao volume de titulante igual a 30,00 ml, os valores calculados quando se considerou os volumes de 30,10 ml, 30,20 e 30,30 ml também foram
EXAME DE SELEÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DO INSTITUTO DE QUÍMICA-ARARAQUARA-UNESP 24/01/2012 CURSOS: MESTRADO E DOUTORADO
 EXAME DE SELEÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DO INSTITUTO DE QUÍMICA-ARARAQUARA-UNESP 24/01/2012 CURSOS: MESTRADO E DOUTORADO Questão 1. Mostre, fazendo uso de mecanismos e reagentes adequados,
EXAME DE SELEÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DO INSTITUTO DE QUÍMICA-ARARAQUARA-UNESP 24/01/2012 CURSOS: MESTRADO E DOUTORADO Questão 1. Mostre, fazendo uso de mecanismos e reagentes adequados,
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DE RORAIMA/ MESTRADO
 UNIVERSIDADE FEDERAL DE RORAIMA PRÓ-REITORIA DE PESQUISA E PÓS-GRADUAÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DE RORAIMA/2016.1
UNIVERSIDADE FEDERAL DE RORAIMA PRÓ-REITORIA DE PESQUISA E PÓS-GRADUAÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DE RORAIMA/2016.1
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 20 de maio de 2016 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 20 de maio de 2016 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre Edital n 001/PPGQMC/2015
 EXAME DE SELEÇÃ PARA MESTRAD Segunda Etapa: Provas de Química Inorgânica e de Química rgânica Parte-1: Caderno de Questões de Proposições Múltiplas Instruções: 1-) candidato deverá devolver o caderno de
EXAME DE SELEÇÃ PARA MESTRAD Segunda Etapa: Provas de Química Inorgânica e de Química rgânica Parte-1: Caderno de Questões de Proposições Múltiplas Instruções: 1-) candidato deverá devolver o caderno de
Resolução do Exame de Química Geral (1ª Data, 18/1/08) 1ª Questão
 Resolução do Exame de Química Geral (1ª Data, 18/1/8) 1ª Questão a) O princípio da incerteza de Heisenberg afirma que não é possível conhecer simultâneamente, com precisão arbitrária, a posição e o momento
Resolução do Exame de Química Geral (1ª Data, 18/1/8) 1ª Questão a) O princípio da incerteza de Heisenberg afirma que não é possível conhecer simultâneamente, com precisão arbitrária, a posição e o momento
PROVA PARA INGRESSO NO MESTRADO. Programa de Pós Graduação em Química 09/12/2016 NOME
 PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 09/12/2016 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 09/12/2016 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
INSTITUTO SUPERIOR TÉCNICO Química Cursos de Engenharia Ambiente e Materiais 1º Semestre de º Teste ( ) Duração 1h 30 m
 INSTITUTO SUPERIOR TÉCNICO Química Cursos de Engenharia Ambiente e Materiais 1º Semestre de 2008-2009 1º Teste (30-10-2008) Duração 1h 30 m I Quando radiação de comprimento de onda 240 nm atinge uma superfície
INSTITUTO SUPERIOR TÉCNICO Química Cursos de Engenharia Ambiente e Materiais 1º Semestre de 2008-2009 1º Teste (30-10-2008) Duração 1h 30 m I Quando radiação de comprimento de onda 240 nm atinge uma superfície
Reações de oxirredução
 LCE-108 Química Inorgânica e Analítica Reações de oxirredução Wanessa Melchert Mattos 2 Ag + + Cu (s) 2 Ag (s) + Cu 2+ Baseada na transferência de elétrons de uma substância para outra Perde oxigênio e
LCE-108 Química Inorgânica e Analítica Reações de oxirredução Wanessa Melchert Mattos 2 Ag + + Cu (s) 2 Ag (s) + Cu 2+ Baseada na transferência de elétrons de uma substância para outra Perde oxigênio e
+1 2 Nox +1 2 Carga Nox +7 8 Carga
 01 Cl 2 Cl Nox = 0 Nox = 1 Cl O +1 2 Nox +1 2 Carga Cl O 4 +7 2 Nox +7 8 Carga Resposta: Respectivamente zero, 1, +1, +7. 1 02 a) NH 4 NO 3 NH 4 + cátion + NO 3 ânion N H 4 + 3 +1 Nox 3 +4 Carga N O 3
01 Cl 2 Cl Nox = 0 Nox = 1 Cl O +1 2 Nox +1 2 Carga Cl O 4 +7 2 Nox +7 8 Carga Resposta: Respectivamente zero, 1, +1, +7. 1 02 a) NH 4 NO 3 NH 4 + cátion + NO 3 ânion N H 4 + 3 +1 Nox 3 +4 Carga N O 3
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
EXAME DE CAPACIDADE IQ/USP 1 o SEMESTRE / 2008 PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA. Nome do Candidato: CADERNO DE QUESTÕES
 Uso SPG EXAME DE CAPACIDADE IQ/USP 1 o SEMESTRE / 2008 PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA Nome do Candidato: CADERNO DE QUESTÕES Instruções: Escreva seu nome em letra de forma Das 10 (dez) questões
Uso SPG EXAME DE CAPACIDADE IQ/USP 1 o SEMESTRE / 2008 PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA Nome do Candidato: CADERNO DE QUESTÕES Instruções: Escreva seu nome em letra de forma Das 10 (dez) questões
PROVA PARA INGRESSO NO MESTRADO. Programa de Pós Graduação em Química 14/06/2017 NOME
 PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 14/06/2017 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 14/06/2017 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC)/ MESTRADO
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. 85 3366 9981 CEP: 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA DE
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. 85 3366 9981 CEP: 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA DE
ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
Química II 1º Exame B 4 de Junho de ª Parte
 Química II 1º Exame B 4 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: Total: Responda às perguntas 1B a 5B na folha do enunciado Responda às perguntas 6B a 16B em
Química II 1º Exame B 4 de Junho de 2018 Nome nº MEQ MEBiol Sala Duração: 3h 1: 2: 3: 4: 5: 6: 7: 8: 9: 10: Total: Responda às perguntas 1B a 5B na folha do enunciado Responda às perguntas 6B a 16B em
QUÍMICA. 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica:
 QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Entrada no Curso de Doutorado do PPGQ-UFRN 2015.1 Instruções 1. Não identifique sua prova.
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Entrada no Curso de Doutorado do PPGQ-UFRN 2015.1 Instruções 1. Não identifique sua prova.
PAG Química Cinética 1.
 1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS
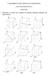 FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA XIX OLÍMPIADA DE QUÍMICA DO RIO GRANDE DO NORTE
 PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA XIX OLÍMPIADA DE QUÍMICA DO RIO GRANDE DO NORTE PROVA OBJETIVA E DISCURSIVA MODALIDADE A1 1ª série PARTE OBJETIVA QUESTÃO 1 Após aquecimento em uma corrente de gás
PROGRAMA NACIONAL OLIMPÍADAS DE QUÍMICA XIX OLÍMPIADA DE QUÍMICA DO RIO GRANDE DO NORTE PROVA OBJETIVA E DISCURSIVA MODALIDADE A1 1ª série PARTE OBJETIVA QUESTÃO 1 Após aquecimento em uma corrente de gás
Somente identifique sua prova com o código de inscrição (não coloque seu nome);
 Orientações gerais Somente identifique sua prova com o (não coloque seu nome); Assim que assinar a lista de presença verifique seu e preencha todos os campos referentes em todas as páginas; Não é permitida
Orientações gerais Somente identifique sua prova com o (não coloque seu nome); Assim que assinar a lista de presença verifique seu e preencha todos os campos referentes em todas as páginas; Não é permitida
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019
 RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
QUI201 (QUI145) QUÍMICA ANALÍTICA B (Química Industrial) Prof. Mauricio X. Coutrim
 QUI201 (QUI145) QUÍMICA ANALÍTICA B (Química Industrial) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) Exemplo: EQUILÍBRIOS DE OXI-REDUÇÃO Reações de oxidação/redução são reações que ocorrem com transferência
QUI201 (QUI145) QUÍMICA ANALÍTICA B (Química Industrial) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) Exemplo: EQUILÍBRIOS DE OXI-REDUÇÃO Reações de oxidação/redução são reações que ocorrem com transferência
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA. Seleção 2019/1
 Seleção 2019/2 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO.
Seleção 2019/2 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO.
Eletrólitos e Não Eletrólitos
 Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
UDESC 2017/2 QUÍMICA. Comentário
 QUÍMICA Sólido: volume definido; forma definida. Líquido: volume definido; forma variável. Gasoso: volume variável; forma variável. 1 e resolução SiC 4 + 2 Mg Si + 2 MgC 2 170,1 g + 48,6 g 28,1 g Massa
QUÍMICA Sólido: volume definido; forma definida. Líquido: volume definido; forma variável. Gasoso: volume variável; forma variável. 1 e resolução SiC 4 + 2 Mg Si + 2 MgC 2 170,1 g + 48,6 g 28,1 g Massa
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA
 PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
(a) Como é feita a determinação das espécies atômicas de interesse e quais os processos que
 QUESTÕES: 01. (Química Analítica) Os métodos espectroscópicos atômicos são empregados na determinação qualitativa e quantitativa de mais de 70 elementos. Tipicamente, esses métodos podem detectar quantidades
QUESTÕES: 01. (Química Analítica) Os métodos espectroscópicos atômicos são empregados na determinação qualitativa e quantitativa de mais de 70 elementos. Tipicamente, esses métodos podem detectar quantidades
Química. Xandão (Renan Micha) Soluções
 Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de Prova de Conhecimentos Gerais em Química. Caderno de Questões
 Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de 2013 Prova de Conhecimentos Gerais em Química Caderno de Questões Nome do candidato: Instruções: Escreva seu nome de forma
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de 2013 Prova de Conhecimentos Gerais em Química Caderno de Questões Nome do candidato: Instruções: Escreva seu nome de forma
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC)/ RESERVADO À COMISSÃO
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. (085)3366.9981 CEP 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. (085)3366.9981 CEP 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas.
 A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC)/ MESTRADO
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. 85 3366 9981 CEP: 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA DE
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. 85 3366 9981 CEP: 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA DE
Olimpíada Brasileira de Química
 Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
LISTA DE EXERCÍCIOS 6 1 (UNIDADE III INTRODUÇÃO À CIÊNCIA DOS MATERIAIS)
 UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 1º semestre de Informações e instruções para a resolução da prova
 Programa de Pós-graduação em Ciência e Tecnologia de Materiais 1º semestre de 2013 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 1º semestre de 2013 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Responda apenas duas (02) questões referentes a área de Química Analítica
 Responda apenas duas (02) questões referentes a área de Química Analítica QUESTÃ 1 Escreva as equações químicas para estabelecimento do equilíbrio químico e calcule o ph das seguintes soluções: a- Solução
Responda apenas duas (02) questões referentes a área de Química Analítica QUESTÃ 1 Escreva as equações químicas para estabelecimento do equilíbrio químico e calcule o ph das seguintes soluções: a- Solução
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG
 PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
Prova Escrita de Conhecimentos Gerais em Química
 Universidade de Brasília (UnB) Instituto de Química (IQ) Programa de Pós-Graduação em Química (PPGQ) Código: (uso da Secretaria) 06/02/2017 SELEÇÃO DE CANDIDATOS AO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
Universidade de Brasília (UnB) Instituto de Química (IQ) Programa de Pós-Graduação em Química (PPGQ) Código: (uso da Secretaria) 06/02/2017 SELEÇÃO DE CANDIDATOS AO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
Tabela Periódica dos Elementos
 MINISTÉRI DA EDUCAÇÃ UNIVERSIDADE FEDERAL D PIAUÍ CENTR DE CIÊNCIAS DA NATUREZA Pró-reitoria de Pesquisa e Pós-Graduação Coordenação do Programa de Pós-Graduação em Química EXAME SELETIV PARA INGRESS N
MINISTÉRI DA EDUCAÇÃ UNIVERSIDADE FEDERAL D PIAUÍ CENTR DE CIÊNCIAS DA NATUREZA Pró-reitoria de Pesquisa e Pós-Graduação Coordenação do Programa de Pós-Graduação em Química EXAME SELETIV PARA INGRESS N
Química. A) 645 kj/mol B) 0 kj/mol C) 645 kj/mol D) 945 kj/mol E) 1125 kj/mol 37.
 Química 7. Dados: Entalpia de ligação H H = 45 kj/mol N H = 9 kj/mol A reação de síntese da amônia, processo industrial de grande relevância para a indústria de fertilizantes e de explosivos, é representada
Química 7. Dados: Entalpia de ligação H H = 45 kj/mol N H = 9 kj/mol A reação de síntese da amônia, processo industrial de grande relevância para a indústria de fertilizantes e de explosivos, é representada
Nome do(a) candidato(a):
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Entrada nos Cursos de Mestrado e Doutorado do PPGQ-UFRN 2018.1 Instruções 1. Não identifique
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Entrada nos Cursos de Mestrado e Doutorado do PPGQ-UFRN 2018.1 Instruções 1. Não identifique
Serviço Público Federal Universidade Federal do Pará Instituto de Ciências Exatas e Naturais Programa de Pós-Graduação em Química
 Questão 1: (1,25 pontos) Uma preparação farmacêutica contendo cromo (III) foi analisada tratando-se 2,63 g da amostra com 5,00 ml de solução 0,0103 mol/l de EDTA. A quantidade de EDTA que não reagiu foi
Questão 1: (1,25 pontos) Uma preparação farmacêutica contendo cromo (III) foi analisada tratando-se 2,63 g da amostra com 5,00 ml de solução 0,0103 mol/l de EDTA. A quantidade de EDTA que não reagiu foi
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
Professora Sonia IME 1992 FOLHA DE DADOS
 IME 1992 FOLHA DE DADOS Massas atômicas: Elemento Massa atômica (u.m.a) Elemento Massa atômica (u.m.a) Ag 108 As 75 Br 80 C 12 Ca 40 C 35,5 Cu 63,5 H 1 N 14 Na 23 O 16 P 31 S 32 U 238 R Cons tan te dos
IME 1992 FOLHA DE DADOS Massas atômicas: Elemento Massa atômica (u.m.a) Elemento Massa atômica (u.m.a) Ag 108 As 75 Br 80 C 12 Ca 40 C 35,5 Cu 63,5 H 1 N 14 Na 23 O 16 P 31 S 32 U 238 R Cons tan te dos
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Ingresso no Curso de Doutorado do PPGQ-UFRN 2017.1 Instruções 1. Não identifique sua
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Ingresso no Curso de Doutorado do PPGQ-UFRN 2017.1 Instruções 1. Não identifique sua
Gabarito Química Grupo J. 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor. Considerando-se as substâncias I, II e III mostradas abaixo,
 VESTIB LAR Gabarito Química Grupo J 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Considerando-se as substâncias I, II e III mostradas abaixo, I) 2-clorobutano II) hidroxi benzeno III) tolueno a) Escreva
VESTIB LAR Gabarito Química Grupo J 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Considerando-se as substâncias I, II e III mostradas abaixo, I) 2-clorobutano II) hidroxi benzeno III) tolueno a) Escreva
