Avaliação da atividade antifúngica de novos compostos em. maturação de biofilme de Candida albicans em superfícies. abióticas.
|
|
|
- Lúcia Filipe Palha
- 6 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DO RIO DE JANEIRO CENTRO DE CIÊNCIAS DA SAÚDE INSTITUTO DE BIOFÍSICA CARLOS CHAGAS FILHO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOFÍSICA) Taissa Vieira Machado Vila Avaliação da atividade antifúngica de novos compostos em células planctônicas e na formação, desenvolvimento e maturação de biofilme de Candida albicans em superfícies abióticas. Orientadora: Profa. Dra. Sonia Rozental Rio de Janeiro 2010
2 Livros Grátis Milhares de livros grátis para download.
3 TAISSA VIEIRA MACHADO VILA Avaliação da atividade antifúngica de novos compostos em células planctônicas e na formação, desenvolvimento e maturação de biofilme de Candida albicans em superfícies abióticas. Orientadora: Profa. Dra. Sonia Rozental Dissertação de mestrado apresentada ao Programa de Pós-graduação em Ciências Biológicas (Biofísica), Instituto de Biofísica Carlos Chagas Filho, Universidade Federal do Rio de Janeiro, como parte dos requisitos necessários à obtenção do grau de Mestre em Ciências Biológicas (Biofísica). UNIVERSIDADE FEDERAL DO RIO DE JANEIRO CENTRO DE CIÊNCIAS DA SAÚDE INSTITUTO DE BIOFÍSICA CARLOS CHAGAS FILHO Rio de Janeiro, 2010
4 i FICHA CATALOGRÁFICA Vila, Taissa Vieira Machado Avaliação da atividade antifúngica de novos compostos na formação, desenvolvimento e maturação de biofilme de candida albicans em superfícies abióticas. Rio de Janeiro, folhas. Dissertação (Mestre em Ciências Biológicas Biofísica). Universidade Federal do Rio de Janeiro, Instituto de Biofísica Carlos Chagas Filho. Orientadora: Profa. Dra. Sonia Rozental. 1. Candida albicans 2. Biofilmes 3. Antifúngicos 4. 24(25)-esterol metiltransferase 5. Análogos de fosfolipídios. 6. Resistencia I. Universidade Federal do Rio de Janeiro II. Título
5 ii AGRADECIMENTOS Este espaço é dedicado a todos os que participaram, direta ou indiretamente, da realização deste trabalho. A todos eles deixo aqui o meu sincero agradecimento. Agradeço à minha orientadora, Dra. Sonia Rozental pela oportunidade, confiança, apoio e ensinamentos durante todos estes anos. À Kelly, pela orientação durante a iniciação científica, pelo modo empenhado e estimulante com que acompanhou todas as fases de realização deste trabalho, pela constante disponibilidade e por todos os conselhos e sugestões. À todos do Laboratório de Biologia Celular de Fungos, Carol, Amanda, Luana, Talita, Raul e Anderson, pela boa convivência, colaboração e sugestões. Àos professores, alunos e funcionários do Laboratório de Ultraestrutura Celular Hertha Meyer pela convivência e apoio técnico durante esses anos. Agradeço, em especial, aos meus pais e à minha avó, pelo apoio incondicional e incentivo constante, sem os quais nada disso seria possível. À Camilla pela amizade, carinho, incentivo e conversas, sem as quais toda minha caminhada teria sido muito menos prazerosa. Agradeço por ser meu porto seguro, sempre. Ao Luis, pelo carinho, apoio e paciência nos dias mais difíceis, pelos fins-de-semana perdidos, pelo seu colo, pela companhia e por toda sua compreensão. Às amigas da graduação, Alicia, Anne, Letícia e Mariah, pela amizade, conselhos e trocas de experiências. E às amigas de sempre, Ana, Taty e Maíra, por toda amizade, apoio e carinho durante tantos e tantos anos.
6 iii Foi o tempo que perdeste com tua rosa que fez tua rosa tão importante. Antoine de Saint-Exupéry
7 iv RESUMO VILA, Taissa Vieira Machado. Avaliação da atividade antifúngica de novos compostos em células planctônicas e na formação, desenvolvimento e maturação de biofilme de Candida albicans em superfícies abióticas. Rio de Janeiro, Dissertação (Mestrado em Ciências Biológicas Biofísica) Instituto de Biofísica Carlos Chagas Filho, Universidade Federal do Rio de Janeiro, Rio de Janeiro, Infecções relacionadas à utilização de cateter são a principal causa de mortalidade entre pacientes hospitalizados e a formação de biofilmes está associada a 90% destas infecções. Candida albicans é a levedura mais isolada em pacientes com dispositivos médicos associados. Portanto, o objetivo deste trabalho foi avaliar a atividade antifúngica de inibidores da enzima Δ24-esterol metil transferase (24-SMT) e de análogos de fosfolipídios em células planctônicas (em suspensão) e de biofilme em C. albicans. Analisamos, também, o efeito destes compostos sobre a hidrofobicidade de superficie celular (HSC) e as alterações na morfologia e no perfil lipídico destas leveduras em suspensão. A susceptibilidade das células planctônicas e de biofilmes a dois inibidores da 24-SMT, azasterol (AZA) e epiminolanosterol (EIL), e a dois análogos de fosfolipídios, miltefosina (MLT) e Tcan26 foi comparada à dos antifúngicos padrão anfotericina B (AMB), fluconazol (FLU) e itraconazol (ITRA). As suspensões das duas cepas testadas (ATCC e 44A) mostraram-se susceptíveis aos 7 antifúngicos, porém, apenas AMB, AZA, MLT e Tcan26 determinaram redução significativa na formação de biofilme, em placa de 96 poços. As concentrações inibitórias de crescimento para células de biofilme mostraram-se de 4 a 64 vezes maiores do que as de células planctônicas. Os biofilmes maduros mostraram-se mais resistentes aos tratamentos do que os biofilmes em formação e os biofilmes da cepa ATCC foram mais susceptíveis aos tratamentos do que os de isolado clínico. Em cateter venoso central (CVC), a capacidade de formação de biofilme parece relacionar-se a HSC, pois, a cepa mais hidrofóbica, 44A, formou biofilmes mais densos. O desenvolvimento do biofilme da cepa 44A, em CVC, sofreu alterações morfológicas significativas, quando ocorreu na presença de FLU, EIL, MLT ou Tcan 26, sendo composto, basicamente, por leveduras e pseudohifas e poucas camadas de células. Os análogos de fosfolipidios inibiram a filamentação do biofilme sobre cateter de ambas as cepas, enquanto o inibidores da 24-SMT apenas inibiram filamentação da cepa ATCC. MLT e Tcan26 mostraram um perfil de atividade sobre a formação e maturação do biofilme melhor do que os inibidores da 24-SMT. Dentre os agentes testados, o Tcan26 apresentou o melhor perfil de atividade para ambas as cepas e, para a cepa ATCC, a susceptibilidade das células no biofilme foi semelhante à das células em suspensão. As leveduras em suspensão, tratadas com MLT, apresentaram alterações ultraestruturais, principalmente, na parede e membrana celular, e na formação de brotamentos. Ainda, o conteúdo de ergosterol, fosfolipidios e ácidos graxos mostraram-se alterados. Portanto, nossos resultados sugerem que os inibidores da 24-SMT e os análogos de fosfolipídios inibem a filamentação das células de C. albicans durante o desenvolvimento do biofilme, levando, provavelmente, à redução da virulência associada às eles. Além disso, MLT e seu análogo, Tcan26, reduziram significativamente a formação de biofilme, apresentando-se, então, como substâncias antifúngicas com ação tanto sobre células planctônicas como células em biofilmes.
8 v ABSTRACT VILA, Taissa Vieira Machado. Avaliação da atividade antifúngica de novos compostos em células planctônicas e na formação, desenvolvimento e maturação de biofilme de Candida albicans em superfícies abióticas. Rio de Janeiro, Dissertação (Mestrado em Ciências Biológicas Biofísica) Instituto de Biofísica Carlos Chagas Filho, Universidade Federal do Rio de Janeiro, Rio de Janeiro, Infections related to the use of catheters are the leading mortality cause among hospitalized patients and the formation of biofilms is associated with 90% of these infections. Candida albicans is the yeast most commonly isolated in patients with associated medical devices. Therefore, the aim of this work was to evaluate the antifungal activity of Δ24-sterol methyl transferase (24-SMT) inhibitors and analogues of phospholipids in planktonic cells (in suspension) and in biofilms of C. albicans. We have also analyzed the effect of these compounds on the cell surface hydrophobicity (CSH) and changes in morphology and lipid profile of this yeast in suspension. Susceptibility of planktonic cells and biofilms to two inhibitors of 24-SMT, azasterol (AZA) and epiminolanosterol (EIL) and two analogues of phospholipids, miltefosine (MLT) and Tcan26 was compared to these of standard antifungal drugs: amphotericin B (AMB), fluconazole (FLU) and itraconazole (ITRA). The suspensions of two strains tested (ATCC and 44A) were susceptible to seven antifungal agents, however, only AMB, AZA, MLT and Tcan26 determined a significant reduction in biofilm formation in 96-well plate. Inhibitory concentrations for biofilm cells growth were shown to be 4-64 times higher than those of planktonic cells. Mature biofilms were more resistant to treatment than biofilms under development and biofilm formation of strain ATCC were more susceptible to treatments than those of clinical isolate. On central venous catheter (CVC), the ability of biofilm formation appears to be related to the HSC, because the more hydrophobic strain, 44A, formed thicker biofilms. The biofilm development of strain 44A, in CVC, suffered significant morphological changes when occurred in the presence of FLU, EIL, MLT or Tcan26, being composed primarily by yeast and pseudohyphae and few layers of cells. The analogues of phospholipids inhibited the filamentation of the biofilm, on catheter, of both strains, while the 24-SMT inhibitors only inhibited filamentation of strain ATCC. MLT and Tcan26 showed a better profile of activity on the formation and maturation of biofilm than the 24-SMT inhibitors. Among the agents tested, Tcan26 showed the best activity profile for both strains and, for the ATCC strain, the susceptibility of the biofilm cells was similar to cells in suspension. The yeast in suspension, treated with MLT, showed ultrastructural changes mainly in the cell wall and membrane, and in the budding process. Still, the content of ergosterol, phospholipids and fatty acids were shown to be altered. Therefore, our results suggest that inhibitors of 24-SMT and analogues of phospholipids inhibit filamentation of the cells of C. albicans during biofilm development, probably leading to the reduction in virulence associated with them. Moreover, MLT and its analog, Tcan26, significantly reduced biofilm formation, presenting, then, as possible substances with antifungal action on both planktonic and biofilms cells.
9 vi LISTA DE FIGURAS Figura 1: Esquema ilustrativo da transição entre as diferentes morfologias em C. albicans. Adaptado de: Romani L., Figura 2: Esquema ilustrativo dos componentes da parede celular de C. albicans. Os polímeros de β-1,3 e β-1,6 glucana estão representados em amarelo e azul, respectivamente; proteinas em verde, filamentos de quitina em laranja e mananas em vermelho Figura 3: Colônias brancas e opacas de C. albicans. Em (a) colônia branca com um setor opaco, (b) colônica branca (acima) e opaca (abaixo), (c) e (d) micrografias de microscopia eletrônica de varredura, em aumento de 1000 x, das células de colônia branca (c) e opaca (d). Adaptado de: Johnson A., Figura 4: Esquema ilustrativo da seqüência de desenvolvimento do biofilme de C. albicans, em suas diferentes fases. A: adesão de leveduras em suspensão à superfície, B: formação de colônias e multiplicação celular, C: secreção de matriz extracelular (MEC) e formação de hifas, formando uma estrutura tridimensional complexa. Adaptado de: Douglas J.L., Figura 5: Microscopia eletrônica de varredura de biofilmes de Candida albicans. (a) biofilme fino mostrando extensa matriz extracelular, indicado pela seta branca. (b) biofilme altamente filamentado, seta branca indica um canal de água. (c) biofilme maduro com presença de hifas e leveduras, matriz extracelular não visível. Barras = 10 µm Figura 6: Possíveis mecanismos envolvidos na resistência antifúngica do biofilme de C. albicans. Adaptado de: Niimi et al., Figura 7: Principais alvos de ação na célula fúngica dos agentes empregados, atualmente, no tratamento das candidemias. Adaptado de: Katzung B.G., Figura 8: Estrutura química dos agentes azóis. Retirado de: 21 Figura 9: Estrutura química dos agentes poliênicos. Retirado de: 21 Figura 10: Mecanismo de ação da anfotericina B na célula fúngica. (A) bicamada lipídica com poro, permitindo a saída de material citoplasmático. (B) esquema explicativo da interação da molécula de anfotericina B com o ergosterol e formação do poro na mambrana celular. Adaptado de: Ghannoum e Rice, Figura 11: Estrutura química das equinocandinas. Adaptado de: www. doctorfungus.com Figura 12: Via biosintética do ergosterol e colesterol, mostrando as principais etapas e as enzimas envolvidas. Em vermelho estão demonstradas as etapas inibidas pelos azóis e azasteróis. Adaptado de: De Souza e Rodrigues,
10 vii Figura 13: Esquema representativo da microdiluição em caldo utilizando diluições seriadas dos antifúngicos para determinação do IC 50 e IC 90 de cada um dos compostos. Após a diluição dos compostos (fileiras 1-10), todos os poços da microplaca, exceto a coluna 12, receberam a mesma alíquota de suspensão fúngica padronizada Figura 14: Esquema representativo dos testes in vitro utilizados para a determinação da atividade de drogas na formação e no biofilme maduro; e da quantificação por reação com XTT. Cada fileira (A-G) da placa de 96 poços recebeu 100 µl de um composto antifúngico nas concentrações determinadas entre colchetes (64, 16, 4 vezes maior ou igual a IC de cada droga). Todos os poços receberam 100 µl de suspensão antifúngica padronizada, exceto os poços 7-9 da fileira H, que receberam apenas meio de cultura. Os poços 1-6 da fileira H receberam apenas suspensão fúngica e são isentos de drogas (controle positivo). Após a incubação com XTT:Menadiona, a intensidade de cor laranja formada pela presença do composto formazan é proporcional à concentração de células viáveis em cada poço Figura 15: Comparação entre os índices de hidrofobicidade obtidos para as células controle das cepas ATCC e 44A de C. albicans Figura 16: Micrografias de microscopia eletrônica de transmissão de C. albicans 44A controle (A-B) e tratada com 3 μg/ml de miltefosina (C-F). Células controle apresentaram membrana celular contínua (mp, em B), parede celular homogênea e compacta (pc, em B) e fibrilas organizadas e compactadas (f, em B). As células tratadas mostram desorganização e afrouxamento das fibrilas (setas pretas em C e E), invaginações e alterações na membrana celular (setas amarelas em D-F), aumento da espessura da parede celular (setas vermelhas em E-F), vacúolos (v, em C) e inchaço mitocondrial (m, em C e F). As leveduras tratadas apresentaram alteração de forma celular (C-F) e brotamentos alterados (* em C). Barras correspondem a 0,5 μm em A,B,C e E, e a 1 μm em D e F Figura 17: Cromatografia em camada delgada da fração polar de lipídeos extraídos de C. albicans (44A) tratada com 0,5 e 1,0 µg/ml de miltefosina, em meio RPMI 1640, por 48 h, a 35 C. A concentração inibitória que inibiu 100% do crescimento fúngico foi de 4,0 µg/ml. Concentrações das drogas estão µg/ml Figura 18: Redução de formação de biofilme por C. albicans ATCC na presença de drogas padrão em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga Figura 19: Redução de formação de biofilme por C. albicans ATCC na presença de inibidores da 24-SMT e análogos de fosfolipidios em concentrações iguais ao IC 50 (AZA e EIL) ou IC 90 (miltefosina e Tcan 26), 4 e 16 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 ou IC 90 da droga Figura 20: Redução de formação de biofilme por C. albicans 44A na presença de drogas padrão em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga
11 viii Figura 21: Redução de formação de biofilme por C. albicans 44A na presença de inibidores da 24-SMT (AZA e EIL) em concentrações iguais ao IC 50, 4 e 16 vezes maiores, e na presença de análogos de fosfolipidios (miltefosina e Tcan26) em concentrações iguais ao IC 90, 4 e 8 ou 16 vezes maiores. A menor concentração em cada gráfico é referente ao valor de IC 50 ou IC 90 da droga Figura 22: Redução do biofilme maduro de C. albicans ATCC após a adição de drogas padrão em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga Figura 23: Redução do biofilme maduro de C. albicans ATCC após a adição de inibidores da 24- SMT e análogos de fosfolipidios em concentrações iguais ao IC 50 (AZA e EIL) ou IC 90 (miltefosina e Tcan 26), 4 e 16 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 ou IC 90 da droga Figura 24: Redução do biofilme maduro de C. albicans 44A após a adição de drogas padrão, em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga Figura 25: Redução do biofilme maduro de C. albicans 44A após a adição de inibidores da 24-SMT (AZA e EIL) em concentrações iguais ao IC 50, 4 e 16 vezes maiores, e após a adição de análogos de fosfolipidios (miltefosina e Tcan26) em concentrações iguais ao IC 90, 4 e 8 ou 16 vezes maiores. A menor concentração em cada gráfico é referente ao valor de IC 50 ou IC 90 da droga Figura 26: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e formado na presença de 16 μg/ml de FLU(C-D), 256 μg/ml de AZA (E e F) e 16 μg/ml de EIL (G e H) por 48h, a 35 ºC. Barras correspondem a 500 μm em A,C,E,G e 10 μm em B,D,F,H. Insets com barras de 10 μm (D) e 5 μm (H). É Possivel observar alterações na quantidade de células aderidas ao cateter após o tratamento com FLU, AZA e EIL, em relação ao controle nao tratado Figura 27: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e formado na presença de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E e 10 μm em B,D,F. Insets em D e F com barras de 5 μm. É possível observar alterações tanto na densidade de células aderidas à superfície do cateter quanto na divisão celular nos biofilmes formados na presença de MLT e Tcan26, em relação ao biofilme controle Figura 28: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e formado na presença de 16 μg/ml de FLU(C-D), 4 μg/ml de AZA (E e F) e 32 μg/ml de EIL (G e H) por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E,G e 10 μm em B,D,F,H. Observamos tanto a redução da densidade de células aderidas à superfície do cateter quanto a inibição da filamentação, nos biofilmes formados na presença de FLU e EIL, em relação ao controle. Nenhuma alteração foi observada em biofilmes formados na presença de AZA... 76
12 ix Figura 29: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e formado na presença de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E e 5 μm em B,D,F. Observamos tanto a redução da densidade de células aderidas à superfície do cateter quanto a inibição da filamentação nos biofilmes formados na presença de MLT e Tcan26, em relação ao controle Figura 30: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e após a adição de 16 μ g/ml de FLU(C-D), 256 μ g/ml de AZA (E e F) e 16 μ g/ml de EIL (G e H), ao bifilme já formado, por 48h, a 35 C. Barras correspondem a 500 μ m em A,C,E,G; 10 μ m em B,D,F,H e 5 μ m no inset (H). é Possivel observar tanto a redução da densidade de células aderidas à superfície do cateter quanto a inibição da filamentação, nos biofilmes apos a adição de FLU, AZA e EIL, em relação ao controle Figura 31: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e após a adição de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), ao biofilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E e 10 μm em B,D,F. Observamos tanto a redução da densidade de células aderidas à superfície do cateter nos biofilmes apos a adição de MLT e Tcan26, quanto a inibição da filamentação, nos biofilmes adicionados de Tcan26, quando comparados ao controle Figura 32: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e após a adição de 16 μg/ml de FLU(C-D), 4 μg/ml de AZA (E e F) e 32 μg/ml de EIL (G e H), ao biofilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E,G; 10 μm em B,D,F,H e 5 μm no inset (F). Observamos alterações de superfície celular em biofilmes tratados com AZA. A adição detes antifúngcos não alterou nem densidade de células aderidas ao cateter nem filamentação Figura 33: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e após a adição de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), ao biofilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E; 10 μm em B,D,F e 5 μm no inset (D). É Possivel observar grumos de celular com alterações de superfície em biofilmes tratados com MLT. Biofilmes tratados com Tcan26 exibem tanto redução na densidade de células aderidas à superfície do cateter quanto inibição da filamentação, quando comparado ao controle
13 x LISTA DE TABELAS Tabela 1: Principais condições de pacientes, em ambiente hospitalar, associadas à candidemia. Publicado por: Hinrichsen et al., Tabela 2: Incidência de C. albicans em 712 casos de candidemia, entre 2003 e 2004, no Brasil. Publicado por: Colombo et al., Tabela 3: Estruturas químicas e mecanismos de ação de algumas substâncias antifúngicas utilizadas Tabela 4: Interpretação dos resultados da determinação da IC das drogas padrão (CLSI, 2008) Tabela 5: Susceptibilidade das cepas de C. albicans aos inibidores da 24-SMT, aos análogos de fosfolipídios e aos antifúngicos padrão, analisados pelo método da microdiluição em caldo. Resultados de CI 50 e CI 90 estão expressos em µg/ml Tabela 6: Determinação da concentração fungicida mínima (CFM) dos inibidores da 24-SMT (AZA e EIL) e dos análogos de fosfolipidios (MLT e Tcan 26) contra cepas de C. albicans. 45 Tabela 7: Índice de hidrofobicidade celular de leveduras em suspensão após tratamento com AZA, EIL, fluconazol (FLU), itraconazol (ITRA), ou anfotericina B (AMB), nas concentrações de IC 50 de cada substância Tabela 8: Índice de hidrofobicidade celular de leveduras em suspensão após tratamento com miltefosina (MLT) ou Tcan26, nas concentrações de IC 90 de cada substância Tabela 9: Porcentagem relativa de esteróis extraídos de leveduras de C. albicans 44A não tratadas (controle) e tratadas com miltefosina (concentrações em µg/ml), obtido por meio de um cromatógrafo gasoso acoplado a um espectro de massas Tabela 10: Porcentagem relativa de ésteres de ácidos graxos extraídos de leveduras de C. albicans (44A) controle e tratadas com 0,5 e 1 µg/ml de miltefosina, obtidos por meio de um cromatógrafo à gás acoplado a um espectrômetro de massas Tabela 11: Resumo do perfil de atividade dos agentes antifúngicos, nas duas fases de desenvolvimento do biofilme, formado sobre dois substratos diferentes. Análise quantitativa do biofilme em poliestireno (placa de 96 poços) por redução de XTT e avaliação visual do cateter tratado quanto a redução de densidade e filamentação das células fúngicas, em relação ao cateter controle não tratado
14 xi LISTA DE SIGLAS E ABREVIATURAS 24-SMT: Δ24(25)-esterol metiltransferase AMB: Anfotericina B ASD: Ágar Saburaud dextrose ATCC: American Type Culture Colection AZA: 22,26 azasterol CFM: Concentração fungicida mínima DNA: Ácido desoxiribonucléico EIL: Epiminolanosterol FLC: Fluconazol HIV: Vírus da imunodeficiência adquirida IC: Concentração inibitória Minima IC 50 : Concentração inibitória mínima capaz de inibir 50% do crescimento IC 90 : Concentração inibitória mínima capaz de inibir 90% do crescimento ITC: Itraconazol MEC: Matriz Extracelular MLT: Miltefosina MOPS: Ácido 3-(N-morfolino)propanosulfônico PBS: Salina tamponada com fosfato SAP: Aspartil proteinases secretadas SFB: Soro fetal bovino UFC: Unidade formadora de colônia
15 xii SUMÁRIO 1 INTRODUÇÃO O gênero Candida spp C. albicans e seus fatores de virulência Morfogênese Aderência Enzimas hidrolíticas Alteração fenotípica Candidíases Epidemiologia Biofilmes Formação de biofilmes por C. albicans Matriz extracelular do biofilme de C. albicans Resistência a antifúngicos em biofilmes de C. albicans Terapia antifúngica para candidemia Derivados azólicos Poliênicos Equinocandinas Novas substâncias com atividade antifúngica OBJETIVOS Objetivo geral: Objetivos específicos MATERIAL E MÉTODOS Micro-organismos Drogas antifúngicas Teste de susceptibilidade in vitro aos agentes antifúngicos... 35
16 xiii Determinação da concentração inibitória mínima (IC) Determinação da concentração fungicida mínima (CFM) Efeito das drogas sobre a hidrofobicidade de superfície celular (HSC) Análise de lipídeos Extração e separação de lipídeos neutros (LN) e polares (LP) Análise de lipídeos neutros Análise de fosfolipídios Análise de ácidos graxos Formação de biofilme por C. albicans Condições de cultivo Formação do biofilme Quantificação do biofilme Efeito do tratamento com compostos antifúngicos no biofilme Efeito da adição dos compostos durante a formação do biofilme Efeito dos compostos no biofilme maduro Microscopia eletrônica de varredura (MEV) Microscopia Eletrônica de Transmissão (MET) Análise estatística RESULTADOS Perfil de susceptibilidade aos agentes antifúngicos Determinação da concentração inibitória minima Determinação da concentração fungicida minima Efeito das drogas sobre a Hidrofobicidade de Superfície Celular (HSC) Alterações ultraestruturais após tratamento com miltefosina Análise de esteróis Análise de fosfolipídios Análise de ácidos graxos Avaliação quantitativa dos efeitos da adição de drogas em diferentes fases de desenvolvimento do biofilme de C. albicans... 58
17 xiv Avaliação do feito da adição de drogas durante a formação do biofilme Avaliação do efeito da adição de drogas ao biofilme maduro Alterações morfológicas após a adição de drogas em diferentes fases de desenvolvimento do biofilme de C. albicans em catéter venoso central Alterações por adição de drogas durante a formação do biofilme Alterações morfológicas por adição de drogas ao biofilme maduro DISCUSSÃO CONCLUSÕES REFERÊNCIAS
18 1 1 INTRODUÇÃO 1.1 O gênero Candida spp. Os fungos do gênero Candida ssp. são micro-organismos eucariotos, não fotossintéticos, com organelas citoplasmáticas, membrana celular rica em esteróis (comumente o ergosterol) e parede celular. (AKPAN e MORGAN, 2002). Esse gênero compreende mais de 150 espécies que crescem em amplas faixas de temperatura, entre 20 e 38 C, e de ph, entre 2,5 e 7,5 (ODDS, 1998). Este comportamento permite que estes micro-organismos colonizem o hospedeiro tanto em sua superficie, onde as temperaturas são mais baixas, quanto internamente, em temperaturas de 36 C. Da mesma maneira, é possível que ocorra colonização por Candida spp. tanto em mucosas ácidas como o trato gênito-urinário, onde o ph pode chegar a 2,5, quanto na corrente sanguínea, onde o ph está em torno de 7. Cerca de 15 espécies de Candida spp. são reconhecidas como patógenos do hospedeiro humano: C. albicans, C. glabrata, C. tropicalis, C. parapsilosis, C. krusei, C. guilliermondii, C. lusitaniae, C. dubliniensis, C. pelliculosa, C. kefyr, C. lipolytica, C. famata, C. inconspicua, C. rugosa e C. norvegenis (PAPAS P., 2006). Dentro deste gênero, a C. albicans é a espécie mais patogênica ao homem e também é a mais frequentemente isolada em pacientes com infecção por Candida spp.(colombo et al., 2006). O comportamento patogênico e a invasividade tecidual de C. albicans parecem estar relacionados à expressão de alguns fatores de virulência, como: morfogênese, aderência, produção de enzimas hidrolíticas e mudança de fenótipo.
19 2 1.2 C. albicans e seus fatores de virulência Morfogênese Morfogênese (ou dimorfismo celular), em C. albicans e em C. dubliniensis, refere-se à transição entre a forma leveduriforme, unicelular, e o crescimento filamentoso, formando hifas e/ou pseudohifas (CALDERONE e FONZI, 2001) (Figura 01). A relação entre a formação de hifas e a virulência permanece incerta mas sabe-se que esta é atenuada em mutantes incapazes de mudar de forma. Assim, mutantes exclusivamente formadores de hifas ou de leveduras são menos virulentos do que aqueles que desenvolvem as duas morfologias (CALDERONE e FONZI, 2001). Dessa forma, ambas as morfologias parecem estar envolvidas no desenvolvimento da doença, considerando que a maioria das lesões apresenta tanto leveduras quanto hifas em seu interior e, portanto, ambas devem ser necessárias para a virulência do fungo. Figura 1: Esquema ilustrativo da transição entre as diferentes morfologias em C. albicans. Adaptado de: Romani L., Três observações levam a hipótese de que a formação de hifas está relacionada com a virulência, em C. albicans: primeiro, a formação de filamentos é estimulada por soro fetal bovino ou humano, a 37 C (BROWN e GOW, 1999), e estas circunstâncias mimetizam o ambiente do hospedeiro. Segundo, os filamentos recém-formados (tubos germinativos)
20 3 aderem-se com maior facilidade às células de mamíferos do que as leveduras unicelulares (CUTLER et al., 1991), e a aderência é essencial para que ocorra penetração tecidual. E terceiro, leveduras fagocitadas por macrófagos produzem filamentos e lisam a célula fagocítica, portanto, a produção de filamentos é, também, um mecanismos de evasão das defesas imunológicas do hospedeiro que permite a sobrevivência do patógeno e o desenvolvimento da infecção (CUTLER et al.,1991; LO et al., 1997; MITCHELL, P. et al.,1998) Aderência A aderência de C. albicans às células teciduais é um passo crucial para a sobrevivência do fungo no hospedeiro e é essencial para a invasão e disseminação do fungo pelo organismo. A levedura apresenta, na superfície da parede celular, receptores responsáveis pela aderência às células epiteliais e endoteliais, às proteínas do soro e às proteínas de matriz extracelular (CHAFFIN et al., 1998). Além disso, as células fúngicas também aderem à superfícies abióticas, como dispositivos médicos, levando à formação de biofilmes. A parede celular de C. albicans é construída de β-glucanas (polímeros ramificados de glicose contendo resíduos com ligações do tipo β-1,3 e β-1,6), quitina (polímeros de N-acetilglucosamina contendo ligações β-1,4), manoproteínas, pequenas quantidades de outras proteínas e lipídios (CHAFFIN et al., 1998) (Figura 2).
21 4 Figura 2: Esquema ilustrativo dos componentes da parede celular de C. albicans. Os polímeros de β- 1,3 e β-1,6 glucana estão representados em amarelo e azul, respectivamente; proteinas em verde, filamentos de quitina em laranja e mananas em vermelho. A adesão às células e às superfícies é conferida por proteínas de superficie celular especializadas, chamadas adesinas, que ligam aminoácidos específicos ou resíduos de açúcar na superfície de outras células, ou promovem a ligação à superfícies abióticas (VERSTREPEN et al., 2006). Estas adesinas incluem proteínas da família Als, Hwp1p, Eap1p, Csh1p e outros receptores de superfície celular menos conhecidos. A família de proteínas Als (seqüência aglutinina-like") inclui diversas proteínas ligadas à superfície da célula fúngica, com estrutura semelhante mas com ligantes diferentes, que são responsáveis pela adesão ao colágeno, fibronectina, laminina, células endoteliais e epiteliais, e agregação de célula a célula (FILLER et al., 2006). O receptor Hwp1p está presente somente na superfície de hifas e facilita a adesão ao epitélio (STAAB et al., 1999). Um outro receptor, o Eap1p ("maior aderência ao poliestireno") mostra homologia e similaridade estrutural ao Hwp1p, mas seus ligantes ainda são desconhecidos (FILLER et al., 2006).
22 5 Além disso, o receptor Csh1p, de 38 kda, que foi descrito por Singleton et al. (2001), aumenta a hidrofobicidade de superfície das células de C. albicans e, com isso, facilita interações específicas entre receptor e ligante no processo de aderência às células epiteliais, endoteliais e às proteínas da matriz extracelular. Embora muitas adesinas fúngicas tenham sido identificadas (STAAB et al., 1999; Singleton et al., 2001; FILLER et al., 2006), pouco se sabe sobre receptores do hospedeiro envolvidos na adesão. Atualmente, sabemos que os receptores Toll-like e outros receptores presentes na superfície das células imunológicas humanas estão envolvidos nestas interações. Proteínas presentes na superfície das células epiteliais ou endoteliais, como N-caderina, são importantes para o reconhecimento de diferentes formas de C. albicans e para sua endocitose (PHAN et al.2005; FILLER, 2006) Enzimas hidrolíticas A produção e secreção de enzimas hidrolíticas, como: proteases, lipases e fosfolipases são importantes fatores de virulência de C. albicans. Essas enzimas desempenham papel não só na nutrição, mas, também, nos danos teciduais, na disseminação no interior do hospedeiro, na aquisição de ferro e na evasão do sistema imunológico do hospedeiro. Desta maneira, contribuem para a patogenicidade do fungo. Diferentes tipos de enzimas hidrolíticas secretadas por C. albicans são conhecidas atualmente. A atividade de fosfolipases é muito alta durante a invasão do tecido, pois estas enzimas são responsáveis pela hidrólise das ligações de um ou mais ésteres de glicerofosfolípidos, componentes da membrana celular do hospedeiro. Ibrahim et al. (1995) mostrou que células de C. albicans isoladas de sangue têm atividades de fosfolipase extracelular maiores do que as estirpes comensais. Quatro diferentes fosfolipases secretadas são conhecidas: A, B, C e D (CALDERONE e FONZI, 2001; YANG, 2003). Dentre estas, a atividade de fosfolipase B1 (PLB1), que é tanto hidrolase quanto lisofosfolipase-transacilase
23 6 (GHANNOUM, 2000; YANG, 2003), é de extrema importância para a virulência de C. albicans, pois, mutantes deficientes na produção desta enzima mostraram virulência atenuada em modelos murinos de infecção (CALDERONE e FONZI, 2001), caracterizando-a como importante fator de virulência para este fungo. C. albicans pode, ainda, produzir proteinases, como as SAPs ( Secreted Aspartyl Proteinases ), já descritas como fator de virulência destas leveduras (NAGLIK et al., 2003). Diversas proteínas do hospedeiro sofrem hidrolise por SAPs, incluindo: colágeno, laminina, fibronectina, mucina, imunoglobulinas, citocinas pró-inflamatórias, complemento e precursores de fatores de coagulação do sangue (NAGLIK et al., 2004; SCHALLER et al., 2005). Além de aspartil proteinases, uma serina peptidase que hidrolisa diversos substratos, incluindo proteínas da matriz extracelular e proteínas do soro, também é secretada por C. albicans (DOS SANTOS et al., 2006) Alteração fenotípica A alteração de fenótipo, ou switching fenotípico, em C. albicans, pode ocorrer com alta frequência e de maneira reversível. Esta troca de fenótipos tem sido relacionada à virulência desta levedura uma vez que os isolados clínicos, que tendem a ser mais virulentos, fazem estas alterações com frequência mais alta do que as cepas laboratoriais, de menor virulência (JONES et al., 1994). A alteração classificada como sistema branco-opaco, em cepas WO-1, no qual colônias lisas e brancas transformam-se em colônias opacas e cinzentas, é a mais estudada dentre todas as alterações fenotípicas, em C. albicans. Algumas diferenças entre estes dois tipos de colônias são: a forma das células (células brancas são ovóides e células opacas são alongadas ou em forma de feijão) (Figura 3) e a germinação, a 37 C e em ph 6,7, só ocorre em células brancas e não em opacas (CALDERONE e FONZI, 2001).
24 7 Figura 3: Colônias brancas e opacas de C. albicans. Em (a) colônia branca com um setor opaco, (b) colônica branca (acima) e opaca (abaixo), (c) e (d) micrografias de microscopia eletrônica de varredura, em aumento de 1000 x, das células de colônia branca (c) e opaca (d). Adaptado de: Johnson A., 2003 Em experimentos de expressão diferencial de genes de proteínas da família SAP, foi demonstrado que SAP1 e SAP3 foram específicas de células opacas e SAP2 específica de células brancas. O gene EFG1, relacionado à morfogênese celular, foi expresso em células brancas, mas não em células opacas e a expressão ectópica deste gene em células opacas resultou na conversão imediata para a fase branca (CALDERONE e FONZI, 2001). Além disso, as células opacas mostraram-se melhores colonizadoras, em um modelo cutâneo de infecção, do que células em fase branca, mas, no entanto, as células opacas foram menos virulentas em um modelo animal de infecção sistêmica (KVAAL,C. et al., 1999). A expressão de fatores de virulência em C. albicans relaciona-se diretamente com a patogenicidade da cepa e sua capacidade de adaptação, sobrevivência e disseminação no organismo hospedeiro, determinando, assim, o desenvolvimento de doença.
25 8 1.3 Candidíases Fungos do gênero Candida spp. são componentes normais da microbiota da pele, do trato gastrintestinal e do trato urinário em indivíduos saudáveis. A partir de um desequilíbrio imunológico ou competitivo do hospedeiro, o crescimento destes fungos perde a sua regulação e pode ocorrer proliferação excessiva, levando ao desenvolvimento da doença, denominada candidíase. Esse comportamento caracteriza a candidíase como uma infecção fúngica oportunista. Na maioria dos casos, a infecção se instala na superfície cutânea ou nas mucosas mas pode, também, se disseminar para órgãos adjacentes ou distantes. Em casos de infecção da via hematogênica, chamados de candidemia, pode haver disseminação do fungo por todo o organismo do hospedeiro, permitindo a colonização de diversos orgãos e mucosas. Ao longo dos últimos trinta anos, o desenvolvimento da medicina, dos procedimentos cirúrgicos e dos transplantes, levou a um aumento drástico no número de indivíduos imunocomprometidos, que são mais susceptíveis às infecções fúngicas oportunistas. Pacientes com o sistema imunológico comprometido, como aqueles com infecção por HIV, portadores de doenças hematológicas, pós-cirúrgicos, pós-transplantados ou em terapia contra o câncer, encontram-se sob maior risco de desenvolver micoses invasivas. Além disso, o uso indiscriminado de agentes antimicrobianos de largo espectro de ação, de agentes imunossupressores e terapia prolongada com corticosteróides também determinam fatores de risco para o desenvolvimento destas infecções (KARKOWSKA-KULETA et al., 2009). Nessas circunstâncias, espécies de Candida spp. são capazes de causar infecções fúngicas invasivas (IFIs), que são complicações cada vez mais comuns em pacientes muito debilitados e são freqüentemente fatais. Um estudo, em um hospital terciário de recife - PE, realizado por Hinrichsen et al. (2008) mostrou que, em ambiente hospitalar, as principais condições de pacientes associadas à candidemia foram: antibióticoterapia, internação em unidade de tratamento intensivo (UTI), presença de cateter venoso central, terapia com corticosteróides,
26 9 nutrição parenteral total, adminstração de bloqueador de receptor H2 (bloqueadores do receptor de histamina do tipo 2, são inibidores da secreção ácida estomacal) e terapia com imunossupressores (Tabela 1). Tabela 1: Principais condições de pacientes, em ambiente hospitalar, associadas à candidemia. Publicado por: Hinrichsen et al., Condições associadas Número* Porcentagem Antibióticos 19 90,0 Internação na unidade de terapia itensiva 13 62,0 Cateter venoso central 12 57,0 Corticoesteróide 11 52,0 Nutrição parenteral total 5 24,0 Bloqueador H2 3 14,0 Imunossupressor 1 4,8 * Número de vezes em que as condições aparecem. (No período do estudo foram observados 21 episódios de candidemia em 18 pacientes) A disseminação de Candida spp. por via hematogênica ocorre, com frequência, em consequência ao uso de catéteres intravasculares, sondas gástricas ou prótese valvular cardíaca, estando frequentemente associada à formação de biofilmes (SENEVIRATNE, 2008). 1.4 Epidemiologia A candidemia tem demonstrado importância cada vez maior em casos de infecções hospitalares e Candida spp. é o quarto patógeno mais freqüentemente isolado de culturas sanguíneas hospitalares, sendo os mais isolados, em ordem decrescente: Staphylococcus coagulase-negativo, Staphylococcus aureus e Klebsiella pneumoniae (COLOMBO et al., 2006).
27 10 Nos últimos anos, alguns estudos têm reportado uma mudança na etiologia da candidemia em todo o mundo. Enquanto C. albicans ainda é considerada a espécie causadora mais comum (COLOMBO et al., 2006), o aumento de candidemias causadas por C. tropicalis, C. parapsilosis, C. glabrata e C. krusei tem sido demonstrado por diversas pesquisas (COLOMBO et al., 1999; SANDVEN et al., 1998; TRICK et al., 2002). Ainda assim, um estudo epidemiológico de Colombo et al. (2006) mostrou que, no Brasil, C. albicans foi responsável por 40% dos casos de candidemia, em um estudo com 712 pacientes (Tabela 2), onde a taxa de mortalidade foi de 54% (COLOMBO et al., 2006). Este mesmo estudo confirmou que C. tropicalis e C. parapsilosis foram responsáveis pela maior parte das infecções fúngicas por Candida não-albicans no Brasil e, também, que a taxa de candidemia em hospitais brasileiros foi de 2 a 15 vezes mais elevada do que em centros de controle nos Estados Unidos (WISPLINGHOFF et al., 2004), Canadá (MACPHAIL et al., 2002), e Europa (TORTORANO et al., 2002). Tabela 2: Incidência de C. albicans em 712 casos de candidemia, entre 2003 e 2004, no Brasil. Publicado por: Colombo et al., 2006 Espécies Número de casos (%) Incidência em 1,000 admissões Incidência em 1,000 pacientes/dia C. albicans 291 (40,9) 1,01 0,15 C. tropicalis 149 (20,9) 0,52 0,07 C. parapsilosis 146 (20,5) 0,51 0,07 C. pelliculosa 44 (6,2) 0,15 0,02 C. glabrata 35 (4,9) 0,12 0,02 C. guilliermondii 17 (2,4) 0,06 0,009 P. ohmeri 9 (1,3) 0,03 0,005 C. krusei 8 (1,1) 0,03 0,004 Outras a 13 (1,3) a : Outras espécies de Candida: C. lusitaniae, quatro casos; C. lipolytica, três casos; C. zeylanoides, um caso; Candida spp., cinco casos. Mais da metade das infecções da corrente sanguínea, incluindo infecções por Candida spp. em UTI estão relacionados com cateteres. A utilização de cateter venoso central (CVC) parece ser o fator de risco mais comum para o desenvolvimento de candidemia em pacientes
28 11 sem neutropenia ou imunodeficiências graves (TUMBARELLO et al., 2007). Em um estudo multicêntrico de 427 pacientes com candidemia, a taxa de mortalidade para pacientes com candidemia relacionada à utilização de cateter foi de 41%. Cerca de 40% dos pacientes com colonização microbiana em cateter venoso desenvolveram fungemia, com consequências que foram desde doenças focais até sepsemia e morte (CHANDRA et al., 2001). A alta mortalidade em pacientes com candidemia associada à utilização de CVC parece estar relacionada com a capacidade de formação de biofilme destes isolados clínicos. Em um estudo recente, Tumbarello et al. (2007), mostraram que a taxa de mortalidade em pacientes com candidemia, causada por isolados formadores de biofilme, apresentou-se significativamente maior do que em pacientes com infecções causadas por isolados não formadores de biofilme, demonstrando que a formação de biofilmes afetou a saúde de pacientes hospitalizados com candidemia e também mostrou-se um indicador significativo de mortalidade. 1.5 Biofilmes Desde o século XVII, biofilmes têm sido descritos em vários sistemas. A maioria das bactérias crescem, preferencialmente, em biofilmes, em todos os ecossistemas aquáticos autosuficientes em nutrientes, e estas células sésseis bacterianas diferem profundamente das suas homólogas planctônicas (células em suspensão) ( COSTERTON et al., 1995). As definições de biofilme evoluíram ao longo dos anos, paralelamente aos avanços da biologia e de pesquisas acerca do tema. Inicialmente, Costerton et al. (1987) postularam que biofilmes eram compostos por células individuais e microcolônias, embutidas em uma matriz altamente hidratada predominantemente composta por hexopolímeros aniônicos. Em seguida, Costerton e Lappin-Scott (1995) demonstraram que este processo é regulado por genes específicos, transcritos a partir da fixação inicial da célula. Em uma definição atual, um biofilme é uma comunidade microbiana de derivados sésseis caracterizado por células que
29 12 estão ligadas a um substrato, ou umas às outras, incorporadas em uma matriz de substâncias poliméricas extracelulares, produzida por elas mesmas, e exibem um fenótipo alterado no que diz respeito a taxa de crescimento e transcrição de genes (DONLAN e COSTERTON, 2002). Frequentemente, isolados de Candida spp. são identificados como agentes de candidemias, pneumonias hospitalares e infecções do trato urinário e, quase invariavelmente, estas infecções estão associadas à utilização de algum dispositivo médico e à formação de biofilme na superfície deste dispositivo. O dispositivo médico mais comumente colonizado é o CVC, utilizado para administração de líquidos, nutrientes e medicamentos. O fluido de infusão ou o cateter podem estar contaminados, mas, com maior frequência, os micro-organismos são introduzidos a partir da pele do paciente ou das mãos dos profissionais de saúde. Alternativamente, estes micro-organismos podem migrar para o cateter a partir de uma lesão pré-existente. No entanto, se Candida spp. colonizar o trato gastrointestinal como comensal, é capaz de penetrar a mucosa intestinal, disseminar-se através da corrente sangüínea e, então, leveduras circulantes podem colonizar de maneira endógena o cateter. Este poderia ser um mecanismo de disseminação do patógeno comum em pacientes com câncer que recebem quimioterapias causadoras de danos à mucosa intestinal (DOUGLAS, J.L., 2003). Após a formação do biofilme na superfície do cateter, o desprendimento de leveduras deste biofilme pode resultar em uma infecção disseminada aguda. Esta infecção pode, eventualmente, responder à terapia antimicrobiana mas as células que permanecerem no biofilme serão resistentes e poderão persistir como um reservatório da infecção até o cateter ser removido (BAILLIE e DOUGLAS, 1999). 1.6 Formação de biofilmes por C. albicans O desenvolvimento do biofilme de C. albicans, in vitro, em superfícies abióticas, ocorre em quatro etapas seqüenciais: (i) fase inicial, na qual as leveduras em suspensão e
30 13 circulantes aderem à superfície; (ii) fase intermediária, referente ao desenvolvimento do biofilme; (iii) fase de maturação, na qual a matriz polimérica embebe completamente todas as camadas de células aderidas à superfície, em uma estrutura tridimensional; (iv) dispersão, onde as células mais superficiais se desprendem do biofilme e colonizam áreas adjacentes da superfície (Figura 04) (CHANDRA et al., 2001; RAMAGE et al., 2005, SENEVIRATNE et al., 2008). Figura 4: Esquema ilustrativo da seqüência de desenvolvimento do biofilme de C. albicans, em suas diferentes fases. A: adesão de leveduras em suspensão à superfície, B: formação de colônias e multiplicação celular, C: secreção de matriz extracelular (MEC) e formação de hifas, formando uma estrutura tridimensional complexa. Adaptado de: Douglas J.L., 2003.
31 14 A fase inicial de desenvolvimento ocorre a partir da aderência da primeira levedura à superfície e estende-se por cerca de 11 horas. Inicialmente (0-2 h), a maior parte das células de C. albicans é de leveduras, que aderem à superfície e desenvolvem colônias, ao longo das 4 horas seguintes. Ao fim de 11 h, com a expansão lateral das colônias, as mesmas acabam por formar um filme de poucas camadas de células sobre a superfície. A fixação das leveduras ao substrato abiótico é mediada, primeiramente, por fatores inespecíficos, como hidrofobicidade de superfície celular e forças eletrostáticas (DONLAN et al., 2002) e, posteriormente, por adesinas específicas, como proteínas da família Als, presentes na superfície celular do fungo, que reconhecem ligantes na superfície ou nos componentes do meio fluido, tais como proteínas do soro (fibronectina e fibrinogênio) e fatores salivares (ZHAO et al., 2005). Durante a fase de desenvolvimento do biofilme (entre 12 e 30 h), as leveduras multiplicam-se e iniciam a formação de pseudo-hifas e hifas. As células, começam a produzir polissacarídeos e proteínas, formando uma matriz polimérica que embebe as células do biofilme, mantendo-as juntas e aderidas (Figura 5 a). Ao logo da fase de maturação (de 38 a 72 horas), a quantidade de material extracelular aumenta, de forma que todas as células encontram-se encorporadas à matriz polimérica. Ao final do processo, o biofilme consiste em uma rede densa de células sob a forma de leveduras, hifas e pseudo-hifas, embebidas por matriz extracelular polimérica e com canais de água entre as células, que facilitam a difusão de nutrientes do meio ambiente através da biomassa para as camadas inferiores e, também, permitem a eliminação de resíduos (Figura 5 b-c) (CHANDRA et al., 2001; RAMAGE et al., 2005; RAMAGE et al., 2001a). O biofilme maduro, ao atingir uma massa crítica, encontra um equilíbrio dinâmico no qual o aumento da densidade de células é compensado pela liberação de células de camadas mais superficiais para a colonização de outras superfícies, em um fenômeno chamado dispersão.
32 15 Figura 5: Microscopia eletrônica de varredura de biofilmes de Candida albicans. (a) biofilme fino mostrando extensa matriz extracelular, indicado pela seta branca. (b) biofilme altamente filamentado, seta branca indica um canal de água. (c) biofilme maduro com presença de hifas e leveduras, matriz extracelular não visível. Barras = 10 µm. Biofilmes de Candida spp., formados em modelos in vivo, parecem seguir a mesma seqüência de formação (ANDES et al., 2004), no entanto, a maturação ocorre mais rapidamente e a espessura final é maior nestes biofilmes do que naqueles cultivados em sistemas in vitro. O biofilme cultivado in vitro pode ter espessura variável entre 25 e 450 µm (CHANDRA et al., 2001; RAMAGE et al., 2001a; KUHN et al., 2002a), e, em modelos in vivo, a espessura é geralmente superior a 100 µm (ANDES et al., 2004). A arquitetura final do biofilme é variável e depende, em parte, do substrato sobre o qual ele é formado. O biofilme de Candida formado em superfícies de polimetilmetacrilato é descrito como uma camada espessa de matriz extracelular em que uma densa rede de leveduras, pseudo-hifas, e hifas estão inseridas. Já em um biofilme formado em superfícies planas e hidrofóbicas, tais como silicone e PVC, existe uma distribuição bifásica de componentes, ou seja, uma camada aderente de leveduras coberta por várias camadas de hifas e pseudo-hifas incorporadas em matriz extracelular (SENEVIRATNE et al., 2008). Além da composição da superfície do substrato, as condições de crescimento nas quais o biofilme é formado, tais como: meio de cultura utilizado (in vitro), concentração e tipos de açúcares, presença de proteínas do soro, ph e temperatura (KUMAMOTO, 2002;
33 16 SENEVIRATNE et al., 2008), influenciarão na composição final. E, ainda, diferentes cepas de C. albicans divergirão em sua capacidade de formação de biofilme. (KUHN, 2002a) Matriz extracelular do biofilme de C. albicans A matriz extracelular (MEC) é uma das características mais peculiares de um biofilme microbiano e é a responsável por formar a estrutura tridimensional do biofilme. A MEC mostra-se similar a um gel, altamente hidratado, no qual os micro-organismos apresentam-se imobilizados. A composição da matriz varia de acordo com a natureza dos organismos presentes no biofilme (AL FATTANI et al., 2006). Os polímeros que compõem a MEC de biofilmes bacterianos são principalmente exopolissacarídeos, dentre os quais, muitos são carregados negativamente, devido à presença da carboxila, grupamentos sulfato ou fosfato. Quantidades menores de proteínas, ácidos nucléicos e lipídios também podem estar presentes. Dois polissacarídeos de MEC bacteriana já caracterizados são: alginato, produzido por Pseudomonas aeruginosa, e poli β-1,6-n-acetilglicosaminas, secretados por bactérias Staphylococcus epidermidis e Staphylococcus aureus (STARKEY et al. 2004; GOTZ, 2002). A síntese de ambos os polissacarídeos tem sido relacionada à virulência dessas bactérias. A composição geral da MEC de biofilmes de C. albicans foi determinada por Alfattani et al. (2006) e esta apresentou, majoritariamente, carboidratos (39,6%), onde a maior proporção foi de glicose (32,2%), seguido de pequenas quantidades de manose e galactose. A matriz mostrou, ainda, pequenas quantidades de proteínas (5,0%), hexosamina (3,3% ), fósforo (0,5%) e ácido urônico (0,1%) Resistência a antifúngicos em biofilmes de C. albicans Segundo a definição de biofilme, as células que compõem esta estrutura apresentam fenótipo alterado e diferem das células planctônicas na expressão de genes, taxa de crescimento e, principalmente, na susceptibilidade aos agentes antifúngicos. O aumento
34 17 drástico da resistência antifúngica em células de C. albicans cultivadas como biofilmes, em relação às suas formas planctônicas, é a alteração comportamental de maior relevância médica. Múltiplos mecanismos têm sido sugeridos para explicar o aumento da resistência a antifúngicos do biofilme de C. albicans, incluindo a dificuldade de penetração da droga através da MEC e a morfológia das células fúngicas, que podem apresentar bombas de efluxo de drogas (Figura 6). Figura 6: Possíveis mecanismos envolvidos na resistência antifúngica do biofilme de C. albicans. Adaptado de: Niimi et al., 2010 A MEC pode se apresentar como uma barreira física, impedindo o acesso de agentes antimicrobianos às células incorporadas na comunidade do biofilme e, então, colaborar para o aumento da resistência à droga. Este obstáculo parece depender da quantidade e da natureza da matriz, assim como das propriedades físico-químicas da droga. Em biofilmes de bactérias, enzimas da MEC, também, podem digerir drogas, reduzindo seu efeito final (SENEVIRATNE, 2008). Em biofilmes de C. albicans, a produção de matriz aumenta drasticamente quando biofilmes são cultivados sob agitação, em comparação ao desenvolvimento em condições estáticas e, no entanto, ambos os tipos de biofilmes mostramse igualmente resistentes às drogas antifúngicas. Da mesma maneira, células em suspensão, recuperadas de biofilmes maduros, ressuspensas em meio líquido mostraram-se resistentes ao
35 18 fluconazol e à anfotericina B, mas não no mesmo nível que as células que permanecem no biofilme maduro (RAMAGE et al., 2005). Estes resultados parecem indicar que a MEC desempenha um papel parcial na resistência de células sésseis mas outros fatores, provavelmente, estão envolvidos. A resistência aos azóis em células planctônicas de C. albicans pode ser mediada por bombas de efluxo localizadas na membrana, pelos transportadores ligados a ATP (transportadores tipo ABC) e pelos facilitadores (MUKHERJEE, 2005). O papel dos genes que codificam bombas de efluxo na resistência antifúngica de biofilmes de C. albicans foi investigado por Ramage et al. (2002). Neste trabalho, demonstrou-se que a expressão dos genes CDR1, CDR2 e MDR1, responsáveis pela formação das bombas de efluxo de drogas em C. albicans, é regulada durante o curso de formação do biofilme. Mutantes de C. albicans com depleções simples e duplas (Δcdr1, Δcdr2, Δmdr1, Δcdr1/Δcdr2 e Δmdr1/Δcdr1) foram hiper-sensíveis ao fluconazol quando cultivados como células planctônicas, mas, ainda assim, mantiveram o fenótipo de resistência durante o crescimento do biofilme. Posteriormente, Mukherjee et al. (2003) demonstraram que os biofilmes formados pelas estirpes knockout para Cdr1, Cdr2 e/ou Mdr1, mostraram-se mais suscetíveis ao fluconazol no início do desenvolvimento do biofilme mas, ao longo do desenvolvimento e maturação, todas as cepas se tornaram resistentes ao antifúngico, indicando que o envolvimento de bombas de efluxo na resistência, em fases posteriores da formação do biofilme, é reduzido e que outros fatores parecem estar contribuindo para o comportamento resistente das células do biofilme maduro aos azóis. Análises de esteróis de membrana celular mostraram que os níveis de ergosterol apresentam-se significativamente menores nas fases intermediária e matura de desenvolvimento do biofilme de C. albicans em comparação à fase inicial. Uma vez que o metabolismo dos esteróis é o processo afetado pelas drogas mais amplamente empregadas na
36 19 terapia antifúngica, os níveis diminuídos de ergosterol presente nas células sésseis de biofilmes maduros de C. albicans podem refletir um estado fisiológico destas células mais propício para o comportamento resistente (RAMAGE, 2005). 1.7 Terapia antifúngica para candidemia As principais classes de antifúngicos comercializadas compreendem os poliênicos, os azóis, os tiocarbamatos, as alilaminas, os derivados morfolínicos, a 5-fluorocitosina, a griseofulvina e as equinocandinas (ODDS, 2003). A escolha da classe de antifúngico, assim como sua formulação, é feita a partir do quadro clínico desenvolvido pelo paciente. Para o tratamento da candidíase disseminada, desde 2004, a Sociedade Americana de Doenças Infecciosas recomenda equinocandinas (caspofungina), derivados azólicos (fluconazol e itraconazol) e polienos (anfotericina B). Entretanto, novos antifúngicos estão sendo incluídos ao tratamento, como voriconazol, posaconazol e micafungina (PAPPAS, 2004). A figura 7 mostra os principais alvos de ação dos agentes antifúngicos empregados no tratamento das candidemias. Figura 7: Principais alvos de ação na célula fúngica dos agentes empregados, atualmente, no tratamento das candidemias. Adaptado de: Katzung B.G., 2009.
37 Derivados azólicos Os azóis podem ser classificados, de acordo com sua estrutura química, em imidazóis e triazóis. Os imidazóis são caracterizados pela presença do anel imidazol (contendo 2 átomos de nitrogênio) enquanto os triazóis, pelo anel triazol (contendo 3 átomos de nitrogênio). Dentre os imidazóis, somente o cetoconazol possui atividade sistêmica, mas não é utilizado no tratamento de candidemias. Todos os triazóis têm atividade sistêmica e esta subclasse inclui: fluconazol, itraconazol, posaconazol, voriconazol e ravuconazol (Figura 8). O mecanismo de ação destes fármacos baseia-se na inibição da enzima C-14-α-lanosterol demetilase, componente de um sistema microssomal dependente do citocromo P450, prejudicando a biossíntese de ergosterol da membrana citoplasmática e levando ao acúmulo de 14-α-metilesteróis (do tipo 14α-metil-3,6-diol) no citoplasma da célula fúngica. Esses metilesteróis não possuem a mesma conformação nem as mesmas propriedades físicas que o ergosterol e, por isso, determinam alterações na permeabilidade e na fluidez da membrana celular do fungo. A inibição da síntese do ergosterol pode resultar em inibição do crescimento da célula fúngica (efeito fungistático) ou em morte celular (efeito fungicida), dependendo da sensibilidade da cepa causadora da infecção e do azol empregado no tratamento (SHEEHAN et al., 1999). Os novos triazóis (voriconazol, posaconazol e ravuconazol) apresentam maior potência e espectro de ação mais amplo quando comparados aos antigos azóis (fluconazol e itraconazol). Em estudo comparativo utilizando isolados clínicos de Candida spp., os três novos antifúngicos mostraram atividade semelhante entre si, substancialmente maior que a do fluconazol e pouco maior que a do itraconazol (PFALLER et al.,1998).
38 21 Figura 8: Estrutura química dos agentes azóis. Retirado de: Poliênicos Os representantes desta classe são anfotericina B e nistatina (Figura 9). A nistatina não pode ser administrada sistemicamente por conta de sua alta toxicidade e, portanto, apenas a anfotericina B é utilizada para o tratamento de candidemias. Anfotericina B é um dos fármacos de escolha na maioria das doenças fúngicas em humanos. Sua ação é fungicida, sendo indicada, em infecções sistêmicas, com administração por infusão endovenosa. Figura 9: Estrutura química dos agentes poliênicos. Retirado de: A estrutura básica dos poliênicos consiste em um anel lactâmico, com uma cadeia lipofílica rígida e uma porção hidrofílica flexível. Como mecanismo de ação, a anfotericina B liga-se diretamente à molécula de ergosterol formando poros na membrana celular, permitindo a saída de componentes intracelulares de baixo peso molecular (como íons) e culminando na morte celular por desestabilização da célula (Figura 10). A associação da
39 22 molécula de anfotericina B ao ergosterol ocorre por interação da cadeia hidrofóbica da substância antifúngica ao esterol de membrana (GHANNOUM e RICE, 1999). Figura 10: Mecanismo de ação da anfotericina B na célula fúngica. (A) bicamada lipídica com poro, permitindo a saída de material citoplasmático. (B) esquema explicativo da interação da molécula de anfotericina B com o ergosterol e formação do poro na mambrana celular. Adaptado de: Ghannoum e Rice, 1999 Os esteróis são essenciais para a estrutura normal e função das membranas celulares. Em mamíferos, o colesterol é o principal esterol de membrana na célçula, entretanto, em outros organismos eucariotos, como fungos e tripanosomatídeos, há a predominância de outros esteróis, incluindo o ergosterol e 24-metil esteróis. Esses esteróis são vitais para a viabilidade e crescimento das células fúngicas e tripanosomatídeos, mas estão ausente nas células de mamífero (SONG, 2007). Ergosterol e colesterol são moléculas estruturalmente muito parecidas, diferindo em poucos pontos. É sabido que algumas partes das moléculas de colesterol e ergosterol são importantes para a atividade da membrana celular, como o núcleo tetracíclico esteroidal e 3β- OH. Diferentemente do colesterol, o ergosterol (ergosta-5,7,22-trien-3β-ol) é um esterol anfipático caracterizado por conter uma hidroxila no C3 do anel A da molécula, o que caracteriza a porção polar, e o restante da cadeia alifática é a porção apolar da molécula. Também, possui duas duplas ligações no anel B, e uma dupla ligação na cadeia lateral alifática em C22(23), além de um grupo metil em C24. Essas três últimas características e ausência de metila em C4 e C14 parecem ser essenciais para o crescimento dos fungos
40 23 (SONG, 2007). A molécula de ergosterol dos fungos possui conformação tridimencional cilíndrica enquanto que o colesterol, esterol majoritário nas membranas celulares de mamíferos, possui conformação sigmóide. Esta diferença conformacional, provavelmente, é suficiente para explicar a maior afinidade de ligação da anfotericina B ao ergosterol em comparação ao colesterol. Entretanto, esta seletividade é baixa e a droga tem seu uso limitado devido ao alto grau de toxicidade (nefrotoxicidade, hepatotoxicidade e anemia hemolítica) (ODDS et al., 2003). Diversas formulações lipídicas foram desenvolvidas na tentativa de diminuir a natureza tóxica da formulação convencional. A tecnologia lipossomal foi empregada na produção da anfotericina B lipossomal (L-AMB), diminuindo drasticamente os efeitos adversos da anfotericina deoxicolato, entretanto estudos mostram que a eficácia terapêutica é similar a anfotericina deoxicolato. L-AMB é composto de anfotericina B complexado com fosfatidilcolina de soja hidrogenada, distearoilfosfatidilglicerol e colesterol, caracterizando um verdadeiro composto de lipossomas unilamelares (Ambisome, Astellas). Além da L- AMB, outras formulações lipídicas também foram desenvolvidas, como o complexo lipídico de anfotericina B (Abelcet, Enzon) e anfotericina B dispersão coloidal (Amphotec, Three Rivers). Também, está sendo desenvolvida a nistatina lipossomal para uso sistêmico (Nyotran, Aronex Pharmaceuticals) (ODDS et al., 2003). No entanto, a forma lipossomal é muito mais cara que as formas paternas, anfotericina B deoxicolato, o que pode restringir a sua utilização em centros médicos públicos, custanto cerca de 20 vezes mais que a anfotericina B deoxicolato (The Medical Letter, 2009) Equinocandinas As equinocandinas são uma nova classe de antifúngicos altamente seletivos. São lipopetídeos que se ligam à β-(1,3) glucano sintase, inibindo a síntese das β-(1,3) glucanas, constituintes da parede celular fúngica e levando a perda de função da mesma.
41 24 A parede celular é absolutamente essencial para a sobrevivência; mutações ou drogas que afetam a síntese dos componentes de parede celular podem resultar em células fúngicas inviáveis ao crescimento e ao estabelecimento de infecção. Tendo em vista que a parede celular não está presente como componente de células de mamíferos, estes não possuem β-(1,3) glucanas e esta classe de antifúngicos torna-se altamente seletiva em sua ação em fungos, apresentando reduzida toxicidade em células de mamíferos (KURTZ e DOUGLAS, 1997). Atualmente, existem três equinocandinas liberadas para uso pelo FDA: micafungina, caspofungina e anidulafungina (Figura 11). Dentre estas, somente a caspofungina está aprovada para o tratamento de candidíase (PERLIN, 2007). Figura 11: Estrutura química das equinocandinas. Adaptado de: www. doctorfungus.com. Em um estudo anterior, Pfaller et al. (2003) identificaram 351 isolados de Candida spp. resistentes ao fluconazol in vitro (IC > 64 µg/ml) e todos estes isolados mostraram-se sensíveis a caspofungina (99% dos ICs foram < 2 µg/ml). Em seguida, Cocuaud et al. (2005) demonstraram os efeitos do tratamento com doses terapêuticas de caspofungina em diferentes fases do desenvolvimento do biofilme de C. albicans e C. parapsilosis. A utilização deste antifúngico em concentrações de 2 µg/ml inibiu a formação de biofilme de ambas as espécies testadas, em todos os estágios de maturação (2, 24 ou 48 h) e este efeito mostrou-se independente da sensibilidade das cepas ao fluconazol (no caso de C. albicans). A eficácia da
42 25 caspofungina nestes experimentos confirma o potencial deste antifúngico como inibidor da formação de biofilmes de C. albicans e C. parapsilosis em dispositivos médicos. 1.8 Novas substâncias com atividade antifúngica Nas últimas décadas, o avanço da medicina vem propicíando um aumento na sobrevida de pacientes e no tempo de internação destes. Com isso, um aumento do número de indivíduos sob risco de aquisição de infecções fúngicas invasivas, bem como outras infecções oportunistas, também pode ser observado atualmente. O limitado arsernal terapêutico disponível para o tratamento de infeções fúngicas, associado às altas taxas de resistência aos antifúngicos, apontam para a necessidade de busca de novos alvos de ação na célula fúngica e novas moléculas com ação antifúngica para o tratamento destas infeções. Desde a década de 70, além dos agentes azólicos, novas moléculas inibidoras da síntese de ergosterol têm sido sintetizadas. Dentre estas, a atividade antifúngica dos azasteróis, inibidores da Δ24-esterol metiltransferase (24-SMT), foi demonstrada por diversos estudos ao longo dos últimos anos (BURBIEL et al., 2003). A inibição da 24-SMT é um alvo de estudo bastante interessante porque esta enzima é exclusiva da via biossintética de ergosterol, estando ausente na biossintese de outros esteróis, como o colesterol. Sendo assim, a 24-SMT está presente apenas em células de fungos, tripanossomatídeos e plantas e encontra-se ausente em células de mamíferos. Esta característica confere aos inibidores da 24- SMT seletividade e específicidade, que provavelmente determinarão uma redução dos efeitos adversos comuns durante a utilização de agentes inibidores de enzimas presentes tanto na biosintese de ergosterol quanto de colesterol. Estudos anteriores mostraram que o 15-azasterol, em concentrações entre 0,01 e 4,08 μg/ml, inibe o crescimento de Saccharomyces cerevisae e C. albicans, com um acúmulo
43 26 concomitante de moléculas intermediárias da via biosintética de esgosterol (OEHLSCHLAGER, 1984; GEORGOPAPADAKOU et al., 1987; HAYS et al., 1977). Dois azasteróis específicos, o azasterol (AZA) e o Epiminolanosterol (EIL) têm sido largamente estudados nos últimos anos e suas atividades tanto antifúngica quanto antiprotozoário já foram demonstradas por diferentes grupos de pesquisa. Recentemente, Ishida et al. (2009) mostraram que AZA e EIL induzem alterações ultraestruturais, acúmulo de corpos lipídicos e alterações no ciclo celular, em C. albicans. Além disso, a atividade antifúngica de AZA contra Paracoccidioides brasiliensis (VISBAL et al., 2003) foi demonstrada, assim como contra Pneumocystis carinii, no qual observa-se interrupção do crescimento e acúmulo de esteróis intermediários, indicando inibição de 24-SMT (URBINA et al., 1997). Estudos em protozoários, também, confirmaram a atividade inibitória de AZA e EIL em Trypanossoma cruzi (URBINA et al., 1995), L. amazonensis (RODRIGUES et al., 2007; RODRIGUES et al., 2002), Toxoplasma gondii (DANTAS-LEITE et al., 2004), e Giardia lamblia (MAIA, C. et al., 2007).
44 Figura 12: Via biosintética do ergosterol e colesterol, mostrando as principais etapas e as enzimas envolvidas. Em vermelho estão demonstradas as etapas inibidas pelos azóis e azasteróis. Adaptado de: De Souza e Rodrigues,
45 28 Alternativamente, um novo alvo de ação antifúngica parece estar surgindo a partir de estudos com análogos de fosfolipídios, como a miltefosina. Análogos de lisofosfolipidios constituem uma ampla classe de compostos metabolicamente estáveis que incluem as alquilfosfocolinas, tais como a hexadecilfosfocolina (miltefosina). A miltefosina foi inicialmente desenvolvida como agente antiproliferativo celular para o tratamento do câncer, porém sua atividade anticancerígena mostrou-se limitada devido a inaceitável toxicidade gastrointestinal e atividade limitada quando administrada por via oral. No entanto, este composto tem demonstrado ser eficaz como uma formulação tópica no tratamento de linfomas cutâneos e foi licenciado na Europa para o tratamento de metástases da pele devido ao câncer de mama. Em paralelo, os análogos de fosfolipídios mostraram ter potente atividade antiparasitária e seletividade, em especial contra parasitas tripanossomatídeos, como Leishmania spp. e Trypanosoma cruzi. Esses resultados levaram a estudos clínicos de administração oral de miltefosina em pacientes com leishmaniose visceral, incluindo aqueles infectados com cepas de L. donovani resistentes aos antimôniais. A elevada taxa de resposta e os efeitos colaterais relativamente suaves têm levado muitos pesquisadores a considerar essa substância como o tratamento oral aguardado para esta condição de risco de vida. A miltefosina é licenciada, para esta indicação, na India e na Alemanha, bem como na Colômbia para o tratamento de leishmaniose cutânea. Dada a sua natureza química e propriedades físico-químicas, esperamos que os análogos de fosfolipídios sejam capazes de interagir com uma variedade de estruturas subcelulares e enzimas, particularmente aquelas associadas às membranas celulares. Apesar deste fato, os resultados de muitos estudos independentes concluíram que a interferência com um número relativamente pequeno de alvos parece justificar os efeitos biológicos conhecidos destas substâncias.
46 29 Por conta da sua estrutura molecular, os análogos de fosfolipidios têm sido intensamente investigados como potenciais inibidores de enzimas envolvidas na síntese, degradação ou modificação da membrana lipídica. Os mais investigados são os efeitos destes análogos na via de síntese de fosfatidilcolina. Estudos têm demonstrado que estes compostos inibem a síntese deste fosfolipídio essencial em vários tipos celulares e, ainda, outros pesquisadores relataram uma correlação entre a inibição da síntese de fosfatidilcolina e o bloqueio da proliferação celular (Revisado em URBINA JA, 2006). Além disso, um possível mecanismo de ação para estes análogos seria a indução de apoptose. A diminuição da síntese de fosfocolina irá deprimir a produção de esfingomielina, já que estas vias biossintéticas são fortemente acoplados, e, por sua vez, levará à elevação dos níveis intracelulares de ceramida, que é um conhecido indutor de apoptose. Outra possibilidade, deduzida a partir de estudos em leveduras, é que os níveis intracelulares de ácido fosfatídico, produzido a partir da hidrólise fosfatidilcolina pela fosfolipase D, são os principais reguladores do crescimento das células nestes organismos (URBINA JA, 2006). O metabolismo da miltefosina e edelfosina foi investigado em L. mexicana por Lux et al. (2000), que verificou que esses compostos inibem uma enzima chave na remodelação de lipídios. Lira et al. (2001) realizou um estudo detalhado dos efeitos da miltefosina, edelfosina e ilmofosine na composição de fosfolipídios e esteróis de epimastigotas de T. cruzi e verificou que a biossíntese de fosfatidilcolina nestas células procede principalmente através da via Brenmer-Greenberg (transmetilação), que também é a principal via de fungos, mas só é usado em mamíferos sob condições de privação de colina. Além disso, os estudos em T. cruzi sugerem que a inibição da síntese de fosfatidilcolina através da via de Brenmer-Greenberg, especificamente ao nível de fosfatidiletanolaminametil-transferase-n, é um efeito primário da atividade antiparasitária destes compostos. Lira et al. (2001) observaram, ainda, que os IC 50 para edelfosina e miltefosina, necessários para
47 30 inibir a biossíntese de fosfatidilcolina em T. cruzi, foram vezes menores do que os necessários para atingir os mesmos efeitos em células de mamíferos. Estes resultados explicam a maior seletividade dos análogos de fosfolipidios em protozoários, comparado às células de mamíferos. Neste mesmo trabalho, ficou demonstrado que os análogos de fosfolipidios também induzem modificação na composição de esteróis livres em epimastigotas de T. cruzi, através da inibição da Δ-22-esterol desaturase, provavelmente um efeito secundário, resultante da alteração na composição fosfolipídica. Esta constatação levou a uma investigação sobre o possível sinergismo entre a antividade antiproliferativa dos análogos de fosfolipidios e os inibidores da biossíntese de ergosterol. Ainda que muitos estudos em protozoários já tenham sido realizados, pouco se sabe sobre os efeitos dos análogos de fosfolipídios em fungos. Recentemente, Widmer et al. (2006) demonstraram a atividade inibitória da miltefosina em diversas espécies fúngicas de importância médica, como: C. albicans, Cryptococcus neoformans e C. gattii, Aspergillus fumigatus, Fusarium solani, Scedosporium apiospermum, S. prolificans, e alguns zigomicetos. Entretanto, os mecanismos de ação relacionados a esta atividade antifúngica permanecem pouco conhecidos. O estudo de novas moléculas com potencial antifúngico contra os principais agentes causadores de micoses invasivas é importante para direcionar a busca por substâncias com maior espectro de ação e seletividade e menor toxicidade, visando o desenvolvimento de novos agentes antifúngicos. Diversos tipos de infecções por Candida spp. podem estar relacionadas com a formação de biofilme. Estas infecções são um sério problema de saúde humana, uma vez que a sensibilidade das células sésseis aos antifúngicos é reduzida quando comparada às células plactônicas (HAWSER e DOUGLAS,1995; RAMAGE et al., 2001b). Conseqüentemente, o
48 31 tratamento destas infecções torna-se complicado e o biofilme pode estabelecer-se como uma fonte permanente de infecção (DONLAN, 2001). Dentre os poucos antifúngicos disponíveis para o tratamento de candidemias, apenas as formulações lipídicas de anfotericina B e as equinocandinas (BACHMANN et al., 2002; KUHN et al., 2002b) mostraram atividade inibitória sobre o biofilme de Candida spp.. Em concentração terapêutica (2 µg/ml), a caspofungina foi capaz de reduzir significativamente a atividade metabólica do biofilme de C. albicans e C. tropicalis (COCUAUD et al., 2005). Tendo em vista que diversos procedimentos médicos exigem a utilização de dispositivos internos por longos períodos de tempo, como marca-passos, nutrição parenteral, e administração de medicamentos por via endovenosa, a disponibilidade de antifúngicos eficazes na prevenção da formação de biofilmes por C. albicans em dispositivos médicos torna-se extremamente importante. O reduzido número de classes de drogas disponíveis para o tratamento de candidemias associadas à formação de biofilmes e a alta incidência de resistência às drogas disponíveis, demonstra a necessidade de busca de novos compostos com atividade antifúngica e que também sejam ativos sobre células de biofilmes de C. albicans.
49 32 2 OBJETIVOS 2.1 Objetivo geral: Avaliar a atividade antifúngica de compostos com diferentes mecanismos de ação sobre células planctônicas e de biofilme de C. albicans. 2.2 Objetivos específicos Determinar a Concentração Inibitória Mínima e a Concentração Fungicida Mínima de cada um dos agentes antifúngicos para as células planctônicas de C. albicans; Avaliar o efeito dos compostos antifúngicos sobre a hidrofobicidade de superfície celular de cada uma das cepas de C. albicans; Avaliar as alterações ultraestruturais em cepas de C. albicans tratadas, através de microscopia eletrônica de transmissão; Avaliar as alterações no perfil lipídico de C. albicans após tratamento antifúngico; Avaliar quantitativamente o efeito dos compostos antifúngicos sobre a capacidade de formação de biofilme de duas cepas de C. albicans; Avaliar quantitativamente o efeito dos compostos antifúngicos sobre o biofilme maduro de duas cepas de C. albicans; Avaliar as alterações morfológicas causadas por compostos antifúngicos adicionados durante a formação de biofilme por cepas de C. albicans, em cateter venoso central, utilizando microscopia eletrônica de varredura; Avaliar as alterações morfológicas causadas por compostos antifúngicos adicionados sobre o biofilme maduro formado em cateter venoso central por cepas de C. albicans, utilizando microscopia eletrônica de varredura.
50 33 3 MATERIAL E MÉTODOS 3.1 Micro-organismos Foram utilizadas neste trabalho: uma cepa de C. albicans da American Type Culture Colection (ATCC 10231) e um isolado clínico de C. albicans (44A), obtido a partir de lavado gástrico de paciente atendido no Laboratório de Microbiologia e Micologia do Instituto Estadual de Hematologia Arthur de Siqueira Cavalcanti (HemoRio), Rio de Janeiro, Brazil (BRAGA-SILVA et al., 2009) e gentilmente cedido por Marcos Dornellas Ribeiro. 3.2 Drogas antifúngicas Os antifúngicos utilizados como padrão nos experimentos foram: fluconazol (Pfizer), itraconazol (SIGMA) e anfotericina B (SIGMA). Estas drogas foram diluídas em dimetilsulfóxido (DSMO) obtendo-se soluções estoque de 2000, 1600 e 1600 μg/ml, respectivamente. Os compostos 22,26 Azasterol (AZA) e 25-Epiminolanosterol (EIL) (cedidos pelo pesquisador Dr. Julio Urbina Caracas, Venezuela) foram diluídos em DMSO para obtenção das concentrações estoque de 12,5 e 1 mm, respectivamente. Miltefosina (MLT)(Caymen) e Tcan26 (composto cedido pela Dra. Theodora Calogeropoulou, Institute of Organic and Pharmaceutical Chemistry, National Hellenic Research Foundation, Grécia), foram diluídos em DMSO:Etanol (1:1) para a obtenção de concentração estoque de 1,56 e 50 mm, respectivamente. As soluções estoque foram diluídas em RPMI 1640, tamponado com MOPS, para a obtenção da concentração ideal em cada teste. A concentração final de DMSO não excedeu 1% para evitar a influência no crescimento das leveduras. O AZA e o EIL são inibidores sintéticos da enzima 24(25) esterol metil transferase (24-SMT) da via biosintética do ergosterol. Já a MLT e seu análogo sintético Tcan26, são alquilfosfocolinas (análogos de fosfolipídios) que atuam interferindo no metabolismo lipídico
51 34 da célula fúngica. A tabela 3 mostras as estruturas químicas de alguns compostos utilizados. A estrutura química do Tcan26 não está demonstrada porque ainda não foi publicada. Tabela 3: Estruturas químicas e mecanismos de ação de algumas substâncias antifúngicas utilizadas. Estrutura química Substância Mecanismo de ação Anfotericina B Ligação à molécula de ergosterol na membrana fúngica e formação de poros Fluconazol Inbição da 14-α-lanosterol demetilase na biossíntese de ergosterol Itraconazol Azasterol Inibição da 24-SMT na biossíntese de ergosterol Epiminolanosterol Miltefosina Alteração do metabolismo lipídico na célula fúngica
52 Teste de susceptibilidade in vitro aos agentes antifúngicos Determinação da concentração inibitória mínima (IC) A concentração inibitória mínima foi determinada pela técnica de microdiluição em caldo (Figura 13) descrito no documento M27-A3 (CLSI, 2008). Leveduras cultivadas em meio Sabouraud dextrose, por 48 h, foram padronizadas para 1-5 x 10 6 UFC/mL e diluídas para a obtenção de uma suspensão a 1-5 x 10 3 UFC/mL, em microplacas de 96 poços. 100 µl de meio RPMI 1640, com tampão MOPS 0,165 M, foram distribuídos em cada poço da microplaca, posteriormente, diluições seriadas das drogas foram realizadas para obter concentrações finais de 0,03 a 16 μg/ml para AZA, EIL, miltefosina e Tcan26; 0,25 a 128 μg/ml para fluconazol (FLU) e itraconazol (ITRA); e 0,015 a 8 µg/ml μg/ml para anfotericina B (AMB). Um volume de 100 µl da suspensão de leveduras (1-5 x 10 3 UFC/mL) foi dispensado nos poços para obter uma concentração fúngica final de 0,5-2,5 x 10 3 UFC/mL. As microplacas foram incubadas em uma câmara umidecida, a 35 C. A IC é definida como menor concentração da droga capaz de inibir o crescimento microbiano in vitro. As concentrações que inibem o crescimento de leveduras em 50% (IC 50 ) e em 90% (IC 90 ) foram determinadas no tempo de 48 h, por meio da densidade ótica em comprimento de onda de 492 nm, e a susceptibilidade aos antifúngicos padrão foi avaliada de acordo com os pontos de corte propostos pelo CLSI (2008), especificados na tabela 4.
53 36 Figura 13: Esquema representativo da microdiluição em caldo utilizando diluições seriadas dos antifúngicos para determinação do IC 50 e IC 90 de cada um dos compostos. Após a diluição dos compostos (fileiras 1-10), todos os poços da microplaca, exceto a coluna 12, receberam a mesma alíquota de suspensão fúngica padronizada. Tabela 4: Interpretação dos resultados da determinação da IC das drogas padrão (CLSI, 2008) Antifúngicos Concentração (µg/ml) Susceptível (S) Susceptível dose-dependente (SDD) Resistente (R) Fluconazol Itraconazol 0,125 0,25-0,5 1 Anfotericina B < Determinação da concentração fungicida mínima (CFM) Após a determinação da IC da droga, uma alíquota de 2 µl das concentrações inibitórias de cada droga foi semeada na superfície de agar Sabouraud dextrose isento de droga, incubadas a 35 C por 48 h. A CFM foi obtida pela observação da menor concentração da droga onde não houve crescimento de colônias. O efeito fungicida foi considerado quando a CFM for igual ou até 4 vezes maior que o valor de IC (PFALLER et al., 2004). 3.4 Efeito das drogas sobre a hidrofobicidade de superfície celular (HSC) A determinação da hidrofobicidade de superfície celular foi feita utilizando a uma metodologia baseada na afinidade das leveduras por um hidrocarboneto.
54 37 Leveduras tratadas ou não com as drogas, em RPMI 1640 tamponado com MOPS por 24h a 35 C, foram centrifugadas a 3300 rpm por 10 min, lavadas em PBS 0,05M ph 7,4 estéril, e resuspendidas no mesmo tampão. A absorbância da suspensão de leveduras foi determinada em espectrofotômetro, em comprimento de onda de 660 nm. Posteriormente, a suspensão de leveduras em PBS foi coloca em contato com xileno, em proporção 2,5:1; v/v. Os tubos falcon contendo a mistura foram agitados por 2 min e deixados em repouso por 20 min. A absorbância da fase aquosa foi determinada, e o índice de hidrofobicidade (IH) foi calculado utilizando a fórmula: IH = (A suspensão A xileno ) x 100 / A suspensão ; na qual: A suspensão é absorbância da suspensão de levedura em PBS e A xileno é a absorbância da fase aquosa obtida após a adição de xileno (TEIXEIRA et al., 1993). 3.5 Análise de lipídeos Acomposição lipídica da membrana células planctônicas do isolado clínico 44A foi avaliada em duas condições distintas de crescimento: na ausência e na presença de duas concentrações sub-inibitórias de miltefosina. O estudo do perfil lipídico foi realizado com objetivo de investigar se o mecanismo de ação antifúngica desta substância, um análogo de fosfolipídio, estaria relacionado ao metabolismo lipídico da célula. Para a determinação deste perfil foram avaliados dois grupos de lipídios presentes em grande quantidade na mebrana celular fúngica: lipídeos neutros e lipídeos polares. O grupo de lipídeos polares foi ainda dividido em fosfolipídios e ácidos graxos Extração e separação de lipídeos neutros (LN) e polares (LP) Leveduras de C. albicans (isolado 44A) foram tratadas com miltefosina, em diferentes concentrações previamente diluídas em meio RPMI 1640, tamponado com MOPS, por 48h, a 35 ⁰C. Os lipídeos totais de membrana de leveduras foram extraídos com uma mescla de clorofórmio:metanol (2:1, v/v), filtrados e concentrados à pressão reduzida. As amostras de
55 38 lipídeos foram ressuspendidas em clorofórmio e aplicadas em uma coluna de sílica gel (100 mesh, Sigma Aldrich), previamente ativado a 100 C, por 24 h. Os lipídeos neutros (LN) e polares (LP) foram separados utilizando clorofórmio e uma mescla de clorofórmio:metanol (1:1, v/v), respectivamente (BLIGH; DYER, 1959). Depois da separação, os LN e LP foram secos por pressão reduzida e armazenados a -70 C, até as próximas análises, como descrito a seguir Análise de lipídeos neutros As frações de LN foram analisadas por cromatografia em fase gasosa, acoplada à um espectrômetro de massas (CG-EM) para a análise quantitativa e estrutural dos lipídeos (VISBAL & SAN-BLAS, 2007). Os lipídeos neutros foram separados em uma coluna capilar de alta resolução HP-5 ultra 2 (25 m de comprimento, 0,20 mm de diâmetro interno, 5% difenil e 95 % dimetil polisiloxano com 0,33 mm de espessura) em um cromatógrafo a gás, modelo CG 5890 series II (Hewlett Packard), equipado com um detector de massas HP5972 (Hewlett Packard). Brevemente, os lipídeos foram diluídos em clorofórmio e injetados em uma coluna, que foi mantida a 50 C, por 1 min, em seguida, foi realizado um aumento crescente da temperatura até alcançar 280 C em uma taxa de aumento de 25 C /min, e finalmente, um aumento a 300 C na taxa de 1 C /min. O fluxo da fase móvel gasosa (hélio) foi mantido constante a 0,6 ml/min e as temperaturas do injetor e do detector foram mantidas a 250 C e 280 C, respectivamente Análise de fosfolipídios A fração de LP, que contém, principalmente, fosfolipídios, foi ressuspendida em 50 µl de uma mescla de clorofórmio:metanol (2:1, v/v) e um volume de 10 µl da amostra foi aplicado em uma placa sílica gel de dimensões de 10 x 20 cm (fase estacionária). As amostras foram eluídas da sílica gel usando uma mescla de clorofórmio:metanol: 32% amoníaco p/v
56 39 (17:7:1, por volume) (fase móvel) (CUZNER et al., 1967). Paralelamente às amostras, foram aplicados padrões de fosfolipídios (todos da Sigma Aldrich): L-α-fosfatidil-DL-glicerol, L-αácido fosfatídico dipalmitoil, L-α-fosfatidil-N1N-dimetil etanolamina dipalmitoil, L-αfosfatidil-L-serina, L-α-fosfatidilcolina, L-α-fosfatidilinositol, 3-sn- L-α-ácido fosfatídico e L-α-fosfatidiletanolamina. Os fosfolipídios separados por CCD foram revelados com iodo, e o fator de retenção (Rf) de cada substância foi calculado, sendo a razão da distância do percurso da substância (cm) e a distância do percurso da fase móvel (cm) Análise de ácidos graxos Para a análise de ácidos graxos esterificados, a fração de LP foi dissolvida em 200 µl de clorofórmio, e uma alíquota 50 µl de cada fração foi transmetilada pela adição de 200 µl de H 2 SO 4 5% em metanol, em banho-maria a 60 C, por 1h. Posteriormente, a reação foi parada adicionando 200 µl de água destilada (GUCKERT et al., 1985). Os ácidos graxos esterificados foram extraídos com éter de petróleo, secos e quantitativamente analisados pelo CG-MS, como descrito anteriormente para análise de LN. 3.6 Formação de biofilme por C. albicans Condições de cultivo As cepas de C. albicans foram cultivadas em agar Sabouraud dextrose a 35 C por 24 h, e, em seguida, em caldo Sabouraud a 35 C, por 24h. As leveduras foram lavadas em PBS 0,01 M, ph 7,2 e padronizadas a 1 x 10 7 UFC/mL em meio RPMI 1640 tamponado com MOPS e suplementado com 2% de glicose e 20% de Soro Fetal Bovino (SFB) (adaptado de JIN, Y. et al., 2003, 2004; NIKAWA et al., 2000).
57 Formação do biofilme O biofilme foi formado na superfície de poliestireno da microplaca de 96 poços. Primeiramente, 100 μl da suspensão fúngica (1 x 10 7 UFC/mL) foi dispensada nos poços, e incubadas a 37 C por 1,5 h, sob agitação. Após esse período as placas foram lavadas com PBS 0,01 M estéril e 100 μl de meio RPMI 1640 suplementado com 2% de glicose e 20% SFB foi adicionado em cada um dos poços. As placas foram incubadas por até 48 h a 35 C, sob agitação constante (adaptado de KUHN et al., 2002a) Quantificação do biofilme A quantificação do biofilme formado em microplaca de 96 poços foi realizada através do ensaio de redução do sal 2,3-bis (2-metoxi-4-nitro-5-sulfofenil)-5-[(fenilamino) carbonil]- 2H-hidróxido de tetrazolium (XTT)(Sigma). O biofilme foi lavado com PBS e 150 μl de solução XTT-menadiona em PBS, onde a concentração final é de 0,5mg/mL de XTT e 1mM de menadiona (Sigma), foram adicionados a cada poço e as placas foram incubadas por 2 h, a 35 C e ao abrigo da luz. Foram transferidos para uma placa de 96 poços, 100 μl da solução para a leitura da absorbância em 490 nm (adaptado de BIZERRA et al., 2008). 3.7 Efeito do tratamento com compostos antifúngicos no biofilme Efeito da adição dos compostos durante a formação do biofilme Inicialmente, 100 μl de suspensão fúngica padronizada (1 x 10 7 UFC/mL) foi dispensada nos poços de uma microplanca de 96 poços, e esta incubada a 35 C, por 1,5 h, sob agitação. Após este período de aderência, as placas foram lavadas com PBS 0,01 M estéril e 100 μl de diferentes concentrações das drogas, diluídas em meio RPMI 1640, tamponado com MOPS, suplementado com 2% de glicose e 20% de SFB, foram adicionados nos poços. As placas foram incubadas por até 48 h, a 35 C, sob agitação. O sobrenadante foi
58 41 descartado e o biofilme foi lavado em tampão PBS. A quantificação do biofilme foi realizada pela redução do XTT (Figura 14) (BRAGA et al., 2008) Efeito dos compostos no biofilme maduro O biofilme foi formado por 48 h na superfície da placa de poliestireno, como descrito anteriormente. Após esse período, o sobrenadante foi retirado e o biofilme foi lavado com PBS 0,01 M, ph 7,2. Em seguida foram adicionados à placa 100 μl das diferentes concentrações das drogas, previamente diluídas em meio RPMI 1640, tamponado com MOPS, suplementado com 2% de glicose e 20% de SFB e a placa foi incubada a 35 C, sob agitação, por mais 48 h. O sobrenadante foi descartado, o biofilme foi lavado em tampão PBS e a quantificação foi realizada pela redução do XTT (Figura 14) (CHANDRA et al., 2008). Figura 14: Esquema representativo dos testes in vitro utilizados para a determinação da atividade de drogas na formação e no biofilme maduro; e da quantificação por reação com XTT. Cada fileira (A-G) da placa de 96 poços recebeu 100 µl de um composto antifúngico nas concentrações determinadas entre colchetes (64, 16, 4 vezes maior ou igual a IC de cada droga). Todos os poços receberam 100 µl de suspensão antifúngica padronizada, exceto os poços 7-9 da fileira H, que receberam apenas meio de cultura. Os poços 1-6 da fileira H receberam apenas suspensão fúngica e são isentos de drogas (controle positivo). Após a incubação com XTT:Menadiona, a intensidade de cor laranja formada pela presença do composto formazan é proporcional à concentração de células viáveis em cada poço.
59 Microscopia eletrônica de varredura (MEV) O cateter intravenoso central do tipo BD Intracath em biomaterial Vialon, de 1.7 mm de diâmetro e 61 cm de comprimento, foi cortado para a obtenção de secções de aproximadamente 5 mm. Estas secções de cateter, com biofilmes controle e tratados com drogas em concentração 16 ou 8 vezes maior que a respectiva IC 50 ou IC 90 obtida para as células planctônicas, foram processados para MEV. Os cateteres foram lavados em PBS 0,01 M, ph 7,2, fixados em glutaraldeído 2,5% e paraformaldeído 4%, em tampão cacodilato 0,1 M, por 1 h, a temperatura ambiente. Posteriormente, os cateteres foram lavados no mesmo tampão e pós fixados em tetróxido de ósmio 1 % e ferrocianeto de potássio 1,25 % por 2h. Em seguida, foram desidratados em concentrações crescentes de etanol (30, 50, 70, 90, 100%) e etanol ultra-seco, durante 30 min em cada concentração. As amostras foram secas, em ponto crítico de CO 2, metalizadas com ouro e observadas em microscópio eletrônico de varredura Jeol JSM Microscopia Eletrônica de Transmissão (MET) As suspensões de células tratadas ou não, por 48h, a 35 C, com concentração sub-ic 90 de miltefosina foram processadas para MET. As suspensões foram lavadas em PBS 0,01 M, ph 7,2, fixadas em glutaraldeído 2,5% e paraformaldeído 4%, em tampão cacodilato 0,1 M, por 1 h, a temperatura ambiente. Posteriormente, as células foram lavadas no mesmo tampão e pós fixadas em tetróxido de ósmio 1 % e ferrocianeto de potássio 1,25 % por 2h. Em seguida, foram desidratados em concentrações crescentes de etanol (30, 50, 70, 90, 100%) e etanol ultra-seco durante 30 min em cada concentração. Após a desidratação, as amostras foram infiltradas, gradativamente, em mistura de resina spurr:etanol (1:3, 1:2, 1:1, 2:1, 3:1) e, em seguida, em spurr puro, overnight, a temperatura ambiente. Os materiais foram incluídos em spurr com DMAE, por 48 h, a 60 C. Os blocos foram cortados e os cortes ultrafinos
60 43 coletados em grades de cobre para contrastação com acetato de uranila 5%, por 45 minutos, e citrato de chumbo, por 5 minutos. A observação do material foi feita em microscópio Zeiss Análise estatística Os resultados obtidos nos itens 3.4 e 3.7 foram analisados utilizando o programa PRISM 5.0, e o intervalo de confiança de 95% foi considerado estatisticamente significativo.
61 44 4 RESULTADOS 4.1 Perfil de susceptibilidade aos agentes antifúngicos Determinação da concentração inibitória minima Os resultados do teste de susceptibilidade aos antifúngicos padrão (fluconazol, itraconazol e anfotericina B), aos inibidores da 24-SMT (AZA e EIL) e aos análogos de fosfolipídios (miltefosina e Tcan 26), podem ser vistos na tabela 5. Nela podemos observar as concentrações, em microgramas por mililitro (μg/ml), capazes de inibir 50% e 90% do crescimento fúngico, em relação ao controle, das duas cepas de C. albicans utilizadas neste estudo, frente a cada um dos inibidores. Esta determinação foi realizada no tempo de 48 h, por meio da densidade ótica, em espectrofotômetro, no comprimento de onda de 492 nm. Dentre os antifúngicos padrão, a anfotericina B mostrou menores valores de IC 50 e IC 90 para ambas as cepas. A cepa ATCC não foi sensível ao tratamento com AZA, enquanto que o isolado clínico (44A) apresentou valores de IC 50 e IC 90 significativamente baixos, semelhantes aos antifúngicos padrão, para este mesmo composto. Ambas as cepas mostraram-se sensíveis ao EIL, com valores de IC 50 semelhantes ao fluconazol. Os análogos de fosfolipídios mostraram IC 90 de 4 μg/ml para ambas as cepas e, tanto a MLT quanto o Tcan26, demonstraram atividade fungicida para a cepa 44A, com valor de CFM igual e duas vezes maior que o IC 90, respectivamente Determinação da concentração fungicida minima Os resultados do ensaio de determinação do efeito fungicida podem ser vistos na tabela 6, onde observamos a concentração fungicida mínima (CFM), em μg/ml, de cada um dos inibidores, para cada cepa de C. albicans. Esta determinação foi realizada no tempo de 48 horas, por meio de leitura visual da ausência de crescimento fúngico.
62 45 Tabela 5: Susceptibilidade das cepas de C. albicans aos inibidores da 24-SMT, aos análogos de fosfolipídios e aos antifúngicos padrão, analisados pelo método da microdiluição em caldo. Resultados de CI 50 e CI 90 estão expressos em µg/ml. Fluconazol Itraconazol Anfotericina B Azasterol EIL MLT Tcan 26 C. albicans ATCC C. albicans 44A IC 50 IC 90 IC 50 IC 90 IC 50 IC 90 IC 50 IC 90 IC 50 IC 90 IC 50 IC 90 IC 50 IC 90 1 >128 T 0,5 >16 T 0,12 0,06 >16 >16 1 > ,12 0,5 SDD 0,12 0,25 0, * 4 * 4 *Não foi possível determinar o IC 50 t: Efeito trailling SDD: Susceptível dose-dependente Tabela 6: Determinação da concentração fungicida mínima (CFM) dos inibidores da 24-SMT (AZA e EIL) e dos análogos de fosfolipidios (MLT e Tcan 26) contra cepas de C. albicans. 22,26 Azasterol EIL MLT Tcan 26 C. albicans ATCC >16 >16 * * C. albicans 44A * >16 4 8
63 * Não foram determinados. 46
64 Efeito das drogas sobre a Hidrofobicidade de Superfície Celular (HSC) De acordo com Hazen et al. (2000), leveduras com índice de hidrofobicidade celular menor que 10% são classificadas como células hidrofílicas, enquanto leveduras com índice maior que 90%, são consideradas hidrofóbicas. As suspensões de células de C. albicans tratadas com os inibidores da 24-SMT (AZA e EIL), com os análogos de fosfolipidios (miltefosina e Tcan 26) e com as drogas padrão (fluconazol, itraconazol e anfotericina B) tiveram sua hidrofobicidade de superfície determinada através de metodologia baseada na afinidade celular por hidrocarboneto insolúvel (TEIXEIRA et al., 1993). A HSC das células após o tratamento com os agentes antifúngicos foi comparada à HSC da célula controle não tratada. Os índices de hidrofobicidade (IH) calculados para cada uma das cepas de C. albicans anteriormernte e posteriormente ao tratamento com os agentes antifúngicos, assim como para os controles não tratados, estão descritos nas tabelas 7 e 8. O tratamento da cepa ATCC com fluconazol, em concentrações iguais ao IC 50 para esta droga, resultou em diminuição significativa na HSC, enquanto o tratamento com azasterol, também em concentrações iguais ao IC 50, determinou aumento significativo da hidrofobicidade superficial da célula. Os tratamentos com itraconazol, anfotericina B e EIL (tabela 7), bem como com miltefosina e Tcan26 (tabela 8) na cepa ATCC não determinaram alterações significativas de hidrofobicidade de superfície. Da mesma maneira, no isolado clínico, enquanto fluconazol, itraconazol, anfotericina B, AZA, EIL e miltefosina não alteraram a HSC, o tratamento com Tcan26 determinou redução significativa (tabelas 7 e 8) da mesma.
65 48 Tabela 7: Índice de hidrofobicidade celular de leveduras em suspensão após tratamento com AZA, EIL, fluconazol (FLU), itraconazol (ITRA), ou anfotericina B (AMB), nas concentrações de IC 50 de cada substância. Controle FLU ITRA AMB AZA EIL X ± DPM X ± DPM X ± DPM X ± DPM X ± DPM X ± DPM C. albicans ATCC ± ± ** ± ± ± * ± C. albicans 44A ± ± ± ± ± ± X: Média; DPM: Desvio Padrão da Média. * Estatisticamente diferente, onde p<0,05 (teste t-student). ** Estatisticamente diferente, onde p<0,01 (teste t-student). Tabela 8: Índice de hidrofobicidade celular de leveduras em suspensão após tratamento com miltefosina (MLT) ou Tcan26, nas concentrações de IC 90 de cada substância. Controle MLT Tcan 26 X ± DPM X ± DPM X ± DPM C. albicans ATCC ± ± ± C. albicans 44A ± ± ± * X: Média; DPM: Desvio Padrão da Média. * Estatisticamente diferente, onde p<0,05 (teste t-student). ** Estatisticamente diferente, onde p<0,01 (teste t-student).
66 Índice de Hidrofobicidade 49 Em relação aos controles positivos, crescidos na ausência de antifúngicos, a cepa de C. albicans ATCC mostrou-se menos hidrofóbica do que o isolado clínico, C. albicans 44A, com índices de hidrofobicidade em torno de 21 e 45, respectivamente (figura 15). Hidrofobicidade de Superfície Celular 50 *** ATCC A Figura 15: Comparação entre os índices de hidrofobicidade obtidos para as células controle das cepas ATCC e 44A de C. albicans. *** Estatisticamente diferentes, onde p<0, Alterações ultraestruturais após tratamento com miltefosina Células de C. albicans 44A em suspensão, controle e tratadas com 3µg/mL de miltefosina, foram avaliadas por microscopia eletrônica de transmissão. A concentracão de 3µg/mL (inferior a IC 90 ) foi escolhida para que houvesse crescimento celular significativo na presença da droga, ainda que com alterações morfológicas. A figura 16 apresenta as alterações morfológicas na célula após o tratamento com miltefosina (Figura 16 C-F), em relação à célula controle de C. albicans 44A (Figura 16 A-B). Na figura 16 A-B observamos a ultraestrutura da levedura controle, não tratada, que possui forma definida, fibrilas bem compactadas, parede celular homogênea e delimitada, com a membrana celular justaposta e citoplasma homogêneo. Em contrapartida, células tratadas com miltefosina (Figura 16 C-F) apresentaram espessamento e afrouxamento das
67 50 fibrilas (setas pretas na figura 16 C e E, respectivamente), parede celular espessada em determinados pontos (setas vermelhas nas figuras 16 E-F), alterações na integridade da membrana celular (setas amarelas na figura 16 D-F), e presença de invaginações de membrana celular (setas amarelas na figura 16 D-E). A divisão celular por brotamentos parece ser afetada pelo tratamento com a miltefosina, pois, muitas células filhas apresentaram-se extremamente alteradas (* na figura 16 E). Em algumas células tratadas com miltefosina foi possível observar inchaço mitocondrial (m, figuras 16 C e F), presença de vacúolos eletrondensos (v, figura 16 C) e citoplasma granuloso (Figura 16 F).
68 Figura 16: Micrografias de microscopia eletrônica de transmissão de C. albicans 44A controle (A-B) e tratada com 3 μg/ml de miltefosina (C-F). Células controle apresentaram membrana celular contínua (mp, em B), parede celular homogênea e compacta (pc, em B) e fibrilas organizadas e compactadas (f, em B). As células tratadas mostram desorganização e afrouxamento das fibrilas (setas pretas em C e E), invaginações e alterações na membrana celular (setas amarelas em D-F), aumento da espessura da parede celular (setas vermelhas em E-F), vacúolos (v, em C) e inchaço mitocondrial (m, em C e F). As leveduras tratadas apresentaram alteração de forma celular (C-F) e brotamentos alterados (* em C). Barras correspondem a 0,5 μm em A,B,C e E, e a 1 μm em D e F. 51
69 52
70 Análise de esteróis As células controle de C. albicans (44) apresentaram o esqualeno como esterol majoritário (88,87%), seguido de colesterol e ergosterol (Tabela 9). Quando as leveduras foram tratadas com concentrações sub-inibitórias de miltefosina, foi verificada presença de ergosterol em 39,5%, sobretudo quando o tratamento foi feito com 0,5 µg/ml do composto. Entretanto, o aumento da síntese de ergosterol na maior concentração utilizada, de 1 µg/ml, não foi proporcional à concentração de droga utilizada, como o esperado (Tabela 9). É importante relatar que na concentração de 1 µg/ml de miltefosina observou-se, por meio de um microscópio de luz, a presença de debris celulares, o que poderia ter influenciado na perda de lipídeos durante o processo de extração. O número de células na amostras controle e tratadas foi padronizado antes da realização da análise, assim, as porcentagens de esteróis encontradas se relacionam a uma mesma concentração de células, em cada uma das situações analisadas. Tabela 9: Porcentagem relativa de esteróis extraídos de leveduras de C. albicans 44A não tratadas (controle) e tratadas com miltefosina (concentrações em µg/ml), obtido por meio de um cromatógrafo gasoso acoplado a um espectro de massas. Esteróis (Peso molecular) Tempo de retenção (min) Controle 0,5 µg/ml 1 µg/ml Esqualeno (410) 16,20 88,87 56,04 83,04 Colesterol (386) 21,61 6,15 4,44 6,80 Ergosterol (396) 23,37 4,97 39,50 10,15
71 Análise de fosfolipídios Uma análise qualitativa do perfil de fosfolipídios extraídos de leveduras tratadas com diferentes drogas pode ser avaliada por meio de uma cromatografia em camada delgada. Os padrões de fosfolipídios utilizados neste trabalho foram testados previamente em por meio de uma cromatografia em camada delgada de sílica gel, onde os Rfs foram determinados: (1) L-α-fosfatidil-DL-glicerol (Rf=não detectado), (2) L-α- ácido fosfatidico dipalmitoil (Rf=0), (3) L- α -fosfatidil-n 1 N-dimetil etanolamino dipalmitoil (Rf=0,62), (4) L- α-fosfa-l-serina (Rf=não detectado), (6) L-α-fosfatidilcolina (Rf=0,38), (7) L-αfosfatidilinositol (Rf=0,21), (8) 3-sn-L-α- ácido fosfatidico de sódio (Rf=0,16) e (9) L-αfosfatidiletanolamina (Rf=0,52). Colunas (5) e (10) são mesclas dos padrões de fosfolipídios. Esses valores de Rf serão utilizados para identificar as manchas encontradas em cromatograma de amostras de lipídeos polares analisadas posteriormente. Na amostra de leveduras de C. albicans 44A controle foi possível identificar todos os fosfolipídios com Rf determinado em experimento anterior (Figura 17). No entanto, o crescimento em meio RPMI 1640, tamponado com MOPS, contendo 0,5 ou 1,0 µg/ml de miltefosina parece afetar a síntese de fosfolipídios, diminuindo qualitativamente a síntese de (2), (6) e (8). Considerando que estes são, respectivamente, ácido fosfatídico dipalmitoil, fosfatidilcolina e ácido fosfatídico de sódio, o tratamento de C. albicans com concentrações subinibitórias de MLT parece determinar alterações nos níveis de fosfolipídios, em especial os derivados de fosfatidilcolina. Devemos considerar o efeito inibitório drástico que a miltefosina exerce sobre o crescimento de C. albicans (44A) em concentração igual ou superior a 4,0 µg/ml (concentração inibitória mínima IC), apresentando 100 % de inibição do crescimento fúngico. Adicionalmente, em concentrações 1,0 µg/ml, miltefosina não apresenta nenhum efeito inibitório. Interessantemente, esta droga apresenta efeito fungicida em leveduras tratadas com a IC 90 (4 µg/ml) e concentrações acima da IC 90.
72 Figura 17: Cromatografia em camada delgada da fração polar de lipídeos extraídos de C. albicans (44A) tratada com 0,5 e 1,0 µg/ml de miltefosina, em meio RPMI 1640, por 48 h, a 35 C. A concentração inibitória que inibiu 100% do crescimento fúngico foi de 4,0 µg/ml. Concentrações das drogas estão µg/ml. 55
73 56
74 Análise de ácidos graxos Após a reação de esterificação dos ácidos graxos com 5% H 2 SO 4 em metanol, as amostras foram analisadas em um cromatógrafo a gás acoplado a um espectrômetro de massas. Podemos observar a presença de ésteres de ácidos graxos em C. albicans 44A, tais como: ácido palmitoleico (C16:1), ácido palmítico (C16:0), ácido linolenico (C18:3), ácido linoleico (C18:2), ácido oleico (C18:1) e ácido esteárico (C18:0). O ácido graxo majoritário, em C. albicans 44A controle, foi o ácido palmítico (C16:0) (Tabela 10). Foi possível identificar pequenas alterações no perfil de ácidos graxos em células de C. albicans (44A) tratadas com miltefosina, em concentrações de 0,5 e 1 µg/ml, como o aumento de ácido oleico (C18:1) e ácido linolenico (C18:3), quando comparado com as células controle (Tabela 10). Tabela 10: Porcentagem relativa de ésteres de ácidos graxos extraídos de leveduras de C. albicans (44A) controle e tratadas com 0,5 e 1 µg/ml de miltefosina, obtidos por meio de um cromatógrafo à gás acoplado a um espectrômetro de massas. Ácidos graxos Tempo de retenção (min) Miltefosina Controle 0,5 µg/ml 1,0 µg/ml C16:1 17,92 6,7 6,2 5,4 C16:0 18,35 26,4 32,7 19,9 C18:3 18,97 23,9 21,6 29,7 C18:2 22,54 15,0 11,9 13,0 C18:1 22,70 22,3 22,4 27,3 C18:0 23,30 5,5 5,1 4,6
75 Avaliação quantitativa dos efeitos da adição de drogas em diferentes fases de desenvolvimento do biofilme de C. albicans Avaliação do feito da adição de drogas durante a formação do biofilme A formação de biofilme por C. albicans ATCC na presença dos azóis (fluconazol e itraconazol), em concentrações iguais ao IC 50 das células planctônicas, e em 4, 16 e 64 vezes maiores que o IC 50, não foi reduzida significativamente, quando comparada ao biofilme controle, formado na ausência de drogas (Figura 18). Contudo, o número de células viáveis no biofilme de C. albicans ATCC formado na presença de fluconazol mostrou uma pequena redução que, apesar de não ser estatisticamente significativa para as concentrações testadas, apresenta um padrão dose-dependente (Figura 18). A formação de biofilme por C. albicans ATCC foi significativamente reduzida (p<0,05) quando na presença de concentracões de 8 μ g/ml de anfotericina B (concentração 64 vezes maior do que o IC 50 ), mas o mesmo não ocorreu com concentracões menores desta droga (Figura 18). A cepa ATCC mostrou formação de biofilme significativamente reduzida (p<0,01) quando na presença de 256 μg/ml de AZA, mas concentracões menores desta droga não resultaram em redução do biofilme formado (Figura 19). A atividade metabólica do biofilme formado na presença de EIL, em todas as concentracões testadas (igual ao IC 50, 4 e 16 vezes maior que o IC 50 ), foi semelhante à do controle (Figura 19). Dentre os análogos de fosfolipidios, a miltefosina, em concentracões de 32 μg/ml (16 vezes maiores que IC 90 ), reduziu significativamente (p<0,05) a formação do biofilme, enquanto que concentracões menores desta droga não mostraram os mesmos resultados (Figura 19). A adição de Tcan26, em todas as concentracões testadas, durante o desenvolvimento do biofilme de C. albicans ATCC 10231, levou a formação de um biofilme significativamente (p<0,05) reduzido, quando comparado ao controle (Figura 19).
76 Absorbância (490 nm) Absorbância (490 nm) Absorbância (490nm) Fluconazol Controle Itraconazol Controle 0, Concentração ( g/ml) Concentração( g/ml) Anfotericina B Controle 0,12 0,5 2 8 * Concentração ( g/ml) Figura 18: Redução de formação de biofilme por C. albicans ATCC na presença de drogas padrão em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga. *Estatisticamente diferente, onde p<0,05 (teste de t-student)
77 Absorbância (490 nm) Absorbância (490nm) Absorbância (490 nm) Absorbância (490 nm) AZA ** Controle EIL Controle Concentração ( g/ml) Concentração ( g/ml) Miltefosina * Controle Tcan 26 * * * Controle Concentração ( g/ml) Concentração ( g/ml) Figura 19: Redução de formação de biofilme por C. albicans ATCC na presença de inibidores da 24-SMT e análogos de fosfolipidios em concentrações iguais ao IC 50 (AZA e EIL) ou IC 90 (miltefosina e Tcan 26), 4 e 16 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 ou IC 90 da droga. *Estatisticamente diferente, onde p<0,05 (teste de t-student) **Estatisticamente diferente, onde p<0,01 (teste de t-student)
78 61 A susceptibilidade do isolado cínico (44A) aos antifúngicos padrão não foi semelhante à cepa ATCC (Figuras 18 e 20). O biofilme de C. albicans 44A, quando formado na presença de 16 e 64 μg/ml de fluconazol (16 e 64 vezes maiores que o IC 50, respectivamente), mostrou atividade metabólica significativamente reduzida (p<0,05 e p<0,01, respectivamente) em relação ao controle (Figura 20). A adição de itraconazol ou anfotericina B, em concentracões até 64 vezes maiores que o IC 50 destas substâncias, não alterou a capacidade de formação de biofilme do isolado clínico (Figura 20). A atividade metabólica das células no biofilme formado na presença de anfotericna B mostrou redução com padrão dose-dependente, mas não siginicativa em relação ao controle (Figura 20). Os biofilmes de C. albicans 44A, formados na presença de diferentes concentrações dos inibidores da 24-SMT, mostraram atividade metabólica semelhante ao controle, formado na ausência das drogas (Figura 21). Entretanto, os análogos de fosfolipidios mostram-se capazes de reduzir a formação de biofilme por esta cepa. A adição de concentrações de 16 e 32 μg/ml de miltefosina (4 e 8 vezes maiores que o IC 50 ) culminaram em redução significativa (p<0,05) do biofilme formado ao final de 48h (Figura 21). Da mesma maneira, redução significativa foi obtida quando concentracões de 64 μg/ml de Tcan26 (16 vezes maiores que o IC 50 ) foram adicionadas durante a formação do biofilme do isolado clínico (Figura 21).
79 Absorbância (490nm) Absorbância (490nm) Absorbância (490nm) Fluconazol 0.5 Itraconazol 0.4 * ** Controle Concentração ( g/ml) 0.0 Controle 0,12 0,5 2 8 Concentração ( g/ml) 0.5 Anfotericina B Controle 0,06 0, Concentração ( g/ml) Figura 20: Redução de formação de biofilme por C. albicans 44A na presença de drogas padrão em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga. *Estatisticamente diferente, onde p<0,05 (teste de t-student) **Estatisticamente diferente, onde p<0,01 (teste de t-student)
80 Absorbância (490nm) Absorbância (490 nm) Absorbância (490 nm) Absorbância (490 nm) AZA 0.5 EIL Controle 0, Controle Concentração ( g/ml) Concentração ( g/ml) 0.5 Miltefosina 0.5 Tcan * * * Controle Controle Concentração ( g/ml) Concentração ( g/ml) Figura 21: Redução de formação de biofilme por C. albicans 44A na presença de inibidores da 24- SMT (AZA e EIL) em concentrações iguais ao IC 50, 4 e 16 vezes maiores, e na presença de análogos de fosfolipidios (miltefosina e Tcan26) em concentrações iguais ao IC 90, 4 e 8 ou 16 vezes maiores. A menor concentração em cada gráfico é referente ao valor de IC 50 ou IC 90 da droga. *Estatisticamente diferente, onde p<0,05 (teste de t-student)
81 Avaliação do efeito da adição de drogas ao biofilme maduro Em biofilmes maduros de C. albicans ATCC 10231, formados em placas de 96 poços, por 48h, o tratamento com diferentes concentrações de azois, por 48h adicionais, não reduziu a massa final de biofilme, em relação ao controle (Figura 22). Entretanto, o tratamento do biofilme maduro com anfotericina B, nas concentrações de 2 e 8 μg/ml (16 e 64 vezes maiores que o IC 50, respectivamente) determinaram reduções significativas (p<0,05 e p<0,01, respectivamente) na atividade metabólica da massa final de células que compõe o biofilme (Figura 22). O tratamento de biofilmes maduros, formados pela cepa ATCC 10231, com inibidores da 24-SMT, em concentrações iguais e maiores que o IC 50 de cada uma das drogas, não reduziu a atividade metabólica final do biofilme. Da mesma maneira, após o tratamento de biofilmes maduros desta cepa com análogos de fosfolipídios, nenhuma redução significativa de viabilidade celular foi observada, em relação ao biofilme controle (Figura 23). O biofilme maduro formado por C. albicans 44A, após ser tratado, por 48h adicionais, com fluconazol, itraconazol, anfotericina B, inibidores da 24-SMT ou análogos de fosfolipidios, mostrou atividade metabólica final semelhante ao biofilme controle, em todas as concentrações utilizadas (Figuras 24-25). Entretanto, o tratamento de biofilmes maduros do isolado clínico (44A) com 4 μg/ml de Tcan26 (concentração igual ao IC 90 ) determinou aumento significativo (p<0,05) na massa final de biofilme (Figura 25).
82 Absorbância (490 nm) Absorbância (490nm) Absorbância (490nm) 65 Fluconazol Controle Itraconazol Controle 0, Concentração ( g/ml) Concentração ( g/ml) Anfotericina B * ** Controle 0,12 0,5 2 8 Concentração ( g/ml) Figura 22: Redução do biofilme maduro de C. albicans ATCC após a adição de drogas padrão em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga. *Estatisticamente diferente, onde p<0,05 (teste de t-student) **Estatisticamente diferente, onde p<0,01 (teste de t-student)
83 Absorbância (490nm) Absorbância (490nm) Absorbância (490 nm) Absorbância (490nm) AZA 0.7 EIL Controle Controle Concentração ( g/ml) Concentração ( g/ml) 0.7 Miltefosina 0.7 Tcan Controle Controle Concentração ( g/ml) Concentração ( g/ml) Figura 23: Redução do biofilme maduro de C. albicans ATCC após a adição de inibidores da 24- SMT e análogos de fosfolipidios em concentrações iguais ao IC 50 (AZA e EIL) ou IC 90 (miltefosina e Tcan 26), 4 e 16 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 ou IC 90 da droga.
84 Absorbância (490nm) Absorbância (490nm) Absorbância (490nm) 67 Fluconazol Itraconazol Controle Concentração ( g/ml) Controle 0,12 0,5 2 8 Concentração ( g/ml) Anfotericina B Controle 0,06 0, Concentração ( g/ml) Figura 24: Redução do biofilme maduro de C. albicans 44A após a adição de drogas padrão, em concentrações iguais ao IC 50 e 4, 16 e 64 vezes maiores, sendo a menor concentração em cada gráfico igual ao valor de IC 50 da droga.
85 Absorbância (490nm) Absorbância (490nm) Absorbância (490nm) Absorbância (490nm) 68 AZA EIL Controle 0, Controle Concentração ( g/ml) Concentração ( g/ml) Miltefosina Tcan * Controle Controle Concentração ( g/ml) Concentração ( g/ml) Figura 25: Redução do biofilme maduro de C. albicans 44A após a adição de inibidores da 24-SMT (AZA e EIL) em concentrações iguais ao IC 50, 4 e 16 vezes maiores, e após a adição de análogos de fosfolipidios (miltefosina e Tcan26) em concentrações iguais ao IC 90, 4 e 8 ou 16 vezes maiores. A menor concentração em cada gráfico é referente ao valor de IC 50 ou IC 90 da droga. *Estatisticamente diferente, onde p<0,05 (teste de t-student)
86 Alterações morfológicas após a adição de drogas em diferentes fases de desenvolvimento do biofilme de C. albicans em catéter venoso central Alterações por adição de drogas durante a formação do biofilme A formação de biofilmes de C. albicans ATCC e C. albicans 44A, em cateter venoso central (CVC), na presença de concentrações 16 vezes maiores que o IC 50 de fluconazol, AZA e EIL, 8 e 16 vezes maiores que o IC 90 de miltefosina e Tcan26, respectivamente, foi analizada em relação ao biofilme controle crescido na ausência de drogas. Para esta análise de alterações morfológicas foi utilizada a microscopia eletrônica de varredura (MEV). O biofilme formado, por 48 h, por C. albicans ATCC (figuras 26 A-B, 27 A-B) mostrou menor densidade de células do que o formado pela cepa de C. albicans 44A (figuras 28 A-B, 29 A-B). As células de C. albicans ATCC aderidas ao cateter, na ausência de drogas, apresentaram formato de levedura, com abundantes brotamentos e poucos filamentos (Figuras 26-B, 27-B). A adição de 16 μg/ml de fluconazol ao cateter durante o desenvolvimento do biofilme da cepa ATCC levou à redução do número de células aderidas ao dispositivo (figura 26-C), além de determinar alterações na morfologia de algumas células (figura 26-D e inset). Em contrapartida, a adição de 256 μg/ml de AZA ao cateter levou ao aumento no número de células aderidas (figura 26-E) e não pareceu determinar alterações morfológicas às células, que apresentaram-se íntegras, leveduriformes e com abundância de brotamentos (figura 26-F). O tratamento com EIL (16 μg/ml), no entanto, levou a redução pronunciada da aderência de leveduras ao cateter e, além disso, as células crescidas na presença desta droga parecem estar maiores do que as células do biofilme controle (Figura 26 G-H).
87 70 Os análogos de fosfolipídios, ao serem adicionados ao CVC, durante a formação do biofilme de C. albicans ATCC 10231, determinaram alterações significativas na morfologia celular (Figura 27 D e F). Os cateteres, após adição de miltefosina ou Tcan26, em concentracões de 32 e 64 μg/ml, respectivamente, (16 vezes maiores que o IC 90 de cada droga) apresentaram células aderidas em quantidade semelhante ao controle (Figuras 27 C e E), porém, as células tratadas parecem estar aumentadas (análise visual), quando comparadas ao controle, e a formação de brotamentos parece estar bastante alterada (Figuras 27 D e F, insets).
88 Figura 26: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e formado na presença de 16 μg/ml de FLU(C-D), 256 μg/ml de AZA (E e F) e 16 μg/ml de EIL (G e H) por 48h, a 35 ºC. Barras correspondem a 500 μm em A,C,E,G e 10 μm em B,D,F,H. Insets com barras de 10 μm (D) e 5 μm (H). É Possivel observar alterações na quantidade de células aderidas ao cateter após o tratamento com FLU, AZA e EIL, em relação ao controle nao tratado. 71
89 72
90 Figura 27: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e formado na presença de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E e 10 μm em B,D,F. Insets em D e F com barras de 5 μm. É possível observar alterações tanto na densidade de células aderidas à superfície do cateter quanto na divisão celular nos biofilmes formados na presença de MLT e Tcan26, em relação ao biofilme controle. 73
91 74
92 75 O biofilme formado por C. albicans 44A na ausência de drogas mostrou-se altamente filamentado, com ampla aderência de células e praticamente todo o cateter apresentava-se revestido por filamentos (Figuras 28 A e 29 A). As hifas formadas mostraram-se longas e com brotamentos em abundância (Figuras 28 B e 29 B). A adição de 16 μg/ml de fluconazol ao cateter durante a formação do biofilme, do isolado clínico 44A, determinou significativa redução no número de células aderidas ao dispositivo (Figura 28 C) e na filmentação das células, que apresentavam-se majoritariamente como leveduras e pseudo-hifas (Figura 28 D), não apresentando hifas longas e multibrotantes, como o controle. A adição de AZA, em concentracão de 4 μg/ml, ao biofilme em formação não determinou redução da massa final de células no cateter e estas apresentaram-se pouco alteradas (hifas onduladas) em relação às células controle (Figura 28 E-F). A formação de estruturas largas e com superfície rugosa e irregular, lembrando uma hifa alterada, foi observada tanto em biofilmes tratados com AZA (Figura 28 E-F) quanto em biofilmes controle (dado não mostrado). Esta estrutura, provavelmente, é formada por fios do cateter que se desprendem durante a secção com a navalha. Entretanto, o tratamento do biofilme em formação com 32 μg/ml de EIL culminou em redução drástica do número de células aderidas ao cateter e inibiu completamente a filamentação das células, que apresentaram-se exclusivamente sob a forma de leveduras (Figura 28 G-H). Da mesma maneira, a adição de análogos de fosfolipidios ao biofilme em formação reduziu a massa final de células aderidas e inibiu a formação de hifas, em C. albicans 44A (Figura 29). Concentrações de 32 μg/ml de miltefosina e 64 μg/ml de Tcan26 determinaram menor formação de biofilme (Figura 29 C e E) e alterações na morfologia das leveduras que, visualmente, parecem, também, estar maiores do que as células controle (Figura 29 D e F).
93 Figura 28: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e formado na presença de 16 μg/ml de FLU(C-D), 4 μg/ml de AZA (E e F) e 32 μg/ml de EIL (G e H) por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E,G e 10 μm em B,D,F,H. Observamos tanto a redução da densidade de células aderidas à superfície do cateter quanto a inibição da filamentação, nos biofilmes formados na presença de FLU e EIL, em relação ao controle. Nenhuma alteração foi observada em biofilmes formados na presença de AZA. 76
94 77
95 Figura 29: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e formado na presença de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E e 5 μm em B,D,F. Observamos tanto a redução da densidade de células aderidas à superfície do cateter quanto a inibição da filamentação nos biofilmes formados na presença de MLT e Tcan26, em relação ao controle. 78
96 79
97 Alterações morfológicas por adição de drogas ao biofilme maduro Após 96 horas totais de incubação, em meio rico em glicose (2%) e SFB (20%), leveduras de ambas as cepas, ATCC e 44A, de C. albicans formaram biofilmes densos e altamente filamentados, por toda a extensão do CVC, com o qual estiveram em contato. Os biofilmes controle de ambas as cepas (Figuras 30 A-B, 31 A-B, 32 A-B e 33 A-B) formaram hifas longas e abundantes em ramificações e brotamentos. O tratamento do biofilme maduro de C. albicans ATCC 10231, formado por 48h, em meio de cultura rico em glicose (2%) e SFB (20%), com 16 μg/ml de fluconazol, por 48h adicionais, reduziu discretamente a extensão de cateter colonizado por leveduras, mas não interfiriu na densidade final da rede de filamentos que compõe o biofilme (Figura 30 C-D). Por outro lado, o tratamento com 256 μg/ml de AZA ou com 16 μg/ml de EIL, reduziu significativamente a colonização do cateter por leveduras (Figuras 30 E e G), e, ainda, inibiu a formação da rede de hifas, característica do biofilme controle. O tratamento com AZA inibiu completamente a formação de hifas e o biofilme, ao final da incubação, apresentava-se composto, exclusivamete, por células leveduriformes e com a presença de muitas células alongadas (Figura 30-F). O biofilme tratado com EIL, ao final da incubação com a droga, apresentava cadeias de pseudo-hifas e brotamentos leveduriformes abundantes (Figura 30-H), alem de algumas células bastante alteradas quanto à forma (inset na figura 30-H). A adição de 32 μg/ml de miltefosina e 64 μg/ml de Tcan26 ao biofilme maduro da cepa ATCC levou a redução drástica da área do cateter colonizada (Figura 31 C e E). Após o tratamento com miltefosina, as células apresentavam alguns filamentos curtos e muitas células leveduriformes (Figura 31-D). O tratamento com Tcan26, entretanto, levou a inibição total da filamentação das células, onde todas apresentavam se leveduriformes, além da presença de células alongadas, semelhantes a bastonetes (Figura 31-F).
98 81 Já o biofilme de C. albicans 44A, não teve sua densidade ou extensão reduzidas após o tratamento com 16 μg/ml de fluconazol, por 48h (Figura 32-C). As células, ao final da incubação, não apresentavam-se alteradas com relação ao controle (Figura 32-D). Da mesma maneira, o tratamento do biofilme maduro com 4 μg/ml de AZA ou 32 μg/ml de EIL, não determinou redução da colonização do cateter ou da densidade do biofilme formado sobre ele (Figura 32 E e G). Entretanto, células com alterações de forma mostraram-se presentes nos biofilmes tratados com AZA ( inset na figura 32-F). Os análogos de fosfolipidios apresentaram comportamento diferente frente ao biofilme maduro de C. albicans 44A. Enquanto o tratamento com 32 μg/ml de miltefosina (8 vezes o IC 90 desta droga) não foi capaz de reduzir a extensão do cateter colonizada por leveduras (Figura 33 C), 64 μg/ml de Tcan26 (16 vezes o IC 90 desta droga) determinou redução significativa tanto da extensão quanto da espessura do biofilme sobre o cateter (Figura 33 E). A adição de miltefosina ao biofilme, apesar de não reverter a densidade de biofilme já formado, determinou alterações significativas na forma celular. O biofilme final, após o tratamento com miltefosina, apresentava células em grumos (Figura 33-D) e com alterações de forma (inset na figura 33-D). Ainda, ao final do tratamento com Tcan26, as células ainda aderidas ao cateter apresentavam-se exclusivamente leveduriformes, com presença de algumas pseudo-hifas e muitos brotamentos (Figura 33 F), demonstrando a inibição da filamentação destas células pelo Tcan26. Além disso, visualmente, algumas células parecem estar aumentadas em relação ao controle (Figura 33 F).
99 Figura 30: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e após a adição de 16 μg/ml de FLU(C-D), 256 μg/ml de AZA (E e F) e 16 μg/ml de EIL (G e H), ao bifilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E,G; 10 μm em B,D,F,H e 5 μm no inset (H). é Possivel observar tanto a redução da densidade de células aderidas à superfície do cateter quanto a inibição da filamentação, nos biofilmes apos a adição de FLU, AZA e EIL, em relação ao controle. 82
100 83
101 Figura 31: Micrografias de MEV de biofilme de C. albicans ATCC (A e B) e após a adição de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), ao biofilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E e 10 μm em B,D,F. Observamos tanto a redução da densidade de células aderidas à superfície do cateter nos biofilmes apos a adição de MLT e Tcan26, quanto a inibição da filamentação, nos biofilmes adicionados de Tcan26, quando comparados ao controle. 84
102 85
103 Figura 32: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e após a adição de 16 μg/ml de FLU(C-D), 4 μg/ml de AZA (E e F) e 32 μg/ml de EIL (G e H), ao biofilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E,G; 10 μm em B,D,F,H e 5 μm no inset (F). Observamos alterações de superfície celular em biofilmes tratados com AZA. A adição detes antifúngcos não alterou nem densidade de células aderidas ao cateter nem filamentação. 86
104 87
105 Figura 33: Micrografias de MEV de biofilme de C. albicans 44A (A e B) e após a adição de 32 μg/ml de miltefosina (C-D) e 64 μg/ml de Tcan26 (E e F), ao biofilme já formado, por 48h, a 35 C. Barras correspondem a 500 μm em A,C,E; 10 μm em B,D,F e 5 μm no inset (D). É Possivel observar grumos de celular com alterações de superfície em biofilmes tratados com MLT. Biofilmes tratados com Tcan26 exibem tanto redução na densidade de células aderidas à superfície do cateter quanto inibição da filamentação, quando comparado ao controle. 88
106 89
SUSCETIBILIDADE E RESISTÊNCIA AOS ANTIFÚNGICOS
 SUSCETIBILIDADE E RESISTÊNCIA AOS ANTIFÚNGICOS ANTIFÚNGICOS Entende-se por antifúngico ou antimicótico a toda a substância que tem a capacidade de evitar o crescimento de alguns tipos de fungos ou inclusive
SUSCETIBILIDADE E RESISTÊNCIA AOS ANTIFÚNGICOS ANTIFÚNGICOS Entende-se por antifúngico ou antimicótico a toda a substância que tem a capacidade de evitar o crescimento de alguns tipos de fungos ou inclusive
PATOGENICIDADE BACTERIANA
 PATOGENICIDADE BACTERIANA Fatores de de Virulência Instituto Federal de Educação, Ciência e Tecnologia do Pará Instituto Federal de Educação, Ciência e Tecnologia do Pará Curso de Licenciatura Plena em
PATOGENICIDADE BACTERIANA Fatores de de Virulência Instituto Federal de Educação, Ciência e Tecnologia do Pará Instituto Federal de Educação, Ciência e Tecnologia do Pará Curso de Licenciatura Plena em
DANIELLE LETÍCIA DA SILVA. ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL
 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL BELO HORIZONTE 2009 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA
DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL BELO HORIZONTE 2009 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA
Faculdade Alfredo Nasser-Instituto de Ciências da Saúde
 CANDIDA albicans: UMA REVISÃO DE LITERATURA Kely Raiany Araujo da Costa; ProfDr. Angelma Genaro (kellyraianny@outlook.com) (angelmagenaro@hotmail.com) Faculdade Alfredo Nasser-Instituto de Ciências da
CANDIDA albicans: UMA REVISÃO DE LITERATURA Kely Raiany Araujo da Costa; ProfDr. Angelma Genaro (kellyraianny@outlook.com) (angelmagenaro@hotmail.com) Faculdade Alfredo Nasser-Instituto de Ciências da
KELLY ISHIDA. Atividade antifúngica de diferentes inibidores da. biossíntese de esteróis sobre isolados clínicos de Candida spp.:
 UNIVERSIDADE FEDERAL DO RIO DE JANEIRO CENTRO DE CIÊNCIAS DA SAÚDE INSTITUTO DE BIOFÍSICA CARLOS CHAGAS FILHO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOFÍSICA) KELLY ISHIDA Atividade antifúngica
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO CENTRO DE CIÊNCIAS DA SAÚDE INSTITUTO DE BIOFÍSICA CARLOS CHAGAS FILHO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOFÍSICA) KELLY ISHIDA Atividade antifúngica
24/11/2015. Biologia de Microrganismos - 2º Semestre de Prof. Cláudio 1. O mundo microbiano. Profa. Alessandra B. F. Machado
 UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Relação bactéria-hospedeiro Profa. Alessandra B. F. Machado O mundo microbiano Os microrganismos são ubíquos.
UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Relação bactéria-hospedeiro Profa. Alessandra B. F. Machado O mundo microbiano Os microrganismos são ubíquos.
Qualificar Centro de Estudos Técnicos de Formação em Saúde Curso Técnico em Saúde Bucal Disciplina de Microbiologia Reino Fungi
 Qualificar Centro de Estudos Técnicos de Formação em Saúde Curso Técnico em Saúde Bucal Disciplina de Microbiologia Reino Fungi Professor: Bruno Aleixo Venturi O que são os fungos? Os fungos são micro-organismos
Qualificar Centro de Estudos Técnicos de Formação em Saúde Curso Técnico em Saúde Bucal Disciplina de Microbiologia Reino Fungi Professor: Bruno Aleixo Venturi O que são os fungos? Os fungos são micro-organismos
1.4 Metodologias analíticas para isolamento e identificação de micro-organismos em alimentos
 Áreas para Submissão de Resumos (1) Microbiologia de Alimentos Trabalhos relacionados com micro-organismos associados aos alimentos: crescimento, identificação, biossíntese, controle, interação com o hospedeiro,
Áreas para Submissão de Resumos (1) Microbiologia de Alimentos Trabalhos relacionados com micro-organismos associados aos alimentos: crescimento, identificação, biossíntese, controle, interação com o hospedeiro,
BIOLOGIA. Moléculas, células e tecidos. Estrutura e fisiologia da Membrana Plasmática - Parte 1. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 1 Professor: Alex Santos Tópicos em abordagem: Estrutura e fisiologia da Membrana Plasmática - Parte 1 Parte
BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 1 Professor: Alex Santos Tópicos em abordagem: Estrutura e fisiologia da Membrana Plasmática - Parte 1 Parte
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios
 Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
FATORES DE VIRULÊNCIA DE CANDIDA SPP.
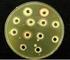 CONEXÃO FAMETRO: ÉTICA, CIDADANIA E SUSTENTABILIDADE XII SEMANA ACADÊMICA ISSN: 2357-8645 FATORES DE VIRULÊNCIA DE CANDIDA SPP. Luana Bezerra da Silva¹, Aline Bezerra², Flávio Rodrigues³ Prof. Dr. João
CONEXÃO FAMETRO: ÉTICA, CIDADANIA E SUSTENTABILIDADE XII SEMANA ACADÊMICA ISSN: 2357-8645 FATORES DE VIRULÊNCIA DE CANDIDA SPP. Luana Bezerra da Silva¹, Aline Bezerra², Flávio Rodrigues³ Prof. Dr. João
Sensibilidade a antifúngicos em amostras hospitalares do gênero Candida
 XXII Congresso Brasileiro de Microbiologia ÁREA INFECÇÃO HOSPITALAR Sensibilidade a antifúngicos em amostras hospitalares do gênero Candida Prof a. Dr a. Claudete Rodrigues Paula Laboratório de Leveduras
XXII Congresso Brasileiro de Microbiologia ÁREA INFECÇÃO HOSPITALAR Sensibilidade a antifúngicos em amostras hospitalares do gênero Candida Prof a. Dr a. Claudete Rodrigues Paula Laboratório de Leveduras
IMUNOPATOGENESE DA CANDIDA ALBICANS: UMA REVISÃO BIBLIOGRÁFICA. RESUMO
 IMUNOPATOGENESE DA CANDIDA ALBICANS: UMA REVISÃO BIBLIOGRÁFICA Sabrina Kécia de Freitas Almeida 1 ; Karyne Barros Queiroz 1 ; Lilian Cortez Sombra Vandesmet 2 1 Discente do Curso de Biomedicina da Faculdade
IMUNOPATOGENESE DA CANDIDA ALBICANS: UMA REVISÃO BIBLIOGRÁFICA Sabrina Kécia de Freitas Almeida 1 ; Karyne Barros Queiroz 1 ; Lilian Cortez Sombra Vandesmet 2 1 Discente do Curso de Biomedicina da Faculdade
Biossegurança 14/02/2019
 Biossegurança 1 Biossegurança é um conjunto de procedimentos, ações, técnicas, metodologias, equipamentos e dispositivos capazes de eliminar ou minimizar riscos inerentes as atividades de pesquisa, produção,
Biossegurança 1 Biossegurança é um conjunto de procedimentos, ações, técnicas, metodologias, equipamentos e dispositivos capazes de eliminar ou minimizar riscos inerentes as atividades de pesquisa, produção,
ANTIFUNGIGRAMA: QUANDO SOLICITAR E COMO INTERPRETAR
 ANTIFUNGIGRAMA: QUANDO SOLICITAR E COMO INTERPRETAR O antifungigrama é recomendado para situações específicas quando o paciente portador de fungemia e/ou imunocomprometido não responde bem ao tratamento
ANTIFUNGIGRAMA: QUANDO SOLICITAR E COMO INTERPRETAR O antifungigrama é recomendado para situações específicas quando o paciente portador de fungemia e/ou imunocomprometido não responde bem ao tratamento
Disciplina de Biologia Celular
 Universidade Salgado de Oliveira Disciplina de Biologia Celular Biomembranas, Matriz Extracelular e Junções Intercelulares Profª Larissa dos Santos Estrutura e composição química das membranas biológicas
Universidade Salgado de Oliveira Disciplina de Biologia Celular Biomembranas, Matriz Extracelular e Junções Intercelulares Profª Larissa dos Santos Estrutura e composição química das membranas biológicas
Membranas Biológicas
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
TÍTULO: PERFIL DE SENSIBILIDADE AOS ANTIMICROBIANOS DE BACTÉRIAS MULTIRRESISTENTES ENCONTRADAS EM UMA UNIDADE DE TERAPIA INTENSIVA ONCOLÓGICA
 TÍTULO: PERFIL DE SENSIBILIDADE AOS ANTIMICROBIANOS DE BACTÉRIAS MULTIRRESISTENTES ENCONTRADAS EM UMA UNIDADE DE TERAPIA INTENSIVA ONCOLÓGICA CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA:
TÍTULO: PERFIL DE SENSIBILIDADE AOS ANTIMICROBIANOS DE BACTÉRIAS MULTIRRESISTENTES ENCONTRADAS EM UMA UNIDADE DE TERAPIA INTENSIVA ONCOLÓGICA CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA:
Infecções causadas por microrganismos multi-resistentes: medidas de prevenção e controle.
 INFORME TÉCNICO XXXVII Outubro 2010 Infecções causadas por microrganismos multi-resistentes: medidas de prevenção e controle. Definição de microorganismos multi-resistentes: São microrganismos resistentes
INFORME TÉCNICO XXXVII Outubro 2010 Infecções causadas por microrganismos multi-resistentes: medidas de prevenção e controle. Definição de microorganismos multi-resistentes: São microrganismos resistentes
COMPOSIÇÃO DA PAREDE CELULAR DOS FUNGOS ECTOMICORRÍZICOS Pisolithus microcarpus e Pisolithus tinctorius
 MATHEUS LOUREIRO SANTOS COMPOSIÇÃO DA PAREDE CELULAR DOS FUNGOS ECTOMICORRÍZICOS Pisolithus microcarpus e Pisolithus tinctorius Dissertação apresentada à Universidade Federal de Viçosa, como parte das
MATHEUS LOUREIRO SANTOS COMPOSIÇÃO DA PAREDE CELULAR DOS FUNGOS ECTOMICORRÍZICOS Pisolithus microcarpus e Pisolithus tinctorius Dissertação apresentada à Universidade Federal de Viçosa, como parte das
Biofilmes Bacterianos
 Biofilmes Bacterianos Biofilmes Bactérias isoladas x Bactérias em associação Biofilmes: Comunidades de bactérias aderidas a superfícies sólidasou semi-sólidas, envoltas por uma matriz de polímeros extracelulares
Biofilmes Bacterianos Biofilmes Bactérias isoladas x Bactérias em associação Biofilmes: Comunidades de bactérias aderidas a superfícies sólidasou semi-sólidas, envoltas por uma matriz de polímeros extracelulares
Filipe A. Mesquita Oliveira INFECÇÕES OPORTUNISTAS CAUSADAS POR LEVEDURAS DO GÊNERO CANDIDA SP. EM PACIENTES IMUNOCOMPROMETIDOS
 Filipe A. Mesquita Oliveira INFECÇÕES OPORTUNISTAS CAUSADAS POR LEVEDURAS DO GÊNERO CANDIDA SP. EM PACIENTES IMUNOCOMPROMETIDOS Trabalho de conclusão de curso apresentado à Universidade Federal de Minas
Filipe A. Mesquita Oliveira INFECÇÕES OPORTUNISTAS CAUSADAS POR LEVEDURAS DO GÊNERO CANDIDA SP. EM PACIENTES IMUNOCOMPROMETIDOS Trabalho de conclusão de curso apresentado à Universidade Federal de Minas
INFEÇÕES OPORTUNISTAS POR FUNGOS
 INFEÇÕES OPORTUNISTAS POR FUNGOS Hospedeiro Meio ambiente Fungo O processo infeccioso não é decorrente diretamente da virulência do fungo, mas sim do comprometimento do hospedeiro e e sua interação com
INFEÇÕES OPORTUNISTAS POR FUNGOS Hospedeiro Meio ambiente Fungo O processo infeccioso não é decorrente diretamente da virulência do fungo, mas sim do comprometimento do hospedeiro e e sua interação com
Imunologia Veterinária. Aula 1 A defesa do organismo
 Imunologia Veterinária Aula 1 A defesa do organismo Uma Breve História da Imunologia Veterinária Quando infecções como a varíola e a peste se espalharam pela sociedade antiga, embora muitos tenham morrido,
Imunologia Veterinária Aula 1 A defesa do organismo Uma Breve História da Imunologia Veterinária Quando infecções como a varíola e a peste se espalharam pela sociedade antiga, embora muitos tenham morrido,
Transporte Intracelular Tráfego vesicular: secreção e endocitose
 Transporte Intracelular Tráfego vesicular: secreção e endocitose Prof. Dr. Luis Lamber0 Março 2017 O sistema de endomembranas RE, Complexo de Golgi, endossomos, lisossomos e membrana plasmá6ca compõem
Transporte Intracelular Tráfego vesicular: secreção e endocitose Prof. Dr. Luis Lamber0 Março 2017 O sistema de endomembranas RE, Complexo de Golgi, endossomos, lisossomos e membrana plasmá6ca compõem
Membrana Plasmática. Dra. Maria Izabel Gallão
 Membrana Plasmática Composição química A composição química das membranas oscila em torno dos valores médios de 60% de proteínas e 40% de lipídios. Associados às proteínas e os lipídios encontram-se açúcares,
Membrana Plasmática Composição química A composição química das membranas oscila em torno dos valores médios de 60% de proteínas e 40% de lipídios. Associados às proteínas e os lipídios encontram-se açúcares,
Membrana Plasmática Estrutura e Função
 Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Membrana Plasmática Estrutura e Função Prof: Dr. Cleverson Agner Ramos Visão Geral das Membranas Biológicas
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Membrana Plasmática Estrutura e Função Prof: Dr. Cleverson Agner Ramos Visão Geral das Membranas Biológicas
TECIDO HEMATOPOIÉTICO E SANGUÍNEO
 TECIDO HEMATOPOIÉTICO E SANGUÍNEO CARACTERÍSTICAS Denomina-se hematopoiese o processo de formação dos elementos figurados do sangue; A hematopoiese antes do nascimento ocorre no saco vitelínico do embrião
TECIDO HEMATOPOIÉTICO E SANGUÍNEO CARACTERÍSTICAS Denomina-se hematopoiese o processo de formação dos elementos figurados do sangue; A hematopoiese antes do nascimento ocorre no saco vitelínico do embrião
das Clínicas da Faculdade de Medicina da Universidade de São Paulo: características clínicas e microbiológicas
 GISELE MADEIRA DUBOC DE ALMEIDA Rhodotorula spp. isoladas de hemocultura no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo: características clínicas e microbiológicas Tese
GISELE MADEIRA DUBOC DE ALMEIDA Rhodotorula spp. isoladas de hemocultura no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo: características clínicas e microbiológicas Tese
Biologia. Alexandre Bandeira (Julio Junior) Membrana e Organelas
 Membrana e Organelas Membrana e Organelas 1. As funções das células estão relacionadas com sua estrutura e com sua atividade metabólica. Apresenta-se abaixo uma tabela em que estão discriminadas, em porcentagens,
Membrana e Organelas Membrana e Organelas 1. As funções das células estão relacionadas com sua estrutura e com sua atividade metabólica. Apresenta-se abaixo uma tabela em que estão discriminadas, em porcentagens,
Resposta imune inata (natural ou nativa)
 Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune inata (natural ou nativa) Profa. Dra. Silvana Boeira Acreditou-se por muitos anos que a imunidade inata fosse inespecífica
Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune inata (natural ou nativa) Profa. Dra. Silvana Boeira Acreditou-se por muitos anos que a imunidade inata fosse inespecífica
Fighting bacteria using selective drugs for membranes
 Universidade de Lisboa Faculdade de Ciências Departamento de Química e Bioquímica Fighting bacteria using selective drugs for membranes Versão Pública Susana Filipa Almeida Dias Dissertação Mestrado em
Universidade de Lisboa Faculdade de Ciências Departamento de Química e Bioquímica Fighting bacteria using selective drugs for membranes Versão Pública Susana Filipa Almeida Dias Dissertação Mestrado em
Caracterização molecular de Enterococcus spp. resistentes à vancomicina em amostras clínicas, ambientes aquáticos e alimentos
 1 UNIVERSIDADE DE SÃO PAULO Faculdade de Ciências Farmacêuticas Programa de Pós-Graduação em Farmácia Área de Análises Clínicas Caracterização molecular de Enterococcus spp. resistentes à vancomicina em
1 UNIVERSIDADE DE SÃO PAULO Faculdade de Ciências Farmacêuticas Programa de Pós-Graduação em Farmácia Área de Análises Clínicas Caracterização molecular de Enterococcus spp. resistentes à vancomicina em
Biofísica de Membranas
 GUARANTÃ DO NORTE» AJES FACULDADE NORTE DE MATO GROSSO Biofísica de Membranas Prof. Me. Thiago Machado BIOFÍSICA DE MEMBRANAS Membrana celular Prof. Me. Thiago Machado Membrana celular Célula Internalizados
GUARANTÃ DO NORTE» AJES FACULDADE NORTE DE MATO GROSSO Biofísica de Membranas Prof. Me. Thiago Machado BIOFÍSICA DE MEMBRANAS Membrana celular Prof. Me. Thiago Machado Membrana celular Célula Internalizados
Membrana Plasmática ou Celular Biomedicina Semestre
 Membrana Plasmática ou Celular Biomedicina Semestre 1-2012 Profa. Luciana F. Krause Funções: Membrana Plasmática Envoltório do citoplasma; Delimita e contém os meios intra e extracelular; dando individualidade
Membrana Plasmática ou Celular Biomedicina Semestre 1-2012 Profa. Luciana F. Krause Funções: Membrana Plasmática Envoltório do citoplasma; Delimita e contém os meios intra e extracelular; dando individualidade
Microbiota Normal do Corpo Humano
 Microbiota Normal do Corpo Humano Microbiota Microbiota Microflora Flora indígena São termos usados para denominar os microrganismos que habitam o corpo humano e interagem de forma benéfica. Flora normal
Microbiota Normal do Corpo Humano Microbiota Microbiota Microflora Flora indígena São termos usados para denominar os microrganismos que habitam o corpo humano e interagem de forma benéfica. Flora normal
MICOSES OPORTUNISTAS. Prof. Dr. Paulo Sergio Rodrigues Coelho Faculdade de Medicina de Ribeirão Preto-USP
 MICOSES OPORTUNISTAS Prof. Dr. Paulo Sergio Rodrigues Coelho Faculdade de Medicina de Ribeirão Preto-USP FATORES PREDISPONENTES Defeitos das defesas do hospedeiro contra fungos Distúrbios das barreiras
MICOSES OPORTUNISTAS Prof. Dr. Paulo Sergio Rodrigues Coelho Faculdade de Medicina de Ribeirão Preto-USP FATORES PREDISPONENTES Defeitos das defesas do hospedeiro contra fungos Distúrbios das barreiras
MEMBRANA PLASMÁTICA: DIGESTÃO INTRACELULAR
 MEMBRANA PLASMÁTICA: DIGESTÃO INTRACELULAR INTRODUÇÃO A membrana plasmática ou celular separa o meio intracelular do meio extracelular e é a principal responsável pelo controle da penetração e saída de
MEMBRANA PLASMÁTICA: DIGESTÃO INTRACELULAR INTRODUÇÃO A membrana plasmática ou celular separa o meio intracelular do meio extracelular e é a principal responsável pelo controle da penetração e saída de
CARACTERÍSTICAS GERAIS
 Fungos CARACTERÍSTICAS GERAIS Eucariontes Heterótrofos por absorção (digestão extra corpórea) Substância de reserva: glicogênio Parede celular de quitina e ergosterol Uni ou multicelulares Corpo formado
Fungos CARACTERÍSTICAS GERAIS Eucariontes Heterótrofos por absorção (digestão extra corpórea) Substância de reserva: glicogênio Parede celular de quitina e ergosterol Uni ou multicelulares Corpo formado
Membranas biológicas
 Membranas biológicas Membrana celular Estrutura, organização e função Exemplos da importância no funcionamento de um organismo animal Biofísica Vet. 2019 - FCAV/UNESP Membrana celular (estrutura) Células
Membranas biológicas Membrana celular Estrutura, organização e função Exemplos da importância no funcionamento de um organismo animal Biofísica Vet. 2019 - FCAV/UNESP Membrana celular (estrutura) Células
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP
 1 MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP 2 RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES INFECCIOSOS - BARREIRAS 1. Barreiras
1 MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP 2 RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES INFECCIOSOS - BARREIRAS 1. Barreiras
MULTIPLICAÇÃO OU REPLICAÇÃO VIRAL Dentre as características essenciais dos vírus, se destaca a propriedade de somente serem aptos a se multiplicar no
 MULTIPLICAÇÃO OU REPLICAÇÃO VIRAL Dentre as características essenciais dos vírus, se destaca a propriedade de somente serem aptos a se multiplicar no interior de células vivas (parasitas intracelulares
MULTIPLICAÇÃO OU REPLICAÇÃO VIRAL Dentre as características essenciais dos vírus, se destaca a propriedade de somente serem aptos a se multiplicar no interior de células vivas (parasitas intracelulares
AGENTES ANTIFÚNGICOS
 AGENTES ANTIFÚNGICOS F propoxi ou butoxi GRISEOFULVINA -Isolada: Penicillium griseofiulvum -Eficaz em dermatofitoses -Fungistática ou fungicida. Não é bactericida -Farmacocinética: via oral -Absorção no
AGENTES ANTIFÚNGICOS F propoxi ou butoxi GRISEOFULVINA -Isolada: Penicillium griseofiulvum -Eficaz em dermatofitoses -Fungistática ou fungicida. Não é bactericida -Farmacocinética: via oral -Absorção no
Imunologia. Introdução ao Sistema Imune. Lairton Souza Borja. Módulo Imunopatológico I (MED B21)
 Imunologia Introdução ao Sistema Imune Módulo Imunopatológico I (MED B21) Lairton Souza Borja Objetivos 1. O que é o sistema imune (SI) 2. Revisão dos componentes do SI 3. Resposta imune inata 4. Inflamação
Imunologia Introdução ao Sistema Imune Módulo Imunopatológico I (MED B21) Lairton Souza Borja Objetivos 1. O que é o sistema imune (SI) 2. Revisão dos componentes do SI 3. Resposta imune inata 4. Inflamação
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR
 FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
Cultura de Células Animais. Aula 5 - Linhagens Permanentes e Primárias. Prof. Me. Leandro Parussolo
 Cultura de Células Animais Aula 5 - Linhagens Permanentes e Primárias Prof. Me. Leandro Parussolo Biologia da Célula em Cultura Cultura de Cells Crítica - Cell faz parte de um microambiente não reproduzido
Cultura de Células Animais Aula 5 - Linhagens Permanentes e Primárias Prof. Me. Leandro Parussolo Biologia da Célula em Cultura Cultura de Cells Crítica - Cell faz parte de um microambiente não reproduzido
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas) PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP
 MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas) PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES INFECCIOSOS
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas) PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES INFECCIOSOS
FISIOLOGIA GASTRINTESTINAL
 FISIOLOGIA GASTRINTESTINAL 03.05.11 Secreções gastrintestinais SECREÇÃO = adição de líquidos, enzimas, mucos ao lúmen do TGI 21.09.10 Secreção salivar Funções: 1) Lubrificação dos alimentos ingeridos com
FISIOLOGIA GASTRINTESTINAL 03.05.11 Secreções gastrintestinais SECREÇÃO = adição de líquidos, enzimas, mucos ao lúmen do TGI 21.09.10 Secreção salivar Funções: 1) Lubrificação dos alimentos ingeridos com
ESTUDO DAS CANDIDEMIAS NO HOSPITAL DE CLÍNICAS NO PERÍODO DE JANEIRO DE 2001 A DEZEMBRO DE 2004
 JOÃO CESAR BEENKE FRANÇA ESTUDO DAS CANDIDEMIAS NO HOSPITAL DE CLÍNICAS NO PERÍODO DE JANEIRO DE 2001 A DEZEMBRO DE 2004 Dissertação apresentada como requisito parcial à obtenção do grau de Mestre, Curso
JOÃO CESAR BEENKE FRANÇA ESTUDO DAS CANDIDEMIAS NO HOSPITAL DE CLÍNICAS NO PERÍODO DE JANEIRO DE 2001 A DEZEMBRO DE 2004 Dissertação apresentada como requisito parcial à obtenção do grau de Mestre, Curso
Determinação de sensibilidade bacteriana aos antimicrobianos
 Determinação de sensibilidade bacteriana aos antimicrobianos Prof. Adj. Ary Fernandes Junior Departamento de Microbiologia e Imunologia Instituto de Biociências UNESP Tel. 14 3880.0412/0413 ary@ibb.unesp.br
Determinação de sensibilidade bacteriana aos antimicrobianos Prof. Adj. Ary Fernandes Junior Departamento de Microbiologia e Imunologia Instituto de Biociências UNESP Tel. 14 3880.0412/0413 ary@ibb.unesp.br
ATIVIDADE DE COMPOSTOS NATURAIS E SINTÉTICOS
 Universidade Federal de Minas Gerais - UFMG Instituto de Ciências Biológicas - Departamento de Microbiologia DANIELLE LETÍCIA DA SILVA ATIVIDADE DE COMPOSTOS NATURAIS E SINTÉTICOS CONTRA FUNGOS DE INTERESSE
Universidade Federal de Minas Gerais - UFMG Instituto de Ciências Biológicas - Departamento de Microbiologia DANIELLE LETÍCIA DA SILVA ATIVIDADE DE COMPOSTOS NATURAIS E SINTÉTICOS CONTRA FUNGOS DE INTERESSE
A célula e seus Constituintes Moleculares
 Universidade Federal de Pelotas CDTec - Graduação em Biotecnologia Disciplina de Biologia Molecular A célula e seus Constituintes Moleculares Priscila M. M. de Leon Dra., Médica Veterinária Profa, PNDP
Universidade Federal de Pelotas CDTec - Graduação em Biotecnologia Disciplina de Biologia Molecular A célula e seus Constituintes Moleculares Priscila M. M. de Leon Dra., Médica Veterinária Profa, PNDP
PALAVRAS-CHAVE: Staphylococcus coagulase negativa. Infecção Hospitalar. Recém-nascidos. UTIN.
 PREVALÊNCIA DE STAPHYLOCOCCUS COAGULASE NEGATIVA EM UNIDADE DE TERAPIA INTENSIVA NEONATAL Ana Carolina Palmezone Ramos 1 Bruno Henrique da Silva 1 Ana Cláudia Alves de Oliveira Santos 2 Aroldo Vieira de
PREVALÊNCIA DE STAPHYLOCOCCUS COAGULASE NEGATIVA EM UNIDADE DE TERAPIA INTENSIVA NEONATAL Ana Carolina Palmezone Ramos 1 Bruno Henrique da Silva 1 Ana Cláudia Alves de Oliveira Santos 2 Aroldo Vieira de
Micro-organismos eucariotas que nos colonizam (I)
 Micro-organismos eucariotas que nos colonizam (I) As ferramentas moleculares, cada vez mais rápidas e precisas, nos permitem enxergar cada vez mais o mundo microbiano, em qualquer ambiente que ele estiver.
Micro-organismos eucariotas que nos colonizam (I) As ferramentas moleculares, cada vez mais rápidas e precisas, nos permitem enxergar cada vez mais o mundo microbiano, em qualquer ambiente que ele estiver.
Fronteiras da Célula.
 Fronteiras da Célula 1 MEMBRANA PLASMÁTICA - Célula: compartimento isolado do meio ambiente por uma finíssima película, a membrana plasmática, constituída fundamentalmente por fosfolipídios e proteínas.
Fronteiras da Célula 1 MEMBRANA PLASMÁTICA - Célula: compartimento isolado do meio ambiente por uma finíssima película, a membrana plasmática, constituída fundamentalmente por fosfolipídios e proteínas.
EXAMES LABORATORIAIS: IMUNOLOGIA
 EXAMES LABORATORIAIS: IMUNOLOGIA Aula 2 CONCEITOS GERAIS Imunidade: conjunto de processos fisiológicos que permite ao organismo reconhecer corpos estranhos e responder contra os mesmos. Sistema imune:
EXAMES LABORATORIAIS: IMUNOLOGIA Aula 2 CONCEITOS GERAIS Imunidade: conjunto de processos fisiológicos que permite ao organismo reconhecer corpos estranhos e responder contra os mesmos. Sistema imune:
INFECÇÃO VAGINAL: FATORES DE RISCO PARA A OCORRÊNCIA DE CANDIDÍASE EM MULHERES
 INFECÇÃO VAGINAL: FATORES DE RISCO PARA A OCORRÊNCIA DE CANDIDÍASE EM MULHERES Luciana Lima da Silva! ¹, Mikaele Miranda do Nascimento ²; Juliana A. F. Noronha ³ 1 Graduanda do Curso de Enfermagem da Unesc
INFECÇÃO VAGINAL: FATORES DE RISCO PARA A OCORRÊNCIA DE CANDIDÍASE EM MULHERES Luciana Lima da Silva! ¹, Mikaele Miranda do Nascimento ²; Juliana A. F. Noronha ³ 1 Graduanda do Curso de Enfermagem da Unesc
Membrana Plasmática. Moléculas componentes das membranas plasmáticas: A membrana plasmática é mosaico fluido
 A membrana plasmática é mosaico fluido Membrana Plasmática A membrana plasmática é formada por lipideos, proteínas e glicideos Filamentos do citoesqueleto se ligam a membrana pelo lado citoplasmático Filamentos
A membrana plasmática é mosaico fluido Membrana Plasmática A membrana plasmática é formada por lipideos, proteínas e glicideos Filamentos do citoesqueleto se ligam a membrana pelo lado citoplasmático Filamentos
Técnicas Microbiológicas
 IX Semana de Biologia da UFPB Técnicas Microbiológicas e Rotina Laboratorial Laboratório de Genética de Microrganismos - DBM Conjunto de procedimentos, ações, técnicas, metodologias, equipamentos e dispositivos
IX Semana de Biologia da UFPB Técnicas Microbiológicas e Rotina Laboratorial Laboratório de Genética de Microrganismos - DBM Conjunto de procedimentos, ações, técnicas, metodologias, equipamentos e dispositivos
Terapia Ocupacional. Fisilogia
 Curso: Terapia Ocupacional Disciplina: Fisilogia Aula: Membrana Plasmática Profº. Ms. Rafael Palhano Fedato rafapalha@gmail.com Membrana Plasmática ou Membrana celular É uma dupla camada de lipídios com
Curso: Terapia Ocupacional Disciplina: Fisilogia Aula: Membrana Plasmática Profº. Ms. Rafael Palhano Fedato rafapalha@gmail.com Membrana Plasmática ou Membrana celular É uma dupla camada de lipídios com
HISTOLOGIA. Tecido Epitelial
 HISTOLOGIA Tecido Epitelial Geralmente avascularizado Características Escassez de matriz extracelular Membrana basal: separa e prende o epitélio ao tecido conjuntivo Células justapostas com junções intercelulares
HISTOLOGIA Tecido Epitelial Geralmente avascularizado Características Escassez de matriz extracelular Membrana basal: separa e prende o epitélio ao tecido conjuntivo Células justapostas com junções intercelulares
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas Metazoários) Prof. Helio José Montassier / FCAVJ-UNESP
 MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas Metazoários) Prof. Helio José Montassier / FCAVJ-UNESP RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas Metazoários) Prof. Helio José Montassier / FCAVJ-UNESP RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES
Tecido conjuntivo e tecido osseo
 Tecido conjuntivo e tecido osseo Tipos de tecido conjuntivo Tecidos responsáveis por unir, ligar, nutrir, proteger e sustentar os outros tecidos Tecidos Conjuntivos Propriamente Ditos Frouxo Denso Modelado
Tecido conjuntivo e tecido osseo Tipos de tecido conjuntivo Tecidos responsáveis por unir, ligar, nutrir, proteger e sustentar os outros tecidos Tecidos Conjuntivos Propriamente Ditos Frouxo Denso Modelado
INTEGRAÇÃO DE CÉLULAS EM TECIDOS
 INTEGRAÇÃO DE CÉLULAS EM TECIDOS Junções Celulares Matriz Extracelular Integração de células em tecidos Introdução A maioria das células animais organizam se em tecidos que se associam em unidades funcionais
INTEGRAÇÃO DE CÉLULAS EM TECIDOS Junções Celulares Matriz Extracelular Integração de células em tecidos Introdução A maioria das células animais organizam se em tecidos que se associam em unidades funcionais
DOENÇAS CAUSADAS POR BACTÉRIAS
 Doenças Causadas por Bactérias, Fungos e Vírus 1 DOENÇAS CAUSADAS POR BACTÉRIAS INFECÇÕES SUPERFICIAIS ESTAFILOCÓCICAS Doenças Causadas por Bactérias, Fungos e Vírus 2 INFECÇÕES SUPERFICIAIS ESTAFILOCÓCICAS:
Doenças Causadas por Bactérias, Fungos e Vírus 1 DOENÇAS CAUSADAS POR BACTÉRIAS INFECÇÕES SUPERFICIAIS ESTAFILOCÓCICAS Doenças Causadas por Bactérias, Fungos e Vírus 2 INFECÇÕES SUPERFICIAIS ESTAFILOCÓCICAS:
PERFIL DE SUSCETIBILIDADE DE CANDIDA ALBICANS OBTIDAS DE PACIENTES HIV POSITIVOS, FRENTE A ANFOTERICINA B, VORICONAZOL E ITRACONAZOL.
 PERFIL DE SUSCETIBILIDADE DE CANDIDA ALBICANS OBTIDAS DE PACIENTES HIV POSITIVOS, FRENTE A ANFOTERICINA B, VORICONAZOL E ITRACONAZOL. LEMOS, Janine de Aquino; COSTA, Carolina Rodrigues; ARAUJO, Crystiane
PERFIL DE SUSCETIBILIDADE DE CANDIDA ALBICANS OBTIDAS DE PACIENTES HIV POSITIVOS, FRENTE A ANFOTERICINA B, VORICONAZOL E ITRACONAZOL. LEMOS, Janine de Aquino; COSTA, Carolina Rodrigues; ARAUJO, Crystiane
Aula ao vivo de Biologia (17/03/2014) Transporte em membrana e organelas
 Aula ao vivo de Biologia (17/03/2014) Transporte em membrana e organelas 1) Considerando não haver rompimento da membrana plasmática, com a adição de água destilada, o citosol das células sofre a seguinte
Aula ao vivo de Biologia (17/03/2014) Transporte em membrana e organelas 1) Considerando não haver rompimento da membrana plasmática, com a adição de água destilada, o citosol das células sofre a seguinte
Marcos Paulo Wille Caracterização clínica e epidemiológica das infecções de corrente sanguínea causadas por Candida spp. no Hospital São Paulo
 Marcos Paulo Wille Caracterização clínica e epidemiológica das infecções de corrente sanguínea causadas por Candida spp. no Hospital São Paulo Tese apresentada à Universidade Federal de São Paulo Escola
Marcos Paulo Wille Caracterização clínica e epidemiológica das infecções de corrente sanguínea causadas por Candida spp. no Hospital São Paulo Tese apresentada à Universidade Federal de São Paulo Escola
13/10/2016 DOENÇA. Patogênese de bactérias anaeróbias. Definições. Infecção: Estabelecimento da bactéria capaz de produzir
 Definições Infecção: Estabelecimento da bactéria capaz produzir doença no corpo humano ou animal. Patogênese bactérias anaeróbias Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac Doença:
Definições Infecção: Estabelecimento da bactéria capaz produzir doença no corpo humano ou animal. Patogênese bactérias anaeróbias Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac Doença:
DETERMINAÇÃO DA SUSCEPTIBILIDADE DE CANDIDA SPP A ANIDULAFUNGINA E CASPOFUNGINA PELO MÉTODO DE MICRODILUIÇÃO EM CALDO
 PROGRAMA DE APRIMORAMENTO PROFISSIONAL SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE RECURSOS HUMANOS FUNDAÇÃO DO DESENVOLVIMENTO ADMINISTRATIVO - FUNDAP Natalia Augusta Barbosa de Freitas DETERMINAÇÃO
PROGRAMA DE APRIMORAMENTO PROFISSIONAL SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE RECURSOS HUMANOS FUNDAÇÃO DO DESENVOLVIMENTO ADMINISTRATIVO - FUNDAP Natalia Augusta Barbosa de Freitas DETERMINAÇÃO
Conceitos Gerais Relação Parasita Hospedeiro. Prof. Cor
 Parasitologia Humana Conceitos Gerais Relação Parasita Hospedeiro Prof. Cor Divisão da Parasitologia MICROBIOLOGIA: bactéria, fungos e vírus PARASITOLOGIA: protozoários, helmintos e artrópodes Microbiota
Parasitologia Humana Conceitos Gerais Relação Parasita Hospedeiro Prof. Cor Divisão da Parasitologia MICROBIOLOGIA: bactéria, fungos e vírus PARASITOLOGIA: protozoários, helmintos e artrópodes Microbiota
TRABALHO DE BIOLOGIA QUÍMICA DA VIDA
 TRABALHO DE BIOLOGIA QUÍMICA DA VIDA Água Sais minerais Vitaminas Carboidratos Lipídios Proteínas Enzimas Ácidos Núcleos Arthur Renan Doebber, Eduardo Grehs Água A água é uma substância química composta
TRABALHO DE BIOLOGIA QUÍMICA DA VIDA Água Sais minerais Vitaminas Carboidratos Lipídios Proteínas Enzimas Ácidos Núcleos Arthur Renan Doebber, Eduardo Grehs Água A água é uma substância química composta
Resposta Inata. Leonardounisa.wordpress.com
 Resposta Inata t: @professor_leo Inst: @professorleonardo Leonardounisa.wordpress.com Características Primeira linha de defesa Estão presentes antes do encontro com o agente agressor São rapidamente ativados
Resposta Inata t: @professor_leo Inst: @professorleonardo Leonardounisa.wordpress.com Características Primeira linha de defesa Estão presentes antes do encontro com o agente agressor São rapidamente ativados
Revisão de Específicas de Biologia
 Revisão de Específicas de 1. Uma enzima, extraída da secreção de um órgão abdominal de um cão, foi purificada, dissolvida em uma solução fisiológica com ph 8 e distribuída em seis tubos de ensaio. Nos
Revisão de Específicas de 1. Uma enzima, extraída da secreção de um órgão abdominal de um cão, foi purificada, dissolvida em uma solução fisiológica com ph 8 e distribuída em seis tubos de ensaio. Nos
Resposta Imunológica celular. Alessandra Barone
 Resposta Imunológica celular Alessandra Barone Resposta mediada pelos linfócitos T: TCD4 e TCD8 Resposta contra microrganismos que estão localizados no interior de fagócitos e de células não fagocíticas
Resposta Imunológica celular Alessandra Barone Resposta mediada pelos linfócitos T: TCD4 e TCD8 Resposta contra microrganismos que estão localizados no interior de fagócitos e de células não fagocíticas
Exercícios de Água, Sais, Lipídios e Glicídios
 Exercícios de Água, Sais, Lipídios e Glicídios 1. (Enem 2005) A água é um dos componentes mais importantes das células. A tabela a seguir mostra como a quantidade de água varia em seres humanos, dependendo
Exercícios de Água, Sais, Lipídios e Glicídios 1. (Enem 2005) A água é um dos componentes mais importantes das células. A tabela a seguir mostra como a quantidade de água varia em seres humanos, dependendo
Testes manuais e automatizados para detecção de resistência bacteriana a antibióticos
 Testes manuais e automatizados para detecção de resistência bacteriana a antibióticos Dr. Maria Teresa Destro Dir. Assuntos Científicos P I O N E E R I N G D I A G N O S T I C S COMPROMISO FAMILIAR HISTÓRICO
Testes manuais e automatizados para detecção de resistência bacteriana a antibióticos Dr. Maria Teresa Destro Dir. Assuntos Científicos P I O N E E R I N G D I A G N O S T I C S COMPROMISO FAMILIAR HISTÓRICO
Staphylococcus 15/10/2009. Staphylococcus aureus UNIVERSIDADE FEDERAL FLUMINENSE INTRODUÇÃO. Família Staphylococcaceae; 41 espécies e 25 subespécies.
 UNIVERSIDADE FEDERAL FLUMINENSE Staphylococcus INTRODUÇÃO Família Staphylococcaceae; 41 espécies e 25 subespécies. Ambiente. Microbiota de mamíferos e aves: BACTERIOLOGIA FARMÁCIA E ODONTOLOGIA 2º SEMESTRE,
UNIVERSIDADE FEDERAL FLUMINENSE Staphylococcus INTRODUÇÃO Família Staphylococcaceae; 41 espécies e 25 subespécies. Ambiente. Microbiota de mamíferos e aves: BACTERIOLOGIA FARMÁCIA E ODONTOLOGIA 2º SEMESTRE,
Patogênese das doenças bacterianas e relação bactéria-hospedeiro
 Universidade Federal de Juiz de Fora Departamento de Parasitologia, Microbiologia e Imunologia Patogênese das doenças bacterianas e relação bactéria-hospedeiro Vânia Lúcia da Silva Qual a importância de
Universidade Federal de Juiz de Fora Departamento de Parasitologia, Microbiologia e Imunologia Patogênese das doenças bacterianas e relação bactéria-hospedeiro Vânia Lúcia da Silva Qual a importância de
ANTIFUNGICOS NA OFTALMOLOGIA EM EQUINOS
 ANTIFUNGICOS NA OFTALMOLOGIA EM EQUINOS BOCARDO, Marcelo FERREIRA, Letícia Lemos GONZAGA, Priscila de A. Lanzi PARRA, Brenda Silvia FAGUNDES, Eduardo Siqueira Acadêmicos da Faculdade de Medicina Veterinária
ANTIFUNGICOS NA OFTALMOLOGIA EM EQUINOS BOCARDO, Marcelo FERREIRA, Letícia Lemos GONZAGA, Priscila de A. Lanzi PARRA, Brenda Silvia FAGUNDES, Eduardo Siqueira Acadêmicos da Faculdade de Medicina Veterinária
IMUNIDADE INATA. Profa. Rosa Maria Tavares Haido Profa. Associada Disciplina de Imunologia
 Profa. Rosa Maria Tavares Haido Profa. Associada Disciplina de Imunologia Barreiras Físicas Pele e Mucosas integridade colonização rompimento Cirurgia,queimadura, perfuração. Etc. aderência Pili, PTN M,
Profa. Rosa Maria Tavares Haido Profa. Associada Disciplina de Imunologia Barreiras Físicas Pele e Mucosas integridade colonização rompimento Cirurgia,queimadura, perfuração. Etc. aderência Pili, PTN M,
Membrana plasmática (plasmalema)
 Membrana plasmática (plasmalema) Bicamada lipídica (fosfolipídio + colesterol) responsável pela proteção e pelo controle da entrada e saída de substâncias da célula (permeabilidade seletiva). Modelo do
Membrana plasmática (plasmalema) Bicamada lipídica (fosfolipídio + colesterol) responsável pela proteção e pelo controle da entrada e saída de substâncias da célula (permeabilidade seletiva). Modelo do
Curso Técnico em Análises Químicas Microbiologia. Meios de cultura
 Curso Técnico em Análises Químicas Microbiologia Meios de cultura DEFINIÇÃO: Formulações químicas (associação qualitativa e quantitativa) Nutrientes necessários Multiplicação (desenvolvimento, cultivo)
Curso Técnico em Análises Químicas Microbiologia Meios de cultura DEFINIÇÃO: Formulações químicas (associação qualitativa e quantitativa) Nutrientes necessários Multiplicação (desenvolvimento, cultivo)
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas Metazoários) PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP
 MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas Metazoários) PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES
MECANISMOS DE IMUNIDADE CONTRA AGENTES INFECCIOSOS (Bactérias, Vírus, Parasitas Metazoários) PROF. HELIO JOSÉ MONTASSIER / FCAVJ-UNESP RESUMO:-MECANISMOS DE IMUNIDADE INATA DO HOSPEDEIRO CONTRA AGENTES
Cultura de Células Animais. Aula 4 - Fases do Crescimento Celular. Prof. Me. Leandro Parussolo
 Cultura de Células Animais Aula 4 - Fases do Crescimento Celular Prof. Me. Leandro Parussolo NOVA CÉLULA Introdução A dinâmica de uma cell é + bem compreendida examinandose o curso de sua vida; divisão
Cultura de Células Animais Aula 4 - Fases do Crescimento Celular Prof. Me. Leandro Parussolo NOVA CÉLULA Introdução A dinâmica de uma cell é + bem compreendida examinandose o curso de sua vida; divisão
INTRODUÇÃO À HEMOSTASIA. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria
 INTRODUÇÃO À HEMOSTASIA Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Hemostasia A hemostasia compreende as interações que ocorrem
INTRODUÇÃO À HEMOSTASIA Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Hemostasia A hemostasia compreende as interações que ocorrem
Resposta imune adquirida do tipo celular
 Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune adquirida do tipo celular Profa. Dra. Silvana Boeira Imunidade adquirida Imunidade adaptativa = específica = adquirida
Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune adquirida do tipo celular Profa. Dra. Silvana Boeira Imunidade adquirida Imunidade adaptativa = específica = adquirida
RENATA APARECIDA MENDES
 RENATA APARECIDA MENDES Efeito de diferentes condições de cultivo sobre o crescimento e a sobrevivência de Escherichia coli, Yersinia enterocolitica e Salmonella spp. Tese apresentada à Universidade Federal
RENATA APARECIDA MENDES Efeito de diferentes condições de cultivo sobre o crescimento e a sobrevivência de Escherichia coli, Yersinia enterocolitica e Salmonella spp. Tese apresentada à Universidade Federal
Diana Margarida Ferraz Bogas Resistência da Candida glabrata a diferentes concentrações de antifúngico
 UMinho 2013 Diana Margarida Ferraz Bogas Resistência da Candida glabrata a diferentes concentrações de antifúngico Escola de Engenharia Diana Margarida Ferraz Bogas Resistência da Candida glabrata a diferentes
UMinho 2013 Diana Margarida Ferraz Bogas Resistência da Candida glabrata a diferentes concentrações de antifúngico Escola de Engenharia Diana Margarida Ferraz Bogas Resistência da Candida glabrata a diferentes
ED1- Citologia Microbiana
 1. Quais os principais morfotipos procarióticos? Determinação na morfologia celular coco bacilo espirilo Parede celular: confere forma e rigidez a célula Citoesqueleto: MreB e crescentina espiroqueta Bactérias
1. Quais os principais morfotipos procarióticos? Determinação na morfologia celular coco bacilo espirilo Parede celular: confere forma e rigidez a célula Citoesqueleto: MreB e crescentina espiroqueta Bactérias
MEMBRANA PLASMÁTICA. CONCEITO: Envoltório fino, flexível, de contorno irregular que delimita o espaço de toda e qualquer célula.
 MEMBRANA PLASMÁTICA CONCEITO: Envoltório fino, flexível, de contorno irregular que delimita o espaço de toda e qualquer célula. COMPOSIÇÃO: Lipoprotéica - constituída por proteínas, colesterol e fosfolipídios.
MEMBRANA PLASMÁTICA CONCEITO: Envoltório fino, flexível, de contorno irregular que delimita o espaço de toda e qualquer célula. COMPOSIÇÃO: Lipoprotéica - constituída por proteínas, colesterol e fosfolipídios.
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas
 Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Noções básicas da Mitose e Meiose Ciclo Celular Noções básicas da Mitose e Meiose Ciclo Celular Fase S e
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Biologia Celular Aulas Teóricas Noções básicas da Mitose e Meiose Ciclo Celular Noções básicas da Mitose e Meiose Ciclo Celular Fase S e
ALESSANDRO COMARÚ PASQUALOTTO. EPIDEMIOLOGIA DAS INFECÇÕES POR Candida spp. NA CORRENTE SANGUÍNEA:
 ALESSANDRO COMARÚ PASQUALOTTO EPIDEMIOLOGIA DAS INFECÇÕES POR Candida spp. NA CORRENTE SANGUÍNEA: coorte retrospectiva em hospital terciário brasileiro Tese apresentada ao Programa de Pós- Graduação em
ALESSANDRO COMARÚ PASQUALOTTO EPIDEMIOLOGIA DAS INFECÇÕES POR Candida spp. NA CORRENTE SANGUÍNEA: coorte retrospectiva em hospital terciário brasileiro Tese apresentada ao Programa de Pós- Graduação em
UNIVERSIDADE FEDERAL DO PARANÁ
 UNIVERSIDADE FEDERAL DO PARANÁ CARLOS RENATO PFAU EFICÁCIA DO SULFETO DE SELÊNIO EM DIFERENTES CONCENTRAÇÕES SOBRE Malassezia pachydermatis EM CÃES: ESTUDO IN VITRO E IN VIVO. Dissertação apresentada ao
UNIVERSIDADE FEDERAL DO PARANÁ CARLOS RENATO PFAU EFICÁCIA DO SULFETO DE SELÊNIO EM DIFERENTES CONCENTRAÇÕES SOBRE Malassezia pachydermatis EM CÃES: ESTUDO IN VITRO E IN VIVO. Dissertação apresentada ao
Biologia Celular e Molecular:
 Disciplina: Biologia Celular e Molecular: Prof.Dr. Antonio Augusto L. Barboza Diferenciação Celular EUCARIONTES Célula Animal Célula Vegetal Células procariontes Pobreza de membranas (somente a membrana
Disciplina: Biologia Celular e Molecular: Prof.Dr. Antonio Augusto L. Barboza Diferenciação Celular EUCARIONTES Célula Animal Célula Vegetal Células procariontes Pobreza de membranas (somente a membrana
Patogenia Viral II. Rafael B. Varella Prof. Virologia UFF
 Patogenia Viral II Rafael B. Varella Prof. Virologia UFF Patogenia: interação de fatores do vírus e do hospedeiro, com consequente produção de doença Patogenia das viroses Processo de desenvolvimento de
Patogenia Viral II Rafael B. Varella Prof. Virologia UFF Patogenia: interação de fatores do vírus e do hospedeiro, com consequente produção de doença Patogenia das viroses Processo de desenvolvimento de
15/10/2009 GENÉTICA BACTERIANA. Disciplina: Microbiologia Geral Curso: Nutrição Prof. Renata Fernandes Rabello. Informação genética essencial.
 GENÉTICA BACTERIANA GENOMA BACTERIANO Cromossoma (nucleóide) Informação genética essencial. Ácido desoxirribonucléico (DNA). Disciplina: Microbiologia Geral Curso: Nutrição Prof. Renata Fernandes Rabello
GENÉTICA BACTERIANA GENOMA BACTERIANO Cromossoma (nucleóide) Informação genética essencial. Ácido desoxirribonucléico (DNA). Disciplina: Microbiologia Geral Curso: Nutrição Prof. Renata Fernandes Rabello
VIVIANE MENEZES DE MENEZES. ADESÃO E FORMAÇÃO DE BIOFILME POR ISOLADOS CLÍNICOS DE Candida spp
 CENTRO UNIVERSITÁRIO DO MARANHÃO PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA PARASITÁRIA VIVIANE MENEZES DE MENEZES ADESÃO E FORMAÇÃO DE BIOFILME POR ISOLADOS
CENTRO UNIVERSITÁRIO DO MARANHÃO PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA PARASITÁRIA VIVIANE MENEZES DE MENEZES ADESÃO E FORMAÇÃO DE BIOFILME POR ISOLADOS
