AVALIAÇÃO IMUNO-HISTOQUIMICA DA PROLIFERAÇÃO E MORTE CELULAR EM NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS
|
|
|
- Isabella Bugalho Alcaide
- 6 Há anos
- Visualizações:
Transcrição
1 DANIELA DE CARVALHO MARTINS AVALIAÇÃO IMUNO-HISTOQUIMICA DA PROLIFERAÇÃO E MORTE CELULAR EM NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS Orientadora: Profª Drª Ana Maria Reis Ferreira Universidade Federal Fluminense NITERÓI 2008
2 DANIELA DE CARVALHO MARTINS AVALIAÇÃO IMUNO-HISTOQUÍMICA DA PROLIFERAÇÃO E MORTE CELULAR EM NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS Tese apresentada ao curso de Pós-Graduação em Patologia da Universidade Federal Fluminense, como requisito parcial para obtenção do Grau de Doutor. Área de concentração: Anatomia Patológica Humana e Veterinária. Orientadora: Profª Drª Ana Maria Reis Ferreira NITERÓI 2008
3 DANIELA DE CARVALHO MARTINS AVALIAÇÃO IMUNO-HISTOQUÍMICA DA PROLIFERAÇÃO E MORTE CELULAR EM NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS Orientadora: Profª Drª Ana Maria Reis Ferreira Tese apresentada ao curso de Pós-Graduação em Patologia da Universidade Federal Fluminense, como requisito parcial para obtenção do Grau de Doutor. Área de concentração: Anatomia Patológica Humana e Veterinária. Aprovada em 30 de maio de BANCA EXAMINADORA Profº Drº Geovanni Dantas Cassali Departamento de Patologia Geral - UFMG Profª Drª Maria de Lourdes Gonçalves Ferreira Departamento de Patologia e Clínica Veterinária UFF Profª Drª Marcela Freire Vallim de Mello Departamento de Patologia e Clínica Veterinária UFF Profª Drª Terezinha de Jesus Sirotheau-Corrêa Departamento de Morfologia - UFF Profª Drª Marilene de Farias Brito Queiroz Departamento de Epidemiologia e Saúde Publica - UFRRJ NITERÓI 2008
4 A toda minha família, em especial, meus pais, meu irmão, meu marido, minha avó (in memorian) e meus animais Bud, Bingo e em especial Teddy (in memorian). Com muito amor e carinho, pois é impossível ser feliz sozinho e sem o AMOR a vida seria insípida. Amo muito vocês!!
5 AGRADECIMENTOS A Deus, nosso Pai supremo, fonte eterna de Amor, pelas bênçãos de sermos e existirmos, somente Ele tem o poder sobre os homens e será sempre conforme a Sua vontade. A Ana Maria Reis Ferreira, minha amiga pessoal, profissional e orientadora. Por todos esses anos, desde a iniciação científica, pela paciência e profissionalismo, contribuindo enormemente para meu amadurecimento científico. O que sou profissionalmente, devo a você. Muito obrigada pelas inúmeras vezes em que mediante minhas dúvidas, dificuldades, medos e incertezas esteve ao meu lado e me amparado, por ter me mostrado que sempre há um caminho. Além dos ensinamentos, ofereceu-me apoio fraterno. Minha gratidão, admiração e respeito imensuráveis. Muito obrigada por tudo! A Eliene Carvalho da Fonseca, amiga e chefe do Laboratório de Imuno-histoquímica do HUAP-UFF. Pela calorosa acolhida todos esses anos, desde a iniciação científica, por estar sempre de braços abertos, pela enorme competência, sempre oferecendo sugestões e contribuindo com sua experiência. Obrigada pela confiança em mim depositada, amizade e ensinamentos. A Ana Beatriz Soares Monteiro, pela paciência, sempre com muita disposição e boa vontade na realização das análises estatísticas. Obrigada por tudo! A Geovanni Dantas Cassali pela amizade, disponibilidade e colaboração de forma ética e responsável na leitura e revisão deste trabalho. Muito obrigada! A Maria de Lourdes Gonçalves Ferreira, pela amizade, carinho, compreensão, apoio, competência e colaboração na leitura e revisão deste trabalho. Muito obrigada! As meninas, técnicas do Laboratório de Imuno-histoquímica do HUAP-UFF, em especial Rita de Cássia Costa Cunha e Kátia Valéria Ferreira Costa, minhas amigas, pelo apoio, amizade de longa data, companheirismo, ajuda sempre presente,
6 compartilhando valiosas sugestões para a melhoria de nossas reações imunohistoquímicas. Obrigada por tudo! A Antonio Carlos dos Santos, pela simpatia, dedicação e paciência na realização dos cortes histológicos. Ao curso de Pós-graduação em Patologia da UFF, em especial a Profª Drª Eliane Pedra Dias, coordenadora e Thereza Cristina Fontana de Paiva (Tê), secretária, pelo apoio, ajuda, companheirismo, colaboração e competência. A minha família, em especial minha mãe, Marilza de Carvalho Martins, meu pai, Wilson Martins e meu irmão Walace de Carvalho Martins, extensivo também a Mainha, Dindão, Suzy e Alex, aos quais devo tudo que sou e todas as minhas conquistas, por toda compreensão, por minhas ausências e abandono. Sem vocês nada disso seria possível. A vocês meu amor, meu amor, meu amor!!! A minha avó, Azumitha de Carvalho Grado (in memorian), que nos deixou há tão pouco tempo, o meu amor, meu carinho e saudades eternas. Ao meu amigo e marido, André Luis Tenório e Silva, pelo carinho, amor, pela paciência, e por toda sua compreensão nas horas em que estive ausente. A Elan Cardozo Paes-de-Almeida, minha amiga, exemplo profissional, que nunca mediu esforços para ajudar, pelo carinho, cumplicidade, incentivo constante, sempre com muita disposição e boa vontade. Obrigada por tudo! A Anna Carolina Donato, Juliana Leite, Marcela Freire, minhas amigas, pelo estímulo, pela ajuda sempre constante, convívio extremamente agradável, pelo apoio e palavras encorajadoras. A Universidade Unigranrio, em especial ao Profº Drº Carlos Henrique de Freitas Burity, diretor do Instituto de Biociências, pelo apoio, compreensão, competência, respeito, seriedade, paciência e plena disponibilidade. Muito obrigada!
7 Aos amigos e companheiros da Unigranrio, em especial, Viviane Moreira de Lima, Ricardo Luis de Azevedo Pereira e João Cossatis, pela amizade, por terem me ouvido quando precisei, pelo apoio sempre constante e incentivo. Obrigada pro tudo! Aos meus animais, Bud, Bingo e em especial Teddy (in memorian), pela amizade sincera e desinteressada, pelo companheirismo, lealdade, fidelidade e amor incondicional. Muitas, muitas saudades! Aos animais, únicos responsáveis pela minha escolha profissional. A todos que direta ou indiretamente colaboraram na elaboração deste trabalho, meus sinceros agradecimentos. Muito obrigada!
8 SUMÁRIO 1 INTRODUÇÃO 17 2 REVISÃO DE LITERATURA NEOPLASIA MAMÁRIA PROLIFERAÇÃO CELULAR MARCADORES DE PROLIFERAÇÃO CELULAR Antígeno Nuclear de Proliferação Celular (PCNA) Marcador de Proliferação Celular KI MORTE CELULAR POR APOPTOSE MARCADOR DE APOPTOSE CASPASE HIPÓTESES 48 4 OBJETIVOS OBJETIVO GERAL OBJETIVOS ESPECÍFICOS 49 5 MATERIAIS E MÉTODOS MATERIAL PROCEDIMENTOS IMUNO-HISTOQUÍMICA ANÁLISE DO MATERIAL ANÁLISES HISTOPATOLÓGICA E IMUNO-HISTOQUÍMICA ANÁLISE ESTATÍSTICA 55 6 RESULTADOS ANÁLISE HISTOPATOLÓGICA ANÁLISE IMUNO-HISTOQUÍMICA ANÁLISE DA IMUNOMARCAÇÃO COM O ANTICORPO ANTI-PCNA 63 (ANTÍGENO NUCLEAR DE PROLIFERAÇÃO CELULAR) ANÁLISE DA IMUNOMARCAÇÃO COM O ANTICORPO ANTI-KI ANÁLISE DA IMUNOMARCAÇÃO COM O ANTICORPO ANTI-CASPASE-3 73 CLIVADA CORRELAÇÃO DAS IMUNOMARCAÇÕES COM OS ANTICORPOS ANTI- 78 PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA 7 DISCUSSÃO 98 8 CONCLUSÕES REFERÊNCIAS BIBLIOGRÁFICAS PRODUÇÃO CIENTÍFICA ANEXOS ANEXO 1 128
9 LISTA DE FIGURAS Figura 1: CARCINOSSARCOMA MAMÁRIO CANINO COLORAÇÃO HE p.84 Figura 2: TUMOR MISTO MALIGNO MAMÁRIO CANINO COLORAÇÃO HE p.85 Figura 3: ADENOCARCINOMA TUBULAR COMPLEXO MAMÁRIO CANINO COLORAÇÃO HE p.86 Figura 4: ADENOCARCINOMA TUBULAR SIMPLES MAMÁRIO CANINO COLORAÇÃO HE p.87 Figura 5: ADENOCARCINOMA PAPILÍFERO COMPLEXO MAMÁRIO CANINO COLORAÇÃO HE p.88 Figura 6: ADENOCARCINOMA PAPILÍFERO SIMPLES MAMÁRIO CANINO COLORAÇÃO HE p.89 Figura 7: CARCINOMA SÓLIDO SIMPLES MAMÁRIO CANINO COLORAÇÃO HE p.90 Figura 8: ADENOCARCINOMA PAPILÍFERO SIMPLES MAMÁRIO CANINO ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.91 Figura 9: ADENOCARCINOMA TUBULAR COMPLEXO MAMÁRIO CANINO ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.92 Figura 10: ADENOCARCINOMA PAPILÍFERO COMPLEXO MAMÁRIO CANINO ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.93 Figura 11: CARCINOMA SÓLIDO SIMPLES MAMÁRIO CANINO ANTI- PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.94 Figura 12: CARCINOSSARCOMA MAMÁRIO CANINO, ÁREA EPITELIAL ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.95
10 Figura 13: TUMOR MISTO MALIGNO MAMÁRIO CANINO, ÁREA EPITELIAL ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.96 Figura 14: CARCINOSSARCOMA MAMÁRIO CANINO, ÁREA MESENQUIMAL ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA p.97
11 LISTA DE TABELAS Tabela 1: FAIXA ETÁRIA DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS p.56 Tabela 2: FREQÜÊNCIA DAS RAÇAS DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS p.57 Tabela 3: FREQÜÊNCIA DOS DIAGNÓSTICOS HISTOPATOLÓGICOS DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS p.58 Tabela 4: FREQÜÊNCIA DOS DIAGNÓSTICOS HISTOPATOLÓGICOS E A FAIXA ETÁRIA DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS p.58 Tabela 5: FREQÜÊNCIA DAS MARGENS DE SEGURANÇA NAS AMOSTRAS DE NEOPLASIAS MAMÁRIAS MALIGNAS p.62 Tabela 6: VALORES DA MÉDIA E MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS DOS DUCTOS, IMUNOPOSITIVAMENTE MARCADOS PELO ANTICORPO ANTI- PCNA, DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO p.65 Tabela 7: VALORES DA MÉDIA E DA MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS IMUNOMARCADOS PELO ANTICORPO ANTI-PCNA, DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA p.67 Tabela 8: VALORES DA MÉDIA E MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS DOS DUCTOS, IMUNOPOSITIVAMENTE MARCADOS PELO ANTICORPO ANTI- Ki-67, POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO p.70 Tabela 9: VALORES DA MÉDIA E DA MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS IMUNOMARCADOS PELO ANTICORPO ANTI-KI-67, DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA p.72
12 Tabela 10: VALORES DA MÉDIA E MEDIANA DO NÚMERO DE CÉLULAS EPITELIAIS DOS DUCTOS, IMUNOPOSITIVAMENTE MARCADOS PELO ANTICORPO ANTI-CASPASE-3 CLIVADA, POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO p.75 Tabela 11: VALORES DA MÉDIA E DA MEDIANA DO NÚMERO DE CÉLULAS EPITELIAIS IMUNOMARCADOS PELO ANTICORPO ANTI- CASPASE-3 CLIVADA, DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA p.77
13 LISTA DE GRÁFICOS Gráfico 1: BOXPLOT DA MÉDIA DE NÚCLEOS, DAS CÉLULAS EPITELIAIS, MARCADOS IMUNOPOSITIVAMENTE PELO ANTICORPO ANTI- PCNA POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO p.66 Gráfico 2: BOXPLOT DA MÉDIA DE NÚCLEOS DAS CÉLULAS EPITELIAIS MARCADOS COM O ANTICORPO ANTI-PCNA DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA p.68 Gráfico 3: BOXPLOT DA MÉDIA DE NÚCLEOS DAS CÉLULAS EPITELIAIS MARCADOS IMUNOPOSITIVAMENTE PELO ANTICORPO ANTI- KI-67 POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO p.71 Gráfico 4: BOXPLOT DA MÉDIA DE NÚCLEOS DAS CÉLULAS EPITELIAIS MARCADOS COM O ANTICORPO ANTI-KI-67 DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA p.73 Gráfico 5: BOXPLOT DA MÉDIA DE CÉLULAS EPITELIAIS MARCADOS IMUNOPOSITIVAMENTE PELO ANTICORPO ANTI-CASPASE-3 CLIVADA POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO p.76 Gráfico 6: BOXPLOT DA MÉDIA DE CÉLULAS EPITELIAIS MARCADOS COM O ANTICORPO ANTI-CASPASE-3 CLIVADA DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA p.78 Gráfico 7: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-KI-67 X ANTI-PCNA DAS CÉLULAS EPITELIAIS DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS p.79 Gráfico 8: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-PCNA X ANTI-CASPASE-3 CLIVADA DAS CÉLULAS EPITELIAIS DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS p.80 Gráfico 9: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-KI-67 X ANTI-CASPASE-3 CLIVADA DAS CÉLULAS EPITELIAIS DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS p.80
14 Gráfico 10: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-Ki-67 X ANTI-CASPASE-3 CLIVADA NAS ÁREAS EPITELIAIS DOS ADENOCARCINOMAS TUBULARES SIMPLES p.82 Gráfico 11: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-PCNA X ANTI-CASPASE-3 CLIVADA NAS ÁREAS EPITELIAIS DOS ADENOCARCINOMAS TUBULARES SIMPLES p.83
15 LISTA DE ABREVIATURAS APAF-1 Fator ativador de protease da apoptose-1 BSA Soro albumina bovina C Grau Celsius CDK Quinase ciclina-dependente cm Centímetros DAB Diaminobenzidina DP Desvio Padrão Fase G0 Fase de repouso Fase G1 Fase de pré-síntese Fase G2 Fase de crescimento pré-mitótico Fase M Mitose Fase S Fase de síntese Fig Figura Graf Gráfico HE Hematoxilina-eosina hs horas IHQ Imuno-Histoquímica kd Kilodaltons µm micrômetros OMS Organização mundial de saúde PC Papilífero complexo PCNA Antígeno nuclear de proliferação celular PEST Prolina-ácido glutâmico-serina-treonina PS Papilífero simples PST Tempo de sobrevivência pós-cirúrgica SRD Sem Raça Definida Tab Tabela TNF-α Fator de necrose tumoral α TNFR Receptor do fator de necrose tumoral TC Tubular complexo TS Tubular simples
16 RESUMO A neoplasia mamária na espécie canina é a mais comum na cadela e vem sendo muito pesquisada ultimamente, por servir como importante modelo para a carcinogênese mamária nas mulheres. A classificação é a característica essencial para uma avaliação diagnóstica, prognóstica e conseqüentemente no direcionamento de uma conduta clínico-cirúrgica adequada e como às vezes se torna difícil, outras técnicas como um auxílio são utilizadas. A utilização de marcadores de proliferação celular é um método objetivo e quantificável mais sensível e específico para avaliar a atividade mitótica em neoplasias, do que a contagem do número de mitoses na histologia convencional e a identificação da apoptose, é importante pois durante o crescimento tumoral existe um equilíbrio entre a proliferação e morte celular, no qual o processo de morte celular programada está envolvido. Este trabalho teve como objetivo avaliar a atividade proliferativa e apoptótica em neoplasias mamárias malignas caninas associando-se os resultados. Neste trabalho foram utilizados 61 casos de neoplasias malignas mamárias de cadelas. As neoplasias foram classificadas de acordo com a Organização Mundial de Saúde e a técnica utilizada foi a imuno-histoquímica, através do método LSAB, sendo utilizados como anticorpos primários o anti-pcna, anti-ki-67, e anti-caspase- 3 clivada. Das 61 amostras através de histopatologia, foram observados cinco carcinossarcomas, nove carcinomas em tumores mistos, seis adenocarcinomas tubulares complexos, doze adenocarcinomas tubulares simples, treze adenocarcinomas papilíferos complexos, quinze adenocarcinomas papilíferos simples e um carcinoma sólido simples. Não houve pré-disposição racial e a maioria dos animais acometidos tinham entre cinco e dez anos de idade. Nas neoplasias mamárias malignas a expressão do PCNA e Ki-67 foi maior que a expressão da Caspase-3 clivada e existiu uma correlação positiva significativa entre as expressões de PCNA e Ki-67. Com relação aos adenocarcinomas tubulares simples o Ki-67 mostrou uma correlação negativa significativa com a Caspase-3 clivada e o PCNA evidenciou uma tendência de correlação negativa com a Caspase-3 clivada. O estudo da proliferação e morte celulares surge de forma a acrescentar mais informações sobre o comportamento neoplásico. A associação destes marcadores prognósticos à outros fatores comumente utilizados na rotina, podem complementar a classificação já existente das neoplasias e auxiliar de maneira bem expressiva na elaboração de um diagnóstico e prognóstico mais precisos das neoplasias mamárias e conseqüentemente contribuir para uma melhor sobrevida do paciente devido a possibilidade de um tratamento clínico mais adequado e individualizado, podendo desta forma também ser utilizado como modelo experimental nos estudos comparado a neoplasia mamária humana. Palavras Chaves: Neoplasia Mamária, Cadela, PCNA, Ki-67, Caspase-3 clivada
17 ABSTRACT Canine mammary neoplasia is the most common found in the bitch. Researches are being carried out at present as they can be used as an important model for mammary carcinogenesis in women. Classification is the essential characteristic for prognosis and diagnostic evaluation, so that an adequate clinicalsurgical conduct may be carried out, but, as this approach sometimes presents difficulties, other techniques are then used. The use of cell proliferation markers is an objective and quantifiable method, more sensitive and specific to assess the mitotic activity in neoplasia, rather than the mitosis count, as it is done in conventional histology, to identify apoptosis. Therefore, a balance between proliferation and cell death during tumor growth is an important factor, where the process of programmed cell-death is involved. The purpose of this work is to assess the proliferative and apoptic activity in canine malignant mammary neoplasia, associating the results. Sixty-one cases of bitches with malignant mammary neoplasia were used in this work. Neoplasias were classified according to the World Health Organization classification; the immunohistochemical technique was applied by means of the LSAB method; anti-pcna, anti-ki-67 were used as primary antibodies, as well as cleaved anti-caspase-3. Considering 61 samples, by means of the histopathology procedure, five carcinosarcomas, nine carcinomas in mixed tumors, six complex tubular adenocarcinomas, 12 primary tubular adenocarcinomas, 13 complex papilliferous adenocarcinomas, 15 primary papilliferous adenocarcinomas and a primary solid carcinoma were observed. No breed predisposition was found and most of the animals with the disease were between 5 and 10 years old. In the malignant mammary neoplasia, the expression of PCNA and Ki-67 showed to be greater in number than the expression of cleaved Caspase-3 and a positive correlation among the expressions of PCNA and Ki-67 was observed. Regarding primary tubular adenocarcinomas, Ki-67 presented a significant negative correlation with the cleaved Caspase-3 and PCNA showed a negative correlation tendency, which was also significant with the cleaved Caspase-3. The proliferation and cell death study arises to add more information on neoplasic behavior. The association of these prognostic markers to other factors commonly used in routine procedures can complement the already existing classification of neoplasia, providing expressive support in the elaboration of a more precise diagnostic and prognosis of mammary neoplasia, thus contributing to the patient s extra life, facilitating a more adequate and individualized clinical treatment. This may also be used as an experimental model in the studies that compare the human mammary neoplasia. Key words: Mammary Neoplasia, Bitches, PCNA, Ki-67, Cleaved Caspase-3
18 1 INTRODUÇÃO O câncer na espécie humana e em animais domésticos é uma das patologias que mais levam ao óbito, sendo o de mama um dos mais importantes. A importância dos tumores de mama em cadelas tem aumentado, devido à freqüência com que casos desse tipo surgem na clínica dos animais de companhia, e devido às semelhanças que tem com os tumores de mama em humanos, oferecendo deste modo um relevante modelo para o câncer de mama em mulheres (RUTTEMAN ET AL, 1988, NERURKAR ET AL, 1989, JUBB ET AL, 1993 e FONSECA & DALECK, 2000). Devido a isso, pode-se entender por que o câncer de mama tem recebido uma grande publicidade e se tornado o centro de muitos estudos acerca de sua origem, métodos de diagnósticos e tratamento (ZUCCARI ET AL, 2001, FERRI, 2003, KARAYANNOPOULOU, ET AL, 2005, LESTER, 2006 e KING, 2007). A classificação das neoplasias mamárias em cães tem sido uma controvérsia por causa de sua vasta complexidade, além disso, nenhuma das classificações propostas para as neoplasias mamárias caninas é universalmente aceita por todos
19 os patologistas veterinários, com isso numerosos esquemas de classificação têm sido realizados, mas cada um possui uma certa limitação (JONES ET AL, 2000). A classificação é a característica essencial para a avaliação prognóstica, tendo uma grande importância para determinar métodos de tratamento e como às vezes se torna difícil, outras técnicas como um auxílio são utilizadas (KURZMAN & GILBERTSON, 1986, HELLMÉN ET AL, 1993, YAMAGAMI ET AL, 1996, CASSALI ET AL, 2000 e PIRES ET AL, 2004). Atualmente, novos fatores prognósticos em tumores mamários caninos estão sendo estudados (PÉREZ ALENZA ET AL, 1997, GERALDES ET AL, 2000, CASSALI, 2000, KARAYANNOPOULOU, ET AL, 2005, TERZIAN ET AL, 2007). Técnicas especializadas como a imuno-histoquímica, para identificação e avaliação de marcadores prognósticos, podem servir como base para o diagnóstico e prognóstico na ausência de uma característica morfológica apropriada (KURZMAN & GILBERTSON, 1986, MALUF & KOERNER, 1994, CASSALI ET AL, 2000, PIRES ET AL, 2004, BRASILEIRO FILHO ET AL, 2006, TERZIAN ET AL, 2007 e KING, 2007). A utilização de marcadores como o Ki-67 e PCNA é um método objetivo e quantificável mais sensível e específico para avaliar a proliferação celular em neoplasias, do que a contagem do número de mitoses na histologia convencional (ESPOSITO ET AL, 2000 e RIBEIRO JUNIOR ET AL, 2000) e a identificação da apoptose, através da caspase-3 clivada se faz importante pois durante o crescimento tumoral existe um equilíbrio entre a proliferação e morte celular, no qual
20 o processo de morte celular programada está envolvido. Este balanço entre proliferação, diferenciação e morte celulares determina o número de células numa população, bem como o seu tamanho ou mais precisamente o estágio de um tumor (SHEN ET AL, 1998, SIMÃO ET AL, 1999, GONZÁLEZ-CÁMPORA ET AL, 2000 e LIU ET AL, 2001). A mensuração da proliferação celular e da apoptose podem melhorar a confiabilidade do prognóstico do comportamento tumoral, auxiliando na caracterização biológica do tumor (DE JONG ET AL, 2000). Isso justifica o grande interesse, atualmente, na identificação de marcadores com valor prognóstico e em parâmetros biológicos não subjetivos de mensuração como a proliferação celular e apoptose, para proporcionar uma informação diagnóstica e prognóstica mais precisa. Desta maneira, este trabalho, através da associação entre técnicas de imuno-histoquímica para a avaliação da atividade de proliferação celular e apoptótica, poderá contribuir para futuros estudos relacionados à conduta clínico-cirúrgica, o desenvolvimento de novas modalidades terapêuticas, imunoprofilaxia do câncer e proporcionar uma análise comparativa com o câncer de mama na mulher.
21 2 REVISÃO DE LITERATURA 2.1 NEOPLASIA MAMÁRIA O câncer é uma das maiores causas de mortalidade entre os seres humanos e os animais domésticos. As neoplasias das glândulas mamárias ocorrem freqüentemente em cães, gatos, ratos e camundongos. Em outras espécies de animais domésticos e de laboratório, essas neoplasias não são freqüentes. As neoplasias mamárias em cadelas são as neoplasias mais comumente encontradas. (BRODEY ET AL, 1983, BIRCHARD & SHERDING, 1994, ROSTAMI ET AL, 1994, WITHROW & MACEWEN, 1996, COELHO, 2002, CASSALI, 2003 e KARAYANNOPOULOU ET AL, 2005), no entanto, alguns pesquisadores apontam que essas neoplasias constituem a segunda forma mais comum em cães, sendo somente ultrapassado pelos tumores de pele, os tumores mamários representam de 25 a 50% de todas as neoplasias das cadelas (JONES ET AL, 2000, FONSECA & DALECK, 2000, SOUZA ET AL, 2001 e CUSTÓDIO, 2003).
22 As neoplasias mamárias são raras nos animais jovens (MIALOT, 1988). O risco para o desenvolvimento da neoplasia mamária em cadelas aumenta significativamente com a idade (JONES ET AL, 2000). A população de risco, no que se refere aos tumores mamários, é constituída por cadelas entre os cinco e doze anos de idade, sendo a idade de maior susceptibilidade entre os nove e os onze anos, não existindo predisposição racial (ETTINGER, 1992, BOLDIZSÁR ET AL, 1992, OLIVEIRA ET AL, 2003, CASSALI, 2003, ROSCIANI ET AL, 2003, MARIANO ET AL, 2006 e TROMPOWSKY, 2007). A ovariohisterectomia nas cadelas jovens exerce um nítido efeito profilático (MIALOT, 1988 e SOARES E SILVA, 1998). Quando realizada antes do 1º cio reduz a incidência de neoplasia de mama para 0,5%; após o 1º cio diminui para 8% e após o 2º cio, para 26% (DALECK, 1996). Cadelas submetidas à ovariohisterectomia após os dois anos e meio de idade, ou concomitantemente à mastectomia, não são beneficiadas pelos efeitos profiláticos desse procedimento, nem tem efeito sobre o prognóstico, porque nessa idade, as glândulas mamárias já se desenvolveram plenamente (MOULTON, 1990, YAMAGAMI ET AL, 1996, MORRIS ET AL, 1998 e FONSECA & DALECK, 2000). O desenvolvimento de neoplasias malignas antes dos cinco anos de idade é raro, normalmente são neoplasias de caráter benigno (PEREZ ALENZA, 2000). As neoplasias de mama possuem uma incidência três vezes mais alta nas cadelas do que na mulher e de forma semelhante à espécie humana, ocorre quase que exclusivamente em fêmeas (QUEIROGA E LOPES, 2002, CASSALI, 2003,
23 LESTER, 2006, CAVALCANTI & CASSALI, 2006, SILVA ET AL, 2007 e MONTAG & KUMAR, 2008). As neoplasias mamárias em cadelas possuem uma estreita semelhança com a neoplasia humana (NERURKAR ET AL, 1989). Por isso, oferecem um importante modelo experimental para o estudo do câncer de mama em mulheres (RUTTEMAN ET AL, 1988, JUBB ET AL, 1993, PELETEIRO, 1994 e MOTTOLESE ET AL, 1994). Devido a isso, pode-se entender por que o câncer de mama tem recebido uma notória atenção e se tornado o centro de muitos estudos acerca de sua origem, métodos de diagnósticos e tratamento (ZUCCARI ET AL, 2001, FERRI, 2003, KARAYANNOPOULOU ET AL, 2005, LESTER, 2006 e KING, 2007). Nos caninos, os mais comuns são os tumores mistos (NELSON ET AL, 1972 e BRODEY ET AL, 1983). De acordo com MIALOT (1988), HELLMÉN e colaboradores (1993), DALECK e colaboradores (1998), OLIVEIRA e colaboradores (2003), CASSALI (2003) e MARIANO e colaboradores (2006), dentre os tumores malignos, os adenocarcinomas são os mais freqüentes. Os sarcomas de glândula mamária em cadelas são raros, inferior a 10% (ETTINGER, 1992). Num estudo realizado por NERURKAR e colaboradores (1989), de 52 neoplasias mamárias caninas, 14 eram benignas e 38 malignas, sendo que destas apenas 3 foram classificadas como carcinossarcoma e 30 eram adenocarcinomas complexo. Resultados semelhantes também foram encontrados por HELLMÉN e colaboradores (1993), ZANINOVIC & SIMCIC (1994) e DALECK e colaboradores
24 (1998). Já num levantamento de 342 tumores mamários, 178 (52,05%) foram benignos e 164 (47,95%) foram malignos (CASSALI, 2000). Na maioria dos casos, o tratamento da neoplasia primária é conseguido com êxito, mas complicações freqüentemente ocorrem e é devido ao alto poder invasivo e metastático de certos tipos de câncer. O comportamento clínico varia de nódulos bem circunscritos com um crescimento estacionário a amplo e algumas vezes nódulos ulcerados, os quais crescem rapidamente e se tornam bem aderidos aos tecidos adjacentes. A presença de ulceração na pele tem sido associada com malignidade e é considerada um fator independente fortemente ligado a um prognóstico desfavorável (PEREZ ALENZA, 2000). A etiologia exata das neoplasias mamárias é desconhecida (OGILVIE, 1983 e HAHN & ADAMS, 1997). Em mulheres é aceitável a relação da doença com fatores próprios do hospedeiro, como a duração da atividade ovariana; a hereditariedade e com fatores ambientais, tais como a alimentação e a utilização de determinados medicamentos, não sendo estabelecida também nenhuma ligação direta entre vírus e o câncer de mama (LOPES ET AL, 1996, ROSEN, 1997 e CASSALI, 2003). Clinicamente é impossível a distinção de certas displasias e uma neoplasia mamária, esta sendo encontrada em cerca de 10% dos casos. Por outro lado, é muito freqüente no exame histológico se evidenciar as displasias associadas a uma neoplasia (MIALOT, 1988). Da mesma forma, uma neoplasia mamária maligna pode muitas vezes apresentar um quadro clínico de uma neoplasia mamária benigna e a aparência clínica de um tumor mamário é extremamente diversa, não podendo
25 assim ser considerado como única ferramenta para elaboração de um prognóstico (MENDES ET AL, 2005). Vários sistemas de classificação existem para neoplasias mamárias (MOULTON ET AL, 1970; MISDORP ET AL, 1971; MISDORP ET AL, 1972; MISDORP ET AL, 1973; FOWLER ET AL, 1974, MONLUX ET AL, 1977 e MOULTON, 1990), entretanto um dos mais adotados é o de MISDORP e colaboradores (1999), mas a classificação destas neoplasias em cães tem sido uma controvérsia por causa de sua vasta complexidade, pois nenhuma das classificações propostas para as neoplasias mamárias caninas é universalmente aceita por todos os patologistas veterinários, com isso há ausência de critérios uniformes para diferenciar os tipos neoplásicos. Numerosos esquemas de classificação têm sido realizados, mas cada um possui certa limitação (KURZMAN & GILBERTSON, 1986, JONES ET AL, 2000, CASSALI, 2003 e KARAYANNOPOULOU ET AL, 2005). Segundo GILBERTSON e colaboradores (1983), é difícil e muitas vezes impossível se comparar resultados de estudos realizados por pesquisadores de diferentes instituições e chegar a conclusões válidas sobre as características biológicas de diferentes tipos de neoplasias mamárias. A avaliação histopatológica é realizada de uma forma subjetiva e nem sempre apresenta um resultado satisfatório em relação às neoplasias mamárias (PREZIOSI ET AL, 1995). Isso vem a justificar o grande interesse de investigação, através da imuno-histoquímica, de marcadores com valor prognóstico (SIRVENT ET AL, 1995, BODIS ET AL, 1996, SHEN ET AL, 1998, POPOVSKA ET AL, 1999, CASSALI,
26 2000, MACIOROWSKI ET AL, 2001, LIU ET AL, 2001, RUBIO, 2002, ZHAN ET AL, 2002, PIRES ET AL, 2004 e KING, 2007). O diagnóstico tardio tem sido associado a uma diminuição no tempo de sobrevivência livre da doença e no tempo de sobrevivência total do animal após a excisão cirúrgica, este é um fator independente e fortemente relacionado a um diagnóstico desfavorável para cães com neoplasias mamárias (PEREZ ALENZA, 2000). Determinar o prognóstico para o paciente canino com neoplasia mamária é difícil, pois o comportamento biológico dessas neoplasias varia muito. A considerável heterogeneidade das características histológicas e o comportamento desses tumores têm levado a conturbadas conclusões em relação ao critério prognóstico e administração terapêutica (GILBERTSON ET AL, 1983, KURZMAN & GILBERTSON, 1986 e KARAYANNOPOULOU ET AL, 2005). O prognóstico para o tratamento depende de vários fatores, como o tipo histológico neoplásico, tamanho do tumor, grau de invasividade, grau de diferenciação nuclear, estado dos linfonodos, o tempo de demora em se fazer o diagnóstico, presença ou não de ulceração e estado dos receptores hormonais. A ovariectomia ou ovariohisterectomia realizada juntamente com a mastectomia não apresenta efeito sobre o prognóstico, em cães com neoplasias de glândulas mamárias já estabelecidas, assim como a localização da neoplasia e o número de nódulos presentes (YAMAGAMI ET AL, 1996 e WITHROW & MACEWEN, 1996).
27 No câncer de mama hoje em dia, não são somente estudados índices patológicos convencionais tal como, tamanho do tumor, grau histológico e estado de linfonodos, mas em especial técnicas de imuno-histoquímica, para a detecção de receptores hormonais, fração de proliferação celular, morte celular e amplificação de certos oncogenes. Esses dados são de suma importância na tentativa de prever o comportamento biológico dos tumores e por permitir a seleção de uma melhor conduta terapêutica pelo clínico (SIRVENT ET AL, 1995, CASSALI ET AL, 2000 e SILVA ET AL, 2002). Da mesma forma, o estudo da expressão de marcadores biomoleculares em tumores malignos de glândulas mamárias auxilia na detecção de pacientes com alto risco de novas recidivas (SILVA ET AL, 2002 e KUSHLINSKII ET AL, 2004). 2.2 PROLIFERAÇÃO CELULAR Os processos-chave na proliferação das células são a replicação do DNA e a mitose. A seqüência de eventos que controla estes dois processos é conhecida como ciclo celular (KUMAR ET AL, 2008). Durante o ciclo celular, as células têm três caminhos possíveis a percorrer: permanecer no ciclo e, portanto seguir para uma próxima divisão; permanecer viva sem divisões adicionais, ou seja, seguindo para fase G0; ou morrer por apoptose. As decisões sobre qual caminho a ser seguido acontecem em dois pontos cardinais, chamados checkpoints, o ponto onde há comprometimento com a replicação do DNA, chamado ponto de restrição, e aquele onde há comprometimento com a
28 divisão mitótica no final de G2 (ALVES ET AL, 1999). Estes pontos de controle permitem que quaisquer defeitos sejam editados e reparados, assegurando, assim, que as células-filhas recebam o complemento total da informação genética, idêntico ao da célula parental (CAUDELL, 2004 e RIBEIRO-SILVA ET AL, 2006). As células na fase G1 (pré-síntese), estão se preparando para replicação do DNA e sofrem muitas alterações na expressão de genes, incluindo a síntese de proteínas ciclinas que são essenciais para iniciar a replicação normal do DNA. Múltiplas moléculas sensoras/efetoras também estão ativas durante essa fase do ciclo celular e podem detectar e reparar danos do DNA. A detecção de dano ao DNA desencadeia várias proteínas sensoras nucleares que sinalizam para bloquear a iniciação da síntese de DNA (fase S) ou iniciar apoptose para remover a célula danificada do reservatório em proliferação, este ponto de checagem é o chamado ponto de restrição, e como exemplo pode-se citar a proteína p53. Ao parar o ciclo celular em G1 a proteína p53 permite que os mecanismos de reparação atuem sobre os erros espontâneos ou induzidos no DNA. Se estes mecanismos falharem a p53 pode acionar eventos apoptóticos levando à destruição da célula danificada, através da estimulação de membros da família Bcl-2, encontrados na mitocôndria (CARROLL, 2004, RIBEIRO-SILVA ET AL, 2006, RUBIN ET AL, 2006 e KING, 2007). Se a fase G1 progredir sem detecção de mutações, dá-se início a replicação do DNA. Uma vez iniciada a fase S, as ciclinas formam complexos com enzimas chamadas de quinases ciclina-dependentes (CDKs) e estas trabalham pela promoção da replicação do DNA e vários aspectos do processo mitótico e são
29 necessárias para a progressão do ciclo celular. A fase G2 (crescimento pré-mitótico), é uma fase de repouso na qual as células se preparam para divisão e separação cromossômica. Inibidores específicos da progressão do ciclo celular em G2/M (mitose) também podem ser desencadeados por vários estímulos internos e externos. Os bloqueios na progressão do ciclo celular em G1 e G2 freqüentemente provocam apoptose como uma via de correção (CARROLL, 2004, RIBEIRO-SILVA ET AL, 2006, RUBIN ET AL, 2006, KING, 2007 e KUMAR ET AL, 2008). Uma característica crítica da maioria das neoplasias, principalmente, as malignas é a proliferação celular anormal, freqüentemente as células neoplásicas exibem uma perda do controle do ponto de restrição, ou seja, a gênese neoplásica é um processo complexo fundamentalmente relacionado a distúrbios no controle da proliferação celular, no qual uma célula normal sofre alteração na expressão gênica, o que lhe confere vantagens de crescimento sobre as demais células, sendo esta alteração herdada pelas células filhas (CUSTÓDIO, 2003, URRUTICOECHEA ET AL, 2005, RUBIN ET AL, 2006 e KING, 2007). Quanto maior a atividade proliferativa de uma neoplasia, pior será seu comportamento biológico. Como conseqüência, muitos esforços têm sido feitos no desenvolvimento de métodos objetivos para avaliar a proliferação celular e estudar o significado desses métodos no estudo das neoplasias, sendo úteis como um auxílio à terapêutica e ao prognóstico de pacientes de maneira individual (BRUNO & DARZYNKIEWICZ, 1992). De acordo com SCHMITT & GOBBI (2006) e RODASKI & DE NARDI (2006), o índice proliferativo tem uma boa correlação com a sobrevida e período livre de doença, além de ser um bom indicador de resposta à quimioterapia.
30 Na verdade, estudar a dinâmica celular é vital para a compreensão de uma grande variedade de processos fisiológicos e patológicos. Os métodos imunohistoquímicos, já se encontram entre os mais úteis e mais comumente utilizados para avaliação da proliferação celular, podendo servir como base para o diagnóstico e prognóstico na ausência de uma característica morfológica apropriada (KURZMAN & GILBERTSON, 1986; BAUER, 1990 e MALUF & KOERNER, 1994, KUSHLINSKII ET AL, 2004 e TERZIAN ET AL, 2007). Os métodos imuno-histoquímicos que utilizam marcadores de proliferação celular baseiam-se na detecção de antígenos cuja expressão tenha relação qualitativa ou quantitativa com uma ou mais fases do ciclo celular. HOLFSTÄDTER e colaboradores (1995) propõem o agrupamento destes antígenos em duas categorias: enzimas e cofatores que estão envolvidos na síntese de DNA durante a fase S do ciclo celular, onde se enquadra o antígeno nuclear de proliferação celular (PCNA Proliferation Cell Nuclear Antigen), mas também outros como a DNA polimerase alfa e a topoisomerase II alfa, e outras proteínas como Ki-67 (ALVES ET AL, 1999, KUSHLINSKII ET AL, 2004). A proliferação celular tem sido por muitos anos, mensurada através da contagem de figuras mitóticas, pela coloração de rotina hematoxilina e eosina, em cortes de tecidos. No entanto, isso proporciona menos informação do que os métodos mais recentes, devido ao período medido (fase M), ser considerado a menor porção do ciclo celular (PREZIOSI ET AL, 1995). Na maioria dos tecidos existem células que são encontradas no ciclo celular e fora dele, e a fração de
31 crescimento é a relação entre as células em divisão e o número total de células presentes no tecido (SCOTT ET AL, 1991). Um balanço entre proliferação, diferenciação e morte celulares determina o número de células numa população, bem como o seu tamanho ou mais precisamente o estágio de um tumor (SHEN ET AL, 1998). Muitos pesquisadores acreditam que a mensuração da proliferação celular e da apoptose podem melhorar a confiabilidade do prognóstico do comportamento tumoral, caracterizando biologicamente o tumor (DE JONG ET AL, 2000) MARCADORES DE PROLIFERAÇÃO CELULAR Antígeno Nuclear de Proliferação Celular (PCNA) Nos últimos anos o número de trabalhos que descrevem a aplicação dos anticorpos que reconhecem o antígeno nuclear de proliferação celular (PCNA Proliferation Cell Nuclear Antigen), como um marcador de proliferação celular em materiais histológicos tem sido grande, tanto Medicina humana quanto na Medicina Veterinária (HALL ET AL, 1990, MC CORMICK & HALL, 1992, PREZIOSI ET AL, 1995, ESPOSITO ET AL, 2000, FUNAKOSHI ET AL, 2000 e KUSHLINSKII ET AL, 2004). A disponibilidade de anticorpos monoclonais produzidos contra antígenos nucleares do ciclo celular se faz possível, por meio das técnicas de imuno-
32 histoquímica, um método rápido e fácil de avaliar a atividade cinética da neoplasia, juntamente com outros métodos como a medição do índice mitótico (SARLI ET AL, 1994 e SARLI ET AL, 1998). Esse interesse é uma conseqüência da ampla crença em considerar que cada marcador pode demonstrar ser útil como um indicador objetivo do comportamento biológico de pelo menos algumas formas de tumores, juntamente com a resistência de alguns epítopos de PCNA na fixação e no processamento convencional (HALL ET AL, 1990 e MC CORMICK & HALL, 1992). O PCNA é uma proteína altamente conservada, com homologia na seqüência de aminoácidos entre os mamíferos (ALMENDRAL ET AL, 1987). O gene para PCNA está presente não somente em mamíferos, mas também nas células de vegetais superiores (SUZUKA ET AL, 1989). Em 1978 MIYACHI e colaboradores, descreveram um soro autoimune de pacientes com Lupus Eritematoso Sistêmico, o qual reconheceu um antígeno nuclear distribuído nas células em proliferação, e foi conseqüentemente chamado de antígeno nuclear de proliferação celular (MC CORMICK & HALL, 1992), ou seja, o PCNA foi descrito como um auto-anticorpo (ALVES ET AL, 1999). Em 3% dos pacientes que sofrem de Lupus Eritematoso Sistêmico são encontrados anticorpos contra PCNA e foi através do uso do soro desses pacientes que a proteína foi primeiramente definida. Esses anticorpos policlonais têm sido usados para estudos in vivo e in vitro do PCNA (WASEEM & LANE, 1990).
33 O PCNA é uma proteína de 36 kd, reguladora do ciclo celular, detectada através da imunofluorescência (WASEEM & LANE, 1990). O PCNA é um auxiliar da DNA-polimerase-delta que atua na replicação celular (XIONG ET AL, 1992). A concentração de PCNA aumenta rapidamente no meio da fase G1 do ciclo celular, permanece elevado por toda fase S, então rapidamente diminui de G2/M para G1 (SARLI ET AL, 1994). Alguns aspectos biológicos complicam a interpretação de reações para o PCNA, pois há uma superexpressão em alguns tipos de neoplasias malignas, não relacionada às fases do ciclo celular, células normais adjacentes a neoplasias e fora do ciclo celular, podem também apresentar expressão do antígeno (HALL ET AL, 1990). Além disso, um outro fator bem conhecido é a sua meia vida relativamente longa, cerca de 20 horas, que permite que células que há muito já deixaram o ciclo celular ainda persistam apresentando o antígeno (BRAVO & BRAVO, 1987 e SCOTT ET AL, 1991). Algumas proteínas não degradadas podem ainda restar nas células (SARLI ET AL, 1994 e PREZIOSI ET AL, 1995), resultando numa proporção de positividade imuno-histoquímica maior do que a esperada quando avaliamos outros marcadores de proliferação celular (ALVES ET AL, 1999). O PCNA na imuno-histoquímica, mostra dois principais grupos de núcleos, fortemente marcados e menos intensamente marcados; quando o tecido é fixado em formol, somente a contagem dos núcleos fortemente marcados é sugerido por alguns autores para o uso, porque as células nas quais eles ocorrem estão incontestavelmente nas fases G1/S do ciclo celular (PREZIOSI ET AL, 1995). Desta forma, na avaliação do índice PCNA, alguns autores têm sugerido somente a
34 contagem desses núcleos para evitar a inclusão de células que não estão ciclando (SARLI ET AL, 1995). Uma ampla variedade de anticorpos que reconhecem o PCNA estão disponíveis. Comercialmente os reagentes disponíveis incluem os anticorpos monoclonais 19A2, 19F4 e PC10 (MC CORMICK & HALL, 1992). Dois anticorpos monoclonais designados 19A2 e 19F4 têm sido produzidos contra PCNA de coelho. Por Western blotting eles reconhecem PCNA de diferentes espécies de mamíferos. Seus epítopos têm sido localizados na região central da molécula de PCNA (WASEEM & LANE, 1990). É aparente que os epítopos reconhecidos por esses anticorpos são diferentes e existem diferenças nos efeitos de fixação e processamento sobre a detectabilidade desses epítopos. Além disso, parece existir diferenças entre o comportamento imuno-histoquímico desses anticorpos em comparação com os autoanticorpos humanos. Isso talvez seja uma explicação parcial para discrepância entre informações sobre a relação entre a imunoreatividade do PCNA e outros marcadores do ciclo celular (MC CORMICK & HALL, 1992). O clone PC10 reconhece epítopos de proteínas resistentes à parafina e ao formol, facilitando o uso de material reservado, que tem sido processado rotineiramente. Apesar de poder ser usado com recuperação de epítopos pelo calor (microondas, panela de pressão ou banho Maria), o PC10 é mais comumente usado sem este procedimento. O padrão de reação então parece ser fortemente influenciado pela fixação do tecido longos períodos de fixação em formol diminuem significativamente o percentual de células marcadas (ROWLANDS ET AL,
35 1991). Alguns autores têm sugerido que a fixação não deve ser maior que 48 horas (SARLI ET AL, 1995) Marcador de Proliferação Celular Ki-67 Em 1983, GERDES e colaboradores descreveram a preparação de um anticorpo monoclonal de camundongo, dirigido a um antígeno presente em células em proliferação, que foi chamado de Ki-67. Ele reconhece um epítopo sobre um antígeno nuclear o qual é expressado nas células que estão no ciclo celular (YU & FILIPE, 1993). Essa proteína é considerada um componente da matriz nuclear (SARLI ET AL, 1994), e é um marcador que tem uma maior consistência biológica (ALVES ET AL, 1999 e URRUTICOECHEA ET AL, 2005). Estudos sugerem que a distribuição do Ki-67 não é dependente da presença de DNA ou de histonas, o que indica que o antígeno é associado com uma estrutura não protéica, não histônica conhecida como scaffold cromossômico ou é parte integral dela (FONATSCH ET AL, 1991 e ALVES ET AL, 1999), é uma proteína nuclear altamente protease sensitiva, ou seja, possui alta suscetibilidade ao tratamento com proteases, reunida por cadeia polipeptídica, é um complexo bimolecular com um peso molecular evidente de 345 e 395 kd (CASTAGNARO ET AL, 1998). O gene responsável pela expressão do antígeno Ki-67 está localizado no
36 braço longo do cromossomo humano 10 (locus 10q25) (SCHONK ET AL, 1989 e FONATSCH ET AL, 1991). A utilização do anticorpo Ki-67 tem sido proposta para determinar a fração de crescimento em neoplasias e em tecidos (GERDES ET AL, 1984 e KAMEL ET AL, 1989) e existem evidências que a imunomarcação deste anticorpo tem uma boa correlação com outros marcadores de proliferação celular (HALL & LEVISON, 1990 e URRUTICOECHEA ET AL, 2005). De acordo com ESPOSITO e colaboradores (2000), em carcinomas epidermóides do trato aerodigestivo superior em humanos, a expressão imuno-histoquímica do Ki-67 apresentou uma correlação positiva com a expressão do PCNA. Segundo SIRVENT e colaboradores (1995), o Ki-67 é um seguro, rápido e objetivo indicador do grau de agressividade tumoral, ao mesmo tempo, dependendo do grau de diferenciação da neoplasia, tem sido mostrado ser de valor prognóstico para sobrevivência e recorrência do câncer de mama. Em 1984, GERDES e colaboradores publicaram um estudo detalhado da expressão do Ki-67 nas diferentes fases do ciclo celular. A imunomarcação é expressada por todas as fases G1, S, G2 e M, do ciclo celular, com um pico de concentração na fase G2/M (SARLI ET AL, 1994 e SARLI ET AL, 1998). A expressão do Ki-67 é mínima no final da fase G1 e início da fase S e a sua taxa aumenta durante a segunda metade da fase S, e este antígeno desaparece rapidamente após a mitose (BRUNO & DARZYKIEWICZ, 1992). Este antígeno está localizado no nucléolo em G1, com uma distribuição, mais tarde, nucleoplásmica no
37 ciclo, aumentando sua intensidade durante as fases S e G2, atingindo um máximo na mitose. Com a progressão de S para G2, o antígeno Ki-67 está estreitamente associado com a cromatina e na mitose, toda imunoreatividade do Ki-67 está colocalizada com as cromátides (YU & FILIPE, 1993). Células que não estão no ciclo celular, ou seja, as que se encontram na fase G0, não mostram nenhuma reatividade para o anticorpo (SARLI ET AL, 1994). Também não foi encontrado nas células que estão entrando no ciclo celular, vindas de G0 para a parte inicial de G1 (CASTAGNARO ET AL, 1998). A vida média deste antígeno detectável é muito curta, o que é uma vantagem, sendo degradado em 1 hora ou menos após a mitose (BRUNO & DARZYKIEWICZ, 1992), isso provavelmente é devido à presença de numerosos PEST (prolina-ac. glutâmico-serina-treonina) os quais facilitam um rápido catabolismo (YU & FILIPE, 1993). Isso garante que células que já tenham saído do ciclo celular não apresentem o antígeno (ALVES ET AL, 1999). FALINI e colaboradores (1989) encontraram imunoreatividade do Ki-67 em tecidos de outros mamíferos além do homem, como por exemplo cordeiro, bezerro, cão, coelho e rato, mas a precisa extensão da qual ele é evolucionariamente conservado não é ainda determinado (YU & FILIPE, 1993). De qualquer forma, tendo em vista todos estes dados, nos parece claro que a marcação do Ki-67 resulta numa avaliação bastante aproximada da fração de crescimento de uma população celular. Marcação mesmo que tênue pode ser
38 considerada positiva, ou seja, a célula mesmo minimamente marcada encontra-se dentro do ciclo celular (SCOTT ET AL, 1991). CASTAGNARO e colaboradores (1998) investigaram a expressão imunohistoquímica do antígeno Ki-67 em 48 carcinomas mamários felinos, para observar se o índice Ki-67 forneceria uma indicação do tempo de sobrevivência pós-cirúrgica (PST). Um ano depois, 50% dos gatos estavam ainda vivos (grupo A), enquanto os outros 50% foram a óbito (grupo B). Uma diferença estatística significante no Ki-67 foi encontrada entre os dois grupos e nenhuma outra diferença estatística foi encontrada. O Ki-67 não correlacionou com a idade ou diferente tipo histológico, de acordo com a classificação da organização mundial de saúde. No carcinoma mamário em mulheres, a atividade proliferativa estudada através da expressão do anticorpo Ki-67, foi significativamente maior no carcinoma ductal infiltrativo do que no carcinoma ductal in situ (SHEN ET AL, 1998). Segundo ZUCARI (2001), o Ki-67 é um excelente marcador de proliferação celular no diagnóstico e prognóstico de carcinomas mamários e para a malignidade em neoplasias mamárias em cadelas. Verificando que o Ki-67 está associado com a proliferação celular, estando a fração de células neoplásicas positivas ao Ki-67 correlacionada com a evolução clínica da doença. Em relação ao diagnóstico histológico, marcadores proliferativos podem mostrar uma boa correlação com categorias histológicas, como por exemplo, distinguindo entre condições benignas e malignas, ou distinguindo entre
39 malignidades de alto e baixo grau. No entanto, estudos muitas vezes mostram um envolvimento considerável entre os grupos e não é, portanto, justificável na maioria dos casos usar índices de proliferação como um diagnóstico absoluto. O mais indicado é usar os marcadores de proliferação como um adjunto ao critério histológico convencional (YU & FILIPE, 1993). A determinação da imunoreatividade dos marcadores Ki-67 e PCNA é um método objetivo e quantificável mais sensível e específico para avaliar a proliferação celular do que a contagem do número de mitoses na histologia e que pode subsidiar informações prognósticas (ESPOSITO ET AL, 2000 e RIBEIRO JUNIOR ET AL, 2000). A identificação imuno-histoquímica de antígenos específicos para células em multiplicação, por anticorpos monoclonais como Ki-67 e PCNA oferece uma boa abordagem para a avaliação da fração de crescimento (SARLI ET AL, 1994, SARLI ET AL, 1998, PAPANTONIOU ET AL, 2003 e KUSHLINSKII ET AL, 2004). Segundo ALVES e colaboradores (1999) e URRUTICOECHEA e colaboradores (2005), o Ki- 67, na forma do MIB-1, é o melhor marcador operacional da proliferação celular para o patologista cirúrgico. 2.3 MORTE CELULAR POR APOPTOSE A apoptose, também denominada morte celular programada, refere-se a um mecanismo de suicídio celular. É uma via pré-organizada de morte celular,
40 desencadeada por diferentes sinais extracelulares e intracelulares. A apoptose detecta e destrói células que abrigam mutações, mantendo assim a consistência genética e prevenindo o desenvolvimento do câncer. Por outro lado clones de células tumorais freqüentemente desenvolvem mecanismos para impedir a apoptose (KERR ET AL, 1994, LIU ET AL, 2001, PORTH, 2004, PEREIRA, 2006 e RUBIN, STRAYER, 2006, GRIVICICH ET AL, 2007 e TERZIAN, 2007). A apoptose foi primeiramente descrita por KERR e colaboradores (1972), e caracteriza-se por uma seqüência de eventos programados que incluem ativação de enzimas endógenas, resultando em endonucleólise e culminando com a fragmentação do DNA e de proteínas nucleares e citoplasmáticas (WYLLIE, 1980, ARENDS ET AL, 1990, DARZYNKIEWICZ ET AL, 1992, KAJSTURA ET AL, 1996, HENGARTNER, 2000 e KUMAR ET AL, 2008). Através da análise histológica, nos tecidos corados com hematoxilina-eosina, a apoptose envolve células isoladas ou pequenos grupos de células, denominados corpos apoptóticos. A célula apoptótica aparece como uma massa redonda ou oval de citoplasma intensamente eosinofílico, com fragmentos de cromatina nuclear densa. Como a retração celular e a formação de corpúsculos apoptóticos ocorrem de forma acelerada e os fragmentos são rapidamente fagocitados, degradados ou expulsos para a luz, a apoptose pode ocorrer nos tecidos antes que se torne evidente em seções histológicas. Além disso, a apoptose, ao contrário da necrose, não apresenta reação inflamatória, dificultando a sua detecção histológica, pois o recrutamento de neutrófilos ou de linfócitos não é comum (HENGARTNER, 2000,
41 PEREIRA, 2006, MITCHELL, 2006, RUBIN & STRAYER, 2006 e KUMAR ET AL, 2008). A pesquisa do processo de morte celular programada, resultando em apoptose, tornou-se uma das áreas em maior expansão na biologia celular nos últimos anos. Este processo vem evidenciando que a eliminação das células é um dos eventos mais importantes na biologia celular e que constitui o principal mecanismo de morte celular em vários processos fisiológicos ou patológicos. Esse mecanismo de morte celular é importante na maturação de certos sistemas orgânicos, tal como na involução tímica; na remoção de células maduras; também na senescência, como ocorre, por exemplo, na regressão prostática; eliminação de células com dano imposto ao DNA por infecção viral, irradiação ou agentes citotóxicos e eliminação de células neoplásicas em tumores, mais freqüentemente em tumores com crescimento celular ativo (WYLLIE, 1980, SANDFORD ET AL, 1984, SAVILL ET AL, 1989, KERR ET AL, 1994, KAJSTURA ET AL, 1996, STEVENS & LOWE, 2002, SOUZA ET AL, 2004, SCHÖNDORF ET AL, 2004 e GRIVICICH ET AL, 2007). O crescimento da massa tumoral ocorre em função do aumento da taxa de proliferação celular em neoplasias, que é devido não somente ao crescimento descontrolado das células neoplásicas, mas também pela diminuição da taxa de morte celular programada, resultado da falta de células que sofrem apoptose; por outro lado, considera-se que, se o índice de apoptose apresenta-se alto, o tumor cresce muito lentamente (CARSON & RIBEIRO, 1993, CUELLO-CARRIÓN & CIOCCA, 1999, OKADA & MAK, 2004 e STRICKER & KUMAR, 2008). Apesar da
42 enorme variabilidade do câncer, evidências demonstram que a resistência à apoptose é uma das características mais marcantes da maioria dos tumores malignos (OKADA & MAK, 2004). Levando-se em consideração que durante o crescimento tumoral existe um equilíbrio ou um balanço entre a proliferação e morte celular, no qual o processo de apoptose está envolvido, o alto número de células apoptóticas será proporcional a alta taxa de proliferação celular e um prognóstico desfavorável (SIMÃO ET AL, 1999, GONZÁLEZ-CÁMPORA ET AL, 2000, LIU ET AL, 2001, NAKOPOULOU ET AL, 2001 e URRUTICOECHEA ET AL, 2005) Em um estudo realizado por PEREIRA e colaboradores (2003) com 30 casos de tumores mamários caninos, o número de células apoptóticas foi comparado ao prognóstico. Foi observado a possibilidade de um prognóstico desfavorável nos casos com uma alta taxa de células apoptóticas, sendo que nenhum tumor mamário canino, com prognóstico desfavorável apresentou menos que 30 células apoptóticas, contadas em 10 campos de maior aumento. Muitas publicações têm demonstrado que cânceres de mama em mulheres, com um alto índice apoptótico apresentam um prognóstico favorável quando comparado com o mesmo tipo de câncer com um menor índice apoptótico ou nenhuma apoptose (LIPPONEN & AALTOMAA, 1994, BERARDO ET AL, 1998, DEL BUFALO ET AL, 2002, SCHÖNDORF ET AL, 2003 e SIRVENT ET AL, 2004). Taxas extremamente baixas de apoptose podem prolongar a sobrevida ou reduzir a
43 substituição de células anormais. Esse acúmulo de células pode originar neoplasias malignas, como as de mama, próstata e ovários (MITCHELL, 2006). Embora a seqüência de eventos intracelulares responsáveis pela apoptose ainda não esteja totalmente conhecida, várias alterações bioquímicas foram implicadas no processo (STITES ET AL, 2000). O processo de apoptose é bastante complexo e regulado, em parte, por marcadores moleculares muitas vezes associados com a carcinogênese mamária, ou seja, um desequilíbrio entre a proliferação celular e a apoptose pode contribuir para a carcinogênese e progressão tumoral (LIU ET AL, 2001). Dado o papel central da apoptose em muitos processos patológicos, a identificação das células apoptóticas vem se tornando um aspecto importante na investigação da patogênese da doença (POPOVSKA ET AL, 1999, SATOH ET AL, 2000, DEL BUFALO ET AL, 2002, SCHÖNDORF ET AL, 2003, PEREIRA ET AL, 2003 e SIRVENT ET AL, 2004). O evento fundamental na apoptose é a ativação de enzimas denominadas caspases. O processo de apoptose pode ser dividido em uma fase de ativação, ou seja, onde as caspases tornam-se ativas e uma fase efetora, na qual as enzimas atuam provocando a morte celular (SATOH ET AL, 2000, MITCHELL, 2006, PEREIRA, 2006, GRIVICICH ET AL, 2007 e KUMAR ET AL, 2008). As caspases proteolíticas que medeiam a fase de ativação são altamente conservadas entre as espécies: no termo caspase, o c refere-se a uma enzima que possui uma cisteína em seu local ativo e aspase refere-se à habilidade dessas
44 enzimas de clivar os resíduos do ácido aspártico (STITES ET AL, 2000, SATOH ET AL, 2000, GRIFFITHS ET AL, 2001, MITCHELL, 2006 e KING, 2007). As caspases são divididas em dois grupos básicos iniciadoras e efetoras dependendo da ordem em que são ativadas durante a apoptose. As caspases iniciadoras incluem a caspase-8 e a caspase-9. Várias caspases, incluindo a caspase-3 e a caspase-6 são efetoras. Depois que uma caspase iniciadora é ativada, o programa de morte enzimática é iniciado pela ativação rápida e seqüencial das outras caspases, desta forma desencadeiam os processos nucleares e citoplasmáticos que levam à morte celular por apoptose. As caspases efetoras atuam em vários componentes celulares; elas clivam proteínas do citoesqueleto e da matriz nuclear, rompendo assim o citoesqueleto e levando à destruição do núcleo. No núcleo, as caspases clivam as proteínas envolvidas na transcrição, replicação e reparação do DNA. Em especial, a caspase-3 ativa uma DNAse citoplasmática que resulta na clivagem internucleossômica característica do DNA (PATEL ET AL, 1996, DE ROBERTIS, 2001, KIVINEN ET AL, 2005, PEREIRA, 2006 e MITCHELL, 2006). O início da apoptose ocorre por sinais de duas vias distintas, porém convergentes: a via extrínseca ou iniciada por receptores, e a via intrínseca, ou mitocondrial (MITCHELL, 2006 e PEREIRA, 2006). Os desencadeadores da apoptose mais bem conhecidos na membrana celular são o ligante do TNF-α (fator de necrose tumoral) a seu receptor (TNFR) e a proteína ligante Faz/CD95 (Fas-L ou CD95-L) a seu receptor (Fas ou receptor Fas), ou seja, via extrínseca. O TNF-α, é com maior freqüência, uma citocina livre,
45 enquanto a proteína ligante Fas localiza-se na membrana plasmática. Receptores para TNF-α e a proteína ligante Fas tornam-se ativados mediante ligação com seus ligantes. Essas proteínas transmembrana possuem seqüências de aminoácidos em suas caudas citoplasmáticas, denominadas domínios de morte, que operam como pontos de atracamento para os domínios de morte de outras proteínas que participam do processo sinalizador acarretando apoptose. Após se ligar aos receptores, estas últimas proteínas ativam moléculas sinalizadoras na seqüência, especialmente a pró-caspase-8, que é convertida a caspase-8. Por sua vez, a caspase-8 inicia uma cascata de ativação de outras caspases seqüenciais na via da apoptose. Essas caspases (3, 6 e 7) ativam muitas enzimas nucleares, como a PARP (poli-adp-ribosil polimerase) que medeiam a fragmentação nuclear da morte celular apoptótica (YONISH-ROUACH ET AL, 1991, EVAN ET AL, 1992, NAGATA & GOLSTEIN, 1995, RUBIN & STRAYER, 2006 e KUMAR ET AL, 2008). A apoptose também é mediada por proteínas mitocondriais, via intrínseca. A membrana mitocondrial é um regulador essencial do equilíbrio entre morte e sobrevida celular. A escolha entre a sobrevivência e a morte é determinada pela permeabilidade da mitocôndria, controlada por uma família de mais de 20 proteínas, cujo protótipo é a Bcl-2. As proteínas da família de Bcl-2 residem na membrana interna mitocondrial e são pró-apoptóticas ou anti-apoptóticas (pró-sobrevida). Quando há preponderância de homodímeros compostos de proteínas próapoptóticas, desta família, a cascata apoptótica é ativada. Este excesso de constituintes pró-apoptóticos da família bcl-2 promove a abertura dos poros mitocondriais, aumentando a permeabilidade da membrana mitocondrial, permitindo o extravasamento do citocromo C e outras proteínas mitocondriais para o citosol. O
46 citocromo C, em conjunto com alguns co-fatores, como APAF-1 (Fator Ativador de Protease da Apoptose-1), convertem a pró-caspase-9 em caspase-9. Esta ativa as caspases seqüenciais (3, 6, 7) da mesma forma que a caspase-8. Em muitos tipos celulares, a caspase-8 também pode clivar e ativar um membro pró-apoptótico da família Bcl-2, chamado Bid, portanto no interior da via mitocondrial. A ativação combinada de ambas as vias lança um golpe letal para a célula, logo a via mitocondrial parece ser a via responsável pela maioria das situações de apoptose (HOCKENBERY ET AL, 1990, SHEN ET AL, 1998, RUBIN & STRAYER, 2006 e KUMAR ET AL, 2008) MARCADOR DE APOPTOSE CASPASE-3 Um método para o estudo da apoptose, se dá através da pesquisa de marcação imuno-histoquímica da proteína caspase-3. A caspase-3 é uma enzima encontrada no citosol e é ativada somente em células acometidas pela apoptose, uma vez ativada, ela é essencial para a desintegração da estrutura nuclear, contribuindo para a fragmentação do DNA da célula, e é neste estágio que ocorre o desenvolvimento das características morfológicas clássicas da apoptose. A ativação da caspase-3 ocorre em resposta a uma variedade de indutores de apoptose (KUMAR, 1995, HADJILOUCAS ET AL, 2001 e KIVINEN ET AL, 2005). A detecção da forma ativa da caspase-3 no citoplasma de células em apoptose pela imunohistoquímica, indica o início do evento, seguido do desenvolvimento das características morfológicas clássicas da apoptose, sendo uma maneira segura e
47 está fortemente correlacionada com a avaliação morfológica (HADJILOUCAS ET AL, 2001). Devido à ampla expressão da caspase-3 e sua função na regulação da vida e morte dos vários tipos celulares, recentes dados sugerem que a taxa de sua expressão em neoplasias malignas está correlacionada com a progressão da carcinogênese (NAKAGAWARA ET AL, 1997 e VAKKALA ET AL, 1999). Esta molécula desempenha uma importante função no mecanismo de apoptose dos carcinomas mamários, sendo um valioso indicador prognóstico para esses carcinomas (NAKOPOULOU ET AL, 2001). A marcação da caspase-3 pode ser usada no controle da resposta aos tratamentos quimioterápicos quanto a possível resistência da droga, onde a diminuição da expressão pode indicar um mecanismo importante de sobrevivência celular em pacientes com câncer de mama (NERURKAR ET AL, 1989, DE JONG ET AL, 2000, PARTON ET AL, 2002 e O DONOVAN ET AL, 2003). A avaliação da apoptose, é portanto de grande interesse para a avaliação biológica da cinética tumoral e no potencial prognóstico da resposta clínica à um tratamento (MACIOROWSKI ET AL, 2001 e SCHÖNDORF ET AL, 2004). A correlação entre o índice apoptótico e a proliferação celular se mostrou bastante positiva, principalmente em carcinomas mamários, indicando que a apoptose está diretamente relacionada à taxa de proliferação tumoral na tentativa de controlar seu crescimento. Quanto à caspase-3, o alto número de células
48 apoptóticas está relacionado a um prognóstico desfavorável (PARTON ET AL, 2002). Para a avaliação da progressão tumoral, conseqüentemente, de uma proliferação celular mais precisa é necessário a associação de vários marcadores prognósticos, devido a isso este trabalho teve como objetivo avaliar a atividade proliferativa e a morte celular programada em neoplasias mamárias caninas, comparando os resultados de ambas as técnicas, em associação também com uma análise comparativa do tipo histológico das neoplasias. A técnica de imunohistoquímica, surge como um complemento para análise histopatológica de rotina, acrescentado mais informações sobre o comportamento tumoral e auxiliando de forma bem expressiva num diagnóstico e prognóstico mais precisos das neoplasias mamárias e conseqüentemente num tratamento clínico mais adequado por parte do médico veterinário, podendo desta forma também continuar sendo utilizado como um modelo experimental nos estudos comparativos à neoplasia mamária humana.
49 3 HIPÓTESES - Existe correlação entre a imunopositividade do anticorpo anti-pcna e do anticorpo anti-ki-67 (MIB-1) em neoplasias mamárias malignas caninas - Existe correlação entre a imunopositividade do anticorpo anti-pcna e do anticorpo anti-ki-67 (MIB-1) com o anticorpo anti-caspase-3 clivada em neoplasias mamárias malignas caninas
50 4 OBJETIVOS 4.1 OBJETIVO GERAL - Analisar a atividade proliferativa e apoptótica nas neoplasias mamárias malignas caninas 4.2 OBJETIVOS ESPECÍFICOS - Avaliar a expressão dos marcadores anti-pcna (antígeno nuclear de proliferação nuclear) e anti-ki-67 (MIB-1) nas neoplasias mamárias malignas caninas - Avaliar a expressão da caspase-3 clivada nas neoplasias mamárias malignas caninas - Correlacionar a expressão dos anticorpos anti-pcna, anti-ki-67 (MIB-1) e anticaspase-3 clivada nas neoplasias mamárias malignas caninas
51 5 MATERIAIS E MÉTODOS 5.1 MATERIAL Para a realização deste trabalho, foram utilizados 61 casos de neoplasias malignas de glândulas mamárias em cadelas, sendo que todos os casos eram de cadelas que foram submetidas à mastectomia radical, no período de agosto de 2003 a maio de Para cada caso existia uma ficha de pedido para análise anátomopatológica, onde constavam informações importantes, como histórico e a técnica utilizada para a exérese da massa tumoral. Todas as cadeias mamárias recebidas, foram imersas em solução de formol tamponado a 10%. Posteriormente foi realizada a checagem e a coleta de amostras destas cadeias mamárias para serem processados e incluídos em parafina. A partir destes, foram realizados cortes dos blocos de parafina que foram corados pela hematoxilina-eosina, para análise histopatológica.
52 5.2 PROCEDIMENTOS Os casos selecionados foram de neoplasias mamárias malignas caninas obtidas cirurgicamente, através de mastectomia radical bilateral ou não. Foram coletadas informações como a raça e idade do animal, sendo realizada descrição macroscópica da cadeia mamária e descrição microscópica e diagnóstico conclusivo. Posteriormente, foram separados todos os cortes parafinados corados em hematoxilina-eosina dos casos de neoplasias malignas mamárias caninas. A partir de todos os cortes histológicos analisados, foram selecionados de um a dois cortes histológicos, os que melhor representavam o tipo histológico neoplásico observado, ou seja, o diagnóstico conclusivo e após esta seleção, foram obtidos os blocos referentes a cada caso. Dos blocos selecionados foram confeccionados cortes em lâminas silanizadas para a realização de técnica de imuno-histoquímica IMUNO-HISTOQUÍMICA De cada bloco selecionado foram feitos cortes com fragmentos de três a quatro µm de espessura em lâminas pré-tratadas com silano à 4% (ATPS) em acetona, para serem utilizadas pela a técnica de imuno-histoquímica.
53 Ao se iniciar a técnica de imuno-histoquímca, os cortes sofreram um préaquecimento durante dez minutos em estufa à 60 C, a pós, foi realizada a desparafinização, em xilol durante dez minutos em estufa à 60ºC, seguido de quatro banhos de cinco minutos em xilol a temperatura ambiente. Seguiu-se, então a hidratação dos cortes em dois banhos em álcool absoluto (etanol) por cinco minutos, dois banhos em álcool 90% por cinco minutos e duas lavagens em água destilada também por 5 minutos. O bloqueio da peroxidase endógena era realizado com um banho de 30 minutos numa solução de peróxido de hidrogênio a 3% em água destilada. A recuperação antigênica dos cortes era realizada em banho Maria, durante 45 minutos, imersos na solução target retrieval de ph 6.0 (Dako-Cytomation, código S1699) a 10% em água destilada, sendo esta solução previamente aquecida durante 30 minutos. Posteriormente os fragmentos eram esfriados durante, aproximadamente, 40 minutos. Esta etapa só era realizada para os fragmentos que foram incubados com os anticorpos primários anti-ki-67 e anti-caspase-3 clivada, ou seja, para o anticorpo primário anti-pcna a recuperação antigênica não era realizada. Após a recuperação antigênica, as lâminas eram lavadas em tampão TBS, com ph entre 7.2 e 7.4. Em seguida, ocorria a inibição das ligações inespecíficas, onde os cortes foram incubados em câmara úmida com uma solução composta de BSA (soro
54 albumina bovina), TBS com cloreto de sódio e leite em pó desnatado (POLAK E VAN NOORDEN, 1997), por um período de 15 minutos em temperatura ambiente. Depois o excesso desta solução era retirado e incubava-se os cortes com o anticorpo primário durante 18 hs à 4ºC em câmara úmida, com diluição de 1/30 para anticorpo anti-ki-67 (Dako-Cytomation, Clone MIB-1, código M7240), 1/300 para anticorpo anti-pcna (Dako-Cytomation, Clone PC10 código M0879) e 1/400 para anti-caspase-3 clivada (Cell Signaling Technology, ASP175). Passado este tempo, os cortes eram lavados em tampão TBS e incubados com as soluções contidas no Kit LSAB + System HRP (Dako-Cytomation, código K0690), ou seja, durante 30 minutos com a solução Biotinylated link universal e posteriormente por mais 30 minutos com a solução streptavidin-hrp. Entre estas etapas, eram realizadas três lavagens em tampão TBS por 5 minutos. Após esse tempo, os cortes sofriam novas lavagens em TBS e eram revelados com o substrato cromogênico DAB (diaminobenzidina) (Dako-Cytomation), por cerca de quatro minutos para cada corte, esta revelação foi acompanhada através da microscopia ótica, mostrando uma reação de coloração marrom, nos locais onde existia positividade. Em seguida as lâminas sofriam lavagens em água destilada e eram contracoradas com hematoxilina de Harris, sendo azulados em uma solução de água destilada e amônia.
55 Posteriormente, foi realizada a desidratação dos cortes em dois banhos de um minuto em álcool a 90% e dois banhos de um minuto em álcool absoluto. Seguida da diafanização que era realizada através de quatro banhos de dois minutos em xilol. Logo após, montavam-se as lâminas em entelan e lamínula. Como controle positivo foram utilizados cortes histológicos de tecido mamário e linfonodos humanos e para a realização do controle negativo era excluída a etapa de utilização do anticorpo primário. 5.3 ANÁLISE DO MATERIAL ANÁLISES HISTOPATOLÓGICA E IMUNO-HISTOQUÍMICA A análise histopatológica das amostras de neoplasias mamárias malignas caninas foi realizada por dois observadores, através da leitura de cortes corados pela coloração de rotina hematoxilina-eosina. A classificação e o diagnóstico histopatológico das neoplasias mamárias foram realizados de acordo com a classificação da Organização Mundial de Saúde (OMS), desenvolvida para tumores mamários caninos (MISDORP ET AL, 1999). A análise histomorfométrica foi realizada por um único observador, através da contagem de células de origem epitelial e mesenquimal que se mostraram imunopositivas para cada anticorpo utilizado, dentre as células observadas incluiu-se as células dos ductos das glândulas mamárias, células mioepiteliais, células
56 endoteliais e tecido conjuntivo. Antes de se iniciar a contagem, as lâminas eram observadas e toda a área tumoral era circundada usando-se caneta para retroprojetor, no intuito de delinear toda a neoplasia, ou seja, fazendo com que desta forma somente as células da área neoplásica fossem analisadas e contadas. A contagem destas células imunomarcadas, foi feita utilizando-se um microscópio ótico da marca Olympus Optical Company Modelo BX41TF / U-MDOB3, onde foram contados 10 campos com a objetiva de 40x, sendo utilizado para esta contagem o método denominado Barra Grega, para obtenção de uma área contada mais uniforme e fidedigna de todo tumor. Após a contagem, das células imunomarcadas, dos 10 campos era obtida a média de células imunopositivas, por campo, somando-se os valores encontrados em cada campo divididos por 10 (GONZÁLEZ-CÁMPORA ET AL, 2000 e PEREIRA ET AL, 2003) ANÁLISE ESTATÍSTICA A análise foi realizada com base nos valores médios dos 10 campos das amostras. Para as análises estatísticas foram utilizadas ferramentas de estatística descritiva. Para as variáveis quantitativas foram usados o teste de Kruskal-Wallis na comparação de 2 ou mais amostras independentes. Foi realizada uma análise de correlação entre as variáveis quantitativas, com teste de significância para as mesmas. Foi adotado nas análises um nível de significância de 5%. O teste quiquadrado foi utilizado na análise, na comparação de grupos quanto a variáveis qualitativas (VIEIRA, 2003).
57 6 RESULTADOS De acordo com os 61 casos de neoplasias mamárias malignas caninas selecionados (Anexo 1), as massas tumorais apresentaram tamanhos variando de milímetros a 10,0 x 7,8 x 6,0 cm. Com relação a idade dos animais, 4,9% tinham menos de 5 anos de idade, 65,6% tinham entre 5 e 10 anos de idade e 29,5% acima de 10 anos de idade (Tab.1). O maior número de cadelas acometidas foram da raça Poodle (23,0%), sem raça definida (SRD) (16,4%) e da raça Cocker Spaniel (11,5%) (Tab.2). TABELA 1: FAIXA ETÁRIA DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS Freqüência Porcentagem Idade (anos) < 5 3 4,9 [5,10] 40 65,6 > ,5 Total ,0
58 TABELA 2: FREQÜÊNCIA DAS RAÇAS DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS Freqüência Porcentagem Raça poodle 14 23,0 SRD 10 16,4 cocker spaniel 7 11,5 yorkshire 5 8,2 pastor alemão 4 6,6 maltês 3 4,9 basset dachshund 3 4,9 bichon frise 3 4,9 fox paulistinha 2 3,3 rottweiler 2 3,3 pinsher 2 3,3 beagle 2 3,3 labrador 1 1,6 collie 1 1,6 pit bull 1 1,6 husky siberiano 1 1,6 Total ,0 6.1 ANÁLISE HISTOPATOLÓGICA As neoplasias foram classificadas de acordo com a classificação da Organização Mundial de Saúde (OMS) (MISDORP ET AL, 1999), desenvolvida para tumores mamários caninos e posteriormente foram descritas as características conforme os achados histopatológicos. Das 61 (100%) amostras analisadas através da histopatologia, foram observados cinco (8,20%) carcinossarcomas; nove (14,75%) carcinomas em tumores mistos; seis (9,84%) adenocarcinomas tubulares complexos; doze (19,70%) adenocarcinomas tubulares simples; treze (21,31%) adenocarcinomas papilíferos ou
59 papilares complexos; 15 (24,60%) adenocarcinomas papilíferos ou papilares simples e um (1,63%) carcinoma sólido simples (Tab.3). TABELA 3: FREQÜÊNCIA DOS DIAGNÓSTICOS HISTOPATOLÓGICOS DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS Freqüência Porcentagem Diagnóstico Histopatológico papilífero simples 15 24,6 papilífero complexo 13 21,3 tubular simples 12 19,7 carcinoma em tumor misto 9 14,8 tubular complexo 6 9,8 carcinossarcoma 5 8,2 sólido simples 1 1,6 Total ,0 Não houve nenhuma associação entre a faixa etária dos animais estudados quanto ao diagnóstico histopatológico das neoplasias mamárias malignas analisadas (p=0,522) (Tab.4). TABELA 4: FREQÜÊNCIA DOS DIAGNÓSTICOS HISTOPATOLÓGICOS E A FAIXA ETÁRIA DOS ANIMAIS COM NEOPLASIAS MAMÁRIAS MALIGNAS ESTUDADAS Faixa Etária (anos) papilífero complexo papilífero simples Diagnóstico Histopatológico (HE) tubular complexo tubular simples Carcinoma em tumor misto carcinossarcoma sólido simples < [5,10] > Total Total
60 Das 61 amostras de neoplasias mamárias malignas caninas analisadas, cinco (8,2%) foram classificadas como carcinossarcoma (Fig.1). Nestes casos, foi observado tecido glandular mamário apresentando pequenas áreas com formações tubulares de células epiteliais neoplásicas cuboidais a colunares, ora com camada dupla, ora com várias camadas de células, pleomorfismo celular e nuclear variando de discreto a acentuado, hipercromatismo nuclear, nucléolos evidentes, algumas células apresentando mais de um nucléolo, às vezes com aparência esmerilhada e em anel de sinete, presença de figuras de mitoses e algumas células com citoplasma vacuolado. Havia também projeções papiliformes de células neoplásicas de revestimento do ducto. Nestas amostras foram observadas também formações nodulares compostas por material mixóide e/ou por tecido cartilaginoso e/ou por ósseo com características histológicas indicativas de malignidade, que caracterizavam componentes condrossarcomatoso e osteossarcomatoso e às vezes estes predominavam em relação ao componente glandular. Algumas amostras apresentavam proliferação de células mioepiteliais. Várias glândulas apresentavam dilatações císticas, secreção acidófila na sua luz e células descamativas no interior. Em alguns casos se observou extensa área de ulceração com processo inflamatório misto associado, congestão, hemorragia, pigmento de hemossiderina, necrose e focos de mineralização. Em nove (14,8%) casos analisados, foi observado o mesmo padrão histológico anteriormente citado, indicando a malignidade dos componentes epiteliais, mas não houve a observação das características malignas dos componentes mesenquimais, ou seja, tecido cartilaginoso e ósseo, logo essas amostras foram classificadas como carcinomas em tumores mistos (Fig.2).
61 Seis (9,8%) casos, dos 61 estudados, foram definidos como adenocarcinomas tubulares complexos (Fig.3). As amostras destas neoplasias mostraram formações tubulares com revestimento de células epiteliais neoplásicas, em dupla ou mais camadas; este aspecto tubular neoplásico também foi evidenciado na forma de estruturas nodulares circunscritas, mostrando pleomorfismo celular discreto a moderado, núcleos hipercromáticos, nucléolos evidentes, aumentados, células com mais de um nucléolo e a presença de figuras mitóticas. Foram evidenciados também vários ductos dilatados com células descamativas no interior e formações císticas, com material acidófilo na luz. Havia proliferação de células mioepiteliais ao redor dos ductos, ora desorganizadas, ora formando redemoinhos e em determinadas amostras áreas com desmoplasia. Outros aspectos observados foram neovascularização, congestão, hemorragia, pigmento de hemossiderina e em alguns casos áreas de necrose, às vezes com focos de mineralização e presença de infiltrado inflamatório com linfócitos e plasmócitos. Algumas amostras mostraram uma arquitetura e características muito semelhantes ao do adenocarcinoma tubular complexo, por apresentarem células organizadas em formações tubulares, estando em algumas áreas na forma de nódulos circunscritos, com pseudocápsula e no interior proliferação de células epiteliais de revestimento com transformações neoplásicas, com organização tubular, somente não sendo evidenciada a proliferação das células mioepiteliais, desta maneira doze (19,7%) casos foram classificados como adenocarcinomas tubulares simples (Fig.4).
62 Dos 61 casos estudados, treze (21,3%) foram classificados como adenocarcinomas papilíferos ou papilares complexos (Fig.5), onde foram evidenciadas várias formações tubulares, às vezes organizadas em nódulos, com proliferação de células epiteliais de revestimento neoplásicas de múltiplas camadas, com projeções papiliformes projetadas para o interior do lúmen dos ácinos das glândulas mamárias, demonstrando hipercromatismo nuclear, pleomorfismo celular moderado, núcleos com nucléolo evidente, núcleos com mais de um nucléolo, células com núcleos esmerilhados e figuras mitóticas. Foram observados também alguns ácinos com formações císticas, apresentando na sua luz secreção acidófila e células descamativas. Outros aspectos observados foram áreas ou focos de proliferação de células mioepiteliais. Congestão, hemorragia, pigmento de hemossiderina e necrose também foram evidenciados e em determinadas amostras presença de infiltrado inflamatório linfoplasmocitário. Da mesma maneira em quinze (24,6%) amostras, semelhante padrão arquitetônico foi evidenciado, várias formações nodulares, circunscritas, bem delimitadas e presença de projeções papiliformes para o interior dos ductos, com epitélio glandular composto por células neoplásicas cuboidais a colunares, com hipercromatismo nuclear, nucléolos evidentes, algumas células apresentando mais de um nucléolo, pleomorfismo discreto a acentuado, mas a proliferação das células mioepiteliais não foi observada, sendo estas amostras classificadas como adenocarcinomas papilíferos ou papilares simples (Fig.6). Em um (1,60%) caso foi observado formações nodulares separadas por septos de tecido conjuntivo e células epiteliais de revestimento tubular arranjadas
63 em cordões sólidos, algumas com formato ovóide, com ausência de formação tubular e ausência de lúmen. As células apresentavam pleomorfismo moderado, nucléolos evidentes, células com mais de um nucléolo, núcleos hipercromáticos, citoplasma vacuolado e presença de mitoses. Assim sendo, essa neoplasia foi classificada como carcinoma sólido simples de glândula mamária (Fig.7). A avaliação das margens de segurança das amostras das neoplasias mamárias malignas demonstrou que 49,2% das margens estavam livres; 26,2% estavam livres, porém próximas à massa neoplásica; 16,4% tinham as margens de segurança comprometidas; 4,9% tinham as margens de segurança comprometidas com metástase em linfonodos e 3,3% tinham as margens de segurança livres com metástase em linfonodos (Tab.5). TABELA 5: FREQÜÊNCIA DAS MARGENS DE SEGURANÇA NAS AMOSTRAS DE NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS Freqüência Porcentagem Margens de segurança livre 30 49,2 livre, mas próxima 16 26,2 comprometida 10 16,4 comprometida com 3 4,9 metástase linfonodo livre com metástase 2 3,3 linfonodo Total ,0
64 6.2 ANÁLISE IMUNO-HISTOQUÍMICA ANÁLISE DA IMUNOMARCAÇÃO COM O ANTICORPO ANTI- PCNA (ANTÍGENO NUCLEAR DE PROLIFERAÇÃO CELULAR) O anticorpo anti-pcna se mostrou positivo, a marcação dos núcleos das células apresentou certas variações em relação à intensidade, ou seja, em determinadas amostras houve uma marcação intensa e em outros fragmentos, de maneira mais fraca, inclusive, esta variação também pôde ser observada num mesmo campo analisado. Em alguns casos, células em fase M do ciclo celular, apresentaram uma marcação citoplasmática (Fig.8). A imunoreatividade do anticorpo anti-pcna foi mais evidente nos núcleos das células epiteliais dos ductos das glândulas mamárias, do que nas células do tecido conjuntivo e nas células mioepiteliais, encontradas logo abaixo do epitélio ductal glandular (Figs.9 e 10). Da mesma maneira, observou-se uma maior marcação dos núcleos das células nas áreas com menor grau de diferenciação do que em áreas mais bem diferenciadas. Com relação as células endoteliais e inflamatórias, a quantidade de células marcadas foi muito pequena. Com relação ao tipo histológico das neoplasias, foi observado uma maior marcação nos adenocarcinomas tubulares complexos (média=31,53), seguido pelos adenocarcinomas papilíferos simples (média=29,63); carcinossarcomas (média=23,88); adenocarcinomas tubulares simples (média=23,71); carcinomas em
65 tumores mistos (média=19,50) e adenocarcinomas papilíferos complexos (média=15,55) (Tab.6). No carcinoma sólido a marcação se mostrou maior em toda área tumoral (média=238,9) (Fig.11). Da mesma maneira, em alguns casos de adenocarcinomas papilíferos ou tubulares, havia áreas sólidas que apresentavam este mesmo padrão de imunopositividade. No caso dos carcinossarcomas e carcinomas em tumores mistos, estes apresentaram imunopositividade nas células ductais, mas nas áreas mesenquimais, como as áreas mixóides, de formação cartilaginosa e de tecido ósseo mineralizado, não foi observada nenhuma reatividade com o anticorpo anti-pcna. A área mesenquimal, onde pôde ser observada marcação, era aquela mais próxima dos ductos glandulares e de tecido conjuntivo intersticial (Figs.12, 13 e 14). De acordo com a análise estatística, as medianas dos valores de núcleos imunopositivos de células epiteliais, pelo anticorpo anti-pcna nas amostras estudadas das neoplasias mamárias malignas caninas, tiveram valores próximos. A variabilidade das marcações foi menor nos adenocarcinomas papilíferos complexos, tubulares complexos, carcinomas em tumores mistos e carcinossarcomas. Valores discrepantes foram encontrados nos adenocarcinomas papilíferos complexos, tubulares complexos e carcinossarcomas. Os adenocarcinomas papilíferos simples e tubulares simples apresentaram uma maior variabilidade de marcação. Com o diagnóstico de apenas um caso de carcinoma sólido simples, não foi possível uma avaliação estatística detalhada, no entanto foi observado que esta neoplasia é
66 facilmente identificável, devido ao alto valor observado em sua marcação (Tab. 6 e Graf.1). TABELA 6: VALORES DA MÉDIA E MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS DOS DUCTOS, IMUNOPOSITIVAMENTE MARCADOS PELO ANTICORPO ANTI- PCNA, DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO Diagnóstico Histopatológico Nº de casos Média±DP Mediana ADENOCARCINOMA PAPILAR 13 15,55±19,18 9,7 COMPLEXO ADENOCARCINOMA TUBULAR 6 31,53±32,98 20,45 COMPLEXO ADENOCARCINOMA PAPILAR 15 29,63±25,56 17,8 SIMPLES ADENOCARCINOMA TUBULAR 12 23,71±24,66 7,38 SIMPLES CARCINOMA EM TUMOR MISTO 9 19,50±13,03 18,9 CARCINOSSARCOMA 5 23,88±36,15 7,7 CARCINOMA SÓLIDO SIMPLES 1 238,9 206,0 LEGENDA: DP (Desvio Padrão)
67 GRÁFICO 1: BOXPLOT DA MÉDIA DE NÚCLEOS, DAS CÉLULAS EPITELIAIS, MARCADOS IMUNOPOSITIVAMENTE PELO ANTICORPO ANTI-PCNA POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO Não houve diferença significativa entre o diagnóstico dos tipos histopatológicos das neoplasias mamárias malignas caninas quanto à imunomarcação com o anticorpo anti-pcna dos núcleos das células epiteliais imunopositivos, ao nível de significância de 5% (p=0,473). O caso de neoplasia mamária canina com o maior número de núcleos positivos de células epiteliais foi o carcinoma sólido (caso nº9) e um adenocarcinoma tubular complexo (caso nº53) e o caso que apresentou a menor marcação foi um adenocarcinoma papilar complexo (caso nº1). Na avaliação estatística dos núcleos marcados, de células epiteliais, imunopositivamente com o anticorpo anti-pcna, dos casos estudados de neoplasias
68 mamárias, com relação as margens de segurança, os valores das medianas dos três primeiros grupos (que tinham pelo menos cinco animais) ficaram próximos (Tab.7 e Graf.2). Não foi encontrada diferença significativa, entre esses três grupos, das margens de segurança quanto à imunomarcação do anticorpo anti-pcna (p=0,468) nos casos estudados de neoplasias mamárias. TABELA 7: VALORES DA MÉDIA E DA MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS IMUNOMARCADOS PELO ANTICORPO ANTI-PCNA, DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA Nº de casos Média±DP Mediana Margens de Segurança livre 30 17,83±17,94 11,67 livre, mas 16 23,00±21,69 15,92 próxima comprometida 10 48,63±72,87 21,52 comprometida 3 40,60±41,62 26,70 com metástase linfonodo livre com metástase linfonodo 2 71,47±12,33 71,47 LEGENDA: DP (Desvio Padrão)
69 GRÁFICO 2: BOXPLOT DA MÉDIA DE NÚCLEOS DAS CÉLULAS EPITELIAIS MARCADOS COM O ANTICORPO ANTI-PCNA DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA ANÁLISE DA IMUNOMARCAÇÃO COM O ANTICORPO ANTI- Ki-67 O anticorpo anti-ki-67 mostrou imunoreatividade em todas as amostras de neoplasias mamárias malignas caninas, com a marcação dos núcleos das células na fase M do ciclo celular e às vezes mostrando somente a marcação de nucléolos e/ou marcação perinuclear, de maneira semelhante ao observado no controle positivo utilizado (Fig.8). Foi observado também alguma variação na intensidade de marcação das células entre amostras e na mesma amostra.
70 Assim como na imunoreatividade com o anticorpo anti-pcna, a positividade com o anticorpo anti-ki-67, foi mais observada nas células epiteliais dos ductos glandulares mamários, do que nas células de origem mesenquimal (Fig.9 e 10). A marcação das células em proliferação celular foi mais evidente nos adenocarcinomas tubulares complexos (média=27,18), seguidos pelos adenocarcinomas papilíferos simples (média=25,21); adenocarcinomas tubulares simples (média=18,8); carcinossarcomas (média=17,25); carcinomas em tumores mistos (média=11,67) e adenocarcinomas papilíferos complexos (média=10,84) (Tab.8). No caso do carcinoma sólido, uma grande quantidade de células epiteliais positivas foram observadas em toda área neoplásica (média=224,5), inclusive com a marcação de células em anel de sinete. O mesmo foi visualizado nas áreas sólidas encontradas em alguns casos de adenocarcinomas (Fig.11). Em relação aos carcinossarcomas e carcinomas em tumores mistos, a imunopositividade com o anticorpo anti-ki-67, foi mais evidente na área dos ductos glandulares do que nas áreas mixóides, de tecido cartilaginoso e tecido mineralizado, nestas áreas a marcação foi nula. A maioria das células fusiformes que apresentaram positividade foram àquelas mais próximas aos ductos glandulares (Fig.12, 13 e 14). De acordo com a análise estatística, as medianas dos valores de núcleos imunopositivos, de células epiteliais, pelo anticorpo anti-ki-67 das amostras
71 estudadas de neoplasias mamárias caninas tiveram valores próximos. A variabilidade das marcações foi menor do que com o anticorpo anti-pcna, mas esta variabilidade se manteve menor nos adenocarcinomas papilíferos complexos, tubulares complexos, carcinomas em tumores mistos e carcinossarcomas. Valores discrepantes também foram encontrados nos adenocarcinomas papilíferos complexos, tubulares complexos e carcinossarcomas. Os adenocarcinomas papilíferos simples e tubulares simples apresentaram uma maior variabilidade de marcação, assim como o observado com o anti-pcna. Da mesma forma, devido ao diagnóstico de apenas um caso de carcinoma sólido simples, não foi possível uma avaliação estatística detalhada, no entanto foi observado que esta neoplasia é facilmente identificável pelo elevado valor observado (Tab.8 e Graf.3). TABELA 8: VALORES DA MÉDIA E MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS DOS DUCTOS, IMUNOPOSITIVAMENTE MARCADOS PELO ANTICORPO ANTI-Ki- 67, POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO Diagnóstico Histopatológico Nº de casos Média±DP Mediana ADENOCARCINOMA PAPILAR 13 10,84±7,89 8,2 COMPLEXO ADENOCARCINOMA TUBULAR 6 27,18±29,24 17,8 COMPLEXO ADENOCARCINOMA PAPILAR 15 25,21±22,76 13,6 SIMPLES ADENOCARCINOMA TUBULAR 12 18,8±16,23 13,95 SIMPLES CARCINOMA EM TUMOR MISTO 9 11,67±9,48 9,8 CARCINOSSARCOMA 5 17,25±20,84 7,65 CARCINOMA SÓLIDO SIMPLES 1 224,5 202,0 LEGENDA: DP (Desvio Padrão)
72 GRÁFICO 3: BOXPLOT DA MÉDIA DE NÚCLEOS DAS CÉLULAS EPITELIAIS MARCADOS IMUNOPOSITIVAMENTE PELO ANTICORPO ANTI-KI-67 POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO Não foi observada diferença significativa em relação ao diagnóstico dos tipos histopatológicos das neoplasias mamárias caninas e a imunomarcação com o anticorpo anti-ki-67 dos núcleos das células epiteliais imunopositivas, ao nível de significância de 5% (p=0,594). O caso de neoplasia mamária canina com o maior número de núcleos positivos de células epiteliais foi o carcinoma sólido (caso nº9) e um adenocarcinoma papilífero simples (caso nº16) e o caso que apresentou a menor marcação foi um carcinossarcoma (caso nº36). Na avaliação estatística dos núcleos marcados, de células epiteliais, imunopositivamente com o anticorpo anti-ki-67, dos casos estudados de neoplasias
73 mamárias, com relação as margens de segurança, não houve variabilidade entre eles, e os valores das medianas para os três primeiros grupos ficaram próximos (Tab.9 e Graf.4). Não foi encontrada diferença significativa entre os grupos das margens de segurança quanto a imunomarcação do anticorpo anti-ki-67 (p=0,232) nos casos estudados de neoplasias mamárias. TABELA 9: VALORES DA MÉDIA E DA MEDIANA DO NÚMERO DE NÚCLEOS DAS CÉLULAS EPITELIAIS IMUNOMARCADOS PELO ANTICORPO ANTI-KI-67, DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA Margens de Segurança LEGENDA: DP (Desvio Padrão) Nº de casos Média±DP Mediana livre 30 12,88±11,01 8,85 livre, mas 16 19,33±17,30 12,40 próxima comprometida 10 45,17±68,34 10,62 comprometida 3 27,48±23,27 2,17 com metástase linfonodo livre com metástase linfonodo 2 43,05±41,64 43,05
74 GRÁFICO 4: BOXPLOT DA MÉDIA DE NÚCLEOS DAS CÉLULAS EPITELIAIS MARCADOS COM O ANTICORPO ANTI-KI-67 DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA ANÁLISE DA IMUNOMARCAÇÃO COM O ANTICORPO ANTI- CASPASE-3 CLIVADA Com relação ao anticorpo anti-caspase-3 clivada, este mostrou-se positivo com uma marcação citoplasmática nas células dos ductos glandulares, evidenciando as características morfológicas da apoptose e/ou células que estão apresentando a caspase-3 clivada. A imunoreatividade com a caspase-3 clivada, foi bem menor nas áreas observadas, quando comparada com os anticorpos anti-pcna e anti-ki-67.
75 A marcação citoplasmática na maioria das vezes se mostrou de maneira bem intensa, dando ao citoplasma um aspecto granular, já em alguns casos houve variação na intensidade da marcação. Em algumas células em alguns casos também pôde ser observada uma marcação nuclear. A positividade do anticorpo anti-caspase-3 clivada foi mais evidente nas células dos ductos das glândulas mamárias, do que nas células do tecido conjuntivo e nas células mioepiteliais, encontradas logo abaixo do epitélio ductal glandular. Da mesma maneira, observou-se uma maior marcação nas células das áreas com maior grau de diferenciação do que em áreas menos diferenciadas (Fig.8, 9 e 10). A positividade do anticorpo anti-caspase-3 clivada foi mais observada nos adenocarcinomas tubulares complexos e carcinossarcomas (média=5,46 cada um), seguidos pelos adenocarcinomas papilíferos complexos (média=5,08); adenocarcinomas tubulares simples (média=4,87); carcinomas em tumores mistos (média=4,73) e adenocarcinomas papilíferos simples (média=3,16) (Tab.10). Com relação aos casos de carcinomas sólidos a marcação positiva com a caspase-3 clivada foi muito pequena. O mesmo ocorreu em áreas sólidas, encontradas em alguns casos de adenocarcinomas (Fig.11). Em relação aos carcinossarcomas e carcinomas em tumores mistos, a imunopositividade com o anticorpo anti-caspase-3 clivada, foi mais evidente nas células dos ductos glandulares do que nas células das áreas mixóides, de tecido
76 cartilaginoso e tecido mineralizado, nestas áreas a marcação foi nula (Fig.12, 13 e 14). De acordo com a análise estatística, as medianas dos valores de células epitelais imunopositivas pelo anticorpo anti-caspase-3 clivada, nas amostras estudadas das neoplasias mamárias caninas, tiveram valores próximos. Em todos os casos, foi observado uma variabilidade menor e um menor número de células imunopositivas, quando comparado aos valores das imunomarcações com os anticorpos anti-pcna e anti-ki-67. Da mesma forma, devido ao diagnóstico de apenas um caso de carcinoma sólido simples, não foi possível uma avaliação estatística detalhada, no entanto foi observado que esta neoplasia é facilmente identificável pelo baixo valor observado (Tab.10 e Graf.5). TABELA 10: VALORES DA MÉDIA E MEDIANA DO NÚMERO DE CÉLULAS EPITELIAIS DOS DUCTOS, IMUNOPOSITIVAMENTE MARCADAS PELO ANTICORPO ANTI-CASPASE-3 CLIVADA, POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO Diagnóstico Histopatológico Nº de casos Média±DP Mediana ADENOCARCINOMA PAPILAR 13 5,08±3,27 3,9 COMPLEXO ADENOCARCINOMA TUBULAR 6 5,46±5,83 3,97 COMPLEXO ADENOCARCINOMA PAPILAR 15 3,16±2,22 3,55 SIMPLES ADENOCARCINOMA TUBULAR 12 4,87±4,36 3,63 SIMPLES CARCINOMA EM TUMOR MISTO 9 4,73±2,73 3,55 CARCINOSSARCOMA 5 5,46±6,02 1,3 CARCINOMA SÓLIDO SIMPLES 1 0,3 1,0 LEGENDA: DP (Desvio Padrão)
77 GRÁFICO 5: BOXPLOT DA MÉDIA DAS CÉLULAS EPITELIAIS MARCADAS IMUNOPOSITIVAMENTE PELO ANTICORPO ANTI- CASPASE-3 CLIVADA POR CAMPO DOS CASOS ESTUDADOS DENTRO DE CADA TIPO NEOPLÁSICO Não houve diferença significativa entre o diagnóstico dos tipos histopatológicos, das neoplasias mamárias caninas, quanto a imunomarcação com o anticorpo anti-caspase-3 clivada das células epiteliais, ao nível de significância de 5% (p=0,844). O caso de neoplasia mamária canina com o maior número de células epiteliais positivas foi um adenocarcinoma tubular complexo (caso nº23) e os casos que apresentaram uma menor marcação foram o carcinoma sólido (caso nº9) e um adenocarcinoma tubular simples (caso nº48). Na avaliação estatística das células epiteliais marcadas imunopositivamente pelo anticorpo anti-caspase-3 clivada, dos casos estudados de neoplasias mamárias, com relação as margens de segurança, os valores das medianas foram
78 próximos (Tab. 11 e Graf.6). Não foi encontrada diferença significativa entre os grupos das margens de segurança quanto a imunomarcação do anticorpo anticaspase-3 clivada (p=0,934).nos casos estudados de neoplasias mamárias malignas. TABELA 11: VALORES DA MÉDIA E DA MEDIANA DO NÚMERO DE CÉLULAS EPITELIAIS IMUNOMARCADAS PELO ANTICORPO ANTI-CASPASE-3 CLIVADA, DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA Nº de casos Média±DP Mediana Margens de Segurança livre 30 4,47±3,58 3,50 livre, mas 16 3,98±2,90 3,47 próxima comprometida 10 4,08±3,64 3,53 comprometida 3 9,97±7,76 12,30 com metástase linfonodo livre com metástase linfonodo 2 3,00±1,98 3,00 LEGENDA: DP (Desvio Padrão)
79 GRÁFICO 6: BOXPLOT DA MÉDIA DAS CÉLULAS EPITELIAIS MARCADAS COM O ANTICORPO ANTI-CASPASE-3 CLIVADA DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS DE ACORDO COM AS MARGENS DE SEGURANÇA CORRELAÇÃO DAS IMUNOMARCAÇÕES COM OS ANTICORPOS ANTI-PCNA, ANTI-KI-67 E ANTI-CASPASE-3 CLIVADA De uma maneira geral, em todos os casos de neoplasias mamárias malignas caninas estudados, nas células epiteliais, existiu uma correlação positiva entre a imunomarcação com o anticorpo anti-pcna e o anticorpo anti-ki-67, que foi significativa (r=0,923; p<0,001) (Graf.7), ou seja, quando houve um elevado número de núcleos imunopositivos para PCNA, também houve um elevado número de núcleos imunopositivos para Ki-67. Entre a imunomarcação com o anticorpo anti-
80 PCNA e anti-ki-67, quando comparado à imunomarcação com o anticorpo anticaspase-3 clivada, houve uma tendência de correlação negativa, isto é, quando foram observados muitos núcleos imunomarcados pelo PCNA e Ki-67, poucas células foram observadas imunomarcadas pela Caspase-3 clivada, porém não foi considerado significativo a nível de significância de 5% (PCNA: r= -0,219, p=0,09; Ki- 67: r= -0,255; p=0,047) (Graf.8 e 9). GRÁFICO 7: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-KI-67 X ANTI-PCNA DAS CÉLULAS EPITELIAIS DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS
81 GRÁFICO 8: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-PCNA X ANTI-CASPASE-3 CLIVADA DAS CÉLULAS EPITELIAIS DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS GRÁFICO 9: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-KI-67 X ANTI-CASPASE-3 CLIVADA DAS CÉLULAS EPITELIAIS DAS NEOPLASIAS MAMÁRIAS MALIGNAS CANINAS
82 A análise estatística da correlação das imunomarcações dos três anticorpos nas células epiteliais das neoplasias mamárias malignas caninas, só foi realizada nos casos de adenocarcinomas papilíferos complexos, papilíferos simples e tubulares simples, pois os outros tipos histopatológicos, ou seja, os adenocarcinomas tubulares complexos, carcinomas em tumores mistos, carcinossarcomas e carcinoma sólido, tinham um número de amostras insuficientes para a realização desta análise. A significância da associação das imunomarcações das células epiteliais pelos anticorpos anti-ki-67 e anti-pcna, nos adenocarcinomas papilíferos complexos (PC), papilíferos simples (PS) e tubulares simples (TS) foi mantida, ou seja, existiu uma correlação positiva entre a imunomarcação com o anticorpo anti- PCNA e o anticorpo anti-ki-67, que foi significativa, isto é, quando era observado uma grande imunomarcação dos núcleos pelo PCNA, o mesmo ocorria com o Ki-67 (PC: r=0,798, p=0,001; PS: r=0,707, p=0,003; TS: r=0,850, p<0,001). Nos adenocarcinomas papilíferos complexos (PC) e papilíferos simples (PS), a relação entre as imunomarcações das células epiteliais pelos anticorpos anti- PCNA e anti-ki-67, quando comparados com a imunomarcação das células epiteliais pelo anticorpo anti-caspase-3 clivada, pareceu ser decrescente, ou seja, quanto maior era quantidade de núcleos imunopositivos pelos marcadores PCNA e Ki-67, menor era a quantidade de células imunopositivas pela Caspase-3 clivada, mas no entanto, não gerou uma correlação significativa (PC: PCNA: r= -0,096, p=0,755; Ki- 67: r= -0,131, p=0,669 / PS: PCNA: r= -0,361, p=0,186; Ki-67: r= -0,410, p=0,129).
83 No caso dos adenocarcinomas tubulares simples, houve uma correlação linear negativa significativa entre a imunomarcação das células epiteliais pelo anticorpo anti-ki-67, quando comparado com o anticorpo anti-caspase-3 clivada, isto é, quanto maior a quantidade de núcleos imunomarcados pelo Ki-67, havia uma menor quantidade de células imunomarcadas com a Caspase-3 clivada (r= -0,620, p=0,031) e quando da comparação da imunomarcação do anticorpo anti-pcna e com o anti-caspase-3 clivada houve também uma tendência de correlação negativa significativa (r= -0,584, p=0,046) (Graf.10 e 11). GRÁFICO 10: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-Ki-67 X ANTI-CASPASE-3 CLIVADA NAS ÁREAS EPITELIAIS DOS ADENOCARCINOMAS TUBULARES SIMPLES
84 GRÁFICO 11: DIAGRAMA DE DISPERSÃO DA IMUNOMARCAÇÃO DO ANTICORPO ANTI-PCNA X ANTI-CASPASE-3 CLIVADA NAS ÁREAS EPITELIAIS DOS ADENOCARCINOMAS TUBULARES SIMPLES
85 A E C D Figura 1: Cadela. Glândula Mamária. Carcinossarcoma. Fotomicrografia A. Tecido glandular com formações tubulares e papilíferas dos ductos glandulares com células epiteliais neoplásicas e presença de área mixóide. B. Pleomorfismo celular e nuclear, núcleos esmerilhados e núcleolos evidentes. C. Formação de matriz óssea. D. Formação de matriz cartilaginosa com características histológicas indicativas de malignidade.(he,barra=100µ)
86 A B C D Figura 2: Cadela. Glândula Mamária. Carcinoma em Tumor Misto. Fotomicrografia A. Tecido glandular com formações tubulares dos ductos glandulares com células epiteliais neoplásicas e presença de área mixóide. B. Pleomorfismo celular e nuclear, e núcleolos evidentes e aumentados. C. Formação de matriz cartilaginosa. D. Formação de matriz mineralizada.(he,barra=100µ)
87 A B Figura 3: Cadela. Glândula Mamária. Adenocarcinoma Tubular Complexo. Fotomicrografia A e B. Padrão tubular das células epiteliais neoplásicas dos ductos glandulares com proliferação de células mioepiteliais. C. Pleomorfismo nuclear, núcleos hipercromáticos, nucléolos evidentes, aumentados, núcleos esmerilhados, presença de núcleos com mais de um nucléolo e mitoses. (HE,Barra=100µ) C
88 A B Figura 4: Cadela. Glândula Mamária. Adenocarcinoma Tubular Simples. Fotomicrografia A e B. Padrão tubular das células epiteliais neoplásicas dos ductos glandulares. C. Pleomorfismo nuclear, núcleos hipercromáticos, nucléolos evidentes, aumentados, núcleos esmerilhados e mitoses. (HE,Barra=100µ) C
89 A B C D Figura 5: Cadela. Glândula Mamária. Adenocarcinoma Papilífero Complexo. Fotomicrografia A e B. Formações tubulares com projeções papiliformes para o interior do lúmen dos ductos glandulares e proliferação de células mioepiteliais. C. Padrão papilífero. D. Pleomorfismo nuclear, núcleos hipercromáticos, nucléolos evidentes, núcleos com mais de um nucléolo, células com núcleos esmerilhados e figuras mitóticas.(he,barra=100µ)
90 A B Figura 6: Cadela. Glândula Mamária. Adenocarcinoma Papilífero Simples. Fotomicrografia A e B. Presença de projeções papiliformes para o interior dos ácinos glandulares. C. Pleomorfismo celular e nuclear, núcleos hipercromáticos, núcleos esmerilhados, nucléolos evidentes, células com mais de um nucléolo e mitoses. (HE,Barra=100µ) C
91 A B C Figura 7: Cadela. Glândula Mamária. Carcinoma Sólido Simples. Fotomicrografia A e B. Formações nodulares separadas por septos de tecido conjuntivo e arranjo das células em cordões sólidos. C. Pleomorfismo nuclear, núcleos hipercromáticos, nucléolos evidentes e mitoses. (HE,Barra=100µ)
92 A B C D E F Figura 8: Cadela. Glândula Mamária. Adenocarcinoma Papilífero Simples. Fotomicrografia A. Projeções papilíferas para o interior dos ductos glandulares, coloração de hematoxilina-eosina. B e C. Imunoreatividade das células epiteliais dos ductos glandulares em proliferação com o anticorpo anti-pcna. D e E. Imuno-reatividade das células epiteliais dos ductos glandulares em proliferação com o anticorpo anti-ki- 67. F. Imuno-reatividade das células epiteliais dos ductos glandulares com o anticorpo anti-caspase-3 clivada. (Barra=100µ)
93 A B C D Figura 9: Cadela. Glândula Mamária. Adenocarcinoma Tubular Complexo. Fotomicrografia A. Padrão Tubular com proliferação de células mioepiteliais, coloração de hematoxilina-eosina. B. Imuno-reatividade do anticorpo anti-pcna no núcleo das células epiteliais em proliferação e rara marcação na área mesenquimal. C. Imuno-reatividade do anticorpo-anti-ki-67 no núcleo das células epiteliais em proliferação e rara marcação na área mesenquimal. D. Imuno-reatividade do anticorpo anti-caspase-3 clivada e ausência de marcação na área mesenquimal. (Barra=100µ)
94 A B C D Figura 10: Cadela. Glândula Mamária. Adenocarcinoma Papilífero Complexo. Fotomicrografia A. Células dos ductos com características neoplásicas e proliferação de células mioepiteliais, coloração hematoxilinaeosina. B. Imuno-reatividade das células epiteliais dos ductos glandulares em proliferação com o anticorpo anti-pcna. C. Imuno-reatividade das células epiteliais dos ductos glandulares em proliferação com o anticorpo anti-ki-67. D. Imuno-reatividade das células epiteliais dos ductos glandulares com o anticorpo anti-caspase-3 clivada (Barra=100µ)
95 A B C D Figura 11: Cadela. Glândula Mamária. Carcinoma Sólido. Fotomicrografia A. Formações nodulares com padrão sólido das células epiteliais, separadas por septos de tecido conjuntivo, coloração de hematoxilinaeosina. B. Imuno-reatividade do anticorpo anti-pcna no núcleo das células epiteliais em proliferação. C. Imuno-reatividade do anticorpo-anti-ki-67 no núcleo das células epiteliais em proliferação. D. Imunoreatividade do anticorpo anti-caspase-3 clivada evidenciando a ausência de células epiteliais em apoptose. (Barra=100µ)
96 A B C D E F Figura 12: Cadela. Glândula Mamária. Carcinossarcoma. Fotomicrografia A. Formações tubulares e papilíferas dos ductos glandulares com células epiteliais neoplásicas, coloração hematoxilina-eosina. B. Imuno-reatividade das células epiteliais dos ductos glandulares em proliferação com o anticorpo anti- PCNA. C e D. Imuno-reatividade das células epiteliais dos ductos glandulares em proliferação com o anticorpo anti-ki-67. E e F. Imuno-reatividade das células epiteliais dos ductos glandulares com o anticorpo anti-caspase-3 clivada.(barra=100µ)
97 A B C D Figura 13: Cadela. Glândula Mamária. Carcinoma em Tumor Misto. Fotomicrografia A. Padrão tubular com células epiteliais neoplásicas, coloração hematoxilina-eosina. B. Imuno-reatividade do anticorpo anti-pcna nas células em proliferação dos ácinos glandulares. C. Imuno-reatividade do anticorpo anti-ki-67 nas células em proliferação dos ácinos glandulares. D. Imuno-reatividade do anticorpo anti-caspase-3 clivada nas células em apoptose dos ácinos glandulares.(barra=100µ)
98 A B C D E F Figura 14: Cadela. Glândula Mamária. Fotomicrografia A e B Carcinossarcoma. A. Formação de matriz cartilaginosa, coloração hematoxilina-eosina. B. Imuno-reatividade do anticorpo anti-pcna na matriz cartilaginosa. C-F. Carcinoma em Tumor Misto. C Formação de matriz cartilaginosa e óssea, coloração hematoxilina-eosina. D. Imuno-reatividade do anticorpo anti-pcna na matriz cartilaginosa e óssea. E. Imunoreatividade do anticorpo anti-ki-67 na matriz cartilaginosa. E. Imuno-reatividade do anticorpo anti-caspase-3 clivada na matriz cartilaginosa e óssea.(barra=100µ)
TÍTULO: IMUNOMARCAÇÃO DE COX-2 DE MODELO CARCINOGÊNESE MAMARIA POR INDUÇÃO QUÍMICA
 TÍTULO: IMUNOMARCAÇÃO DE COX-2 DE MODELO CARCINOGÊNESE MAMARIA POR INDUÇÃO QUÍMICA CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA INSTITUIÇÃO: FACULDADE DE JAGUARIÚNA AUTOR(ES):
TÍTULO: IMUNOMARCAÇÃO DE COX-2 DE MODELO CARCINOGÊNESE MAMARIA POR INDUÇÃO QUÍMICA CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA INSTITUIÇÃO: FACULDADE DE JAGUARIÚNA AUTOR(ES):
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1
 ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 Bruna Da Rosa Santos 2, Maria Andréia Inkelmann 3, Jerusa Zborowski Valvassori 4, Jessica Chiogna Ascoli 5. 1 PROJETO DE PESQUISA REALIZADO NO CURSO DE MEDICINA
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 Bruna Da Rosa Santos 2, Maria Andréia Inkelmann 3, Jerusa Zborowski Valvassori 4, Jessica Chiogna Ascoli 5. 1 PROJETO DE PESQUISA REALIZADO NO CURSO DE MEDICINA
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES¹ 1. Juliana Costa Almeida2, Maria Andreia Inkelmann3, Daniela Andressa Zambom4,
 ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES¹ 1 Juliana Costa Almeida 2, Daniela Andressa Zambom 3, Maria Andreia Inkelmann 4, Jessica Chiogna Ascoli 5. 1 Projeto Institucional desenvolvido no Departamento de
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES¹ 1 Juliana Costa Almeida 2, Daniela Andressa Zambom 3, Maria Andreia Inkelmann 4, Jessica Chiogna Ascoli 5. 1 Projeto Institucional desenvolvido no Departamento de
TÉCNICAS DE ESTUDO EM PATOLOGIA
 TÉCNICAS DE ESTUDO EM PATOLOGIA Augusto Schneider Carlos Castilho de Barros Faculdade de Nutrição Universidade Federal de Pelotas TÉCNICAS Citologia Histologia Imunohistoquímica/imunofluorescência Biologia
TÉCNICAS DE ESTUDO EM PATOLOGIA Augusto Schneider Carlos Castilho de Barros Faculdade de Nutrição Universidade Federal de Pelotas TÉCNICAS Citologia Histologia Imunohistoquímica/imunofluorescência Biologia
AVALIAÇÃO ULTRASSONOGRÁFICA DE NEOPLASIAS MAMÁRIAS EM CADELAS (Ultrasonographic evaluation of mammary gland tumour in dogs)
 1 AVALIAÇÃO ULTRASSONOGRÁFICA DE NEOPLASIAS MAMÁRIAS EM CADELAS (Ultrasonographic evaluation of mammary gland tumour in dogs) Daniela da Silva Pereira CAMPINHO 1 ; Priscilla Bartolomeu ARAÚJO 1, Francine
1 AVALIAÇÃO ULTRASSONOGRÁFICA DE NEOPLASIAS MAMÁRIAS EM CADELAS (Ultrasonographic evaluation of mammary gland tumour in dogs) Daniela da Silva Pereira CAMPINHO 1 ; Priscilla Bartolomeu ARAÚJO 1, Francine
FIBROADENOCARCINOMA, CARCINOSSARCOMA E LIPOMA EM CADELA RELATO DE CASO FIBROADENOCARCINOMA, CARCINOSARCOMA AND LIPOMA IN BITCH - CASE REPORT
 FIBROADENOCARCINOMA, CARCINOSSARCOMA E LIPOMA EM CADELA RELATO DE CASO FIBROADENOCARCINOMA, CARCINOSARCOMA AND LIPOMA IN BITCH - CASE REPORT 1 SARA LETÍCIA DOS SANTOS ANDRADE¹, SUELLEN BARBOSA DA GAMA
FIBROADENOCARCINOMA, CARCINOSSARCOMA E LIPOMA EM CADELA RELATO DE CASO FIBROADENOCARCINOMA, CARCINOSARCOMA AND LIPOMA IN BITCH - CASE REPORT 1 SARA LETÍCIA DOS SANTOS ANDRADE¹, SUELLEN BARBOSA DA GAMA
PROCESSOS PATOLÓGICOS GERAIS. Prof. Archangelo P. Fernandes
 PROCESSOS PATOLÓGICOS GERAIS Prof. Archangelo P. Fernandes www.profbio.com.br Aula 1: Conceitos gerais para o estudo de Patologia. Grego: pathos = sofrimento e logos = estudo Investigação das causas das
PROCESSOS PATOLÓGICOS GERAIS Prof. Archangelo P. Fernandes www.profbio.com.br Aula 1: Conceitos gerais para o estudo de Patologia. Grego: pathos = sofrimento e logos = estudo Investigação das causas das
ESTUDO DOS CRITÉRIOS PARA CLASSIFICAÇÃO HISTOLÓGICA DOS TUMORES MISTOS MAMÁRIOS CANINOS
 Autor(es): ESTUDO DOS CRITÉRIOS PARA CLASSIFICAÇÃO HISTOLÓGICA DOS TUMORES MISTOS MAMÁRIOS CANINOS Apresentador: Orientador: Revisor : Revisor : Instituição: GUIM, Thomas Normanton, GAMBA, Conrado de Oliveira,
Autor(es): ESTUDO DOS CRITÉRIOS PARA CLASSIFICAÇÃO HISTOLÓGICA DOS TUMORES MISTOS MAMÁRIOS CANINOS Apresentador: Orientador: Revisor : Revisor : Instituição: GUIM, Thomas Normanton, GAMBA, Conrado de Oliveira,
Anais do 38º CBA, p.1751
 LEVANTAMENTO RETROSPECTIVO DE NEOPLASIAS MAMÁRIAS EM CADELAS NA CIDADE DE TERESINA-PI RETROSPECTIVE SURVEY OF MAMMARY NEOPLASMS IN BITCHES IN THE CITY OF TERESINA-PI Alinne Rosa de Melo CARVALHO 1 ; Werner
LEVANTAMENTO RETROSPECTIVO DE NEOPLASIAS MAMÁRIAS EM CADELAS NA CIDADE DE TERESINA-PI RETROSPECTIVE SURVEY OF MAMMARY NEOPLASMS IN BITCHES IN THE CITY OF TERESINA-PI Alinne Rosa de Melo CARVALHO 1 ; Werner
CHRISTIANE TEIXEIRA CARTELLE. PROLIFERAÇÃO EPITELIAL GÁSTRICA EM CRIANÇAS INFECTADAS POR Helicobacter pylori
 CHRISTIANE TEIXEIRA CARTELLE PROLIFERAÇÃO EPITELIAL GÁSTRICA EM CRIANÇAS INFECTADAS POR Helicobacter pylori Dissertação apresentada ao Curso de Pós- Graduação em Patologia da Universidade Federal de Minas
CHRISTIANE TEIXEIRA CARTELLE PROLIFERAÇÃO EPITELIAL GÁSTRICA EM CRIANÇAS INFECTADAS POR Helicobacter pylori Dissertação apresentada ao Curso de Pós- Graduação em Patologia da Universidade Federal de Minas
Avaliação do Índice Apoptótico em Adenomas Pleomórficos de Glândulas Salivares
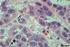 PONTIFÍCIA UNIVERSIDADE CATÓLICA DE MINAS GERAIS Faculdade de Odontologia Avaliação do Índice Apoptótico em Adenomas Pleomórficos de Glândulas Salivares Paulo César de Lacerda Dantas Belo Horizonte- MG
PONTIFÍCIA UNIVERSIDADE CATÓLICA DE MINAS GERAIS Faculdade de Odontologia Avaliação do Índice Apoptótico em Adenomas Pleomórficos de Glândulas Salivares Paulo César de Lacerda Dantas Belo Horizonte- MG
AVALIAÇÃO DE NEOPLASIAS MAMÁRIAS MALIGNAS FELINAS QUANTO AOS ASPECTOS HISTOPATOLÓGICOS E À EXPRESSÃO IMUNO-HISTOQUÍMICA DE Ki-67 E CASPASE 3 CLIVADA
 MILLENA NOGUEIRA SEABRA DA SILVA AVALIAÇÃO DE NEOPLASIAS MAMÁRIAS MALIGNAS FELINAS QUANTO AOS ASPECTOS HISTOPATOLÓGICOS E À EXPRESSÃO IMUNO-HISTOQUÍMICA DE Ki-67 E CASPASE 3 CLIVADA Niterói 2010 MILLENA
MILLENA NOGUEIRA SEABRA DA SILVA AVALIAÇÃO DE NEOPLASIAS MAMÁRIAS MALIGNAS FELINAS QUANTO AOS ASPECTOS HISTOPATOLÓGICOS E À EXPRESSÃO IMUNO-HISTOQUÍMICA DE Ki-67 E CASPASE 3 CLIVADA Niterói 2010 MILLENA
CORRELAÇÃO ENTRE A CITOLOGIA ASPIRATIVA COM AGULHA FINA E HISTOPATOLOGIA: IMPORTÂNCIA PARA O DIAGNÓSTICO DE NEOPLASIAS MAMÁRIAS EM CADELAS 1
 343 CORRELAÇÃO ENTRE A CITOLOGIA ASPIRATIVA COM AGULHA FINA E HISTOPATOLOGIA: IMPORTÂNCIA PARA O DIAGNÓSTICO DE NEOPLASIAS MAMÁRIAS EM CADELAS 1 Thalita Evani Silva de Oliveira 2, João Paulo Machado 3,
343 CORRELAÇÃO ENTRE A CITOLOGIA ASPIRATIVA COM AGULHA FINA E HISTOPATOLOGIA: IMPORTÂNCIA PARA O DIAGNÓSTICO DE NEOPLASIAS MAMÁRIAS EM CADELAS 1 Thalita Evani Silva de Oliveira 2, João Paulo Machado 3,
CRISTINE CIOATO DA SILVA 1 ; CLAUDIA GIORDANI 2 ; THOMAS NORMANTON GUIM 3 ; CRISTINA GEVEHR FERNANDES 4, MARLETE BRUM CLEEF 5 1.
 Estudo retrospectivo dos pacientes portadores de neoplasmas mamários atendidos pelo Serviço de Oncologia Veterinária da Universidade Federal de Pelotas no ano de 2013 CRISTINE CIOATO DA SILVA 1 ; CLAUDIA
Estudo retrospectivo dos pacientes portadores de neoplasmas mamários atendidos pelo Serviço de Oncologia Veterinária da Universidade Federal de Pelotas no ano de 2013 CRISTINE CIOATO DA SILVA 1 ; CLAUDIA
Biologia da célula neoplásica e interacção com o hospedeiro (I)
 Biologia da célula neoplásica e interacção com o hospedeiro (I) Rui Henrique Departamento de Patologia e Imunologia Molecular Instituto de Ciências Biomédicas Abel Salazar Universidade do Porto & Serviço
Biologia da célula neoplásica e interacção com o hospedeiro (I) Rui Henrique Departamento de Patologia e Imunologia Molecular Instituto de Ciências Biomédicas Abel Salazar Universidade do Porto & Serviço
DIAGNÓSTICO DE TUMORES DE MAMA: PARTE II
 DIAGNÓSTICO DE TUMORES DE MAMA: PARTE II EXAME HISTOPATOLÓGICO O exame histopatológico de biópsias incisionais ou excisionais é o método de diagnóstico mais seguro. Além de facilitar a classificação da
DIAGNÓSTICO DE TUMORES DE MAMA: PARTE II EXAME HISTOPATOLÓGICO O exame histopatológico de biópsias incisionais ou excisionais é o método de diagnóstico mais seguro. Além de facilitar a classificação da
Neoplasias. Benignas. Neoplasias. Malignas. Características macroscópicas e microscópicas permitem diferenciação.
 - Neoplasias- Neoplasias Benignas Neoplasias Malignas Características macroscópicas e microscópicas permitem diferenciação. Neoplasias Neoplasias Benignas PONTO DE VISTA CLÍNICO, EVOLUTIVO E DE COMPORTAMENTO
- Neoplasias- Neoplasias Benignas Neoplasias Malignas Características macroscópicas e microscópicas permitem diferenciação. Neoplasias Neoplasias Benignas PONTO DE VISTA CLÍNICO, EVOLUTIVO E DE COMPORTAMENTO
Clínica Universitária de Radiologia. Reunião Bibliográfica. Mafalda Magalhães Director: Prof. Dr. Filipe Caseiro Alves
 + Clínica Universitária de Radiologia Reunião Bibliográfica Director: Prof. Dr. Filipe Caseiro Alves Mafalda Magalhães 14-03-2016 + Introdução RM Mamária: Rastreio de cancro da mama em populações de alto
+ Clínica Universitária de Radiologia Reunião Bibliográfica Director: Prof. Dr. Filipe Caseiro Alves Mafalda Magalhães 14-03-2016 + Introdução RM Mamária: Rastreio de cancro da mama em populações de alto
A Genética do Câncer
 A Genética do Câncer 2 Câncer O câncer é considerado uma doença genética por ser desencadeado por uma série de alterações no DNA da célula Esporádico - alterações de origem somática resultantes da interação
A Genética do Câncer 2 Câncer O câncer é considerado uma doença genética por ser desencadeado por uma série de alterações no DNA da célula Esporádico - alterações de origem somática resultantes da interação
III Tema: Exames de imuno-histoquimica em doenças de mama
 Parecer do Grupo Técnico de Auditoria em Saúde 0005/02 Tema: Imuno-histoquímica para doenças de mama I Data: 26/08/2002. II Grupo de Estudo: Dr.Adolfo Orsi Parenzi Dra. Clemilda Alvarenga Coelho Dra. Lélia
Parecer do Grupo Técnico de Auditoria em Saúde 0005/02 Tema: Imuno-histoquímica para doenças de mama I Data: 26/08/2002. II Grupo de Estudo: Dr.Adolfo Orsi Parenzi Dra. Clemilda Alvarenga Coelho Dra. Lélia
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 STUDY OF MAMMARY NEOPLASMS IN DOGS
 ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 STUDY OF MAMMARY NEOPLASMS IN DOGS Bruna Da Rosa Santos 2, Maria Andréia Inkelmann 3, Simoní Janaína Ziegler 4, Cassiel Gehrke Da Silva 5 1 PROJETO DE PESQUISA REALIZADO
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 STUDY OF MAMMARY NEOPLASMS IN DOGS Bruna Da Rosa Santos 2, Maria Andréia Inkelmann 3, Simoní Janaína Ziegler 4, Cassiel Gehrke Da Silva 5 1 PROJETO DE PESQUISA REALIZADO
Aluna: Bianca Doimo Sousa Orientador: Prof. Dr. Jaques Waisberg. Hospital do Servidor Público Estadual
 Hospital do Servidor Público Estadual Programa de Iniciação Científica em Gastroenterologia Cirúrgica EXPRESSÃO IMUNO-HISTOQUÍMICA DO RECEPTOR DE FATOR DE CRESCIMENTO EPIDÉRMICO (EGFR) NO CARCINOMA COLORRETAL:
Hospital do Servidor Público Estadual Programa de Iniciação Científica em Gastroenterologia Cirúrgica EXPRESSÃO IMUNO-HISTOQUÍMICA DO RECEPTOR DE FATOR DE CRESCIMENTO EPIDÉRMICO (EGFR) NO CARCINOMA COLORRETAL:
J. Health Biol Sci. 2018; 6(1):17-22 doi: / jhbs.v6i p
 J. Health Biol Sci. 2018; 6(1):17-22 doi:10.12662/2317-3076jhbs.v6i1.1420.p17-22.2018 ARTIGO ORIGINAL Caracterização clínica e histopatológica de tumores mamários em cadelas atendidas em Viçosa, MG Clinical
J. Health Biol Sci. 2018; 6(1):17-22 doi:10.12662/2317-3076jhbs.v6i1.1420.p17-22.2018 ARTIGO ORIGINAL Caracterização clínica e histopatológica de tumores mamários em cadelas atendidas em Viçosa, MG Clinical
Mutações em ESR1 e DNA tumoral circulante
 Mutações em ESR1 e DNA tumoral circulante Diagnóstico de resistência ao tratamento endócrino CristianeC. B. A. Nimir cristiane.nimir@idengene.com.br Resistência molecular e heterogeneidade tumoral RESISTÊNCIA
Mutações em ESR1 e DNA tumoral circulante Diagnóstico de resistência ao tratamento endócrino CristianeC. B. A. Nimir cristiane.nimir@idengene.com.br Resistência molecular e heterogeneidade tumoral RESISTÊNCIA
05/01/2016. Letícia Coutinho Lopes 1. Definição Fibroma Ossificante Epidemiologia Oncogênese
 Neoplasias Tópicos da Aula A. Neoplasia B. Carcinogênese C. Tipos de Neoplasia D. Características das Neoplasias E. Invasão e Metástase 2 Definição Fibroma Ossificante Epidemiologia Oncogênese A. Neoplasia
Neoplasias Tópicos da Aula A. Neoplasia B. Carcinogênese C. Tipos de Neoplasia D. Características das Neoplasias E. Invasão e Metástase 2 Definição Fibroma Ossificante Epidemiologia Oncogênese A. Neoplasia
LUIZ CLAUDIO FERREIRA
 COMPARAÇÃO DA SENSIBILIDADE ENTRE AS TÉCNICAS DE HIBRIDIZAÇÃO IN SITU, HISTOPATOLOGIA E IMUNO-HISTOQUÍMICA PARA DIAGNÓSTICO DE LEISHMANIOSE TEGUMENTAR AMERICANA EM AMOSTRAS DE PELE LUIZ CLAUDIO FERREIRA
COMPARAÇÃO DA SENSIBILIDADE ENTRE AS TÉCNICAS DE HIBRIDIZAÇÃO IN SITU, HISTOPATOLOGIA E IMUNO-HISTOQUÍMICA PARA DIAGNÓSTICO DE LEISHMANIOSE TEGUMENTAR AMERICANA EM AMOSTRAS DE PELE LUIZ CLAUDIO FERREIRA
Divisão celular. A única situação em que dividir e multiplicar significam a mesma coisa
 Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
AVALIAÇÃO IMUNOISTOQUÍMICA DA EXPRESSÃO DE COX-2, HSP 27 E HSP 70 EM NEOPLASIAS MAMÁRIAS DE CADELAS 1
 263 AVALIAÇÃO IMUNOISTOQUÍMICA DA EXPRESSÃO DE COX-2, HSP 27 E HSP 70 EM NEOPLASIAS MAMÁRIAS DE CADELAS 1 Thalita Evani Silva de Oliveira 2, João Paulo Machado 3, Marlene Isabel Vargas Vilória 4, Alessandra
263 AVALIAÇÃO IMUNOISTOQUÍMICA DA EXPRESSÃO DE COX-2, HSP 27 E HSP 70 EM NEOPLASIAS MAMÁRIAS DE CADELAS 1 Thalita Evani Silva de Oliveira 2, João Paulo Machado 3, Marlene Isabel Vargas Vilória 4, Alessandra
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 STUDY OF MAMMARY NEOPLASMS IN DOGS
 ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 STUDY OF MAMMARY NEOPLASMS IN DOGS Beatriz Zanfra Sereno 2, Simoní Janaína Ziegler 3, André Lucca Pizutti 4, Ramão Felipe De Marques Alves 5, Maria Andréia Inkelmann
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 STUDY OF MAMMARY NEOPLASMS IN DOGS Beatriz Zanfra Sereno 2, Simoní Janaína Ziegler 3, André Lucca Pizutti 4, Ramão Felipe De Marques Alves 5, Maria Andréia Inkelmann
QUESTÕES PROVA DISCURSIVA TEMA 2018
 QUESTÕES PROVA DISCURSIVA TEMA 2018 1) Paciente de 40 anos submetida à adenomastectomia bilateral com reconstrução imediata. Três semanas após procedimento queixa-se de dor abaixo da mama esquerda. Baseado
QUESTÕES PROVA DISCURSIVA TEMA 2018 1) Paciente de 40 anos submetida à adenomastectomia bilateral com reconstrução imediata. Três semanas após procedimento queixa-se de dor abaixo da mama esquerda. Baseado
Avaliação da caspase-3 e Ki-67 como marcadores prognósticos nas neoplasias mamárias em cadelas
 96 Avaliação da caspase-3 e Ki-67 como marcadores prognósticos nas neoplasias mamárias em cadelas Ana Carolina Bernardes TERZIAN 1 Debora Aparecida Pires de Campos ZUCCARI 2 Rodrigo Storti PEREIRA 2 Marcília
96 Avaliação da caspase-3 e Ki-67 como marcadores prognósticos nas neoplasias mamárias em cadelas Ana Carolina Bernardes TERZIAN 1 Debora Aparecida Pires de Campos ZUCCARI 2 Rodrigo Storti PEREIRA 2 Marcília
Agentes físicos, químicos e biológicos podem induzir agressão ao. genoma e ocasionar alterações fenotípicas configurando uma
 .Carcinogênese: Agentes físicos, químicos e biológicos podem induzir agressão ao genoma e ocasionar alterações fenotípicas configurando uma neoplasia. O processo pelo qual se desenvolvem as neoplasias
.Carcinogênese: Agentes físicos, químicos e biológicos podem induzir agressão ao genoma e ocasionar alterações fenotípicas configurando uma neoplasia. O processo pelo qual se desenvolvem as neoplasias
PERFIL EPIDEMIOLÓGICO DE PACIENTES COM NEOPLASIA DE MAMA EM TRATAMENTO COM TRANSTUZUMABE EM HOSPITAL NO INTERIOR DE ALAGOAS
 PERFIL EPIDEMIOLÓGICO DE PACIENTES COM NEOPLASIA DE MAMA EM TRATAMENTO COM TRANSTUZUMABE EM HOSPITAL NO INTERIOR DE ALAGOAS Andreia Herculano da Silva Casa de Saúde e Maternidade Afra Barbosa Andreiah.silva@hotmail.com
PERFIL EPIDEMIOLÓGICO DE PACIENTES COM NEOPLASIA DE MAMA EM TRATAMENTO COM TRANSTUZUMABE EM HOSPITAL NO INTERIOR DE ALAGOAS Andreia Herculano da Silva Casa de Saúde e Maternidade Afra Barbosa Andreiah.silva@hotmail.com
FREQUÊNCIA DE NEOPLASIA EM CÃES NA CIDADE DO RECIFE NO ANO DE 2008.
 FREQUÊNCIA DE NEOPLASIA EM CÃES NA CIDADE DO RECIFE NO ANO DE 2008. Laila Carina Soares dos Santos¹, Rebeca Marques S. Leitão², Cristiane Maia da Silva³, Acácio Teófilo da Silva Filho 4, Renata Ferreira
FREQUÊNCIA DE NEOPLASIA EM CÃES NA CIDADE DO RECIFE NO ANO DE 2008. Laila Carina Soares dos Santos¹, Rebeca Marques S. Leitão², Cristiane Maia da Silva³, Acácio Teófilo da Silva Filho 4, Renata Ferreira
ENFERMAGEM ATENÇÃO BÁSICA E SAÚDE DA FAMÍLIA. Parte 14. Profª. Lívia Bahia
 ENFERMAGEM ATENÇÃO BÁSICA E SAÚDE DA FAMÍLIA Parte 14 Profª. Lívia Bahia Controle do câncer do colo do útero e de mama na Atenção Básica Controle do câncer da mama O câncer de mama é o mais incidente em
ENFERMAGEM ATENÇÃO BÁSICA E SAÚDE DA FAMÍLIA Parte 14 Profª. Lívia Bahia Controle do câncer do colo do útero e de mama na Atenção Básica Controle do câncer da mama O câncer de mama é o mais incidente em
REVISTA CIENTÍFICA ELETRÔNICA DE MEDICINA VETERINÁRIA ISSN: Ano IX Número 18 Janeiro de 2012 Periódicos Semestral
 ESTUDO RETROSPECTIVO DA APLICAÇÃO DO DIAGNÓSTICO CITOPATOLÓGICO E AVALIAÇÃO DA SOBREVIDA DAS NEOPLASIAS MAMÁRIAS DE CADELAS ATENDIDAS HOSPITAL VETERINÁRIO DA UNIVERSIDADE ESTADUAL DO NORTE DO PARANÁ UENP-CLM
ESTUDO RETROSPECTIVO DA APLICAÇÃO DO DIAGNÓSTICO CITOPATOLÓGICO E AVALIAÇÃO DA SOBREVIDA DAS NEOPLASIAS MAMÁRIAS DE CADELAS ATENDIDAS HOSPITAL VETERINÁRIO DA UNIVERSIDADE ESTADUAL DO NORTE DO PARANÁ UENP-CLM
CÂNCER DE BOCA E OROFARINGE
 CÂNCER DE BOCA E OROFARINGE EQUIPE MULTIDISCIPLINAR LOCAIS MAIS FREQUÊNTES DAS LESÕES PRECOCES Mashberg e Meyer LESÕES PRE- CANCEROSAS CAMPO DE CANCERIZAÇÃO FOCOS MÚLTIPLOS MAIOR PROBABILIDADE DE ALTERAÇÕES
CÂNCER DE BOCA E OROFARINGE EQUIPE MULTIDISCIPLINAR LOCAIS MAIS FREQUÊNTES DAS LESÕES PRECOCES Mashberg e Meyer LESÕES PRE- CANCEROSAS CAMPO DE CANCERIZAÇÃO FOCOS MÚLTIPLOS MAIOR PROBABILIDADE DE ALTERAÇÕES
ONCOGÊNESE. SÁBADO 14/03/ :00 h CARCINOGÊNESE
 ONCOGÊNESE SÁBADO 14/03/2015 08:00 h CARCINOGÊNESE A oncogênese ou carcinogênese é um fenômeno complexo, multifásico e dependente de fenômenos genético e epigenéticos que levam ao surgimento de células
ONCOGÊNESE SÁBADO 14/03/2015 08:00 h CARCINOGÊNESE A oncogênese ou carcinogênese é um fenômeno complexo, multifásico e dependente de fenômenos genético e epigenéticos que levam ao surgimento de células
DIAGNÓSTICO CLÍNICO E HISTOPATOLÓGICO DE NEOPLASMAS CUTÂNEOS EM CÃES E GATOS ATENDIDOS NA ROTINA CLÍNICA DO HOSPITAL VETERINÁRIO DA UNIVIÇOSA 1
 361 DIAGNÓSTICO CLÍNICO E HISTOPATOLÓGICO DE NEOPLASMAS CUTÂNEOS EM CÃES E GATOS ATENDIDOS NA ROTINA CLÍNICA DO HOSPITAL VETERINÁRIO DA UNIVIÇOSA 1 Márcia Suelen Bento 2, Marcelo Oliveira Chamelete 3,
361 DIAGNÓSTICO CLÍNICO E HISTOPATOLÓGICO DE NEOPLASMAS CUTÂNEOS EM CÃES E GATOS ATENDIDOS NA ROTINA CLÍNICA DO HOSPITAL VETERINÁRIO DA UNIVIÇOSA 1 Márcia Suelen Bento 2, Marcelo Oliveira Chamelete 3,
BIOLOGIA. Moléculas, células e tecidos. Ciclo celular. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Professor: Alex Santos Tópicos em abordagem I Conceitos fundamentais II Estágios do ciclo celular III Visão geral da regulação do ciclo celular IV Importância do ciclo
BIOLOGIA Moléculas, células e tecidos Professor: Alex Santos Tópicos em abordagem I Conceitos fundamentais II Estágios do ciclo celular III Visão geral da regulação do ciclo celular IV Importância do ciclo
PROLIFERAÇÃO E APOPTOSE CELULAR NO ENDOMÉTRIO DA CADELA T E S E D E M E S T R A D O I N T E G R A D O E M M E D I C I N A V E T E R I N Á R I A
 PROLIFERAÇÃO E APOPTOSE CELULAR NO ENDOMÉTRIO DA CADELA T E S E D E M E S T R A D O I N T E G R A D O E M M E D I C I N A V E T E R I N Á R I A Sílvia Cruz 10 N O V E M B R O 2011 Ciclo éstrico INTRODUÇÃO
PROLIFERAÇÃO E APOPTOSE CELULAR NO ENDOMÉTRIO DA CADELA T E S E D E M E S T R A D O I N T E G R A D O E M M E D I C I N A V E T E R I N Á R I A Sílvia Cruz 10 N O V E M B R O 2011 Ciclo éstrico INTRODUÇÃO
O CONTROLE DO CICLO CELULAR / PROLIFERAÇÃO EM CÂNCER: CONCEITOS E POTENCIAIS APLICAÇÕES TERAPÊUTICAS
 Universidade Federal do Rio Grande do Sul Laboratório de Sinalização e Plasticidade Celular O CONTROLE DO CICLO CELULAR / PROLIFERAÇÃO EM CÂNCER: CONCEITOS E POTENCIAIS APLICAÇÕES TERAPÊUTICAS Msc. Eduardo
Universidade Federal do Rio Grande do Sul Laboratório de Sinalização e Plasticidade Celular O CONTROLE DO CICLO CELULAR / PROLIFERAÇÃO EM CÂNCER: CONCEITOS E POTENCIAIS APLICAÇÕES TERAPÊUTICAS Msc. Eduardo
ONCOLOGIA. Aula I Profª.Enfª: Darlene Carvalho (www.darlenecarvalho.webnode.com.br)
 ONCOLOGIA Aula I Profª.Enfª: Darlene Carvalho (www.darlenecarvalho.webnode.com.br) CLASSIFICAÇÃO DAS CÉLULAS Lábeis Estáveis Perenes CLASSIFICAÇÃO DAS CÉLULAS Células lábeis: São aquelas em constante renovação
ONCOLOGIA Aula I Profª.Enfª: Darlene Carvalho (www.darlenecarvalho.webnode.com.br) CLASSIFICAÇÃO DAS CÉLULAS Lábeis Estáveis Perenes CLASSIFICAÇÃO DAS CÉLULAS Células lábeis: São aquelas em constante renovação
NEOPLASIA MAMÁRIA CANINA: EVIDENCIAS CLÍNICO - EPIDEMIOLÓGICAS CANINE MAMARIA NEOPLASIA: CLINICAL - EPIDEMIOLOGICAL EVIDENCES
 NEOPLASIA MAMÁRIA CANINA: EVIDENCIAS CLÍNICO - EPIDEMIOLÓGICAS CANINE MAMARIA NEOPLASIA: CLINICAL - EPIDEMIOLOGICAL EVIDENCES Camila Silva de MORAIS 1 ; Rachel Melo RIBEIRO 2, Ferdinan Almeida MELO 3,
NEOPLASIA MAMÁRIA CANINA: EVIDENCIAS CLÍNICO - EPIDEMIOLÓGICAS CANINE MAMARIA NEOPLASIA: CLINICAL - EPIDEMIOLOGICAL EVIDENCES Camila Silva de MORAIS 1 ; Rachel Melo RIBEIRO 2, Ferdinan Almeida MELO 3,
CARCINOMA SÓLIDO MAMÁRIO EM CADELA COM METÁSTASE CUTÂNEA TRADADA COM CARBOPLATINA
 1 CARCINOMA SÓLIDO MAMÁRIO EM CADELA COM METÁSTASE CUTÂNEA TRADADA COM CARBOPLATINA Jessica MAGNANI¹; Gilmar Santos COSTA¹; Marília Carneiro de Araújo MACHADO²; Laís Pereira SILVA 3 ; Mário Jorge Melhor
1 CARCINOMA SÓLIDO MAMÁRIO EM CADELA COM METÁSTASE CUTÂNEA TRADADA COM CARBOPLATINA Jessica MAGNANI¹; Gilmar Santos COSTA¹; Marília Carneiro de Araújo MACHADO²; Laís Pereira SILVA 3 ; Mário Jorge Melhor
AVALIAÇÃO DA IMUNOEXPRESSÃO DE PROTEÍNAS DA VIA DE SINALIZAÇÃO WNT CANÔNICA E NÃO CANÔNICA NO ADENOCARCINOMA GÁSTRICO
 AVALIAÇÃO DA IMUNOEXPRESSÃO DE PROTEÍNAS DA VIA DE SINALIZAÇÃO WNT CANÔNICA E NÃO CANÔNICA NO ADENOCARCINOMA GÁSTRICO PROGRAMA DE INICIAÇÃO CIENTÍFICA PIBIC DO IAMSPE ACADÊMICO: PEDRO AUGUSTO SOFFNER CARDOSO
AVALIAÇÃO DA IMUNOEXPRESSÃO DE PROTEÍNAS DA VIA DE SINALIZAÇÃO WNT CANÔNICA E NÃO CANÔNICA NO ADENOCARCINOMA GÁSTRICO PROGRAMA DE INICIAÇÃO CIENTÍFICA PIBIC DO IAMSPE ACADÊMICO: PEDRO AUGUSTO SOFFNER CARDOSO
Patologia da mama. [Business Plan]
![Patologia da mama. [Business Plan] Patologia da mama. [Business Plan]](/thumbs/78/76999130.jpg) Patologia da mama [Business Plan] Maria João Martins Março 2014 Estudo macroscópico Tipos de abordagem diagnóstica/terapêutica Biópsias por agulha Por tumor Por microcalcificações Ressecção de galactóforos
Patologia da mama [Business Plan] Maria João Martins Março 2014 Estudo macroscópico Tipos de abordagem diagnóstica/terapêutica Biópsias por agulha Por tumor Por microcalcificações Ressecção de galactóforos
Terapia conservadora da mama em casos multifocais/multicêntricos
 Caso Clínico Terapia conservadora da mama em casos multifocais/multicêntricos Realização: Escola Brasileira de Mastologia Antônio Frasson, Francisco Pimentel e Ruffo de Freitas Autor do Caso Márden Pinheiro
Caso Clínico Terapia conservadora da mama em casos multifocais/multicêntricos Realização: Escola Brasileira de Mastologia Antônio Frasson, Francisco Pimentel e Ruffo de Freitas Autor do Caso Márden Pinheiro
Relatório Final de Estágio Mestrado Integrado em Medicina Veterinária
 Relatório Final de Estágio Mestrado Integrado em Medicina Veterinária VIDA E MORTE NOS CARCINOMAS MAMÁRIOS CANINOS: ESTUDO IMUNOHISTOQUÍMICO DA ATIVIDADE PROLIFERATIVA E APOPTOSE Ariana Sousa Martins Orientador(es)
Relatório Final de Estágio Mestrado Integrado em Medicina Veterinária VIDA E MORTE NOS CARCINOMAS MAMÁRIOS CANINOS: ESTUDO IMUNOHISTOQUÍMICO DA ATIVIDADE PROLIFERATIVA E APOPTOSE Ariana Sousa Martins Orientador(es)
Oncologia. Caderno de Questões Prova Discursiva
 Caderno de Questões Prova Discursiva 2015 01 Mulher de 54 anos de idade, pré-menopausa, apresenta mamografia com lesão sólida de 1,3 cm no quadrante superior externo de mama esquerda e calcificações difusas
Caderno de Questões Prova Discursiva 2015 01 Mulher de 54 anos de idade, pré-menopausa, apresenta mamografia com lesão sólida de 1,3 cm no quadrante superior externo de mama esquerda e calcificações difusas
UFF Instituto de Biologia Departamento de Imunobiologia GIM
 UFF Instituto de Biologia Departamento de Imunobiologia GIM 1- PROJETOS EXTENSÃO COORDENADOR RESUMO PERFIL DO ALUNO Produção, aplicação e divulgação de material educativo. Claudia Marcia Borges Barreto
UFF Instituto de Biologia Departamento de Imunobiologia GIM 1- PROJETOS EXTENSÃO COORDENADOR RESUMO PERFIL DO ALUNO Produção, aplicação e divulgação de material educativo. Claudia Marcia Borges Barreto
Aspectos gerais da estrutura celular
 Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
WALTER ARTHUR SILVA VALENTE
 WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA DA EXPRESSÃO DE Ki-67, Bcl-2, EGF e CD57 NO ESPECTRO EVOLUTIVO DE GRANULOMAS E CISTOS PERIRRADICULARES 2016 i WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA
WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA DA EXPRESSÃO DE Ki-67, Bcl-2, EGF e CD57 NO ESPECTRO EVOLUTIVO DE GRANULOMAS E CISTOS PERIRRADICULARES 2016 i WALTER ARTHUR SILVA VALENTE ANÁLISE IMUNOISTOQUÍMICA
COMER OU NÃO COMER? EIS A QUESTÃO! O PAPEL DA AUTOFAGIA A BIOLOGIA TUMORAL
 Universidade Federal do Rio Grande do Sul Laboratório de Sinalização e Plasticidade Celular COMER OU NÃO COMER? EIS A QUESTÃO! O PAPEL DA AUTOFAGIA A BIOLOGIA TUMORAL Msc. Eduardo Cremonese Filippi Chiela
Universidade Federal do Rio Grande do Sul Laboratório de Sinalização e Plasticidade Celular COMER OU NÃO COMER? EIS A QUESTÃO! O PAPEL DA AUTOFAGIA A BIOLOGIA TUMORAL Msc. Eduardo Cremonese Filippi Chiela
AU01. Aspectos Genéticos da Mitose e Meiose. Emanuele Cristina Pesenti. Doutoranda PPG-GEN
 AU01 Aspectos Genéticos da Mitose e Meiose Emanuele Cristina Pesenti Doutoranda PPG-GEN emanuelepesenti@gmail.com Resumo Cromossomos Eucarióticos: Intrudução acerca da estrutura e organização dos cromossomos
AU01 Aspectos Genéticos da Mitose e Meiose Emanuele Cristina Pesenti Doutoranda PPG-GEN emanuelepesenti@gmail.com Resumo Cromossomos Eucarióticos: Intrudução acerca da estrutura e organização dos cromossomos
Ciclo celular. Patricia Coltri
 Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que estimulam/inibem o ciclo celular Métodos para estudo do ciclo Ciclo celular Células se reproduzem com a duplicação
Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que estimulam/inibem o ciclo celular Métodos para estudo do ciclo Ciclo celular Células se reproduzem com a duplicação
Iniciação e progressão neoplásica
 Biopatologia Iniciação e progressão neoplásica Diana Santos Ana Isabel Teixeira Doenças degenerativas -Nos indivíduos novos - a etiologia é hereditária: são sobretudo doenças catabólicas que ocorrem em
Biopatologia Iniciação e progressão neoplásica Diana Santos Ana Isabel Teixeira Doenças degenerativas -Nos indivíduos novos - a etiologia é hereditária: são sobretudo doenças catabólicas que ocorrem em
Serviço de Patologia. Hospital Universitário ufjf Serviço de Anatomia Patológica e Citopatologia Prof. Paulo Torres
 Serviço de Patologia Hospital Universitário ufjf Serviço de Anatomia Patológica e Citopatologia Prof. Paulo Torres Sônia Maria Neumann Cupolilo Doutora em Patologia FIOCRUZ/RJ Professora Titular Chefe
Serviço de Patologia Hospital Universitário ufjf Serviço de Anatomia Patológica e Citopatologia Prof. Paulo Torres Sônia Maria Neumann Cupolilo Doutora em Patologia FIOCRUZ/RJ Professora Titular Chefe
Artigo Original TUMORES DO PALATO DURO: ANÁLISE DE 130 CASOS HARD PALATE TUMORS: ANALISYS OF 130 CASES ANTONIO AZOUBEL ANTUNES 2
 Artigo Original TUMORES DO PALATO DURO: ANÁLISE DE 130 CASOS HARD PALATE TUMORS: ANALISYS OF 130 CASES 1 ANTONIO AZOUBEL ANTUNES 2 ANTONIO PESSOA ANTUNES 3 POLLIANA VILAÇA SILVA RESUMO Introdução: O câncer
Artigo Original TUMORES DO PALATO DURO: ANÁLISE DE 130 CASOS HARD PALATE TUMORS: ANALISYS OF 130 CASES 1 ANTONIO AZOUBEL ANTUNES 2 ANTONIO PESSOA ANTUNES 3 POLLIANA VILAÇA SILVA RESUMO Introdução: O câncer
AULA 1: Introdução à Quimioterapia Antineoplásica
 FARMACOLOGIA DOS QUIMIOTERÁPICOS AULA 1: Introdução à Quimioterapia Antineoplásica Profª. MsC Daniele Cavalheiro Oliveira Zampar Farmacêutica Especialista em Oncologia - Sobrafo Campo Grande, 29/09/2012
FARMACOLOGIA DOS QUIMIOTERÁPICOS AULA 1: Introdução à Quimioterapia Antineoplásica Profª. MsC Daniele Cavalheiro Oliveira Zampar Farmacêutica Especialista em Oncologia - Sobrafo Campo Grande, 29/09/2012
ESPECIALIZAÇÃO OU DIFERENCIAÇÃO CELULAR. Moisés Araújo
 ESPECIALIZAÇÃO OU DIFERENCIAÇÃO CELULAR O QUE É ESPECIALIZAÇÃO CELULAR? CONJUNTO DAS MODIFICAÇÕES QUIMICAS, FÍSICAS OU ESTRUTURAIS E FUNCIONAIS DAS CÉLULAS EMBRIONÁRIAS, INICIALMENTE SIMPLES E INDIFERENCIADAS,
ESPECIALIZAÇÃO OU DIFERENCIAÇÃO CELULAR O QUE É ESPECIALIZAÇÃO CELULAR? CONJUNTO DAS MODIFICAÇÕES QUIMICAS, FÍSICAS OU ESTRUTURAIS E FUNCIONAIS DAS CÉLULAS EMBRIONÁRIAS, INICIALMENTE SIMPLES E INDIFERENCIADAS,
ANEXO A CICLO CELULAR DIVISÃO CELULAR
 ANEXO A CICLO CELULAR DIVISÃO CELULAR CICLO CELULAR DIVISÃO CELULAR 1 CICLO CELULAR: processo em que o material celular é duplicado. 2 PERÍODOS: interfase (G 1, S, G 2 ), divisão celular mitose (prófase,
ANEXO A CICLO CELULAR DIVISÃO CELULAR CICLO CELULAR DIVISÃO CELULAR 1 CICLO CELULAR: processo em que o material celular é duplicado. 2 PERÍODOS: interfase (G 1, S, G 2 ), divisão celular mitose (prófase,
ESTUDO RETROSPECTIVO DE NEOPLASMAS FELINOS DIAGNOSTICADOS DURANTE O PERÍODO DE 1980 A INTRODUÇÃO
 ESTUDO RETROSPECTIVO DE NEOPLASMAS FELINOS DIAGNOSTICADOS DURANTE O PERÍODO DE 1980 A 2006. GUIM, Thomas Normanton 1 ; XAVIER 1, Fernanda da Silva; SPADER 1, Melissa Borba; SECCHI 2, Priscila; GUIM 2,
ESTUDO RETROSPECTIVO DE NEOPLASMAS FELINOS DIAGNOSTICADOS DURANTE O PERÍODO DE 1980 A 2006. GUIM, Thomas Normanton 1 ; XAVIER 1, Fernanda da Silva; SPADER 1, Melissa Borba; SECCHI 2, Priscila; GUIM 2,
PROJETO DE PESQUISA ASPECTOS ANÁTOMO-PATOLÓGICOS DE DOENÇAS DO SISTEMA NERVOSO E TUMORES MÚSCULO-ESQUELÉTICOS
 PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA Centro de Ciências da Saúde - UFPE Av. Prof. Moraes Rego 1235 - Cidade Universitária - CEP: 50670-901 - Recife PE Prédio da Pós-graduação do Centro de Ciências da
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA Centro de Ciências da Saúde - UFPE Av. Prof. Moraes Rego 1235 - Cidade Universitária - CEP: 50670-901 - Recife PE Prédio da Pós-graduação do Centro de Ciências da
REVIEW ARTICLE - PERFIL IMUNOFENOTÍPICO, COM FATOR PROGNOSTICO NO CANCER DE MAMA
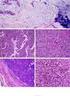 REVIEW ARTICLE REVIEW ARTICLE - PERFIL IMUNOFENOTÍPICO, COM FATOR PROGNOSTICO NO CANCER DE MAMA Marcella de Oliveira Santiago ¹ e Virgílio R. Guedes² Maria Cristina da S. Pranchevicius 3 1. Graduando em
REVIEW ARTICLE REVIEW ARTICLE - PERFIL IMUNOFENOTÍPICO, COM FATOR PROGNOSTICO NO CANCER DE MAMA Marcella de Oliveira Santiago ¹ e Virgílio R. Guedes² Maria Cristina da S. Pranchevicius 3 1. Graduando em
Técnicas de Imuno-Citoquímica e Imuno-Histoquímica
 Técnicas de Imuno-Citoquímica e Imuno-Histoquímica Doutorando: Romeu Moreira dos Santos Prof. Hélio José Montassier Disciplina: Imunologia Veterinária Linfócitos T Seleção e maturação de células T TCR
Técnicas de Imuno-Citoquímica e Imuno-Histoquímica Doutorando: Romeu Moreira dos Santos Prof. Hélio José Montassier Disciplina: Imunologia Veterinária Linfócitos T Seleção e maturação de células T TCR
Ciclo celular. Patricia Coltri
 Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que interferem no ciclo Métodos de estudo Ciclo celular e proliferação Eventos sequenciais coordenados: geração
Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que interferem no ciclo Métodos de estudo Ciclo celular e proliferação Eventos sequenciais coordenados: geração
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg)
 HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
Ciclo Celular e Divisão Celular (Mitose e Meiose)
 Ciclo Celular e Divisão Celular (Mitose e Meiose) CICLO CELULAR Eventos que preparam e realizam a divisão celular Mecanismos responsáveis pelo crescimento e desenvolvimento Células somáticas célula duplica
Ciclo Celular e Divisão Celular (Mitose e Meiose) CICLO CELULAR Eventos que preparam e realizam a divisão celular Mecanismos responsáveis pelo crescimento e desenvolvimento Células somáticas célula duplica
Apoptose. Prof. Tiago Collares, Dr. (MSN) ( )
 Apoptose Prof. Tiago Collares, Dr. tiago_collares@hotmail.com (MSN) collares.t@gmail.com (e-mail ) $99.50 $82.74 $31.86 Necessidades de Morte Celular em Organismos Multicelulares - Característica latente;
Apoptose Prof. Tiago Collares, Dr. tiago_collares@hotmail.com (MSN) collares.t@gmail.com (e-mail ) $99.50 $82.74 $31.86 Necessidades de Morte Celular em Organismos Multicelulares - Característica latente;
BIOTECNOLOGIA. Fermentações industrias. Cultura de tecidos e Células. Produção. fármacos. Clonagem. Melhoramento Genético. Produção de.
 RIBAMAR JR Qualquer aplicação tecnológica que utilize sistemas biológicos (organismos, células, vírus, moléculas), para fabricar ou modificar produtos para utilização específica. Produção de fármacos Fermentações
RIBAMAR JR Qualquer aplicação tecnológica que utilize sistemas biológicos (organismos, células, vírus, moléculas), para fabricar ou modificar produtos para utilização específica. Produção de fármacos Fermentações
TESTE DE AVALIAÇÃO. 02 novembro 2013 Duração: 30 minutos. Organização NOME: Escolha, por favor, a resposta que considera correta.
 TESTE DE AVALIAÇÃO 02 novembro 2013 Duração: 30 minutos NOME: Escolha, por favor, a resposta que considera correta. 1. São indicação para a realização de RM todas as situações, excepto: ( 1 ) Mulher com
TESTE DE AVALIAÇÃO 02 novembro 2013 Duração: 30 minutos NOME: Escolha, por favor, a resposta que considera correta. 1. São indicação para a realização de RM todas as situações, excepto: ( 1 ) Mulher com
Tratamentos do Câncer. Prof. Enf.º Diógenes Trevizan
 Tratamentos do Câncer Prof. Enf.º Diógenes Trevizan As opções de tratamento oferecidas para os pacientes com câncer devem basear-se em metas realistas e alcançáveis para cada tipo de câncer específico.
Tratamentos do Câncer Prof. Enf.º Diógenes Trevizan As opções de tratamento oferecidas para os pacientes com câncer devem basear-se em metas realistas e alcançáveis para cada tipo de câncer específico.
Caso do mês Abril/2016 -A. Shenia Lauanna O. Rezende Bringel Médica residente (R3) Departamento de Anatomia Patológica
 Caso do mês Abril/2016 -A Shenia Lauanna O. Rezende Bringel Médica residente (R3) Departamento de Anatomia Patológica História clínica Masculino, 64 anos, ex-tabagista, HIV-positivo e diabético insulino-dependente,
Caso do mês Abril/2016 -A Shenia Lauanna O. Rezende Bringel Médica residente (R3) Departamento de Anatomia Patológica História clínica Masculino, 64 anos, ex-tabagista, HIV-positivo e diabético insulino-dependente,
Mutagênese... a prevenção é o espelho do índice cultural de uma nação.
 Pontifícia Universidade Católica de Goiás Pró-Reitoria de Graduação Departamento de Biologia Mutagênese Raimundo Jr, M.Sc. Genética / BIO1240 2013/1 Considerações Gerais Objetivando uma melhor qualidade
Pontifícia Universidade Católica de Goiás Pró-Reitoria de Graduação Departamento de Biologia Mutagênese Raimundo Jr, M.Sc. Genética / BIO1240 2013/1 Considerações Gerais Objetivando uma melhor qualidade
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1
 ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 Juliana Costa Almeida 2, Maria Andréia Inkelmann 3, Daniela Andressa Zambom 4, Marina Batista 5, Tiéle Seifert Oldenburg 6. 1 Projeto Institucional desenvolvido
ESTUDO DE NEOPLASMAS MAMÁRIOS EM CÃES 1 Juliana Costa Almeida 2, Maria Andréia Inkelmann 3, Daniela Andressa Zambom 4, Marina Batista 5, Tiéle Seifert Oldenburg 6. 1 Projeto Institucional desenvolvido
Tumores renais. 17/08/ Dra. Marcela Noronha.
 Tumores renais 17/08/2017 - Dra. Marcela Noronha As neoplasias do trato urinário em crianças quase sempre são malignas e localizam-se, em sua maioria, no rim. Os tumores de bexiga e uretra são bastante
Tumores renais 17/08/2017 - Dra. Marcela Noronha As neoplasias do trato urinário em crianças quase sempre são malignas e localizam-se, em sua maioria, no rim. Os tumores de bexiga e uretra são bastante
Embora, pela sua finalidade académica, uma dissertação seja um trabalho. individual há contributos que não podem deixar de ser realçados.
 Agradecimentos vi Embora, pela sua finalidade académica, uma dissertação seja um trabalho individual há contributos que não podem deixar de ser realçados. Por essa razão desejo expressar os meus sinceros
Agradecimentos vi Embora, pela sua finalidade académica, uma dissertação seja um trabalho individual há contributos que não podem deixar de ser realçados. Por essa razão desejo expressar os meus sinceros
MELANOCITOMA DE CORÓIDE EM CÃO - RELATO DE CASO
 1 MELANOCITOMA DE CORÓIDE EM CÃO - RELATO DE CASO Thaís de Almeida MOREIRA 1 *, Talita Lopes SERRA 2, Leandro William BORGES 3, Álisson Souza COSTA 4, Frederico Faria MELO JÚNIOR 5, Márcio de Barros BANDARRA
1 MELANOCITOMA DE CORÓIDE EM CÃO - RELATO DE CASO Thaís de Almeida MOREIRA 1 *, Talita Lopes SERRA 2, Leandro William BORGES 3, Álisson Souza COSTA 4, Frederico Faria MELO JÚNIOR 5, Márcio de Barros BANDARRA
MASTECTOMIA COMO TRATAMENTO DAS NEOPLASIAS MAMÁRIAS DE CADELAS: FREQUÊNCIA E CORRELAÇÃO COM O TIPO HISTOLOGICO
 MASTECTOMIA COMO TRATAMENTO DAS NEOPLASIAS MAMÁRIAS DE CADELAS: FREQUÊNCIA E CORRELAÇÃO COM O TIPO HISTOLOGICO Bruna Couto de SOUZA 1 ; Alessandra Aparecida MEDEIROS-RONCHI 2 e Ednaldo Carvalho GUIMARÃES
MASTECTOMIA COMO TRATAMENTO DAS NEOPLASIAS MAMÁRIAS DE CADELAS: FREQUÊNCIA E CORRELAÇÃO COM O TIPO HISTOLOGICO Bruna Couto de SOUZA 1 ; Alessandra Aparecida MEDEIROS-RONCHI 2 e Ednaldo Carvalho GUIMARÃES
Glomerulonefrite Membranosa Idiopática: um estudo de caso
 Glomerulonefrite Membranosa Idiopática: um estudo de caso Cláudia Maria Teixeira de Carvalho Dissertação de Mestrado Integrado em Medicina Faculdade de Ciências da Saúde Universidade da Beira Interior
Glomerulonefrite Membranosa Idiopática: um estudo de caso Cláudia Maria Teixeira de Carvalho Dissertação de Mestrado Integrado em Medicina Faculdade de Ciências da Saúde Universidade da Beira Interior
CARCINOMA PULMONAR MESTASTÁTICO RESPONSIVO À QUIMIOTERAPIA ANTINEOPLÁSICA EM CADELA: RELATO DO CASO
 CARCINOMA PULMONAR MESTASTÁTICO RESPONSIVO À QUIMIOTERAPIA ANTINEOPLÁSICA EM CADELA: RELATO DO CASO METASTATIC LUNG CARCINOMA RESPONSIVE TO ANTINEOPLASTIC CHEMOTERAPY IN BITCH: CASE REPORT Adna Carolinne
CARCINOMA PULMONAR MESTASTÁTICO RESPONSIVO À QUIMIOTERAPIA ANTINEOPLÁSICA EM CADELA: RELATO DO CASO METASTATIC LUNG CARCINOMA RESPONSIVE TO ANTINEOPLASTIC CHEMOTERAPY IN BITCH: CASE REPORT Adna Carolinne
Ciclo Celular e Controle do Ciclo Celular
 Ciclo Celular e Controle do Ciclo Celular Profa. Dra. Maria Tercília Vilela de Azeredo Oliveira Profa. Dra. Ester Tartarotti MSc. Rita Luiza Peruquetti Divisão Celular Deve ser regulada e Coordenada Ciclo
Ciclo Celular e Controle do Ciclo Celular Profa. Dra. Maria Tercília Vilela de Azeredo Oliveira Profa. Dra. Ester Tartarotti MSc. Rita Luiza Peruquetti Divisão Celular Deve ser regulada e Coordenada Ciclo
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA
 BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2013 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2013 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
Discussão de Caso Clínico Nathalia Rossato
 Discussão de Caso Clínico Nathalia Rossato Gramado, 31 de agosto de 2018 Câncer de mama Inicial em paciente jovem Câncer de mama Inicial em paciente jovem IDENTIFICAÇÃO 02/09/2015 I.G.K., 33 anos, judia
Discussão de Caso Clínico Nathalia Rossato Gramado, 31 de agosto de 2018 Câncer de mama Inicial em paciente jovem Câncer de mama Inicial em paciente jovem IDENTIFICAÇÃO 02/09/2015 I.G.K., 33 anos, judia
Patologia - orientações
 Patologia - orientações Padronização para Patologistas e Ginecologistas Elaborado pelas Sociedades Brasileiras de Citopatologia, de Patologia, de Patologia do Trato Genital Inferior e Colposcopia, FEBRASGO,
Patologia - orientações Padronização para Patologistas e Ginecologistas Elaborado pelas Sociedades Brasileiras de Citopatologia, de Patologia, de Patologia do Trato Genital Inferior e Colposcopia, FEBRASGO,
Prevenção e Tratamento
 Outubro mês do cancro da mama 1 - A PREVENÇÃO FAZ A DIFERENÇA Mama Saudável O cancro da mama é o cancro mais frequente na mulher e, em muitos países, é ainda a sua principal causa de morte. Na população
Outubro mês do cancro da mama 1 - A PREVENÇÃO FAZ A DIFERENÇA Mama Saudável O cancro da mama é o cancro mais frequente na mulher e, em muitos países, é ainda a sua principal causa de morte. Na população
Enquadramento e Racional
 LungOS Advanced non-small cell Lung cancer treatment patterns and Overall Survival: real-world outcomes research study from the Southern Portugal Cancer Registry (ROR-SUL). Enquadramento e Racional O cancro
LungOS Advanced non-small cell Lung cancer treatment patterns and Overall Survival: real-world outcomes research study from the Southern Portugal Cancer Registry (ROR-SUL). Enquadramento e Racional O cancro
Imunidade a Tumores. Prof Vanessa Carregaro Departamento de Bioquímica e Imunologia FMRP-USP
 Imunidade a Tumores Prof Vanessa Carregaro Departamento de Bioquímica e Imunologia FMRP-USP Ribeirão Preto Abril, 2018 Câncer Hipócrates, por volta do ano 400 a.c Câncer: As veias que irradiam a partir
Imunidade a Tumores Prof Vanessa Carregaro Departamento de Bioquímica e Imunologia FMRP-USP Ribeirão Preto Abril, 2018 Câncer Hipócrates, por volta do ano 400 a.c Câncer: As veias que irradiam a partir
CARACTERIZAÇÃO HISTOPATOLÓGICA E MARCADORES IMUNO-HISTOQUÍMICOS NO CÂNCER DE MAMA DE GATAS
 UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CARACTERIZAÇÃO HISTOPATOLÓGICA E MARCADORES IMUNO-HISTOQUÍMICOS NO CÂNCER DE MAMA DE GATAS MARIANA FERNANDES JORGE BOTUCATU
UNIVERSIDADE ESTADUAL PAULISTA FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CARACTERIZAÇÃO HISTOPATOLÓGICA E MARCADORES IMUNO-HISTOQUÍMICOS NO CÂNCER DE MAMA DE GATAS MARIANA FERNANDES JORGE BOTUCATU
Biologia molecular dos meningiomas
 Biologia molecular dos meningiomas Antonio Santos de Araújo Júnior Neurocirurgião Hospital Sírio-Libanês São Paulo Pós-graduando do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal
Biologia molecular dos meningiomas Antonio Santos de Araújo Júnior Neurocirurgião Hospital Sírio-Libanês São Paulo Pós-graduando do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal
LEONORA ZOZULA BLIND POPE. AVALIAÇÃO DO PERFIL EPIDEMIOLÓGICO E DA PROTEINA p 53 EM 12 GLIOBLASTOMAS PEDIÁTRICOS.
 LEONORA ZOZULA BLIND POPE AVALIAÇÃO DO PERFIL EPIDEMIOLÓGICO E DA PROTEINA p 53 EM 12 GLIOBLASTOMAS PEDIÁTRICOS. Dissertação apresentada como requisito parcial à obtenção do grau de Mestre. Programa de
LEONORA ZOZULA BLIND POPE AVALIAÇÃO DO PERFIL EPIDEMIOLÓGICO E DA PROTEINA p 53 EM 12 GLIOBLASTOMAS PEDIÁTRICOS. Dissertação apresentada como requisito parcial à obtenção do grau de Mestre. Programa de
PROGRAMA DE EDUCAÇÃO MÉDICA CONTINUADA PERSPECTIVAS ATUAIS SOBRE O CÂNCER DE MAMA HER2 POSITIVO: UMA REVISÃO SOBRE OS DIFERENTES TESTES DIAGNÓSTICOS
 PROGRAMA DE EDUCAÇÃO MÉDICA CONTINUADA PERSPECTIVAS ATUAIS SOBRE O CÂNCER DE MAMA HER2 POSITIVO: UMA REVISÃO SOBRE OS DIFERENTES TESTES DIAGNÓSTICOS E SEUS SIGNIFICADOS SETEMBRO DE 2017 2 INTRODUÇÃO Prezados(as)
PROGRAMA DE EDUCAÇÃO MÉDICA CONTINUADA PERSPECTIVAS ATUAIS SOBRE O CÂNCER DE MAMA HER2 POSITIVO: UMA REVISÃO SOBRE OS DIFERENTES TESTES DIAGNÓSTICOS E SEUS SIGNIFICADOS SETEMBRO DE 2017 2 INTRODUÇÃO Prezados(as)
42º Congresso Bras. de Medicina Veterinária e 1º Congresso Sul-Brasileiro da ANCLIVEPA - 31/10 a 02/11 de Curitiba - PR
 1 HEMANGIOSSARCOMA CUTÂNEO CANINO: ESTUDO RETROSPECTIVO RENATA MADUREIRA 1, ANA PAULA FREDERICO LOUREIRO BRACARENSE 2, SELWYN ARLINGTON HEADLEY 2, GIOVANA WINGETER DI SANTIS 2, JULIANA SPEROTTO BRUM 1
1 HEMANGIOSSARCOMA CUTÂNEO CANINO: ESTUDO RETROSPECTIVO RENATA MADUREIRA 1, ANA PAULA FREDERICO LOUREIRO BRACARENSE 2, SELWYN ARLINGTON HEADLEY 2, GIOVANA WINGETER DI SANTIS 2, JULIANA SPEROTTO BRUM 1
PROJETO DE LEI DO SENADO Nº, DE 2009
 PROJETO DE LEI DO SENADO Nº, DE 2009 Altera a Lei nº 11.664, de 29 de abril de 2008, para incluir a pesquisa de biomarcadores entre as ações destinadas à detecção precoce das neoplasias malignas de mama
PROJETO DE LEI DO SENADO Nº, DE 2009 Altera a Lei nº 11.664, de 29 de abril de 2008, para incluir a pesquisa de biomarcadores entre as ações destinadas à detecção precoce das neoplasias malignas de mama
INFLUÊNCIA DO TIPO HISTOPATOLÓGICO E DO TEMPO DE EVOLUÇÃO NO TAMANHO DE NEOPLASIAS MAMÁRIAS EM CADELAS
 INFLUÊNCIA DO TIPO HISTOPATOLÓGICO E DO TEMPO DE EVOLUÇÃO NO TAMANHO DE NEOPLASIAS MAMÁRIAS EM CADELAS William Torres Blanca¹, Lígia Fernandes Gundim¹, Thais Almeida Moreira ², Ednaldo Carvalho Guimarães³,
INFLUÊNCIA DO TIPO HISTOPATOLÓGICO E DO TEMPO DE EVOLUÇÃO NO TAMANHO DE NEOPLASIAS MAMÁRIAS EM CADELAS William Torres Blanca¹, Lígia Fernandes Gundim¹, Thais Almeida Moreira ², Ednaldo Carvalho Guimarães³,
Fases do Ciclo Celular.
 Ciclo celular Fases do Ciclo Celular http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=mboc4.figgrp.3170 Fases do Ciclo Celular http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=mboc4.figgrp.3171 Leveduras são
Ciclo celular Fases do Ciclo Celular http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=mboc4.figgrp.3170 Fases do Ciclo Celular http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=mboc4.figgrp.3171 Leveduras são
Biologia Molecular e Celular II. Controle do crescimento celular
 Biologia Molecular e Celular II Controle do crescimento celular 2016 Controle extracelular do crescimento e divisão Tamanho de um órgão ou organismo é definido por 3 processos celulares: Crescimento; Divisão;
Biologia Molecular e Celular II Controle do crescimento celular 2016 Controle extracelular do crescimento e divisão Tamanho de um órgão ou organismo é definido por 3 processos celulares: Crescimento; Divisão;
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA
 BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2017 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
BIOLOGIA MOLECULAR EM ENDOCRINOLOGIA Curso de Atualização em Endocrinologia 2017 Denise Pires de Carvalho Instituto de Biofísica Carlos Chagas Filho / UFRJ DNA Sequência de Nucleotídeos RNA Sequência de
