Metabolismo do azoto dos aminoácidos e ciclo da ureia
|
|
|
- Oswaldo Zagalo de Miranda
- 6 Há anos
- Visualizações:
Transcrição
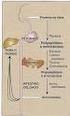
1 Metabolismo do azoto dos aminoácidos e ciclo da ureia Índice 1- Aspetos gerais e enquadramento A conversão de amónio (tóxico) em ureia (não tóxica) ocorre no fígado A ação catalítica da sintétase do carbamil-fosfato I e a das outras enzimas do ciclo da ureia A ureia contém dois átomos de azoto que têm origem direta no amónio e no aspartato Um dos átomos de azoto da ureia tem origem direta no amónio e indireta em todos os aminoácidos Um dos átomos de azoto da ureia tem origem direta no aspartato e indireta em todos os outros aminoácidos Energética do processo de síntese da ureia A regulação da atividade das enzimas do ciclo da ureia e da sintétase de carbamil-fosfato I pelo N-acetilglutamato O catabolismo de uma mesma molécula de um aminoácido pode ocorrer em etapas que têm lugar em órgãos distintos A alanina e a glutamina constituem, em conjunto, mais de metade dos aminoácidos libertados pelos músculos Uma parte do azoto dos aminoácidos é excretada na forma de amónio As relações entre excreção de azoto, a ingestão proteica e o balanço azotado Efeitos dietéticos e patológicos na proteólise, no catabolismo dos aminoácidos, na produção de ureia e na eliminação de azoto A excreção de azoto quando há défice de um aminoácido essencial na dieta O ciclo da ureia para além de permitir converter o amónio em ureia também participa na síntese da arginina Aspetos gerais e enquadramento Embora os aminoácidos nutricionalmente dispensáveis possam, no que refere ao esqueleto carbonado, formar-se a partir da glicose, é uma boa aproximação à realidade afirmar-se que os aminoácidos existentes no sangue e nas células resultam da hidrólise das proteínas endógenas ou das proteínas da dieta. Se pensarmos apenas na porção azotada, mesmo os aminoácidos sintetizados endogenamente a partir da glicose têm origem nos aminoácidos formados nestes processos de hidrólise. A maior parte das moléculas dos aminoácidos libertados aquando da hidrólise das proteínas endógenas são reutilizados na síntese dessas mesmas proteínas ou de outras proteínas, mas uma parte sofre catabolismo perdendo o azoto e gerando intermediários não azotados que, em última análise (direta ou indiretamente), vão acabar por oxidar-se a CO 2. Num indivíduo em balanço azotado nulo a quantidade de azoto ingerido é igual ao que se perde na urina, nas fezes e através da pele, cabelo, unhas, etc. A maior parte do azoto perde-se na urina na forma de ureia e, em menor grau, na forma de amónio. Quase todo o azoto que se perde na forma de ureia e amónio corresponde a moléculas de aminoácidos que foram oxidadas a CO A conversão de amónio (tóxico) em ureia (não tóxica) ocorre no fígado Os aminoácidos ou os intermediários a que dão origem no decurso do seu catabolismo podem perder os grupos azotados em reações de desamidação ou desaminação em que se liberta o ião amónio. A concentração plasmática do amónio é, num indivíduo saudável, muito baixa (cerca de 20 µm no sangue sistémico e cerca de 260 µm na veia porta) 1. Quando a concentração de amónio aumenta no plasma (hiperamonémia) provoca alterações neurológicas que podem culminar em coma e morte. 1 Para comparação: a concentração plasmática da glutamina é cerca de 600 µm, a dos aminoácidos em que a concentração plasmática é mais baixa (metionina e aspartato) ronda os 20 µm [Bergstrom et al. (1974) J Appl Physiol 36:693-7] e a de ureia 5 mm. Página 1 de 11
2 No fígado, ou mais precisamente, nos hepatócitos periportais, o amónio tóxico é convertido em ureia não tóxica. Uma situação clínica aguda que cursa com hiperamonémia é, por exemplo, uma hemorragia para dentro do lúmen do sistema digestivo em doentes com cirrose hepática. Nesta situação as proteínas do sangue acabam por gerar amónio por ação sequenciada das enzimas digestivas e das bactérias intestinais. Existem outras condições clínicas mais raras que também cursam com hiperamonémia: são exemplos as doenças causadas por défices congénitos das enzimas do ciclo da ureia ou da síntase do N-acetil-glutamato (ver, mais à frente, a Equação 26). 3- A ação catalítica da sintétase do carbamil-fosfato I e a das outras enzimas do ciclo da ureia Numa reação catalisada pela sintétase do carbamil-fosfato I (uma enzima da matriz mitocondrial) forma-se carbamil-fosfato (ver Equação 1). Na reação catalisada por esta sintétase consome-se amónio e CO 2 que se ligam para formar o carbamilo [1C,1N] que é fosforilado pelo ATP; o processo também envolve a hidrólise de uma outra molécula de ATP. O carbamil-fosfato vai ser o dador de um dos dois azotos da ureia [1C,2N] que se vai formar. Embora, em termos estritos, não se possa considerar que a sintétase do carbamil-fosfato I seja uma enzima do ciclo da ureia, a relação da sintétase de carbamil-fosfato I com o ciclo da ureia é tão íntima que, na maioria dos livros de texto, é incluída nas enzimas deste ciclo. Equação 1 NH 4 CO 2 2 ATP H 2 O carbamil-fosfato 2 ADP Pi No ciclo da ureia intervém uma enzima que, tal como a sintétase de carbamil-fosfato I, está na matriz mitocondrial, a transcarbamílase da ornitina (ver Equação 2); as outras três estão no citoplasma e são a sintétase do arginino-succinato, a argininosuccínase e a argínase (ver Equação 3, Equação 4 e Equação 5). Equação 2 Equação 3 Equação 4 Equação 5 ornitina carbamil-fosfato citrulina Pi citrulina aspartato ATP arginino-succinato AMP PPi arginino-succinato arginina fumarato arginina H 2 O ureia ornitina Costuma dizer-se que a ornitina [5C,2N] desempenha, no ciclo da ureia, um papel catalítico porque se consome na primeira reação (transcarbamílase da ornitina: ver Equação 2) e, via citrulina [6C,3N], arginino-succinato [10C,4N] e arginina [6C,4N], se regenera na última (argínase: ver Equação 5) 2. É na reação catalisada pela argínase que se dá a hidrólise da arginina formando-se ureia e regenerando-se ornitina, um dos substratos da transcarbamílase da ornitina. Ao longo do ciclo da ureia a estrutura da ornitina vai aceitando os componentes da ureia: como evidenciado pela reação de hidrólise catalisada pela argínase, a arginina [6C, 4N] pode ser entendida como sendo formada por dois resíduos: ornitina [5C,2N] e ureia [1C,2N]. Por ação catalítica da transcarbamílase da ornitina, a ornitina aceita o grupo carbamilo do carbamil-fosfato gerando citrulina que reage com o aspartato gerando arginino-succinato (sintétase do arginino-succinato: ver Equação 3): a formação do arginino-succinato é um processo endergónico acoplado com a hidrólise de ATP a AMP PPi. Por ação duma líase (argininosuccínase) o arginino-succinato desdobra-se em arginina e fumarato (ver Equação 4). Como já referido, a transcarbamílase da ornitina é uma enzima da matriz mitocondrial enquanto que todas as outras três enzimas do ciclo são citoplasmáticas: assim, o produto da transcarbamílase da ornitina, a citrulina, sai da mitocôndria, enquanto o substrato aminoacídico da mesma enzima, a ornitina, entra para a mitocôndria; os dois processos de transporte são catalisados pelo mesmo transportador. 4- A ureia contém dois átomos de azoto que têm origem direta no amónio e no aspartato O somatório das reações catalisadas pelas enzimas do ciclo da ureia e pela sintétase do carbamilfosfato I pode ser expresso pela seguinte equação soma: Equação 6 CO 2 NH 4 aspartato 3 ATP 2 H 2 O ureia 2 ADP AMP 2 Pi PPi fumarato 2 Na realidade, o mesmo se pode dizer a respeito de qualquer dos intermediários de um qualquer ciclo metabólico. Página 2 de 11
3 Os azotos e os carbonos da ureia [OC(NH 2 ) 2 ] têm, obviamente, origem direta na hidrólise da arginina (ver Equação 5) mas, se pensarmos no ciclo da ureia na sua globalidade, também se pode dizer que o carbono tem origem no CO 2, um dos átomos de azoto tem origem direta no amónio e o outro origem direta no aspartato (cujo esqueleto carbonado origina fumarato durante o processo). 5- Um dos átomos de azoto da ureia tem origem direta no amónio e indireta em todos os aminoácidos O amónio que está na origem do carbamil-fosfato hepático tem origem nos aminoácidos que sofrem catabolismo libertando amónio ou na própria ureia que é hidrolisada no lúmen do tubo digestivo 3. Uma parte considerável do amónio (talvez 1/3) utilizado para a síntese de carbamil-fosfato é captado pelo fígado chegando aí, através da veia porta, já como amónio. Este amónio foi formado nos enterócitos a partir da glutamina (via ação da glutamínase que catalisa a hidrólise do grupo amida: ver Equação 7) e no lúmen do intestino por ação das bactérias (que formam amónio quer a partir de produtos azotados com origem na dieta e nas secreções, quer da ureia). É de notar que parte da ureia que circula no sangue passa para o lúmen do cólon onde é reconvertida em amónio pelas bactérias: existe assim um ciclo entero-hepático de azoto envolvendo a ureia e o amónio assim como as enzimas hepáticas do ciclo da ureia e a urease (Equação 8) das bactérias intestinais. Os restantes 2/3 resultam da ação de enzimas hepáticas que provocam a perda de grupos azotados de aminoácidos na forma de amónio. Exemplos deste tipo de enzimas são a enzima de clivagem da glicina (ver Equação 9), a líase da cistationina (ver Equação 10), a desidrátase da serina (ver Equação 11), a histídase (ver Equação 12), a asparagínase (ver Equação 13), a glutamínase (ver Equação 7) e a desidrogénase do glutamato (ver Equação 14). Equação 7 glutamina H 2 O glutamato NH 4 Equação 8 ureia H 2 O CO 2 2 NH 4 Equação 9 glicina H4-folato NAD N 5,N 10 -metileno-h4-folato NADH CO 2 NH 4 Equação 10 cistationina cisteína α-cetobutirato NH 4 Equação 11 serina (ou treonina) piruvato (ou α-cetobutirato) NH 4 Equação 12 histidina urocanato NH 4 Equação 13 asparagina H 2 O aspartato NH 4 Equação 14 glutamato NAD α-cetoglutarato NADH NH 4 É de notar que a maior parte do azoto do amónio libertado pela ação da desidrogénase do glutamato tem origem última em muitos outros aminoácidos. Nalguns casos, o processo envolve reações de transaminação (ver Equação 15) onde o grupo α- amina dos aminoácidos é diretamente transferido para o α-cetoglutarato formando o glutamato (casos, por exemplo, da alanina, da serina, da tirosina, do aspartato e dos aminoácidos ramificados) enquanto noutros a reação de transaminação envolve intermediários da via catabólica (casos, por exemplo, da fenilalanina, cisteína, triptofano e lisina). É de notar que a ação sequenciada das transamínases referidas e da desidrogénase do glutamato (ver Equação 14) permite compreender que o grupo azotado dos aminoácidos que perdem o grupo amina para o α-cetoglutarato possa aparecer como amónio. Estas sequências de dois passos costumam designar-se por processos de transdesaminação (transaminação seguida de desaminação oxidativa do glutamato) [1] e a equação soma correspondente a estes processos é a Equação 16. Equação 15 α-aminoácidos α-cetoglutarato α-cetoácidos correspondentes glutamato Equação 16 α-aminoácidos NAD α-cetoácidos correspondentes NADH NH 4 Nos casos da glutamina (via glutamínase; ver Equação 7), da histidina (via urocanato formimino-glutamato glutamato), da prolina (via semialdeído do glutamato glutamato) e da 3 O amónio que se forma nas células também pode ter origem na desaminação do AMP (adenilato), da adenosina, da guanina, do CMP (citidilato), da citidina e da citosina assim como pode resultar da rotura do anel das bases pirimídicas no seu catabolismo. No entanto é frequentemente ignorar-se esta origem do amónio porque estes processos são quantitativamente muito pouco relevantes e porque o azoto libertado nestes processos incorpora-se nos referidos nucleotídeos, nucleosídeos e bases aquando da sua síntese tendo origem em aminoácidos. Página 3 de 11
4 arginina (via ornitina semialdeído do glutamato glutamato) o produto formado no processo catabólico é o glutamato. 6- Um dos átomos de azoto da ureia tem origem direta no aspartato e indireta em todos os outros aminoácidos O segundo azoto presente na estrutura da ureia tem origem direta no aspartato: o aspartato ao reagir com a citrulina e ao sair como fumarato deixa ficar azoto no grupo guanidina da arginina que vai sofrer hidrólise e gerar a ureia. No entanto, este segundo azoto pode, indiretamente, ter origem em todos os aminoácidos. A alanina (que é vertida no sangue pelos músculos ou pelos enterócitos e é captada pelo fígado) é exemplo de um aminoácido dador de amina para a síntese de aspartato no fígado. Por ação sequenciada da transamínase da alanina (ver Equação 17) e da transamínase do aspartato (ver Equação 18), o grupo amina que estava na alanina pode originar o grupo amina do aspartato; a sequência envolve como intermediário aminado o glutamato. Sequências similares envolvendo diversas transamínases e a transamínase do aspartato podem explicar a transferência de grupos amina de diversos aminoácidos para o oxalacetato e a formação de aspartato; a equação soma que descreve estes processos é a Equação 20 (ver abaixo). Equação 17 Equação 18 alanina α-cetoglutarato piruvato glutamato glutamato oxalacetato α-cetoglutarato aspartato Quando a perda de azoto origina amónio quer diretamente (casos da desamidação hidrolítica da glutamina, da ureia e da asparagina ou as desaminações oxidativas da glicina ou do glutamato, a desaminação por ação de líases de diversos aminoácidos; ver equações 7-14), quer indiretamente (via transdesaminação; ver Equação 16), este ião inorgânico também pode incorporar-se no oxalacetato originando aspartato e, desta maneira, contribuir para formar o segundo azoto da ureia. Por ação da desidrogénase do glutamato (ver Equação 19) a operar em direção inversa à que foi referida na Equação 14 4, o amónio pode originar o grupo amina do glutamato e o glutamato (formado por aminação do α-cetoglutarato) pode, por transaminação, ser dador de amina ao oxalacetato para formar aspartato (ver Equação 18). Tal como nos processos de transdesaminação também aqui está envolvida a desidrogénase do glutamato mas, neste caso, a transamínase pertinente é a transamínase do aspartato. Ao contrário do que acontece nos processos de transdesaminação aqui, em vez de se formar amónio, é este ião inorgânico que é incorporado em compostos orgânicos, no primeiro passo sintetizando-se glutamato (ver Equação 19) e, no segundo, o aspartato (Equação 18). Assim, via α-cetoglutarato/glutamato todos os aminoácidos podem contribuir para o azoto que vai ser cedido diretamente pelo aspartato na síntese da ureia. Equação 19 α-cetoglutarato NH 4 NADPH glutamato NADP H 2 O 7- Energética do processo de síntese da ureia A equação soma relativa ao processo de síntese de ureia mostra que, na síntese de uma molécula de ureia, se gastam 4 ligações ricas em energia do ATP: duas moléculas de ATP convertem-se em ADP e uma em AMP (ver Equação 6) 5. No entanto também é possível defender um outro ponto de vista. O oxalacetato é aceitador de grupos amina em reações de transaminação em que se forma o aspartato (Equação 20). Na conversão do fumarato (formado no ciclo da ureia) a oxalacetato participam a fumárase e a desidrogénase do malato e a equação soma correspondente a esta conversão é a Equação 21. A Equação 25 (que é a soma das equações 6 e 20-24) mostra que, tendo em conta os ATPs que se podem formar como consequência da oxidação do fumarato (via fumárase, desidrogénase do malato, cadeia respiratória e síntase do ATP; ver 4 Embora não esteja definitivamente comprovado, é muito provável que, quando a desidrogénase do glutamato catalisa a síntese de glutamato a partir de α-cetoglutarato e amónio, o agente redutor seja o NADPH (ver Equação 19) e que, quando catalisa a desaminação oxidativa do glutamato, o agente oxidante seja o NAD (ver Equação 14). 5 Embora se gastem diretamente apenas 3 moléculas de ATP, o facto de uma delas (a que se gasta aquando da ação da sintétase de arginino-succinato) originar AMP ( PPi, que se hidrolisa a 2 Pi) explica se gastem 4 ligações ricas em energia. Página 4 de 11
5 Equação 21 e Equação 22), também se pode pensar que o número de ligações ricas em energia gastas na síntese de uma molécula de ureia é de apenas 1,5 ATPs. Equação 20 Equação 21 Equação 22 Equação 23 Equação 24 Equação 25 oxalacetato α-aminoácido aspartato α-cetoácido fumarato NAD H 2 O oxalacetato NADH NADH ½ O 2 2,5 ADP 2,5 Pi NAD 2,5 ATP 3,5 H 2 O AMP ATP 2 ADP PPi H 2 O 2 Pi CO 2 NH 4 1,5 ATP α-aminoácido ½ H 2 O ½ O 2 ureia 1,5 ADP 1,5 Pi α-cetoácido No ciclo da ureia gastam-se 4 ligações ricas em energia do ATP mas, porque a reconversão do fumarato em aspartato permite a formação de 2,5 ATPs (admitindo relação P:O de 2,5 para o NADH), o gasto líquido é de apenas 1,5 ATPs. De qualquer forma, independentemente dos pontos de vista, pode sempre dizer-se que a síntese de ureia a partir de amónio e aspartato é um processo endergónico. 8- A regulação da atividade das enzimas do ciclo da ureia e da sintétase de carbamilfosfato I pelo N-acetil-glutamato A conversão dos esqueletos carbonados dos aminoácidos em glicose ou a sua oxidação direta a CO 2 (maioritariamente via acetil-coa) é acompanhada da libertação de amónio e o destino último do amónio é converter-se em ureia. As condições que levam ao aumento do catabolismo dos aminoácidos também levam ao aumento da síntese de ureia. No período pós-prandial de uma refeição que continha proteínas há aumento da concentração de aminoácidos no plasma (e, presume-se, no interior das células), mas também há aumento do catabolismo dos aminoácidos e da formação de ureia. Durante o período pós-prandial, à formação de ureia que resultava do catabolismo dos aminoácidos libertados na proteólise endógena soma-se a produção de ureia que resulta da fração dos aminoácidos da dieta que são oxidados neste período [2]. Em parte, este aumento da atividade das enzimas do ciclo da ureia pode dever-se ao aumento da concentração de substratos, nomeadamente o aumento da concentração de amónio no interior das mitocôndrias hepáticas [1]. No caso da sintétase de carbamil-fosfato I, a atividade depende estritamente da presença de um ativador alostérico: o N-acetil-glutamato. A enzima responsável pela síntese deste composto denominase síntase do N-acetil-glutamato (ver Equação 26) e é ativada alostericamente pela arginina [3]. Equação 26 acetil-coa glutamato N-acetil-glutamato CoA Quando a dieta é rica em proteínas durante um período alargado de tempo, a concentração de todas as enzimas do ciclo da ureia, incluindo nestas a síntase do N-acetil-glutamato, aumenta porque a sua síntese fica estimulada [1]. Por isso, quando se administra uma refeição teste (contendo, por exemplo, uma determinada quantidade de leite de soja) após uma semana em que a dieta foi hiperproteica, a concentração de aminoácidos no plasma mantém-se alta durante um período mais curto de tempo e a síntese de ureia é acelerada 6. Se a dieta foi normoproteica, o aumento de concentração de aminoácidos no plasma provocado pela mesma refeição prolonga-se durante algumas horas e a velocidade de síntese de ureia é menor [2]. 9- O catabolismo de uma mesma molécula de um aminoácido pode ocorrer em etapas que têm lugar em órgãos distintos A maioria dos aminoácidos é degradada no fígado, mas uma parte importante do catabolismo dos aminoácidos ocorre no músculo e nos enterócitos. É de notar que o catabolismo de uma determinada molécula de um determinado aminoácido até CO 2 e ureia pode ser feito por etapas envolvendo vários órgãos. Um bom exemplo é o caso da glutamina que (em parte) é convertida, nos enterócitos, em amónio e alanina que passam para o sangue da veia porta e são captados no fígado. Esta conversão pode ocorrer 6 É de notar que o aumento da síntese de ureia num período curto de tempo não se reflete obrigatoriamente num aumento da excreção urinária de ureia. Existem muitos fatores que, no nefrónio, influenciam a velocidade de excreção de ureia e a concentração de ureia no plasma é apenas um desses fatores. Um outro é o grau de hidratação que aumenta a excreção de ureia. Página 5 de 11
6 via glutamina glutamato α-cetoglutarato succinil-coa succinato fumarato malato oxalacetato fosfoenolpiruvato piruvato alanina. A equação soma relativa à conversão de glutamina em amónio e alanina é a Equação Equação 27 glutamina (C 5 H 10 O 3 N 2 ) 1,5 O 2 7,5 ADP 7,5 Pi alanina (C 3 NH 7 O 2 ) 2 CO 2 7,5 ATP 7,5 H 2 O NH 4 A conversão de glutamina em alanina pode ser entendida pensando que os 5 carbonos da glutamina dão origem aos 3 carbonos do piruvato e a duas moléculas de CO 2 através da ação sequenciada da glutamínase (ver Equação 7; é nesta reação que se forma o amónio), da transamínase da alanina (ver Equação 17), de enzimas do ciclo de Krebs que convertem o α-cetoglutarato em oxalacetato, da carboxicínase do fosfoenolpiruvato e da cínase do piruvato. O grupo amina da alanina provém de uma molécula de glutamato que, na reação de transaminação acima referida, cede o grupo azotado ao piruvato (ver Equação 17). A alanina formada nos enterócitos (ver Equação 27) é vertida na veia porta e é captada pelo fígado podendo, aqui, ser diretamente oxidada, via alanina piruvato acetil-coa e oxidação do resíduo acetato do acetil-coa no ciclo de Krebs e na cadeia respiratória; ver Equação Equação 28 alanina (C 3 NH 7 O 2 ) 3 O 2 11,75 ADP 11,75 Pi ½ ureia [½ CO(NH 2 ) 2 ] 2,5 CO 2 11,75 ATP 14,25 H 2 O Ou seja a alanina, ao chegar ao fígado, devolve o grupo amina ao α-cetoglutarato convertendo-se em piruvato que é, nas mitocôndrias, oxidado por ação da desidrogénase do piruvato e das enzimas do ciclo de Krebs. Uma outra possibilidade é a alanina que é captada pelo fígado ser convertida em glicose (gliconeogénese) e, esta glicose acabar por ser oxidada a CO 2 numa qualquer célula do organismo que tenha mitocôndrias (a exceção mais óbvia são os eritrócitos). O NH 4 formado nos enterócitos a partir da glutamina [5C,2N] e o azoto da alanina [3C,1N] são, no fígado, convertidos em ureia [1C,2N]. Ignorando a síntese de ATP e a redução/oxidação do NAD /NADH e do FAD/FADH2, a equação soma que descreve a oxidação da glutamina e a conversão dos seus 2 azotos nos dois azotos de uma molécula de ureia é, independentemente dos passos intermédios e dos órgãos intervenientes, a Equação 29. Aceitando que as concentrações de glicose, alanina, intermediários do metabolismo, ATP, ADP, Pi, NADH, NAD, FAD e FADH2 são estacionárias, a Equação 29 é a que descreve o processo global de oxidação da glutamina no organismo entendido como um todo. (De facto, como veremos adiante, os azotos da glutamina também podem ser excretados na urina na forma de amónio e, neste caso, a equação que descreve a oxidação da glutamina no organismo entendido como um todo, é a Equação 30.) Equação 29 glutamina (C 5 H 10 O 3 N 2 ) 4,5 O 2 4 CO 2 3 H 2 O ureia [CO(NH 2 ) 2 ] Equação 30 glutamina (C 5 H 10 O 3 N 2 ) 4,5 O 2 2 H 2 NH 4 5 CO 2 2 H 2 O 10- A alanina e a glutamina constituem, em conjunto, mais de metade dos aminoácidos libertados pelos músculos As transamínases dos α-aminoácidos ramificados (ver Equação 31) são muito mais ativas nos músculos que noutros órgãos e, por isso, os músculos são um importante local de captação (e degradação) dos aminoácidos ramificados (valina, leucina e isoleucina) [4]. No processo de degradação 7 Esta Equação já inclui a formação de ATP resultante da oxidação do FADH2 (formado na conversão succinato fumarato) e do NADH (formado nas conversões α-cetoglutarato succinil-coa e malato oxalacetato), assim como a fosforilação a nível do substrato que é concomitante com a conversão fosfoenolpiruvato piruvato. O GTP formado aquando da conversão succinil-coa succinato (ação da sintétase do succinil-coa) é consumido aquando da conversão oxalacetato fosfoenolpiruvato (carboxicínase do fosfoenolpiruvato). 8 Como consequência da oxidação da molécula da alanina (que resultou da oxidação parcial de uma molécula de glutamina no enterócito) podem formar-se no hepatócito 12,5 ATPs (2,5 em resultado da oxidação do NADH formado na ação da desidrogénase do piruvato e 10 na oxidação do resíduo de acetato do acetil-coa no ciclo de Krebs). No entanto, como já referido, a síntese de ureia é um processo endergónico que, consumindo diretamente 4 ligações ricas em energia do ATP, também permite a formação de uma molécula de NADH por molécula de ureia formada se contabilizarmos a regeneração do aspartato a partir de fumarato. Ou seja, se incluirmos, o gasto líquido de 0,75 ATPs na formação de ½ molécula de ureia, o balanço global do número de ATPs formados na conversão de alanina em CO 2 e em meia molécula de ureia (a ureia tem dois azotos e a alanina só tem um) é de 11,75 ATPs. Página 6 de 11
7 destes aminoácidos, os seus grupos amina podem acabar como azoto da alanina ou da glutamina. Embora constituam apenas 10% dos aminoácidos das proteínas musculares, a alanina e a glutamina constituem, em conjunto, mais de metade dos aminoácidos libertados pelos músculos e contêm mais de 1/3 do azoto aminoacídico plasmático. Equação 31 aminoácido ramificado α-cetoglutarato α-cetoácido ramificado correspondente glutamato (1) A alanina é uma forma de transporte de azoto e de carbonos do músculo para o fígado sendo este transporte um dos passos do ciclo da alanina. A alanina libertada pelo músculo resulta maioritariamente de reações de transaminação em que intervém o piruvato formado na glicólise muscular; esta alanina é captada pelo fígado servindo o azoto para a síntese de ureia e o esqueleto carbonado para a síntese de glicose que, libertada pelo fígado, pode ser usada pelo músculo levando à formação de piruvato que, por transaminação regenera a alanina (ciclo da alanina). Porque o grupo amina da alanina foi cedido pelo glutamato (ver Equação 17) e este grupo amina pode ter tido origem noutros aminoácidos (quer através de outras reações de transaminação (ver Equação 15 e Equação 31), quer através da desidrogénase do glutamato (ver Equação 19) compreende-se que, o transporte de alanina do músculo para o fígado represente o transporte de grupos azotados de variados aminoácidos (que perderam estes grupos no músculos) para o fígado. (2) Embora algumas das moléculas da glutamina libertada pelos músculos possa ter origem na proteólise que ocorre dentro das fibras, a maior parte resulta da conversão de outros aminoácidos. Embora não seja consensual [5], admite-se que o esqueleto carbonado de algumas das moléculas da glutamina libertada pelo músculo tenha origem na valina e na isoleucina. No seu catabolismo estes dois aminoácidos geram succinil-coa; no ciclo de Krebs o succinil-coa pode formar α-cetoglutarato que, aceitando um grupo amina em reações de transaminação, gera glutamato e, via sintétase da glutamina (ver Equação 32), glutamina. Na origem dos grupos azotados da glutamina estariam quer os aminoácidos ramificados (que podem ceder o grupo amina para formar o grupo α-amina da glutamina), quer outros aminoácidos que possam sofrer desaminação no músculo e ceder o NH 4 (que é substrato da sintétase da glutamina) para formar o grupo 5-amida da glutamina. A glutamina, libertada pelo músculo, pode ser, direta ou indiretamente (via alanina e amónio formados nos enterócitos a partir da glutamina), captada pelo fígado onde os carbonos podem gerar glicose (e/ou CO 2 ) e os azotos ureia. Equação 32 glutamato NH 4 ATP glutamina ADP Pi 11- Uma parte do azoto dos aminoácidos é excretada na forma de amónio Para além da ureia, um importante composto azotado da urina é o ião amónio (NH 4 ). Normalmente o amónio excretado na urina é uma pequena fração do azoto eliminado para o meio exterior (menos de 5%), mas em situações de acidose o valor desta fração aumenta marcadamente [6]. A maior parte do amónio excretado na urina forma-se nas células tubulares renais por ação da glutamínase (ver Equação 7) e da desidrogénase do glutamato (ver Equação 14): o rim capta glutamina do plasma (com origem no músculo e, em situações de acidose, também no fígado) e usa os seus azotos para formar o amónio que excreta na urina. O valor do pka do ião amónio é de cerca de 9,3 encontrando-se por isso maioritariamente na forma protonada em phs fisiológicos (ver Equação 33) 9. O ião amónio formado é segregado para o lúmen do nefrónio representando uma forma de excreção de protões. Em situações de acidose como, por exemplo, quando há síntese aumentada de corpos cetónicos num jejum que dura há vários dias, a quantidade de azoto que é excretada na forma de amónio pode aproximar-se da que é excretada na forma de ureia [6]. Equação 33 NH 4 NH 3 H A síntese e a secreção de amónio pelo rim têm um papel homeostático na regulação do ph do meio interno. Para se compreender esta última afirmação é útil escrever a equação que descreve o somatório dos processos que levam à oxidação completa da glutamina com geração de amónio de forma a 9 A forma que pode atravessar as membranas (difusão simples) é a forma desprotonada (amoníaco; NH 3 ) que está em equilíbrio químico com o amónio (ver Equação 33). Página 7 de 11
8 pôr em evidência que se gastam protões durante o processo (ver Equação 30) 10. A excreção de NH 4 na urina é, em última análise, uma forma de excretar protões ligados (tamponados) ao amoníaco (ver Equação 33). De notar que a oxidação da glutamina com geração de ureia não tem as mesmas consequências no que se refere ao consumo de protões (ver Equação 29). 12- As relações entre excreção de azoto, a ingestão proteica e o balanço azotado Para além da ureia e do amónio urinários existem outras formas de eliminar o azoto que foi obtido através da ingestão de proteínas. Essas outras formas são a eliminação urinária de creatinina (formada a partir da creatina que, por sua vez se formou a partir da arginina, da glicina e da metionina) e de ácido úrico (formado com azoto das purinas que por sua vez veio da glicina, do aspartato e da glutamina) e a eliminação de proteínas inteiras e outros produtos azotados nas fezes, pele, suor e secreções genitais e nasais. Num adulto com 70 kg de peso e com uma dieta equilibrada do ponto de vista calórico, mesmo na ausência de ingestão de proteínas, um mínimo de cerca de 25 g de aminoácidos são diariamente perdidos ( perdas obrigatórias de aminoácidos ). Porque o catabolismo dos aminoácidos fica acelerado quando se ingerem proteínas, para manter balanço azotado nulo, há que ingerir mais aminoácidos do que aqueles que são obrigatoriamente perdidos no contexto de uma dieta proteica nula. As estimativas atuais apontam para valores na ordem dos 0,66 g kg -1 dia -1 (46 g/dia num adulto de 70 kg) como correspondendo ao valor de ingestão proteica que supre as necessidades em 50% dos indivíduos adultos saudáveis [7]. No seu conjunto cerca de 16% da massa das proteínas é azoto e, se admitirmos balanço azotado nulo e uma ingestão de 50 g/dia de proteínas, a massa total de azoto perdida na urina, nas fezes, na pele, no suor e nas secreções nasais e genitais perfaz 8 g/dia (50 g/dia 0,16 = 8 g/dia). Em geral, recomenda-se uma ingestão diária de, pelo menos, 0,83 g de proteínas por kg de peso (58 g num indivíduo adulto de 70 kg). Pelo menos no sentido que damos à palavra reserva quando falamos do glicogénio e da gordura dos adipócitos, os mamíferos não fazem reservas de aminoácidos nem de proteínas. Embora em resposta ao aumento da insulina no período pós-prandial haja um aumento da síntese proteica e diminuição da degradação (acontecendo o contrário quando a insulina desce) esta variação cíclica diária na massa proteica é muito pequena ( 0,3%) e, além disso, as proteínas têm papéis biológicos que ficam comprometidos se a massa de proteínas do organismo descer de forma apreciável. Em geral, a morte sobrevém quando, em consequência de jejum ou má nutrição, se perdem cerca de 50% das proteínas endógenas [8]. No caso do glicogénio hepático, 24 horas sem ingestão de glicídeos são suficientes para que este praticamente se esgote. No caso da gordura do tecido adiposo existem patologias congénitas compatíveis com a vida (lipodistrofias) em que este tecido está praticamente ausente. Um adulto saudável que não faz musculação, não está a recuperar de uma situação em que perdeu proteínas endógenas, nem está a engordar, está em equilíbrio azotado (tem um balanço azotado nulo) e em resposta a um aumento da ingestão de proteínas aumenta o catabolismo dos aminoácidos. Para o total do azoto eliminado também contribui o azoto das proteínas das células da pele ou das mucosas que, no seu processo de renovação cíclica, descamam assim como as proteínas da dieta cuja digestão e absorção é incompleta. A digestão incompleta de proteínas é mais marcada no caso das proteínas dos alimentos vegetais. Dependendo da dieta, as perdas nas fezes podem constituir cerca de 10% do total do azoto eliminado diariamente sendo que o restante é, quase todo 11, eliminado na urina. A percentagem de azoto eliminado como ureia varia com a quantidade de proteínas ingeridas aumentando quando aumenta a quantidade de proteínas na dieta. Nas dietas típicas do ocidente cerca de 85% do azoto urinário é azoto ureico sendo o restante componente de diversos compostos azotados da urina (ácido úrico, creatinina, amónia, hipurato, fenil-acetil-glutamina, etc.). Assim, se admitirmos que à ingestão de 100 g/dia de proteínas (a ingestão média nos EUA) corresponde uma absorção de 90 g/dia e que 85% do azoto urinário é azoto ureico, a massa de azoto da ureia seria de cerca de 12 g/dia (90 g/dia 0,85 0,16). 10 De notar que a mesma equação também pode ser escrita de forma a pôr em destaque que se forma bicarbonato: glutamina (C 5 N 2 H 10 O 3 ) 4,5 O 2 2 NH 4 3 CO 2 2 HCO Cerca de 0,3-0,5 g de azoto (correspondente a 2-3 g de proteínas) é eliminado por dia nos tegumentos (descamação da pele e formação de pelos e unhas), no suor, nas secreções nasais e genitais e nas perdas ao lavar os dentes. Página 8 de 11
9 13- Efeitos dietéticos e patológicos na proteólise, no catabolismo dos aminoácidos, na produção de ureia e na eliminação de azoto A velocidade com que o azoto dos aminoácidos é convertido em ureia depende da velocidade de desaminação e oxidação dos aminoácidos (catabolismo dos aminoácidos) e da atividade das enzimas do ciclo da ureia. Muitas das enzimas envolvidas no catabolismo dos aminoácidos têm valores de K m superiores às concentrações em que estes existem nas células, admitindo-se, por este motivo, que são sensíveis a variações na sua concentração [6]. Em todas as células do organismo, mas particularmente nos enterócitos e no fígado que recebem diretamente os aminoácidos libertados aquando da digestão intestinal, o aumento da concentração intracelular de aminoácidos livres pode, no período pós-prandial, resultar da hidrólise das proteínas da dieta. De facto, a esmagadora maioria das moléculas dos aminoácidos glutamina, glutamato e aspartato que entram para os enterócitos a partir do lúmen são degradadas antes de entrar para o sangue [9]. Como já foi referido, a síntese de ureia aumenta quando, no período pós-prandial, aumenta o catabolismo dos aminoácidos da dieta. Nesta condição, o catabolismo dos aminoácidos e a síntese de ureia que resultam da hidrólise das proteínas da dieta somam-se ao catabolismo e à síntese de ureia que já ocorriam no período pós-absortivo (jejum matinal). A velocidade de síntese de ureia é mínima quando a dieta não contém proteínas, mas contém glicídeos e é, em termos calóricos, capaz de colmatar a despesa energética. Comparativamente com esta situação, o catabolismo dos aminoácidos e a síntese de ureia é maior quando a ingestão de alimentos é nula (apenas água). Neste último caso, porque a insulina está baixa (a insulina tem uma ação anabólica nas proteínas musculares), a proteólise endógena está aumentada fornecendo aminoácidos como substratos da gliconeogénese. Por outro lado a descida da secreção de insulina e a subida da de glicagina estimulam a captação de aminoácidos pelo fígado, o seu catabolismo e a gliconeogénese. Se o tempo de jejum se prolonga por vários dias, grande parte da despesa energética do cérebro passa a ser colmatada pelos corpos cetónicos. No entanto, mesmo nesta situação, pelo menos 1/3 da despesa energética do cérebro deriva da oxidação da glicose e a gliconeogénese é a via metabólica onde se forma a glicose que é consumida pelo cérebro. Embora esta adaptação ao jejum (síntese de corpos cetónicos) permita que a degradação das proteínas endógenas diminua à medida que o tempo de jejum total se prolonga, a síntese endógena de glicose está, no jejum total, maioritariamente dependente da degradação das proteínas endógenas e da conversão dos aminoácidos glicogénicos em glicose 12. Acompanhando o aumento da síntese de corpos cetónicos, durante o jejum prolongado diminui a formação de T3 (hormona tiroideia) e esta diminuição provoca diminuição da degradação das proteínas endógenas [6]. No jejum prolongado que já se iniciou há uma semana a perda diária de azoto pode ser da ordem dos 8 g dia -1 (o que corresponde a uma perda de massa proteica endógena de 50 g dia -1 ). Este valor de eliminação de azoto é menor que o que corresponde à ingestão diária de 100 g de proteínas (16 g de azoto dia -1 ), mas é maior que o que corresponde a uma situação experimental em que a dieta é equilibrada do ponto de vista energético e não contém proteínas ( perda obrigatória de aminoácidos ; cerca de 4 g de azoto dia -1 ). Muitas situações de doença cursam com balanço energético e azotado negativos que, em parte, são causados por aumento da despesa energética e da hidrólise das proteínas endógenas. No aumento desta hidrólise participam, como fatores estimuladores, o aumento da produção de citosinas inflamatórias e de cortisol assim como a diminuição da sensibilidade à insulina. Nestas condições há aumento da libertação de aminoácidos livres e aumento da sua oxidação com o aumento concomitante da produção (e da excreção) de ureia. 14- A excreção de azoto quando há défice de um aminoácido essencial na dieta Um outro fator que pode influenciar a velocidade de oxidação e catabolismo dos aminoácidos é a composição aminoacídica da dieta. Se uma dieta é deficiente num aminoácido essencial, a síntese proteica está prejudicada e aumenta a concentração de aminoácidos livres. Existem aminoácidos que, em condições normais, seriam usados na síntese proteica e que, nestas circunstâncias, vão sofrer catabolismo. 12 A glicose formada no fígado pode ter origem na reciclagem da alanina e do lactato nos ciclos da alanina e do lactato mas o cérebro não recicla glicose: o metabolismo cerebral é aeróbio e a glicose é convertida a CO 2. Assim, se pensarmos num tempo de jejum em que já se esgotou o glicogénio, a maior parte da glicose formada de novo durante o jejum total resulta da conversão dos aminoácidos libertados na hidrólise das proteínas endógenas. Uma parte menor (cerca de ¼) resulta da conversão hepática e renal do glicerol libertado aquando da hidrólise dos triacilgliceróis do tecido adiposo. Página 9 de 11
10 Uma dieta deficiente num aminoácido essencial provoca aumento do catabolismo dos outros aminoácidos e balanço azotado negativo. Admitindo uma situação limite: quando a ingestão de um aminoácido essencial é zero, a excreção de azoto equivale ao somatório do azoto das perdas obrigatórias de aminoácidos com o azoto ingerido. 15- O ciclo da ureia para além de permitir converter o amónio em ureia também participa na síntese da arginina A arginina é um intermediário do ciclo da ureia, mas é também um dos aminoácidos constituintes das proteínas e um precursor na síntese de creatina (e, consequentemente, de creatinina) e do NO (óxido nítrico). Assim, quando uma molécula de arginina, abandona o ciclo da ureia para ser usada nestes processos, é imprescindível a sua reposição. A síntese de arginina a partir de ornitina ocorre via ação sequenciada da transcarbamílase da ornitina (ver Equação 2) e da sintétase e da líase do argininosuccinato (ver Equação 3 e Equação 4). Por sua vez a ornitina pode formar-se a partir do glutamato via ação de uma redútase que também consome ATP (ver Equação 34) e da transamínase da ornitina (ver Equação 35). Equação 34 Equação 35 glutamato NADPH ATP semialdeído do glutamato 13 NADP ADP Pi semialdeído do glutamato glutamato ornitina α-cetoglutarato 1. Newsholme, E. A. & Leech, T. (2010) Functional Biochemistry in Health and disease, Wiley-Blackwell, Oxford. 2. Morens, C., Bos, C., Pueyo, M. E., Benamouzig, R., Gausseres, N., Luengo, C., Tome, D. & Gaudichon, C. (2003) Increasing habitual protein intake accentuates differences in postprandial dietary nitrogen utilization between protein sources in humans, J Nutr. 133, Caldovic, L., Ah Mew, N., Shi, D., Morizono, H., Yudkoff, M. & Tuchman, M. (2010) N-acetylglutamate synthase: structure, function and defects, Mol Genet Metab. 100 Suppl 1, S Ooiwa, T., Goto, H., Tsukamoto, Y., Hayakawa, T., Sugiyama, S., Fujitsuka, N. & Shimomura, Y. (1995) Regulation of valine catabolism in canine tissues: tissue distributions of branched-chain aminotransferase and 2-oxo acid dehydrogenase complex, methacrylyl-coa hydratase and 3-hydroxyisobutyryl-CoA hydrolase, Biochim Biophys Acta. 1243, Stipanuk, M. H. & Caudill, M. A. (2013) Biochemical, Physiological, Molecular Aspects of Human Nutrition, 3rd edn, Sunders, Elsevier., USA. 6. Frayn, K. N. (2012) Regulação Metabólica. Uma perspetiva focada no organismo humano., U.P. Editorial, Porto. 7. Rand, W. M., Pellett, P. L. & Young, V. R. (2003) Meta-analysis of nitrogen balance studies for estimating protein requirements in healthy adults, Am J Clin Nutr. 77, Dulloo, A. G., Gubler, M., Montani, J. P., Seydoux, J. & Solinas, G. (2004) Substrate cycling between de novo lipogenesis and lipid oxidation: a thermogenic mechanism against skeletal muscle lipotoxicity and glucolipotoxicity, Int J Obes Relat Metab Disord. 28 Suppl 4, S Wu, G. (1998) Intestinal mucosal amino acid catabolism, J Nutr. 128, De facto, o produto direto da ação da redútase é um composto designado de pirrolina-5-carboxilato que numa reação não enzímica se converte no semialdeído do glutamato. Página 10 de 11
11 Página 11 de 11
Metabolismo do azoto dos aminoácidos e ciclo da ureia
 Metabolismo do azoto dos aminoácidos e ciclo da ureia 1- Os aminoácidos existentes no sangue e nas células resultam da hidrólise das proteínas endógenas ou das proteínas da dieta. A maior parte dos aminoácidos
Metabolismo do azoto dos aminoácidos e ciclo da ureia 1- Os aminoácidos existentes no sangue e nas células resultam da hidrólise das proteínas endógenas ou das proteínas da dieta. A maior parte dos aminoácidos
Metabolismo do azoto dos aminoácidos e ciclo da ureia
 Metabolismo do azoto dos aminoácidos e ciclo da ureia 1- Embora os aminoácidos nutricionalmente dispensáveis possam, no que refere ao esqueleto carbonado, formar-se a partir da glicose, é uma boa aproximação
Metabolismo do azoto dos aminoácidos e ciclo da ureia 1- Embora os aminoácidos nutricionalmente dispensáveis possam, no que refere ao esqueleto carbonado, formar-se a partir da glicose, é uma boa aproximação
Gliconeogênese. Gliconeogênese. Órgãos e gliconeogênese. Fontes de Glicose. Gliconeogênese. Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia
 Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia Gliconeogênese Alexandre Havt Gliconeogênese Fontes de Energia para as Células Definição Via anabólica que ocorre no fígado e, excepcionalmente
Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia Gliconeogênese Alexandre Havt Gliconeogênese Fontes de Energia para as Células Definição Via anabólica que ocorre no fígado e, excepcionalmente
Catabolismo dos aminoácidos 1
 Catabolismo dos aminoácidos; Rui Fontes Catabolismo dos aminoácidos 1 1- No decurso do seu catabolismo os aminoácidos perdem os seus átomos de azoto que, na sua maioria, são incorporados na ureia e excretados
Catabolismo dos aminoácidos; Rui Fontes Catabolismo dos aminoácidos 1 1- No decurso do seu catabolismo os aminoácidos perdem os seus átomos de azoto que, na sua maioria, são incorporados na ureia e excretados
Metabolismo de PROTEÍNAS
 FACULDADE DE CIÊNCIAS E TECNOLOGIA Departamento de Educação Física Metabolismo de PROTEÍNAS Disciplina Nutrição aplicada à Educação Física e ao Esporte Prof. Dr. Ismael Forte Freitas Júnior FORMAÇÃO DAS
FACULDADE DE CIÊNCIAS E TECNOLOGIA Departamento de Educação Física Metabolismo de PROTEÍNAS Disciplina Nutrição aplicada à Educação Física e ao Esporte Prof. Dr. Ismael Forte Freitas Júnior FORMAÇÃO DAS
30/05/2017. Metabolismo: soma de todas as transformações químicas que ocorrem em uma célula ou organismo por meio de reações catalisadas por enzimas
 Metabolismo: soma de todas as transformações químicas que ocorrem em uma célula ou organismo por meio de reações catalisadas por enzimas Metabolismo energético: vias metabólicas de fornecimento de energia
Metabolismo: soma de todas as transformações químicas que ocorrem em uma célula ou organismo por meio de reações catalisadas por enzimas Metabolismo energético: vias metabólicas de fornecimento de energia
Metabolismo de Proteínas. Tiago Fernandes 2014
 Metabolismo de Proteínas Tiago Fernandes 2014 Proteínas (do grego de primordial importância ) - aa acoplados formam proteínas. - 10 a 12 kg de proteína em um adulto saudável - maior proporção no músculo
Metabolismo de Proteínas Tiago Fernandes 2014 Proteínas (do grego de primordial importância ) - aa acoplados formam proteínas. - 10 a 12 kg de proteína em um adulto saudável - maior proporção no músculo
CICLO DE KREBS. Em condições aeróbias: mitocôndria. citosol. Glicólise. ciclo de Krebs. 2 piruvato. 2 Acetil CoA. Fosforilação oxidativa
 CICLO DE KREBS Em condições aeróbias: citosol mitocôndria Glicólise Acetil CoA ciclo de Krebs Fosforilação oxidativa CICLO DE KREBS OU CICLO DOS ÁCIDOS TRICARBOXÍLICOS Ligação entre a glicólise e o ciclo
CICLO DE KREBS Em condições aeróbias: citosol mitocôndria Glicólise Acetil CoA ciclo de Krebs Fosforilação oxidativa CICLO DE KREBS OU CICLO DOS ÁCIDOS TRICARBOXÍLICOS Ligação entre a glicólise e o ciclo
Funções do Metabolismo
 Universidade Federal de Mato Grosso Disciplina de Bioquímica Conceito de Metabolismo METABOLISMO DOS CARBOIDRATOS Prof. Msc. Reginaldo Vicente Ribeiro Atividade celular altamente dirigida e coordenada,
Universidade Federal de Mato Grosso Disciplina de Bioquímica Conceito de Metabolismo METABOLISMO DOS CARBOIDRATOS Prof. Msc. Reginaldo Vicente Ribeiro Atividade celular altamente dirigida e coordenada,
Metabolismo de aminoácidos de proteínas. Profa Dra Mônica Santos de Freitas
 Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 16.05.2011 1 Introdução As proteínas são a segunda maior fonte de estocagem de energia no corpo; O maior estoque de proteínas
Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 16.05.2011 1 Introdução As proteínas são a segunda maior fonte de estocagem de energia no corpo; O maior estoque de proteínas
Metabolismo de aminoácidos de proteínas
 Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 12.09.2012 1 transporte DE AMINOÁCIDOS DENTRO DA CÉLULA O metabolismo de aminoácidos ocorre dentro da célula; A concentração intracelular
Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 12.09.2012 1 transporte DE AMINOÁCIDOS DENTRO DA CÉLULA O metabolismo de aminoácidos ocorre dentro da célula; A concentração intracelular
Catabolismode aminoácidos. Aula anterior...
 Catabolismode aminoácidos Aula anterior... Metabolismo de aminoácidos Catabolismo de aminoácidos Aminotransferases Desaminação oxidativa do glutamato glutamato desidrogenase Papel da glutamina Papel da
Catabolismode aminoácidos Aula anterior... Metabolismo de aminoácidos Catabolismo de aminoácidos Aminotransferases Desaminação oxidativa do glutamato glutamato desidrogenase Papel da glutamina Papel da
Gliconeogénese e Metabolismo do Glicogénio
 Página 1 de 5 Aulas de grupo 2001-02; Rui Fontes Gliconeogénese e Metabolismo do Glicogénio 1- Gliconeogénese 1- A gliconeogénese é um termo usado para incluir o conjunto de processos pelos quais o organismo
Página 1 de 5 Aulas de grupo 2001-02; Rui Fontes Gliconeogénese e Metabolismo do Glicogénio 1- Gliconeogénese 1- A gliconeogénese é um termo usado para incluir o conjunto de processos pelos quais o organismo
Professor Antônio Ruas
 Universidade Estadual do Rio Grande do Sul Curso Superior de Tecnologia em Gestão Ambiental Componente curricular: BIOLOGIA GERAL Aula 4 Professor Antônio Ruas 1. Temas: Macromoléculas celulares Produção
Universidade Estadual do Rio Grande do Sul Curso Superior de Tecnologia em Gestão Ambiental Componente curricular: BIOLOGIA GERAL Aula 4 Professor Antônio Ruas 1. Temas: Macromoléculas celulares Produção
Catabolismo dos aminoácidos 1
 Catabolismo dos aminoácidos 1 1- No decurso do seu catabolismo os aminoácidos perdem os seus átomos de azoto que, na sua maioria, são incorporados na ureia e excretados na urina. (i) A porção não azotada
Catabolismo dos aminoácidos 1 1- No decurso do seu catabolismo os aminoácidos perdem os seus átomos de azoto que, na sua maioria, são incorporados na ureia e excretados na urina. (i) A porção não azotada
METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários. Bioquímica. Profa. Dra. Celene Fernandes Bernardes
 METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários Bioquímica Profa. Dra. Celene Fernandes Bernardes REFERÊNCIA: Bioquímica Ilustrada - Champe ESTÁGIOS DO CATABOLISMO
METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários Bioquímica Profa. Dra. Celene Fernandes Bernardes REFERÊNCIA: Bioquímica Ilustrada - Champe ESTÁGIOS DO CATABOLISMO
Professor Antônio Ruas
 Universidade Estadual do Rio Grande do Sul Curso Superior de Tecnologia em Gestão Ambiental Componente curricular: BIOLOGIA GERAL Aula 4 Professor Antônio Ruas 1. Temas: Macromoléculas celulares Produção
Universidade Estadual do Rio Grande do Sul Curso Superior de Tecnologia em Gestão Ambiental Componente curricular: BIOLOGIA GERAL Aula 4 Professor Antônio Ruas 1. Temas: Macromoléculas celulares Produção
O nitrogênio molecular ( N 2 ) abundante na atmosfera
 O nitrogênio molecular ( N 2 ) abundante na atmosfera Para ser utilizado pelos animais, ele precisa ser fixado reduzido de N 2 para NH 3 (amônia) (microorganismos, plantas, descargas elétricas) Fixação
O nitrogênio molecular ( N 2 ) abundante na atmosfera Para ser utilizado pelos animais, ele precisa ser fixado reduzido de N 2 para NH 3 (amônia) (microorganismos, plantas, descargas elétricas) Fixação
Revisão do Metabolismo da Glicose
 Gliconeogênese Revisão do Metabolismo da Glicose Esquema Geral da Glicólise lise 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas 2 moléculas de Piruvato (3C) Saldo 2 moléculas
Gliconeogênese Revisão do Metabolismo da Glicose Esquema Geral da Glicólise lise 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas 2 moléculas de Piruvato (3C) Saldo 2 moléculas
Aminoácidos e proteínas Metabolismo
 Aminoácidos e proteínas Metabolismo Rota metabólica dos AA Origem dos AA circulantes; Dieta: classificação dos AA Transaminação Destino dos AA; Degradação 1 Stollet al (2006) Partição aminoácidos Biossíntese
Aminoácidos e proteínas Metabolismo Rota metabólica dos AA Origem dos AA circulantes; Dieta: classificação dos AA Transaminação Destino dos AA; Degradação 1 Stollet al (2006) Partição aminoácidos Biossíntese
Introdução ao Metabolismo. Profª Eleonora Slide de aula
 Introdução ao Metabolismo Profª Eleonora Slide de aula Metabolismo Profª Eleonora Slide de aula Relacionamento energético entre as vias catabólicas e as vias anabólicas Nutrientes que liberam energia Carboidratos
Introdução ao Metabolismo Profª Eleonora Slide de aula Metabolismo Profª Eleonora Slide de aula Relacionamento energético entre as vias catabólicas e as vias anabólicas Nutrientes que liberam energia Carboidratos
METABOLISMO DOS CARBOIDRATOS - GLICÓLISE
 Após a absorção dos carboidratos no intestino, a veia porta hepática fornece glicose ao fígado, que vai para o sangue para suprir as necessidades energéticas das células do organismo. GLICÓLISE principal
Após a absorção dos carboidratos no intestino, a veia porta hepática fornece glicose ao fígado, que vai para o sangue para suprir as necessidades energéticas das células do organismo. GLICÓLISE principal
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE. Profa. Dra. Marina Prigol
 Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE Profa. Dra. Marina Prigol GLICONEOGÊNESE PROCESSO DE SÍNTESE DE GLICOSE A PARTIR DE COMPOSTOS NÃO GLICÍDICOS OCORRÊNCIA: Citosol do
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE Profa. Dra. Marina Prigol GLICONEOGÊNESE PROCESSO DE SÍNTESE DE GLICOSE A PARTIR DE COMPOSTOS NÃO GLICÍDICOS OCORRÊNCIA: Citosol do
Metabolismo de aminoácidos de proteínas
 Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 12.09.2012 1 Introdução As proteínas são a segunda maior fonte de estocagem de energia no corpo; O maior estoque de proteínas
Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 12.09.2012 1 Introdução As proteínas são a segunda maior fonte de estocagem de energia no corpo; O maior estoque de proteínas
Membrana interna. Cristas. Matriz Membrana externa. P i P i P i. 7,3 kcal/mol 7,3 kcal/mol 3,4 kcal/mol
 BIEERGÉTIA a célula milhares de compostos estão a ser sintetizados e degradados em simultâneo. Metabolismo: é o conjunto de todas as reacções envolvidas na manutenção deste estado dinâmico. o geral as
BIEERGÉTIA a célula milhares de compostos estão a ser sintetizados e degradados em simultâneo. Metabolismo: é o conjunto de todas as reacções envolvidas na manutenção deste estado dinâmico. o geral as
PRINCIPAIS VIAS METABÓLICAS
 PRINCIPAIS VIAS METABÓLICAS DEGRADAÇÃO DO GLIGOGÊNIO GLICÓLISE VIA DAS PENTOSES FOSFATO GLICONEOGÊNESE SÍNTESE DE CORPOS CETÔNICOS DEGRADAÇÃO DE AMINOÁCIDOS E CICLO DA URÉIA CICLO DE KREBS Β-OXIDAÇÃO DE
PRINCIPAIS VIAS METABÓLICAS DEGRADAÇÃO DO GLIGOGÊNIO GLICÓLISE VIA DAS PENTOSES FOSFATO GLICONEOGÊNESE SÍNTESE DE CORPOS CETÔNICOS DEGRADAÇÃO DE AMINOÁCIDOS E CICLO DA URÉIA CICLO DE KREBS Β-OXIDAÇÃO DE
Profª Eleonora Slide de aula. Metabolismo de Carboidratos
 Metabolismo de Carboidratos Metabolismo de Carboidratos Profª Eleonora Slide de aula Condições de anaerobiose Glicose 2 Piruvato Ciclo do ácido cítrico Condições de anaerobiose 2 Etanol + 2 CO 2 Condições
Metabolismo de Carboidratos Metabolismo de Carboidratos Profª Eleonora Slide de aula Condições de anaerobiose Glicose 2 Piruvato Ciclo do ácido cítrico Condições de anaerobiose 2 Etanol + 2 CO 2 Condições
Metabolismo de Carboidratos
 Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Gliconeogênese - Ocorre principalmente no fígado; - Algumas das enzimas utilizadas na síntese
Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Gliconeogênese - Ocorre principalmente no fígado; - Algumas das enzimas utilizadas na síntese
Metabolismo celular. É o conjunto de todas as reacções químicas que ocorrem numa célula.
 FERMENTAÇÃO Metabolismo celular 3 É o conjunto de todas as reacções químicas que ocorrem numa célula. Metabolismo celular 4 Anabolismo reacções de síntese de moléculas complexas a partir de moléculas simples.
FERMENTAÇÃO Metabolismo celular 3 É o conjunto de todas as reacções químicas que ocorrem numa célula. Metabolismo celular 4 Anabolismo reacções de síntese de moléculas complexas a partir de moléculas simples.
Metabolismo e Regulação
 Metabolismo e Regulação PRBLEMAS - Série 1 Soluções 2009/2010 idratos de Carbono (Revisão) e Metabolismo Central 1 R: (α 1 4) (lineares) Ο (α1 6) (pontos de ramificação) 2. R: Locais de glicosilação são
Metabolismo e Regulação PRBLEMAS - Série 1 Soluções 2009/2010 idratos de Carbono (Revisão) e Metabolismo Central 1 R: (α 1 4) (lineares) Ο (α1 6) (pontos de ramificação) 2. R: Locais de glicosilação são
FISIOLOGIA VEGETAL 24/10/2012. Respiração. Respiração. Respiração. Substratos para a respiração. Mas o que é respiração?
 Respiração Mas o que é respiração? FISIOLOGIA VEGETAL Respiração É o processo pelo qual compostos orgânicos reduzidos são mobilizados e subsequentemente oxidados de maneira controlada É um processo de
Respiração Mas o que é respiração? FISIOLOGIA VEGETAL Respiração É o processo pelo qual compostos orgânicos reduzidos são mobilizados e subsequentemente oxidados de maneira controlada É um processo de
Oxidação parcial o que acontece com o piruvato?
 A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
Processos gerais no metabolismo proteico e síntese de aminoácidos
 Processos gerais no metabolismo proteico e síntese de aminoácidos Índice 1- A taxa de renovação das proteínas endógenas o turnover proteico... 1 2- Hidrólise das proteínas endógenas e das proteínas da
Processos gerais no metabolismo proteico e síntese de aminoácidos Índice 1- A taxa de renovação das proteínas endógenas o turnover proteico... 1 2- Hidrólise das proteínas endógenas e das proteínas da
Síntese e degradação de bases púricas e pirimídicas
 Síntese e degradação de bases púricas e pirimídicas 1- Os nucleotídeos contêm resíduos de ácido fosfórico, de um açúcar (em geral uma pentose: ribose ou 2'-desoxiribose) e de uma base púrica ou pirimídica.
Síntese e degradação de bases púricas e pirimídicas 1- Os nucleotídeos contêm resíduos de ácido fosfórico, de um açúcar (em geral uma pentose: ribose ou 2'-desoxiribose) e de uma base púrica ou pirimídica.
Ciclo de Krebs ou Ciclo do ácido cítrico. Prof. Liza Felicori
 Ciclo de Krebs ou Ciclo do ácido cítrico Prof. Liza Felicori VISÃO GERAL Em circunstâncias aeróbicas piruvato é descarboxilado CO 2 C4 + C2 C6 C6 C6 C6 C5 CO 2 CO 2 C5 C4 C4 C4 C4 NAD+ & FAD 3 Íons H-
Ciclo de Krebs ou Ciclo do ácido cítrico Prof. Liza Felicori VISÃO GERAL Em circunstâncias aeróbicas piruvato é descarboxilado CO 2 C4 + C2 C6 C6 C6 C6 C5 CO 2 CO 2 C5 C4 C4 C4 C4 NAD+ & FAD 3 Íons H-
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICÓLISE AERÓBICA. Ciclo de Krebs e Fosforilação Oxidativa. Profa.
 Universidade Federal do Pampa Campus Itaqui Bioquímica GLICÓLISE AERÓBICA Ciclo de Krebs e Fosforilação Oxidativa Profa. Marina Prigol 1 Glicólise Anaeróbica RESPIRAÇÃO CELULAR ou GLICÓLISE AERÓBICA:
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICÓLISE AERÓBICA Ciclo de Krebs e Fosforilação Oxidativa Profa. Marina Prigol 1 Glicólise Anaeróbica RESPIRAÇÃO CELULAR ou GLICÓLISE AERÓBICA:
Introdução ao Metabolismo Microbiano
 Introdução ao Metabolismo Microbiano METABOLISMO DEFINIÇÃO: Grego: metabole = mudança, transformação; Toda atividade química realizada pelos organismos; São de dois tipos: Envolvem a liberação de energia:
Introdução ao Metabolismo Microbiano METABOLISMO DEFINIÇÃO: Grego: metabole = mudança, transformação; Toda atividade química realizada pelos organismos; São de dois tipos: Envolvem a liberação de energia:
MANUAL DA DISCIPLINA DE BIOQUÍMICA CURSO DE FISIOTERAPIA
 MANUAL DA DISCIPLINA DE BIOQUÍMICA CURSO DE FISIOTERAPIA 2017 MÓDULO 2 METABOLISMO 1 Introdução ao Metabolismo METABOLISMO Tópicos para estudo (em casa): 1- Dê as principais características do ser vivo.
MANUAL DA DISCIPLINA DE BIOQUÍMICA CURSO DE FISIOTERAPIA 2017 MÓDULO 2 METABOLISMO 1 Introdução ao Metabolismo METABOLISMO Tópicos para estudo (em casa): 1- Dê as principais características do ser vivo.
Integração de Metabolismo.
 Integração de Metabolismo http://www.expasy.ch/cgi-bin/show_thumbnails.pl Princípios comuns governam o metabolismo em todos os seres vivos: Toda a regulação metabólica utiliza mecanismos similares: Principais
Integração de Metabolismo http://www.expasy.ch/cgi-bin/show_thumbnails.pl Princípios comuns governam o metabolismo em todos os seres vivos: Toda a regulação metabólica utiliza mecanismos similares: Principais
Lipídeos e ácidos graxos
 Lipídeos e ácidos graxos Tópicos de Estudo Lipídeos Lipoproteínas Passos da -oxidação Regulação em estados absortivos, fome e exercício Lipídeos que contem ácidos graxos Ácidos graxos e triacilgliceróis
Lipídeos e ácidos graxos Tópicos de Estudo Lipídeos Lipoproteínas Passos da -oxidação Regulação em estados absortivos, fome e exercício Lipídeos que contem ácidos graxos Ácidos graxos e triacilgliceróis
Metabolismo de Carboidratos
 Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Carboidratos Três maiores classes de carboidratos Monossacarídeos- são carboidratos não polimerizados;
Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Carboidratos Três maiores classes de carboidratos Monossacarídeos- são carboidratos não polimerizados;
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA COMO AS CÉLULAS SINTETIZAM ATP
 CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
A síndrome do overtraining : características metabólicas da fadiga muscular crônica.
 Texto de apoio ao curso de Especialização Atividade física adaptada e saúde Prof. Dr. Luzimar Teixeira A síndrome do overtraining : características metabólicas da fadiga muscular crônica. A síndrome do
Texto de apoio ao curso de Especialização Atividade física adaptada e saúde Prof. Dr. Luzimar Teixeira A síndrome do overtraining : características metabólicas da fadiga muscular crônica. A síndrome do
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa
 OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
Catabolismo dos aminoácidos 1 e 2 (duas aulas de grupo)
 Catabolismo dos aminoácidos 1 e 2 (duas aulas de grupo) Catabolismo dos aminoácidos; Rui Fontes 1- No decurso do seu catabolismo os aminoácidos perdem os seus átomos de azoto que, na sua maioria, são incorporados
Catabolismo dos aminoácidos 1 e 2 (duas aulas de grupo) Catabolismo dos aminoácidos; Rui Fontes 1- No decurso do seu catabolismo os aminoácidos perdem os seus átomos de azoto que, na sua maioria, são incorporados
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2010/2011. Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2010/2011 Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 7ª AULA TEÓRICO-PRÁTICA
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2010/2011 Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 7ª AULA TEÓRICO-PRÁTICA
5/4/2011. Metabolismo. Vias Metabólicas. Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos).
 Metabolismo Vias Metabólicas Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos). 1 Endergônico Exergônico Catabolismo Durante o catabolismo de carboidratos,
Metabolismo Vias Metabólicas Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos). 1 Endergônico Exergônico Catabolismo Durante o catabolismo de carboidratos,
Processos gerais e síntese de aminoácidos
 Processos gerais e síntese de aminoácidos 1- Um determinado número de moléculas de cada proteína endógena sofre hidrólise durante um dia mas, em geral, um número equivalente é sintetizado. A percentagem
Processos gerais e síntese de aminoácidos 1- Um determinado número de moléculas de cada proteína endógena sofre hidrólise durante um dia mas, em geral, um número equivalente é sintetizado. A percentagem
Como é que as células extraem energia e poder redutor do ambiente? Como é que as células sintetizam as unidades das macromoléculas?
 Metabolismo Como é que as células extraem energia e poder redutor do ambiente? Como é que as células sintetizam as unidades das macromoléculas? Os seres vivos precisam de energia para: Realização de trabalho
Metabolismo Como é que as células extraem energia e poder redutor do ambiente? Como é que as células sintetizam as unidades das macromoléculas? Os seres vivos precisam de energia para: Realização de trabalho
1. Produção de Acetil-CoA. 2. Oxidação de Acetil-CoA. 3. Transferência de elétrons e fosforilação oxidativa
 CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA 2. Oxidação de Acetil-CoA 3. Transferência de elétrons e fosforilação oxidativa CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA
CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA 2. Oxidação de Acetil-CoA 3. Transferência de elétrons e fosforilação oxidativa CICLO DE KREBS OU DO ÁCIDO CÍTRICO 1. Produção de Acetil-CoA
Gliconeogénese. glicose-6-p + H 2 O glicose + Pi (1)
 Gliconeogénese 1- A palavra gliconeogénese é, num sentido mais estrito, usada para designar colectivamente o conjunto de processos pelos quais o organismo pode converter substâncias não glicídicas (como
Gliconeogénese 1- A palavra gliconeogénese é, num sentido mais estrito, usada para designar colectivamente o conjunto de processos pelos quais o organismo pode converter substâncias não glicídicas (como
Glicólise. Professora Liza Felicori
 Glicólise Professora Liza Felicori Glicose Glicose (combustível metabólico) Fígado: Serve como tampão para manter o nível de glicose no sangue (liberação controlada de glicose) Glicose GLICOGÊNIO Estoque
Glicólise Professora Liza Felicori Glicose Glicose (combustível metabólico) Fígado: Serve como tampão para manter o nível de glicose no sangue (liberação controlada de glicose) Glicose GLICOGÊNIO Estoque
Metabolismo e Regulação
 Metabolismo e Regulação PROBLEMAS - Série 4 Perguntas de Exames Tipo Soluções Licenciatura em Bioquímica Licenciatura em Biologia Celular e Molecular Licenciatura em Química Aplicada 2010/2011 1 Perguntas
Metabolismo e Regulação PROBLEMAS - Série 4 Perguntas de Exames Tipo Soluções Licenciatura em Bioquímica Licenciatura em Biologia Celular e Molecular Licenciatura em Química Aplicada 2010/2011 1 Perguntas
O ciclo de Krebs ou do ácido cítrico
 O ciclo de Krebs ou do ácido cítrico O ciclo de Krebs ou do ácido cítrico; Rui Fontes Índice 1- O ciclo de Krebs é uma via metabólica central no metabolismo oxidativo de todos os nutrientes...1 2- As enzimas
O ciclo de Krebs ou do ácido cítrico O ciclo de Krebs ou do ácido cítrico; Rui Fontes Índice 1- O ciclo de Krebs é uma via metabólica central no metabolismo oxidativo de todos os nutrientes...1 2- As enzimas
Processo de obtenção de energia das células respiração celular
 Processo de obtenção de energia das células respiração celular Lipídeos de armazenamento (Gorduras e óleos) Substâncias que originam ácidos graxos e usadas como moléculas que armazenam energia nos seres
Processo de obtenção de energia das células respiração celular Lipídeos de armazenamento (Gorduras e óleos) Substâncias que originam ácidos graxos e usadas como moléculas que armazenam energia nos seres
Glicogênese, Glicogenólise e Gliconeogênese. Profa. Alessandra Barone
 Glicogênese, Glicogenólise e Gliconeogênese Profa. Alessandra Barone www.profbio.com.br Polissacarídeo de reserva animal Constituído por moléculas de α-d-glicose ligadas entre si por ligações glicosídicas
Glicogênese, Glicogenólise e Gliconeogênese Profa. Alessandra Barone www.profbio.com.br Polissacarídeo de reserva animal Constituído por moléculas de α-d-glicose ligadas entre si por ligações glicosídicas
A mitocôndria oxida combustíveis para gerar energia, em analogia ao processo pelo qual as usinas de força utilizam os combustíveis para gerar energia
 A mitocôndria oxida combustíveis para gerar energia, em analogia ao processo pelo qual as usinas de força utilizam os combustíveis para gerar energia elétrica Micrografia eletrônica de uma mitocôndria
A mitocôndria oxida combustíveis para gerar energia, em analogia ao processo pelo qual as usinas de força utilizam os combustíveis para gerar energia elétrica Micrografia eletrônica de uma mitocôndria
METABOLISMO DE NUCLEOTÍDEOS ou ÀCIDOS BILIARES UNIDADE 5
 METABOLISMO DE NUCLEOTÍDEOS ou ÀCIDOS BILIARES UNIDADE 5 Nucleotídeos = ribonucleosídeos e desoxiribonucleotídeos fosfato. transporte de intermediários ativados na síntese de carboidratos, lipídeos e proteínas
METABOLISMO DE NUCLEOTÍDEOS ou ÀCIDOS BILIARES UNIDADE 5 Nucleotídeos = ribonucleosídeos e desoxiribonucleotídeos fosfato. transporte de intermediários ativados na síntese de carboidratos, lipídeos e proteínas
Metabolismo CO 2 + H 2 O O 2 + CH 2 O
 Metabolismo CO 2 + H 2 O O 2 + CH 2 O Glicólise Glicólise A via de Embden-Meyerhof (Warburg) Essencialmente todas as células executam a glicólise Consiste em dez reacções iguais em todas as células
Metabolismo CO 2 + H 2 O O 2 + CH 2 O Glicólise Glicólise A via de Embden-Meyerhof (Warburg) Essencialmente todas as células executam a glicólise Consiste em dez reacções iguais em todas as células
Sistema glicolítico ou metabolismo anaeróbio lático
 Sistema glicolítico ou metabolismo anaeróbio lático Quando a molécula de glicose entra na célula para ser utilizada como energia, sofre uma série de reações químicas que coletivamente recebe o nome de
Sistema glicolítico ou metabolismo anaeróbio lático Quando a molécula de glicose entra na célula para ser utilizada como energia, sofre uma série de reações químicas que coletivamente recebe o nome de
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Semana 12 Respiração Celular
 Semana 12 Respiração Celular Prof. Saul Carvalho Respiração Celular Extração de energia química de substâncias orgânicas (carboidratos e lipídios) Principalmente quebra da Glicose Gera energia celular
Semana 12 Respiração Celular Prof. Saul Carvalho Respiração Celular Extração de energia química de substâncias orgânicas (carboidratos e lipídios) Principalmente quebra da Glicose Gera energia celular
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA COMO AS CÉLULAS SINTETIZAM ATP
 CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
CADEIA DE TRANSPORTE DE ELÉTRONS E FOSFORILAÇÃO OXIDATIVA OU COMO AS CÉLULAS SINTETIZAM ATP SINTETIZAM ATP ÀS CUSTAS DA OXIDAÇÃO DAS COENZIMAS NADH E FADH 2 PELO OXIGÊNIO AS COENZIMAS REDUZIDAS SÃO PRODUZIDAS
NUTRIÇÃO DE CÃES E GATOS
 NUTRIÇÃO DE CÃES E GATOS IMPORTÂNCIA Conhecer fundamentos básicos de nutrição avaliar dietas e alimentos Interações entre nutrientes e o animal Exigências Cães e gatos Quantidade diária de nutrientes Manejo
NUTRIÇÃO DE CÃES E GATOS IMPORTÂNCIA Conhecer fundamentos básicos de nutrição avaliar dietas e alimentos Interações entre nutrientes e o animal Exigências Cães e gatos Quantidade diária de nutrientes Manejo
Processos gerais no metabolismo proteico e síntese de aminoácidos
 Processos gerais no metabolismo proteico e síntese de aminoácidos 1- Um determinado número de moléculas de cada proteína endógena sofre hidrólise durante um dia mas, nos indivíduos adultos saudáveis, um
Processos gerais no metabolismo proteico e síntese de aminoácidos 1- Um determinado número de moléculas de cada proteína endógena sofre hidrólise durante um dia mas, nos indivíduos adultos saudáveis, um
A energética celular:
 A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
Mobilização e Oxidação de Lipídeos
 Fontes de ácidos Graxos: Mobilização e xidação de Lipídeos 1. Gorduras da alimentação; 2. Gorduras armazenadas; Fernanda Malagutti Tomé 3. Gorduras recém-sintetizadas. s vertebrados utilizam as três fontes.
Fontes de ácidos Graxos: Mobilização e xidação de Lipídeos 1. Gorduras da alimentação; 2. Gorduras armazenadas; Fernanda Malagutti Tomé 3. Gorduras recém-sintetizadas. s vertebrados utilizam as três fontes.
Organelas Produtoras de energia
 Professora Priscila F Binatto Citologia - Maio/2015 CAP. 9 METABOLISMO ENERGÉTICO: RESPIRAÇÃO AERÓBIA E FERMENTAÇÃO Organelas Produtoras de energia Mitocôndrias Organização Morfológica Função Respiração
Professora Priscila F Binatto Citologia - Maio/2015 CAP. 9 METABOLISMO ENERGÉTICO: RESPIRAÇÃO AERÓBIA E FERMENTAÇÃO Organelas Produtoras de energia Mitocôndrias Organização Morfológica Função Respiração
Epinefrina, glucagon e insulina. Hormônios com papéis fundamentais na regulação do metabolismo
 Epinefrina, glucagon e insulina Hormônios com papéis fundamentais na regulação do metabolismo Epinefrina ou adrenalina Estímulos para a secreção de epinefrina: Perigos reais ou imaginários Exercício físico
Epinefrina, glucagon e insulina Hormônios com papéis fundamentais na regulação do metabolismo Epinefrina ou adrenalina Estímulos para a secreção de epinefrina: Perigos reais ou imaginários Exercício físico
Aula de Bioquímica II SQM Ciclo do Ácido Cítrico
 Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Tema: Ciclo do Ácido Cítrico Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química
Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Tema: Ciclo do Ácido Cítrico Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química
ph do sangue arterial = 7.4
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
BIOSSÍNTESE DE ÁCIDOS GRAXOS E REGULAÇÃO DO METABOLISMO DE GORDURAS
 BIOSSÍNTESE DE ÁCIDOS GRAXOS E REGULAÇÃO DO METABOLISMO DE GORDURAS Se carboidratos, gorduras e proteínas são consumidas em quantidades que excedam as necessidades energéticas, o excesso será armazenado
BIOSSÍNTESE DE ÁCIDOS GRAXOS E REGULAÇÃO DO METABOLISMO DE GORDURAS Se carboidratos, gorduras e proteínas são consumidas em quantidades que excedam as necessidades energéticas, o excesso será armazenado
Profa Alessandra Barone.
 Profa Alessandra Barone www.profbio.com.br Bioenergética Parte da bioquímica que trata do estudo dos fenômenos energéticos nos seres vivos, bem como sua forma de obtenção, armazenamento, mobilização e
Profa Alessandra Barone www.profbio.com.br Bioenergética Parte da bioquímica que trata do estudo dos fenômenos energéticos nos seres vivos, bem como sua forma de obtenção, armazenamento, mobilização e
21/10/2014. Referências Bibliográficas. Produção de ATP. Substratos Energéticos. Lipídeos Características. Lipídeos Papel no Corpo
 Referências Bibliográficas Livro: McArdle & Katch & Katch. Fisiologia do Exercício: Metabolismo de Lipídeos Durante o Exercício Físico Aeróbico Prof. Dr. Paulo Rizzo Ramires Escola de Educação Física e
Referências Bibliográficas Livro: McArdle & Katch & Katch. Fisiologia do Exercício: Metabolismo de Lipídeos Durante o Exercício Físico Aeróbico Prof. Dr. Paulo Rizzo Ramires Escola de Educação Física e
Metabolismo de Glicídios
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Doenças Metabólicas Metabolismo de Glicídios Lucas Balinhas Mozer Ávila Patrícia Mattei Uriel Londero Pelotas, abril 2015
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Doenças Metabólicas Metabolismo de Glicídios Lucas Balinhas Mozer Ávila Patrícia Mattei Uriel Londero Pelotas, abril 2015
Exercícios de Proteínas
 Exercícios de Proteínas 1. As são compostos formados por unidos (as) por ligações e as são orgânicos, de natureza sensíveis às variações de temperatura. Os termos que corretamente preenchem as lacunas
Exercícios de Proteínas 1. As são compostos formados por unidos (as) por ligações e as são orgânicos, de natureza sensíveis às variações de temperatura. Os termos que corretamente preenchem as lacunas
Pode ser polimerizada, estocada, transportada e liberada rapidamente quando o organismo precisa de energia ou para compor estruturas especiais
 Pode ser polimerizada, estocada, transportada e liberada rapidamente quando o organismo precisa de energia ou para compor estruturas especiais Precursor de intermediários metabólicos em várias reações
Pode ser polimerizada, estocada, transportada e liberada rapidamente quando o organismo precisa de energia ou para compor estruturas especiais Precursor de intermediários metabólicos em várias reações
aaa Bento Gonçalves/RS 1
 a FISIOLOGIA E NUTRIÇÃO DA VIDEIRA aaa Respiração Celular Prof. Leonardo Cury Bento Gonçalves/RS 1 Equação Geral (Respiração celular (Aeróbica)) ATP C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O G = + 2.880 kj -Compostos
a FISIOLOGIA E NUTRIÇÃO DA VIDEIRA aaa Respiração Celular Prof. Leonardo Cury Bento Gonçalves/RS 1 Equação Geral (Respiração celular (Aeróbica)) ATP C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O G = + 2.880 kj -Compostos
Processo de obtenção de energia das células respiração celular
 Processo de obtenção de energia das células respiração celular Macromolécula mais abundante nas células Grande variedade (tamanho e função) Pequenos peptídeos a grandes cadeias com PM alto Diversidade
Processo de obtenção de energia das células respiração celular Macromolécula mais abundante nas células Grande variedade (tamanho e função) Pequenos peptídeos a grandes cadeias com PM alto Diversidade
TIPOS DE ENERGIAS E FORMAS DE ARMAZENAMENTO DE ENERGIA NO CORPO As fontes energéticas são encontradas nas células musculares e em algumas partes do co
 BIOENERGÉTICA E TREINAMENTO DESPORTIVO Bioenergética é a ciência que estuda os sistemas energéticos nos organismos vivos. TIPOS DE ENERGIAS E FORMAS DE ARMAZENAMENTO DE ENERGIA NO CORPO Os sistemas metabólicos
BIOENERGÉTICA E TREINAMENTO DESPORTIVO Bioenergética é a ciência que estuda os sistemas energéticos nos organismos vivos. TIPOS DE ENERGIAS E FORMAS DE ARMAZENAMENTO DE ENERGIA NO CORPO Os sistemas metabólicos
Gliconeogénese. glicose-6-fosfato + H 2 O glicose + Pi
 Gliconeogénese 1- A palavra gliconeogénese é, num sentido mais estrito, usada para designar coletivamente o conjunto de processos pelos quais o organismo pode converter substâncias não glicídicas (como
Gliconeogénese 1- A palavra gliconeogénese é, num sentido mais estrito, usada para designar coletivamente o conjunto de processos pelos quais o organismo pode converter substâncias não glicídicas (como
CITOLOGIA IV (UECE/ENEM) Profa Eduarda de Souza
 CITOLOGIA IV (UECE/ENEM) Profa Eduarda de Souza Alimentos e Energia Ligações químicas Metabolismo Metabolismo capacidade de transformar substâncias de acordo com o interesse Anabolismo: produção de novas
CITOLOGIA IV (UECE/ENEM) Profa Eduarda de Souza Alimentos e Energia Ligações químicas Metabolismo Metabolismo capacidade de transformar substâncias de acordo com o interesse Anabolismo: produção de novas
BIOENERGÉTICA. O que é Bioenergética? ENERGIA. Trabalho Biológico
 O que é Bioenergética? BIOENERGÉTICA Ramo da biologia próximo da bioquímica que estuda as transformações de energia pelos seres vivos. (dicionário Houaiss) Prof. Mauro Batista Parte da fisiologia que estuda
O que é Bioenergética? BIOENERGÉTICA Ramo da biologia próximo da bioquímica que estuda as transformações de energia pelos seres vivos. (dicionário Houaiss) Prof. Mauro Batista Parte da fisiologia que estuda
Processos gerais no metabolismo proteico e síntese de aminoácidos
 Processos gerais no metabolismo proteico e síntese de aminoácidos 1- Um determinado número de moléculas de cada proteína endógena sofre hidrólise durante um dia mas, nos indivíduos adultos saudáveis, um
Processos gerais no metabolismo proteico e síntese de aminoácidos 1- Um determinado número de moléculas de cada proteína endógena sofre hidrólise durante um dia mas, nos indivíduos adultos saudáveis, um
7. OXIDAÇÕES BIOLÓGICAS
 7. OXIDAÇÕES BIOLÓGICAS 2 O que é a oxidação? É o processo pelo qual a matéria viva transforma em diferentes formas de energia atual a energia químico-potencial contida nas estruturas moleculares dos alimentos.
7. OXIDAÇÕES BIOLÓGICAS 2 O que é a oxidação? É o processo pelo qual a matéria viva transforma em diferentes formas de energia atual a energia químico-potencial contida nas estruturas moleculares dos alimentos.
Aula: 29 Temática: Metabolismo dos lipídeos parte I
 Aula: 29 Temática: Metabolismo dos lipídeos parte I Os lipídeos são armazenados em grandes quantidades como triglicerídeos neutros altamente insolúveis, tanto nos vegetais como nos animais. Eles podem
Aula: 29 Temática: Metabolismo dos lipídeos parte I Os lipídeos são armazenados em grandes quantidades como triglicerídeos neutros altamente insolúveis, tanto nos vegetais como nos animais. Eles podem
Faculdade Anhanguera Curso de Graduação em Educação Física
 Faculdade Anhanguera Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Mês de agosto Conteúdo 9 Unidade 1 16 Unidade 1 23 Unidade 1 30
Faculdade Anhanguera Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Mês de agosto Conteúdo 9 Unidade 1 16 Unidade 1 23 Unidade 1 30
Fisiologia do Exercício
 Fisiologia do Exercício REAÇÕES QUÍMICAS Metabolismo inclui vias metabólicas que resultam na síntese de moléculas Metabolismo inclui vias metabólicas que resultam na degradação de moléculas Reações anabólicas
Fisiologia do Exercício REAÇÕES QUÍMICAS Metabolismo inclui vias metabólicas que resultam na síntese de moléculas Metabolismo inclui vias metabólicas que resultam na degradação de moléculas Reações anabólicas
O ciclo de Krebs ou do ácido cítrico
 O ciclo de Krebs ou do ácido cítrico Ciclo de Krebs ou do ácido cítrico; Rui Fontes 1- Por acção das enzimas da glicólise a glicose é, no citoplasma das células, parcialmente oxidada a piruvato. O piruvato
O ciclo de Krebs ou do ácido cítrico Ciclo de Krebs ou do ácido cítrico; Rui Fontes 1- Por acção das enzimas da glicólise a glicose é, no citoplasma das células, parcialmente oxidada a piruvato. O piruvato
BIOENERGÉTICA. O que é Bioenergética? ENERGIA. Ramo da biologia próximo da bioquímica que
 O que é Bioenergética? BIOENERGÉTICA Ramo da biologia próximo da bioquímica que estuda as transformações de energia pelos seres vivos. (dicionário Houaiss) Prof. Renato Barroso renato.barroso@terra.com.br
O que é Bioenergética? BIOENERGÉTICA Ramo da biologia próximo da bioquímica que estuda as transformações de energia pelos seres vivos. (dicionário Houaiss) Prof. Renato Barroso renato.barroso@terra.com.br
PROTEÍNA. Lisina (ARC 1981) Aminoácidos Essenciais. Aminoácidos Essenciais - suínos. Fenilalanina Arginina
 omposição de um Protetor Hepático comercial PROTEÍNA Fórmula: Aspartato de L-ornitina...2,0 g loridrato de L-arginina...7,5 g L-citrulina...0,5 g Acetil metionina...1,0 g loridrato de colina...1,0 g Levulose...10,0
omposição de um Protetor Hepático comercial PROTEÍNA Fórmula: Aspartato de L-ornitina...2,0 g loridrato de L-arginina...7,5 g L-citrulina...0,5 g Acetil metionina...1,0 g loridrato de colina...1,0 g Levulose...10,0
A Diabetes É uma doença metabólica Caracteriza-se por um aumento dos níveis de açúcar no sangue hiperglicemia. Vários factores contribuem para o apare
 Diabetes Mellitus Tipo I Licenciatura em Bioquímica 1º ano 2005/2006 Duarte Nuno Amorim dos Santos A Diabetes É uma doença metabólica Caracteriza-se por um aumento dos níveis de açúcar no sangue hiperglicemia.
Diabetes Mellitus Tipo I Licenciatura em Bioquímica 1º ano 2005/2006 Duarte Nuno Amorim dos Santos A Diabetes É uma doença metabólica Caracteriza-se por um aumento dos níveis de açúcar no sangue hiperglicemia.
DIGESTÃO DOS LIPÍDIOS
 DIGESTÃO DOS LIPÍDIOS - A maior parte das gorduras da dieta são predominantemente triacilglicerois 80% Função da bile: Sais biliares Quebra a gordura, aumentando a área total disponível à ação enzimática
DIGESTÃO DOS LIPÍDIOS - A maior parte das gorduras da dieta são predominantemente triacilglicerois 80% Função da bile: Sais biliares Quebra a gordura, aumentando a área total disponível à ação enzimática
21/11/2016. Destinos do Piruvato na Célula. Respiração Celular X Combustão. Respiração Celular
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Destinos do Piruvato na Célula Curso Engenharia Química Disciplina Bioquimica Metabolismo de Carboidratos Ciclo do
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Destinos do Piruvato na Célula Curso Engenharia Química Disciplina Bioquimica Metabolismo de Carboidratos Ciclo do
Graxos. Metabolismo dos Lipídios. Oxidação. Degradação dos Triacilgliceróis is (TG) do Tecido Adiposo. Tecido Adiposo. Tecido Adiposo.
 Lipóle (β-oxida( oxidação) Cetogênese Síntese de Ácidos Graxos Alexandre Havt Metabolmo dos Lipídios Fonte de obtenção Dieta Triacilgliceró Síntese endógena Transporte Excesso de Carboidratos, Proteínas
Lipóle (β-oxida( oxidação) Cetogênese Síntese de Ácidos Graxos Alexandre Havt Metabolmo dos Lipídios Fonte de obtenção Dieta Triacilgliceró Síntese endógena Transporte Excesso de Carboidratos, Proteínas
BIOLOGIA - 1 o ANO MÓDULO 18 RESPIRAÇÃO CELULAR AERÓBIA
 BIOLOGIA - 1 o ANO MÓDULO 18 RESPIRAÇÃO CELULAR AERÓBIA glicose 2NAD 2(ADP + P) 2NAD 2 2 ATP ácido pirúvico (3C) ácido pirúvico (3C) Como pode cair no enem? (UFF) Mediu-se, em diferentes instantes
BIOLOGIA - 1 o ANO MÓDULO 18 RESPIRAÇÃO CELULAR AERÓBIA glicose 2NAD 2(ADP + P) 2NAD 2 2 ATP ácido pirúvico (3C) ácido pirúvico (3C) Como pode cair no enem? (UFF) Mediu-se, em diferentes instantes
Miologia. Tema C PROCESSOS ENERGÉTICOS NO MÚSCULO ESQUELÉTICO
 PROCESSOS ENERGÉTICOS NO MÚSCULO ESQUELÉTICO 1 Necessidades energéticas da fibra muscular 2 Papel do ATP 3 Processos de ressíntese do ATP 3.1 Aeróbico 3.2 Anaeróbico alático e lático 4 Interação dos diferentes
PROCESSOS ENERGÉTICOS NO MÚSCULO ESQUELÉTICO 1 Necessidades energéticas da fibra muscular 2 Papel do ATP 3 Processos de ressíntese do ATP 3.1 Aeróbico 3.2 Anaeróbico alático e lático 4 Interação dos diferentes
Metabolismo e Regulação
 Metabolismo e Regulação PROBLEMAS - Série 1 Licenciatura em Bioquímica Licenciatura em Biologia Celular e Molecular Licenciatura em Química Aplicada Hidratos de Carbono e Metabolismo Central (Revisão)
Metabolismo e Regulação PROBLEMAS - Série 1 Licenciatura em Bioquímica Licenciatura em Biologia Celular e Molecular Licenciatura em Química Aplicada Hidratos de Carbono e Metabolismo Central (Revisão)
Reações de redox nos seres vivos. nutrientes
 Reações de redox nos seres vivos As reações de oxi-redução (ou redox) costumam definir-se como reações em que há transferência de eletrões. nutrientes ruifonte@med.up.pt Departamento de Bioquímica da Faculdade
Reações de redox nos seres vivos As reações de oxi-redução (ou redox) costumam definir-se como reações em que há transferência de eletrões. nutrientes ruifonte@med.up.pt Departamento de Bioquímica da Faculdade
BIOQUÍMICA GERAL SEMESTRE 1. Ano lectivo Ficha Formativa. Prof. Eng. Nuno Costa
 1 BIQUÍMIA GERAL SEMESTRE 1 Ano lectivo 2009-2010 Ficha Formativa Prof. Eng. Nuno osta ESLA SUPERIR DE ENFERMAGEM S. JSÉ DE LUNY BIÓQUIMIA GERAL 2009-2010 2 1. Quando [S] = 1/7 K M, a velocidade de uma
1 BIQUÍMIA GERAL SEMESTRE 1 Ano lectivo 2009-2010 Ficha Formativa Prof. Eng. Nuno osta ESLA SUPERIR DE ENFERMAGEM S. JSÉ DE LUNY BIÓQUIMIA GERAL 2009-2010 2 1. Quando [S] = 1/7 K M, a velocidade de uma
