MATERIAL AUXILIAR PARA AULAS PRÁTICAS
|
|
|
- Tânia Lage Domingos
- 7 Há anos
- Visualizações:
Transcrição
1 DISCIPLINA DE BROMATOLOGIA CURSOS: CIÊNCIA E TECNOLOGIA DE ALIMENTOS e NUTRIÇÃO Prof. Dr. Tiago André Kaminski MATERIAL AUXILIAR PARA AULAS PRÁTICAS Última atalização: agosto de 2015 SUMÁRIO PRÉ-SECAGEM... 5 DETERMINAÇÃO DA UMIDADE... 6 DETERMINAÇÃO DA ATIVIDADE DE ÁGUA DETERMINAÇÃO DE AÇÚCARES REDUTORES PELO MÉTODO DE LANE & EYNON DETERMINAÇÃO DE AMIDO DETERMINAÇÃO DA FIBRA BRUTA DETERMINAÇÃO DE FIBRA PELO MÉTODO ENZIMÁTICO DETERMINAÇÃO DA FRAÇÃO EXTRATO ETÉREO PELO MÉTODO DE SOXHLET DETERMINAÇÃO DE LIPÍDIOS PELO MÉTODO DE BLIGH & DYER DETERMINAÇÃO DE PROTEÍNA BRUTA PELO MÉTODO DE KJELDAHL DETERMINAÇÃO DE ÁCIDO ASCÓRBICO EM SUCOS PELO MÉTODO INTERLAB X DETERMINAÇÃO DA FRAÇÃO CINZAS TABELA DE COMPOSIÇÃO CENTESIMAL... 36
2 INTRODUÇÃO Os procedimentos apresentados são metodologias físico-químicas extensamente utilizadas na análise de alimentos. Estes procedimentos são baseados nas recomendações do Instituto Adolfo Lutz (2008) e Association of Official Analytical Chemists (2000), exceto quando citada outra fonte. Na maioria das aulas práticas, as metodologias serão adaptadas ao tempo de aula e às condições do laboratório. Mais considerações sobre os procedimentos adotados e recomendações oficiais serão feitas no decorrer das aulas práticas. ANÁLISE DE ALIMENTOS A análise de alimentos é realizada com finalidade de: Controle de qualidade de rotina Principalmente nas indústrias de alimentos, durante o recebimento de matérias-primas, monitoramento do armazenamento, produção e avaliação do produto final. Fiscalização Realizada por órgãos de controle e pesquisa para verificar o cumprimento da legislação em relação aos alimentos comercializados através de métodos analíticos, exatos e precisos e, obviamente, oficiais. Pesquisa Realizada no intuito de desenvolver ou adaptar métodos analíticos exatos, precisos, sensíveis, rápidos, eficientes, simples e de baixo custo na determinação dos componentes dos alimentos. Também é pré-requisito para confirmação da qualidade e viabilidade dos alimentos avaliados e/ou desenvolvidos. Rotulagem nutricional Exigida pela legislação (RESOLUÇÃO RDC n 360, de 23 de dezembro de 2003). AMOSTRAGEM E PREPARO DA AMOSTRA PARA ANÁLISE Amostra É uma porção limitada de material, selecionada de maneira que seja representativa das características essenciais do todo. A validade dos resultados de uma análise depende da representatividade da amostra. A amostra ideal é idêntica em todas as suas propriedades ao todo do qual foi tomada. Amostragem Processo que consiste numa série sucessiva de etapas visando a representatividade da amostra. Compreende três etapas principais: 1- Coleta da amostra bruta (amostragem grosseira) A amostra bruta deve ser uma réplica, em ponto reduzido do todo, tanto na distribuição 2
3 como na composição. Amostras diferem quanto às propriedades físicas, o que implica em diferentes modos de coleta. 2 - Redução da amostra bruta (nova amostragem) A amostra bruta é frequentemente grande demais para o trabalho de análise laboratorial, devendo ser reduzida. Esta redução varia com o tipo de produto a ser analisado. 3 - Preparo da amostra para análise A possibilidade de contaminações e mudanças no comportamento da amostra durante o preparo para análise deve ser considerada. O tipo de preparo depende das características da amostra e do método analítico envolvido. Para extração de um componente da amostra, muitas vezes é necessária uma preparação prévia para alcançar uma extração eficiente do componente em estudo. A maioria dos alimentos apresenta normas e recomendações de amostragem descritas em legislações específicas. Na pesquisa científica, a amostragem tem sua representatividade garantida, além da homogeneização, pelo número de tratamentos e repetições. Preservação da amostra O ideal seria analisar as amostras em estado fresco e o mais rapidamente possível. Como isto nem sempre isso é possível, a amostra deve ser preservada para fins de repetição das análises quando os resultados não forem conclusivos ou quando contestados. As maneiras mais relevantes de preservar a amostras são: Inativação enzimática (preservação do estado original dos componentes) Diminuição das alterações lipídicas (principalmente oxidação) Controle da oxidação dos componentes Controle do ataque microbiológico Manutenção da umidade (a amostra não deve perder nem ganhar umidade) Armazenamento da amostra Acondicionamento - Deve prevenir qualquer tipo de alteração nas amostras, considerando: - Estado físico do produto - Tipo de análise a ser realizada - Características individuais da amostra Lacragem Serve para evitar qualquer alteração no conteúdo da embalagem. Amostras oficiais e legais devem ser lacradas de tal maneira que não possam ser abertas sem quebrar/romper lacres. Rotulagem - As amostras devem ser embaladas e identificadas com rótulos contendo todas as informações necessárias para sua identificação, de modo a não serem confundidas. COMPOSIÇÃO CENTESIMAL A composição centesimal de um alimento representa a proporção em que as substâncias que o compõem aparecem em 100 g do alimento. Os grupos homogêneos de substâncias constituintes dos alimentos são: 3
4 - UMIDADE ou compostos voláteis a 105 C - CINZAS ou resíduo mineral fixo - LIPÍDIOS ou extrato etéreo - PROTEÍNAS - FIBRA (bruta ou alimentar) - CARBOIDRATOS (extrativos não nitrogenados, quando calculados por diferença) AMOSTRA INTEGRAL (AI) Pré-secagem MASSA PARCIALMENTE SECA (MPS) Umidade (105 C) Mufla (550 C) Kjeldhal (N total) MASSA SECA (MS) CINZAS PROTEÍNAS Soxhlet MASSA SECA DESENGORDURADA (MSD) Carboidratos (extrativos não nitrogenados) Fibra bruta ou alimentar* são obtidos pelo cálculo de 100 menos todos os demais parâmetros avaliados FIBRA * Técnica de fibra alimentar requer uma determinação de cinzas e proteínas residuais 4
5 PRÉ-SECAGEM A pré-secagem é importante em alimentos com alto teor de umidade (acima de 14%) para manter os constituintes da amostra em condições relativamente estáveis durante um maior período de tempo. Em alimentos com alto teor de umidade são favorecidas as reações de hidrólise, ação enzimática e desenvolvimento de microrganismos. Além destes inconvenientes, a elevada umidade é, muitas vezes, indesejável nas amostras de análise. MATERIAIS - Balança semi analítica (2 casas decimais) - Estufa ventilada a 60 C - Material para trituração grosseira das amostras - Pratos de alumínio - Moinho, liquidificador ou processador de alimentos - Colher ou espátula - Saco de polietileno ou pote plástico PROCEDIMENTO - Verificar se o material está limpo, seco e desprovido de partes não comestíveis - No caso de produtos de grande tamanho, cortar em pedaços de modo a aumentar a superfície de contato com o ar - Pesar o prato de alumínio vazio - Pesar entre 75 e 100 g da amostra integral (AI) no prato de alumínio - Levar à estufa e manter secagem durante 24 a 72 horas (o tempo depende da amostra, sendo que o término da pré-secagem é determinado quando o material apresenta aspecto seco ) - Retirar o prato com a massa parcialmente seca (MPS) da estufa - Deixar resfriar por aproximadamente 1 hora a temperatura ambiente - Pesar o prato com a MPS - Moer finamente o material e armazená-lo para análises posteriores - Calcular o percentual de MPS contido na AI EXEMPLO DE CÁLCULO Prato + AI Prato AI Prato + MPS Peso do prato MPS Em 150 g de AI 10 g MPS Em 100 g de AI X 157,5 g 7,5 g 150 g 17,5 g 7,5 g 10 g X = 6,67 g% de MPS na AI 5
6 DETERMINAÇÃO DA UMIDADE A determinação da umidade é uma das medidas mais importantes na análise de alimentos. Considerada como ponto de partida na análise de alimentos, é utilizada fundamentalmente na: - Determinação da Massa Seca (MS) - comparação do valor nutritivo de dois ou mais alimentos deve considerar o teor de água - Determinação da composição centesimal e estimativa do valor de carboidratos no cálculo por diferença - Avaliação do estágio de maturação de grãos - Valorização de alguns produtos - Avaliação das condições de armazenamento Os métodos para determinação de umidade são classificados em: 1 Métodos por secagem 2 Métodos por destilação 3 Métodos químicos 4 Métodos físicos 5 Equipamentos especiais para determinação da umidade 1 MÉTODOS POR SECAGEM 1.1 Secagem em estufas Baseia-se na remoção de água por aquecimento. Consiste em pesar uma quantidade definida de amostra numa cápsula previamente seca e tarada. A cápsula é colocada na estufa na temperatura indicada até evaporação completa da água, isto é, até o peso ficar constante. O conjunto cápsula + amostra é pesado após resfriamento em dessecador. O peso da água evaporada vai ser igual a diferença entre o peso da amostra úmida e o peso da amostra seca. A massa seca ou sólidos totais são calculados pela diferença entre o peso total da amostra e o peso da amostra seca. Na aula prática, nos deteremos apenas ao método gravimétrico a 105 C, por ser simples e mais utilizado na análise de alimentos. Mesmo considerado um método simples, há dificuldade na exatidão e precisão dos resultados, devido: - Separação incompleta da água do produto - Decomposição do produto, com liberação de água além da água livre - Evaporação de substâncias voláteis do alimento, computadas no valor da umidade Tipos de estufas: - Simples - Simples com ventilador - A vácuo (utilizada para amostras que se decompõem nas temperaturas das estufas simples) Tipos de cápsulas: Podem ser de porcelana, alumínio ou vidro. Ainda podem ser com ou sem tampa; esta é recomendada nos métodos oficiais, mas deve ficar aberta durante secagem na estufa e fechada durante resfriamento e pesagem. Cápsulas mais largas e menos profundas têm evaporação mais eficiente. Amostras: - Devem estar reduzidas a partículas de pequeno tamanho para facilitar evaporação da água 6
7 - Aplicação limitada às amostras no estado amorfo e líquido - Amostras líquidas devem ser previamente evaporadas em banho-maria até consistência pastosa, apenas então colocadas na estufa - Amostras açucaradas podem formar uma crosta dura superficial, impedindo a evaporação de água; nestes casos, recomenda-se a adição de areia, aresto ou pedra pome em pó, misturada com a amostra para aumentar a superfície de evaporação Condições de secagem: - A temperatura deve estar um pouco acima de 100 C para evaporação da água em estufa simples - No vácuo, a temperatura pode ser de 70 C, preservando a amostra e impedindo a formação de crostas 1.2 Secagem por radiação infravermelho Utiliza uma lâmpada de radiação infravermelho, diminuindo o tempo de secagem em até 1/3 do total. No entanto, os equipamentos disponíveis apresentam a limitação de secagem de apenas uma amostra por vez. É comum em balanças para determinação de umidade. 1.3 Secagem em forno micro-ondas É um método rápido e simples, mas ainda não é um método padrão. Consiste na perda de umidade por mudança de polaridade no campo elétrico, gerado por micro-ondas, fazendo com que haja atrito intermolecular e oscilação no próprio eixo das moléculas. A desidratação ocorre pela geração de calor dentro e através da amostra. 2 MÉTODOS POR DESTILAÇÃO Indicados para amostras com baixa quantidade de umidade e alto teor de compostos voláteis insolúveis em água, como óleos voláteis de ervas e condimentos. A amostra é colocada em um balão de destilação, ligado a um condensador, com solvente de densidade inferior (xileno, tolueno,...) ou ponto de ebulição inferior a água. A mistura é aquecida e os solventes condensados são coletados em tubos coletores graduados. 3 MÉTODOS QUÍMICOS 3.1 Reação de Karl Fischer O reagente de Karl Fischer é constituído de uma mistura de iodo, dióxido de enxofre e piridina em metanol, numa única solução ou em duas soluções separadas: Uma contendo iodo em metanol e outra contendo dióxido de enxofre e piridina em metanol. As soluções separadas são mais estáveis e reconstituem o reagente pela simples mistura. Pode determinar pequenas quantidades de água, embora o método não seja universalmente aplicável. As limitações de dosagens diretas podem ser contornadas através de tratamentos preliminares adequados às amostras. O ponto final é verificado eletrometricamente. 4 MÉTODOS FÍSICOS 7
8 4.1 Índice de refração Serve para determinar a umidade do mel, melado e outros doces. Universalmente é utilizada a refratometria a 20 C com leitura na escala interpretada através da tabela de Chatway. O aparelho mais indicado é o refratômetro de ABBE, com circulação de água a 20 C. 4.2 Densidade Muito utilizado para determinação de umidade no leite, através do método de Ackermann. Este método utiliza um disco de alumínio, que consta de dois discos sobrepostos. Um disco tem graduações correspondentes à densidade e outro tem duas graduações, correspondentes ao percentual de gordura e matéria seca. Desta forma, com o resultado da densidade em lactodensimetro e da gordura em butirômetro, pode ser estimado o valor do extrato seco no leite. 5 EQUIPAMENTOS ESPECIAIS PARA DETERMINAÇÃO DE UMIDADE Envolvem diversos princípios, mas tem substituído a execução de metodologias por fornecer resultados rápidos e confiáveis, se os equipamentos estiverem devidamente calibrados e forem bem manuseados. São muito importantes em determinações a campo e na liberação de matérias-primas. MATERIAIS - Estufa regulada a 105 C - Cápsula ou cadinho de porcelana - Dessecador com sílica - Tenaz - Balança analítica (4 casas decimais) - Espátula PROCEDIMENTO - Dessecar a cápsula em estufa a 105 C por, no mínimo, 3 horas - Resfriar a cápsula até temperatura ambiente em dessecador com sílica 8
9 - Pesar a cápsula em balança analítica (transportar com pinça ou tenaz, evitando o contato com a mão para não passar umidade e gordura à cápsula) - Pesar de 2 a 5 g de amostra na cápsula (com exatidão de 0,00xx) e levar a estufa a 105 C por 16 horas (overnight) - Técnicas oficiais recomendam pesar as amostras mais de uma vez, até o peso se manter constante entre duas pesagens consecutivas - Retirar a cápsula com a MS da estufa - Resfriar a cápsula até temperatura ambiente em dessecador com sílica - Pesar cápsula com MS (pesagem a quente não fornece um resultado exato), tomar nota do valor e calcular o percentual de umidade EXEMPLO DE CÁLCULO No caso de uma amostra que passou pela pré-secagem: Cadinho + MPS = 22,00 g Cadinho + MS = 21,7 g Peso do cadinho = 20,00 g Peso do cadinho = 20,00 g MPS = 2,00 g MS = 1,70 g Em 2,00 g de MPS 1,70 g de MS Em 100 g de MPS X X = 85,00 g% de MS na MPS Em 100 g de MPS 85,00 g de MS Em 6,67 g de MPS* Y * Dado obtido na prática de pré-secagem!!! Y = 5,67 g% de MS na AI Umidade = MS Umidade = 100 5,67 Umidade = 94,33% Amostra integral submetida diretamente à secagem: Em 2,00 g de AI 1,50 g de MS Em 100 g de AI X X = 75,00 g% de MS na AI Umidade = MS Umidade = ,00 Umidade = 25,00% 9
10 DETERMINAÇÃO DA ATIVIDADE DE ÁGUA A água contida nos alimentos encontra-se sob duas formas: livre e ligada. A água livre é a forma predominante no alimento, está fracamente ou não está ligada às estruturas moleculares do alimento é relativamente fácil de ser determinada pela maioria dos métodos. Funciona como solvente, permitindo o desenvolvimento de microrganismos e reações químicas, mas pode ser eliminada com facilidade. A água ligada, também chamada de combinada, está fortemente ligada ao substrato, porém representa um teor muito pequeno em relação ao total de água do alimento. Não pode ser utilizada como solvente, não permite o desenvolvimento de microrganismos e retarda reações químicas, além de ser de difícil remoção do alimento. Neste contexto, a atividade de água representa o teor de água livre (disponível) nos alimentos, ou seja, a intensidade das forças que unem a água com outros componentes não aquosos do alimento. A atividade de água estabelece uma estreita relação entre o teor de água livre de um alimento e sua conservação. A determinação de atividade de água pode ser realizada por diferentes métodos nos alimentos: - Em câmaras com sensor de umidade relativa (UR), ou seja, com uma atividade de água constante, controlada e conhecida, que estabelece uma relação de umidade relativa do equilíbrio entre o alimento e o solvente puro. - Acondicionamento do alimento em recipientes com soluções salinas saturadas, de atividade de água conhecida (LiCl = 0,11; MgCl 2 = 0,33; K 2 CO 3 = 0,43; Mg(NO 3 ) 2 = 0,53; NaCl = 0,75; K 2 SO 4 = 0,97; K 2 Cr 2 O 7 =0,98). Em soluções de menor atividade de água, o alimento perde peso e viceversa. - Em analisadores de feixe infravermelho focado em um pequeno espelho que determina a temperatura do ponto de orvalho da amostra, traduzida em atividade de água. Ponto de orvalho: É a temperatura em que uma determinada parcela de ar úmido deve ser arrefecida, a pressão atmosférica constante, para que o vapor de água seja condensado. É uma medida primária da pressão de vapor utilizada há décadas. O ponto de orvalho está associado com a umidade relativa: - Alta umidade relativa indica que o ponto de orvalho é próximo da temperatura do ar. 10
11 - Umidade relativa de 100% indica que o ponto de orvalho é igual à temperatura do ar (ar saturado de vapor de água). - Nunca o ponto de orvalho vai ser superior à temperatura do ar. - Se a umidade relativa permanecer constante e a temperatura aumentar, aumenta a capacidade do ar conter vapor de água. - Se a umidade relativa permanecer constante e a temperatura diminuir, reduz a capacidade do ar conter vapor de água, que condensa (fenômenos de geada, nevoeiro, chuva ou neve). Aumento da pressão, em temperatura constante do ar, provoca aumento no ponto de orvalho (fica mais próximo da temperatura do ar, aproximando a possibilidade de condensação). Na aula prática será utilizado o AquaLab, que é um psicrômetro que utiliza a técnica do ponto de orvalho em espelho resfriado para medida de atividade de água e apresenta as seguintes características: - faixa de leitura entre 0,03 e 1,00 - exatidão de ±0,003 - facilidade e rapidez de leitura (cerca de 5 minutos) - reprodutibilidade (diferentes usuários, diferentes locais e mesmos resultados) A atividade de água é medida quando ocorre o equilíbrio entre a água da amostra com o vapor de água no espaço vazio da câmara de amostra. Mede-se então a pressão de vapor no espaço vazio. A grande vantagem na determinação da pressão de vapor da água no ar, por ponto de orvalho, é que o ar pode ser resfriado sem alterar o conteúdo de água até a sua saturação. A temperatura de formação do ponto de orvalho é a temperatura na qual o ar alcança a saturação. No AquaLab isso é determinado pela medida da temperatura em um espelho resfriado quando começa a condensação. A atividade de água da amostra é a razão entre a saturação da pressão de vapor na temperatura da amostra pela pressão de vapor de saturação na temperatura do ponto de orvalho. MATERIAIS - material para trituração da amostra (gral e pistilo, liquidificador, processador de alimentos, moinho, peneiras, faca, tábua de corte,...) - amostra finamente dividida (quando sólida) - analisador de atividade de água AquaLab - cápsula de amostra que acompanha o equipamento - espátula PROCEDIMENTO - Verificar se amostra está bem moída e/ou homogênea - Adicionar cerca de 7,5 ml de amostra (sólida, líquida,...) em cápsula própria do analisador Aqualab (se a amostra não for analisada imediatamente, deixar a cápsula com a amostra tampada até o momento da análise) - Colocar a cápsula no analisador AquaLab - Fechar a tampa da câmara e aguardar o equilíbrio de vapor - O término da análise é indicado por sinais sonoros - Tomar nota da atividade de água e da temperatura indicadas no display do analisador 11
12 DETERMINAÇÃO DE AÇÚCARES REDUTORES PELO MÉTODO DE LANE & EYNON A determinação dos carboidratos dos alimentos é realizada, quando não estimada através do cálculo de diferença na composição centesimal, por métodos titulométricos que envolvem uma reação de óxido redução. Os carboidratos quantificados através do método de Lane & Eynon são redutores, enquanto que os não redutores devem ser transformados em formas redutoras para que possam ser determinados. A técnica consta de três etapas: 1ª Etapa Determinação do título do licor de Fehling 2ª Etapa Preparação de uma solução da amostra 3ª Etapa Titulação com a solução da amostra MATERIAIS - Balança analítica - Banho-maria a 60 C - Chapa de aquecimento - Buretas graduadas de 25 ou 50 ml - Pipetas de 2 e 10 ml - Proveta de 50 ml - Béqueres de 50 ml - Erlenmeyers de 200 ou 250 ml - Cápsula de porcelana - Bastão de vidro - Balões volumétricos de 250 e 1000 ml - Funil pequeno e papel filtro - Pérolas de vidro - Papel indicador de ph - Picetas REAGENTES - Água destilada - Ácido clorídrico - Solução de ferrocianeto de potássio a 15% - Solução de acetato de zinco a 30% - Licor de Fehling: Solução de Fehling A (Dissolver 69,28 g de sulfato de cobre (CuSO 4 ) em balão volumétrico de 1000 ml e completar o volume com água destilada) e Fehling B (Dissolver 346 g de tartarato duplo de sódio e potássio (KNa(C 4 H 4 O 6 )) e 100 g de hidróxido de sódio em balão volumétrico de 1000 ml, completar o volume com água destilada e filtrar em papel filtro ao passar para o recipiente de armazenamento) - Solução de azul de metileno a 1% - Solução de glicose 1% ou solução de açúcar invertido 1% (Pesar 9,5 g de sacarose, transferir para um balão volumétrico de 1000 ml, diluir com água destilada até cerca de 100 ml e adicionar 5 ml de ácido clorídrico; manter a solução acidificada por 7 dias de 12 a 15ºC ou 3 dias de 20 a 25ºC, completar o volume com água destilada. A solução ácida de açúcar invertido permanece estável por 12
13 vários meses. Antes de usar, pipetar 50 ml da solução ácida para um balão volumétrico de 250 ml, neutralizar com solução de hidróxido de sódio 1N 40 g de NaOH diluídos em 1 L de água destilada e completar o volume com água, obtendo uma solução com concentração final de 0,2%) PROCEDIMENTO 1ª Etapa - Em uma bureta, adicionar a solução de glicose ou de açúcar invertido - Em enlenmeyer de 200 ml, adicionar 10 ml da solução de Fehling A, 10 ml da solução de Fehling B, 40 ml de água destilada e pérolas de vidro - Colocar o enlenmeyer com a mistura em chapa de aquecimento - Após início da ebulição, adicionar 5 gotas do azul de metileno e iniciar titulação com a solução de glicose ou açúcar invertido - Titular sob aquecimento até o desaparecimento da cor azul e formação de um precipitado vermelho tijolo - Calcular o título do licor de Fehling 2ª Etapa - Homogeneizar 5 g em uma cápsula de porcelana com 50 ml de água destilada quente (se necessário, levar ao banho-maria a 60 C para facilitar a dissolução da amostra) - Transferir a amostra homogeneizada para um balão volumétrico de 250 ml - Adicionar 2 ml da solução de ferrocianeto de potássio a 15% e 2 ml da solução de acetato de zinco a 30% - Completar o volume com água destilada - Filtrar através de funil com papel filtro, coletando o filtrado em um enlenmeyer - Colocar o filtrado em uma bureta para titulação 3ª Etapa - Em outro enlenmeyer, adicionar 10 ml da solução de Fehling A, 10 ml da solução de Fehling B, 40 ml de água destilada e pérolas de vidro - Colocar o enlenmeyer com a mistura na chapa de aquecimento - Após ebulição, adicionar 5 gotas do azul de metileno e iniciar titulação com a solução filtrada da amostra - Titular sob aquecimento até o desaparecimento da cor azul e formação de um precipitado vermelho tijolo - Calcular o valor de açúcares redutores da amostra Observação: O ponto final da titulação é quando desaparece a cor roxa e o azul de metileno é descorado, aparecendo um precipitado vermelho tijolo no fundo do enlenmeyer. Se a solução ficar em repouso, a cor roxa retorna, pois o composto reduzido é rapidamente oxidado pelo oxigênio atmosférico, retornando a coloração roxa e azul. EXEMPLO DE CÁLCULO O título do licor de Fehling é obtido pela padronização das soluções de Fehling com uma solução de açúcar redutor de concentração conhecida. Assim, o resultado é geralmente expresso em açúcares redutores ou em glicose. 13
14 Por exemplo, se o gasto médio na titulação com a solução de concentração conhecida de açúcares redutores (solução de glicose 1%) for 7 ml: 100 ml de solução g de glicose 7 ml X X = 0,07 g de glicose são necessários para reduzir o licor de Fehling Se o gasto médio na titulação com a solução da amostra for de 10 ml: 10 ml da solução de amostra ,07 g de açúcares redutores 250 ml Y Y = 1,75 g de açúcares redutores em 5 g de amostra que foram diluídos em balão volumétrico de 250 ml 5 g ,75 g 100 g Z Z = 35 g% de açúcares redutores na amostra Este raciocínio pode ser resumido na seguinte fórmula: Onde: 250 = volume do balão volumétrico 100 = porcentual na amostra T = título do licor de Fehling V = volume gasto da solução de amostra filtrada P = peso de amostra homogeneizada % de açúcares redutores = 250 x 100 x T V x P PRINCÍPIO DA TÉCNICA Os açúcares redutores promovem a redução de soluções alcalinas do sulfato de cobre (CuSO 4 ) em presença de tartarato de sódio e potássio. O resultado desta reação de redução é a formação de óxido cuproso (Cu 2 O), que aparece como um precipitado de coloração vermelho tijolo. O Cu 2 O é bastante instável e oxida pelo O 2 atmosférico, retomando a coloração roxa azulada na mistura. O ferrocianeto de potássio e o acetato de zinco são utilizados para desnaturar e remover proteínas, deixando apenas os açúcares redutores após a filtragem da amostra. 14
15 DETERMINAÇÃO DE AMIDO O amido constitui a mais importante reserva de nutrientes de todas as plantas superiores, ocorrendo principalmente em sementes, tubérculos e raízes. Desta forma, é um componente em grande quantidade nos alimentos e fonte mais expressiva de carboidratos da alimentação humana. O amido é um homopolissacarídio neutro formado por duas frações: amilose e amilopectina. A primeira é formada por unidades de glicose ligadas por ligações α-1,4 e a segunda por unidades de glicose unidas em α-1,4 com cadeias ligadas em α-1,6. Este método tem aplicação na determinação de amido em produtos com grande quantidade deste polissacarídio, como cereais e derivados, sendo que estes devem ser pobres em gordura ou previamente desengordurados. A técnica tem 2 etapas: 1ª Etapa: Hidrólise energética do amido em meio altamente ácido. 2ª Etapa: A glicose (açúcar redutor) formada após hidrólise é quantificada pelo método de Lane & Eynon. MATERIAIS - Balança analítica - Autoclave - Frasco shot de 500 ml para autoclavagem - Chapa de aquecimento - Papel indicador de ph - Buretas graduadas de 25 ml - Pipetas de 2 e 10 ml - Proveta de 50 ml - Béqueres de 50 ml - Erlenmeyers de 250 ml - Gral e pistilo de porcelana - Cápsula de porcelana - Balões volumétricos de 500 e 1000 ml - Funil pequeno e papel filtro - Pérolas de vidro - Picetas REAGENTES - Farinha - Água destilada - Ácido clorídrico - Solução de hidróxido de sódio a 40% - Solução de ferrocianeto de potássio a 15% - Solução de acetato de zinco a 30% - Licor de Fehling com título conhecido (Solução de Fehling A e Fehling B) - Solução de azul de metileno a 1% 15
16 PROCEDIMENTO 1ª Etapa - Pesar 5 g de amostra de farinha de trigo - Transferir a amostra para o frasco shot junto com 200 ml de água destilada - Adicionar 10 ml de ácido clorídrico concentrado - Autoclavar a 120 C e 1 atm por 20 minutos - Após autoclavagem, aguardar o resfriamento da amostra hidrolisada e neutralizar com a solução de hidróxido de sódio 40%, controlando ph através do uso de papel indicador - Transferir para balão volumétrico de 500 ml - Adicionar 10 ml da solução de ferrocianeto de potássio 15% e 10 ml da solução de sulfato de zinco 30% - Completar o volume com água destilada e homogeneizar - Aguardar sedimentação e filtrar a solução em enlenmeyer 2ª Etapa - Em outro enlenmeyer, adicionar 10 ml da solução de Fehling A, 10 ml da solução de Fehling B, 40 ml de água destilada e pérolas de vidro - Colocar o enlenmeyer com a mistura na chapa de aquecimento - Após ebulição, adicionar 5 gotas do azul de metileno e iniciar titulação com o filtrado - Titular sob aquecimento até o desaparecimento da cor azul e formação de um precipitado vermelho tijolo - Calcular o valor de açúcares redutores e transformar para o valor de amido EXEMPLO DE CÁLCULO Nesta técnica se utilizam as mesmas soluções de Fehling da determinação dos açúcares redutores (título do licor de Fehling = 0,07). Se o gasto da titulação com o hidrolisado de amido foi de 5 ml: 0,07 g ml X ml X = 0, g de açúcares redutores / ml de sol. 1 ml , g 500 ml Y Y = 3,97 g de açúcares redutores (glicose)/5 g de farinha Ocorre que o peso da glicose livre é maior do que o peso de cada unidade de glicose do amido, em uma proporção de 1:0,9 (1 g de glicose = 0,9 g de amido), assim: 3,97 x 0,9 = 3,57353 g de amido / 5 g de farinha de trigo (3,57353/5) x 100 = 71,47% de amido na farinha de trigo 16
17 DETERMINAÇÃO DA FIBRA BRUTA Nutricionalmente, o termo fibra é restrito ao material filamentoso dos alimentos. O termo fibra dietética ou fibra alimentar foram introduzidos para assinalar todas as estruturas celulares das paredes vegetais que não são digeridas pelos sucos digestivos humanos. A alteração de termos também foi acompanhada de mudanças nos métodos de análise de fibras, com o aperfeiçoamento das técnicas, em especial do método enzimático. O método de determinação da fibra bruta baseia-se na determinação do resíduo orgânico insolúvel da amostra, após uma digestão ácida e outra alcalina sob condições especiais. Foi o primeiro método utilizado para determinar este constituinte nos alimentos e extensamente utilizado até a década de 70, quando novos métodos foram desenvolvidos. O termo fibra dietética associa a totalidade dos componentes não digestivos das paredes celulares, incluindo celulose, hemicelulose, lignina, amido resistente, pectina, gomas e mucilagens, divididos quanto a solubilidade ou não em água, que determina seu papel fisiológico. Sabe-se que o resíduo da digestão no ser humano é muito maior do que o determinado pelo método da fibra bruta, portanto este método subestima a porção de fibra do alimento. Apenas cerca de 20% da hemicelulose, 10 a 40% da lignina e 50 a 90% da celulose são determinadas no método de fibra bruta. MATERIAIS - Balança analítica - Espátula - Erlenmeyer de 500 ml - Chapa de aquecimento - Funil e papéis filtro - Timer - Estufa a 105 C - Dessecador com sílica - Papel indicador de ph REAGENTES - Água destilada - Solução de ácido sulfúrico 1,25% ou 0,255N (Diluir 7 ml de ácido sulfúrico concentrado em balão volumétrico de 1000 ml com cerca de 500 ml de água destilada; completar o volume e padronizar com solução de hidróxido de sódio 0,2N) - Solução de hidróxido de sódio 1,25% ou 0,313N (Pesar 12,5 g de hidróxido de sódio em becker, solubilizar com água destilada e transferir para um balão volumétrico de 1000 ml; completar o volume e padronizar com solução de ácido sulfúrico 0,2N) - Solução antiespumante (álcool n-amílico ou mistura de 1 g de silicone, 50 ml de éter etílico e 50 ml de éter de petróleo) - Etanol p.a. - Acetona p.a. - Éter etílico p.a. - Éter de petróleo p.a. 17
18 PROCEDIMENTO - Previamente à análise, deixar um papel filtro em estufa a 105 C por, no mínimo, 3 horas - Resfriar em dessecador e pesar - Pesar 3 g de amostra seca e desengordurada (4 lavagens com 20 ml de éter etílico, se o teor de gordura for maior que 5%) - Transferir a amostra para um erlenmeyer de 500 ml - Adicionar 200 ml da solução de ácido sulfúrico 1,25% e 5 gotas da solução antiespumante - Colocar na chapa de aquecimento e, após início da ebulição, manter digestão por 30 minutos - Filtrar através de um papel filtro (não necessariamente o previamente pesado) - Lavar o resíduo do papel filtro com água destilada quente - Retornar o resíduo para recipiente de digestão - Adicionar 200 ml da solução de hidróxido de sódio 1,25% e 5 gotas da solução antiespumante - Colocar na chapa de aquecimento e, após início da ebulição, manter digestão por mais 30 minutos - Filtrar através do papel filtro previamente pesado - Lavar o resíduo com água destilada quente até o filtrado ser neutralizado, verificando o ph através de papel indicador - Lavar o resíduo com 20 ml de etanol, 20 ml de acetona e 20 ml de éter de petróleo - Colocar o papel filtro com o resíduo na estufa a 105 C por 3 horas - Retirar o papel filtro da estufa - Resfriar em dessecador e pesar - Calcular o teor de fibra bruta EXEMPLO DE CÁLCULO Onde: R = peso do papel filtro + resíduo P = peso do papel filtro A = peso da amostra FIBRA BRUTA (%) = (R P). 100 A 18
19 MODELO ESQUEMÁTICO DA DETERMINAÇÃO DE FIBRA BRUTA AMOSTRA SECA DESENGORDURADA DIGESTÃO ÁCIDA (H 2 SO 4 1,25%) DIGESTÃO BÁSICA (NaOH 1,25%) LAVAGEM DO RESÍDUO SECAGEM DO RESÍDUO (105 C/3 hrs) PESAGEM E CÁLCULO 19
20 DETERMINAÇÃO DE FIBRA PELO MÉTODO ENZIMÁTICO A fibra determinada em laboratório vai ser próxima daquela que resulta da digestão no organismo humano se os processos de digestão forem semelhantes. A dificuldade está na reprodução do processo de digestão humano, que é bastante complexo, envolve muitas enzimas e varia conforme o grau de trituração, mastigação, mistura de alimentos,... Este método é resultado dos esforços de pesquisadores que procuram criar metodologias que aproximem mais o resíduo de fibra determinada com resultante da digestão humana. O método utilizado é baseado no método da AOAC (fibra alimentar total, solúvel e insolúvel em alimentos) e no método da AACC (determinação de fibra alimentar solúvel, insolúvel e total), e, resumidamente, a amostra é sujeita à digestão enzimática e o resíduo quantificado por método gravimétrico. O Ministério da Saúde, em portaria de 2001, através da ANVISA, define fibras alimentares como qualquer material comestível de origem vegetal que não seja hidrolisado pelas enzimas endógenas do trato digestivo humano, determinado segundo os métodos publicados pela AOAC em sua edição mais atual. Nesta metodologia é possível quantificar os teores de fibra alimentar solúvel e insolúvel, observando a seguinte relação: Onde: FAT = Fibra alimentar total FAI = Fibra alimentar insolúvel FAS = Fibra alimentar solúvel FAT = FAI + FAS Compreendem a fração insolúvel a celulose, hemicelulose, ligninas e amido resistente; enquanto que na fração solúvel encontram-se algumas hemiceluloses, pectinas, gomas e mucilagens. MATERIAIS - Balança analítica - Béqueres de 20 e 500 ml - Pipetas de 10 ml - Micropipetadores e ponteiras para 100 µl e 300 µl - Proveta de 50 ml - Bastão de vidro - Cadinhos de vidro sinterizado com porosidade de 40 a 60 µ - Picetas - Banho-maria com agitação a 100 C - Banho-maria com agitação a 60 C - phmetro - Timer - Bandejas (para transporte dos béqueres) - Sistema de vácuo (para filtragem) - Estufa a 105 C 20
21 - Dessecador com sílica - Sistema para digestão e destilação (determinação do nitrogênio total por Kjeldhal) - Mufla a 550 C REAGENTES - Lã de vidro média - Água destilada - Tampão fosfato 0,08M ph 6 (Dissolver 1,4 g de fosfato de sódio dibásico anidro (Na 2 HPO 4 ) ou 1,753 g de dihidratado e 9,68 g de fosfato de sódio monobásico monohidratado (NaH 2 PO 4.H 2 O) ou 10,94 g de dihidratado com cerca de 700 ml de água destilada em balão volumétrico de 1000 ml. Completar o volume e verificar o ph) - Enzimas amilase, protease e amiloglicosidase - Solução de hidróxido de sódio 0,275N (Diluir 11 g de NaOH em 1 L de água destilada) - Solução de ácido clorídrico 1N (Diluir 85 ml de ácido clorídrico concentrado em 1 L de água destilada) -Solução de ácido clorídrico 0,325N (Diluir 325 ml da solução de HCl 1N em 1 L de água destilada) - Etanol 95%. - Etanol 78% - Acetona PA - Reagentes para determinação do nitrogênio total (ácido sulfúrico, mistura catalítica, solução de hidróxido de sódio 40%, solução de ácido bórico 4%, solução de indicadores vermelho de metila e verde de bromocresol, solução de indicador fenolftaleína e solução de ácido sulfúrico 0,05N) PROCEDIMENTO - Pesar 1 g de amostra em cada béquer de 500 ml (conduzir 4 béqueres para cada amostra, que se tiver teor de extrato etéreo igual ou superior a 10% deve ser previamente desengordurada) - Adicionar 50 ml de tampão fosfato e homogeneizar, se necessário, com auxílio de um bastão de vidro - Adicionar 100 L de -amilase - Incubar e agitar por 30 minutos em banho-maria a 100 C - Retirar o béquer, resfriar e corrigir o ph para 7,5 com a solução de NaOH 0,275N - Adicionar 100 L de protease - Incubar e agitar por 30 minutos em banho-maria a 60 C - Retirar o béquer, resfriar e corrigir o ph para 4,5 com a solução de HCl 0,325N - Adicionar 300 L de amiloglicosidase - Incubar e agitar por 30 minutos em banho-maria a 60 C - Em dois béqueres, adicionar 280 ml de etanol 95% previamente aquecido a 60 C e deixar em repouso por 1 hora para precipitação da fibra solúvel - Nos outros dois béqueres proceder a filtragem - Filtrar em cadinho de vidro sinterizado forrado com lã de vidro e previamente pesado: - Resíduo da fibra total Após precipitação da fibra solúvel, filtrar a mistura remanescente lavando o béquer com etanol 78%, 40 ml de etanol 95% e 20 ml de acetona - Resíduo da fibra insolúvel Filtrar a mistura remanescente lavando o béquer com água destilada, 40 ml de etanol 95% e 20 ml de acetona 21
22 - Levar os cadinhos com resíduo para estufa a 105 C - Após 16 horas, retirar os cadinhos da estufa, resfriar em dessecador e pesar - Da duplicata de cada uma das frações de fibra determinadas (insolúvel e total), incinerar um dos cadinhos em mufla a 550ºC por 5 horas e transferir a lã de vidro com o resíduo do outro cadinho para um tubo de digestão proteica - Calcular os teores de fibra alimentar, corrigindo com os valores de cinzas e proteína EXEMPLO DE CÁLCULO FIBRA ALIMENTAR (%) = {[(R1 + R2) / 2] P - C} / [(M1 + M2) / 2]. 100 Onde: R1 e R2 são os pesos dos resíduos P é o teor de proteína no resíduo C é o teor de cinzas no resíduo M1 e M2 são os pesos das amostras Tabela de dados para determinação de fibra alimentar de uma amostra hipotética Peso da amostra (g) Resíduo (g) Cinzas (g) Proteína (g) 1,0023 0,572-0,06 1,0071 0,6046 0, FA = (0,5883 0,06 0,0156) ,0047 FA = 51,03 g% de FA 22
23 MODELO ESQUEMÁTICO DA DETERMINAÇÃO DE FIBRA ALIMENTAR AMOSTRA Tampão fosfato ph 6 INCUBAÇÃO COM α-amilase A 100 C Correção ph 7,5 com NaOH 0,275N INCUBAÇÃO COM PROTEASE A 60 C Correção ph 4,5 com HCl 0,325N INCUBAÇÃO COM AMILOGLICOSIDASE A 60 C Etanol 95% PRECIPITAÇÃO DA FIBRA SOLÚVEL Após 1 hora FILTRAGEM FILTRAGEM Etanol 78% Água destilada Etanol 95% Etanol 95% Acetona Acetona RESÍDUO Cinzas Proteína bruta RESÍDUO Cinzas Proteína bruta FIBRA ALIMENTAR TOTAL FIBRA ALIMENTAR INSOLÚVEL 23
24 DETERMINAÇÃO DA FRAÇÃO EXTRATO ETÉREO PELO MÉTODO DE SOXHLET Os lipídios constituem um grupo diverso de substâncias formadas por longas cadeias hidrocarbonadas. Essas cadeias conferem um caráter apolar que, por sua vez, determina a insolubilidade em solventes polares e solubilidade em solventes apolares para estes compostos. Na solubilidade em solventes apolares é que se baseiam os métodos de determinação dos lipídios nos alimentos. Os solventes apolares também podem extrair substâncias diferentes dos lipídios, pelas quais têm afinidade, por isso, a fração extraída do alimento é considerada como extrato etéreo ou gordura bruta. A extração dos lipídios pode ser feita com solventes a frio ou a quente. Nesta aula prática, será utilizado o aparelho extrator Soxhlet, a partir da extração com solvente apolar a frio. Soxhlet é um aparelho de laboratório inventado em 1879 por Franz Von Soxhlet. Ele foi originalmente desenvolvido para a extração de lipídios em materiais sólidos. O princípio do método é o refluxo de solvente em um processo intermitente. Os solventes mais utilizados são o éter etílico e o éter de petróleo, que após ebulição e condensação, entram em contato com a amostra e transferem os lipídios desta para o balão quando atingem a altura do sifão. A principal vantagem é que a amostra não fica em contato com o solvente quente. Porém há desvantagens, como o gasto excessivo de solvente e o tempo de análise (4 a 20 horas). Figura 1. Modelo do método de Soxhlet MATERIAIS - Balança analítica - Aparelho extrator de Soxhlet 24
25 - Cartucho poroso (de papel filtro) - Proveta de 200 ml - Pinça - Estufa a 105 C - Dessecador com sílica - Capela REAGENTES - Amostra (finamente dividida e seca, para aumentar a superfície de contato e facilitar a penetração do solvente) - Solvente extrator (éter etílico ou éter de petróleo) PROCEDIMENTO - Previamente à análise, deixar o balão do extrator em estufa a 105 C por, no mínimo, 3 horas - Resfriar em dessecador e pesar - Pesar aproximadamente 2 g de amostra seca no cartucho - Fechar o cartucho e levá-lo ao aparelho extrator - Colocar 200 ml do solvente, acoplar o condensador e regular aquecimento em temperatura de 40 a 50 C (gotejamento ideal do solvente é de 2 gotas/segundo) - Manter extração por 6 horas (depende da amostra, podendo variar de 4 a 20 horas) - Terminada a extração, retirar a amostra e recuperar o solvente (sempre antes de atingir o sifão, despejar o éter em frasco do solvente) - Deixar o balão em capela por aproximadamente 1 hora para evaporação do excesso de solvente - Levar o balão para estufa a 105 C por 3 horas - Resfriar em dessecador e pesar - Calcular o valor de extrato etéreo na amostra EXEMPLO DE CÁLCULO Peso do balão = 100 g Peso da amostra (MS) = 2 g Peso do balão + EE = 100,3 g Extrato etéreo: 100,3 100 = 0,3 g 2 g de amostra 0,3 g de extrato etéreo 100 g X X = 15% de extrato etéreo na amostra seca* * Transformar valor para a amostra integral! 25
26 DETERMINAÇÃO DE LIPÍDIOS PELO MÉTODO DE BLIGH & DYER O Método de Bligh & Dyer é um método muito utilizado de extração de lipídios. É caracterizado por ser feito a frio, utilizando-se uma mistura de clorofórmio, metanol e água. Inicialmente, amostra, metanol e clorofórmio formam apenas uma fase; posteriormente, mais clorofórmio e água são adicionados, estabelecendo duas fases. Os lipídios ficam na fase do clorofórmio, que pode ser separada e removida por evaporação. As vantagens em relação ao método de Soxhlet são: - Método rápido - Possibilidade de analisar diversas amostras concomitantemente - Todo processo ocorre a frio - Menor quantidade de solvente - Amostra não precisa ser seca MATERIAIS - Balança analítica - Tubos falcon de 15 e 50 ml - Suporte para tubos falcon - Pipetas de 5, 10 e 20 ml - Pipetador - Funil e papel filtro - Béqueres de 25 ml - Espátula - Agitador de tubos - Centrífuga - Estufa a 105 C - Dessecador com sílica - Capela REAGENTES - Amostra - Clorofórmio p.a. - Metanol p.a. - Água destilada - Sulfato de sódio anidro - Solução de sulfato de sódio 1,5% PROCEDIMENTO - Deixar o béquer em estufa a 105ºC por, no mínimo, 3 horas - Resfriar em dessecador e pesar - Pesar aproximadamente 2 g da amostra moída no tubo falcon com capacidade para 50 ml - Adicionar 8 ml de clorofórmio, 16 ml de metanol e 6,4 ml de água destilada - Tampar os tubos e colocá-los em agitador por 30 minutos 26
27 - Adicionar 8 ml de clorofórmio e 8 ml de solução de sulfato de sódio 1,5% - Tampar novamente os tubos e agitá-los por mais 2 minutos - Deixar separar as camadas de forma natural ou centrifugar a 1000 rpm por 2 minutos - Pipetar de 10 a 12 ml da camada inferior (clorofórmio) para um tubo falcon de 15 ml - Adicionar aproximadamente 1 g de sulfato de sódio anidro, tampar e agitar manualmente - Filtrar para outro tubo falcon de 15 ml, através de funil pequeno e papel filtro - Pipetar 5 ml do filtrado para o béquer previamente pesado - Colocar o béquer em estufa a 105 C até evaporação do solvente - Resfriar em dessecador e pesar - Calcular o teor de lipídios na amostra EXEMPLO DE CÁLCULO Peso da amostra = 2 g Peso do béquer = 30 g Peso do béquer + resíduo = 30,07 g Resíduo (lipídios): 30,07 30 = 0,07 g 0,07 g de lipídios ml do filtrado (clorofórmio) X ml X = 0,224 g 0,224 g de lipídios g de amostra Y g Y = 11,2% de lipídios Fonte: BLIGH, E.C. & DYER, W.J., A rapid method of total lipid. Extraction and purification. Can. J. Biochem. Physiol., 37:
28 DETERMINAÇÃO DE PROTEÍNA BRUTA PELO MÉTODO DE KJELDAHL As proteínas, polímeros de aminoácidos de alto peso molecular, são compostos, no mínimo, quaternários porque contém, além do carbono, hidrogênio e oxigênio, também o nitrogênio. A grande maioria das proteínas também contém enxofre e algumas podem conter elementos como o fósforo, ferro, entre outros. O método de Kjeldahl baseia-se na determinação do nitrogênio presente na amostra e é recomendado em diversos protocolos da AOAC. O método de Kjeldahl recebe o nome do seu desenvolvedor, o químico dinamarquês Johan Gustav Kjeldahl. Pode ser micro ou macro Kjeldahl, dependendo da quantidade de amostra e, consequentemente, reagentes utilizados. É muito utilizado para determinação do conteúdo proteico dos alimentos, devido à facilidade de execução, uso de equipamentos simples e baixo custo nas análises. Três fases compreendem o método de Kjeldhal: 1ª fase - Mineralização ou digestão Pela digestão com ácido sulfúrico concentrado, ocorre a oxidação da matéria orgânica e redução do nitrogênio da amostra a amônia, que é prendida na forma de sulfato de amônio. A reação é demonstrada do seguinte modo: - C - NH 2 (matéria orgânica/proteína) + H 2 SO 4 (NH 4 ) 2 SO 4 + CO 2 + SO 2 + H 2 0 Para aumentar a rapidez e a eficiência do processo, adiciona-se: - Sais (como o sulfato de potássio ou de sódio) para aumentar a temperatura da digestão. - Catalizadores (como cobre, mercúrio e/ou selênio) para facilitar a oxidação da matéria orgânica. 2ª fase Destilação Previamente à destilação, é estabelecido um meio alcalino pela adição de hidróxido de sódio, onde o sulfato de amônio forma hidróxido de amônio, através da seguinte reação: (NH 4 ) 2 SO 4 + 2NaOH 2NH 4 OH + Na 2 SO 4 28
29 O hidróxido de amônio é bastante instável e por ação do calor forma amônia e água: 2NH 4 OH 2NH 3 + 2H 2 O A amônia, por sua vez, é um composto volátil e facilmente destilado por arraste de vapor. O condensado é recolhido em um frasco coletor contendo a solução de ácido bórico e mistura de indicadores (verde de bromocresol e vermelho de metila). A amônia reage com o ácido bórico formando o borato de amônio: 3NH 3 + H 3 BO 3 (NH 4 ) 3 BO 3 3ª fase Titulação Quantifica-se a quantidade de borato de amônio (proporcional à quantidade de nitrogênio) pela reação com ácido clorídrico, formando cloreto de amônio e ácido bórico: (NH 4 ) 3 BO 3 + 3HCl 3NH 4 Cl + H 3 BO 3 O indicador misto de verde de bromocresol e vermelho de metila possibilita a fácil observação da mudança de cor na titulação. O borato de amônio confere coloração verde à solução (ph alcalino), mas quando é convertido em ácido bórico e o ácido clorídrico fica em excesso, a solução reassume a coloração rósea (ph ácido = ponto final). 29
30 MATERIAIS - Balança analítica - Espátula - Bloco digestor - Tubo de micro Kjeldahl - Sistema destilador Kjeldahl - Piceta - Erlenmeyer de 125 ml - Bureta de 50 ml - Béquer de 50 ml - Pipetas graduadas de 2 e 20 ml REAGENTES - Mistura catalítica (100 g de sulfato de sódio, 10 g de sulfato de cobre e 1 g de selênio) - Ácido sulfúrico concentrado - Água destilada - Solução dos indicadores verde de bromocresol/vermelho de metila (Dissolver 0,099 g de verde de bromocresol e 0,066 g de vermelho de metila em 100 ml de etanol p.a.) - Solução indicadora de ácido bórico (Dissolver 40 g de ácido bórico em 700 ml de água destilada quente, transferir para um balão volumétrico de 2 litros, adicionar 300 ml de etanol p.a. e 40 ml da solução dos indicadores verde de bromocresol/vermelho de metila, completar o volume com água destilada) - Solução de hidróxido de sódio 40% (Dissolver 400 g de hidróxido de sódio em 1000 ml de água destilada) - Solução de ácido clorídrico 0,1 N (Transferir 8,5 ml de de ácido clorídrico concentrado para um balão volumétrico de 1000 ml contendo 500 ml de água destilada, após resfriar, completar o volume e padronizar a solução) PROCEDIMENTO - Pesar 0,2 g de amostra e transferir para o tubo de digestão - Adicionar uma dose da mistura catalítica (cerca de 1 g) e 2 ml de ácido sulfúrico concentrado no tubo de digestão - Levar o tubo ao bloco digestor e proceder digestão a 375 ºC, aumentando a temperatura gradualmente até que o líquido apresente tonalidade verde azulada e fique límpido - Desligar o bloco, retirar os tubos, aguardar o resfriamento e diluir até 20 ml com água destilada - Adicionar 20 ml da solução indicadora de ácido bórico em enlenmeyer de 125 ml e acoplá-lo na porção coletora final do destilador - Inserir o tubo no destilador (na entrada de vapor) e adicionar 10 ml de hidróxido de sódio 40% - Ligar o aquecimento e proceder destilação até que toda amônia seja recolhida (até o volume do erlenmeyer atingir 75 ml) - Titular o destilado com solução de ácido clorídrico 0,1 N até o desaparecimento da cor verde e surgimento de coloração violeta ou rósea 30
31 - Tomar nota do gasto, calcular o teor de N e transformar para proteína através do fator de correção para a amostra EXEMPLO DE CÁLCULO 0,1 N de HCl - 0,1 N (NH 4 ) 3 BO 3-0,1 N de nitrogênio 1 N de Nitrogênio - 14 g ml 0,1 N - X ml X = 1,4 g de nitrogênio/1000 ml 1,4 g de N ml Y - 1 ml Y = 0,0014 g de nitrogênio/ml 0,0014 g de N - 1 ml Z - 12 ml (gasto na titulação) Z = 0,0168 g de N 0,0168 g N - 0,2 g de amostra W g de amostra W = 8,4 g de N As proteínas apresentam diferentes proporções de nitrogênio na estrutura e para cada fonte proteica é estabelecido um fator de correção: Fonte proteica Fator de correção % de proteína (para o exemplo) Vegetais 5,75 48,30% Carnes, soja e milho 6,25 52,50% Lácteos 6,38 53,59% Fonte: Resolução RDC n 360, 23 de dezembro de
32 DETERMINAÇÃO DE ÁCIDO ASCÓRBICO EM SUCOS PELO MÉTODO INTERLAB X-1 Este método é aplicável para avaliação de ácido ascórbico reduzido, mas não é aplicável em sucos de frutas muito coloridos ou em presença de Fe ferroso, Sn estanhoso, Cu cuproso, SO 2, sulfito e tiossulfato, nos quais os valores são superestimados. O princípio da técnica é a redução do indicador-corante 2,6 diclorofenol indofenol sódico. No ponto final de uma titulação, o excesso do indicador-corante não reduzido confere uma coloração rosa pink em meio ácido, que é o meio utilizado na titulação para evitar a autoxidação do ácido ascórbico. MATERIAIS - Balança analítica - Espátula - Balões volumétrico de 50, 100, 200 ml - Funil e papel filtro - Erlenmeyers de 250 ml - Proveta de 50 ml - Bureta de 25 ou 50 ml - Pipetas graduadas de 2, 5, 10 e 20 ml - Faca - Espremedor de frutas - Funil com algodão ou gaze - Béquer de 200 ml - Béqueres de 50 ml REAGENTES - Suco de fruta - Água destilada - Solução padrão de 2,6 diclorofenol indofenol (Pesar 50 mg de 2,6 diclorofenol indofenol e dissolver com 50 ml de água destilada em balão volumétrico de 200 ml; agitar até a completa dissolução e completar o volume do balão; filtrar, se necessário, e guardar a solução em frasco âmbar sob refrigeração) - Solução de ácido oxálico 1% (Pesar 10 g de ácido oxálico p.a., transferir para balão volumétrico de 1000 ml, diluir e completar o volume com água destilada) - Solução de ácido ascórbico 0,1% (Pesar 50 mg de ácido ascórbico, transferir para balão volumétrico de 50 ml, diluir e completar o volume com a solução de ácido oxálico 1%) PROCEDIMENTO Padronização da solução de 2,6 diclorofenol indofenol - Transferir 2 ml da solução de ácido ascórbico 0,1% para erlenmeyer de 250 ml contendo 50 ml da solução de ácido oxálico 1% - Titular com a solução de 2,6 diclorofenol indofenol em bureta até aparecimento de coloração rósea persistente por mais de 5 segundos 32
33 - Cada titulação deve consumir cerca de 15 ml da solução de 2,6 diclorofenol indofenol e coincidir em 0,1 ml - Simultaneamente, titular um branco com água destilada no lugar da solução de ácido ascórbico e diminuir do gasto na titulação da solução de ácido ascórbico 0,1% Preparo da amostra - Cortar frutas ao meio - Espremer as frutas em espremedor - Filtrar o suco através de algodão ou gaze para um béquer Determinação do ácido ascórbico no suco - Pipetar 5 ml de suco filtrado para erlenmeyer de 250 ml contendo 50 ml da solução de ácido oxálico 1% - Titular com a solução de 2,6 diclorofenol indofenol até coloração rósea persistente por 15 segundos - Anotar o gasto da solução de 2,6 diclorofenol indofenol e calcular o teor de ácido ascórbico da amostra EXEMPLO DE CÁLCULO Gasto médio da titulação do padrão com solução de 2,6 diclorofenol indofenol = 15,1 ml Gasto médio da titulação do branco com solução de 2,6 diclorofenol indofenol = 0,1 ml Gasto médio da titulação da amostra de suco com solução de 2,6 diclorofenol indofenol = 22,1 ml Solução padrão Amostra 500 ml 0,125 g 15 ml X X = 0,00375 g de 2,6 diclorofenol indofenol 500 ml 0,125 g 22 ml Y Y = 0,0055 g de 2,6 diclorofenol indofenol 0,00375 g 0,002 g (solução ácido ascórbico 0,1%) 0,0055 g Z Z = 0, g 0, g 5 ml de suco W 100 ml W = 0,059 g% de ácido ascórbico/100 ml suco Fonte: Portaria n 76, de 27 de novembro de 1986, do Ministério da Agricultura e Reforma Agrária Secretaria Nacional de Defesa Agropecuária. Diário Oficial da União, 3 de dezembro de 1986, Seção I, página
34 DETERMINAÇÃO DA FRAÇÃO CINZAS Considera-se cinza total ou resíduo mineral fixo, o resultado da incineração do produto em mufla na temperatura entre 500 e 600ºC, até oxidação total da matéria orgânica. É um método importante na determinação da composição centesimal, como um passo na determinação de minerais isolados, no controle de qualidade e caracterização de alguns produtos. Os constituintes quantificados na fração cinzas são elementos minerais essenciais (macro e micronutrientes), além de minerais sem função conhecida no organismo. A Legislação estabelece limites, normalmente máximos, para o teor de cinzas da maioria dos alimentos, como por exemplo: Farinha de trigo (máximo de 2% para integral, 0,65% para especial e entre 0,65-1,35% para comum) Produtos de soja (máximo de 6,5% para farinha desengordurada, 6,5% para proteína texturizada 5% para proteína concentrada) Ovos (máximo de 1,1% para ovo líquido e 4% para desidratado). Representam dificuldades e desvantagens comuns na obtenção da fração cinzas: - Materiais ricos em fósforo tendem a formar uma massa vítrea que envolve o carvão. - Produtos ricos em lipídios tendem a formar espumas, que podem projetar materiais para fora do cadinho com perda de amostra. - Materiais de elevada umidade tendem a projetar material para fora do cadinho durante aquecimento. - Tendência à hidratação e facilidade de perdas das cinzas durante retirada da mufla e pesagem. - Superestimação do conteúdo mineral, pois elementos residuais ficam na forma de óxidos, fosfatos, nitratos, sulfatos, cloretos,... MATERIAIS - Balança analítica - Espátula - Estufa a 105 C - Cadinho de porcelana - Dessecador com sílica - Tenaz - Mufla PROCEDIMENTO - Previamente, deixar cadinho em estufa a 105 C por 16 horas - Resfriar em dessecador e pesar - Pesar aproximadamente 2 g de amostra no cadinho - Levar o cadinho com a amostra para mufla - Ligar a mufla e regular aquecimento na temperatura de 550 C - Manter incineração por 5 horas - Desligar a mufla e aguardar redução da temperatura - Retirar cadinho da mufla quando temperatura for menor que 150 C - Resfriar em dessecador e pesar - Calcular o teor de cinzas na amostra 34
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE NITROGÊNIO
 AULA PRÁTICA Nº - 07 28 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE NITROGÊNIO FUNDAMENTO: A determinação do nitrogênio total (NT) proposta por Kjeldahl em 1883, ainda é muito usada por ser uma
AULA PRÁTICA Nº - 07 28 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE NITROGÊNIO FUNDAMENTO: A determinação do nitrogênio total (NT) proposta por Kjeldahl em 1883, ainda é muito usada por ser uma
AULA 3. Prof a Dra. Rosa Lúcia Carneiro da Silva
 AULA 3 Prof a Dra. Rosa Lúcia Carneiro da Silva Os alimentos são matrizes complexas e apresentam uma variabilidade muito grande na sua composição. O alimento é definido como qualquer substância que fornece
AULA 3 Prof a Dra. Rosa Lúcia Carneiro da Silva Os alimentos são matrizes complexas e apresentam uma variabilidade muito grande na sua composição. O alimento é definido como qualquer substância que fornece
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO ÓXIDO DE FERRO
 Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS
 LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA. Tópicos de Química Experimental. Débora Alvim/ Willian Miguel
 MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
AULA PRÁTICA Nº / Maio / 2016 Profª Solange Brazaca DETERMINAÇÃO DE CARBOIDRATOS
 AULA PRÁTICA Nº - 08 05 / Maio / 2016 Profª Solange Brazaca FUNDAMENTO: DETERMINAÇÃO DE CARBOIDRATOS Este método baseia-se na propriedade que alguns açúcares apresentam em reduzir o Cu+2 (Íon Cúprico)
AULA PRÁTICA Nº - 08 05 / Maio / 2016 Profª Solange Brazaca FUNDAMENTO: DETERMINAÇÃO DE CARBOIDRATOS Este método baseia-se na propriedade que alguns açúcares apresentam em reduzir o Cu+2 (Íon Cúprico)
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Redações Anteriores. Art. 3º Esta Instrução Normativa entra em vigor na data de sua publicação.
 MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO GABINETE DO MINISTRO INSTRUÇÃO NORMATIVA Nº 8, DE 11 DE MARÇO DE 2009 O MINISTRO DE ESTADO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, no uso da atribuição
MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO GABINETE DO MINISTRO INSTRUÇÃO NORMATIVA Nº 8, DE 11 DE MARÇO DE 2009 O MINISTRO DE ESTADO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, no uso da atribuição
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO FATOR DA SOLUÇÃO DE AZUL DE METILENO POR TITULAÇÃO COM SOLUÇÃO DE CLORETO TITANOSO (TiCl 3 )
 Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
PÓ DE CARVÃO MINERAL PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE ENXOFRE TOTAL PELO PROCESSO DE ESCHKA (GRAVIMETRIA)
 SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
APÊNDICE A - Calibração do Forno de Redução
 APÊNDICE A - Calibração do Forno de Redução A calibração do forno de redução Combustol para o conhecimento da temperatura real em seu centro, foi realizada com base num indicador digital de temperatura,
APÊNDICE A - Calibração do Forno de Redução A calibração do forno de redução Combustol para o conhecimento da temperatura real em seu centro, foi realizada com base num indicador digital de temperatura,
UMIDADE E SÓLIDOS TOTAIS 11/05/2016. Umidade, Sólidos Totais e Cinzas INTRODUÇÃO
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE INTRODUÇÃO Composição centesimal Disciplina: Análise de Alimentos Umidade, Sólidos Totais e Cinzas Proª. Msc. Dayana do Nascimento
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE INTRODUÇÃO Composição centesimal Disciplina: Análise de Alimentos Umidade, Sólidos Totais e Cinzas Proª. Msc. Dayana do Nascimento
MT DEPARTAMENTO NACIONAL DE ESTRADAS DE RODAGEM
 Método de Ensaio Página 1 de 6 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser usado na determinação do de material termoplástico para demarcação viária. Prescreve a aparelhagem,
Método de Ensaio Página 1 de 6 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser usado na determinação do de material termoplástico para demarcação viária. Prescreve a aparelhagem,
RESINA FENÓLICA PARA FUNDIÇÃO DETERMINAÇÃO DE NITROGÊNIO TOTAL DA RESINA E DO CATALISADOR
 Método de Ensaio Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexos A e B 1_ OBJETIVO 1.1_ Esta recomendação
Método de Ensaio Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexos A e B 1_ OBJETIVO 1.1_ Esta recomendação
AULA PRÁTICA Nº / Fevereiro / 2016 Profª Solange Brazaca DETERMINAÇÃO DE VITAMINA C
 AULA PRÁTICA Nº - 01 25 / Fevereiro / 2016 Profª Solange Brazaca DETERMINAÇÃO DE VITAMINA C FUNDAMENTO: O teor de ácido Ascórbico pode ser determinado pelo método de Tillmans que é um método titulométrico.
AULA PRÁTICA Nº - 01 25 / Fevereiro / 2016 Profª Solange Brazaca DETERMINAÇÃO DE VITAMINA C FUNDAMENTO: O teor de ácido Ascórbico pode ser determinado pelo método de Tillmans que é um método titulométrico.
SUBSTÂNCIAS E MISTURAS
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL).
 MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
Aula prática 1: Materiais de laboratório, exatidão e precisão. 1. Material de laboratório
 Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
RESÍDUO MINERAL FIXO OU CINZA
 RESÍDUO MINERAL FIXO OU CINZA CINZA DEFINIÇÃO: toda substância inorgânica, não é destruída pela queima do alimento. Nutricionalmente é definida como sais minerais ou apenas minerais. Nos alimentos temos
RESÍDUO MINERAL FIXO OU CINZA CINZA DEFINIÇÃO: toda substância inorgânica, não é destruída pela queima do alimento. Nutricionalmente é definida como sais minerais ou apenas minerais. Nos alimentos temos
Unidade V - Determinação de umidade e sólidos totais
 Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
ANÁLISES DE ALIMENTOS METODOLOGIAS
 ANÁLISES DE ALIMENTOS METODOLOGIAS Profª. Drª. Mariana Schmidt 1 - METODOLOGIA PARA DETERMINAÇÃO DE UMIDADE EM ALIMENTOS Secagem em estufas: É o método mais utilizado em alimentos e está baseado na remoção
ANÁLISES DE ALIMENTOS METODOLOGIAS Profª. Drª. Mariana Schmidt 1 - METODOLOGIA PARA DETERMINAÇÃO DE UMIDADE EM ALIMENTOS Secagem em estufas: É o método mais utilizado em alimentos e está baseado na remoção
APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN
 APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN Aparelho ligado ao gás, utilizado para aquecimento de materiais não inflamáveis. Possui em sua base um regulador de entrada de ar para controlar o tipo de chama:
APARELHAGEM DE LABORATÓRIO 1. BICO DE BÜNSEN Aparelho ligado ao gás, utilizado para aquecimento de materiais não inflamáveis. Possui em sua base um regulador de entrada de ar para controlar o tipo de chama:
RESINA FENÓLICA PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE FENOL LIVRE
 SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
Determinação de cinzas em alimentos
 UNIVERSIDADE DE SÃO PAULO FACULDADE DE CIÊNCIAS FARMACÊUTICAS DEPARTAMENTO DE ALIMENTOS E NUTRIÇÃO EXPERIMENTAL DISCIPLINA: BROMATOLOGIA BÁSICA (FBA-201) Determinação de cinzas em alimentos Elizabete W
UNIVERSIDADE DE SÃO PAULO FACULDADE DE CIÊNCIAS FARMACÊUTICAS DEPARTAMENTO DE ALIMENTOS E NUTRIÇÃO EXPERIMENTAL DISCIPLINA: BROMATOLOGIA BÁSICA (FBA-201) Determinação de cinzas em alimentos Elizabete W
XXVI - CERA DE ABELHA
 XXVI - CERA DE ABELHA 1. CARACTERÍSTICAS E PREPARO DA AMOSTRA Comercialmente a cera de abelha poderá ser encontrada como bruta, prébeneficiada e beneficiada. A amostra deve ser representativa do lote,
XXVI - CERA DE ABELHA 1. CARACTERÍSTICAS E PREPARO DA AMOSTRA Comercialmente a cera de abelha poderá ser encontrada como bruta, prébeneficiada e beneficiada. A amostra deve ser representativa do lote,
Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório
 MATERIAL EXTRA 2 BIMESTRE ENSINO MÉDIO Prof.: Cotrim 1ª Série Data: 18/04/2017 Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório A execução de experimentos, em um laboratório
MATERIAL EXTRA 2 BIMESTRE ENSINO MÉDIO Prof.: Cotrim 1ª Série Data: 18/04/2017 Complemento das Aulas 13 e 14: Os principais equipamentos presentes em um laboratório A execução de experimentos, em um laboratório
3016 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4
 6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
Equipamentos e Técnicas laboratoriais: Amostragem e separação de misturas
 MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA CÂMPUS LAGES Equipamentos e Técnicas laboratoriais: Amostragem e separação de
MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA CÂMPUS LAGES Equipamentos e Técnicas laboratoriais: Amostragem e separação de
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno
 3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
PROTEÍNA 01/06/2016. Proteína e Lipídeo INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE INTRODUÇÃO FUNÇÕES BIOLÓGICAS
 0/06/06 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos Proteína e Lipídeo Proª. Me. Dayana do Nascimento Ferreira PROTEÍNA Currais Novos, Maio
0/06/06 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos Proteína e Lipídeo Proª. Me. Dayana do Nascimento Ferreira PROTEÍNA Currais Novos, Maio
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Noções de Nutrição Animal com Ênfase nos Ruminantes parte I
 Noções de Nutrição Animal com Ênfase nos Ruminantes parte I Victor Hugo Pedraça Dias 1 Fonte: google imagem Fonte: google imagem 1 Engº Agrônomo - Esp. Geografia e Gestão Ambiental Prof. Substituto de
Noções de Nutrição Animal com Ênfase nos Ruminantes parte I Victor Hugo Pedraça Dias 1 Fonte: google imagem Fonte: google imagem 1 Engº Agrônomo - Esp. Geografia e Gestão Ambiental Prof. Substituto de
1. PREPARO DE SOLUÇÕES E TITULAÇÃO
 1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
MF-0418.R-1 - MÉTODO TITULOMÉTRICO DE DETERMINAÇÃO DE CIANETO TOTAL
 MF-0418.R-1 - MÉTODO TITULOMÉTRICO DE DETERMINAÇÃO DE CIANETO TOTAL Notas: Aprovado pela Deliberação CECA nº 042 de 04 de janeiro de 1979 Publicado no DOERJ de 16 de março de 1979 1. OBJETIVO O objetivo
MF-0418.R-1 - MÉTODO TITULOMÉTRICO DE DETERMINAÇÃO DE CIANETO TOTAL Notas: Aprovado pela Deliberação CECA nº 042 de 04 de janeiro de 1979 Publicado no DOERJ de 16 de março de 1979 1. OBJETIVO O objetivo
Determinação de amido em farinha de mandioca, produtos amiláceos e outros
 Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta
 3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
MF-0428.R-1 - MÉTODO DE DETERMINAÇÃO DE FENÓIS (AMINO ANTIPIRINA)
 MF-0428.R-1 - MÉTODO DE DETERMINAÇÃO DE FENÓIS (AMINO ANTIPIRINA) Notas: Aprovado pela Deliberação CECA nº 0045, de 01 de fevereiro de 1979. Publicado no DOERJ de 25 de abril de 1979. 1. OBJETIVO O objetivo
MF-0428.R-1 - MÉTODO DE DETERMINAÇÃO DE FENÓIS (AMINO ANTIPIRINA) Notas: Aprovado pela Deliberação CECA nº 0045, de 01 de fevereiro de 1979. Publicado no DOERJ de 25 de abril de 1979. 1. OBJETIVO O objetivo
Universidade Federal de Sergipe Departamento de Química Química Analítica Experimental Prof. Marcelo da Rosa Alexandre Alunos:
 Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
Determinação de Proteína Bruta pelo Método de Kjeldahl
 Determinação de Proteína Bruta pelo Método de Kjeldahl Prof. Dr. Moacir Cardoso Elias Prof. Dr. Nathan Levien Vanier Doutorando Cristian de Souza Batista, Engº Agrº, M.Sc. Introdução Proteínas Introdução
Determinação de Proteína Bruta pelo Método de Kjeldahl Prof. Dr. Moacir Cardoso Elias Prof. Dr. Nathan Levien Vanier Doutorando Cristian de Souza Batista, Engº Agrº, M.Sc. Introdução Proteínas Introdução
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 )
 Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico
 NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
4025 Síntese de 2-iodopropano a partir do 2-propanol
 4025 Síntese de 2-iodopropano a partir do 2-propanol OH I + 1/2 I 2 + 1/3 P x + 1/3 P(OH) 3 C 3 H 8 O (60,1) (253,8) (31,0) C 3 H 7 I (170,0) (82,0) Classificação Tipos de reação e classes de substâncias
4025 Síntese de 2-iodopropano a partir do 2-propanol OH I + 1/2 I 2 + 1/3 P x + 1/3 P(OH) 3 C 3 H 8 O (60,1) (253,8) (31,0) C 3 H 7 I (170,0) (82,0) Classificação Tipos de reação e classes de substâncias
Volumetria. Procedimentos gerais
 Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
AULA PRÁTICA 4 Série de sólidos
 SANEAMENTO AMBIENTAL EXPERIMENTAL TH 758 DHS PPGERHA - UFPR AULA PRÁTICA 4 Série de sólidos 1. Série de sólidos Resíduos ou sólidos são todas as matérias suspensas ou dissolvidas na água, provenientes
SANEAMENTO AMBIENTAL EXPERIMENTAL TH 758 DHS PPGERHA - UFPR AULA PRÁTICA 4 Série de sólidos 1. Série de sólidos Resíduos ou sólidos são todas as matérias suspensas ou dissolvidas na água, provenientes
08/11/2015 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE. Amostragem, preparo de amostra e tratamento de dados INTRODUÇÃO
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos INTRODUÇÃO BROMATOLOGIA: Ciência que estuda os alimentos em sua composição química qualitativa e
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos INTRODUÇÃO BROMATOLOGIA: Ciência que estuda os alimentos em sua composição química qualitativa e
EXPERIMENTOS DE QUIMICA ORGANICA I(QUI 127, QUI 186 E QUI 214) EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO
 EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini
 Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
BIOQUÍMICA DO PESCADO
 BIOQUÍMICA DO PESCADO Aula 6 Profa. Elaine Cristina Santos BROMATOLOGIA A Bromatologia estuda os alimentos, sua composição química, sua ação no organismo, seu valor alimentício e calórico, suas propriedades
BIOQUÍMICA DO PESCADO Aula 6 Profa. Elaine Cristina Santos BROMATOLOGIA A Bromatologia estuda os alimentos, sua composição química, sua ação no organismo, seu valor alimentício e calórico, suas propriedades
MF-0419.R-1 - MÉTODO COLORIMÉTRICO DE DETERMINAÇÃO DE CIANETO TOTAL
 MF-0419.R-1 - MÉTODO COLORIMÉTRICO DE DETERMINAÇÃO DE CIANETO TOTAL Notas: Aprovado pela Deliberação CECA nº 0042 de 04 de janeiro de 19. Publicado no DOERJ de 16 de março de 1979. 1. OBJETIVO O objetivo
MF-0419.R-1 - MÉTODO COLORIMÉTRICO DE DETERMINAÇÃO DE CIANETO TOTAL Notas: Aprovado pela Deliberação CECA nº 0042 de 04 de janeiro de 19. Publicado no DOERJ de 16 de março de 1979. 1. OBJETIVO O objetivo
Autor (1) Claudiany Silva Leite Lima; Autor (2) Eleilde de Sousa Oliveira; Orientador (1) Denise Silva do Amaral Miranda.
 AVALIAÇÃO DAS ALTERAÇÕES NAS PROPRIEDADES FÍSICO- QUÍMICAS DO DOCE DE LEITE EM PASTA COMERCIALIZADO EM AÇAILÂNDIA/MA DURANTE A VIDA DE PRATELEIRA DO PRODUTO Autor (1) Claudiany Silva Leite Lima; Autor
AVALIAÇÃO DAS ALTERAÇÕES NAS PROPRIEDADES FÍSICO- QUÍMICAS DO DOCE DE LEITE EM PASTA COMERCIALIZADO EM AÇAILÂNDIA/MA DURANTE A VIDA DE PRATELEIRA DO PRODUTO Autor (1) Claudiany Silva Leite Lima; Autor
MÉTODO DE ANÁLISE LL-WM 80 L NOVO PROCESSO PARA ANODIZAÇÃO DO ALUMÍNIO. Procedimento para a padronização da solução de Sulfato Cérico 0,1N
 Reagentes Necessários Solução de Ácido Sulfúrico 50% Solução de Sulfato Cérico 0,1 N Solução de Ácido Oxálico 0,1 N Solução de Sulfato Ferroso de Amônia (F.A.S.), 0,1 N Solução Ferroin como indicador Modo
Reagentes Necessários Solução de Ácido Sulfúrico 50% Solução de Sulfato Cérico 0,1 N Solução de Ácido Oxálico 0,1 N Solução de Sulfato Ferroso de Amônia (F.A.S.), 0,1 N Solução Ferroin como indicador Modo
UNIVERSIDADE DE SÃO PAULO FACULDADE DE CIÊNCIAS FARMACÊUTICAS
 UNIVERSIDADE DE SÃO PAULO FACULDADE DE CIÊNCIAS FARMACÊUTICAS FBA0201 Bromatologia Básica FIBRA ALIMENTAR: MÉTODOS ANALÍTICOS ERIC DE CASTRO TOBARUELA Farmacêutico UFC Mestrado Ciência dos Alimentos -
UNIVERSIDADE DE SÃO PAULO FACULDADE DE CIÊNCIAS FARMACÊUTICAS FBA0201 Bromatologia Básica FIBRA ALIMENTAR: MÉTODOS ANALÍTICOS ERIC DE CASTRO TOBARUELA Farmacêutico UFC Mestrado Ciência dos Alimentos -
02/05/2016. Normas de laboratório INTRODUÇÃO INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE SEGURANÇA NO LABORATÓRIO:
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos Normas de laboratório INTRODUÇÃO Acidente de trabalho é todo evento: inesperado e indesejável que
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Análise de Alimentos Normas de laboratório INTRODUÇÃO Acidente de trabalho é todo evento: inesperado e indesejável que
Preparação do cloreto de t-butila. Carina de Freitas Vellosa Daiane Cristina Romanini
 Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Digestão enzimática do amido de milho pela ptialina da saliva
 Digestão enzimática do amido de milho pela ptialina da saliva Objetivos: Gelatinização de amido de milho Digestão de amido de milho gelatinizado com amilase salivar Digestão de amido de milho gelatinizado
Digestão enzimática do amido de milho pela ptialina da saliva Objetivos: Gelatinização de amido de milho Digestão de amido de milho gelatinizado com amilase salivar Digestão de amido de milho gelatinizado
4028 Síntese de 1-bromodecano a partir de 1-dodecanol
 4028 Síntese de 1-bromodecano a partir de 1-dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Classificação Tipos de reações e classes das substâncias
4028 Síntese de 1-bromodecano a partir de 1-dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Classificação Tipos de reações e classes das substâncias
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA
 MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
Determinação da cor, turbidez, ph, salinidade, condutividade e O 2 dissolvido
 Experimento 1 Águas Determinação da cor, turbidez, ph, salinidade, condutividade e O 2 dissolvido Todos os parâmetros mencionados serão determinados de uma só vez in situ com um sensor portátil Hanna.
Experimento 1 Águas Determinação da cor, turbidez, ph, salinidade, condutividade e O 2 dissolvido Todos os parâmetros mencionados serão determinados de uma só vez in situ com um sensor portátil Hanna.
QUÍMICA FARMACÊUTICA
 INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
MF-441.R-1 - MÉTODO DE DETERMINAÇÃO DA ALCALINIDADE (MÉTODO TITULOMÉTRICO COM INDICADOR)
 MF-441.R-1 - MÉTODO DE DETERMINAÇÃO DA (MÉTODO TITULOMÉTRICO COM INDICADOR) Notas: Aprovado pela Deliberação CECA n 0313, de 01 de julho de 1982 Publicado no DOERJ de 25 de agosto de 1982 1. OBJETIVO Determinação
MF-441.R-1 - MÉTODO DE DETERMINAÇÃO DA (MÉTODO TITULOMÉTRICO COM INDICADOR) Notas: Aprovado pela Deliberação CECA n 0313, de 01 de julho de 1982 Publicado no DOERJ de 25 de agosto de 1982 1. OBJETIVO Determinação
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS
 EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
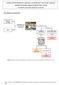 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
3001 Hidroboração/oxidação de 1-octeno a 1-octanol
 3001 Hidroboração/oxidação de 1-octeno a 1-octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Referência Bibliográfica A.S. Bhanu
3001 Hidroboração/oxidação de 1-octeno a 1-octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Referência Bibliográfica A.S. Bhanu
MF-431.R-1 - MÉTODO TURBIDIMÉTRICO PARA DETERMINAÇÃO DE SULFATO
 MF-431.R-1 - MÉTODO TURBIDIMÉTRICO PARA DETERMINAÇÃO DE SULFATO Notas: Revisão aprovada pela Deliberação CECA nº 0102, de 04 de setembro de 1980. Publicada no DOERJ de 18 de setembro de 1980. 1. OBJETIVO
MF-431.R-1 - MÉTODO TURBIDIMÉTRICO PARA DETERMINAÇÃO DE SULFATO Notas: Revisão aprovada pela Deliberação CECA nº 0102, de 04 de setembro de 1980. Publicada no DOERJ de 18 de setembro de 1980. 1. OBJETIVO
Concentração de soluções e diluição
 Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES. META Determinar a concentração de ácido clorídrico por titulometria de neutralização.
 Aula INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES META Determinar a concentração de ácido clorídrico por titulometria de neutralização. OBJETIVOS Ao final desta aula o aluno deverá: detectar o ponto
Aula INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES META Determinar a concentração de ácido clorídrico por titulometria de neutralização. OBJETIVOS Ao final desta aula o aluno deverá: detectar o ponto
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D
 RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
EQUIPAMENTO BÁSICO DE LABORATÓRIO
 1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
4006 Síntese do éster etílico do ácido 2-(3-oxobutil) ciclopentanona-2-carboxílico
 4006 Síntese do éster etílico do ácido 2-(3-oxobutil) ciclopentanona-2-carboxílico CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156,2) (70,2) (270,3) (226,3) Classificação Tipos de reações
4006 Síntese do éster etílico do ácido 2-(3-oxobutil) ciclopentanona-2-carboxílico CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156,2) (70,2) (270,3) (226,3) Classificação Tipos de reações
Professor Daniel Rossi Janeiro de 2012
 Equipamentos de Laboratório Professor Daniel Rossi Janeiro de 2012 [Escolha a data] O LABORATORIO A palavra laboratório provém da união de duas palavras latinas: labor = trabalho + oratorium = lugar de
Equipamentos de Laboratório Professor Daniel Rossi Janeiro de 2012 [Escolha a data] O LABORATORIO A palavra laboratório provém da união de duas palavras latinas: labor = trabalho + oratorium = lugar de
1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº. Conteúdo: Vidrarias de laboratório
 1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Vidrarias de laboratório Legenda: 1 Tubos de ensaio: Usado em reações químicas, principalmente
1º trimestre Sala de Estudo Química Data: 26/02/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Vidrarias de laboratório Legenda: 1 Tubos de ensaio: Usado em reações químicas, principalmente
XXV - MEL. Esta classificação é em fotômetro ou espectrofotômetro a 560nm, em célula de 1cm, usando como branco a glicerina pura.
 XXV - MEL 1. CARACTERÍSTICAS ORGANOLÉPTICAS 1.1. Aspecto: Líquido denso, viscoso, translúcido ou cristalino. 1.2. Classificação segundo a coloração Coloração Escala de Pfund Faixa de coloração Branco d
XXV - MEL 1. CARACTERÍSTICAS ORGANOLÉPTICAS 1.1. Aspecto: Líquido denso, viscoso, translúcido ou cristalino. 1.2. Classificação segundo a coloração Coloração Escala de Pfund Faixa de coloração Branco d
POQ 6 Determinação do teor de Lípidos
 POQ 6 Determinação do teor de Lípidos Elaboração: RQ Verificação: DT e RDQ Aprovação: DT e RQ Entidade Emissora: RQ POQ 6 E0 (18-10-2013) 1/7 Historial de Versões Edição Data Motivo da Emissão/Alterações
POQ 6 Determinação do teor de Lípidos Elaboração: RQ Verificação: DT e RDQ Aprovação: DT e RQ Entidade Emissora: RQ POQ 6 E0 (18-10-2013) 1/7 Historial de Versões Edição Data Motivo da Emissão/Alterações
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS. Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
fmvz-unesp FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA - BOTUCATU Curso de Pós-Graduação em Zootecnia Nutrição e Produção Animal
 fmvz-unesp FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA - BOTUCATU Curso de Pós-Graduação em Zootecnia Nutrição e Produção Animal MÉTODOS DE DETERMINAÇÃO DE AMINOÁCIDOS NOS ALIMENTOS Kátia Sardinha Bisinato
fmvz-unesp FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA - BOTUCATU Curso de Pós-Graduação em Zootecnia Nutrição e Produção Animal MÉTODOS DE DETERMINAÇÃO DE AMINOÁCIDOS NOS ALIMENTOS Kátia Sardinha Bisinato
PROCESSOS DE SEPARAÇÃO. Prof. Ms. George Verçoza
 PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
Ministério da Educação Universidade Federal do Paraná Setor Palotina. Soluções e cálculos de soluções
 Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno
![3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno 3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno](/thumbs/61/45682965.jpg) 00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
4ª Jornada Científica e Tecnológica e 1º Simpósio de Pós-Graduação do IFSULDEMINAS 16, 17 e 18 de outubro de 2012, Muzambinho MG
 4ª Jornada Científica e Tecnológica e 1º Simpósio de Pós-Graduação do IFSULDEMINAS 16, 17 e 18 de outubro de 2012, Muzambinho MG Análise de resíduos da fabricação de queijos para uso potencial em demais
4ª Jornada Científica e Tecnológica e 1º Simpósio de Pós-Graduação do IFSULDEMINAS 16, 17 e 18 de outubro de 2012, Muzambinho MG Análise de resíduos da fabricação de queijos para uso potencial em demais
ASSUNTO: Uso do Microscópio Luminoso e Microscópio Estereoscópico
 AULA PRÁTICA 01 ASSUNTO: Uso do Microscópio Luminoso e Microscópio Estereoscópico Microscópio Luminoso Microscópio Estereoscópico AMOSTRA: com fragmentos Fragmentos em placas 1. Observar as lâminas no
AULA PRÁTICA 01 ASSUNTO: Uso do Microscópio Luminoso e Microscópio Estereoscópico Microscópio Luminoso Microscópio Estereoscópico AMOSTRA: com fragmentos Fragmentos em placas 1. Observar as lâminas no
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
EXTRAÇÃO COM SOLVENTES II
 EXTRAÇÃO COM SOLVENTES II (Quimicamente Ativa) Discentes: Ana Carolina G. V. Carvalho Laisa dos Santos Lípari Docentes: Profª. Amanda Coelho Danuello Prof.Dr. José Eduardo de Oliveira Prof.Dr. Leonardo
EXTRAÇÃO COM SOLVENTES II (Quimicamente Ativa) Discentes: Ana Carolina G. V. Carvalho Laisa dos Santos Lípari Docentes: Profª. Amanda Coelho Danuello Prof.Dr. José Eduardo de Oliveira Prof.Dr. Leonardo
2028 Reação de brometo de magnésio de ciclohexila com dióxido de carbono para ácido ciclo-hexano carboxílico
 28 Reação de brometo de magnésio de ciclohexila com dióxido de carbono para ácido ciclo-hexano carboxílico Br + Mg éter etílico MgBr 1. CO 2 2. H 3 O O OH C 6 H 11 Br CO 2 (163,1) (24,3) (44,) C 7 H 12
28 Reação de brometo de magnésio de ciclohexila com dióxido de carbono para ácido ciclo-hexano carboxílico Br + Mg éter etílico MgBr 1. CO 2 2. H 3 O O OH C 6 H 11 Br CO 2 (163,1) (24,3) (44,) C 7 H 12
Preparação e padronização de soluções
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Figura 1: Equilíbrio químico entre as espécies glicose, manose e frutose em meio alcalino
 Introducão Um açúcar redutor (AR) pode ser identificado pelo reagente de Benedict 1 porque o grupo aldeído, presente no açúcar, reduz o íon cúprico (Cu 2+ ) formando um precipitado de óxido de cobre (I),
Introducão Um açúcar redutor (AR) pode ser identificado pelo reagente de Benedict 1 porque o grupo aldeído, presente no açúcar, reduz o íon cúprico (Cu 2+ ) formando um precipitado de óxido de cobre (I),
Alguns materiais utilizados no Laboratório de Química
 Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Experiência 1: Identificação de Amostras Sólidas por densidade 59
 Sumário Prefácio da 2 a Edição 17 Prefácio da 1 a edição 21 Capítulo 1: EQUIPAMENTOS BÁSICOS DE LABORATÓRIO 25 Capítulo 2: SEGURANÇA EM LABORATÓRIO 39 COMO MANTER UM AMBIENTE DE LABORATÓRIO SAUDÁVEL? 39
Sumário Prefácio da 2 a Edição 17 Prefácio da 1 a edição 21 Capítulo 1: EQUIPAMENTOS BÁSICOS DE LABORATÓRIO 25 Capítulo 2: SEGURANÇA EM LABORATÓRIO 39 COMO MANTER UM AMBIENTE DE LABORATÓRIO SAUDÁVEL? 39
REAGENTES H 2 C N CH 2 CH 2 N CH 2
 PRÁTICA 2 DETERMINAÇÃ DE CÁLCI EM LEITE Metodologia de análise: Volumetria de Complexação MATERIAIS Bureta de 25 ml Béquer 100 e 250 ml Erlenmeyer de 250 ml Proveta de 50 ml Balão volumétrico 100 ml Pipetas
PRÁTICA 2 DETERMINAÇÃ DE CÁLCI EM LEITE Metodologia de análise: Volumetria de Complexação MATERIAIS Bureta de 25 ml Béquer 100 e 250 ml Erlenmeyer de 250 ml Proveta de 50 ml Balão volumétrico 100 ml Pipetas
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
MÉTODOS PARA DETERMINAÇÃO DA COMPOSIÇÃO CENTESIMAL DE ALIMENTOS
 MÉTODOS PARA DETERMINAÇÃO DA COMPOSIÇÃO CENTESIMAL DE ALIMENTOS Goiânia 2015 1 SUMÁRIO RESÍDUO POR INCINERAÇÃO CINZAS... 1 1 Princípios Gerais do Método... 1 2 Material... 1 3 Procedimento... 1 4 Bibliografia
MÉTODOS PARA DETERMINAÇÃO DA COMPOSIÇÃO CENTESIMAL DE ALIMENTOS Goiânia 2015 1 SUMÁRIO RESÍDUO POR INCINERAÇÃO CINZAS... 1 1 Princípios Gerais do Método... 1 2 Material... 1 3 Procedimento... 1 4 Bibliografia
DETERMINAÇÃO DO GRAU DE UMIDADE EM SEMENTES. Francisco Guilhien Gomes Junior. Identificação da maturidade fisiológica
 Produção de Sementes (LPV-638) Graduação Engenharia Agronômica Segundo Semestre de 2015 DETERMINAÇÃO DO GRAU DE UMIDADE EM SEMENTES Francisco Guilhien Gomes Junior Tecnologia de Sementes Depto de Produção
Produção de Sementes (LPV-638) Graduação Engenharia Agronômica Segundo Semestre de 2015 DETERMINAÇÃO DO GRAU DE UMIDADE EM SEMENTES Francisco Guilhien Gomes Junior Tecnologia de Sementes Depto de Produção
AULA 3. Soluções: preparo e diluição. Laboratório de Química QUI OBJETIVOS
 AULA 3 Soluções: preparo e diluição OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
AULA 3 Soluções: preparo e diluição OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
