UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS MESTRADO ACADÊMICO EM CIÊNCIAS VETERINÁRIAS
|
|
|
- João Guilherme Lima Lacerda
- 6 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS MESTRADO ACADÊMICO EM CIÊNCIAS VETERINÁRIAS LIVIA BRUNETTI APOLLONI EFEITO DO HORMÔNIO ANDROSTENEDIONA SOBRE O DESENVOLVIMENTO IN VITRO DE FOLÍCULOS SECUNDÁRIOS CAPRINOS ISOLADOS FORTALEZA CEARÁ 2015
2 LIVIA BRUNETTI APOLLONI EFEITO DO HORMÔNIO ANDROSTENEDIONA SOBRE O DESENVOLVIMENTO IN VITRO DE FOLÍCULOS SECUNDÁRIOS CAPRINOS ISOLADOS Dissertação apresentada ao Programa de Pós-Graduação em Ciências Veterinárias da Faculdade de Veterinária da Universidade Estadual do Ceará, como requisito parcial para a obtenção do grau de Mestre em Ciências Veterinárias. Área de Concentração: Reprodução e Sanidade Animal. Linha de Pesquisa: Reprodução e Sanidade de Pequenos Ruminantes. Orientador: Prof. Dr. José Ricardo de Figueiredo. FORTALEZA CEARÁ 2015
3
4
5 A Deus, por sempre me colocar no lugar certo, na hora certa!
6 AGRADECIMENTOS À Universidade Estadual do Ceará (UECE) e ao Programa de Pós-graduação em Ciências Veterinárias (PPGCV) por minha formação e capacitação profissional. Á Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo incentivo concedido na forma de bolsa de estudo e ao Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais (LAMOFOPA) por todo suporte oferecido para a realização deste trabalho. À Deus primeiramente, por ter me concedido a oportunidade de lutar para realizar meus sonhos, por ter iluminado meus caminhos e meus passos e por ter colocado anjos disfarçados de amigos nessa trajetória. À minha mãe Marli Brunetti Apolloni e ao meu pai Luis Antônio Apolloni, por todo amor dedicado a mim diariamente, mesmo nos dias em que eu não merecia tanto amor assim. Por toda a paciência e dedicação concedida a minha pessoa, e principalmente pelo exemplo de perceverança que levarei comigo por toda vida. Àquela que chegou e se tornou minha segunda mãe. Àquela que encheu meu coração de amor nos dias mais difíceis, que me deu a mão nos momentos em que eu mais precisava e que me fez ter fé que tudo no final daria certo. Àquela que soube, com a maneira mais doce e paciente que poderia existir, transmitir todo o seu conhecimento, me ajudando a adquirir as ferramentas necessárias para concluir esta etapa da minha vida. Àquela que foi minha co-orientadora mas, que acima de tudo, foi o melhor presente que eu poderia ganhar. Àquela que foi o elemento chave para a conclusão deste trabalho, me dando suporte emocional e científico. Àquela que foi essencial para essa trajetória, que será sempre lembrada com o coração cheio de saudade. Àquela que eu não sei expressar com palavras o quanto é especial para mim, mas que eu espero ter demonstrado isso á ela todos os dias em que convivemos. Jamily Bezerra Bruno por todo o carinho dedicado a mim, muito obrigada. Aos meus amigos Lívia Miranda, Marcos Vinícius do Amaral, Matheus Neiva da Matta, Gustavo Pontel, Jéssica Cilense de Andrade, Marina Mansur, Mariane Crespoline dos Santos, Laís Simonetti, Milena Chales Pereira e Heloísa Pinotti que dividiram comigo todas as alegrias e angústias presentes nesta trajetória. Que se fizeram presentes, mesmo na ausência a cada momento. Dedico. À minha equipe Anna Clara Accioly Ferreira, Victor Macêdo Paes, Jesus de los Reyes Cadenas Moreno e Francisco Léo Nascimento de Aguiar, que foram
7 extremamente eficientes e dedicados para a realização deste trabalho, me oferecendo o auxílio necessário para concluir o experimento proposto bem como a escrita do artigo técnico. Ao Benner Geraldo Alvez que chegou para deixar perfeitamente completo e finalizar a realização deste trabalho com êxito, contribuindo com todo o seu conhecimento, criatividade e paciência. À Kele Amaral Alves sua esposa, pelos conselhos e apoio. Aos meus grandes amigos Franciele Lunardi e Francisco Léo Nascimento de Aguiar pelas infinitas conversas, conselhos, amor, alegria e todos os bons sentimentos recebidos e compartilhados. À minha amiga Marcela Pinheiro Paz, pelo companheirismo, disposição e tranquilidade que sempre me dedicou em todos os dias desta caminhada. À vocês três, que esse seja o começo de uma grande amizade para toda a vida. Aos funcionários do PPGCV, Adriana, Sr. João e Daniela, em especial ao Cesár que desde o início me acolheu com carinho. À todos os membros da equipe do LAMOFOPA que me deram apoio e contribuíram de forma direta ou indireta para a execução deste trabalho. Ao Dr. Felipe Zandonadi Brandão, Dr. Johan Smitz e ao Dr. Gary Apgar pela contribuição na realização deste trabalho. Aos membros da banca Dra. Jamily Bezerra Bruno, Dr. Felipe Zandonadi Brandão e Dr. Luis Alberto Vieira, por gentilmente terem aceitado o convite de participar da minha banca examinadora, contribuindo para a finalização desta dissertação. Ao meu orientador José Ricardo de Figueiredo, pela confiança depositada em mim, por ter aberto as portas do seu laboratório e ter me dado a oportunidade de crescer profissionalmente e pessoalmente. Por ter dividido comigo todo seu conhecimento e ter transmitido toda a sua calma e serenidade necessárias para minha permanência. Por acreditar que eu poderia ir sempre além do esperado, fazendo assim com que eu quebrasse minhas próprias barreiras. Por mesmo sem saber, ter sido um exemplo de profissional a ser seguido por mim, sempre. Enfim, a todos vocês, meu muito obrigada!
8 RESUMO Este estudo investigou o efeito de androstenediona (A4) sozinha ou em associação com diferentes formas de adição do hormônio folículo-estimulante recombinante bovino (FSH) sobre o cultivo in vitro de folículos pré-antrais caprinos isolados. Os folículos foram mecanicamente isolados a partir de fragmentos do tecido ovariano e cultivados durante 18 dias em α-mem suplementado ou não com A4 (10 ng/ml) sozinha ou em associação com uma concentração fixa (A4+FixFSH: 100 ng/ml) ou sequencial (A4+SeqFSH: Dia 0: 100 ng/ml; Dia 6: 500 ng/ml; 12 Dia: 1000 ng/ml) de FSH. Após 18 dias, os oócitos foram recuperados para a maturação in vitro e posterior análise do status meiótico através do microscópio de fluorescência. Ao final do cultivo in vitro, somente o tratamento A4+SeqFSH apresentou menor (P < 0.05) taxa de folículos intactos, probabilidade de sobrevivência e retomada da meiose, assim como maior (P < 0.05) percentagem de folículos degenerados e/ou extrusos após formação de antro. Os resultados em geral mostraram também uma correlação positiva entre os folículos que apresentaram crescimento rápido e os folículos que degeneraram e/ou extrusaram após a formação do antro. Em relação a produção hormonal, a adição de A4 sozinha ou em associação com o FSH não aumentou (P> 0.05) os níveis de estradiol ou de androstenediona após o dia 6, quando comparados com o controle. No entanto, no dia 18 os níveis de androstenodiona foram menores (P < 0.05) no tratamento A4+SeqFSH quando comparado com A4 sozinha ou ao tratamento A4+FixFSH, porém a produção de estradiol não diferiu (P > 0.05). Em conclusão, este estudo demonstrou que o crescimento folicular acelerado afetou negativamente a morfologia dos folículos préantrais caprino cultivados in vitro. Além disso, a associação de androstenodiona com concentrações crescentes de FSH foi prejudicial para o desenvolvimento folicular, uma vez que esta associação acelerou o crescimento in vitro dos folículos cultivados. Palavras-chave: cultivo in vitro, folículos secundários, cabra, FSH, andrógeno, taxa de crescimento.
9 ABSTRACT This study investigated the effect of androstenedione (A4) alone or in association with different concentrations of bovine recombinant FSH on the in vitro culture of isolated goat preantral follicles. Follicles were mechanically isolated from the ovarian tissue and cultured for 18 days in α-mem supplemented or not with A4 (10 ng/ml) alone or in association with fixed (A4+FixFSH: 100 ng/ml) or sequential (A4+SeqFSH: Day 0: 100 ng/ml; Day 6: 500 ng/ml; Day 12: 1000 ng/ml) concentrations of FSH. After 18 days, the oocytes were recovered for in vitro maturation and fluorescence analysis. At day 18 of culture, only A4+SeqFSH treatment showed a lower (P < 0.05) rate of intact follicles, survival probability and meiotic resumption, as well as higher (P < 0.05) percentage of degeneration and/or extrusion after antrum formation. Take together, these results showed a positive correlation between fast-growing follicles and follicles that degenerated and/or extruded after antrum formation. When compared to control, the addition of A4 alone or in association of FSH did not increase (P > 0.05) the estradiol production or androstenedione levels on Day 6. However on Day 18, the androstenedione levels was significantly lower in A4+SeqFSH treatment when compared to A4 alone or to A4+FixFSH treatments, while the estradiol production did not differ (P > 0.05). In summary, this study demonstrated that accelerated follicle growth negatively impacted the morphology of caprine preantral follicle cultured in vitro. In addition, the association of androstenedione with increasing concentration of FSH was detrimental to follicular survival and development. Keywords: in vitro culture, secondary follicles, goat, FSH, androgens, growth rates
10 LISTA DE FIGURAS Capítulo 1 Figura 1 - Representação esquemática da esteroidogênese nas células ovarianas. Nas células da teca, os andrógenos (androstenediona e testosterona) são produzidos em resposta ao estímulo do hormônio luteinizante (LH) através da captação do colesterol circulante. Após difundir-se para as células da granulosa, os andrógenos são convertidos em estrógenos (estrona e estradiol) pela enzima aromatase sob a ação do FSH Figura 2 - Ação genômica do receptor de andrógeno. (1) Ligação do andrógeno ao seu receptor (AR) no citoplasma celular; (2) Dissociação da proteína de choque término (HSP) do complexo e recrutamento da importina-α e proteína 70 associada ao receptor de andrógeno (ARA70) para translocação do complexo para o núcleo; (3) Formação de um dímero de complexos ligantes-receptores; (4) Ligação dos dímeros a sequência do DNA responsiva aos andrógenos (ARE) e; (5) Início da transcrição gênica dos genes alvos Figura 3 - Ação não-genômica do receptor de andrógeno. (1) Ativação do AR e interação com moléculas sinalizadoras (PI3K e RTK) localizadas na membrana plasmática; (2) Ativação das vias AKT e MAPK pela PI3K e RTK, respectivamente. (3) Fosforilação dos AR pelas moléculas sinalizadoras (independente da ligação de seus ligantes) (4) Translocação nuclear dos AR. (5) Sinalização de cascatas através vias AKT e MAPK que regulam receptores nucleares (RN) e fatores de transcrição (FT) e/ou; (6) Eventos sinalizadores citoplasmáticos, tais como a liberação de cálcio (Ca 2+ ) intracelular pelo reticulo endoplasmático e mitocôndria Capítulo 2 Figure 1 - Percentage of intact follicles during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus
11 Figure 2 - Figure 3 - Figure 4 - Figure 5-11 androstenedione and fixed concentrations of rbfsh. A,B Within day, uncommon uppercase letters indicate difference (P < 0.05). a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Tended to differ from Day 18 (P < 0.08) Follicle survival probability (Kaplan-Meier plot) during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. * Differed from control ( P < 0.05) Percentage of degenerated follicles during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α- MEM + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Among treatments within the same day (P > 0.05) Percentage of extruded follicles during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Among treatments within the same day (P > 0.05) (A) Representation of follicles (n = 169) classified according to growth rate in non-, slow-, and fast-growing. (B) Frequency distributions of follicles in growing categories during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus
12 Figure 6 - Figure 7 - Figure 8 - Figure 9 - Figure androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within the same growing categories, uncommon lowercase letters indicate difference (P < 0.05). # Tended to differ from control (P < 0.06). Tended to differ from control (P < 0.07). 77 Relationship between antrum formation and follicle diameter. Each point of the graph is a follicle recorded during in vitro culture (n = 169). The follicles evaluated were defined by binary values (without antrum formation = 0; presence of antrum formation = 1) to dependent variable. A logistic regression (antrum predicted probability) is represented by the equation and the black line [Logit P = ( follicle diameter); P < 0.05].. 78 Mean (± SEM) daily growth rate of follicles according to their ability to form antrum and maintain normal morphology. a,b,c Uncommon lowercase letters indicate difference (P < 0.05) Effect of the addition of androstenedione associated or not with fixed and sequential concentrations of FSH on the antrum formation and maintenance of normal morphology. Control: α-mem + ; A4: α- MEM + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within the same antrum conditions, uncommon lowercase letters indicate difference (P < 0.05) Relationship between antrum phenotypes conditions and follicular growth. Each point of graph is a follicle recorded during in vitro culture (n = 169). The follicles evaluated were defined by binary values (absence of antrum formation = 1; antrum maintenance = 2; follicles degenerated and/or extruded after antrum formation = 3) to dependent variable. A linear regression is represented by the equation and the black line [Antrum formation conditions = ( follicular growth); R 2 = 0.08; r = 0.28; P < 0.001] Percentage of meiotic resumption, germinal vesicle (GV), germinal vesicle breakdow (GVBD), metaphase I (MI) and metaphase II (MII) of oocytes from preantral follicles cultured in vitro in
13 Figure 11 - Figure medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α- MEM + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within the same parameter, values with different letters differ (P < 0.05). # Tended to differ from A4+SeqFSH (P < 0.06).. 82 Regression analysis of the chromatin configuration (GV, germinal vesicle; GVBD, germinal vesicle breakdow; MI, metaphase I; MII, metaphase II) and oocyte diameter. Each point of graph is a oocyte evaluated after in vitro maturation (n = 68). The oocytes evaluated were defined by values (GV = 2; GVBD = 3; MI = 4; and MII = 5) to chromatin configuration (dependent variable). A linear regression is represented by the equation and the black line [chromatin configuration = ( oocyte diameter); R 2 = 0.06; r = 0.24; P < 0.05] Mean (± SEM) androstenedione levels from preantral follicles cultured in vitro in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α- MEM + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. A,B,C Within day, uncommon uppercase letters indicate difference (P < 0.05). Tended to differ from A4 (P < 0.07). Within treatment between days (P > 0.05)
14 14 LISTA DE TABELAS Capítulo 1 Tabela 1 - Efeito dos andrógenos no desenvolvimento folicular in vitro Capítulo 2 Table 1 - Mean (± SEM) diameter of normal follicles cultured in vitro for 18 days in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH Table 2 - Mean (± SEM) daily growth of normal follicles cultured in vitro for 18 days in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH... 72
15 LISTA DE ABREVIAÇÕES 15 A4 Androstenedione (Androstenediona) AMH Anti-Mullerian Hormone (Hormônio Anti-Mulleriano) AR Androgen receptor (receptor de andrógeno) ARA70 Proteína 70 associada ao receptor de andrógeno ARE Elementos responsivos aos andrógenos AREG Anfiregulina ARKO AR knockout (Nocaute para o receptor de andrógeno) BSA Bovine serum albumin (Albumina sérica bovina) C Graus Celsius Ca 2+ Calceína - AM CAPES cdna CG CNPq CO 2 COX-2 CV CYP17 CYP19 Cálcio Calceína acetoximetil Coordenação de Aperfeiçoamento de Pessoal de Nível Superior Complementary DNA (DNA Complementar) Células da granulosa Conselho Nacional de Desenvolvimento Científico e Tecnológico Carbon dioxide (Dióxido de Carbono) Ciclooxigenase-2 Coefficient of variation (coeficiente de variação) Cytochrome P alpha hydroxylase P450 aromatase D6, D12, D18 Day 6, Day 12, Day 18 (Dia 6, Dia 12, Dia 18) DHT Dihydrotestosterone (Dihidrotestosterona) DNA Ácido desoxirribonulceico Dr. Doctor (Doutor) Dra. Doctor (Doutora) E2 Estradiol EGF Epidermal growth factor (Fator de crescimento epidermal) FGF Fibroblast growth factor (Fator de crescimento de fibroblastos) FSH Follicle Stimulating Hormone (Hormônio Folículo Estimulante) Fig Figura FIV Fertilização in vitro FixFSH FSH em uma concentração fixa FSHR FSH Receptor (Receptor para FSH)
16 FT Fator de transcrição G Gauge GH Growth Hormone (Hormônio do crescimento) h Horas HSP Proteína de choque término IGF-I Insulin-like growth factor-i (Fator de crescimento semelhante à insulina-i) IGF-II Insulin-like growth factor-ii (Fator de crescimento semelhante à insulina-ii) IVM In vitro maturation (maturação in vitro) kg Quilograma LAMOFOPA Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais LH Luteinizing hormone (Hormônio Luteinizante) LHR Luteinizing hormone receptor (Receptor do hormônio luteinizante) LRH-1 Receptor homólogo do fígado -1 M Molar MEM Minimal essential medium (Meio essencial mínimo) mg Miligrama min Minutos mirna microrna ml Mililitro Mm mili-molar mm milímetro mrna Messenger ribonucleic acid (Ácido ribonucléico mensageiro) MOEPF Manipulation of Oocytes Enclosed in Preantral Follicles MOIFOPA Manipulação de Oócitos Inclusos em Folículos Ovarianos Préantrais MI Metaphase I (Metáfase I) MII Metaphase II (Metáfase II) nm Nanomol ng Nanograma P4 Progesterona P450scc Enzima da clivagem da cadeia lateral do colesterol P < 0.05 Probabilidade de erro menor do que 5%
17 p. Página PBS Phosphate buffered saline (Tampão fosfato-salino) PCR Polymerase Chain Reaction (Reação em cadeia da polimerase) pg Picograma PH potencial hidrogeniônico PPGCV Programa de Pós-Graduação em Ciências Veterinárias qpcr Quantitative PCR RIA Radioimmunoassay (radioimunoensaio) rbfsh Recombinant bovine FSH (FSH recombinante bovino) RN Receptor Nuclear RT-PCR Real time PCR (PCR em tempo real) SEM Standard error of means (Erro padrão da média) SET Protein patient SE translocation SeqFSH FSH em concentrações crescentes SF-1 Fator esteroidogênico-1 StAR Proteína Reguladora Aguda da Esteroidogênese T Testosterona TC TCM-199 Theca cell (célula da teca) Tissue culture medium (Meio de cultivo tecidual- 199) TRL Trilostano U Unidade UECE Universidade Estadual do Ceará UFF Universidade Federal Fluminense USA United States of America UZ Universitair Ziekenhuis VG Germinal vesicle (Vesícula germinal) VGBD Germinal vesicle breakdown (Quebra da vesícula germinal) α-mem Alpha minimal essential medium (Meio essencial mínimo alfa) μg Microgramas μl Microlitro μm Micrômetro µm Micromolar 3β-HSD 3β-hydroxysteroid dehydrogenase 17β-HSD 17 β-hydroxisteroid dehydrogenase % Porcentagem
18 < Menor = Igual > Maior Maior ou igual Menor ou igual + Mais ± Mais ou Menos
19 SUMÁRIO 1. INTRODUÇÃO REVISÃO DE LITERATURA CAPÍTULO JUSTIFICATIVA HIPÓTESES CIENTÍFICAS OBJETIVOS OBJETIVO GERAL OBJETIVOS ESPECÍFICOS CAPÍTULO CONCLUSÃO PERSPECTIVAS REFERÊNCIAS... 92
20 1. INTRODUÇÃO 20 Biotécnicas de reprodução animal vêm sendo desenvolvidas visando aumentar o potencial reprodutivo e a produtividade dos rebanhos, proporcionando uma grande revolução na multiplicação de animais de elevado potencial econômico (ARAÚJO, 2013). Dentre estas biotécnicas destaca-se a Manipulação de Oócitos Inclusos em Folículos Ovarianos Pré-Antrais (MOIFOPA) cujo objetivo é a recuperação de um grande número de oócitos inclusos em folículos pré-antrais, visando seu cultivo in vitro e sua completa maturação para uma posterior fecundação in vitro (FIV) (FIGUEIREDO et al., 2008). O desenvolvimento de um sistema de cultivo in vitro que garanta a ativação e o crescimento folicular até o estádio antral, no qual os oócitos possam ser recuperados e maturados in vitro é importante para o conhecimento dos fatores que controlam a foliculogênese (ANDRADE et al., 2005). Sendo assim, a composição do meio é essencial para a obtenção do sucesso no cultivo in vitro, uma vez que este deve prevenir ao máximo o processo de atresia folicular. Estudos vem sendo realizados testando a adição e associação de diferentes substâncias (hormônios: LIMA-VERDE et al., 2010; SARAIVA et al., 2010; MAGALHÃES et al., 2011; CHAVES et al., 2012; fatores de crescimento: MATOS et al., 2007; BRUNO et al., 2009) ao meio de cultivo in vitro de folículos pré-antrais visando maximizar o número de folículos viáveis após o cultivo, buscando completa maturação oocitária. Dentre os hormônios destacam-se os andrógenos, os quais estão diretamente relacionados com o processo de foliculogênese (LIMA-VERDE et al., 2011). Pesquisas avaliando seus efeitos no cultivo in vitro de folículos pré-antrais vem sendo realizadas em diferentes espécies a fim de melhorar o desenvolvimento folicular e maturação oocitária in vitro (murinos: TARUMI et al., 2014; suínos: TASAKI et al., 2013; caprinos: LIMA-VERDE et al., 2010; bovinos: YANG; FORTUNE, 2006; primatas não humano: RODRIGUES et al., 2015). De acordo com Lima-Verde et al. (2010) a adição de androstenediona (A4) associada ao FSH no meio de cultivo de folículos pré-antrais inclusos em fragmentos de tecido ovariano caprino, teve um papel importante na manutenção da percentagem de folículos normais durante o cultivo. Já quando adicionada isoladamente (A4: 50 e 100 ng/ml) promoveu um aumento significativo no diâmetro oocitário após um curto período de cultivo. Apesar destas informações, pouco se sabe sobre os reais efeitos
21 21 deste andrógeno associado ou não ao FSH (em diferentes concentrações) no cultivo in vitro de folículos pré-antrais caprino isolados. Assim, para um maior esclarecimento da importância deste projeto, a revisão de literatura a seguir (Capítulo 1) abordará os aspectos relacionados à foliculogênese e a biotécnica de MOIFOPA ( Ovário artificial ), a importância dos andrógenos no desenvolvimento folicular, bem como sua síntese e expressão de seus receptores, além do seu mecanismo de ação, dando ênfase nos principais resultados envolvendo a utilização destes hormônios no meio de cultivo in vitro de células ovarianas. Vale ressaltar que a presente revisão de literatura deu origem à um artigo de revisão intitulado Papel do andrógenos na foliculogênese em mamíferos submetido no periódico Acta Scientiae Veterinariae.
22 2. REVISÃO DE LITERATURA 2.1 CAPÍTULO 1 22 Papel dos Andrógenos na Foliculogênese em Mamíferos The Role of Androgens in Mammals Folliculogenesis Submetido no Periódico: Acta Scientiae Veterinariae Em: Novembro de 2015 Qualis: B1
23 Acta Scientiae Veterinariae Review Article 23 Papel dos Andrógenos na Foliculogênese em Mamíferos The Role of Androgens in Mammals Folliculogenesis Livia Brunetti Apolloni, Jamily Bezerra Bruno, Benner Geraldo Alves & José Ricardo de Figueiredo Laboratório de Manipulação de Oócitos Inclusos em Folículos Pré-Antrais (LAMOFOPA), Programa de Pós-graduação em Ciências Veterinárias (PPGCV), Universidade Estadual do Ceará (UECE), Fortaleza, CE, Brasil. CORRESPONDENCE: L.B. Apolloni Fax: +55 (85) ]. LAMOFOPA, Faculdade de Veterinária, Universidade Estadual do Ceará (UECE). Av. Dr. Silas Munguba, 1700, Campus do Itaperi. CEP Fortaleza, CE, Brazil. ABSTRACT Background: The production of steroid hormones is a physiological process termed steroidogenesis. An important stage of this process is the conversion of androgens into estrogens through aromatase enzyme. Ovarian cells (i.e., granulosa and theca cells) participate on the production of steroid hormones that are directly related with follicle development. Furthermore, androgens are important in the process of folliculogenesis, promoting follicular growth in different species. Thus, the aim of this review was to present the process of synthesis, mechanism of action, and importance of androgens in folliculogenesis. Additionally, the main results of in vitro culture of ovarian cells in the presence of these hormones were emphasized. Review: Folliculogenesis begins in prenatal life in most of species and can be defined as the process of formation, follicular growth, and oocyte maturation. Preantral follicles represent 95% of the follicular population and assisted reproductive technologies have been developed (e.g., Manipulation of Oocytes Enclosed in Preantral Follicles - MOEPF) in order to avoid the great follicle loss that occurs naturally in vivo by atresia. The MOEPF aim to obtain a large number of competent oocytes from preantral follicles and then subject to in vitro maturation, fertilization, and culture for embryo production. However, the development of an efficient medium to ensure the follicular survival and oocyte maturation is the major challenge of this biotechnology. To achieve the success
24 24 on in vitro culture, the effects of substances as androgens on follicular development have been evaluated. Androgens are steroid hormones produced in theca cells (TC) that are fundamental for follicular growth. These cells provide all the androgens required by the developing follicles for conversion into estrogens by the granulosa cells (GC). Androgens receptors (AR) are localized in cell cytoplasm of all follicular categories, being more expressed in preantral follicles. The androgen pathway initiates through its connection to its receptor, making a complex androgen-ar, that in the nucleus helps on the process of gene transcription related with follicular survival. This mechanism is androgen receptor genomic activity. In addition to genomic action, there is an androgen receptor non-genomic activity. This occurs through activation of AR and its interaction with different signaling molecules located on the cell membrane, triggering events that aid in the follicular development. Regardless of the androgens actions, ovarian cells of several species subjected to in vitro culture have shown the importance of these hormones on the follicle development. Recent studies demonstrated that androgens addition on the culture medium stimulated the activation of preantral follicles (bovine and caprine), antrum formation (swine), survival (non-primate), and oocyte maturation (antral follicles; bovine). Also, some studies suggest that the addition of these hormones on in vitro culture is dose-dependent and species-specific. Conclusion: This review shows the role of androgens in different stages of follicular development and its action as a substrate for steroidogenesis and transcription of genes related to follicular survival and oocyte maturation. However, when these hormones should be added during in vitro follicular culture and which concentration is required remains unclear, being necessary more studies to elucidate these aspects. Keywords: follicles, in vitro culture, androgens, steroidogenesis. Descritores: folículos, cultivo in vitro, andrógenos, esteroidogênese. I. INTRODUÇÃO II. FOLICULOGÊNESE E O OVÁRIO ARTIFICIAL III. SÍNTESE E IMPORTÂNCIA DOS ANDRÓGENOS NA FOLICULOGÊNESE OVARIANA IV. RECEPTORES DE ANDRÓGENOS (AR) V. MECANISMO DE AÇÃO DOS ANDRÓGENOS VI. PRINCIPAIS RESULTADOS OBTIDOS NO CULTIVO IN VITRO DE FOLÍCULOS COM ANDRÓGENOS
25 VII. CONCLUSÃO VIII. REFERÊNCIAS BIBLIOGRÁFICAS 25 I. INTRODUÇÃO A foliculogênese é um evento fisiológico complexo e responsável pela formação, crescimento e maturação folicular [95]. Durante este processo, diversos hormônios e fatores de crescimento estão envolvidos, tais como as gonadotrofinas (LH e FSH) e os hormônios esteróides (andrógenos e estrógenos) [45]. Estudos avaliando o cultivo folicular in vitro, demonstraram que a adição de hormônios [46,77], fatores de crescimento [10,56] entre outras substâncias [73,82] auxiliam no desenvolvimento de folículos pré-antrais nas espécies mamíferas. Dentre os hormônios estudados, os andrógenos destacam-se por sua importância no ovário mamífero e nos processos reprodutivos das fêmeas. Apesar de existirem trabalhos relacionados com o estudo dos andrógenos em diferentes espécies [74,91,107], alguns aspectos relativos à sua ação direta no desenvolvimento folicular ainda permanecem pouco esclarecidos e contraditórios. Nesta revisão serão abordados tópicos envolvendo a importância dos andrógenos no desenvolvimento folicular, bem como sua síntese e expressão de seus receptores, além do seu mecanismo de ação, dando ênfase nos principais resultados envolvendo a utilização destes hormônios no meio de cultivo in vitro de células ovarianas. II. FOLICULOGÊNESE E O OVÁRIO ARTIFICIAL A foliculogênese é um evento iniciado na vida pré-natal na maioria das espécies e pode ser definida como o processo de formação, crescimento e maturação folicular, iniciando-se com a formação do folículo primordial e culminando com o estádio de folículo pré-ovulatório [95]. Durante este processo, a morfologia folicular é alterada, uma vez que o oócito cresce e as células da granulosa e tecais circundantes se diferenciam. De acordo com seu grau de evolução, os folículos podem ser divididos em pré-antrais ou não cavitários (primordiais, primários e secundários) e antrais ou cavitários (terciários e pré-ovulatórios) [7], sendo que os folículos pré-antrais representam cerca de 90-95% de toda a população folicular [28]. Os folículos primordiais são constituídos por um oócito quiescente, esférico ou oval, circundado por células da granulosa de formato pavimentoso ou pavimentoso e cuboidais [71]. Seu núcleo é relativamente grande e ocupa uma posição central a excêntrica mostrando um nucléolo evidente. A zona pelúcida nesse estádio ainda não é
26 26 observada, verificando-se apenas uma justaposição do oócito e células da granulosa, sem nenhuma junção específica [49]. Acredita-se que a ativação dos folículos primordiais seja regulada por um balanço entre fatores inibitórios e estimulatórios originários tanto do ovário quanto de outras glândulas endócrinas [95]. Sendo assim, uma vez ativado o folículo caracteriza-se como primário e apresenta uma única camada de células da granulosa de formato cúbico circundando o oócito. A partir desse estádio o oócito passa a manter um estreito contato com essas células mediado por endocitose [9]. Na continuação do desenvolvimento folicular, os folículos secundários são caracterizados por possuírem um oócito circundado por duas camadas de células da granulosa de formato cubóide. Com o desenvolvimento dos folículos, aumenta o número de microvilos e inicia-se a formação da zona pelúcida, bem como das células da teca externa, a partir do estroma intersticial [95]. A partir do crescimento destes folículos e organização das células da granulosa em várias camadas, ocorre a formação de uma cavidade repleta de líquido denominada antro [9], sendo que a partir deste estádio os folículos passam a ser chamados de terciários ou antrais, os quais evoluem para folículos pré-ovulatórios ou De Graaf. O desenvolvimento dos folículos antrais é caracterizado por uma fase de crescimento, recrutamento, seleção e dominância [95] sendo a formação de folículos pré-ovulatórios um pré-requisito para a ovulação e formação do corpo lúteo, bem como da manutenção da fertilidade [23]. Porém, os sinais que interrompem a latência do folículo primordial quiescente e induzem o início do seu crescimento em direção à ovulação ou atresia ainda não são completamente conhecidos. É sabido que o número de folículos por ovário varia entre espécies e indivíduos, sendo aproximadamente na camundonga [79], na vaca [6], na cabra [48] e na mulher [25]. Porém 99,9% desta grande população folicular presente no ovário mamífero não chega à ovulação pois sofre um processo natural denominado atresia [28], reduzindo significantemente o número de oócitos à serem ovulados e diminuindo assim o potencial reprodutivo das fêmeas. Pesquisadores propuseram a existência de formação de novas células germinativas em mulheres [11] e camundongas [41] durante a vida adulta, sugerindo pela primeira vez a existência da neogênese (formação de novos ovócitos), desafiando assim o dogma instituído pela literatura sobre a existência finita de uma reserva de oócitos ao nascimento. Outros estudos realizados por Zou et al. [110] e White et al. [105] comprovaram a existência de células-tronco presentes na superfície do epitélio ovariano capazes de serem transformadas em oócitos tanto em camundongas quanto em mulheres.
27 27 Visando evitar a enorme perda folicular que ocorre naturalmente in vivo pela atresia, têm sido desenvolvidos sistemas de cultivo in vitro de folículos pré-antrais e antrais que tem possibilitado o estudo dos fatores que controlam este processo, além de auxiliarem na compreensão da foliculogênese in vitro. Dentre eeses sistemas de cultivo, destaca-se a MOIFOPA (Manipulação de Oócitos Inclusos em Folículos Ovarianos Pré- Antrais) também conhecida como Ovário artificial, uma biotécnica de reprodução assistida que vem sendo desenvolvida como alternativa para a recuperação de folículos pré-antrais, visando à obtenção de um grande número de oócitos competentes maturados in vitro para a produção de embriões. Esta biotécnica encontra-se em desenvolvimento e vem sendo aprimorada nos últimos anos, contribuindo significativamente para a pesquisa fundamental [2,8,74,75,91,92,107] por meio da elucidação da foliculogênese inicial, uma vez que permite acompanhar o desenvolvimento folicular a partir da fase pré-antral. A partir da MOIFOPA é possível a conservação de folículos isolados [8,16,73,77] ou inclusos em tecido ovariano [46,72] visando à estocagem por curto [39] ou longo período [26,50] e/ou descongelamento/aquecimento para posterior utilização no cultivo folicular in vitro [51]. Associada à criopreservação e transplante de tecido ovariano [3,20,80] pode auxiliar na preservação da fertilidade de mulheres que são submetidas a tratamentos quimio/radioterápicos [27]. Na medicina veterinária, apesar da mesma ainda não ter sido transferida para o sistema reprodutivo, no futuro poderá contribuir para o aumento da produtividade de animais de alto valor genético, além de auxiliar na preservação de animais ameaçados de extinção [81]. No tocante ao cultivo folicular, este pode ser realizado de duas maneiras, a saber: o cultivo in situ, no qual os folículos são cultivados inclusos no tecido ovariano [10] ou o cultivo de folículos isolados, nos quais os mesmos são isolados enzimaticamente [96] e/ou mecanicamente [8] a partir de fragmentos do córtex ovariano. O cultivo in situ tem como vantagem preservar a integridade tridimensional dos folículos, através da presença das células do estroma, assemelhando-se às condições in vivo [4]. Já o cultivo de folículos isolados proporciona a obtenção de um grande número de folículos primários e/ou secundários intactos, o acompanhamento individual dos folículos, além de favorecer uma maior perfusão do meio durante o cultivo [1]. Vale ressaltar que a eficiência do cultivo folicular in vitro pode ser avaliada através de diferentes técnicas, tais como: (i) histologia clássica [72]; (ii) microscopia eletrônica de
28 28 transmissão [24]; (iii) microscopia de fluorescência [8]; (iv) produção hormonal [74] e (v) biologia molecular [16]. O sistema de cultivo que apresenta melhores resultados é conhecido como cultivo em dois passos, no qual foi relatado o nascimento de 53 camundongos a partir de folículos primordiais desenvolvidos, maturados e fecundados in vitro [63]. Neste modelo é efetuado inicialmente o cultivo in situ, com o objetivo de maximizar a ativação folicular e o crescimento dos folículos primordiais até o estádio secundário, sendo posteriormente realizado o isolamento dos mesmos para o cultivo in vitro dos folículos isolados até a fase antral [93]. No entanto, apesar dos avanços observados, a produção de nascimentos a partir de folículos pré-antrais cultivados in vitro ainda não foi alcançada em espécies domésticas, se limitando apenas a produção de pequeno número de embriões na espécie caprina [55] e ovina [52]. Nota-se que, nas espécies domésticas, a composição do meio é um importante fator para obtenção de sucesso no cultivo folicular in vitro. Neste contexto, estudos têm sido realizados com o objetivo de avaliar os efeitos da adição de diferentes substâncias ao meio de cultivo, tais como hormônios [16,46,55,73] e fatores de crescimento [10,56] que atuam regulando a ativação e o crescimento folicular, com a finalidade de proporcionar um ambiente favorável para o completo desenvolvimento destes folículos até a fase pré ovulatória. Estudos demonstram ainda que a adição de piruvato, glutamina, hipoxantina e ITS (insulina, transferrina e selênio), aumentam o percentual de folículos morfologicamente normais e estimulam o crescimento folicular [19,83]. Além destes, tem-se observado que o ácido ascórbico atua beneficamente sobre a foliculogênese, com o papel de reduzir as taxas de apoptose de folículos pré-antrais em camundongos [61] e estimular a manutenção da viabilidade em caprinos, após cultivo de longa duração [82]. Já a adição de andrógenos ao meio de cultivo têm apresentado resultados contraditórios, uma vez que o hiperandrogenismo induz alterações na morfologia e função de oócitos em desenvolvimento, bem como diminui as taxas de sobrevivência de folículos secundários em roedores [91]. Porém Tasaki et al. [92] observaram que a adição de um andrógeno (androstenediona) ao meio de cultivo de folículos porcinos, proporcionou o aumento nas taxas de formação de antro. Além disso, Rodrigues et al. [74] demonstraram que a adição de outro andrógeno (dihidrotestosterona) ao meio de cultivo de folículos secundários de macacas, teve efeito benéfico sobre a taxa de sobrevivência folicular após 40 dias de cultivo.
29 29 Assim, a proposta desta revisão foi abordar a síntese e importância da adição dos andrógenos ao meio de cultivo folicular, bem como os principais resultados obtidos nos estudos realizados até o momento, para melhor esclarecimento do mecanismo de ação e atuação na foliculogênese destes hormônios. III. SÍNTESE E IMPORTÂNCIA DOS ANDRÓGENOS NA FOLICULOGÊNESE OVARIANA A ideia que os andrógenos podem regular o desenvolvimento folicular inicial teve início em meados dos anos 90, com estudos que observaram a expressão de receptores de andrógenos (AR) no ovário [70]. Estes estudos mostraram a expressão de AR em células da teca (CT), células da granulosa (CG) e no oócito de folículos em diferentes estádios de desenvolvimento nas mais variadas espécies [12,15,34,42,43,103]. É sabido que, durante a foliculogênese, os andrógenos aromatizáveis (androstenediona e testosterona) produzidos no ovário são sintetizados nas CT sob ação do hormônio luteinizante (LH) em um processo chamado esteroidogênese [59], que tem como resultado final a conversão de andrógenos em estrógenos (estrona e estradiol) [89]. Este processo inicia-se com a captação do colesterol circulante para dentro da mitocôndria da CT através da enzima StAR (proteína reguladora aguda da esteroidogênese), onde encontra-se a desmolase (P450scc), que converte o colesterol em pregnenolona sendo esta última convertida em progesterona (P4) por meio da enzima 3β-hidroxidesidrogenase (3β-HSD) [31,94]. A P4, por sua vez, poderá exercer suas funções biológicas no organismo ou servir como substrato para a produção de outros andrógenos. Seguindo pela esteroidogênese, a androstenediona (A4) é produzida a partir da P4 pela ação da enzima CYP17 (citocromo P450-17α-hidroxilase) que, assim como a P4, poderá exercer suas funções no organismo ou ser convertida em testosterona (T), sob ação da 17 β -hidroxidesidrogenase (17 β -HSD). A testosterona tem três caminhos, a saber: atuar no organismo, converter-se em dihidrotestosterona através da 5α-redutase ou ser convertida em estradiol (E2) pela P450 aromatase (CYP19), nos quais ambas as conversões são realizadas na CG [45]. Outra via para a produção de E2 seria a aromatização da A4 em estrona nas CG pela CYP19, e esta em E2 pela 17β- HSD, finalizando assim este processo [99] (Figura 1).
30 30 Figura 1. Representação esquemática da esteroidogênese nas células ovarianas. Nas células da teca, os andrógenos (androstenediona e testosterona) são produzidos em resposta ao estímulo do hormônio luteinizante (LH) através da captação do colesterol circulante. Após difundir-se para as células da granulosa, os andrógenos são convertidos em estrógenos (estrona e estradiol) pela enzima aromatase sob a ação do FSH. Os andrógenos são os esteroides predominantes produzidos durante o desenvolvimento folicular inicial e estão presentes em altas concentrações no fluido folicular [53], porém dependendo do estágio de desenvolvimento do folículo, a esteroidogênese nas CG pode aumentar ou diminuir, devido a atividade da P450 aromatase [45]. A ligação andrógeno-receptor regula a produção e expressão de alguns genes, como por exemplo o IGF-1 que, por sua vez, estimula a proliferação das CG e aumenta os efeitos do FSH que induz a expressão da P450 aromatase [98]. Os hormônios esteróides estão envolvidos tanto na morte quanto na sobrevivência celular [74,91]. Narkwichean et al. [62] administraram in vivo a desidroepiandrostenediona (andrógeno oriundo das células adrenais) em ovelhas e observaram que este pode ser útil no tratamento clínico do envelhecimento ovariano, aumentando o número de folículos responsivos a gonadotrofinas e estimulando assim o desenvolvimento folicular. Outro estudo demonstrou que a suplementação oral de desidroepiandrostenediona aumenta os níveis de IGF-1, gerando um efeito positivo sobre o desenvolvimento folicular e a qualidade oocitária em mulheres [13]. Em espécies poliovulatórias, estudos com camundongos knockout para receptores de andrógenos (ARknockout) indicaram um papel estimulador dos andrógenos sobre o crescimento e desenvolvimento folicular [100,102]. Otala et al. [66] cultivaram fragmentos ovarianos humanos na presença de andrógenos, estradiol e uma substância inibitória aos estímulos androgênicos (casodex) e observaram que na
31 31 presença dos andrógenos houve uma redução nas taxas de apoptose, o que não foi alcançado com a adição de estradiol. Já na presença do casodex, este efeito positivo não foi encontrado, o que confirma a importância dos andrógenos no cultivo folicular. O cultivo folículos pré-antrais de camundongos na presença de um anticorpo anti-andrógeno associado ou não a androstenediona demonstrou que, no tratamento com o anti-andrógeno, o crescimento e diferenciação folicular foram inibidos, porém esses efeitos foram restaurados com a adição da androstenediona [60]. Em ratas tratadas in vivo com androstenediona no pós-parto, foi observada uma redução nos níveis de apoptose folicular [33]. Apesar destes resultados, os andrógenos podem exercer efeitos antagonistas na função folicular quando presentes em altas concentrações, inibindo o desenvolvimento folicular e aumentando as taxas de apoptose [109]. O hiperandrogenismo está associado a síndrome do ovário policístico [30], tendo como características a anovulação e infertilidade, que também estão relacionadas a um aumento nas anormalidades metabólicas, o que pode levar a obesidade, resistência à insulina, doenças cardiovasculares e diabetes do tipo 2 [29,32,68]. IV. RECEPTORES DE ANDRÓGENOS (AR) Receptores de andrógenos (AR) são proteínas, membros da superfamília de receptores nucleares esteroidais que consistem em receptores de mineracorticóides, glicocorticóides, estrogênios e progesterona [36,58]. Os AR estão agrupados dentro da classe I, os quais incluem receptores do hormônio da tireóide, receptores de ácido retinóico, receptores ativado por proliferador de peroxissoma e receptores de vitamina D [21]. Quando não associados ao seu ligante, os AR estão localizados no citoplasma de algumas células, onde se associam com as proteínas de choque térmico [35,47], proteínas do citoesqueleto [97] e outras chaperonas [47,67]. A ligação específica hormônio-receptor ocorre através da presença de um andrógeno, que difunde-se através da membrana plasmática e liga-se ao seu receptor no citoplasma, podendo agir localmente, mimetizando a ação de alguns fatores de crescimento, ou dirigir-se para o núcleo das células. Para a realização desta translocação, o AR sofre uma alteração conformacional e transloca-se para o núcleo, carregando o hormônio específico [14]. Dentro do núcleo, a ligação hormônio-receptor acopla-se ao DNA como um homodímero e melhora a transcrição de genes relacionados à maturação oocitária e ovulação, como por exemplo o gene anfiregulina (AREG) e o ciclooxigenase-2 (COX-
32 32 2) [108], agindo por interação direta com a maquinaria de transcrição basal ou através de co-ativadores. No ovário, as CG são altamente responsivas aos andrógenos, no entanto, apenas a testosterona (T) e a dihidrotestosterona (DHT; andrógeno puro, não aromatizável) se ligam diretamente aos AR enquanto que a androstenediona pode mediar sua ação através da sua conversão intrácrina a um andrógeno mais potente (T ou DHT) que tem maior afinidade aos AR, para então, exercer seus efeitos androgênicos [99]. Esta ligação andrógeno-receptor está intimamente envolvida com a fertilidade feminina [108], sendo que a conservação evolutiva da expressão destes receptores em ovários mamíferos suporta a ideia que a ação dos andrógenos é mediada por AR e influencia o desenvolvimento folicular ovariano [99]. No entanto, isso só foi confirmado na última década, por meio de modelos de camundongos AR knockout (ARKO). Esses animais apresentaram deficiência reprodutiva, com redução nas taxas de fertilidade, desenvolvimento folicular anormal bem como redução nas taxas de ovulação [17,101]. Os AR foram localizados em folículos primordiais e primários de roedores [43], ovinos [42], suínos [12] e bovinos [34]. Foram observados nas CG e CT de folículos pré-antrais de ratos [43], bovinos [76], ovinos [42], equinos [57], primatas não humanos [37] e humanos [38]. Em folículos antrais de ratas foi observada sua presença nas CG e células do cúmulus [87]. Em ovinos [42], bovinos [76] e suínos [84] os AR foram localizados em CG e CT, sendo mais predominante nas CG dos folículos antrais. A imunocoloração para os AR também esteve presente em CG e CT humanas de folículos antrais e pré-ovulatórios [86]. V. MECANISMO DE AÇÃO DOS ANDRÓGENOS Os andrógenos podem agir de duas maneiras: via receptores intracelulares, que estão localizados no citoplasma das células, ou através da modificação da atividade gênica nuclear [22]. Inicialmente o AR encontra-se inativo e acoplado a uma proteína de choque término (HSP) no citoplasma das células. Após a ligação do andrógeno ao AR, o complexo é ativado e dissocia-se da HSP. Outras proteínas tais como a importina-α e a proteína 70 associada ao AR (ARA70) são recrutadas para ajudar a estabilizar o AR e promover sua translocação nuclear. Uma vez localizado no núcleo, este complexo forma um dímero com uma segunda molécula de AR ativada, que se liga então a uma sequência específica no DNA conhecida como ARE (elementos responsivos aos andrógenos) [5]. Acredita-se que a ligação do AR ao ARE estabilize os fatores de
33 33 transcrição nos promotores dos genes alvo, induzindo assim um alto nível de iniciação de transcrição [40,64]. Esta resposta clássica é denominada de genômica, uma vez que envolve a transcrição de genes (Figura 2). Figura 2. Ação genômica do receptor de andrógeno. (1) Ligação do andrógeno ao seu receptor (AR) no citoplasma celular; (2) Dissociação da proteína de choque término (HSP) do complexo e recrutamento da importina-α e proteína 70 associada ao receptor de andrógeno (ARA70) para translocação do complexo para o núcleo; (3) Formação de um dímero de complexos ligantes-receptores; (4) Ligação dos dímeros a sequência do DNA responsiva aos andrógenos (ARE) e; (5) Início da transcrição gênica dos genes alvos. Wu et al. [104] relataram o aumento da expressão do receptor homólogo do fígado -1 (LRH-1), que funciona como um fator de transcrição para a enzima CYP19, na presença de testosterona em CG murina. Além deste estudo, tem-se relatos de alguns fatores de transcrição que ativam as enzimas esteroidogênicas na presença de outros hormônios, como o fator esteroidogênico-1 (SF-1), que se liga na região promotora da proteína reguladora aguda da esteroidogênese (StAR) bem como na mesma região da CYP17, promovendo maior expressão dessas enzimas na presença de LH em CT bovinas. Outro fator de transcrição que estimula a expressão das enzimas citadas anteriormente é o GATA-6, representante da família de fatores de transcrição GATA [59]. Estudos relataram que a proteína patient SE translocation (SET) pertencente a uma família de proteínas de multitarefas, envolvida na apoptose e montagem do nucleossoma, também funciona como um fator de transcrição para a CYP17 e 3β-HSD, promovendo uma super expressão das mesmas em CT de ratas transfectadas com a proteína em questão [18,106]. Li et al. [44] demonstraram que o receptor nuclear órfão
34 34 (NR4A1) tem função transcricional sobre todas as enzimas esteroidogênicas encontradas nas CT de camundongas. Além da ação genômica clássica dos andrógenos via receptor intracelular, existe ainda a atividade não genômica de receptores de andrógenos. O AR pode iniciar respostas não genômicas através da sua ativação e interação com moléculas sinalizadoras, tais como PI3K e RTK localizadas na membrana plasmática que ativam as vias AKT e MAPK, respectivamente. Estas moléculas sinalizadoras também podem fosforilar os AR, prevenindo a degradação dos mesmos (independente da ligação de seus ligantes) e promovendo sua translocação nuclear. Além disso, uma vez ativadas, essas vias também sinalizam cascatas que regulam outros receptores nucleares (RN) e fatores de transcrição (FT) e/ou eventos sinalizadores citoplasmáticos, tais como a liberação de cálcio (Ca 2+ ) intracelular pelo reticulo endoplasmático e mitocôndria [5] (Figura 3). Figura 3. Ação não-genômica do receptor de andrógeno. (1) Ativação do AR e interação com moléculas sinalizadoras (PI3K e RTK) localizadas na membrana plasmática; (2) Ativação das vias AKT e MAPK pela PI3K e RTK, respectivamente. (3) Fosforilação dos AR pelas moléculas sinalizadoras (independente da ligação de seus ligantes) (4) Translocação nuclear dos AR. (5) Sinalização de cascatas através vias AKT e MAPK que regulam receptores nucleares (RN) e fatores de transcrição (FT) e/ou; (6) Eventos sinalizadores citoplasmáticos, tais como a liberação de cálcio (Ca 2+ ) intracelular pelo reticulo endoplasmático e mitocôndria. Machelon et al. [54] demonstraram que a adição de androstenediona causou um aumento rápido de cálcio citosólico em CG luteinizadas humanas, envolvendo os canais de cálcio dependentes da voltagem e fosfolipase C. A mobilização do cálcio intracelular é seguida por um influxo de cálcio do meio extracelular, sendo que o mesmo funciona como um segundo mensageiro intracelular proporcionando proliferação e diferenciação
35 35 das células. Outro estudo demonstrou que a adição de andrógenos no meio de cultivo de CG promoveu a ativação da via MAPK, que por sua vez fosforilou uma proteína sinalizadora de vias intra e extranucleares (paxilina), promovendo a expressão de um microrna antiapoptótico (mirna-125b) [78]. Apesar desses estudos, a base molecular dos efeitos AR não-genômicas ainda não foi totalmente esclarecida. VI. PRINCIPAIS RESULTADOS OBTIDOS NO CULTIVO IN VITRO DE FOLÍCULOS COM ANDRÓGENOS Os efeitos dos andrógenos sobre a foliculogênese estão sendo avaliados com o auxílio da biotécnica de MOIFOPA, a partir de diferentes sistemas de cultivo in vitro em diferentes espécies mamíferas (Tabela 1). Tabela 1. Efeito dos andrógenos no desenvolvimento folicular in vitro. Referência Animal Metodologia Principais resultados MURRAY et al. [60] Roedor Cultivo de 6 dias de folículos préantrais na presença de: (i) um anticorpo anti-andrógeno em associação ou não com 1μg/ml A4; (ii) um antagonista do AR (casodex) em associação ou não com 1μg/ml DHT Adição do anticorpo anti-andrógeno inibiu o crescimento folicular, efeito este que foi revertido com a adição de A4. No tratamento com o casodex, o crescimento folicular também foi inibido e revertido posteriormente com a adição de DHT SPEARS et al. [85] Roedor Cultivo de 6 dias de folículos préantrais na presença de FSH em associação ou não com 1μg/ml de A4 O tratamento com FSH promoveu o crescimento folicular o qual foi melhorado na presença de A4 ROMERO & SMITZ. [75] Roedor Cultivo de 13 dias de folículos pré-antrais na presença de: (i) 20 ou 200 nm de A4 associada ou não ao FSH; (ii) 20, 200 nm ou 2 μm de T associada ou não ao FSH As concentrações superiores a 200 nm de ambos os andrógenos prejudicaram a maturação oocitária OKUTSU et al. [65] Roedor Cultivo de 10 dias de folículos pré-antrais na presença de 10-5 M de A4 A4 promoveu uma luteinização precoce nas células da granulosa TARUMI et al. [90] Roedor Cultivo de 12 dias de folículos pré-antrais na presença de 10-10, 10-8 e 10-6 M de DHT e E2 O tratamento com DHT (10-6 M) apresentou maior diâmetro folicular. Uma redução na produção de P4 e danos na retomada da meiose foram observados nos folículos cultivados com 10-6 M de E2
36 36 SEN et al. [78] Roedor Expressão do microrna-125b, sobrevivência folicular e formação de antro foram analisadas no cultivo de ovário inteiro e folículos pré-antrais na presença de DHT e FSH em diferentes concentrações Na presença de DHT a expressão do microrna-125b, o diâmetro folicular e a formação de antro apresentaram um aumento TAKETSURU et al. [88] Bovino Folículos antrais iniciais foram cultivados por 14 dias na presença de 0,10 e 100 ng/ml de A4 ou E2 Na presença de A4 as taxas de maturação foram similares ao controle in vivo YANG & FORTUNE et al. [107] Bovino Fragmentos do córtex ovariano foram cultivados por 10 dias na presença de: 10-7 e 10-6 M de T ou 10-6 M de E2; (ii) 10-7 M de T em associação flutamida T promoveu um aumento na transição de folículos primários para secundários, a qual foi inibida na presença de flutamida e não ocorreu no tratamento com E2 LIMA-VERDE et al. [46] Caprino Fragmentos do córtex ovariano foram cultivados por 7 dias na presença de 1, 10, 50, 100 ng/ml de A4 associada ou não com FSH A4 (50 ng/ml) promoveu um aumento nos diâmetros folicular e oocitário. As concentrações 50 ou 100 ng/ml de A4 associadas ao FSH apresentaram 93.3% de folículos viáveis RODRIGUES et al. [74] Primata não humano Cultivo de 40 dias de folículos pré-antrais encapsulados na presença de: (i) 50 ng/ml de DHT associada ou não ao TRL; (ii) 10 ou 50 ng/ml de T associadas ao TRL O tratamento com DHT aumentou a sobrevivência folicular em mais de 80% quando comparado ao controle. Entretanto, uma diminuição na produção de E2 foi observada A4: androstenediona; DHT: dihidrotestosterona; E2: estradiol; P4: progesterona; T: testosterona; TRL: trilostano. O cultivo de folículos secundários isolados de primatas não humanos, com a adição de dihidrotestosterona (50 ng/ml) mostrou um aumento na produção de estradiol, mesmo na presença de um inibidor da síntese de esteróides, e uma taxa de sobrevivência folicular significativamente superior ao controle após 40 dias de cultivo [74]. Outro estudo avaliou o efeito deste mesmo hormônio no cultivo in vitro de folículos pré antrais isolados de camundongas, revelando um aumento significativo no diâmetro folicular bem como maiores taxas de formação de antro no tratamento com 10-6 M de dihidrotestosterona, quando comparado ao controle. Além dos resultados de desenvolvimento folicular, esses autores obtiveram altas taxas de maturação oocitária (75-80%) em todos os tratamentos na presença do andrógeno [90]. Sen et al. [78] avaliaram a ação da dihidrotestosterona no ovário de camundongos e observaram que a mesma aumenta a expressão de um microrna responsável por reduzir as taxas de apoptose, além de proporcionar um aumento
37 37 significativo no diâmetro folicular e proporcionar maiores taxas de folículos antrais na associação desse andrógeno ao FSH. Yang & Fortune [107] observaram que o cultivo de fragmentos ovarianos bovinos com adição de 10-7 e M de testosterona promoveu maior transição de folículos primários para secundários após 10 dias. Considerando que Hampton et al. [34] detectaram a expressão do mrna para AR em folículos primários bovinos, conlcuiu-se que a testosterona exerce um papel estimulatório na foliculogênese inicial. O cultivo in vitro de fragmentos do córtex ovariano caprino com a adição de androstenediona (10 ng/ml) e FSH manteve o desenvolvimento folicular entre os dias 1 e 7 de cultivo. Além disso, 50 e 100 ng/ml de androstenediona associada ao FSH apresentaram uma percentagem de 93,3% de folículos viáveis ao longo de 7 dias de cultivo [46]. Taketsuru et al. [88] observaram que a adição de 10 e 100 ng/ml de androstenediona no cultivo de folículos antrais bovinos, resultou em taxas de maturação de 67% e 65%, respectivamente, sendo similares ao controle in vivo (86%). Porém a adição de androstenediona e testosterona (em concentrações de 200 nm) no cultivo de folículos pré-antrais de roedores reduziram as taxas de extrusão do primeiro corpúsculo polar em 32% e 48%, respectivamente [75]. Este achado sugere que altas concentrações de andrógenos durante a foliculogênese podem prejudicar a formação do fuso meiótico durante a retomada da meiose. Trabalhos têm mostrado que a exposição de folículos pré-antrais a altas concentrações de andrógenos induz a luteinização precoce nas células da granulosa [65] e reduz o crescimento e a viabilidade folicular [91], o que pode ser comparado a síndrome do ovário policístico em mulheres. Além destes efeitos, o hiperandrogenismo pode levar a uma secreção prematura de estradiol, aumentando a responsividade dos folículos em desenvolvimento ao FSH, levando à inibição da secreção deste hormônio e consequente parada no desenvolvimento folicular [69], o que reforça o fato da adição de andrógenos ser concentração hormônio-dependente. VII. CONCLUSÃO A presente revisão mostra o relevante papel dos andrógenos nos diferentes estádios de desenvolvimento folicular, atuando através de seus receptores em CG e CT, servindo como um substrato para a esteroidogênese ou agindo na transcrição de genes relacionados a sobrevivência folicular, além de auxiliarem na maturação oocitária. Estes
38 38 hormônios são essenciais no processo reprodutivo das fêmeas, regulando a foliculogênese e modulando os efeitos de outros hormônios, como por exemplo, o FSH. No entanto, apesar dos estudos já realizados enfocando a ação dos andrógenos nos folículos ovarianos, a forma como estes hormônios devem ser adicionados no cultivo folicular in vitro, bem como a concentração a ser utilizada, ainda permanecem pouco esclarecidas, sendo indispensáveis mais estudos para elucidar estes aspectos. VIII. REFERÊNCIAS 1 Abir R., Nitkse S., Ben-Harous A. & Fisch B In vitro maturation of human primordial ovarian follicles: Clinical significance, progress in mammals, and methods for growth evaluation. Histology and Histopathology. 21(8): Almeida A.P., Saraiva M.V.A., Alves Filho J.G., Silva G.M., Gonçalves R.F.B., Brito I.R., Silva A.W.B., Lima A.K.F., Cunha R.M.S., Silva J.R.V. & Figueiredo J.R Gene expression and immunolocalization of fibroblast growth factor 2 in the ovary and its effect on the in vitro culture of caprine preantral ovarian follicles. Reproduction in Domestic Animals. 47(1): F.I: Andersen C.Y., Rosendahl M., Byskov A.G., Loft A., Ottosen C., Dueholm M., Schmidt K.L.T., Andersen A.N. & Ernst E Two successful pregnancies following autotransplantation of frozen/thawed ovarian tissue. Human Reproduction. 23(10): Araújo V.R Estudo dos fatores que afetam a eficiência do cultivo in vitro de folículos pré-antrais caprinos e bovinos: efeito do regime de troca, meios de cultivo de base e suplementos. 290f. Fortaleza, CE. Tese (Doutorado em Ciências Veterinárias) Programa de Pós-graduação em Ciências Veterinárias, Universidade Estadual do Ceará. 5 Bennett N.C., Gardinerb R.A., Hooperd J.D., Johnsone D.W. & Gobea G.C Molecular cell biology of androgen receptor signalling. The International Journal of Biochesmitry & Cell Biology. 42(6): Betteridge, K.J.; Smith, C.; Stubbings, R.B.; Xu, K.P. & King, W.A Potential genetic improvement of cattle by fertilization of fetal oocytes in vitro. Jornal of Reproduction and Fertility. 38: Bristol-Gould S., Woodruff T.K Folliculogenesis in the domestic cat (Felis catus). Theriogenology. 66(1): 5-13.
39 39 8 Brito I.R., Silva C.M.G., Duarte A.B.G., Lima I.M.T., Rodrigues G.Q., Rossetto R., Sales A.D., Lobo C.H., Bernuci M.P., Rosa-E-Silva A.C.J.S., Campello C.C., Xu M. & Figueiredo J.R Alginate hydrogel matrix stiffness influences the in vitro development of caprine preantral follicles. Molecular Reproduction & Development. 81(7): F.I: Bruno J.B Utilização de soro no cultivo in vitro de folículos pré-antrais caprinos. 66f. Fortaleza, CE. Dissertação (Mestrado em Ciências Veterinárias) Programa de Pós-graduação em Ciências Veterinárias, Universidade Estadual do Ceará. 10 Bruno J.B., Celestino J.J., Lima-Verde I.B., Lima L.F., Matos M.H., Araújo V.R., Saraiva M.V., Martins F.S., Campello C.C. & Figueiredo J.R Expression of vascular endothelial growth factor (VEGF) receptor in goat ovaries and improvement of in vitro caprine preantral follicle survival and growth with VEGF. Reproduction, Fertility, and Development. 21(5): F.I: Bukovski A., Caudle M.R., Svetlikova M. & Upadhyaya N.B Origin of germ cells and formation of new primary follicles in adult human ovaries. Reproduction Biology and Endocrinology. 2(20): Cárdenas H. & Pope W.F Androgen receptor and follicle-stimulating hormone receptor in the pig ovary during the follicular phase of the estrous cycle. Molecular Reproduction and Development. 62(1): Casson P.R., Santoro N. Elkind-Hirsch K., Carson S.A., Hornsby P.J., Abraham G. & Buster J.E Postmenopausal dehydroepiandrosterone administration increases free insulin-like growth factor-i and decreases highdensity lipoprotein: a six-month trial. Fertility and Sterility. 70(1): Cato A.C.B. & Peterziel H The androgen receptor as mediator of gene expression and signal transduction pathways. Trends in Endocrinology and Metabolism. 9(4): Chadha S., Pache T. D., Huikeshoven F. J. M., Brinkmann A. O. & Van der Kwast T. H Androgen receptor expression in human ovarian and uterine tissue of long term androgen-treated transsexual women. Human Pathology. 25(11): Chaves R.N., Duarte A.B.G., Rodrigues G.Q., Celestino J.J.H., Silva G.M., Lopes C.A.P., Almeida A.P., Donato M.A.M., Peixoto C.A., Moura A.A.A., Lobo C.H., Locatelli Y., Mermillod P., Campello C.C. & Figueiredo J.R The effects of insulin and follicle-stimulating hormone (FSH) during in vitro
40 40 development of ovarian goat preantral follicles and relative mrna expression for insulin and FSH receptors and cytochrome P450 aromatase in cultured follicles. Biology of Reproduction. 87(3): F.I: Cheng X.B., Jimenez M., Desai R., Middleton L.J., Joseph S.R., Ning G., Allan C.M., Smith J.T., Handelsman D.J. & Walters K.A Characterizing the neuroendocrine and ovarian defects of androgen receptor-knockout female mice. American Journal of Physiology Endocrinology and Metabolism. 305(6): Compagnone N.A., Zhang P., Vigne J.L. & Mellon S.H Novel role for the nuclear phosphoprotein SET in transcriptional activation of P450c17 and initiation of neurosteroidogenesis. Molecular Endocrinology. 14(6): Demeestere I., Centner J., Gervy Y. & Delbaere A Impact of various endocrine and paracrine factors on culture of preantral follicles in rodents. Reproduction. 130(2): Demeestere I., Simon P., Emiliani S., Delbaere A. & Englert Y Fertility preservation: Successful transplantation of cryopreserved ovarian tissue in a young patient previously treated for Hodgkin s disease. Oncologist. 12(12): Detera-Wadleigh S.D. & Fanning T.G Phylogeny of the steroid receptor superfamily. Molecular Phylogenetics and Evolution. 3(3): Dode M.A. & Graves C.N Role of estradiol-17 on nuclear and cytoplasmic maturation of pig oocytes. Animal Reproduction Science. 78(1-2): Drummond A. E The role of steroids in follicular growth. Reproductive Biology and Endocrinology. 4(16): Duarte A.B.G., Araújo V.R., Chaves R.N., Silva G.M., Magalhães-Padilha D.M., Satrapa R.A., Donato M.A.M., Peixoto C.A., Campello C.C., Matos M.H.T., Barros C.M. & Figueiredo J.R Bovine dominant follicular fluid promotes the in vitro development of goat preantral follicles. Reproduction, Fertility, and Development. 24(3): F.I: Erickson G.F An analysis of follicle development and ovum maturation. Semin Reproduction Endocrinology. 4(3): Fatehi R., Ebrahimi B., Shahhosseini M., Farrokhi A. & Fathi R Effect of ovarian tissue vitrification method on mice preantral follicular development and gene expression. Theriogenology. 81(2): Faustino L.R., Rossetto R., Lima I.M., Silva C.M., Saraiva M.V., Lima L.F., Silva A.W., Donato M.A., Campello C.C., Peixoto C.A., Figueiredo J.R. & Rodrigues A.P Expression of keratinocyte growth factor in goat ovaries and
41 41 its effects on preantral follicles within cultured ovarian cortex. Reproductive Sciences. 18(12): F.I: Figueiredo J.R., Rodrigues A.P.R., Amorim C.A. & Silva J.R.V Manipulação de oócitos inclusos em folículos ovarianos pré-antrais MOIFOPA. In: Gonçalves P.B.D., Figueiredo J.R. & Freitas V.J.F. Biotécnicas aplicadas à reprodução animal. 2.ed. São Paulo: Roca, pp Franks S Polycystic ovary syndrome. New England Journal of Medicine. 333(13): Gilling-Smith C., Willis D.S., Beard R.W. & Franks S Hypersecretion of androstenedione by isolated thecal cells from polycystic ovaries. Journal of Clinical Endocrinology and Metabolism. 79(4): Giometti I.C., Castilho A.C.S., Sá-Filho O.G., Papa P.C. & Buratini Jr.J Controle local e endócrino do desenvolvimento e da regressão do corpo lúteo bovino. Revista Brasileira de Reprodução Animal. 33(1): Goodarzi M.O., Dumesic D.A., Chazenbalk G. & Azziz R Polycystic ovary syndrome: etiology, pathogenesis and diagnosis. Nature Reviews Endocrinology. 7(4): Goyeneche A.A., Calvo V., Gibori G. & Telleria C.M Androstenedione interfere in luteal regression by inhibiting apoptosis and stimulating progesterone production. Biology of Reproduction. 66(5): Hampton J. H., Manikkam M., Lubahn D. B., Smith M. F. & Garverick H. A Androgen receptor mrna expression in the bovine ovary. Domestic Animal Endocrinology. 27(1): He B., Kemppainen J.A., Voegel J.J., Gronemeyer H. & Wilson E.M Activation function 2 in the human androgen receptor ligand binding domain mediates interdomain communication with the NH(2)-terminal domain. Journal of Biological Chemistry. 274(52): Heinlein C.A. & Chang C Androgen receptor (AR) coregulators: an overview. Endocrinology Review. 23(2): Hild-Petito S., West N. B., Brenner R. M. & Stouffer R. L Localization of androgen receptor in the follicle and corpus luteum of the primate ovary during the menstrual cycle. Biology of Reproduction. 44(3): Horie K., Takakura K., Imai K., Liao S. & Mori T Immunohistochemical localization of androgen receptor in the human endometrium, decidua, placenta and pathological conditions of the endometrium. Human Reproduction. 7(10): 1461-
42 Isachenko V., Isachenko E., Weiss J.M., Todorov P. & Kreienberg R Cryobanking of human ovarian tissue for anti-cancer treatment: comparison of vitrification and conventional freezing. Cryoletters. 30(6): Jenster G Coactivatiors and corepressors as mediators of nuclear receptor function: an update. Molecular and Cellular Endocrinology. 143(1-2): Johnson J., Bagley J., Skaznik-Wikiel M., Lee H.J., Adams G.B., Niikura Y., Tschudy K.S., Tilly J.C., Cortes M.L., Forkert R., Spitzer T., Iacomini J., Scadden D.T. & Tilly J.L Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell. 122(2): Juengel J.L., Heath D.A., Quirke L.D. & McNatty K.P Oestrogen receptor α and β, androgen receptor and progesterone receptor mrna and protein localisation within the developing ovary and in small growing follicles of sheep. Reproduction. 131(1): Lenie S. & Smitz J Functional AR signaling is evident in an in vitro mouse follicle culture bioassay that encompasses most stages of folliculogenesis. Biology of Reproduction. 80(4): Li M., Xue K., Ling J., Diao F.Y., Cui Y.G. & Liu J.Y The orphan nuclear receptor NR4A1 regulates transcription of key steroidogenic enzymes in ovarian theca cells. Molecular and Cellular Endocrinology. 319(1-2): Lima-Verde I.B., Rosseto R. & Figueiredo J.R Influência dos hormônios esteroides na foliculogênse. Revista Brasileira Reprodução Animal. 35(4): Lima-Verde I.B., Rossetto R., Matos M.H.T., Celestino J.J.H., Bruno J.B., Silva C.M.G., Faustino L.R., Mororó M.B.S., Araújo V.R., Campello C.C. & Figueiredo J.R Androstenedione and follicle stimulating hormone involvement in the viability and development of goat preantral follicles in vitro. Animal Reproduction. 7(2): Loy C.J., Sim K.S. & Yong E.L Filamin-A fragment localizes to the nucleus to regulate androgen receptor and coactivator functions. PNAS. 100(8): Lucci C.M., Amorim C.A., Báo S.N., Figueiredo J.R., Rodrigues A.P.R., Silva J.R. & Gonçalves P.B.D Effect of the interval of serial sections of ovarian in the tissue chopper on the number of isolated caprine preantral follicles. Animal Reproduction Science. 56(1): F.I: 1.555
43 43 49 Lucci C.M., Silva R.V., Carvalho C.A., Figueiredo J.R. & Báo S.N Light microscopical and ultrastrutural characterization of goat preantral follicles. Small Ruminant Research. 41(1): F.I: Lunardi F.O., Araújo V.R., Faustino L.R., Carvalho A.A., Gonçalves R.F.B., Bass C.S., Báo S.N., Name K.P.O., Campello C.C., Figueiredo J.R. & Rodrigues A.P.R Morphologic, viability and ultrastructural analysis of vitrified sheep preantral follicles enclosed in ovarian tissue. Small Ruminant Research. 107(3): F.I: Lunardi F.O., Chaves R.N., Lima L.F., Araújo V.R., Brito I.R., Souza C.E.A., Donato M.A.M., Peixoto C.A., Dinnyes A., Campello C.C., Figueiredo J.R. & Rodrigues A.P.R Vitrified sheep isolated secondary follicles are able to grow and form antrum after a short period of in vitro culture. Cell and Tissue Research. 362(1): F.I: Luz V.B., Araújo V.R., Duarte A.B.G., Silva G.M., Chaves R.N., Brito I.R., Serafim M.K.B., Campello C.C., Feltrin C., Bertolini M., Almeida A.P., Santos R.R. & Figueiredo J.R Kit ligand and insulin-like growth factor I affect the in vitro development of ovine preantral follicles. Small Ruminant Research. 115(2-3): F.I: Macaulay A.D., Hamilton C.K., King W. A. & Bartlewski P.M Influence of physiological concentrations of androgens on the developmental competence and sex ratio of in vitro produced bovine embryos. Reproductive Biology. 13(1): Machelon V., Nome F. & Tesarik J Nongenomic effects of androstenedione on human granulosa luteinizing cells. Journal of Clinical Endocrinology and Metabolism. 83(1): Magalhães D.M., Duarte A.B.G., Araújo V.R., Brito I.R., Soares T.G., Lima I.M.T., Lopes C.A.P., Campello C.C., Rodrigues A.P.R. & Figueiredo J.R In vitro production of a caprine embryo from a preantral follicle cultured in media supplemented with growth hormone. Theriogenology. 75(1): F.I: Matos M.H.T., Van den Hurk R., Lima-Verde I.B., Luque M.C.A., Santos K.D.B., Martins F.S., Báo S.N., Lucci C.M. & Figueiredo J.R Effects of fibroblast growth factor-2 on the in vitro culture of caprine preantral follicles. Cells Tissues Organs. 186(2): F.I: 2.137
44 44 57 Mlodawska W. & Okolski A Immunolocalization of androgen receptors and assessment of steroidogenic activity of the ovaries in prepubertal and pubertal mare. Journal of Equine Veterinary Science. 34(1): Montgomery J.S., Price D.K. & Figg W.D The androgen receptor gene and its influence on the development and progression of prostate cancer. Journal of Pathology. 195(2): Murayama C., Miyazaki H., Miyamoto A. & Shimizu T Luteinizing hormone (LH) regulates production of androstenedione and progesterone via control of histone acetylation of StAR and CYP17 promoters in ovarian theca cells. Molecular and Cellular Endocrinology. 350(1): Murray A. A., Gosden R. G., Allison V. & Spears N Effect of androgens on the development of mouse follicles growing in vitro. Journal of Reproduction and Fertility. 113(1): Murray A.A., Molinek M.D., Baker S.J., Kojima F.N., Smith M.F., Hillier S.G. & Spears N Role of ascorbic acid in promoting follicle integrity and survival in intact mouse ovarian follicles in vitro. Reproduction. 121(1): Narkwichean A., Jayaprakasan K., Maalouf W.E., Hernandez-Medrano J.H., Pincott-Allen C. & Campbell B.K Effects of dehydroepiandrosterone on in vivo ovine follicular development. Human Reproduction. 29(1): O brien M.J., Pendola J.K. & Eppig J.J A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biology of Reproduction. 68(5): O malley B.W. & Tsai M.J Molecular pathway of steroid receptor action. Biology of Reproduction. 46(2): Okutsu Y., Itoh M.T., Takahashi N. & Ishizuka B Exogenous androstenedione induces formation of follicular cysts and premature luteinization of granulosa cells in the ovary. Fertility and Sterility. 93(3): Otala M., Makinen S., Tuuri T., Sjoberg J., Pentikainen V., Matikainen T. & Dunkel L Effects of testosterone, dihydrotestosterone, and 17β-estradiol onhumanovarian tissue survival in culture. Fertility and Sterility. 82(3): Ozanne D.M., Brady M.E., Cook S., Gaughan L., Neal D.E. & Robson C.N Androgen receptor nuclear translocation is facilitated by the f-actin crosslinking protein filamin. Molecular Endocrinology. 14(10): Pasquali R., Stener-Victorin E., Yildiz B.O., Duleba A.J., Hoeger K., Mason H., Homburg R., Hickey T., Franks S., Tapanainen J.S., Balen A., Abbott
45 45 D.H., Diamati-Kandarakis E. & Legro R.S PCOS Forum: research in polycystic ovary syndrome today and tomorrow. Clinical Endocrinology. 74(4): Pradeep P.K., Li X., Peegel H. & Menon K.M Dihydrotestosterone inhibits granulosa cell proliferation by decreasing the cyclin D2 mrna expression and cell cycle arrest at G phase. Endocrinology. 143(8): Prizant H., Gleicher N., Sen A Androgen actions in the ovary: balance is key. Journal of Endocrinology. 222(3): Ricarte A.R.F. & Silva A.R Morfofisiologia da reprodução de caprinos: revisão. Acta Veterinaria Brasilica. 4(1): Rocha R.M.P., Lima L.F., Alves A.M.C.V., Celestino J.J.H., Matos M.H.T., Lima-Verde I.B., Bernuci M.P., Lopes C.A.P., Báo S.N., Campello C.C., Rodrigues A.P.R. & Figueiredo J.R Interaction between melatonin and follicle-stimulating hormone promotes in vitro development of caprine preantral follicles. Domestic Animal Endocrinology. 44(1): 1-9. F.I: Rodrigues G.Q., Silva C.M.G., Faustino L.R., Bruno J.B., Pinto L.C., Lopes C.A.P., Campello C.C. & Figueiredo J.R Efeito de diferentes concentrações de hormônio folículo-estimulante recombinante sobre o desenvolvimento in vitro de folículos pré-antrais caprinos e ovinos isolados. Acta Veterinaria Brasileira. 4(3): Rodrigues J.K., Navarro P.A., Zelinski M.B., Stouffer R.L. & Xu J Direct actions of androgens on the survival, growth and secretion of steroids and anti-mullerian hormone by individual macaque follicle during three-dimensional culture. Human Reproduction. 30(3): Romero S. & Smitz J Exposing cultured mouse ovarian follicles under increased gonadotropin tonus to aromatizable androgens influences the steroid balance and reduces oocyte meiotic capacity. Endocrinology. 38(2): Salvetti N.R., Alfaro N.S. & Velázquez M.M Alteration in localization of steroid hormone receptors and coregulatory proteins in follicles from cows with induced ovarian follicular cysts. Reproduction. 144(6): Saraiva M.V.A., Celestino J.J.H., Araújo V.R., Chaves R.N., Almeida A.P., Lima-Verde I.B., Duarte A.B.G., Silva G.M., Martins F.S., Bruno J.B., Matos M.H.T., Campello C.C., Silva J.R.V. & Figueiredo J.R Expression of follicle-stimulating hormone receptor (FSHR) in goat ovarian follicles and the impact of sequential culture medium on in vitro development of caprine preantral
46 46 follicles. Zygote. 19(3): F.I: Sen A., Prizant H., Light A., Biswas A., Hayes E., Lee H.J., Barad D., Gleicher N. & Hammes S.R Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microrna-125b expression. PNAS. 111(8): Shaw J.M., Oranratnachai A. & Trounson A.O Fundamental cryobiology of mammalian oocytes and ovarian tissue. Theriogenology. 53(1): Silber S.J., DeRosa M., Pineda J., Lenahan K., Grenia D., Gorman K. & Gosden, R.G A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23(7): Silva C.M.G Utilização do hormônio luteinizante (LH), fator de crescimento epidermal (EGF) e ativina-a no cultivo in vitro de folículos pré-antrais caprinos isolados. 191f. Fortaleza, CE. Tese (Doutorado em Ciências Veterinárias) Programa de Pós-graduação em Ciências Veterinárias, Universidade Estadual do Ceará. 82 Silva C.M.G., Castro S.V., Faustino L.R., Rodrigues G.Q., Brito I.R., Saraiva M.V.A., Rossetto R., Silva T.F.P., Campello C.C. & Figueiredo J.R Moment of addition of LH to the culture medium improves in vitro survival and development of secondary goat pre-antral follicles. Reproduction In Domestic Animals. 46(4): F.I: Silva J.R.V., van den Hurk R., van Tol H.T.A., Roelen B.A.J. & Figueiredo J.R Gene expression and protein localisation for activin-a, follistatin and activin receptors in goat ovaries. Journal of Endocrinology. 183(1): Slomczynska M. & Tabarowski Z Localization of androgen receptor and cytochrome P450 aromatase in the follicle and corpus luteum of the porcine ovary. Animal Reproduction Science. 65(1-2): Spears N., Murray A. A., Allison V., Boland N. I. & Gosden R. G Role of gonadotropins and ovarian steroids in the development of mouse follicles in vitro. Journal of Reproduction and Fertility. 113(1): Suzuki T., Sasano H., Kimura N., Tamura M., Fukaya T., Yajima A. & Nagura H Immunohistochemical distribution of progesterone, androgen and oestrogen receptors in the human ovary during the menstrual cycle: relationship to expression of steroidogenic enzymes. Human Reproduction. 9(9): Szoltys M. & Slomczynska M Changes in distribution of androgen receptor
47 47 during maturation of rat ovarian follicles. Experimental and Clinical Endocrinology & Diabetes. 108(3) Taketsuru H., Hirao Y., Takenouchi N., Kosuke I. & Miyano T Effect of androstenedione on the growth and meiotic competence of bovine oocytes from early antral follicles. Zygote. 20(4): Taniguchi F., Couse J.F., Rodriguez K.F., Emmen J.M.A., Poirier D. & Korach K.S Estrogen receptor-α mediates an intraovarian negative feedback loop on thecal cell steroidogenesis via modulation of Cyp17α1 (cytochrome P450, steroid 17α-hydroxylase/17,20 lyase) expression. FASEB J. 21(2): Tarumi W., Itoh M.T. & Suzuki N Effects of 5α-dihydrotestosterone and 17β-estradiol on the mouse ovarian follicle development and oocyte maturation. PLoS ONE. 9(6): Tarumi W., Tsukamoto S., Okutsu Y., Takahashi N., Horiuchi T., Masanori T.I. & Ishizuka B Androstenedione induces abnormalities in morphology and function of developing oocytes, which impairs oocyte meiotic competence. Fertility and Sterility. 97(2): Tasaki H., Iwata H., Sato D., Monjy Y. & Kuwayama T Estradiol has a major role in antrum formation of porcine preantral follicles cultured in vitro. Theriogenology. 79(5): Telfer E.E., Mclaughlin M., Ding C. & Thong K.J A two-step serum free culture system supports development of human oocytes from primordial follicles in the presence of activin. Human Reproduction. 23(5): Valdez K.E., Cuneo S.P., Gorden P.J. & Turzillo A.M The role of thecal androgen production in the regulation of estradiol biosynthesis by dominant bovine follicles during the first follicular wave. Journal of Animal Science. 83(3): Van Den Hurk R. & Zhao J Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles. Theriogenology. 63(6): Vanacker J., Camboni A., Dath C., Langendonckt A.V., Dolmans M.M., Donnez J. & Amorim C.A Enzymatic isolation of human primordial and primary ovarian follicles with Liberase DH: protocol for application in a clinical setting. Fertility Preservation. 96(2): Veldscholte J., Berrevoets C.A., Zegers N.D., van der Kwast T.H., Grootegoed J.A. & Mulder E Hormone-induced dissociation of the androgen receptorheat-shock protein complex: use of a new monoclonal antibody to distinguish
48 48 transformed from nontransformed receptors. Biochemistry. 31(32): Vendola K., Zhou J., Wang J. & Bondy C.A Androgens promote insulinlike growth factor-i and insulin-like growth factor-i receptor gene expression in the primate ovary. Human Reproduction. 14(9): Walters KA Role of androgens in normal and pathological ovarian function. Reproduction and Fertility. 149(4): Walters K.A., Allan C.M. & Handelsman D.J Androgen actions and the ovary. Biology of Reproduction. 78(3): Walters K.A., Middleton L.J., Joseph S.R., Hazra R., Jimenez M., Simanainen U., Allan C.M. & Handelsman D.J Targeted loss of androgen receptor signaling in murine granulosa cells of preantral and antral follicles causes female subfertility. Biology of Reproduction. 87(6): Wang R.S., Chang H.Y., Kao H.S., Kao C.H., Wu Y.C., Yeh S., Tzeng C.R. & Chang C Abnormal mitochondrial function and impaired granulosa cell differentiation in androgen receptor knockout mice. International Journal of Molecular Sciences. 16(5): Weil S., Vendola K., Zhou J. & Bondy C.A Androgen and folliclestimulating hormone interactions in primate ovarian follicle development. Journal of Clinical Endocrinology. 84(8): Wu Y.G., Bennett J., Talla D. & Stocco C Testosterone, not 5 α - Dihydrotestosterone, stimulates LRH-1 leading to FSH-independent expression of Cyp19 and P450scc in granulosa cells. Molecular Endocrinology. 25(4): White, Y.A.R.; Woods, D.C.; Ishihara, Y.T.O.; Seki, H.; Tilly. J.L Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nature Medicine. 18(3): Xu B., Gao L., Cui Y., Gao L., Dai X., Li M., Zhang Y., Ma X., Diao F. & Liu J SET protein up-regulated testosterone production in the cultured preantral follicles. Reproductive Biology and Endocrinology. 11(9): Yang M.Y. & Fortune J.E Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75(6): Yazawa T., Kawabe S., Kanno M., Mizutani T., Imamichi Y., Ju Y., Matsumura T., Yamazaki Y., Usami Y., Kuribayashi M., Shimada M., Kitano T., Umezawa A. & Miyamoto K Androgen/androgen receptor pathway regulates expression of the genes for cyclooxygenase-2 and amphiregulin in
49 49 periovulatory granulosa cells. Molecular and Cellular Endocrinology. 369(1-2): Zeleznik A.J., Little-Ihrig L. & Ramasawamy S Administration of dihydrotestosterone to rhesus monkeys inhibits gonadotropin-stimulated ovarian steroidogenesis. Journal of Clinical Endocrinology and Metabolism. 89(2): Zou K., Yuan Z., Yang Z., Luo H., Sun K., Zhou L., Xiang J., Shi L., Yu Q., Zhang Y., Hou R. & Wu J Production of offspring from a germline stem cell line derived from neonatal ovaries. Nature Cell Biology. 11(5):
50 3. JUSTIFICATIVA 50 A execução de um projeto de pesquisa se justifica pela contribuição original dos resultados à ciência. Dessa forma, serão abordados a seguir três aspectos que justificaram a execução deste trabalho: importância do modelo animal, da biotécnica de MOIFOPA e originalidade do protocolo utilizado. a. Escolha da espécie: O rebanho nacional da espécie caprina está concentrado em mais de 90% na região nordeste e desempenha extrema importância socioeconômica para esta região. Além disso, pode ser utilizada como modelo experimental por apresentar semelhanças morfofisiológicas com o ovário humano, contribuindo para o aperfeiçoamento de biotécnicas reprodutivas, visando maximizar o potencial reprodutivo de animais domésticos de alto valor zootécnico ou ameaçados de extinção, bem como auxiliar no tratamento de mulheres com problemas de infertilidade. b. Importância da biotécnica de MOIFOPA: Como já mencionado anteriormente, os folículos pré-antrais representam a quase totalidade da população folicular ovariana (cerca de 90-95%), armazenando assim a maioria dos oócitos presentes em ovários mamíferos. Porém a grande maioria dos folículos não chegam à fase ovulatória, sendo eliminados pelo processo de atresia, reduzindo significativamente o potencial reprodutivo das fêmeas. Neste contexto, a biotécnica de MOIFOPA tem como objetivo resgatar estes folículos do ovário antes que os mesmos se tornem atrésicos e cultivá-los in vitro até a completa maturação oocitária. Diante disso, o desenvolvimento de um sistema de cultivo eficiente poderá fornecer subsídios para uma melhor compreensão sobre os fatores que regulam o crescimento folicular e maturação oocitária in vitro. c. Originalidade do protocolo: No que se refere à espécie caprina, os fatores que regulam a foliculogênese in vitro ainda são limitantes para o sucesso da biotécnica de MOIFOPA, devido aos resultados inconstantes em relação aos meios de bases utilizados. Na tentativa de melhorar os meios de desenvolvimento de folículos pré-antrais in vitro, o Laboratório de Manipulação de Oócitos e Folículos Ovarianos Pré-antrais (LAMOFOPA) vem testando o efeito de diferentes de hormônios (FSH: RODRIGUES et al., 2010; GH:
51 51 MAGALHÃES et al., 2011; insulina e FSH: CHAVES et al., 2012; A4: LIMA-VERDE et al., 2010) e fatores de crescimento (IGF-1: YUAN e GIUDICE, 1999; FGF: MATOS et al., 2007; VEGF: BRUNO et al., 2009). Dentre os hormônios estudados, destacam-se a A4 e o FSH, que desempenham um papel importante na regulação do desenvolvimento folicular. Baseado em estudos in vitro no cultivo de folículos pré-antrais caprinos isolados, a utilização do FSH, adicionado em momentos específicos do cultivo e de maneira crescente (SeqFSH: Dia 0: 100 ng/ml; Dia 6: 500 ng/ml; 12 Dia: 1000 ng/ml) combinado à insulina na concentração 10 ng/ml promoveu melhores taxas de sobrevivência folicular e retomada da meiose (CHAVES et al., 2012). Outro estudo avaliou o efeito de concentrações fixas de FSH (100 e 1000 ng/ml) no cultivo de folículos pré-antrais caprinos e observou que ambas as concentrações aumentaram a taxa de crescimento diário durante o cultivo (RODRIGUES et al., 2010). Entretanto, Saraiva et al. (2010) demonstraram que a adição de concentrações crescentes de FSH promoveu melhores taxas de sobrevivência, formação de antro, crescimento, bem como retomada da meiose, quando comparado à utilização do FSH em uma concentração fixa (100 ng/ml) no cultivo in vitro de folículos pré-antrais caprinos isolados. Em relação aos andrógenos, a adição de androstenediona tem apresentado resultados controversos, demonstrando ser concentração dependente e espécie específica. O cultivo de folículos pré-antrais isolados de roedores demonstrou que a adição de androstenediona reduziu a taxa de sobrevivência folicular, de maneira dose dependente (TARUMI et al., 2012). Por outro lado, o cultivo de folículos pré-antrais suínos em meio contendo androstenediona aumentou as taxas de formação de antro (TASAKI et al., 2013). Na espécie caprina, o cultivo de folículos pré-antrais inclusos em fragmentos do córtex ovariano na presença de androstenediona (10 ng/ml) associada ao FSH em uma concentração fixa (50 ng/ml) manteve a percentagem de folículos normais durante o cultivo in vitro (LIMA-VERDE et al., 2010). Embora a importância do FSH no controle da foliculogênese tenha sido bem estabelecida, a associação da androstenediona ao FSH (seja em concentrações crescentes ou fixa) ainda não foi testada no cultivo in vitro de folículos pré-antrais isolados caprinos. Sendo assim, o presente estudo demonstra pela primeira vez a influência da androstenediona associada ou não ao FSH, em diferentes concentrações, no cultivo in vitro de folículos pré-antrais caprinos e os seus efeitos sobre a produção de estradiol.
52 4. HIPÓTESES CIENTÍFICAS 52 Diante do exposto, foram formuladas as seguintes hipóteses científicas: A androstenediona associada ou não ao FSH, em diferentes formas de adição, influenciam positivamente na manutenção da sobrevivência folicular e no crescimento de folículos pré-antrais caprinos isolados cultivados in vitro, permitindo que seus oócitos se tornem meioticamente competentes. A androstenediona associada ou não ao FSH, em diferentes concentrações, estimula a produção de estradiol a partir de folículos pré-antrais caprinos isolados cultivados in vitro.
53 5. OBJETIVOS GERAL Avaliar os efeitos da adição da androstenediona associada ou não a concentrações crescentes ou fixa do FSH sobre o cultivo in vitro de folículos secundários isolados a partir de ovários caprinos. 5.2 ESPECÍFICOS Investigar o efeito da adição de androstenediona (10 ng/ml) associada ou não a concentrações crescentes de FSH (dia 0 ao dia 6= 100 ng/ml; dia 6 ao dia 12= 500 ng/ml; dia 12 ao dia 18= 1000 ng/ml) ou fixa (100 ng/ml), sobre as taxas de sobrevivência folicular, formação de antro e maturação oocitária a partir de folículos pré-antrais caprinos isolados cultivados in vitro. Avaliar se a adição de androstenediona, associada ou não ao FSH, afeta as concentrações de estradiol e androstenediona durante o cultivo in vitro de folículos pré-antrais caprinos isolados.
54 6. CAPÍTULO 2 54 Accelerated follicle growth during the culture of isolated caprine preantral follicles is detrimental to follicular survival and oocyte meiotic resumption Crescimento folicular acelerado durante o cultivo de folículos pré-antrais caprinos isolados é prejudicial na sobrevivência folicular e retomada da meiose Artigo submetido ao periódico: Theriogenology Em: Novembro de 2015 Qualis: A2
55 Accelerated follicle growth during the culture of isolated caprine preantral follicles is detrimental to follicular survival and oocyte meiotic 55 Livia Brunetti Apolloni a, Jamily Bezerra Bruno a, Benner Geraldo Alves a, Anna Clara Accioly Ferreira a, Victor Macêdo Paes a, Jesus de los Reyes Cadenas Moreno a, Francisco Léo Nascimento de Aguiar a, Felipe Zandonadi Brandão b, Johan Smitz c, Gary Apgar d, José Ricardo de Figueiredo a a Laboratory of Manipulation of Oocyte Enclosed in Preantral Follicles LAMOFOPA, Faculty of Veterinary, University of Ceará, Fortaleza, Brazil b Department of Animal Reproduction, Faculty of Veterinary, Federal University Fluminense, Niterói, Rio de Janeiro, Brazil c Follicles Biology Laboratory, Center for Reproductive Medicine, UZ Brussel, Laarbeeklaan 101, B-1090 Brussels, Belgium d Department of Animal Science, Food and Nutrition, Southern Illinois University- Carbondale, USA. * Corresponding author. Tel: ; Fax: address: jrf.lamofopapapers@gmail.com.br (José Ricardo de Figueiredo).
56 ABSTRACT 56 This study investigated the effect of androstenedione (A4) alone or in association with different concentrations of bovine recombinant FSH on the in vitro culture of isolated goat preantral follicles. Follicles were mechanically isolated from the ovarian tissue and cultured for 18 days in α-mem supplemented or not with A4 (10 ng/ml) alone or in association with fixed (A4+FixFSH: 100 ng/ml) or sequential (A4+SeqFSH: Day 0: 100 ng/ml; Day 6: 500 ng/ml; Day 12: 1000 ng/ml) concentrations of FSH. After 18 days, the oocytes were recovered for in vitro maturation and fluorescence analysis. At day 18 of culture, only A4+SeqFSH treatment showed a lower (P < 0.05) rate of intact follicles, survival probability and meiotic resumption, as well as higher (P < 0.05) percentage of degeneration and/or extrusion after antrum formation. Take together, these results showed a positive correlation between fast-growing follicles and follicles that degenerated and/or extruded after antrum formation. When compared to control, the addition of A4 alone or in association of FSH did not increase (P > 0.05) the estradiol production or androstenedione levels on Day 6. However on Day 18, the androstenedione levels was significantly lower in A4+SeqFSH treatment when compared to A4 alone or to A4+FixFSH treatments, while the estradiol production did not differ (P > 0.05). In summary, this study demonstrated that accelerated follicle growth negatively impacted the morphology of caprine preantral follicle cultured in vitro. In addition, the association of androstenedione with increasing concentration of FSH was detrimental to follicular survival and development. Keywords: secondary follicles, goat, FSH, androgens, growth rates.
57 1. Introduction 57 Ovarian function depends on multiple integrated processes that culminate in the production of competent oocytes during folliculogenesis. FSH plays an important role in folliculogenesis [1]. Regardless the FSH addition in in vitro culture media (i.e., fixed or increased concentrations) [2,3] it provides for the maintenance of follicular growth and survival as well as stimulates steroidogenesis [4]. Among the steroidal hormones, addition of androgens (androstenedione, dihidroandrostenediona, dihydrotestosterone and testosterone) promotes follicular growth in different species [5-7] through the stimulation of their receptors. Androgen receptors are located in the cytoplasm of granulosa cells (GC), theca cells (TC) and oocytes [8] of preantral follicles [9-11]; and antral [9, 10, 12], being the GC more responsive to androgens [13]. An important tool to investigate in vitro folliculogenesis, including the effect of different substances, is the media culture of preantral follicles [14]. Studies evaluating the role of androstenedione on in vitro follicule culture have been shown controversial with findings being both concentration-dependent and species specific. For example, addition of androstenedione in a dose dependent manner reduced the survival rate of isolated mice preantral follicles [15]. On the other hand, culture of isolated swine preantral follicles in medium containing androstenedione improved antrum formation rates [16]. In another study, after in vitro culture of goat preantral follicles (primordial and primary) enclosed in ovarian tissue, androstenedione associated with FSH maintained the percentage of normal follicles during the culture [17]. However, the effect of androstenedione and FSH on in vitro culture of isolated secondary preantral follicles has not been investigated in caprines. It is well known that goats are spread worldwide having social and economic importance in many countries. In addition, the goat has been proposed as an important animal model for women [18].
58 58 Therefore, the objective of this study was to investigate the effect of androstenedione addition, associated or not with FSH (fixed or sequencial concentration) to the culture medium, evaluating the following endpoints: (i) folicular survival and growth, (ii) antrum formation, (iii) hormonal production (androstenedione and estradiol), and (iv) meiotic resumption of caprine isolated secondary follicles. 2. Material and Methods 2.1 Chemicals Unless stated otherwise, all the chemicals and culture media used for this study were purchased from Sigma Chemical Company (St. Louis, MO, USA). 2.2 Source of ovaries Ovaries (n= 60) from 30 adults (between 1 and 3 years old), non-pregnant, mixed-breed goats (Capra hircus) were collected at a slaughterhouse. Immediately postmortem, pairs of ovaries were washed in 70% alcohol for 10 seconds and then twice in minimum essential medium plus HEPES (MEM-HEPES) supplemented with 100 µg/ml penicillin and 100 µg/ml streptomycin. After which, the ovaries were transported within 4 h to the laboratory in MEM-HEPES at 4 C [19]. 2.3 Isolation and selection of preantral follicles In the laboratory, the surrounding fatty tissue and ligaments were stripped from the ovaries. Ovarian cortical slices (1 2 mm thick) were excised from the ovarian surface using a surgical blade under sterile conditions and subsequently placed in holding medium consisting of MEM-HEPES with antibiotics. Preantral follicles, approximately µm in diameter without antral cavities (secondary follicles),
59 59 were visualized under a stereomicroscope (model SMZ 645; Nikon, Tokyo, Japan) and mechanically isolated by using 26-gauge (26 G) needles. Approximately 10 secondary follicles were isolated from each ovarian pair. These follicles were then transferred to 100 µl droplets containing basic culture medium for the evaluation of quality. Only secondary follicles that displayed the following characteristics were selected for culture: an intact basement membrane, two or more layers of granulosa cells and a visible oocyte that was round and centrally located within the follicle, without any dark cytoplasm. Then, isolated follicles were pooled and randomly allocated to the treatments [20]. 2.4 In vitro culture of preantral follicles After selection, the follicles were individually cultured (one follicle per droplet) in 100 µl droplets of culture medium under mineral oil in Petri dishes (60x15 mm; Corning, Sarstedt, Newton, NC, USA). The medium used was α-mem (ph ; Gibco, Invitrogen, Karlsruhe, Germany) supplemented with 3.0 mg/ml bovine serum albumin (BSA), 10 ng/ml insulin, 5.5 μg/ml transferrin, 5 ng/ml selenium, 2 mm glutamine, 2 mm hypoxanthine and 50 μg/ml ascorbic acid, here in after referred as α- MEM + [20]. Incubation was conducted at 39 C and 5% CO 2 in air for 18 days. Fresh media were prepared and incubated for 1 h prior to use, with 60 μl medium being changed in each drop every 2 days. The experimental conditions were replicated four times and at least 40 follicles were used per treatment. 2.5 Experimental design Follicles were randomly assigned to four different treatments as follows: 1) α- MEM + alone (control group); 2) α-mem + supplemented with androstenedione (A4: 10 ng/ml); 3) α-mem + plus A4 (10 ng/ml) associated with recombinant bovine FSH -
60 60 rbfsh (Nanocore, São Paulo, Brazil) in increasing concentrations (Sequential FSH: from day 0 to day 6 = 100 ng/ml; from day 6 to day 12 = 500 ng/ml; from day 12 to day 18 = 1000 ng/ml; A4+SeqFSH); 4) α-mem + plus A4 (10 ng/ml) associated with a fixed concentration of rbfsh (FixFSH: 100 ng/ml; A4+FixFSH). Concentrations of A4 and rbfsh were chosen based on previous work performed by our group (A4: [17]; SeqFSH: [3]; FixFSH: [2]). 2.6 Morphological evaluation of follicle development Follicles were evaluated during culture (days 0, 6, 12 and 18) to the following end-points: integrity of the basement membrane, morphology of the oocyte and surrounding granulosa cells, and morphological signs of degeneration such as darkness. The percentage of morphologically intact follicles was calculated by excluding the follicles which experienced rupture of the basement membrane and had degenerated. The percentage of degenerated follicles was calculated using the number of follicles that exhibited dark and/or misshapen cytoplasm of the oocyte and surrounding cumulus cells. Then, the percentage of extruded follicles was calculated using the number of follicles that showed rupture of the basement membrane. The follicular diameter was measured only in morphologically intact follicles every 6 days with the aid of an ocular micrometer attached to a stereomicroscope (SMZ 645 Nikon, Tokyo, Japan; magnification: X 100). Two perpendicular diameters were recorded for each follicle and the average of these two values was reported as the follicular diameter. To evaluate daily follicular growth, the mean increase in follicular diameter was calculated as follows: the diameter of morphologically intact follicles at day 18 minus their diameter at day 0, divided by 18 days. In vitro cultured follicles were divided into three growing categories: (i) non-growing: follicles that didn t grow during the culture; (ii) slowgrowing: follicles with a daily growth between μm/day; and (iii) fast-growing:
61 follicles with a daily growth between μm/day. Also, antral cavity formation was defined as a visible translucent cavity within the granulosa cell layers In vitro maturation At the end of the culture period, all the morphologically intact follicles were carefully and mechanically opened with 26 G needles under a stereomicroscope for oocyte recovery. Only oocytes ( 110 μm) with homogeneous cytoplasm and surrounded by at least one compact layer of cumulus cells were selected for in vitro maturation (IVM). The oocyte recovery rate was calculated by the ratio between the number of oocytes 110 μm (including zona pellucida) and the total number of normal and degenerated oocytes (smaller and larger than 110 μ m). The cumulus-oocyte complexes were selected and washed three times in maturation medium consisting of TCM-199 supplemented with 1% BSA, 5 μg/ml of luteinizing hormone (LH), 0.5 μ g/ml of rbfsh, 10 ng/ml of epidermal growth factor (EGF), 50 ng/ml of recombinant insuline-like growth factor (IGF), 100 μ M of cysteamine, 1 mm of pyruvate, and 1 μg/ml of estradiol [21]. After washing, oocytes were transferred to 100 µl drops of maturation medium under mineral oil and then incubated for 32 hours at 39 o C with 5% CO 2 in air. 2.8 Assessment of oocyte viability and chromatin configuration Fluorescence microscopy was used to analyze the viability of the oocytes from the caprine follicles classified as morphologically normal under the stereomicroscope, after culture. Briefly, the oocytes were incubated in 5.5 μ L calcein-am, 88.5 μ l ethidium homodimer-1 (Molecular Probes, Invitrogen, Karlsruhe, Germany), 5.0 μl Hoechst and 1.0 μl glutaraldehyde (Sigma, Deisenhofen, Germany) at 37 C, for 30 min.
62 62 After the incubation, oocytes were washed three times in TCM 199 HEPES and placed in 3 μl droplets of mounting medium (6.25 ml of PBS, 6.25 ml of glycerol and 6.25 μl Hoechst), covered with cover slip on slide and evaluated under a fluorescence microscope (Nikon, Eclipse 80i, Tokyo, Japan). Oocytes with cytoplasm stained by calcein-am (green) were classified as viable and those that had chromatin marked with ethidium homodimer-1 (red) were considered to be degenerated. Hoechst was used to analyze the oocyte chromatin configuration for intact germinal vesicles (GV), meiotic resumption (germinal-vesicle breakdown (GVBD), metaphase I (MI) and metaphase II (MII). 2.9 Androstenedione and Estradiol Assay To evaluate the relationship between follicle development and hormone production, 60 μl of culture medium from all the follicles were collected every 6 days (Days 6, 12 and 18) to quantify androstenedione (A4) and estradiol (E2) production. Androstenedione was measured by direct radioimmunoassay from DIAsource Immunoassay (androstenedione-ria-ct, DIASource Europe, Nivelles, Belgium) with a sensitivity of 70 ng/l and a total imprecision profile (CV = 10%) for concentrations between 100 and 7,000 ng/l. Hormone Assay for E2 (DSL4800) secretion was determined by double antibody radioimmunoassay (RIA) using a commercial kit Immunotech (catalog No: DSL4800, IMMUNOTECH s.r.o. - Radiová Prague 10 - Czech Republic). The analytical sensitivity of the assay was 2.2 pg/ml (assay range, pg/ml). Intra-assay: samples were assayed 12 times in the same run. The coefficients of variation were 8.9%. Inter-assay: samples were assayed in duplicate in 8 different runs. The coefficients of variation were 12.2%. All samples were assayed in the same RIA to eliminate inter- assay variability.
63 2.10 Statistical analysis 63 All statistical analyses were performed using Sigma Plot 11 (Systat Software Inc., USA). Data that were not normally distributed (Shapiro-Wilk test) were submitted to logarithmic transformation. Follicle and oocyte diameter, and follicular growth among treatments were compared by Kruskal-Wallis test, while the Wilcoxon signed test was used to analyze the effect of treatment within days of culture. The proportion of follicular variables (intact, degenerated, extruded, antrum formation, and meiotic resumption) among treatments and days of culture were analyzed by Fisher s exact test. A linear regression analysis was performed to evaluate the association of oocyte diameter with chromatin configuration and the relationship of follicular growth and antrum phenotype, while the logistic regression analyzed the association between follicle diameter and antrum formation. The follicle survival probability throughout the culture was plotted using Kaplan-Meier method and the difference among survival curves (treatments) was evaluated using log rank test. Data are presented as mean (±SEM) and percentage and the results were considered different when P < Probability values > 0.05 and 0.1 indicated that a difference approached significance. 3. Results 3.1 Follicular morphology A total of 169 follicles were selected for in vitro culture with a mean of 42.2 ± 0.6 follicles analyzed per treatment. The effect of A4 (10 ng/ml) associated or not with different concentrations of FSH on the percentage of intact follicles was assessed over 18 days of culture (Fig. 1). Except for the control, the percentage of intact follicle decreased (P < 0.05) from day 0 to day 18 and tended to decrease (P < 0.08) only in the A4+SeqFSH treatment from day 12 to day 18. In addition, this treatment was lower on
64 64 day 18 compared to the control (P < 0.05). The effect of treatments on follicle survival probability was evaluated by Kaplan Meier method (Fig. 2). The only treatment that showed a reduction (73.8%; P < 0.05) in the follicle survival on Day 18 was the A4+SeqFSH when compared to the control group. The rate of degenerated follicles was similar (P > 0.05) among the treatments (Fig. 3). However, from Day 12 to Day 18 the A4+SeqFSH treatment showed an increase (P < 0.05) in the percentage (11.9%) of degenerated follicles. The percentage of follicular extrusion is shown (Fig. 4). No difference was observed among treatments (P > 0.05). However, treatments containing FSH increased (P < 0.05) the percentage of extruded follicles from day 0 to day Follicular diameter and growth rate The average values of follicular diameter during in vitro culture of isolated preantral follicles is shown (Table 1). Regardless of the treatment, a progressive increase (P < 0.05) in follicular diameter throughout the culture period was observed. However, the follicle diameter was similar (P > 0.05) among treatments irrespective of the culture period. The daily growth rate is shown (Table 2), and the A4+SeqFSH treatment tended (P < 0.09) to be higher than control group in the second third of culture perdiod (D6-D12). Moreover, only A4+SeqFSH treatment the growth rate tended to be higher (P < 0.07) in the second third compared to the first third of culture. The frequency distributions of follicles classified according to growing rates is shown (Fig. 5A,B). We observed that the A4+SeqFSH treatment presented a reduction (P < 0.05) in the percentage of slow-growing follicles compared to control and A4 treatments. Additionally, FSH treatments showed a higher (P > 0.05) percentage of fast growing follicles compared to control (Fig. 5B).
65 3.3 Antrum formation 65 Regardless of treatment, the percentage of antrum formation increased (P < 0.05) from Day 0 until Day 12 of culture and remained constant until the end of the culture period (data not shown). A positive correlation between antrum formation and follicular diameter during in vitro culture was observed by logistic regression analysis (Fig. 6). When taken together, the mean growth rate of follicles that formed antrum followed by degeneration and extrusion was 1.8-fold superior than follicles that maintained the antrum (Fig. 7). When the treatments were compared to each other using this end points (Fig. 8), the A4+SeqFSH had a decrease (P < 0.05) in the percentage of follicles that maintained the antrum but an increase (P < 0.05) in the percentage of follicles that degenerated or extruded after antrum formation compared control group. These results could be confirmed by the positive association between antrum formation phenotypes and follicular growth rates (Fig. 9). 3.4 Oocyte parameters and chromatin configuration No difference in the oocyte recovery rate ( 110 µm), oocyte diameter (µm) and oocyte viability (%) were observed among the treatments (P > 0.05) after 18 days of culture (data not shown). The A4+SeqFSH treatment had a percentage of meiotic resumption lower (P < 0.05) than the control group and, this treatment tended to differ (P < 0.06) from A4+FixFSH treatment. Metaphase II (MII) was observed only in the control and A4+FixFSH treatments (Fig. 10). Finally, as expected a positive relationship between chromatin configuration and oocyte diameter was observed using a regression analysis (Fig. 11). 3.5 Hormonal production
66 66 Regardless of treatment, androstenedione concentrations were similar (P > 0.05) between 6 and 18 days of culture. However, at 18 days there was a decrease in androstenedione levels of A4+SeqFSH compared with A4 (tended to differ; P < 0.07) and A4+FixFSH treatments (P < 0.05; Fig. 12). No difference (P > 0.05) was observed among treatments on the estradiol concentration during the in vitro culture (data not shown). 4. Discussion This study demonstrated for the first time the effect of androstenedione, in association or not with FSH (different concentrations), on the in vitro culture of isolated caprine secondary follicles. In general, we observed that androstenedione, associated with increasing concentrations of FSH (A4+SeqFSH) hampered the follicular development and survival in vitro. Previous studies in caprines, have shown that the presence of increasing concentrations of FSH the addition of others substances such as activin A [22] epidermal growth factor [23] and IGF-II [24] did not impair follicular development and improved meiosis resumption of the oocytes recovered from in vitro growth of preantral follicles. Unlike the positive effects of those substances associated with increasing FSH concentrations, in our study the androstenedione caused a deleterious effect on the in vitro culture of preantral follicles, when associated with increasing concentrations of FSH and no effects when associated with fixed FSH concentration. Even though we expected positive results, these findings clearly show the timeliness of this study. In our study, we observed that the percentage of morphologically intact follicles, as well as the follicular survival probability decreased, whereas the rate of degenerated follicles increased at the end of culture in the A4+SeqFSH treatment. Several authors
67 67 have described that during the in vitro culture of preantral follicles, the addition of FSH either in increasing concentrations [3] or in decreasing concentrations associated to dihydrotestosterone [7] increased follicle survival. It is well known that follicular growth and atresia depends on a delicate balance between gonadotropin and paracrine factors [25]. Therefore, we suggest that increasing concentrations of FSH associated with androstenedione may cause a toxic effect, compromising the follicular physiology through the inappropriate proliferation of GC [26]. In relation to extrusion rates, FSH treatments (fixed and sequential) presented an increase of the rate of extruded follicles between Day 0 and Day18. It is known that androgens increase the expression of FSH receptor (FSHR) in the GC [27,28]. Thus, we propose that the association of androstenedione with FSH may have potentiated the action of this hormone in the intrafollicular environment, hyperstimulating the proliferation of GC [26] and consequently, causing the rupture of basal membrane and releasing the cumulus-oocyte complexes. These findings are supported by the fact that FSH treatments presented higher proportion of follicles in fast-growing category than control group. Additionally, using the linear regression analysis it was possible to observe a correlation between fast-growing follicles and follicles that degenerated and/or extruded after antrum formation, implying that follicles require a slow growth rate to maintain follicular viability. In the present study, the A4+SeqFSH treatment was the only one that had lower percentage of follicles that formed antrum and remained intact until the end of the culture when compared to control. This fact can be explained by the high rates of degeneration and/or extrusion after antrum formation observed in this treatment. Other study tested the effect of different concentrations of androstenedione (10 and 100 ng/ml) in medium FSH-free on the in vitro culture of bovine early antral follicles and
68 68 demonstrated that both concentrations were able to maintain the antrum intact until the end of culture [29]. This is the first study that evaluated the production of androstenedione during the in vitro culture of goat preantral follicles. Despite the difference in androstenedione concentrations at the onset of culture (0 ng/ml-control vs 10 ng/ml-a4 treatments), the androstenedione levels on Day 6 were equivalent between control and A4 treatments. In other words, the concentration of androstenedione was reduced at least 66 times in A4 treatments indicating a high rate of metabolization of androstenedione by cultured follicles in these treatments. In addition, follicles cultured in the medium containing low insulin were able to reduce adequate levels of androstenedione, resulting in equivalent production of estradiol both on Day 6 and 18 of culture. This clearly shows that the excessive metabolization of androstenedione was not used for estradiol production. During the steroidogenesis process, androstenedione can be converted either to: (i) testosterone by 17β-HSD (17 β-hydroxisteroid dehydrogenase) which itself can then be aromatised into estradiol by P450arom (CYP19) in CG (A4 T E2), (ii) estrone by P450arom (CYP19) for subsequent conversion in estradiol by 17β-HSD in CG (A4 E1 E2), or (iii) testosterone by 17β-HSD in TC which itself can then be converted into dihydrotestosterone by 5α-reductase in GC (A4 T DHT) [8]. Therefore, in our study, we suggest that the major pathway used by the follicles cultured in A4 treatments was A4 DHT since the estradiol production did not differ among treatments regardless the culture period. This assumption can be support by Bogovish and Richards [30] which demonstrated the ability of GC from rodents to generate dihydrotestosterone when treated with androstenedione. Moreover, WU et al. [31] demonstrated that the addition of testosterone in medium containing FSH or not, promoted a stimulatory effect of CYP19 in mice GC, which correlated with estradiol production.
69 69 Similar to the other studied end points the A4+SeqFSH treatment also showed lower rates of meiosis resumption than control after oocyte in vitro maturation. The control medium used in our experiment was previously developed by our team [20] that defined the appropriated insulin concentration (10 ng/ml). Insulin is a major factor related to follicular survival, growth and production of steroids hormones [20]. Like androgens [27], studies have reported that insulin increases the expression of FSHR [32,33]. We believe that androstenedione associated with insulin enhanced the action of FSH on the in vitro culture of preantral follicles. The high FSH concentrations used in the A4+SeqFSH treatment caused a deleterious effect on the meiosis resumption. This result is in agreement with Sánchez et al. [26] that reported that higher concentrations of FSH increased the levels of LH receptors (LHR) in mice cumulus cells, compromising oocyte competence, since the upregulation of LHR is related to low oocyte quality [34]. In our study, surviving follicles were divided into three categories (non-, slowand fast-growing follicles), according to their growth rates. The growth rates are an important parameter to evaluate the efficiency of follicular development in culture. However, in our study, accelerated follicle growth was correlated with degeneration and/or extrusion which may allow it to be used as a tool to predict follicular fate in vitro. On the other hand, Xu et al. [35] demonstrated that in the culture of monkeys preantral follicles, the production of anti-mullerian hormone (AMH) was correlated with follicular growth, wherein early AMH production can predict further development of cultured preantral follicles. Other studies using activin A in the culture medium of isolated caprine preantral follicles showed that the treatment with the highest percentage of fast-growing follicles also presented high meiotic resumption rates [23]. Differences in the species, in the medium composition as well as in the classification on the follicle growth categories may explain this controversial finding. For instance, in the culture of isolated caprine preantral follicles, Silva et al. [23] classified fast-growing follicles as
70 70 those which showed growth rate higher than 10μm/day, while in our study the follicles that had a daily growth between μ m/day were classified as fast-growing follicles. Besides the presence of androstenedione in the majority of our treatments, Silva et al. [23] used higher insulin concentration in the basic medium. This correlation indicates that in the presence of androstenedione and increasing concentrations of FSH the acceleration of follicular development was detrimental for efficiency of caprine preantral follicles cultured in vitro. In summary, the addition of androstenedione alone or associated with fixed concentrations of FSH did not improve either follicular survival, development or steroidal levels after in vitro culture. Moreover, increasing FSH concentrations associated with androstenedione had a detrimental effect on follicle survival and oocyte meiotic resumption. Finally, this study demonstrated that accelerated follicle growth negatively affected the morphology of caprine preantral follicle cultured in vitro. Acknowledgments This work was carried out at the Laboratory of Manipulation of Oocytes and Ovarian Preantral Follicles (LAMOFOPA), Faculty of Veterinary Medicine of Ceará State University, Fortaleza, CE, Brazil, and supported by CNPq (407594/2013-2). Livia Brunetti Apolloni is recipient of a grant from CAPES Brazil and José Ricardo de Figueiredo is recipient of a grant from CNPq Brazil. Disclosures Conflict of interest: None of the authors declared having any conflict of interest.
71 Tables 71 Table 1. Mean (± SEM) diameter of normal follicles cultured in vitro for 18 days in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Follicular diameter (µm) Treatments Day 0 Day 6 Day 12 Day 18 Control ± 7.4 a ± 12.1 b ± 13.9 c ± 18.8 d A ± 7.5 a ± 11.1 b ± 14.0 c ± 21.3 d A4+SeqFSH ± 9.4 a ± 12.8 b ± 18.6 c ± 29.9 d A4+FixFSH ± 7.9 a ± 11.1 b ± 18.4 c ± 26.3 d Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh.. a,b,c,d Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Among treatments within the same day (P > 0.05).
72 Table Mean (± SEM) daily growth of normal follicles cultured in vitro for 18 days in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Follicular growth (µm/day) on different intervals of culture Treatments D0-D6 D6-D12 D12-D18 Overall (D0-D18) Control 6.1 ± 1.4 Aa 3.2 ± 1.6 Aa 5.2 ± 1.5 Aa 4.8 ± 0.8 A A4 4.5 ± 1.4 Aa 5.2 ± 2.0 ABa 6.6 ± 1.6 Aa 5.4 ± 1.1 A A4+SeqFSH 3.8 ± 2.0 Aa 9.0 ± 2.2 B b # 6.5 ± 2.7 Aab 6.4 ± 1.5 A A4+FixFSH 5.4 ± 1.4 Aa 8.7 ± 2.1 ABa 5.4 ± 1.8 Aa 6.5 ± 1.2 A Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. A,B Within interval time, uncommon uppercase letters indicate difference (P < 0.05). Tended to differ from control group within the same interval of culture (P < 0.09). a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). # Tended to differ from D0- D6 interval (P < 0.07).
73 Figures and legends 73 Figure 1. Percentage of intact follicles during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. A,B Within day, uncommon uppercase letters indicate difference (P < 0.05). a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Tended to differ from Day 18 (P < 0.08).
74 74 Figure 2. Follicle survival probability (Kaplan-Meier plot) during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. * Differed from control ( P < 0.05).
75 75 Figure 3. Percentage of degenerated follicles during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Among treatments within the same day (P > 0.05).
76 76 Figure 4. Percentage of extruded follicles during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within treatment, uncommon lowercase letters indicate difference (P < 0.05). Among treatments within the same day (P > 0.05).
77 77 Figure 5. (A) Representation of follicles (n = 169) classified according to growth rate in non-, slow-, and fast-growing. (B) Frequency distributions of follicles in growing categories during in vitro culture in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within the same growing categories, uncommon lowercase letters indicate difference (P < 0.05). # Tended to differ from control (P < 0.06). Tended to differ from control (P < 0.07).
78 78 Figure 6. Relationship between antrum formation and follicle diameter. Each point of the graph is a follicle recorded during in vitro culture (n = 169). The follicles evaluated were defined by binary values (without antrum formation = 0; presence of antrum formation = 1) to dependent variable. A logistic regression (antrum predicted probability) is represented by the equation and the black line [Logit P = ( follicle diameter); P < 0.05].
79 79 Figure 7. Mean (± SEM) daily growth rate of follicles according to their ability to form antrum and maintain normal morphology. a,b,c Uncommon lowercase letters indicate difference (P < 0.05).
80 80 Figure 8. Effect of the addition of androstenedione associated or not with fixed and sequential concentrations of FSH on the antrum formation and maintenance of normal morphology. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α- MEM + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α- MEM + plus androstenedione and fixed concentrations of rbfsh. a,b Within the same antrum conditions, uncommon lowercase letters indicate difference (P < 0.05).
81 81 Figure 9. Relationship between antrum phenotypes conditions and follicular growth. Each point of graph is a follicle recorded during in vitro culture (n = 169). The follicles evaluated were defined by binary values (absence of antrum formation = 1; antrum maintenance = 2; follicles degenerated and/or extruded after antrum formation = 3) to dependent variable. A linear regression is represented by the equation and the black line [Antrum formation conditions = ( follicular growth); R 2 = 0.08; r = 0.28; P < 0.001].
82 82 Figure 10. Percentage of meiotic resumption, germinal vesicle (GV), germinal vesicle breakdow (GVBD), metaphase I (MI) and metaphase II (MII) of oocytes from preantral follicles cultured in vitro in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α- MEM + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. a,b Within the same parameter, values with different letters differ (P < 0.05). # Tended to differ from A4+SeqFSH (P < 0.06).
83 83 Figure 11. Regression analysis of the chromatin configuration (GV, germinal vesicle; GVBD, germinal vesicle breakdow; MI, metaphase I; MII, metaphase II) and oocyte diameter. Each point of graph is a oocyte evaluated after in vitro maturation (n = 68). The oocytes evaluated were defined by values (GV = 2; GVBD = 3; MI = 4; and MII = 5) to chromatin configuration (dependent variable). A linear regression is represented by the equation and the black line [chromatin configuration = ( oocyte diameter); R 2 = 0.06; r = 0.24; P < 0.05].
84 84 Figure 12. Mean (± SEM) androstenedione levels from preantral follicles cultured in vitro in medium containing androstenedione associated or not with fixed and sequential concentrations of FSH. Control: α-mem + ; A4: α-mem + plus androstenedione; A4+SeqFSH: α-mem + plus androstenedione and sequential concentrations of rbfsh; A4+FixFSH: α-mem + plus androstenedione and fixed concentrations of rbfsh. A,B,C Within day, uncommon uppercase letters indicate difference (P < 0.05). Tended to differ from A4 (P < 0.07). Within treatment between days (P > 0.05).
EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS
 1 EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS EFFECT OF TYPE OF CULTURE SYSTEM ON THE IN VITRO DEVELOPMENT OF ISOLATED CAPRINE PREANTRAL
1 EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS EFFECT OF TYPE OF CULTURE SYSTEM ON THE IN VITRO DEVELOPMENT OF ISOLATED CAPRINE PREANTRAL
SISTEMA REPRODUTOR FEMININO
 Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR FEMININO Histologia e Embriologia Geral Veterinária Profa. Janaina Serra Azul Monteiro Evangelista SISTEMA REPRODUTOR FEMININO
Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR FEMININO Histologia e Embriologia Geral Veterinária Profa. Janaina Serra Azul Monteiro Evangelista SISTEMA REPRODUTOR FEMININO
GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS. Profª Msc. Tatiane da Silva Poló
 GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS Profª Msc. Tatiane da Silva Poló ou OOGÊNESE ou OVULOGÊNESE e FOLICULOGÊNESE DEFINIÇÃO OVOGÊNESE: É uma sequência de eventos através dos quais as células germinativas
GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS Profª Msc. Tatiane da Silva Poló ou OOGÊNESE ou OVULOGÊNESE e FOLICULOGÊNESE DEFINIÇÃO OVOGÊNESE: É uma sequência de eventos através dos quais as células germinativas
Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca
 Topicos Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca Fertilizacao e desenvolvimento embrionario Cerebro
Topicos Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca Fertilizacao e desenvolvimento embrionario Cerebro
Produção in vitro de embriões
 Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões Vicente
Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões Vicente
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Efeito do ácido lisofosfatídico durante a maturação in vitro do complexo cumulus-oócito: expansão do cumulus, metabolismo
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Efeito do ácido lisofosfatídico durante a maturação in vitro do complexo cumulus-oócito: expansão do cumulus, metabolismo
ENDOCRINOLOGIA REPRODUTIVA. M. V. Doutorando Lucas Balinhas Farias
 ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução
 Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução Apresentadores: Med. Vet. Andressa Stein Maffi Kauana Soares FI: 1,79 Qual
Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução Apresentadores: Med. Vet. Andressa Stein Maffi Kauana Soares FI: 1,79 Qual
Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes Lucas Hax e Patrícia Mattei Pelotas, 18 de
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes Lucas Hax e Patrícia Mattei Pelotas, 18 de
Produção in vitro de embriões ovinos
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Produção in vitro de embriões ovinos Apresentadores: Mauri Mazurek Rodrigo C. de C. de Azambuja Orientação: Liziane Lemos Viana Small Ruminant Resarch
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Produção in vitro de embriões ovinos Apresentadores: Mauri Mazurek Rodrigo C. de C. de Azambuja Orientação: Liziane Lemos Viana Small Ruminant Resarch
REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACAS: UM ESTUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULAS DA GRANULOSA
 REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACA: UM ETUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULA DA GRANULOA Douglas Peraoli & Francielle Bado Augusto chneider FI: 3.300
REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACA: UM ETUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULA DA GRANULOA Douglas Peraoli & Francielle Bado Augusto chneider FI: 3.300
NUPEEC. Núcleo de Pesquisa, Ensino e Extensão em Pecuária
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Fatores Parácrinos, Autócrinos e Endócrinos que Mediam a Influência da Nutrição na Reprodução em Bovinos e Suínos Journal of Animal Science 1996
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Fatores Parácrinos, Autócrinos e Endócrinos que Mediam a Influência da Nutrição na Reprodução em Bovinos e Suínos Journal of Animal Science 1996
Competência Oocitária
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Laboratório de Reprodução Animal -EMBRAPA Competência Oocitária Lucas Hax Médico Veterinário Doutorando em Biotecnologia
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Laboratório de Reprodução Animal -EMBRAPA Competência Oocitária Lucas Hax Médico Veterinário Doutorando em Biotecnologia
hormônios do sistema genital masculino gônadas masculinas
 Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Interação dos mecanismos fisiológicos que influenciam a fertilidade em vacas leiteiras
 Ministério da Educação Universidade Federal de Pelotas Faculdade de Medicina Veterinária Núcleo de Ensino, Pesquisa e Extensão em Pecuária-NUPEEC Interação dos mecanismos fisiológicos que influenciam a
Ministério da Educação Universidade Federal de Pelotas Faculdade de Medicina Veterinária Núcleo de Ensino, Pesquisa e Extensão em Pecuária-NUPEEC Interação dos mecanismos fisiológicos que influenciam a
Papel dos andrógenos na foliculogênese em mamíferos
 Acta Scientiae Veterinariae, 2016. 44: 1369. REVIEW ARTICLE Pub. 1369 ISSN 1679-9216 Papel dos andrógenos na foliculogênese em mamíferos The Role of Androgens in Mammals Folliculogenesis Livia Brunetti
Acta Scientiae Veterinariae, 2016. 44: 1369. REVIEW ARTICLE Pub. 1369 ISSN 1679-9216 Papel dos andrógenos na foliculogênese em mamíferos The Role of Androgens in Mammals Folliculogenesis Livia Brunetti
Fisiologia da Reprodução
 Texto de Referência Fisiologia da Reprodução Conhecimentos de anatomia e fisiologia são imprescindíveis para o Médico Veterinário que pretende trabalhar de forma correta e tirar o máximo proveito da técnica
Texto de Referência Fisiologia da Reprodução Conhecimentos de anatomia e fisiologia são imprescindíveis para o Médico Veterinário que pretende trabalhar de forma correta e tirar o máximo proveito da técnica
DHEA E REPRODUÇÃO ASSISTIDA DRA ISABEL CORREA
 DHEA E REPRODUÇÃO ASSISTIDA DRA ISABEL CORREA ANDROGÊNIOS E REPRODUÇÃO Em primatas Aumento do crescimento de folículos imaturos Aumento em 3-4 X expressão do IGF1 nas células da granulosa e teca Aumento
DHEA E REPRODUÇÃO ASSISTIDA DRA ISABEL CORREA ANDROGÊNIOS E REPRODUÇÃO Em primatas Aumento do crescimento de folículos imaturos Aumento em 3-4 X expressão do IGF1 nas células da granulosa e teca Aumento
O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas Apresentadores: Andressa Stein Maffi Mauri Mazurek
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas Apresentadores: Andressa Stein Maffi Mauri Mazurek
TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO
 TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO Raphael Bessa Parmigiani, PhD Centro de Oncologia Molecular Instituto Sírio-Libanes de Ensino e Pesquisa Curso de Introdução à Biologia Molecular Goiânia, Maio
TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO Raphael Bessa Parmigiani, PhD Centro de Oncologia Molecular Instituto Sírio-Libanes de Ensino e Pesquisa Curso de Introdução à Biologia Molecular Goiânia, Maio
BIOLOGIA. Moléculas, Células e Tecidos Gametogênese. Prof. Daniele Duó
 BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
Produção in vitro de embriões
 Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós- Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões
Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós- Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões
ALLANA FERREIRA DA COSTA PESSOA
 1 UNIVERSIDADE ESTADUAL DO CEARÁ- UECE PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA- FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS-PPGCV ALLANA FERREIRA DA COSTA PESSOA
1 UNIVERSIDADE ESTADUAL DO CEARÁ- UECE PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA- FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS-PPGCV ALLANA FERREIRA DA COSTA PESSOA
Mutações no gene STAT5A estão associadas com a sobrevivência embrionária e produção de leite
 UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE VETERINÁRIA Núcleo de Pesquisa, Ensino e Extensão em Pecuária Mutações no gene STAT5A estão associadas com a sobrevivência embrionária e produção de leite Apresentação:
UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE VETERINÁRIA Núcleo de Pesquisa, Ensino e Extensão em Pecuária Mutações no gene STAT5A estão associadas com a sobrevivência embrionária e produção de leite Apresentação:
Fisiologia celular I. Fisiologia Prof. Msc Brunno Macedo
 celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
Expressão Gênica em Oócitos e Embriões
 Universidade Federal de Pelotas Graduação em Biotecnologias Manipulação de Gametas e Embriões Expressão Gênica em Oócitos e Embriões Prof. Tiago Collares Prof a. Priscila M. M. de Leon Janeiro, 2013 Análise
Universidade Federal de Pelotas Graduação em Biotecnologias Manipulação de Gametas e Embriões Expressão Gênica em Oócitos e Embriões Prof. Tiago Collares Prof a. Priscila M. M. de Leon Janeiro, 2013 Análise
ENDOCRINOLOGIA DA REPRODUÇÃO. Elisângela Mirapalheta Madeira Medica Veterinária, MC
 ENDOCRINOLOGIA DA REPRODUÇÃO Elisângela Mirapalheta Madeira Medica Veterinária, MC Introdução Glândulas Endócrinas Hipotálamo Hipófise Gônadas Glândula pineal Glândulas Endócrinas Hipotálamo Glândulas
ENDOCRINOLOGIA DA REPRODUÇÃO Elisângela Mirapalheta Madeira Medica Veterinária, MC Introdução Glândulas Endócrinas Hipotálamo Hipófise Gônadas Glândula pineal Glândulas Endócrinas Hipotálamo Glândulas
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular
 Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Interações hormonais relacionadas com a reprodução. Professor: Arturo Arnáez Vaella
 Interações hormonais relacionadas com a reprodução Professor: Arturo Arnáez Vaella 1. a paralisação (diplóteno) Fonte: Carlson, B. (2014). Embriologia humana e biologia do desenvolvimento (5 ed.) 1. a
Interações hormonais relacionadas com a reprodução Professor: Arturo Arnáez Vaella 1. a paralisação (diplóteno) Fonte: Carlson, B. (2014). Embriologia humana e biologia do desenvolvimento (5 ed.) 1. a
ENDOCRINOLOGIA REPRODUTIVA. M.S. Cássio Cassal Brauner FAEM-UFPel
 ENDOCRINOLOGIA REPRODUTIVA M.S. Cássio Cassal Brauner Prof. DZ-FAEM FAEM-UFPel ENDOCRINOLOGIA REPRODUTIVA Endocrinologia é parte das ciências médicas que trata da secreção das glândulas internas (hormônios)
ENDOCRINOLOGIA REPRODUTIVA M.S. Cássio Cassal Brauner Prof. DZ-FAEM FAEM-UFPel ENDOCRINOLOGIA REPRODUTIVA Endocrinologia é parte das ciências médicas que trata da secreção das glândulas internas (hormônios)
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular
 Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Inseminação artificial em tempo - fixo (IATF) utilizando estradiol e progesterona em vacas Bos indicus: Estratégias e fatores que afetam a fertilidade
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Inseminação artificial em tempo - fixo (IATF) utilizando estradiol e progesterona em vacas Bos indicus: Estratégias e fatores que afetam a fertilidade
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Inseminação artificial em tempo - fixo (IATF) utilizando estradiol e progesterona em vacas Bos indicus: Estratégias e fatores que afetam a fertilidade
Gametogênese Ovogênese. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese Ovogênese Prof a. Marta G. Amaral, Dra. Embriologia molecular Cél germinativa primordial (CGP) CGP Oogônias Inicia antes do nascimento Depois entra em repouso Na puberdade termina a diferenciação
Gametogênese Ovogênese Prof a. Marta G. Amaral, Dra. Embriologia molecular Cél germinativa primordial (CGP) CGP Oogônias Inicia antes do nascimento Depois entra em repouso Na puberdade termina a diferenciação
Regulação gênica em Eucariotos. Prof. Dr. Marcelo Ricardo Vicari
 Regulação gênica em Eucariotos REGULAÇÃO GÊNICA Neurônio e célula de fígado: células de um mesmo indivíduo e que contêm a mesmo genoma REGULAÇÃO GÊNICA Diferenciação celular 1973 REGULAÇÃO GÊNICA Dolly:
Regulação gênica em Eucariotos REGULAÇÃO GÊNICA Neurônio e célula de fígado: células de um mesmo indivíduo e que contêm a mesmo genoma REGULAÇÃO GÊNICA Diferenciação celular 1973 REGULAÇÃO GÊNICA Dolly:
Efeitos do volume de Percoll, duração e força de centrifugação na produção in vitro e proporção de sexos de embriões bovinos.
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Efeitos do volume de Percoll, duração e força de centrifugação na produção in vitro e proporção de sexos de embriões bovinos. Machado, G. M. et.
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Efeitos do volume de Percoll, duração e força de centrifugação na produção in vitro e proporção de sexos de embriões bovinos. Machado, G. M. et.
Coleta, Classificação e Maturação in vitrode Oócitos
 Universidade Federal de Pelotas Graduação em Biotecnologias Disciplina de Manipulação de Gametas e Embriões 2ª Aula: Coleta, Classificação e Maturação in vitrode Oócitos Priscila M. M. de Leon Doutoranda
Universidade Federal de Pelotas Graduação em Biotecnologias Disciplina de Manipulação de Gametas e Embriões 2ª Aula: Coleta, Classificação e Maturação in vitrode Oócitos Priscila M. M. de Leon Doutoranda
T AT A A T M A E M NT N O
 Interpretação de exames laboratoriais em RHA Técnicas de Reprodução Assistida Dr. Pedro Augusto Araujo Monteleone pedro@monteleone.med.br 24 de fevereiro de 2012 exames laboratoriais em RHA DIAGNÓSTICO
Interpretação de exames laboratoriais em RHA Técnicas de Reprodução Assistida Dr. Pedro Augusto Araujo Monteleone pedro@monteleone.med.br 24 de fevereiro de 2012 exames laboratoriais em RHA DIAGNÓSTICO
CAMILA BIZARRO DA SILVA
 CENTRO DE PESQUISA EM CIÊNCIAS AGRÁRIAS MESTRADO EM SAÚDE E PRODUÇÃO DE RUMINANTES CAMILA BIZARRO DA SILVA EFEITO DE DIFERENTES CONCENTRAÇÕES DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NO SISTEMA DE CULTIVO
CENTRO DE PESQUISA EM CIÊNCIAS AGRÁRIAS MESTRADO EM SAÚDE E PRODUÇÃO DE RUMINANTES CAMILA BIZARRO DA SILVA EFEITO DE DIFERENTES CONCENTRAÇÕES DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NO SISTEMA DE CULTIVO
UNIVERSIDADE ESTADUAL DO CEARÁ-UECE FACULDADE DE VETERINÁRIA-FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS- PPGCV
 1 UNIVERSIDADE ESTADUAL DO CEARÁ-UECE FACULDADE DE VETERINÁRIA-FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS- PPGCV PATRÍCIA MAGALHÃES DE ANDRADE EFEITO DOS MEIOS DE CULTIVO DE BASE α-mem E
1 UNIVERSIDADE ESTADUAL DO CEARÁ-UECE FACULDADE DE VETERINÁRIA-FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS- PPGCV PATRÍCIA MAGALHÃES DE ANDRADE EFEITO DOS MEIOS DE CULTIVO DE BASE α-mem E
2
 1 2 3 4 5 6 7 8 9 10 O ovário mamífero é um órgão dinâmico encarregado de proporcionar um ambiente ideal para a produção de hormônios e liberação dos gametas femininos. No ovário, estão contidos milhares
1 2 3 4 5 6 7 8 9 10 O ovário mamífero é um órgão dinâmico encarregado de proporcionar um ambiente ideal para a produção de hormônios e liberação dos gametas femininos. No ovário, estão contidos milhares
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR. Sinalização Celular SALVADOR - BA 2016
 UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal
 Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal Disciplina de Reprodução Humana Departamento de Ginecologia e Obstetrícia FMRP - USP Profa Dra
Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal Disciplina de Reprodução Humana Departamento de Ginecologia e Obstetrícia FMRP - USP Profa Dra
exames laboratoriais em RHA DIAGNÓSTICO TRATAMENTO PROGNÓSTICO SEGUIMENTO RESULTADO
 Interpretação de exames laboratoriais em RHA Técnicas de Reprodução Assistida exames laboratoriais em RHA DIAGNÓSTICO TRATAMENTO PROGNÓSTICO SEGUIMENTO RESULTADO Esquema Prático de Avaliação do Casal Infértil
Interpretação de exames laboratoriais em RHA Técnicas de Reprodução Assistida exames laboratoriais em RHA DIAGNÓSTICO TRATAMENTO PROGNÓSTICO SEGUIMENTO RESULTADO Esquema Prático de Avaliação do Casal Infértil
Rede de Pesquisa do Ovário Artificial
 Rede de Pesquisa do Ovário Artificial Coordenador Instituição Executora Vigência Número de pesquisadores envolvidos Projetos associados a Rede/Coordenadores Importância da tecnologia do ovário artificial
Rede de Pesquisa do Ovário Artificial Coordenador Instituição Executora Vigência Número de pesquisadores envolvidos Projetos associados a Rede/Coordenadores Importância da tecnologia do ovário artificial
Aparelho Reprodutor Feminino
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho Reprodutor Feminino Prof. Msc. Macks Wendhell Gonçalves mackswenedhell@gmail.com É formado por: Parte interna: - Dois ovários
Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho Reprodutor Feminino Prof. Msc. Macks Wendhell Gonçalves mackswenedhell@gmail.com É formado por: Parte interna: - Dois ovários
Estado nutricional. Desordens metabólicas - jejum, desnutrição, baixa ingestão calórica proteica
 Estado nutricional Desordens metabólicas - jejum, desnutrição, baixa ingestão calórica proteica Balanço catabolismo / anabolismo aumentado Alto GH, baixo IGF e insulina lipólise ativada (mecanismo adaptativo
Estado nutricional Desordens metabólicas - jejum, desnutrição, baixa ingestão calórica proteica Balanço catabolismo / anabolismo aumentado Alto GH, baixo IGF e insulina lipólise ativada (mecanismo adaptativo
Fisiologia Endócrina
 Fisiologia Endócrina Profa. Letícia Lotufo Claude Bernard: pai da endocrinologia Definiu o termo milieu intérieur Endocrinologia estudo das secreções internas do organismos. 1 Sistema Endócrino e Homeostasia
Fisiologia Endócrina Profa. Letícia Lotufo Claude Bernard: pai da endocrinologia Definiu o termo milieu intérieur Endocrinologia estudo das secreções internas do organismos. 1 Sistema Endócrino e Homeostasia
Mecanismos de comunicação celular 26/05/2015
 Mecanismos de comunicação celular 26/05/2015 Alvos terapêuticos Hopkins & Groom (2002) Nature Reviews Drug Discovery 1:727 Elementos da comunicação celular LIGANTE RECEPTOR Há dois tipos de receptores
Mecanismos de comunicação celular 26/05/2015 Alvos terapêuticos Hopkins & Groom (2002) Nature Reviews Drug Discovery 1:727 Elementos da comunicação celular LIGANTE RECEPTOR Há dois tipos de receptores
Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente desenvolvimento folicular em fetos de ovelhas
 Universidade Federal de Pelotas Faculdade de Veterinária Núcleo de Pesquisa Ensino e Extensão em Pecuária Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente
Universidade Federal de Pelotas Faculdade de Veterinária Núcleo de Pesquisa Ensino e Extensão em Pecuária Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente
SISTEMA ENDÓCRINO. Prof.ª Leticia Pedroso
 SISTEMA ENDÓCRINO Prof.ª Leticia Pedroso Sistema Endócrino Existem no nosso organismo várias glândulas endócrinas (produzir e secretar hormônios para dentro do sangue). Hormônios: substâncias químicas
SISTEMA ENDÓCRINO Prof.ª Leticia Pedroso Sistema Endócrino Existem no nosso organismo várias glândulas endócrinas (produzir e secretar hormônios para dentro do sangue). Hormônios: substâncias químicas
Doenças Metabólicas. Interação Metabolismo x Reprodução. Bruna Mion
 Doenças Metabólicas Interação Metabolismo x Reprodução Bruna Mion Interação Metabolismo x Reprodução Reprodução Processos fisiológicos Produção de leite Processos imunes Mantença Interação Metabolismo
Doenças Metabólicas Interação Metabolismo x Reprodução Bruna Mion Interação Metabolismo x Reprodução Reprodução Processos fisiológicos Produção de leite Processos imunes Mantença Interação Metabolismo
CONCENTRAÇÃO DE ESTRÓGENO E PROGESTERONA NO FLUIDO FOLICULAR SUÍNO OBTIDO A PARTIR DE FOLÍCULOS OVARIANOS DE DIFERENTES DIÂMETROS
 CONCENTRAÇÃO DE ESTRÓGENO E PROGESTERONA NO FLUIDO FOLICULAR SUÍNO OBTIDO A PARTIR DE FOLÍCULOS OVARIANOS DE DIFERENTES DIÂMETROS Guilherme OBERLENDER 1 ; Aryenne K. OLIVEIRA 2 ; Luis D. S. MURGAS 2 ;
CONCENTRAÇÃO DE ESTRÓGENO E PROGESTERONA NO FLUIDO FOLICULAR SUÍNO OBTIDO A PARTIR DE FOLÍCULOS OVARIANOS DE DIFERENTES DIÂMETROS Guilherme OBERLENDER 1 ; Aryenne K. OLIVEIRA 2 ; Luis D. S. MURGAS 2 ;
Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini
 Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Do grego: Hormon = estimular Hormônios são substâncias químicas produzidas por um grupo de células
Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Do grego: Hormon = estimular Hormônios são substâncias químicas produzidas por um grupo de células
Inter-relações da nutrição, hormônios metabólicos e reinicio da ovulação em vacas de corte multíparas amamentando manejadas em pastagem subtropical
 Inter-relações da nutrição, hormônios metabólicos e reinicio da ovulação em vacas de corte multíparas amamentando manejadas em pastagem subtropical Apresentadores: Andressa Stein Maffi Tiago Garlet Pelotas,
Inter-relações da nutrição, hormônios metabólicos e reinicio da ovulação em vacas de corte multíparas amamentando manejadas em pastagem subtropical Apresentadores: Andressa Stein Maffi Tiago Garlet Pelotas,
BIOLOGIA CELULAR. Organelas celulares ORGANELAS CELULARES
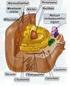 BIOLOGIA CELULAR ORGANELAS CELULARES Organelas celulares Núcleo; Retículo endoplasmático; Ribossomos; Complexo de Golgi; Endossomos; Lisossomos; Peroxissomos; Citoesqueleto; Mitocôndrias. 2 1 Retículo
BIOLOGIA CELULAR ORGANELAS CELULARES Organelas celulares Núcleo; Retículo endoplasmático; Ribossomos; Complexo de Golgi; Endossomos; Lisossomos; Peroxissomos; Citoesqueleto; Mitocôndrias. 2 1 Retículo
Sinalização Celular. Rafael Silva Rocha FMRP-USP, SP, Brazil
 Sinalização Celular Rafael Silva Rocha FMRP-USP, SP, Brazil silvarochar@gmail.com http://silvarochar.wixsite.com/ssbl 1 A célula e seu ambiente Temperatura Nutrientes Estresses Integridade própria Injurias
Sinalização Celular Rafael Silva Rocha FMRP-USP, SP, Brazil silvarochar@gmail.com http://silvarochar.wixsite.com/ssbl 1 A célula e seu ambiente Temperatura Nutrientes Estresses Integridade própria Injurias
Carla Bianchini Ponchirolli INFLUÊNCIA DOS FATORES DE CRESCIMENTO NO DESENVOLVIMENTO FOLICULAR
 Carla Bianchini Ponchirolli INFLUÊNCIA DOS FATORES DE CRESCIMENTO NO DESENVOLVIMENTO FOLICULAR Botucatu 2003 Universidade Estadual Paulista - UNESP Faculdade de Medicina Veterinária e Zootecnia Campus
Carla Bianchini Ponchirolli INFLUÊNCIA DOS FATORES DE CRESCIMENTO NO DESENVOLVIMENTO FOLICULAR Botucatu 2003 Universidade Estadual Paulista - UNESP Faculdade de Medicina Veterinária e Zootecnia Campus
UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL. Luciana da Paz dos Santos
 1 UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL Luciana da Paz dos Santos IMUNOLOCALIZAÇÃO DO FATOR DE CRESCIMENTO EPIDERMAL (EGF) EM OVÁRIOS OVINOS E SEU EFEITO
1 UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL Luciana da Paz dos Santos IMUNOLOCALIZAÇÃO DO FATOR DE CRESCIMENTO EPIDERMAL (EGF) EM OVÁRIOS OVINOS E SEU EFEITO
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS CLEIDSON MANOEL GOMES DA SILVA UTILIZAÇÃO DO HORMÔNIO
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS CLEIDSON MANOEL GOMES DA SILVA UTILIZAÇÃO DO HORMÔNIO
REGIANE GONÇALVES FEITOSA LEAL NUNES. ATIVIDADE BIOLÓGICA DE Lentinula edodes E PRODUÇÃO DE SHIITAKE EM SUBSTRATO ENRIQUECIDO COM SELÊNIO
 REGIANE GONÇALVES FEITOSA LEAL NUNES ATIVIDADE BIOLÓGICA DE Lentinula edodes E PRODUÇÃO DE SHIITAKE EM SUBSTRATO ENRIQUECIDO COM SELÊNIO Tese apresentada à Universidade Federal de Viçosa, como parte das
REGIANE GONÇALVES FEITOSA LEAL NUNES ATIVIDADE BIOLÓGICA DE Lentinula edodes E PRODUÇÃO DE SHIITAKE EM SUBSTRATO ENRIQUECIDO COM SELÊNIO Tese apresentada à Universidade Federal de Viçosa, como parte das
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS DOUTORADO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS DOUTORADO EM CIÊNCIAS VETERINÁRIAS HUDSON HENRIQUE VIEIRA CORREIA CULTIVO IN VITRO DE OÓCITOS
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS DOUTORADO EM CIÊNCIAS VETERINÁRIAS HUDSON HENRIQUE VIEIRA CORREIA CULTIVO IN VITRO DE OÓCITOS
Bases Moleculares da Obesidade e Diabetes. Hormônios e Diabetes
 Bases Moleculares da Obesidade e Diabetes Hormônios e Diabetes Prof. Carlos Castilho de Barros http://wp.ufpel.edu.br/obesidadediabetes/ SISTEMA ENDÓCRINO CONSISTE EM 1) Glândulas e células específicas,
Bases Moleculares da Obesidade e Diabetes Hormônios e Diabetes Prof. Carlos Castilho de Barros http://wp.ufpel.edu.br/obesidadediabetes/ SISTEMA ENDÓCRINO CONSISTE EM 1) Glândulas e células específicas,
NUPEEC. Núcleo de Pesquisa, Ensino e Extensão em Pecuária
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Perfis metabólicos na ovulação e anovulação de vacas leiteiras primíparas durante a primeira onda folicular pós-parto KAWASHIMA et al. APRESENTADORES:
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Perfis metabólicos na ovulação e anovulação de vacas leiteiras primíparas durante a primeira onda folicular pós-parto KAWASHIMA et al. APRESENTADORES:
HORMÔNIOS VEGETAIS. Katia Christina Zuffellato-Ribas
 HORMÔNIOS VEGETAIS Katia Christina Zuffellato-Ribas HORMÔNIO VEGETAL COMPOSTO ORGÂNICO, NÃO NUTRIENTE, DE OCORRÊNCIA NATURAL, PRODUZIDO NA PLANTA, O QUAL, EM BAIXAS CONCENTRAÇÕES (10-4 A 10-6 M), PROMOVE,
HORMÔNIOS VEGETAIS Katia Christina Zuffellato-Ribas HORMÔNIO VEGETAL COMPOSTO ORGÂNICO, NÃO NUTRIENTE, DE OCORRÊNCIA NATURAL, PRODUZIDO NA PLANTA, O QUAL, EM BAIXAS CONCENTRAÇÕES (10-4 A 10-6 M), PROMOVE,
Nutrigenômica x Nutrigenética - doenças relacionadas
 Nutrigenômica x Nutrigenética - doenças relacionadas Início Projeto Genoma Humano 20.000 genes (120.000 inicialmente estimados) Diversidade nucleotídica: 0,1 a 0,4% pares de base correspondente a aproximadamente
Nutrigenômica x Nutrigenética - doenças relacionadas Início Projeto Genoma Humano 20.000 genes (120.000 inicialmente estimados) Diversidade nucleotídica: 0,1 a 0,4% pares de base correspondente a aproximadamente
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS JULIÂN DA TRINDADE PONTES EFEITO DO CORTISOL SOBRE
1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS JULIÂN DA TRINDADE PONTES EFEITO DO CORTISOL SOBRE
Princípios. Gerais da Fisiologia Endócrina. Diego Veras Wilke
 Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Avaliação do padrão e número de sítios de fosforilação (EPIYA) da proteína CagA de H. pylori e risco de carcinoma gástrico e úlcera duodenal
 UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS CURSO DE PÓS-GRADUAÇÃO EM MICROBIOLOGIA Avaliação do padrão e número de sítios de fosforilação (EPIYA) da proteína CagA de H. pylori
UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS CURSO DE PÓS-GRADUAÇÃO EM MICROBIOLOGIA Avaliação do padrão e número de sítios de fosforilação (EPIYA) da proteína CagA de H. pylori
Determinação do sexo
 Determinação do sexo No reino animal sexo é um dos fenótipos mais visíveis John Wiley & Sons, Inc. Esse dimorfismo, as vezes é determinado por fatores ambientais John Wiley & Sons, Inc. Exemplo Em uma
Determinação do sexo No reino animal sexo é um dos fenótipos mais visíveis John Wiley & Sons, Inc. Esse dimorfismo, as vezes é determinado por fatores ambientais John Wiley & Sons, Inc. Exemplo Em uma
Estado de energia metabólica durante o período seco, que é. atividade ovariana pós-parto em vacas leiteiras
 UNIVERSIDADE FEDERAL DE PELOTAS Faculdade de Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária Estado de energia metabólica durante o período seco, que é crucial para a retomada da atividade
UNIVERSIDADE FEDERAL DE PELOTAS Faculdade de Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária Estado de energia metabólica durante o período seco, que é crucial para a retomada da atividade
Introdução. Graduanda do Curso de Medicina Veterinária FACISA/UNIVIÇOSA. hotmail.com. 2
 FUNÇÃO DO ESTRÓGENO NO TRATO REPRODUTIVO DO MASCULINO Amarine Loures Furtado 1, Giancarlo Magalhães dos Santos 2, João Gabriel Viana de Grázia 3, Carolina Marinho de Assunção 4 Resumo: Considerado um hormônio
FUNÇÃO DO ESTRÓGENO NO TRATO REPRODUTIVO DO MASCULINO Amarine Loures Furtado 1, Giancarlo Magalhães dos Santos 2, João Gabriel Viana de Grázia 3, Carolina Marinho de Assunção 4 Resumo: Considerado um hormônio
O sistema endócrino também é conhecido como sistema hormonal.
 Sistema endócrino O sistema endócrino também é conhecido como sistema hormonal. O que são hormônios? Hormônios são moléculas químicas que atuam como mensageiros bioquímicos, controlando as atividades de
Sistema endócrino O sistema endócrino também é conhecido como sistema hormonal. O que são hormônios? Hormônios são moléculas químicas que atuam como mensageiros bioquímicos, controlando as atividades de
Avanços, aplicações, limitações e perspectivas da tecnologia do ovário artificial de ruminantes
 Anais do IX Congresso Norte e Nordeste de Reprodução Animal (CONERA 2018); Belém, PA, 10 a 12 de setembro de 2018. Avanços, aplicações, limitações e perspectivas da tecnologia do ovário artificial de ruminantes
Anais do IX Congresso Norte e Nordeste de Reprodução Animal (CONERA 2018); Belém, PA, 10 a 12 de setembro de 2018. Avanços, aplicações, limitações e perspectivas da tecnologia do ovário artificial de ruminantes
Glândulas endócrinas:
 Sistema Endócrino Glândulas endócrinas: Funções: Secreções de substâncias (hormônios) que atuam sobre célula alvo Hormônios: Substâncias informacionais distribuídas pelo sangue. Eles modificam o funcionamento
Sistema Endócrino Glândulas endócrinas: Funções: Secreções de substâncias (hormônios) que atuam sobre célula alvo Hormônios: Substâncias informacionais distribuídas pelo sangue. Eles modificam o funcionamento
SINCRONIZE CICLO ESTRAL: Vaca Poliéstrica, ou seja, manifesta vários cios durante o ano, sendo interrompido pela gestação.
 SINCRONIZE CICLO ESTRAL: Vaca Poliéstrica, ou seja, manifesta vários cios durante o ano, sendo interrompido pela gestação. Estro caracteriza-se pela receptividade sexual da fêmea e é nesta fase que ocorre
SINCRONIZE CICLO ESTRAL: Vaca Poliéstrica, ou seja, manifesta vários cios durante o ano, sendo interrompido pela gestação. Estro caracteriza-se pela receptividade sexual da fêmea e é nesta fase que ocorre
UNIVERSIDADE FEDERAL DO PARANÁ
 UNIVERSIDADE FEDERAL DO PARANÁ CARLOS RENATO PFAU EFICÁCIA DO SULFETO DE SELÊNIO EM DIFERENTES CONCENTRAÇÕES SOBRE Malassezia pachydermatis EM CÃES: ESTUDO IN VITRO E IN VIVO. Dissertação apresentada ao
UNIVERSIDADE FEDERAL DO PARANÁ CARLOS RENATO PFAU EFICÁCIA DO SULFETO DE SELÊNIO EM DIFERENTES CONCENTRAÇÕES SOBRE Malassezia pachydermatis EM CÃES: ESTUDO IN VITRO E IN VIVO. Dissertação apresentada ao
Regulation of Fat Synthesis by Conjugated Linoleic Acid: Lactation and the Ruminant Model
 Regulation of Fat Synthesis by Conjugated Linoleic Acid: Lactation and the Ruminant Model Dale E. Bauman, James W. Perfield II, Kevin J. Harvatine, and Lance H. Baumgard Aluno: Gabriel de Assis Reis Pesquisa
Regulation of Fat Synthesis by Conjugated Linoleic Acid: Lactation and the Ruminant Model Dale E. Bauman, James W. Perfield II, Kevin J. Harvatine, and Lance H. Baumgard Aluno: Gabriel de Assis Reis Pesquisa
GUIA DE ESTUDOS INSULINA E GLUCAGON
 GUIA DE ESTUDOS INSULINA E GLUCAGON 1) O pâncreas é uma glândula mista, ou seja, possui função endócrina e exócrina. Na porção endócrina, o pâncreas produz dois hormônios: a insulina e o Esses hormônios
GUIA DE ESTUDOS INSULINA E GLUCAGON 1) O pâncreas é uma glândula mista, ou seja, possui função endócrina e exócrina. Na porção endócrina, o pâncreas produz dois hormônios: a insulina e o Esses hormônios
ARYÁDINA MARA RIBEIRO DE SOUZA
 ARYÁDINA MARA RIBEIRO DE SOUZA ATIVIDADE DAS BACTERIOCINAS BOVICINA HC5 E NISINA SOBRE O CRESCIMENTO E A RESISTÊNCIA TÉRMICA DE Alicyclobacillus acidoterrestris EM SUCOS DE FRUTAS Dissertação apresentada
ARYÁDINA MARA RIBEIRO DE SOUZA ATIVIDADE DAS BACTERIOCINAS BOVICINA HC5 E NISINA SOBRE O CRESCIMENTO E A RESISTÊNCIA TÉRMICA DE Alicyclobacillus acidoterrestris EM SUCOS DE FRUTAS Dissertação apresentada
O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50
 O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50 Sistema reprodutor feminino Ovários = produz óvulos Tubas uterinas = transportam e protegem os óvulos Útero = prove meio adequado
O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50 Sistema reprodutor feminino Ovários = produz óvulos Tubas uterinas = transportam e protegem os óvulos Útero = prove meio adequado
Avaliação do Índice Apoptótico em Adenomas Pleomórficos de Glândulas Salivares
 PONTIFÍCIA UNIVERSIDADE CATÓLICA DE MINAS GERAIS Faculdade de Odontologia Avaliação do Índice Apoptótico em Adenomas Pleomórficos de Glândulas Salivares Paulo César de Lacerda Dantas Belo Horizonte- MG
PONTIFÍCIA UNIVERSIDADE CATÓLICA DE MINAS GERAIS Faculdade de Odontologia Avaliação do Índice Apoptótico em Adenomas Pleomórficos de Glândulas Salivares Paulo César de Lacerda Dantas Belo Horizonte- MG
BIOTÉCNICAS REPRODUTIVAS E BEM-ESTAR ANIMAL
 70 BIOTÉCNICAS REPRODUTIVAS E BEM-ESTAR ANIMAL José Ricardo FIGUEIREDO 1 e Lúcia Daniel Machado da SILVA 2 Resumo - Considera-se inegável a contribuição que as biotécnicas reprodutivas têm dado ao desenvolvimento
70 BIOTÉCNICAS REPRODUTIVAS E BEM-ESTAR ANIMAL José Ricardo FIGUEIREDO 1 e Lúcia Daniel Machado da SILVA 2 Resumo - Considera-se inegável a contribuição que as biotécnicas reprodutivas têm dado ao desenvolvimento
5.COMUNICAÇÃO CELULAR
 DEPARTAMENTO DE CIÊNCIAS FISIOLÓGICAS-DFS CURSO DE ESPECIALIZAÇÃO EM FISIOLOGIA HUMANA 5.COMUNICAÇÃO CELULAR PROF. DRA. MARIA IDA B.R. SPEZIALI UNIVERSIDADE ESTADUAL DE MARINGÁ-UEM Comunicação célula-célula
DEPARTAMENTO DE CIÊNCIAS FISIOLÓGICAS-DFS CURSO DE ESPECIALIZAÇÃO EM FISIOLOGIA HUMANA 5.COMUNICAÇÃO CELULAR PROF. DRA. MARIA IDA B.R. SPEZIALI UNIVERSIDADE ESTADUAL DE MARINGÁ-UEM Comunicação célula-célula
Viviane Rohrig Rabassa Prof a. Assist., Doutoranda em Veterinária, UFPel. Marcio Nunes Corrêa Prof. Adjunto, FV-UFPel
 Universidade Federal de Pelotas Programa de Pós-graduação em Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária Viviane Rohrig Rabassa Prof a. Assist., Doutoranda em Veterinária, UFPel Marcio
Universidade Federal de Pelotas Programa de Pós-graduação em Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária Viviane Rohrig Rabassa Prof a. Assist., Doutoranda em Veterinária, UFPel Marcio
BLOQUEIO DE OÓCITOS DE BORREGAS EM VESÍCULA GERMINATIVA COM ROSCOVITINA
 BLOQUEIO DE OÓCITOS DE BORREGAS EM VESÍCULA GERMINATIVA COM ROSCOVITINA Raphael Colombo GASPAR* 1, Sony Dimas BICUDO 2, Fernanda da Cruz LANDIM- ALVARENGA 2 ; Letícia Ferrari CROCOMO 1, Sergio LEDDA 3.
BLOQUEIO DE OÓCITOS DE BORREGAS EM VESÍCULA GERMINATIVA COM ROSCOVITINA Raphael Colombo GASPAR* 1, Sony Dimas BICUDO 2, Fernanda da Cruz LANDIM- ALVARENGA 2 ; Letícia Ferrari CROCOMO 1, Sergio LEDDA 3.
benefícios oriundos de uma melhor compreensão do desenvolvimento folicular para a melhoria da eficiência reprodutiva dos caprinos também são
 1. INTRODUÇÃO Os caprinos são considerados animais economicamente atrativos por serem importantes fontes de carne, leite e pele. Além de estarem presentes em todos os continentes, no Brasil, eles desempenham
1. INTRODUÇÃO Os caprinos são considerados animais economicamente atrativos por serem importantes fontes de carne, leite e pele. Além de estarem presentes em todos os continentes, no Brasil, eles desempenham
Bloco X- Testes- Células germinativas
 Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
grandes lábios pequenos lábios clitóris Prepúcio do clitóris (clitoriano): Monte de Vênus: Óstio (meato) uretral externo: Vestíbulo da vagina:
 1 2 Delimitada e protegida por duas pregas cutâneo mucosas intensamente irrigadas e inervadas os grandes lábios recobertos por pêlos pubianos na mulher reprodutivamente madura. Mais internamente, outra
1 2 Delimitada e protegida por duas pregas cutâneo mucosas intensamente irrigadas e inervadas os grandes lábios recobertos por pêlos pubianos na mulher reprodutivamente madura. Mais internamente, outra
HORMÔNIOS ESTERÓIDES
 UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA HORMÔNIOS ESTERÓIDES Prof a. Dr a. Nereide Magalhães Recife, fevereiro de 2005 HORMÔNIOS ESTERÓIDES Hormônios
UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA HORMÔNIOS ESTERÓIDES Prof a. Dr a. Nereide Magalhães Recife, fevereiro de 2005 HORMÔNIOS ESTERÓIDES Hormônios
REGULAÇÃO HORMONAL DO METABOLISMO PROTEÍCO
 REGULAÇÃO HORMONAL DO METABOLISMO PROTEÍCO Giovanni Resende de Oliveira giovanni@epamig.br Fonte: ROCHA,C e OLIVEIRA, R.S INTRODUÇÃO Crescimento do Animal Crescimento dos Tecidos Grau de hiperplasia e
REGULAÇÃO HORMONAL DO METABOLISMO PROTEÍCO Giovanni Resende de Oliveira giovanni@epamig.br Fonte: ROCHA,C e OLIVEIRA, R.S INTRODUÇÃO Crescimento do Animal Crescimento dos Tecidos Grau de hiperplasia e
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 i UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS FRANCIELE OSMARINI LUNARDI VITRIFICAÇÃO E CULTIVO IN
i UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS FRANCIELE OSMARINI LUNARDI VITRIFICAÇÃO E CULTIVO IN
BIOSSÍNTESE DOS HORMÔNIOS (Protéicos) Estoque citoplasmático - secreção
 BIOSSÍNTESE DOS HORMÔNIOS (Protéicos) Estoque citoplasmático - secreção Exemplo HORMÔNIOS ESTEROIDES Sexuais e do tecido interrenal Outros tecidos Os esteroides estão envolvidos na regulação de vários
BIOSSÍNTESE DOS HORMÔNIOS (Protéicos) Estoque citoplasmático - secreção Exemplo HORMÔNIOS ESTEROIDES Sexuais e do tecido interrenal Outros tecidos Os esteroides estão envolvidos na regulação de vários
Painel temático. Pelotas, 28 de setembro de 2017
 Painel temático Pelotas, 28 de setembro de 2017 Universidade Federal de Pelotas Faculdade De Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária www.ufpel.edu.br/nupeec Painel temático Efeitos
Painel temático Pelotas, 28 de setembro de 2017 Universidade Federal de Pelotas Faculdade De Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária www.ufpel.edu.br/nupeec Painel temático Efeitos
BIOLOGIA. Identidade dos Seres Vivos. Sistema Endócrino Humano Parte 2. Prof.ª Daniele Duó
 BIOLOGIA Identidade dos Seres Vivos Parte 2 https://www.qconcursos.com Prof.ª Daniele Duó Principais órgãos que constituem o sistema endócrino são: o o o o o o o Hipófise; Hipotálamo; Tireóide; Paratireóide;
BIOLOGIA Identidade dos Seres Vivos Parte 2 https://www.qconcursos.com Prof.ª Daniele Duó Principais órgãos que constituem o sistema endócrino são: o o o o o o o Hipófise; Hipotálamo; Tireóide; Paratireóide;
A célula e seus Constituintes Moleculares
 Universidade Federal de Pelotas CDTec - Graduação em Biotecnologia Disciplina de Biologia Molecular A célula e seus Constituintes Moleculares Priscila M. M. de Leon Dra., Médica Veterinária Profa, PNDP
Universidade Federal de Pelotas CDTec - Graduação em Biotecnologia Disciplina de Biologia Molecular A célula e seus Constituintes Moleculares Priscila M. M. de Leon Dra., Médica Veterinária Profa, PNDP
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Associação entre polimorfismos de genes do eixo somatotrópico e fertilidade de vacas da raça Holandês Adriane Dalla Costa
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Associação entre polimorfismos de genes do eixo somatotrópico e fertilidade de vacas da raça Holandês Adriane Dalla Costa
Glândulas endócrinas:
 SISTEMA ENDÓCRINO Glândulas endócrinas: Funções: Secreções de substâncias (hormônios) que atuam sobre célula alvo Regulação do organismo (homeostase) Hormônios: Substâncias químicas que são produzidas
SISTEMA ENDÓCRINO Glândulas endócrinas: Funções: Secreções de substâncias (hormônios) que atuam sobre célula alvo Regulação do organismo (homeostase) Hormônios: Substâncias químicas que são produzidas
Resposta Imunológica humoral. Alessandra Barone
 Resposta Imunológica humoral Alessandra Barone Estimulada por antígenos extracelulares Mediada por anticorpos produzidos por plasmócitos. Linfócito B Resposta T independente: Estimulada diretamente por
Resposta Imunológica humoral Alessandra Barone Estimulada por antígenos extracelulares Mediada por anticorpos produzidos por plasmócitos. Linfócito B Resposta T independente: Estimulada diretamente por
