METAIS NO ORGANISMO HUMANO METAIS AMBIENTE E VIDA
|
|
|
- Mariana Sampaio Desconhecida
- 7 Há anos
- Visualizações:
Transcrição
1 METAIS NO ORGANISMO HUMANO METAIS AMBIENTE E VIDA
2 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel. arsénico, chumbo, cádmio, mercúrio, alumínio, titânio, estanho e o tungsténio. 2
3 Metais Essenciais Definir um metal como essencial para a saúde humana significa verificar até que ponto a sua ausência na dieta produz anomalias funcionais ou estruturais Regulação Homeostática 3
4 Metais Essenciais Participam em mecanismos metabólicos que estão relacionados com trocas iónicas associadas à transmissão de sinais eléctricos nos músculos e nervos. 4
5 Metais Essenciais 5
6 Metais Essenciais 3. Metais Ambiente e Vida 6
7 Metais tóxicos O termo Metais Tóxicos é uma alternativa ao termo metais pesados, sendo recomendada a sua aplicação aos elementos não essenciais Elementos que não são necessários aos organismos vivos A manifestação dos efeitos tóxicos está associada à dose. Podem afectar vários órgãos, alterando processos bioquímicos e membranas celulares São venenos acumulativos para todos os seres vivos aumentando a sua concentração de nível para nível da cadeia alimentar - BIOMAGNIFICAÇÃO 7
8 Metais tóxicos 8
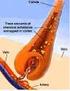
9 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue A hemoglobina é formada por 4 subunidades de globina Cada subunidade de globina tem unido um grupo hemo (uma molécula de protoporfirina IX complexada com um ião Fe2+), responsável da cor vermelha da hemoglobina e do sangue. 9
10 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue O grupo heme é um complexo octaédrico de ferro, em que este se encontra coordenado por um ião di-negativo de porfirina tetradentado e tem número de oxidação +2. Os quatro átomos dadores de azoto da porfirina envolvem o ferro no mesmo plano. 10
11 Vamos fazer um parênteses O QUE SÃO IÕES COMPLEXOS? 11
12 Metais, Complexos e Cor Uma das características dos metais de transição é formar compostos de cores muito variadas: os Compostos de Coordenação que contém iões complexos. Importa perceber: O que são; Qual a sua nomenclatura; Qual a sua geometria. 12
13 Iões Complexos Existem sais que ao serem dissolvidos em água sofrem solvatação originando o catião metálico e o anião não metálico Ligação entre estes iões é explicada pelo modelo da ligação iónica 13
14 Iões Complexos 3. Metais Ambiente e Vida Metais como os de transição que podem comportar-se como ácidos de Lewis (aceitam pares electrónicos) podem ligar-se a outras espécies partilhando esses pares 14
15 Iões Complexos 15
16 Iões Complexos 3. Metais Ambiente e Vida 16
17 Compostos de Coordenação 17
18 Classificação dos Ligandos 18
19 Classificação dos Ligandos 19
20 Iões Complexos (Quelatos) 3. Metais Ambiente e Vida 20
21 Número de Coordenação e Geometria 21
22 Estabilidade dos Complexos 22
23 24
24 A Cor nos Complexos Porquê uma solução apresenta cor? 25
25 A Cor nos Complexos 26
26 A Cor nos Complexos Porquê os complexos apresentam cor? [Ar] 3d 1 27
27 A Cor nos Complexos Espectro de Absorção do ião [Ti(H 2 O) 6 ] 3+ 28
28 A Cor nos Complexos 3. Metais Ambiente e Vida A separação das orbitais d não se dá da mesma maneira em todos os iões complexos: depende da sua geometria 29
29 A Cor nos Complexos (Estado oxidação metal) 30
30 A Cor nos Complexos Relação entre a intensidade de radiação absorvida por uma solução corada e a sua concentração Lei de Lambert Beer 31
31 A Cor nos Complexos Quanto maior for a fracção de um determinado comprimento de onda que é absorvido, menor será a percentagem de luz transmitida, sendo essa percentagem medida pela grandeza transmitância (T) 32
32 Esquema funcionamento Espectrofotómetro 3. Metais Ambiente e Vida O perfil da curva de absorvância é característica de cada complexo A relação entre a intensidade da absorvância e a concentração a cada c.d.o. É dada pela Lei de Lambert-Beer A = ε l c 33
33 AL A Cor e a composição quantitativa de soluções Água Consumo Humano Um dos parâmetros usados para a caracterizar é o teor total de ferro soma Fe 2+ e Fe 3+ A legislação relativa às águas destinadas a consumo humano determina que o teor em ferro total não exceda os 200 µg /dm 3 34
34 AL A Cor e a composição quantitativa de soluções Como se pode determinar a concentração de uma solução corada pela intensidade da sua cor? A relação entre a intensidade da cor de uma solução e a respectiva concentração é dada por A = ε l C 35
35 AL A Cor e a composição quantitativa de soluções Constrói-se um gráfico da absorvância em função da concentração a partir de um conjunto de soluções-padrão de diferentes concentrações na espécie em estudo. 0 gráfico resultante é uma recta que passa na origem dos eixos (à qual se chama recta ou curva de calibração). 36
36 AL A Cor e a composição quantitativa de soluções A Lei de Beer-Lambert só pode ser aplicada cara soluções diluídas, em geral para concentrações inferiores a 0,01 mol dm -3. Estes desvios estão associados a interacções entre as espécies absorventes ou a limitações técnicas do equipamento usado. 37
37 Como se pode determinar teores reduzidos de ferro numa água? Por espectrofotometria usando radiação de c.d.o. 320 nm à qual corresponde o máximo de absorção para soluções aquosas com Fe 2+. Método mais rigoroso e sensível ( teores da ordem 0.05 a 0.2 mg /dm 3 ) envolve a combinação de Fe 2+ com fenantrolina para formar um complexo alaranjado. 38
38 1,10 fenantrolina monohidratada 39
39 Como se pode determinar teores reduzidos de ferro numa água? A concentração do complexo é determinada por espetrofotometria. A intensidade da cor é independente da acidez do meio no intervalo de ph de 2 a 9. O ph é mantido entre 2.5 e 4.5 para garantir que todo o ferro é reduzido a Fe 2+. Constrói-se uma recta de calibração com soluções de concentração conhecida. Utilizam-se várias diluições da amostra em estudo para seleccionar uma coloração comparável à das soluções da recta calibração. 40
40 Como se pode determinar teores reduzidos de ferro numa água? Selecciona-se o melhor c.d.o. Para traçar a curva de calibração No caso do Fe e fenantrolina temos o figura ao lado 41
41 Como se pode determinar teores reduzidos de ferro numa água? Soluções preparadas em balões volumétricos de 50 ml (Redutor) Fe(NH 4 ) 2 (SO 4 ) 2.6H 2 O 42
42 Como se pode determinar teores reduzidos de ferro numa água? 1. Regula-se o espectrofetómetro para c.d.o. Seleccionado. 2. Mede-se as Absorvâncias para as soluções de B a F. Ajustase em cada medição a absorvância zero usando a solução A como branco. 3. Das soluções X, Y e Z selecciona-se aquela cuja tonalidade está incluída nas soluções que compõem a recta. 4. Regista-se a absorvância dessa solução. 43
43 Solução Conc. mg/l Absorvância A 0 0 B 0,02 0,008 C 0,04 0,01 D 0,1 0,023 E 0,2 0,034 F 0,3 0,066 G 0,4 0,079 x= 0,072 / 0,2022 x= 0, Amostra x 0,072 x = 0, mg/l Recta Calibração 0,09 0,08 y = 0,2022x R 2 = 0,9818 Absorvância 0,07 0,06 0,05 0,04 0,03 0,02 0, ,06 0,12 0,18 0,24 0,3 0,36 0,42 Concentração (mg/l) Absorvância Linear (Absorvância) 44
44 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue Para além da porfirina, o ferro é também coordenado por um átomo de azoto da cadeia proteica de outro segmento da hemoglobina, sendo estas ligações nos quatro grupos heme que mantêm os quatro segmentos proteicos unidos. A geometria global do complexo em torno do átomo de ferro é octaédrica, sendo o vértice oposto ao ocupado por este átomo dador de azoto o local onde se vai coordenar o oxigénio e onde se dão as trocas gasosas que ocorrem em função da respiração celular. 45
45 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue Como existem quatro grupos heme, cada hemoglobina pode transportar quatro moléculas de oxigénio. A ligação ao oxigénio é cooperativa, o que significa que a ligação num grupo hemo aumenta a tendência para a ligação no segundo, a do segundo aumenta a tendência da ligação no terceiro e a do terceiro aumenta a tendência da ligação no quarto. Reacção de trocas gasosas nas células A estabilidade do complexo oxigenado aumenta com a basicidade do meio Efeito de Bohr 46
46 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue A estabilidade do complexo oxigenado aumenta com a basicidade do meio Efeito de Bohr A libertação de oxigénio nos tecidos é facilitada pelo pequeno abaixamento do ph resultante da presença do CO 2 formado na respiração celular. Este efeito vai aumentar a tendência para a evolução no sentido directo da reacção 47
47 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue A hemoglobina destaca-se pela sua capacidade para formar um complexo muito estável com o monóxido de carbono por troca com o oxigénio. Kc= 200 Significa na prática que se o monóxido de carbono estiver presente numa quantidade significativa, vai complexar mais fortemente a hemoglobina e ainda que, após ligar-se a ela, a capacidade desta para transportar o oxigénio se encontra praticamente perdida. 48
48 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue O caso do CO 2 indispensável: efeito tampão Ka 10-7 H 2 CO 3 (aq) + H 2 O (l) H 3 O + (aq) + HCO 3- (aq) 49
49 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue O caso do CO 2 indispensável: efeito tampão H 2 CO 3 (aq) + H 2 O (l) H 3 O + (aq) + HCO 3- (aq) SOLUÇÃO TAMPÃO 50
50 Metais no Organismo Humano A hemoglobina e o transporte de gases no sangue O caso do CO 2 indispensável: efeito tampão SOLUÇÃO TAMPÃO 51
51 Metais no Organismo Humano Vamos fazer um parênteses SOLUÇÃO TAMPÃO Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? 52
52 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? RELEMBRAR 53
53 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? RELEMBRAR 54
54 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? RELEMBRAR 55
55 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? Grau de ionização vs Força de Ácidos e Bases Soluções aquosas 0.1 mol/dm 3 (25ºC) 56
56 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? Grau de ionização vs Força de Ácidos e Bases 1. Se tivermos soluções diluídas de dois ácidos fracos de concentrações diferentes, mesmo sabendo qual é o mais fraco, não se poderá afirmar directamente qual é a solução que terá maior grau de ionização. 2. O grau de ionização não é constante, é necessária uma grandeza, independente da concentração do ácido, que permita caracterizar a solução em equilíbrio a determinada temperatura: as constantes de ionização (de hidrólise no caso de compostos iónicos) Ka e Kb. 57
57 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? Grau de ionização vs Força de Ácidos e Bases HA (aq) H + (aq) + A - (aq) 58
58 Exercício 3. Metais Ambiente e Vida 59
59 Exercício 3. Metais Ambiente e Vida 60
60 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? Propriedades ácidas ou básicas das soluções de Sais Os sais são compostos iónicos, que se podem obter, por exemplo, como produto da reacção entre um ácido e um hidróxido; as respectivas soluções aquosas nem sempre são neutras (em termos de ph). A dissociação iónica de um sal origina catiões e aniões. 61
61 Como se comportam os ácidos, as bases e os sais quando se dissolvem em água? Propriedades ácidas ou básicas das soluções de Sais Os catiões de metais alcalinos e alcalino-terrosos (grupos 1 e 2 da TP) não têm tendência para reagir com a água e, por isso, não afectam o ph das respectivas soluções aquosas. Os aniões, bases conjugadas de ácidos muito fortes, como, por exemplo, os iões CI -, Br -, NO 3-, são praticamente neutros. Isto significa que soluções de cloreto de sódio, de nitrato de cálcio ou de brometo de potássio são neutras, ou seja, têm ph = 7, a 25 C. 62
62 Propriedades ácidas ou básicas das soluções de Sais A - Sal de um ácido fraco e de base forte NaNO 2 A Solução aquosa fica alcalina 63
63 Propriedades ácidas ou básicas das soluções de Sais B - Sal de base fraca e ácido forte NH 4 Cl A Solução aquosa fica ácida 64
64 Propriedades ácidas ou básicas das soluções de Sais C - Sal de ácido e base fracos NH 4 NO 2 65
65 Propriedades ácidas ou básicas das soluções de Sais D - Sal de metal transição e anião neutro São na maior parte dos casos ácidos fracos. A acidez deve-se ao facto do os catiões se encontrarem hidratados. (ligandos são moléculas de água). Cu 2+ (aq) [Cu(H 2 O) 4 ] 2+ (aq) Fe 3+ (aq) [Fe(H 2 O) 6 ] 3+ (aq) 66
66 Propriedades ácidas ou básicas das soluções de Sais D - Sal de metal transição e anião neutro Catião (base Lewis) atrai e partilha electrões com uma ou mais moléculas de água. Enfraquecimento da ligação O-H Libertação de H + e formação de H 3 O + 67
67 Propriedades ácidas ou básicas das soluções de Sais D - Sal de metal transição e anião neutro A concentração de H 3 O + aumenta solução fica ácida 68
68 Propriedades ácidas ou básicas das soluções de Sais D - Sal de metal transição e anião neutro 69
69 Propriedades ácidas ou básicas das soluções de Sais Solução Tampão 70
70 Propriedades ácidas ou básicas das soluções de Sais CH 3 COOH (l) + H 2 O (l) CH 3 COO - (aq) + H 3 O + (aq) (1M) CH 3 COONa (s) CH 3 COO - (aq) + Na + (aq) (1M) 71
71 Propriedades ácidas ou básicas das soluções de Sais CH 3 COOH (l) + H 2 O (l) CH 3 COO - (aq) + H 3 O + (aq) (1M) 2H 2 O (l) H 3 O + (aq) + OH - (aq) 72
72 Propriedades ácidas ou básicas das soluções de Sais Soluções-tampão em que existe um par conjugado ácido fraco-base conjugada, uma diluição não altera o ph da solução, pois afecta de igual modo a concentração do ácido e da base conjugada; No caso de ácido forte ou de base forte, uma diluição altera de forma significativa o ph. 73
73 Propriedades ácidas ou básicas das soluções de Sais (2) NH 4 Cl (s) NH 4+ (aq) + Cl - (aq) (1M) NH 3 (aq) + H 2 O (l) NH 4+ (aq) + HO - (aq) 2H 2 O (l) H 3 O + (aq) + OH - (aq) (1M) 74
74 Propriedades ácidas ou básicas das soluções de Sais Um ácido forte como o ácido clorídrico actua como solução-tampão em situações de ph baixo. O que acontece de adicionar 1ml HNO 3 1mol/dm 3? ph =
75 Propriedades ácidas ou básicas das soluções de Sais O que acontece de adicionar 1ml NaOH 1mol/dm 3? ph =
76 EXERCÍCIO 3. Metais Ambiente e Vida 77
77 EXERCÍCIO 3. Metais Ambiente e Vida 1.1 ph = ph = ph = ph = No gráfico podem referenciar-se duas zonas em que o titulado evidencia propriedades tampão, ou seja, uma ligeira variação do ph do titulado por adição da base forte: - do inicio até à adição de cerca de 30 ml de solução ácida; - após o ponto de equivalência, entre 50 ml e 80 ml de titulante adicionado 78
78 Como se poderá escolher a melhor solução tampão? A "melhor" solução será aquela que apresenta variações de ph pouco significativas por adição de maiores quantidades de ácido ou de base fortes. Esta propriedade é designada por capacidade-tampão. De que depende a capacidade de um tampão? Esta capacidade é tanto maior quanto maiores e mais próximas forem as concentrações do ácido e da base conjugada. 79
79 Quando é que esta capacidade é destuída? Quando se adiciona uma grande quantidade de ácido forte, a qual consome toda a base, de tal modo que não há possibilidade de neutralizar mais ácido. Quando se adiciona uma grande quantidade de base forte, a qual consome todo o ácido, de tal modo que não há possibilidade de neutralizar mais base. Como explicar que o ph do sangue se mantém entre valores muito próximos? 80
80 H 2 CO 3 (aq) + H 2 O (l) H 3 O + (aq) + HCO 3- (aq) 81
81 Titulações Ácido - Base Titulação ácido forte base forte 15 ml HCl 0.10M e NaOH 0.10 M No Ponto Equivalência n(h 3 O + ) = n(oh - ) ph = 7 82
82 Titulações Ácido - Base Titulação ácido forte base forte 15 ml HCl 0.10M e NaOH 0.10 M Inicio da titulação 83
83 Titulações Ácido - Base Titulação ácido forte base forte 15 ml HCl 0.10M e NaOH 0.10 M Antes do PE Ponto de equivalência n (H 3 O + )= n(oh - ) n (HCl) = n (NaOH) 84
84 Titulações Ácido - Base Titulação ácido forte base forte 15 ml HCl 0.10M e NaOH 0.10 M Depois do PE 85
85 Titulações Ácido - Base Zona viragem fenolftaleina Zona viragem azul bromotimol Zona viragem vermelho metilo Zona viragem vermelho metilo 1 86
86 Titulações Ácido - Base Titulação ácido fraco base forte No Ponto Equivalência n(h 3 O + ) = n (OH - ) Na + CH 3 COO - + H 2 O (l) CH 3 COOH (aq) + OH - (aq) ph Ponto Equivalência Básico 87
87 Titulações Ácido - Base Titulação ácido fraco base forte Três zonas importantes na curva: 1. Antes do início da titulação - O ph antes da adição de ácido é definido a partir do Ka do ácido fraco e da sua concentração. Zona viragem fenolftaleina 2. O ph do ponto de equivalência - A solução é apenas constituída pelo sal do par conjugado do ácido, pois este foi todo neutralizado pela base forte. O ph é definido pelo equilíbrio ácido-base da solução de ião acetato, nas condições de concentração do ponto de equivalência. 3. O ph na região tampão - Em qualquer ponto entre o início e o ponto de equivalência a solução tem ácido acético e ião acetato em proporções que não são as de uma solução da substância pura. 88
88 Titulações Ácido - Base Titulação base fraca ácido forte No Ponto Equivalência n(h 3 O + ) = n (OH - ) Cl - NH H 2 O (l) NH 3 (aq) + H 3 O + (aq) ph Ponto Equivalência Ácido 89
89 Titulações Ácido - Base Três zonas importantes na curva: 1. Antes do início da titulação - O ph antes da adição de ácido é definido a partir do Kb da base e da sua concentração. 2. O ph do ponto de equivalência - O único contributo para o ph da solução é do sal do par conjugado da base, tendo a base fraca sido totalmente neutralizada pelo ácido forte. O ph é definido pelo equilíbrio ácidobase da solução do par conjugado da base fraca (neste caso, o NH 4+ ), nas condições de concentração do ponto de equivalência. 3. O ph na região tampão nesta região as concentrações da base e do seu ácido conjugado são iguais ou muito próximas. 90
Metais no Organismo Humano
 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
3. Metais Ambiente e Vida. A Cor nos Complexos Dulce Campos
 A Cor nos Complexos 1 A Cor nos Complexos Porquê uma solução apresenta cor? 2 A Cor nos Complexos 3 A Cor nos Complexos Porquê os complexos apresentam cor? [Ar] 3d 1 4 A Cor nos Complexos Espectro de Absorção
A Cor nos Complexos 1 A Cor nos Complexos Porquê uma solução apresenta cor? 2 A Cor nos Complexos 3 A Cor nos Complexos Porquê os complexos apresentam cor? [Ar] 3d 1 4 A Cor nos Complexos Espectro de Absorção
Ácidos e Bases. O ph de soluções de sais
 Ácidos e Bases O ph de soluções de sais ph de soluções de sais Se medirmos o ph de uma solução de sal, em geral não encontramos o valor "neutro" do ph = 7 Se neutralizamos ácido acético 0,3 mol/dm 3 com
Ácidos e Bases O ph de soluções de sais ph de soluções de sais Se medirmos o ph de uma solução de sal, em geral não encontramos o valor "neutro" do ph = 7 Se neutralizamos ácido acético 0,3 mol/dm 3 com
Ácidos e Bases. Capítulo 15
 Capítulo 15 Ácidos e Bases Ácidos e Bases de Brønsted Propriedades Ácido-Base da Água ph Uma Medida de Acidez Força de Ácidos e de Bases Ácidos Fracos e Constantes de Ionização Ácida Bases Fracas e Constantes
Capítulo 15 Ácidos e Bases Ácidos e Bases de Brønsted Propriedades Ácido-Base da Água ph Uma Medida de Acidez Força de Ácidos e de Bases Ácidos Fracos e Constantes de Ionização Ácida Bases Fracas e Constantes
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Gabaritos Resolvidos Energia Química Semiextensivo V4 Frente C
 01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
Os sais são neutros, ácidos ou básicos? Íons como Ácidos e Bases
 Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
ROTEIRO PRÁTICO DE QUÍMICA GERAL
 ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Calcule o ph de uma solução de HCl 1x10-7 mol L-1
 Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
O que é uma solução-tampão
 Soluções Tampão O que é uma solução-tampão Soluções-tampão são soluções que não apresentam variação significativa de ph por adição de pequenas quantidades de ácido ou de base fortes. Dulce Campos 27-11-2011
Soluções Tampão O que é uma solução-tampão Soluções-tampão são soluções que não apresentam variação significativa de ph por adição de pequenas quantidades de ácido ou de base fortes. Dulce Campos 27-11-2011
Volumetria de Neutralização
 Volumetria de Neutralização H 3 O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva Princípio Envolve titulações de espécies ácidas com soluções padrão alcalinas e titulações de espécies
Volumetria de Neutralização H 3 O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva Princípio Envolve titulações de espécies ácidas com soluções padrão alcalinas e titulações de espécies
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril Versão 1 11.º Ano Turmas A e B
 ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril. 2016 Versão 1 11.º Ano Turmas A e B Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina na palavra FIM Nome:
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril. 2016 Versão 1 11.º Ano Turmas A e B Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina na palavra FIM Nome:
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Química C Semiextensivo V. 4
 Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE
 TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
Constantes de acidez e basicidade
 Constantes de acidez e basicidade Quando se dissolve ácido nítrico, HNO 3, em água, o ácido ioniza-se de acordo com a equação: HNO 3 (aq) + H 2 O (l) NO 3 (aq) + H 3 O + (aq) A extensão desta reação relaciona-se
Constantes de acidez e basicidade Quando se dissolve ácido nítrico, HNO 3, em água, o ácido ioniza-se de acordo com a equação: HNO 3 (aq) + H 2 O (l) NO 3 (aq) + H 3 O + (aq) A extensão desta reação relaciona-se
Equilíbrio Ácido-Base. Ácidos e Bases Fracos
 Equilíbrio Ácido-Base Ácidos e Bases Fracos ph de soluções CH 3 COOH (aq) 0,10 mol/dm 3 HCl (aq) 0,10 mol/dm 3 ph? ph= 2,9 ph= 1 [H 3 O + ] < [H 3 O + ] PORQUÊ? 2 ph de soluções Segundo Arrhenius o ácido
Equilíbrio Ácido-Base Ácidos e Bases Fracos ph de soluções CH 3 COOH (aq) 0,10 mol/dm 3 HCl (aq) 0,10 mol/dm 3 ph? ph= 2,9 ph= 1 [H 3 O + ] < [H 3 O + ] PORQUÊ? 2 ph de soluções Segundo Arrhenius o ácido
ÁCIDOS E BASES de LEWIS. ÁCIDO - espécie química que pode. ou coordenada, aceitando um par de. BASE - espécie química que pode
 METAIS,, COMPLEXOS E COR 1 Fonte: www.yteach.co.uk/ Química 12. ano Marília Peres e Rosa Pais ÁCIDOS E BASES de LEWIS ÁCIDO - espécie química que pode estabelecer uma ligação covalente dativa ou coordenada,
METAIS,, COMPLEXOS E COR 1 Fonte: www.yteach.co.uk/ Química 12. ano Marília Peres e Rosa Pais ÁCIDOS E BASES de LEWIS ÁCIDO - espécie química que pode estabelecer uma ligação covalente dativa ou coordenada,
Fundamentos de Química Q101 Aulas Téorico-Práticas Ano letivo 2011/12 Licenciaturas em Química e Bioquímica
 DEPARTAMENTO DE QUÍMICA E BIOQUÍMICA Fundamentos de Química Q101 Aulas Téorico-Práticas Ano letivo 2011/12 Licenciaturas em Química e Bioquímica Equilíbrio ácido-base (10.32) Calcule o ph e o poh de cada
DEPARTAMENTO DE QUÍMICA E BIOQUÍMICA Fundamentos de Química Q101 Aulas Téorico-Práticas Ano letivo 2011/12 Licenciaturas em Química e Bioquímica Equilíbrio ácido-base (10.32) Calcule o ph e o poh de cada
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em , Prof. Mauricio
 Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Agrupamento de Escolas da Senhora da Hora
 Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Gestão de Equipamentos Informáticos Informação Prova da Disciplina de Física e Química - Módulo: 10 Equilíbrio de ácido-base.
Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Gestão de Equipamentos Informáticos Informação Prova da Disciplina de Física e Química - Módulo: 10 Equilíbrio de ácido-base.
ESTUDO DA ESTABILIDADE E PROPRIEDADES DE COMPOSTOS DE COORDENAÇÃO
 versão Fev 2007 TRABALHO 2 ESTUDO DA ESTABILIDADE E PROPRIEDADES DE COMPOSTOS DE COORDENAÇÃO 1. OBJECTIVOS 1) Determinação da estequiometria e do coeficiente de extinção molar do complexo [Ni- EDTA] 2-
versão Fev 2007 TRABALHO 2 ESTUDO DA ESTABILIDADE E PROPRIEDADES DE COMPOSTOS DE COORDENAÇÃO 1. OBJECTIVOS 1) Determinação da estequiometria e do coeficiente de extinção molar do complexo [Ni- EDTA] 2-
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell
 LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
1- Reação de auto-ionização da água
 Equilíbrio Iônico 1- Reação de auto-ionização da água A auto- ionização da água pura produz concentração muito baixa de íons H 3 O + ou H + e OH -. H 2 O H + (aq) + OH - (aq) (I) ou H 2 O + H 2 O H 3 O
Equilíbrio Iônico 1- Reação de auto-ionização da água A auto- ionização da água pura produz concentração muito baixa de íons H 3 O + ou H + e OH -. H 2 O H + (aq) + OH - (aq) (I) ou H 2 O + H 2 O H 3 O
Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA. Departamento de Engenharia Química e do Ambiente. QUÍMICA I (1º Ano/1º Semestre)
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
Curva de titulação efeito da concentração
 Exercício 1) Considere a titulação de 100 ml de solução HCl 0,0100 mol L -1 com solução padrão de NaOH 0,0500 mol L -1. Calcule o ph da solução do titulado após a adição das seguintes quantidades de titulante:
Exercício 1) Considere a titulação de 100 ml de solução HCl 0,0100 mol L -1 com solução padrão de NaOH 0,0500 mol L -1. Calcule o ph da solução do titulado após a adição das seguintes quantidades de titulante:
EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS
 EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS Eletrólitos Fortes Fracos Ionizam/Dissociam completamente Ionizam/Dissociam parcialmente Ex: HCl, NaNO 3 Ex: HF, BaSO 4 EQUILÍBRIOS ÁCIDO-BASE
EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS Eletrólitos Fortes Fracos Ionizam/Dissociam completamente Ionizam/Dissociam parcialmente Ex: HCl, NaNO 3 Ex: HF, BaSO 4 EQUILÍBRIOS ÁCIDO-BASE
1. O amoníaco é uma base, segundo a teoria de Brönsted-Lowry, sendo a sua reação de ionização em água traduzida pela seguinte equação:
 ESCOLA SECUNDÁRIA DE CASQUILHOS FQA FICHA DE EXERCÍCIOS DE EXAME UNIDADE 2 - QUÍMICA 10.março. 2016 11.º Ano Turma B Professor: Duração da prova: 90 minutos. NOME: Nº 1 1. O amoníaco é uma base, segundo
ESCOLA SECUNDÁRIA DE CASQUILHOS FQA FICHA DE EXERCÍCIOS DE EXAME UNIDADE 2 - QUÍMICA 10.março. 2016 11.º Ano Turma B Professor: Duração da prova: 90 minutos. NOME: Nº 1 1. O amoníaco é uma base, segundo
8ª Ficha de Avaliação de Conhecimentos Turma: 11ºA. Física e Química A - 11ºAno
 8ª Ficha de Avaliação de Conhecimentos Turma: 11ºA Física e Química A - 11ºAno Professora Paula Melo Silva Data: 29 de abril 2016 Ano Letivo: 2015/2016 135 + 15 min 1. Na produção de cobre são usados 500
8ª Ficha de Avaliação de Conhecimentos Turma: 11ºA Física e Química A - 11ºAno Professora Paula Melo Silva Data: 29 de abril 2016 Ano Letivo: 2015/2016 135 + 15 min 1. Na produção de cobre são usados 500
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Nome Completo : Prova de Acesso de Química para Maiores de 23 Anos. Candidatura de Junho de 2013, 10: h
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
Química Analítica IV TITULOMETRIA DE NEUTRALIZAÇÃO
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE FRACA COM ÁCIDO
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE FRACA COM ÁCIDO
ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA
 ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA CURSOS PROFISSIONAIS Disciplina: FÍSICA E QUÍMICA Módulo (*) : Q4 Equilíbrio Ácido-base + E.Q4 Titulações Ácido-base (*) e extensão do módulo, se aplicável.
ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA CURSOS PROFISSIONAIS Disciplina: FÍSICA E QUÍMICA Módulo (*) : Q4 Equilíbrio Ácido-base + E.Q4 Titulações Ácido-base (*) e extensão do módulo, se aplicável.
Reações ácido base 1
 1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
Volumetria Ácido-base
 Volumetria Ácido-base H O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Volumetria Ácido-base H O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Introdução à Análise Química QUI 094 VOLUMETRIA DE NEUTRALIZAÇÃO
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos VOLUMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos VOLUMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Faculdade de Ciências da Universidade do Porto Departamento de Química. Programa do 10º ano e do 11º ano de Química do Ensino Secundário
 Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
COMPOSTOS DE COORDENAÇÃO de Metais de Transição
 COMPOSTOS DE COORDENAÇÃO de Metais de Transição 1 Metais de transição na Tabela Periódica [Ar]3d 1 4s 2 [Ar]3d 10 4s 2 Configuração electrónica e outras propriedades dos metais da 1ª série de transição
COMPOSTOS DE COORDENAÇÃO de Metais de Transição 1 Metais de transição na Tabela Periódica [Ar]3d 1 4s 2 [Ar]3d 10 4s 2 Configuração electrónica e outras propriedades dos metais da 1ª série de transição
NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE
 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE O que se pretende Determinar a concentração desconhecida de uma solução aquosa de um ácido forte por titulação com uma base forte através de dois métodos. Num dos
NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE O que se pretende Determinar a concentração desconhecida de uma solução aquosa de um ácido forte por titulação com uma base forte através de dois métodos. Num dos
ESCOLA SECUNDÁRIA 3EB Dr Jorge Correia TAVIRA Ano lectivo 2008/2009 Química A 12º ano 3º Teste de avaliação escrita
 ESCOLA SECUNDÁRIA 3EB Dr Jorge Correia TAVIRA Ano lectivo 2008/2009 Química A 12º ano 3º Teste de avaliação escrita 1. O sangue que percorre o nosso corpo apresenta se sobe duas formas: sangue venoso (de
ESCOLA SECUNDÁRIA 3EB Dr Jorge Correia TAVIRA Ano lectivo 2008/2009 Química A 12º ano 3º Teste de avaliação escrita 1. O sangue que percorre o nosso corpo apresenta se sobe duas formas: sangue venoso (de
Nome: BI: Data - Local Emissão: / / -
 Prova de acesso para maiores de 23 anos Química Nome: BI: Data - Local Emissão: / / - Duração da prova: 75 minutos + 15 de tolerância Coloque o seu documento de identificação em cima da mesa. Coloque o
Prova de acesso para maiores de 23 anos Química Nome: BI: Data - Local Emissão: / / - Duração da prova: 75 minutos + 15 de tolerância Coloque o seu documento de identificação em cima da mesa. Coloque o
Nome: Ano: Turma: Nº.: Duração da prova: 60 minutos
 PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova A Nome: Ano: Turma: Nº.: Data:
PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova A Nome: Ano: Turma: Nº.: Data:
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Sais e Hidrólise Salina Docente: Prof a. Dr a. Luciana M. Saran 1. OBJETIVOS Discutir as propriedades ácido-base dos sais em soluções aquosas;
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Sais e Hidrólise Salina Docente: Prof a. Dr a. Luciana M. Saran 1. OBJETIVOS Discutir as propriedades ácido-base dos sais em soluções aquosas;
MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações
 MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações sobre a composição de uma amostra. Método: é a aplicação
MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações sobre a composição de uma amostra. Método: é a aplicação
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes)
 Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
EXERCÍCIOS. Química 11. e problemas Exames Testes intermédios Professor Luís Gonçalves
 Química 11 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 Unidade 1 Controlo
Química 11 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 Unidade 1 Controlo
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 1
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/10 Págs. Duração da prova: 120 minutos 1.ª FASE 2002 2.ª
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/10 Págs. Duração da prova: 120 minutos 1.ª FASE 2002 2.ª
Abuso Sexual nas escolas Não dá para aceitar
 Abuso Sexual nas escolas Não dá para aceitar Por uma escola livre do SIDA República de Moçambique Química Ministério da Educação Exame Extraordinário 12ª Classe / 2013 Conselho Nacional de Exames, Certificação
Abuso Sexual nas escolas Não dá para aceitar Por uma escola livre do SIDA República de Moçambique Química Ministério da Educação Exame Extraordinário 12ª Classe / 2013 Conselho Nacional de Exames, Certificação
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Disciplina: Química Geral Docente Responsável: Prof a. Dr a. Luciana Maria Saran. Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação
 Disciplina: Química Geral Docente Responsável: Prof a. Dr a. Luciana Maria Saran 1 Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação 1. Ácidos e Bases: conceito de Lewis O modelo de Lewis baseia-se
Disciplina: Química Geral Docente Responsável: Prof a. Dr a. Luciana Maria Saran 1 Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação 1. Ácidos e Bases: conceito de Lewis O modelo de Lewis baseia-se
Equilíbrio Químico Folha 03 Prof.: João Roberto Mazzei
 01. (UERJ 2006) Numa aula experimental, foram preparadas quatro soluções eletrolíticas com a mesma concentração de soluto e as mesmas condições adequadas para o estabelecimento de um estado de equilíbrio
01. (UERJ 2006) Numa aula experimental, foram preparadas quatro soluções eletrolíticas com a mesma concentração de soluto e as mesmas condições adequadas para o estabelecimento de um estado de equilíbrio
Fonte: «Do velho se faz novo», PROTESTE, 248, pp , Junho 2004 (adaptado)
 I O automóvel é um dos grandes culpados pela poluição atmosférica. Durante o uso, emite gases poluentes, tais como os que contribuem para o efeito de estufa, a ocorrência de chuvas ácidas e o smog de Verão.
I O automóvel é um dos grandes culpados pela poluição atmosférica. Durante o uso, emite gases poluentes, tais como os que contribuem para o efeito de estufa, a ocorrência de chuvas ácidas e o smog de Verão.
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
TEORIA DE ÁCIDOS E BASES
 TEORIA DE ÁCIDOS E BASES Proposição de S. Arrhenius (1887) Substâncias produtoras de íons hidrogênio em água fossem chamadas de ácidos Substâncias produtoras de íons hidroxila em água fossem chamadas de
TEORIA DE ÁCIDOS E BASES Proposição de S. Arrhenius (1887) Substâncias produtoras de íons hidrogênio em água fossem chamadas de ácidos Substâncias produtoras de íons hidroxila em água fossem chamadas de
Prática 10 Determinação da constante de equilíbrio entre íons Fe 3+ e SCN -
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 10 Determinação da constante de equilíbrio
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 10 Determinação da constante de equilíbrio
D 1s 2 2s 1 2p 1 x 2p 1 y 2p 1 z
 Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação ª Época 1ª Classe / 011 Conselho Nacional de Exames, Certificação e Equivalências
Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação ª Época 1ª Classe / 011 Conselho Nacional de Exames, Certificação e Equivalências
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica
 PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do aluno:
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do aluno:
MODELO ou MODELO DE QUESTÕES DA PROVA ESPECÍFICA DE QUÍMICA
 Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores dos Maiores de 23 Anos (M23) Ano Letivo 2017/2018 MODELO ou MODELO DE QUESTÕES DA PROVA ESPECÍFICA
Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores dos Maiores de 23 Anos (M23) Ano Letivo 2017/2018 MODELO ou MODELO DE QUESTÕES DA PROVA ESPECÍFICA
Escola Secundária de Lagoa. Ficha de Trabalho 15. Física e Química A 11º Ano Paula Melo Silva. Escola Secundária de Lagoa Paula Melo Silva Página 1
 Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva AL 1.1. Síntese do Ácido Acetilsalicílico. Objetivo geral: Realizar a síntese do ácido acetilsalicílico e determinar o rendimento.
Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva AL 1.1. Síntese do Ácido Acetilsalicílico. Objetivo geral: Realizar a síntese do ácido acetilsalicílico e determinar o rendimento.
Funcionamento de um sistema tampão
 Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Revisão da aula anterior
 Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 1
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 1.ª FASE 2002 1.ª
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 1.ª FASE 2002 1.ª
Física e Química A. Nomes: N.º s : T.ª: Como neutralizar resíduos de ácidos/bases do laboratório de Química da escola?
 Física e Química A 11ºAno - Química AL.2.3. Neutralização: uma reacção de ácido-base Ano lectivo: 2010/2011 Nomes: N.º s : T.ª: PARTE I - Introdução Questão problema Como identificar se os resíduos são
Física e Química A 11ºAno - Química AL.2.3. Neutralização: uma reacção de ácido-base Ano lectivo: 2010/2011 Nomes: N.º s : T.ª: PARTE I - Introdução Questão problema Como identificar se os resíduos são
Experimento 11 - Equilíbrio químico e sistema tampão
 1 Experimento 11 - Equilíbrio químico e sistema tampão 1. INTRODUÇÃO 1.1. EQUILÍBRIO QUÍMICO As reações estudadas em química não resultam de uma conversão completa de reagentes em produtos, pois todas
1 Experimento 11 - Equilíbrio químico e sistema tampão 1. INTRODUÇÃO 1.1. EQUILÍBRIO QUÍMICO As reações estudadas em química não resultam de uma conversão completa de reagentes em produtos, pois todas
As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos
 Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 20 de maio de 2016 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 20 de maio de 2016 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
Nome: Ano: Turma: Nº.: Duração da prova: 60 minutos
 PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova B Nome: Ano: Turma: Nº.: Data:
PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova B Nome: Ano: Turma: Nº.: Data:
Abuso Sexual nas Escolas Não dá para aceitar
 Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação 1ª Época 12ª Classe / 2011 Conselho Nacional de Exames, Certificação e Equivalências
Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação 1ª Época 12ª Classe / 2011 Conselho Nacional de Exames, Certificação e Equivalências
CONCEITO DE ÁCIDOS E BASES 1
 CONCEITO DE ÁCIDOS E BASES 1 1. Conceito de Arrhenius A primeira definição de ácidos e bases foi dada pelo químico sueco Svante Arrhenius ao redor de 1884: Substâncias ácidas são aquelas que em solução
CONCEITO DE ÁCIDOS E BASES 1 1. Conceito de Arrhenius A primeira definição de ácidos e bases foi dada pelo químico sueco Svante Arrhenius ao redor de 1884: Substâncias ácidas são aquelas que em solução
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos
 Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
Provas de Acesso ao Ensino Superior para maiores de 23 anos
 Provas de Acesso ao Ensino Superior para maiores de 23 anos Duração: 1h30min.; Tolerância: 30 minutos Parte I - Seleccione a única opção que permite obter uma afirmação correcta nas seguintes questões:
Provas de Acesso ao Ensino Superior para maiores de 23 anos Duração: 1h30min.; Tolerância: 30 minutos Parte I - Seleccione a única opção que permite obter uma afirmação correcta nas seguintes questões:
mol / kg de água do mar NaCl 0,4186 MgCl 2 0,0596 Na 2 SO 4 0,02856
 QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
para as soluções e pressão para gases. Identificar o par
 Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
LISTA DE EXERCÍCIOS 1º ANO
 GAB LISTA - 11 a) Elemento: Carbono; número de massa do isótopo do carbono com 8 nêutrons:14 b) Moléculas com ligações polares: (figura 01) Moléculas com ligações apolares: (figura 02) a) Observe a figura
GAB LISTA - 11 a) Elemento: Carbono; número de massa do isótopo do carbono com 8 nêutrons:14 b) Moléculas com ligações polares: (figura 01) Moléculas com ligações apolares: (figura 02) a) Observe a figura
Abuso Sexual nas escolas Não dá para aceitar
 Abuso Sexual nas escolas Não dá para aceitar Por uma escola livre do SIDA República de Moçambique Ministério da Educação Conselho Nacional de Exames, Certificação e Equivalências ESG / 2014 Exame de Química
Abuso Sexual nas escolas Não dá para aceitar Por uma escola livre do SIDA República de Moçambique Ministério da Educação Conselho Nacional de Exames, Certificação e Equivalências ESG / 2014 Exame de Química
QUÍMICA TITULAÇÃO ,0 ml de uma solução de NaOH neutralizam totalmente 10,0 ml de uma solução de HNO
 QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
Prova de Acesso de Química para Maiores de 23 Anos 2009/2010
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos 2009/2010 21 Julho 2009, 10:00 13:00 h Respostas às perguntas de escolha múltipla: assinale a resposta certa quando lhe for
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos 2009/2010 21 Julho 2009, 10:00 13:00 h Respostas às perguntas de escolha múltipla: assinale a resposta certa quando lhe for
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica
 PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do
AB-I - Concentrações e Diluições
 Problemas da disciplina de Química II Ácidos e bases 2º semestre de 2007-2008 Coligidos por: Rita Delgado e Luís Vilas Boas e outros docentes do DEQB - IST Este ficheiro destina-se exclusivamente aos alunos
Problemas da disciplina de Química II Ácidos e bases 2º semestre de 2007-2008 Coligidos por: Rita Delgado e Luís Vilas Boas e outros docentes do DEQB - IST Este ficheiro destina-se exclusivamente aos alunos
Exercícios Equilíbrio Iônico
 Exercícios Equilíbrio Iônico 1. O ph tem uma importância significativa nos processos de laboratório, da indústria e dos organismos vivos. Ele pode ser avaliado de forma simples, usando-se substâncias chamadas
Exercícios Equilíbrio Iônico 1. O ph tem uma importância significativa nos processos de laboratório, da indústria e dos organismos vivos. Ele pode ser avaliado de forma simples, usando-se substâncias chamadas
12 GAB. 1 1 o DIA PASES 1 a ETAPA TRIÊNIO QUÍMICA QUESTÕES DE 21 A 30
 12 GAB. 1 1 o DIA PASES 1 a ETAPA TRIÊNIO 2005-2007 QUÍMICA QUESTÕES DE 21 A 30 21. A hemoglobina das células vermelhas do sangue contém o complexo de ferro com uma porfirina. Sabendo que um indivíduo
12 GAB. 1 1 o DIA PASES 1 a ETAPA TRIÊNIO 2005-2007 QUÍMICA QUESTÕES DE 21 A 30 21. A hemoglobina das células vermelhas do sangue contém o complexo de ferro com uma porfirina. Sabendo que um indivíduo
Indicadores e Titulações
 SÉRIE ITA/IME ENSINO PRÉ-UNIVERSITÁRIO PROFESSOR(A) ALUNO(A) TURMA ANTONINO TURNO SEDE DATA Nº / / TC QUÍMICA Indicadores e Titulações Indicadores São espécies químicas que admitem colorações distintas
SÉRIE ITA/IME ENSINO PRÉ-UNIVERSITÁRIO PROFESSOR(A) ALUNO(A) TURMA ANTONINO TURNO SEDE DATA Nº / / TC QUÍMICA Indicadores e Titulações Indicadores São espécies químicas que admitem colorações distintas
Fundamentos de Química Profa. Janete Yariwake
 Bloco 2. Soluções. Equilíbrio químico em solução aquosa 2.1 Ácidos e bases 1 Bibliografia - Exercícios selecionados Exercícios retirados dos seguintes livros-texto: J.E. Brady, G.E. Humiston. Química Geral,
Bloco 2. Soluções. Equilíbrio químico em solução aquosa 2.1 Ácidos e bases 1 Bibliografia - Exercícios selecionados Exercícios retirados dos seguintes livros-texto: J.E. Brady, G.E. Humiston. Química Geral,
Volumetria de Neutralização
 Volumetria de Neutralização H 3 O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Volumetria de Neutralização H 3 O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA II
 INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA II ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os materiais
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA II ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os materiais
EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2015 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. É expressamente proibido assinar ou fazer qualquer
EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2015 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. É expressamente proibido assinar ou fazer qualquer
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Natal/RN SOLUÇÃO TAMPÃO
 QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
PRÉ-QUÍMICO. RESOLUÇÃO DO EXAME DE ADMISSÃO DE QUÍMICA DA UP a PARTE
 PRÉ-QUÍMICO RESOLUÇÃO DO EXAME DE ADMISSÃO DE QUÍMICA DA UP 2018 1 a PARTE 1. Considere os seguintes dados referentes aos átomos A, B, e C: 20 A Z ; 21 B 44 ; X C Y. Sabendo que A e B são isóbaros, B e
PRÉ-QUÍMICO RESOLUÇÃO DO EXAME DE ADMISSÃO DE QUÍMICA DA UP 2018 1 a PARTE 1. Considere os seguintes dados referentes aos átomos A, B, e C: 20 A Z ; 21 B 44 ; X C Y. Sabendo que A e B são isóbaros, B e
