Nome: BI: Data - Local Emissão: / / -
|
|
|
- Joaquim Vidal Chagas
- 6 Há anos
- Visualizações:
Transcrição
1 Prova de acesso para maiores de 23 anos Química Nome: BI: Data - Local Emissão: / / - Duração da prova: 75 minutos + 15 de tolerância Coloque o seu documento de identificação em cima da mesa. Coloque o seu telemóvel desligado em cima da mesa. Não pode desagrafar o teste. Não pode usar folhas de rascunho. Se necessário use o verso do enunciado. O teste inclui questões de escolha múltipla, problemas e de desenvolvimento. Responda às questões na folha de respostas, excepto quando indicado. Nas questões de escolha múltipla, assinale a opção correcta fazendo um X no local correcto, debaixo da letra correspondendo à opção desejada. Não serão cotadas respostas a problemas, assinaladas sem a respectiva resolução. Pergunta / Opção a) b) c) d)
2 Responda a esta questão no enunciado 2
3 1.(1 valor) Escreva a equação acertada na folha de respostas. Acerte a equação da reacção química abaixo. Transcreva a sua resposta para a folha de respostas. CH 3 OH (g) + O 2(g) H 2 O (g) + CO 2(g) 2. (1 valor) Um composto tem a seguinte composição em percentagem por massa: S, 46,27%; Fe, 53,73%. Qual é a fórmula empírica do composto? (A) FeS 2 (B) Fe 3 S 2 (C) FeS (D)Fe 2 S 3 3. A atmosfera terrestre tem vindo a ser contaminada por diversos gases poluentes, como CO 2, CH 4, NO x, SO 2, etc., sendo alguns deles responsáveis pelas chuvas ácidas (1 valor) Uma das reacções que está na origem das chuvas ácidas é a reacção do dióxido de enxofre, SO 2(g), com o oxigénio da atmosfera, O 2(g), originando trióxido de enxofre, SO 3(g), traduzida por 2SO 2(g) + O 2(g) 2SO 3(g) O gráfico da figura seguinte representa uma das possíveis evoluções das concentrações dos componentes da mistura reaccional em função do tempo, em recipiente fechado contendo inicialmente uma mistura de SO 2(g) e O 2(g). 3
4 Seleccione a alternativa que contém a sequência que refere a evolução das concentrações de SO 2(g), O 2(g) e SO 3(g), respectivamente. (A) III, II e I. (B) II, III e I. (C) III, I e II. (D) II, I e III (1 valor) A chuva normal tem, usualmente, ph cerca de 5,6. Indique o gás que, ao dissolver-se, é responsável por este valor. (A) SO 2(g) (B) O 2(g) (C) SO 3(g) (D) H 2 O (g) 4. O dióxido de carbono, CO 2(g), é um dos principais gases que contribuem para o efeito de estufa, sendo conhecidas diversas acções conducentes à redução das suas emissões para a atmosfera. No entanto, além do dióxido de carbono, o vapor de água, H 2 O (g), e o metano, CH 4(g), também contribuem para esse efeito. 4.1.(1 valor) Tanto a molécula H 2 O como a molécula CO 2 têm um átomo central, respectivamente de oxigénio e de carbono. Seleccione a alternativa que corresponde à geometria correcta dessas moléculas. (A) A molécula H 2 O é linear, assim como a molécula CO 2. (B) A molécula H 2 O é linear, enquanto a molécula CO 2 é angular. (C) A molécula H 2 O é angular, assim como a molécula CO 2. 4
5 (D) A molécula H 2 O é angular, enquanto a molécula CO 2 é linear (1 valor) O metano, CH 4, é o alcano mais simples, com apenas um átomo de carbono por molécula. A cadeia carbonada dos alcanos pode ser ramificada ou não ramificada, ocorrendo a ramificação apenas a partir do butano, C 4 H 10. Considere o alcano de cadeia ramificada, cuja fórmula de estrutura está representada na figura abaixo. Seleccione a alternativa que corresponde ao nome deste alcano, de acordo com as regras da IUPAC. (A) 3 metil-heptano. (B) 2,4 dimetil-hexano. (C) 2 etil 4 metilpentano. (D) 3 etil 1,1 dimetilbutano. 5. O mercúrio contribui para a poluição atmosférica como material particulado. Já um dos seus compostos, o catião metilmercúrio, CH 3 Hg +, quando em soluções aquosas, entra na cadeia alimentar, originando intoxicações. A toxicidade do mercúrio e dos seus compostos deve-se à sua interferência em processos enzimáticos, impedindo a respiração e o metabolismo celular (1 valore) Nos seres humanos, a concentração mínima de metilmercúrio no sangue, normalmente associada ao aparecimento de sintomas de intoxicação, é 0,20 mg/l. Indique o valor desta concentração, expresso em mol dm 3. (A).9.28x10-4 mol.dm -3 (B) 9.28x10-4 mol.dm -7 (C) 9.28x10-4 mol.dm -10 (D) 9.28x10-4 mol.dm -1 5
6 5.2. (2 valores) Cada ser humano não deve ingerir, em média, por dia, um valor superior a 2, mg de metilmercúrio por quilograma da sua massa corporal. Analisou-se uma amostra de 25,0 g de peixe, originária de uma remessa que ia ser comercializada, verificando-se que continha 1, mg de metilmercúrio. Mostre que a ingestão de 125 g daquele peixe pode provocar intoxicação numa pessoa de 60 kg. Apresente todas as etapas de resolução e assinale o valor final. (A) 8.3x10-1 mg.kg -1 (B) 8.3x10-10 mg.kg -1 (C) 8.3x10-7 mg.kg -1 (D) 8.3x10-4 mg.kg O amoníaco, obtido industrialmente pelo processo de Haber-Bosch, é uma substância relevante na nossa sociedade, pelas suas múltiplas utilizações. É matéria-prima no fabrico de fertilizantes, de ácido nítrico, de explosivos, de detergentes, entre outros (2 valores) O hidrogénio, H 2(g), usado no fabrico do amoníaco, é normalmente obtido a partir do gás natural, essencialmente constituído por metano, CH 4(g), reacção que pode ser traduzida pela equação química CH 4(g) + H 2 O (g) CO (g) + 3H 2(g) Calcule o volume de hidrogénio que se obtém, medido em condições PTN, considerando a reacção completa de 960 kg de metano com excesso de vapor de água. Apresente todas as etapas de resolução e assinale a resposta. (A) ,980 dm 3 (B) 4019, dm 3 (C) 4, dm 3 (D) ,0 dm 3 6
7 6.2. (2 valores) Num recipiente fechado de capacidade 5,0 dm 3, uma mistura constituída por 1,0 mol de H 2(g), 2,5 mol de N 2(g) e 2,0 mol de NH 3(g) encontra-se a 500 C. A essa temperatura, a constante de equilíbrio da reacção traduzida por N 2(g) + 3H 2(g) 2NH 3(g) é Kc = 0,30. Mostre, com base no valor do quociente de reacção, Qc, que a concentração de amoníaco, na mistura reaccional, diminui até se estabelecer o equilíbrio. Apresente todas as etapas de resolução. (A) Qc=Kc (B) Qc<Kc (C) Qc>Kc (D) não se aplica 6.3. (1 valor) Seleccione a alternativa correcta, relativamente à reacção de formação do amoníaco, indicada em 6.2. (A) A espécie oxidante é o N 2(g) e o elemento que se reduz é o hidrogénio. (B) A espécie redutora é o H 2(g) e o elemento que se oxida é o hidrogénio. (C) A espécie redutora é o N 2(g) e o elemento que se oxida é o azoto. (D) A espécie oxidante é o H 2(g) e o elemento que se reduz é o azoto (1 valor) O amoníaco, resultante da decomposição da ureia presente na urina, é um dos responsáveis pelo odor desagradável nas casas de banho. A sua ionização em água pode ser traduzida por NH 3(aq) + H 2 O (l) NH 4 + (aq) + OH - (aq) Indique um dos pares conjugados ácido-base envolvidos nesta reacção. (A) NH 3(aq) / H 2 O (l) (B) NH 4 + (aq) / OH - (aq) (C) H 2 O (l) / OH - (aq) (D) HCl (g) / Cl - (aq) 7
8 7. Num laboratório, um grupo de alunos pretende preparar, com rigor, uma solução aquosa neutra, por meio de uma reacção de neutralização, e aproveitar essa solução para verificar como o produto iónico da água, Kw, varia com a temperatura. Kw = 1x10-14 a 25ºC. A solução aquosa neutra foi preparada misturando 50 ml de ácido clorídrico, HCl (aq), de concentração 0,100 mol dm 3, com um determinado volume de uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração 0,500 mol dm 3. Em seguida, mediram o ph dessa solução a diferentes temperaturas, o que lhes permitiu verificar como Kw varia com a temperatura (2 valores) Na preparação, com rigor, da solução aquosa neutra, o volume de NaOH (aq) que tiveram de utilizar foi... (A) 5,0 ml. (B) 10 ml. (C) 15 ml. (D) 20 ml (1 valor) Seleccione a alternativa que corresponde ao material de vidro que deve ser utilizado na medição do volume de NaOH (aq). (A) Pipeta graduada. (B) Proveta graduada. (C) Copo de precipitação. (D) Pipeta de Pasteur (2 valor) Explique como varia o produto iónico da água, Kw, em função da temperatura. Na tabela seguinte apresentam-se os valores de ph dessa solução neutra, a diversas temperaturas. Sugestão: Com base na tabela, calcule os valores de K W para as diferentes temperaturas. 8
9 9
10 10
MODELO ou MODELO DE QUESTÕES DA PROVA ESPECÍFICA DE QUÍMICA
 Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores dos Maiores de 23 Anos (M23) Ano Letivo 2017/2018 MODELO ou MODELO DE QUESTÕES DA PROVA ESPECÍFICA
Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores dos Maiores de 23 Anos (M23) Ano Letivo 2017/2018 MODELO ou MODELO DE QUESTÕES DA PROVA ESPECÍFICA
Leia com atenção as questões do teste. Apresente na folha de teste todos os cálculos, expressões que utilizar nas resoluções dos exercícios.
 ESCOLA BÁSICA E SECUNDÁRIA DE VELAS Física e Química A 11º ANO ANO LECTIVO 2010/2011 Ficha de Avaliação Sumativa nº 5 Física e Química A Duração da Prova: 90 minutos 02.06.2011 11º ano de Escolaridade
ESCOLA BÁSICA E SECUNDÁRIA DE VELAS Física e Química A 11º ANO ANO LECTIVO 2010/2011 Ficha de Avaliação Sumativa nº 5 Física e Química A Duração da Prova: 90 minutos 02.06.2011 11º ano de Escolaridade
mol / kg de água do mar NaCl 0,4186 MgCl 2 0,0596 Na 2 SO 4 0,02856
 QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
1.1. A partir de 10 mol de ácido nítrico qual é a massa de nitrato de amónio que se obtém?
 Escola Secundária de Lagoa Física e Química A 11º Ano Turma A Paula Melo Silva Ficha de Trabalho 5 Cálculos estequiométricos 1. O ácido nítrico é uma das mais importantes substâncias inorgânicas industriais.
Escola Secundária de Lagoa Física e Química A 11º Ano Turma A Paula Melo Silva Ficha de Trabalho 5 Cálculos estequiométricos 1. O ácido nítrico é uma das mais importantes substâncias inorgânicas industriais.
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto Lei n.º 64/2006, de 21 de Março) 2010 PROVA DE QUÍMICA Data da prova:
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto Lei n.º 64/2006, de 21 de Março) 2010 PROVA DE QUÍMICA Data da prova:
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
1. O amoníaco é uma base, segundo a teoria de Brönsted-Lowry, sendo a sua reação de ionização em água traduzida pela seguinte equação:
 ESCOLA SECUNDÁRIA DE CASQUILHOS FQA FICHA DE EXERCÍCIOS DE EXAME UNIDADE 2 - QUÍMICA 10.março. 2016 11.º Ano Turma B Professor: Duração da prova: 90 minutos. NOME: Nº 1 1. O amoníaco é uma base, segundo
ESCOLA SECUNDÁRIA DE CASQUILHOS FQA FICHA DE EXERCÍCIOS DE EXAME UNIDADE 2 - QUÍMICA 10.março. 2016 11.º Ano Turma B Professor: Duração da prova: 90 minutos. NOME: Nº 1 1. O amoníaco é uma base, segundo
PROVA PARA AVALIAÇÃO DE CAPACIDADE PARA FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS 2016/2017. Instituto Superior de Engenharia (ISE)
 PROVA PARA AVALIAÇÃO DE CAPACIDADE PARA FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS Notas: 2016/2017 Instituto Superior de Engenharia (ISE) Licenciatura em Tecnologia e Segurança Alimentar (ISE)
PROVA PARA AVALIAÇÃO DE CAPACIDADE PARA FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS Notas: 2016/2017 Instituto Superior de Engenharia (ISE) Licenciatura em Tecnologia e Segurança Alimentar (ISE)
ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR FÍSICA E QUÍMICA A 10ºANO (2015/2016)
 ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR FÍSICA E QUÍMICA A 10ºANO (2015/2016) Ficha de Trabalho D2 SD5 Domínio 2: Propriedades e Transformações da Matéria Subdomínio 5: Gases e Dispersões 1. A atmosfera
ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR FÍSICA E QUÍMICA A 10ºANO (2015/2016) Ficha de Trabalho D2 SD5 Domínio 2: Propriedades e Transformações da Matéria Subdomínio 5: Gases e Dispersões 1. A atmosfera
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO 13/11/2009 PROVA ESCRITA Nome do candidato: Assinatura do candidato:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO 13/11/2009 PROVA ESCRITA Nome do candidato: Assinatura do candidato:
ESCOLA SECUNDÁRIA DE MONSERRATE
 ESCOLA SECUNDÁRIA DE MONSERRATE F.Q. A 2º ANO EQUILÍBRIO QUÍMICO 1. Para ocorrer uma situação de equilíbrio num sistema são necessárias, pelo menos, duas das condições seguintes: A Todos os reagentes se
ESCOLA SECUNDÁRIA DE MONSERRATE F.Q. A 2º ANO EQUILÍBRIO QUÍMICO 1. Para ocorrer uma situação de equilíbrio num sistema são necessárias, pelo menos, duas das condições seguintes: A Todos os reagentes se
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Provas de Acesso ao Ensino Superior para maiores de 23 anos
 Provas de Acesso ao Ensino Superior para maiores de 23 anos Duração: 1h30min.; Tolerância: 30 minutos Parte I - Seleccione a única opção que permite obter uma afirmação correcta nas seguintes questões:
Provas de Acesso ao Ensino Superior para maiores de 23 anos Duração: 1h30min.; Tolerância: 30 minutos Parte I - Seleccione a única opção que permite obter uma afirmação correcta nas seguintes questões:
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 20 de maio de 2016 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 20 de maio de 2016 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Estudantes Maiores de 23 Anos Candidatos 2018-2019 14 de Junho de 2018 10h00 12h00 Nome C. C. nº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS
Prova de Acesso de Química Estudantes Maiores de 23 Anos Candidatos 2018-2019 14 de Junho de 2018 10h00 12h00 Nome C. C. nº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS
Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano. Ano lectivo 2008/2009
 Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2008/2009 Teste de Avaliação Sumativa (1/2/2009) Nome: Nº de Aluno: Turma: Classificação: Professor: Tabela de Constantes
Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2008/2009 Teste de Avaliação Sumativa (1/2/2009) Nome: Nº de Aluno: Turma: Classificação: Professor: Tabela de Constantes
ESCOLA SECUNDÁRIA DE CASQUILHOS
 6.º teste sumativo de FQA 3.março.15 ESCOLA SECUNDÁRIA DE CASQUILHOS 11.º Ano Turma B Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. VERSÃO 2 Este teste é constituído por 8 páginas
6.º teste sumativo de FQA 3.março.15 ESCOLA SECUNDÁRIA DE CASQUILHOS 11.º Ano Turma B Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. VERSÃO 2 Este teste é constituído por 8 páginas
Questões de Exame Resolvidas. Física e Química A. 11. ano. Química
 Questões de Exame Resolvidas Física e Química A 11. ano Química Índice Apresentação 3 Questões de Exame e de Testes Intermédios Química 10.º ano Domínio 1 Elementos químicos e sua organização 7 Subdomínio
Questões de Exame Resolvidas Física e Química A 11. ano Química Índice Apresentação 3 Questões de Exame e de Testes Intermédios Química 10.º ano Domínio 1 Elementos químicos e sua organização 7 Subdomínio
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril Versão 1 11.º Ano Turmas A e B
 ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril. 2016 Versão 1 11.º Ano Turmas A e B Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina na palavra FIM Nome:
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 26. Abril. 2016 Versão 1 11.º Ano Turmas A e B Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina na palavra FIM Nome:
4. «[...] se não houver trocas, nem de matéria nem de energia, entre o sistema e o exterior [...]», o sistema químico será um sistema
![4. «[...] se não houver trocas, nem de matéria nem de energia, entre o sistema e o exterior [...]», o sistema químico será um sistema 4. «[...] se não houver trocas, nem de matéria nem de energia, entre o sistema e o exterior [...]», o sistema químico será um sistema](/thumbs/64/51653194.jpg) 2013 / 1.ª FASE Quando um sistema químico, no qual ocorra uma reação química reversível, se encontra num estado de equilíbrio o que, em rigor, só é possível se não houver trocas, nem de matéria nem de
2013 / 1.ª FASE Quando um sistema químico, no qual ocorra uma reação química reversível, se encontra num estado de equilíbrio o que, em rigor, só é possível se não houver trocas, nem de matéria nem de
2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor dessa pressão em atm e kpa?
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto-Lei n.º 64/2006, de 21 de março) 2014 PROVA DE QUÍMICA Data da prova:
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto-Lei n.º 64/2006, de 21 de março) 2014 PROVA DE QUÍMICA Data da prova:
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 09 de maio de 2017 Duração: 2 horas DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA V m (PTN) = 22,4 L/mol Grupo I
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
7ª Ficha de Avaliação de Conhecimentos Turma: 11ºA
 Página1 7ª Ficha de Avaliação de Conhecimentos Turma: 11ºA Física e Química A - 11ºAno (Versão 1) Professora Paula Melo Silva Data: 20 de março Ano Letivo: 2018/2019 90 min + 15 min 1. O ácido acético,
Página1 7ª Ficha de Avaliação de Conhecimentos Turma: 11ºA Física e Química A - 11ºAno (Versão 1) Professora Paula Melo Silva Data: 20 de março Ano Letivo: 2018/2019 90 min + 15 min 1. O ácido acético,
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto-Lei n.º 64/2006, de 21 de março) 2017 PROVA DE QUÍMICA Data da prova:
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto-Lei n.º 64/2006, de 21 de março) 2017 PROVA DE QUÍMICA Data da prova:
QUÍMICA QUESTÃO O oxigênio e o enxofre podem ser encontrados como moléculas O 2 QUESTÃO 32
 T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
Relações Mássicas em Reacções Químicas
 Relações Mássicas em Reacções Químicas Química - Aula 2 Massa Atómica N.º de Avogadro e Massa Molar Massa Molecular Reacções Químicas e Equações Químicas Quantidades de Reagentes e Produtos 1 Mundo Micro
Relações Mássicas em Reacções Químicas Química - Aula 2 Massa Atómica N.º de Avogadro e Massa Molar Massa Molecular Reacções Químicas e Equações Químicas Quantidades de Reagentes e Produtos 1 Mundo Micro
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto-Lei n.º 64/2006, de 21 de março) 2016 PROVA DE QUÍMICA Data da prova:
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto-Lei n.º 64/2006, de 21 de março) 2016 PROVA DE QUÍMICA Data da prova:
Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Cinética e Eq. Químico Folha 10 João Roberto Fortes Mazzei
 01. Em um recipiente de 500 ml, encontram-se, em condições de equilíbrio, 10 mol/l de H 2 (g) e 0,01 mol/l de I 2 (g). Qual é a concentração do HI(g), sabendo-se que, nas condições do experimento, a constante
01. Em um recipiente de 500 ml, encontram-se, em condições de equilíbrio, 10 mol/l de H 2 (g) e 0,01 mol/l de I 2 (g). Qual é a concentração do HI(g), sabendo-se que, nas condições do experimento, a constante
FICHA DE TRABALHO DE FÍSICA E QUÍMICA A FEVEREIRO 2012
 FICHA DE TRABALHO DE FÍSICA E QUÍMICA A FEVEREIRO 2012 APSA Nº14 11º Ano de Escolaridade 1. Qual a massa de hidróxido de sódio necessária para reagir completamente com 49,05 g de ácido sulfúrico de acordo
FICHA DE TRABALHO DE FÍSICA E QUÍMICA A FEVEREIRO 2012 APSA Nº14 11º Ano de Escolaridade 1. Qual a massa de hidróxido de sódio necessária para reagir completamente com 49,05 g de ácido sulfúrico de acordo
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Nome: Nº BI: Data - Local Emissão: / / -
 PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA. Departamento de Engenharia Química e do Ambiente. QUÍMICA I (1º Ano/1º Semestre)
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano/1º Semestre) 4ª Série de Exercícios EQUILÍBRIO QUÍMICO Tomar (2003) 1 Equilíbrio
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 7º Teste de FQA 2.março. 2015 Versão 1 10º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
ESCOLA SECUNDÁRIA DE CASQUILHOS 7º Teste de FQA 2.março. 2015 Versão 1 10º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
1. A fermentação é um processo químico complexo do fabrico de vinho no qual a glucose é convertida em etanol e dióxido de carbono:
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 4. Reacções químicas II Ficha de exercícios 1. A fermentação é um processo químico complexo do fabrico de vinho no qual a glucose é convertida em etanol
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 4. Reacções químicas II Ficha de exercícios 1. A fermentação é um processo químico complexo do fabrico de vinho no qual a glucose é convertida em etanol
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 19. fevereiro. 2015 Versão 1 10.º Ano Turma A Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 19. fevereiro. 2015 Versão 1 10.º Ano Turma A Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por
Final Pergunta Q1 Q2 Q3 Total Cotação Classificação
 Final 2018-05-12 Duração 1h 30min Pergunta Q1 Q2 Q3 Total Cotação 15 25 20 60 Classificação Escola Nome Nota: Apresente todos os cálculos que efetuar e indique o resultado com o número de algarismos significativos
Final 2018-05-12 Duração 1h 30min Pergunta Q1 Q2 Q3 Total Cotação 15 25 20 60 Classificação Escola Nome Nota: Apresente todos os cálculos que efetuar e indique o resultado com o número de algarismos significativos
Equilíbrio Químico Folha 2.1 Prof.: João Roberto Mazzei
 01. A cisteína é um aminoácido que contém enxofre e é encontrada na feijoada, devido às proteínas da carne e derivados. A reação de conversão da cisteína em cistina ocorre de acordo com a seguinte equação
01. A cisteína é um aminoácido que contém enxofre e é encontrada na feijoada, devido às proteínas da carne e derivados. A reação de conversão da cisteína em cistina ocorre de acordo com a seguinte equação
UNIVERSIDADE DE ÉVORA
 UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 8 de setembro de 2017 Duração: 2 horas V m (PTN) = 22,4 L/mol DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA Grupo
UNIVERSIDADE DE ÉVORA ACESSO AO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA ESCRITA DE QUÍMICA 8 de setembro de 2017 Duração: 2 horas V m (PTN) = 22,4 L/mol DADOS NECESSÁRIOS À RESOLUÇÃO DA PROVA Grupo
ESCOLA SECUNDÁRIA PINHAL DO REI Domínio 2 Propriedades e transformações da matéria Nome: 10º/ nro:
 Ano Letivo 2016/2017 ESCOLA SECUNDÁRIA PINHAL DO REI Domínio 2 Propriedades e transformações da matéria Nome: 10º/ nro: Física e Química A Volume molar. Troposfera 1. A atmosfera que herdámos é não só
Ano Letivo 2016/2017 ESCOLA SECUNDÁRIA PINHAL DO REI Domínio 2 Propriedades e transformações da matéria Nome: 10º/ nro: Física e Química A Volume molar. Troposfera 1. A atmosfera que herdámos é não só
Componente de Química
 Componente de Química Unidade 1 Química e Indústria: equilíbrios e desequilíbrios A Química, o amoníaco e muito mais A Revolução Industrial Desenvolvimento sustentável versus desenvolvimento insustentável
Componente de Química Unidade 1 Química e Indústria: equilíbrios e desequilíbrios A Química, o amoníaco e muito mais A Revolução Industrial Desenvolvimento sustentável versus desenvolvimento insustentável
Faculdade de Ciências da Universidade do Porto Departamento de Química. Programa do 10º ano e do 11º ano de Química do Ensino Secundário
 Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 1
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/10 Págs. Duração da prova: 120 minutos 1.ª FASE 2002 2.ª
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/10 Págs. Duração da prova: 120 minutos 1.ª FASE 2002 2.ª
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Equilíbrio Químico. Controlo da Produção Industrial de Amoníaco
 Equilíbrio Químico Controlo da Produção Industrial de Amoníaco Reações completas Combustão do carvão C (s) + O 2 (g) CO 2 (g) Reações completas Reação do Ácido clorídrico com o Magnésio 2 HCl (aq) + Mg
Equilíbrio Químico Controlo da Produção Industrial de Amoníaco Reações completas Combustão do carvão C (s) + O 2 (g) CO 2 (g) Reações completas Reação do Ácido clorídrico com o Magnésio 2 HCl (aq) + Mg
Final Pergunta Q1 Q2 Q3 Total Cotação Classificação
 Final 2018-05-12 Duração 1h 30min Pergunta Q1 Q2 Q3 Total Cotação 17 25 18 60 Classificação Escola Nome Nota: Apresente todos os cálculos que efetuar e indique o resultado com o número de algarismos significativos
Final 2018-05-12 Duração 1h 30min Pergunta Q1 Q2 Q3 Total Cotação 17 25 18 60 Classificação Escola Nome Nota: Apresente todos os cálculos que efetuar e indique o resultado com o número de algarismos significativos
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
O lançamento descontrolado de dióxido de enxofre (SO 2
 QUÍMICA 20 O lançamento descontrolado de dióxido de enxofre (SO 2 (g)) na atmosfera é uma das principais causas da acidez da água da chuva nos grandes centros urbanos. Esse gás, na presença de O 2 e água
QUÍMICA 20 O lançamento descontrolado de dióxido de enxofre (SO 2 (g)) na atmosfera é uma das principais causas da acidez da água da chuva nos grandes centros urbanos. Esse gás, na presença de O 2 e água
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 5º teste sumativo de FQA 02. março. 2015 Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas
ESCOLA SECUNDÁRIA DE CASQUILHOS 5º teste sumativo de FQA 02. março. 2015 Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas
UNIVERSIDADE FEDERAL FLUMINENSE
 UNIVERSIDADE FEDERAL FLUMINENSE REINGRESSO E MUDANÇA DE CURSO 2017 QUÍMICA CADERNO DE QUESTÕES INSTRUÇÕES AO CANDIDATO Você deverá ter recebido o Caderno com a Proposta de Redação, a Folha de Redação,
UNIVERSIDADE FEDERAL FLUMINENSE REINGRESSO E MUDANÇA DE CURSO 2017 QUÍMICA CADERNO DE QUESTÕES INSTRUÇÕES AO CANDIDATO Você deverá ter recebido o Caderno com a Proposta de Redação, a Folha de Redação,
Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal
 Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal Ano Letivo 2017/2018 Física e Química A 10º ano Teste de Avaliação 2 A 05/11/2017 Duração: 90 minutos Página 1 de 7 Teste 2A
Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal Ano Letivo 2017/2018 Física e Química A 10º ano Teste de Avaliação 2 A 05/11/2017 Duração: 90 minutos Página 1 de 7 Teste 2A
Reações ácido base 1
 1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
Nome Completo : Prova de Acesso de Química para Maiores de 23 Anos. Candidatura de Junho de 2013, 10: h
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos Candidatura 2013-2014 18 de Junho de 2013, 10:00 12.30 h Respostas às perguntas de escolha múltipla: assinale a resposta certa
ATENÇÃO ESTE CADERNO CONTÉM 10 (DEZ) QUESTÕES. VERIFIQUE SE ESTÁ COMPLETO. DURAÇÃO DA PROVA: 3 (TRÊS) HORAS
 ATENÇÃO ESTE CADERNO CONTÉM 10 (DEZ) QUESTÕES. VERIFIQUE SE ESTÁ COMPLETO. DURAÇÃO DA PROVA: 3 (TRÊS) HORAS A correção de uma questão será restrita somente ao que estiver apresentado no espaço correspondente,
ATENÇÃO ESTE CADERNO CONTÉM 10 (DEZ) QUESTÕES. VERIFIQUE SE ESTÁ COMPLETO. DURAÇÃO DA PROVA: 3 (TRÊS) HORAS A correção de uma questão será restrita somente ao que estiver apresentado no espaço correspondente,
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
D 1s 2 2s 1 2p 1 x 2p 1 y 2p 1 z
 Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação ª Época 1ª Classe / 011 Conselho Nacional de Exames, Certificação e Equivalências
Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação ª Época 1ª Classe / 011 Conselho Nacional de Exames, Certificação e Equivalências
4ª Ficha de Avaliação de Conhecimentos Turma: 10ºA. Física e Química A - 10ºAno. Data: 24 fevereiro 2015 Ano Letivo: 2014/ min.
 4ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A - 10ºAno Professora Paula Melo Silva Data: 24 fevereiro 2015 Ano Letivo: 2014/2015 90 min Grupo I 1. Os átomos de cloro podem substituir
4ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A - 10ºAno Professora Paula Melo Silva Data: 24 fevereiro 2015 Ano Letivo: 2014/2015 90 min Grupo I 1. Os átomos de cloro podem substituir
Exercícios de Revisão - 2
 Exercícios de Revisão - 2 1. Na tentativa de explicar a origem dos seres vivos, Müller reproduziu, em seu experimento, as condições atmosféricas primitivas, que continham os gases metano (CH4); amônia
Exercícios de Revisão - 2 1. Na tentativa de explicar a origem dos seres vivos, Müller reproduziu, em seu experimento, as condições atmosféricas primitivas, que continham os gases metano (CH4); amônia
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS Ficha Formativa de FQA 24. janeiro. 2018 10º Ano Turma B Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
ESCOLA SECUNDÁRIA DE CASQUILHOS Ficha Formativa de FQA 24. janeiro. 2018 10º Ano Turma B Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
UNIVERSIDADE EDUARDO MONDLANE
 UNIVERSIDADE EDUARDO MONDLANE COMISSÃO DE EXAMES DE ADMISSÃO EXAME DE QUIMICA - 2005 Duração: 120 minutos LEIA ATENTAMENTE AS SEGUINTES INSTRUÇÕES: 1. A prova é constituída por trinta e sete (37) perguntas,
UNIVERSIDADE EDUARDO MONDLANE COMISSÃO DE EXAMES DE ADMISSÃO EXAME DE QUIMICA - 2005 Duração: 120 minutos LEIA ATENTAMENTE AS SEGUINTES INSTRUÇÕES: 1. A prova é constituída por trinta e sete (37) perguntas,
Nome: Ano: Turma: Nº.: Duração da prova: 60 minutos
 PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova A Nome: Ano: Turma: Nº.: Data:
PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova A Nome: Ano: Turma: Nº.: Data:
Física e Química A. Teste Intermédio de Física e Química A. Teste A. Teste Intermédio
 Teste Intermédio de Física e Química A Teste A Teste Intermédio Física e Química A Duração do Teste: 90 minutos 17.03.2009 11.º ou 12.º Anos de Escolaridade Decreto-Lei n.º 74/2004, de 26 de Março COTAÇÕES
Teste Intermédio de Física e Química A Teste A Teste Intermédio Física e Química A Duração do Teste: 90 minutos 17.03.2009 11.º ou 12.º Anos de Escolaridade Decreto-Lei n.º 74/2004, de 26 de Março COTAÇÕES
1) A tabela seguinte contém os pontos de ebulição (P.E.), a 1 atm, medidos em C, de diversos alcanos.
 Sem limite para crescer Colégio: Nome: nº Professor: CHARLES 3ª SÉRIE E.M. Data: / /2013 TURMA: EXERCÍCIOS QUÍMICA 2º trimestre 1) A tabela seguinte contém os pontos de ebulição (P.E.), a 1 atm, medidos
Sem limite para crescer Colégio: Nome: nº Professor: CHARLES 3ª SÉRIE E.M. Data: / /2013 TURMA: EXERCÍCIOS QUÍMICA 2º trimestre 1) A tabela seguinte contém os pontos de ebulição (P.E.), a 1 atm, medidos
Final 10 de Maio de 2008
 Final 10 de Maio de 2008 Prova Teórica Nome:.... Escola:....... Pergunta Total Problema 1 Problema 2 Problema 3 Questões Classificação teórica Classificação prática Classificação final universidade de
Final 10 de Maio de 2008 Prova Teórica Nome:.... Escola:....... Pergunta Total Problema 1 Problema 2 Problema 3 Questões Classificação teórica Classificação prática Classificação final universidade de
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 2
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/14 Págs. Duração da prova: 120 minutos 2005 1.ª FASE PROVA
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/14 Págs. Duração da prova: 120 minutos 2005 1.ª FASE PROVA
EXERCÍCIOS. Química 11. e problemas Exames Testes intermédios Professor Luís Gonçalves
 Química 11 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 Unidade 1 Controlo
Química 11 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 Unidade 1 Controlo
2º Trimestre Sala de Estudo Data: 22/05/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 2º Trimestre Sala de Estudo Data: 22/05/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Cálculo Estequiométrico Avançado Questão 01 - (UFRR/2017) O produto vendido comercialmente como
2º Trimestre Sala de Estudo Data: 22/05/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Cálculo Estequiométrico Avançado Questão 01 - (UFRR/2017) O produto vendido comercialmente como
2ª série EM - Lista de Questões para a RECUPERAÇÃO FINAL - QUÍMICA
 ª série EM - Lista de Questões para a RECUPERAÇÃ FINAL - QUÍMICA 1 01. Considere a seguinte equação termoquímica Para a formação de,0 mols de NH (g) pergunta-se: a) Haverá o consumo de quantos mols de
ª série EM - Lista de Questões para a RECUPERAÇÃ FINAL - QUÍMICA 1 01. Considere a seguinte equação termoquímica Para a formação de,0 mols de NH (g) pergunta-se: a) Haverá o consumo de quantos mols de
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 3
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 4
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 1
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 A quantidade de Na 2 CO 3.10H 2
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 A quantidade de Na 2 CO 3.10H 2
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 2
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considere que, a 25 o C, temos
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considere que, a 25 o C, temos
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
Nome: Ano: Turma: Nº.: Duração da prova: 60 minutos
 PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova B Nome: Ano: Turma: Nº.: Data:
PGA - Prova Global do Agrupamento Direção de Serviços Região Algarve Agrupamento de Escolas Silves Sul Departamento de Ciências Físicas e Naturais Físico Química 8º Ano Prova B Nome: Ano: Turma: Nº.: Data:
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
Escola Secundária de Lagoa. Correção da Ficha de Trabalho 14. Física e Química A pontos
 Escola Secundária de Lagoa Física e Química A 10º Ano Turmas A e B Paula Silva e Emília Correia Correção da Ficha de Trabalho 14 2014/2015 1. 1.1.. 12 pontos O buraco da camada de ozono consiste na baixa
Escola Secundária de Lagoa Física e Química A 10º Ano Turmas A e B Paula Silva e Emília Correia Correção da Ficha de Trabalho 14 2014/2015 1. 1.1.. 12 pontos O buraco da camada de ozono consiste na baixa
Qui. Professores: Allan Rodrigues Xandão Monitor: Renan Micha
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 2
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 2005 2.ª FASE PROVA
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 2005 2.ª FASE PROVA
Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um:
![Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um: Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um:](/thumbs/65/52626462.jpg) Olimpíada Brasileira de Química - 2003 Exame nacional - fase III MODALIDADE A PARTE I: QUESTÕES MÚLTIPLA ESCOLHA 1) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto,
Olimpíada Brasileira de Química - 2003 Exame nacional - fase III MODALIDADE A PARTE I: QUESTÕES MÚLTIPLA ESCOLHA 1) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto,
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas.
 A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
LABORATÓRIO DE QUÍMICA QUI126 2ª LISTA DE EXERCÍCIOS
 Exercício 1. (UFMG, Adapt.) O rótulo de uma garrafa de vinagre indica que a concentração de ácido acético (CH3COOH) é 42g/L. A fim de verificar se a concentração da solução ácida corresponde à indicada
Exercício 1. (UFMG, Adapt.) O rótulo de uma garrafa de vinagre indica que a concentração de ácido acético (CH3COOH) é 42g/L. A fim de verificar se a concentração da solução ácida corresponde à indicada
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Equilíbrios químicos Equilíbrios iônicos Recuperação do 3 Bimestre disciplina Química 2ºano Lista de exercícios - (PUC-SP) O metanol (CH 3 OH) é um combustível
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Equilíbrios químicos Equilíbrios iônicos Recuperação do 3 Bimestre disciplina Química 2ºano Lista de exercícios - (PUC-SP) O metanol (CH 3 OH) é um combustível
EXAME NACIONAL DO ENSINO SECUNDÁRIO VERSÃO 1
 EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 1.ª FASE 2003 2.ª
EXAME NACIONAL DO ENSINO SECUNDÁRIO 12.º Ano de Escolaridade (Decreto-Lei n.º 286/89, de 29 de Agosto) Cursos Gerais Agrupamentos 1 e 2 PROVA 142/12 Págs. Duração da prova: 120 minutos 1.ª FASE 2003 2.ª
(aq) + H 3 O + (aq) K 1 = 1,0 x (aq) + H 3 O + (aq) K 2 = 1,0 x 10-11
 Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Escola Secundária de Lagoa. Ficha de Trabalho 5. Física e Química A 11º Ano Paula Melo Silva. 1. Considere a molécula de metano.
 Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva Ficha de Trabalho 5 Química 10ºano 1. Considere a molécula de metano. 1.1. Calcule o número de moléculas de metano, CH 4, presentes
Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva Ficha de Trabalho 5 Química 10ºano 1. Considere a molécula de metano. 1.1. Calcule o número de moléculas de metano, CH 4, presentes
Lista de exercícios de Química nº 10
 Nome: nº: Bimestre: 3º Ano/série: 3ª série Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: / / Lista de exercícios de Química nº 10 Revisão dos principais tópicos sobre Equilíbrio
Nome: nº: Bimestre: 3º Ano/série: 3ª série Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: / / Lista de exercícios de Química nº 10 Revisão dos principais tópicos sobre Equilíbrio
Como fonte, pode ser usado o livro texto, livros didáticos de química e textos de química.
 Aluno (a): Disciplina QUÍMICA Curso Professor ESINO MÉDIO GUILHERME ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO Série 2ª Série Número: 1 - Conteúdo: Gases Lei do gás ideal Misturas Gasosas Relações estequiométricas
Aluno (a): Disciplina QUÍMICA Curso Professor ESINO MÉDIO GUILHERME ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO Série 2ª Série Número: 1 - Conteúdo: Gases Lei do gás ideal Misturas Gasosas Relações estequiométricas
O hidrogênio é usado na fabricação de inúmeros produtos importantes:
 Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
O diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura.
 13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
Prova de Avaliação de Capacidade e Prova Específica de Avaliação de Conhecimentos n.º 1 do artigo 6.º do Regulamento dos TeSP da UAlg.
 Prova de Avaliação de Capacidade e Prova Específica de Avaliação de Conhecimentos n.º 1 do artigo 6.º do Regulamento dos TeSP da UAlg. Prova Escrita de Química Prova Modelo Duração da Prova: 90 minutos.
Prova de Avaliação de Capacidade e Prova Específica de Avaliação de Conhecimentos n.º 1 do artigo 6.º do Regulamento dos TeSP da UAlg. Prova Escrita de Química Prova Modelo Duração da Prova: 90 minutos.
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
3ª Ficha de Avaliação de Conhecimentos Turma: 10ºA. Física e Química A - 10ºAno
 3ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A - 10ºAno Professora Paula Melo Silva Data: 4 fevereiro 2015 Ano Letivo: 2014/2015 135 min 1. A água é uma substância vital para qualquer
3ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A - 10ºAno Professora Paula Melo Silva Data: 4 fevereiro 2015 Ano Letivo: 2014/2015 135 min 1. A água é uma substância vital para qualquer
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos
 Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
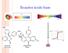
44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III
 22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
