Prova 3 - Química ... GABARITO 4. N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: Química. UEM Comissão Central do Vestibular Unificado
|
|
|
- Alana Van Der Vinne Henriques
- 7 Há anos
- Visualizações:
Transcrição
1 Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta fixada em sua carteira. 2. Confira se o número do gabarito deste caderno corresponde ao constante na etiqueta fixada em sua carteira. Se houver divergência, avise, imediatamente, o fiscal. 3. É proibido folhear o Caderno de Questões antes do sinal, às 9 horas. 4. Após o sinal, confira se este caderno contém 40 questões objetivas e/ou qualquer tipo de defeito. Qualquer problema, avise, imediatamente, o fiscal. 5. O tempo mínimo de permanência na sala é de 2 horas e 30 minutos, após o início da resolução da prova. 6. No tempo destinado a esta prova (4 horas), está incluso o de preenchimento da Folha de Respostas. 7. Transcreva as respostas deste caderno para a Folha de Respostas. A resposta para cada questão será a soma dos números associados às alternativas corretas. Portanto, preencha sempre dois alvéolos: um na coluna das dezenas e um na coluna das unidades, conforme o exemplo ao lado: questão 13, resposta 09 (soma, no exemplo, das alternativas corretas, 01 e 08). 8. Este Caderno de Questões não será devolvido. Assim, se desejar, transcreva as respostas deste caderno no Rascunho para Anotação das Respostas, constante abaixo, e destaque-o para recebê-lo amanhã, ao término da prova. 9. Ao término da prova, levante o braço e aguarde atendimento. Entregue ao fiscal este caderno, a Folha de Respostas, o Rascunho para Anotação das Respostas. 10. São de responsabilidade do candidato a leitura e a conferência de todas as informações contidas no Caderno de Questões e na Folha de Respostas. Corte na linha pontilhada.... RASCUNHO PARA ANOTAÇÃO DAS RESPOSTAS PROVA 3 VERÃO 2014 N ọ DE ORDEM: NOME: UEM Comissão Central do Vestibular Unificado
2 2 Vestibular de Verão/2014 Prova 3
3 Questão 01 QUÍMICA A respeito dos polímeros etilênicos, assinale a(s) alternativa(s) correta(s). 01) O polietileno é produzido a partir do monômero acetileno por meio de uma reação de substituição. 02) Os polímeros de adição apresentam todas as cadeias poliméricas com mesmo valor de massa molecular. 04) No poliestireno o anel aromático faz parte da cadeia principal do polímero. 08) O polipropileno pode ser produzido a partir dos monômeros propileno ou 1,3-dimetilbutadieno, em uma reação de condensação. 16) O teflon é produzido a partir do tetrafluoretileno, em uma reação de adição. Questão 03 A respeito de reações de oxidação e redução de compostos orgânicos, assinale a(s) alternativa(s) correta(s). 01) O número de oxidação do carbono em compostos orgânicos pode variar de -4 a +4, dependendo da eletronegatividade dos elementos ligados a esse átomo de carbono. 02) Uma solução de permanganato de potássio concentrado em meio ácido oxida a molécula de 2-buteno a 2,3-butanodiol. 04) Uma solução de dicromato de potássio concentrado em meio ácido oxida álcoois primários a ácido carboxílico e álcoois secundários a cetonas. 08) Aldeídos podem ser oxidados a ácido carboxílico mesmo em soluções oxidantes fracas, como podem ser reduzidos a álcoois primários em solução redutora. 16) O ácido butanodioico pode ser produzido a partir do ciclobutano em solução de HNO 3 concentrado. Questão 02 A respeito de gorduras, óleos vegetais, biodiesel, ácidos graxos e sabões, assinale a(s) alternativa(s) correta(s). 01) As gorduras trans são produzidas a partir de um processo de oxidação catalítica. 02) Sabões podem ser produzidos a partir de uma reação ácido-base entre uma base forte e um ácido graxo. 04) As gorduras de origem animal são constituídas essencialmente de ácidos graxos saturados, e os óleos vegetais apresentam cadeias saturadas, monoinsaturadas e poli-insaturadas. 08) Óleos vegetais poli-insaturados são sólidos e a partir do processo de hidrogenação se tornam líquidos, em temperatura ambiente. 16) A partir de uma reação de transesterificação é possível produzir biodiesel. Para isso, reage-se um óleo vegetal na presença de um álcool de cadeia curta e de um catalisador. 3
4 Questão 04 Assinale a(s) alternativa(s) correta(s) a respeito de reações de substituição em alcanos e aromáticos. 01) A reação de cloração do metilbutano apresentará uma única molécula orgânica como produto final. 02) Moléculas que apresentam carbonos primários e terciários apresentarão maior grau de substituição por bromação no carbono primário. 04) Na halogenação de aromáticos é necessário o uso de catalisadores como o AlCl 3 ou o FeBr 3. 08) A halogenação de alcanos ocorre por meio da formação de radicais livres, e estes são formados a partir de irradiação com luz de frequência adequada ou por aquecimento. 16) O ácido sulfúrico fumegante é utilizado na sulfonação de aromáticos, e o ácido sulfúrico concentrado age como catalisador na reação de nitração de aromáticos em presença de ácido nítrico. Questão 06 O rótulo de um produto químico orgânico puro aponta a fórmula estrutural C 18 NO 2 Cl, sendo que o número de hidrogênios presentes estava rasurado. Baseando-se nessa fórmula, assinale a(s) alternativa(s) correta(s) quanto à descrição das possíveis funções orgânicas dessa molécula. 01) A molécula pode ser aromática e apresentar função ácido carboxílico. 02) A molécula pode apresentar ao mesmo tempo função cetona e função amida. 04) Quanto maior o número de insaturações na molécula, menor será o número de átomos de hidrogênio na fórmula estrutural. 08) O cloro pode estar presente na molécula como um heteroátomo ou fazendo parte de uma função cloreto de acila. 16) A molécula pode apresentar uma função amina e uma função éster. Questão 05 Observe a lista de moléculas orgânicas abaixo e assinale a(s) alternativa(s) correta(s) a respeito da isomeria. butan-1-ol, isopropanol, éter dietílico, propanona, n-propanol, ciclopropano, propanal, propeno, metóxipropano, 1,2-dicloroeteno. 01) O propanol e o propanal são isômeros de cadeia. 02) Há pelo menos 2 pares de moléculas que podem ser classificados como isômeros funcionais. 04) Somente uma molécula pode apresentar isomeria geométrica. 08) As moléculas butan-1-ol, éter dietílico e metóxipropano podem ser classificadas, duas a duas, como isômeros de função duas vezes, e como metâmeros uma vez. 16) Nenhuma das moléculas apresenta isomeria óptica. 4
5 Questão 07 Uma garrafa metálica aberta, de volume interno de 1 (um) litro, é colocada em um sistema onde sua temperatura pode ser alterada (aquecida ou resfriada), sem que seu volume interno se altere. Assinale a(s) afirmação(ões) correta(s) sobre esse sistema, inicialmente colocado na temperatura de 27 o C, nos experimentos descritos abaixo, realizados ao nível do mar, onde a pressão atmosférica é 1,0 atm, ou na cidade de La Paz, na Bolívia, onde a pressão atmosférica é de ~0,75 atm. Dados: R = 0,082 (atm.litro)/(mol.k). 01) Tanto ao nível do mar como em La Paz, constatou-se que a quantidade de gás dentro da garrafa diminui com o seu aquecimento. 02) Ao se aquecer a garrafa ao nível do mar até 127 o C, a quantidade de ar dentro da garrafa será aproximadamente igual à quantidade de ar dentro da garrafa colocada em La Paz na temperatura de 27 o C. 04) Tanto ao nível do mar como em La Paz, ao se aquecer a garrafa até a temperatura de 250 o C, tampála e resfriá-la à temperatura ambiente, a pressão do gás no interior da garrafa será menor do que a pressão atmosférica. 08) Na temperatura de 0 o C, o número de moléculas de ar no interior da garrafa colocada ao nível do mar ou colocada na cidade de La Paz é idêntico. 16) O número de moléculas de ar dentro da garrafa a 27 o C dividido pelo número de moléculas de ar dentro da garrafa a 227 o C não será o mesmo para experimentos feitos ao nível do mar ou em La Paz. Questão 09 Na formação das moléculas de ácido clorídrico, ácido hipocloroso, ácido clórico e de ácido perclórico podem participar os isótopos de 1 H, 2 H, 3 H, 16 O, 17 O, 18 O, 35 Cl e 37 Cl. Com relação às massas moleculares das moléculas formadas, assinale o que for correto: 01) A menor massa molecular é 36u e a maior massa molecular é 112u. 02) A massa molecular do ácido hipocloroso pode variar entre 52u e 58u. 04) As moléculas de 2 H 35 Cl 17 O e 1 H 37 Cl 16 O apresentam número de nêutrons totais diferente. 08) O número de prótons em moléculas de ácido perclórico com diferentes massas moleculares é o mesmo. 16) Compostos de mesma fórmula molecular, mas com massa molecular diferente, apresentam o mesmo número de elétrons e número de nêutrons diferente. Questão 08 Considerando os tipos de cadeias carbônicas, assinale o que for correto. 01) A molécula de éter dietílico apresenta cadeia aberta, somente carbonos primários, e não possui heteroátomo. 02) A molécula de terc-butanol apresenta carbonos primário e terciário, cadeia aberta, e não apresenta heteroátomo na cadeia carbônica. 04) A molécula de 3-etil-non-4-en-5-ol é acíclica, ramificada, insaturada e homogênea. 08) A molécula de fenol apresenta anel benzênico e cadeia heterogênea. 16) É possível construir quatro moléculas diferentes numa estrutura carbônica que possui oito átomos de carbono e que apresenta um anel benzênico, sendo que essas moléculas são isômeros. 5
6 Questão 10 Assinale a(s) alternativa(s) correta(s). 01) Os processos mecânicos de separação, levigação e peneiramento têm como princípios de funcionamento, respectivamente, a diferença de densidade e a diferença de tamanho entre partículas sólidas. 02) Uma mistura azeotrópica entre água e etanol não pode ser separada por destilação simples, mas sim por destilação fracionada. 04) Numa torre de destilação fracionada de petróleo, os gases são retirados na parte superior da torre, e óleos pesados e asfalto, na parte inferior. 08) A recristalização é uma técnica de purificação de substâncias sólidas que leva em consideração a solubilidade da substância em função da temperatura do meio na qual está dissolvida. 16) A liquefação pode ser usada para extrair nitrogênio líquido do ar atmosférico. Questão 12 Sobre os conceitos de cinética química, assinale o que for correto. 01) A reação 2A + D A 2 D é classificada como elementar se v = k [A] 2 [D]. 02) Se a velocidade da reação 2A + 2D E + G duplicar ao duplicar-se [A], mantendo-se [D] constante, então a reação é de segunda ordem em relação a A. 04) Se a reação global CaO + CO 2 CaCO 3 possuir a etapa intermediária lenta Ca(OH) 2 CaO + H 2 O, então a lei de velocidade é v = k [CaO] 2 [CO 2 ][H 2 O]. 08) Considerando que a reação N 2 + O 2 2NO é elementar, sua molecularidade é igual a 2. 16) É possível aumentar o rendimento da reação N 2(g) + 3H 2(g) 2NH 3(g) ( H < 0) combinando-se um aumento da temperatura e da pressão do sistema, pois esse procedimento, feito com valores adequados de temperatura e pressão, afeta, neste caso, de forma favorável, o balanço entre a cinética e o equilíbrio químico da reação. Questão 11 Considere uma pilha formada por eletrodos de manganês e de ferro imersos em soluções aquosas, respectivamente de sais de Mn 2+ e Fe 3+ (1 mol/litro a 25 o C, usando uma ponte salina), e assinale o que for correto. Dados: Mn 2+ (aq) + 2e Mn (s) E 0 red = -1,18 V Fe 3+ (aq) + 3e Fe (s) E 0 red = -0,04 V 01) A força eletromotriz da pilha é -1,04 V. 02) O ânodo da pilha é o manganês. 04) No eletrodo de ferro ocorre uma semirreação de redução. 08) A pilha pode ser representada por: Mn 0 (s) Mn 2+ (aq) Fe 3+ (aq) Fe 0 (s) 16) A reação global de funcionamento da pilha é uma reação reversível e, portanto, ao atingir o equilíbrio, a voltagem da pilha será igual a zero. 6
7 Questão 13 Assinale o que for correto. 01) Se a solubilidade de um sal hipotético AB 2, que se dissocia segundo a equação abaixo, é 1 x 10-4 mol/litro, então seu produto de solubilidade é 4 x (mol/litro) 3. AB 2 AB + B 02) Sob pressão constante, a entalpia de uma reação pode variar em função da variedade alotrópica ou do estado de agregação, pois estas diferentes formas possuem diferentes conteúdos de energia. 04) De acordo com a reação abaixo, considerando H = 136 kcal/mol, a entalpia padrão de formação da água líquida é igual a 68 kcal/mol. 2H 2 O (l) 2H 2(g) + O 2(g) 08) Nos casos em que não é possível medir diretamente a entalpia de formação de uma substância, podemos utilizar dados de equações termoquímicas intermediárias, aplicando-se a Lei de Hess. 16) A energia da ligação H-H equivale a 436 kj/mol. Isso significa que para separar 1 mol de ligações entre átomos de hidrogênio, no estado gasoso e em condições padrão, é necessário fornecer 436 kj de energia ao sistema. Questão 14 Assinale o que for correto. 01) A força de um ácido está diretamente associada com o número de átomos de hidrogênio em sua molécula. Portanto, o ácido ortofosfórico é mais forte do que o ácido sulfúrico. 02) Quando se faz borbulhar cloro gasoso em uma solução aquosa de NaBr, forma-se cloreto de sódio na solução e há liberação de bromo. Este é um exemplo de uma reação de deslocamento. 04) A concentração, em quantidade de matéria por massa, de uma solução preparada pela dissolução de 2 gramas de NaOH em 200 mililitros de água é de 0,00025 mols/kg. Dados: densidade da água = 1,0 grama/mililitro. 08) A mistura de 150 mililitros de uma solução aquosa de HCl de concentração 0,1 mol/litro com 350 mililitros de uma solução aquosa de NaOH de concentração 0,2 mol/litro resulta em uma solução de concentração igual a aproximadamente 0,03 mol/litro em NaCl. 16) Uma solução coloidal pode ter sua fase dispersa separada de sua fase de dispersão utilizando-se ultrafiltros. Questão 15 A respeito de equilíbrio químico e equilíbrio iônico, assinale a(s) alternativa(s) correta(s). 01) Quanto maior for o valor da constante de equilíbrio de uma reação, maior será a velocidade dessa reação no sentido direto comparada à velocidade no sentido inverso. 02) O poh de uma solução 0,001 mol/litro de um ácido que possui constante de ionização igual a 10% é igual a ) O cianeto de potássio é um sal que, em meio aquoso, pode sofrer uma hidrólise básica e, portanto, originar uma solução aquosa básica. 08) Sob pressão constante, o rendimento da produção de HCl (g) em uma reação exotérmica partindo-se de H 2(g) e Cl 2(g) pode ser aumentado a partir da elevação da temperatura do sistema. 16) Em uma reação em equilíbrio hipotética que contém A (aq) e D (aq) como reagentes e E (aq) como produto, um aumento da concentração de D (aq), mantendo-se a pressão e a temperatura constantes, provoca uma elevação no valor da constante de equilíbrio, pois há um aumento da concentração do produto E (aq). 7
8 Questão 16 A respeito da estrutura das moléculas orgânicas e dos orbitais híbridos, assinale a(s) alternativa(s) correta(s). 01) A ligação C-H na molécula de metano envolve um orbital híbrido do tipo sp 3 do carbono e um orbital tipo s do hidrogênio. 02) Uma hibridização do tipo sp 2 envolve um orbital atômico do tipo s e dois orbitais atômicos do tipo p. 04) Na molécula de etileno ocorre uma hibridização do átomo de carbono do tipo sp. 08) Tanto na grafite quanto no diamante, as hibridizações do átomo de carbono são do tipo sp 3. 16) A molécula de CO 2 é linear porque os orbitais híbridos do tipo sp do átomo de carbono são lineares, e não há influência de pares de elétrons não compartilhados. Questão 18 Assinale o que for correto. 01) Os números quânticos de spin variam de l a +l, passando por zero. 02) O número quântico magnético indica a energia do elétron no subnível. 04) O número quântico principal indica a energia do elétron no orbital. 08) O movimento do elétron ao redor do núcleo atômico gera um campo magnético externo, e o movimento do elétron em torno de seu próprio eixo gera outro campo magnético. 16) A região de máxima probabilidade de se encontrar o elétron em um subnível s é uma região esférica. Questão 17 A respeito das propriedades periódicas dos elementos, assinale a(s) alternativa(s) correta(s). 01) A reatividade química dos metais aumenta com o caráter metálico crescente. 02) Os elementos químicos de maior densidade estão localizados na região central inferior da tabela periódica, onde estão o ósmio, o irídio e a platina. 04) Os elementos que possuem os maiores volumes atômicos são os metais alcalinos, seguidos dos gases nobres. 08) Quanto menor for o raio atômico, mais próximo estará o elétron do núcleo e, portanto, maior será a energia necessária para removê-lo. 16) Em uma mesma família da tabela periódica, a afinidade eletrônica cresce de cima para baixo. 8
9 Questão 19 Assinale o que for correto. 01) Átomos de um mesmo elemento químico podem ter o número de massa diferente em consequência do diferente número de nêutrons. 02) Elemento químico é um conjunto de átomos no qual cada átomo possui o mesmo número de prótons. 04) Por terem igual número de prótons e igual número de elétrons, os isótopos de um mesmo elemento químico têm, em geral, propriedades físicas e químicas semelhantes, exceto pela massa e por certas características radioativas. 08) O isótopo do carbono mais abundante na natureza é o que contém o número de nêutrons igual a oito. 16) Isótopos são átomos de um mesmo elemento químico e possuem número atômico diferente. Questão 20 Sobre os principais fundamentos da teoria atômica de Dalton, assinale a(s) alternativa(s) correta(s). 01) A massa fixa de um elemento pode combinar-se com massas múltiplas de outro elemento para formar substâncias diferentes. 02) O átomo é semelhante a uma massa gelatinosa carregada positivamente, tendo cargas negativas espalhadas nessa massa. 04) A carga positiva de um átomo não está distribuída por todo o átomo, mas concentrada na região central. 08) Existem vários tipos de átomos e cada um constitui um elemento químico. Átomos de um mesmo elemento químico são idênticos, particularmente em seu peso. 16) Toda matéria é composta por átomos, que são partículas indivisíveis e não podem ser criados ou destruídos. 9
10 UEM Comissão Central do Vestibular Unificado
Prova 3 - Química ... GABARITO 1. N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: Química. UEM Comissão Central do Vestibular Unificado
 Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta
Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta
Prova 3 - Química ... GABARITO 2. N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: Química. UEM Comissão Central do Vestibular Unificado
 Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta
Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta
Prova 3 - Química ... GABARITO 3. N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: Química. UEM Comissão Central do Vestibular Unificado
 Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta
Prova 3 - QUESTÕES OBJETIIVAS N ọ DE ORDEM: N ọ DE INSCRIÇÃO: NOME DO CANDIDATO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, que constam na etiqueta
UFJF CONCURSO VESTIBULAR 2012 GABARITO DA PROVA DE QUÍMICA
 Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Estas aminas são bases de Lewis já que sobram elétrons no átomo de nitrogênio e como tal podem reagir com ácidos.
 01. Os compostos mostrados são respectivamente amina primária, amina secundária e amina terciária. O composto III, por não apresentar ligações (pontes) de hidrogênio, é o menos solúvel em água, tornando
01. Os compostos mostrados são respectivamente amina primária, amina secundária e amina terciária. O composto III, por não apresentar ligações (pontes) de hidrogênio, é o menos solúvel em água, tornando
Resolução da Prova de Química Vestibular Inverno UPF 2003 Prof. Emiliano Chemello
 Resolução da Prova de Química Vestibular Inverno UPF 2003 Professor Emiliano Chemello www.quimica.net/emiliano emiliano@quimica.net Questões Resoluções Os óxidos básicos (Oxigênio ligado a um metal de
Resolução da Prova de Química Vestibular Inverno UPF 2003 Professor Emiliano Chemello www.quimica.net/emiliano emiliano@quimica.net Questões Resoluções Os óxidos básicos (Oxigênio ligado a um metal de
Reação de neutralização:
 01 Reação de neutralização: Ácido entanodioico Hidróxido de sódio Etanoato de sódio Água (oxálico) 1 02 Deslocamento do hidrogênio: Propanoato de sódio (A) Neutralização: Propanoato de sódio (B) Liberação
01 Reação de neutralização: Ácido entanodioico Hidróxido de sódio Etanoato de sódio Água (oxálico) 1 02 Deslocamento do hidrogênio: Propanoato de sódio (A) Neutralização: Propanoato de sódio (B) Liberação
ONC 2016 FÍSICA - PROGRAMA OFICIAL PARA AS PROVAS
 ONC 2016 FÍSICA - PROGRAMA OFICIAL PARA AS PROVAS Os estudantes deverão conhecer e utilizar, preferencialmente, as unidades do Sistema Internacional de Unidades (SI) com seus múltiplos e submúltiplos.
ONC 2016 FÍSICA - PROGRAMA OFICIAL PARA AS PROVAS Os estudantes deverão conhecer e utilizar, preferencialmente, as unidades do Sistema Internacional de Unidades (SI) com seus múltiplos e submúltiplos.
CURSO APOIO QUÍMICA RESOLUÇÃO
 QUÍMICA CURSO APOIO 15. O sulfato de sódio é um composto utilizado na indústria de celulose e na fabricação de detergentes. Por apresentar grande afinidade por água, pode ser encontrado na forma de um
QUÍMICA CURSO APOIO 15. O sulfato de sódio é um composto utilizado na indústria de celulose e na fabricação de detergentes. Por apresentar grande afinidade por água, pode ser encontrado na forma de um
CONHECIMENTOS ESPECÍFICOS
 A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram
VI Olimpíada Norte - Nordeste de Química e
 VI Olimpíada Norte - Nordeste de Química e Seletiva para a Olimpíada Ibero-americana de Química - 2000 Exame aplicado em 27.05.2000 Somente as questões de números 1 a 6 serão consideradas na composição
VI Olimpíada Norte - Nordeste de Química e Seletiva para a Olimpíada Ibero-americana de Química - 2000 Exame aplicado em 27.05.2000 Somente as questões de números 1 a 6 serão consideradas na composição
ferro bromo brometo de ferro 40g 120g 0g 12g 0g 148g 7g 40g 0g 0g x g 37g
 01) (FCMSC-SP) A frase: Do nada, nada; em nada, nada pode transformar-se relaciona-se com as idéias de: a) Dalton. b) Proust. c) Boyle. d) Lavoisier. e) Gay-Lussac. 02) Acerca de uma reação química, considere
01) (FCMSC-SP) A frase: Do nada, nada; em nada, nada pode transformar-se relaciona-se com as idéias de: a) Dalton. b) Proust. c) Boyle. d) Lavoisier. e) Gay-Lussac. 02) Acerca de uma reação química, considere
3. Misturas, Substâncias Simples e Compostas e Processos de Separação de Misturas.
 Conteúdo I. 1. Elementos, modelos atômicos e representações: modelos atômicos de Dalton, Tomson, Rutherford-Bohr. Elemento químico. Número atômico e número de massa. Prótons, elétrons e nêutrons. Distribuição
Conteúdo I. 1. Elementos, modelos atômicos e representações: modelos atômicos de Dalton, Tomson, Rutherford-Bohr. Elemento químico. Número atômico e número de massa. Prótons, elétrons e nêutrons. Distribuição
Modelos atômicos. Modelo de Bohr
 Modelos atômicos Modelo de Bohr O modelo de Bohr apresenta limitações significativas, não servindo para explicar vários dos fenômenos nos quais estão envolvidos elétrons. As deficiências do modelo de Bohr
Modelos atômicos Modelo de Bohr O modelo de Bohr apresenta limitações significativas, não servindo para explicar vários dos fenômenos nos quais estão envolvidos elétrons. As deficiências do modelo de Bohr
EXAME 2014. Questões Objetivas
 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) A alternativa que contém o elemento de maior raio atômico é a: A) Na B)
Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) A alternativa que contém o elemento de maior raio atômico é a: A) Na B)
mais vapores do vinho. É, portanto, uma mistura homogênea.
 Resolução das atividades complementares Química p. I. Falsa. As amostras A e B contêm a mesma substância (naftalina). Essas amostras se fundem, portanto, na mesma temperatura. II. Falsa. A temperatura
Resolução das atividades complementares Química p. I. Falsa. As amostras A e B contêm a mesma substância (naftalina). Essas amostras se fundem, portanto, na mesma temperatura. II. Falsa. A temperatura
DESAFIO EM QUÍMICA 03/10/15
 DESAFIO EM QUÍMICA 03/10/15 Nome: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 1,0 4 a 1,0 5 a 2,0 6 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas questões e derivações.
DESAFIO EM QUÍMICA 03/10/15 Nome: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 1,0 4 a 1,0 5 a 2,0 6 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas questões e derivações.
UNIVERSIDADE ESTADUAL DE PONTA GROSSA COMISSÃO PERMANENTE DE SELEÇÃO 2 o CONCURSO VESTIBULAR DE 2009. Questões de Química
 UNIVERSIDADE ESTADUAL DE PONTA GROSSA COMISSÃO PERMANENTE DE SELEÇÃO 2 o CONCURSO VESTIBULAR DE 2009 Questões de Química 01 O gráfico abaixo registra o aquecimento de um líquido transparente e incolor,
UNIVERSIDADE ESTADUAL DE PONTA GROSSA COMISSÃO PERMANENTE DE SELEÇÃO 2 o CONCURSO VESTIBULAR DE 2009 Questões de Química 01 O gráfico abaixo registra o aquecimento de um líquido transparente e incolor,
PROCESSO DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UFS 2014.1 GABARITO
 PROCESSO DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UFS 2014.1 GABARITO Questão 1) Para o composto sólido de C: 1 mol = 12 g. d = m / V = 12 g / 5,0 cm 3 = 2,4 g cm -3 Para o composto sólido
PROCESSO DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UFS 2014.1 GABARITO Questão 1) Para o composto sólido de C: 1 mol = 12 g. d = m / V = 12 g / 5,0 cm 3 = 2,4 g cm -3 Para o composto sólido
REGULAMENTO DA OLIMPÍADA ALAGOANA DE QUÍMICA 2014
 REGULAMENTO DA OLIMPÍADA ALAGOANA DE QUÍMICA 2014 Art. 1 o - A Olimpíada Alagoana de Química 2014 (OALQ 2014), evento integrante do Programa Nacional Olimpíadas de Química, é uma promoção da Coordenação
REGULAMENTO DA OLIMPÍADA ALAGOANA DE QUÍMICA 2014 Art. 1 o - A Olimpíada Alagoana de Química 2014 (OALQ 2014), evento integrante do Programa Nacional Olimpíadas de Química, é uma promoção da Coordenação
É o cálculo das quantidades de reagentes e/ou produtos das reações químicas.
 Estequiometria Introdução Estequiometria É derivada da palavra grega STOICHEON (elemento) e METRON (medida) significa medida dos elementos químicos", ou ainda medir algo que não pode ser dividido. É o
Estequiometria Introdução Estequiometria É derivada da palavra grega STOICHEON (elemento) e METRON (medida) significa medida dos elementos químicos", ou ainda medir algo que não pode ser dividido. É o
02. (UNIRIO-RJ) O trinitrotolueno, ou TNT, um explosivo muito conhecido, apresenta a seguinte fórmula:
 I. Recomendações: 01. Caderno ou Bloco Móbi le. 02. Ser feita a mão e individualmente. 03. Não é necessário copiar o enunciado. 04. Não será aceito só a resposta. Tem que ter a resolução dos exercícios.
I. Recomendações: 01. Caderno ou Bloco Móbi le. 02. Ser feita a mão e individualmente. 03. Não é necessário copiar o enunciado. 04. Não será aceito só a resposta. Tem que ter a resolução dos exercícios.
Lista de Exercícios Química Geral Entropia e energia livre
 Lista de Exercícios Química Geral Entropia e energia livre 1. Se a reação A + B C tiver uma constante de equilíbrio maior do que 1, qual das seguintes indicações está correta? a) A reação não é espontânea.
Lista de Exercícios Química Geral Entropia e energia livre 1. Se a reação A + B C tiver uma constante de equilíbrio maior do que 1, qual das seguintes indicações está correta? a) A reação não é espontânea.
Reações orgânicas Oxidação - Ozonólise - Oxidação branda e enérgica
 Reações orgânicas Oxidação - Ozonólise - Oxidação branda e enérgica Enunciado dos exercícios de 01 a 04: Dê as equações orgânicas que representam a ozonólise em presença de água dos seguintes compostos.
Reações orgânicas Oxidação - Ozonólise - Oxidação branda e enérgica Enunciado dos exercícios de 01 a 04: Dê as equações orgânicas que representam a ozonólise em presença de água dos seguintes compostos.
1 a QUESTÃO: (2,0 pontos) Avaliador Revisor
 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Calcule o ph de uma solução de H 2 SO 4(aq) 0,010 M a 25 o C. Considere que: K a1 = (muito grande) e, K = 1,2 x 102 a2 (pk a = 1,92) Dados: log 2 0,30 ; log
1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Calcule o ph de uma solução de H 2 SO 4(aq) 0,010 M a 25 o C. Considere que: K a1 = (muito grande) e, K = 1,2 x 102 a2 (pk a = 1,92) Dados: log 2 0,30 ; log
I OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 13/06/2015 ENSINO MÉDIO - FASE 2
 I OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 13/06/2015 ENSINO MÉDIO - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada), cada uma com 4
I OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 13/06/2015 ENSINO MÉDIO - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada), cada uma com 4
OLIMPÍADA PIAUIENSE DE QUÍMICA - 2014 Modalidade EF
 OLIMPÍADA PIAUIENSE DE QUÍMICA - 2014 Modalidade EF INSTRUÇÕES 1 Esta prova contém oito questões no total, sendo duas questões abertas e seis questões de múltipla escolha. 2 Antes de iniciar a prova, confira
OLIMPÍADA PIAUIENSE DE QUÍMICA - 2014 Modalidade EF INSTRUÇÕES 1 Esta prova contém oito questões no total, sendo duas questões abertas e seis questões de múltipla escolha. 2 Antes de iniciar a prova, confira
Concurso de Seleção 2004 NÚMERO DE INSCRIÇÃO - QUÍMICA
 QUÍMICA QUESTÃO 21 Muitas pessoas já ouviram falar de gás hilariante. Mas será que ele é realmente capaz de provocar o riso? Na verdade, essa substância, o óxido nitroso (N 2 O), descoberta há quase 230
QUÍMICA QUESTÃO 21 Muitas pessoas já ouviram falar de gás hilariante. Mas será que ele é realmente capaz de provocar o riso? Na verdade, essa substância, o óxido nitroso (N 2 O), descoberta há quase 230
www.professormazzei.com FUNÇÕES INORGÂNICAS Folha 02 João Roberto Fortes Mazzei
 01. Durante um experimento, seu professor de química pediu que você identificasse as soluções aquosas presentes em cada um dos béqueres (A, B, C) apresentados na figura a seguir. Dois béqueres do experimento
01. Durante um experimento, seu professor de química pediu que você identificasse as soluções aquosas presentes em cada um dos béqueres (A, B, C) apresentados na figura a seguir. Dois béqueres do experimento
Faculdade Pitágoras de Londrina Disciplina: Química Geral Prof. Me. Thiago Orcelli. Aluno:
 1 Faculdade Pitágoras de Londrina Disciplina:. Aluno: Turma: Exercícios de Fixação englobando conteúdos das Aulas 1-4. Orientação: Escolha um livro de Química Geral disponível na biblioteca e resolva os
1 Faculdade Pitágoras de Londrina Disciplina:. Aluno: Turma: Exercícios de Fixação englobando conteúdos das Aulas 1-4. Orientação: Escolha um livro de Química Geral disponível na biblioteca e resolva os
Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada
 1 Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada 1. Questões de estudo - Como preparar uma solução aquosa de NaOH 0,1 M? - Como preparar uma solução
1 Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada 1. Questões de estudo - Como preparar uma solução aquosa de NaOH 0,1 M? - Como preparar uma solução
Dicas de Química Tasso
 Dicas de Química Tasso Questão 01) Considere a reação química representada pela equação: 2Fe 2 S 3(s) + 6H 2 O (l) +3O 2(g) 4Fe(OH) 3(s) +6S (s) Calcule a quantidade de (em mols) de Fe(OH) 3 que pode ser
Dicas de Química Tasso Questão 01) Considere a reação química representada pela equação: 2Fe 2 S 3(s) + 6H 2 O (l) +3O 2(g) 4Fe(OH) 3(s) +6S (s) Calcule a quantidade de (em mols) de Fe(OH) 3 que pode ser
Química Prof. Rogério 2016. Química. Professor Rogério. Imagens meramente ilustrativas, domínio público sites diversos/internet
 Química Prof. Rogério 2016 Química Professor Rogério Imagens meramente ilustrativas, domínio público sites diversos/internet 1º MOMENTO - Propriedades básicas da matéria - Tabela periódica - Estrutura
Química Prof. Rogério 2016 Química Professor Rogério Imagens meramente ilustrativas, domínio público sites diversos/internet 1º MOMENTO - Propriedades básicas da matéria - Tabela periódica - Estrutura
ESTRUTURA ELETRÔNICA DOS ÁTOMOS
 ESTRUTURA ELETRÔNICA DOS ÁTOMOS MECÂNICA QUÂNTICA E OS ORBITAIS ATÔMICOS 1926 Físico austríaco Erwin Schrödinger Equação de onda de Schrödinger Incorpora tanto o comportamento ondulatório como o de partícula
ESTRUTURA ELETRÔNICA DOS ÁTOMOS MECÂNICA QUÂNTICA E OS ORBITAIS ATÔMICOS 1926 Físico austríaco Erwin Schrödinger Equação de onda de Schrödinger Incorpora tanto o comportamento ondulatório como o de partícula
Unidade 2 Substâncias e átomos
 Unidade 2 Substâncias e átomos Substâncias Puras pág. 51 A matéria é composta por uma ou mais substâncias químicas. Porém, é difícil saber se um corpo é composto por uma única substância ou por uma mistura
Unidade 2 Substâncias e átomos Substâncias Puras pág. 51 A matéria é composta por uma ou mais substâncias químicas. Porém, é difícil saber se um corpo é composto por uma única substância ou por uma mistura
Química Orgânica I. Ácidos e Bases, tipos de reações, intermediários de reações, termodinâmica e cinética de reações orgânicas.
 Química Orgânica I Ácidos e Bases, tipos de reações, intermediários de reações, termodinâmica e cinética de reações orgânicas Aula 4 (Parte I) Profa. Alceni Augusta Werle Profa Tânia Márcia Sacramento
Química Orgânica I Ácidos e Bases, tipos de reações, intermediários de reações, termodinâmica e cinética de reações orgânicas Aula 4 (Parte I) Profa. Alceni Augusta Werle Profa Tânia Márcia Sacramento
EXERCÍCIOS DE QUÍMICA 1º ENSINO MÉDIO. 01. Utilizando o esquema de Lewis, dê o íon-fórmula dos compostos constituídos por:
 EXERCÍCIOS DE QUÍMICA 1º ENSINO MÉDIO 01. Utilizando o esquema de Lewis, dê o íon-fórmula dos compostos constituídos por: a) Ca (Z = 20) e F (Z = 9) b) Na (Z = 11) e S (Z = 16) c) K (Z = 19) e O (Z = 8)
EXERCÍCIOS DE QUÍMICA 1º ENSINO MÉDIO 01. Utilizando o esquema de Lewis, dê o íon-fórmula dos compostos constituídos por: a) Ca (Z = 20) e F (Z = 9) b) Na (Z = 11) e S (Z = 16) c) K (Z = 19) e O (Z = 8)
Prova 3 Química. N ọ DE INSCRIÇÃO:
 Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
H 9. O Em relação à equação acima, que representa a obtenção ), é INCORRETO afirmar que: Cl 5 O C 14 + H 2
 QUÍMICA As questões 31 e 32, referem-se ao texto abaixo. RGANCLRADS Defensivos agrícolas para as indústrias. Agrotóxicos para os defensores da natureza. Pontos de vista diferentes sobre substâncias usadas
QUÍMICA As questões 31 e 32, referem-se ao texto abaixo. RGANCLRADS Defensivos agrícolas para as indústrias. Agrotóxicos para os defensores da natureza. Pontos de vista diferentes sobre substâncias usadas
Aula II - Tabela Periódica
 Aula II - Tabela Periódica Tutora: Marcia Mattos Pintos Rio Grande, 16 agosto de 2014. Revisão Átomo: Unidade fundamental da matéria; Partes do átomo: núcleo e eletrosfera. Carga Elétrica das partículas
Aula II - Tabela Periódica Tutora: Marcia Mattos Pintos Rio Grande, 16 agosto de 2014. Revisão Átomo: Unidade fundamental da matéria; Partes do átomo: núcleo e eletrosfera. Carga Elétrica das partículas
Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar. Reações Orgânicas
 Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar Disciplina: Química Orgânica Reações Orgânicas 1 Introdução: Inorgânicas Reações Químicas Orgânicas Reações rápidas,
Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar Disciplina: Química Orgânica Reações Orgânicas 1 Introdução: Inorgânicas Reações Químicas Orgânicas Reações rápidas,
Prova 3 Química. N ọ DE INSCRIÇÃO:
 Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Prova 3 Química. N ọ DE INSCRIÇÃO:
 Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Cálculo Químico ESTEQUIOMETRIA
 Cálculo Químico ESTEQUIOMETRIA Profº André Montillo www.montillo.com.br Definição: É o estudo da quantidade de reagentes e produtos em uma reação química, portanto é uma análise quantitativa de um fenômeno
Cálculo Químico ESTEQUIOMETRIA Profº André Montillo www.montillo.com.br Definição: É o estudo da quantidade de reagentes e produtos em uma reação química, portanto é uma análise quantitativa de um fenômeno
B H (g) 3 O ( ) 2 HBO (g) 2 H O( )
 Lista introdução estequiometria 1. (Uff 2012) Na natureza nada se cria, nada se perde, tudo se transforma é a definição do químico francês Antoine Lavoisier (1743-1794) para sua teoria de conservação da
Lista introdução estequiometria 1. (Uff 2012) Na natureza nada se cria, nada se perde, tudo se transforma é a definição do químico francês Antoine Lavoisier (1743-1794) para sua teoria de conservação da
Lista de Exercícios. Estudo da Matéria
 FACULDADE PITÁGORAS DE BETIM Credenciada pela portaria 792, de 27 de março de 2006. Curso: Engenharia Química Lista de Exercícios Disciplina: Química Geral Semestre: 2º / 2013 Docente: Carla Soares Souza
FACULDADE PITÁGORAS DE BETIM Credenciada pela portaria 792, de 27 de março de 2006. Curso: Engenharia Química Lista de Exercícios Disciplina: Química Geral Semestre: 2º / 2013 Docente: Carla Soares Souza
C o l é g i o R i c a r d o R o d r i g u e s A l v e s
 C o l é g i o R i c a r d o R o d r i g u e s A l v e s Educação Infantil - Ensino Fundamental I - Ensino Médio 1 TRIMESTRE Química 1ª Série do Ensino Médio Conteúdo Introdução a Química Átomo Molécula
C o l é g i o R i c a r d o R o d r i g u e s A l v e s Educação Infantil - Ensino Fundamental I - Ensino Médio 1 TRIMESTRE Química 1ª Série do Ensino Médio Conteúdo Introdução a Química Átomo Molécula
Lista de Exercícios Estequiometria
 Lista de Exercícios Estequiometria Átomos e Mols de Átomos Fonte: Química Geral, Vol. 1 John B. Russel 1. Calcule a massa atômica do elemento X, dado que 2,02 x l0 6 átomos de X têm uma massa de 1,70 x
Lista de Exercícios Estequiometria Átomos e Mols de Átomos Fonte: Química Geral, Vol. 1 John B. Russel 1. Calcule a massa atômica do elemento X, dado que 2,02 x l0 6 átomos de X têm uma massa de 1,70 x
t 1 t 2 Tempo t 1 t 2 Tempo
 Concentração 01)Uma reação química atinge o equilíbrio químico quando: a) ocorre simultaneamente nos sentidos direto e inverso. b) as velocidades das reações direta e inversa são iguais. c) os reatantes
Concentração 01)Uma reação química atinge o equilíbrio químico quando: a) ocorre simultaneamente nos sentidos direto e inverso. b) as velocidades das reações direta e inversa são iguais. c) os reatantes
HOMOGÊNEO HETEROGÊNEO
 Sistemas materiais HOMOGÊNEO SUBSTÂNCIA PURA? SIMPLES MISTURA HOMOGÊNEA? COMPOSTA SISTEMA? HETEROGÊNEO SUBSTÂNCIA PURA MISTURA HETEROGÊNEA Sistema É parte do universo físico f que contenha ou não matéria,
Sistemas materiais HOMOGÊNEO SUBSTÂNCIA PURA? SIMPLES MISTURA HOMOGÊNEA? COMPOSTA SISTEMA? HETEROGÊNEO SUBSTÂNCIA PURA MISTURA HETEROGÊNEA Sistema É parte do universo físico f que contenha ou não matéria,
1
 Níveis de dificuldade das Questões Fácil Pontifícia Universidade Católica do Rio Grande do Sul Médio Difícil Resolução da Prova de Química Vestibular Verão PUCRS 2005 Prof. Emiliano Chemello www.quimica.net/emiliano
Níveis de dificuldade das Questões Fácil Pontifícia Universidade Católica do Rio Grande do Sul Médio Difícil Resolução da Prova de Química Vestibular Verão PUCRS 2005 Prof. Emiliano Chemello www.quimica.net/emiliano
QUÍMICA. Quantos átomos de carbono e quantos átomos de hidrogênio existem em uma molécula desse composto? a) 10 e 13 b) 10 e 14 c) 9 e 12 d) 8 e 4
 QUÍMICA 1. O benzopireno é um composto aromático formado na combustão da hulha e do fumo. Pode ser encontrado em carnes grelhadas, em carvão ou peças defumadas. Experiências em animais comprovaram sua
QUÍMICA 1. O benzopireno é um composto aromático formado na combustão da hulha e do fumo. Pode ser encontrado em carnes grelhadas, em carvão ou peças defumadas. Experiências em animais comprovaram sua
ORIENTAÇÃO DE ESTUDOS
 ORIENTAÇÃO DE ESTUDOS RECUPERAÇÃO SEMESTRAL 1º Ano do Ensino Médio Disciplina: Química 1. Considere a tabela a seguir, onde estão relacionados os pontos de fusão e de ebulição de algumas substâncias sob
ORIENTAÇÃO DE ESTUDOS RECUPERAÇÃO SEMESTRAL 1º Ano do Ensino Médio Disciplina: Química 1. Considere a tabela a seguir, onde estão relacionados os pontos de fusão e de ebulição de algumas substâncias sob
A ( ) I. B ( ) I e III. C ( ) II. D ( ) II e IV. E ( ) IV.
 CONSTANTES Constante de Avogadro = Constante de Faraday (F) = 1 6, 0 x 10 mol Volume molar de gás ideal =, 4 L (CNTP) Carga elementar = Constante dos gases (R) = Constante gravitacional (g) = 9, 65 x 10
CONSTANTES Constante de Avogadro = Constante de Faraday (F) = 1 6, 0 x 10 mol Volume molar de gás ideal =, 4 L (CNTP) Carga elementar = Constante dos gases (R) = Constante gravitacional (g) = 9, 65 x 10
Substâncias Puras e Misturas
 MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS LAGES Substâncias Puras e Misturas Elementos Químicos
MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS LAGES Substâncias Puras e Misturas Elementos Químicos
SUBSTÂNCIAS, MISTURAS E SEPARAÇÃO DE MISTURAS
 NOTAS DE AULA (QUÍMICA) SUBSTÂNCIAS, MISTURAS E SEPARAÇÃO DE MISTURAS PROFESSOR: ITALLO CEZAR 1 INTRODUÇÃO A química é a ciência da matéria e suas transformações, isto é, estuda a matéria. O conceito da
NOTAS DE AULA (QUÍMICA) SUBSTÂNCIAS, MISTURAS E SEPARAÇÃO DE MISTURAS PROFESSOR: ITALLO CEZAR 1 INTRODUÇÃO A química é a ciência da matéria e suas transformações, isto é, estuda a matéria. O conceito da
Átomos & Moléculas. Definição: é uma porção de matéria que tem propriedades bem definidas e que lhe são característica.
 Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Definição: é uma porção de matéria que tem propriedades bem definidas e que lhe são característica. SUBSTÂNCIA (Material Puro): material formado
Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Definição: é uma porção de matéria que tem propriedades bem definidas e que lhe são característica. SUBSTÂNCIA (Material Puro): material formado
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 01 TURMA ANUAL. 05. Item A
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS 01. Item B AULA 01 TURMA ANUAL I Correto. Ao passar para um nível mais interno o elétron emite energia na forma de luz. II Falso. Rutherford não propôs um átomo maciço,
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS 01. Item B AULA 01 TURMA ANUAL I Correto. Ao passar para um nível mais interno o elétron emite energia na forma de luz. II Falso. Rutherford não propôs um átomo maciço,
Aula 01 QUÍMICA GERAL
 Aula 01 QUÍMICA GERAL 1 Natureza da matéria Tales de Mileto (624-548 a. C.) Tudo é água Anaxímenes de Mileto (585-528 a. C.) Tudo provém do ar e retorna ao ar Empédocle (484-424 a. C.) As quatro raízes,
Aula 01 QUÍMICA GERAL 1 Natureza da matéria Tales de Mileto (624-548 a. C.) Tudo é água Anaxímenes de Mileto (585-528 a. C.) Tudo provém do ar e retorna ao ar Empédocle (484-424 a. C.) As quatro raízes,
II OLimpíada Brasileira de Química Júnior - Fase II
 II OLimpíada Brasileira de Química Júnior - Fase II 17/10/2009 - II OBQjr 2009 INSTRUÇÕES: II Olimpíada Brasileira de Química Júnior Exames - Fase II 1. A prova consta de 25 questões, cada uma contém quatro
II OLimpíada Brasileira de Química Júnior - Fase II 17/10/2009 - II OBQjr 2009 INSTRUÇÕES: II Olimpíada Brasileira de Química Júnior Exames - Fase II 1. A prova consta de 25 questões, cada uma contém quatro
Colégio Saint Exupéry
 Colégio Saint Exupéry Apostila QUÍMICA No nosso dia-a-dia o ato de classificar as coisas é algo corriqueiro. Em um faqueiro colocamos em um mesmo espaço as facas, em outro os garfos, etc. Agrupar coisas
Colégio Saint Exupéry Apostila QUÍMICA No nosso dia-a-dia o ato de classificar as coisas é algo corriqueiro. Em um faqueiro colocamos em um mesmo espaço as facas, em outro os garfos, etc. Agrupar coisas
9º ANO ENSINO FUNDAMENTAL -2015
 COLÉGIO NOSSA SENHORA DE LOURDES trimestral Disciplina: Professor (a): QUÍMICA LUIS FERNANDO Roteiro de estudos para recuperação 9º ANO ENSINO FUNDAMENTAL -2015 Conteúdo: Referência para estudo: Sites
COLÉGIO NOSSA SENHORA DE LOURDES trimestral Disciplina: Professor (a): QUÍMICA LUIS FERNANDO Roteiro de estudos para recuperação 9º ANO ENSINO FUNDAMENTAL -2015 Conteúdo: Referência para estudo: Sites
M A S S A S E M E D I D A S
 M A S S A S E M E D I D A S PROF. AGAMENON ROBERTO < 2010 > Prof. Agamenon Roberto ATOMÍSTICA www.agamenonquimica.com 2 MASSAS E MEDIDAS UNIDADE DE MASSA ATÔMICA (u.m.a.) Para pesar ou medir algo se torna
M A S S A S E M E D I D A S PROF. AGAMENON ROBERTO < 2010 > Prof. Agamenon Roberto ATOMÍSTICA www.agamenonquimica.com 2 MASSAS E MEDIDAS UNIDADE DE MASSA ATÔMICA (u.m.a.) Para pesar ou medir algo se torna
Estudos de Recuperação para Oportunidade Adicional 2010-2º TRIMESTRE Tabela Periódica, Ligações Químicas e Nox
 1 Aluno(a): Nº.: Série: Turma: Data: / / Estudos de Recuperação para Oportunidade Adicional 2010-2º TRIMESTRE Tabela Periódica, Ligações Químicas e Nox 01 - O ferro faz parte da molécula de hemoglobina
1 Aluno(a): Nº.: Série: Turma: Data: / / Estudos de Recuperação para Oportunidade Adicional 2010-2º TRIMESTRE Tabela Periódica, Ligações Químicas e Nox 01 - O ferro faz parte da molécula de hemoglobina
IME - 2006 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 IME - 2006 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Um composto de fórmula molecular AB 5 é constituído por elementos que pertencem ao mesmo período de um determinado gás nobre.
IME - 2006 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Um composto de fórmula molecular AB 5 é constituído por elementos que pertencem ao mesmo período de um determinado gás nobre.
Educação para toda a vida
 LIGAÇÕES IÔNICAS E COVALENTES Noções sobre Ligações Químicas Regra do Octeto Ligação Iônica ou Eletrovalente Ligação Covalente ou Molecular Ligação Metálica Teoria do Octeto Todos os elementos buscam formas
LIGAÇÕES IÔNICAS E COVALENTES Noções sobre Ligações Químicas Regra do Octeto Ligação Iônica ou Eletrovalente Ligação Covalente ou Molecular Ligação Metálica Teoria do Octeto Todos os elementos buscam formas
Química 1 Cecília e Regina 2ºEM/TI 2º. Química 1-2ºTI
 2º anos - 2012 Matéria Professor(a) Ano/Série Turma Data Trimestre Química 1 Cecília e Regina 2ºEM/TI 2º Aluno(a) Número Observação Química 1-2ºTI Projeto de Recuperação Paralela Atividades podem ser feitas
2º anos - 2012 Matéria Professor(a) Ano/Série Turma Data Trimestre Química 1 Cecília e Regina 2ºEM/TI 2º Aluno(a) Número Observação Química 1-2ºTI Projeto de Recuperação Paralela Atividades podem ser feitas
Pode-se dizer que na molécula H Cl as eletrosferas dos átomos H e Cl são, respectivamente, iguais às eletrosferas dos átomos dos gases nobres:
 Questão 01) Um elemento químico A, de número atômico 11, um elemento químico B, de número atômico 8, e um elemento químico C, de número atômico 1, combinam-se formando o composto ABC. As ligações entre
Questão 01) Um elemento químico A, de número atômico 11, um elemento químico B, de número atômico 8, e um elemento químico C, de número atômico 1, combinam-se formando o composto ABC. As ligações entre
Tabela de Incompatibilidade
 Tabela de Incompatibilidade Nome do Produto Fórmula Incompatibilidade Tipo de Incompatível Ácido acético CH 3 C OH O CrO 3, KMnO 4, H 2 O 2 Acetona CH 3 C CH 3 O HNO 3, H 2 SO 4, CrO 3 Acetileno H C C
Tabela de Incompatibilidade Nome do Produto Fórmula Incompatibilidade Tipo de Incompatível Ácido acético CH 3 C OH O CrO 3, KMnO 4, H 2 O 2 Acetona CH 3 C CH 3 O HNO 3, H 2 SO 4, CrO 3 Acetileno H C C
QIE0001 Química Inorgânica Experimental Prof. Fernando R. Xavier. Prática 01 Reatividade de Metais: Síntese do gás hidrogênio
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC QIE0001 Química Inorgânica Experimental Prof. Fernando R. Xavier Prática 01 Reatividade de Metais:
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC QIE0001 Química Inorgânica Experimental Prof. Fernando R. Xavier Prática 01 Reatividade de Metais:
LIGAÇÕES QUÍMICAS Folha 04 João Roberto Mazzei
 01. Assinale a fórmula de Lewis da molécula HCN. a) H x C xn b) H x C x N c) H x C x N x d) H x C x x N e) Hx C x xn 0. Assinale a alternativa que apresenta, ao mesmo tempo, ligações covalentes e iônicas.
01. Assinale a fórmula de Lewis da molécula HCN. a) H x C xn b) H x C x N c) H x C x N x d) H x C x x N e) Hx C x xn 0. Assinale a alternativa que apresenta, ao mesmo tempo, ligações covalentes e iônicas.
Introdução à Eletroquímica. 1. Gentil V. Corrosão. 3 edição. 2. Cotton F. A. e Wilkinson G. Basic Inorganic Chemistry, John Wiley & Son, USA, 1976.
 Introdução à Eletroquímica 1. Gentil V. Corrosão. 3 edição. 2. Cotton F. A. e Wilkinson G. Basic Inorganic Chemistry, John Wiley & Son, USA, 1976. INTRODUÇÃO Eletroquímica: estuda as relações entre efeitos
Introdução à Eletroquímica 1. Gentil V. Corrosão. 3 edição. 2. Cotton F. A. e Wilkinson G. Basic Inorganic Chemistry, John Wiley & Son, USA, 1976. INTRODUÇÃO Eletroquímica: estuda as relações entre efeitos
CPV O cursinho que mais aprova na fgv
 CPV O cursinho que mais aprova na fgv FGV economia 1 a Fase 29/novembro/2009 QUÍMICA Para responder às questões de números 106 e 107 utilize as informações do texto. O clorato de potássio, KC O 3, é uma
CPV O cursinho que mais aprova na fgv FGV economia 1 a Fase 29/novembro/2009 QUÍMICA Para responder às questões de números 106 e 107 utilize as informações do texto. O clorato de potássio, KC O 3, é uma
MASSA ATÔMICA, MOLECULAR, MOLAR, NÚMERO DE AVOGADRO E VOLUME MOLAR.
 MASSA ATÔMICA, MOLECULAR, MOLAR, NÚMERO DE AVOGADRO E VOLUME MOLAR. UNIDADE DE MASSA ATÔMICA Em 1961, na Conferência da União Internacional de Química Pura e Aplicada estabeleceu-se: DEFINIÇÃO DE MASSA
MASSA ATÔMICA, MOLECULAR, MOLAR, NÚMERO DE AVOGADRO E VOLUME MOLAR. UNIDADE DE MASSA ATÔMICA Em 1961, na Conferência da União Internacional de Química Pura e Aplicada estabeleceu-se: DEFINIÇÃO DE MASSA
Distribuição Eletrônica Tabela Periódica
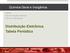 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Distribuição Eletrônica Tabela Periódica Orbitais e Números Quânticos N o Quântico Principal Camada Subcamada
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Distribuição Eletrônica Tabela Periódica Orbitais e Números Quânticos N o Quântico Principal Camada Subcamada
AMINOÁCIDOS E PROTEÍNAS
 AMINOÁCIDOS E PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição
AMINOÁCIDOS E PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição
CONCEITOS DE BRÖNSTED-LOWRY CONCEITOS DE ÁCIDOS E BASES CONCEITOS DE ARRHENIUS. Ácido: Ácido: HCN + H O H O + - Base ou hidróxido: Base: + +
 Ácido: CONCEITOS DE ÁCIDOS E BASES CONCEITOS DE ARRENIUS Toda substância que em solução aquosa, sofre ionização, produzindo como cátion, apenas o íon CN O ( aq ) CN ( aq ) Na realidade, o íon, quando em
Ácido: CONCEITOS DE ÁCIDOS E BASES CONCEITOS DE ARRENIUS Toda substância que em solução aquosa, sofre ionização, produzindo como cátion, apenas o íon CN O ( aq ) CN ( aq ) Na realidade, o íon, quando em
QUÍMICA. Um estudante pretende separar os componentes de uma amostra contendo três sais de chumbo II: Pb(NO 3. e PbI 2
 QUÍMICA 37 d Um estudante pretende separar os componentes de uma amostra contendo três sais de chumbo II: Pb(N 3, PbS 4 e PbI 2 Após analisar a tabela de solubilidade abaixo, Solubilidade em água Substâncias
QUÍMICA 37 d Um estudante pretende separar os componentes de uma amostra contendo três sais de chumbo II: Pb(N 3, PbS 4 e PbI 2 Após analisar a tabela de solubilidade abaixo, Solubilidade em água Substâncias
Específicas (UEG, UNICAMP, UNEMAT)
 Específicas (UEG, UNICAMP, UNEMAT) 1. (UNICAMP 2010) A maioria dos homens que mantêm o cabelo escurecido artificialmente utiliza uma loção conhecida como tintura progressiva. Os familiares, no entanto,
Específicas (UEG, UNICAMP, UNEMAT) 1. (UNICAMP 2010) A maioria dos homens que mantêm o cabelo escurecido artificialmente utiliza uma loção conhecida como tintura progressiva. Os familiares, no entanto,
Exercícios de Equílíbrio Químico ENEM Resolução Comentada Professora Simone
 Exercícios de Equílíbrio Químico ENEM Resolução Comentada Professora Simone 1. O equilíbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da
Exercícios de Equílíbrio Químico ENEM Resolução Comentada Professora Simone 1. O equilíbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da
Questão 1. Considerando condições ambientes, assinale a opção ERRADA.
 CONSTANTES Constante de Avogadro (N A ) = 6,02 x 10 23 mol 1 Constante de Faraday (F) = 9,65 x 10 4 C mol 1 = 9,65 x 10 4 A s mol 1 = 9,65 x 10 4 1 J V 1 mol Volume molar de gás ideal = 22,4 L (CNTP) Carga
CONSTANTES Constante de Avogadro (N A ) = 6,02 x 10 23 mol 1 Constante de Faraday (F) = 9,65 x 10 4 C mol 1 = 9,65 x 10 4 A s mol 1 = 9,65 x 10 4 1 J V 1 mol Volume molar de gás ideal = 22,4 L (CNTP) Carga
1. (G1 - ifsul 2016) Para o processo de purificação da água, são adicionadas substâncias como sulfato de alumínio, A 2(SO 4) 3,
 1. (G1 - ifsul 2016) Para o processo de purificação da água, são adicionadas substâncias como sulfato de alumínio, A 2(SO 4) 3, para formação de flocos com a sujeira da água; cloro, C 2, para desinfecção;
1. (G1 - ifsul 2016) Para o processo de purificação da água, são adicionadas substâncias como sulfato de alumínio, A 2(SO 4) 3, para formação de flocos com a sujeira da água; cloro, C 2, para desinfecção;
Prova 3 Química. N ọ DE INSCRIÇÃO:
 Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Prova 3 QUESTÕES OBJETIIVAS N ọ DE ORDEM: NOME DO CANDIDATO: N ọ DE INSCRIÇÃO: IINSTRUÇÕES PARA A REALIIZAÇÃO DA PROVA 1. Confira os campos N ọ DE ORDEM, N ọ DE INSCRIÇÃO e NOME, conforme o que consta
Considere recipientes com os seguintes volumes de substâncias gasosas, nas mesmas condições de pressão e temperatura.
 76 e Considere recipientes com os seguintes volumes de substâncias gasosas, nas mesmas condições de pressão e temperatura Substância Gasosa C C 2 2 C 2 H 4 Volume (L) 20 20 10 10 Com base no Princípio
76 e Considere recipientes com os seguintes volumes de substâncias gasosas, nas mesmas condições de pressão e temperatura Substância Gasosa C C 2 2 C 2 H 4 Volume (L) 20 20 10 10 Com base no Princípio
www.professormazzei.com - FUNÇÕES OXIGENADAS Folha 01 João Roberto Mazzei
 01. (UFRS 2008) Nos compostos orgânicos, além do carbono e do hidrogênio, é muito frequente a presença do oxigênio. Assinale a alternativa em que os três compostos apresentam oxigênio. a) formaldeído,
01. (UFRS 2008) Nos compostos orgânicos, além do carbono e do hidrogênio, é muito frequente a presença do oxigênio. Assinale a alternativa em que os três compostos apresentam oxigênio. a) formaldeído,
o Seu pé direito na medicina
 o Seu pé direito na medicina UNIFESP 15/12/2004 QUÍMICA 76. Considere recipientes com os seguintes volumes de substâncias gasosas, nas mesmas condições de pressão e temperatura. Substância Gasosa Volume
o Seu pé direito na medicina UNIFESP 15/12/2004 QUÍMICA 76. Considere recipientes com os seguintes volumes de substâncias gasosas, nas mesmas condições de pressão e temperatura. Substância Gasosa Volume
QUÍMICA ORGÂNICA É A QUÍMICA DO CARBONO E SEUS COMPOSTOS. MOLÉCULAS ORGÂNICAS
 É A QUÍMICA DO CARBONO E SEUS COMPOSTOS. MOLÉCULAS ORGÂNICAS Um dos objetivos da Química Orgânica é relacionar a estrutura de uma molécula e suas reações, para poder estudar as etapas que ocorrem em cada
É A QUÍMICA DO CARBONO E SEUS COMPOSTOS. MOLÉCULAS ORGÂNICAS Um dos objetivos da Química Orgânica é relacionar a estrutura de uma molécula e suas reações, para poder estudar as etapas que ocorrem em cada
Turma: Terça-feira ( ) Quarta-feira diurno ( ) Quarta-feira noturno ( ) Quinta-feira ( ) Sexta-feira ( ) Nome do aluno ID Assinatura
 005 Lista de exercícios que deve ser entregue no dia da prova (conteúdo: propriedades da matéria, unidades de medidas, estrutura atômica, propriedades eletrônicas e tabela periódica Química para Engenharia
005 Lista de exercícios que deve ser entregue no dia da prova (conteúdo: propriedades da matéria, unidades de medidas, estrutura atômica, propriedades eletrônicas e tabela periódica Química para Engenharia
www.professormazzei.com Assunto: Eletroquímica Folha 4.2 Prof.: João Roberto Mazzei
 www.professormazzei.com Assunto: Eletroquímica Folha 4.2 Prof.: João Roberto Mazzei 01. (UDESC 2009) O hidrogênio tem sido proposto como o combustível "ecológico", já que a sua reação de combustão com
www.professormazzei.com Assunto: Eletroquímica Folha 4.2 Prof.: João Roberto Mazzei 01. (UDESC 2009) O hidrogênio tem sido proposto como o combustível "ecológico", já que a sua reação de combustão com
www.professormazzei.com Estequiometria Folha 03 Prof.: João Roberto Mazzei
 01. (CFTCE 2007) Dada a reação de neutralização: HCl + NaOH NaCl + H 2O, a massa de NaCl, produzida a partir de 80 g de hidróxido de sódio (NaOH), é: a) 58,5 g b) 40 g c) 117 g d) 80 g e) 120 g 02. (CFTCE
01. (CFTCE 2007) Dada a reação de neutralização: HCl + NaOH NaCl + H 2O, a massa de NaCl, produzida a partir de 80 g de hidróxido de sódio (NaOH), é: a) 58,5 g b) 40 g c) 117 g d) 80 g e) 120 g 02. (CFTCE
AS TRANSFORMAÇÕES DA MATÉRIA.
 AS TRANSFORMAÇÕES DA MATÉRIA. Toda e qualquer alteração que a matéria venha a sofrer é denominada de transformação ou fenômeno. Algumas transformações (fenômenos) são reversíveis, isto é, podem ser desfeitas
AS TRANSFORMAÇÕES DA MATÉRIA. Toda e qualquer alteração que a matéria venha a sofrer é denominada de transformação ou fenômeno. Algumas transformações (fenômenos) são reversíveis, isto é, podem ser desfeitas
Disciplina Química geral (MAF1293) Professora Cleonice Rocha Aluno - Estudo Dirigido Reações em solução aquosa (valor = 1,5 pt)
 Disciplina Química geral (MAF1293) Professora Cleonice Rocha Aluno - Estudo Dirigido Reações em solução aquosa (valor = 1,5 pt) Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções
Disciplina Química geral (MAF1293) Professora Cleonice Rocha Aluno - Estudo Dirigido Reações em solução aquosa (valor = 1,5 pt) Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções
Série: 2º ano. Assunto: Estequiometria
 Aluno: Série: 2º ano Assunto: Estequiometria 1) A massa de dióxido de carbono liberada na queima de 80 g de metano, quando utilizado como combustível, é: (Dados: massas molares, em g/mol: H = 1, C =12,
Aluno: Série: 2º ano Assunto: Estequiometria 1) A massa de dióxido de carbono liberada na queima de 80 g de metano, quando utilizado como combustível, é: (Dados: massas molares, em g/mol: H = 1, C =12,
II Correto. Quanto maior a distância entre as cargas, mais fraca é a ligação e menos energia é empregada na sua quebra.
 01. Item B I Correto. A energia para quebrar a ligação H (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando menos o ácido que passa a ser o mais fraco entre os listados.
01. Item B I Correto. A energia para quebrar a ligação H (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando menos o ácido que passa a ser o mais fraco entre os listados.
ATIVIDADE DE ÁGUA (Aw) E REAÇÕES DE DETERIORAÇÃO
 ATIVIDADE DE ÁGUA (Aw) E REAÇÕES DE DETERIORAÇÃO Água A molécula de água é triatômica e possui estrutura tetraédrica. Tem baixo peso molecular, pequeno volume e é diamagnética. Apresentaria um ângulo de
ATIVIDADE DE ÁGUA (Aw) E REAÇÕES DE DETERIORAÇÃO Água A molécula de água é triatômica e possui estrutura tetraédrica. Tem baixo peso molecular, pequeno volume e é diamagnética. Apresentaria um ângulo de
Concurso de seleção 2004-2 Química Página 1 QUÍMICA
 Concurso de seleção 004- Química Página 1 QUÍMICA QUESTÃO 51 Uma das conseqüências da poluição ambiental é a chuva ácida, que, em alguns casos, pode causar danos irreparáveis à natureza. Substâncias básicas
Concurso de seleção 004- Química Página 1 QUÍMICA QUESTÃO 51 Uma das conseqüências da poluição ambiental é a chuva ácida, que, em alguns casos, pode causar danos irreparáveis à natureza. Substâncias básicas
Vestibular Nacional Unicamp 1999
 Vestibular Nacional Unicamp 1999 Provas da 2 ª Fase Química 1 QUÍMICA ATENÇÃO: Escreva a resolução COMPLETA de cada questão no espaço reservado para a mesma. Não basta escrever apenas o resultado final:
Vestibular Nacional Unicamp 1999 Provas da 2 ª Fase Química 1 QUÍMICA ATENÇÃO: Escreva a resolução COMPLETA de cada questão no espaço reservado para a mesma. Não basta escrever apenas o resultado final:
P2 - PROVA DE QUÍMICA GERAL - 08/10/07
 P2 - PRVA DE QUÍMICA GERAL - 08/10/07 Nome: Nº de Matrícula: GABARIT Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 R = 8,314 J mol -1 K -1 = 0,0821 atm L mol
P2 - PRVA DE QUÍMICA GERAL - 08/10/07 Nome: Nº de Matrícula: GABARIT Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 R = 8,314 J mol -1 K -1 = 0,0821 atm L mol
Revisão de Química Orgânica
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Revisão de Química Orgânica Prof. Dra. Narlize Silva Lira Cavalcante A Química Orgânica e a Vida A uímica
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Revisão de Química Orgânica Prof. Dra. Narlize Silva Lira Cavalcante A Química Orgânica e a Vida A uímica
7. EQUILÍBRIO QUÍMICO
 Departamento de Química Inorgânica IQ / UFRJ IQG 18 / IQG 1 7. EQUILÍBRIO QUÍMICO I. INTRODUÇÃO Quando a concentração de todos os reagentes e produtos, em um sistema fechado, não variam mais com o tempo
Departamento de Química Inorgânica IQ / UFRJ IQG 18 / IQG 1 7. EQUILÍBRIO QUÍMICO I. INTRODUÇÃO Quando a concentração de todos os reagentes e produtos, em um sistema fechado, não variam mais com o tempo
