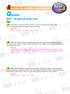
C C O H O 2HC CO CO C CO C COC. H 1g mol ; C 12g mol ; O 16g mol ; C 35,5g mol. Adaptado.
|
|
|
- Emanuel Godoi de Barros
- 8 Há anos
- Visualizações:
Transcrição
1 TEXTO PARA A PRÓXIMA QUESTÃO: Uma medida adotada pelo governo do estado para amenizar a crise hídrica que afeta a cidade de São Paulo envolve a utilização do chamado volume morto dos reservatórios do Sistema Cantareira. Em artigo publicado pelo jornal O Estado de S.Paulo, três especialistas alertam sobre os riscos trazidos por esse procedimento que pode trazer à tona poluentes depositados no fundo das represas, onde se concentram contaminantes que não são tratados por sistemas convencionais. Entre os poluentes citados que contaminam os mananciais há compostos inorgânicos, orgânicos altamente reativos com os sistemas biológicos, microbiológicos e vírus. Segundo as pesquisadoras, quanto mais baixo o nível dos reservatórios, maior é a concentração de poluentes, recomendando maiores cuidados. Adaptado. 1. (Unesp 015) De modo geral, em sistemas aquáticos a decomposição de matéria orgânica de origem biológica, na presença de oxigênio, se dá por meio de um processo chamado degradação aeróbica. As equações representam reações genéricas envolvidas na degradação aeróbica, em que "MO" matéria orgânica contendo nitrogênio e enxofre. CHO no n nco nho MOC,H,N,S no CO HO NO3 SO4 Analisando as equações apresentadas, é correto afirmar que no processo de degradação aeróbica ocorrem reações de a) decomposição, em que o oxigênio não sofre alteração em seu número de oxidação. b) oxirredução, em que o oxigênio atua como agente redutor. c) decomposição, em que o oxigênio perde elétrons. d) oxirredução, em que o oxigênio sofre oxidação. e) oxirredução, em que o oxigênio atua como agente oxidante.. (Uepa 014) O processo de lavagem a seco ocorre sob uma determinada temperatura, e isso está diretamente relacionado ao solvente utilizado. Por exemplo, quando o solvente é o tetracloroeteno (CC 4), comercialmente conhecido como percloroetileno, é usado largamente na indústria de lavagem a seco como agente de limpeza, a melhor temperatura para aquecer o ar que circula no tambor da máquina é de 60 C. Se essa temperatura não for alcançada, algumas roupas podem não ficar completamente secas ao final do processo; se ficar acima, a roupa poderá enrugar, e alguns tecidos mais sensíveis poderão ser danificados. Quando os vapores de percloroetileno são expostos a situações de elevada temperatura, acima de 600 C, na presença de oxigênio e água, observa-se a formação das espécies HC, CO, CO e C, representadas pelas equações: C C O H O HC CO CO C 4(g) (g) (g) (g) (g) (g) (g) CO C COC Dados: (g) (g) (g) 1 1 H 1g mol ; C 1g mol ; 1 1 O 16gmol ; C 35,5g mol Marque a alternativa correta: a) CC 4(g) O(g) H O(g) HC (g) CO(g) CO(g) C (g) é uma reação de síntese. b) O monóxido de carbono é um óxido básico, enquanto que CO é um óxido ácido. c) A reação: CO(g) C (g) COC (g) corresponde a uma reação de dupla troca. d) O C é formado tanto por ligação covalente, quanto por ligação iônica. Página 1 de 8
2 e) As espécies CC 4; O e HO possuem massas moleculares, respectivamente: 166; 3 1 e 18g mol. 3. (Ufsm 014) Na produção de eletricidade, são, algumas vezes, usados geradores a óleo. Quando o óleo queima, produz SO, que deve ser eliminado antes de ser emitido ao ar, pois é formador de chuva ácida. Um dos métodos para a sua eliminação usa o calcário, produzindo sulfito de cálcio que, posteriormente, é removido por precipitação eletrostática. As reações envolvidas na eliminação do SO são: 1. CaCO 3 CaO(s) CO(g). CaO(s) SO(g) CaSO 3(s) As reações 1 e denominam-se, respectivamente, reações de a) deslocamento e análise. b) deslocamento e síntese. c) síntese e análise. d) análise e síntese. e) síntese e deslocamento. TEXTO PARA A PRÓXIMA QUESTÃO: Baseado no texto a seguir, responda a(s) questão(ões)... Por mais surpreendente que pareça, a desintegração do exército napoleônico pode ser atribuída a algo tão pequeno quanto um botão um botão de estanho, para sermos mais exatos, do tipo que fechava todas as roupas no exército, dos sobretudos dos oficiais às calças e paletós dos soldados de infantaria. Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico continua sendo estanho, mas com forma estrutural diferente. (Adaptado de Os Botões de Napoleão Penny Le Couteur e Jay Burreson p. 8). 4. (Espcex (Aman) 014) Em relação ao texto acima e baseado em conceitos químicos, são feitas as seguintes afirmativas: I. o texto faz alusão estritamente a ocorrência de fenômenos físicos. II. o texto faz alusão a ocorrência de uma reação de oxidação do estanho do botão. III. o texto faz alusão a ocorrência de uma reação de síntese. IV. o texto faz alusão a ocorrência de uma reação sem transferência de elétrons entre as espécies estanho metálico e o oxigênio do ar. Das afirmativas apresentadas estão corretas apenas: a) II e III. b) III e IV. c) II e IV. d) I e III. e) I e II. TEXTO PARA A PRÓXIMA QUESTÃO: Dadas as equações químicas abaixo, responda à(s) questão(ões): Página de 8
3 E I. Me tano Ar produtos ΔH 80 kj / mol II. HC KOH produtos ΔH 55 kj / mol Δ III. CaCO3 produtos ΔH 178, kj / mol 5. (Uepb 014) Quais os tipos de reações, respectivamente, que ocorrem nas equações I, II e III? a) Aeração, hidrogenação e sulfonação. b) Hidrólise, cloração e oxirredução. c) Combustão, neutralização e decomposição. d) Dupla troca, ácido-base e combustão. e) Neutralização, dupla troca e oxirredução. 6. (Uem 013) Considere as reações abaixo e assinale a(s) alternativa(s) correta(s). I. SO3 HO HSO4 II. HSO4 CaCO3 CaSO4 HCO3 III. CaSO 4 NaOH Ca OH NaSO4 01) A reação I é uma reação de adição. 0) A reação III é uma reação de neutralização. 04) Todas as reações apresentadas acima estão balanceadas. 08) Carbonato de cálcio é um exemplo de sal insolúvel em água. 16) O ácido carbônico formado na reação II é um ácido fraco, instável e se decompõe formando água e dióxido de carbono. 7. (G1 - cftmg 013) A equação que representa uma reação de neutralização é a) HI aq KOH aq HO KI aq b) Zn s HC aq ZnC aq Hg c) Na s HO NaOH aq Hg d) HNO 3 HO H3O aq NO3 aq 8. (G1 - utfpr 01) Dadas as equações: I. CuC HSO4 CuSO 4 HC II. CuOH CuSO NaOH Na SO Cu OH 4 4 CuO H O III. 1 A classificação da reação equacionada e a função química do composto assinalado em negrito são: a) em I, dupla troca e ácido. b) em II, dupla troca e base. c) em III, síntese e óxido. d) em I, simples troca e sal. e) em III, análise e sal. 9. (Espcex (Aman) 01) Abaixo são fornecidos os resultados das reações entre metais e sais. Página 3 de 8
4 FeSO4aq Ags não ocorre a reação AgNO Fe Fe NO Ag 3aq s 3 aq s 4 s 4 s 3Fe SO A A SO 3Fe aq 3 aq A SO4 Fe 3 aq s não ocorre a reação De acordo com as reações acima equacionadas, a ordem decrescente de reatividade dos metais envolvidos em questão é: a) A, Fe e Ag. b) Ag, Fe e A. c) Fe, A e Ag. d) Ag, A e Fe. e) A, Ag e Fe. 10. (Espcex (Aman) 01) O quadro a seguir relaciona ordem, equação química e onde as mesmas ocorrem: Ordem Equação Química Ocorrem I 3Ca OH A SO4 A aq 3 s OH3 s 3Ca SO4 Tratamento de aq água II Mg s 1O g MgO Flash s fotográfico Ataque do III Zns HC aq ZnC aq H ácido clorídrico g a lâminas de zinco IV NH4HCO3 s COg NH3 g HO Fermento químico As equações químicas I, II, III e IV correspondem, nessa ordem, aos seguintes tipos de reação: a) I-síntese; II-análise; III-deslocamento e IV-dupla troca. b) I-dupla troca; II-síntese; III-deslocamento e IV-análise. c) I-análise; II-síntese; III-deslocamento e IV-dupla troca. d) I-síntese; II-análise; III-dupla troca e IV-deslocamento. e) I-deslocamento; II-análise; III-síntese e IV-dupla troca. Página 4 de 8
5 Gabarito: Resposta da questão 1: [E] No processo de degradação aeróbica ocorrem reações de oxirredução, em que o oxigênio atua como agente oxidante. agente oxidante CHO no n nco nho 0 (redução) MOC,H,N,S agente oxidante no CO HO NO3 SO4 0 (redução) Resposta da questão : [E] [A] Incorreta. Reações de síntese formam apenas um só produto. [B] Incorreta. O monóxido de carbono é um óxido neutro. [C] Incorreta. A reação: CO(g) C (g) COC (g) é uma reação de síntese, onde dois ou mais reagentes formam apenas um único produto. [D] Incorreta. O C é formado pelo compartilhamento de elétrons, ou seja, apenas por ligação covalente. [E] Correta. 1 CC 4 (1 ) (35,5 4) 166 g mol 1 O (16 ) 3g mol 1 HO (1 ) 16 18g mol Resposta da questão 3: [D] Teremos: 1. CaCO3 CaO(s) CO (g) : reação de análise ou decomposição.. CaO SO CaSO : reação de síntese ou formação. (s) (g) 3(s) Resposta da questão 4: [A] Ocorre uma reação de síntese na presença do oxigênio presente no ar: 1 Sn(s) O (g) SnO(s) Resposta da questão 5: [C] Página 5 de 8
6 [I] CH4(g) O(g) CO(g) H O(v) reação de combustão [II] HC (aq) KOH(aq) KC (aq) H O( ) reação de neutralização [III] CaCO3(s) CaO(s) CO(g) reação de decomposição Resposta da questão 6: = 5. Teremos: I. SO3 HO HSO4 (reação de síntese ou formação ou adição; balanceada) II. HSO4 CaCO3 CaSO4 HCO3 (reação de dupla troca; balanceada) sal insolúvel em água III. CaSO 4 NaOH CaOH Na SO 4 (reação de dupla troca; não balanceada) Observação: H CO H O CO 3 ácido fraco Resposta da questão 7: [A] A equação que representa uma reação de neutralização, ou seja, na qual H OH HOH, é: HI aq KOHaq HO KIaq H aq I aq K aq OH aq HO KIaq Resposta da questão 8: [B] Teremos: I. CuC H SO CuSO HC (dupla troca) Sal II. CuSO NaOH Cu OH Na SO (dupla troca) III. Cu OH Base CuO H O (decomposição ou análise) Óxido 4 Resposta da questão 9: [A] De acordo com as equações fornecidas, percebemos por A SO4 Fe 3 aq s não ocorre a reação, que o ferro é menos reativo do que o alumínio. Analisando FeSO4aq Ags não ocorre a reação, percebemos que a prata é menos reativa que o ferro. Página 6 de 8
7 AgNO Fe Fe NO Ag e A partir de 3aq s 3 aq s 3Fe SO 4 A s A SO 4 3Fe s aq, concluímos que o alumínio é mais reativo 3 aq que o ferro. Conclusão: O alumínio é mais reativo que o ferro e ambos são mais reativos que a prata. Podemos confirmar a conclusão utilizando a fila de reatividade: O alumínio é mais reativo que o ferro e ambos são mais reativos que a prata. Resposta da questão 10: [B] Teremos a seguinte classificação: Ordem Equação Química Classificação 3Ca OH A SO A OH 3Ca SO Dupla troca I aq 4 3 s 3 s 4 aq II Mg s 1O g MgOs Síntese Deslocamento III Zns HC aq ZnC aq H g ou simples troca IV NH4HCO3 s COg NH3 g HO Decomposição ou análise Página 7 de 8
8 Resumo das questões selecionadas nesta atividade Q/prova Q/DB Grau/Dif. Matéria Fonte Tipo Média... Química... Unesp/ Múltipla escolha Média... Química... Uepa/ Múltipla escolha Média... Química... Ufsm/ Múltipla escolha Média... Química... Espcex (Aman)/ Múltipla escolha Média... Química... Uepb/ Múltipla escolha Média... Química... Uem/ Somatória Média... Química... G1 - cftmg/ Múltipla escolha Média... Química... G1 - utfpr/01... Múltipla escolha Elevada... Química... Espcex (Aman)/01... Múltipla escolha Média... Química... Espcex (Aman)/01... Múltipla escolha Página 8 de 8
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014
 RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
Química Geral Classificação das Reações
 Química Geral Classificação das Reações 1. (Ufsm 2014) Na produção de eletricidade, são, algumas vezes, usados geradores a óleo. Quando o óleo queima, produz SO 2, que deve ser eliminado antes de ser emitido
Química Geral Classificação das Reações 1. (Ufsm 2014) Na produção de eletricidade, são, algumas vezes, usados geradores a óleo. Quando o óleo queima, produz SO 2, que deve ser eliminado antes de ser emitido
Fonte: UNIVERSIDADE FEDERAL DE BRASILIA. A contribuição dos portugueses. ATAN/DAB/SPS/MS.
 REAÇÕES INORGÂNICAS AULAS 55-56 01. (Pucpr 2005) Uma das etapas da formação da chuva ácida pode ser representada pela equação a seguir: SO 3 + H 2 O H 2 SO 4 A respeito desse processo, podemos afirmar:
REAÇÕES INORGÂNICAS AULAS 55-56 01. (Pucpr 2005) Uma das etapas da formação da chuva ácida pode ser representada pela equação a seguir: SO 3 + H 2 O H 2 SO 4 A respeito desse processo, podemos afirmar:
1) Faça o balanceamento das equações abaixo:
 PROFESSORA: GIOVANA CARABALLO MELATTI DATA: / /2015 COMPONENTE CURRICULAR: QUÍMICA LISTA DE EXERCÍCIOS DE SALA ALUNO: LISTA DE EXERCÍCIOS REVISÃO 1) Faça o balanceamento das equações abaixo: a) C 2 H 6
PROFESSORA: GIOVANA CARABALLO MELATTI DATA: / /2015 COMPONENTE CURRICULAR: QUÍMICA LISTA DE EXERCÍCIOS DE SALA ALUNO: LISTA DE EXERCÍCIOS REVISÃO 1) Faça o balanceamento das equações abaixo: a) C 2 H 6
LISTA DE EXERCÍCIOS 1º ANO
 Questão 1 Questão 2 Questão 3 Questão 4 Química GABARITO a) I) Fe 2 O 3 (s)+3h 2 SO 4 (aq) Fe 2 (SO 4 (aq)+3h 2 O II) 2Al(OH (s)+3h 2 SO 4 (aq) Al 2 (SO 4 (aq)+6h 2 O IIICaO(s)+2H 3 PO 4 (aq) Ca 3 (PO
Questão 1 Questão 2 Questão 3 Questão 4 Química GABARITO a) I) Fe 2 O 3 (s)+3h 2 SO 4 (aq) Fe 2 (SO 4 (aq)+3h 2 O II) 2Al(OH (s)+3h 2 SO 4 (aq) Al 2 (SO 4 (aq)+6h 2 O IIICaO(s)+2H 3 PO 4 (aq) Ca 3 (PO
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
As questões de 31 a 34 referem-se ao texto abaixo.
 QUÍMICA As questões de 31 a 34 referem-se ao texto abaixo. Em diversos países, o aproveitamento do lixo doméstico é quase 100%. Do lixo levado para as usinas de compostagem, após a reciclagem, obtém-se
QUÍMICA As questões de 31 a 34 referem-se ao texto abaixo. Em diversos países, o aproveitamento do lixo doméstico é quase 100%. Do lixo levado para as usinas de compostagem, após a reciclagem, obtém-se
 Reações Químicas Reações Químicas DG O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças químicas, onde ocorre a conversão de uma substância, ou mais, em outras substâncias. A + B REAGENTES C +
Reações Químicas Reações Químicas DG O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças químicas, onde ocorre a conversão de uma substância, ou mais, em outras substâncias. A + B REAGENTES C +
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Lista I de exercícios de estequiometria e balanceamento de equações Química Geral e Experimental I Prof. Hamilton Viana
 1. O iso-octano é um combustível automotivo. A combustão desse material ocorre na fase gasosa. Dados a massa molar do iso-octano igual a 114g/mol, o volume molar de gás nas "condições ambiente" igual a
1. O iso-octano é um combustível automotivo. A combustão desse material ocorre na fase gasosa. Dados a massa molar do iso-octano igual a 114g/mol, o volume molar de gás nas "condições ambiente" igual a
2. (Ifsc 2014) A reação abaixo representa este processo: CO 3H H COH H O ΔH 12 kcal/mol
 1. (Uel 2014) A gasolina é uma mistura de vários compostos. Sua qualidade é medida em octanas, que definem sua capacidade de ser comprimida com o ar, sem detonar, apenas em contato com uma faísca elétrica
1. (Uel 2014) A gasolina é uma mistura de vários compostos. Sua qualidade é medida em octanas, que definem sua capacidade de ser comprimida com o ar, sem detonar, apenas em contato com uma faísca elétrica
ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 IX Olimpíada Capixaba de Química 2011 Prova do Grupo II 2 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
IX Olimpíada Capixaba de Química 2011 Prova do Grupo II 2 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
De onde vêm as lágrimas?
 De onde vêm as lágrimas? É toda substância que, em solução aquosa, sofre dissociação, liberado pelo menos um cátion diferente de H + e um ânion diferente de OH -. a) Presença de oxigênio b) Sal não oxigenado
De onde vêm as lágrimas? É toda substância que, em solução aquosa, sofre dissociação, liberado pelo menos um cátion diferente de H + e um ânion diferente de OH -. a) Presença de oxigênio b) Sal não oxigenado
Questão 61. Questão 63. Questão 62. alternativa B. alternativa B. alternativa D
 Questão 61 A limpeza de pisos de mármore normalmente é feita com solução de ácido clorídrico comercial (ácido muriático). Essa solução ácida ataca o mármore, desprendendo gás carbônico, segundo a reação
Questão 61 A limpeza de pisos de mármore normalmente é feita com solução de ácido clorídrico comercial (ácido muriático). Essa solução ácida ataca o mármore, desprendendo gás carbônico, segundo a reação
A limpeza de pisos de mármore normalmente é feita com solução de ácido clorídrico comercial (ácido muriático).
 61 b A limpeza de pisos de mármore normalmente é feita com solução de ácido clorídrico comercial (ácido muriático). Essa solução ácida ataca o mármore, desprendendo gás carbônico, segundo a reação descrita
61 b A limpeza de pisos de mármore normalmente é feita com solução de ácido clorídrico comercial (ácido muriático). Essa solução ácida ataca o mármore, desprendendo gás carbônico, segundo a reação descrita
Questão 76. Questão 78. Questão 77. alternativa D. alternativa C. alternativa A
 Questão 76 O hidrogênio natural é encontrado na forma de três isótopos de números de massa, 1, 2 e 3, respectivamente: 1 1 H, 2 1 H e 3 1 H As tabelas periódicas trazem o valor 1,008 para a sua massa atômica,
Questão 76 O hidrogênio natural é encontrado na forma de três isótopos de números de massa, 1, 2 e 3, respectivamente: 1 1 H, 2 1 H e 3 1 H As tabelas periódicas trazem o valor 1,008 para a sua massa atômica,
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA
 SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
VIII EXAME Questões Objetivas. RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE.
 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
1ª Parte Substâncias e Misturas
 1ª Parte Substâncias e Misturas 1. Dadas amostras dos seguintes materiais: I. cloro gasoso II. ar atmosférico III. latão IV. diamante representam substâncias puras a) I e II b) I e III c) I e IV d) II
1ª Parte Substâncias e Misturas 1. Dadas amostras dos seguintes materiais: I. cloro gasoso II. ar atmosférico III. latão IV. diamante representam substâncias puras a) I e II b) I e III c) I e IV d) II
 Lista de estequiometria 1. (Ufes) A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono. Decompondo-se 5,0g de carbonato de cálcio impuro e recolhendo-se todo o dióxido
Lista de estequiometria 1. (Ufes) A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono. Decompondo-se 5,0g de carbonato de cálcio impuro e recolhendo-se todo o dióxido
5. (Espcex (Aman) 2013) Uma amostra de 5 g de hidróxido de sódio (NaOH) impuro foi dissolvida em água suficiente para formar 1L de solução.
 1. (Enem ª aplicação 010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1. A maioria dos produtos
1. (Enem ª aplicação 010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1. A maioria dos produtos
QUÍMICA. Professora Caroline Azevedo
 QUÍMICA Professora Caroline Azevedo FUNÇÕES INORGÂNICAS Ácidos Segundo Arrhenius, toda substância que em solução aquosa sofre ionização produzindo como cátion, apenas o íon H +, é um ácido. Ex. H 2 O +
QUÍMICA Professora Caroline Azevedo FUNÇÕES INORGÂNICAS Ácidos Segundo Arrhenius, toda substância que em solução aquosa sofre ionização produzindo como cátion, apenas o íon H +, é um ácido. Ex. H 2 O +
Projeto Embuá Unidade de Aprendizagem: ENERGIA
 Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
TIPOS DE REAÇÕES QUÍMICAS MATERIAL RETIRADO PARCIALMENTE OU NA INTEGRA DE LISTAS DE EXERCÍCIOS ENCONTRADAS NA INTERNET
 TIPOS DE REAÇÕES QUÍMICAS MATERIAL RETIRADO PARCIALMENTE OU NA INTEGRA DE LISTAS DE EXERCÍCIOS ENCONTRADAS NA INTERNET 1. Unifor-CE O metal potássio reage vigorosamente com água, produzindo hidrogênio
TIPOS DE REAÇÕES QUÍMICAS MATERIAL RETIRADO PARCIALMENTE OU NA INTEGRA DE LISTAS DE EXERCÍCIOS ENCONTRADAS NA INTERNET 1. Unifor-CE O metal potássio reage vigorosamente com água, produzindo hidrogênio
3) Dadas as equações: I CuCl 2 + H 2 SO 4
 1) Observe as reações I e II abaixo: I NH 3 + HCl NH 4 Cl II 2HgO aquecimento 2Hg + O 2 Podemos afirmar que I e II são, respectivamente, reações de: a) síntese e análise b) simples troca e síntese c) dupla
1) Observe as reações I e II abaixo: I NH 3 + HCl NH 4 Cl II 2HgO aquecimento 2Hg + O 2 Podemos afirmar que I e II são, respectivamente, reações de: a) síntese e análise b) simples troca e síntese c) dupla
REVISÃO QUÍMICA. Profº JURANDIR QUÍMICA
 REVISÃO QUÍMICA Profº JURANDIR QUÍMICA DADOS 01. (ENEM 2004) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H 2 SO 4 ) foram derramadas pelo navio Bahamas no litoral do Rio Grande
REVISÃO QUÍMICA Profº JURANDIR QUÍMICA DADOS 01. (ENEM 2004) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H 2 SO 4 ) foram derramadas pelo navio Bahamas no litoral do Rio Grande
Professora Sonia - Química para o Vestibular Questões Resolvidas Hidrólise Salina (com respostas e resoluções no final)
 Questões Resolvidas Hidrólise Salina (com respostas e resoluções no final) 01. (Uftm) Em soluções aquosas de acetato de sódio, o íon acetato sofre hidrólise: 3 l 3 CH COO (aq) + H O( ) CH COOH (aq) + OH
Questões Resolvidas Hidrólise Salina (com respostas e resoluções no final) 01. (Uftm) Em soluções aquosas de acetato de sódio, o íon acetato sofre hidrólise: 3 l 3 CH COO (aq) + H O( ) CH COOH (aq) + OH
IX Olimpíada Catarinense de Química 2013. Etapa I - Colégios
 I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
I Olimpíada Catarinense de Química - 2013 I Olimpíada Catarinense de Química 2013 Etapa I - Colégios Imagem: Oxidação Fonte:Gilson Rocha Reynaldo, 2013 Primeiro Ano Conselho Regional de Química CRQ III
Leis Históricas da Estequiometria
 Estequiometria A proporção correta da mistura ar-combustível para o motor de uma carro de corrida pode ser tão importante quanto a habilidade do piloto para ganhar a corrida. As substâncias químicas, como
Estequiometria A proporção correta da mistura ar-combustível para o motor de uma carro de corrida pode ser tão importante quanto a habilidade do piloto para ganhar a corrida. As substâncias químicas, como
Qualidade Ambiental Química
 Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
Química. Resolução das atividades complementares. Q53 Ácidos de Arrhenius
 Resolução das atividades complementares 4 Química Q53 Ácidos de Arrhenius p 35 1 (UFRGS-RS) Admitindo-se 100% de ionização para o ácido clorídrico em solução diluída, pode-se afirmar que essa solução não
Resolução das atividades complementares 4 Química Q53 Ácidos de Arrhenius p 35 1 (UFRGS-RS) Admitindo-se 100% de ionização para o ácido clorídrico em solução diluída, pode-se afirmar que essa solução não
Gabarito Química - Grupo A. 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor
 VESTIB LAR Gabarito Química - Grupo A 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Muitos álcoois, como o butanol (C 4 H 10 O), têm importância comercial como solventes e matériasprimas na produção industrial
VESTIB LAR Gabarito Química - Grupo A 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Muitos álcoois, como o butanol (C 4 H 10 O), têm importância comercial como solventes e matériasprimas na produção industrial
Estequiometria. Prof a. Dr a. Flaviana Tavares Vieira
 Universidade Federal dos Vales do Jequitinhonha e Mucuri Bacharelado em Ciência e Tecnologia Diamantina - MG Estequiometria Prof a. Dr a. Flaviana Tavares Vieira -A palavra estequiometria deriva das palavras
Universidade Federal dos Vales do Jequitinhonha e Mucuri Bacharelado em Ciência e Tecnologia Diamantina - MG Estequiometria Prof a. Dr a. Flaviana Tavares Vieira -A palavra estequiometria deriva das palavras
Ocorrência das Reações
 Ocorrência das Reações Efervescência Mudança de Cor Ocorrência das Reações Formação de Precipitado Reação x Equações Químicas Classificação 1. De acordo com a complexibilidade Adição ou síntese ou composição:
Ocorrência das Reações Efervescência Mudança de Cor Ocorrência das Reações Formação de Precipitado Reação x Equações Químicas Classificação 1. De acordo com a complexibilidade Adição ou síntese ou composição:
b) explique duas medidas adotadas pelo poder público para minimizar o problema da poluição atmosférica na cidade de São Paulo.
 1. (Fuvest 2013) Observe a imagem, que apresenta uma situação de intensa poluição do ar que danifica veículos, edifícios, monumentos, vegetação e acarreta transtornos ainda maiores para a população. Trata-se
1. (Fuvest 2013) Observe a imagem, que apresenta uma situação de intensa poluição do ar que danifica veículos, edifícios, monumentos, vegetação e acarreta transtornos ainda maiores para a população. Trata-se
QUÍMICA QUESTÃO 41 QUESTÃO 42
 Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
(b) É uma reacção de neutralização: base + ácido sal + água 2 mol de NaOH reagem com 1 mol de H 2 SO 4 originando 1 mol de Na 2 SO 4 e 2 mol de H 2 O.
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 3. Reacções químicas I Soluções da ficha de exercícios 1. (a) NaOH = hidróxido de sódio. H 2 SO 4 = ácido súlfurico. Na 2 SO 4 = sulfato de sódio. H 2 O
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 3. Reacções químicas I Soluções da ficha de exercícios 1. (a) NaOH = hidróxido de sódio. H 2 SO 4 = ácido súlfurico. Na 2 SO 4 = sulfato de sódio. H 2 O
Ocorrência das Reações
 Ocorrência das Reações Efervescência Mudança de Cor Ocorrência das Reações Formação de Precipitado Reação x Equações Químicas Classificação 1. De acordo com a complexibilidade Adição ou síntese ou composição:
Ocorrência das Reações Efervescência Mudança de Cor Ocorrência das Reações Formação de Precipitado Reação x Equações Químicas Classificação 1. De acordo com a complexibilidade Adição ou síntese ou composição:
P R O V A D E Q UÍMICA I. A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes.
 17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
c) NH4OH. d) H2SO4. 4) Qual a classificação correta das moléculas NaOH, NaCl e HCl? a) Ácido, base e sal b) Sal, base e ácido
 Funções e reações inorgânicas - Exercícios 1) (UFPA) Considerando a equação química: Cl2O7 + 2 NaOH 2 NaClO4 + H2O os reagentes e produtos pertencem, respectivamente, às funções: a) óxido, base, sal e
Funções e reações inorgânicas - Exercícios 1) (UFPA) Considerando a equação química: Cl2O7 + 2 NaOH 2 NaClO4 + H2O os reagentes e produtos pertencem, respectivamente, às funções: a) óxido, base, sal e
UFSC. Química (Amarela) 31) Resposta: 43. Comentário
 UFSC Química (Amarela) 1) Resposta: 4 01. Correta. Ao perder elétrons, o núcleo exerce maior atração sobre os elétrons restantes, diminuindo o raio. Li 1s2 2s 1 Li+ 1s 2 Raio atômico: átomo neutro > íon
UFSC Química (Amarela) 1) Resposta: 4 01. Correta. Ao perder elétrons, o núcleo exerce maior atração sobre os elétrons restantes, diminuindo o raio. Li 1s2 2s 1 Li+ 1s 2 Raio atômico: átomo neutro > íon
Exercícios de Revisão - 2
 Exercícios de Revisão - 2 1. Na tentativa de explicar a origem dos seres vivos, Müller reproduziu, em seu experimento, as condições atmosféricas primitivas, que continham os gases metano (CH4); amônia
Exercícios de Revisão - 2 1. Na tentativa de explicar a origem dos seres vivos, Müller reproduziu, em seu experimento, as condições atmosféricas primitivas, que continham os gases metano (CH4); amônia
Química. Resolução das atividades complementares. Q49 Polaridade das moléculas
 Resolução das atividades complementares 4 Química Q49 Polaridade das moléculas p 7 1 Em relação à polaridade das moléculas, responda: a) Quais as condições para que uma molécula seja polar? b) Uma molécula
Resolução das atividades complementares 4 Química Q49 Polaridade das moléculas p 7 1 Em relação à polaridade das moléculas, responda: a) Quais as condições para que uma molécula seja polar? b) Uma molécula
1ª Série do Ensino Médio
 1ª Série do Ensino Médio 16. Considere as equações abaixo: I. H 2 + Cl 2 2 HCl II. Zn + H 2 SO 4 ZnSO 4 + H 2 III. HNO 3 + KOH KNO 3 + H 2 O IV. KClO 3 KCl + O 2 As quatro equações representam, nesta ordem,
1ª Série do Ensino Médio 16. Considere as equações abaixo: I. H 2 + Cl 2 2 HCl II. Zn + H 2 SO 4 ZnSO 4 + H 2 III. HNO 3 + KOH KNO 3 + H 2 O IV. KClO 3 KCl + O 2 As quatro equações representam, nesta ordem,
Coeficientes de distribuição de metais pesados em solos de São Paulo. Luís Reynaldo F. Alleoni ESALQ/USP Dep. de Ciência do Solo
 Coeficientes de distribuição de metais pesados em solos de São Paulo Luís Reynaldo F. Alleoni ESALQ/USP Dep. de Ciência do Solo Definição de metais pesados Química - grande grupo de elementos com: densidade
Coeficientes de distribuição de metais pesados em solos de São Paulo Luís Reynaldo F. Alleoni ESALQ/USP Dep. de Ciência do Solo Definição de metais pesados Química - grande grupo de elementos com: densidade
Funções inorgânicas - Sais
 Funções inorgânicas - Sais 01. Faça as equações de neutralização (ou salificação) total entre os seguintes compostos: 02. (UNESP) Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto
Funções inorgânicas - Sais 01. Faça as equações de neutralização (ou salificação) total entre os seguintes compostos: 02. (UNESP) Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto
EXERCÍCIOS PROPOSTOS RESUMO. ΔH: variação de entalpia da reação H R: entalpia dos reagentes H P: entalpia dos produtos
 Química Frente IV Físico-química Prof. Vitor Terra Lista 04 Termoquímica Entalpia (H) e Fatores que Alteram o ΔH RESUMO Entalpia (H) é a quantidade total de energia de um sistema que pode ser trocada na
Química Frente IV Físico-química Prof. Vitor Terra Lista 04 Termoquímica Entalpia (H) e Fatores que Alteram o ΔH RESUMO Entalpia (H) é a quantidade total de energia de um sistema que pode ser trocada na
A equação fornecida, quando trabalhada como oxi-redução fica como mostrado abaixo.
 01. Item D A equação fornecida, quando trabalhada como oxi-redução fica como mostrado abaixo. Fe 2 O 3 (s) + C (s) + O 2 (g) Fe (s) + CO 2 + energia +3 0 0 0 +4 2 Redução1 Redução2 Oxidação I Correto.
01. Item D A equação fornecida, quando trabalhada como oxi-redução fica como mostrado abaixo. Fe 2 O 3 (s) + C (s) + O 2 (g) Fe (s) + CO 2 + energia +3 0 0 0 +4 2 Redução1 Redução2 Oxidação I Correto.
QUÍMICA. 3. (FCC BA) A reação abaixo pode ser classificada como endotérmica ou exotérmica? Justifique H2(g) + ½ O2(g) H2O(g) + 242kJ
 QUÍMICA Prof. Arthur LISTA DE EXERCÍCIOS - 2.8: TERMOQUÍMICA 1. (UFMG-MG) O gás natural (metano) é um combustível utilizado, em usinas termelétricas, na geração de eletricidade, a partir da energia liberada
QUÍMICA Prof. Arthur LISTA DE EXERCÍCIOS - 2.8: TERMOQUÍMICA 1. (UFMG-MG) O gás natural (metano) é um combustível utilizado, em usinas termelétricas, na geração de eletricidade, a partir da energia liberada
+1 2 Nox +1 2 Carga Nox +7 8 Carga
 01 Cl 2 Cl Nox = 0 Nox = 1 Cl O +1 2 Nox +1 2 Carga Cl O 4 +7 2 Nox +7 8 Carga Resposta: Respectivamente zero, 1, +1, +7. 1 02 a) NH 4 NO 3 NH 4 + cátion + NO 3 ânion N H 4 + 3 +1 Nox 3 +4 Carga N O 3
01 Cl 2 Cl Nox = 0 Nox = 1 Cl O +1 2 Nox +1 2 Carga Cl O 4 +7 2 Nox +7 8 Carga Resposta: Respectivamente zero, 1, +1, +7. 1 02 a) NH 4 NO 3 NH 4 + cátion + NO 3 ânion N H 4 + 3 +1 Nox 3 +4 Carga N O 3
http://www.rumoaoita.com / - Material escrito por: Marlos Cunha (ITA T-12) Métodos de Balanceamento
 Métodos de Balanceamento Conteúdo Introdução... 1 Método das tentativas... 1 Método algébrico... 1 Método do íon-elétron... 2 Método da oxi-redução... 3 Auto oxi-redução... 3 Balanceamento dependendo do
Métodos de Balanceamento Conteúdo Introdução... 1 Método das tentativas... 1 Método algébrico... 1 Método do íon-elétron... 2 Método da oxi-redução... 3 Auto oxi-redução... 3 Balanceamento dependendo do
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S SÓ ABRA QUANDO AUTORIZADO.
 U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
Prof a. Dr a. Luciana M. Saran
 HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 O QUE É? ANÁLISE TITRIMÉTRICA
HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 O QUE É? ANÁLISE TITRIMÉTRICA
 CaO + H2O Ca(OH)2 3 H2 + 1 N2 2 NH3 3 H2 + 1 N2 2 NH3 + 01) A equação refere-se à transformação de ozônio em oxigênio comum, representada pela equação: 2 O3 3 O2 Os números 2 e 3 que aparecem no lado esquerdo
CaO + H2O Ca(OH)2 3 H2 + 1 N2 2 NH3 3 H2 + 1 N2 2 NH3 + 01) A equação refere-se à transformação de ozônio em oxigênio comum, representada pela equação: 2 O3 3 O2 Os números 2 e 3 que aparecem no lado esquerdo
PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS
 3 PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS QUÍMICA 01 - O dispositivo de segurança que conhecemos como air-bag utiliza como principal reagente para fornecer o gás N 2 (massa molar igual a 28 g mol -1
3 PROCESSO SELETIVO 2006 QUESTÕES OBJETIVAS QUÍMICA 01 - O dispositivo de segurança que conhecemos como air-bag utiliza como principal reagente para fornecer o gás N 2 (massa molar igual a 28 g mol -1
Cinética e Eq. Químico Folha 10 João Roberto Fortes Mazzei
 01. Em um recipiente de 500 ml, encontram-se, em condições de equilíbrio, 10 mol/l de H 2 (g) e 0,01 mol/l de I 2 (g). Qual é a concentração do HI(g), sabendo-se que, nas condições do experimento, a constante
01. Em um recipiente de 500 ml, encontram-se, em condições de equilíbrio, 10 mol/l de H 2 (g) e 0,01 mol/l de I 2 (g). Qual é a concentração do HI(g), sabendo-se que, nas condições do experimento, a constante
Exercícios sobre Termoquímica- lei de hess
 Exercícios sobre Termoquímica- lei de hess 01. (Unesp - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância;
Exercícios sobre Termoquímica- lei de hess 01. (Unesp - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância;
B) (até três pontos) Para os pares de espécies apresentados em i, ii e iii, tem-se, respectivamente, Al +, F - e Li.
 Química 1. O raio atômico (ou iônico) é uma propriedade periódica que exerce grande influência na reatividade dos átomos (ou dos íons). A) Explique, em termos de carga nuclear efetiva, a variação apresentada
Química 1. O raio atômico (ou iônico) é uma propriedade periódica que exerce grande influência na reatividade dos átomos (ou dos íons). A) Explique, em termos de carga nuclear efetiva, a variação apresentada
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
P2 - PROVA DE QUÍMICA GERAL - 11/10/08
 P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
química FUVEST ETAPA Resposta QUESTÃO 1 QUESTÃO 2 c) Determine o volume adicionado da solução
 Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
Reações Químicas. Profº André Montillo
 Reações Químicas Profº André Montillo www.montillo.com.br Definição: É o processo no qual 1 ou mais substâncias (regentes) se transformam em 1 ou mais substâncias novas (produtos). Estão presentes em todos
Reações Químicas Profº André Montillo www.montillo.com.br Definição: É o processo no qual 1 ou mais substâncias (regentes) se transformam em 1 ou mais substâncias novas (produtos). Estão presentes em todos
UFJF CONCURSO VESTIBULAR 2011-2 GABARITO DA PROVA DISCURSIVA DE QUÍMICA
 UFJF CNCURS VESTIBULAR 2011-2 GABARIT DA PRVA DISCURSIVA DE QUÍMICA Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes.
UFJF CNCURS VESTIBULAR 2011-2 GABARIT DA PRVA DISCURSIVA DE QUÍMICA Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes.
Colégio Paulo VI Ensino Médio
 Colégio Paulo VI Ensino Médio Aluno (a): Nº.: 1º Ano - Ensino médio Turma: Turno: Vespertino Disciplina: Química Professor: Willian Prado Data: / / 2015 LISTA 1 Reações Químicas Balanceamento Introdução
Colégio Paulo VI Ensino Médio Aluno (a): Nº.: 1º Ano - Ensino médio Turma: Turno: Vespertino Disciplina: Química Professor: Willian Prado Data: / / 2015 LISTA 1 Reações Químicas Balanceamento Introdução
Reações com transferência de elétrons: oxirredução
 Reações com transferência de elétrons: oxirredução Química Geral Prof. Edson Nossol Uberlândia, 19/05/2016 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto iônico)
Reações com transferência de elétrons: oxirredução Química Geral Prof. Edson Nossol Uberlândia, 19/05/2016 Número de oxidação: número de cargas que um átomo teria em uma molécula (em um composto iônico)
A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas.
 A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas. Não há reação química que ocorra sem variação de energia! A energia é conservativa. Não pode ser criada
A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas. Não há reação química que ocorra sem variação de energia! A energia é conservativa. Não pode ser criada
). Escreva a equação balanceada que representa essa transformação. Resolução: CaCO 3(s) O (,) 1 CO 2(g)
 Resolução das atividades complementares 4 Química Q59 Reações de dupla troca p. 65 1 (Fuvest-SP) A chuva ácida pode transformar o mármore das estátuas em gesso (Ca ). Escreva a equação balanceada que representa
Resolução das atividades complementares 4 Química Q59 Reações de dupla troca p. 65 1 (Fuvest-SP) A chuva ácida pode transformar o mármore das estátuas em gesso (Ca ). Escreva a equação balanceada que representa
Leis Ponderais e Cálculo Estequiométrico
 Leis Ponderais e Cálculo Estequiométrico 1. (UFF 2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos
Leis Ponderais e Cálculo Estequiométrico 1. (UFF 2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos
Resolução Comentada - Química
 Resolução Comentada - Química UFTM 2013 1 Fase Vestibular UFTM 2013 1 Resolução Prova de Química Tipo 1 Questão 76 A soja é considerada um dos alimentos mais completos em termos de propriedades nutricionais,
Resolução Comentada - Química UFTM 2013 1 Fase Vestibular UFTM 2013 1 Resolução Prova de Química Tipo 1 Questão 76 A soja é considerada um dos alimentos mais completos em termos de propriedades nutricionais,
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO. 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3?
 NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
NÚMERO DE OXIDAÇÃO. Porém, nem todos os compostos que existem são formados por íons. Observe a seguinte estrutura: METANO H C
 NÚMER DE XIDAÇÃ INTRDUÇÃ Na química há reações chamadas reações de óxido-redução que são de extrema importância no nosso dia-a-dia. Essas reações (que serão estudadas na próxima unidade) podem apresentar
NÚMER DE XIDAÇÃ INTRDUÇÃ Na química há reações chamadas reações de óxido-redução que são de extrema importância no nosso dia-a-dia. Essas reações (que serão estudadas na próxima unidade) podem apresentar
Química Analítica Avançada: Volumetria de Neutralização. Prof a Lilian Silva 2011
 Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Termoquímica. Química 10/08/2015. Enem 15 Semanas. 1. Observando o diagrama a seguir, é correto afirmar que:
 Termoquímica 1. Observando o diagrama a seguir, é correto afirmar que: [Dadas as massas molares (g/mol): H=1 e O=16] a) para vaporizar 18g de água são liberados 10,5 kcal. b) o calor de reação, na síntese
Termoquímica 1. Observando o diagrama a seguir, é correto afirmar que: [Dadas as massas molares (g/mol): H=1 e O=16] a) para vaporizar 18g de água são liberados 10,5 kcal. b) o calor de reação, na síntese
Química Geral 3º ANO
 Química Geral 3º ANO Teoria de Arrhenius Teoria Ácido-Base Teoria de Arrhenius Teoria Ácido-Base Ácido são substâncias que, dissolvidas em água, se ionizam liberando, na forma de cátions, exclusivamente
Química Geral 3º ANO Teoria de Arrhenius Teoria Ácido-Base Teoria de Arrhenius Teoria Ácido-Base Ácido são substâncias que, dissolvidas em água, se ionizam liberando, na forma de cátions, exclusivamente
EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS 1. INTRODUÇÃO
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS 1. INTRODUÇÃO
Questão 13. Questão 15. Questão 14. alternativa C. alternativa E
 Questão 13 As três substâncias indicadas abaixo são usadas em remédios para gripe, devido a sua ação como descongestionantes nasais: neo-sinefrina propadrina benzedrex Essas três substâncias apresentam
Questão 13 As três substâncias indicadas abaixo são usadas em remédios para gripe, devido a sua ação como descongestionantes nasais: neo-sinefrina propadrina benzedrex Essas três substâncias apresentam
Prova de Química e Biologia
 Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores do IPVC dos Maiores de 23 Anos Prova de Química e Biologia Prova modelo Prova Específica de Química
Provas Especialmente Adequadas Destinadas a Avaliar a Capacidade para a Frequência dos Cursos Superiores do IPVC dos Maiores de 23 Anos Prova de Química e Biologia Prova modelo Prova Específica de Química
QUESTÃO 01 Analise este gráfico, em que se mostra o resultado de um experimento de decomposição térmica de uma substância orgânica:
 QUESTÃO 01 Analise este gráfico, em que se mostra o resultado de um experimento de decomposição térmica de uma substância orgânica: 1. Considere que, durante esse experimento, a diminuição de massa se
QUESTÃO 01 Analise este gráfico, em que se mostra o resultado de um experimento de decomposição térmica de uma substância orgânica: 1. Considere que, durante esse experimento, a diminuição de massa se
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
QUÍMICA Exercícios de revisão resolvidos
 9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
Simulador de Química Reações de dupla-troca
 Lista de exercícios A seguir, apresentamos uma série de exercícios relacionados ao tema de reações de dupla- -troca. Na primeira parte, estão atividades baseadas no conteúdo multimídia Simulador de Química
Lista de exercícios A seguir, apresentamos uma série de exercícios relacionados ao tema de reações de dupla- -troca. Na primeira parte, estão atividades baseadas no conteúdo multimídia Simulador de Química
MECANISMOS BÁSICOS DE CORROSÃO
 Centro Universitário de Brasília Disciplina: Química Tecnológica Geral Professor: Edil Reis MECANISMOS BÁSICOS DE CORROSÃO No estudo dos processos corrosivos devem ser sempre consideradas as variáveis
Centro Universitário de Brasília Disciplina: Química Tecnológica Geral Professor: Edil Reis MECANISMOS BÁSICOS DE CORROSÃO No estudo dos processos corrosivos devem ser sempre consideradas as variáveis
Em quais das passagens destacadas a seguir está ocorrendo uma transformação química?
 Atividade extra Questão 1 Adaptado de UFPE Em quais das passagens destacadas a seguir está ocorrendo uma transformação química? 1. O reflexo de luz nas águas onduladas pelos ventos lembrava-lhe os cabelos
Atividade extra Questão 1 Adaptado de UFPE Em quais das passagens destacadas a seguir está ocorrendo uma transformação química? 1. O reflexo de luz nas águas onduladas pelos ventos lembrava-lhe os cabelos
FUNÇÕES E REAÇÕES INORGÂNICAS
 1. (G1 - cftmg 2016) Sobre as características do dióxido de enxofre (SO 2 ), afirma-se que: I. apresenta geometria angular. II. apresenta ligações covalentes. III. corresponde a um óxido básico. IV. corresponde
1. (G1 - cftmg 2016) Sobre as características do dióxido de enxofre (SO 2 ), afirma-se que: I. apresenta geometria angular. II. apresenta ligações covalentes. III. corresponde a um óxido básico. IV. corresponde
é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos).
 REAÇÕES QUÍMICAS Reação Química é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos). é um fenômeno onde os átomos
REAÇÕES QUÍMICAS Reação Química é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos). é um fenômeno onde os átomos
Final 8 de Maio de 2010
 Final 8 de Maio de 2010 Prova Teórica Nome:.... Escola:....... Pergunta Total Átomo, elemento e núcleo Contar os átomos Massa, moles e concentrações Equações Químicas Classificação teórica Classificação
Final 8 de Maio de 2010 Prova Teórica Nome:.... Escola:....... Pergunta Total Átomo, elemento e núcleo Contar os átomos Massa, moles e concentrações Equações Químicas Classificação teórica Classificação
Fração. Página 2 de 6
 1. (Fgv 2014) De acordo com dados da Agência Internacional de Energia (AIE), aproximadamente 87% de todo o combustível consumido no mundo são de origem fóssil. Essas substâncias são encontradas em diversas
1. (Fgv 2014) De acordo com dados da Agência Internacional de Energia (AIE), aproximadamente 87% de todo o combustível consumido no mundo são de origem fóssil. Essas substâncias são encontradas em diversas
E-books PCNA. Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS
 E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS 1 QUÍMICA ELEMENTAR CAPÍTULO 3 SUMÁRIO Apresentação -------------------------------------------- 3 Capítulo 3 ------------------------------------------------
E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS 1 QUÍMICA ELEMENTAR CAPÍTULO 3 SUMÁRIO Apresentação -------------------------------------------- 3 Capítulo 3 ------------------------------------------------
Energias de ionização (ev) 1ª 2ª 3ª 4ª 5ª 6ª 7ª 8ª X 5,4 75,6 122,4 Y 13,6 35,2 54,9 77,4 113,9 138,1 739,1 871,1
 1. (Cefet MG 2014) Na tabela a seguir, estão representadas as energias de ionização de dois elementos X e Y pertencentes ao segundo período do quadro periódico. Elementos Energias de ionização (ev) 1ª
1. (Cefet MG 2014) Na tabela a seguir, estão representadas as energias de ionização de dois elementos X e Y pertencentes ao segundo período do quadro periódico. Elementos Energias de ionização (ev) 1ª
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre
 PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
CO 3 H 2. (aq) e H 2. O, ocorrendo, portanto, acidose
 11 A maior parte do dióxido de carbono gerado no metabolismo celular, no corpo humano, por reagir rapidamente com a água contida no sangue, é conduzida pela corrente sanguínea, para eliminação nos pulmões.
11 A maior parte do dióxido de carbono gerado no metabolismo celular, no corpo humano, por reagir rapidamente com a água contida no sangue, é conduzida pela corrente sanguínea, para eliminação nos pulmões.
Condutividade de Soluções Aquosas, Funções e Reações Inorgânicas
 Ensino Médio QUÍMICA Data: / /01 Atividade : Exercícios de Recuperação Paralela e Anual aula Nome : n o Classe: 1MB Condutividade de Soluções Aquosas, Funções e Reações Inorgânicas 1. (Espcex (Aman)) Considere
Ensino Médio QUÍMICA Data: / /01 Atividade : Exercícios de Recuperação Paralela e Anual aula Nome : n o Classe: 1MB Condutividade de Soluções Aquosas, Funções e Reações Inorgânicas 1. (Espcex (Aman)) Considere
Associe corretamente a coluna da direita à da esquerda.
 1. (G1 - ifba 2014) A respeito da geometria, polaridade e ligações químicas das moléculas dos compostos, previstas por suas estruturas de Lewis, pode-se afirmar corretamente que a) a molécula do PC 3 é
1. (G1 - ifba 2014) A respeito da geometria, polaridade e ligações químicas das moléculas dos compostos, previstas por suas estruturas de Lewis, pode-se afirmar corretamente que a) a molécula do PC 3 é
Atividade complementar de Química. Transformação química das substâncias. Atenção
 Atividade complementar de Química Transformação química das substâncias Educação de Jovens e Adultos Nas transformações químicas, também conhecida como reação química, as substâncias são transformadas
Atividade complementar de Química Transformação química das substâncias Educação de Jovens e Adultos Nas transformações químicas, também conhecida como reação química, as substâncias são transformadas
Resolução: 0,86ºC. x = 0,5 mol etanol/kg acetona. 0,5 mol 1000 g de acetona. 200 g de acetona. y = 0,1 mol de etanol. 1 mol de etanol (C 2 H 6 O) 46 g
 (ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
(ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS EXTRAS 2º TRIMESTRE 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professor: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professor: Lúcia Nascimento COMPONENTE CURRICULAR:
ELETROQUÍMICA (Parte II)
 ELETROQUÍMICA (Parte II) I ELETRÓLISE A eletrólise é um processo de oxirredução não espontâneo, em que a passagem da corrente elétrica em uma solução eletrolítica (solução com íons), produz reações químicas.
ELETROQUÍMICA (Parte II) I ELETRÓLISE A eletrólise é um processo de oxirredução não espontâneo, em que a passagem da corrente elétrica em uma solução eletrolítica (solução com íons), produz reações químicas.
