Revisão Profº Almir Química Kapa
|
|
|
- Miguel Igrejas Quintanilha
- 7 Há anos
- Visualizações:
Transcrição
1 1. (Unesp 016) Analise as fórmulas que representam as estruturas do retinol (vitamina A), lipossolúvel, e do ácido pantotênico (vitamina B5), hidrossolúvel. Com base na análise das fórmulas, identifique as funções orgânicas presentes em cada vitamina e justifique por que a vitamina B5 é hidrossolúvel e a vitamina A é lipossolúvel. Qual dessas vitaminas apresenta isomeria óptica? Justifique sua resposta.. (Unesp 016) A malaquita é um mineral cuja composição é dada pela fórmula Cu (OH) CO. Por aquecimento a seco, a malaquita produz óxido de cobre (II), um sólido preto, além de água e dióxido de carbono, ambos no estado gasoso. O óxido de cobre (II), por sua vez, reage com solução aquosa de ácido sulfúrico, originando uma solução aquosa azul de sulfato de cobre (II). Por evaporação da água, formam-se cristais azuis de CuSO4 5HO. Escreva a equação química do aquecimento a seco da malaquita produzindo óxido de cobre(ii), água e dióxido de carbono e, em seguida, a equação química da reação do óxido de cobre(ii) com a solução aquosa de ácido sulfúrico. Admitindo rendimento de 100%, calcule a massa de sulfato de cobre penta-hidratado obtida a partir de,1 g de malaquita. Dados: Cu 6,5; O 16; H 1; C 1; S.. (Unesp 016) Em 1840, o cientista Germain Henri Hess ( ) enunciou que a variação de entalpia ( H) em uma reação química é independente do caminho entre os estados inicial e final da reação, sendo igual à soma das variações de entalpias em que essa reação pode ser desmembrada. Durante um experimento envolvendo a Lei de Hess, através do calor liberado pela reação de neutralização de uma solução aquosa de ácido cianídrico (HCN) e uma solução aquosa de hidróxido de sódio (NaOH), foi 1 obtido o valor de,9 kcal mol para a entalpia nesta reação. Sabendo que a entalpia liberada pela 1 neutralização de um ácido forte e uma base forte é de 1, kcal mol que o ácido cianídrico é um ácido muito fraco e que o hidróxido de sódio é uma base muito forte, calcule a entalpia de ionização do ácido cianídrico em água e apresente as equações químicas de todas as etapas utilizadas para esse cálculo. 4. (Unesp 016) O metanol, CHOH, é uma substância de grande importância para a indústria química,
2 como matéria-prima e como solvente. Esse álcool é obtido industrialmente pela reação entre os gases CO e H, conforme a equação: CO(g) H (g) CHOH(g) ΔH 10kJ mol de metanol Para realizar essa reação, os gases reagentes, misturados na proporção estequiométrica e em presença de catalisador (geralmente prata ou cobre), são comprimidos a 06 atm e aquecidos a 00 C. Nessas condições, o equilíbrio apresenta um rendimento de 60% no sentido da formação de metanol. Escreva a expressão da constante K p desse equilíbrio e explique o papel do catalisador na reação entre os gases CO e H. Com base no princípio de Le Chatelier, justifique a importância da compressão desses gases para a produção de metanol e explique o que aconteceria com o rendimento do equilíbrio no sentido da formação de metanol, caso a reação ocorresse em temperaturas superiores a 00 C. TEXTO PARA AS PRÓXIMAS QUESTÕES: Leia o texto para responder à(s) quest(ões). Em um laboratório, uma estudante sintetizou sulfato de ferro (II) hepta-hidratado (FeSO 4 7HO) a partir de ferro metálico e ácido sulfúrico diluído em água. Para tanto, a estudante pesou, em um béquer, 14,9 g de ferro metálico de pureza 98,00%. Adicionou água destilada e depois, lentamente, adicionou excesso de ácido sulfúrico concentrado sob agitação. No final do processo, a estudante pesou os cristais de produto formados. 5. (Unesp 016) Para a síntese do sulfato de ferro(ii) hepta-hidratado, após a reação entre ferro metálico e ácido sulfúrico, a estudante deixou o béquer resfriar em banho de gelo, até a cristalização do sal hidratado. A seguir, a estudante separou o sólido por filtração, o qual, após ser devidamente lavado e secado, apresentou massa igual a 5,1 g. 1 Dadas as massas molares (gmol ) : Fe 56,0; S,0; H 1,0; O 16,0, escreva a equação balanceada da reação global de formação do sulfato de ferro (II) hepta-hidratado sintetizado pela estudante e calcule o rendimento da reação a partir do ferro metálico e do ácido sulfúrico. 6. (Unesp 016) A tabela apresenta os valores de potencial-padrão para algumas semirreações. Equação de semirreação H (aq) e H (g) E (V) 1 (1mol,100 kpa e 5 C) 0,00 Fe (aq) e Fe (s) 0,44 Considerando que o experimento foi realizado pela estudante nas condições ambientes, escreva as equações das semirreações e a equação global da reação entre o ferro metálico e a solução de ácido sulfúrico. Tendo sido montada uma célula galvânica com as duas semirreações, calcule o valor da força eletromotriz da célula ( E ). 7. (Unesp 015) Em um laboratório, nas condições ambientes, uma determinada massa de carbonato de cálcio (CaCO ) foi colocada para reagir com excesso de ácido nítrico diluído. Os valores do volume de gás liberado pela reação com o transcorrer do tempo estão apresentados na tabela.
3 tempo (min) volume de gás (cm ) Escreva a equação balanceada da reação e calcule a velocidade média da reação, em no intervalo entre 1 minuto e minutos. Dado: Volume molar do nas condições ambientes = 8. (Unesp 015) A indústria de doces utiliza grande quantidade de açúcar invertido para a produção de biscoitos, bolos, bombons, dentre outros produtos. O açúcar invertido consiste em um xarope transparente, isento de odores, com poder edulcorante maior que o da sacarose e é obtido a partir da reação de hidrólise ácida ou enzimática, de acordo com a equação: catalisador sacarose glicose frutose C H O H O C H O C H O 1 Em uma reação de hidrólise enzimática, inicialmente, a concentração de sacarose era de 0,1 mol L. Após 1 10 h de reação, a concentração caiu para 0,06 mol L e, após 0 h de reação, a concentração caiu para 1 0,0 mol L. Determine a meia-vida da reação e a velocidade média de consumo da sacarose, em 1 1 mol L min, no intervalo entre 600 e 100 min. TEXTO PARA AS PRÓXIMAS QUESTÕES: Em um laboratório didático, um aluno montou pilhas elétricas usando placas metálicas de zinco e cobre, separadas com pedaços de papel-toalha, como mostra a figura. Utilizando três pilhas ligadas em série, o aluno montou o circuito elétrico esquematizado, a fim de produzir corrente elétrica a partir de reações químicas e acender uma lâmpada. Com o conjunto e os contatos devidamente fixados, o aluno adicionou uma solução de sulfato de cobre aos pedaços de papel-toalha de modo a umedecê-los e, instantaneamente, houve o acendimento da lâmpada. 9. (Unesp 015) Sabe-se que o aluno preparou 400 ml de solução de sulfato de cobre com concentração 1 igual a 1,00 mol L. Utilizando os dados da Classificação Periódica, calcule a massa necessária de sal utilizada no preparo de tal solução e expresse a equação balanceada de dissociação desse sal em água. 10. (Unesp 015) A tabela apresenta os valores de potencial-padrão para algumas semirreações.
4 Equação de semirreação (aq) (g) E (V) H e H 0,00 (aq) (s) 1 (1mol L, Zn e Zn 0,76 (aq) (s) Cu e Cu 0,4 100kPa e 5 C) Considerando os dados da tabela e que o experimento tenha sido realizado nas condições ambientes, escreva a equação global da reação responsável pelo acendimento da lâmpada e calcule a diferença de potencial (ddp) teórica da bateria montada pelo estudante. TEXTO PARA AS PRÓXIMAS QUESTÕES: Chama-se titulação a operação de laboratório realizada com a finalidade de determinar a concentração de uma substância em determinada solução, por meio do uso de outra solução de concentração conhecida. Para tanto, adiciona-se uma soluçãopadrão, gota a gota, a uma solução-problema (solução contendo uma substância a ser analisada) até o término da reação, evidenciada, por exemplo, com uma substância indicadora. Uma estudante realizou uma titulação ácido-base típica, titulando de uma solução aquosa de e gastando de uma solução padrão de de concentração igual a 11. (Unesp 015) Utilizando os dados do texto, apresente a equação balanceada de neutralização envolvida na titulação e calcule a concentração da solução de Ca(OH) (Unesp 015) Para preparar 00 ml da solução-padrão de concentração 0,10 mol L utilizada na titulação, a estudante utilizou uma determinada alíquota de uma solução concentrada de HNO, cujo título 1 era de 65,0% (m m) e a densidade de 1,50 g ml. Admitindo-se a ionização de100% do ácido nítrico, expresse sua equação de ionização em água, calcule o volume da alíquota da solução concentrada, em ml, e calcule o ph da solução-padrão preparada. Dados: 1 Massa molar do HNO 6,0 g mol ph log[h ] 1. (Unesp 014) Em sua edição de julho de 01, a revista Pesquisa FAPESP, sob o título Voo Verde, anuncia que, até 050, os motores de avião deverão reduzir em 50% a emissão de dióxido de carbono, em relação às emissões consideradas normais em 005. Embora ainda em fase de pesquisa, um dos caminhos tecnológicos para se atingir essa meta envolve a produção de bioquerosene a partir de caldo de cana-deaçúcar, com a utilização de uma levedura geneticamente modificada. Essas leveduras modificadas atuam no processo de fermentação, mas, ao invés de etanol, produzem a molécula conhecida como farneseno, fórmula molecular C 15H 4, cuja fórmula estrutural é fornecida a seguir.
5 14. (Unesp 014) Dentre as etapas utilizadas nas Estações de Tratamento de Água (ETAs), a floculação é um processo que visa retirar as partículas em suspensão presentes na água a ser tratada. Isso é conseguido mediante a adição de reagentes químicos que produzirão um hidróxido gelatinoso e pouco solúvel, capaz de adsorver partículas suspensas, de modo a formar flocos. Em seguida, a água é submetida à agitação mecânica para possibilitar que os flocos se agreguem com as demais partículas em suspensão, permitindo sua decantação mais rápida. Em determinada ETA, o processo de floculação foi realizado adicionando-se hidróxido de cálcio à água captada e, em seguida, adicionando-se cloreto de ferro III. Considerando que os reagentes encontram-se dissolvidos em água, escreva a equação química balanceada que representa a reação ocorrida entre hidróxido de cálcio e cloreto de ferro III e escreva o nome do produto responsável pela floculação. TEXTO PARA AS PRÓXIMAS QUESTÕES: Leia o texto para responder à(s) questão(ões) a seguir. A hidrazina, substância com fórmula molecular NH 4, é um líquido bastante reativo na forma pura. Na forma de seu monoidrato, NH4 HO, a hidrazina é bem menos reativa que na forma pura e, por isso, de manipulação mais fácil. Devido às suas propriedades físicas e químicas, além de sua utilização em vários processos industriais, a hidrazina também é utilizada como combustível de foguetes e naves espaciais, e em células de combustível. 15. (Unesp 014) A atuação da hidrazina como propelente de foguetes envolve a seguinte sequência de reações, iniciada com o emprego de um catalisador adequado, que rapidamente eleva a temperatura do sistema acima de 800 C: N H ( ) 4 NH (g) N (g) 4 NH 4 ( ) 4 NH (g) N (g) 8 H (g) Por hidrogenação total, o farneseno é transformado em farnesano, conhecido como bioquerosene. Nessa reação de hidrogenação, a cadeia carbônica original do farneseno é mantida. Dados: Massas molares, em g. mol 1 : N = 14,0; H = 1,0 Volume molar, medido nas Condições Normais de Temperatura e Pressão (CNTP) =,4 L Calcule a massa de H e o volume total dos gases formados, medido nas CNTP, gerados pela decomposição estequiométrica de 1,0 g de NH 4 ( ). 16. (Unesp 014) Observe o esquema de uma célula de combustível de hidrazina monoidratada/oxigênio do ar em funcionamento, conectada a um circuito elétrico externo. No compartimento representado no lado esquerdo do esquema, é introduzido apenas o reagente NH4 HO, obtendo-se os produtos N (g) e HO ( ) em sua saída. No compartimento representado no lado direito do esquema, são introduzidos os reagentes O (g) e HO ( ), sendo HO ( ) consumido apenas parcialmente na semirreação, e seu excesso liberado inalterado na saída do compartimento.
6 Escreva a equação química balanceada que representa a reação global que ocorre durante o funcionamento dessa célula de combustível e indique os estados de oxidação, nos reagentes e nos produtos, do elemento que é oxidado nesse processo. TEXTO PARA AS PRÓXIMAS QUESTÕES: O valor da Constante de Avogadro é determinado experimentalmente, sendo que os melhores valores resultam da medição de difração de raios X de distâncias reticulares em metais e em sais. O valor obtido mais recentemente e = recomendado é Um modo alternativo de se determinar a Constante de Avogadro é utilizar experimentos de eletrólise. Essa determinação se baseia no princípio enunciado por Michael Faraday ( ), segundo o qual a quantidade de produto formado (ou reagente consumido) pela eletrólise é diretamente proporcional à carga que flui pela célula eletrolítica. Observe o esquema que representa uma célula eletrolítica composta de dois eletrodos de zinco metálico imersos em uma solução de sulfato de zinco (ZnSO 4). Os eletrodos de zinco estão conectados a um circuito alimentado por uma fonte de energia (CC), com corrente contínua, em série com um amperímetro (Amp) e com um resistor (R) com resistência ôhmica variável. 17. (Unesp 014) Calcule a massa de sulfato de zinco (ZnSO 4) necessária para se preparar 00 ml da solução utilizada no experimento e escreva a equação que representa a dissociação deste sal em água. 1 Dados: Massas molares, em gmol : Zn 65,4; S,1; O 16,0 18. (Unesp 014) Após a realização da eletrólise aquosa, o eletrodo de zinco que atuou como catodo no experimento foi levado para secagem em uma estufa e, posteriormente, pesado em uma balança analítica. Os resultados dos parâmetros medidos estão apresentados na tabela. parâmetro carga massa do eletrodo de Zn inicial (antes da realização da eletrólise) massa do eletrodo de Zn final (após a realização da eletrólise) medida 168 C,5000 g,5550 g Escreva a equação química balanceada da semirreação que ocorre no catodo e calcule, utilizando os dados experimentais contidos na tabela, o valor da Constante de Avogadro obtida. Dados: Massa molar, em Carga do elétron, em
7 19. (Unesp 01) As fórmulas apresentadas a seguir, numeradas de 1 a 6, correspondem a substâncias de mesma fórmula molecular. Determine a fórmula molecular dessas substâncias e escreva a fórmula estrutural completa do álcool primário que apresenta carbono assimétrico (quiral). 0. (Unesp 01) A taurina é uma substância química que se popularizou como ingrediente de bebidas do tipo energéticos. Foi isolada pela primeira vez a partir da bile bovina, em (Unesp 01) Leia a notícia publicada em janeiro de 01. China volta a registrar níveis alarmantes de poluição atmosférica Névoa voltou a encobrir céu de cidades chinesas, como a capital Pequim. Governo chinês emitiu alerta à população para os próximos dias. (g1.globo.com) O carvão mineral é a principal fonte de poluição do ar na China. Diariamente, o país queima milhões de toneladas de carvão para produzir energia elétrica, aquecer as casas e preparar alimentos. Além do carvão, o aumento do número de carros movidos a gasolina tem papel significativo no agravamento da poluição atmosférica. Entre as substâncias que poluem o ar da China estão o SO e compostos relacionados. Considere as equações seguintes: SO g O g SO g (1) () SO g H O g H SO g 4 Escreva a equação química que expressa a constante de equilíbrio para a reação (1). Sabendo que uma usina de geração de energia elétrica movida a carvão liberou SO suficiente para formar 1 kg de SO e considerando a reação (), calcule a massa de H SO 4, em g, que se forma quando há vapor de água suficiente para reagir completamente com a quantidade de SO liberada pela usina.. (Unesp 01) Uma forma de obter hidrogênio no laboratório é mergulhar zinco metálico em uma solução de ácido clorídrico, conforme a reação descrita pela equação apresentada a seguir. Zn(s) HC (aq) ZnC (aq) H (g) Na literatura médica e científica, a taurina é frequentemente apresentada como um aminoácido. Entretanto, tecnicamente a taurina é apenas uma substância análoga aos aminoácidos. Explique por que a taurina não pode ser rigorosamente classificada como um aminoácido e, sabendo que, em soluções aquosas de ph neutro, a taurina encontra-se como um sal interno, devido aos grupos ionizados (zwitterion), escreva a equação que representa essa dissociação em água com ph igual a 7.
8 Considere que uma tira de zinco metálico foi colocada em um recipiente contendo HC em solução aquosa na concentração de 1 mol/l. Em 0 segundos a temperatura do recipiente elevou-se em 0,05 C e 5 ml de hidrogênio foram produzidos. Considerando que essa reação ocorreu a 7 C e 1 atm, determine a velocidade da reação em ml H /s e em mol H /s. 1 1 Use: R 0,08 L atm K mol. (Unesp 01) A imagem é a fotografia de uma impressão digital coletada na superfície de um pedaço de madeira. Para obtê-la, foi utilizada uma técnica baseada na reação entre o sal do suor presente na impressão digital, com solução aquosa diluída de um reagente específico. Depois de secar em uma câmara escura, a madeira é exposta à luz solar. Considere soluções aquosas diluídas de AgNO e de KNO. Indique qual delas produziria um registro fotográfico de impressão digital ao reagir com o sal do suor, nas condições descritas, e justifique sua resposta descrevendo as reações químicas envolvidas. 4. (Unesp 01) O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador. Com base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador.
9 Gabarito: Resposta da questão 1: Funções orgânicas presentes em cada vitamina: A vitamina B5 é hidrossolúvel, pois apresenta grupos que fazem ligações de hidrogênio com a água, ou seja, as funções álcool, amida e ácido carboxílico. A vitamina A é lipossolúvel, pois é predominantemente apolar, fazendo dipolo-induzido com as cadeias de moléculas de gordura. A vitamina B5 ou ácido pantotênico apresenta isomeria óptica, pois possui carbono quiral ou assimétrico. Resposta da questão : Equação química do aquecimento a seco da malaquita produzindo óxido de cobre(ii), água e dióxido de carbono: Δ Cu (OH) CO CuO HO CO Balanceando : Δ Cu (OH) CO(s) CuO(s) 1H O(g) 1CO(g) Equação química da reação do óxido de cobre(ii) com a solução aquosa de ácido sulfúrico: CuO H SO CuSO H O (s) 4(aq) 4(aq) ( ) Cálculo da massa de sulfato de cobre penta-hidratado obtida a partir de,1 g de malaquita:
10 Cu (OH) CO(s) CuO(s) CuO(s) CuSO4(aq) 1H O(g) 1CO(g) HSO4(aq) CuSO4(aq) H O( ) 10H O( ) CuSO 4.5H O(s) Cu (OH) CO(s) HSO4(aq) 10H O( ) H O(g) 1CO(g) CuSO4 5H O(s) m 1 g,1 g CuSO45HO 49,9 g Resposta da questão : 49,5 g 4,95 g Δ 1 Δ 1 ácido base forte forte HCN(aq) NaOH(aq) Na (aq) CN (aq) H O( ) H,9 kcal mol H (aq) OH (aq) H O( ) H 1, kcal mol Então, HCN(aq) Na (aq) OH (aq) Na (aq) CN (aq) HO( ) 1 ΔH1,9 kcal mol HO( ) H (aq) OH (aq) 1 ΔH 1, kcal mol HCN(aq) Global H (aq) CN (aq) ΔH ΔH1 ΔH ΔH,9 1, 10,4 kcal Resposta da questão 4: Expressão da constante CO(g) H (g) CHOH(g) pch OH Kp pco ph K desse equilíbrio: p Importância da compressão ou aumento de pressão: o equilíbrio é deslocado no sentido do menor volume, o que acarreta maior rendimento no sentido da produção de metanol. CO(g) H (g) CH OH(g) volume 1 vol vol 1 vol 1 volume volume 1 volume P V k P V k Deslocamento para a direita volume 1 volume Deslocamento 1 CO(g) H (g) 1 CH OH(g)
11 Caso a reação ocorresse em temperaturas superiores a 00 C, o processo exotérmico seria desfavorecido e o processo endotérmico seria favorecido. O equilíbrio deslocaria para a esquerda ocorrendo diminuição no rendimento da produção de metanol. Exotérmico (favorecido pela diminuição da temperatura) Endotérmico (favorecido pela elevação da temperatura) CO(g) H (g) CH OH(g) Δ H 10kJ mol de metanol Observação: a velocidade aumenta com a elevação da temperatura, porém o rendimento no sentido da produção de metanol diminui. Resposta da questão 5: Equação balanceada da reação global de formação do sulfato de ferro (II): Global Fe(s) 7H O( ) HSO 4(aq) H (g) FeSO 4.7H O(s) De acordo com o texto fornecido na questão, no laboratório a estudante sintetizou sulfato de ferro (II) hepta-hidratado (FeSO 4 7HO) a partir de ferro metálico e ácido sulfúrico diluído em água. Para tanto, ela pesou, em um béquer, 14,9 g de ferro metálico de pureza 98,00%. Então: Global 4 4 Fe(s) 7H O( ) H SO (aq) H (g) FeSO.7H O(s) 56 g 78 gr 14,9 0,98 g 5,1 g 56 5,1 r 0, ,98 % 14,9 0,98 78 Resposta da questão 6: H (aq) e H (g) Fe (s) Fe (aq) e (redução) (oxidação) Global H (aq) Fe (s) H (g) Fe (aq) H (aq) e H (g) o E 0,00 V Fe (aq) e Fe (s) o E 0,44 V 0,00 V 0,44 V o ΔE Emaior Emenor 0,00 ( 0,44) 0,44 V o ΔE 0,44 V Resposta da questão 7: Equação balanceada da reação: CaCO (s) HNO (aq) 1HO( ) CO (g) Ca(NO ) (aq). De acordo com a tabela, vem:
12 tempo 1 min min volume de gás 150 cm 0,15L 40 cm 0,4 L min 00 cm 0,0 L Tempo de 1 minuto V 0,15 L n n 1 mol 1 minuto 1 minuto 5 L 0,15 L 0,006 mol Tempo de minutos V 0,0 L 1 mol 5 L n n 1 minuto 1 minuto 0,0 L 0,01 mol v v média média Δn 0,01 mol 0,006 mol Δt min1 min 0,00 mol/min Resposta da questão 8: Teremos: [sacarose] : concentração molar da sacarose t 1 : tempo de meia vida (tempo que demora para metade do reagente reagir) t 1 t 1 t 1 t 1 [sacarose] [sacarose] [sacarose] [sacarose] tempo de reação 0 h [ sacarose] inicial 0,1 mol / L t1 t1 0,1 mol / L 0,1 mol / L 0,1 mol / L 4 t 1 0 h t 1 10 h 10 h 10 h 0,1 mol / L 0,06 mol / L 0,0 mol / L 1 1 Cálculo da velocidade média de consumo da sacarose, em mol L min, no intervalo entre 600 min (10 60 min 10 h) e 100 min (060 min 0 h) : Δ[sacarose] vmédia Δt 0,0 mol / L 0,06 mol / L vmédia 5 10 mol L min 100 min 600 min vmédia 5 10 mol L min
13 Resposta da questão 9: 1 O aluno preparou 400 ml de solução de sulfato de cobre (CuSO 4) com concentração igual a 1,00 mol L. Então: CuSO4 159, ml n 400 ml CuSO4 CuSO4 CuSO4 0,4 mol 1,00 mol de CuSO 4 n CuSO4 m 0,4 159,6 6,84 g m 6,84 g Equação balanceada de dissociação do sulfato de cobre em água: HO 4 4 CuSO (s) Cu (aq) SO (aq) Resposta da questão 10: De acordo com a tabela, teremos: Maior potencial elétrico: 0,4 V. Menor potencial elétrico: 0,76 V. Então, 0 Zn (aq) e Zn(s) E 0,76 V 0 Cu (aq) e Cu(s) E 0,4 V 0,4 V 0,76 V Zn(s) Zn (aq) e (oxidação) Cu (aq) e Cu(s) (redução) Global Zn(s) Cu (aq) Zn (aq) Cu(s) ΔE Emaior Emenor ou ΔE Eredução Eoxidação ΔE 0,4 ( 0,76) 1,10 V ΔE 1,10 V ou ΔE 0,4 0,76 1,10 V ΔE 1,10 V Para um conjunto de três pilhas ligadas em série deve-se somar as diferenças de potenciais. ΔE ddp ΔE 1,10 1,10 1,10,0 V ΔE,0 V
14 Resposta da questão 11: De acordo com o texto, utilizou-se 5 ml de uma solução aquosa de Ca(OH) e 0,0 ml de uma solução 1 padrão de HNO de concentração igual a 0,10 mol L. Equação balanceada de neutralização envolvida na titulação: HNO (aq) Ca(OH) (aq) H O( ) Ca(NO ) (aq). VCa(OH) (aq) 5 ml VHNO (aq) 0,0 ml [HNO ] 0,10 mol/l n Ca(OH) [Ca(OH) ] VCa(OH) (aq) n HNO [HNO ] VHNO (aq) HNO (aq) Ca(OH) (aq) HO( ) Ca(NO ) (aq) mols 1 mol nhno nca(oh) [HNO ] VHNO (aq) [Ca(OH) ] VCa(OH) (aq) 0,10 mol/ L 0 ml [Ca(OH) ] 5 ml [Ca(OH) ] 0,04 mol/ L Resposta da questão 1: Utilizou-se uma alíquota de uma solução concentrada de HNO, cujo título era de 65,0% (m m) e a 1 densidade de 1,50 g ml. Então,
15 Concentração comum (HNO ) : chno Concentração molar (HNO ) : [HNO ] Massa molar (HNO ) : MHNO chno Título densidade chno 0, g/l chno 975 g/l c HNO [HNO ] MHNO 975 g/l [HNO ] 6 g/mol [HNO ] 15,476 mol/ L n HNO (solução) n HNO (solução padrão) [HNO ] V [HNO ] padrão Vpadrão 15,476 mol/l V 0,10 mol/l 0, L V 0,0019 L V 1,9 ml Cálculo do ph da solução padrão preparada : 100 % de ionização HNO H NO 0,1 mol/l 0,1 mol/l 0,1 mol/l 1 [H ] 0,1 mol/l 10 mol/l ph log[h ] 1 ph log10 ph 1 Resposta da questão 1: Hidrogenação total do farneseno: Combustão completa de 1 mol do farnesano (C15H ) : 1C15H O 15 CO 16 HO Resposta da questão 14:
16 Ca(OH) FeC Fe(OH) CaC O hidróxido de Ferro III, Fe(OH), é o composto químico responsável pela floculação. Resposta da questão 15: Somando as equações estequiométricas, teremos: NH 4 ( ) 4 NH (g) N (g) NH 4 ( ) 4 NH (g) N (g) 8 H (g) 4 NH 4 ( ) 4 N (g) 8 H (g) 1 1 NH4 g.mol ; H g.mol 4 NH 4 ( ) 4 N (g) 8 H (g) 4 g 8 g m H 1g 0,15 g m H 4 NH 4 ( ) 4 N (g) 8 H (g) 1 volumes 4 g 1,4 L 1g Vtotal,10 L Vtotal Resposta da questão 16: Teremos: Teremos: NH 4 HO NH 4 HO Então:
17 N H 4 HO O H O 4e N 4H 4e HO (em I) 4OH 4 4 Equação 4 global (em II) N H O H O N 4H 4OH N H O H O N 4H O N H O N H O 4 HO 0 (oxidação do nitrogênio) Resposta da questão 17: concentração 0,1molL V 0,L MM ZnSO4 161,5 g mol 1 1 Usando a fórmula da molaridade, teremos: m concentração molar MM V m 0,1 m 4,84g 161,5 0, Equação de dissociação do ZnSO 4 em água: HO 4(s) (aq) 4(aq) ZnSO Zn SO Resposta da questão 18: A semirreação que ocorre no cátodo é a redução do zinco, dada por: 0 Zn(aq) e Zn(s) Cálculo da Constante de Avogadro: A massa de zinco depositada no cátodo, de acordo com a tabela, foi: Massa depositada: m f m i =,5550g,5000g = 0,055g de Zn. Quantidade de carga do processo: 1e 1, C 1mol de e x 19 x 1mol de e 1,6 10 C Assim:
18 0 (aq) (s) Zn e Zn 19 1mol de e (1,6 10 C) 65,4g 1mol de e 6, C 0,055g Resposta da questão 19: Fórmula molecular dessas substâncias (todas as fórmulas possuem 5 carbonos, 1 hidrogênios e 1 oxigênio): C5H1 O. Fórmula estrutural completa do álcool primário (hidroxila ligada a carbono primário) que apresenta carbono assimétrico (quiral): Resposta da questão 0: Um aminoácido possui o grupo amino e o grupo carboxila. Percebe-se pela análise da fórmula da taurina que esta molécula possui o grupo amino e o grupo (ácido) sulfônico. Por isso, rigorosamente não pode ser classificada como um aminoácido. Equação que representa essa dissociação em água com ph igual a 7: Resposta da questão 1:
19 Equações que podem expressar a constante de equilíbrio: p SO P SO O [SO ] K ou K [SO ] [O ] p p Estequiometria da reação: SO (g) HO( ) HSO 4(g) 80 g 98 g 1000 g m HSO4 15 g m HSO4 Resposta da questão : Cálculo da velocidade da reação em ml H /s: Volume de H produzido 5 ml v 1,5 ml / s tempo 0 s Cálculo da velocidade da reação em mol H /s: P V nr T n 0, ml 77 n 1,0 10 mol 1,0 10 mol 5 vh 5,1 10 mol / s 0 s Resposta da questão : Um registro fotográfico de impressão digital seria formado por prata sólida. Então, teremos: NaC (aq) AgNO (aq) NaNO (aq) AgC (s) Pr esente Pr ecipitado no suor AgC (s) Ag(s) C (g) Registro da digital Resposta da questão 4: O catalisador diminui a energia de ativação do sistema, pois altera o caminho da reação. Logo, a curva II representa a reação na presença de catalisador. O valor da variação de entalpia ( H) permanece constante.
20
21
Química - UNESP fase
 Química - UNESP -015-014- fase 1. (Unesp 015) Em um laboratório, nas condições ambientes, uma determinada massa de carbonato de cálcio (CaCO ) foi colocada para reagir com excesso de ácido nítrico diluído.
Química - UNESP -015-014- fase 1. (Unesp 015) Em um laboratório, nas condições ambientes, uma determinada massa de carbonato de cálcio (CaCO ) foi colocada para reagir com excesso de ácido nítrico diluído.
Essa substância é obtida pela reação entre ácido mirístico de alta pureza e álcool isopropílico.
 1. (Unesp 2017) A fórmula representa a estrutura do miristato de isopropila, substância amplamente empregada na preparação de cosméticos, como cremes, loções, desodorantes e óleos para banho. Essa substância
1. (Unesp 2017) A fórmula representa a estrutura do miristato de isopropila, substância amplamente empregada na preparação de cosméticos, como cremes, loções, desodorantes e óleos para banho. Essa substância
GABARITO - Revisão UNESP/ UNIFESP 2015
 GABARITO - Revisão UNESP/ UNIFESP 015 Resposta da questão 1: a) Coposto 1: aida. Coposto : álcool. b) A estrutura 1 apresenta isoeria óptica, pois possui carbono quiral ou assiétrico (*). O caráter ácido-básico
GABARITO - Revisão UNESP/ UNIFESP 015 Resposta da questão 1: a) Coposto 1: aida. Coposto : álcool. b) A estrutura 1 apresenta isoeria óptica, pois possui carbono quiral ou assiétrico (*). O caráter ácido-básico
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Unesp 2ª fase revisão Questão 01 - (UNESP SP/2018) No cultivo hidropônico, a composição
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Unesp 2ª fase revisão Questão 01 - (UNESP SP/2018) No cultivo hidropônico, a composição
Pb 2e Pb E 0,13 v. Ag 2e Ag E +0,80 v. Zn 2e Zn E 0,76 v. Al 3e Al E 1,06 v. Mg 2e Mg E 2,4 v. Cu 2e Cu E +0,34 v
 QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUI 01 PROF. Claudio Equilíbrio químico e ph
 facebook.com/proj.medicina QUI 01 PROF. Claudio Equilíbrio químico e ph RESOLUÇÃO DAS QUESTÕES DE AULA 1. (Unifesp 017) Certo produto utilizado como tira-ferrugem contém solução aquosa de ácido oxálico,
facebook.com/proj.medicina QUI 01 PROF. Claudio Equilíbrio químico e ph RESOLUÇÃO DAS QUESTÕES DE AULA 1. (Unifesp 017) Certo produto utilizado como tira-ferrugem contém solução aquosa de ácido oxálico,
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
QUÍMICA Prof. Marcelo ESTEQUIOMETRIA FIXAÇÃO. Nomelini Química Página 1. = 1 g mol; C = 12 g mol e O = 16 g mol
 QUÍMICA Prof. Marcelo ESTEQUIOMETRIA FIXAÇÃO 01. No Brasil, o etanol (álcool etílico) é obtido principalmente por processos fermentativos. O material a ser fermentado pode ser obtido de cana-de-açúcar,
QUÍMICA Prof. Marcelo ESTEQUIOMETRIA FIXAÇÃO 01. No Brasil, o etanol (álcool etílico) é obtido principalmente por processos fermentativos. O material a ser fermentado pode ser obtido de cana-de-açúcar,
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Especial Específicas (UNIFESP, UNESP, UEPG)
 Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
QUÍMICA TITULAÇÃO ,0 ml de uma solução de NaOH neutralizam totalmente 10,0 ml de uma solução de HNO
 QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS
 SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica
 Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
Química. Xandão (Renan Micha) Soluções
 Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Instruções: Titulação: análise laboratorial de soluções. Entalpia e energia nas transformações químicas. Entalpia de ligação. Ciências da Natureza
 Ciências da Natureza Química Gabriela Rosa TRABALHO DE RECUPERAÇÃO 1ª ETAPA 1ª 10 pts 6,5 pts 18 2º A/B Instruções: Leia atentamente cada questão antes de resolvê-la. A interpretação faz parte desse trabalho.
Ciências da Natureza Química Gabriela Rosa TRABALHO DE RECUPERAÇÃO 1ª ETAPA 1ª 10 pts 6,5 pts 18 2º A/B Instruções: Leia atentamente cada questão antes de resolvê-la. A interpretação faz parte desse trabalho.
H = - = 2 (-110,5) (-910,9) H
 UNESP 2013 1- A areia comum tem como constituinte principal o mineral quartzo (SiO 2 ), a partir do qual pode ser obtido o silício, que é utilizado na fabricação de microchips. A obtenção do silício para
UNESP 2013 1- A areia comum tem como constituinte principal o mineral quartzo (SiO 2 ), a partir do qual pode ser obtido o silício, que é utilizado na fabricação de microchips. A obtenção do silício para
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre
 PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
3º Trimestre Sala de Estudo Data: 11/09/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 11/9/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletroquímica (Pilhas) Questão 1 - (FUVEST SP/215) A figura abaixo ilustra as estabilidades relativas
3º Trimestre Sala de Estudo Data: 11/9/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletroquímica (Pilhas) Questão 1 - (FUVEST SP/215) A figura abaixo ilustra as estabilidades relativas
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
O hidrogênio é usado na fabricação de inúmeros produtos importantes:
 Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Atividades de Recuperação Paralela de Química A/B
 Atividades de Recuperação Paralela de Química A/B 1ª série Ensino Médio 3 Trimestre/2018 SETOR A: Conteúdo para estudos: Livro-texto 2:. Capítulo 12: Determinação de fórmulas químicas Compreender os conceitos
Atividades de Recuperação Paralela de Química A/B 1ª série Ensino Médio 3 Trimestre/2018 SETOR A: Conteúdo para estudos: Livro-texto 2:. Capítulo 12: Determinação de fórmulas químicas Compreender os conceitos
Qui. Allan Rodrigues Xandão (Gabriel Pereira)
 Semana 15 Allan Rodrigues Xandão (Gabriel Pereira) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. 23
Semana 15 Allan Rodrigues Xandão (Gabriel Pereira) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. 23
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
VIII EXAME Questões Objetivas. RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE.
 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
Resolução UNIFESP 2015
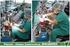 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
A A A A A A A A A A A A A A A. > Na+ QUÍMICA
 QUÍMIC 1 Dois eletrodos conectados a uma lâmpada foram introduzidos em uma solução aquosa, a fim de que a luminosidade da lâmpada utilizada avaliasse a condutividade da solução. Desta forma, foram feitos
QUÍMIC 1 Dois eletrodos conectados a uma lâmpada foram introduzidos em uma solução aquosa, a fim de que a luminosidade da lâmpada utilizada avaliasse a condutividade da solução. Desta forma, foram feitos
LABORATÓRIO DE QUÍMICA QUI126 2ª LISTA DE EXERCÍCIOS
 Exercício 1. (UFMG, Adapt.) O rótulo de uma garrafa de vinagre indica que a concentração de ácido acético (CH3COOH) é 42g/L. A fim de verificar se a concentração da solução ácida corresponde à indicada
Exercício 1. (UFMG, Adapt.) O rótulo de uma garrafa de vinagre indica que a concentração de ácido acético (CH3COOH) é 42g/L. A fim de verificar se a concentração da solução ácida corresponde à indicada
QUÍMICA Exercícios de revisão resolvidos
 9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Exercício de Revisão III Unidade. Eletroquímica
 1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
QUÍMICA Tabela Algumas propriedades dos elementos químicos do grupo 16
 QUESTÕES de 01 a 06-2012 UFBA UFBA - 2ª - 2ª FASE 2012 Questão 01 Tabela Algumas propriedades dos elementos químicos do grupo 16 A tabela periódica é a mais importante ferramenta que os químicos criaram
QUESTÕES de 01 a 06-2012 UFBA UFBA - 2ª - 2ª FASE 2012 Questão 01 Tabela Algumas propriedades dos elementos químicos do grupo 16 A tabela periódica é a mais importante ferramenta que os químicos criaram
C (grafite) + 2 H 2(g) + ½ O 2(g) CH 3 OH (l) + 238,6 kj. CO 2(g) C (grafite) + O 2(g) 393,5 kj. H 2(g) + ½ O 2(g) H 2 O (l) + 285,8 kj
 Questão 1 (PUC SP) Num calorímetro de gelo, fizeram-se reagir 5,400 g de alumínio (Al) e 16,000 g de óxido férrico, Fe 2 O 3. O calorímetro continha, inicialmente, 8,000 Kg de gelo e 8,000 Kg de água.
Questão 1 (PUC SP) Num calorímetro de gelo, fizeram-se reagir 5,400 g de alumínio (Al) e 16,000 g de óxido férrico, Fe 2 O 3. O calorímetro continha, inicialmente, 8,000 Kg de gelo e 8,000 Kg de água.
SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA.
 SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA. QUESTÕES LISTA DE EXERCÍCIOS Cinética Química. 1) A tabela abaixo mostra a variação da massa de peróxido de hidrogênio que ocorre na reação de decomposição
SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA. QUESTÕES LISTA DE EXERCÍCIOS Cinética Química. 1) A tabela abaixo mostra a variação da massa de peróxido de hidrogênio que ocorre na reação de decomposição
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, ). As descobertas de compostos como o XePtF 6
 20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
Solubilidade, estequiometria, misturas e gases
 Solubilidade, estequiometria, misturas e gases 1) O cientista italiano Amedeo Avogadro, na tentativa de compreender relações de volumes nas reações dos gases, propôs uma hipótese, estabelecendo que (CNTP
Solubilidade, estequiometria, misturas e gases 1) O cientista italiano Amedeo Avogadro, na tentativa de compreender relações de volumes nas reações dos gases, propôs uma hipótese, estabelecendo que (CNTP
Disciplina: Química Data: 05 / 05 / Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo:
 Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
2º Trimestre Sala de Estudo Data: 19/06/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 2º Trimestre Sala de Estudo Data: 19/06/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Cinética Química I (Quantificando a rapidez de uma reação) Questão 01 - (UERJ/2017) Em um exame
2º Trimestre Sala de Estudo Data: 19/06/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Cinética Química I (Quantificando a rapidez de uma reação) Questão 01 - (UERJ/2017) Em um exame
Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162
 Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162 1) Explique porque uma solução eletrolítica é capaz de conduzir eletricidade. 2) O Hidróxido de Bário Ba(OH) 2, um composto
Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162 1) Explique porque uma solução eletrolítica é capaz de conduzir eletricidade. 2) O Hidróxido de Bário Ba(OH) 2, um composto
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
P2 - PROVA DE QUÍMICA GERAL - 12/05/12
 P2 - PROVA DE QUÍMICA GERAL - 12/05/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
P2 - PROVA DE QUÍMICA GERAL - 12/05/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
COVEST/UFPE ª ETAPA
 COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO. 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3?
 NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
QUÍMICA. Prof. Daniel Pires TERMOQUÍMICA
 QUÍMICA Prof. Daniel Pires TERMOQUÍMICA 1 QUESTÕES 1. (Uerj 13) A equação química abaixo representa a reação da produção industrial de gás hidrogênio. H O g C s CO g H g Na determinação da variação de
QUÍMICA Prof. Daniel Pires TERMOQUÍMICA 1 QUESTÕES 1. (Uerj 13) A equação química abaixo representa a reação da produção industrial de gás hidrogênio. H O g C s CO g H g Na determinação da variação de
QUÍMICA. 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica:
 QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
LABORATÓRIO DE QUÍMICA QUI126 1ª LISTA DE EXERCÍCIOS
 1. Soluções básicas servem para a dissolução de gorduras sólidas que obstruem tubulações das cozinhas. O hidróxido de sódio é um exemplo, pois reage com gorduras e gera produtos solúveis. Qual a massa
1. Soluções básicas servem para a dissolução de gorduras sólidas que obstruem tubulações das cozinhas. O hidróxido de sódio é um exemplo, pois reage com gorduras e gera produtos solúveis. Qual a massa
ESCOLA SECUNDÁRIA DE CASQUILHOS
 6.º teste sumativo de FQA 3.março.15 ESCOLA SECUNDÁRIA DE CASQUILHOS 11.º Ano Turma B Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. VERSÃO 2 Este teste é constituído por 8 páginas
6.º teste sumativo de FQA 3.março.15 ESCOLA SECUNDÁRIA DE CASQUILHOS 11.º Ano Turma B Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. VERSÃO 2 Este teste é constituído por 8 páginas
FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019
 FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019 CNHECIMENTS GERAIS E ESPECÍFICS CNHECIMENTS GERAIS 31. quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019 CNHECIMENTS GERAIS E ESPECÍFICS CNHECIMENTS GERAIS 31. quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
a) 20 L. b) 25 L. c) 50 L. d) 75 L. e) 100 L. Dados: Na = 23; H = 1; C = 12; O = 16. a) 84 g. b) 212 g. c) 106 g. d) 62 g. e) 168 g.
 LISTA EXTRA º ANO 1. (G1 - cps 018) Lavoisier foi quem descobriu uma maneira de sintetizar o salitre em grandes quantidades, o que possibilitou um aumento sensível na produção e utilização da pólvora.
LISTA EXTRA º ANO 1. (G1 - cps 018) Lavoisier foi quem descobriu uma maneira de sintetizar o salitre em grandes quantidades, o que possibilitou um aumento sensível na produção e utilização da pólvora.
a) Escreva os nomes das substâncias presentes nos frascos A, B e C. A B C
 PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
Olimpíada Brasileira de Química Fase III (Etapa 1 nacional)
 Page 1 of 5 Olimpíada Brasileira de Química - 2001 Fase III (Etapa 1 nacional) Questão 1 (48 th Chemistry Olympiad - Final National Competition - 2001 - Estonia) Exame aplicado em 01.09.2001 Os compostos
Page 1 of 5 Olimpíada Brasileira de Química - 2001 Fase III (Etapa 1 nacional) Questão 1 (48 th Chemistry Olympiad - Final National Competition - 2001 - Estonia) Exame aplicado em 01.09.2001 Os compostos
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
B) Defina a que forma de apresentação do alumínio corresponde cada uma das curvas. Justifique sua resposta.
 Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS EXTRAS 2º TRIMESTRE 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professor: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professor: Lúcia Nascimento COMPONENTE CURRICULAR:
AULA 10 ESTEQUIOMETRIA
 AULA 10 ESTEQUIOMETRIA Cálculo estequiométrico ou estequiometria é o cálculo de quantidades de substâncias que interagem, pode ser do reagente consumido ou do produto formado. Baseia-se nas proporções
AULA 10 ESTEQUIOMETRIA Cálculo estequiométrico ou estequiometria é o cálculo de quantidades de substâncias que interagem, pode ser do reagente consumido ou do produto formado. Baseia-se nas proporções
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
3º Trimestre Sala de Estudo Data: 21/09/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 21/09/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Revisão para prova (cinética química, soluções ultradiluídas, estequiometria com soluções e
3º Trimestre Sala de Estudo Data: 21/09/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Revisão para prova (cinética química, soluções ultradiluídas, estequiometria com soluções e
a) 0,60 M e 0,20 M b) 0,45 M e 0,15 M c) 0,51 M e 0,17 M d) 0,75 M e 0,25 M
 ª série E.M. - APE 1. (Vunesp) Medicamentos, na forma de preparados injetáveis, devem ser soluções isotônicas com relação aos fluidos celulares. O soro fisiológico, por exemplo, apresenta concentração
ª série E.M. - APE 1. (Vunesp) Medicamentos, na forma de preparados injetáveis, devem ser soluções isotônicas com relação aos fluidos celulares. O soro fisiológico, por exemplo, apresenta concentração
UFU 2008/2-1ª FASE. 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina).
 UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
(aq) + H 3 O + (aq) K 1 = 1,0 x (aq) + H 3 O + (aq) K 2 = 1,0 x 10-11
 Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
4. UNESP) Um estudante montou a célula eletroquímica ilustrada na figura, com eletrodos de Cu(s) e Ni(s) de massas conhecidas.
 Revisão Específicas 1. (UNESP-2013) O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador. Com base no esquema,
Revisão Específicas 1. (UNESP-2013) O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador. Com base no esquema,
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por
 Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por oxidação de íons ag(+) c) cátodo, por redução de átomos
Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por oxidação de íons ag(+) c) cátodo, por redução de átomos
CRONOGRAMA DE RECUPERAÇÃO ATIVIDADE DE RECUPERAÇÃO
 CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico
 PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO 13/11/2009 PROVA ESCRITA Nome do candidato: Assinatura do candidato:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO 13/11/2009 PROVA ESCRITA Nome do candidato: Assinatura do candidato:
Trabalho de Recuperação Final 2018
 Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/18 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2018 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Estequiometria e
Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/18 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2018 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Estequiometria e
Cinética e Eq. Químico Folha 10 João Roberto Fortes Mazzei
 01. Em um recipiente de 500 ml, encontram-se, em condições de equilíbrio, 10 mol/l de H 2 (g) e 0,01 mol/l de I 2 (g). Qual é a concentração do HI(g), sabendo-se que, nas condições do experimento, a constante
01. Em um recipiente de 500 ml, encontram-se, em condições de equilíbrio, 10 mol/l de H 2 (g) e 0,01 mol/l de I 2 (g). Qual é a concentração do HI(g), sabendo-se que, nas condições do experimento, a constante
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
AULA DE VÉSPERA 2ª FASE UECE / GABARITO Professor: Michel Henri
 AULA DE VÉSPERA ª FASE UECE / GABARITO Professor: Michel Henri Resposta da questão 1: [E] A equação de Henderson-Hasselbach é válida com melhor aproximação entre ph 4 e ph 10, devido às simplificações
AULA DE VÉSPERA ª FASE UECE / GABARITO Professor: Michel Henri Resposta da questão 1: [E] A equação de Henderson-Hasselbach é válida com melhor aproximação entre ph 4 e ph 10, devido às simplificações
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
ESTEQUIOMETRIA - 3C13 - Profª
 ESTEQUIOMETRIA - 3C13 - Profª Estequiometria é a parte da Química que estuda as proporções dos elementos que se combinam ou que reagem. MASSA ATÔMICA (u) É a massa do átomo medida em unidades de massa
ESTEQUIOMETRIA - 3C13 - Profª Estequiometria é a parte da Química que estuda as proporções dos elementos que se combinam ou que reagem. MASSA ATÔMICA (u) É a massa do átomo medida em unidades de massa
Banco de Questões para o 2º ano MEDF. 1. De acordo com o gráfico abaixo, assinale o caminho que sugere a presença de catalisador. Explique.
 Banco de Questões para o 2º ano MEDF Cinética Química 1. De acordo com o gráfico abaixo, assinale o caminho que sugere a presença de catalisador. Explique. Gabarito: O caminho que sugere a presença de
Banco de Questões para o 2º ano MEDF Cinética Química 1. De acordo com o gráfico abaixo, assinale o caminho que sugere a presença de catalisador. Explique. Gabarito: O caminho que sugere a presença de
FUVEST Segunda Fase. Química 06/01/2003
 FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao longo das duas horas de duração do experimento.
 Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
FUVEST 1978 Primeira fase e Segunda fase
 FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
I - 4 Au (s) + O 2(g) + 2 H 2 O (l) + 8 CN - -
 QUESTÕES OBJETIVAS Questão 9: O processo do cianeto pode ser utilizado para extrair ouro de rochas. Esse processo consiste em, inicialmente, tratar as rochas trituradas com cianeto, havendo formação do
QUESTÕES OBJETIVAS Questão 9: O processo do cianeto pode ser utilizado para extrair ouro de rochas. Esse processo consiste em, inicialmente, tratar as rochas trituradas com cianeto, havendo formação do
CINÉTICA QUÍMICA Estuda a velocidade (rapidez) das reações. Exemplo a síntese do HCl: H 2 (g) + Cl 2 (g) 2HCl(g)
 CINÉTICA QUÍMICA Estuda a velocidade (rapidez) das reações. Exemplo a síntese do HCl: H 2 (g) + Cl 2 (g) 2HCl(g) TEORIA DAS COLISÕES Para que ocorra uma reação química, os reagentes devem ter uma certa
CINÉTICA QUÍMICA Estuda a velocidade (rapidez) das reações. Exemplo a síntese do HCl: H 2 (g) + Cl 2 (g) 2HCl(g) TEORIA DAS COLISÕES Para que ocorra uma reação química, os reagentes devem ter uma certa
PROFESSOR: EQUIPE DE QUÍMICA
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 4 ============================================================================================= Termoquímica
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 4 ============================================================================================= Termoquímica
QUIMICA: Eletroquimica Prof. Douglas_10/10/2018 1
 [AE-10 ] c) d) 01. (Enem 017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir
[AE-10 ] c) d) 01. (Enem 017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir
TERMOQUÍMICA EXERCÍCIOS PARA TREINO
 TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
P1 - PROVA DE QUÍMICA GERAL - 18/09/04
 P1 - PROVA DE QUÍMICA GERAL - 18/09/0 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 a,5 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 K = C + 73,15 1 atm
P1 - PROVA DE QUÍMICA GERAL - 18/09/0 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 a,5 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 K = C + 73,15 1 atm
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
Centro Universitário Padre Anchieta Faculdade de Engenharia Química Química Analítica Quantitativa Prof. Vanderlei Lista 2
 Lista 1. Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico
Lista 1. Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09
 Química Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09 Re Resolução 1. O carbeto de cálcio CaC 2 (s) (massa molar = 64 g mol 1 ), também conhecido como carbureto, pode ser obtido aquecendo-se
Química Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09 Re Resolução 1. O carbeto de cálcio CaC 2 (s) (massa molar = 64 g mol 1 ), também conhecido como carbureto, pode ser obtido aquecendo-se
FUVEST 1991 Primeira fase e Segunda fase
 FUVEST 1991 Primeira fase e Segunda fase CNHECIMENTS GERAIS 01. ar gás carbônico naftaleno iodo latão ouro 18 quilates Se esses materiais forem classificados em substâncias puras e misturas, pertencerão
FUVEST 1991 Primeira fase e Segunda fase CNHECIMENTS GERAIS 01. ar gás carbônico naftaleno iodo latão ouro 18 quilates Se esses materiais forem classificados em substâncias puras e misturas, pertencerão
Solução Comentada Prova de Química
 34. Considere duas soluções de ácido clorídrico (HCl), um ácido forte, (solução I), e ácido acético (CH 3 COOH), um ácido fraco, k a =1,8 x 10-5, (solução II). Ambas as soluções com concentração 0,02 mol.
34. Considere duas soluções de ácido clorídrico (HCl), um ácido forte, (solução I), e ácido acético (CH 3 COOH), um ácido fraco, k a =1,8 x 10-5, (solução II). Ambas as soluções com concentração 0,02 mol.
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
2º trimestre Sala de Estudo Química Data: 08/05/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 2º trimestre Sala de Estudo Química Data: 08/05/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Termoquímica (entalpia padrão de formação) Questão 01 - (PUC RS/2017) O metano é uma
2º trimestre Sala de Estudo Química Data: 08/05/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Termoquímica (entalpia padrão de formação) Questão 01 - (PUC RS/2017) O metano é uma
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM)
 NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
Olimpíada Brasileira de Química
 Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
Estequiometria Folha 04 Prof.: João Roberto Mazzei
 01- (UFRRJ 2005) Observe a figura e leia o texto. No balão A, são adicionados carbonato de sódio e ácido clorídrico em quantidades suficientes para a produção de 11,2 litros de um gás, nas CNTP, sendo
01- (UFRRJ 2005) Observe a figura e leia o texto. No balão A, são adicionados carbonato de sódio e ácido clorídrico em quantidades suficientes para a produção de 11,2 litros de um gás, nas CNTP, sendo
