FUNCIONALIZAÇÃO DE SÍLICA MESOPOROSA PARA APLICAÇÃO EM SISTEMAS DE LIBERAÇÃO CONTROLADA DE FÁRMACO. Gracielle Ferreira Andrade
|
|
|
- Raphaella Carvalhal Pedroso
- 7 Há anos
- Visualizações:
Transcrição
1 Comissão Nacional de Energia Nuclear CENTRO DE DESENVOLVIMENTO DA TECNOLOGIA NUCLEAR Programa de Pós-Graduação em Ciência e Tecnologia das Radiações, Minerais e Materiais FUNCIONALIZAÇÃO DE SÍLICA MESOPOROSA PARA APLICAÇÃO EM SISTEMAS DE LIBERAÇÃO CONTROLADA DE FÁRMACO Gracielle Ferreira Andrade Dissertação apresentada ao Curso de Pós-Graduação em Ciência e Tecnologia das Radiações, Minerais e Materiais, como parte dos requisitos para obtenção do Grau de Mestre Área de Concentração: Materiais Orientador: Dra. Edésia Martins Barros de Sousa Belo Horizonte 2011
2 1 Comissão Nacional de Energia Nuclear CENTRO DE DESENVOLVIMENTO DA TECNOLOGIA NUCLEAR Programa de Pós-Graduação em Ciência e Tecnologia das Radiações, Minerais e Materiais FUNCIONALIZAÇÃO DE SÍLICA MESOPOROSA PARA APLICAÇÃO EM SISTEMAS DE LIBERAÇÃO CONTROLADA DE FÁRMACO Gracielle Ferreira Andrade Dissertação apresentada ao Curso de Pós-Graduação em Ciência e Tecnologia das Radiações, Minerais e Materiais, como parte dos requisitos à obtenção do Grau de Mestre Área de concentração: Materiais Orientador: Dra. Edésia Martins Barros de Sousa Belo Horizonte 2011
3 2
4 3 AGRADECIMENTOS A Deus, primeiramente, por me dar a fé e a força para seguir a diante e me guiar até aqui. A minha família e ao meu namorado pelo apoio, incentivo, compreensão e amor; À professora Edésia Martins Barros de Sousa pela oportunidade, orientação, confiança, incentivo e dedicação, muito obrigada. Ao Professor Ricardo, Waldemar e José Domingos pela confiança ao disponibilizar os laboratórios para as medidas necessárias a esse trabalho. À Andreza e Karynne pela grande amizade, simplicidade, paciência e companheirismo, e ainda, pela grande contribuição e ajuda na realização desse trabalho. Aos colegas de laboratório pela colaboração e por proporcionar um ambiente acolhedor e agradável, em especial ao Tiago, Anderson, Paula, Iara e Izabela por toda a ajuda. Ao Daniel, Éden, Ivan, Pio e Tiaozinho por serem sempre prestativos. A todos os professores da pós-graduação do CDTN por compartilharem seus conhecimentos. Aos amigos e colegas do Mestrado, obrigada pela companhia, ajuda e pelos bons momentos compartilhados. Ao Ramon (Unicamp) e ao Paulo Ornelas por realizarem análises essenciais para esse trabalho. A todos do Centro de Microscopia da UFMG pela realização das medidas de microscopia. Ao CDTN por oferecer toda a infra-estrutura disponível. A todos do Cíclotron pela recepção em especial a Juliana por sere imensamente solicita. Aos amigos do prédio 7. Aos meus amigos que estiveram comigo nessa caminhada, incentivando, torcendo e compreendendo muitas vezes a minha ausência. Ao CNPq pelo apoio financeiro.
5 4 RESUMO Materiais mesoporosos ordenados tipo SBA-16 possuem uma rede de canais e poros de tamanho bem definido na escala nanométrica, com estrutura cúbica, elevada área superficial ( m 2.g -1 ) e tamanho de poros usualmente em torno de 2 a 30 nm. Essa estrutura de poros torna esses materiais apropriados para incorporar e liberar uma grande variedade de moléculas na sua matriz. Dentre os diversos tipos de materiais SBA, o SBA-16 é considerado uma mesoestrutura muito interessante devido ao fato de possuir um ordenamento de mesoporos cúbico tridimensional correspondente ao grupo especial Im3m, podendo ser um material promissor para várias aplicações. Os materiais mesoporosos podem sofrer diversas modificações na sua superfície, devido à presença dos grupos silanóis, podendo produzir um material com uma funcionalidade direcionada. Neste trabalho, estudou-se a síntese e caracterização do material SBA-16 puro e após o processo de funcionalização para avaliar sua aplicação como sistema de liberação controlada de um fármaco modelo. O processo de modificação da superfície foi realizado pelo método pós-síntese, ou seja, após o obter o material SBA-16, esse passou por um segundo processo para se obter as amostras funcionalizadas. A caracterização do SBA-16 puro e funcionalizado foi feita por análise elementar (CHN), Espectroscopia na Região do Infravermelho com Transformada de Fourier (FTIR), Análise Termogravimétrica (TG), Adsorção de Nitrogênio, Microscopia Eletrônica de Varredura (MEV), Microscopia Eletrônica de Transmissão (MET), Espalhamento de Raios X a Baixos Ângulos (SAXS), e Ressonância Magnética Nuclear (RMN). Por meio da técnica de espectroscopia de absorção na região do infravermelho, foi possível observar, a partir dos espectros das amostras funcionalizadas, bandas características das vibrações da rede de sílica, bem como bandas referentes às vibrações dos grupos alquilas ancorados na estrutura da sílica. A presença do fármaco atenolol no material mesoporoso e nas amostras funcionalizadas também pode ser confirmada por meio das medidas de FTIR. A estabilidade térmica e as degradações que ocorrem nos componentes puros, bem como nas amostras modificadas na superfície, foram investigadas e estabelecidas pela análise termogravimétrica. Por meio da TG foi possível quantificar a presença dos grupos orgânicos ancorados nesse material. A presença dos grupos orgânicos conduziu a alterações na estrutura do material final, com a diminuição da área superficial e volume de poros. Porém, a distribuição de poros se mostrou semelhante em todas as amostras. Os resultados de MEV, MET e SAXS do SBA-16 e das amostras funcionalizadas revelaram uma estrutura bem ordenada de mesoporos, característica intrínseca desses materiais. Por meio das medidas de ressonância magnética nuclear de 29 Si e 13 C de estado sólido (RMN-MAS) nas amostras funcionalizadas, foi possível caracterizar e avaliar a forma de ligação desses grupos orgânicos na
6 5 matriz de sílica. Através do ensaio de liberação, foi possível avaliar a quantidade de atenolol incorporado e verificar o comportamento da liberação desse nas amostras sintetizadas. Com os resultados de citotoxicidade foi possível determinar a viabilidade celular, obtendo-se resultados satisfatórios para uma futura aplicação clínica desse material. Palavras-chave: SBA-16, funcionalização, síntese, sistema de liberação de fármaco, atenolol.
7 6 ABSTRACT Type ordered mesoporous materials SBA-16 have a network of channels and well defined pore size in nanometer scale. Cubic structure has a high surface area ( m 2.g -1 ) and pore size is usually around 20 to 30 nm. This porous structure makes these materials appropriate to incorporate and release a large variety of molecules in the matrix. Among these SBA-type silica materials, SBA-16 is considered a very interesting mesostructure due to the its 3D cubic arrangement of mesopores corresponding to the Im3m space group, a promising material for a large range of applications. The mesoporous materials may undergo several changes in its surface due to the presence of silanol groups, which can produce a material with a targeted feature. The materials were characterized by elemental analysis (CHN), Fourier Transform Infrared Spectroscopy (FTIR), Nitrogen Adsorption, Scanning Electron Microscopy (SEM), Transmission Electron Microscopy (TEM), Small Angle X Ray Scattering (SAXS), Nuclear Magnetic Resonance (RMN), and Thermal Analysis. Through the FTIR analysis technique, it was possible to observe characteristic bands of the silica vibrations, as well as vibrations bands due the presence of alkyl groups anchored into the silica structure. The presence of the atenolol in the mesoporous material and functionalised samples was also confirmed by FTIR. The thermal stability and the degradation of the surface modified samples were determined by thermogravimetry. The incorporation of the organic groups into the mesoporous silica led to a significant change in the structural properties of the system, with the decrease of the specific surface area and pore volume, but the pore size distribuition was similar in all samples. The results obtained by SEM, TEM and SAXS for the samples reveal a well-defined cubic arrangement of uniform mesoporous structure, intrinsic characteristic of these materials. By measuring nuclear magnetic resonance of 29 Si and 13 C solid state (MAS-NMR) in the functionalized samples, it was possible to characterize and measure the extent of binding of organic groups in the silica matrix. Through the release assay was possible to evaluate the amount of embedded atenolol and verify the behavior of the drug release from the synthesized samples. Considering the results of cytotoxicity, it was possible to determine cell viability by obtaining satisfactory results for future clinical application of this material. Keyword: SBA-16, functionalization, synthesis, drug delivery systems, atenolol.
8 7 LISTA DE FIGURAS FIGURA 1 - Exemplos de materiais micro, meso e macroporosos, mostrando domínios de tamanho de poros e distribuição de tamanho de poros. Adaptado de SOLER-ILLIA, FIGURA 2 - Esquema da formação da estrutura inorgânica mesoporosa mediada por agente direcionador de estrutura. Figura adaptada de Raman et al., FIGURA 3 - Estrutura cúbica do SBA-16. (BRAKKE, 2005) (ZHOU, 2007) FIGURA 4 - Representação da fórmula estrutural dos copolímeros F123 e F FIGURA 5 - (A) Classificação das isotermas de sorção segundo a IUPAC. (B) Classificação moderna das alças de histerese (GOBIN, 2006) FIGURA 6 - Desenho esquemático do tipo e tamanho dos poros do SBA-16 (ZHANG. et.al., 2009) FIGURA 7 - Disposição dos grupos silanóis na sílica FIGURA 8 - Diferentes formas de ancoramento de organosilanos na superfície de um suporte contendo grupos silanóis: a) monodentada b) bidentada c) tridentada (ARAKAKI, 1999) FIGURA 9 - Esquema de possíveis modificações da superfície da sílica com diferentes grupos orgânicos por (a) pós-síntese e (b) co-condensação FIGURA 10 - Esquema da funcionalização do poro na parede da sílica mesoporosa. (VALLET-REGÍ, 2006B) FIGURA 11 - Proposta da interação da enzima PA com a base do material. (A) Ligações de hidrogênio, (B) Interações hidrofóbicas, e (C) Interações eletrostáticas (ZHAO, 2006) FIGURA 12 - Modificação interna da sílica mesoporosa (Adaptada de HILL, 2007) FIGURA 13 - Perfil de concentração plasmática da droga versus tempo de uma droga administrada oralmente, comparado com um sistema de liberação controlada. (Adapatada de DASH & CUDWORTH II, 1998) FIGURA 14 - Estruturas de canais hexagonais de SBA-15 (a) e esquema representando a uniformidade do processo de incorporação de moléculas de ibuprofeno em uma matriz mesoporosa ordenada (b) FIGURA 15 - Estrutura química da molécula de atenolol FIGURA 16 - Representação de uma molécula de atenolol com as distâncias interatômicas correspondentes FIGURA 17 - Diagrama da síntese de SBA FIGURA 18 - Diagrama de Funcionalização do SBA FIGURA 19 - Estruturas dos Funcionalizantes (a) Etiltrietoxisilano (ETES), (b) Propiltrietoxisilano (PTES), (c) 3-Aminopropiltrietoxisilano (APTES) FIGURA 20 - Curva de Calibração de Atenolol a 25 ºC FIGURA 21 - Representação esquemática da liberação de atenolol em uma matriz mesoporosa de sílica FIGURA 22 - Desenho esquemático do MTT sendo reduzido pelas enzimas desidrogenases de células metabolicamente viáveis e dando origem ao Formazan FIGURA 23 - Tipos das principais vizinhas químicas dos átomos de silício de alcoxissilanos imobilizados. Adaptado de COSTA, FIGURA 24 - Representação da forma de ancoramento tridentada do 3-aminopropiltrietoxisilano na superfície da sílica FIGURA 25 - Espectro de FTIR do SBA-16 puro e funcionalizado com tolueno FIGURA 26 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com tolueno (região ). 68 FIGURA 27 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com tolueno (região ) FIGURA 28 - Espectro de FTIR do SBA-16 puro e funcionalizado com metanol FIGURA 29 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com metanol (região ). 69 FIGURA 30 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com metanol (região ) FIGURA 31 - Espectro expandido de FTIR do SBA-16 puro e SBA-16 incorporado com Atenolol ( ) FIGURA 32 - Espectro expandido de FTIR do SBA-16, T-PTES, T-PTES incorporado com Atenolol ( ) FIGURA 33 - Espectro expandido de FTIR do SBA-16, M-PTES, M-PTES incorporado com Atenolol ( ) FIGURA 34 - Curva de TG e sua derivada (DTG) para SBA-16 puro FIGURA 35 - Curva de TG e sua derivada para SBA-16 puro e funcionalizado ETES FIGURA 36 - Curva de TG e sua derivada para SBA-16 puro e funcionalizado PTES FIGURA 37 - Curva de TG e sua derivada para SBA-16 puro e funcionalizado APTES
9 FIGURA 38 - Relação de perda de massa e número de carbono, obtido por CHN, da amostra pura e das funcionalizadas com metanol FIGURA 39 - Relação de perda de massa e número de carbono, obtido por CHN, da amostra pura e das funcionalizadas com tolueno FIGURA 40 - Relação entre os dados de área superficial e o número de carbonos obtido por CHN usando metanol como solvente FIGURA 41 - Relação entre os dados de área superficial e o número de carbonos obtido por CHN usando tolueno como solvente FIGURA 42 - Isoterma de Adsorção de Nitrogênio de SBA FIGURA 43 - Isoterma de Adsorção de Nitrogênio de SBA-16, e amostras funcionalizadas com metanol FIGURA 44 - Isoterma de Adsorção de Nitrogênio de SBA-16 e amostras funcionalizadas com tolueno FIGURA 45 - Distribuição de tamanho de poros da amostra de SBA-16 e M-ETES FIGURA 46 - Curva α s para a amostra SBA FIGURA 47 - Curva α s para a amostra T-PTES FIGURA 48 - Curva α s para a amostra T-ETES FIGURA 49 - Micrografia da amostra de SBA FIGURA 50 - Micrografia das amostras (a) T-APTES e (b) M-PTES FIGURA 52 - (a) Micrografia da amostra M-PTES com estrutura cúbica: na direção paralela ao eixo dos poros, (b) Micrografia da amostra T-PTES na direção perpendicular ao eixo dos poros FIGURA 53 - Imagens de HREM de SBA-16(calcinado) e os respectivos difratogramas de Fourier a (100), b (110) e c (111) (SAKAMOTO, 2000) FIGURA 54 - Difratograma da amostra de SBA FIGURA 55 - Difratograma da amostra SAB-16 pura e M-ETES FIGURA 56 - Difratograma da amostra M-PTES e M-APTES FIGURA 57 - Difratograma das amostras T-ETES e T-PTES FIGURA 58 - Difratograma da amostra T-APTES FIGURA 59 - Conformações do silício nas espécies Q 4 (a), Q 3 (b) e Q 2 (c) FIGURA 60 - Espectro de RMN de 29 Si do SBA FIGURA 61 - Conformações das espécies químicas T 1 (a), T 2 (b) e T 3 (c) (GERMANO, 2008) FIGURA 62 - Espectro de RMN de 29 Si do T-APTES FIGURA 63 - Espectro de RMN-MAS de 29 Si do T-PTES FIGURA 64 - Espectro de RMN-MAS de 29 Si do T-ETES FIGURA 65 - Espectro de RMN de 13 C do T-APTES FIGURA 66 - Espectro de RMN-MAS de 13 C do T-PTES FIGURA 67 - Espectro de RMN-MAS de 13 C do T-ETES FIGURA 68 - Curvas de liberação em função do tempo para as amostras SBA-16, T-ETES, M-ETES, M-PTES e T-PTES na forma de pastilha submetidas a uma solução de 1 mg.ml FIGURA 69 - Curvas de liberação em função do tempo para as amostras SBA-16, M-PTES e T-PTES na forma de pó submetidas a uma solução de 1 mg.ml FIGURA 70: Curvas de liberação em função do tempo para as amostras SBA-16, M-PTES e T-PTES na forma de pastilha submetidas a uma solução de 10 mg.ml FIGURA 71 - Células U87 foram semeadas em placas de 96 poços numa densidade de 1500 céls/poço e incubadas por 24 h. Após este período, as amostras foram adicionadas em concentração de 0,1 a 200 µg.ml -1, diluídas em DMEM. A sobrevivência celular foi avaliada pelo ensaio do MTT FIGURA 72- Células T98 foram semeadas em placas de 96 poços numa densidade de 1500 céls/poço e incubadas por 24 h. Após este período, as amostras foram adicionadas em concentração de 0,1 a 200 µg.ml -1, diluídas em DMEM. A sobrevivência celular foi avaliada pelo ensaio do MTT FIGURA 73 - Células MCF-7 foram semeadas em placas de 96 poços numa densidade de 1500 céls/poço e incubadas por 24 h. Após este período, as amostras foram adicionadas em concentração de 0,1 a 200 µg.ml -1, diluídas em DMEM. A sobrevivência celular foi avaliada pelo ensaio do MTT
10 9 LISTA DE TABELAS TABELA 1: Parâmetros de solubilidade dos solventes TABELA 2 - Fórmulas moleculares e estruturais e peso molecular dos grupos silanos Tabela 3 - Condições experimentais do procedimento de incorporação de atenolol nas amostras SBA-16, T- PTES, M-PTES, T-ETES e M-ETES Tabela 4 - Condições experimentais do procedimento de incorporação de atenolol nas amostras SBA-16, T- PTES e M-PTES TABELA 5: Porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) nos agentes sililantes TABELA 6 - Porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) contidos nas amostras pura e funcionalizadas TABELA 8 - Identificação espectrofotométrica de alguns grupos funcionais TABELA 9 - Bandas de absorção no infravermelho e suas respectivas atribuições identificadas no espectro do fármaco atenolol TABELA 10: Perda de Massa em duas faixas de temperatura TABELA 11: Resultados da adsorção de nitrogênio usando metanol como solvente TABELA 12: Resultados de adsorção de nitrogênio TABELA 13 - Parâmetros estruturais do SBA-16 puro e funcionalizado usando metanol com solvente TABELA14 - Avaliação da quantidade de atenolol incorporada nas amostras SBA-16, T-PTES e M-PTES por meio de medidas de espectroscopia UV-VIS das soluções após a incorporação TABELA 15 - Parâmetros cinéticos calculados por meio do modelo de Ritger & Peppas das amostras na forma de pastilha incorporadas em solução de 1 mg.ml TABELA 16 - Parâmetros cinéticos calculados por meio do modelo de Ritger & Peppas das amostras na forma de pó incorporadas em solução de 1 mg.ml TABELA 17 - Parâmetros cinéticos calculados por meio do modelo de Ritger & Peppas das amostras na forma de pó incorporadas em solução de 10 mg.ml
11 10 LISTA DE NOTAÇÕES a 0 - Parâmetro de Célula Unitária para a Rede Cúbica APTES - 3-aminopropiltrietoxisilano BET - Brunauer-Emmet-Teller BJH - Barrett-Joyner-Halenda BCS Classificação Biofarmacêutica CBET - Constante Calculada a partir da Equação BET CDTN - Centro de Desenvolvimento da Tecnologia Nuclear CHN análise elementar de carbono, hidrogênio e nitrogênio CMC - Concentração Micelar Crítica d(110) - Espaçamento Interplanar entre os Planos 110 DMEM - Dulbecco s modified Eagle s DMSO dimetilsulfóxido Dp- Diâmetro de Poros Calculado DRIFT -reflectância difusa ETES etiltrietoxisilano FTIR - Fourier Transform Infrared Spectroscopy (Espectroscopia na Região do Infravermelho com Transformada de Fourier) hkl - Índices de Miller HMS Hexagonal Mesoporous Sílica HPLC - High performance liquid chromatography (I + ) representa os precursores inorgânicos catiônicos (I - ) representa os precursores inorgânicos aniônicos IC50 - concentração do composto que produziu 50% de morte celular IUPAC - International Union of Pure and Applied Chemistry LCT - Liquid Crystal Templating (Mecanismo de Direcionamento por Cristal Líquido) LNLS - Laboratório Nacional de Luz Síncroton MCF-7 - Adenocarcinoma mamário humano MCM-41 - Mobil Composition of Matter Number 41 MCM-48 - Mobil Composition of Matter Number 48 MCV-VCU - MedicalCollege of Virginia, Virginia Commonwealth University MET - Microscopia Eletrônica de Transmissão MEV - Microscopia Eletrônica de Varredura MTT - 3-(4,5-dimetyl-2-thiazolyl-2,5-diphenyl-2H-tetrazolium bromide) P/P0 - Pressão Relativa P123 - Pluronic poli(óxido de etileno) 20 -poli(óxido de propileno) 70 -poli(óxido de etileno) 20 P127 - Pluronic poli(óxido de etileno) 106 -poli(óxido de propileno) 70 -poli(óxido de etileno) 106 PTES propiltrietoxisilano PVA- Álcool Polivinílico FSM 16 Folded-sheet mesoporous materials 16 PEO - Poli(óxido de etileno) PLGA - Poli(ácido láctico co ácido glicólico) PPO - Poli(óxido de propileno) Q n - Sítios de coordenação da sílica RMN-MAS - Ressonância Magnética Nuclear com Rotação no Ângulo Mágico S + ) representa o surfactante catiônico (S - ) representa o surfactante aniônico
12 SAXS - Small Angle X Ray Scattering (Espalhamento de Raios X a Baixo Ângulo) SBA-1 - Santa Barbara Amorphous Number 1 SBA-2 - Santa Barbara Amorphous Number 2 SBA-3 - Santa Barbara Amorphous Number 3 SBA-6 - Santa Barbara Amorphous Number 6 SBA-15 - Santa Barbara Amorphous Number 15 SBA-16 - Santa Barbara Amorphous Number 16 SBET - Área Superficial Específica Calculada pelo Método BET SBF - Simulated Body Fluid (Fluido Corpóreo Simulado) SFB - soro fetal bovino S ext - Área Superficial Externa S N 2 mecanismo de reação nucleofílica S t - Área Superficial Total T98 - Glioblastoma multiforme humano TEOS Tetraetilortossilicato TG - Termogravimetria ou Análise Termogravimétrica T m - Sítios de Coordenação da Sílica Funcionalizada TMC - Temperatura Micelar Crítica TMOS Tetrametilortosilicato UCST - Upper Critical Solution Temperature (Temperatura de Solução Crítica Inferior) UV-VIS - Ultravioleta Visível Vmeso1 - Volume de Mesoporos Primários Vmeso2 - Volume de Mesoporos Secundários V mi - Volume de Microporos Vp - Volume de Poros (X + ) representa os contra-íons catiônicos (X - ) representa os contra-íons aniônicos XPS - X Ray Photoecletron Spectroscopy (Espectroscopia de Fotoelétrons Excitados por Raios X) α OH quantidade de grupos silanóis por unidade de área superficial em nm 2 δd interação de dispersão δo interação do tipo dipolo δa interações do tipo ligações de hidrogênio 11
13 12 SUMÁRIO 1. INTRODUÇÃO OBJETIVOS Gerais Específicos MOTIVAÇÃO REFERENCIAL TEÓRICO Materiais Híbridos Orgânico-Inorgânicos Materiais Mesoporosos SBA Copolímeros Adsorção de gases Funcionalização Grupos Silanos Liberação Controlada de Fármaco Cinética de Liberação do Fármaco Escolha do Fármaco Modelo METODOLOGIA Síntese do SBA Remoção do surfactante Modificação Superficial Caracterização das Amostras Análise Elementar CHN Espectroscopia na Região de Infravermelho Análise Térmica Adsorção de Gases Microscopia Eletrônica de Varredura Microscopia Eletrônica de Transmissão Espalhamento de Raios X a Baixos Ângulos (SAXS) Espectroscopia de Ressonância Magnética Nuclear (RMN) de 29 Si e 13 C Obtenção dos Dispositivos para Liberação Controlada de Drogas Ensaio da Liberação do Atenolol nos Diferentes Sistemas Estudo da Liberação Controlada do Fármaco... 59
14 Ensaio de Citotoxicidade RESULTADOS E DISCUSSÕES Análise Elementar Resultados Obtidos para a Amostra Pura e as Funcionalizadas Incorporadas com Atenolol nas diferentes Concentrações Espectroscopia na Região do Infravermelho Resultados obtidos para as amostras puras e funcionalizadas Resultados Obtidos para as Amostras Pura e Funcionalizadas Incorporadas com Atenolol Análise térmica Adsorção de Gases-BET Análise das Isotermas Distribuição de Tamanho de Poros Parâmetros Texturais - método alfa-s Microscopia Eletrônica de Varredura Microscopia Eletrônica de Transmissão (MET) Espalhamento de Raios X a Baixos Ângulos (SAXS) Ressonância Magnética Nuclear - RMN Amostras Funcionalizadas Incorporação do Atenolol nos Diferentes Sistemas Estudo da Liberação de Atenolol nas Amostras de SBA-16 Puras e Funcionalizadas Ensaio de Citotoxicidade CONCLUSÃO Proposições Futuras REFERENCIAL BIBLIOGRÁFICO
15 14 1. INTRODUÇÃO Do ponto de vista tecnológico, materiais mesoporosos nanoestruturados podem ser manipulados quimicamente através da modificação de suas superfícies com moléculas orgânicas específicas. As propriedades desses materiais os tornam atrativos para serem aplicados em processos de adsorção, catálises, nanotecnologia, aplicações eletrônicas, e como hospedeiros de uma incontável variedade de moléculas. Cada aplicação requer certas qualidades em termos da estrutura de sua fase nanométrica e organização da macroestrutura. Desta maneira, a síntese, a modificação e o controle desses materiais nesta escala representam o acesso a novas propriedades e diversificado comportamento desses. Todas essas características tornam os materiais mesoporosos um suporte para aplicação nas áreas ocupadas pela bionanotecnologia. A bionanotecnologia tem produzido avanços importantes em diagnósticos, terapêuticas, biologia molecular e bioengenharia. Hoje é bastante plausível o uso de nanosistemas para a veiculação de drogas e tratamento de inúmeras doenças, como os que se baseiam em lipossomos e nanopartículas. Diante dessa realidade, muitos materiais vêm sendo estudados como potenciais candidatos para diversos tipos de aplicações. Dentre os diferentes tipos de materiais estudados, destaca-se a sílica mesoporosa estruturalmente ordenada denominada SBAn (Santa Barbara Amorphous) descrita por Zhao e colaboradores (ZHAO, 1998). Sílicas mesoporosas ordenadas são compostos a base de silicatos que, embora amorfos, apresentam estruturas altamente organizadas, que conferem a esses materiais características texturais bastante interessantes, tais como alta estabilidade térmica, tamanho de poros bem definido, distribuição estreita de tamanho de poros e elevada área superficial (CELER, 2007). Além de possuírem essas características, a possibilidade de modificar de forma seletiva esses materiais com o intuito de serem utilizados para aplicações específicas, vislumbra uma vasta área a ser explorada, levando-se em consideração as características intrínsecas desses. Para aplicação na área farmacêutica, esses materiais, ao sofrerem modificações em suas superfícies, podem oferecer uma funcionalidade direcionada, atuando como reservatórios para os princípios ativos, podendo promover, por exemplo, a proteção dessas moléculas durante a absorção no corpo humano. Podem servir como barreiras à degradação ou metabolização
16 15 indesejada dos fármacos, propiciando, assim, uma manutenção da dose dentro do intervalo de eficácia terapêutica, levando assim, a uma diminuição dos efeitos indesejados. Portanto, a busca por uma liberação controlada de uma droga tem como objetivo minimizar as reações adversas que ocasionam muitos efeitos colaterais indesejados. As formas atuais de administração de drogas passam por vários obstáculos fisiológicos até atingir o local desejado. Desta forma, ocorre a diminuição da quantidade de droga que realmente atinge o alvo. A diminuição da eficácia de muitos fármacos é causada por uma incapacidade de entregar o fármaco de forma específica e inalterada para as células ou tecidos. Melhorando a capacidade de adsorção e controlando a liberação da droga ao se modificar a superfície desses materiais, pode-se aumentar sua especificidade e possibilitar a melhora de oferta da droga no local desejado de maneira específica, aumentando a sua eficácia. Matrizes mesoporosas com pontes de grupos orgânicos ancorados nas paredes de seus canais, empregados como sistema de liberação controlada, podem oferecer distinta capacidade de adsorção e melhor liberação das moléculas de fármacos ao se comparar com materiais não modificados. Considerando que em um dispositivo para liberação controlada de fármacos as interações droga-material são as responsáveis pela absorção e liberação da droga, parece interessante estudar esse aspecto com mais detalhe. Este trabalho envolve o estudo da funcionalização da sílica mesoporosa com estrutura cúbica ordenada, SBA-16, com diferentes agentes funcionalizantes e diferentes alcóxidos, e está dividido da seguinte forma. Nos Capítulos 2 e 3 são explicitados os objetivos e a motivação para o desenvolvimento deste trabalho. No Capitulo 4, uma revisão bibliográfica é apresentada, abordando aspectos sobre os materiais mesoporosos e os sistemas híbridos orgânico-inorgânicos, a química do processo de funcionalização superficial de estruturas a base de sílica, e o potencial de aplicação destes sistemas como dispositivos para liberação controlada de fármacos. O Capítulo 5 descreve detalhes experimentais e as metodologias utilizadas neste trabalho, bem como as técnicas utilizadas para a caracterização dos materiais. No Capítulo 6, os principais resultados são apresentados e discutidos; e no Capítulo 7, algumas conclusões são consideradas. O Capítulo 8 apresenta algumas perspectivas futuras. As referências bibliográficas pesquisadas estão apresentadas no Capítulo 9.
17 16 2. OBJETIVOS 2.1. Gerais O principal objetivo deste trabalho é sintetizar a sílica mesoporosa com estrutura cúbica, o SBA-16, promover a modificação química através da funcionalização superficial com diferentes grupos orgânicos e avaliar as propriedades especiais desse material puro e modificado como dispositivos de liberação controlada de fármacos Específicos - Sintetizar matriz de sílica mesoporosa estruturalmente ordenada, SBA-16; - Modificar superficialmente o material através da funcionalização química com diferentes agentes orgânicos; - Caracterizar as propriedades físico-químicas e microestruturais da matriz por combinação de diferentes técnicas (MET, FTIR, adsorção de gases, MEV, RMN); - Estudar os mecanismos cinéticos de liberação de diferentes fármacos modelos em solução fluído simulado (SBF) sob condições in vitro, a partir da quantificação dos teores das drogas liberadas (espectrofotometria de UV-visível); - Avaliar a conexão entre a funcionalização e as propriedades físico-químicas das matrizes mesoporosas e sua influência no processo de incorporação e liberação de fármacos.
18 17 3. MOTIVAÇÃO O presente trabalho envolve o estudo de sistemas de liberação controlada de drogas, baseado em materiais compostos de uma cerâmica e um fármaco estabelecido. Esses materiais, em especial os mesoporosos, têm despertado um interesse cada vez maior na comunidade científica motivado tanto pela singularidade das suas propriedades, quanto pelas diversificadas possibilidades de avanços tecnológicos associadas. Sabe-se que os avanços na pesquisa de fármacos eficientes não é o suficiente no tratamento de doenças; certamente, a dosagem correta e o local de alcance do medicamento são igualmente importantes para um sucesso clínico. Pesquisas em sistemas de liberação controlada de drogas trabalham especificamente nessas áreas para aumentar a eficácia dos terapêuticos, oferecendo muitas vantagens e potenciais retornos com relação à terapia tradicional. O desenvolvimento de uma tecnologia moderna de liberação de drogas tem conduzido a sistemas sofisticados que permitem uma liberação controlada de substâncias específicas em um local determinado. Os materiais mesoporosos estruturalmente ordenados são candidatos promissores para a incorporação de moléculas orgânicas, considerando que essas moléculas retêm suas características físicas e propriedades químicas, mesmo após o encapsulamento. Além disso, elas são acessíveis a reagentes externos por causa da rede de poros dos materiais; dessa forma, reações químicas e interações podem ser possíveis. Como resultado, os problemas associados com combinações de agentes farmacológicos, como toxicidade, pode ser minimizado e medicamentos difíceis de obter ou caros, como modificadores usados em terapia genética, podem ser usados somente nas mínimas doses necessárias. Considerando as vantagens óbvias que a família dos mesoporosos apresenta para ser aplicada como matriz para liberação controlada de drogas, trabalhos relacionados com a inclusão de biomoléculas na rede da sílica mesoporosa nanoestrutrada com superfície modificada estão em amplo crescimento. Embora se tenha alcançado um progresso significativo quanto ao desenvolvimento de sistemas para encapsulamento de biomoléculas no grupo de pesquisa Materiais Nanoestruturados para Bioaplicações do Centro de Desenvolvimento da Tecnologia Nuclear (CDTN), processos associados à funcionalidade superficial motivou a desenvolver sistemas hospedeiros que propiciem uma utilização clínica mais segura e vetorizada. A funcionalização ou a modificação química da sílica mesoporosa nanoestruturada através do ancoramento de átomos ou moléculas às superfícies dos poros é a estratégia proposta para conferir especificidade química e permitir a manipulação da sílica nas diversas aplicações, com possibilidade inclusive de controle do grau de alteração em suas propriedades. O material
19 18 SBA-16 foi o escolhido dentre os vários materiais mesoporosos devido a sua estrutura porosa tridimensional, com conectividade de poros, o que favorece a difusão de moléculas nesses; além disso, a sua forma esférica é mais adequada para aplicações biológicas. Contudo, dentre os diferentes materiais mesoporosos investigados por vários grupos de pesquisa do mundo, existem poucas publicações sobre a funcionalização do SBA-16 e sua aplicação como dispositivo para liberação controlada de fármacos. No Brasil, apenas o grupo do CDTN se dedica à investigação deste sistema funcionalizado.
20 19 4. REFERENCIAL TEÓRICO 4.1. Materiais Híbridos Orgânico-Inorgânicos Materiais híbridos orgânico-inorgânicos são constituídos pela combinação dos componentes orgânicos e inorgânicos intimamente misturados que normalmente apresentam propriedades complementares, originando um único material com propriedades diferenciadas daquelas que lhe deram origem (SANCHES et.al., 2010) Independentemente da estratégia utilizada na preparação de um híbrido, o processo sol-gel é, indiscutivelmente, um dos métodos de síntese mais empregados (SOUSA, 2006). O processo sol-gel consiste basicamente na transformação de um sol, que é uma suspensão de partículas coloidais em um líquido, em um gel. O sol é constituído de partículas coloidais (dimensão entre 1 e 1000 nm) e o gel é formado pela estrutura rígida de partículas coloidais ou por cadeias poliméricas que imobilizam a fase líquida nos seus interstícios (MATIJEVIC, 1973). No processo sol-gel os precursores usados para a preparação do material consistem de um elemento metálico rodeado por vários ligantes. Os precursores utilizados podem ser inorgânicos ou orgânicos. Aqueles mais usados na pesquisa do processo sol-gel são os alcóxidos metálicos (ULRICH, 1990) tais como os de silício, como, por exemplo, o tetraetilortosilicato (TEOS) e o tetrametilortossilicato (TMOS). A preparação de uma sílica gel se inicia com um alcóxido apropriado, TMOS ou TEOS, que é misturado em água e em um solvente comum, como etanol ou metanol, para formar uma solução. A reação de hidrólise e condensação dos grupos alcoxilsilanos é catalisada por ácido ou base e conduz à formação dos grupos silanóis Si-OH. Estas espécies são apenas intermediárias, uma vez que elas reagem para formar grupos siloxanos Si-O-Si. À medida que as reações de hidrólise e condensação continuam, a viscosidade da solução aumenta e o gel é formado (BRINKER, 1990) (HENCH, 1990). As reações químicas envolvidas em um processo sol-gel convencional baseado em derivados alcóxidos são:
21 20 1. Hidrólise do precursor: M(OR) + H 2 O M(OH) + ROH onde M= Si, Sn, Ti, Al, Mo, etc 2. Condensação alcoólica e/ou aquosa: M(OR) + HO(M) M(O)M + ROH M(OH) + M(OH) M(O)M + H 2 O O primeiro passo do processo ocorre por via da substituição nucleofílica do alcóxido (RO-) por grupos hidroxilas (OH-), por meio de um mecanismo do tipo S N 2, em que ocorre uma protonação reversível do grupo alcóxido e a subseqüente substituição nucleofílica dos grupos silanóis ou da água (CELER, 2007). O processo sol-gel é relativamente complexo. Vários parâmetros como o tempo e temperatura da reação, razão água/alcóxido, ph da solução, natureza do solvente etc., influenciam as reações de hidrólise e de condensação, e determinam as características finais do material resultante. Variando estes parâmetros de síntese, materiais com diferentes microestruturas e superfícies químicas podem ser obtidos. As vantagens inerentes ao processamento sol-gel, tais como a obtenção de materiais com elevada pureza e homogeneidade, grandes áreas superficiais, porosidade controlada e habilidade de trabalhar com geometrias complexas, tornam o método bastante eficaz para sintetizar materiais mesoporosos híbridos orgânico-inorgânicos. Contudo, o processo sol-gel tradicional pode resultar em materiais com uma distribuição de tamanho de poros muito extensa, o que pode comprometer o seu desempenho, dependendo da sua aplicação final, como, por exemplo, nos sistemas para liberação controlada de fármacos. Uma rota alternativa à síntese sol-gel clássica seria a obtenção de materiais mesoporosos estruturalmente ordenados, que envolve o uso de surfactantes, cujo tamanho e concentração controlam as dimensões estruturais do material final devido às suas propriedades de formar micelas (SANCHES et.al., 2010).
22 Materiais Mesoporosos De acordo com a classificação feita pela IUPAC (SING, 1985) sólidos porosos podem ser arranjados em três categorias principais, dependendo de seu tamanho de poros (diâmetro, d), em micro (d < 2 nm), meso (2 nm < d < 50 nm) e materiais macroporosos (d > 50 nm), conforme apresentado na FIG. 1. FIGURA 1 - Exemplos de materiais micro, meso e macroporosos, mostrando domínios de tamanho de poros e distribuição de tamanho de poros. Adaptado de SOLER-ILLIA, Cientistas da Móbil, em 1992, foram bem sucedidos na síntese de peneiras moleculares mesoporosas denominadas M41S, sendo que o MCM-41, de estrutura hexagonal, e o MCM- 48, de estrutura cúbica, são dois membros típicos. Esse procedimento foi um avanço na síntese de compostos orgânico-inorgânicos bifásicos (McGRATH, 1997). Materiais mesoporosos são sistemas altamente ordenados com elevada área superficial. Além disso, outras características podem ser observadas, como diâmetro de poros bem definidos e um ordenamento de poros a longo alcance. Esses materiais, ainda, podem ser promissores para uso comercial por serem economicamente favorável e possuir uma estabilidade que favorece sua produção em larga escala. Além desses fatores, a presença de geometria regular, possibilita diversificadas atuações desses materiais devido ao elevado potencial nas aplicações como: catálise, adsorção, separação, uso médico, ecológico e em nanotecnologia (VINU, 2006).
23 22 Vários mecanismos são propostos para explicar a síntese desses materiais mesoporosos. Um mecanismo proposto, inicialmente, é baseado na síntese de sílica mesoporosa a partir da formação de mesofases, estruturas de fases líquido-cristalinas de moléculas anfifílicas (surfactantes), que servem como direcionadores para uma polimerização in situ de ácidos ortosilícicos, FIG. 2. Esse mecanismo é conhecido como direcionamento por cristal líquido, LCT (Liquid Crystal Templating). A síntese pode ser realizada em condições acidas ou básicas, e a fonte de sílica pode ser sílica, silicato de sódio, ou um óxido tetra-alquil silano. O primeiro material relatado por pesquisadores da Mobil (designado como MCM-41) era uma partícula de tamanho micrométrico com mesoporos hexagonais ordenados (BECK, 1992). Materiais mesoporosos ordenados podem ser preparados por uma variedade de procedimentos e sobre uma extensa faixa de composições, usando-se para isso vários direcionadores de estrutura (templates) diferentes. Os templates orgânicos mais utilizados são: surfactantes (catiônicos, aniônicos e neutros), templates poliméricos (copolímeros em bloco, dendrímeros e látex) e sistemas biológicos (proteínas, polissacarídeos, bactérias e vírus). Os surfactantes possuem uma estrutura molecular consistindo de um grupo funcional hidrofóbico (cauda apolar) junto a um grupo hidrofílico (cabeça polar). Esta estrutura é conhecida como anfifílica. Moléculas anfifílicas se auto-organizam em uma variedade de estruturas. A forma mais simples destas estruturas é a micela. Micelas são agregados moleculares possuindo ambas as regiões estruturais, hidrofílica e hidrofóbica, que dinamicamente se associam espontaneamente em solução aquosa a partir de certa concentração micelar crítica (CMC), formando grandes agregados moleculares de dimensões coloidais. Esses agregados coloidais podem apresentar diferentes microestruturas: esférica, cilíndrica, planar, etc (SOUSA, 2009).
24 23 FIGURA 2 - Esquema da formação da estrutura inorgânica mesoporosa mediada por agente direcionador de estrutura. Figura adaptada de Raman et al., Para um sistema binário surfactante-água em soluções muito diluídas, moléculas surfactantes encontram-se sob a forma monomérica. À medida que a concentração aumenta, as moléculas se agregam para formar micelas. O aumento da concentração pode promover transições na morfologia dos agregados e as fases líquido-cristalinas podem ser verificadas em soluções ainda mais concentradas. O tamanho dos poros das mesofases obtido pelo sistema binário é limitado pelo comprimento da cadeia do surfactante e pela variação da composição (ATTARD, 1995). Tentativas de expandir a composição e o tamanho de poros resultaram em materiais com perda do ordenamento a longo alcance (STUCKY, 1994). Com o objetivo de introduzir maior flexibilidade e diversidade no processo de síntese de materiais mesoporosos Feng e colaboradores (FENG, 2000) relataram uma síntese de sílica mesoporosa baseado em fases líquido-cristalinas de surfactantes preparada a partir de sistema ternário consistindo de copolímero tribloco anfifílico, F127, co-surfactante tais como butanol e pentanol e água. O pluronic F127, por ter um grande peso molecular com um volume hidrofílico elevado, é o surfactante ideal para esse tipo de síntese. A longa cadeia hidrofílica oferece a possibilidade de sintetizar óxidos mesoporosos com paredes espessas que podem levar a uma maior estabilidade térmica e hidrotérmica. A vantagem do uso de co-surfactante é a forma como esse permite o controle do tamanho de poros. O conceito de direcionamento por cristal líquido (liquid crystal template) foi introduzido em 1992 por Beck e colaboradores e consiste no uso de um arranjo tridimensional de moléculas de surfactante para direcionamento de estrutura sólida (BECK, 1992). Duas formas de sínteses podem ser realizadas com direcionamento por cristal líquido, a síntese direta e indireta. Os critérios para selecionar as condições de síntese direta de direcionamento por cristal líquido se diferem dos critérios para a síntese do cristal líquido indireto quanto à concentração do surfactante. No caso do direcionamento por cristal líquido indireto, a concentração do surfactante
25 24 é baixa, e nessa concentração as moléculas do surfactante existem na forma micelar, porém não se obtém uma organização de longo alcance das estruturas do surfactante. A auto-organização orgânico-inorgânica é direcionada por ligações não covalente, tais como ligações de hidrogênio, forças de van der Waals e ligações eletrostáticas entre o copolímero tribloco e a espécie inorgânica. Dessa forma, no caso do direcionamento indireto, é importante usar condições fortemente ácidas ou básicas para melhorar as interações (eletrostáticas, ligações de hidrogênio, etc) entre os oligômeros de sílica e o surfactante. Essas interações orgânicoinorgânicas servem para induzir o ordenamento de longo alcance das espécies de surfactantes, e esses por sua vez, auxiliam na organização da polimerização das espécies inorgânicas, atuando como direcionadores (MONNIER, 1993). Já no caso da síntese direta de direcionamento cristal-líquido, a concentração de surfactante é alta o suficiente para formar o ordenamento a longa distância, mesmo sem a interação sílicasurfactante. Portanto, não é necessário criar fortes interações sílica-surfactante, já que essas podem perturbar as interações de longo alcance existentes nas matrizes do surfactante. Por essa razão as sínteses em sistemas ternários são realizadas no ponto isoelétrico da sílica (ph 2) para minimizar as interações eletrostáticas. Para não se criar essas interações fortes, o uso de surfactantes Plurônicos não iônicos deve ser mais adequado para esse tipo de síntese do que surfactantes carregados (FENG, 2000). Recentemente, materiais mesoporosos com largos tamanhos de poros e melhor estabilidade comparado com material M41S, foram sintetizados com o direcionador não iônico, copolímero tribloco poli(óxido de etileno)-poli(óxido de propileno)-poli(óxido de etileno), por Zhao e colaboradores (ZHAO, 1998). Essas novas sílicas mesoporosas foram denominadas de materiais SBA-n, e dentre essas, tem-se materiais que exibem estrutura de poros bi e tridimensional hexagonal (SBA-2, 12, 3 e 15) e cúbicas (SBA-1, 6 e 16) (CHENG, 2003) SBA-16 O SBA-16 é uma sílica mesoporosa com tamanho de poros da ordem de 5-15 nm, com elevada área superficial ( m 2.g -1 ) e alta estabilidade térmica. A estrutura dos mesoporos é tridimensional, cúbica ordenada, obtida por remoção da fase orgânica, que possui simetria correspondente ao grupo espacial Im3m, conforme a FIG. 3. Com um formato esférico, apresenta estrutura de poros cúbica de corpo centrado, podendo ser descrita, de
26 25 acordo com estudos de cristalografia, como sendo envolto por uma superfície tripla periódica mínima I-WP, caracterizando um material com estrutura de corpo centrado, como pacote embrulhado (RASMUSSEN, 2010). Estudos de cristalografia eletrônica indicam que cada mesoporo de SBA-16 está ligado a oito mesoporos vizinhos. A estrutura 3D confere a esses materiais aplicações variadas como na catálise, detecção e separação química e na adsorção. As características estruturais, a conectividade e a porosidade são críticas para sua aplicação (KRUK, 2003). FIGURA 3 - Estrutura cúbica do SBA-16. (BRAKKE, 2005) (ZHOU, 2007). Alguns exemplos de materiais mesoporosos com estrutura 3D são o SBA-1, sintetizado em condições ácidas, e o SBA-6 sob condições básicas. O SBA-1 é sintetizado sob as mesmas condições ácidas do que o SBA-16, e a síntese desses materiais, considerando o ph, acontece abaixo do ponto isoelétrico da sílica em água (ph 2), já que, sob essas condições, a síntese possui cargas apropriadas que favorecem as interações de hidrogênio e de van der Waals. Tais interações são importantes para a interface orgânico-inorgânica que pode ser obtida ao se trabalhar com a sílica catiônica, que se encontra desta forma abaixo do ponto isoelétrico (ZHAO, Nature) (ZHAO, 1998). Na síntese de vários tipos de materiais da família SBA são utilizados como agentes direcionadores copolímeros tribloco não iônico. Esse tipo de direcionador é de fácil separação, não tóxico, biodegradável e de baixo custo (STUCKY, 1998). O SBA-16 é sintetizado pela junção de um sistema ternário de água, butanol e polímero tribloco, sob condições ácidas, em que a reação ocorre através do mecanismo S 0 H + X - I +. Esse mecanismo consiste da reação entre uma fonte de sílica representada por I +, com carga positiva, geralmente, uma espécie de silício monomérico. S 0 H + representa um surfactante que
27 26 forma ligação de hidrogênio com íons hidrônios (H 3 O + ). Normalmente, para se obter o ph baixo é usado o ácido clorídrico, e o íon clorídrico é representado X - ; esse íon é responsável pela interação entre as espécies, formando ligações fracas não covalentes entre o surfactante copolímero tribloco e a sílica (RIVERA-MUÑOZ, 2010). O agente direcionador nesse caso é o surfactante não iônico Pluronic F127 (EO 106 PO 70 EO 106 ) que proporciona uma porosidade complementar a esse material Copolímeros Copolímeros são polímeros constituídos de diferentes unidades de repetição. Os copolímeros são divididos em uma série de classes dependendo da forma em que as diferentes unidades de repetição são distribuídas nas cadeias poliméricas. A classe do copolímero utilizado na síntese do SBA-16 é o copolímero em bloco (ORÉFICE, LEPCom). Os copolímeros em blocos são formados pela combinação de dois ou mais blocos de polímeros unindo cabeça à cauda por interações covalentes (GIDO et. at. 1993). Eles possuem uma tendência de se auto-organizar quando dissolvidos em um solvente seletivo, sendo que esse solvente é bom para um dos blocos. Para copolímeros triblocos (por exemplo, EO-PO-EO, onde EO é o óxido de etileno e PO é o óxido de propileno) entre 40 e 50ºC, as micelas esféricas contêm entre 15 e 60 moléculas por agregado, com raio hidrodinâmico na escala de 6 a 10nm (LOH, 2002; ALEXANDRIDIS & HATTON, 1995). De maneira semelhante aos outros surfactantes, a altas concentrações e temperaturas, são conhecidos outros arranjos para esses copolímeros em blocos. Esses arranjos podem variar de cilíndricos a cúbicos ou hexagonais, lamelares ou outras estruturas (SOUSA, 2009). Alguns copolímeros triblocos com cadeias relativamente grandes de óxido de etileno (PEO), tais como, F127, F108 e F98 podem servir como templates, porém, templates com cadeias muito longas de PEO são raramente usados por não favorecerem a formação do SBA-16 com alta qualidade. A mesofase pode ser criada usando também uma mistura de Pluronic P123 e Pluronic F127 ou um sistema ternário de água, butanol e Pluronic F127. Devido à longa cadeia do Pluronic F127 comparado ao Pluronic P123, o SBA-16 geralmente possui maior
28 27 espessura de parede de poros do que SBA-15 (STUCKY, 1994). A FIG. 4 apresenta as fórmulas estruturais desses copolímeros. F127 F123 FIGURA 4 - Representação da fórmula estrutural dos copolímeros F123 e F127. O ajuste da relação do volume entre os blocos hidrofílicos e hidrofóbicos e seu comportamento específico de agregação (auto-montagem) podem fornecer propriedades supramoleculares de direcionamento com um apreciável grau de controle da estrutura de poros. Em outras palavras, a topologia do poro, o tamanho e a conectividade dos poros podem ser adaptados em função da concentração do copolímero, da temperatura de síntese ou da relação do volume entre os diferentes blocos (KLEITZ, 2004). Estudos realizados por Kleitz (KLEITZ, 2004) com copolímero tribloco usando butanol como co-surfactante com baixa concentração de ácido para obtenção de sílica mesoporosa com excepcional controle do comportamento de fase, demonstraram que a introdução de butanol na síntese de sílica mesoporosa se mostrou eficiente como meio de ajuste da estrutura do material. O butanol é conhecido por participar como co-surfactante juntamente com o copolímero tribloco na formação da interface polar/apolar. Especificamente, acredita-se que o butanol se localiza principalmente na interface hidrofílica/hidrofóbica (EO/PO) estabilizando a agregação micelar determinando assim a curvatura da superfície. Controle estrutural e textural é desejável especialmente para a projeção de sólidos com poros funcionais para aplicações envolvendo seletivamente adsorção e difusão e interação hospedeiro-hóspede com elaborados materiais nanoestruturados, tal como ocorre no processo de liberação de drogas (KLEITZ, 2004). Muitos esforços têm sido direcionados para compreender o papel das interações entre o processo de formação da mesofase e a reação de policondensação da fonte de sílica. Algumas
29 28 propostas de mecanismo da síntese são apresentadas. Stucky e colaboradores (STUCKY, 1994) propuseram quatro rotas de sínteses cujos mecanismos são representados por S + I -, S - I +, S + X - I + e S - X + I -. (S + ) representa o surfactante catiônico, (S - ) representa o surfactante aniônico, (I + ) representa os precursores inorgânicos catiônicos, (I - ) representa os precursores inorgânicos aniônicos, (X + ) representa os contra-íons catiônicos, (X - ) representa os contraíons aniônicos (STUCKY, 1994). Por outro lado, um mecanismo baseado em interações de hidrogênio, representadas por S 0 I 0 e N 0 I 0 foi proposta por Pinnavaia e colaboradores (PINNAVAIA, 2003) em que as mesoestruturas são preparadas sob condições neutras. S 0 são aminas neutras, N 0 são surfactantes não iônicos, e I 0 são oligômeros de silicatos hidratados de tetraetilortosilicato (TEOS) (STUCKY, 1994). Os direcionadores não iônicos, copolímeros triblocos anfifílicos, são usados para sintetizar o material SBA Adsorção de gases Com os dados gerados pela análise de adsorção de gás é possível extrair informações interessantes sobre as características relacionadas à estrutura do material, tais como volume do poros, tamanho e distribuição de tamanho de poros e área superficial, através da determinação da sorção das moléculas do gás com os poros do sólido. Essa adsorção de gás no sólido gera isotermas as quais representam as quantidades de moléculas condensadas (adsorbato) nos poros do sólido (adsorvente) em função da pressão parcial da fase do gás a uma temperatura constante. A IUPAC desenvolveu em 1985 uma classificação geral que padronizou as isotermas de sorção em seis tipos, dependendo da estrutura do sólido e da força durante a adsorção como apresentado na FIG. 5 As isotermas do tipo I são características de sólidos microporosos ou se adsorção de monocamadas; as do tipo II são de não porosos e as do tipo III são de sólidos macroporosos. As isotermas do tipo IV e V possuem uma alça de histerese típica que caracteriza o processo de sorção em mesoporosos devido à adsorção em multicamadas e a condensação capilar (GOBIN, 2006).
30 29 A histerese pode ser causada pela rede porosa (CELER, 2007). A interpretação das alças das histereses, típicas de materiais mesoporosos, pode revelar fenômenos interessantes. Essas alças de histereses foram classificadas em quatro tipos, conforme apresentado na FIG. 5. FIGURA 5 - (A) Classificação das isotermas de sorção segundo a IUPAC. (B) Classificação moderna das alças de histerese (GOBIN, 2006). Três diferentes efeitos podem afetar a alça de histerese. Estes são a cavitação e o efeito de bloqueio de poros ou a dessorção próxima do equilíbrio. Em materiais como SBA-16 de poros bloqueados, a dessorção é cineticamente limitada pela entrada dos poros menores. A dessorção pode ser spinodal; isso significa que em um determinado ponto crítico o líquido passará de um regime metaestável para um regime instável e dessorverá imediatamente para fora dos mesoporos a uma dada pressão. Efeitos de cavitação e bloqueio de poros são similares e também ocorre uma dessorção spinodal, mas isso acontece a uma baixa pressão (0,45-0,48 P/P 0 ) devido ao pequeno tamanho da entrada dos poros (RAVIKOVITCH, 2002). O SBA-16 apresenta isoterma do tipo IV, com alças de histerese adsorção-dessorção do tipo H2 característica de materiais mesoporos do tipo gaiola, com uma entrada muito mais estreita do que o tamanho da gaiola, como pode ser visto na FIG. 6. O SBA-16 sintetizado até uma temperatura de 100 C possui tamanho da gaiola da ordem de 5,3 nm e entrada de poro da ordem de 3,6 nm, como descrito por Zhang (ZHANG. et.al., 2009).
31 30 FIGURA 6 - Desenho esquemático do tipo e tamanho dos poros do SBA-16 (ZHANG. et.al., 2009) Funcionalização Desde que os vários tipos de materiais mesoporosos ordenados como M41S, FSM 16, HMS, MSU, e SBA foram sintetizados na presença de surfactantes iônicos, neutros e não-iônicos, a funcionalização ou modificação desses materiais tem desempenhado um papel importante em vários aspectos tecnológicos, tais como a melhoria da estabilidade térmica/ hidrotérmica, a imobilização de moléculas orgânicas, desenvolvimento de novos catalisadores e adsorventes e nanotecnologia (ZHAO & QIAO, 2004). Portanto, vários estudos têm sido direcionados para conferir especificidade química aos sólidos mesoporosos por meio da introdução de moléculas orgânicas. Esses materiais podem ser preparados e modificados com uma grande variedade de combinações de moléculas, diversificando as propriedades do material. A maior versatilidade introduzida, associada às suas novas propriedades, apresenta um grande potencial de aplicações, tais como catálise, imobilização de enzimas, adsorção de metais pesados, confecção de sistemas de liberação controlada de drogas, entre outras (XUE, 2004; RYOO, 2005; LIU, 2003). A estrutura da sílica é constituída por unidades tetraédricas SiO 4 distribuídas aleatoriamente e unidas por pontes de siloxanos (Si-O-Si) em seu interior com grupos silanóis (Si-OH) dispersos, cobrindo toda a superfície, os quais podem ser modificados por diversas reações. Dependendo das posições dos grupos silanóis, FIG. 7, eles são denominados isolados (1) vicinais (2) ou geminais (3).
32 31 Isolados Vicinais Geminais FIGURA 7 - Disposição dos grupos silanóis na sílica. Os grupos silanóis são provenientes da condensação do ácido silícico durante o processo de preparação da sílica gel e concedem característica polar à sílica, sendo responsáveis pela sua capacidade adsortiva. A sílica possui um caráter levemente ácido com características de um ácido de Brönsted, devido aos grupos silanóis superficiais, sendo que seus sítios ácidos são responsáveis pelo controle da reatividade que ocorre na superfície; assim é interessante que os grupos silanóis estejam livres para possíveis interações antes de efetuar quaisquer reações. Através da modificação química da superfície da sílica, obtêm-se compostos de maior versatilidade e com propriedades mais refinadas, com as propriedades do agente modificador (relacionada às espécies ligadas à superfície e suas propriedades específicas), com a vantagem do aumento da estabilidade do mesmo em relação à perda por lixiviação (MUÑOZ, 2003). A presença de grupos silanóis foi detectada pela primeira vez em 1936 (CHRYSTY, 2005). Com o intuito de quantificar os grupos silanóis presentes na superfície da sílica, uma série de técnicas e abordagens tem sido empregados, como método sofisticado de troca de deutério acoplado à espectrometria de massa e CPMAS NMR e espectroscopia na região do infravermelho (ZHURAVLEV, 1987). A quantidade de silanóis estabelecidos por esses métodos variam de 2,0 a 9,5 de grupos OH por nm 2, que é representado por α OH, expresso normalmente por unidade de área superficial em nm 2. Entretanto, o número geralmente considerado para a maioria dos estudos é um valor aproximado de α OH na ordem de 5,0 OH/nm 2, independente da origem e das diversas características estruturais, tais como, área superficial específica, tipo e tamanho de poros e densidade de empacotamento de partículas (FARIAS, 1998). Além desses métodos, estudos utilizando a termogravimetria confirmaram o valor de α OH (OLIVEIRA, 2008).
33 32 Uma maneira de se explorar a reatividade dos grupos silanóis na superfície consiste na reação de sililação, onde um alcoxisilano passa a ser quimicamente ligado à superfície, essa por sua vez, muda suas propriedades, e esse processo é denominado de organofuncionalização (ARAKAKI, 1999). Para que ocorra o processo de organofuncionalização, é indispensável haver a ativação dos grupos silanóis, no sentido de facilitar a ligação aos grupos ativos dos compostos organosilanos. A ativação consiste em eliminar as moléculas de água residuais, através de vácuo com aquecimento, que formam ligações de hidrogênio com os grupos silanóis da superfície. A remoção da água fisicamente adsorvida pode ser realizada na faixa de 373 K a 473 K sem afetar a quantidade de grupos silanóis superficiais. Acima desta faixa de temperatura inicia-se a condensação dos grupos silanóis, formando grupos siloxanos, diminuindo a reatividade da superfície (ILER, 1979) Grupos Silanos A funcionalização pode utilizar agentes sililantes, em que os grupos silanóis da superfície formam uma ligação covalente com esses agentes. O termo sililação refere-se à fixação no suporte de um composto triorganosilil, principalmente espécies como trimetilalcoxisilil em superfícies, obtendo assim compostos silanos organofuncionalizados. Os agentes sililantes são compostos triorganossilil; os silanos são amplamente aplicados devido à reatividade dos grupos reativos presentes, tais como: amino, haletos e em sua maioria alcóxidos (VIEIRA, 1997). Esse último aspecto é relevante do ponto de vista prático, porque os silanos com tais grupos reagem facilmente com substratos hidroxilados. Como resultado dessa reatividade, forma-se uma ligação covalente entre as moléculas do silano e a superfície hidroxilada de um suporte, com conseqüente eliminação do álcool correspondente (ARAKAKI, 1999). A fórmula geral dos grupos silanos consiste de R-(CH 2 ) n -Si-X 3 em que R é o grupo organofuncional, (CH 2 ) n é o grupo de ligação, Si é o átomo de silício e o X 3 corresponde ao grupo passível de sofrer hidrólise; esse grupo normalmente consiste de grupo aquil, aciloxil, halogênios ou amina (GELEST, Inc, 2006). A modificação da superfície por alcoxisilanos se deve à fixação do agente modificador no suporte inorgânico, obtendo-se um composto híbrido orgânico-inorgânico. O sucesso da
34 33 reação em meio não aquoso, depende da disponibilidade dos grupos silanóis em formar covalentemente ligação com o agente sililante de maneira monodentada, bidentada ou tridentada, como pode ser visto na FIG. 8, sendo as formas mais comuns de ligação do tipo mono e bidentada (FARIAS, 2000). FIGURA 8 - Diferentes formas de ancoramento de organosilanos na superfície de um suporte contendo grupos silanóis: a) monodentada b) bidentada c) tridentada (ARAKAKI, 1999). Em um processo de modificação superficial, o agente funcionalizante de interesse deve apresentar uma efetiva ligação na superfície, de tal maneira que se a matriz estiver envolvida em uma seqüência de reações, após atingir a etapa final nesta seqüência, a estrutura da matriz deverá permanecer inalterada. Portanto, cuidados especiais devem ser tomados na escolha dos tipos de materiais para que se efetue a funcionalização de forma efetiva. Na maioria das vezes, os métodos utilizados são uma combinação de um ou mais modos de ligação, visando à fixação do substrato na superfície, os quais, basicamente, podem ser descritos como: ligação covalente, em que ocorre um compartilhamento de elétrons entre os átomos, ocorrendo uma atração mútua entre esses formando uma ligação forte; adsorção, ou seja, a adesão de moléculas de um fluido a uma superfície sólida; e policondensação, em que os monômeros sofrem polimerização devido à existência das reações de condensação. A imobilização de grupos alcóxidos, por exemplo, 3-aminopropiltrietoxisilano, é mais facilmente obtida por uma via denominada rota heterogênea. O processo consiste em suspender a sílica gel em condições anidras, com a adição do agente de interesse, por um
35 34 longo tempo de refluxo na temperatura de ebulição do solvente apolar empregado, para fixar a molécula de maneira covalente na superfície da sílica (AIROLDI, 2008). Métodos para funcionalização de materiais mesoporosos a base de sílica são amplamente descritos. Geralmente, híbridos orgânico-inorgânicos de peneiras moleculares podem ser preparados por duas vias: (1) in situ funcionalização durante a síntese (co-condensação) ou (2) funcionalização pós-síntese (HUMPHREY, 2005). Funcionalização por co-condensação de espécies orgânicas durante a síntese permite ajustar as propriedades superficiais e, dessa maneira, pode fornecer maior seletividade deste material para uma aplicação específica. O princípio que envolve essa rota de funcionalização é a condensação dos grupos alcoxisilanos, sendo que um é o funcionalizante e o outro é o não funcionalizante (ex. 3-aminopropiltrietoxisilano com tetraetoxisilano (TEOS)). O grupo alcoxisilano funcionalizante pode sofrer hidrólise a uma mesma taxa que o tetraetoxisilano ou um gel heterogêneo pode ser formado podendo resultar em uma distribuição não uniforme dos grupos funcionais; a adição de grupos alcoxisilanos pode alterar o tipo de estrutura da sílica formada (HUMPHREY, 2005). No processo de funcionalização pós síntese do material, primeiro é obtida a sílica mesoporosa com o auxílio de um agente direcionador e o agente modificador desejado é ancorado posteriormente à superfície da sílica mesoporosa. A metodologia de pósmodificação apresenta o inconveniente de empregar uma etapa a mais de reação e, também, a possibilidade de funcionalização uniforme é bem menor que o método de funcionalização durante o processo de síntese. Conseqüentemente, o desenvolvimento de sólidos mesoestruturados tem sido obtido preferencialmente pelo procedimento de funcionalização durante a co-condensação. A FIG. 9 mostra um exemplo clássico de possíveis modificações químicas na superfície da sílica. Os grupos Si-OH exercem uma marcante influência nas propriedades do material. Geralmente, sua afinidade por moléculas polares aumenta com maior concentração de grupos silanóis, mas esses grupos podem reagir com uma larga variedade de produtos químicos promovendo ligações covalentes do tipo Si-O-R. Esse fato permite ligar ou abrigar espécies químicas diferentes na superfície do material, isto é, funcionalizar sua superfície, como mostra a FIG. 10 (VALLET-REGÍ, 2006B).
36 35 (b) FIGURA 9 - Esquema de possíveis modificações da superfície da sílica com diferentes grupos orgânicos por (a) pós-síntese e (b) co-condensação. FIGURA 10 - Esquema da funcionalização do poro na parede da sílica mesoporosa. (VALLET-REGÍ, 2006B). A funcionalização orgânica de silicatos permite o controle preciso sobre as propriedades de superfície, a modificação do caráter hidrofílico/hidrofóbico da superfície, a alteração da reatividade superficial, a proteção da superfície ao ataque, e ao mesmo tempo a estabilização dos materiais para hidrólise. Além disso, a escolha do tipo de solvente utilizado no processo de funcionalização pode influenciar de forma significativa esse processo. Isso é devido às prováveis interações que podem ocorrer entre a matriz, o solvente e o agente funcionalizante. Dessa forma, devem-se levar em consideração na seleção dos solventes os seus respectivos parâmetros de solubilidade (δ), além do que o caráter polar tanto da superfície a ser modificada, quanto do agente funcionalizante são critérios a serem considerados.
37 36 O parâmetro de solubilidade foi definido por Hildebrand, em 1936, e posteriormente, Hansen propôs uma extensão dos parâmetros para estimar a miscibilidade dos sistemas de ligações polares e de hidrogênio (HANSEN, 1967). Esse dividiu os parâmetros de solubilidade em três componentes: dispersão, polar e ligação de hidrogênio. Os três componentes são empiricamente adaptados para definir as características de miscibilidade dos solventes. Normalmente, quanto maior o valor de δ, maior a polaridade do solvente. Esse parâmetro é agrupado nos três componentes, de acordo com a interação intermolecular, como por exemplo δd para interação de dispersão, δo para interação do tipo dipolo e δa para interações do tipo ligações de hidrogênio. Os solventes utilizados nesse trabalho foram o metanol, ou álcool metílico, e o tolueno, também denominado metilbenzeno. Esses solventes foram escolhidos por serem bem diferentes entre si no que diz respeito à polaridade. O tolueno é um solvente apolar, praticamente insolúvel em água, sendo solúvel em solvente orgânico como acetona, clorofórmio e benzeno. O metanol é um solvente altamente polar, miscível em água e, além disso, apresenta o grupo hidroxila na sua molécula (BELMARES, 2004). A TAB. 1 apresenta os valores dos parâmetros de solubilidade do metanol e do tolueno. Os valores do parâmetro de solubilidade para interações do tipo ligação de hidrogênio para o tolueno é de 0,5, o qual é muito menor do que o apresentado pelo metanol, que é de 7,5. Como a sílica apresenta grupos hidroxilas na sua superfície, a interação do tipo ligação de hidrogênio é favorecida com solventes que apresentam maiores valores de δa. Quanto menor os valores de δa, menor a interação da sílica com o solvente, como acontece com o tolueno, sendo, portanto, que a interação da sílica com os agentes alcoxisilanos fica mais favorecida nesse ambiente mais apolar (SOUSA, 2006). O componente de dispersão do parâmetro de solubilidade é maior para o tolueno, favorecendo ainda mais a dispersão desse na superfície da sílica, mais um fator para que esse solvente favoreça a funcionalização. TABELA 1: Parâmetros de solubilidade dos solventes. Solvente δd (cal/cm 3 ) ½ δo (cal/cm 3 ) ½ δa (cal/cm 3 ) ½ Tolueno 8,9 0 0,5 Acetona 6,8 5 2,5 Metanol 6,2 5 7,5 Fonte: (SOUSA, 2006).
38 37 A sílica pode ser modificada superficialmente com compostos que apresentem grupos ácidos ou básicos, com o objetivo de produzir sólidos ácidos e/ou básicos, que são capazes de interagir com diferentes princípios ativos, de acordo com o interesse de aplicação. Modificações de superfície da sílica-gel foram relatadas por Mishra e colaboradores (MISHRA, 2004), enumerando os possíveis processos de modificações superficiais e suas aplicações, principalmente, para adsorção de íons metálicos. Funcionalizações de nanoporos de SBA-15 com diferentes grupos organosilanos, pelo método de co-condensação, foram realizadas por Zhao e colaboradores (ZHAO, 2006). Com essas funcionalizações foi possível a imobilização de moléculas biológicas, como a enzima penicilinase, como ilustrado pela FIG. 11. Os autores buscaram uma melhor interação da enzima com os grupos funcionais avaliando o caráter hidrofóbico reforçado, interações eletrostáticas e ligações de hidrogênio. FIGURA 11 - Proposta da interação da enzima PA com a base do material. (A) Ligações de hidrogênio, (B) Interações hidrofóbicas, e (C) Interações eletrostáticas (ZHAO, 2006). Sistemas mesoporosos funcionalizados apresentam grande potencialidade para serem aplicados como dispositivos para liberação controlada de fármacos. Estudos comparativos da capacidade de adsorção e propriedade de liberação de diferentes materiais mesoporosos, os quais foram funcionalizados com grupos funcionais distintos, foram realizados por Wang e colaboradores (WANG, 2009). Sínteses por duas vias distintas (co-condensação e pós-síntese) foram feitas e vários grupos silanos promoveram modificação superficial, como exemplificado na FIG. 12. Além disso, dois diferentes fármacos hidrofóbicos e hidrofílicos foram utilizados como modelo de droga no estudo. Os grupos funcionais usados incluem 3- aminopropil, 3-mercaptopropil, vinil e grupos de aminas secundárias usadas para
39 38 funcionalizar materiais mesoporosos que foram incorporados com rodamina 6G (R6G) e Ibuprofeno, em que se avaliou a adsorção e liberação desses. FIGURA 12 - Modificação interna da sílica mesoporosa (Adaptada de HILL, 2007). Ao funcionalizar a superfície do MCM-41 com o grupo aminopropil usando o método de cocondensação e pós-síntese, Vallet e colaboradores (VALLET-REGÍ, 2008) compararam os parâmetros texturais e avaliaram tanto a absorção quanto a cinética de liberação de ibuprofeno nas diferentes matrizes. O que se observou foi uma redução do diâmetro e do volume de poros após o processo de funcionalização, sendo que essa redução foi maior ao se empregar o método pós-síntese. Como conseqüência dessa diferença de volume de poro, o MCM-41 funcionalizado pelo método pós-síntese absorveu menos ibuprofeno do que o funcionalizado pelo método de cocondensação. E ao se investigar a cinética de liberação desses materiais, viu-se que o material
40 39 funcionalizado por co-condensação liberou de forma semelhante ao material não modificado, e que o MCM-41 funcionalizado por pós-síntese liberou três vezes mais lento do que o MCM- 41 puro. Esse comportamento sugere uma interação forte dos grupos amino do MCM-41 póssintetizado com o grupo carboxílico do ibuprofeno. Sousa e colaboradores (SOUSA, 2006) funcionalizaram SBA-15 com diferentes alcoxisilanos e observaram a influência de solventes com diferentes polaridades (tolueno, acetona e metanol) quanto à reatividade dos funcionalizantes com a superfície da sílica, sendo constatada a reatividade na superfície da sílica de todos os alcoxisilanos quando se utilizou tolueno como solvente. A incorporação de drogas dentro de matrizes de sílica mesoporosa depende das características físico-químicas da molécula. Drogas básicas são liberadas de uma forma controlada, enquanto que as neutras ou ácidas são liberadas muito rapidamente. Isso é devido às propriedades iônicas da estrutura da sílica mesoporosa. As moléculas com grupos reativos funcionais, tais como grupos alcóolicos ou fenólicos podem ser quimicamente ligadas à superfície da sílica através de ligações do tipo =Si-O-C=, ou por meio de ligações de hidrogênio. Fortes ligações de hidrogênio são formadas com bases fracas contendo nitrogênio, como as piridinas. Em alguns casos, drogas contendo moléculas hidrofóbicas, como as hidrocortisonas, podem ser de fácil adsorção na superfície da sílica. Portanto, uma das grandes vantagens que a sílica mesoporosa apresenta é a versatilidade em adsorver compostos específicos, devido a essa possibilidade de adsorção em sua superfície de diferentes grupos ligantes. A modificação da superfície do material pode promover, então, um aumento na afinidade e seletividade dos reagentes com a superfície. Como exemplos, cita-se os metais que possuem diferentes afinidades com grupos funcionais orgânicos ou os fármacos, que podem interagir com a superfície modificada, alterando assim sua adsorção, bem como liberação, no caso de serem aplicados como dispositivos de liberação controlada de fármacos. Essa característica é uma grande motivação desse trabalho; ou seja, a modificação química da superfície dos solventes através da síntese orgânica no estado sólido, que é a reação da fase sólida com reagentes na fase líquida, gerando outros grupos funcionais como hidrocarbonetos, amidas, aminas, isocianatos e etc.
41 40 Para a caracterização da sílica organofuncionalizada costuma-se utilizar a espectroscopias de infravermelho (FTIR) e reflectância difusa (DRIFT). Além de caracterizar a presença das moléculas ancoradas na superfície, é possível fazer determinações quantitativas e o estudo da cinética de reação. Outra técnica que aprimora os resultados é a ressonância magnética nuclear. A espectroscopia Raman, termogravimetria (TG), calorimetria exploratória diferencial (DSC), e Espectroscopia de Fotoelétrons Excitados por Raios X (XPS) são também comumente utilizadas para a caracterização de sílicas modificadas superficialmente Liberação Controlada de Fármaco A tecnologia de liberação controlada se caracteriza como um sistema capaz de prover algum controle terapêutico, seja de natureza temporal, espacial ou ambos. Em geral, sistemas de liberação controlada de drogas podem manter a concentração da droga em sítios específicos do corpo dentro de um intervalo ótimo, ou seja, abaixo do limite tóxico e acima do limite de eficácia terapêutica (ZHOA e CHONG, 2004). Quando o veículo empregado promove apenas uma liberação em tempo prolongado, podemos denominar como liberação sustentada. Tal tecnologia envolve diferentes aspectos multidisciplinares e pode contribuir muito para o avanço da saúde humana. Os sistemas de liberação oferecem inúmeras vantagens quando comparados a outros de dosagem convencionais, tais como: - Maior eficácia terapêutica, com liberação progressiva e controlada do fármaco; - Diminuição significativa da toxicidade, maior tempo de permanência na circulação; - Natureza e composição dos veículos, além de proteção contra mecanismos de instabilidade e decomposição do fármaco (inativação prematura); - Administração segura, sem reações inflamatórias locais; - Diminuição do número de doses devido à liberação progressiva; - Possibilidade de direcionamento a alvos específicos. As duas vias mais tradicionalmente usadas de administração de drogas, administração oral e injetável, são caracterizadas por elevadas concentrações da droga no plasma quando o fármaco é absorvido no organismo e após a sua metabolização ocorre um decréscimo da sua
42 41 presença. Essa variação leva a um comportamento senoidal da droga no plasma em função do tempo. A maior vantagem no desenvolvimento de sistemas que liberam drogas de uma maneira controlada pode ser apreciada pelo exame da FIG. 13, que ilustra duas situações de administração de um medicamento: a situação A, em que um determinado medicamento é liberado de forma controlada e a situação B, em que é liberado de forma convencional. Na situação B, após a ingestão ou injeção de formas de dosagem padrão, o nível sangüíneo da droga aumenta, vai até um máximo e então, decai exponencialmente quando a droga é excretada e/ou metabolizada, requerendo a administração da dose várias vezes ao dia. Já que tais drogas têm uma faixa terapêutica acima da qual é tóxica e abaixo da qual é ineficaz, as oscilações dos níveis da droga podem causar períodos alternantes de ineficiência e toxicidade (LANGER, 1990). Por essa razão, o desenvolvimento de dispositivos de liberação controlada, que podem manter um nível desejado no plasma por um longo período sem alcançar um nível tóxico ou ir além de um nível efetivo mínimo, é de grande interesse (situação A). FIGURA 13 - Perfil de concentração plasmática da droga versus tempo de uma droga administrada oralmente, comparado com um sistema de liberação controlada. (Adapatada de DASH & CUDWORTH II, 1998). A liberação controlada de agentes ativos a partir de uma matriz inerte tem se apresentado como um tema de grande importância para sistemas terapêuticos orais, transdérmicos e implantáveis, devido às suas vantagens de segurança, eficácia e conveniência. Diferentes tipos de materiais tais como polímeros, vidros e cerâmicas, têm sido utilizados como matriz para dispositivos de liberação controlada de drogas. Uma grande variedade de materiais tem sido
43 42 empregada para esse fim, incluindo misturas de polímeros e compósitos poliméricos com diferentes materiais, tais como vidros bioativos ou cerâmicas. Nesse caso, geralmente a droga é inserida por meio de uma mistura mecânica, o que apresenta como grande desvantagem a heterogeneidade das amostras devido às dificuldades de garantir distribuição homogênea da droga através da matriz, afetando assim a taxa de liberação. Portanto, a necessidade de suprir essa desvantagem tem conduzido a melhoras nesse campo através da utilização de materiais quimicamente homogêneos que possuem porosidade bem definida para receber moléculas orgânicas em sua rede FIG. 14. A influência tanto da composição química quanto da porosidade das matrizes no comportamento da liberação tem sido objeto de várias pesquisas. Em geral, a presença de microporos (poros com diâmetro 2 nm) deve ser evitada em matrizes designadas para uma eficiente e controlada liberação de drogas, uma vez que elas podem produzir baixas taxas de difusão, que são indesejáveis, e também impedem a incorporação de moléculas grandes devido à discriminação de tamanho. A família de materiais mesoporosos poderia superar esses problemas, já que tais materiais contêm uma distribuição de mesoporos homogênea e são caracterizados por uma distribuição de tamanho de poros muito estreita. O tamanho e volume de poros desses materiais fazem com que eles sejam potenciais matrizes para incorporar e posteriormente liberar uma grande variedade de moléculas com atividade terapêutica. Alguns exemplos são: liberação de antibióticos como gentamicina, amoxilina, beta bloquadores, como atenolol. FIGURA 14 - Estruturas de canais hexagonais de SBA-15 (a) e esquema representando a uniformidade do processo de incorporação de moléculas de ibuprofeno em uma matriz mesoporosa ordenada (b). Dentre as diversas aplicações terapêuticas dos sistemas a base de silício, alguns estudos foram direcionados para o desenvolvimento de dispositivos implantados e, posteriormente, a utilização de novas vias de administração, tais como a oral, foram surgindo (AHMED, 2002). Desde a descoberta de materiais de sílica mesoporosa ordenada na década de 90, síntese e aplicação de sólidos mesoporosos tem recebido atenção devido à estrutura altamente
44 43 ordenada, ao grande tamanho de poro e volume de poro, e a elevada área superficial. Por causa da estável estrutura mesoporosa e propriedade bem definida da superfície, materiais mesoporosos parecem ideais para encapsulamento de drogas farmacêuticas, proteínas e outras moléculas biológicas. Recentemente, o emprego desses materiais como hospedeiros e ainda como dispositivos de liberação de uma variedade de moléculas de interesse farmacêutico tem sido realizados (HATMANN, 2005). Dentro desse contexto, moléculas de drogas de ambos tamanhos, grandes e pequenas, podem ser abrigadas dentro dos mesoporos por um processo de incorporação e liberadas de forma controlada por um mecanismo de difusão (HUMPHREY, 2005). Em 2001, pesquisadores incorporaram ibuprofeno no MCM-41, com diferentes tamanhos de poros e estudaram a liberação de droga em um fluído simulado corpóreo. Este estudo mostrou que a estrutura mesoporosa singular com formato de poros hexagonais do MCM-41 podia ser usada para abrigar uma grande quantidade de droga e controlar a sua taxa de liberação (VALLET-REGÍ, 2001). A pesquisa de sistemas de liberação controlada usando biocerâmicas como matrizes hospedeiras apresenta dois lados distintos: uma via destinada a incorporação de fármacos em biomateriais projetados para reconstrução e regeneração de tecidos vivos a fim de neutralizar as respostas inflamatórias, infecções, carcinomas ósseos, dentre outras. Enquanto que a outra via segue na promoção de sistemas mais tradicionais de introdução de drogas, como por exemplo, administração oral (VALLET-REGÍ, 2007B). Nos materiais mesoporosos ordenados a base de sílica as moléculas de drogas são facilmente absorvidas por um simples mecanismo de difusão que não afeta a estrutura química da parede dos poros da sílica, o qual também exerce um meio de controle da liberação da droga. A taxa entre o tamanho da droga e o diâmetro do mesoporo é um fator determinante para a difusão da molécula através da matriz tanto relacionado ao confinamento como em relação à liberação. As recentes pesquisas sobre as vantagens dos materiais mesoporosos como veículos de entrega da droga têm incentivado a investigação em novas aplicações, apoiando também as formas farmacêuticas convencionais, e vários materiais em potencial para essa aplicação vem sendo investigados (SALONEN, 2005).
45 44 Vários estudos têm sido realizados com diferentes tipos de fármacos e diferentes matrizes para avaliação da absorção e da liberação controlada de drogas. Em trabalho pioneiro, Fujiwara e colaboradores (FUJIWARA, 2003) obtiveram por fotocontrole o armazenamento e liberação de drogas com sílica mesoporosa. Lin e co-autores (LIN, 2003) realizaram um sistema de liberação controlada de sílica mesoporosa utilizando camadas que definem os canais de abertura utilizando nanopartículas de CdS para bloquear fisicamente a droga e/ou neurotransmissores. J. Salonen e colaboradores (SALONEN, 2005) realizaram estudos com cinco fármacos modelos incorporados em uma matriz estável de sílica mesoporosa avaliando a absorção e o comportamento de liberação por administração oral das drogas. Os compostos foram escolhidos para representar uma ampla gama de solubilidade com diferenças quanto ao caráter ácido/base e lipofilicidade, ao mesmo tempo em que representam as drogas de diferentes classificações biofarmacêuticas (BCS). A gentamicina foi incorporada no sistema de liberação controlada SBA-15 por Vallet-Regí e colaboradores (VALLET-REGÍ, 2004), que avaliaram o desempenho desse sistema, quantificando a liberação, usando um novo método por Cromatografia líquida de alta eficiência (High performance liquid chromatography HPLC). A liberação foi realizada encontrando-se o material em duas formas distintas, na forma de pó e disco, sendo a taxa de liberação similar para ambos. Muitos fatores devem ser considerados ao projetar um sistema de liberação utilizando os materiais mesoporosos. O tamanho dos poros que servirão de abrigo deve estar de acordo como o tamanho da molécula que será adsorvida dentro desses mesoporos. Além disso, a adsorção e liberação das moléculas na matriz mesoporosa são governadas por seletividade de tamanho, como se fosse peneiras moleculares. Outro fator que deve ser levado em consideração na adsorção e liberação dentro dessas matrizes é a relação química entre a molécula do fármaco e a parede do poro. Portanto, a apropriada modificação química dos grupos silanóis da superfície da parede dos poros pode aumentar a adsorção e o confinamento das moléculas do fármaco e isso poderia permitir uma modulação da liberação (VALLET- REGÍ, 2007B).
46 45 A influência do tamanho de poros na adsorção de fármaco e na cinética de liberação é um fator relevante a ser levado em consideração ao se utilizar materiais mesoporosos. Estudos utilizando a mesma estrutura mesoporosa como matriz para abrigo da droga causando uma variação do diâmetro de poros foram realizados empregando-se diferentes estratégias de síntese (VALLET-REGÍ, 2001). Esse sistema foi utilizado para investigação da liberação de ibuprofeno. Além disso, foi avaliado, para efeito de comparação, duas estruturas similares, mas com diferentes diâmetro de poros. Ou seja, foram usados dois materiais com estruturas hexagonais 2D com diferentes tamanhos de poros, MCM-41 (ø = 3nm) e SBA-15 (ø = 9 nm), sendo que, a droga modelo escolhida como modelo foi o alendronato. Através de uma análise do estudo com ibuprofeno percebeu-se que, ao se variar o tamanho dos poros, a ampliação desses poros resulta no aumento da quantidade incorporada de ibuprofeno. Com isso, pode-se concluir que a variação no tamanho de poro em escala nanométrica afeta a incorporação e liberação da droga (VALLET-REGÍ, 2003). Já com o estudo relacionado ao alendronato em que esse foi incorporado dentro das matrizes mesoporosas 2D, MCM-41 e SBA-15, observou-se uma maior incorporação da droga no MCM-41 do que no SBA-15, o que foi intrigante ao se levar somente em consideração o diâmetro de poros, pois o SBA-15 possui um tamanho de poros quase três vezes maior que o MCM-41. Esse comportamento pode ser explicado por dois fatores. Um fator seria o fenômeno de difusão que pode ocorrer durante o processo de incorporação do alendronato em solução aquosa, em que esse seria confinado nos poros, porém não apresentando interações diretas com as paredes desses poros, a droga não seria retida e, portanto, seria liberada rapidamente entrando em equilíbrio com a solução de incorporação durante o processo de incorporação. E outro fator que se deve levar em consideração, é a diferença da área superficial desses dois materiais. O SBA-15 usado no experimento apresenta área superficial de 719 m 2 /g, enquanto que a do MCM-41 é de 1157 m 2 /g. Essa diferença oferece um maior contato superficial da droga com as paredes dos mesoporos no caso do MCM-41, conseqüentemente, uma maior retenção da droga (VALLET-REGÍ, 2008) Cinética de Liberação do Fármaco Métodos de modelagem matemática avaliam a aproximação de pontos experimentais a um modelo descrito pela comparação estatística de parâmetros calculados. Para investigar mais precisamente o efeito da estrutura e do grau de funcionalização das amostras na liberação do
47 46 atenolol, os resultados foram analisados de acordo com o modelo de Higuchi (HIGUCHI, 1963). No caso do fármaco estar disperso na matriz com uma solubilidade limitada, a liberação é governada por um mecanismo de difusão baseado no modelo de liberação de Higuchi. Esse modelo é fundamentado na segunda lei de Fick em que a cinética de liberação pode ser descrita pela equação 1, onde se espera obter um reta para a quantidade liberada em função da raiz quadrada do tempo. M = Kt ½ (1) onde M é a quantidade total de droga liberada, K é a constante de liberação e t é o tempo. Quando a droga está dispersa em uma matriz e sua difusão ocorre através de poros, a formulação da constante é (Equação 2): Κ = ƒ (D, ε, τ, С, А) (2) onde D é a difusividade da droga no solvente, é o fator de tortuosidade do sistema, é a porosidade da matriz, C é a solubilidade da droga no solvente usado e A é a quantidade total da droga presente na matriz. Esse modelo segue os seguintes postulados: (a) a concentração inicial da droga no sistema deve ser maior que a sua solubilidade no meio; (b) a análise matemática é baseada em difusão unidimensional; (c) a dissolução do sistema de liberação é desprezível; (d) o coeficiente de liberação da droga é constante; (e) é válida somente para os primeiros 60% de liberação da droga. Existe outro modelo (RITGER & PEPPAS, 1987) que utiliza uma equação mais generalizada para a cinética de liberação da droga. Neste modelo a equação empírica (Equação 3) é usada para relacionar a liberação fracional do fármaco com o tempo. Mt/M = Kt n (3) onde Mt é a quantidade cumulativa de fármaco liberada no tempo t e M é a quantidade cumulativa de fármaco liberada no infinito, K é a constante de proporcionalidade que
48 47 incorpora características da rede macromolecular e da droga e o expoente n é usado para obter informações sobre o mecanismo de liberação difusional. A inclinação n indica o mecanismo que controla a liberação do fármaco, que pode ser dividido em três tipos: 1) Difusão Fickiana: a) Caso I A difusão é mais lenta que o tempo de acomodação das cadeias, sendo este o tempo necessário para a máxima expansão até atingir o equilíbrio soluçãogel. Neste caso, a difusão é o fator principal na transferência de massa. b) Caso II A difusão é mais rápida que o tempo de relaxação das cadeias poliméricas. Assim, o tempo de acomodação é o fator principal. 2) Difusão Não Fickiana ou Anômala Nenhum dos fatores predomina. Neste caso a difusão e o tempo de relaxação são comparáveis. Para sistemas que obedecem à lei de Fick um valor de n igual a 0,5 é obtido. Um valor de n compreendido entre 0,5 e 1,0 descreve a difusão anômala. O limite superior, ou seja, n =1,0 corresponde ao Caso II, no qual a liberação da droga segue uma cinética de ordem zero. Os parâmetros da equação 3 podem ser obtidos a partir da equação 4 ln Mt/M = ln K + nlnt (4) Semelhante ao modelo de Higuchi, esse modelo só é válido para os primeiros 60% de Fármaco liberado a partir da matriz polimérica. O expoente difusional, n, especifica o mecanismo de liberação e esta equação pode ser usada para analisar liberação de drogas em dispositivos de diferentes geometrias (filmes, cilindros, esferas, discos (tabletes) e microesferas polidispersas). A análise da cinética de liberação de fármacos a partir dos materiais mesoporosos é realizada usando o modelo de Higuchi. Pode-se perceber que a liberação a partir desses materiais é controlada pelo mecanismo de difusão.
49 48 Alguns trabalhos foram publicados usando o modelo matemático de Higuchi para a liberação de fármacos em materiais mesoporosos. Vallet-Regí e colaboradores (VALLET-REGÍ, 2006A) utilizaram o modelo de Higuchi para avaliar a cinética de liberação da eritromicina em um material mesoporos, MCM-41, após passar por um processo de funcionalização com grupos silanos. Foram observados os efeitos do ancoramento de C8 e C18 na superfície da matriz sobre a cinética de liberação do fármaco através da avaliação dos valores da constante K Escolha do Fármaco Modelo O atenolol pode ser quimicamente descrito como benzenoacetamida, 4-[2'-hydroxi-3'-[(1- metiletil) amino] propoxi], com uma massa molar de 266 g/mol. É um composto relativamente polar e sua fórmula molecular é apresentada na FIG. 15. Os experimentos foram realizados em triplicata e os resultados apresentados reproduzem o valor médio dos dados obtidos. CH 3 NH 2 H 3 C N O O H OH FIGURA 15 - Estrutura química da molécula de atenolol. O atenolol é um fármaco utilizado no tratamento de hipertensão, sendo escolhido neste trabalho em virtude da sua conhecida utilização, e também, devido a sua estrutura, solubilidade em água, baixo custo e facilidade de caracterização analítica. Pertence à classe dos betabloqueadores, que são inibidores e interferem com a ação de hormônios estimulantes nos receptores adrenérgico beta-1 do coração. Estes fármacos podem ser usados para tratar hipertensão por causa da sua habilidade em dilatar os vasos sangüíneos permitindo que o fluxo sangüíneo prossiga a uma pressão mais baixa. Os efeitos colaterais, devido a sua administração por via oral, são os mais diversos, tais como diarréia, náusea, depressão, cansaço, colite isquêmica, trombose, entre outros. Assim, no caso de hipertensão, por exemplo, o desenvolvimento de dispositivos de liberação controlada de anti-hipertensivos é vantajoso por minimizar esse tipo de desconforto para o paciente, visto que a concentração da
50 49 droga tende a se manter num nível controlável na corrente sangüínea por um período de tempo maior, buscando, desta forma, ausência de picos nas concentrações. Além da escolha do fármaco ter sido feita de acordo com sua atividade farmacológica, outro fator considerado foi o seu tamanho molecular. Um modelamento molecular foi realizado empregando o programa HYPERCHEM 7.52 (Hypercube, 2003), permitindo a configuração de energia mais baixa, como mostrado na FIG. 16. FIGURA 16 - Representação de uma molécula de atenolol com as distâncias interatômicas correspondentes. As representações gráficas foram efetuadas utilizando o programa MERCURY (BRUNO, 2002). O tamanho da molécula de atenolol foi estimado em aproximadamente 1,6 nm, o que indica que estas moléculas podem facilmente ter acesso aos mesoporos do material. Além disso, os grupos funcionais amina, amida e hidroxila presentes na molécula de atenolol podem interagir com os grupos silanóis que ainda podem estar presentes na superfície da sílica mesoporosa. Além disso, podem ocorrer interações orgânicas com os grupos alcoxisilanos utilizados na funcionalização.
51 50 5. METODOLOGIA Apesar da potencialidade de aplicações devido às características nanoestruturais de elevada organização dos sistemas mesoporosos, interessante para aplicação como dispositivos para liberação controlada de drogas, pouco se tem estudado sobre o SBA-16 funcionalizado. Dentro deste contexto, o que se propõe neste trabalho é conferir especificidade química ao sólido mesoporoso, SBA-16, por meio da introdução de moléculas orgânicas visto que este material pode ser preparado e modificado com uma grande variedade de combinações dos componentes individuais, conferindo diferentes contribuições nas propriedades do material resultante, explorando assim, as potencialidades de aplicação desse sistema em bionanotecnologia. A metodologia desenvolvida durante o estudo para se atingir os objetivos deste trabalho pode ser subdividida, sumariamente, nas etapas descritas a seguir Síntese do SBA-16 A preparação iniciou-se com a dissolução de 3,0 g do surfactante não iônico F127 (poli [(etileno oxido)-bloco-poli(propileno oxido)bloco-poli(etileno oxido)] (ALDRICH)) em uma mistura de 144 ml de água destilada e ácido (13,98 ml de HCl 38%), colocados em um pote de teflon, e mantida sob agitação e temperatura ambiente. Ao se passar 30 minutos, adicionaram-se 11,11mL de butanol. Após 1 hora, a esta solução foi adicionado 15,3 ml de tetraetilortossilicato (TEOS, Sigma-Adrich), mantendo-se as mesmas condições iniciais. Logo após a adição do TEOS, o recipiente de teflon foi fechado e mantido a temperatura constante de 45 ± 2 ºC, por 24 horas. A mistura final foi aquecida por mais 24 horas em uma estufa (FANEM, controlador modelo A-HI) a temperatura de envelhecimento de 100 ± 1 C. Após o tratamento térmico, a mistura foi filtrada a quente e o material sólido obtido foi seco a 37ºC, por aproximadamente 24 horas Remoção do surfactante O material obtido até esta etapa ainda apresenta em sua estrutura o agente direcionador de rede, que é o surfactante F127. Para o SBA-16 sintetizado, a remoção do surfactante foi feita utilizando-se o método de calcinação. Na calcinação utilizou-se um forno tubular horizontal no qual o material sintetizado foi aquecido sob atmosfera de nitrogênio (99,999 % Air Liquid) a uma taxa de 5 ºC por minuto até a temperatura de 550 ºC. Esta temperatura foi mantida
52 51 durante 2 horas e 45 minutos, sendo que o fluxo de nitrogênio foi mantido somente nas primeiras 1h e 45 minutos. O resfriamento se deu até a temperatura ambiente, também à taxa de 5 ºC por minuto. Assim, após a calcinação, obteve-se a sílica mesoporosa estruturalmente ordenada SBA-16: um pó branco muito fino. O esquema da síntese do SBA-16 se encontra no diagrama da FIG.17. H 2 O C 500 C F127 Butanol TEOS Tratamento Térmico Calcinação SBA-16 Solução HCl FIGURA 17 - Diagrama da síntese de SBA Modificação Superficial Dentre os métodos existentes para modificar a superfície o método pós-síntese foi o escolhido para um estudo inicial. Esse método foi escolhido por não promover modificações significativas na partícula de SBA-16. As etapas da funcionalização do SBA-16 estão apresentadas na FIG. 18. O SBA-16 foi modificado superficialmente através do ancoramento de cadeias de hidrocarbonetos na superfície. O processo consistiu da reação entre o SBA-16 calcinado e 3 diferentes alcoxisilanos: propiltrietoxisilano PTES, etiltrietoxisilano ETES e 3- aminopropiltrietoxisilano APTES, conforme mostrado na TAB. 2. A FIG. 19 mostra a estrutura das moléculas dos funcionalizantes usados na modificação superficial do material. Foram suspensas 5 g da sílica previamente seca em um balão de fundo redondo de três bocas em agitação mecânica em 30 ml do solvente. Em seguida foi adicionado a esta suspensão 4meq do agente funcionalizante. Esta mistura foi mantida sob refluxo em atmosfera de argônio durante 24 h em temperatura controlada, de acordo com o solvente, para as amostras funcionalizadas com metanol e tolueno foram mantidas as temperaturas de 65 e 80 C, respectivamente. O sólido resultante foi filtrado em funil de placa porosa, lavado com o respectivo solvente e acetona. O filtrado foi seco em vácuo a 60 ºC por 24 h.
53 52 Metanol 24h 100 C SBA /80 C Argônio Refluxo Filtração Secagem SBA-16 Funcionalizado Funcionalizante Lavagem 60 C/24h Tolueno FIGURA 18 - Diagrama de Funcionalização do SBA-16. TABELA 2 - Fórmulas moleculares e estruturais e peso molecular dos grupos silanos. Alcoxisilano Fórmula Molecular Fórmula estrutural Peso molecular (g/mol) Etiltrietoxisilano C 8 H 20 O 3 Si CH 3 CH 2 -Si-(OC 2 H 5 ) 3 192,3 Propiltrietoxisilano C 9 H 22 O 3 Si CH 3 CH 2 CH 2 -Si-(OC 2 H 5 ) 3 206,3 Aminopropiltrietoxisilano C 9 H 23 NO 3 Si H 2 NCH 2 CH 2 CH 2 -Si-(OC 2 H 5 ) 3 221,3 (a) (b) (c) FIGURA 19 - Estruturas dos Funcionalizantes (a) Etiltrietoxisilano (ETES), (b) Propiltrietoxisilano (PTES), (c) 3-Aminopropiltrietoxisilano (APTES). Os parâmetros de solubilidade, assim como, a polaridade da superfície a ser modificada e do agente funcionalizante foram fatores considerados ao se realizar a modificação do SBA-16. Isso porque, como se sabe, o tipo de solvente usado durante a funcionalização pode influenciar as interações, gerando modificações superficiais diferentes. Para avaliar a influência do solvente nesse processo, foram utilizados dois diferentes solventes escolhidos em função dos seus parâmetros de solubilidade: metanol (M) e tolueno (T). As amostras funcionalizadas foram nomeadas como PTES, ETES, APTES de acordo com o alcoxisilano utilizado, acrescido ao nome a inicial (M ou T) do solvente empregado em cada processo. Por exemplo, M-PTES e T-PTES, M- ETES, T- ETES, M-APTES, T-APTES.
54 Caracterização das Amostras Tanto a matriz como os produtos funcionalizados finais obtidos foram caracterizados. Os parâmetros texturais das amostras foram avaliados por adsorção de gases (BET) - NOVA 2200 Quantacrome. Imagens de microscopia eletrônica de varredura (MEV) foram utilizadas para caracterizar a morfologia do material. Técnicas de microscopia eletrônica de transmissão (MET) e espalhamento de raios X a baixos ângulos (SAXS) foram empregadas para elucidar o arranjo dos poros tanto do material puro quanto funcionalizado. A estabilidade térmica, temperatura de degradação e quantidade de funcionalizante na rede de sílica foram investigados por análise termogravimétrica (TG). Para a caracterização qualitativa dos grupos funcionais como da cadeia de hidrocarboneto adicionados à sílica foram avaliados por espectroscopia no infravermelho (FTIR) - ABB Bomem modelo MB102 e ressonância magnética nuclear (RMN). Já a técnica de análise elementar (CHN) possibilitou uma análise quantitativa dos grupos adicionados à sílica. A seguir serão apresentados detalhes experimentais de cada técnica empregada nesse trabalho e do ensaio de liberação Análise Elementar CHN O conteúdo de moléculas do funcionalizante imobilizadas na superfície da sílica SBA-16 foi avaliado através da leitura das amostras de sílica pura e funcionalizada às análises de carbono, hidrogênio e nitrogênio. As determinações foram realizadas em um equipamento da CHNSO da Perkin-Elmer, modelo Espectroscopia na Região de Infravermelho Espectroscopia na Região de Infravermelho por Transformada de Fourrier (FTIR) foi empregada para caracterizar os grupos funcionais típicos da rede de sílica e para caracterizar os grupos funcionais adicionados a matriz. Os espectros de IV abrangendo a região de cm -1 foram obtidos por meio de um espectrofotômetro FTIR ABB Bomen modelo MB102. Os espectros foram obtidos à temperatura ambiente, em pastilhas sólidas do pó com KBr, e foram adquiridos com resolução de 4 cm -1 e 64 scans/min.
55 Análise Térmica As medidas de termogravimetria (TG) foram realizadas no equipamento TGA 50WS da Shimadzu. Amostras em torno de 3 mg foram analisadas nas seguintes condições: razão de aquecimento 10 ºC.min -1, faixa de temperatura de 15 a 600 ºC e sob atmosfera de N 2 com fluxo de 20 ml.min -1 e célula de platina aberta. As curvas termogravimétricas obtidas relacionam perda de massa a um gradiente de temperatura. Através dessas análises foi possível avaliar a estabilidade térmica dos materiais estudados e estimar o teor de funcionalizante presente nas amostras Adsorção de Gases As características dos poros das amostras foram analisadas usando um equipamento Quantachrome NOVA 2200, o qual é composto por um sistema de adsorção física automatizado que fornece dados de equilíbrio de adsorção e dessorção. As amostras mesoporosas puras e funcionalizadas foram desgaseificadas por 2 horas a 120 ºC, antes de cada ensaio. Os dados de volume adsorvido e dessorvido em várias pressões relativas foram utilizados para gerar informações sobre a área superficial por BET, volume de poros, distribuição e tamanho médio de poros, e área superficial de micro e mesoporos. Medidas da área superficial específica foram baseadas nas teorias de Brunauer-Emmett-Teller (BET) (BRUNAUER et al., 1940) usando os dados de adsorção na faixa de pressão de 0,045 a 0,25. Análises do tamanho de poros e volume total de poros foram obtidas pelo método de Barret, Joyner e Halenda (BJH) (BARRET et al., 1951). O volume total de poros foi estimado pela quantidade de nitrogênio adsorvida a uma pressão relativa P/P 0 de aproximadamente 0,99 (SING, et.al., 1985). Os parâmetros: superficial total (S t ), área superficial externa (S ext ), área superficial de mesoporos primários (S meso ), volume de microporos (V mi ) e volume de mesoporos (V meso ) foram calculados usando o método comparativo α s -plot. A área superficial total é definida como a área superficial de mesoporos e macroporos. A área superficial externa é definida como a área superficial de macroporos e mesoporos secundários (KRUK, et.al., 1997). A área superficial total e volume de microporos foram estimados no intervalo padrão de adsorção reduzida, α s, de 0,7 a 1 (região de pressão relativa de 0,15 a 0,40). A área superficial externa e o volume de mesoporos primários foram calculados no intervalo de α s de 1,5 a 2,0 (região de pressão relativa de 0,8 a 0,98). O volume de mesoporos secundários foi estimado como a diferença entre o volume total de poros, volume de mesoporos primários e o
56 55 volume de microporos. A análise α s -plot foi realizada utilizando uma sílica não porosa hidroxilada com área superficial de 2,8 m 2.g -1 como referência (GREGG & SING, 1982). O softtware NovaWin da Quantachrome Instruments, foi utilizado para realização do cálculo de distribuição de tamanho de poros. Os diâmetros de mesoporos foram estimados nas posições do pico das curvas de distribuição de tamanho de mesoporos Microscopia Eletrônica de Varredura As imagens do material mesoporoso puro e dos materiais funcionalizados, para o estudo da morfologia, foram obtidas por microscopia eletrônica de varredura. Utilizou-se o microscópio eletrônico de varredura com canhão de emissão por efeito de campo modelo Quanta 200- FEG-FEI-2006 do Centro de Microscopia da UFMG para a realização dessas imagens. As amostras na forma de pó foram suspensas em uma solução de etanol e gotas dessa suspensão foram adicionadas em uma fita condutora de carbono dupla-face. A amostra foi exposta a uma nuvem de ouro sublimado por 10s Microscopia Eletrônica de Transmissão As imagens do material mesoporoso puro e funcionalizado, para o estudo da estrutura dos poros, foram obtidas por microscopia eletrônica de transmissão. Utilizou-se o equipamento do Centro de Microscopia da UFMG para a realização dessas imagens. A amostra SBA-16 foi dispersa em água e sonificada por 5 minutos em banho de ultra-som. Após decantação por 10 minutos, uma gota da solução foi depositada sobre uma grade-suporte de cobre de 300 mesh de malha, revestida com carbono. As imagens foram obtidas em um microscópio eletrônico de transmissão Tecnai G2 Spirit FEI-2006 (operando a 120kV). A captura das imagens foi realizada com câmera CCD, com o software item da AnalySis Espalhamento de Raios X a Baixos Ângulos (SAXS) Os experimentos de Espalhamento de Raios X a Baixos Ângulos foram realizados no Laboratório Nacional de Luz Síncroton, LNLS, na linha de luz D11A-SAXS, utilizando um monocromador de duplo cristal de Si 111, que focaliza horizontalmente o feixe de raios X. O comprimento de onda dos raios X incidente foi fixado em 1,488Å e o ângulo de espalhamento 2 variou de 0 a 5º. A distância detector-amostra foi de 373,6mm. A energia dessa linha de luz é de 6 a 12KeV (1 a 2Å).
57 56 Um tubo de vácuo posicionado entre o monocromador e o diretor foi utilizado pra reduzir a absorção de espalhamento de raios X do ar. As amostras ETES (M e T), PTES (T) foram obtidos nessa linha. Para a verificação da estrutura das amostras PTES (M), APTES (M e T) foram realizadas análises de SAXS obtidos através do instrumento Rigaku, modelo ultima IV, utilizando a fonte de radiação CuKα Espectroscopia de Ressonância Magnética Nuclear (RMN) de 29 Si e 13 C Os espectros de ressonância magnética nuclear dos núcleos de 13 C e 29 Si das amostras de sílica pura e funcionalizada foram obtidas através de um espectrômetro AC 300/P Burker (Instituto de Química UNICAMP) à temperatura ambiente utilizando a técnica de polarização cruzada (CP) com rotação de ângulo mágico (MAS). Aproximadamente 100 mg de cada amostra foi compactado em um rotor de óxido de zircônio de 4 mm. As medidas foram realizadas nas freqüências de 75,46 e 59,54 MHz para carbono e silício, respectivamente, com velocidade de rotação de 10 khz e pulsos de repetição de 60s e 3 s para silício e carbono, respectivamente. Tempos de contato de 4 ms Obtenção dos Dispositivos para Liberação Controlada de Drogas A incorporação do atenolol nas amostras foi realizada com quantidades distintas das amostras puras e das funcionalizadas. Foram pesados dois grupos distintos de amostras: 0,5g das amostras SBA-16 pura, M-PTES, T-PTES, M-ETES e T-ETES, e 0,2 g das amostras SBA-16 pura, M-PTES e T-PTES. Estas amostras foram imersas em solução de atenolol com concentração de 1 mg.ml -1, durante 2 dias, sob agitação. Um terceiro grupo amostras foi preparado na quantidade de 0,2 g, SBA-16, M-PTES e T-PTES, e imersos em uma solução de atenolol, com concentração de 10 mg.ml -1, durante 2 dias, sob agitação. Para o ensaio de liberação foram utilizadas algumas amostras em forma de pastilhas e algumas em pó. Para conformação das pastilhas foram pesados aproximadamente 0,1 g das amostras em pó. O pó foi comprimido a uma pressão de 300 MPa em uma prensa hidráulica marca CIOLA. A prensagem foi realizada com a adição de uma gota do aglomerante álcool polivinílico (PVA) com aproximadamente 15 segundos de compactação. As pastilhas foram obtidas com diâmetro aproximado de 6 mm e com 2 mm de espessura, com uma massa aproximada de 50mg.
58 57 As condições empregadas no procedimento de incorporação são resumidas nas TAB. 3 e 4. Tabela 3 - Condições experimentais do procedimento de incorporação de atenolol nas amostras SBA-16, T-PTES, M-PTES, T-ETES e M-ETES. Fármaco Atenolol Concentração da solução de incorporação (mg.ml -1 ) 1 mg.ml -1 Materiais (pó) SBA-16; PTES (M e T), ETES (M e T) Tempo de incorporação (horas) 48 Temperatura ( C) 25 Agitação (rpm) 200 Proporção Droga/Sílica (D/S) 0,3 Massa de sílica (mg) 500 Volume da solução de incorporação (ml) 150 Solubilidade do atenolol (mg.ml -1 ) 37 C 26,5 Forma final Pastilhas Tabela 4 - Condições experimentais do procedimento de incorporação de atenolol nas amostras SBA-16, T-PTES e M-PTES. Materiais (pó) SBA-16; PTES (M e T) Fármaco Atenolol Atenolol Concentração da solução de incorporação (mg.ml -1 ) 1 mg.ml mg.ml -1 Proporção Droga/Sílica (D/S) 0,3 3 Massa de sílica (mg) Volume da solução de incorporação (ml) Tempo de incorporação (horas) 48 Temperatura ( C) 25 Agitação (rpm) 200 Solubilidade do atenolol (mg.ml -1 ) 37 C 26,5 Forma final pó Após o período de incorporação o material sólido em pó foi filtrado em placa porosa e, em seguida, lavado rapidamente para retirar excessos do fármaco na superfície do material. O
59 58 material puro e funcionalizado sofreu a etapa de compressão, resultando em uma pastilha, submetido ao procedimento descrito anteriormente, no caso das amostras apresentadas na TAB.3. Além das amostras na forma de pastilha, foram selecionadas, a amostra pura e duas amostras funcionalizadas com Propiltrietoxisilano, usando como solvente o metanol e o tolueno, para realização dos ensaios de liberação na forma de pó, TAB.4. O processo de lavagem é uma importante etapa, pois ela assegura a eliminação de uma fração de fármaco não absorvida que fica aderida na superfície das amostras. A presença do fármaco na superfície da sílica ocasiona o fenômeno conhecido como burst release (liberação abrupta) que fornece um valor superestimado nos primeiros instantes dos ensaios de liberação (SOUSA, 2009). O tempo de incorporação do fármaco na matriz foi determinado segundo a metodologia obtida a partir de estudos realizados anteriormente (SOUSA, 2009). A medida da concentração da solução preparada para incorporação foi feita em um espectrofotômetro Shimadzu UV-VIS V Para quantificar a concentração do medicamento incorporado e posteriormente liberado, foi feita uma curva de calibração para o atenolol com comprimento de onda fixo (274 nm). A curva de calibração apresentada na FIG. 20 possibilitou que a quantificação da concentração do fármaco fosse realizada durante as medidas. Após os dois dias de incorporação, as matrizes foram lavadas com água destilada, para retirar o excesso de fármaco na superfície e secas à temperatura ambiente. 2,5 2,0 y = (0,0023± 0,0031)x + (0,01042±0,000007) R 2 = 0,999 Absorbância 1,5 1,0 0,5 0, Concentração ( µg.ml -1 ) FIGURA 20 - Curva de Calibração de Atenolol a 25 ºC.
60 Ensaio da Liberação do Atenolol nos Diferentes Sistemas Estudo da Liberação Controlada do Fármaco O estudo da liberação do atenolol pelo SBA-16 puro e funcionalizado foi realizado in vitro. Após o período de incorporação do princípio ativo, as pastilhas e os pós foram secos à temperatura ambiente e os dispositivos de liberação obtidos foram imersos em frascos esterilizados de polietileno, FIG. 21 contendo volumes pré-determinados (30 ml) de um fluido corpóreo simulado (SBF, ph 7,3) (KOKUBO, 1990). O perfil da liberação foi obtido medindo-se a concentração do atenolol nas soluções acima, utilizando-se um espectrofotômetro modelo Shimadzu V 2401 na região de UV-Vis. A absorbância a 274 nm foi medida em intervalos de tempo de aproximadamente 15 minutos nas primeiras 3 horas e em intervalos maiores nas demais. Solução contendo SBF FIGURA 21 - Representação esquemática da liberação de atenolol em uma matriz mesoporosa de sílica Ensaio de Citotoxicidade A atividade citotóxica das amostras SBA-16, T-PTES, M-PTES e T-APTES foram avaliadas através do ensaio com o MTT. O MTT [3-(4,5-dimetyl-2-thiazolyl-2,5-diphenyl-2Htetrazolium bromide)] é um sal de coloração amarela capaz de captar elétrons da cadeia transportadores de elétrons, em uma reação de oxi-redução. O MTT ao ser reduzido por enzimas desidrogenases de células metabolicamente viáveis forma cristais de coloração roxa, o Formazan FIG. 22. Esses cristais são insolúveis em água e apresentam pico de absorção em 570 nm (ISO , 2009).
61 60 As linhagens de células de glioblastoma multiforme murino (RT2), status p53 selvagem, e de glioblastoma multiforme humano (T98), status p53 mutante, foram, geralmente cedidas pelo Departamento de neurocirurgia da MCV-VCU (MedicalCollege of Virginia, Virginia Commonwealth University). As linhagens de células de adenocarcinoma mamário humano (MCF-7), status p53 selvagem, e carcinoma mamário ascítico de Ehrlich (CAE), status p53 selvagem, foram, respectivamente, cedidas pela Fundação Oswaldo Cruz (FIOCRUZ) e pelo Departamento de Patologia Comparada do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais (UFMG). Todas as células foram cultivadas em estufa de CO 2 (5% CO 2 - Cole Parmer) com atmosfera úmida à 37ºC, em meio Dulbecco s modified Eagle s (DMEM) suplementado com 10% de soro fetal bovino (SFB) e 1% de penicilina/estreptomicina (meio DMEM completo). Ao atingirem 80% de confluência, as células foram tripsinizadas e a viabilidade celular foi avaliada através da exclusão do azul de Tripan. O azul de Tripan é um corante de alto peso molecular que só é capaz de entrar em células mortas ou que possuem a permeabilidade de membrana aumentada. A avaliação da viabilidade celular através da exclusão do azul de Tripan consiste em incubar as células por 1 minuto com este corante e quantificá-las com o auxílio de uma câmara de Neubauer. Células vivas em perfeito estado (membrana impermeável) permanecem incolores e células mortas ou com a permeabilidade de membrana aumentada são visualizadas em azul. As células viáveis (incolores) foram utilizadas nos experimentos (Faixa de passagem: 5-20). As células tumorais RT2, T98, MCF-7 (500 células/poço), Ehrlich (1500 células/poço), foram semeadas em placas de cultura de 96 poços e incubadas por 24 horas para aderência. Decorrido esse tempo, diferentes concentrações das amostras SBA-16, T-PTES, M-PTES e T- APTES (0,1 a 200 µg.ml -1 ), foram adicionadas as células aderidas. Em seguida, as células foram novamente incubadas por mais 48 horas. Após este tempo, as células foram incubadas com o MTT (0,5 mg/ml) durante 4 horas, ao abrigo da luz. Posteriormente, o sobrenadante contendo MTT foi retirado e 100 µl de DMSO foram colocados em cada poço para solubilizar os cristais de Formazan. As amostras foram medidas por espectrofotometria em um leitor de microplaca UV-visível (Molecular Devices) a 570 nm. A fração de sobrevivência foi calculada como porcentagem do controle (Absorbância no controle =100% de sobrevivência).
62 61 Os experimentos foram feitos em quadruplicatas. O valor do IC50 (concentração do composto que produziu 50% de morte celular) dos compostos Culac, Lac, Lacm, Lacpt, foram determinados graficamente usando o programa Graphpad Prism. Os aspectos morforlógicos das células MCF-7, Ehrlich, RT2 e T98 foram analisados pela observação ao microscópio óptico (M.O.) das células controle e das tratadas com as amostras SBA-16, T-PTES, M-PTES e M-APTES. Foram realizados, em paralelo, testes usando dimetilsulfóxido (DMSO) como controle negativo, pois SBA-16, T-PTES, M-PTES e T-APTES foram pré-dissolvidas em DMSO a 0,5%. Esse ensaio foi realizado no laboratório de radiobiologia do Centro de Desenvolvimento da tecnologia nuclear (CDTN/CNEN). C N N N N N C NADH NAD + C N N N N N C S C S C MTT FORMAZAM FIGURA 22 - Desenho esquemático do MTT sendo reduzido pelas enzimas desidrogenases de células metabolicamente viáveis e dando origem ao Formazan.
63 62 6. RESULTADOS E DISCUSSÕES 6.1. Análise Elementar Uma das técnicas utilizadas para evidenciar a presença de moléculas orgânicas ancoradas na superfície da sílica mesoporosa foi a análise elementar. Esta técnica indica a presença dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) na amostra de sílica pura e nas funcionalizadas, sendo que um aumento do percentual desses grupos pode ser um indício da presença de grupos orgânicos pendentes na estrutura inorgânica. Com isso, é possível estabelecer as quantidades de cada um destes elementos presentes nas matrizes. As porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) dos agentes sililantes usados no processo de funcionalização são mostrados na TAB.5. TABELA 5: Porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) nos agentes sililantes. Ligante % C % H % N C/N exp C/N teórico (mmol.g -1 ) (mmol.g -1 ) PTES 52,6 11,2 0,6 - - ETES 50,5 11,0 0,4 - - APTES 48,5 10,8 7,0 8,1 9,0 As porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) nas amostras puras e funcionalizadas são mostrados na TAB. 6. TABELA 6 - Porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) contidos nas amostras pura e funcionalizadas. Amostras C H N % mmol.g -1 C* mmol.g -1 % % mmol.g -1 SBA-16 0,25±0,05 0,21 0,78±0,05 0,03±0,01 - M-ETES 2,53±0,02 2,11 1,9 1,09±0,09 0,34±0,01 - T-ETES 6,37±0,74 5,31 5,1 1,43±0,11 0,07±0,02 - M-PTES 2,11±0,01 1,76 1,6 1,91±0,03 0,51±0,09 - T-PTES 7,88±1,09 6,57 6,3 1,32±0,28 0,07±0,02 - M-APTES 5,56±0,06 4,64 4,4 2,32±0,08 2,99±0,17 2,1 T-APTES 9,75±0,06 8,13 7,9 2,82±0,01 4,94±0,07 3,5 * C = amostra funcionalizada amostra pura (mmol.g -1 ) Os dados obtidos indicam que o grau de funcionalização de cada amostra é influenciado tanto pelo solvente quanto pelo tipo de agente funcionalizante. É possível perceber que os grupos
64 63 funcionalizados com o solvente tolueno apresentaram um valor mais significativo, tanto na porcentagem de carbono como na de hidrogênio, quando comparados com os materiais funcionalizados com o solvente metanol. Dentre todas as amostras, aquela que apresentou maior quantidade desses elementos foi o 3-aminopropiltrietoxisilano (APTES) com %C de 9,75±0,06 quando se utilizou tolueno como solvente, e 5,56±0,06 quando o solvente usado foi o metanol. Esse comportamento relacionado ao solvente pode ser explicado levando em consideração os parâmetros de solubilidade, principalmente, dos componentes δd para interação de dispersão e δa para interação do tipo ligação de hidrogênio. Nesse caso, o tolueno apresenta um valor maior do que o metanol para o δd, tendo uma maior capacidade de dispersão na superfície. Por outro lado, o metanol possui maior valor δa relacionado a interações do tipo ligação de hidrogênio do que o tolueno; essa situação pode levar uma interação do solvente com a superfície da sílica, reduzindo a interação dos funcionalizantes com essa. Pode também ocorrer uma maior interação dos funcionalizantes com o solvente, sendo que esse último se comportaria como um fator de impedimento da interação do funcionalizante com a superfície da sílica. Os teores de nitrogênio obtidos para as amostras M-APTES e T-APTES foram utilizados para o cálculo das quantidades de moléculas orgânicas incorporadas nos materiais, relacionando a massa de nitrogênio em 1,0 g de material e dividindo-se este valor pela massa atômica deste elemento. Como cada molécula de sililante possui apenas um átomo de nitrogênio, este valor corresponde à quantidade de cadeias imobilizadas por massa de sólido, sendo aqui expresso como densidade de grupos funcionais imobilizados, ou grau de funcionalização (g). (MELO Jr. 2008). A utilização dessas amostras funcionalizadas com grupo amino fornece uma confiança maior quanto ao fornecimento do grau de funcionalização, já que o nitrogênio está presente só no funcionalizante. Conforme a TAB. 6, observa-se valores da ordem de 2,1 mmol.g -1 de nitrogênio para o M- APTES e 3,5 mmol.g -1 de nitrogênio para o T-APTES, evidenciando o efetivo ancoramento deste grupo orgânico na superfície da sílica. Com isso, percebe-se que a amostra funcionalizada com tolueno apresenta uma incorporação maior da molécula orgânica. Quando o processo de funcionalização acontece em meio apolar
65 64 ocorre uma incorporação maior dos grupos alcoxisilanos, possivelmente, devido ao comportamento do solvente apolar não atuar como competidor dos grupos silanóis presentes na sílica, já que, o tolueno não apresenta grupos OH na sua estrutura. Além disso, o parâmetro de solubilidade δo relacionado à interação do tipo dipolo é 0 para o tolueno e 5 para o metanol. Isto indica que as interações polares entre o solvente e a superfície são maiores para o metanol, podendo ocorrer uma menor interação dos grupos alcoxisilanos com a superfície, já que essa possui grupos OH que podem interagir com o metanol. No caso do metanol, o valor de δa, relacionado à interação do tipo ligação de hidrogênio, é bem maior do que do tolueno; esse fator pode contribuir para uma menor interação dos funcionalizantes com a superfície, ocorrendo uma interação maior do solvente com essa. A relação teórica C/N foi feita levando em consideração a fórmula molecular do 3- aminopropiltrietoxisilano e as possibilidades desse funcionalizante se ligar a superfície da sílica. A relação teórica da quantidade de carbono presente na molécula em relação à quantidade de nitrogênio (C/N) é de 9, e a relação experimental é de 8,1, como pode ser visto na TAB. 5. Porém, a quantidade encontrada das amostras funcionalizadas na análise elementar promove uma relação C/N de 2,1 para o M-APTES e uma relação C/N de 2,3 para T-PTES. Ou seja, a relação C/N nas amostras funcionalizadas é somente dos 3 carbonos da molécula do funcionalizante que estão ligados diretamente ao silício, sendo o sítio da molécula que não sofreu condensação e que permaneceram livres na superfície. Esse resultado indica que ocorreu a condensação dos grupos trietoxisilanos, ou seja, a molécula do 3- aminopropiltrietoxisilano que poderia se ligar de três formas diferentes à superfície da sílica, como pode ser visto na FIG. 23, liga-se preferencialmente de maneira tridentada, FIG. 24, deixando livre somente 3 carbonos. Desta forma, a superfície da sílica contém, na forma livre, somente o grupo propilamino, e assim, a relação teórica de C/N é de 3.
66 65 FIGURA 23 - Tipos das principais vizinhas químicas dos átomos de silício de alcoxissilanos imobilizados. Adaptado de COSTA, FIGURA 24 - Representação da forma de ancoramento tridentada do 3-aminopropiltrietoxisilano na superfície da sílica Resultados Obtidos para a Amostra Pura e as Funcionalizadas Incorporadas com Atenolol nas diferentes Concentrações. Uma das evidências de que ocorreu a incorporação do atenolol nas amostras foi obtida pela técnica de análise elementar. Esta técnica apontou o aumento na variação das porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) nas amostras que passaram pelo processo de incorporação do fármaco. Na TAB. 7 encontram-se os valores desses elementos contidos nas amostras após incorporação.
67 66 TABELA 7 - Porcentagens dos elementos carbono (C), hidrogênio (H) e nitrogênio (N) contidos nas amostras pura e funcionalizadas. C Cincor H N Amostras % mmol.g -1 mmol.g -1 % % mmol.g -1 SBA-16 1mg.mL -1 5,17±0,04 4,30 4,09 3,08±0,11 2,26±0,27 1,62 M-PTES 1mg.mL -1 5,21±0,51 3,43 1,67 1,83±0,07 2,08±0,19 1,49 T-PTES 1mg.mL -1 6,47±0,11 5,39 0 2,76±0,10 1,41±0,65 1,01 SBA-16 10mg.mL -1 7,77±0.01 6,47 6,26 3,85±0,15 2,70±0,17 1,93 M-PTES 8,81±0,01 7,34 5,58 0,73±0,02 4,06±0,01 2,9 10mg.mL -1 T-PTES 10mg.mL -1 9,10±0,02 7,58 1,22 1,50±0,07 2,04±0,16 1,46 Cincor = amostra antes de incorporar-amostra após incorporar Como as amostras de SBA-16 puras e funcionalizadas não apresentavam nitrogênio na sua estrutura pode-se quantificar a presença de atenolol segundo a quantidade de nitrogênio nessas amostras. Além disso, a variação da quantidade de carbono ao se comparar as amostras antes de incorporar com as amostras após incorporar, demonstra um aumento desse elemento nas amostras, com exceção da amostra T-PTES 1 mg/ml. Mas essa amostra apresenta um aumento na quantidade de nitrogênio, indicando que ocorreu incorporação de atenolol, já que, essa amostra antes de incorporar não apresentava nitrogênio na sua estrutura. Percebe-se, também, que as amostras que foram submetidas à solução de atenolol de maior concentração (10 mg/ml) apresentaram uma variação maior dos elementos. Porém, essa variação não segue a relação de diferença de concentração das soluções. Ou seja, a solução mais concentrada tem uma relação de 10x maior do que a solução menos concentrada (1mg/ml). Levando em consideração a variação de nitrogênio acrescido nas amostras o que se percebe é uma relação em torno de um. Uma análise estatística de variância usando-se a comparação de médias pelo modelo de Tukey (VIEIRA, 2006) ao nível de 5% de probabilidade foi realizada com os resultados obtidos pela técnica de CHN.
68 67 Ao se comparar a porcentagem do elemento carbono presente nas amostras incorporadas em solução de 1mg/mL -1 percebe-se que há diferenças significativas ao se comparar as médias entre SBA-16 e o T-PTES e entre o M-PTES e o T-PTES. Já o M-PTES e o SBA-16 não diferem significativamente entre si. Ao se comparar a porcentagem do elemento carbono nas amostras incorporadas em solução de 10mg/mL percebe-se que há diferenças significativas entre as três amostras já que o valor de P<0, Espectroscopia na Região do Infravermelho Com a espectroscopia na região do infravermelho por transformada de Fourier (FTIR) foi possível caracterizar os componentes químicos tanto da amostra pura quanto das amostras funcionalizadas Resultados obtidos para as amostras puras e funcionalizadas Nas FIG. 25, 26, 27, 28, 29 e 30 são apresentados os espectros de infravermelhos das amostras puras e funcionalizadas com os diferentes solventes. Em todas as amostras estudadas, o espectro do infravermelho mostra bandas de absorção referentes às vibrações fundamentais da rede de sílica que estão resumidas na TAB. 8. T-APTES Intensidade (u.a.) T-PTES T-ETES SBA Número de onda (cm -1 ) FIGURA 25 - Espectro de FTIR do SBA-16 puro e funcionalizado com tolueno.
69 68 T-APTES Intensidade (u.a.) T-PTES T-ETES δ Si-OH SBA Número de onda (cm -1 ) FIGURA 26 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com tolueno (região ). Intensidade (u.a.) T-APTES T-PTES T-ETES υ C-H(CH 2, CH 3 ) SBA Número de onda (cm -1 ) FIGURA 27 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com tolueno (região ).
70 69 M-APTES Intensidade (u.a) M-PTES M-ETES SBA Número de onda (cm -1 ) FIGURA 28 - Espectro de FTIR do SBA-16 puro e funcionalizado com metanol. 100 M-APTES Intensidade (u.a) M-PTES δ SiOH M-ETES SBA Número de onda (cm -1 ) FIGURA 29 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com metanol (região ).
71 70 M-APTES Intensidade (u.a) M-PTES M-ETES υ C-H(CH 2, CH 3 ) SBA Número de onda (cm -1 ) FIGURA 30 - Espectro expandido de FTIR do SBA-16 puro e funcionalizado com metanol (região ). Para a amostra pura SBA-16, o espectro de infravermelho mostra bandas de absorção referentes às vibrações fundamentais da rede de sílica, em torno de 460, 810, 960, , cm -1. A banda entre 1080 e 1160 cm -1 é relativa ao estiramento assimétrico das ligações Si-O-Si do SiO 4. As bandas em 960 cm -1 e 1640 cm -1 são atribuídas aos grupos silanóis existentes na estrutura do material. A banda em torno de 810 cm -1 é relativa ao estiramento simétrico da ligação Si-O-Si. A banda larga na região de cm -1, relaciona-se ao grupo hidroxila da água e ao modo de vibração de deformação axial de OH do grupo Si-OH (SOUSA, 2009). No caso das amostras funcionalizadas, percebe-se a presença de outras bandas, atribuídas ao ancoramento de grupos orgânicos na superfície da sílica. Além disso, observa-se uma redução da intensidade da banda em 960 cm -1 atribuída aos grupos silanóis existentes na estrutura do material nas amostras funcionalizadas, indicando que o consumo dos grupos hidroxilas pode ser um indício do ancoramento dos grupos funcionalizantes na superfície das amostras, como pode ser observado nas FIG. 26 e 29. Bandas em torno de cm -1 são referentes aos modos de vibrações de estiramentos CH 3 e CH 2 de hidrocarbonetos alifáticos, FIG 27 e 30. No espectro da sílica funcionalizada observam-se algumas alterações na superfície química de SiO 2, que consistem de um estiramento assimétrico da ligação CH em torno de 2900 cm -1 e uma deformação fora do plano (torção) δ HCH na banda de 1470 cm -1 referente à cadeia de hidrocarbonetos. As bandas de estiramento dos átomos de hidrogênio ligados a átomos de
72 71 carbono de hibridização sp 3 ocorrem em freqüências na faixa de cm -1, conforme pode ser observado nos espectros das amostras funcionalizadas, FIG. 25 e 28. Dois picos de absorção em torno de 690 cm -1 e 1560 cm -1 atribuídos à vibração de deformação de N-H e vibração de estiramento simétrico NH 2, respectivamente, indicam a presença de grupos amino na superfície da sílica, respectivamente (SHI, 2009). Além disso, um pico em 1630 cm -1 pode ser atribuído à vibração de estiramento N-H, que pode ser superposto à vibração de estiramento de H 2 O absorvida, FIG. 27 (CHONG, 2003). Um pico de absorção de vibração de estiramento em um intervalo de cm -1 não está bem resolvido devido à sobreposição dos picos de absorção de vibração estiramento Si-O-Si no intervalo de cm -1, FIG. 26 e 27, e vibração de estiramento no intervalo de cm -1, FIG. 25 e 28, (SHI, 2009). Picos de absorção no intervalo de cm -1 referem-se a vibrações de estiramento simétricas e assimétricas de H 2 O. Portanto, é difícil determinar a vibração de estiramento de NH 2 na região de cm -1 porque essa banda se sobrepõe à banda larga em 3420 cm -1 correspondente a água absorvida, FIG 25 e 28. Fonte: (SOUSA, 2009). TABELA 8 - Identificação espectrofotométrica de alguns grupos funcionais. Bandas principais observadas no SBA-16 (cm -1 ) Atribuição ν (s) H-O-H, ν (s) Si-OH 2857 CH e 2926 CH 2 ~1640 δ H-O-H, δ Si-OH 1560 ν (s) NH ν (ass) Si-O-Si ~960 δ Si-OH ~810 ν (s) Si-O-Si 690 ν N-H Resultados Obtidos para as Amostras Pura e Funcionalizadas Incorporadas com Atenolol. Os espectros de FTIR obtidos para as amostras de SBA-16 puro e SBA-16 Atenolol são mostrados na FIG. 31. Comparando os espectros, a presença do atenolol pode ser confirmada
73 72 observando a presença dos picos referentes ao fármaco. As bandas relativas às funções esperadas na molécula de atenolol são indexadas na TAB. 9. TABELA 9 - Bandas de absorção no infravermelho e suas respectivas atribuições identificadas no espectro do fármaco atenolol. Bandas Principais Observadas Atribuição ν N-H (amina I) / ν (s) C-H(CH 3 ), ν (s) C-H(CH 2 ) / ν (ass) C-H(CH 3 ), ν (s) C-H(CH 2 ) 1704 ν C=O (amidas) 1640 δ N-H(amina I) 1610, 1584,1513,1455 δ anel aromático / δ C-H metileno (ass)/(s) ν C-H 1297 No plano δ OH (álcool II) ν C-O-C, ν C-O Fonte: (SOUSA, 2009). Transmitância (u.a.) SBA-16 Atenolol SBA-16 ν C=O (amidas) δ Anel Aromático δ Anel Aromático δ Anel Aromático Número de onda (cm -1 ) FIGURA 31 - Espectro expandido de FTIR do SBA-16 puro e SBA-16 incorporado com Atenolol ( ).
74 73 Transmitância (u.a) T-PTES atenolol T-PTES ν C=O (amidas) δ Anel Aromático δ Anel Aromático δ Anel Aromático SBA Número de onda (cm -1 ) FIGURA 32 - Espectro expandido de FTIR do SBA-16, T-PTES, T-PTES incorporado com Atenolol ( ). Transmitância (u.a) M-PTES atenolol M-PTES ν C=O (amidas) δ Anel Aromático δ Anel Aromático δ Anel Aromático SBA Número de onda (cm -1 ) FIGURA 33 - Espectro expandido de FTIR do SBA-16, M-PTES, M-PTES incorporado com Atenolol ( ). No espectro expandido de , FIG. 31, é possível observar uma banda larga na amostra pura característica de deformação angular H-O-H fora do plano. Ao se comparar com o espectro da amostra de SBA-16 incorporada observa-se o aparecimento de picos característicos das vibrações de deformação de anel aromático, em torno de 1610, 1513 e 1455 cm -1. Além desses, outro pico em torno de 1704 cm -1 atribuído a vibração C=O de grupo funcional amida foi observado. As outras bandas presentes no espectro do fármaco não são observadas no espectro da amostra incorporada com o fármaco por causa da sobreposição dos picos característicos da sílica.
75 74 Os espectros das amostras funcionalizadas T-PTES e M-PTES, após sofrerem o processo de incorporação, podem ser vistos FIG. 32 e 33, respectivamente. Os picos característicos esperados após a incorporação estão presentes nas amostras funcionalizadas, assim como, descritos, anteriormente, para o SBA-16 atenolol Análise térmica A Termogravimetria (TG) foi utilizada para verificar a estabilidade térmica, a temperatura de degradação e estimar a quantidade de funcionalizante na sílica modificada. O princípio dessa técnica se baseia na perda de massa de uma amostra em função da variação da temperatura, produzindo curvas termogravimétricas. Uma quantidade conhecida da amostra é submetida a um aumento gradual de temperatura em um forno, sob atmosfera controlada, e a perda de massa resultante dos processos decorrentes deste aumento de temperatura é detectada por uma termobalança. A perda de massa no primeiro evento térmico das amostras, entre 25 e 150 ºC, decorre da termodessorção de água fisicamente adsorvida. SBA-16 foi funcionalizado com grupos que promoveram uma superfície apolar da sílica, portanto, ao se comparar a amostra pura com as amostras funcionalizadas, observa-se uma menor porcentagem de perda de massa nessa faixa de temperatura das amostras funcionalizadas, podendo esse comportamento ser atribuído a uma menor adsorção de água. A amostra pura, FIG.34, apresentou uma perda em torno de 13% nessa faixa inicial, acima de 150 C até 600 não foi observada nenhuma perda significativa. Com isso, pode-se dizer que o SBA-16 apresentou excelente estabilidade térmica na faixa de temperatura investigada, uma vez que não sofre nenhuma decomposição ou degradação estrutural. Somente nas amostras funcionalizadas observa-se uma perda de massa entre 150 e 600 C, que pode ser atribuída à degradação térmica dos agentes funcionalizantes.
76 SBA Perda de Massa % (m/m) DTG Temperatura ( C) FIGURA 34 - Curva de TG e sua derivada (DTG) para SBA-16 puro. Perda de Massa % (m/m) 100 SBA T-ETES M-ETES Temperatura ( C) DTG FIGURA 35 - Curva de TG e sua derivada para SBA-16 puro e funcionalizado ETES.
77 76 Perda de Massa % (m/m) 100 SBA T-PTES M-PTES DTG Temperatura ( C) FIGURA 36 - Curva de TG e sua derivada para SBA-16 puro e funcionalizado PTES. Perda de massa % (m/m) 100 SBA T-APTES M-APTES DTG Temperatura ( C) FIGURA 37 - Curva de TG e sua derivada para SBA-16 puro e funcionalizado APTES. Para as amostras funcionalizadas usando tolueno como solvente, as perdas de massas ocorrem em duas regiões distintas, como pode ser visto nas FIG. 35, 36 e 37. A primeira região compreende o intervalo de temperatura ambiente até 150 C, com uma perda de massa em torno de 1,3% para T-PTES, 4,5% para T-ETES e 6,0% para T-APTES. Essas perdas nessa faixa de temperatura podem ser atribuídas à perda de água adsorvida residual presente na estruturas desses materiais.
78 77 As amostras funcionalizadas com o solvente tolueno apresentaram uma maior quantidade de carbono na superfície, que foi possível confirmar com a análise de CHN. Desta forma, as superfícies das amostras com maior presença de carbono encontram-se mais hidrofóbicas. Portanto, observa-se uma adsorção menor de moléculas de água nessas amostras, consequentemente, uma menor perda de massa na região até 150 C ao se comparar com a amostra pura de SBA-16. As amostras modificadas com diferentes agentes funcionalizantes possuem comportamentos diversificados quanto à variação de moléculas de carbono adicionadas à amostra pura inicial. Observa-se, portanto, uma variação da porcentagem de perda de massa entre as amostras funcionalizadas com tolueno, na região de C, podendo ser feita uma relação dessa perda com a variação de número de carbono obtida pela análise de CHN. A amostra T-PTES teve a menor perda de massa de 1,3%, FIG. 36, e apresenta um conteúdo de carbono de 6,36mmol.g - 1, ou seja, a amostra com maior quantidade de carbono mostrou a menor perda de massa, o que indica menor adsorção de água, devido à maior hidrofobicidade da superfície após a modificação. A amostra T-ETES teve a segunda menor perda de massa nessa região de 4,5%, FIG. 35, e possui um conteúdo de carbono de 5,1 mmol.g -1. Entretanto, comportamento diferente foi observado para a amostra T-APTES, que apresentou 7,92 mmol.g -1 de número de carbono e a maior perda de massa de 6,0%, FIG. 37. Esse comportamento pode ser explicado devido à presença do grupo amino, que pode interagir com as moléculas de água por ligações de hidrogênio, favorecendo a adsorção dessas. Pela análise de CHN foi comprovada que a amostra T-APTES que possui 3,53 mmol.g -1 de nitrogênio. Uma segunda região de temperatura que vai de 150 C a 600 C, indicou uma perda de massa para as amostras T-PTES e T-APTES de aproximadamente 7,2% e 11,4%, respectivamente, sendo que esses valores foram os mais elevados na termodecomposição da sílica modificada. Além desses, foi observada perda de 4,1% para T-ETES. Essas perdas podem ser atribuídas à decomposição dos grupos orgânicos ancorados na sílica (ESPÍNOLA, 2003). Para as amostras funcionalizadas usando metanol como solvente, as perdas de massas também aconteceram em duas regiões distintas, FIG. 35, 36 e 37. A primeira região foi no intervalo da temperatura ambiente até 150 C, com uma perda de massa de 3,4% para M-PTES, 4,6% para M-APTES e 9,8% para M-ETES, que deve ser devido à perda de água presente nos materiais.
79 78 Semelhante às amostras funcionalizadas com tolueno, as amostras funcionalizadas com metanol possuem uma relação entre a perda de massa e o número de carbono adicional na sílica pura. Ao se fazer uma comparação entre as amostras em que foi utilizado como solvente o metanol, no intervalo de temperatura de 25 a 150 C, a amostra M-ETES teve uma perda de massa de 9,8%, FIG. 35, tendo uma variação de número de carbono de 1,9 mmol.g -1. A amostra M- PTES, FIG 36, que teve uma perda de massa de 3,4%, apresentando uma variação do número de carbono de 1,55 mmol.g -1. A amostra M-APTES teve uma perda de massa de 4,6%, FIG. 37, maior que a amostra M-PTES e menor que a M-ETES. M-APTES apresentou um variação de número de carbono de 4,43 mmol.g -1, sendo essa variação maior que os valores das amostras M-ETES e M-PTES. Porém, a amostra M-APTES possui grupo amino que pode formar interação do tipo ligação de hidrogênio com a água, favorecendo a adsorção dessa última. Em uma segunda região que compreende o intervalo de C, foi possível observar uma perda de massa de 2,3% para M-ETES, 2,8% para M-PTES e 4,6% para M-APTES. Essa perda pode ser atribuída à decomposição dos grupos orgânicos presentes na superfície após a modificação da sílica mesoporosa. Relacionando-se a perda de massa na região de C, indicada como a região de perda de grupo orgânico, com a variação do número de carbono, pode-se perceber que as amostras M-PTES e M-ETES, que tiveram uma variação de carbono em torno de 1,55 e 1,9 mmol.g -1 apresentaram as menores perdas de massa, em torno de 2,8 e 2,3%. A amostra M-APTES com perda de massa de 7,4%, apresentou variação de número de carbono de 4,43 mmol.g -1. Observa-se, portanto, uma compatibilidade dos resultados de perda de massa na região de C com os valores de variação de número de carbono apresentados pelo CHN. Além disso, é possível perceber que as amostras funcionalizadas com tolueno apresentam uma perda de massa maior na região atribuída à perda dos grupos orgânicos ancorados ao se comparar com a perda nessa mesma região das amostras funcionalizadas com metanol. Ou seja, as amostras funcionalizadas com o tolueno obtiveram valores maiores de conteúdo de carbono comparados aos resultados obtidos pelas amostras funcionalizadas com metanol. A maior parcela de massa perdida na análise está relacionada à decomposição da parte orgânica,
80 79 indicando, desta maneira, uma maior presença dos grupos orgânicos nas amostras funcionalizadas com tolueno. Esses resultados estão resumidos na TAB. 10. Esse comportamento pode ser explicado pela propriedade mais apolar do tolueno, que possui uma maior capacidade de solubilizar os agentes funcionalizantes e não atua como um competidor dos grupos silanóis da superfície da sílica pelos funcionalizantes. Já no caso do metanol, que é um solvente prótico, ou seja, por possuir o grupo hidroxila em sua molécula, ele pode formar ligações de hidrogênio, e pode solvatar as moléculas dos funcionalizantes, reduzindo a probabilidade de interação desses com as hidroxilas da superfície, atuando como um solvente que não favorece tanto o processo de funcionalização. Além disso, pode interagir de forma mais efetiva com a superfície da sílica, reduzindo a interação dos funcionalizantes com essa. TABELA 10: Perda de Massa em duas faixas de temperatura. Amostra Perda de massa (% m/m) Perda de massa (% m/m) Resíduos (% m/m) ºC ºC SBA-16 13,1-85 M-PTES 3,4 2,8 93 T-PTES 1,3 7,2 91 M-ETES 9,8 2,3 87 T-ETES 4,5 4,1 91 M-APTES 4,6 7,4 87 T-APTES 6,0 11,4 82 A relação entre a perda de massa orgânica para as amostras funcionalizadas usando metanol e tolueno como solventes, no intervalo de C, e o teor de grupos orgânicos ancorados, que foram expressos em termos de número de carbono, está indicada nas FIG 38 e 39. Esses dados sugerem a efetividade das reações e a relação dos resultados obtidos na análise elementar e na termogravimetria.
81 M-APTES 6 Perda de massa (%) M-PTES M-ETES 0 SBA Nc FIGURA 38 - Relação de perda de massa e número de carbono, obtido por CHN, da amostra pura e das funcionalizadas com metanol. 12 T-APTES 10 Perda de massa (%) T-ETES T-PTES 2 0 SBA Nc FIGURA 39 - Relação de perda de massa e número de carbono, obtido por CHN, da amostra pura e das funcionalizadas com tolueno.
82 Adsorção de Gases-BET Com o objetivo de caracterizar a estrutura do SBA-16 e desse material funcionalizado foi utilizada a medida de adsorção de N 2. A TAB. 11 apresenta os resultados obtidos das medidas de adsorção de N 2, que mostram os valores numéricos para os parâmetros texturais comumente utilizados para caracterizar materiais porosos. Nesta tabela, estão listados os valores da área superficial específica calculada por BET (S BET ), os valores obtidos do volume total de poros (Vp) e diâmetro de poros (Dp) calculado pelo método BJH das amostras de SBA-16 puras e modificadas usando metanol e tolueno como solventes. Os índices T e M referem-se aos solventes empregados em cada processo: tolueno e metanol, respectivamente. No diâmetro de poros não foi observado variação significativa após o processo de funcionalização. Área superficial de cerca de 550 m 2 /g foi medida para SBA-16 puro. Um decréscimo para valores da ordem 403 m 2 /g é observado para sistemas utilizando metanol como solvente como pode ser observado na amostra M-ETES. No caso das amostras funcionalizadas com T-PTES, essa redução foi de 311 m 2 /g. Uma redução significativa ocorreu nas amostras funcionalizadas com APTES, independente do solvente utilizado. Para amostras funcionalizadas em metanol, foi encontrado um valor de área superficial da ordem de 75 m 2 /g. Uma redução mais expressiva, foi observada para a amostra funcionalizada em tolueno, que apresenta uma área superficial de 49 m 2 /g. TABELA 11: Resultados da adsorção de nitrogênio usando metanol como solvente. Material Dp (nm) S BET (m 2 /g) Vp (cm³/g) SBA-16 3, ,35 M-ETES 3, ,39 M-PTES 3, ,54 M-APTES 3,7 75 0,13 T-ETES 3, ,34 T-PTES 3, ,35 T-APTES 3,6 49 0,02 É possível observar por meio destes resultados que um decaimento da área superficial à medida que a imobilização aumenta indica o ancoramento de espécies orgânicas na superfície
83 82 da sílica. Esse comportamento pode ser explicado pela substituição dos grupos silanóis pelos grupos silanos. Relacionando a quantidade de número de carbono das amostras funcionalizadas, obtido pelo CHN, com a redução área superficial, observa-se que quanto maior quantidade de número de carbono, menor a área superficial, como pode ser visto nas FIG. 40 e SBA-16 M-PTES Área superficial (m 2.g -1 ) M-ETES 100 M-APTES Nc FIGURA 40 - Relação entre os dados de área superficial e o número de carbonos obtido por CHN usando metanol como solvente SBA-16 Área superficial (m 2.g -1 ) T-ETES T-PTES T-APTES Nc FIGURA 41 - Relação entre os dados de área superficial e o número de carbonos obtido por CHN usando tolueno como solvente.
84 83 A adsorção efetiva dos grupos funcionalizantes no sistema de poros do SBA-16 quando se utiliza o tolueno como solvente é evidenciada por uma maior diminuição da área superficial e volume de poros da matriz em relação ao metanol. A redução do volume de poros não foi observada nas amostras M-PTES e M-ETES que apresentaram aumento no volume de poros, porém esse aumento não foi significativo, conforme mostrado na TAB Análise das Isotermas A adsorção de gases em um sólido pode ser descrito pelas isotermas de adsorção. A sílica mesoporosa ordenada possui isotermas do tipo IV, com a presença da etapa de condensação capilar (a uma dada pressão relativa) que está relacionada ao tamanho dos seus mesoporos. Um cenário clássico da condensação capilar implica no atraso da transição de fase vaporlíquido devido a existência de filmes de adsorção metaestável e pontes de nucleação líquida dificultadas. A análise do tamanho de poros dos materiais mesoporosos por isotermas de adsorção é baseada na interpretação dos mecanismos de condensação e evaporação capilar associados ao fenômeno de histerese (THOMMES, 2006). Por outro lado, a altura da etapa de condensação capilar depende do volume primário dos mesoporos ordenados e quanto mais vertical ele for mais uniforme são os diâmetros dos poros. O oposto da condensação capilar é a evaporação capilar, que não ocorre na mesma posição da pressão relativa da condensação, levando a chamada histerese de adsorção/dessorção. Nas isotermas de adsorção são observadas regiões que exibem acontecimentos que caracterizam os poros do material, FIG 42. A porção inicial da isoterma (A) corresponde à adsorção na região de baixas pressões relativas (P/P 0 : 10-5 a 0,02) devido ao preenchimento dos microporos e a formação de um filme nas paredes dos poros. Em seguida, em (B) ocorre um aumento linear do volume adsorvido devido à adsorção na monocamada e multicamada sobre a superfície do material, incluindo a superfície dos mesoporos. A etapa de condensação capilar acentuada, entre os pontos (C) e (D), indica uma estreita distribuição de tamanho de poros. No ponto (D), em pressões relativas altas, ocorre a adsorção nos macroporos. A dessorção é, consideravelmente, tardia e essencialmente não ocorre até o ponto (E), seguida por uma acentuada etapa de evaporação EF em uma pressão relativa de 0,4 (RAVIKOVITCH, 2002).
85 SBA-16 (E) (D) 250 Volume Adsorvido (cm 3.g -1 ) (A) (B) (F) (C) Pressão relativa (P/P 0 ) FIGURA 42 - Isoterma de Adsorção de Nitrogênio de SBA-16. Como pode se ver, a isoterma da amostra pura apresenta ramos de adsorção e dessorção que formam uma histerese assimétrica e triangular, que pode ser atribuído a sistemas de poros com conectividade de rede de poros e efeito de bloqueio de poros. Esses poros ordenados bem definidos são do tipo garrafa de tinta (ink-bottle), em que a condensação capilar ocorre muito próxima do equilíbrio, enquanto a evaporação capilar ocorre de forma tardia, indicando presença de grandes cavidades (RAVIKOVITCH, 2002). As histereses apresentadas pelas amostras são do tipo H2, com etapa de evaporação acentuada, são características de materiais mesoporosos do tipo gaiola. Esse tipo de histerese é esperado para materiais mesoporosos com uma estrutura de conexão de poros. As isotermas de adsorção de nitrogênio da amostra SBA-16 pura e das amostras funcionalizadas com os diferentes funcionalizantes usando metanol e tolueno como solventes (M ou T) estão apresentadas na FIG. 43 e 44, respectivamente. Observa-se através dessas isotermas que as histereses das amostras funcionalizadas usando tolueno como solvente sofreram uma redução em altura. Além disso, os ramos de adsorção destas isotermas sofreram deslocamentos para menores valores de pressões relativas. Tais alterações fornecem um indício da diminuição do tamanho e volume de mesoporos.
86 85 Já para as amostras funcionalizadas usando metanol como solvente as histereses apresentaram um aumento da altura e as etapas de adsorção por capilaridade se deslocaram para pressões relativas maiores. Isso é um indicativo do aumento do tamanho e volume de poros (GOBIN, 2006). Verifica-se que os perfis das isotermas das amostras funcionalizadas com metanol e tolueno não possuem assimetrias quanto aos ramos de adsorção e dessorção, preservando as características estruturais da matriz mesoporosa, mesmo após a modificação superficial. Entretanto, o volume total de N 2 adsorvido decresce para todas as pressões relativas, indicando a presença dos agentes funcionalizantes nos poros da sílica. Conforme discutido anteriormente, nas amostras funcionalizadas com o grupo APTES ocorreu uma redução pronunciada da área superficial, como pode ser visto na TAB. 11. Além disso, a amostra T-APTES não apresentou a forma característica das isotermas de material mesoporoso. Isso pode indicar a maior ocupação do funcionalizante no interior dos poros da sílica. Esse indício é também observado nas análises realizadas anteriormente, como é o caso do CHN, em que o grupo APTES apresenta o maior aumento na quantidade de carbono e de nitrogênio comparado aos demais funcionalizantes em relação ao SBA-16 puro. Como também, na análise de TG, em que a perda de massa no intervalo de C, é a mais pronunciada para essa amostra. Ainda, no caso das amostras funcionalizadas com APTES, tanto em metanol como em tolueno, a diminuição do volume de N 2 adsorvido é significativa, indicando a ausência de espaço livre nos poros para a utilização desse material em processos de adsorção e/ou incorporação de moléculas orgânicas, tais como fármacos. Esse resultado está de acordo com aqueles encontrados por meio da técnica de CHN, em que não foi possível verificar algum conteúdo de carbono e nitrogênio provenientes do atenolol na estrutura do T-APTES e M- APTES. Nas amostras funcionalizadas com tolueno é possível observar uma maior redução no volume de N 2 adsorvido, como também, nos valores obtidos para área superficial. Esse comportamento pode indicar que as amostras em que foi usado o tolueno como solvente, apresentam uma quantidade maior dos grupos funcionalizantes na sua superfície. Isso pode ser explicado pelo caráter apolar do tolueno que favorece a solubilização dos funcionalizantes,
87 86 porém não forma interações fortes com esses a ponto de atuar como competidor com a hidroxila presente na sílica, como pode ocorrer com o metanol SBA-16 M ETES M APTES M PTES Volume Adsorvido (cm 3.g -1 ) Pressão relativa (P/P 0 ) FIGURA 43 - Isoterma de Adsorção de Nitrogênio de SBA-16, e amostras funcionalizadas com metanol SBA-16 T ETES T APTES T PTES Volume Adsorvido (cm 3.g -1 ) Pressão relativa (P/P 0 ) FIGURA 44 - Isoterma de Adsorção de Nitrogênio de SBA-16 e amostras funcionalizadas com tolueno Distribuição de Tamanho de Poros Uma das significantes ferramentas fornecidas pela análise de adsorção é a distribuição de tamanho de poros do adsorvente estudado. Essa distribuição reflete de alguma forma, a distribuição de qualquer parâmetro geométrico unidimensional de um material poroso.
88 87 O método usado foi desenvolvido por Barrett, Joyner e Halenda, que é denominado método BJH. O método é baseado no mecanismo de adsorção de mesoporos cilíndricos, sendo um processo via formação de filme e condensação por capilaridade. No gráfico de distribuição de tamanho de poros, FIG. 45, da amostra de SBA-16 pura, pode ser observado um ponto máximo em torno de 3nm. 0,25 SBA-16 0,25 M-ETES 0,20 dv(r) (cm 3.nm -1.g -1 ) 0,20 0,15 0,10 dv(r) (cm 3.nm -1.g -1 ) 0,15 0,10 0,05 0, ,05 Diâmetro de poros (nm) 0, Diâmetro de poros (nm) FIGURA 45 - Distribuição de tamanho de poros da amostra de SBA-16 e M-ETES. A distribuição de tamanho de poros nas amostras não foi afetada pelo processo de funcionalização, ou seja, nas amostras funcionalizadas observa-se uma distribuição de tamanho de poros semelhante à encontrada na amostra pura. As amostras funcionalizadas seguem a distribuição de poros semelhantes a da amostras M-ETES Parâmetros Texturais - método alfa-s Neste trabalho, o volume de microporos na presença de mesoporos, bem como outros parâmetros texturais foram estimados a partir da isoterma de adosrção de nitrogênio, utilizando como forma de tratamento dos dados o método comparativo α s conhecido como α s -plot que é um método muito utilizado na determinação do volume de microporos, volume de mesoporos, área superficial externa e total de materiais micro e mesoporos (SAYARI et. at., 1997; KRUK et. at., 1997). Esta é uma ferramenta mais elaborada para avaliação dos parâmetros texturais de materiais porosos, e é apresentada neste trabalho com o
89 88 objetivo de indicar o quanto se pode explorar dos dados de adsorção de N 2. Entretanto, este estudo foi realizado somente com as amostras SBA-16, T-PTES e T-ETES. As curvas α s representativas para adsorção de nitrogênio 77K das amostras SBA-16, T-PTES e T-ETES estão apresentadas nas FIG. 46, 47 e 48. Nessas curvas são observadas duas regiões linearizadas em baixas e altas pressões relativas. 300 SBA-16 (4) 250 (3) (segunda região linear) Volume adsorvido (cm 3.g -1 ) (2) (primeira região linear) 0 (1) 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 Adsorção padrão reduzida (α s ) FIGURA 46 - Curva α s para a amostra SBA T-PTES (4) Volume adsorvido (cm 3.g -1 ) (1) (2) (3) (segunda região linear) (primeira região linear) 0,5 1,0 1,5 2,0 2,5 3,0 Adsorção padrão reduzida (α s ) FIGURA 47 - Curva α s para a amostra T-PTES.
90 89 Volume adsorvido (cm 3.g -1 ) T-ETES (2) (4) (segunda região linear) (3) (primeira região linear) (1) 0,5 1,0 1,5 2,0 2,5 3,0 Adsorção padrão reduzida (α s ) FIGURA 48 - Curva α s para a amostra T-ETES. Quatro regiões distintas podem ser observadas nas curvas α s : (1) na região de baixas pressões relativas (alfa s entre 0.15 e 1.09) devido à adsorção de microporos; (2) uma primeira região linear devido à adsorção na monocamada e multicamada sobre a parede dos poros; (3) uma região devido à condensação capilar em mesoporos primários; (4) uma região devido à adsorção em multicamadas na superfície externa do material. Os valores numéricos para os parâmetros texturais comumente usados para caracterizar materiais mesoporosos estão na TAB. 12. Nesta tabela, estão contidos os valores de área superficial específica pelo método BET (S BET ) com os respectivos valores de constante C BET, os valores obtidos para o volume total de poros e diâmetro de poros calculados pelo método BJH. Além desses, na TAB.12, estão listados os valores numéricos calculados pelo método α s -plot: área superficial total (S t ), área superficial externa (S ext ), área superficial de mesoporos primários (S meso ), volume de microporos (V mi ) e volume de mesoporos (V meso ). Realizou-se a avaliação dos parâmetros texturais em duas amostras funcionalizadas com tolueno.
91 90 Métodos BET e BJH Método comparativo αs. TABELA 12: Resultados de adsorção de nitrogênio. SBA-16 T-PTES T-ETES S BET (m 2.g -1 ) C BET Vp (cm 3.g -1 ) 0,35 0,29 0,31 Dp (BJH) (nm) 3,6 3,7 3,7 S t (m 2. g -1 ) S ext (m 2. g -1 ) S meso (m 2.g -1 ) V mi 0,052 0,005 0,006 V meso, 1 0,44 0,27 0,30 V meso, 2 0,038 0,015 0,004 % V mi 9,8 0,9 1,1 Legenda: S BET = área superficial específica calculada pelo método BET, C BET = constante calculada a partir da equação BET, Vp = volume de poro, Dp = diâmetro de poro calculado pelo método BJH, S t = área superficial total, S ext = área superficial externa, S meso = área superficial de mesoporos, V mi = volume de microporos, V meso,1 volume de mesoporos primários,v meso,2 = volume de mesoporos secundários. Uma significativa diferença foi observada nos valores de S BET,S t, S ext e S meso para as amostras SBA-16, T-PTES e T-ETES, o que pode ser um indício da presença do grupo alcoxisilano na estrutura de poros da sílica. Através do método α s -plot, pode-se obter tanto a área específica interna de mesoporos primários, S meso, quanto a área superficial externa (área de macroporos e mesoporos secundários) que inclui os mesoporos desorganizados, S ext. As diferenças encontradas entre S BET e S t são em torno de 22% para SBA-16, de 0,6% para T-PTES e 0,3% para o T-ETES. A razão dessas diferenças pode estar relacionada ás fontes de erros inerentes ao cálculo da área superficial pelos métodos BET e α s -plot (KRUK et.al, 1997). Os valores calculados para os parâmetros texturais, mesmo providos de alguma incerteza, nos informam que as reduções observadas para as áreas superficiais S BET, S t, S meso ocorreram com valores aproximados. O material mesoporoso puro apresentou uma redução de em torno de 43% em sua S BET, 26% em sua S t, 33% em sua S meso após o processo de funcionalização resultando na amostra T-PTES. Com relação ao volume total de poros e volume de mesoporosos calculados por meio do método α s -plot para a amostra T-PTES observou-se uma redução maior no volume secundário. As reduções observadas para V p, V meso1, V meso2 foram de 17%, 37% e 60%, respectivamente. Percebe-se que as reduções dos volumes de poros são diferentes das observadas para as áreas superficiais indicando que o processo de introdução dos grupos
92 91 silanos na estrutura dos poros do SBA-16 não ocorre de forma homogênea, privilegiando a ocupação dos mesoporos secundários. O material mesoporoso puro apresentou uma redução em torno de 40% em sua S BET, 22% em sua S t, 24% em sua S meso após o processo de funcionalização resultando na amostra T-ETES, e obteve um aumento de 27% em sua S ext. As reduções observadas para V p, V meso1, V meso2 foram de 11%, 32% e 89%, respectivamente. Pelos resultados percebe-se que as reduções dos volumes de poros são diferentes das observadas para as áreas superficiais indicando, novamente, que o processo de introdução dos grupos silanos na estrutura dos poros do SBA- 16 não ocorre de forma homogênea. Como ocorreu com a amostra T-PTES, as reduções dos volumes de poros privilegiam a ocupação dos mesoporos secundários. Observa-se que o volume de microporos calculado pelo método α s -plot é cerca de 9,8% e que após o processo de funcionalização teve uma redução de 90% para a amostra T-PTES, apresentando um volume de 0,9%, e 88% para a amostra T-ETES, resultado de um volume de microporos de 1,1%. Uma diminuição significativa no valor da constante C BET com a introdução dos grupos silanos nos poros da sílica, também, pode ser observada na TAB.12. Os valores encontrados para a constante C BET é calculada a partir do ajuste linear na região 0,05<P/P 0 <0,2 da curva BET (P/P 0 )/[V[1-(P/P 0 )] versus (P/P 0 ) de acordo com a seguinte relação (Equação 5): C BET = s/i + 1 (5) Onde, s e i são, respectivamente, a inclinação e o intercepto com o eixo y, obtidos a partir da regressão linear. Para materiais a base de sílica, os valores calculados para C BET são usados para inferir sobre a polaridade superficial (SING et.al., 1985). Valores de C BET são altos para superfícies polares e baixos para superfícies apolares. No caso de materiais mesoporosos de sílica, altos valores de C BET indicam fortes interações entre a molécula de nitrogênio e os grupos hidroxila da superfície. Como pode ser visto na TAB. 12, a amostra de SBA-16 pura possui um alto valor para C BET (204). As amostras funcionalizadas possuem valores bem menores do que o apresentado para a amostra de SBA-16 pura. Como a funcionalização ocasiona uma alteração
93 92 no ambiente químico superficial da sílica, proporciona outros tipos de interações entre o adsorvente e o adsorbato, causando, dessa maneira, a redução do valor da constante. Tal interação pode ser em função da redução dos grupos silanóis devido à substituição por grupos hidrocarbonetos, que causam uma diminuição na quantidade de grupos hidroxilas livres para interagirem com as moléculas de nitrogênio Microscopia Eletrônica de Varredura A microscopia eletrônica de varredura é uma técnica eficiente no estudo da morfologia (textura, forma e tamanho) de um material. Com as imagens de MEV foi possível estimar o tamanho e a forma da partícula do SBA-16. A FIG. 49 mostrou que o SBA-16 apresenta partículas esféricas, resultado condizente com o descrito na literatura (ZHAO, 2004). Observa-se, porém, agregados de tamanhos variados, sugerindo que não há uniformidade de tamanho das partículas obtidas. Foram realizadas, também, imagens de microscopia do material funcionalizado, FIG. 50, que apresentaram partículas esféricas similares as da amostra pura. Esse resultado evidencia que mesmo após a introdução dos funcionalizantes a morfologia da sílica mesoporosa não sofreu modificação significativa. O diâmetro médio das partículas foi calculado utilizando-se o programa de análise de imagens Quantikov Image Analyzer (PINTO, 1996). Para isso, foram utilizadas as imagens que forneceram melhor visualização e contraste. O diâmetro médio calculado para as partículas de SBA-16 foi de (6±2) µm. Os valores para as amostras funcionalizadas não sofreram variação. 20 SBA Frequência Diâmetro (µm) FIGURA 49 - Micrografia da amostra de SBA-16.
94 93 a b (b) FIGURA 50 - Micrografia das amostras (a) T-APTES e (b) M-PTES Microscopia Eletrônica de Transmissão (MET) Para elucidar a estrutura de poros do SBA-16, a técnica de microscopia eletrônica de transmissão (b) foi utilizada. Essa técnica gera imagem de uma estrutura muito pequena a partir feixes de elétrons focalizados em direção a amostra. A intensidade da difração depende da orientação dos planos dos átomos em um cristal em relação ao feixe de elétrons. No caso do SBA-16 as orientações que mais favorece a obtenção dos picos de difração são (100), (110) e (111). A FIG. 51 mostra uma imagem de MET de uma amostra de SBA-16 obtida com o feixe incidente na direção paralela ao eixo dos poros (a), e obtida na direção perpendicular ao eixo dos poros (b) revelando claramente um arranjo cúbico de canais uniformes e eqüidistantes, confirmando um arranjo altamente ordenado. Esse ordenamento fornece características favoráveis ao material tais como estabilidade térmica, tamanho de poros bem definidas, distribuição estreita de tamanho de poros e elevada área superficial, sendo essas características evidenciadas pelas análises realizadas nesse trabalho.
95 94 a b FIGURA 51 - Micrografia da amostra SBA-16 com estrutura cúbica: (a) na direção paralela ao eixo dos poros, (b) na direção perpendicular ao eixo dos poros. a b FIGURA 52 - (a) Micrografia da amostra M-PTES com estrutura cúbica: na direção paralela ao eixo dos poros, (b) Micrografia da amostra T-PTES na direção perpendicular ao eixo dos poros Com o auxílio do programa Quantikov Image Analyzer (PINTO, 1996), o parâmetro de célula unitária para a rede cúbica (a 0 ) foi estimado. As medidas da distância do centro de um mesoporo cúbico ao centro de outro mesoporo foram realizadas em regiões distintas. O valor médio calculado para a 0 foi (15,2 ± 0,7) nm para o SBA-16 puro. Esses valores estão de acordo com os descritos na literatura.
96 95 Sakamoto e colaboradores descreveram a estrutura dos poros do SBA-16 através de imagens de HREM que mostram os planos (100), (110) e (111) incidentes e os difratogramas de Fourier correspondentes das imagens, como pode ser visto na FIG. 53. A morfologia observada desse material é de um cubo simples, que indica o grupo m3m, confirmando que pertence ao grupo Im3m (a 0 =133Å), que é um grupo espacial estável (SAKAMOTO, 2000). Essa descrição estrutural é semelhante à obtida neste trabalho, os resultados obtidos tanto para a amostra de SBA-16 pura quanto para as amostras funcionalizadas são condizentes com a literatura. FIGURA 53 - Imagens de HREM de SBA-16(calcinado) e os respectivos difratogramas de Fourier a (100), b (110) e c (111) (SAKAMOTO, 2000) Espalhamento de Raios X a Baixos Ângulos (SAXS) Essa técnica foi utilizada para obter informações da estrutura do material. Os materiais mesoporosos ordenados caracterizam-se por serem materiais amorfos, porém o arranjo periódico dos poros e a diferença de densidade da parede e dos poros possibilitam a detecção desse ordenamento a ângulos baixos pela difração de raio X. Devido ao maior espaçamento, os picos de intensidade se encontram a baixo ângulo (normalmente na faixa de 2θ igual a 0,5 5). Foi possível verificar por essa técnica a estrutura característica do arranjo de poros cúbico através da observação dos planos característicos e as possíveis alterações causadas pela introdução das moléculas orgânicas. O difratograma de raio X a baixo ângulo da amostra SBA-16 pura é apresentado na FIG. 54. Três sinais de espalhamento correspondentes aos planos (hkl), ou seja, baseados nos índices
OBTENÇÃO DE NANOPARTÍCULAS HÍBRIDAS DE SÍLICA EM SISTEMAS MICELARES.
 OBTENÇÃO DE NANOPARTÍCULAS HÍBRIDAS DE SÍLICA EM SISTEMAS MICELARES. Eliane Ribeiro Januário (Universidade de Franca) Eduardo José Nassar ( Universidade de Franca) Kátia Jorge Ciuffi (Universidade de Franca)
OBTENÇÃO DE NANOPARTÍCULAS HÍBRIDAS DE SÍLICA EM SISTEMAS MICELARES. Eliane Ribeiro Januário (Universidade de Franca) Eduardo José Nassar ( Universidade de Franca) Kátia Jorge Ciuffi (Universidade de Franca)
ESTUDO DAS PROPORÇÕES MOLARES DE ETANOL NAS PROPRIEDADES DA PENEIRA MOLECULAR SBA- 15
 ESTUDO DAS PROPORÇÕES MOLARES DE ETANOL NAS PROPRIEDADES DA PENEIRA MOLECULAR SBA- 15 F. O. COSTA 1, C. G. A. MISAEL 2, A. M. da SILVA 3 e B. V. de SOUSA 4 1 Universidade Federal de Campina Grande, Departamento
ESTUDO DAS PROPORÇÕES MOLARES DE ETANOL NAS PROPRIEDADES DA PENEIRA MOLECULAR SBA- 15 F. O. COSTA 1, C. G. A. MISAEL 2, A. M. da SILVA 3 e B. V. de SOUSA 4 1 Universidade Federal de Campina Grande, Departamento
AULA 5 Adsorção, isotermas e filmes monomoleculares. Prof a Elenice Schons
 AULA 5 Adsorção, isotermas e filmes monomoleculares Prof a Elenice Schons ADSORÇÃO É um processo de acumulação e concentração seletiva de um ou mais constituintes contidos num gás ou líquido sobre superfícies
AULA 5 Adsorção, isotermas e filmes monomoleculares Prof a Elenice Schons ADSORÇÃO É um processo de acumulação e concentração seletiva de um ou mais constituintes contidos num gás ou líquido sobre superfícies
Andreza de Sousa. Híbridos de Gel Polimérico em Sílica Mesoporosa Estruturalmente Ordenada para Liberação Controlada de Fármacos
 U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S E S C O L A D E E N G E N H A R I A P R O G R A M A D E P Ó S - G R A D U A Ç Ã O E M E N G E N H A R I A Q U Í M I C A Híbridos de Gel Polimérico
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S E S C O L A D E E N G E N H A R I A P R O G R A M A D E P Ó S - G R A D U A Ç Ã O E M E N G E N H A R I A Q U Í M I C A Híbridos de Gel Polimérico
SÍNTESE E CARACTERIZAÇÃO DE SÍLICAS MESOPOROSAS COM FERRO E COBALTO ASSOCIADOS
 SÍNTESE E CARACTERIZAÇÃO DE SÍLICAS MESOPOROSAS COM FERRO E COBALTO ASSOCIADOS Aluno: Renan Vieira Bela Orientadora: Maria Isabel Pais Introdução Desde o seu desenvolvimento, em 1998, a sílica mesoporosa
SÍNTESE E CARACTERIZAÇÃO DE SÍLICAS MESOPOROSAS COM FERRO E COBALTO ASSOCIADOS Aluno: Renan Vieira Bela Orientadora: Maria Isabel Pais Introdução Desde o seu desenvolvimento, em 1998, a sílica mesoporosa
Métodos Químicos para Fabricação de Materiais Nanoestruturado
 Métodos Químicos para Fabricação de Materiais Nanoestruturados Prof. Dr. Sergio da Silva Cava sergiocava@gmail.com Curso de Engenharia de Materiais - UFPel 30 de setembro de 2009 Introdução O que é Nano?
Métodos Químicos para Fabricação de Materiais Nanoestruturados Prof. Dr. Sergio da Silva Cava sergiocava@gmail.com Curso de Engenharia de Materiais - UFPel 30 de setembro de 2009 Introdução O que é Nano?
CQ136 Química Experimental I. Carbono, Silício e seus compostos
 CQ136 Química Experimental I Carbono, lício e seus compostos Introdução Nanomateriais à base de grafeno têm recebido muita atenção nos últimos anos. Grafeno é uma monocamada de átomos de carbono em hibridização
CQ136 Química Experimental I Carbono, lício e seus compostos Introdução Nanomateriais à base de grafeno têm recebido muita atenção nos últimos anos. Grafeno é uma monocamada de átomos de carbono em hibridização
4 Resultados e Discussão
 46 4 Resultados e Discussão 4.1. Difração de Raios-X com refinamento de Rietveld A seguir são apresentados os resultados de difração de raios-x das amostras preparadas. A partir deste, foi feito o refinamento
46 4 Resultados e Discussão 4.1. Difração de Raios-X com refinamento de Rietveld A seguir são apresentados os resultados de difração de raios-x das amostras preparadas. A partir deste, foi feito o refinamento
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes
 PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes AULA 2 CLASSIFICAÇÃO DOS PROCESSOS DE SEPARAÇÃO POR MEMBRANAS Prof.: José Carlos Mierzwa Processos de Separação por Membranas
PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes AULA 2 CLASSIFICAÇÃO DOS PROCESSOS DE SEPARAÇÃO POR MEMBRANAS Prof.: José Carlos Mierzwa Processos de Separação por Membranas
INTRODUÇÃO Á BIOQUÍMICA
 INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
Introdução a Engenharia e Ciência dos Materiais
 Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
FÍSICA DAS SUPERFÍCIES
 FÍSICA DAS SUPERFÍCIES Produção de vácuo forte Preparação de máscaras de gás (usam carvão ativado para gases perigosos Controlo de humidade com gel de sílica Remoção das impurezas de diversos produtos
FÍSICA DAS SUPERFÍCIES Produção de vácuo forte Preparação de máscaras de gás (usam carvão ativado para gases perigosos Controlo de humidade com gel de sílica Remoção das impurezas de diversos produtos
Síntese e Caracterização dos Compósitos de Fosfato Dicálcio Anidro/Óxido de Silício e avaliação da estabilidade química
 Síntese e Caracterização dos Compósitos de Fosfato Dicálcio Anidro/Óxido de Silício e avaliação da estabilidade química Ane Josana Dantas Fernandes, José Hundemberg Pereira Barbosa *Maria Gardênnia da
Síntese e Caracterização dos Compósitos de Fosfato Dicálcio Anidro/Óxido de Silício e avaliação da estabilidade química Ane Josana Dantas Fernandes, José Hundemberg Pereira Barbosa *Maria Gardênnia da
SÍNTESE E CARACTERIZAÇÃO DE UM SISTEMA MULTIFUNCIONAL SBA-16/NANOPARTÍCULAS MAGNÉTICAS/GEL POLIMÉRICO PARA BIOAPLICAÇÕES
 0 Comissão Nacional de Energia Nuclear Centro de Desenvolvimento da Tecnologia Nuclear Programa de Pós-Graduação em Ciência e Tecnologia das Radiações, Minerais e Materiais SÍNTESE E CARACTERIZAÇÃO DE
0 Comissão Nacional de Energia Nuclear Centro de Desenvolvimento da Tecnologia Nuclear Programa de Pós-Graduação em Ciência e Tecnologia das Radiações, Minerais e Materiais SÍNTESE E CARACTERIZAÇÃO DE
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande diversidade
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande diversidade
ESTUDO DA INFLUÊNCIA DA TEMPERATURA NA OBTENÇÃO DE HIDROXIAPATITA PARA FINS BIOMÉDICOS
 ESTUDO DA INFLUÊNCIA DA TEMPERATURA NA OBTENÇÃO DE HIDROXIAPATITA PARA FINS BIOMÉDICOS T. C. S. PEREIRA 1, G. A. FERNANDES 1 1 Universidade Federal de Itajubá, Instituto de Engenharia Mecânica E-mail para
ESTUDO DA INFLUÊNCIA DA TEMPERATURA NA OBTENÇÃO DE HIDROXIAPATITA PARA FINS BIOMÉDICOS T. C. S. PEREIRA 1, G. A. FERNANDES 1 1 Universidade Federal de Itajubá, Instituto de Engenharia Mecânica E-mail para
Ligações químicas e estrutura dos materiais
 Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física que regem
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física que regem
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Influência dos Parâmetros de Síntese nas Propriedades da Zeólita MCM-22
 Luciene Stivanin Garcia Influência dos Parâmetros de Síntese nas Propriedades da Zeólita MCM-22 Dissertação de Mestrado Dissertação apresentada como requisito parcial para obtenção do título de Mestre
Luciene Stivanin Garcia Influência dos Parâmetros de Síntese nas Propriedades da Zeólita MCM-22 Dissertação de Mestrado Dissertação apresentada como requisito parcial para obtenção do título de Mestre
PROVA PARA INGRESSO NO MESTRADO. Programa de Pós Graduação em Química 14/06/2017 NOME
 PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 14/06/2017 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 14/06/2017 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
SOLUÇÃO PRATIQUE EM CASA - QUÍMICA
 SOLUÇÃO PC. Percebe-se pela geometria apresentada, que: 3 2 () A hibridização de é sp d. 2 2 6 2 6 2 0 6 2 0 6 Xe (Z 54) : s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Xe (camada de valência): SOLUÇÃO PRATIQUE EM CASA
SOLUÇÃO PC. Percebe-se pela geometria apresentada, que: 3 2 () A hibridização de é sp d. 2 2 6 2 6 2 0 6 2 0 6 Xe (Z 54) : s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p Xe (camada de valência): SOLUÇÃO PRATIQUE EM CASA
APLICAÇÃO DA PENEIRA MOLECULAR SBA-15 COMO ADSORVENTE PARA ESPÉCIES POLUENTES DE CÁTIONS METÁLICOS EM SOLUÇÃO AQUOSA.
 APLICAÇÃO DA PENEIRA MOLECULAR SBA-15 COMO ADSORVENTE PARA ESPÉCIES POLUENTES DE CÁTIONS METÁLICOS EM SOLUÇÃO AQUOSA. J. J. RODRIGUES 1, J. C. MARINHO 1, V. E. ALMEIDA 2, G. VERAS 2 e M. G. F. RODRIGUES
APLICAÇÃO DA PENEIRA MOLECULAR SBA-15 COMO ADSORVENTE PARA ESPÉCIES POLUENTES DE CÁTIONS METÁLICOS EM SOLUÇÃO AQUOSA. J. J. RODRIGUES 1, J. C. MARINHO 1, V. E. ALMEIDA 2, G. VERAS 2 e M. G. F. RODRIGUES
UTILIZAÇÃO DE NANOPARTÍCULAS DE SÍLICA FUNCIONALIZADAS COM GRUPOS NITROGENADOS COMO SUPORTE PARA IMOBILIZAÇÃO DE CORANTES
 UTILIZAÇÃO DE NANOPARTÍCULAS DE SÍLICA FUNCIONALIZADAS COM GRUPOS NITROGENADOS COMO SUPORTE PARA IMOBILIZAÇÃO DE CORANTES André Cavalcante de Lima 1 ; Lucas Samuel Soares dos Santos 2 1 Aluno do Curso
UTILIZAÇÃO DE NANOPARTÍCULAS DE SÍLICA FUNCIONALIZADAS COM GRUPOS NITROGENADOS COMO SUPORTE PARA IMOBILIZAÇÃO DE CORANTES André Cavalcante de Lima 1 ; Lucas Samuel Soares dos Santos 2 1 Aluno do Curso
QUÍMICA DE MATERIAIS CRISTALINOS AMORFOS AULA 01: INTRODUÇÃO A QUÍMICA DOS MATERIAIS
 QUÍMICA DE MATERIAIS AULA 01: INTRODUÇÃO A QUÍMICA DOS MATERIAIS TÓPICO 04: SÓLIDOS AMORFOS E CRISTALINOS Os sólidos têm forma e volume definidos, possuem baixa compressibilidade, são densos, e apresentam
QUÍMICA DE MATERIAIS AULA 01: INTRODUÇÃO A QUÍMICA DOS MATERIAIS TÓPICO 04: SÓLIDOS AMORFOS E CRISTALINOS Os sólidos têm forma e volume definidos, possuem baixa compressibilidade, são densos, e apresentam
REMOÇÃO DE ENXOFRE EM COMBUSTÍVEIS POR ADSORÇÃO EM MATERIAIS MESOPOROS ORDENADOS
 REMOÇÃO DE ENXOFRE EM COMBUSTÍVEIS POR ADSORÇÃO EM MATERIAIS MESOPOROS ORDENADOS Aluna: Marianna Rangel Antunes Orientadora: Maria Isabel Pais Introdução A queima de combustíveis que possuem enxofre em
REMOÇÃO DE ENXOFRE EM COMBUSTÍVEIS POR ADSORÇÃO EM MATERIAIS MESOPOROS ORDENADOS Aluna: Marianna Rangel Antunes Orientadora: Maria Isabel Pais Introdução A queima de combustíveis que possuem enxofre em
SÍNTESE E CARCATERIZAÇÃO DE BETA FOSFATO TRICÁLCICO OBTIDO POR MISTURA A SECO EM MOINHO DE ALTA ENERGIA
 SÍNTESE E CARCATERIZAÇÃO DE BETA FOSFATO TRICÁLCICO OBTIDO POR MISTURA A SECO EM MOINHO DE ALTA ENERGIA T. C. S. PEREIRA 1 e G. A. FERNANDES 2 1 Universidade Federal de Itajubá, Instituto de Recursos Naturais
SÍNTESE E CARCATERIZAÇÃO DE BETA FOSFATO TRICÁLCICO OBTIDO POR MISTURA A SECO EM MOINHO DE ALTA ENERGIA T. C. S. PEREIRA 1 e G. A. FERNANDES 2 1 Universidade Federal de Itajubá, Instituto de Recursos Naturais
Síntese e Caracterização de Óxidos Nanoestruturados: Óxidos de Vanádio
 Síntese e Caracterização de Óxidos Nanoestruturados: Óxidos de Vanádio Aluna: Laís Groetares de Lima Orientador: Roberto de Avillez Introdução Nos últimos anos, a atenção tem sido cada vez maior em nanomateriais,
Síntese e Caracterização de Óxidos Nanoestruturados: Óxidos de Vanádio Aluna: Laís Groetares de Lima Orientador: Roberto de Avillez Introdução Nos últimos anos, a atenção tem sido cada vez maior em nanomateriais,
QUITOSANA QUIMICAMENTE MODIFICADA COM ACETILACETONA NA AUSÊNCIA DE SOLVENTE
 QUITOSANA QUIMICAMENTE MODIFICADA COM ACETILACETONA NA AUSÊNCIA DE SOLVENTE José Francisco B. Júnior, Pedro D. R. Monteiro, Jairton de M. Alencar, Luizângela R. Silva, José Milton E. de Matos, Kaline S.
QUITOSANA QUIMICAMENTE MODIFICADA COM ACETILACETONA NA AUSÊNCIA DE SOLVENTE José Francisco B. Júnior, Pedro D. R. Monteiro, Jairton de M. Alencar, Luizângela R. Silva, José Milton E. de Matos, Kaline S.
Adsorção de Solução. ( é um fenômeno de superfície e é relacionada a tensão superficial de soluções )
 Adsorção de Solução Adsorção é a acumulação de uma substância em uma interface. Ocorre com todos os tipos de interface, tais como gás-sólido, solução-sólido, solução-gás, solução α -solução β ( é um fenômeno
Adsorção de Solução Adsorção é a acumulação de uma substância em uma interface. Ocorre com todos os tipos de interface, tais como gás-sólido, solução-sólido, solução-gás, solução α -solução β ( é um fenômeno
ARRANJOS ATÔMICOS. Química Aplicada. Profº Vitor de Almeida Silva
 ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 Complexidade química e organização estrutural 2 - Extração, transformação e uso da energia do meio
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 Complexidade química e organização estrutural 2 - Extração, transformação e uso da energia do meio
MODIFICAÇÃO DE SÍLICA MESOPOROSA APLICADA COMO SISTEMA DE LIBERAÇÃO DE DROGA
 MODIFICAÇÃO DE SÍLICA MESOPOROSA APLICADA COMO SISTEMA DE LIBERAÇÃO DE DROGA G.F.Andrade, A. Sousa, E.M.B.Sousa R. Prof. Mário Werneck, s/ nº, Campus Universitário- Belo Horizonte- MG, CEP 30.123-970-
MODIFICAÇÃO DE SÍLICA MESOPOROSA APLICADA COMO SISTEMA DE LIBERAÇÃO DE DROGA G.F.Andrade, A. Sousa, E.M.B.Sousa R. Prof. Mário Werneck, s/ nº, Campus Universitário- Belo Horizonte- MG, CEP 30.123-970-
Síntese e caracterização de peneiras moleculares mesoporosas tipo MCM-41 a partir de diferentes direcionadores estruturais
 5º Encontro Regional de Química & Blucher Chemistry Proceedings 4º Encontro Nacional de Química Novembro de 2015, Volume 3, Número 1 Síntese e caracterização de peneiras moleculares mesoporosas tipo MCM-41
5º Encontro Regional de Química & Blucher Chemistry Proceedings 4º Encontro Nacional de Química Novembro de 2015, Volume 3, Número 1 Síntese e caracterização de peneiras moleculares mesoporosas tipo MCM-41
Sumário. 1 Introdução: matéria e medidas 1. 2 Átomos, moléculas e íons Estequiometria: cálculos com fórmulas e equações químicas 67
 Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
ESTUDO DO PROCESSO DE ADSORÇÃO DE AZUL DE METILENO EM MEIO AQUOSO EMPREGANDO SILICA SBA-15 COMO ADSORVENTE RESUMO
 ESTUDO DO PROCESSO DE ADSORÇÃO DE AZUL DE METILENO EM MEIO AQUOSO EMPREGANDO SILICA SBA-15 COMO ADSORVENTE G. R. F. GONÇALVES 1*, O. R. R GANDOLFI 1, J. G. PIMENTEL², C. M. VELOSO³, R. C. I. FONTAN 4,
ESTUDO DO PROCESSO DE ADSORÇÃO DE AZUL DE METILENO EM MEIO AQUOSO EMPREGANDO SILICA SBA-15 COMO ADSORVENTE G. R. F. GONÇALVES 1*, O. R. R GANDOLFI 1, J. G. PIMENTEL², C. M. VELOSO³, R. C. I. FONTAN 4,
Forças de van der Waals e Estabilidade Coloidal
 Pós-Graduação em Ciência de Materiais Faculdade UnB - Planaltina Forças de van der Waals e Estabilidade Coloidal Prof. Alex Fabiano C. Campos, Dr Balanço de Interações em Colóides Convencionais Balanço
Pós-Graduação em Ciência de Materiais Faculdade UnB - Planaltina Forças de van der Waals e Estabilidade Coloidal Prof. Alex Fabiano C. Campos, Dr Balanço de Interações em Colóides Convencionais Balanço
Aula 3 Fabricação de Nanomateriais
 ESZM002-13 - Nanociência e Nanotecnologia (2-0-2) Prof. Everaldo Carlos Venancio Sala 601-1, Bloco A, Torre 1, Santo André E-mail: pacatoecv@gmail.com everaldo.venancio@ufabc.edu.br Site do curso: http//sites.google.com/site/nanocienciaufabc
ESZM002-13 - Nanociência e Nanotecnologia (2-0-2) Prof. Everaldo Carlos Venancio Sala 601-1, Bloco A, Torre 1, Santo André E-mail: pacatoecv@gmail.com everaldo.venancio@ufabc.edu.br Site do curso: http//sites.google.com/site/nanocienciaufabc
Forças Intermoleculares
 Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
SÍNTESE E CARACTERIZAÇÃO DA PENEIRA MOLECULAR SBA-15: INFLUÊNCIA DA TEMPERATURA
 SÍNTESE E CARACTERIZAÇÃO DA PENEIRA MOLECULAR SBA-15: INFLUÊNCIA DA TEMPERATURA G. M. de PAULA 1, L. A. LIMA 1 e M. G. F. RODRIGUES 1 1 Universidade Federal de Campina Grande, Unidade Acadêmica de Engenharia
SÍNTESE E CARACTERIZAÇÃO DA PENEIRA MOLECULAR SBA-15: INFLUÊNCIA DA TEMPERATURA G. M. de PAULA 1, L. A. LIMA 1 e M. G. F. RODRIGUES 1 1 Universidade Federal de Campina Grande, Unidade Acadêmica de Engenharia
COMPÓSITOS DE MATRIZ PDMS PREPARADOS COM TEOS POR IRRADIAÇÃO GAMA
 Encontro Nacional de Materiais e Estruturas Compósitas ENMEC2010 A. J. M. Ferreira (Editor) FEUP, Porto, 2010 COMPÓSITOS DE MATRIZ PDMS PREPARADOS COM TEOS POR IRRADIAÇÃO GAMA F.M.A. Margaça *, I.M. Miranda
Encontro Nacional de Materiais e Estruturas Compósitas ENMEC2010 A. J. M. Ferreira (Editor) FEUP, Porto, 2010 COMPÓSITOS DE MATRIZ PDMS PREPARADOS COM TEOS POR IRRADIAÇÃO GAMA F.M.A. Margaça *, I.M. Miranda
Química Geral I. Química - Licenciatura Prof. Udo Eckard Sinks
 Química Geral I Química - Licenciatura Prof. Udo Eckard Sinks Conteúdo 19/05/2017 Contextualização Química Química Inorgânica Química Orgânica Físico Química Química Analítica Funções Químicas Funções
Química Geral I Química - Licenciatura Prof. Udo Eckard Sinks Conteúdo 19/05/2017 Contextualização Química Química Inorgânica Química Orgânica Físico Química Química Analítica Funções Químicas Funções
Análise de alimentos II Introdução aos Métodos Espectrométricos
 Análise de alimentos II Introdução aos Métodos Espectrométricos Profª Drª Rosemary Aparecida de Carvalho Pirassununga/SP 2018 Introdução Métodos espectrométricos Abrangem um grupo de métodos analíticos
Análise de alimentos II Introdução aos Métodos Espectrométricos Profª Drª Rosemary Aparecida de Carvalho Pirassununga/SP 2018 Introdução Métodos espectrométricos Abrangem um grupo de métodos analíticos
INFLUÊNCIA DA CONCENTRAÇÃO DE CITRATO DE SÓDIO NA FORMAÇÃO DE NANOPARTÍCULAS DE PRATA.
 INFLUÊNCIA DA CONCENTRAÇÃO DE CITRATO DE SÓDIO NA FORMAÇÃO DE NANOPARTÍCULAS DE PRATA. Resumo Guilherme Mosquim Lemes 1, Maiara Lima Castilho, Leandro Raniero. Laboratório de Nanossensores - Universidade
INFLUÊNCIA DA CONCENTRAÇÃO DE CITRATO DE SÓDIO NA FORMAÇÃO DE NANOPARTÍCULAS DE PRATA. Resumo Guilherme Mosquim Lemes 1, Maiara Lima Castilho, Leandro Raniero. Laboratório de Nanossensores - Universidade
ORDEM. Periocidade. SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico de átomos, moléculas ou iões, formando uma estrutura cristalina regular
 Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
5 Crescimento de filmes de Ti-B-N
 5 Crescimento de filmes de Ti-B-N 5.1. Introdução O sistema Ti-B-N tem sido estudado há pouco mais de uma década [79-81] devido principalmente a suas boas propriedades mecânicas e tribológicas. Estes compostos
5 Crescimento de filmes de Ti-B-N 5.1. Introdução O sistema Ti-B-N tem sido estudado há pouco mais de uma década [79-81] devido principalmente a suas boas propriedades mecânicas e tribológicas. Estes compostos
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
Origem grego (protos) primeira, mais importante
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PMT Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
ESTADO SÓLIDO. paginapessoal.utfpr.edu.br/lorainejacobs. Profª. Loraine Jacobs
 ESTADO SÓLIDO lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª. Loraine Jacobs Estado Sólido Tradicionalmente, um sólido é definido como uma substância que mantém um volume e uma
ESTADO SÓLIDO lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª. Loraine Jacobs Estado Sólido Tradicionalmente, um sólido é definido como uma substância que mantém um volume e uma
Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos
 UNIVERSIDADE DE SÃO PAULO USP FARMÁCIA BIOQUÍMICA 015N Reatividade de Compostos Orgânicos II Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos Beatriz In Soon Chang (9328183) João Gabriel
UNIVERSIDADE DE SÃO PAULO USP FARMÁCIA BIOQUÍMICA 015N Reatividade de Compostos Orgânicos II Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos Beatriz In Soon Chang (9328183) João Gabriel
Capítulo 1 - Cristais
 1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
Diferentes modelos de ligação química
 Ligação covalente Diferentes modelos de ligação química A grande diversidade de substâncias resulta da combinação de átomos dos elementos químicos através de diferentes modelos de ligação: covalente, iónica
Ligação covalente Diferentes modelos de ligação química A grande diversidade de substâncias resulta da combinação de átomos dos elementos químicos através de diferentes modelos de ligação: covalente, iónica
INFLUÊNCIA DA AGITAÇÃO NO MÉTODO HIDROTÉRMICO DA PENEIRA MOLECULAR MCM-41
 INFLUÊNCIA DA AGITAÇÃO NO MÉTODO HIDROTÉRMICO DA PENEIRA MOLECULAR MCM-41 Josiele Souza Batista Santos 1 ; Carlos Eduardo Pereira 2 ; Bianca Viana de Sousa 3 1 Universidade Federal de Campina Grande, Unidade
INFLUÊNCIA DA AGITAÇÃO NO MÉTODO HIDROTÉRMICO DA PENEIRA MOLECULAR MCM-41 Josiele Souza Batista Santos 1 ; Carlos Eduardo Pereira 2 ; Bianca Viana de Sousa 3 1 Universidade Federal de Campina Grande, Unidade
Macromolécula mais abundante nas células
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
ESTRUTURA DOS SÓLIDOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
Síntese e Caracterização de Peneiras Moleculares Mesoporosas do Tipo SBA-15 Impregnadas com Níquel e Molibdênio
 Síntese e Caracterização de Peneiras Moleculares Mesoporosas do Tipo SBA-15 Impregnadas com Níquel e Molibdênio FROTA, Ronaldo Oliveira da. Aluno de Graduação da UERN, ronaldodeboer_89@hotmail.com; YUSEF,
Síntese e Caracterização de Peneiras Moleculares Mesoporosas do Tipo SBA-15 Impregnadas com Níquel e Molibdênio FROTA, Ronaldo Oliveira da. Aluno de Graduação da UERN, ronaldodeboer_89@hotmail.com; YUSEF,
6 - Microestrutura Fases
 24 6 - Microestrutura 6-1. Fases Um cubo de gelo flutuando na água e a atmosfera que os envolve são exemplos dos três estados da matéria, sem dúvida, mas também são exemplos de fases (Figura 6-1). Uma
24 6 - Microestrutura 6-1. Fases Um cubo de gelo flutuando na água e a atmosfera que os envolve são exemplos dos três estados da matéria, sem dúvida, mas também são exemplos de fases (Figura 6-1). Uma
HIGH PERFORMANCE LIQUID CROMATOGRAPHY CROMATOGRAFIA LÍQUIDA DE ALTA PERFORMANCE CROMATOGRAFIA LÍQUIDA DE ALTO DESEMPENHO
 HIGH PERFORMANCE LIQUID CROMATOGRAPHY CROMATOGRAFIA LÍQUIDA DE ALTA PERFORMANCE CROMATOGRAFIA LÍQUIDA DE ALTO DESEMPENHO CROMATOGRAFIA LÍQUIDA DE ALTA EFICIÊNCIA (CLAE) 1 CONCEITOS E FUNDAMENTOS HPLC usa
HIGH PERFORMANCE LIQUID CROMATOGRAPHY CROMATOGRAFIA LÍQUIDA DE ALTA PERFORMANCE CROMATOGRAFIA LÍQUIDA DE ALTO DESEMPENHO CROMATOGRAFIA LÍQUIDA DE ALTA EFICIÊNCIA (CLAE) 1 CONCEITOS E FUNDAMENTOS HPLC usa
ANÁLISE TÉRMICA Sumário
 ANÁLISE TÉRMICA Sumário 1- Conceito 2- Tipos de métodos térmicos Princípios gerais de cada método Instrumentação Aplicações Conceito Análise Térmica é um termo que abrange um grupo de técnicas nas quais
ANÁLISE TÉRMICA Sumário 1- Conceito 2- Tipos de métodos térmicos Princípios gerais de cada método Instrumentação Aplicações Conceito Análise Térmica é um termo que abrange um grupo de técnicas nas quais
TÍTULO: INCORPORAÇÃO DE ÍONS LANTANÍDEOS EM MATRIZES OXIDAS DE 'YTTRIUM ALUMINIUM GARNET' OBTIDAS VIA ROTA SOL-GEL NAO HIDROLITICO.
 TÍTULO: INCORPORAÇÃO DE ÍONS LANTANÍDEOS EM MATRIZES OXIDAS DE 'YTTRIUM ALUMINIUM GARNET' OBTIDAS VIA ROTA SOL-GEL NAO HIDROLITICO. CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: Química
TÍTULO: INCORPORAÇÃO DE ÍONS LANTANÍDEOS EM MATRIZES OXIDAS DE 'YTTRIUM ALUMINIUM GARNET' OBTIDAS VIA ROTA SOL-GEL NAO HIDROLITICO. CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: Química
TP064 - CIÊNCIA DOS MATERIAIS PARA EP. FABIANO OSCAR DROZDA
 TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
Desenvolvimento de Materiais Híbridos com Aplicações Biomédicas. Prof. Joana Lancastre
 Desenvolvimento de Materiais Híbridos com Aplicações Biomédicas Prof. Joana Lancastre JULHO DE 2014 Introdução Os materiais híbridos são materiais constituídos por uma componente orgânica (polímero - PDMS)
Desenvolvimento de Materiais Híbridos com Aplicações Biomédicas Prof. Joana Lancastre JULHO DE 2014 Introdução Os materiais híbridos são materiais constituídos por uma componente orgânica (polímero - PDMS)
Estrutura Molecular, Ligações Químicas e Propriedades dos Compostos Orgânicos
 Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar Profa. Roberlucia A. Candeia Disciplina: Química Orgânica Estrutura Molecular, Ligações Químicas e Propriedades dos
Universidade Federal de Campina Grande Centro de Ciências e Tecnologia Agroalimentar Profa. Roberlucia A. Candeia Disciplina: Química Orgânica Estrutura Molecular, Ligações Químicas e Propriedades dos
Princípios fisico-químicos laboratoriais. Aula 08 Profº Ricardo Dalla Zanna
 Princípios fisico-químicos laboratoriais Aula 08 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 3 Química orgânica o Seção 3.1 Ligação e estrutura molecular o Seção 3.2 Funções orgânicas - Hidrocarbonetos
Princípios fisico-químicos laboratoriais Aula 08 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 3 Química orgânica o Seção 3.1 Ligação e estrutura molecular o Seção 3.2 Funções orgânicas - Hidrocarbonetos
SÍNTESE E CARACTERIZAÇÃO DE HIDRÓXIDOS DUPLOS LAMELARES PARA USO NO TRATAMENTO DE ÁGUAS CONTAMINADAS POR METAIS PESADOS
 UNIVERSIDADE FEDERAL DO PARÁ INSTITUTO DE GEOCIÊNCIAS PROGRAMA DE PÓS-GRADUAÇÃO EM GEOLOGIA E GEOQUÍMICA DISSERTAÇÃO DE MESTRADO SÍNTESE E CARACTERIZAÇÃO DE HIDRÓXIDOS DUPLOS LAMELARES PARA USO NO TRATAMENTO
UNIVERSIDADE FEDERAL DO PARÁ INSTITUTO DE GEOCIÊNCIAS PROGRAMA DE PÓS-GRADUAÇÃO EM GEOLOGIA E GEOQUÍMICA DISSERTAÇÃO DE MESTRADO SÍNTESE E CARACTERIZAÇÃO DE HIDRÓXIDOS DUPLOS LAMELARES PARA USO NO TRATAMENTO
SÍNTESE DE BETA FOSFATO TRICÁLCICO, POR REAÇÃO DE ESTADO SÓLIDO, PARA USO BIOMÉDICO
 SÍNTESE DE BETA FOSFATO TRICÁLCICO, POR REAÇÃO DE ESTADO SÓLIDO, PARA USO BIOMÉDICO T. C. S. PEREIRA 1, G. R. SANTOS 1 e G. A. FERNANDES 1 1 Universidade Federal de Itajubá, Instituto de Engenharia Mecânica
SÍNTESE DE BETA FOSFATO TRICÁLCICO, POR REAÇÃO DE ESTADO SÓLIDO, PARA USO BIOMÉDICO T. C. S. PEREIRA 1, G. R. SANTOS 1 e G. A. FERNANDES 1 1 Universidade Federal de Itajubá, Instituto de Engenharia Mecânica
INGREDIENTE ATIVO é o composto responsável pela eficácia biológica.
 ADJUVANTES DEFINIÇÕES INGREDIENTE ATIVO é o composto responsável pela eficácia biológica. ADJUVANTES - é qualquer substância contida numa formulação ou adicionada ao tanque que modifica a atividade herbicida
ADJUVANTES DEFINIÇÕES INGREDIENTE ATIVO é o composto responsável pela eficácia biológica. ADJUVANTES - é qualquer substância contida numa formulação ou adicionada ao tanque que modifica a atividade herbicida
Nanopartículas de Prata e. Curva de Calibração da Curcumina
 RELATÓRIODEAULAPRÁTICA Disciplina:NanotecnologiaFarmacêutica NanopartículasdePratae CurvadeCalibraçãodaCurcumina Grupo 4 Erick Nunes Garcia Fernanda Buzatto Gabriela do Amaral Gleicy Romão Manuela Pereira
RELATÓRIODEAULAPRÁTICA Disciplina:NanotecnologiaFarmacêutica NanopartículasdePratae CurvadeCalibraçãodaCurcumina Grupo 4 Erick Nunes Garcia Fernanda Buzatto Gabriela do Amaral Gleicy Romão Manuela Pereira
Aula de Bioquímica I. Tema: Água. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
FUNCIONALIZAÇÃO DA CELULOSE COM AMINOETANOTIOL
 FUNCIONALIZAÇÃO DA CELULOSE COM AMINOETANOTIOL Lucinaldo dos Santos Silva, Luiz de S. Santos Júnior, Maria Rita de M. C. Santos, José Milton E. de Matos, Ana Lúcia N. F. Oliveira, Edson C. da Silva Filho
FUNCIONALIZAÇÃO DA CELULOSE COM AMINOETANOTIOL Lucinaldo dos Santos Silva, Luiz de S. Santos Júnior, Maria Rita de M. C. Santos, José Milton E. de Matos, Ana Lúcia N. F. Oliveira, Edson C. da Silva Filho
REMOÇÃO DE ENXOFRE EM COMBUSTÍVEIS POR ADSORÇÃO EM MATERIAIS MESOPOROSOS ORDENADOS
 Departamento de Química REMOÇÃO DE ENXOFRE EM COMBUSTÍVEIS POR ADSORÇÃO EM MATERIAIS MESOPOROSOS ORDENADOS Maria Luiza de Melo Moreira E-mail: ml.moreira@ymail.com Maria Isabel Pais E-mail: isapais@puc-rio.br
Departamento de Química REMOÇÃO DE ENXOFRE EM COMBUSTÍVEIS POR ADSORÇÃO EM MATERIAIS MESOPOROSOS ORDENADOS Maria Luiza de Melo Moreira E-mail: ml.moreira@ymail.com Maria Isabel Pais E-mail: isapais@puc-rio.br
Polaridade, Geometria Molecular e Forças Intermoleculares
 Polaridade, Geometria Molecular e Forças Intermoleculares Polaridade das Ligações x Polaridade das Moléculas Polaridade das Ligações Ligações covalentes Apolares: elétrons são compartilhados igualmente
Polaridade, Geometria Molecular e Forças Intermoleculares Polaridade das Ligações x Polaridade das Moléculas Polaridade das Ligações Ligações covalentes Apolares: elétrons são compartilhados igualmente
FUVEST 2015 (Questões 1 a 6)
 (Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
(Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
SÍNTESE E CARACTERIZAÇÃO DE COMPLEXOS DE POLIAMINAS COM METAIS DE INTERESSE BIOLÓGICO
 SÍNTESE E CARACTERIZAÇÃO DE COMPLEXOS DE POLIAMINAS COM METAIS DE INTERESSE BIOLÓGICO Aluno: Marta Cristina de Brito Sousa Orientador: Judith Felcman Introdução A fosfocreatina (PC), assim como o ATP,
SÍNTESE E CARACTERIZAÇÃO DE COMPLEXOS DE POLIAMINAS COM METAIS DE INTERESSE BIOLÓGICO Aluno: Marta Cristina de Brito Sousa Orientador: Judith Felcman Introdução A fosfocreatina (PC), assim como o ATP,
Estrutura atômica e ligação interatômica. Profa. Daniela Becker
 Estrutura atômica e ligação interatômica Profa. Daniela Becker Referências Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 2, 2002. Shackelford, J.F. Ciências dos
Estrutura atômica e ligação interatômica Profa. Daniela Becker Referências Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 2, 2002. Shackelford, J.F. Ciências dos
Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica
 Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica Avaliação para Seleção de Mestrado em Agroquímica - 2017.I Número ou código do(a) candidato(a): INSTRUÇÕES
Universidade Federal de Viçosa Departamento de Química Programa de Pós-Graduação em Agroquímica Avaliação para Seleção de Mestrado em Agroquímica - 2017.I Número ou código do(a) candidato(a): INSTRUÇÕES
NANOPARTÍCULAS DE CARBONO: SÍNTESE E PROPRIEDADES*
 NANOPARTÍCULAS DE CARBONO: SÍNTESE E PROPRIEDADES* Claudilene Ribeiro Chaves 1 Anderson Caires de Jesus 2 Bárbara Brenda de Almeida Costa 3 Ana Maria de Paula 4 Luiz Alberto Cury 4 Luiz Orlando Ladeira
NANOPARTÍCULAS DE CARBONO: SÍNTESE E PROPRIEDADES* Claudilene Ribeiro Chaves 1 Anderson Caires de Jesus 2 Bárbara Brenda de Almeida Costa 3 Ana Maria de Paula 4 Luiz Alberto Cury 4 Luiz Orlando Ladeira
Estrutura de Lewis, Formas de representação e Interações intermoleculares. Aula 2
 Universidade Federal de Ouro Preto Estrutura de Lewis, Formas de representação e Interações intermoleculares Aula 2 Flaviane Francisco ilário 1 1 Estrutura de Lewis Um símbolo de Lewis é um símbolo no
Universidade Federal de Ouro Preto Estrutura de Lewis, Formas de representação e Interações intermoleculares Aula 2 Flaviane Francisco ilário 1 1 Estrutura de Lewis Um símbolo de Lewis é um símbolo no
Isaque Cardoso da Silva. Propriedades de Catalisadores de Mo-SnO 2 e o Efeito da Adição de Sódio
 Isaque Cardoso da Silva Propriedades de Catalisadores de Mo-SnO 2 e o Efeito da Adição de Sódio Dissertação de Mestrado Dissertação apresentada ao Programa de Pós-graduação em Química da PUC-Rio como requisito
Isaque Cardoso da Silva Propriedades de Catalisadores de Mo-SnO 2 e o Efeito da Adição de Sódio Dissertação de Mestrado Dissertação apresentada ao Programa de Pós-graduação em Química da PUC-Rio como requisito
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I
 Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
PREPARAÇÃO E CARACTERIZAÇÃO DO COMPÓSITO NANOTUBOS DE CARBONO/FERRITA POR PROCESSO HIDROTÉRMICO.
 PREPARAÇÃO E CARACTERIZAÇÃO DO COMPÓSITO NANOTUBOS DE CARBONO/ERRITA POR PROCESSO HIDROTÉRMICO. E. L. oletto 1 ; J. S. Salla 1 ; J. S. Oliveira 1 1-Departamento de Engenharia Química Universidade ederal
PREPARAÇÃO E CARACTERIZAÇÃO DO COMPÓSITO NANOTUBOS DE CARBONO/ERRITA POR PROCESSO HIDROTÉRMICO. E. L. oletto 1 ; J. S. Salla 1 ; J. S. Oliveira 1 1-Departamento de Engenharia Química Universidade ederal
INFLUÊNCIA DA FONTE DE SÍLICA NA ESTABILIDADE DA CTA-MCM-41 UTILIZADA EM TRANSESTERIFICAÇÃO CATALÍTICA
 INFLUÊNCIA DA FONTE DE SÍLICA NA ESTABILIDADE DA CTA-MCM-41 UTILIZADA EM TRANSESTERIFICAÇÃO CATALÍTICA I. W. ZAPELINI, P. P. MODESTO, L. L. da SILVA, A. F. Campos e D. CARDOSO 1 Universidade Federal de
INFLUÊNCIA DA FONTE DE SÍLICA NA ESTABILIDADE DA CTA-MCM-41 UTILIZADA EM TRANSESTERIFICAÇÃO CATALÍTICA I. W. ZAPELINI, P. P. MODESTO, L. L. da SILVA, A. F. Campos e D. CARDOSO 1 Universidade Federal de
SÍNTESE DE PIGMENTOS DE ALUMINA/FERRO RESUMO
 SÍNTESE DE PIGMENTOS DE ALUMINA/FERRO R.C. L. Zampieri, E. Longo, E. R. Leite Via Washington Luiz, Km. 235 - Caixa Postal 676; CEP 13.565-905 - São Carlos - SP Brasil renatacl@dq.ufscar.br CMDMC - LIEC/DQ/UFSCar
SÍNTESE DE PIGMENTOS DE ALUMINA/FERRO R.C. L. Zampieri, E. Longo, E. R. Leite Via Washington Luiz, Km. 235 - Caixa Postal 676; CEP 13.565-905 - São Carlos - SP Brasil renatacl@dq.ufscar.br CMDMC - LIEC/DQ/UFSCar
ORGANOFUNCIONALIZAÇÃO DA ARGILA FIBROSA SEPIOLITA COM 3- CLOROPROPILTRIETROXISILANO VIA MÉTODO SOL-GEL
 ORGANOFUNCIONALIZAÇÃO DA ARGILA FIBROSA SEPIOLITA COM 3- CLOROPROPILTRIETROXISILANO VIA MÉTODO SOL-GEL Hugo Baldan Junior 1 ; Evane Silva 2 ; Kátia Jorge Ciuffi 3 ; Emerson Henrique de Faria 4. RESUMO
ORGANOFUNCIONALIZAÇÃO DA ARGILA FIBROSA SEPIOLITA COM 3- CLOROPROPILTRIETROXISILANO VIA MÉTODO SOL-GEL Hugo Baldan Junior 1 ; Evane Silva 2 ; Kátia Jorge Ciuffi 3 ; Emerson Henrique de Faria 4. RESUMO
a) ( ) 7,7 ml b) ( ) 15,1 ml c) ( ) 20,7 ml d) ( ) 2,8 ml Resposta Questão 01 Gabarito Questão 1) alternativa C.
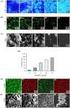 QUESTÕES DE ÂMBITO GERL Questão 01: Sabendo que a pureza do HCl concentrado é de 37%, sua massa molar é de 36,46 g mol -1 e sua densidade é de 1,19 g ml -1, pode-se afirmar que o volume de HCl concentrado
QUESTÕES DE ÂMBITO GERL Questão 01: Sabendo que a pureza do HCl concentrado é de 37%, sua massa molar é de 36,46 g mol -1 e sua densidade é de 1,19 g ml -1, pode-se afirmar que o volume de HCl concentrado
Terapia Ocupacional. Fisilogia
 Curso: Terapia Ocupacional Disciplina: Fisilogia Aula: Membrana Plasmática Profº. Ms. Rafael Palhano Fedato rafapalha@gmail.com Membrana Plasmática ou Membrana celular É uma dupla camada de lipídios com
Curso: Terapia Ocupacional Disciplina: Fisilogia Aula: Membrana Plasmática Profº. Ms. Rafael Palhano Fedato rafapalha@gmail.com Membrana Plasmática ou Membrana celular É uma dupla camada de lipídios com
Química 2º Ano. Professora Cristina Lorenski Ferreira
 Química 2º Ano Professora Cristina Lorenski Ferreira 2016 1 GEOMETRIA MOLECULAR POLARIDADE DAS MOLÉCULAS INTERAÇÕES INTERMOLECULARES PROFESSORA CRISTINA LORENSKI FERREIRA 2 ALGUNS QUESTIONAMENTOS Como
Química 2º Ano Professora Cristina Lorenski Ferreira 2016 1 GEOMETRIA MOLECULAR POLARIDADE DAS MOLÉCULAS INTERAÇÕES INTERMOLECULARES PROFESSORA CRISTINA LORENSKI FERREIRA 2 ALGUNS QUESTIONAMENTOS Como
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 02 Determinar a polaridade de cada ligação e da molécula como um todo CCl 4 HCCl 3 C 2 H
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 02 Determinar a polaridade de cada ligação e da molécula como um todo CCl 4 HCCl 3 C 2 H
6 RESULTADOS E DISCUSSÃO
 6 RESULTADOS E DISCUSSÃO Nesta seção serão apresentados e discutidos os resultados em relação à influência da temperatura e do tempo espacial sobre as características dos pósproduzidos. Os pós de nitreto
6 RESULTADOS E DISCUSSÃO Nesta seção serão apresentados e discutidos os resultados em relação à influência da temperatura e do tempo espacial sobre as características dos pósproduzidos. Os pós de nitreto
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 UNIVERSIDADE FEDERAL D CEARÁ CENTR DE CIÊNCIAS DEPARTAMENT DE QUÍMICA RGÂNICA E INRGÂNICA PRGRAMA DE PÓS-GRADUAÇÃ EM QUÍMICA ANTNIA FLÁVIA JUSTIN UCHÔA SÍNTESE DE SÍLICA MESPRSA SBA 15 FUNCINALIZADA PARA
UNIVERSIDADE FEDERAL D CEARÁ CENTR DE CIÊNCIAS DEPARTAMENT DE QUÍMICA RGÂNICA E INRGÂNICA PRGRAMA DE PÓS-GRADUAÇÃ EM QUÍMICA ANTNIA FLÁVIA JUSTIN UCHÔA SÍNTESE DE SÍLICA MESPRSA SBA 15 FUNCINALIZADA PARA
Ressonância, Formas de respresentação de moléculas orgânicas, Forças intermoleculares. Aula 3
 Universidade Federal de uro Preto Ressonância, Formas de respresentação de moléculas orgânicas, Forças intermoleculares Aula 3 Flaviane Francisco ilário 1 1 Ressonância ESTRUTURA DE LEWIS Explica de maneira
Universidade Federal de uro Preto Ressonância, Formas de respresentação de moléculas orgânicas, Forças intermoleculares Aula 3 Flaviane Francisco ilário 1 1 Ressonância ESTRUTURA DE LEWIS Explica de maneira
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS. Enzimas. Prof. Me. Cássio Resende de Morais
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
CROMATOGRAFIA EM CAMADA DELGADA ( CCD) Bruno Henrique Ferreira José Roberto Ambrósio Jr.
 CROMATOGRAFIA EM CAMADA DELGADA ( CCD) Bruno Henrique Ferreira José Roberto Ambrósio Jr. CROMATOGRAFIA Método usado para separar, identificar e quantificar componentes de uma mistura; Método físico-químico
CROMATOGRAFIA EM CAMADA DELGADA ( CCD) Bruno Henrique Ferreira José Roberto Ambrósio Jr. CROMATOGRAFIA Método usado para separar, identificar e quantificar componentes de uma mistura; Método físico-químico
SÍNTESE E CARACTERIZAÇÃO DE CATALISADORES DE Co e Fe PARA REAÇÃO DE SÍNTESE DE FISCHER-TROPSCH.
 SÍNTESE E CARACTERIZAÇÃO DE CATALISADORES DE Co e Fe PARA REAÇÃO DE SÍNTESE DE FISCHER-TROPSCH. Aluna: Bárbara Carlos Bassane Orientadora: Maria Isabel Pais Introdução A demanda mundial por energia limpa
SÍNTESE E CARACTERIZAÇÃO DE CATALISADORES DE Co e Fe PARA REAÇÃO DE SÍNTESE DE FISCHER-TROPSCH. Aluna: Bárbara Carlos Bassane Orientadora: Maria Isabel Pais Introdução A demanda mundial por energia limpa
