Preparação para Exame Laboratorial de Tecnologia Farmacêutica III /2003 Trabalho III
|
|
|
- Eliza Wagner da Cunha
- 7 Há anos
- Visualizações:
Transcrição
1 Preparação para Exame Laboratorial de Tecnologia Farmacêutica III - 00/003 Trabalho III 1. Solução de hipoclorito de sódio Cal clorada... 18,5 g Carbonato de sódio crist... 17,3 g Bicarbonato de sódio... 7,6 g Água destilada g As quantidades indicadas na fórmula correspondem à cal clorada com 30 % de cloro activo; quando o teor desta for diferente empregue as quantidades indicadas na Tabela XVI (F.P.IV). ATENÇÃO - a parte apresentada da preparação deste trabalho não é necessária visto que apenas nos é dada uma solução para ensaiar o título; assim see essa solução tiver título a mais têm de acertar com água; se tiver a menos o produto é simplesmente rejeitado. Sendo assim, tudo o que estiver em fundo cinzento é dispensável!!!!!! Ensaio (que não vai ser muito aprofundado por se tratar de uma simples volumetria) b)dilua 10 ml de solução de hipoclorito de sódio com 50 ml de água, junte 0 ml de solução de iodeto de potássio, 10 ml de ácido clorídrico diluído e n' ml de hipossulfíto de sódio N/10 até que no líquido se não vejam vestígios de cor amarela. A solução de hipoclorito de sódio (solução de Dakin) é usada como desinfectante, propriedade que lhe é conferida pelo cloro activo. A solução de hipoclorito de sódio pode-se obter a partir de uma solução mais concentrada ou através da seguinte reacção: cal clorada+ carbonato de sódio(na CO 3 )+ Bicarbonato de sódio(nahco 3 ) MaClO+NaCl+NaOH+CaCO 3 Cal clorada= cloreto de cálcio (CaCl )+oxocloreto de cálcio (CaCl O)+ perclorato de cálcio (Ca(ClO) 4 )+Ca(OH) +Ca(ClO) + Como a solução de hipoclorito de sódio é usada como um desinfectante para aplicar na pele, deve obedecer a determinados requisitos: deve ser neutra o NaHO que se forma na reacção tem de ser neutralizado com um ácido, pois uma solução muito alcalina é cáustica, lesando a pele (daí se adicionar ácido Bórico!!); a concentração de cloro activo deve ser 4,8 g/l - o cloro é bastante tóxico e, como tal, deve obedecer ao limite estabelecido na Farmacopeia; teríamos assim que dosear o cloro activo na solução, e não estiver dentro dos limites fazem-se correcções do título. Medicamento: Solução de Hipoclorito de sódio Teor em substancias activas: 100 ml (g ou unidades) contêm 0,48 g (ml) de Cloro activo ( segundo os limites teóricos dados pela Farmacopeia)
2 Forma Farmacêutica: Solução Número do lote: ( só se disserem!) Data de preparação: (dia do fatídico exame...) a preparar: podem pedir para preparar qualquer quantidade; vai usar-se o exemplo em que se preparou 100 g da fórmula. Matérias-Primas N º do lote Origem Farmacopeia para 100 g (ml ou unidades) Qnantidade calculada Cal clorada - Ver - 1,61 g 1,61 g Carbonato de sódio - Ver - 1,51 g 1,51 g crist. Bicarbonato de - ver - 0,66 g 0,66 g sódio Água destilada - Lab: TEC III - 96, 96, g pesada Aquilo que aparece na balança... Técnica operatória Arranjar material essencial para a preparação: Cápsula, vareta, papel costaneira, proveta rolhada, gobelé, funil com algodão de vidro; provetas; para o ensaio precisam de material para uma volumetria (indirecta de oxidação/redução): bureta, pipeta volumétrica de 10 ml, provetas de 50 ml, 5 ml, 10 ml, matraz de boca larga 1. Pesagem da cal clorada ( 9,5 g em papel) e transferência para a cápsula. Pesagem de parte da água e adição à cal clorada ( medir 36, ml de água em proveta e colocar na cápsula) 3. Maceração durante 1 hora em vaso tapado ( agitar vigorosamente com vareta e tapar com um papel costaneira/parafilme) 4. Pesagem de carbonato de sódio cristalizado ( 1,51g em papel) 5. Pesagem do Bicarbonato de sódio (0,66g em papel) 6. Pesagem da água restante (60 ml de água em proveta) 7. Dissolução dos carbonatos pesados anteriormente ( transferir os pós para gobelé com a água e dissolver com uma vareta) 8. Reunião das duas soluções ( na cápsula adicionar a solução dos carbonatos e com agitação, após o período de maceração) 9. Decantação e filtração( decantar e filtrar por algodão de vidro para a proveta rolhada porque para acertarmos o título temos de ter um valor conhecido e já obtivemos perdas) Ensaio1. Medição de uma toma de 10ml de solução (muito rigoroso e colocar a toma num matraz de boca larga; temos de ter em atenção a diluição efectuada). Adição de 0 ml de iodeto de potássio (proveta) 3. Adição de 10 ml de ác. Clorídrico (proveta) 4. Titulação com tiossulfato de sódio N/10 (com bureta claro!!!)
3 Aparelhagem usada (preparação): Balança Semi-analítica, analítica Tipo de embalagem: Frasco de vidro castanho bem fechado Capacidade do recipiente: depende do que for dito... Condições de conservação Condições de conservação: Ao abrigo do ar e da luz Rotulagem Menções a constar do rótulo: Solução de Dakin desinfectante USO EXTERNO Contém 4,8 g/l de cloro activo. Conservar fechado ao abrigo da luz Prazo de utilização Manter fora do alcance das crianças Verificação Ensaio Especificação Resultado Aspecto Líquido incolor (?) conforme ph ph neutro conforme Teor (volumetria simples) Teor em cloro activo de 4,8g/L conforme (todo o tipo de ensaios organolépticos que achem importantes de mencionar) Operador Cálculos Neste trabalho, são exigidos dois ensaios: um que não foi realizado (a) e que não é mais que a verificação do ph alcalino para posterior acerto com Ác. Bórico ( já que para aplicar na pele o ph tem de ser adequado) ver PRISTA pág. 991/ ou sebenta Lab. TEC. III para pormenores... e o ensaio de teor em cloro activo (b) que foi realizado. As reacções químicas regen-se pelas seguintes equações: KI + Cl I + KCl I + Na S 0 3 NaI + Na S 4 O 6 Os cálculos estão a seguir ( estão do meu modo): 4,8g 1000ml x 10ml( toma) x = 0,048g 0,048g moles( Cl ) = = 6, ,9g( MA _ Cl ) Assim, 6, ,1N 1000ml _ S 1, x = 13,5ml = 1,35 10 x 3 O 3 eq _ S O 3 4 mol Primeiro foi feito o cálculo do valor teórico, sabendo-se que 1 equivalente está para metade da mol, e daí aquele factor!
4 Após titulação gastamos 16 ml, o que indica que o teor é superior ao esperado. Temos de saber o teor actual para sabermos a quantidade de água a adicionar e acertar o título: 3 16ml 0,1mol = 1,6 10 mols O PARa _ mol 1,6 10 8, ,9 = 0,0567g 0, ml x 1000ml = 8,0 10 mol _ Cl x = 5,67g / L Agora temos de fazer o cálculo para saber o volume a adicionar para ficarmos com o título adequado: ,7 ( x) 4, = ,8x x = 187,5 em _1000ml x 15( resto) = 187,5ml x =,8ml Assim, teríamos de adicionar,8 ml aos 15 que nos pediram para acertar para ter o título adequado; embora este volume na aula fosse de água, nos casos em que temos de acertar o ph este volume seria o de água mais o Ác. usado na neutralização. Após isto a solução era guardada no frasco adequado. Observações As observações prendem-se a relatar o resultado dos ensaios realizados e sua posterior correcção, no caso das soluções com título inferior relatar aqui que foi esse o motivo da rejeição do produto; outros casos pontuais devem ser mencionados.. Solução de peróxido de hidrogénio Água oxigenada Prepare 50 ml de água oxigenada a 10 volumes. Deve conter no mínimo 3 e no máximo 3,3 % de H 0, doseado do seguinte modo: Dilua 10 ml de solução em tanta água quanto baste para que o produto perfaça 100 ml e a 10 ml do liquido junte igual volume de ácido sulfúrico diluído e solução decinormal de permanganato de potássio até que adquira cor rósea persistente. Calcule a percentagem multiplicando o número de ml gastos de solução de permanganato por 0,170. A solução com 3% de peróxido de hidrogénio liberta aproximadamente 10 vezes o seu volume de oxigénio à pressão e temperatura normais (Convém salientar que os limites da F.P. VII é no mínimo,5% e no máximo 3,5% e, portanto, se o valor cair dentro deste intervalo temos uma Água oxigenada conforme a F.P.) ,8
5 A água oxigenda é um vulgar antiséptico e desinfectante de feridas; tem um aspecto incolor, límpido, inodoro ou de cheiro que lembra o do ozono; tem um sabor levemente metálico e ácido espumando fortemente na boca. Decompõe-se rapidamente por acçção do calor, libertando O. A preparação é feita a partir do Peridrol que é uma solução mãe de peróxido de hidrogénio mais concentrada (e corrosiva daí que o uso de luvas é aconselhável).o doseamento segue as normas da F.P.VII (pelo que podem consultá-la por via das dúvidas). Medicamento: Solução de Peróxido de Hidrogénio Teor em substancias activas: 100 ml (g ou unidades) contêm 3 (ml) de peróxido de Hidrogénio( equivalente a 1000 ml de O libertado) (uma vez que é uma solução a 3% e sabemos que esta solução liberta 10x o seu volume em oxigénio nas condições de pressão e temperatura normais) Forma Farmacêutica: Solução Número do lote: ( só se disserem!) Data de preparação: (dia do fatídico exame...) a preparar: podem pedir para preparar qualquer quantidade; esta técnica é explícita: 50 ml Matérias-Primas N º do lote Origem Farmacopeia para 100 g (ml ou unidades) Qnantidade calculada Peridrol - Ver - 10 ml 5 ml Água destilada - Lab: TEC III - q.b.p. 100 ml q.b.p. 50 ml pesada - Técnica operatória Arranjar material essencial para a preparação: proveta 50 ml rolhada, pipeta volumétrica/graduada de 5 ml, pipeta de Pasteur; ensaio: material de volumetria matraz médio boca larga, bureta, balão volumétrico de 100 ml, 3 pipetas de 10 ml 1. Medição do Peridrol ( 5 ml rigorosos em pipeta colocando em proveta de 50 ml rolhada). Acerto do volume final ( acertar rigorosamente com água até 50 ml) 3. Homogeneizar (por inversão da proveta; após isto deixar alguns minutos em repouso para haver uma homogeneização eficiente!!) 4. Realização do doseamento (medir 10 ml em pipeta e colocar em balão volumétrico aferido de 100 ml; daqui com pipeta retirar 10 ml de solução e colocar no matraz; adicionar ao matraz 10 ml de ácido sulfúrico- para acidificar em pipeta - poderá ser em proveta;titular então com o permanganato até coloração rósea persistente) Aparelhagem usada: - Tipo de embalagem: Frasco de plástico/vidro rolhado Capacidade do recipiente: depende do que for dito...
6 Condições de conservação Condições de conservação: em recipientes incompletamente cheios, rolhados e em lugar fresco Rotulagem Menções a constar do rótulo: Água oxigenada 10 volumes antisséptico USO EXTERNO Contém 3% de peróxido de hidrogénio Conservar fechado em local fresco Prazo de utilização Manter fora do alcance das crianças Verificação Ensaio Especificação Resultado Aspecto Líquido incolor conforme Odor Inodoro ou com cheiro que lembra ozono conforme Sabor Ácido e metálico conforme Teor Deve conter no mínimo 3 e, no máximo, 3,3,% de conforme H O (todo o tipo de ensaios organolépticos que achem importantes de mencionar) Operador Cálculos Neste trabalho, é exigido um ensaio de dosemanto: assim vamos determinar o título da nossa Água oxigenada para depois a acertarmos. A primeira coisa antes de efectarmos o ensaio é sabermos os ml de Peridrol a utilizar. Assim, 1ml(10v) 10mlO 50ml( tecnica) x x = 500mlO Peridrol 1ml( peridrol) 100mlO x 500mlO x = 5ml _ peridrol Depois então de preparar a água oxigenada, vamos fazer o doseamento. Para isso temos de ter ideia o valor de titulante teórico a utilizar: M ( H O ) = 68g 988mlO 100ml 68g 400mlO x 1ml Consideramos 1 ml porque 3g( de _ 3%) x x = 9,88mlO x = 988mlO houve uma diluição! Após isto em vez de recorrermos a reacções químicas para fazermos os cálculos das proporções podemos consultar a F.P.VII para ver as quantidades correspondentes ao titulante e titulado. Assim temos que 0,1N de
7 permanganato correspondem a 0,0M; além disso 1 ml desta solução de permanganato corresponde a 1,701 mg de H O ou 0,56 ml de O. Deste modo: 1mlKMnO4 0,56mlO x 9,88mlO Por outro lado podemos calcular isto de outra forma: se x = 17,6ml sabemos que, para sabermos a % basta multiplicar o volume de titulante por 0,170 então se dividirmos 3,0% por 0,170 temos um valor teórico: 17,6 ml. Atenção que ele pode pedir com volumagem diferente!! Assim usem a regra do 68g 400 ml oxígénio e a fórmula de (permanganato 0,1) 17g (corresponde a metade da massa e a 1 equivalente de peróxido) e conseguem chegar lá facilmente; para saberem a vossa percentagem na primeira fórmula dá uma massa da ordem dos 0,03 g... multiplicam por 100 e é a vossa % visto que os cálculos estão para 1 ml. Após titulação, chegamos, no caso da nossa aula, a um valor de titulante de 19,75 ml. Ora, 19,75 x 0,170 = 3,4%. Segundo este valor temos uma água oxigenada dentro dos limites da F.P. Mas agora vejamos: se hipoteticamente o valor tivesse sido 1,6 ml x 0,170 = 3,7 %. Temos então um valor elevado e queremos que o resto da solução que preparamos tenha 3,0 %. Se usamos no ensaio 10 ml restam-nos 40 ml.assim: 3, ,7 (100 + x) x = 370 x = 3,3ml em _100ml x 40( resto) x = 9,3ml 70 3 = 3,3ml Assim, teríamos de adicionar 9,3 ml de água aos 40 de solução que tínhamos na proveta para ter o título adequado; nos casos é que dá a menos (%) torna-se necessário recorrer a uma solução mais concentrada para acertar o título determinando a quantidade de moles de H O a adicionar e juntando aos 40 ml o volume dessa solução adequado. Observações As observações prendem-se a relatar o resultado dos ensaios realizados e sua posterior correcção; outros casos pontuais devem ser mencionados. 3. Prepare 50 ml de solução de timerosal Timerosal l g Álcool ml Acetona 100 ml Eosina l g Água purificada.q.b.p ml A solução de Timerosal é usada externamente como anti-séptico. O Timerosal é um composto bem tolerado pelos tecidos que apresenta uma elevada potência
8 bactériostática e fungistática, razões que explicam o seu uso como anti-séptico (Metriolato); a Eosina é um corante para visualisar as feridas; o álcool é o veículo do timerosal e vai incorporá-lo; a Acetona vai dissolver o corante (que pode ou não estar presente). A técnica tem como truque juntar a acetona+eosina e à parte álcool+timerosal juntando-se posteriormente esta àquela mas não na totalidade pois isto favorece a miscibilidade ( da solução corada provavelmente...); depois junta-se tudo com a água. Medicamento: Solução de Timerosal Teor em substancias activas: 100 ml (g ou unidades) contêm 0,1g (ml) de Timerosal (uma vez que é a fórmula está para 1000 ml totais) Forma Farmacêutica: Solução Número do lote: ( só se disserem!) Data de preparação: (dia do fatídico exame...) a preparar: podem pedir para preparar qualquer quantidade; na aula foi preparada 1/0 da fórmula. Matérias-Primas N º do lote Origem Farmacopeia para 100 g (ml ou unidades) Qnantidade calculada Timerosal ver Ver - 0,1 g 0,05 g Álcool 90º - Ver - 50 ml 5 ml Acetona - Ver - 10 ml 5 ml Eosina ver Ver - 0,1 g 0,05 g Água purificada - Lab: TEC III - q.b.p. 100 ml q.b.p. 50 ml pesada O que pesarem na balança... Técnica operatória Arranjar material essencial: proveta 50 ml rolhada, papel vegetal, espátula, dois copos médios, varetas, pipeta de pasteur, proveta de 5 ml, proveta de 10 ml 1. Medição do álcool 90º ( 5 com proveta ). Pesagem do Timerosal ( 0,05g em papel vegetal colocando logo num gobelé ou vidro de relógio) 3. Dissolução do Timerosal em Álcool 90º (colocar o álcool nesse gobelé e agitar com vareta até dissolução total) 4. Pesagem da Eosina (0,05g em papel vegetal e colocar no outro gobelé) 5.Medição da Acetona (5 ml em proveta) 6.Dissolução da eosina em acetona (juntar a acetona ao gobelé e agitar com vareta até dissolução completa) 7. Mistura da solução de eosina com a solução de timerosal e lavagem do copo (adicionar a solução incolor à solução corada com cuidado e não toda de uma vez;lavar o copo com um pouco de água) 8. Tranferência para proveta e acerto do volume (transfere-se para a proveta rolhada, e acerta-se com água lavando se possível o copo com parte da água restante; acertar pelos 50
9 ml) 9.Homogeneização e filtração (homogeneizar por inversão e filtrar por algodão de vidro porque o timerosal ataca o papel) Aparelhagem usada: Balança analítica Tipo de embalagem: Frasco de vidro escuro rolhado com vedante Capacidade do recipiente: depende do que for dito... Condições de conservação Condições de conservação: (?)bem fechado, ao abrigo da luz e em lugar fresco Rotulagem Menções a constar do rótulo: Solução de Timerosal anti-séptico USO EXTERNO Contém 0,1g de timerosal por cada 100 ml. Conservar fechado em local fresco e ao abrigo da luz Prazo de utilização Manter fora do alcance das crianças Verificação Ensaio Especificação Resultado Aspecto Líquido côr laranja conforme Odor Cheiro característico... conforme (todo o tipo de ensaios organolépticos que achem importantes de mencionar) Operador Cálculos Neste trabalho os únicos cálculos são regras de 3 para calcular as quantidades por 100 ml e para 1/0 da fórmula pedido. Observações Relatar casos pontuais do trabalho Solução de hidróxido de cálcio Água de cal Óxido de cálcio... 0 g Água destilada g Guarde em frasco rolhado. Filtre só na ocasião de emprego. A água de cal pode ser usada quer internamente como antidiarreico como externamente para o tratamento de queimaduras, depois de adicionado a óleos (caso do linimento óleo-calcário 50g de CaOH + 50g de Óleo de amendoim, não
10 necessitando de agente emulsivo devido à auto emulsão...).é a única solução da F.P. IV que é saturada e deve permanecer saturada até ao momento de emprego, para que não ocorram perdas de cálcio devido ao oxigénio do ar, que levam à formação de ácido carbónico. A fórmula dá para fazer 1000 g de água de cal, pois das 000g de água 1000 são rejeitadas( os 50 ml da hidratação da água de lavagem que dissolve as impurezas). Conforme o nº. de águas de lavagem temos águas de cal de 1ª, de ª e de 3ª sendo esta ultima a mais pura das 3 e aumentando a pureza com o nº. de lavagens como é óbvio. Medicamento: Solução de Hidróxido de Cálcio Teor em substancias activas: 100 ml (g ou unidades) contêm 1,86 (ml) de Hidróxido de Cálcio (valor visto no Prista e porque se trata de uma solução saturada) Forma Farmacêutica: Solução Número do lote: ( só se disserem!) Data de preparação: (dia do fatídico exame...) a preparar: podem pedir para preparar qualquer quantidade; preparouse na aula 1/10 da fórmula. Matérias-Primas N º do lote Origem Farmacopeia para 100 g (ml ou unidades) Qnantidade calculada Óxido de Cálcio - Ver - 1 g g Água destilada - Lab: TEC III - 100g 00g pesada O que pesarem... É um pouco esquisito que para cada 100 g tenhamos em componentes! Mas temos de ter em conta que fica um depósito no final que vai manter a solução saturada...estes cálculos tem como base as quantidades de 1/0 da fórmula. Técnica operatória Arranjar material essencial para a preparação: vaso de louça (tipo caneca), vareta, proveta 1. Pesagem do Óxido de Cálcio (g em papel e transferir para vaso de loiça). Hidratação do óxido de cálcio ( adicionar cerca de 5 ml de água aos poucos para hidratar e com agitação) 3. Adição da água de lavagem e agitação (adicionar aos poucos os restantes 95 ml e agitar fortemente) 4. Repouso durante horas (deixar em repouso tendo o cuidado de agitar de 15 em 15 minutos; tapar com papel costaneira) 5.Decantação e rejeição da água de lavagem (decantar com cuidado desprezando o líquido) 6. Adição da água restante e acondicionamento (adicionar os outros 100 ml de água e transferirpara recipiente adequado) Aparelhagem usada: Balança semi-analítica Tipo de embalagem: Frasco de vidro escuro rolhado bem cheio Capacidade do recipiente: depende do que for dito...
11 Condições de conservação Condições de conservação: em recipientes bem cheios, rolhados e ao abrigo da luz Rotulagem Menções a constar do rótulo: Água de cal antidiarreico USO INTERNO Contém 1,68% de hidróxido de cálcio Conservar fechado ao abrigo da luz Prazo de utilização Manter fora do alcance das crianças Agitar e filtrar antes de usar Verificação Ensaio Especificação Resultado Aspecto Líquido incolor ou ligeira/ turvo com depósito de conforme partículas brancas cristalinas quando em repouso Odor Odor típico a cal (?) conforme Teor Deve apresentar-se saturada em hidróxido de cálcio conforme (todo o tipo de ensaios organolépticos que achem importantes de mencionar) Operador Cálculos São precisos apenas para calcular as quantidades por 100 g e para o 1/10 da fórmula pedido. Observações Pode referir-se que trata de uma água de 1ª devido a existir apenas uma lavagem; outros casos pontuais devem ser mencionados.
AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta
 3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
Titulação de cálcio e magnésio no leite com EDTA. Ilustrar: Titulação por retorno Titulação complexométrica, com EDTA
 TRABALHO PRÁTICO Titulação de cálcio e magnésio no leite com Ilustrar: Titulação por retorno Titulação complexométrica, com PARTE EXPERIMENTAL Procedimento para determinação do teor de cálcio mais magnésio
TRABALHO PRÁTICO Titulação de cálcio e magnésio no leite com Ilustrar: Titulação por retorno Titulação complexométrica, com PARTE EXPERIMENTAL Procedimento para determinação do teor de cálcio mais magnésio
Alexandra Silva Fernandes
 Alexandra Silva Fernandes APL 2.1. 1ª parte Soluções como se preparam? Problema: Como preparar 50,0 cm 3 de um solução aquosa de tiossulfato de sódio 0,030 mol.dm 3? Como preparar uma solução, a partir
Alexandra Silva Fernandes APL 2.1. 1ª parte Soluções como se preparam? Problema: Como preparar 50,0 cm 3 de um solução aquosa de tiossulfato de sódio 0,030 mol.dm 3? Como preparar uma solução, a partir
Preparação para Exame Laboratorial de Tecnologia Farmacêutica III /2003 Trabalho V Suspensões 1. Avaliação de diversoso agentes supensores
 Preparação para Exame Laboratorial de Tecnologia Farmacêutica III - 2002/2003 Trabalho V Suspensões Quando falámos em suspensões estamos a falar de sistemas heterogéneos em que a fase externa ou contínua
Preparação para Exame Laboratorial de Tecnologia Farmacêutica III - 2002/2003 Trabalho V Suspensões Quando falámos em suspensões estamos a falar de sistemas heterogéneos em que a fase externa ou contínua
QUÍMICA FARMACÊUTICA II
 2016-2017 QUÍMICA FARMACÊUTICA II MÓDULO DE QUÍMICA FARMACÊUTICA INORGÂNICA SÉRIE LABORATORIAL Aulas 2 e 3 Monografia KBr (Farmacopeia Portuguesa 9) PLANO DAS AULAS LABORATORIAIS 2 e 3 (Q.F. Inorgânica):
2016-2017 QUÍMICA FARMACÊUTICA II MÓDULO DE QUÍMICA FARMACÊUTICA INORGÂNICA SÉRIE LABORATORIAL Aulas 2 e 3 Monografia KBr (Farmacopeia Portuguesa 9) PLANO DAS AULAS LABORATORIAIS 2 e 3 (Q.F. Inorgânica):
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
Preparação e padronização de soluções
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
Reconhecer as vidrarias volumétricas utilizadas no preparo de soluções;
 AULA 5 Preparo e diluição de soluções OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
AULA 5 Preparo e diluição de soluções OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
1. PREPARO DE SOLUÇÕES E TITULAÇÃO
 1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE
 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE O que se pretende Determinar a concentração desconhecida de uma solução aquosa de um ácido forte por titulação com uma base forte através de dois métodos. Num dos
NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE O que se pretende Determinar a concentração desconhecida de uma solução aquosa de um ácido forte por titulação com uma base forte através de dois métodos. Num dos
Qual a quantidade de halogenetos que existe na água do mar?
 20 Qual a quantidade de halogenetos que existe na água do mar? E20-1 o que necessitas cloreto de sódio sólido com grau de pureza analítico cromato de potássio sólido um balão de diluição de 100 ml dois
20 Qual a quantidade de halogenetos que existe na água do mar? E20-1 o que necessitas cloreto de sódio sólido com grau de pureza analítico cromato de potássio sólido um balão de diluição de 100 ml dois
AULA 3. Soluções: preparo e diluição. Laboratório de Química QUI OBJETIVOS
 AULA 3 Soluções: preparo e diluição OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
AULA 3 Soluções: preparo e diluição OBJETIVOS Preparar soluções a partir de reagentes sólidos e líquidos; Fazer cálculos prévios da quantidade de reagentes sólidos ou líquidos necessários para o preparo
ESCOLA SECUNDÁRIA DE S. LOURENÇO EM PORTALEGRE ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE. Versão professor. Algumas notas prévias
 ESCOLA SECUNDÁRIA DE S. LOURENÇO EM PORTALEGRE ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE Versão professor O que se pretende: Conhecer processos para neutralizar resíduos de ácidos/bases
ESCOLA SECUNDÁRIA DE S. LOURENÇO EM PORTALEGRE ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE Versão professor O que se pretende: Conhecer processos para neutralizar resíduos de ácidos/bases
Actividade nº 2. Actividade laboratorial: Preparação de soluções e sua diluição
 Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2008/2009 Actividade nº 2 Protocolo Experimental Data: 9/10/2008 Duração: 135 min Actividade laboratorial: Preparação
Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2008/2009 Actividade nº 2 Protocolo Experimental Data: 9/10/2008 Duração: 135 min Actividade laboratorial: Preparação
Relatório: Volumétrica
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico De Química E Biologia Bacharelado em Química Tecnológica Licenciatura Química Relatório: Preparação, Padronização e Análise Volumétrica
Universidade Tecnológica Federal do Paraná Departamento Acadêmico De Química E Biologia Bacharelado em Química Tecnológica Licenciatura Química Relatório: Preparação, Padronização e Análise Volumétrica
TITULAÇÃO ÁCIDO-BASE
 ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE O que se pretende: Conhecer processos para neutralizar resíduos de ácidos/bases no laboratório. Realizar tecnicamente uma titulação. Seleccionar
ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE O que se pretende: Conhecer processos para neutralizar resíduos de ácidos/bases no laboratório. Realizar tecnicamente uma titulação. Seleccionar
TITULAÇÃO ÁCIDO-BASE. Versão aluno
 ESCOLA SECUNDÁRIA DE S. LOURENÇO EM PORTALEGRE ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE Versão aluno O que se pretende: Conhecer processos para neutralizar resíduos de ácidos/bases
ESCOLA SECUNDÁRIA DE S. LOURENÇO EM PORTALEGRE ACTIVIDADE LABORATORIAL QUÍMICA 11º ANO TITULAÇÃO ÁCIDO-BASE Versão aluno O que se pretende: Conhecer processos para neutralizar resíduos de ácidos/bases
PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO
 PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO Aula 15 METAS Familiarizar com as técnicas de preparo e padronização de solução de tiossulfato de
PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO Aula 15 METAS Familiarizar com as técnicas de preparo e padronização de solução de tiossulfato de
Concentração de soluções e diluição
 Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Práticas de Química Geral QB71J
 PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ - UTFPR DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA BACHARELADO EM QUÍMICA / LICENCIATURA
PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ - UTFPR DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA BACHARELADO EM QUÍMICA / LICENCIATURA
ACÇÃO DE FORMAÇÃO GUIÃO DE ACTIVIDADE PRÁTICA. (Versão Professor)
 Escola Secundária Marques de Castilho ÁGUEDA ACÇÃO DE FORMAÇÃO UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES GUIÃO DE ACTIVIDADE PRÁTICA FUNCIONAMENTO DE UM SISTEMA TAMPÃO (Versão Professor) Formando: Henrique
Escola Secundária Marques de Castilho ÁGUEDA ACÇÃO DE FORMAÇÃO UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES GUIÃO DE ACTIVIDADE PRÁTICA FUNCIONAMENTO DE UM SISTEMA TAMPÃO (Versão Professor) Formando: Henrique
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
Volumetria de Neutralização Ácido-Base. Preparação & Padronização de Soluções. Concentração de Soluções
 Volumetria de Neutralização Ácido-Base Preparação & Padronização de Soluções Concentração de Soluções ETEC Tiquatira (SP) Professor Daniel e Professor Barbosa Página 1 de 11 Volumetria de Neutralização
Volumetria de Neutralização Ácido-Base Preparação & Padronização de Soluções Concentração de Soluções ETEC Tiquatira (SP) Professor Daniel e Professor Barbosa Página 1 de 11 Volumetria de Neutralização
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
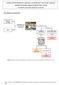 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
MÉTODOS ENVOLVENDO O IODO, I 2 TITULAÇÃO IODOMÉTRICA. O par redox iodo/iodeto pode ser caracterizado pela semi- reação,
 MÉTODOS ENVOLVENDO O IODO, I 2 TITULAÇÃO IODOMÉTRICA As aplicações do iodo como reagente redox são bastante extensas, principalmente porque: (1) o potencial padrão de redução do par I 2 /I - é intermediário,
MÉTODOS ENVOLVENDO O IODO, I 2 TITULAÇÃO IODOMÉTRICA As aplicações do iodo como reagente redox são bastante extensas, principalmente porque: (1) o potencial padrão de redução do par I 2 /I - é intermediário,
Síntese do acetato de n-butilo ou etanoato de n-butilo
 Síntese do acetato de n-butilo ou etanoato de n-butilo Realização experimental a microescala (baseado no protocolo de Williamson 1 ) A reacção entre o butan-1-ol e o ácido acético glacial (ou ácido etanoico)
Síntese do acetato de n-butilo ou etanoato de n-butilo Realização experimental a microescala (baseado no protocolo de Williamson 1 ) A reacção entre o butan-1-ol e o ácido acético glacial (ou ácido etanoico)
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO FATOR DA SOLUÇÃO DE AZUL DE METILENO POR TITULAÇÃO COM SOLUÇÃO DE CLORETO TITANOSO (TiCl 3 )
 Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Química. APL 1.6 Funcionamento de um sistema-tampão: titulação ácido forte-base fraca (HCl e Na 2 CO 3 )
 Química APL 1.6 Funcionamento de um sistema-tampão: titulação ácido forte-base fraca (HCl e Na 2 CO 3 ) Luísa Neves, 12ºCT 09 de março de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4
Química APL 1.6 Funcionamento de um sistema-tampão: titulação ácido forte-base fraca (HCl e Na 2 CO 3 ) Luísa Neves, 12ºCT 09 de março de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4
Agrupamento de Escolas de Bobadela Escola EBI de Bobadela. Preparação de soluções aquosas de sulfato de cobre
 Agrupamento de Escolas de Bobadela Escola EBI de Bobadela Ano letivo 2013/2014 C. Físico-Químicas 7º ano Relatório da actividade experimental: Preparação de soluções aquosas de sulfato de cobre Elaborado
Agrupamento de Escolas de Bobadela Escola EBI de Bobadela Ano letivo 2013/2014 C. Físico-Químicas 7º ano Relatório da actividade experimental: Preparação de soluções aquosas de sulfato de cobre Elaborado
Padronizar uma solução aquosa de hidróxido de sódio 0,1mol/L para posteriormente determinar a acidez de amostras.
 Pág. 1 de 6 I - OBJETIVOS Padronizar uma solução de ácido clorídrico 0,1mol/L para posterior determinação de pureza de amostras alcalinas. Padronizar uma solução aquosa de hidróxido de sódio 0,1mol/L para
Pág. 1 de 6 I - OBJETIVOS Padronizar uma solução de ácido clorídrico 0,1mol/L para posterior determinação de pureza de amostras alcalinas. Padronizar uma solução aquosa de hidróxido de sódio 0,1mol/L para
XXVI - CERA DE ABELHA
 XXVI - CERA DE ABELHA 1. CARACTERÍSTICAS E PREPARO DA AMOSTRA Comercialmente a cera de abelha poderá ser encontrada como bruta, prébeneficiada e beneficiada. A amostra deve ser representativa do lote,
XXVI - CERA DE ABELHA 1. CARACTERÍSTICAS E PREPARO DA AMOSTRA Comercialmente a cera de abelha poderá ser encontrada como bruta, prébeneficiada e beneficiada. A amostra deve ser representativa do lote,
QUÍMICA - 3 o ANO MÓDULO 25 MISTURA DE SOLUÇÕES
 QUÍMICA - 3 o ANO MÓDULO 25 MISTURA DE SOLUÇÕES + = 1 2 F 1) M x V = M X V (x = 1) (x = 1) M b V b = M a V a 2) m x = M x V MOL (x = 1) (x = 1) m B = M a V a MOL 3) + = NaOH KOH H 2 SO 4 4) M x V M x V
QUÍMICA - 3 o ANO MÓDULO 25 MISTURA DE SOLUÇÕES + = 1 2 F 1) M x V = M X V (x = 1) (x = 1) M b V b = M a V a 2) m x = M x V MOL (x = 1) (x = 1) m B = M a V a MOL 3) + = NaOH KOH H 2 SO 4 4) M x V M x V
ACTIVIDADE LABORATORIAL - QUÍMICA 12º ANO. Produção de BIODIESEL a partir de óleo alimentar usado
 ACTIVIDADE LABORATORIAL - QUÍMICA 12º ANO Produção de BIODIESEL a partir de óleo alimentar usado 1. Objectivo: Reutilizar os óleos vegetais rejeitados 2. O que se pretende: 2.1 Seleccionar material adequado
ACTIVIDADE LABORATORIAL - QUÍMICA 12º ANO Produção de BIODIESEL a partir de óleo alimentar usado 1. Objectivo: Reutilizar os óleos vegetais rejeitados 2. O que se pretende: 2.1 Seleccionar material adequado
RESINA FENÓLICA PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE FENOL LIVRE
 SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA
 Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Qui. Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa EXERCÍCIOS DE AULA 1. Para determinar a pureza de uma amostra de ácido sulfúrico (H2SO 4), uma analista dissolveu 14,0 g do ácido
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa EXERCÍCIOS DE AULA 1. Para determinar a pureza de uma amostra de ácido sulfúrico (H2SO 4), uma analista dissolveu 14,0 g do ácido
Teste de Laboratórios de Química I e soluções
 É OBRIGATÓRIO IDENTIFICAR TODAS AS FOLHAS DE EXAME AS FOLHAS NÃO IDENTIFICADAS SÃO ANULADAS Teste de Laboratórios de Química I e soluções 4 de Janeiro de 2013 Duração: 1h 30m Mestrado Integrado em Engenharia
É OBRIGATÓRIO IDENTIFICAR TODAS AS FOLHAS DE EXAME AS FOLHAS NÃO IDENTIFICADAS SÃO ANULADAS Teste de Laboratórios de Química I e soluções 4 de Janeiro de 2013 Duração: 1h 30m Mestrado Integrado em Engenharia
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p )
 REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES. META Determinar a concentração de ácido clorídrico por titulometria de neutralização.
 Aula INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES META Determinar a concentração de ácido clorídrico por titulometria de neutralização. OBJETIVOS Ao final desta aula o aluno deverá: detectar o ponto
Aula INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES META Determinar a concentração de ácido clorídrico por titulometria de neutralização. OBJETIVOS Ao final desta aula o aluno deverá: detectar o ponto
Funcionamento de um sistema tampão
 Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
FORMAS FARMACÊUTICAS. Apresentação da fórmula farmacêutica.
 FORMAS FARMACÊUTICAS Apresentação da fórmula farmacêutica. Líquidas: soluções, suspensões, emulsões, etc. Sólidas: pós, cápsulas, comprimidos, drágeas, supositórios, etc. Semi-sólidas (pastosas): pomadas,
FORMAS FARMACÊUTICAS Apresentação da fórmula farmacêutica. Líquidas: soluções, suspensões, emulsões, etc. Sólidas: pós, cápsulas, comprimidos, drágeas, supositórios, etc. Semi-sólidas (pastosas): pomadas,
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 )
 Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO
 VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO A volumetria de precipitação envolve a reação na qual forma-se um produto de baixa solubilidade. Sua principal aplicação
VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO A volumetria de precipitação envolve a reação na qual forma-se um produto de baixa solubilidade. Sua principal aplicação
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA
 PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
Preparação do cloreto de t-butila. Carina de Freitas Vellosa Daiane Cristina Romanini
 Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em , Prof. Mauricio
 Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
Óleo de Amendoim... 25g Solução de hidróxido de Cálcio... 25g Ácido oléico...
 Preparação para Exame Laboratorial de Tecnologia Farmacêutica III - 2002/2003 Trabalho VI Emulsões As emulsões são sistemas heterogéneos formados por dois líquidos imiscíveis entre si; são compostas por
Preparação para Exame Laboratorial de Tecnologia Farmacêutica III - 2002/2003 Trabalho VI Emulsões As emulsões são sistemas heterogéneos formados por dois líquidos imiscíveis entre si; são compostas por
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D
 RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
Funcionamento de um sistema tampão
 Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Volumetria. Procedimentos gerais
 Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
11º ENTEC Encontro de Tecnologia: 16 de outubro a 30 de novembro de 2017
 ESTUDO DA CLARIFICAÇÃO DA LECITINA DE SOJA COM ADIÇÃO DE PERÓXIDO DE HIDROGÊNIO CONTROLADO PELA ENZIMA CATALASE OLIVEIRA, Fernanda Luiza Mendonça 1 ; SANTOS, Romulo Antônio Silva² ; Orientador: SOUZA FILHO,
ESTUDO DA CLARIFICAÇÃO DA LECITINA DE SOJA COM ADIÇÃO DE PERÓXIDO DE HIDROGÊNIO CONTROLADO PELA ENZIMA CATALASE OLIVEIRA, Fernanda Luiza Mendonça 1 ; SANTOS, Romulo Antônio Silva² ; Orientador: SOUZA FILHO,
Exercícios Complementares - Recuperação Paralela. Soluções parte Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é
 Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Soluções parte 1 01 Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é a) ar atmosférico.
Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Soluções parte 1 01 Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é a) ar atmosférico.
PÓ DE CARVÃO MINERAL PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE ENXOFRE TOTAL PELO PROCESSO DE ESCHKA (GRAVIMETRIA)
 SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
Universidade Federal de Sergipe Departamento de Química Química Analítica Experimental Prof. Marcelo da Rosa Alexandre Alunos:
 Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
MT DEPARTAMENTO NACIONAL DE ESTRADAS DE RODAGEM
 Método de Ensaio Página 1 de 6 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser usado na determinação do de material termoplástico para demarcação viária. Prescreve a aparelhagem,
Método de Ensaio Página 1 de 6 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser usado na determinação do de material termoplástico para demarcação viária. Prescreve a aparelhagem,
R E L A T Ó R I O D A A C T I V I D A D E L A B O R A T O R I A L
 1 R E L A T Ó R I O D A A C T I V I D A D E L A B O R A T O R I A L ACTIVIDADE LABORATORIAL 1.3 Efeitos da temperatura e da concentração na progressão global de uma reacção de equilíbrio com iões de cobalto
1 R E L A T Ó R I O D A A C T I V I D A D E L A B O R A T O R I A L ACTIVIDADE LABORATORIAL 1.3 Efeitos da temperatura e da concentração na progressão global de uma reacção de equilíbrio com iões de cobalto
SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS
 EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
Introdução à Análise Ambiental 2016/2017
 Faculdade de Ciências da Universidade do Porto Departamento de Química e Bioquímica MÓDULO DE QUÍMICA Introdução à Análise Ambiental 2016/2017 TP1 - Preparação de soluções (2 aulas) TP2 Titulação de uma
Faculdade de Ciências da Universidade do Porto Departamento de Química e Bioquímica MÓDULO DE QUÍMICA Introdução à Análise Ambiental 2016/2017 TP1 - Preparação de soluções (2 aulas) TP2 Titulação de uma
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) REAÇÕES DE OXI REDUÇÃO / EQUAÇÃO DE NERNST Avaliação da espontaneidade da reação potencial da reação pelo potencial
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) REAÇÕES DE OXI REDUÇÃO / EQUAÇÃO DE NERNST Avaliação da espontaneidade da reação potencial da reação pelo potencial
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
mol / kg de água do mar NaCl 0,4186 MgCl 2 0,0596 Na 2 SO 4 0,02856
 QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
Calcule o ph de uma solução de HCl 1x10-7 mol L-1
 Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO. Ano de Escolaridade : 11
 Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO Ano de Escolaridade : 11 AL 2.2 Chuva normal e chuva ácida A classificação em chuva
Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO Ano de Escolaridade : 11 AL 2.2 Chuva normal e chuva ácida A classificação em chuva
QUÍMICA - 2 o ANO MÓDULO 03 SOLUÇÕES: INTRODUÇÃO - PARTE 3
 QUÍMICA - 2 o ANO MÓDULO 03 SOLUÇÕES: INTRODUÇÃO - PARTE 3 Fixação 1) (PUC) No preparo de solução alvejante de tinturaria, 521,5g de hipoclorito de sódio são dissolvidos em água suficiente para 10,0 litros
QUÍMICA - 2 o ANO MÓDULO 03 SOLUÇÕES: INTRODUÇÃO - PARTE 3 Fixação 1) (PUC) No preparo de solução alvejante de tinturaria, 521,5g de hipoclorito de sódio são dissolvidos em água suficiente para 10,0 litros
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
SUBSTÂNCIAS E MISTURAS
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
MF-441.R-1 - MÉTODO DE DETERMINAÇÃO DA ALCALINIDADE (MÉTODO TITULOMÉTRICO COM INDICADOR)
 MF-441.R-1 - MÉTODO DE DETERMINAÇÃO DA (MÉTODO TITULOMÉTRICO COM INDICADOR) Notas: Aprovado pela Deliberação CECA n 0313, de 01 de julho de 1982 Publicado no DOERJ de 25 de agosto de 1982 1. OBJETIVO Determinação
MF-441.R-1 - MÉTODO DE DETERMINAÇÃO DA (MÉTODO TITULOMÉTRICO COM INDICADOR) Notas: Aprovado pela Deliberação CECA n 0313, de 01 de julho de 1982 Publicado no DOERJ de 25 de agosto de 1982 1. OBJETIVO Determinação
INTRODUÇÃO A TITULAÇÃO
 Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Nome:... Escola:... Prova Prática
 Nome:.... Escola:....... Prova Prática Leia atentamente o protocolo antes de iniciar a experiência. Deve ser capaz de o realizar em 50 min, incluindo a lavagem e arrumação do material. Questão 1 2 Total
Nome:.... Escola:....... Prova Prática Leia atentamente o protocolo antes de iniciar a experiência. Deve ser capaz de o realizar em 50 min, incluindo a lavagem e arrumação do material. Questão 1 2 Total
Aula 4 PREPARO DE SOLUÇÕES. META Introduzir técnicas básicas de preparo de soluções.
 PREPARO DE SOLUÇÕES META Introduzir técnicas básicas de preparo de soluções. OBJETIVOS Ao final desta aula o aluno deverá: Fornecer conhecimento necessário para o preparo de soluções. Calcular a concentração
PREPARO DE SOLUÇÕES META Introduzir técnicas básicas de preparo de soluções. OBJETIVOS Ao final desta aula o aluno deverá: Fornecer conhecimento necessário para o preparo de soluções. Calcular a concentração
INTRODUÇÃO A TITULAÇÃO
 Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Uma solução é uma mistura homogénea de duas ou mais substâncias. Solvente Soluto(s) Solução
 Concentração de uma Uma é uma mistura homogénea de duas ou mais substâncias. Na obtida por dis em água de dicromato de potássio a água é o solvente o dicromato de potássio é o. Por exemplo o dicromato
Concentração de uma Uma é uma mistura homogénea de duas ou mais substâncias. Na obtida por dis em água de dicromato de potássio a água é o solvente o dicromato de potássio é o. Por exemplo o dicromato
TÍTULO: ANÁLISE TITRIMÉTRICA (Volumétrica)
 Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO ÓXIDO DE FERRO
 Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
CQ136 Química Experimental I. Água Dura e Halogênios - Diagrama de Latimer
 1 CQ136 Química Experimental I Água Dura e Halogênios - Diagrama de Latimer Introdução: Os elementos do grupo 2 são tipicamente metálicos, porém menos reativos que os metais alcalinos. Magnésio é um elemento
1 CQ136 Química Experimental I Água Dura e Halogênios - Diagrama de Latimer Introdução: Os elementos do grupo 2 são tipicamente metálicos, porém menos reativos que os metais alcalinos. Magnésio é um elemento
PRODUTO DE SOLUBILIDADE
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química PRODUTO DE SOLUBILIDADE Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química PRODUTO DE SOLUBILIDADE Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
PORCENTAGEM DE ÓXIDO DE CÁLCIO (CaO) EM CAL HIDRATADA
 PORCENTAGEM DE ÓXIDO DE CÁLCIO (CaO) EM CAL HIDRATADA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 001-13 09/2014 T 001-13 pg 1 - Centro de Desenvolvimento Tecnológico
PORCENTAGEM DE ÓXIDO DE CÁLCIO (CaO) EM CAL HIDRATADA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 001-13 09/2014 T 001-13 pg 1 - Centro de Desenvolvimento Tecnológico
PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES
 PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES METAS Apresentar o objetivo da parte prática da disciplina; apresentar as instruções de trabalho
PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES METAS Apresentar o objetivo da parte prática da disciplina; apresentar as instruções de trabalho
UTILIZAÇÃO E ORGANIZAÇÃO DOS LABORATÓRIOS ESCOLARES
 ACÇÃO DE FORMAÇÃO UTILIZAÇÃO E ORGANIZAÇÃO DOS LABORATÓRIOS ESCOLARES FORMADOR: Vitor Duarte Teodoro FORMANDA: Ana Maria Costa Veloso Azevedo Julho 2010 Actividade Laboratorial Química 11º ano Amoníaco
ACÇÃO DE FORMAÇÃO UTILIZAÇÃO E ORGANIZAÇÃO DOS LABORATÓRIOS ESCOLARES FORMADOR: Vitor Duarte Teodoro FORMANDA: Ana Maria Costa Veloso Azevedo Julho 2010 Actividade Laboratorial Química 11º ano Amoníaco
Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO. Ano de Escolaridade : 11
 Escola Secundária / º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO Ano de Escolaridade : 11 AL 1.1 Amoníaco e compostos de amónio em materiais de uso
Escola Secundária / º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO Ano de Escolaridade : 11 AL 1.1 Amoníaco e compostos de amónio em materiais de uso
VOLUMETRIA DE NEUTRALIZAÇÃO.
 13 Técnica 1. VOLUMETRIA DE NEUTRALIZAÇÃO. PADRONIZAÇÃO DA SOLUÇÃO APROXIMADAMENTE 0,1 M DE HCl COM SOLUÇÃO PADRÃO 0,05 M DE Na 2 CO 3. Colocar no erlenmeyer exatamente 10 ml de solução padrão 0,05 M de
13 Técnica 1. VOLUMETRIA DE NEUTRALIZAÇÃO. PADRONIZAÇÃO DA SOLUÇÃO APROXIMADAMENTE 0,1 M DE HCl COM SOLUÇÃO PADRÃO 0,05 M DE Na 2 CO 3. Colocar no erlenmeyer exatamente 10 ml de solução padrão 0,05 M de
Prova de conhecimento em Química Analítica DQ/UFMG
 CÓDIGO DO(A) CANDIDATO(A): Questão 1A. Considere os seguintes reagentes: I) KF sólido com teor de pureza de 95,0% m/m II) HF 28,0% m/m, d = 1,02 kg L -1, pk a = 3,17 III) KOH 0,400 mol L -1 a) Calcule
CÓDIGO DO(A) CANDIDATO(A): Questão 1A. Considere os seguintes reagentes: I) KF sólido com teor de pureza de 95,0% m/m II) HF 28,0% m/m, d = 1,02 kg L -1, pk a = 3,17 III) KOH 0,400 mol L -1 a) Calcule
Física e Química A. Nomes: N.º s : T.ª: Como neutralizar resíduos de ácidos/bases do laboratório de Química da escola?
 Física e Química A 11ºAno - Química AL.2.3. Neutralização: uma reacção de ácido-base Ano lectivo: 2010/2011 Nomes: N.º s : T.ª: PARTE I - Introdução Questão problema Como identificar se os resíduos são
Física e Química A 11ºAno - Química AL.2.3. Neutralização: uma reacção de ácido-base Ano lectivo: 2010/2011 Nomes: N.º s : T.ª: PARTE I - Introdução Questão problema Como identificar se os resíduos são
Química Fascículo 06 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 06 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Soluções...1 Exercícios... 5 Gabarito...7 Soluções Unidades de Concentração Concentração é determinada
Química Fascículo 06 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Soluções...1 Exercícios... 5 Gabarito...7 Soluções Unidades de Concentração Concentração é determinada
Diluição de soluções
 COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ANO LETIVO 2018 3º BIMESTRE ATIVIDADE COMPLEMENTAR Série Turma (s) Turno 2º do Ensino Médio A B C D E F G H I MATUTINO Professor: CHARLYS
COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ANO LETIVO 2018 3º BIMESTRE ATIVIDADE COMPLEMENTAR Série Turma (s) Turno 2º do Ensino Médio A B C D E F G H I MATUTINO Professor: CHARLYS
Determinação de amido em farinha de mandioca, produtos amiláceos e outros
 Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES
 PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES 1- INTRODUÇÃO Análise volumétrica refere-se a todo procedimento no qual o volume de um reagente necessário para reagir com um constituinte em análise é medido. - Em
PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES 1- INTRODUÇÃO Análise volumétrica refere-se a todo procedimento no qual o volume de um reagente necessário para reagir com um constituinte em análise é medido. - Em
Prof a. Dr a. Luciana M. Saran
 HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 ANÁLISE TITRIMÉTRICA O QUE
HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 ANÁLISE TITRIMÉTRICA O QUE
Título do vídeo: Um ciclo de cobre. Nome dos participantes: Ana Silva, Ana Almeida, Christine Lycklama, Leonardo Egger, Shirley Horst.
 Título do vídeo: Um ciclo de cobre. Nome dos participantes: Ana Silva, Ana Almeida, Christine Lycklama, Leonardo Egger, Shirley Horst. Professor responsável: Dina Albino. E-mail da professora responsável:
Título do vídeo: Um ciclo de cobre. Nome dos participantes: Ana Silva, Ana Almeida, Christine Lycklama, Leonardo Egger, Shirley Horst. Professor responsável: Dina Albino. E-mail da professora responsável:
Ácido nítrico concentrado: R: 8-35; S: Ácido sulfúrico concentrado: R: ; S: /37/ Realizar na hotte. Usar luvas.
 REALIZAÇÃO EXPERIMENTAL Objectivos Verificar e interpretar a ocorrência de reacções químicas de ácido-base. Verificar e interpretar a ocorrência de reacções químicas de oxidação-redução. Interpretar as
REALIZAÇÃO EXPERIMENTAL Objectivos Verificar e interpretar a ocorrência de reacções químicas de ácido-base. Verificar e interpretar a ocorrência de reacções químicas de oxidação-redução. Interpretar as
AULA 10 EQUILÍBRIO DE SOLUBILIDADE
 Fundamentos de Química Analítica (009) AULA 10 EQUILÍBRIO DE SOLUBILIDADE OBJETIVOS Definir solubilidade do soluto. Definir solução saturada, não saturada e supersaturada. Conhecer as regras de solubilidade.
Fundamentos de Química Analítica (009) AULA 10 EQUILÍBRIO DE SOLUBILIDADE OBJETIVOS Definir solubilidade do soluto. Definir solução saturada, não saturada e supersaturada. Conhecer as regras de solubilidade.
DURAÇÃO DA PROVA: 03 HORAS
 DURAÇÃO DA PROVA: 03 HORAS Nº de Inscrição do Candidato PROCESSO SELETIVO 2014/2 - CPS CURSO DE GRADUAÇÃO EM MEDICINA PROVA DISCURSIVA DE QUÍMICA INSTRUÇÕES: 1. Só abra a prova quando autorizado. 2. Veja
DURAÇÃO DA PROVA: 03 HORAS Nº de Inscrição do Candidato PROCESSO SELETIVO 2014/2 - CPS CURSO DE GRADUAÇÃO EM MEDICINA PROVA DISCURSIVA DE QUÍMICA INSTRUÇÕES: 1. Só abra a prova quando autorizado. 2. Veja
Unidade Temática: Soluções 2 ( Operações com soluções )
 Unidade Temática: Soluções 2 ( Operações com soluções ) 1. (Uft 2011) Um litro de solução de H 2 SO 4 2 mol/l, armazenada indevidamente, derramou, restando 250 ml do seu volume inicial, esta quantidade
Unidade Temática: Soluções 2 ( Operações com soluções ) 1. (Uft 2011) Um litro de solução de H 2 SO 4 2 mol/l, armazenada indevidamente, derramou, restando 250 ml do seu volume inicial, esta quantidade
Lista de Exercício. Professor: Cassio Pacheco Disciplina: Química 2 Ano Data de entrega: 04/03/2016. Concentração Comum
 Professor: Cassio Pacheco Disciplina: Química 2 Ano Data de entrega: 04/03/2016 Lista de Exercício Concentração Comum 1- Num balão volumétrico de 250 ml adicionam-se 2,0g de sulfato de amônio sólido; o
Professor: Cassio Pacheco Disciplina: Química 2 Ano Data de entrega: 04/03/2016 Lista de Exercício Concentração Comum 1- Num balão volumétrico de 250 ml adicionam-se 2,0g de sulfato de amônio sólido; o
Unidade 1: Materiais e aplicações - tintas e vernizes: proteger e embelezar Física e Química B 10º ano Data: 09/01/2006 e 12/01/2006
 Reagentes: Água desionizada; Nitrato de chumbo(ii) Pb(NO 3) 2 Preparação da solução de nitrato de chumbo(ii) 0,5 mol dm 3 Balança semianalítica; Vidro de relógio; Goblé de 100 ml; Esguicho; Balão volumétrico
Reagentes: Água desionizada; Nitrato de chumbo(ii) Pb(NO 3) 2 Preparação da solução de nitrato de chumbo(ii) 0,5 mol dm 3 Balança semianalítica; Vidro de relógio; Goblé de 100 ml; Esguicho; Balão volumétrico
