CAPÍTULO 3. O propósito do corpo é levar o cérebro para passear. Thomas Edison ( ), inventor americano
|
|
|
- Theodoro Carreiro
- 5 Há anos
- Visualizações:
Transcrição
1 CAPÍTULO 3 O propósito do corpo é levar o cérebro para passear. Thomas Edison ( ), inventor americano Em matemática você não compreende as coisas. Simplesmente se acostuma com elas. Johann von Neumann ( ), cientista da computação americano
2 72 3. TÉCNICAS NÃO-ELETROQUÍMICAS As técnicas químicas foram as primeiras técnicas utilizadas para avaliar a porosidade e, consequentemente, a qualidade dos revestimentos. A seguir são comentadas algumas técnicas não-eletroquímicas de determinação da porosidade. As vantagens, aplicações e algumas limitações são comentadas durante a descrição de cada uma delas. Este capítulo apresenta ao leitor uma revisão sobre as principais técnicas químicas e técnicas não-eletroquímicas existentes e comumentemente utilizadas. Caso o leitor não tenha interesse em tais técnicas, suas características e aplicações, pode-se avançar para o próximo capítulo sem prejuízo para o entendimento e compreensão do assunto que está sendo tratado na presente dissertação EXPOSIÇÃO À DIVERSAS SOLUÇÕES AGRESSIVAS Ensaio com Ferrocianeto (EF) É o ensaio mais empregado. Muito utilizado na indústria, mas pouco empregado em centros de pesquisa, sofreu algumas modificações tentando-se obter maior sensibilidade (14). Pode ser usado para controle de qualidade dos revestimentos e para controle de banhos. ERNST et al. (1997) sugeriram a construção de uma curva ótima de deposição com padrões e, a comparação das amostras com essa curva para identificar se o banho está abaixo das condições ótimas de operação (9). É uma técnica pouco sensível a poros de pequenas dimensões, com o inconveniente de que somente nos oferece uma análise qualitativa da porosidade do revestimento (16). É utilizada preferencialmente para determinar a porosidade de
3 73 revestimentos de cobre, níquel, prata e ouro depositados sobre ferro, cobre ou latão, embora com algumas adaptações possa ser aplicada para outros sistemas substrato/revestimento (16). Este ensaio não serve para revestimentos anódicos em relação ao substrato (25). Pois, neste caso, o ensaio com ferrocianeto pode atacar o revestimento em regiões em que o revestimento estava anormalmente fino, podendo então indicar um número maior de poros (25). Esta técnica, baseia-se na observação de manchas coloridas que aparecem sobre um papel umedecido com um reagente adequado. Este papel é colocado sobre a peça cujo revestimento se deseja analisar por 10 a 30 min (2). O reagente empregado tem a função de atacar o substrato através dos poros, dissolvendo-o. Os produtos de corrosão do substrato ficam impregnados no papel, e as manchas coloridas são produzidas quando colocamos este papel em contato com uma solução reveladora (16). O ensaio é baseado na formação do complexo azul cianoferrato, o qual possui pouca solubilidade e precipita no local dos poros (9). Se executado desta forma, o processo realiza-se em duas etapas: primeiro existe a transferência de íons do metal para o papel de filtro e depois, a revelação, pela imersão deste papel na solução reveladora (16). Em uma variante deste processo, o papel é impregnado com ambas as soluções de ataque e de revelação. Neste caso, o tempo de ataque ao substrato é menor (16). Através da contagem dos pontos coloridos que aparecem numa área prédeterminada, obtêm-se um índice aproximado da porosidade do revestimento. De maneira geral, somente considera-se aceitável o revestimento que tenha somente 1 (um) poro por 6 cm 2 de superfície (16). A Tabela 3 é uma tentativa de agrupar informações com relação às possíveis combinações revestimento/substrato, solução de ataque e solução de revelação. As informações foram compiladas a partir de diversos autores. O caráter corrosivo da solução de ferrocianeto significa que, junto com a
4 74 contagem dos poros reais, pontos em que o revestimento estava realmente ausente, o resultado de um ensaio destes pode incluir lugares em que o revestimento não estava ausente, mas apenas anormalmente fino. Esses locais, são em geral locais onde a deposição esteve ausente até pouco tempo antes de se interromper a eletrodeposição, ou em pontos onde a taxa de deposição é menor (7) (13). Os testes convencionais (químicos e eletrográficos) são difíceis de serem aplicados em peças com geometria complexa (30). Outros problemas que podem ocorrer, são o bloqueio dos poros finos e o espalhamento sobre a superfície dos produtos de corrosão, os quais atrapalham a determinação da área real dos poros (31). A contagem de poros pode ser muito difícil de ser executada, ou até impossível, em revestimentos muito finos, ou pode apresentar resultados inconclusivos para revestimentos que possuem diferenças de porosidade muito pequenas entre si (17). O ensaio com ferrocianeto é útil para a determinação da porosidade, mas seus resultados nem sempre são reprodutíveis Ensaios com Água (EA) Estas técnicas foram propostas inicialmente para determinar a porosidade de revestimentos de estanho sobre ferro ou aço. Posteriormente esta técnica foi adaptada para a determinação da porosidade de revestimentos de níquel, prata e bronze sobre ferro ou aço (2) (16). Na técnica de Ensaio com Água Quente (EAQ), a peça a ser analisada é mergulhada em água quente a 93 a 100 C, ph 4,5 a 7, por um período de 6 horas. Depois deste tempo, retira-se a peça e deixa-se secar (16). Uma variante desta técnica recomenda temperatura de 85 C, ph 4,5 a 7, por um 1 hora (2). Na técnica de Ensaio com Água Aerada (EAAE), a peça a ser analisada é mergulhada em água à temperatura ambiente, por um período de 4 horas e sob forte aeração (2).
5 TABELA 3 APLICAÇÕES DO ENSAIO DE FERROCIANETO PARA A DETERMINAÇÃO DA POROSIDADE DE REVESTIMENTOS (16) Substrato Revestimento Solução de desengraxe Solução de ataque Tempo de ataque ao substrato Solução de revelação Cor produzida pela reação Cobre ou latão 1 Cobre ou latão Ferro ou aço Níquel, zinco, cádmio, estanho, prata, cobalto ou ouro Níquel, zinco, cádmio, estanho, prata, cobalto ou ouro Cobre, níquel, zinco, cádmio, estanho, prata, cobalto ou ouro Mistura éter/álcool (v/v) Mistura éter/álcool (v/v) 30 g/l NaCl 15 g/l ágar-ágar 60 g/l NaCl 10 g/l ágar-ágar 50 g/l NaCl 50 g/l ágar-ágar Ferro ou aço (56) Níquel 15 g/l NaCl 25 g/l K 3 [Fe(CN) 6 ] Ferro ou aço 1 Ferro ou aço Cobre, níquel, zinco, cádmio, estanho, prata, cobalto ou ouro Cobre, níquel, zinco, cádmio, estanho, prata, cobalto ou ouro Mistura éter/álcool (v/v) Mistura éter/álcool (v/v) 30 g/l NaCl 15 g/l ágar-ágar 60 g/l NaCl 10 g/l ágar-ágar Níquel Cromo 60 g/l NaCl, 30 g/l NH 4 Cl 10 g/l K 3 [Fe(CN) 6 ] 10 g/l ágar-ágar Ferro ou aço Níquel 5 % NaCl 10 g/l ágar-ágar 60 min 5 g/l K 4 [Fe(CN) 6 ] 10 min 10 g/l K 3 [Fe(CN) 6 ] 10 g/l K 4 [Fe(CN) 6 ] 10 a 30 min 10 g/l K 3 [Fe(CN) 6 ] Pontos vermelhos e/ou marrons Pontos vermelhos 30 s Pontos azuis 60 min 5 g/l K 4 [Fe(CN) 6 ] Pontos azuis 10 min 10 g/l K 3 [Fe(CN) 6 ] 10 g/l K 4 [Fe(CN) 6 ] 10 min 10 % dimetilglioxima amoniacal 10 min 0,1 % α-nitroso-βnaftol em metanol Fonte: Adaptado de JULVE (1986). 1 - Ensaio do gel ágar-ágar, norma francesa NF-A (maio, 1966). Pontos azuis Pontos rosados e/ou vermelhos Pontos verdes intensos 75
6 76 Novamente, através da contagem dos pontos marrons (ferrugem) decorrentes da oxidação do substrato, obtêm-se um índice aproximado da porosidade do revestimento. Possui a vantagem de possibilitar a análise de peças de grandes dimensões, mas as informações obtidas são qualitativas (16). Este ensaio apresenta problemas de detecção, pois a ferrugem em poros de pequenas dimensões podem ser negligenciados (25). Além disso, a água possui baixa condutividade e a concentração de oxigênio é baixa, devido à temperatura de realização do ensaio, o que diminui a sensibilidade da técnica (25). A Tabela 4 apresenta alguns ensaios de imersão e os sistemas a que são comumentemente aplicados Ensaio com Cloreto-Peróxido (ECP) É um ensaio mais agressivo que os descritos anteriormente. É utilizado para analisar revestimentos sobre substrato de ferro ou aço (16). Utiliza-se uma solução de 3 % cloreto de sódio (NaCl) e 1,5 % peróxido de hidrogênio (H 2 O 2 ) 20 volumes (v/v). Esta solução é aplicada sobre a peça a analisar por 10 min. Através da contagem dos pontos marrons obtêm-se um índice aproximado da porosidade do revestimento (16) Ensaio de Imersão em Soluções Agressivas (EISA) É aplicado para determinar a porosidade de revestimentos específicos sobre substratos também específicos (16). Por exemplo: Zinco sobre ferro/aço Método de sulfato de cobre neutro (CuSO 4 ) (DIN 0957); Cromo sobre níquel Método de cloreto de sódio (NaCl) e cloreto de cobre (CuCl 2 ) (NF- A ); Cromo sobre níquel/cobre/latão Método de persulfato de amônio ((NH 4 ) 2 S 2 O 8 ); Ouro sobre cobre/prata Método de polissulfeto de amônio ((NH 4 ) 2 S).
7 Ensaio Anódico com Ácido Crômico (EAAC) Empregado para revestimentos de cromo sobre camada intermediária de níquel (peças niqueladas) ou para cromo sobre substrato de ferro ou aço. Consiste em submeter a peça a ser analisada como ânodo em um banho de deposição de cromo, composto por: 350 g/l óxido de cromo (CrO 3 ) e 3,5 g/l ácido sulfúrico (H 2 SO 4 ). Aplica-se uma densidade de corrente de 30 A/dm 2 durante 2 a 5 min. Observa-se a presença de poros ou trincas com o auxílio de um microscópio (aumento de 50 a 100 vezes) (16) Ensaio com Tiocianato (ET) Um ensaio baseada no mesmo princípio do EF é o ensaio com tiocianato de amônio (NH 4 SCN). Neste ensaio um papel de filtro é impregnado com 15 % (peso) tiocianato de amônio (NH 4 SCN) e colocado sobre a amostra a ser analisada (1). Este ensaio é mais utilizado para a determinação de íons ferro (10). Para aumentar a velocidade e a sensibilidade deste ensaio, SHERLOCK et al. sugeriram uma solução com: 1 % ácido acético (H 3 CCOOH), 2 % tiocianato de amônio (NH 4 SCN) e 0,06 % peróxido de hidrogênio (H 2 O 2 ) (38) Ensaio com Alizarina (EAL) O ensaio com Alizarina é específico para substratos de alumínio e ligas de alumínio. A amostra a ser analisada é colocada em contato com uma solução 10 % hidróxido de sódio (NaOH) por alguns minutos. Depois disso a peça é tratada com alizarina (1,2 dihidroxiantraquinona). Os poros são identificados como pontos vermelhos na superfície da peça (2).
8 Ensaio Eletrográfico (EE) Os ensaios apresentados até aqui são técnicas que fornecem dados sobre a porosidade superficial das amostras analisadas, principalmente sobre poros de grandes dimensões. Para detectar poros de menor dimensão, desenvolveram-se os ensaios eletrográficos (16). Estas técnicas visam aumentar a sensibilidade, pois com a aplicação de uma corrente, forçando a dissolução do substrato é possível detectar poros de menor diâmetro Ensaio Eletrográfico sobre Papel (EEP) Esta técnica foi utilizada pela primeira vez em 1929, e tem sido utilizada para vários tipos de revestimentos e substratos (16). Consiste basicamente em um Ensaio de Ferrocianeto Acelerado fazendo-se passar corrente elétrica através da amostra. A amostra é colocada como ânodo, um papel de filtro embebido em uma solução adequada como o eletrólito e uma placa de cobre ou alumínio como cátodo. Este conjunto é preso em uma prensa devidamente isolada e submetido a uma diferença de potencial (16). A Tabela 5 e a Tabela 6 apresentam algumas soluções de ataque e revelação utilizadas no EEP. A peça cujo revestimento se deseja analisar deve estar totalmente limpa e desengraxada. O papel pode ser papel celofane, papel de filtro comum ou papel poroso especial para esta finalidade. Após umedecer este papel com a solução adequada, devese colocar o mesmo sobre a peça, evitando-se a formação de bolhas de ar.
9 TABELA 4 APLICAÇÕES DE ENSAIOS QUÍMICOS BASEADOS EM IMERSÃO EM SOLUÇÕES AGRESSIVAS PARA A DETERMINAÇÃO DA POROSIDADE DE REVESTIMENTOS (16) Tipo de ensaio Solução Temp. ( C) Duração Observações (procedimento) Aplicação Ensaios com água (EA) Ensaio com Cloreto- Peróxido (ECP) Ensaio de eletrodeposição de cobre (EEDC) Ensaio anódico com ácido crômico (EAAC) Água ph 4,5 a 7 Água aerada 3 % NaCl 1,5 % H 2 O 2 20 vol (v/v) 75 g/l CuSO 4. 5 H2O H 2 SO 4 Deposição de cromo: 350 g/l CrO 3 3,5 g/l H 2 SO 4 93 a (2) ambiente 1 6 horas 1 hora (2) 4 horas 1 Ensaio com Alizarina 10 % NaOH Alguns (EAL) (2) minutos Fonte: Adaptado de JULVE (1986). 1. Variante da técnica com água aerada (2). Recomendada para revestimentos de estanho sobre ferro ou aço. Adaptada para níquel, prata e bronze. 10 min Recomendado para revestimentos sobre ferro ou aço Submeter a peça como cátodo. Realiza-se a eletrólise (0,3 A/dm 2 ) 2 a 5 min Submeter a peça como ânodo (30 A/dm 2 ) Após imersão na soda, a peça é tratada com alizarina. Revestimentos de cromo sobre camada intermediária de níquel (peças niqueladas) Revestimentos de cromo sobre camada intermediária de níquel (peças niqueladas) ou para cromo sobre substrato de ferro ou aço Específico para substratos de alumínio e ligas de alumínio. 79
10 TABELA 5 APLICAÇÕES DO ENSAIO ELETROGRÁFICO SOBRE PAPEL (16) Substrato Revestimento Solução de ataque ao substrato (% em peso) Ferro, latão ou níquel Todos 5 % NaNO 3 ou KNO 3 Níquel Ouro 4,3 % Na 2 CO 3 + 0,7 % NaCl Todos Todos 5 % Na 2 CO % NaCl Todos Zinco 4 % K 4 [Fe(CN) 6 ] + 0,2 % MgSO 4 Fonte: Adaptado de JULVE (1986). Uma vez colocado o papel sobre a peça a ser analisada, coloca-se a lâmina de cobre, alumínio ou aço inoxidável e prende-se o conjunto na prensa (14 a 28 kgf/cm 2 ). Aplica-se uma densidade de corrente de 300 ma/dm 2 a uma diferença de potencial de 3 V por 15 segundos (16). KERR et al. (1996) sugerem uma corrente de 100 ma/dm 2 por 45 segundos. Depois de 45 min o papel é removido e deixado secar por 30 min (1). Decorrido este tempo, retira-se o papel e mergulha-se numa solução de revelação adequada, contendo um ânion que forme com o cátion do metal-base um complexo colorido e facilmente identificável (16). A existência de poros é indicada pela presença sobre o papel de pontos ou manchas coloridas, da mesma forma que no ensaio com ferrocianeto (16). O ensaio eletrográfico avalia a corrosão pela dissolução anódica do substrato (14) Ensaio Eletrográfico em Meio Gelatinoso (EEMG) Neste ensaio, substitui-se o papel por um meio gelatinoso. Este meio é composto por 94,6 % (volume) de gelatina, 3,4 % de eletrólito (solução de ataque) e 2 % de solução reveladora. A gelatina é composta de 9 % (peso) de gelatina em pó em água, podendo ser conservada em geladeira (16). A amostra a ser analisada é mergulhada no meio gelatinoso, atuando como ânodo. O contato elétrico é feito utilizando-se um arame de ouro, mesmo material do
11 cátodo. Depois de resfriado o meio gelatinoso, aplica-se uma densidade de corrente de 380 ma/dm 2 durante um tempo de 15 a 20 segundos. Os poros do revestimento aparecem na forma de pontos coloridos na massa de gelatina que envolve a peça (16). TABELA 6 SOLUÇÕES DE REVELAÇÃO UTILIZADAS NO ENSAIO ELETROGRÁFICO SOBRE PAPEL Substrato Revestimento Solução de revelação (% em peso) Cor produzida pela reação Cobre Ouro 1 % dimetilglioxima alcoólica 5 % amoníaco Pontos verdes Cobre Ouro 5 % K 4 [Fe(CN) 6 ] Pontos verdes Ferro ou aço Cobre 1 % dimetilglioxima alcoólica (alcalinizada com amônio) Ferro ou aço Níquel 5 % K 4 [Fe(CN) 6 ] Pontos azul turquesa Latão Estanho Sulfeto de antimônio (sólido) Mergulhar em H 3 PO 4 diluído Níquel Ouro 1 % dimetilglioxima alcoólica 5 % amoníaco Pontos negros de sulfeto de cobre Pontos rosados Níquel Cromo 1 % dimetilglioxima alcoólica Pontos rosados Prata Ouro Revelador de fotografia comum Vários 1 Ouro e metais preciosos 10 % cloreto de cádmio 5 % sulfeto de sódio (5 min) Lavagem em água (30 min) Pontos azuis Pontos vermelhos e/ou marrons Fonte: Adaptado de JULVE (1986). 1 - Ensaio eletrográfico com sulfeto de cádmio. Pressão: 14 kgf/cm 2, densidade de corrente: 700 ma/dm 2, tempo: 30 s) ENSAIOS ACELERADOS EM CÂMARAS Ensaios de corrosão são bastante utilizados na indústria e podem ser divididos em: ensaios de campo (fornecem dados mais confiáveis mas são muito demorados) e ensaios acelerados (10). Nestes ensaios os poros são revelados por pontos e/ou manchas escuros na superfície do revestimento. As maiores desvantagens são: pouca
12 reprodutibilidade e dificuldades para uma interpretação quantitativa dos resultados, devido ao bloqueio de poros de pequena dimensão por produtos de corrosão invisíveis à olho nu. Além disso, a penetração do eletrólito em poros de pequena dimensão é difícil, de modo que a ocorrência destes defeitos não poderá ser revelada nessa técnica. Os produtos de corrosão tendem a se espalhar na superfície, fornecendo resultados incorretos (10). Ensaios de corrosão são realizados de acordo com alguma norma ou padrão (57). As normas podem ser escritas pelo consumidor, uma norma para uso próprio; podem ser escritas por uma instituição em um determinado país, por exemplo a BSI (Bureau of Standards Institute), uma norma com especificações válidas em todo o território nacional; ou podem ser escritas por um órgão internacional, por exemplo a ISO, com especificações em âmbito mundial (57). A norma mais conhecida para ensaio de névoa salina (salt-spray) é a ASTM B Salt-spray (fog) testing (57). Para o ensaio em câmara de dióxido de enxofre (SO 2 ), temos o Ensaio de Atmosfera Industrial BS 2011 Kc (57). Os ensaios de corrosão acelerados são geralmente constituídos de 3 partes: (i) temperatura, (ii) umidade relativa e (iii) agente corrosivo. Cada um destes fatores têm um papel muito importante no mecanismo e na taxa de corrosão e, consequentemente, na reprodutibilidade dos resultados (57). Em câmaras de névoa salina as amostras a serem avaliadas são submetidas a atmosferas corrosivas bem definidas. Em testes úmidos, a solução a ser utilizada é atomizada no interior de uma câmara (sem atomização direta sobre a superfície da amostra) formando uma névoa, a partir da qual gotas podem ser formadas sobre a superfície das peças a serem testadas. Em testes gasosos, um gás em uma atmosfera com umidade controlada produz as condições na qual gotas de condensado podem ser formadas sobre a superfície das peças. O poros são revelados através de alterações de cor do revestimento ou de dissolução do substrato (2).
13 A Tabela 7 e a Tabela 8 apresentam, respectivamente, ensaios recomendados para várias combinações substrato/revestimento e condições de aplicação de diversos tipos de ensaios em câmaras Ensaio de Névoa Salina Neutra (ENSN) Nesse ensaio, utiliza-se uma solução de cloreto de sódio (NaCl) 50 g/l em ph neutro e temperatura de 35 C. O número e distribuição dos poros são avaliados depois de 2 a 1000 horas de exposição. Este ensaio é recomendado para um grande número de combinações substrato/revestimento (Ver Tabela 7) (2). O ENSN é muito utilizado para a determinação da porosidade, mas seus resultados nem sempre são reprodutíveis. Os ensaios são considerados destrutivos e muito demorados (53), possui ainda severas limitações, pois os produtos de corrosão se espalham e impedem uma análise quantitativa (9), e a presença de oxigênio é pequena, diminuindo a sensibilidade e aumentando o tempo de ensaio (25). O ENSN não serve para revestimentos anódicos (25) Ensaio de Névoa Salina Ácida (ENSA) É similar ao ENSN. A diferença consiste em ajustar o ph para valores próximos de 3,1 a 3,3 com ácido acético (H 3 CCOOH). Este procedimento aumenta a severidade do ensaio. É particularmente recomendado para revestimentos decorativos de cromo/níquel ou cromo/níquel/cobre, mas também pode ser utilizado para outros tipos de revestimento, como por exemplo para alumínio anodizado (2).
14 Ensaio de Névoa Salina Acelerado com Cobre (ENSAC) É similar ao ENSA, mas adiciona-se 0,2 g/l cloreto cuproso (CuCl 2 ), aumentando a corrosividade da solução ainda mais. O ENSAC é recomendado para revestimentos de cromo/níquel, cromo/níquel/cobre e alumínio anodizado (2) Ensaio de Corrosão Salino (ECS) Neste ensaio prepara-se uma solução similar à água do mar. Esta solução é aspergida sobre a amostra, deixando gotas sobre a sua superfície. As amostras são então colocadas em uma câmara-úmida (85 a 90 % de umidade relativa) à temperatura ambiente. O número e distribuição dos poros são avaliados depois de 2 a 1000 horas de exposição. Se necessário, as amostras são reaspergidas durante o teste para manter as gotas sobre a superfície. Este ensaio é recomendado para detectar poros em revestimentos mais nobres que o substrato e para testar revestimentos obtidos por processos de conversão de superfícies, com cromatos e fosfatos (2) Ensaio de Corrosão com Dióxido de Enxofre (ECDE) Ensaios com dióxido de enxofre (SO 2 ) podem ser divididos em dois grupos: (1) aqueles envolvendo condensação, por exemplo Ensaio de Kesternich, e aqueles sem condensação, Ensaio de Clarke e Leeds. Estes utilizaram esta técnica para ouro e platina sobre substrato de cobre, prata e/ou níquel. De acordo com TANG et al. (1995) (In ERNST et al., 1997) não é possível distinguir entre a corrosão do substrato devido a existência de poucos poros no revestimento e a corrosão do próprio revestimento (9). O ensaio de câmara-úmida com vapores de dióxido de enxofre (SO 2 ) possui um grande número de variantes. Em todos os casos as amostras são mantidas em uma
15 atmosfera úmida de SO 2, mas a concentração de SO 2 e a temperatura variam de um tipo para outro. A atmosfera de SO 2 pode ser formada tanto pela injeção direta de SO 2 na câmara ou pela reação de ácido sulfúrico (H 2 SO 4 ) com tiossulfato de sódio (Na 2 S 2 O 3 ) no interior da câmara. A duração dos testes varia e depende da concentração de SO 2, geralmente de 8 horas a diversos dias. Não é recomendado para revestimentos anódicos com relação ao substrato (2). O uso de atmosferas contendo pequenas concentrações de dióxido de enxofre (SO 2 ) tem sido utilizado para revelar poros em revestimentos de estanho (38). Depois de revelados os poros apareceram como manchas e/ou pontos marrons/pretos ou áreas de corrosão na superfície. É um ensaio muito lento para níquel, o qual produz pontos vermelhos, provavelmente devido à formação de FeS (9). Apresenta grandes dificuldades para interpretação dos resultados (1) (9). No caso deste ensaio, os filmes formados na superfície do metal contém ácido sulfúrico (H 2 SO 4 ), este ataca o aço exposto no fundo dos poros e leva à formação de íons ferro solúveis. Estes íons se difundem a partir do fundo dos poros para formar sais de ferro insolúveis (férrico ou ferroso) (1). No entanto, estes sais são bastante volumosos e se espalham rapidamente sobre a superfície do revestimento que não foi atacado. Desta forma, a área coberta pela ferrugem é maior que a área real de substrato de ferro exposto através dos poros (1). Devido a isso, os resultados obtidos a partir de ensaios com dióxido de enxofre (SO 2 ) fornecem, geralmente, índices de porosidade anormalmente altos, sendo mais prudente expressar o resultado como porcentagem de ferrugem sobre a superfície e não como porosidade (1) Ensaio de Corrosão com Lamas Corrosivas (ECLC) Ensaio também conhecido como Corrodkote. Neste ensaio as amostras são recobertas com uma lama corrosiva, essa lama contém nitrato de cobre (Cu(NO 3 ) 2 ),
16 cloreto férrico (FeCl 3 ) e cloreto de amônio (NH 4 Cl), antes de serem colocadas em uma câmara-úmida (85 a 90 % de umidade relativa) à 38 C. Cada ciclo no interior da câmara tem duração de 16 horas. Caso sejam necessários dois ou mais ciclos, a amostra é retirada, limpa e a lama reaplicada. É recomendado para revestimentos de cromo/níquel ou cromo/níquel/cobre (1) (2). A solução utilizada por KERR et al. (1996) foi: 0,035 g nitrato de cobre (Cu(NO 3 ) 2 ), 0,165 g cloreto férrico (FeCl 3 ) e 1 g cloreto de amônio (NH 4 Cl) dissolvidos em 50 ml água deionizada. A esta solução foi adicionado 30 g de caulim. A pasta resultante foi aplicada com um espalhador de 100 µm sobre as amostras. Após secas até uma umidade relativa menor que 50 %, as amostras foram transferidas para uma câmara úmida não-condensante mantida a 36 a 39 C por 20 horas (1). O ensaio com lamas agressivas apresenta o mesmo inconveniente do ensaio com dióxido de enxofre (SO 2 ), o óxido se espalha sobre a superfície e, desta forma, apresenta índices de porosidade também anormalmente altos. Apresenta pouca reprodutibilidade, não sendo indicado para revestimentos de níquel sobre aço (1) Ensaio de Corrosão com Ácido Nítrico (ECAN) As amostras são expostas a uma atmosfera contendo 70 % ácido nítrico (HNO 3 ) por 75 min e secas em forno por 30 min. A porosidade é avaliada pela contagem do número de poros e bolhas. É recomendado para revestimentos de ouro sobre níquel, cobre e ligas de cobre (2) Ensaio de Corrosão com Enxofre (ECE) As amostras são expostas a uma câmara contendo dois recipientes: um para água e outro para enxofre sublimado. A câmara é aquecida até 80 C por algumas horas
17 e os poros tornam-se visíveis pela formação de sulfeto de cobre (Cu 2 S) ou prata (Ag 2 S). É recomendado para revestimentos de ouro sobre prata, cobre e ligas de cobre (2) OUTRAS TÉCNICAS Ensaio de Eletrodeposição de Cobre (EEDC) Utilizado para a determinação de trincas e poros em revestimentos de cromo sobre aço (2) ou cromo sobre camada intermediária de níquel (peças niqueladas) (16). Quando o cobre é depositado a partir de um banho de cobre ácido a baixas densidades de corrente de deposição (0,3 A/dm 2 ) por 1 min, o cobre tende a se depositar sobre as áreas onde o substrato de aço está exposto através dos poros. A inspeção com um microscópio revela os poros do revestimento. Um processo similar de deposição pode ser utilizado para a determinação de poros em revestimentos de fosfato sobre o aço (2). ERNST et al. (1997) estudaram revestimentos de nitretos de alumínio e titânio (TiAlN) (59). Utilizaram técnica de cementação com cobre em que o cobre deposita-se quimicamente sobre o substrato no fundo dos poros do revestimento. A solução utilizada foi 0,1 g/l sulfato de cobre (CuSO 4 ), ph 1,1 (59).
18 TABELA 7 TESTES DE POROSIDADE RECOMENDADOS PARA DIFERENTES COMBINAÇÕES SUBSTRATO/REVESTIMENTO. A INDICAÇÃO: CROMO/NÍQUEL REPRESENTA UM REVESTIMENTO DE CROMO, SOBRE UM REVESTIMENTO DE NÍQUEL APLICADO SOBRE OUTRO SUBSTRATO (2) Substrato Revestimento Ensaio de porosidade recomendado Aço Alumínio Ligas de alumínio Cobre Ligas de cobre Cádmio ou Zinco Cromo Cromo/níquel Cromo/níquel/cobre Cobre Ouro/níquel Chumbo Níquel Níquel-fósforo Estanho Estanho-chumbo Estanho-níquel Estanho-níquel/cobre Cromo/níquel Cromo/níquel/cobre Óxido de alumínio Níquel ou Níquel/fósforo Cromo/níquel Ouro Níquel Prata Estanho Estanho-níquel Estanho-chumbo ENSN ou ENSA ECS, EAQ, EF ou EEDC ENSA, ENSAC, ECLC, ECS ou EAQ ENSA, ENSAC, ECLC, ECS ou EAQ EFM ou EE ECS, EF ou EAQ ENSN, ENSA, ECS ou EAQ ENSN, ENSA, ECS, EF, EAQ ou EE ENSN, ENSA, ECS, EF ou EAQ ECS, ECDE, EF, EAQ ou EE ECS, ECDE ou EAQ ECS, ECDE ou EAQ ECS, ECDE ou EAQ ENSA, ENSAC, ECLC ou ECS ENSA, ENSAC, ECLC ou ECS ENSA EA ENSA, ENSAC ECAN, ECDE, ECE ou EE ECE ECDE ECDE ou EE ECDE ECDE Ligas de Zinco Cromo/níquel/cobre ENSA, ENSAC, ECS ou ECLC Níquel Ouro Metais do grupo da Platina Estanho ECAN, ECDE ou EE ECDE ou EE ECDE Prata Níquel Ouro Estanho Fonte: LEISNER e BENZON (1997) ECDE, ECE ou EE ECDE ou EE ECE
19 TABELA 8 CONDIÇÕES DE APLICAÇÃO DE ENSAIOS EM CÂMARAS PARA A DETERMINAÇÃO DA POROSIDADE DE REVESTIMENTOS Tipo de ensaio Solução ph Temp. ( C) Duração Tipo de Câmara Aplicação Ensaio de névoa salina neutra (ENSN) 50 g/l NaCl neutro 35 2 a % NaCl (56) horas 24 horas (56) Muito variada Ensaio de névoa salina ácida (ENSA) 50 g/l NaCl 3,1 a 3,3 (ácido acético) 35 Menor que o anterior Cromo/níquel ou cromo/níquel/cobre. Pode ser usado para alumínio anodizado Ensaio de névoa salina acelerado com cobre (ENSAC) 50 g/l NaCl 0,2 g/l CuCl 2 35 Menor que o anterior Cromo/níquel, cromo/níquel/cobre e alumínio anodizado Ensaio de corrosão salino (ECS) Similar água do mar ambiente 2 a 1000 horas Úmida Umidade relativa 85 a 90 % Revestimentos mais nobres que o substrato e revestimentos obtidos por processos de conversão de superfícies Ensaio de corrosão com lamas corrosivas (ECLC) 0,7 g/l nitrato cobre 3,3 g/l cloreto férrico 20 g/l cloreto amônio 600 g/l caulim 38 Ciclos de 16 horas 20 horas (1) Úmida Umidade relativa 85 a 90 % Cromo/níquel ou cromo/níquel/cobre Ensaio de corrosão com dióxido de enxofre (ECDE) Conc. SO 2 variável 10 % SO 2 (1) 4/1 tiocianato 20 % e H 2 SO 4 50 % (58) Variável 25 Variável 8 horas a dias (58) (1) 24 horas Úmida Umidade relativa 85 a 90 % Ouro e platina sobre cobre, prata e níquel. Com restrições, para revestimentos de níquel químico Ensaio de corrosão com ácido nítrico (ECAN) 70 % HNO 3 75 min Ouro sobre níquel, cobre e ligas de cobre Ensaio de corrosão com enxofre (ECE) dois recipientes: um para água e outro para enxofre sublimado 80 Algumas horas Ouro sobre, cobre e ligas de cobre Fonte: Adaptado de LEISNER e BENZON (1997). 89
20 Ensaios de Exposição de Campo (EEC) Ensaios de exposição de campo são os mais realistas, mas também os mais demorados. Neste tipo de ensaio, as amostras são submetidas à condições muito similares, ou até mesmo idênticas, daquelas a que será submetida a peça durante o seu tempo de vida. Ensaios deste tipo são realizados em ambientes que podem ser classificados como: industrial, marinho, doméstico ou rural. Em ensaios de exposição acelerados, as amostras são constantemente aspergidas com água do mar (2). Ensaios deste tipo não são, em sua essência, ensaios para a determinação da porosidade, mas como uma conseqüência do teste obtêm-se informações acerca da porosidade (2) Microscopia Eletrônica de Varredura (MEV) Técnica utilizada por KERR et al. (1996) utilizaram imagens obtidas a partir de elétrons retroespalhados para avaliar a porosidade de revestimentos. As imagens obtidas foram analisadas por EDX (1) e a porosidade calculada como poros por cm 2 (1). Verificaram que existem mais poros de menor diâmetro do que poros de maior diâmetro. A medida que o tamanho de poro aumenta o número desses poros diminui (1) Ensaios por Permeação de Gases (EPG) São utilizados quando se precisa de grande penetração, se comparado com o ensaio de ferrocianeto. É demorado, cerca de 24 horas, e possui uma preparação de amostra bastante complexa. Deve-se remover o revestimento do substrato que se deseja analisar, o que pode ocasionar alterações na qualidade do revestimento (14). A técnica eletroquímica proposta neste trabalho apresenta vantagens sobre as
21 91 técnicas químicas pois possibilita uma determinação quantitativa e rápida da porosidade. Com relação às outras técnicas eletroquímicas, a principal vantagem está relacionada ao tempo de execução da análise, uma vez que medidas de PC e CC necessitam de tempos relativamente longos para que a obtenção de medidas estáveis e as medidas por RP necessitam de velocidades de varredura baixas. As medidas por IE necessitam de um modelo para ajuste e interpretação dos dados, e estes modelos nem sempre estão disponíveis na literatura. O sucesso na aplicação da técnica de dissolução anódica está baseada na escolha adequada das condições de utilização da técnica, as quais devem ser selecionadas a fim de evitar ataques ao revestimento, aumentando o tamanho dos poros, e a fim de se obter a sensibilidade desejada, de modo que a carga medida seja exclusivamente de processos de dissolução/passivação do substrato.
02/10/2017 ELETRÓLISE AQUOSA
 ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
HIDROMETALURGIA E ELETROMETALURGIA. Prof. Carlos Falcão Jr.
 HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. Definição de HIDROMETALURGIA parte da metalurgia que engloba os processos de extração de metais, nos quais a principal etapa de separação metal-ganga
HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. Definição de HIDROMETALURGIA parte da metalurgia que engloba os processos de extração de metais, nos quais a principal etapa de separação metal-ganga
OXIDAÇÃO DE METAIS INTRODUÇÃO
 OXIDAÇÃO DE METAIS INTRODUÇÃO Oxidação é uma palavra do âmbito da química que significa a perda de elétrons, mesmo que não seja causada pelo oxigênio. Indica também o processo de oxidar, ou seja, de combinar
OXIDAÇÃO DE METAIS INTRODUÇÃO Oxidação é uma palavra do âmbito da química que significa a perda de elétrons, mesmo que não seja causada pelo oxigênio. Indica também o processo de oxidar, ou seja, de combinar
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
PRINCIPIAS REATIVOS PARA MACRO - REVELAÇÃO
 PRINCIPIAS REATIVOS PARA MACRO - REVELAÇ AÇOS AO CARBONO E AÇOS DE BAIXA E DE ALTA LIGA REATIVO COMPOSIÇ IDENTIFICAÇ TEMPO DE ATAQUE Nítrico Persulfato de Amônia Stead Fry Clorídrico 25 ml de Nítrico 10
PRINCIPIAS REATIVOS PARA MACRO - REVELAÇ AÇOS AO CARBONO E AÇOS DE BAIXA E DE ALTA LIGA REATIVO COMPOSIÇ IDENTIFICAÇ TEMPO DE ATAQUE Nítrico Persulfato de Amônia Stead Fry Clorídrico 25 ml de Nítrico 10
LL-SAL DE SELAGEM NF
 Patentes: Italiana, Européia, USA, Canadá e México. DESCRIÇÃO O produto permite a selagem da camada anódica do Alumínio Anodizado e suas ligas, operando num intervalo de temperatura de 26 ºC a 30 ºC. A
Patentes: Italiana, Européia, USA, Canadá e México. DESCRIÇÃO O produto permite a selagem da camada anódica do Alumínio Anodizado e suas ligas, operando num intervalo de temperatura de 26 ºC a 30 ºC. A
Atividade complementar de Química. Substância pura e mistura de substâncias
 Atividade complementar de Química Substância pura e mistura de substâncias Educação de Jovens e Adultos Sobre as substâncias químicas, é importante que esteja claro, que todas as substâncias são constituídas
Atividade complementar de Química Substância pura e mistura de substâncias Educação de Jovens e Adultos Sobre as substâncias químicas, é importante que esteja claro, que todas as substâncias são constituídas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
ALEXANDRE MICHEL MAUL
 ALEXANDRE MICHEL MAUL ANÁLISE POR TÉCNICA ELETROQUÍMICA DA POROSIDADE DE REVESTIMENTOS SOBRE SUPERFÍCIES METÁLICAS Dissertação apresentada como requisito parcial à obtenção do grau de Mestre, apresentada
ALEXANDRE MICHEL MAUL ANÁLISE POR TÉCNICA ELETROQUÍMICA DA POROSIDADE DE REVESTIMENTOS SOBRE SUPERFÍCIES METÁLICAS Dissertação apresentada como requisito parcial à obtenção do grau de Mestre, apresentada
Ocorrência de reações
 Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
CORROSÃO ATMOSFÉRICA. É extremamente dependente das condições no local de exposição.
 CORROSÃO ATMOSFÉRICA Ocorre sob um filme fino de eletrólito adsorvido à superfície do metal É extremamente dependente das condições no local de exposição. CORROSÃO ATMOSFÉRICA Classificação das atmosferas:
CORROSÃO ATMOSFÉRICA Ocorre sob um filme fino de eletrólito adsorvido à superfície do metal É extremamente dependente das condições no local de exposição. CORROSÃO ATMOSFÉRICA Classificação das atmosferas:
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015
 PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
QUÍMICA - 2 o ANO MÓDULO 29 ELETROQUÍMICA - EXERCÍCIOS
 QUÍMICA - 2 o ANO MÓDULO 29 ELETROQUÍMICA - EXERCÍCIOS 1) (PUC) Considerando 1 F = 96.500 C (quantidade de eletricidade relativa a 1 mol de elétrons), na eletrólise ígnea do cloreto de alumínio, AlCl 3,
QUÍMICA - 2 o ANO MÓDULO 29 ELETROQUÍMICA - EXERCÍCIOS 1) (PUC) Considerando 1 F = 96.500 C (quantidade de eletricidade relativa a 1 mol de elétrons), na eletrólise ígnea do cloreto de alumínio, AlCl 3,
QUÍMICA ANALÍTICA QUALITATIVA - PROVAS RECOMENDADAS PARA A IDENTIFICAÇÃO DOS ÍONS SÓDIO, POTÁSSIO E AMÔNIO. USAR SAIS DE CLORETO OU NITRATO!!!!
 QUÍMICA ANALÍTICA QUALITATIVA PROVAS RECOMENDADAS PARA A IDENTIFICAÇÃO DOS ÍONS SÓDIO, POTÁSSIO E AMÔNIO. USAR SAIS DE CLORETO OU NITRATO!!!! Sódio (amostra sólida): a) Coloração da chama. Esta prova é
QUÍMICA ANALÍTICA QUALITATIVA PROVAS RECOMENDADAS PARA A IDENTIFICAÇÃO DOS ÍONS SÓDIO, POTÁSSIO E AMÔNIO. USAR SAIS DE CLORETO OU NITRATO!!!! Sódio (amostra sólida): a) Coloração da chama. Esta prova é
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PRATIQUE EM CASA SOLUÇÃO PC. H O( ) H (aq) OH (aq) OH (aq) HO( ) O (g) e (Ânodo ( ); oxidação) + H (aq) + e H (g) (Cátodo ( ); redução) Global HO( ) H (g) O (g) Volume,5 Volume SOLUÇÃO PC. [C]
SOLUÇÃO PRATIQUE EM CASA SOLUÇÃO PC. H O( ) H (aq) OH (aq) OH (aq) HO( ) O (g) e (Ânodo ( ); oxidação) + H (aq) + e H (g) (Cátodo ( ); redução) Global HO( ) H (g) O (g) Volume,5 Volume SOLUÇÃO PC. [C]
Plating Zink -AL. Descrição :
 Plating Zink -AL Descrição : Plating Zink-Al oferece um filme aderente de zincato sobre o alumínio. O processo é utilizado sobre todos os tipos de alumínio e suas ligas e deposita por imersão um filme
Plating Zink -AL Descrição : Plating Zink-Al oferece um filme aderente de zincato sobre o alumínio. O processo é utilizado sobre todos os tipos de alumínio e suas ligas e deposita por imersão um filme
Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle
 Curso Técnico Integrado em Química Físico-química III VÍDEO AULA Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle 1 Professor: Me. Sebastião Junior T. Vasconcelos
Curso Técnico Integrado em Química Físico-química III VÍDEO AULA Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle 1 Professor: Me. Sebastião Junior T. Vasconcelos
HIDROMETALURGIA E ELETROMETALURGIA. Prof. Carlos Falcão Jr.
 HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
DÉBORA JIMENEZ MORILLAS APLICAÇÃO DE DISSOLUÇÃO ANÓDICA PARA AVALIAÇÃO DE DESCONTINUIDADES EM REVESTIMENTOS DE CROMO DURO
 DÉBORA JIMENEZ MORILLAS APLICAÇÃO DE DISSOLUÇÃO ANÓDICA PARA AVALIAÇÃO DE DESCONTINUIDADES EM REVESTIMENTOS DE CROMO DURO Dissertação apresentada ao Programa de Pós-Graduação em Engenharia (PIPE), Área
DÉBORA JIMENEZ MORILLAS APLICAÇÃO DE DISSOLUÇÃO ANÓDICA PARA AVALIAÇÃO DE DESCONTINUIDADES EM REVESTIMENTOS DE CROMO DURO Dissertação apresentada ao Programa de Pós-Graduação em Engenharia (PIPE), Área
Centro Universitário Padre Anchieta Controle de Processos Químicos Ciência dos Materiais Prof Ailton. Metais Não Ferrosos
 Metais Não Ferrosos 8.1 - Introdução Denominam-se metais não ferrosos, os metais em que não haja ferro ou em que o ferro está presente em pequenas quantidades, como elemento de liga Os metais não ferrosos
Metais Não Ferrosos 8.1 - Introdução Denominam-se metais não ferrosos, os metais em que não haja ferro ou em que o ferro está presente em pequenas quantidades, como elemento de liga Os metais não ferrosos
COLÓIDES. Prof. Harley P. Martins filho SISTEMAS COLOIDAIS. Colóide: dispersão de pequenas partículas de um material em outro
 COLÓIDES Prof. Harley P. Martins filho SISTEMAS COLOIDAIS Colóide: dispersão de pequenas partículas de um material em outro Faixa de tamanho das partículas coloidais 10-9 a 10-6 m Classificação geral:
COLÓIDES Prof. Harley P. Martins filho SISTEMAS COLOIDAIS Colóide: dispersão de pequenas partículas de um material em outro Faixa de tamanho das partículas coloidais 10-9 a 10-6 m Classificação geral:
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR
 INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
Exercícios Sobre Ocorrência de ReaÇões
 Exercícios Sobre Ocorrência de ReaÇões Dados: Força de ácidos e bases Ácidos fortes α 50 % Ácidos semifortes ou moderados 5 % α 50% Ácidos fracos α 5% Classificação dos hidrácidos mais conhecidos: Hidrácidos
Exercícios Sobre Ocorrência de ReaÇões Dados: Força de ácidos e bases Ácidos fortes α 50 % Ácidos semifortes ou moderados 5 % α 50% Ácidos fracos α 5% Classificação dos hidrácidos mais conhecidos: Hidrácidos
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes)
 Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
CAPÍTULO 7. Os homens nascem ignorantes, mas são necessários anos de. estudo para torná-los estúpidos.
 CAPÍTULO 7 Os homens nascem ignorantes, mas são necessários anos de estudo para torná-los estúpidos. George Bernard Shaw (1856 1950), dramaturgo irlandês Experiência é o nome que damos aos nossos próprios
CAPÍTULO 7 Os homens nascem ignorantes, mas são necessários anos de estudo para torná-los estúpidos. George Bernard Shaw (1856 1950), dramaturgo irlandês Experiência é o nome que damos aos nossos próprios
ARTIGO TÉCNICO I O EFEITO DO HYDROFLOW NA CORROSÃO. Danny Stefanini, PhD. Setembro 2002
 ARTIGO TÉCNICO I O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Setembro 2002 O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Corrosão é um fenômeno eletroquímico, ligado ao estabelecimento
ARTIGO TÉCNICO I O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Setembro 2002 O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Corrosão é um fenômeno eletroquímico, ligado ao estabelecimento
(MACK-SP) Na eletrólise ígnea de NaCl, verificase
 (MACK-SP) Na eletrólise ígnea de NaCl, verificase que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição de NaCl. e) no cátodo,
(MACK-SP) Na eletrólise ígnea de NaCl, verificase que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição de NaCl. e) no cátodo,
Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por
 Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por oxidação de íons ag(+) c) cátodo, por redução de átomos
Na obtenção de prata por eletrólise de solução aquosa de nitrato de prata, o metal se forma no: a) cátodo, por redução de íons Ag(+) b) cátodo, por oxidação de íons ag(+) c) cátodo, por redução de átomos
Aula 20 Eletrodeposição
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
O que esses dispositivos tem em comum? São dispositivos móveis. O que faz os dispositivos móveis funcionarem?
 O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
Eletroquímica: Pilha e Eletrólise
 Eletroquímica: Pilha e Eletrólise Enem 15 semanas 1. O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica
Eletroquímica: Pilha e Eletrólise Enem 15 semanas 1. O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica
Corrosão e degradação de materiais. Modificação aparência. Interação Comprometimento pp mecânicas
 Corrosão e degradação de materiais Modificação aparência Interação Comprometimento pp mecânicas Deterioração é diferente para os diversos tipos de materiais: M Dissolução (corrosão) Formação de crosta
Corrosão e degradação de materiais Modificação aparência Interação Comprometimento pp mecânicas Deterioração é diferente para os diversos tipos de materiais: M Dissolução (corrosão) Formação de crosta
LISTA DE EXERCÍCIOS Eletroquímica
 DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas.
 A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
A prova escrita é composta de 10 questões, sendo 4 obrigatórias e 6 eletivas. O candidato deverá responder 8 questões: as 4 obrigatórias (questões de números 1 a 4) e outras 4 escolhidas dentre as eletivas
Gabarito de Química Frente 2
 Gabarito de Química Frente 2 Módulo 05 01. E Calculo do nox: 1) HNO 3 1 + X + 3 x (- 2) = 0 X= + 5 +1 2 X 2) HNO 2 1 + Y + 2 x (- 2) = 0 Y= + 3 +1 Y 2 3) NH 3 Z + 3 x (+1) = 0 Z = - 3 Z 02.A +1 Para calcular
Gabarito de Química Frente 2 Módulo 05 01. E Calculo do nox: 1) HNO 3 1 + X + 3 x (- 2) = 0 X= + 5 +1 2 X 2) HNO 2 1 + Y + 2 x (- 2) = 0 Y= + 3 +1 Y 2 3) NH 3 Z + 3 x (+1) = 0 Z = - 3 Z 02.A +1 Para calcular
CORROSÃO PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES. Prof. Mazer AULA 05
 AULA 05 Prof. Mazer PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES 2 FUNDAMENTOS GERAIS: O concreto protege a armadura de duas formas: - Confere uma barreira física separando o aço do meio-ambiente - A água no
AULA 05 Prof. Mazer PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES 2 FUNDAMENTOS GERAIS: O concreto protege a armadura de duas formas: - Confere uma barreira física separando o aço do meio-ambiente - A água no
Aluno (a): Data: / / Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta à caneta, organizada e completa.
 Disciplina: Química Turma: 2 série Escola SESI Jundiaí Professor: Rosilene Paulino da Silva Aluno (a): Data: / / 2018. Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta
Disciplina: Química Turma: 2 série Escola SESI Jundiaí Professor: Rosilene Paulino da Silva Aluno (a): Data: / / 2018. Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta
AULA 10 EQUILÍBRIO DE SOLUBILIDADE
 Fundamentos de Química Analítica (009) AULA 10 EQUILÍBRIO DE SOLUBILIDADE OBJETIVOS Definir solubilidade do soluto. Definir solução saturada, não saturada e supersaturada. Conhecer as regras de solubilidade.
Fundamentos de Química Analítica (009) AULA 10 EQUILÍBRIO DE SOLUBILIDADE OBJETIVOS Definir solubilidade do soluto. Definir solução saturada, não saturada e supersaturada. Conhecer as regras de solubilidade.
Quí. Quí. Monitor: Rodrigo Pova
 Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele. d) KMnO 4 + H 2 C 2 O 4 + H 2 SO 4 K 2 SO 4 + MnSO 4 + CO 2 + H 2 O
 REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
PMT AULAS 1 E 2 Augusto Camara Neiva. PMT Augusto Neiva
 PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
E (V) Ag + e Ag 0,80 Zn + 2e Zn 0,76
 PROVA DE QUÍMICA - 2 o TRIMESTRE 2013 PROF. MARCOS NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
PROVA DE QUÍMICA - 2 o TRIMESTRE 2013 PROF. MARCOS NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
Ligação iônica = transfere elétrons (um doa outro recebe) 1, 2, 3 e - c.v. 5, 6, 7 e - c.v. Doar e - Receber e - Íon+ Íon - Cl - : NaCl.
 LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons
LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons
Processo RF. Descrição:
 Processo RF Descrição: Processo RF é um processo de Zinco Ácido a base de Cloreto de Potássio, isento de amônea e cianeto, que produz depósitos brilhantes e dúcteis sobre diversos metais, inclusive aço
Processo RF Descrição: Processo RF é um processo de Zinco Ácido a base de Cloreto de Potássio, isento de amônea e cianeto, que produz depósitos brilhantes e dúcteis sobre diversos metais, inclusive aço
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
ELETROQUÍMICA REAÇÃO ENERGIA QUÍMICA ELÉTRICA. Pilha. Eletrólise. espontânea. não espontânea
 ELETROQUÍMICA REAÇÃO Pilha espontânea ENERGIA QUÍMICA Eletrólise não espontânea ELÉTRICA SEMI REAÇÕES DE OXIDAÇÃO E REDUÇÃO Zn 0 Zn +2 + 2e - semi-reação de oxidação Cu +2 + 2e - Cu 0 semi-reação de redução
ELETROQUÍMICA REAÇÃO Pilha espontânea ENERGIA QUÍMICA Eletrólise não espontânea ELÉTRICA SEMI REAÇÕES DE OXIDAÇÃO E REDUÇÃO Zn 0 Zn +2 + 2e - semi-reação de oxidação Cu +2 + 2e - Cu 0 semi-reação de redução
BANHO DE NIQUEL SEMI BRILHANTE
 Rev. 000 Data: 24/09/10 Página 1 1 DESCRIÇÃO O PROCESSO NÍQUEL SB 3NE deposita camadas semi-brilhantes de baixo teor de enxofre e com boas características de nivelamento. Seu uso principal é a deposição
Rev. 000 Data: 24/09/10 Página 1 1 DESCRIÇÃO O PROCESSO NÍQUEL SB 3NE deposita camadas semi-brilhantes de baixo teor de enxofre e com boas características de nivelamento. Seu uso principal é a deposição
e - Zinco ZnSO 4 Zn(s) Zn 2 Zn(s) Zn 2+ (aq) + 2 e - + 0,76 V Cu(s) Cu 2+ (aq) + 2 e - - 0,34 V
 Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
GUIA DE LABORATÓRIO ANÁLISES QUALITATIVAS. Departamento de Química. Instituto de Ciências Exatas. Universidade Federal de Juiz de Fora
 GUIA DE LABORATÓRIO ANÁLISES QUALITATIVAS Departamento de Química Instituto de Ciências Exatas Universidade Federal de Juiz de Fora 2 INSTRUÇÕES GERAIS O trabalho que se realiza em um curso prático de
GUIA DE LABORATÓRIO ANÁLISES QUALITATIVAS Departamento de Química Instituto de Ciências Exatas Universidade Federal de Juiz de Fora 2 INSTRUÇÕES GERAIS O trabalho que se realiza em um curso prático de
Exercícios sobre eletrólise em solução aquosa - Eletroquímica
 Exercícios sobre eletrólise em solução aquosa - Eletroquímica 01. (Cesgranrio) O voltômetro de Hoffman anterior, é usado para realizar a eletrólise da água. Se a eletrólise de uma solução diluída de H
Exercícios sobre eletrólise em solução aquosa - Eletroquímica 01. (Cesgranrio) O voltômetro de Hoffman anterior, é usado para realizar a eletrólise da água. Se a eletrólise de uma solução diluída de H
Exercício 3: (PUC-RIO 2007) Considere a célula eletroquímica abaixo e os potenciais das semi-reações:
 Exercício 1: (PUC-RIO 2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre
Exercício 1: (PUC-RIO 2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre
Guia Defeito Cobre Alcalino
 Guia Defeito Cobre Alcalino Aderência Imperfeita: Causa: excesso de cianeto livre, usualmente indicado por formação excessiva de fases no catodo e pela aparência brilhante e cristalina dos anodos. Correção:
Guia Defeito Cobre Alcalino Aderência Imperfeita: Causa: excesso de cianeto livre, usualmente indicado por formação excessiva de fases no catodo e pela aparência brilhante e cristalina dos anodos. Correção:
Eletrólise Eletrólise de soluções aquosas
 Eletrólise de soluções aquosas As reações não espontâneas necessitam de uma corrente externa para fazer com que a reação ocorra. As reações de eletrólise são não espontâneas. Nas células voltaicas e eletrolíticas:
Eletrólise de soluções aquosas As reações não espontâneas necessitam de uma corrente externa para fazer com que a reação ocorra. As reações de eletrólise são não espontâneas. Nas células voltaicas e eletrolíticas:
Reações inorgânicas Atividades 2
 Reações inorgânicas Atividades 2 Introdução Os exercícios propostos abaixo abordam o conteúdo de reações inorgânicas, com os principais tipos dessas reações, dessa vez com os nomes das substâncias, para
Reações inorgânicas Atividades 2 Introdução Os exercícios propostos abaixo abordam o conteúdo de reações inorgânicas, com os principais tipos dessas reações, dessa vez com os nomes das substâncias, para
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS
 PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
QUÍMICA. Transformações Químicas e Energia. Prof ª. Giselle Blois
 QUÍMICA Transformações Químicas e Energia Eletroquímica: Oxirredução, Potenciais Padrão de Redução, - Parte 2 Prof ª. Giselle Blois REAÇÃO QUÍMICA PILHA (fenômeno espontâneo) ELETRÓLISE (fenômeno não-espontâneo)
QUÍMICA Transformações Químicas e Energia Eletroquímica: Oxirredução, Potenciais Padrão de Redução, - Parte 2 Prof ª. Giselle Blois REAÇÃO QUÍMICA PILHA (fenômeno espontâneo) ELETRÓLISE (fenômeno não-espontâneo)
Química. Eletroquímica
 CIC Colégio Imaculada Conceição Química Eletroquímica Msc. Camila Soares Furtado Couto Eletrólise Inverso da Pilha; Reação de oxi-redução que é provocada pela corrente elétrica; Não espontânea!!!! Eletrólise
CIC Colégio Imaculada Conceição Química Eletroquímica Msc. Camila Soares Furtado Couto Eletrólise Inverso da Pilha; Reação de oxi-redução que é provocada pela corrente elétrica; Não espontânea!!!! Eletrólise
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele. d) KMnO 4 + H 2 C 2 O 4 + H 2 SO 4 K 2 SO 4 + MnSO 4 + CO 2 + H 2 O. Ag. Redutor: H 2 C 2 O 4
 REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
1ª Série Ensino Médio. 16. O sistema a seguir mostra a ocorrência de reação química entre um ácido e um metal, com liberação do gás X:
 1ª Série Ensino Médio 16. O sistema a seguir mostra a ocorrência de reação química entre um ácido e um metal, com liberação do gás X: O gás X, liberado neste sistema, é o: (A) O 2 ; (B) Cl 2 ; (C) O 3
1ª Série Ensino Médio 16. O sistema a seguir mostra a ocorrência de reação química entre um ácido e um metal, com liberação do gás X: O gás X, liberado neste sistema, é o: (A) O 2 ; (B) Cl 2 ; (C) O 3
Plating LX 120. Tanques : revestidos de PVC ( material plástico anti-ácido ); cerâmica, aço inoxidável 18/8 ou vidro.
 Plating LX 120 Descrição: Plating LX 120 é um passivador em pó indicado para formação de camadas claras/incolores ou amarelas iridiscentes sobre zinco e cádmio, ferro galvanizado e zamack, oferecendo uma
Plating LX 120 Descrição: Plating LX 120 é um passivador em pó indicado para formação de camadas claras/incolores ou amarelas iridiscentes sobre zinco e cádmio, ferro galvanizado e zamack, oferecendo uma
Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28
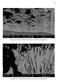 60 Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28 Fotografia 30 - Microestrutura destacada em amarelo na Fotografia 28 61 Tabela 11- Composição química do revestimento da chapa L
60 Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28 Fotografia 30 - Microestrutura destacada em amarelo na Fotografia 28 61 Tabela 11- Composição química do revestimento da chapa L
Zinacid MB. Descrição:
 Zinacid MB Descrição: Zinacid MB é um processo de Zinco Ácido a base de Cloreto de Potássio, isento de amônia e cianeto, que produz depósitos brilhantes e dúcteis sobre uma diversos metais base, inclusive
Zinacid MB Descrição: Zinacid MB é um processo de Zinco Ácido a base de Cloreto de Potássio, isento de amônia e cianeto, que produz depósitos brilhantes e dúcteis sobre uma diversos metais base, inclusive
Índice. Agradecimentos... Prefácio da Edição Revisada... Prefácio...
 Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
Guia de Defeito Zinco Alcalino sem Cianeto
 Guia de Defeito Zinco Alcalino sem Cianeto Deposito fosco com a1) Concentração do banho e dos a1) Anotar os valores, para granulação bem fina em toda aditivos dentro do especificado referências futuras.
Guia de Defeito Zinco Alcalino sem Cianeto Deposito fosco com a1) Concentração do banho e dos a1) Anotar os valores, para granulação bem fina em toda aditivos dentro do especificado referências futuras.
Qui. Semana. Allan Rodrigues Gabriel Pereira (Victor Pontes)
 Semana 7 Allan Rodrigues Gabriel Pereira (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Semana 7 Allan Rodrigues Gabriel Pereira (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
METALURGIA EXTRATIVA DOS NÃO FERROSOS
 METALURGIA EXTRATIVA DOS NÃO FERROSOS PMT 2509 PMT 3409 Flávio Beneduce PRODUÇÃO DE Ni USOS DO NÍQUEL Aços inoxidáveis e aços ligados: 70% Ligas não ferrosas Superligas: ligas resistentes à oxidação e
METALURGIA EXTRATIVA DOS NÃO FERROSOS PMT 2509 PMT 3409 Flávio Beneduce PRODUÇÃO DE Ni USOS DO NÍQUEL Aços inoxidáveis e aços ligados: 70% Ligas não ferrosas Superligas: ligas resistentes à oxidação e
Conteúdo: Eletrólise (ígnea, aquosa e aspectos quantitativos)
 3º Trimestre Sala de Estudo - Química Data: 30/10/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletrólise (ígnea, aquosa e aspectos quantitativos) Questão 01 - (PUC Camp SP/2017)
3º Trimestre Sala de Estudo - Química Data: 30/10/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletrólise (ígnea, aquosa e aspectos quantitativos) Questão 01 - (PUC Camp SP/2017)
BOLETIM TÉCNICO E-CLPS 2100: PRÉ-TRATAMENTO NÃO CRÔMICO PARA ALUMÍNIO
 BOLETIM TÉCNICO E-CLPS 2100 PRÉ-TRATAMENTO NÃO CRÔMICO PARA ALUMÍNIO Introdução O E-CLPS 2100 é um líquido isento de cromo hexavalente e fosfatos, que produzem sobre o alumínio e suas ligas uma película
BOLETIM TÉCNICO E-CLPS 2100 PRÉ-TRATAMENTO NÃO CRÔMICO PARA ALUMÍNIO Introdução O E-CLPS 2100 é um líquido isento de cromo hexavalente e fosfatos, que produzem sobre o alumínio e suas ligas uma película
QUÍMICA. Equilíbrio Químico. Sistemas Homogêneos: Solubilidade dos Sais, Hidrólise dos Sais e Curvas de Titulação - Parte 1. Prof ª.
 QUÍMICA Equilíbrio Químico Sistemas Homogêneos: Solubilidade dos Sais, - Parte 1 Prof ª. Giselle Blois SOLUBILIDADE DOS SAIS A solubilidade dos sais está relacionada com a capacidade de dissolução na água
QUÍMICA Equilíbrio Químico Sistemas Homogêneos: Solubilidade dos Sais, - Parte 1 Prof ª. Giselle Blois SOLUBILIDADE DOS SAIS A solubilidade dos sais está relacionada com a capacidade de dissolução na água
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA
 QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
TIPOS DE REAÇÕES QUÍMICAS
 Tipos de Reações químicas 1 TIPOS DE REAÇÕES QUÍMICAS Introdução Várias reações da química inorgânica podem ser classificadas em uma das quatro categorias: combinação, decomposição, deslocamento simples
Tipos de Reações químicas 1 TIPOS DE REAÇÕES QUÍMICAS Introdução Várias reações da química inorgânica podem ser classificadas em uma das quatro categorias: combinação, decomposição, deslocamento simples
Corrosão Metálica. Introdução. O que é corrosão? Classificação dos processos de corrosão. Principais tipos de corrosão
 Corrosão Metálica Introdução O estudo da corrosão de superfícies é importante para a solução de problemas de peças e equipamentos. Ter o conhecimento dos tipos de corrosão existentes, compreender os seus
Corrosão Metálica Introdução O estudo da corrosão de superfícies é importante para a solução de problemas de peças e equipamentos. Ter o conhecimento dos tipos de corrosão existentes, compreender os seus
SAIS E ÓXIDOS FUNÇÕES INORGÂNICAS
 SAIS E ÓXIDOS FUNÇÕES INORGÂNICAS SAIS Os sais são comuns em nosso cotidiano: SAIS São compostos iônicos que possuem, pelo menos um cátion diferente do H + e um ânion diferente do OH -. Exemplos: NaCl
SAIS E ÓXIDOS FUNÇÕES INORGÂNICAS SAIS Os sais são comuns em nosso cotidiano: SAIS São compostos iônicos que possuem, pelo menos um cátion diferente do H + e um ânion diferente do OH -. Exemplos: NaCl
GRUPO 15 NITROGÊNIO E SEUS COMPOSTOS
 GRUPO 15 NITROGÊNIO E SEUS COMPOSTOS O nitrogênio é um gás, sendo o principal componente da nossa atmosfera com cerca de 78% em massa do ar atmosférico. O elemento é também dotado de uma alta energia de
GRUPO 15 NITROGÊNIO E SEUS COMPOSTOS O nitrogênio é um gás, sendo o principal componente da nossa atmosfera com cerca de 78% em massa do ar atmosférico. O elemento é também dotado de uma alta energia de
para as soluções e pressão para gases. Identificar o par
 Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
Processo de Soldagem MIG/MAG. Processo MIG / MAG Prof. Vilmar Senger
 Processo de Soldagem MIG/MAG Gases de proteção O ar atmosférico é expulso da região de soldagem por um gás de proteção com o objetivo de evitar a contaminação da poça de fusão. A contaminação é causada
Processo de Soldagem MIG/MAG Gases de proteção O ar atmosférico é expulso da região de soldagem por um gás de proteção com o objetivo de evitar a contaminação da poça de fusão. A contaminação é causada
Dependendo do diâmetro (Ø) das partículas que constituem o disperso, as dispersões podem ser:
 Soluções Químicas A mistura de dois ou mais materiais podem ser uma perfeita dissolução denominada mistura homogênea ou uma separação total das partes constituintes do sistema a qual chamamos mistura heterogênea.
Soluções Químicas A mistura de dois ou mais materiais podem ser uma perfeita dissolução denominada mistura homogênea ou uma separação total das partes constituintes do sistema a qual chamamos mistura heterogênea.
QUÍMICA. em 100mL dessa solução.
 QUÍMICA 36. Essa questão trata sobre soluções aquosas e as diferentes formas de expressar suas concentrações. Trata ainda de suas propriedades e das reações que podem ocorrer entre elas. 0 0 A concentração
QUÍMICA 36. Essa questão trata sobre soluções aquosas e as diferentes formas de expressar suas concentrações. Trata ainda de suas propriedades e das reações que podem ocorrer entre elas. 0 0 A concentração
Abrange todos processo químicos que envolvem transferência de elétrons.
 Abrange todos processo químicos que envolvem transferência de elétrons. Quando um processo químico ocorre, produzindo transferência de elétrons, é chamado de pilha ou bateria. 1 2 Anodo: eletrodo negativo,
Abrange todos processo químicos que envolvem transferência de elétrons. Quando um processo químico ocorre, produzindo transferência de elétrons, é chamado de pilha ou bateria. 1 2 Anodo: eletrodo negativo,
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
CORROSÃO EM FRESTAS ("crevice corrosion")
 CORROSÃO EM FRESTAS ("crevice corrosion") Corrosão relativamente localizada em frestas de uma peça metálica, ou formadas pela sobreposição de outro metal ou de materiais inertes sobre o metal. Exemplos
CORROSÃO EM FRESTAS ("crevice corrosion") Corrosão relativamente localizada em frestas de uma peça metálica, ou formadas pela sobreposição de outro metal ou de materiais inertes sobre o metal. Exemplos
III.1 Classificação das Misturas: Soluções e Dispersões.
 III SOLUÇÕES III.1 Classificação das Misturas: Soluções e Dispersões. Frequentemente as substâncias químicas (elementos e compostos) encontram-se misturadas umas às outras. O sangue, a água do mar, o solo
III SOLUÇÕES III.1 Classificação das Misturas: Soluções e Dispersões. Frequentemente as substâncias químicas (elementos e compostos) encontram-se misturadas umas às outras. O sangue, a água do mar, o solo
Atividades de Recuperação Paralela de Química Setor A
 Atividades de Recuperação Paralela de Química Setor A 2ª série Ensino Médio. Conteúdos para estudos: Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer cálculos
Atividades de Recuperação Paralela de Química Setor A 2ª série Ensino Médio. Conteúdos para estudos: Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer cálculos
Em meio aquoso sofrem dissociação liberando íons na água, o que torna o meio condutor de corrente elétrica.
 Aula 7 Funções Inorgânicas (sais e óxidos) Sal Os sais são compostos que possuem um cátion qualquer (só não pode ser exclusivamente o H +, senão será um ácido) e um ânion qualquer(só não pode ser exclusivamente
Aula 7 Funções Inorgânicas (sais e óxidos) Sal Os sais são compostos que possuem um cátion qualquer (só não pode ser exclusivamente o H +, senão será um ácido) e um ânion qualquer(só não pode ser exclusivamente
4 PROCEDIMENTO EXPERIMENTAL
 34 4 PROCEDIMENTO EXPERIMENTAL 4.1. Metodologia Experimental Figura 7 - Fluxograma geral do processo experimental com o uso de NaOH na ustulação 35 A figura 7 mostra o fluxograma geral do processo. Ele
34 4 PROCEDIMENTO EXPERIMENTAL 4.1. Metodologia Experimental Figura 7 - Fluxograma geral do processo experimental com o uso de NaOH na ustulação 35 A figura 7 mostra o fluxograma geral do processo. Ele
ELETROQUÍMICA. paginapessoal.utfpr.edu.br/lorainejacobs. Profª Loraine Jacobs DAQBI
 lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI CORROSÃO Corrosão Processo espontâneo Contato do metal com um eletrólito Reações Anódicas e Catódicas Frequente
lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI CORROSÃO Corrosão Processo espontâneo Contato do metal com um eletrólito Reações Anódicas e Catódicas Frequente
DATA: 05 / 12 / 2016 III ETAPA AVALIAÇÃO ESPECIAL DE INTRODUÇÃO À QUÍMICA 9.º ANO/EF ALUNO(A): N.º: TURMA: VALOR: 10,0
 SOCIEDADE MINEIRA DE CULTURA Mantenedora da PUC Minas e do COLÉGIO SANTA MARIA DATA: 05 / 2 / 206 UNIDADE: III ETAPA AVALIAÇÃO ESPECIAL DE INTRODUÇÃO À QUÍMICA 9.º ANO/EF ALUNO(A): N.º: TURMA: PROFESSOR(A):
SOCIEDADE MINEIRA DE CULTURA Mantenedora da PUC Minas e do COLÉGIO SANTA MARIA DATA: 05 / 2 / 206 UNIDADE: III ETAPA AVALIAÇÃO ESPECIAL DE INTRODUÇÃO À QUÍMICA 9.º ANO/EF ALUNO(A): N.º: TURMA: PROFESSOR(A):
1 Introdução Princípios Básicos da Corrosão Eletroquímica... 5
 Sumário 1 Introdução................................ 1 2 Princípios Básicos da Corrosão Eletroquímica........ 5 2.1 POTENCIAIS ELETROQUÍMICOS............................ 5 2.2 PILHAS DE CORROSÃO...................................17
Sumário 1 Introdução................................ 1 2 Princípios Básicos da Corrosão Eletroquímica........ 5 2.1 POTENCIAIS ELETROQUÍMICOS............................ 5 2.2 PILHAS DE CORROSÃO...................................17
Exercícios Sobre Potenciais elétricos e Pilhas - Eletroquímica
 Exercícios Sobre Potenciais elétricos e Pilhas - Eletroquímica 01. (U. F. Uberlândia MG) São dadas as seguintes semi-reações, com respectivos potenciais de eletrodos: Mg Mg 2+ + 2e - Ni Ni 2+ + 2e - Cu
Exercícios Sobre Potenciais elétricos e Pilhas - Eletroquímica 01. (U. F. Uberlândia MG) São dadas as seguintes semi-reações, com respectivos potenciais de eletrodos: Mg Mg 2+ + 2e - Ni Ni 2+ + 2e - Cu
Atividades de Recuperação Paralela de Química
 Atividades de Recuperação Paralela de Química 2ª série Ensino Médio Conteúdos para estudos:. Química A Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer
Atividades de Recuperação Paralela de Química 2ª série Ensino Médio Conteúdos para estudos:. Química A Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer
Funções inorgânicas ácidos de Arrhenius
 Funções inorgânicas ácidos de Arrhenius Ácidos são substâncias que, em solução aquosa, sofrem ionização, liberando como cátion somente H +. Ex:. HNO 3 H + + NO 3 Se colocarmos a água como reagente podemos
Funções inorgânicas ácidos de Arrhenius Ácidos são substâncias que, em solução aquosa, sofrem ionização, liberando como cátion somente H +. Ex:. HNO 3 H + + NO 3 Se colocarmos a água como reagente podemos
VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO
 VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO A volumetria de precipitação envolve a reação na qual forma-se um produto de baixa solubilidade. Sua principal aplicação
VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO A volumetria de precipitação envolve a reação na qual forma-se um produto de baixa solubilidade. Sua principal aplicação
RELATÓRIO DE EXPERIMENTO Equilíbrio químico
 UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE ENGENHARIA DA COMPUTAÇÃO DISCIPLINA: QUÍMICA GERAL PROFESSORA: FERNANDA SANTOS CARVALHO DOS ANJOS RELATÓRIO DE EXPERIMENTO Equilíbrio químico Aluno:
UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE ENGENHARIA DA COMPUTAÇÃO DISCIPLINA: QUÍMICA GERAL PROFESSORA: FERNANDA SANTOS CARVALHO DOS ANJOS RELATÓRIO DE EXPERIMENTO Equilíbrio químico Aluno:
Resumo de Química: Pilhas e eletrólise
 Resumo de Química: Pilhas e eletrólise Número de oxidação (NOX) Nox fixo:1a(+1), 2A (+2), Al +3, Zn +2 e Ag + Nox usual: Hidrogênio (+1), exceto nos hidretos metálicos (-1) e Oxigênio (-2), exceto nos
Resumo de Química: Pilhas e eletrólise Número de oxidação (NOX) Nox fixo:1a(+1), 2A (+2), Al +3, Zn +2 e Ag + Nox usual: Hidrogênio (+1), exceto nos hidretos metálicos (-1) e Oxigênio (-2), exceto nos
October, 2013 Osvaldo Araújo
 Prensa-cabos Latão versus Alumínio October, 2013 Osvaldo Araújo Qual o prensa-cabo ideal para ambientes corrosivos? Uma das questões mais colocadas pelo cliente é: que tipo de material usar em ambientes
Prensa-cabos Latão versus Alumínio October, 2013 Osvaldo Araújo Qual o prensa-cabo ideal para ambientes corrosivos? Uma das questões mais colocadas pelo cliente é: que tipo de material usar em ambientes
