Universidade Federal da Bahia. Escola de Medicina Veterinária e Zootecnia. Programa de Pós Graduação em Ciência Animal nos Trópicos
|
|
|
- Brenda Osório Henriques
- 6 Há anos
- Visualizações:
Transcrição
1 Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Programa de Pós Graduação em Ciência Animal nos Trópicos OCORRÊNCIA DE ANTICORPOS ANTI-SARCOCYSTIS NEURONA EM GATOS (FELIS DOMESTICUS) DE SALVADOR, BAHIA Iris Daniela Santos de Meneses Salvador-Bahia 2012
2 ii IRIS DANIELA SANTOS DE MENESES OCORRÊNCIA DE ANTICORPOS ANTI-SARCOCYSTIS NEURONA EM GATOS (FELIS DOMESTICUS) DE SALVADOR, BAHIA. Dissertação apresentada à Escola de Medicina Veterinária e Zootecnia da Universidade Federal da Bahia, como requisito para obtenção do título de Mestre em Ciência Animal nos Trópicos, na área de Saúde Animal Orientador: Prof. Dr. Luís Fernando Pita Gondim Salvador Bahia 2012
3 iii OCORRÊNCIA DE ANTICORPOS ANTI-SARCOCYSTIS NEURONA EM GATOS (FELIS DOMESTICUS) DE SALVADOR, BAHIA. Iris Daniela Santos de Meneses Dissertação defendida e aprovada para obtenção do grau de Mestre em Ciência Animal nos Trópicos Salvador, 10 de fevereiro de 2012 Comissão examinadora: Dr. Luís Fernando Pita Gondim MEV/UFBA Orientador/Presidente Dr. Thiago Campanharo Bahiense ICS/UFBA Dr. Alexandre Moraes Pinheiro UFRB
4 iv
5 v AGRADECIMENTOS Agradeço primeiramente a Deus, por tudo... por tudo!!! Aos meus pais, que sempre estiveram ao meu lado em todos os momentos difíceis e felizes; Ao meu orientador e amigo, Luís Fernando Pita Gondim, exemplo de dedicação, sabedoria e ética; As amigas queridas: Bárbara Paraná, Marta Bittencourt, Laís Silva e Rosângela Uzêda; Aos amigos Dr. Fernando e Lucylla, pela total compreensão...!!! A todos da Diagnovet... minha segunda casa...especialmente à Rey, Gleisson, Messias e Nilson... imprescindíveis na realização deste trabalho. Não sei o que teria feito sem vocês!!! Aos meus filhos presentes, Bahuan, Iron e Carrance e aos saudosos Billy, Belinha, Bilú e Zoião; Aos colaboradores: Jane Queiroz, Karenene, Carlos Fontes, Dr. Jorge e clientes da Diagnovet; A todos do Laboratório de Diagnóstico das Parasitoses dos Animais (LDPA) e do Laboratório de Análises Clínicas (LAC), especialmente Muller, Renato, Ana Carla, Rogério, Leane, Paula, Mari, Rose, Vitor e Romana; Aos funcionários, residentes, estagiários e professores do Hospital de Medicina Veterinária da UFBA; A CAPES, pela bolsa de estudos durante a realização desta pesquisa. Ao Programa de Pós-graduação em Ciência Animal nos Trópicos da EMVZ/UFBA, especialmente aos professores e às funcionárias Kátia e Angélica, sempre disponíveis para ajudar.
6 vi O único lugar onde o sucesso vem antes do trabalho é no dicionário Albert Einstein
7 vii ÍNDICE LISTA DE TABELAS... vii LISTA DE FIGURAS... viii LISTA DE ABREVIATURAS... ix RESUMO... x SUMMARY... xi 1. INTRODUÇÃO GERAL REVISÃO DE LITERATURA Sarcocystis neurona Histórico Ciclo de vida, transmissão e hospedeiros de S. neurona Hospedeiros definitivos Hospedeiros intermediários Infecção em animais silvestres O papel do gato no ciclo do parasito Mieloencefalite Protozoária Equina (MPE) Estudos soroepidemiológicos Diagnóstico Histopatologia Imunoistoquímica Testes sorológicos Testes moleculares ARTIGO CIENTÍFICO CONSIDERAÇÕES GERAIS REFERÊNCIAS ANEXOS
8 viii LISTA DE TABELAS TABELA 1 Soroprevalência da infecção por Sarcocystis neurona em diferentes hospedeiros de várias regiões. página 27
9 ix LISTA DE FIGURAS página FIGURA 1 Merozoítos de Sarcocystis neurona extra e intracelulares cultivados in vitro em células CV-1 16 FIGURA 2 Ciclo de vida e hospedeiros de Sarcocystis neurona 20 FIGURA 3 Frequência de anticorpos anti-s. neurona em 13 gatos soropositivos em Salvador, Bahia 38 FIGURA 4 Monocamada de células CV-1 não infectadas 57 FIGURA 5 Monocamada de células CV-1 infectadas com merozoítos de Sarcocystis neurona. 57
10 x LISTA DE ABREVIATURAS DNA - Ácido desoxirribonucléico ELISA Ensaio de imunoadsorção enzimática EUA Estados Unidos da América IFI Imunofluorescência indireta IFN-γ - Interferon gama IL-4 Interleucina 4 LCR Líquido céfalorraquidiano MPE Mieloencefalite protozoária equina PCR - Reação em cadeia da polimerase SNC Sistema nervoso central T CD4+ - Linfócitos T helper SAT Teste de aglutinação direta UV - Ultravioleta WB Western Blotting
11 xi MENESES, I.D.S. Ocorrência de anticorpos anti-sarcocystis neurona em gatos (Felis domesticus) em Salvador, Bahia. Salvador, Bahia, 2012, p 57. Dissertação (Mestrado em Ciência Animal nos Trópicos); Escola de Medicina Veterinária e Zootecnia, Universidade Federal da Bahia, RESUMO Sarcocystis neurona é um protozoário coccídeo apicomplexa e o agente etiológico da Mieloencefalite Protozoária Equina (MPE). Além de causar infecção em equinos, S. neurona também infecta várias espécies animais em todo o continente americano, causando um grande impacto econômico e ambiental. Os hospedeiros definitivos são os marsupiais Didelphis virginiana na América do norte e central e Didelphis albiventris, primeiramente descrito no Brasil, mas distribuído em toda a extensão da América do sul. O gato doméstico foi o primeiro animal descrito como hospedeiro intermediário deste parasito. No Brasil ainda não há relatos de possíveis hospedeiros intermediários do parasito, porém foi identificada uma alta soroprevalência para S. neurona em eqüinos de diferentes regiões do país. Os objetivos deste trabalho foram implantar a cultura celular para a produção de merozoítos de S. neurona no país e pesquisar anticorpos anti- S. neurona em gatos (Felis domesticus) criados em Salvador, Bahia. Amostras séricas de 89 gatos foram colhidas e testadas através do teste de Imunofluorescência Indireta (IFI) adotando-se como ponto de corte uma diluição sérica de 1:25. Das amostras testadas, 14,6% foram reagentes nas diluições entre 1:25 e 1:400. Estes resultados correspondem ao primeiro relato de anticorpos anti-s. neurona em gatos no Brasil. Conclui-se que gatos de Salvador, Bahia, são expostos a esporocistos de S. neurona. Palavras-chave: Imunofluorescência Indireta, Sarcocystis neurona, gatos, Salvador, Bahia.
12 xii MENESES, I.D.S. Occurrence of antibodies against Sarcocystis neurona in cats (Felis domesticus) in Salvador, Bahia, p 57. Dissertation (MSc in Ciência Animal nos Trópicos), Escola de Medicina Veterinária e Zootecnia, Universidade Federal da Bahia, SUMMARY Sarcocystis neurona is an apicomplexan protozoan coccidian and the etiologic agent of equine protozoal myeloencephalitis (EPM). Besides infecting horses, S. neurona infects several animal species in the Americas and causes a great economic and environmental impact. The definitive hosts are the opossums Didelphis virginiana, in North and Central America, and Didelphis albiventris, firstly described in Brazil, but widely distributed in South America. The domestic cat was the first animal species described as intermediate host of the parasite. In Brazil there are no reports about potential intermediate hosts of the parasite, however a high prevalence of antibodies against S. neurona has been observed in horses from different regions of the country. The aims of this work were to perform cell culture for multiplication of S. neurona merozoites in Brazil, and to perform a serological survey of antibodies against the parasite in cats (Felis domesticus) from Salvador, Bahia. Serum samples of 89 cats were collected and tested by an indirect immunofluorescent assay (IFAT) with a serum dilution of 1:25 as a cut-off. Out of the tested samples, 14.6% were positive at dilutions between 1:25 and 1:400. This is the first report of antibodies against S. neurona in cats in Brazil. It was concluded that cats living in Salvador, Bahia, were exposed to sporocysts of S. neurona. Key-words: indirect immunofluorescent assay, Sarcocystis neurona, cats, Salvador, Bahia
13 12 1. INTRODUÇÃO GERAL Sarcocystis neurona é um protozoário coccídeo formador de cistos e o principal agente etiológico da Mieloencefalite Protozoária Equina (MPE), uma importante síndrome neurológica que acomete eqüídeos em toda a extensão do continente americano (Dubey et al, 2001c). Nos EUA, S. neurona tem sido largamente estudado em eqüinos e em diferentes espécies animais, sendo observados valores variáveis de soroprevalência, a depender da espécie animal e região estudada (Lindsay et al, 2001; Mitchell et al, 2002; Bentz et al, 2003). Na América do sul, apesar da importância da MPE, ainda há poucos estudos sobre S. neurona, porém foi observada uma alta prevalência de anticorpos em eqüinos no Brasil e na Argentina (Dubey et al, 1999c; Hoane et al, 2006). Os hospedeiros definitivos conhecidos de S. neurona são os marsupiais da espécie Didelphis, sendo o D. virginiana encontrado na América do Norte e Central, e o D. albiventris presente no sul do continente americano (Fenger et al, 1995; Dubey et al, 2001b}. O gato doméstico foi descrito como primeiro hospedeiro intermediário de S. neurona, após infecção experimental com esporocistos eliminados por D. virginiana (Dubey et al, 2000). Outras espécies como guaxinins (Procyon lotor) (Dubey et al, 2001d), tatus (Dasypus novemcinctus) (Cheadle et al, 2001c), gambás listrado (Mephitis mephitis) {Cheadle et al, 2001c), lontras (Enhydra lutris) (Dubey et al, 2001e), pássaros de cabeça marrom (Molothrus ater) (Mansfield et al, 2008) já foram descritas como hospedeiros intermediários deste parasito nos EUA, porém ainda não foi descoberto qual o hospedeiro intermediário natural. O diagnóstico da infecção por S. neurona pode ser baseado em testes sorológicos associados a achados histopatológicos, imunoistoquímico, testes moleculares, bioensaio em camundongos e cultivo in vitro. A Imunoflorescência indireta (IFI) vem sendo utilizada com bastante freqüência na detecção de animais soropositivos, pois apresenta altas sensibilidade e especificidade, além de ser menos trabalhosa e dispendiosa quando
14 13 comparada ao Western blotting (WB), considerado padrão ouro para o diagnóstico sorológico de exposição a S. neurona (Dubey et al, 2001c). No Brasil há poucos relatos de soroprevalência em espécies hospedeiras de S. neurona, além de não haver trabalhos sobre os possíveis hospedeiros intermediários do parasito no país (Dubey et al, 1999a; Dubey et al, 2002a; Hoane et al, 2006; Valadas et al, 2009). Objetivou-se, com a realização deste trabalho, implantar o cultivo celular de merozoítos de S. neurona no país e pesquisar anticorpos anti-s. neurona em gatos (Felis domesticus) residentes em Salvador, Bahia.
15 14 2. REVISÃO DE LITERATURA 2.1 Sarcocystis neurona Histórico Sarcocystis neurona é o principal agente etiológico da Mieloencefalite Protozoária Equina (MPE), uma importante síndrome neurológica que acomete equídeos de várias regiões do continente americano (Dubey et al., 2001c). A MPE foi primeiramente descrita em 1970 em Lexington e Filadélfia, baseada em 52 casos de neuropatia em equinos, sendo denominada de mielite segmentar. Na década de 70, cientistas identificaram o agente etiológico desta doença e associaram à infecção por Toxoplasma gondii (Rooney et al., 1970), denominando-a de encefalomielite protozoária eqüina. Há relatos de comprometimento neurológico severo com evolução progressiva nos animais, os quais apresentavam dificuldade de mastigação e deglutição, ataxia, alterações de marcha, andar em círculos e achados histopatológicos caracterizados por infiltrado linfocítico e malácea em região perivascular, hemorragia difusa em Sistema Nervoso Central (SNC) e presença de estruturas ovóides ou alongadas, intra e extracitoplasmáticas, semelhantes a protozoários (Beech and Dodd, 1974). Em trabalhos posteriores verificou-se que este agente apresentava características distintas de T. gondii, passando a ser denominado de S. neurona, e o nome da doença modificado para mieloencefalite protozoária eqüina, como é conhecida atualmente. A confirmação da etiologia desta enfermidade só ocorreu após cultivo in vitro e multiplicação de formas assexuadas de S. neurona em monócito bovino (M617) de amostras coletadas de lesões em sistema nervoso central de equinos infectados (Davis et al., 1991a; Dubey et al., 1991; Dubey et al., 2001c).
16 15 Os primeiros relatos no Brasil ocorreram em 1986 no sul do país, quando foram visualizados organismos semelhantes a S. neurona na medula espinhal de um equino adulto que apresentava alterações neurológicas sugestivas de mielopatia grave (Lombardo de Barros et al., 1986), e na década de 90, (Masri et al., 1992) descreveram dois casos de mieloencefalite parasitária em equinos que apresentavam ataxia, sendo visualizados esquizontes em cortes histológicos de medula espinhal e cérebro destes animais Ciclo de vida, transmissão e hospedeiros de S. neurona Dentre as espécies de Sarcocystis que acometem mamíferos, aves e répteis, S. neurona é uma das mais patogênicas (Dubey et al., 2001c). Este parasito é um protozoário coccídeo formador de cistos teciduais, pertencente ao filo Apicomplexa e família Sarcocystidae (Dubey and Lindsay, 1998). Uma das formas de diferenciação entre as espécies de Sarcocystis é a sua habilidade de infectar e completar os estágios do ciclo em hospedeiros distintos. Parasitos deste gênero possuem um ciclo heteroxênico, ou seja, necessitam de mais de um hospedeiro para completar seu ciclo de vida, ocorrendo o estágio assexuado nos hospedeiros intermediários, com a multiplicação do parasito através de merogonia nas células endoteliais, e o estágio sexuado, por gametogonia, no intestino dos hospedeiros definitivos (Dubey et al., 2001c) Assim como outros protozoários intracelulares relacionados, S. neurona possui três estágios infectantes no seu ciclo de vida: os bradizoítos (que se multiplicam lentamente dentro de cistos, localizados em tecidos musculares dos hospedeiros intermediários), os merozoítos (formas de multiplicação rápida figura 1) e os esporozoítos (presentes no interior dos oocistos) (Dubey et al., 2001c). Diferentemente dos parasitos do mesmo filo, S. neurona divide-se por endopoligenia, produzindo vários merozoítos por esquizonte. Os esquizontes e merozoítos localizam-se fora do vacúolo parasitóforo em qualquer fase de desenvolvimento (Dubey et al., 2001c).
17 16 Figura 1 Merozoítos de Sarcocystis neurona intracelulares (A) e extracelulares (B) cultivados in vitro em células CV-1 (Aumento de 1000x em microscópio óptico - Panótico) Fonte: Laboratório de Diagnóstico das Parasitoses dos Animais/UFBA Nos hospedeiros definitivos o parasito possui uma fase intestinal que culmina com a produção de oocistos, as formas resistentes do parasito no ambiente. Estes apresentam parede delgada, ausência de grânulos polares e de resíduos. Contêm dois esporocistos alongados e elipsoidais, arranjados longitudinalmente e medindo em média 11,3 ± 0,47 µm por 8,2 ± 0,43 µm. Cada esporocisto contém quatro esporozoítos, além de diversos grânulos (Lindsay et al., 2004). Uma vez dentro do trato gastrointestinal do hospedeiro definitivo, ocorre a excistação da maioria dos oocistos e a liberação dos dois esporocistos, cada um contendo quatro esporozoítos. Os esporozoítos penetram na parede do intestino e invadem as células endoteliais de vários órgãos. Estes tornam-se multinucleados, transformando-se em esquizontes, os quais produzem numerosos merozoítos. Os merontes desenvolvem-se nas células hospedeiras, e após a ruptura destas, merozoítos são liberados para a corrente sanguínea(lindsay et al., 2004). Em cortes histológicos de tecidos infectados, merozoítos individuais mediram cerca de 4 x 1 µm e apresentaram um único núcleo vesicular central, arranjados em rosetas ao redor de um corpo residual e não continham roptrias, enquanto que esquizontes maduros mediram até 5-35 x 5-20 µm, com formatos ovais, redondos, alongados ou irregulares (Dubey et al., 1991; Dubey et al., 2001c).
18 17 Nos hospedeiros intermediários, após ocorrência de ciclos de merogonia, os organismos formam sarcocistos (cistos em tecidos musculares contendo inúmeros bradizoítos), que também são microscópicos, podendo medir até 700 µm de comprimento e parede com cerca de 1-2 µm de espessura. Estes cistos servem como fonte de infecção para os hospedeiros definitivos, o que propicia um novo ciclo de multiplicação do parasito (Dubey et al., 2001c). Os bradizoítos são pequenos e delgados (5 µm de comprimento) com numerosos micronemas (Dubey, 2001b; Dubey et al., 2000). Em estudos morfológicos, através de microscopia óptica e eletrônica, foi possível a observação dos mecanismos de infecção de S. neurona em leucócitos dos hospedeiros. Demonstrou-se que os merozoítos conseguem penetrar e sobreviver nos linfócitos por até três dias, o que os confere proteção contra anticorpos presentes no sangue e no liquor. A invasão do agente ocorre ativamente em torno de cinco minutos, impossibilitando a fagocitose pelas células do sistema imune (Lindsay et al., 2006) Hospedeiros definitivos Após evidências de gametogonia em trato intestinal de marsupiais das espécies Didelphis virginiana e Didelphis albiventris, estes foram reconhecidos como os hospedeiros definitivos de S. neurona. A identificação do envolvimento de D. albiventris no ciclo de vida deste parasito foi descrita na América do Sul e América central (Dubey et al., 2000; Dubey et al., 2001b), o que justifica a alta prevalência de anticorpos anti-s. neurona em eqüinos em determinadas regiões do Brasil e Argentina (Dubey et al., 1999a; Dubey et al., 1999c). O D. albiventris é um mamífero popularmente conhecido como gambá de orelha branca. Os membros da família Didelphidae são de pequeno a médio porte, apresentam ampla distribuição na América do Sul, principalmente nas áreas neotropicais. Estes animais possuem hábitos crepusculares, noturnos e alta sinantropia, sendo seu habitat natural as matas primárias e secundárias. Em decorrência de seus hábitos, o gambá é considerado um disseminador de patógenos em potencial, tanto entre animais silvestres
19 18 quanto em relação aos animais domésticos e o homem (Muller et al, 2005) Com a destruição do habitat destes animais, principalmente devido a queimadas e desmatamentos, os marsupiais têm se aproximado das regiões peridomiciliar e domiciliar, onde procuram abrigos e alimentos, o que favorece o contato dos hospedeiros domésticos e selvagens com os seus dejetos, e conseqüentemente, a transmissão de S. neurona (Rickard et al., 2001). Os marsupiais são onívoros e considerados limpadores, alimentam-se de frutos, insetos e carcaças abandonadas de roedores, répteis, anfíbios, filhotes de aves e pequenos mamíferos (Rickard et al., 2001; Dubey et al, 2001c}. No sistema digestivo dos marsupiais, ocorre a digestão proteolítica das paredes dos cistos, a liberação dos bradizoítos, formação dos gametócitos nas células epiteliais intestinais, reprodução sexuada e liberação dos oocistos contendo os esporocistos nas fezes (Dubey et al., 2000). O estágio sexuado que ocorre nos hospedeiros definitivos conhecidos, não causa lesões ou alterações clínicas nestes animais, os quais podem albergar milhões de oocistos no epitélio intestinal, no entanto, liberando poucos oocistos ou esporocistos no ambiente (Mullaney et al., 2005). A transmissão transplacentária de S. neurona ainda não foi comprovada nos hospedeiros definitivos (Cheadle et al., 2002; Duarte et al., 2004). Embora testes moleculares confirmem a presença de esporocistos de S. neurona em fezes e raspados intestinais de marsupiais Didelphis virginiana em Michigan e na Califórnia (Elsheikha et al., 2004a; Rejmanek et al., 2009), os exames sorológicos apresentam baixa sensibilidade para a detecção de animais soropositivos, podendo ser devido à mínima produção de anticorpos detectáveis ou reatividade a parasitos antigenicamente semelhantes. Em um estudo realizado na Califórnia, observou-se que a localização dos animais, estação do ano, período reprodutivo e presença de filhotes na bolsa (marsúpio) são fatores de risco para infecções por S. neurona em Didelphis virginiana (Rejmanek et al., 2009)
20 19 Em 2004, na Virginia, realizou-se a coleta e identificação molecular de esporocistos encontrados em raspados intestinais de marsupiais D. virginiana. A maioria dos animais estudados estava infectada com S. neurona e S. falcatula, observando-se também hospedeiros coinfectados (Elsheikha et al., 2004b) Hospedeiros intermediários Ao contrário da maioria das espécies de Sarcocystis, S. neurona parece manter a sua existência através de múltiplos hospedeiros intermediários. Estes se infectam após a ingestão de água e alimentos contaminados com esporocistos eliminados pelos hospedeiros definitivos (Dubey et al., 2001a; Dubey et al., 2002b; Butcher et al., 2002). O gato doméstico foi o primeiro animal descrito como hospedeiro intermediário experimental deste parasito (Dubey et al., 2000), porém várias espécies como os tatus (Dasypus novemcinctus), guaxinins (Procyon lotor), lontras marinhas (Enhydra lutris), gambás listrados (Mephitis mephitis) e pássaros (Molothrus ater) (Cheadle et al., 2001b; Tanhauser et al., 2001;Dubey et al., 2001d; Cheadle et al., 2001c; Gillis et al., 2003; Mansfield et al., 2008) também já foram descritos como hospedeiros intermediários e acidentais de S. neurona, no entanto ainda é desconhecido o hospedeiro intermediário natural deste agente (Figura 2).
21 20 Figura 2 Ciclo de vida e hospedeiros de Sarcocystis neurona. (Fonte: Traduzido para o português Os principais obstáculos na investigação de novos hospedeiros do parasito são as possíveis reações cruzadas com as várias espécies de Sarcocystis em testes sorológicos e a impossibilidade de identificação de estágios teciduais infectantes através de microscopia óptica (Cheadle et al., 2001a; Cheadle et al., 2001b), porém é possivel a diferenciação entre essas espécies relacionadas através de testes moleculares (Tanhauser et al., 1999) Os hospedeiros aberrantes ou acidentais de S. neurona são aqueles animais que possuem estágios assexuados de multiplicação do parasito, porém sem a formação de cistos contendo bradizoítos; os estágios assexuados podem ser identificados, geralmente em encéfalo, medula espinhal ou qualquer parte do sistema nervoso central (Dubey et al., 2001c). Anteriormente, os equinos eram descritos somente como hospedeiros aberrantes do parasito, porém em relatos atuais, foram observados esquizontes no encéfalo e
22 21 medula espinhal de animais infectados, além de sarcocistos maduros na língua e músculo esquelético, ambos com confirmação morfológica e molecular. Sendo assim, foi evidenciado o papel do equino como um hospedeiro intermediário em potencial, no entanto ainda não há estudos que possam comprovar a produção de oocistos pelos marsupiais após ingestão de tecidos de equinos infectados (Mullaney et al., 2005) Infecção em animais silvestres Várias espécies de animais silvestres são descritas como hospedeiros intermediários (tatus, gambás, lontras, guaxinins e pássaros) de S. neurona, porém raramente estes são sintomáticos (Dubey et al., 2001d; Cheadle et al., 2001b; Dubey et al., 2001e; Lindsay et al., 2001; Cheadle et al., 2002; Mansfield et al., 2008; Burcham et al., 2010). Em diferentes trabalhos de soroprevalência, pesquisadores americanos sugerem que os guaxinins são bastante susceptíveis à infecção por S. neurona, além de muitas vezes apresentarem sintomatologia clínica severa (Hamir and Dubey, 2001; Dubey et al., 2001d; Lindsay et al., 2001; Mitchell et al., 2002; Hancock et al., 2004). Em Indiana, EUA, um gambá listrado (Mephitis mephitis) foi submetido à eutanásia e necropsia após apresentar acentuadas alterações neurológicas. Ao exame histopatológico, notaram-se numerosos esquizontes intracitoplasmáticos associados à intensa necrose vascular em parênquima pulmonar e hepático, áreas de encefalite e focos de rinite linfo-histiocítica. S. neurona foi confirmado por meio de exame imunohistoquímico e PCR. Neste caso, a constatação de infecção concomitante com o vírus da cinomose é sugestiva de que a imunossupressão facilitou o desenvolvimento da sarcocistose sistêmica (Burcham et al, 2010). Embora S. neurona tenha afinidade pelo sistema nervoso central, alguns hospedeiros podem apresentar infecções disseminadas para outros tecidos. Através de testes moleculares, histopatológico e imunoistoquímico, em achados de necrópsia observou-se severa mieloencefalite e rinite em um ferret juvenil (Mustela putorius furo)
23 22 naturalmente infectado por S. neurona, possivelmente associada à imunodepressão após vacinação contra cinomose (Britton et al, 2010). Nos EUA, foi relatado um caso de encefalite e retinocoroidite em uma lontra marinha (Enhydra lutris nereis) encontrada morta nesta região. Identificou-se também que a infecção por S. neurona foi considerada um importante fator de risco para cardiomiopatias nesta espécie (Kreuder et al., 2005). Em avaliações de morbidade e mortalidade em lontras marinhas, este parasito foi descrito como um dos agentes que causam doença fatal nesses animais ( Miller et al, 2009; Dubey and Thomas, 2011). Durante uma investigação epidemiológica realizada no Brasil, amostras de capivaras (Hydrochoerus hydrochaeris) de diferentes regiões de São Paulo foram enviadas e testadas nos EUA, observando-se baixa freqüência de animais soropositivos para S. neurona (Valadas et al, 2009) O papel do gato no ciclo do parasito Os felinos são conhecidos como hospedeiros definitivos de mais de 15 espécies diferentes de Sarcocystis (Collins et al., 1978; Dubey et al., 1994; Gillis et al., 2003). Em exame histológico de amostras musculares de gatos naturalmente infectados, foram observados sarcocistos, encontrados principalmente no quadríceps, sendo estes muitas vezes visíveis em tecidos frescos, contudo, as espécies não foram identificadas. Também não foi observada reação inflamatória em torno dos cistos teciduais (Gillis et al., 2003). Em infecção experimental, após ingestão de grande número de esporocistos de S. neurona eliminados por marsupiais naturalmente infectados, houve a formação de cistos teciduais em gatos, e por sua vez, os tecidos destes animais foram infectantes para os hospedeiros definitivos, demonstrando-se assim, a importância potencial desta espécie no ciclo de vida deste parasito (Turay et al., 2002; Stanek et al., 2003). Em estudo sobre a possível dieta de 68 marsupiais, hospedeiros definitivos do S. neurona, 2,4% de carcaça de gato foi observado no volume total de alimentos
24 23 consumidos por estes animais (Reynolds, 1945). Também já foi demonstrado um gato selvagem naturalmente infectado que serviu como hospedeiro intermediário viável (Turay et al., 2002). Em São Paulo foram analisadas 502 amostras séricas de felinos, porém não foram encontrados animais soropositivos para S. neurona utilizando-se o teste de aglutinação, com ponto de corte 1:50, o que é sugestivo de que os gatos desta região não são expostos à esporocistos deste parasito (Dubey et al., 2002a). Em criações de equinos com histórico de MPE em regiões próximas à Ohio, a alta soroprevalência para S. neurona foi relacionada à presença de gatos domésticos, vadios e marsupiais que viviam próximos aos animais. Os felinos também foram testados e apresentaram alta soroprevalência quando comparados com animais que não tinham vida livre (Stanek et al., 2003). Diferentemente do que foi descrito anteriormente, a presença de anticorpos anti-s. neurona em equinos e felinos, assim como a identificação esporocistos intestinais nos hospedeiros definitivos sugerem que os gatos são comumente infectados e podem servir como importantes hospedeiros intermediários naturais do parasito (Rossano et al., 2002). Enquanto dados indicam baixa a moderada percentagem de gatos domésticos com anticorpos anti-s. neurona circulantes, a doença neurológica é raramente descrita nesta espécie. Vários autores sugerem que a imunossupressão possa ser importante na patogênese da doença associada à infecção por Sarcocystis (Gillis et al., 2003; Bisby et al, 2010). Apesar desta hipótese não ter sido confirmada em felídeos, há um relato de encefalomielite em um gato causada por S. neurona após castração eletiva, o que sugere infecção protozoária disseminada após estresse cirúrgico (Dubey et al., 2003a). Em camundongos nocauteados em interferon gama, a doença disseminada com meningoencefalite foi observada, mas não é comum em camundongos imunocompetentes, sugerindo a imunossupressão como facilitador da disseminação extraneural de S. neurona nesta espécie (Marsh et al., 1997; Dubey et al., 2003a; Britton et al., 2010) Em alguns casos, os gatos domésticos podem tornar-se sintomáticos, apresentando alterações clínicas neurológicas como ataxia, anisocoria, hiperestesia
25 24 espinhal, tremores musculares, convulsões, andar em círculos, vocalização, letargia e estupor tendo como diagnósticos diferenciais infecções por Toxoplasma gondii, Criptococcus sp, Vírus da Peritonite infecciosa felina, leucemia felina, imunodeficiência felina e neoplasias como o linfoma (Bisby et al, 2010). Há um relato de encefalite parasitária em felino doméstico, tendo o diagnóstico presuntivo através da análise do líquido cefalorraquidiano (LCR), observando-se acentuada pleocitose neutrofílica e presença de merozoítos de Sarcocystis sp extra e intracitoplasmáticos. Esta infecção foi confirmada através de testes sorológicos e moleculares, principalmente para diagnóstico diferencial de outros protozoários relacionados (Bisby et al, 2010). Gatos imunocompetentes, ao ingerirem esporocistos de S. neurona, soroconvertem em 20 dias após inoculação, enquanto que gatos tratados com cortisona, soroconvertem precocemente sete dias após a inoculação (Dubey et al., 2002b). O papel exato dos gatos no ciclo de vida de S. neurona ainda é incerto. Acreditase que o nicho ecológico compartilhado por marsupiais e os possíveis hospedeiros intermediários naturais do parasito possam permitir a caça destas espécies, sendo esta relação predador-presa a causa significativa da contaminação ambiental. Sabe-se também que gatos frequentemente residem em torno de celeiros de equinos, o que é sugestivo de que felinos são importantes na epidemiologia da MPE (Stanek et al., 2003) Mieloencefalite Protozoária Equina (MPE) A MPE é uma importante síndrome neurológica que acomete equinos e que tem apresentação clínica grave, incluindo sintomas como apatia, fraqueza, ataxia, incoordenação motora, perda de massa muscular, alterações comportamentais e morte (Masri et al., 1992; Dubey et al., 2001c). Após a exposição ao parasito, a maioria dos equinos torna-se soropositiva, porém estes podem ser assintomáticos durante toda a vida. Em alguns animais, S.
26 25 neurona migra para o sistema nervoso central causando encefalite, o que é indicativo da afinidade do parasito pelo tecido nervoso (MacKay, 1997a). As infecções naturais também podem ser disseminadas, havendo comprometimento do cérebro e outros órgãos, porém são incomuns em animais imunocompetentes (Burcham et al, 2010). Com relação à resposta imune em equinos, ainda não está claro se a imunossupressão aumenta a probabilidade do desenvolvimento da doença ou se animais infectados são, em seguida, suprimidos pelo parasito, tornando-se sintomáticos, semelhantemente ao que ocorre com outros protozoários relacionados como T. gondii, que suprime a resposta imune do hospedeiro facilitando a disseminação do agente (Saville et al., 2000; Tornquist et al., 2001; Spencer et al., 2004). A hipótese de maior susceptibilidade à MPE em decorrência da imunossupressão foi confirmada quando se constatou que animais de exposições, competições, em transporte e fêmeas gestantes apresentavam maior risco de desenvolver a doença devido à imunossupressão causada pelo estresse temporário (Saville et al., 2000). Estes achados podem ocorrer devido ao aumento de produção de interleucina 4 (IL-4) pelos linfócitos T auxiliares (CD4+) que favorecem uma resposta com preponderância de células Th2, sendo esta inapropriada para a maioria dos microrganismos intracelulares. A resposta imune adequada para estes agentes é do tipo Th1 (mediada por células), em resposta ao aumento da produção de interferon gama (IFN-γ) pelos linfócitos (Spencer et al., 2005). Devido à crescente preocupação com a MPE, equinos nos EUA têm sido frequentemente testados através de testes sorológicos para avaliação de exposição à S. neurona. Nos animais jovens, vários fatores podem dificultar a interpretação de resultados positivos, incluindo o potencial de exposição uterina, transferência passiva de anticorpos maternos através do colostro e a persistência de anticorpos maternais. Como a placenta do equino é do tipo epiteliocorial, não ocorre transferência passiva de anticorpos da mãe para o feto antes do nascimento, porém o feto equino é capaz de montar uma resposta imune humoral após 180 dias de gestação, sendo assim, se houver exposição após este período, anticorpos específicos séricos próprios estarão circulantes após o nascimento antes da ingestão do colostro (Cook et al., 2001).
27 26 Animais hígidos e jovens, com até três meses de idade, filhos de éguas soropositivas, foram testados para presença de anticorpos séricos e no liquor, sendo observada alta reatividade, sugerindo a possível transferência passiva de imunoglobulinas maternas dificultando o diagnóstico sorológico da infecção em neonatos e potros (Cook et al., 2002) Estudos soroepidemiológicos Há diversos trabalhos sobre a presença de S. neurona nas Américas (Tabela 1), porém ainda há poucos relatos na América do Sul, principalmente no Brasil. Nos Estados Unidos, onde maiores esforços foram empreendidos no estudo da MPE, estimou-se o prejuízo anual em até 100 milhões de dólares e este impacto econômico inclui perda de carcaças, gastos com medicamentos e veterinários, além do longo período de tratamento (Dubey et al., 2001c). A soroprevalência em equinos nos Estados Unidos e na América do Sul é de aproximadamente 50 e 35%, respectivamente (Dubey et al., 1999a; Dubey et al., 1999c; MacKay, 1997b; Saville et al., 1997; Bentz et al., 2003). Na tentativa de diminuição das perdas econômicas causadas pela MPE, foram realizados estudos epidemiológicos com possíveis hospedeiros intermediários, investigando-se a presença de anticorpos anti-s neurona, com o objetivo de se estabelecer os riscos de exposição ao parasito e os métodos de controle. Nos Estados Unidos, foi observado que o número de marsupiais e equídeos infectados e a contaminação ambiental com esporocistos de S. neurona durante o verão era maior do que no inverno. Isto se deve à reduzida sobrevivência dos esporocistos no ambiente nas épocas mais frias, reduzindo as chances de exposição dos hospedeiros (Rickard et al., 2001)
28 27 Tabela 1. Soroprevalência da infecção por Sarcocystis neurona em diferentes hospedeiros de várias regiões. Região Espécie Animais Teste Referência soropositivos (%) Oregon EUA EQ 45,0% WB (Blythe et al., 1997) Ohio EUA EQ 53,0% WB (Saville et al., 1997) Pensilvania EUA EQ 45,3% WB (Bentz et al., 1997) Brasil EQ 35,6% WB (Dubey et al., 1999a) Argentina EQ 35,5% SAT (Dubey et al., 1999c) Flórida, Nova Jersey, Massachusetts, Pensilvânia EUA GX 58,6% SAT (Lindsay et al., 2001) Nova Zelândia, Missouri, Montana, Califórnia e Flórida EUA EQ 26,0% IFI e WB (Vardeleon et al., 2001) Michigan EUA EQ 60,0% WB (Rossano et al., 2001) São Paulo, Brasil GT 0,0% SAT (Dubey et al., 2002a) Coréia EQ 0,0% IFI e (Gupta et al., 2002) WB Connecticut, EUA GL, GX e MA GL 46,0% GX -100% MA 78,0% SAT (Mitchell et al., 2002) Oklahoma EUA EQ 89,0 % WB (Bentz et al., 2003) Wyoming EUA EQ WB- 6,5% WB (Dubey et al., 2003b) SAT- 14,7% Ohio EUA GT EQ GT 40,0% EQ - >75% WB SAT (Stanek et al., 2003) Virgínia EUA GX 92,3% SAT (Hancock et al., 2004) Brasil EQ 69,6% SAT (Hoane et al., 2006) Georgia EUA LM 25,0% ELISA (Yabsley et al., 2007) São Paulo, Brasil CP 3,0% SAT (Valadas et al., 2009) Costa Rica EQ 42,2% IFI (Dangoudoubiyam et al.) Louisiana - EUA MA 17,0% ELISA (Houk et al.,2010) Virginia e Pensilvania - EUA GT 9,0% Virginia 5,0% Pensilvania IFI (Hsu et al., 2010) Testes diagnósticos: WB Western blotting; IFI Imunofluorescência Indireta; SAT Teste de aglutinação direta; ELISA Ensaio de imunoadsorção enzimática. Espécies: EQ- Equídeos; GL Gambás litrados GX Guaxinins; GT Gatos; LM Lêmures; CP- Capivaras; MA Marsupiais.
29 Diagnóstico Geralmente o diagnóstico definitivo de infecção por S. neurona é confirmado após o óbito do animal, através de histopatologia, imunoistoquímica, cultivo celular e PCR. Estes testes baseiam-se, respectivamente, na morfologia do parasito nos tecidos em cortes histológicos e reconhecimento por anticorpos específicos (Dubey et al., 2001c; Johnson et al., 2010), na manutenção do parasito in vitro e na detecção do DNA do S. neurona através de técnicas moleculares (Davis et al., 1991b; Elsheikha et al., 2006) Histopatologia O exame histopatológico é empregado para a observação de lesões características da infecção por S. neurona e das formas evolutivas do parasito, principalmente os cistos, esquizontes e merozoítos (Burcham et al., 2010). Este teste geralmente é realizado em amostras de tecidos de animais necropsiados. Embora não seja possível diferenciar S. neurona de outros coccídeos relacionados através da microscopia óptica, achados histológicos podem ser sugestivos da espécie do parasito através de características inerentes ao agente, como formas de divisão celular, afinidade e localização tecidual, formas evolutivas distintas, hospedeiros e espessura de parede cística (Dubey et al., 2001c). Por meio da microscopia eletrônica, é possível avaliar minuciosamente a ultraestrutura de S. neurona, como organelas presentes e divisão celular por endopoligenia. Apesar de sua grande importância, esta técnica é geralmente utilizada para fins de pesquisa devido ao alto custo do exame e necessidade de mão-de-obra qualificada (Dubey et al., 2001a) As lesões visualizadas em cortes histológicos de equinos acometidos pela MPE são geralmente localizadas nas substâncias branca e cinzenta, mais pronunciadas na medula espinhal e cérebro. Essas lesões demonstram múltiplas áreas de necrose,
30 29 acompanhadas por hemorragias e infiltrado linfocitário, plasmocitário, eosinofílico, e ocasionalmente, observa-se a presença de células gigantes (MacKay, 1997a; Cutler et al., 2001) Imunoistoquímica A imunoistoquímica é uma técnica em que são utilizados anticorpos monoclonais ou policlonais para a detecção de antígenos presentes em preparações citológicas ou em tecidos fixados. É uma técnica qualitativa que apresenta altas sensibilidade e especificidade (Dubey and Hamir, 2000; Britton et al., 2010). Tecidos parasitados com S. neurona são facilmente detectados por imunoistoquímica, particularmente merozoítos e esquizontes, porém esta técnica não deve ser utilizada para a distinção entre espécies de Sarcocystis. Foi demonstrado que os sarcocistos não são intensamente corados quando marcados com anticorpos policlonais. Isto deve-se ao método de preparação dos anticorpos contra merozoítos e esquizontes em cultivo celular, os quais não reconhecem os bradizoítos que estão no interior dos cistos (Dubey et al., 1999b) Testes sorológicos As técnicas sorológicas consistem na detecção de anticorpos circulantes em fluidos corporais e podem ser realizadas como indicadores de infecção em animais sintomáticos e para inquéritos epidemiológicos. O diagnóstico antemortem é mais preciso se houver sinais clínicos compatíveis com doenças que atingem SNC (excluindo outras causas comuns de neuropatias e lesões músculo-esqueléticas) e confirmação de exposição ao S. neurona através de testes sorológicos (Dubey et al., 2001b; Johnson et al., 2010). O diagnóstico sorológico de exposição para S. neurona em marsupiais é complicado porque estas espécies são hospedeiros definitivos e intermediários de outras
31 30 espécies de Sarcocystis, o que aumenta as chances de reações cruzadas (Houk et al., 2010). A detecção de imunoglobulinas séricas indica a exposição prévia ao parasito, porém não é definitivo para o diagnóstico da doença. A presença de anticorpos específicos para S. neurona no liquor é mais sugestivo de infecção ativa, pois indica uma resposta imune intratecal após a invasão de SNC pelo microrganismo (Furr, 2006). No entanto, se houver intensa contaminação do liquor com sangue durante a colheita da amostra, anticorpos séricos podem ser detectáveis, produzindo resultados falsopositivos {Dubey et al, 2001c) O primeiro teste sorológico específico para a MPE foi o Western blotting (WB), o qual ainda é considerado padrão ouro para o diagnóstico antemortem de exposição ou infecção por S. neurona em equinos. Neste teste, o antígeno solúvel é separado por eletroforese e depois transferido para uma membrana específica, permitindo que, após a incubação com a amostra, proteínas específicas sejam reconhecidas por anticorpos. Com esta técnica é possível a detecção de imunoglobulinas específicas no soro e no liquor, apresentando 89% de sensibilidade e especificidade, porém possui a desvantagem de ser um teste laborioso e necessitar de reagentes espécie-específicos (Dubey et al, 2001c ; Daft et al., 2002). No intuito de desenvolver testes diagnósticos mais simples que apresentem alta sensibilidade e especificidade, ensaios atuais desenvolvidos para detecção de anticorpos, incluindo testes de aglutinação direta (SAT), reações de imunofluorescência indireta (IFI) e diferentes tipos de ensaio de imunoadsorção enzimática (ELISA), já foram descritos para o diagnóstico de infecções por S. neurona e outros protozoários relacionados, como Neospora caninum e Toxoplasma gondii (Granstrom et al., 1993; Lindsay and Dubey, 2001; Duarte et al., 2003; Stanek et al., 2003;Hoane et al., 2005) A SAT é uma técnica que tem como princípio a utilização de partículas antigênicas insolúveis na sua forma íntegra ou fragmentada, e consiste na avaliação da reação antígeno-anticorpo utilizando diluições seriadas de amostras com anticorpos em quantidade constante de antígeno. Apresenta as vantagens de ser de fácil execução, ter
32 31 basto custo e de não necessitar de reagentes espécie-específicos para a sua realização, porém apresenta baixa especificidade (Lindsay et al., 2001; Dubey et al., 2002a). Testes quantitativos, como a Imunofluorescência Indireta (IFI), consistem na reação antígeno-anticorpo detectada através de um conjugado marcado com um fluorocromo e emissão de fluorescência em microscopia com ultravioleta (UV). Esta técnica é utilizada mundialmente e pode ser empregada para diagnóstico antemortem e levantamentos epidemiológicos de diversas doenças infecciosas (Duarte et al., 2003). Em 2001, Vardeleon et al., (2001) referenciam a utilização da IFI para a realização de triagem de animais soropositivos para S. neurona e Neospora huguesi, testando animais possivelmente assintomáticos em regiões que apresentam alta prevalência de MPE, favorecendo assim o tratamento precoce e consequentemente a possível cura do animal. Embora esta técnica possa apresentar elevadas sensibilidade e especificidade, a utilização de baixo ponto de corte pode ter aspectos negativos, pois esta síndrome neurológica pode ser falsamente diagnosticada resultando em gastos desnecessários com o tratamento de animais sadios, além de confundir o manejo clínico em infecções com outras agentes etiológicos. Por isso, é recomendando a confirmação através do imunoblotting. A IFI apresenta vantagem no diagnóstico da infecção por S. neurona devido a possibilidade de escolha de um ponto de corte para uma amostra com resultado positivo, aumentando a sensibilidade ou especificidade do teste, a depender do ponto de corte escolhido. Sendo assim, quanto maior o ponto de corte utilizado na IFI, maior a especificidade, enquanto que menores diluições maximizam a sensibilidade. Em trabalhos anteriores, demonstrou-se que a IFI é um teste menos trabalhoso, menos dispendioso e mais rápido do que o WB, e sua natureza quantitativa apresenta grande vantagem no diagnóstico da infecção por S. neurona (Duarte et al., 2003). A IFI apresentou sensibilidade e especificidade superiores para a detecção de anticorpos anti-s. neurona quando comparada a outras técnicas sorológicas e pode ser utilizada em inquéritos epidemiológicos para diferentes espécies hospedeiras (Duarte et al., 2003; Hsu et al., 2010) Em 2010, a IFI foi utilizada para a detecção de anticorpos em marsupiais objetivando-se determinar a prevalência de infecção por S. neurona e
33 32 outros protozoários relacionados em Didelphis sp em Lousiana (Houk et al., 2010; Johnson et al., 2010). A IFI pode ser realizada com amostras de LCR, que mesmo contaminadas com amostras de sangue de animais com concentrações séricas de anticorpos, não apresentariam resultados falso positivos. Porém, a concentração de eritrócitos não deve ultrapassar /mm 3 e o título de anticorpos séricos do animal testado não deve ser maior do que 160 (Finno et al., 2007). Em alguns trabalhos é relatado um teste ELISA com a utilização de proteínas imunogênicas localizadas na superfície do parasito, tendo a finalidade de aumentar a sensibilidade e especificidade do teste. Estas proteínas de superfície apresentam diferenças moleculares significativas a depender da forma parasitária do agente, porém estas são importantes para a progressão do desenvolvimento do parasito através dos estágios do ciclo de vida (Gautam et al., 2011 ; Yeargan and Howe, 2011). O ELISA apresenta como vantagem a interpretação objetiva, menores custos, tempo e trabalho, além de fornecer um resultado quantitativo (Yeargan and Howe, 2011), sendo utilizado para a diferenciação de quadros de MPE e mielopatia cervical compressiva em equinos (Furr et al., 2011) Testes moleculares A PCR é um método de amplificação do material genético in vitro. No diagnóstico de infecção por S. neurona, esta técnica geralmente é empregada em amostras de biópsias ou necropsias (Miller et al., 2009) A detecção de DNA do parasito por PCR no liquor também pode fornecer informações quanto à presença do agente no SNC. A sensibilidade é menor do que a observada em exames sorológicos, pois raramente são observados merozoítos intactos no liquor e o seu DNA é rapidamente destruído devido à ação enzimática imediata. Porém, este teste pode ser utilizado em amostras de tecidos contendo as diferentes
34 33 formas parasitárias microscópicas de S. neurona, sendo complementar no diagnóstico da MPE em animais sintomáticos e soronegativos (Marsh et al., 1996; Dubey et al., 2001c; Rejmanek et al., 2010). Diferentes primers são utilizados para a detecção de potenciais marcadores no DNA de protozoários do gênero Sarcocystis, possibilitando a diferenciação do material genético dos esporocistos de diferentes espécies que apresentam o D. albiventris como hospedeiro definitivo (Tanhauser et al., 1999).
35 34 3. ARTIGO CIENTÍFICO Ocorrência de anticorpos anti-sarcocystis neurona em gatos (Felis domesticus) em Salvador, Bahia. Occurrence of antibodies against Sarcocystis neurona in cats (Felis domesticus) in Salvador, Bahia MENESES 1, Iris Daniela Santos de; UZÊDA 1 Rosângela Soares; BITTENCOURT 1, Marta Vasconcelos,; ANDRADE 1, Muller Ribeiro; LINDSAY 2, D.; GONDIM 1, Luís Fernando Pita. 1-Universidade Federal da Bahia, Escola de Medicina Veterinária, Departamento de Patologia e Clínicas, Avenida Ademar de Barros, 500, Ondina, Salvador, Bahia, Brasil Center for Molecular and Infectious Diseases, Department of Biomedical Sciences and Pathobiology, Virginia-Tech, 1410 Prices Fork Road, Blacksburg, VA , USA. Resumo Sarcocystis neurona é um protozoário coccídeo formador de cistos teciduais, agente etiológico da Mieloencefalite Protozoária Equina, uma severa síndrome neurológica que acomete eqüinos e causa grande impacto econômico nas Américas, continente em o parasito está distribuído. Este agente apresenta como hospedeiros definitivos os marsupiais Didelphis virginiana e D. albiventris, e como hospedeiros intermediários, alguns vertebrados (gatos, guaxinins, gambás listrados, tatus, lontras marinhas e pássaros). O objetivo deste trabalho foi avaliar a ocorrência de anticorpos anti-s. neurona em gatos (Felis domesticus) residentes em Salvador, Bahia. Foram analisadas 89 amostras séricas de felinos domiciliados e não domiciliados através do teste de imunofluorescência indireta. Das amostras testadas, 14,6% (13/89) foram positivas para anticorpos anti-s. neurona nas diluições de 1:25 a 1:400. Conclui-se que gatos de Salvador, Bahia são expostos a esporocistos de S. neurona. Palavras-chaves: Sarcocystis neurona, Imunofluorescência indireta, Gatos Abstract Sarcocystis neurona is a cyst-forming protozoan coccidian and etiologic agent of equine protozoal myeloencephalitis (EPM), a severe neurological syndrome that affects horses and causes a great economic impact in the Americas, where the parasite occurs. The marsupials Didelphis virginiana and D. albiventris are the definitive hosts, and several vertebrates serve as intermediate hosts (cats, raccoons, skunks, armadillos, sea otters and birds). The aim of this work was to evaluate the occurrence of antibodies against S. neurona in cats (Felis domesticus) living in Salvador, Bahia. A total of 89 serum samples of housed and feral cats were analyzed by an immunofluorescent antibody test. Out of the tested samples, 14.6% (13/89) were positive for antibodies against S. neurona at dilutions ranging from 1:25 to 1:400. In conclusion, cats from Salvador, Bahia, are exposed to sporocysts of S. neurona. Key-words: Sarcocystis neurona, Immunofluorescent antibody test, Cats
36 35 Introdução Sarcocystis neurona é um protozoário coccídeo formador de cistos teciduais (Dubey and Lindsay, 1998). Desde a sua descoberta, em 1970, tem sido crescente o interesse pelo estudo deste parasito, uma vez que ele é o principal agente etiológico da Mieloencefalite Protozoária Eqüina (MPE), uma síndrome neurológica que acomete eqüinos e com larga distribuição no continente americano (Dubey et al., 2001b). Nos EUA, este parasito foi descrito como o principal agente infeccioso encontrado no SNC de lontras marinhas (Enhydra lutris) que apresentavam meningoencefalite protozoária, sendo responsável por grandes impactos ambientais em regiões costeiras (Thomas et al., 2007). São descritos como hospedeiros definitivos de S. neurona os marsupiais das espécies Didelphis virginiana, presentes na América do Norte, e Didelphis albiventris, encontrados no sul do continente americano. Os hospedeiros definitivos eliminam esporocistos nas fezes após a ingestão de tecidos infectados de hospedeiros intermediários (Dubey et al., 2001a; Rejmanek et al., 2009 ; Rejmanek et al., 2010). O gato doméstico foi a primeira espécie animal identificada como hospedeiro intermediário de S. neurona (Dubey et al., 2000); neste trabalho, gatos foram infectados experimentalmente com esporocistos de S. neurona e desenvolveram cistos teciduais, que após consumidos por gambás (Didelphis virginiana) induziram nestes a excreção de esporocistos do parasito em suas fezes. No Missouri, EUA, tecidos de um gato naturalmente infectado, contendo cistos de S. neurona, foram fornecidos a gambás (D. virginiana), os quais excretaram esporocistos, identificados como S. neurona, por meio de bioensaio e testes moleculares, o que confirma o papel do gato como hospedeiro intermediário natural do parasito (Dubey et al., 2000; Turay et al., 2002). Em estudos soroepidemiológicos foi evidenciada a exposição de gatos a S. neurona em diferentes regiões dos EUA(Hsu et al., 2010; Stanek et al., 2003) Além dos gatos, outras espécies de vertebrados como os tatus (Dasypus novemcinctus) (Cheadle et al., 2001a), guaxinins (Procyon lotor) (Dubey et al., 2001c), lontras marinhas (Enhydra lutris) (Dubey et al., 2001d), gambás listrados (Mephitis
37 36 mephitis) (Cheadle et al., 2001b) e pássaros (Molothrus ater) (Mansfield et al., 2008) também já foram descritas como hospedeiros intermediários deste parasito. O Western blotting foi considerado, desde a identificação de S. neurona, o teste padrão ouro no diagnóstico sorológico de animais infectados pelo parasito (Daft et al., 2002), porém a imunofluorescência indireta apresentou altas sensibilidade e especificidade para detecção de anticorpos contra o parasito (Duarte et al., 2003), passando a ser utilizado de forma crescente em inquéritos soroepidemiológicos relacionados a S. neurona (Hsu et al., 2010). No nordeste brasileiro ainda não existem estudos epidemiológicos envolvendo S. neurona e os seus possíveis hospedeiros intermediários, possivelmente devido à falta de testes diagnósticos padronizados no país. Em um único estudo sorológico de S. neurona em gatos, com amostras do sudeste Brasil testadas nos EUA, não foram detectados anticorpos contra o parasito (Dubey et al., 2002), porém isto pode não representar a situação nacional. Objetivou-se, com a realização deste trabalho, pesquisar anticorpos anti S.neurona em gatos (Felis domesticus) residentes em Salvador, Bahia. Material e métodos Foram colhidas amostras de sangue de 89 gatos domésticos residentes em Salvador, Bahia, de ambos os sexos, diferentes idades e raças. Destes animais, 82 gatos apresentavam histórico de acesso à rua e sete gatos eram domiciliados. Nenhum animal apresentava qualquer sinal clínico de neuropatia durante as colheitas de sangue. As amostras foram colhidas durante avaliação laboratorial de rotina e após a separação do soro, estas foram acondicionadas em duplicatas a -20 C no Laboratório de Diagnóstico das Parasitoses dos Animais da Universidade Federal da Bahia, para posterior análise.
38 37 O número de amostras foi calculado para uma população infinita, considerandose uma prevalência esperada de 5% de gatos soropositivos, nível de confiança de 95% e precisão de 5%, de acordo com o cálculo descrito por Thrusfield (1995). Cálculo da amostra para n infinito: (p) x (1-p) x Z 2 / L 2 Prevalência estimada (p): 0,05 (5%) Precisão desejada (L): 0,05 (5%) Nível de confiança (Z): Z=1,96 (95%) O cultivo de S. neurona foi realizado de acordo com metodologia proposta por Duarte et al., (2003), levemente modificada (Figuras 4 e 5 - Anexos). A cepa de S. neurona (SN37R) foi gentilmente cedida pelo Dr. David Lindsay (Virginia Tech, EUA). Merozoítos do parasito foram cultivados em células CV-1 (Fibroblastos de rim de macaco verde africano) em meio RPMI contendo L-glutamina, antibióticos (estreptomicina e penicilina), antimicótico (anfotericina-d) e soro fetal bovino a 5%. Os frascos de cultura foram mantidos em estufa à 37 C e atmosfera com 5% de CO 2. Quando cerca de 80% da monocamada celular estava infectada, as células foram raspadas com scrapper e filtradas por meio de filtro de seringa de 5µm. Os merozoítos foram diluídos para uma concentração de 500 a 1000 merozoítos/µl de PBS (Anexo) e colocados em lâminas com poços de 5mm de diâmetro, as quais foram secas em estufa à 37 C, fixadas em metanol por cinco minutos e conservadas em temperatura de -20 C até o momento do uso. Para a reação de imunofluorescência indireta, as amostras de soro foram triadas empregando-se um ponto de corte de 1:25. Após adição do soro, as lâminas foram incubadas por 30 minutos em câmara úmida em estufa à 37 C, lavadas duas vezes em PBS por cinco minutos, sendo adicionado, em seguida, conjugado anti-igg felino (Sigma) diluído em PBS (1:800). As lâminas foram incubadas por 30 minutos em estufa à 37 C, lavadas em PBS como descrito anteriormente, secas em estufa e montadas com lamínula após a adição de glicerina tamponada. Em cada lâmina foram adicionados soros controles positivo e negativo para anticorpos anti-s. neurona, selecionados durante a triagem de amostras.
39 38 A leitura das reações foi feita em microscópio de fluorescência (CX 31 Olympus) com aumento de 400X, considerando-se positivos os poços onde mais de 50% dos merozoítos apresentaram fluorescência periférica total. As amostras positivas foram tituladas em diluições dobradas. Resultados Das amostras séricas de gatos analisadas pela técnica de imunofluorescência indireta, com o ponto de corte de 1:25, 14,6% (13/89) apresentaram anticorpos anti-s. neurona nas diluições 1:25 (1/13), 1:50 (4/13), 1:100 (4/13), 1:200 (3/13), 1:400 (1/13) (Figura 3) Figura 3 - Frequência de anticorpos anti-s. neurona em 13 gatos soropositivos em Salvador, Bahia Todos os gatos soropositivos tinham acesso à rua, eram assintomáticos, fêmeas (9/13), adultos (9/13), alimentavam-se preferencialmente de ração comercial, e apresentavam o hábito de caçar insetos (2/13).
40 39 Discussão Este trabalho é o primeiro relato da presença de anticorpos anti-s. neurona em gatos no Brasil. Apesar da baixa freqüência de animais soropositivos, os resultados foram semelhantes aos de soroprevalência realizados por (Hsu et al., 2010), também por meio da imunofluorescência indireta, nos estados americanos da Virginia e Pensilvânia, porém o número de animais testados nos EUA foi superior ao do presente trabalho. No estado de São Paulo, foram obtidas 502 amostras séricas de felinos oriundas das cidades de São Paulo e Guarulhos, testadas nos EUA, sendo a maioria das amostras pertencentes a animais capturados pelo Centro de Controle de Zoonoses (Dubey et al., 2002); não foram identificados animais soropositivos nas duas cidades paulistas, porém tal resultado parece não refletir a situação nacional, uma vez que a ocorrência de animais soropositivos é influenciada pela presença do hospedeiro definitivo na região estudada. Todos os animais soropositivos testados neste trabalho tinham histórico de livre acesso à rua. Houve um maior número de gatos adultos e fêmeas, o que possivelmente facilitou a exposição destes animais aos esporocistos eliminados pelos hospedeiros definitivos, já que a frequência de exposição ao parasito é maior entre os animias adultos (Stanek et al., 2003). A ocorrência de gatos soropositivos para S. neurona está, potencialmente, associada à presença da MPE, que é uma doença neurológica que acomete eqüinos em todo o continente americano, causando grande impacto econômico (Stanek et al., 2003). No Brasil, foi realizado um estudo epidemiológico para S. neurona em eqüinos de várias regiões através de SAG ELISA. Apesar da distribuição de amostras entre as diferentes regiões do país não ter sido homogênea, observou-se alta soroprevalência na maioria das regiões estudadas, principalmente em Minas Gerais, o que caracteriza elevada exposição desses animais a esporocistos de S. neurona eliminados pelos hospedeiros definitivos (Hoane et al., 2006). Estes dados são semelhantes aos descritos em várias regiões dos EUA (Saville et al., 1997; Blythe et al., 1997; Rossano et al., 2001; Bentz et al., 2003).
41 40 O único relato de anticorpos anti-s. neurona em animais na Bahia corresponde ao trabalho mencionado no parágrafo acima, em que do total de amostras testadas de equinos, nove foram oriundas do estado da Bahia; sete, das nove amostras analisadas, continham anticorpos contra o parasito (Hoane et al., 2006). A IFI mostrou-se eficaz na detecção de anticorpos anti-s. neurona como, já descrito por Rossano et al. (2002), quando compararam este teste diagnóstico com o WB em amostras séricas de gatos testadas previamente para Toxoplasma gondii, relacionando os títulos mais altos da IFI com resultados positivos no WB; os autores sugerem que há pouca possibilidade de reação cruzada entre anticorpos contra estes parasitos relacionados. Em um trabalho com eqüinos suspeitos de MPE, a IFI demonstrou altas sensibilidade e especificidade quando foram utilizadas amostras testadas por WB (Duarte et al., 2003). Como há relatos de eqüinos soropositivos e infectados com S. neurona no Brasil, além da identificação de hospedeiros definitivos (D. albiventris) no país, é provável que existam outros hospedeiros intermediários do parasito, além do gato, servindo como fonte de infecção e disseminação de S. neurona (Dubey et al., 2001a). Os gambás (Didelphis sp.) apresentam hábitos sinantrópicos, e com o desmatamento, a tendência é colonização dos centros urbanos em busca de alimentos, aumentando as chances de contato com os hospedeiros intermediários de S. neurona (Rickard et al., 2001). Em um trabalho realizado com Didelphis sp em São Paulo, foram capturados 146 gambás, e entre estes, 72,6% dos animais encontrados em zoológicos e em centros de proteção à animais silvestres pertenciam à espécie D. aurita e 27,4% D. albiventris; a maioria dos animais capturados no referido trabalho não é identificada como hospedeiro definitivo de S. neurona, podendo justificar a baixa soroprevalência para o parasitio nesta região, visto que não há evidências que D. aurita participe do ciclo de vida deste parasito (Casagrande et al, 2011). Em Salvador, Bahia, região alvo do presente trabalho, ainda não há relatos da distribuição de Didelphis sp, porém acredita-se que seja semelhante aos dados de São Paulo.
42 41 Em um trabalho realizado na Virginia e Pensilvânia, Hsu et al. (2010) sugerem que o gato não seja um hospedeiro intermediário importante de S. neurona, devido a pequena quantidade de animais soropositivos (7%) encontrada por estes autores. Dados semelhantes foram obtidos em Michigan (Rossano et al., 2002), cuja soroprevalência em gatos foi de 5%. Nos dois artigos mencionados acima, os autores acreditam que os gambás listrados, guaxinins e tatus possam apresentar maior importância como fonte de infecção natural de S. neurona, pois em trabalhos prévios, realizados nos EUA, foram observadas altas freqüências de anticorpos contra o parasito nessas espécies animais (Tanhauser et al., 2001; Lindsay et al., 2001; Mitchell et al., 2002). É desconhecida a presença de outros hospedeiros intermediários do parasito em Salvador, Bahia, além do gato, como por exemplo algumas aves sinantrópicas relatadas por Mansfield et al., (2008). Portanto, é possível que o gato tenha relevância no ciclo de S. neurona na região estudada, o que torna necessária a realização de estudos futuros na tentativa de identificação de outros hospedeiros do parasito. Agradecimentos A CAPES pela concessão de uma bolsa de mestrado para Iris Daniela Santos de Meneses. Ao Prof. João Luís Garcia, pelo fornecimento de alguns reagentes. Ao CNPq, pela concessão de bolsa de produtividade a L. F. P. Gondim.
43 42 REFERÊNCIAS BENTZ, B. G.; EALEY, K. A.; MORROW, J.; CLAYPOOL, P. L. ; SALIKI, J. T. Seroprevalence of antibodies to Sarcocystis neurona in equids residing in Oklahoma. Journal of Veterinary Diagnostic Investigation v. 15, n.6, p , BLYTHE, L. L.; GRANSTROM, D. E.; HANSEN, D. E.; WALKER, L. L.;BARTLETT, J. ; STAMPER, S. Seroprevalence of antibodies to Sarcocystis neurona in horses residing in Oregon. Journal of the Americam Veterinary Medical Association v.210, n.4, p , CASAGRANDE, R. A., LOPES, L.F.L; REIS, E.M.; RODRIGUES, D.P.; MATUSHIMA, E.R.. Isolation of Salmonella enterica in opossum (Didelphis aurita and Didelphis albiventris) of the São Paulo State, Brazil Ciência Rural v.41 n.3, 2011 CHEADLE, M. A.;TANHAUSER, S. M.; DAME, J. B.; SELLON, D. C.; HINES, M.; GINN, P. E., MACKAY; R. J.; GREINER, E. C. The nine-banded armadillo (Dasypus novemcinctus) is an intermediate host for Sarcocystis neurona. The International Journal of Parasitology v.31, n.4, p , 2001a. CHEADLE, M. A.; YOWELL, C. A.; SELLON, D. C.; HINES, M., GINN; P. E.; MARSH A. E.; MACKAY, R. J.; DAME, J. B; GREINER, E. C. The striped skunk (Mephitis mephitis) is an intermediate host for Sarcocystis neurona. The International Journal of Parasitology v.31, n.8, p , 2001b. DAFT, B. M.; BARR, B. C.; GARDNER, I. A.; READ, D.; BELL, W.; PEYSER, K. G.; ARDANS, A.; KINDE, H; MORROW, J. K. Sensitivity and specificity of western blot testing of cerebrospinal fluid and serum for diagnosis of equine protozoal myeloencephalitis in horses with and without neurologic abnormalities. Journal of the Americam Veterinary Medical Association v.221, n.7, p , DUARTE, P. C.; DAFT, B. M.; CONRAD, P. A.; PACKHAM, A. E.; GARDNER, I. A. Comparison of a serum indirect fluorescent antibody test with two Western blot tests for the diagnosis of equine protozoal myeloencephalitis. Journal of Veterinary Diagnostic Investigation v.15, n.1, p. 8-13, DUBEY, J. P; LINDSAY, D. S. Isolation in immunodeficient mice of Sarcocystis neurona from opossum (Didelphis virginiana) faeces, and its differentiation from Sarcocystis falcatula. The International Journal of Parasitology v.28, n.12, p , DUBEY, J. P.; LINDSAY, D. S.; HILL, D.; ROMAND, S.; THULLIEZ, P.; KWOK, O. C.; SILVA, J. C.; OLIVEIRA-CAMARGO, M. C.; GENNARI, S. M. Prevalence of antibodies to Neospora caninum and Sarcocystis neurona in sera of domestic cats from Brazil. The Journal of Parasitology v.88, n.6, p , 2002.
44 43 DUBEY, J. P.; LINDSAY, D. S.; KERBER, C. E.; KASAI, N.; PENA, H. F.; GENNARI, S. M.; KWOK, O. C.; SHEN, S. K.; ROSENTHAL, B. M. First isolation of Sarcocystis neurona from the South American opossum, Didelphis albiventris, from Brazil. Veterinary Parasitology v.95, n.2-4, p , 2001a. DUBEY, J. P.; LINDSAY, D. S.; SAVILLE, W. J.; REED, S. M.; GRANSTROM, D. E. ; SPEER, C. A. A review of Sarcocystis neurona and equine protozoal myeloencephalitis (EPM). Veterinary Parasitology. v.95, n. 2-4, p , 2001b. DUBEY, J. P.; SAVILLE, W. J.; LINDSAY, D. S.; STICH, R. W.; STANEK, J. F.; SPEERT, C. A.; ROSENTHAL, B. M.; NJOKU, C. J.; KWOK, O. C.; SHEN, S. K; REED, S. M. Completion of the life cycle of Sarcocystis neurona. The Journal of Parasitology v.86, n.6, p , DUBEY, J. P.; SAVILLE, W. J.; STANEK, J. F.; LINDSAY, D. S.; ROSENTHAL, B. M.; OGLESBEE, M. J.; ROSYPAL, A. C.; NJOKU, C. J.; STICH, R. W.; KWOK, O. C.; SHEN, S. K.; HAMIR, A. N.; REED, S. M. Sarcocystis neurona infections in raccoons (Procyon lotor): evidence for natural infection with sarcocysts, transmission of infection to opossums (Didelphis virginiana), and experimental induction of neurologic disease in raccoons. Veterinary Parasitology. v.100, n.3-4, p , 2001c. DUBEY, J. R.; ROSYPAL, A. C.; ROSENTHAL, B. M.; THOMAS, N. J.; LINDSAY, D. S.; STANEK, J. F.; REED, S. M.; SAVILLE, W. J. Sarcocystis neurona infections in sea otter (Enhydra lutris): evidence for natural infections with sarcocysts and transmission of infection to opossums (Didelphis virginiana). The Journal of Parasitology v.87, n.6, p , 2001d. HOANE, J. S.; GENNARI, S. M.; DUBEY, J. P.; RIBEIRO, M. G.; BORGES, A. S.; YAI, L. E.; AGUIAR, D. M.; CAVALCANTE, G. T.; BONESI, G. L.; HOWE, D. K. Prevalence of Sarcocystis neurona and Neospora spp. infection in horses from Brazil based on presence of serum antibodies to parasite surface antigen. Veterinary Parasitology v.136, n.2, p , HSU, V.; GRANT, D. C.; DUBEY, J. P.; ZAJAC, A. M.; LINDSAY, D. S. Prevalence of antibodies to Sarcocystis neurona in cats from Virginia and Pennsylvania. The Journal of Parasitology v.96, n.4, p ,2010. LINDSAY, D. S.; ROSYPAL, A. C.; SPENCER, J. A.; CHEADLE, M. A.; ZAJAC, A. M.; RUPPRECHT, C.; DUBEY, J. P.; BLAGBURN, B. L. Prevalence of agglutinating antibodies to Sarcocystis neurona in raccoons, Procyon lotor, from the United States. Veterinary Parasitology v.100, n.3-4, p , MANSFIELD, L. S.; MEHLER, S.; NELSON. K.; ELSHEIKHA, H. M.; MURPHY, A. J.; KNUST, B.; TANHAUSER, S. M.; GEARHART, P. M.; ROSSANO, M. G.; BOWMAN, D. D.; SCHOTT, H. C.; PATTERSON, J. S. Brown-headed cowbirds (Molothrus ater) harbor Sarcocystis neurona and act as intermediate hosts. Veterinary Parasitology v.153, n.1-2, p , 2008.
45 44 MITCHELL, S. M.; RICHARDSON, D. J.; CHEADLE, M. A.; ZAJAC, A. M.; LINDSAY, D. S. Prevalence of agglutinating antibodies to Sarcocystis neurona in skunks (Mephitis Mephitis), raccoons (Procyon lotor), and opossums (Didelphis Virginiana) from Connecticut. The Journal of Parasitology v.88, n.5, p , REJMANEK, D.; MILLER, M. A.; GRIGG, M. E.; CROSBIE, P. R; CONRAD, P. A. Molecular characterization of Sarcocystis neurona strains from opossums (Didelphis virginiana) and intermediate hosts from Central California. Veterinary Parasitology v.170, n.1-2, p , REJMANEK, D.; VANWORMER, E.; MILLER, M. A.; MAZET, J. A.; NICHELASON, A. E.; MELLI, A. C.; PACKHAM, A. E.; JESSUP, D. A.; CONRAD, P. A. Prevalence and risk factors associated with Sarcocystis neurona infections in opossums (Didelphis virginiana) from central California. Veterinary Parasitology v.166, n.1-2, p. 8-14, RICKARD, L. G.; BLACK, S. S.; RASHMIR-RAVEN, A.; HURST, G.; DUBEY, J. P. Risk factors associated with the presence of Sarcocystis neurona sporocysts in opossums (Didelphis virginiana). Veterinary Parasitology v.102, n.3, p , ROSSANO, M. G.; KANEENE, J. B.; MARTENIUK, J. V. ; BANKS, B. D.; SCHOTT, H. C.; MANSFIELD, L. S. The seroprevalence of antibodies to Sarcocystis neurona in Michigan equids. Preventive Veterinary Medicine v.48, n.2, p , ROSSANO, M. G.; MURPHY, A. J.; VRABLE, R. A.; VANZO, N. E.; LEWIS, S. K.; SHELINE, K. D.; KANEENE, J. B.; MANSFIELD, L. S. Cross-sectional study of serum antibodies against Sarcocystis neurona in cats tested for antibodies against Toxoplasma gondii. Journal of the Americam Veterinary Medical Association v.221, n.4, p , SAVILLE, W. J.; REED, S. M.; GRANSTROM, D. E.;, HINCHCLIFF, K. W.; KOHN, C. W.; WITTUM, T. E.; STAMPER, S. Seroprevalence of antibodies to Sarcocystis neurona in horses residing in Ohio. Journal of the Americam Veterinary Medical Association v.210, n.4, p , STANEK, J. F.; STICH, R. W.; DUBEY, J. P.; REED, S. M.; NJOKU, C. J.; LINDSAY, D. S.; SCHMALL, L. M.; JOHNSON G. K;, LAFAVE, B. M.; SAVILLE, W. J. Epidemiology of Sarcocystis neurona infections in domestic cats (Felis domesticus) and its association with equine protozoal myeloencephalitis (EPM) case farms and feral cats from a mobile spay and neuter clinic. Veterinary Parasitology v.117, n.4, p , TANHAUSER, S. M.; CHEADLE, M. A.; MASSEY, E. T.; MAYER, B. A.; SCHROEDTER, D. E.; DAME, J. B.; GREINER, E. C. ; MACKAY, R. J. The nine-banded armadillo (Dasypus novemcinctus) is naturally infected with Sarcocystis neurona. The Internacional Journal of Parasitology v.31, n.4, p , 2001.
46 45 THOMAS, N.J.; DUBEY, J.P.; LINDSAY, D.S.; COLE, R.A.; METEYER, C.U. Protozoal meningoencephalitis in sea otters (Enhydra lutris): histopathological and immunohistochemical study of naturally occorring cases. Journal of Comparative Pathology, v. 137, n. 2-3 p , THRUSFIELD, M Veterinary Epidemiology. Cambrige: Black-Weel Science, 479p. TURAY, H. O.; BARR, B. C.; CALDWELL, A.; BRANSON, K. R.; COCKRELL, M. K.; MARSH, A. E. Sarcocystis neurona reacting antibodies in Missouri feral domestic cats (Felis domesticus) and their role as an intermediate host. Parasitology Research v.88, n.1, p , 2002.
47 46 4. CONSIDERAÇÕES GERAIS Foi possível incrementar os recursos diagnósticos relacionados a parasitoses causadas por protozoários no país através da implantação e manutenção merozoítos de S. neurona em cultura celular. Foi implantada a técnica de imunofluorescência indireta para a detecção de anticorpos contra S. neurona em gatos. Foram identificados gatos domésticos soropositivos para o parasito, sugerindo que esta espécie animal está envolvida no ciclo de vida de S. neurona em Salvador, Bahia.
48 47 5. REFERÊNCIAS BEECH, J.; DODD, D. C. Toxoplasma-like encephalomyelitis in the horse. Veterinary Pathology v.11, n.1, p , BENTZ, B. G.; EALEY, K. A.; MORROW, J.; CLAYPOOL, P. L. ; SALIKI, J. T. Seroprevalence of antibodies to Sarcocystis neurona in equids residing in Oklahoma. Journal of Veterinary Diagnostic Investigation v. 15, n.6, p , BENTZ, B. G.; GRANSTROM, D. E.; STAMPER, S. Seroprevalence of antibodies to Sarcocystis neurona in horses residing in a county of southeastern Pennsylvania. Journal of the Americam Veterinary Medical Association v.210, n.4, p , BISBY, T. M.; HOLMAN, P. J.; PITOC, G. A.; PACKER, R. A.; THOMPSON, C. A.; RASKIN, R. E. Sarcocystis sp. encephalomyelitis in a cat. Veterinary Clinical Pathology v.39, n.1 p , BLYTHE, L. L.; GRANSTROM, D. E.; HANSEN, D. E.; WALKER, L. L.;BARTLETT, J. ; STAMPER, S. Seroprevalence of antibodies to Sarcocystis neurona in horses residing in Oregon. Journal of the Americam Veterinary Medical Association v.210, n.4, p , BRITTON, A. P.;DUBEY, J. P.; ROSENTHAL, B. M. Rhinitis and disseminated disease in a ferret (Mustela putorius furo) naturally infected with Sarcocystis neurona. Veterinary Parasitology v.169, n.1-2, p , BURCHAM, G. N.;RAMOS-VARA, J. A.; VEMULAPALLI, R. Systemic sarcocystosis in a striped skunk (Mephitis mephitis). Veterinary Pathology v.47, n.3, p , BUTCHER, M.; LAKRITZ, J.; HALANEY, A.; BRANSON, K.; GUPTA, G. D.; KREEGER, J.; MARSH, A. E. Experimental inoculation of domestic cats (Felis domesticus) with Sarcocystis neurona or S. neurona-like merozoites. Veterinary Parasitology v.107, n.1-2, p. 1-14, CHEADLE, M. A.; DAME, J. B.; GREINER, E. C. Sporocyst size of isolates of Sarcocystis shed by the Virginia opossum (Didelphis virginiana). Veterinary Parasitology v.95, n.2-4, p , 2001a. CHEADLE, M. A.;GINN, P. E.; LINDSAY, D. S; GREINER, E. C. Neurologic disease in gamma-interferon gene knockout mice caused by Sarcocystis neurona sporocysts collected from opossums fed armadillo muscle. Veterinary Parasitology v.103, n.1-2, p , CHEADLE, M. A.;TANHAUSER, S. M.; DAME, J. B.; SELLON, D. C.; HINES, M.; GINN, P. E., MACKAY; R. J.; GREINER, E. C. The nine-banded armadillo (Dasypus
49 48 novemcinctus) is an intermediate host for Sarcocystis neurona. The International Journal of Parasitology v.31, n.4, p , 2001b. CHEADLE, M. A.; YOWELL, C. A.; SELLON, D. C.; HINES, M., GINN; P. E.; MARSH A. E.; MACKAY, R. J.; DAME, J. B; GREINER, E. C. The striped skunk (Mephitis mephitis) is an intermediate host for Sarcocystis neurona. The International Journal of Parasitology v.31, n.8, p , 2001c. COLLINS, G. H.; CHARLESTON, W. A; MCKENNA, P. B. Cats as hosts for sarcocystis of sheep. New Zealand Veterinary Journal v.26, n.8, p. 214, COOK, A. G.; BUECHNER-MAXWELL, V.; MORROW, J. K.; WARD, D. L.; PARKER, N. A.; DASCANIO, J. J.; LEY,W. B.;COOPER, W. Interpretation of the detection of Sarcocystis neurona antibodies in the serum of young horses. Veterinary Parasitology v.95, n.2-4, p , COOK, A. G.; MAXWELLV. B.; DONALDSON, L. L.; PARKER, N. A.;WARD, D. L; MORROW, J. K. Detection of antibodies against Sarcocystis neurona in cerebrospinal fluid from clinically normal neonatal foals. Journal of the Americam Veterinary Medical Association v.220, n.2, p , CUTLER, T. J.; MACKAY, R. J.; GINN, P. E.; GILLIS, K.; TANHAUSER, S. M.; LERAY, E. V.; DAME, J. B; GREINER, E. C. Immunoconversion against Sarcocystis neurona in normal and dexamethasone-treated horses challenged with S. neurona sporocysts. Veterinary Parasitology v.95, n.2-4, p , DAFT, B. M.; BARR, B. C.; GARDNER, I. A.; READ, D.; BELL, W.; PEYSER, K. G.; ARDANS, A.; KINDE, H; MORROW, J. K. Sensitivity and specificity of western blot testing of cerebrospinal fluid and serum for diagnosis of equine protozoal myeloencephalitis in horses with and without neurologic abnormalities. Journal of the Americam Veterinary Medical Association v.221, n.7, p , DANGOUDOUBIYAM, S.; OLIVEIRA, J. B.; VIQUEZ, C.; GOMEZ-GARCIA, A.; GONZALEZ, O.; ROMERO, J. J.; KWOK, O. C.; DUBEY, J. P.; HOWE, D. K. Detection of antibodies against Sarcocystis neurona, Neospora spp., and Toxoplasma gondii in horses from Costa Rica. The Journal of Parasitology v. 97, n.3, p , DAVIS, S. W.; DAFT, B. N.; DUBEY, J. P. Sarcocystis neurona cultured in vitro from a horse with equine protozoal myelitis. Equine Veterinary Journal v.23, n.4, p. : , 1991a. DAVIS, S. W.; SPEER, C. A.; DUBEY, J. P. In vitro cultivation of Sarcocystis neurona from the spinal cord of a horse with equine protozoal myelitis. The Journal of Parasitology v.77, n.5, p , 1991b. DUARTE, P. C.; CONRAD, P. A.; BARR, B. C.; WILSON, W. D.; FERRARO, G. L., PACKHAM, A. E.; CARPENTER, T. E; GARDNER, I. A. Risk of transplacental
50 49 transmission of Sarcocystis neurona and Neospora hughesi in California horses. The Journal of Parasitology v.90, n.6, p , DUARTE, P. C.; DAFT, B. M.; CONRAD, P. A.; PACKHAM, A. E.; GARDNER, I. A. Comparison of a serum indirect fluorescent antibody test with two Western blot tests for the diagnosis of equine protozoal myeloencephalitis. Journal of Veterinary Diagnostic Investigation v.15, n.1, p. 8-13, DUBEY, J. P. Migration and development of Sarcocystis neurona in tissues of interferon gamma knockout mice fed sporocysts from a naturally infected opossum. Veterinary Parasitology v.95, n.2-4, p , 2001a. DUBEY, J. P. Parasitemia and early tissue localization of Sarcocystis neurona in interferon gamma gene knockout mice fed sporocysts. The Journal of Parasitology v.87, n.6, p , 2001b. DUBEY, J. P.; BENSON, J.; LARSON, M. A. Clinical Sarcocystis neurona encephalomyelitis in a domestic cat following routine surgery. Veterinary Parasitology v.112, n.4, p , 2003a. DUBEY, J. P.; DAVIS, S. W.; SPEER, C. A.; BOWMAN, D. D.; DE LAHUNTA, A.; GRANSTROM, D. E.; TOPPER, M. J.; HAMIR, A. N.;CUMMINGS, J. F.; SUTER, M. M. Sarcocystis neurona n. sp. (Protozoa: Apicomplexa), the etiologic agent of equine protozoal myeloencephalitis. The Journal of Parasitology v.77, n.2, p , DUBEY, J. P.; HAMIR, A. N. Immunohistochemical confirmation of Sarcocystis neurona infections in raccoons, mink, cat, skunk, and pony. The Journal of Parasitology v.86, n.5, p , DUBEY, J. P.; HIGGINS, R. J.; BARR, B. C.; SPANGLER, W. L.; KOLLIN, B.; JORGENSEN, L. S. Sarcocystis-associated meningoencephalomyelitis in a cat. Journal of Veterinary Diagnostic Investigation. v.6, n.6, p , DUBEY, J. P.; KERBER, C. E.; GRANSTROM, D. E. Serologic prevalence of Sarcocystis neurona, Toxoplasma gondii, Neospora caninum in horses in Brazil. Journal of the Americam Veterinary Medical Association v.215, n.7, p , 1999a. DUBEY, J. P; LINDSAY, D. S. Isolation in immunodeficient mice of Sarcocystis neurona from opossum (Didelphis virginiana) faeces, and its differentiation from Sarcocystis falcatula. The International Journal of Parasitology v.28, n.12, p , DUBEY, J. P.; LINDSAY, D. S.; FRITZ, D.; SPEER, C. A. Structure of Sarcocystis neurona sarcocysts. The Journal of Parasitology v.87, n.6, p , 2001a. DUBEY, J. P.; LINDSAY, D. S.; HILL, D.; ROMAND, S.; THULLIEZ, P.; KWOK, O. C.; SILVA, J. C.; OLIVEIRA-CAMARGO, M. C.; GENNARI, S. M. Prevalence of antibodies to Neospora caninum and Sarcocystis neurona in sera of domestic cats from Brazil. The Journal of Parasitology v.88, n.6, p , 2002a.
51 50 DUBEY, J. P.; LINDSAY, D. S.; KERBER, C. E.; KASAI, N.; PENA, H. F.; GENNARI, S. M.; KWOK, O. C.; SHEN, S. K.; ROSENTHAL, B. M. First isolation of Sarcocystis neurona from the South American opossum, Didelphis albiventris, from Brazil. Veterinary Parasitology v.95, n.2-4, p , 2001b. DUBEY, J. P.; LINDSAY, D. S.; SAVILLE, W. J. Serologic responses of cats against experimental Sarcocystis neurona infections. Veterinary Parasitology v.107, n.3, p , 2002b. DUBEY, J. P.; LINDSAY, D. S.; SAVILLE, W. J.; REED, S. M.; GRANSTROM, D. E. ; SPEER, C. A. A review of Sarcocystis neurona and equine protozoal myeloencephalitis (EPM). Veterinary Parasitology. v.95, n. 2-4, p , 2001c. DUBEY, J. P.; MATTSON, D. E.; SPEER, C. A.; BAKER, R. J.; MULROONEY, D. M.; TORNQUIST, S. J.; HAMIR, A. N.; GERROS, T. C. Characterization of a Sarcocystis neurona isolate (SN6) from a naturally infected horse from Oregon. The Journal of Eukaryotic Microbiology. v.46, n.5, p , 1999b. DUBEY, J. P.; MITCHELL, S. M.; MORROW, J. K.; RHYAN, J. C.; STEWART, L. M.; GRANSTROM, D. E.; ROMAND, S.; THULLIEZ, P.; SAVILLE, W. J.; LINDSAY, D. S. Prevalence of antibodies to Neospora caninum, Sarcocystis neurona, and Toxoplasma gondii in wild horses from central Wyoming. The Journal of Parasitology v.89, n.4, p , 2003b. DUBEY, J. P.; SAVILLE, W. J.; LINDSAY, D. S.; STICH, R. W.; STANEK, J. F.; SPEERT, C. A.; ROSENTHAL, B. M.; NJOKU, C. J.; KWOK, O. C.; SHEN, S. K; REED, S. M. Completion of the life cycle of Sarcocystis neurona. The Journal of Parasitology v.86, n.6, p , DUBEY, J. P.; SAVILLE, W. J.; STANEK, J. F.; LINDSAY, D. S.; ROSENTHAL, B. M.; OGLESBEE, M. J.; ROSYPAL, A. C.; NJOKU, C. J.; STICH, R. W.; KWOK, O. C.; SHEN, S. K.; HAMIR, A. N.; REED, S. M. Sarcocystis neurona infections in raccoons (Procyon lotor): evidence for natural infection with sarcocysts, transmission of infection to opossums (Didelphis virginiana), and experimental induction of neurologic disease in raccoons. Veterinary Parasitology. v.100, n.3-4, p , 2001d. DUBEY, J. P.; THOMAS, N. J. Sarcocystis neurona retinochoroiditis in a sea otter (Enhydra lutris kenyoni). Veterinary Parasitology v.183, n.1-2, p , DUBEY, J. P.; VENTURINI, M. C.; VENTURINI, L.; MCKINNEY, J.; PECORARO, M. Prevalence of antibodies to Sarcocystis neurona, Toxoplasma gondii and Neospora caninum in horses from Argentina. Veterinary Parasitology v.86, n.1, p , 1999c. DUBEY, J. R.; ROSYPAL, A. C.; ROSENTHAL, B. M.; THOMAS, N. J.; LINDSAY, D. S.; STANEK, J. F.; REED, S. M.; SAVILLE, W. J. Sarcocystis neurona infections in sea otter (Enhydra lutris): evidence for natural infections with sarcocysts and
52 51 transmission of infection to opossums (Didelphis virginiana). The Journal of Parasitology v.87, n.6, p , 2001e. ELSHEIKHA, H. M.; FITZGERALD, S. D.; ROSENTHAL, B. M.; MANSFIELD, L. S. Concurrent presence of Sarcocystis neurona sporocysts, Besnoitia darlingi tissue cysts, and Sarcocystis inghami sarcocysts in naturally infected opossums (Didelphis virginiana). Journal of Veterinary Diagnostic Investigation v.16, n.4, p , 2004a. ELSHEIKHA, H. M.; MURPHY, A. J.; MANSFIELD, L. S. Prevalence of Sarcocystis species sporocysts in Northern Virginia opossums (Didelphis virginiana). Parasitology Research v.93, n.5, p , 2004b. ELSHEIKHA, H. M.; ROSENTHAL, B. M.; MURPHY, A. J.; DUNAMS, D. B.; NEELIS, D. A.; MANSFIELD, L. S. Generally applicable methods to purify intracellular coccidia from cell cultures and to quantify purification efficacy using quantitative PCR. Veterinary Parasitology v.135, v.3-4, p , FINNO, C. J.; PACKHAM, A. E.; DAVID WILSON, W.; GARDNER, I. A.; CONRAD, P. A.; PUSTERLA, N. Effects of blood contamination of cerebrospinal fluid on results of indirect fluorescent antibody tests for detection of antibodies against Sarcocystis neurona and Neospora hughesi. Journal of Veterinary Diagnostic Investigation v.19, n.3, p , FURR, M.; HOWE, D.; REED, S. ; YEARGAN, M. Antibody coefficients for the diagnosis of equine protozoal myeloencephalitis. Journal of Veterinary Internal Medicine v.25, n.1, p , GAUTAM, A.; DUBEY, J. P.; SAVILLE, W. J.; HOWE, D. K. The SnSAG merozoite surface antigens of Sarcocystis neurona are expressed differentially during the bradyzoite and sporozoite life cycle stages. Veterinary Parasitology v.183, n.1-2, p.37-42, 2011 GILLIS, K. D.; MACKAY, R. J.; YOWELL, C. A.; LEVY, J. K.; GREINER, E. C.; DAME, J. B.; CHEADLE, M. A.; HERNANDEZ, J.; MASSEY, E. T. Naturally occurring Sarcocystis infection in domestic cats (Felis catus). Internacional Journal of Parasitology v.33, n.8, p , GRANSTROM, D. E.; DUBEY, J. P.; DAVIS, S. W.; FAYER, R.; FOX, J. C.; POONACHA, K. B.; GILES, R. C.; COMER, P. F. Equine protozoal myeloencephalitis: antigen analysis of cultured Sarcocystis neurona merozoites. Journal of Veterinary Diagnostic Investigation v.5, n.1, p , GUPTA, G. D.; LAKRITZ, J.; KIM, J. H.; KIM, D. Y.; KIM, J. K; MARSH, A. E. Seroprevalence of Neospora, Toxoplasma gondii and Sarcocystis neurona antibodies in horses from Jeju island, South Korea. Veterinary Parasitology v.106, n.3, p , 2002.
53 52 HAMIR, A. N.; DUBEY, J. P. Myocarditis and encephalitis associated with Sarcocystis neurona infection in raccoons (Procyon lotor). Veterinary Parasitology v.95, n.2-4, p , HANCOCK, K.; ZAJAC, A. M.; ELVINGER, F.; LINDSAY, D. S. Prevalence of agglutinating antibodies to Sarcocystis neurona in raccoons (Procyon lotor) from an urban area of Virginia. The Journal of Parasitology v.90, n.4, p , HOANE, J. S.; GENNARI, S. M.; DUBEY, J. P.; RIBEIRO, M. G.; BORGES, A. S.; YAI, L. E.; AGUIAR, D. M.; CAVALCANTE, G. T.; BONESI, G. L.; HOWE, D. K. Prevalence of Sarcocystis neurona and Neospora spp. infection in horses from Brazil based on presence of serum antibodies to parasite surface antigen. Veterinary Parasitology v.136, n.2, p , HOANE, J. S.; MORROW, J. K.; SAVILLE, W. J.; DUBEY, J. P.; GRANSTROM, D. E. ; HOWE, D. K. Enzyme-linked immunosorbent assays for detection of equine antibodies specific to Sarcocystis neurona surface antigens. Clinical and Diagnostic Laboratory Immunology v.12, n.9, p , HOUK, A. E.; GOODWIN, D. G.; ZAJAC, A. M.; BARR, S. C.; DUBEY, J. P.; LINDSAY, D. S. Prevalence of antibodies to Trypanosoma cruzi, Toxoplasma gondii, Encephalitozoon cuniculi, Sarcocystis neurona, Besnoitia darlingi, and Neospora caninum in North American opossums, Didelphis virginiana, from southern Louisiana. The Journal of Parasitology v.96, n.6, p , HSU, V.; GRANT, D. C.; DUBEY, J. P.; ZAJAC, A. M.; LINDSAY, D. S. Prevalence of antibodies to Sarcocystis neurona in cats from Virginia and Pennsylvania. The Journal of Parasitology v.96, n.4, p ,2010. JOHNSON, A. L.; BURTON, A. J.; SWEENEY, R. W. Utility of 2 immunological tests for antemortem diagnosis of equine protozoal myeloencephalitis (Sarcocystis neurona Infection) in naturally occurring cases. Journal of Veterinary Internal Medicine v.24, n.5, p , KREUDER, C.; MILLER, M. A.; LOWENSTINE, L. J.; CONRAD, P. A.; CARPENTER, T. E.; JESSUP, D. A.; MAZET, J. A. Evaluation of cardiac lesions and risk factors associated with myocarditis and dilated cardiomyopathy in southern sea otters (Enhydra lutris nereis). Americam Journal of Veterinary Research v.66, n.2, p , LINDSAY, D. S.; DUBEY, J. P. Direct agglutination test for the detection of antibodies to Sarcocystis neurona in experimentally infected animals. Veterinary Parasitology v.95, n.2-4, p , LINDSAY, D. S.; MITCHELL, S. M.; VIANNA, M. C.; DUBEY, J. P. Sarcocystis neurona (Protozoa: Apicomplexa): description of oocysts, sporocysts, sporozoites, excystation, and early development. The Journal of Parasitology v.90, n.3, p , 2004.
54 53 LINDSAY, D. S.; MITCHELL, S. M.; YANG, J.; DUBEY, J. P.; GOGAL, R. M., JR.; WITONSKY, S. G. Penetration of equine leukocytes by merozoites of Sarcocystis neurona. Veterinary Parasitology v.138, n.3-4, p , LINDSAY, D. S.; ROSYPAL, A. C.; SPENCER, J. A.; CHEADLE, M. A.; ZAJAC, A. M.; RUPPRECHT, C.; DUBEY, J. P.; BLAGBURN, B. L. Prevalence of agglutinating antibodies to Sarcocystis neurona in raccoons, Procyon lotor, from the United States. Veterinary Parasitology v.100, n.3-4, p , LOMBARDO DE BARROS, C. S.; DE BARROS, S. S. ; DOS SANTOS, M. N. Equine protozoal myeloencephalitis in southern Brazil. Veterinary Record v.119, n.11, p , MACKAY, R. J. Equine protozoal myeloencephalitis. Veterinary clinics of North Americam: Equine Practice v.13, n.1, p , 1997a. MACKAY, R. J. Serum antibodies to Sarcocystis neurona--half the horses in the United States have them! Journal of the Americam Veterinary Medical Association v.210, n.4, p , 1997b. MANSFIELD, L. S.; MEHLER, S.; NELSON. K.; ELSHEIKHA, H. M.; MURPHY, A. J.; KNUST, B.; TANHAUSER, S. M.; GEARHART, P. M.; ROSSANO, M. G.; BOWMAN, D. D.; SCHOTT, H. C.; PATTERSON, J. S. Brown-headed cowbirds (Molothrus ater) harbor Sarcocystis neurona and act as intermediate hosts. Veterinary Parasitology v.153, n.1-2, p , MARSH, A. E.; BARR, B. C.; LAKRITZ, J.; NORDHAUSEN, R.; MADIGAN, J. E.; CONRAD, P. A. Experimental infection of nude mice as a model for Sarcocystis neuronaassociated encephalitis. Parasitology Research v.83, n.7, p , MARSH, A. E.; BARR, B. C.; MADIGAN, J.; LAKRITZ, J.; NORDHAUSEN, R.; CONRAD, P. A. Neosporosis as a cause of equine protozoal myeloencephalitis. Journal of the Americam Veterinary Medical Association v.209, n.11, p , MASRI, M. D.; ALDA, J. L.; DUBEY, J. P. Sarcocystis neurona-associated ataxia in horses in Brazil. Veterinary Parasitology v.44, n.3-4, p , MILLER, M. A.; BARR, B. C.; NORDHAUSEN, R.; JAMES, E. R.; MAGARGAL, S. L.; MURRAY, M.; CONRAD, P. A.; TOY-CHOUTKA, S.; JESSUP. D. A.; GRIGG, M. E. Ultrastructural and molecular confirmation of the development of Sarcocystis neurona tissue cysts in the central nervous system of southern sea otters (Enhydra lutris nereis). The International Journal of Parasitology v.39, n.12, p , MILLER, M. A.; CONRAD, P. A.; HARRIS, M.; HATFIELD, B.; LANGLOIS, G.; JESSUP, D. A.; MAGARGAL, S. L.; PACKHAM, A. E.; TOY-CHOUTKA, S.; MELLI, A. C.; MURRAY, M. A.; GULLAND, F. M.; GRIGG, M. E. A protozoal-associated epizootic impacting marine wildlife: mass-mortality of southern sea otters
55 54 (Enhydra lutris nereis) due to Sarcocystis neurona infection. Veterinary Parasitology v.172, n.3-4, p , MITCHELL, S. M.; RICHARDSON, D. J.; CHEADLE, M. A.; ZAJAC, A. M.; LINDSAY, D. S. Prevalence of agglutinating antibodies to Sarcocystis neurona in skunks (Mephitis Mephitis), raccoons (Procyon lotor), and opossums (Didelphis Virginiana) from Connecticut. The Journal of Parasitology v.88, n.5, p , MULLANEY, T.; MURPHY, A. J.; KIUPEL, M.; BELL, J. A.; ROSSANO, M. G.; MANSFIELD, L. S. Evidence to support horses as natural intermediate hosts for Sarcocystis neurona. Veterinary Parasitology v.133, n.1, p , MULLER, G.; BRUM, J.G.W.; LANGONI, P.Q.;MICHELS,G.H.;SNKOC,A.L.; RUAS, J.L.; BERNE,M.E.A. Didelphis albiventris Lund, 1841, parasitado por Ixodes loricatus Neumann, 1899, e Amblyomma aureolatum Pallas, 1772, (Acari: Ixodidae) no Rio Grande do Sul. Arquivos do Instituto Biológico. v.72, n.3, p , REJMANEK, D.; MILLER, M. A.; GRIGG, M. E.; CROSBIE, P. R; CONRAD, P. A. Molecular characterization of Sarcocystis neurona strains from opossums (Didelphis virginiana) and intermediate hosts from Central California. Veterinary Parasitology v.170, n.1-2, p , REJMANEK, D.; VANWORMER, E.; MILLER, M. A.; MAZET, J. A.; NICHELASON, A. E.; MELLI, A. C.; PACKHAM, A. E.; JESSUP, D. A.; CONRAD, P. A. Prevalence and risk factors associated with Sarcocystis neurona infections in opossums (Didelphis virginiana) from central California. Veterinary Parasitology v.166, n.1-2, p. 8-14, REYNOLDS,H., Some aspects of the life history and ecology of the opossum in central Missouri, Journal of mammalogy, v.26, n.4, p , RICKARD, L. G.; BLACK, S. S.; RASHMIR-RAVEN, A.; HURST, G.; DUBEY, J. P. Risk factors associated with the presence of Sarcocystis neurona sporocysts in opossums (Didelphis virginiana). Veterinary Parasitology v.102, n.3, p , ROONEY, J. R.; PRICKETT, M. E.; DELANEY, F. M.; CROWE, M. W. Focal myelitisencephalitis in horses. Cornell Veterinary Medicine v.60, n.3, p , ROSSANO, M. G.; KANEENE, J. B.; MARTENIUK, J. V. ; BANKS, B. D.; SCHOTT, H. C.; MANSFIELD, L. S. The seroprevalence of antibodies to Sarcocystis neurona in Michigan equids. Preventive Veterinary Medicine v.48, n.2, p , ROSSANO, M. G.; MURPHY, A. J.; VRABLE, R. A.; VANZO, N. E.; LEWIS, S. K.; SHELINE, K. D.; KANEENE, J. B.; MANSFIELD, L. S. Cross-sectional study of serum antibodies against Sarcocystis neurona in cats tested for antibodies against
56 55 Toxoplasma gondii. Journal of the Americam Veterinary Medical Association v.221, n.4, p , SAVILLE, W. J.; REED, S. M.; GRANSTROM, D. E.;, HINCHCLIFF, K. W.; KOHN, C. W.; WITTUM, T. E.; STAMPER, S. Seroprevalence of antibodies to Sarcocystis neurona in horses residing in Ohio. Journal of the Americam Veterinary Medical Association v.210, n.4, p , SAVILLE, W. J.; REED, S. M.; MORLEY, P. S.; GRANSTROM, D. E.; KOHN, C. W.; HINCHCLIFF, K. W.; WITTUM, T. E. Analysis of risk factors for the development of equine protozoal myeloencephalitis in horses. Journal of the Americam Veterinary Medical Association v.217, n.8, p , SPENCER, J. A.; DEINNOCENTES, P.; MOYANA, E. M.; GUARINO, A. J.; ELLISON, S. E.; BIRD, R. C.; BLAGBURN, B. L. Cytokine gene expression in response to SnSAG1 in horses with equine protozoal myeloencephalitis. Clinical and Diagnostic Laboratory Immunology v.12, n.5, p , SPENCER, J. A.; ELLISON, S. E.; GUARINO, A. J.; BLAGBURN, B. L. Cell-mediated immune responses in horses with equine protozoal myeloencephalitis. The Journal of Parasitology v.90, n.2, p , STANEK, J. F.; DUBEY, J. P.; OGLESBEE, M. J.; REED, S. M.; LINDSAY, D. S.; CAPITINI, L. A.; NJOKU, C. J.; VITTITOW, K. L.; SAVILLE, W. J. Life cycle of Sarcocystis neurona in its natural intermediate host, the raccoon, Procyon lotor. The Journal of Parasitology v.88, n.6, p , STANEK, J. F.; STICH, R. W.; DUBEY, J. P.; REED, S. M.; NJOKU, C. J.; LINDSAY, D. S.; SCHMALL, L. M.; JOHNSON G. K;, LAFAVE, B. M.; SAVILLE, W. J. Epidemiology of Sarcocystis neurona infections in domestic cats (Felis domesticus) and its association with equine protozoal myeloencephalitis (EPM) case farms and feral cats from a mobile spay and neuter clinic. Veterinary Parasitology v.117, n.4, p , TANHAUSER, S. M.; CHEADLE, M. A.; MASSEY, E. T.; MAYER, B. A.; SCHROEDTER, D. E.; DAME, J. B.; GREINER, E. C. ; MACKAY, R. J. The nine-banded armadillo (Dasypus novemcinctus) is naturally infected with Sarcocystis neurona. The Internacional Journal of Parasitology v.31, n.4, p , TANHAUSER, S. M.; YOWELL, C. A.; CUTLER, T. J.; GREINER, E. C.; MACKAY, R. J.; DAME, J. B. Multiple DNA markers differentiate Sarcocystis neurona and Sarcocystis falcatula. The Journal of Parasitology v.85, n.2, p , TORNQUIST, S. J.; BOEDER, L. J.; MATTSON, D. E.; CEBRA, C. K.; BILDFELL, R. J.; HAMIR, A. N. Lymphocyte responses and immunophenotypes in horses with Sarcocystis neurona infection. Equine Veterinary Journal v.33, n.7, p , TURAY, H. O.; BARR, B. C.; CALDWELL, A.; BRANSON, K. R.; COCKRELL, M. K.; MARSH, A. E. Sarcocystis neurona reacting antibodies in Missouri feral
57 56 domestic cats (Felis domesticus) and their role as an intermediate host. Parasitology Research v.88, n.1, p , VALADAS, S.; GENNARI, S.; YAI, L., ROSYPAL, A.; LINDSAY, D. Prevalence of Antibodies to Trypanosoma Cruzi, Leishmania Infantum, Encephalitozoon Cuniculi, Sarcocystis Neurona, and Neospora Caninum and in Capybara, Hydrochoerus Hydrochaeris, from Sao Paulo State Brazil. The Journal of Parasitology, v.96, n.3, p VARDELEON, D.; MARSH, A. E.; THORNE, J. G.; LOCH, W.; YOUNG, R.; JOHNSON, P. J. Prevalence of Neospora hughesi and Sarcocystis neurona antibodies in horses from various geographical locations. Veterinary Parasitology v.95, n.2-4, p , YABSLEY, M. J.; JORDAN, C. N.; MITCHELL, S. M.; NORTON, T. M.; LINDSAY, D. S. Seroprevalence of Toxoplasma gondii, Sarcocystis neurona, and Encephalitozoon cuniculi in three species of lemurs from St. Catherines Island, GA, USA. Veterinary Parasitology v.144, n.1-2, p , YEARGAN, M. R.; HOWE, D. K. Improved detection of equine antibodies against Sarcocystis neurona using polyvalent ELISAs based on the parasite SnSAG surface antigens. Veterinary Parasitology v.176, n.1, p , 2011.
58 57 6. ANEXOS Figura 4 Monocamada de células CV-1 não infectadas. Aumento de 400x em microscópio óptico invertido. Fonte: Laboratório de Diagnóstico das Parasitoses dos Animais/UFBA Figura 5 Monocamada de células CV-1 infectadas com merozoítos de Sarcocystis neurona (setas). Aumento de 400x em microscópio óptico invertido. Fonte: Laboratório de Diagnóstico das Parasitoses dos Animais/UFBA
Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Grupo de Pesquisa de Protozoários Coccídeos. Prof. Luís Fernando Pita Gondim
 Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Grupo de Pesquisa de Protozoários Coccídeos Prof. Luís Fernando Pita Gondim Email: pita@ufba.br Sarcocystis neurona (principal agente)
Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Grupo de Pesquisa de Protozoários Coccídeos Prof. Luís Fernando Pita Gondim Email: pita@ufba.br Sarcocystis neurona (principal agente)
Profa. Carolina G. P. Beyrodt
 Profa. Carolina G. P. Beyrodt Agente etiológico: Toxoplasma gondii (Protozoário coccídeo do Filo Apicomplexa) Histórico Isolado em 1908 de um roedor do deserto: Ctenodactylus gondii 1923 descrição do primeiro
Profa. Carolina G. P. Beyrodt Agente etiológico: Toxoplasma gondii (Protozoário coccídeo do Filo Apicomplexa) Histórico Isolado em 1908 de um roedor do deserto: Ctenodactylus gondii 1923 descrição do primeiro
Toxoplasmose. Zoonose causada por protozoário Toxoplasma gondii. Único agente causal da toxoplasmose. Distribuição geográfica: Mundial
 Toxoplasmose Zoonose causada por protozoário Toxoplasma gondii Único agente causal da toxoplasmose Distribuição geográfica: Mundial Hospedeiros: a) Hospedeiros finais ou definitivos: - felideos (gato doméstico
Toxoplasmose Zoonose causada por protozoário Toxoplasma gondii Único agente causal da toxoplasmose Distribuição geográfica: Mundial Hospedeiros: a) Hospedeiros finais ou definitivos: - felideos (gato doméstico
Toxoplasmose. Filo: Apicomplexa (porque possui complexo apical)
 Toxoplasmose Parasito Reino: Protozoa Filo: Apicomplexa (porque possui complexo apical) Ordem: Eucoccidiida Família: Sarcocystidae Gênero: Toxoplasma Espécie: Toxoplasma gondii - É uma doença cosmopolita.
Toxoplasmose Parasito Reino: Protozoa Filo: Apicomplexa (porque possui complexo apical) Ordem: Eucoccidiida Família: Sarcocystidae Gênero: Toxoplasma Espécie: Toxoplasma gondii - É uma doença cosmopolita.
Toxoplasma gondii. Ciclo de vida e patogênese com foco para imunodeprimidos
 Toxoplasma gondii Ciclo de vida e patogênese com foco para imunodeprimidos INTRODUÇÃO O Toxoplasma gondii é um protozoário intracelular obrigatório, para que seu ciclo de vida esteja completo, precisa
Toxoplasma gondii Ciclo de vida e patogênese com foco para imunodeprimidos INTRODUÇÃO O Toxoplasma gondii é um protozoário intracelular obrigatório, para que seu ciclo de vida esteja completo, precisa
TRABALHO TÉCNICO DE CONSULTORIA AMBIENTAL
 TRABALHO TÉCNICO DE CONSULTORIA AMBIENTAL ESTUDO POPULACIONAL DE PEQUENOS MAMÍFEROS NO CLUBE HÍPICO DE SANTO AMARO NO MUNICÍPIO DE SÃO PAULO/SP, E DIAGNÓSTICO DO PROTOZOÁRIO Sarcocystis neurona NOS MARSUPIAIS
TRABALHO TÉCNICO DE CONSULTORIA AMBIENTAL ESTUDO POPULACIONAL DE PEQUENOS MAMÍFEROS NO CLUBE HÍPICO DE SANTO AMARO NO MUNICÍPIO DE SÃO PAULO/SP, E DIAGNÓSTICO DO PROTOZOÁRIO Sarcocystis neurona NOS MARSUPIAIS
PARASITOSES EMERGENTES e OPORTUNISTAS
 PARASITOSES EMERGENTES e OPORTUNISTAS Parasitoses emergentes: Doenças parasitárias comuns em animais e que têm sido assinaladas com maior frequência no homem ultimamente. Parasitoses emergentes Motivos:
PARASITOSES EMERGENTES e OPORTUNISTAS Parasitoses emergentes: Doenças parasitárias comuns em animais e que têm sido assinaladas com maior frequência no homem ultimamente. Parasitoses emergentes Motivos:
Toxoplasmose. Zoonoses e Administração em Saúde Pública. Prof. Fábio Raphael Pascoti Bruhn
 Universidade Federal de Pelotas Departamento de Veterinária Preventiva Toxoplasmose Zoonoses e Administração em Saúde Pública Prof. Fábio Raphael Pascoti Bruhn Por que estudar a toxoplasmose Zoonose Soroprevalência
Universidade Federal de Pelotas Departamento de Veterinária Preventiva Toxoplasmose Zoonoses e Administração em Saúde Pública Prof. Fábio Raphael Pascoti Bruhn Por que estudar a toxoplasmose Zoonose Soroprevalência
Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain
 67 4.2 Estudo II Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain Enquanto anticorpos anti-t. gondii são
67 4.2 Estudo II Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain Enquanto anticorpos anti-t. gondii são
Universidade Federal de Pelotas Departamento de Veterinária Preventiva Toxoplasmose Zoonoses e Administração em Saúde Pública
 Universidade Federal de Pelotas Departamento de Veterinária Preventiva Toxoplasmose Zoonoses e Administração em Saúde Pública Fábio Raphael Pascoti Bruhn Por que estudar a toxoplasmose Zoonose Nos EUA,
Universidade Federal de Pelotas Departamento de Veterinária Preventiva Toxoplasmose Zoonoses e Administração em Saúde Pública Fábio Raphael Pascoti Bruhn Por que estudar a toxoplasmose Zoonose Nos EUA,
Mieloencefalite Protozoária Eqüina (EPM)
 Mieloencefalite Protozoária Eqüina (EPM) MOÇO, Helder Filippi RAYA, Diego Abdo DIAS, Lauriane Conceição Acadêmicos da Faculdade de Medicina Veterinária e Zootecnia de Garça-SP FAMED-FAEF, UNITERRA NEVES,
Mieloencefalite Protozoária Eqüina (EPM) MOÇO, Helder Filippi RAYA, Diego Abdo DIAS, Lauriane Conceição Acadêmicos da Faculdade de Medicina Veterinária e Zootecnia de Garça-SP FAMED-FAEF, UNITERRA NEVES,
Anemia Infecciosa das Galinhas
 Anemia Infecciosa das Galinhas Leonardo Bozzi Miglino Programa de Pós-graduação - UFPR Mestrado Ciências Veterinárias 2010 Histórico: Isolado e descrito no Japão (1979), chamado de agente da anemia das
Anemia Infecciosa das Galinhas Leonardo Bozzi Miglino Programa de Pós-graduação - UFPR Mestrado Ciências Veterinárias 2010 Histórico: Isolado e descrito no Japão (1979), chamado de agente da anemia das
MIELOENCEFALITE PROTOZOÁRIA EQUINA: Revisão Bibliográfica
 MIELOENCEFALITE PROTOZOÁRIA EQUINA: Revisão Bibliográfica Ana Flávia Neves Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas FITL/AEMS Paula Rafaela de Jesus Ferreira Graduanda em
MIELOENCEFALITE PROTOZOÁRIA EQUINA: Revisão Bibliográfica Ana Flávia Neves Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas FITL/AEMS Paula Rafaela de Jesus Ferreira Graduanda em
42º Congresso Bras. de Medicina Veterinária e 1º Congresso Sul-Brasileiro da ANCLIVEPA - 31/10 a 02/11 de Curitiba - PR 1
 1 ASPECTOS CLÍNICOS E EPIDEMIOLÓGICOS DA MIELOENCEFALITE PROTOZOARIA EQUINA NO CERRADO SUL MATOGROSSENSE CLINICAL AND EPIDEMIOLOGICAL PROTOZOAL MYELOENCEPHALITIS OF EQUINE CLOSED IN SOUTH MATOGROSSENSE
1 ASPECTOS CLÍNICOS E EPIDEMIOLÓGICOS DA MIELOENCEFALITE PROTOZOARIA EQUINA NO CERRADO SUL MATOGROSSENSE CLINICAL AND EPIDEMIOLOGICAL PROTOZOAL MYELOENCEPHALITIS OF EQUINE CLOSED IN SOUTH MATOGROSSENSE
Toxoplasma gondii e Toxoplasmose. Nicolle e Manceaux, 1909
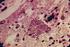 Nicolle e Manceaux, 1909 A toxoplasmose é uma zoonose, muito freqüente em várias espécies animais(+ de 300), mamíferos e aves, domésticos ou silvestres, de distribuição geográfica mundial, atinge 60% da
Nicolle e Manceaux, 1909 A toxoplasmose é uma zoonose, muito freqüente em várias espécies animais(+ de 300), mamíferos e aves, domésticos ou silvestres, de distribuição geográfica mundial, atinge 60% da
Imunoensaios no laboratório clínico
 Imunoensaios no laboratório clínico Onde pesquisamos Ag e Ac?? Imunoensaios detecção e quantificação de antígeno e anticorpo: Doenças infecciosas: diagnóstico da doença diferenciação da fase da doença
Imunoensaios no laboratório clínico Onde pesquisamos Ag e Ac?? Imunoensaios detecção e quantificação de antígeno e anticorpo: Doenças infecciosas: diagnóstico da doença diferenciação da fase da doença
COCCIDIOSES COCCIDIOSES. COCCIDIOSES (Isospora REINO: Protista SUB-REINO: Protozoa FILO: CLASSE: ORDEM:
 PROTOZOÁRIOS Sarcomastigophora Apicomplexa Ciliophora Mastigophora Sarcodina Babesia Balantidium Trypanosoma Leishmania Giardia Entamoeba Acanthamoeba Naegleria Eimeria Isospora Sarcocystis Trichomonas
PROTOZOÁRIOS Sarcomastigophora Apicomplexa Ciliophora Mastigophora Sarcodina Babesia Balantidium Trypanosoma Leishmania Giardia Entamoeba Acanthamoeba Naegleria Eimeria Isospora Sarcocystis Trichomonas
Toxoplasmose Roteiro da Aula
 Doenças de veiculação hídrica e ingestão de alimento contaminado Toxoplasmose oocisto/cisto Ascaridíase - ovos Amebíase - cistos Giardíase - cistos Oxiuríase - ovos Teníase / cisticercose cisto/ovos Ancilostomíase
Doenças de veiculação hídrica e ingestão de alimento contaminado Toxoplasmose oocisto/cisto Ascaridíase - ovos Amebíase - cistos Giardíase - cistos Oxiuríase - ovos Teníase / cisticercose cisto/ovos Ancilostomíase
Parasitologia VET05596 REINO PROTOZOA
 Parasitologia REINO VET05596 PROTOZOA Classificação Reino Protozoa Filo Sarcomastigophora Filo Apicomplexa Classes: Sarcodina Mastigophora Classes: Coccidia Piroplasmasida Filo Apicomplexa Classes: Coccidea
Parasitologia REINO VET05596 PROTOZOA Classificação Reino Protozoa Filo Sarcomastigophora Filo Apicomplexa Classes: Sarcodina Mastigophora Classes: Coccidia Piroplasmasida Filo Apicomplexa Classes: Coccidea
MIELOENCEFALITE PROTOZOÁRIA EQUINA
 INSTITUTO FEDERAL DE EDUCAÇÃO DE CIÊNCIA E TECNOLOGIA DE SÃO PAULO CAMPUS BARRETOS FELIPE DE PAULA MARTINS MIELOENCEFALITE PROTOZOÁRIA EQUINA Barretos SP 2016 FELIPE DE PAULA MARTINS MIELOENCEFALITE PROTOZOÁRIA
INSTITUTO FEDERAL DE EDUCAÇÃO DE CIÊNCIA E TECNOLOGIA DE SÃO PAULO CAMPUS BARRETOS FELIPE DE PAULA MARTINS MIELOENCEFALITE PROTOZOÁRIA EQUINA Barretos SP 2016 FELIPE DE PAULA MARTINS MIELOENCEFALITE PROTOZOÁRIA
ENFERMAGEM SAÚDE DA MULHER. Doenças Sexualmente Transmissíveis Parte 2. Profª. Lívia Bahia
 ENFERMAGEM SAÚDE DA MULHER Doenças Sexualmente Transmissíveis Parte 2 Profª. Lívia Bahia Sífilis Agente Etiológico: Treponema pallidum Morfologicamente o Treponema pallidum é uma bactéria espiral fina
ENFERMAGEM SAÚDE DA MULHER Doenças Sexualmente Transmissíveis Parte 2 Profª. Lívia Bahia Sífilis Agente Etiológico: Treponema pallidum Morfologicamente o Treponema pallidum é uma bactéria espiral fina
Filo Apicomplexa, continuação da aula anterior...
 Filo Apicomplexa, continuação da aula anterior... (Aves e anfíbios) (Cachorro e gato) (Gado) (Gado e galinha) (Ungulados) Reino Filo Classe Ordem Família Gênero Espécie Protozoa Apicomplexa Taxonomia Sporozoa
Filo Apicomplexa, continuação da aula anterior... (Aves e anfíbios) (Cachorro e gato) (Gado) (Gado e galinha) (Ungulados) Reino Filo Classe Ordem Família Gênero Espécie Protozoa Apicomplexa Taxonomia Sporozoa
CRYPTOSPORIDIUM PARVUM/CRIPTOSPORIDIOSE
 INFORME-NET DTA Secretaria de Estado da Saúde de São Paulo Coordenadoria dos Institutos de Pesquisa - CIP Centro de Vigilância Epidemiológica - CVE MANUAL DAS DOENÇAS TRANSMITIDAS POR ALIMENTOS CRYPTOSPORIDIUM
INFORME-NET DTA Secretaria de Estado da Saúde de São Paulo Coordenadoria dos Institutos de Pesquisa - CIP Centro de Vigilância Epidemiológica - CVE MANUAL DAS DOENÇAS TRANSMITIDAS POR ALIMENTOS CRYPTOSPORIDIUM
DISCIPLINA PARASITOLOGIA 2019
 DISCIPLINA PARASITOLOGIA 2019 14 de março TOXOPLASMOSE Docente: Profa. Dra. Juliana Q. Reimão SOCRATIVE (SALA JULIANA2019) Quiz eletrônico sobre as possíveis formas de transmissão da toxoplasmose VÍDEO
DISCIPLINA PARASITOLOGIA 2019 14 de março TOXOPLASMOSE Docente: Profa. Dra. Juliana Q. Reimão SOCRATIVE (SALA JULIANA2019) Quiz eletrônico sobre as possíveis formas de transmissão da toxoplasmose VÍDEO
ENFERMAGEM DOENÇAS INFECCIOSAS E PARASITÁRIAS. OUTRAS DOENÇAS INFECCIOSAS E PARASITÁRIAS Aula 2. Profª. Tatiane da Silva Campos
 ENFERMAGEM DOENÇAS INFECCIOSAS E PARASITÁRIAS Aula 2 Profª. Tatiane da Silva Campos Tétano Acidental: causa: ação exotoxinas produzidas pelo bacilo tetânico = provoca hiperexcitabilidade do sistema nervoso
ENFERMAGEM DOENÇAS INFECCIOSAS E PARASITÁRIAS Aula 2 Profª. Tatiane da Silva Campos Tétano Acidental: causa: ação exotoxinas produzidas pelo bacilo tetânico = provoca hiperexcitabilidade do sistema nervoso
Disciplina de Parasitologia
 Disciplina de Parasitologia Curso de Medicina 2018 Tema: Toxoplasmose Profa. Dra. Juliana Quero Reimão Toxoplasmose Generalidades Zoonose cujo quadro clínico no homem varia desde infecção assintomática
Disciplina de Parasitologia Curso de Medicina 2018 Tema: Toxoplasmose Profa. Dra. Juliana Quero Reimão Toxoplasmose Generalidades Zoonose cujo quadro clínico no homem varia desde infecção assintomática
DIAGNÓSTICOS SOROLÓGICO NAS INFECÇÕES BACTERIANAS. Sífilis
 DIAGNÓSTICOS SOROLÓGICO NAS INFECÇÕES BACTERIANAS Sífilis Sífilis Agente Etiológico Doença crônica sistêmica Família Spirochaetaceae Espiroqueta: Treponema pallidum, sub espécie pallidum Motilidade Característica:
DIAGNÓSTICOS SOROLÓGICO NAS INFECÇÕES BACTERIANAS Sífilis Sífilis Agente Etiológico Doença crônica sistêmica Família Spirochaetaceae Espiroqueta: Treponema pallidum, sub espécie pallidum Motilidade Característica:
Morfologia Forma taquizoíta
 Toxoplasma gondii e Toxoplasmose Filo Apicomplexa Classe Sporozoea Subclasse Coccidia Ordem Eucocciida Subordem Eimeriina Família Eimeriidae Isospora belli Família Sarcocystidae Sarcocystis hominis Toxoplasma
Toxoplasma gondii e Toxoplasmose Filo Apicomplexa Classe Sporozoea Subclasse Coccidia Ordem Eucocciida Subordem Eimeriina Família Eimeriidae Isospora belli Família Sarcocystidae Sarcocystis hominis Toxoplasma
CINÉTICA, AVALIAÇÃO DA TRANSMISSÃO VERTICAL E MONITORAMENTO DA TRANSFERÊNCIA PASSIVA DE ANTICORPOS ANTI-Neospora sp. EM EQÜINOS.
 DANIELE CRISTINE SILVEIRA HOFFMANN CINÉTICA, AVALIAÇÃO DA TRANSMISSÃO VERTICAL E MONITORAMENTO DA TRANSFERÊNCIA PASSIVA DE ANTICORPOS ANTI-Neospora sp. EM EQÜINOS. Dissertação apresentada ao curso de Pós-Graduação
DANIELE CRISTINE SILVEIRA HOFFMANN CINÉTICA, AVALIAÇÃO DA TRANSMISSÃO VERTICAL E MONITORAMENTO DA TRANSFERÊNCIA PASSIVA DE ANTICORPOS ANTI-Neospora sp. EM EQÜINOS. Dissertação apresentada ao curso de Pós-Graduação
Métodos de Pesquisa e Diagnóstico dos Vírus
 Métodos de Pesquisa e Diagnóstico dos Vírus Estratégias Isolamento em sistemas vivos Pesquisa de antígeno viral Pesquisa de anticorpos Pesquisa do ácido nucléico viral (DNA ou RNA) Pré requisitos para
Métodos de Pesquisa e Diagnóstico dos Vírus Estratégias Isolamento em sistemas vivos Pesquisa de antígeno viral Pesquisa de anticorpos Pesquisa do ácido nucléico viral (DNA ou RNA) Pré requisitos para
SORODIAGNÓSTICO DE ANTICORPOS ANTI-Neospora caninum EM CÃES DA ÁREA URBANA E RURAL DO SUL DO RIO GRANDE DO SUL
 SORODIAGNÓSTICO DE ANTICORPOS ANTI-Neospora caninum EM CÃES DA ÁREA URBANA E RURAL DO SUL DO RIO GRANDE DO SUL CUNHA, Filho Nilton Azevedo 1 ; LUCAS, Andréia da Silveira 2 ; PAPPEN, Felipe 2 ; RUAS, Jerônimo
SORODIAGNÓSTICO DE ANTICORPOS ANTI-Neospora caninum EM CÃES DA ÁREA URBANA E RURAL DO SUL DO RIO GRANDE DO SUL CUNHA, Filho Nilton Azevedo 1 ; LUCAS, Andréia da Silveira 2 ; PAPPEN, Felipe 2 ; RUAS, Jerônimo
Diagnóstico Laboratorial de Infecções Virais. Profa. Claudia Vitral
 Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
ELIANA MONTEFORTE CASSARO VILLALOBOS
 ELIANA MONTEFORTE CASSARO VILLALOBOS Identificação de infecção por protozoários da família Sarcocystidae em sistema nervoso central de equinos com sinais clínicos neurológicos e reprodutivos São Paulo
ELIANA MONTEFORTE CASSARO VILLALOBOS Identificação de infecção por protozoários da família Sarcocystidae em sistema nervoso central de equinos com sinais clínicos neurológicos e reprodutivos São Paulo
Infecções congênitas. Prof. Regia Lira
 Infecções congênitas Prof. Regia Lira 12 de maio de 2015 ADAPTAÇÃO IMUNOLÓGICA MATERNO-FETAL Interpretação de resultados dos imunoensaios: Feto ou necém-nascido: sistema imune em desenvolvimento (fora
Infecções congênitas Prof. Regia Lira 12 de maio de 2015 ADAPTAÇÃO IMUNOLÓGICA MATERNO-FETAL Interpretação de resultados dos imunoensaios: Feto ou necém-nascido: sistema imune em desenvolvimento (fora
MIELOENCEFALITE EQUINA POR PROTOZOARIO (MEP): REVISÃO DE LITERATURA EQUINE PROTOZOAL MYELOENCEPHALITIS (EPM): LITERATURE REVIEW
 REVISTA CIENTÍFICA DE MEDICINA VETERINÁRIA - ISSN 679-7353 Ano XIV - Número 8 Janeiro de 07 Periódico Semestral MIELOENCEFALITE EQUINA POR PROTOZOARIO (MEP): REVISÃO DE LITERATURA EQUINE PROTOZOAL MYELOENCEPHALITIS
REVISTA CIENTÍFICA DE MEDICINA VETERINÁRIA - ISSN 679-7353 Ano XIV - Número 8 Janeiro de 07 Periódico Semestral MIELOENCEFALITE EQUINA POR PROTOZOARIO (MEP): REVISÃO DE LITERATURA EQUINE PROTOZOAL MYELOENCEPHALITIS
MIELOENCEFALITE EQUINA POR PROTOZOARIO (MEP): REVISÃO DE LITERATURA EQUINE PROTOZOAL MYELOENCEPHALITIS (EPM): LITERATURE REVIEW
 MIELOENCEFALITE EQUINA POR PROTOZOARIO (MEP): REVISÃO DE LITERATURA EQUINE PROTOZOAL MYELOENCEPHALITIS (EPM): LITERATURE REVIEW Amanda Camozzato TEIXEIRA 1 ; Lanny Kappes NOGUEIRA 1 ; Leticia Claudia CHIODI
MIELOENCEFALITE EQUINA POR PROTOZOARIO (MEP): REVISÃO DE LITERATURA EQUINE PROTOZOAL MYELOENCEPHALITIS (EPM): LITERATURE REVIEW Amanda Camozzato TEIXEIRA 1 ; Lanny Kappes NOGUEIRA 1 ; Leticia Claudia CHIODI
Mieloencefalite protozoária equina (Sarcocystis neurona e Neospora hughesi): Revisão
 https://doi.org/10.31533/pubvet.v13n01a246.1-11 Mieloencefalite protozoária equina (Sarcocystis neurona e Neospora hughesi): Revisão Severino Ernesto Rezende Vilela 1, Priscila Gomes de Oliveira 2, Cecília
https://doi.org/10.31533/pubvet.v13n01a246.1-11 Mieloencefalite protozoária equina (Sarcocystis neurona e Neospora hughesi): Revisão Severino Ernesto Rezende Vilela 1, Priscila Gomes de Oliveira 2, Cecília
Bases do diagnóstico bacteriológico
 Bases do diagnóstico bacteriológico Prof. Cláudio Galuppo Diniz Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação agentes
Bases do diagnóstico bacteriológico Prof. Cláudio Galuppo Diniz Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação agentes
Trypanosoma cruzi Doença de Chagas
 Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
PROTOZOOLOGIA. Filo APICOMPLEXA(Sporozoa)
 Filo APICOMPLEXA(Sporozoa) Filo APICOMPLEXA(Sporozoa) Protozoários que ocorrem de forma intracelular Possuem complexo apical durante alguma fase Os trofozoítas não possuem cílios e flagelos Reprodução
Filo APICOMPLEXA(Sporozoa) Filo APICOMPLEXA(Sporozoa) Protozoários que ocorrem de forma intracelular Possuem complexo apical durante alguma fase Os trofozoítas não possuem cílios e flagelos Reprodução
Renato Andreotti NEOSPOROSE: UM POSSÍVEL PROBLEMA REPRODUTIVO PARA O REBANHO BOVINO
 Renato Andreotti NEOSPOROSE: UM POSSÍVEL PROBLEMA REPRODUTIVO PARA O REBANHO BOVINO Campo Grande, MS 2001 Embrapa Gado de Corte. Documentos, 104 Tiragem: 1.000 exemplares COMITÊ DE PUBLICAÇÕES Cacilda
Renato Andreotti NEOSPOROSE: UM POSSÍVEL PROBLEMA REPRODUTIVO PARA O REBANHO BOVINO Campo Grande, MS 2001 Embrapa Gado de Corte. Documentos, 104 Tiragem: 1.000 exemplares COMITÊ DE PUBLICAÇÕES Cacilda
Disciplina de Parasitologia
 Faculdade de Medicina de Jundiaí Disciplina de Parasitologia Curso de Medicina 2018 Tema: Coccídios intestinais Profa. Dra. Juliana Quero Reimão Coccídios intestinais Generalidades Parasitas intracelulares
Faculdade de Medicina de Jundiaí Disciplina de Parasitologia Curso de Medicina 2018 Tema: Coccídios intestinais Profa. Dra. Juliana Quero Reimão Coccídios intestinais Generalidades Parasitas intracelulares
TÉCNICAS DE ESTUDO EM PATOLOGIA
 TÉCNICAS DE ESTUDO EM PATOLOGIA Augusto Schneider Carlos Castilho de Barros Faculdade de Nutrição Universidade Federal de Pelotas TÉCNICAS Citologia Histologia Imunohistoquímica/imunofluorescência Biologia
TÉCNICAS DE ESTUDO EM PATOLOGIA Augusto Schneider Carlos Castilho de Barros Faculdade de Nutrição Universidade Federal de Pelotas TÉCNICAS Citologia Histologia Imunohistoquímica/imunofluorescência Biologia
DETECÇÃO DE ANTICORPOS CONTRA Sarcocystis spp. E INVESTIGAÇÃO DA OCORRÊNCIA DE TRANSMISSÃO VERTICAL POR Sarcocystis neurona EM EQUINOS.
 UNIVERSIDADE FEDERAL DE SANTA MARIA CENTRO DE CIÊNCIAS RURAIS PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA VETERINÁRIA DETECÇÃO DE ANTICORPOS CONTRA Sarcocystis spp. E INVESTIGAÇÃO DA OCORRÊNCIA DE TRANSMISSÃO
UNIVERSIDADE FEDERAL DE SANTA MARIA CENTRO DE CIÊNCIAS RURAIS PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA VETERINÁRIA DETECÇÃO DE ANTICORPOS CONTRA Sarcocystis spp. E INVESTIGAÇÃO DA OCORRÊNCIA DE TRANSMISSÃO
Toxoplasma gondii em Tamanduá Bandeira (Myrmecophaga tridactyla, Linnaeus 1758) da região Noroeste do Estado de São Paulo
 Toxoplasma gondii em Tamanduá Bandeira (Myrmecophaga tridactyla, Linnaeus 758) da região Noroeste do Estado de São Paulo LUIZ PAULO NOGUEIRA AIRES, VINICIUS MATHEUS FERRARI 2, HERBERT SOUSA SOARES, CINARA
Toxoplasma gondii em Tamanduá Bandeira (Myrmecophaga tridactyla, Linnaeus 758) da região Noroeste do Estado de São Paulo LUIZ PAULO NOGUEIRA AIRES, VINICIUS MATHEUS FERRARI 2, HERBERT SOUSA SOARES, CINARA
Diagnóstico Laboratorial de Infecções Virais. Profa. Claudia Vitral
 Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
TOXOPLASMOSE. Prof. Sérvio Túlio Stinghen
 TOXOPLASMOSE Prof. Sérvio Túlio Stinghen 1 Toxoplasmose: histórico 1908: Charles Nicolle e Louis Hubert Manceaux Toxoplasma gondii em roedores 1932: doença infecciosa 1939: Wolf et al infecção congênita
TOXOPLASMOSE Prof. Sérvio Túlio Stinghen 1 Toxoplasmose: histórico 1908: Charles Nicolle e Louis Hubert Manceaux Toxoplasma gondii em roedores 1932: doença infecciosa 1939: Wolf et al infecção congênita
Agente etiológico. Leishmania brasiliensis
 Leishmaniose Agente etiológico A leishmaniose é causada por protozoários flagelados chamados Leishmania brasiliensis e Leishmania chagasi, que invadem e se reproduzem dentro das células que fazem parte
Leishmaniose Agente etiológico A leishmaniose é causada por protozoários flagelados chamados Leishmania brasiliensis e Leishmania chagasi, que invadem e se reproduzem dentro das células que fazem parte
11 a 14 de dezembro de 2012 Campus de Palmas
 SENSIBILIDADE E ESPECIFICIDADE DA IMUNOFLUORESCÊNCIA INDIRETA UTILIZANDO CEPA DE LEISHMANIA SPP. ISOLADA DE CÃO DA CIDADE DE ARAGUAÍNA-TO NO DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA. Emerson Danillo
SENSIBILIDADE E ESPECIFICIDADE DA IMUNOFLUORESCÊNCIA INDIRETA UTILIZANDO CEPA DE LEISHMANIA SPP. ISOLADA DE CÃO DA CIDADE DE ARAGUAÍNA-TO NO DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA. Emerson Danillo
Toxocara canis Toxocara cati
 UNIVERSIDADE FEDERAL DE PELOTAS INSTITUTO DE BIOLOGIA DEPARTAMENTO DE MICROBIOLOGIA E PARASITOLOGIA DISCIPLINA DE PARASITOLOGIA INTRODUÇÃO Toxocara canis Toxocara cati Toxocara canis - Parasito de cães
UNIVERSIDADE FEDERAL DE PELOTAS INSTITUTO DE BIOLOGIA DEPARTAMENTO DE MICROBIOLOGIA E PARASITOLOGIA DISCIPLINA DE PARASITOLOGIA INTRODUÇÃO Toxocara canis Toxocara cati Toxocara canis - Parasito de cães
MIELOENCEFALITE PROTOZOÁRIA EQUINA
 REVISTA CIENTÍFICA DE MEDICINA VETERINÁRIA - ISSN 1679-7353 Ano XVI - Número 32 JANEIRO de 2019 Periódico Semestral MIELOENCEFALITE PROTOZOÁRIA EQUINA ELEOTERIO Mirelli Cristina, ¹ OLIVEIRA, Maria Luiza
REVISTA CIENTÍFICA DE MEDICINA VETERINÁRIA - ISSN 1679-7353 Ano XVI - Número 32 JANEIRO de 2019 Periódico Semestral MIELOENCEFALITE PROTOZOÁRIA EQUINA ELEOTERIO Mirelli Cristina, ¹ OLIVEIRA, Maria Luiza
Vírus da Peste suína Clássica - VPSC. Diagnóstico Laboratorial
 Vírus da Peste suína Clássica - VPSC Diagnóstico Laboratorial Freitas, T. R. P. 2009 Diagnóstico laboratorial Variabilidade dos sinais clínicos e das lesões post- mortem Doenças confundíveis Exame diferencial
Vírus da Peste suína Clássica - VPSC Diagnóstico Laboratorial Freitas, T. R. P. 2009 Diagnóstico laboratorial Variabilidade dos sinais clínicos e das lesões post- mortem Doenças confundíveis Exame diferencial
Mieloencefalite protozoária eqüina. Equine protozoal myeloencephalitis
 Rev. Bras. Saúde Prod. An., v.4, n.1, p. 30-34, 2003 ISSN 1519 9940 Mieloencefalite protozoária eqüina Equine protozoal myeloencephalitis PEIXOTO, A.P.C. 1*, KUCHEMBUCK, M.R.G. 2, GONÇALVES R.C. 2, CHIACCHIO,
Rev. Bras. Saúde Prod. An., v.4, n.1, p. 30-34, 2003 ISSN 1519 9940 Mieloencefalite protozoária eqüina Equine protozoal myeloencephalitis PEIXOTO, A.P.C. 1*, KUCHEMBUCK, M.R.G. 2, GONÇALVES R.C. 2, CHIACCHIO,
Cryptosporidium Do grego Kryptos = escondido, spora = Semente
 1 2 Cryptosporidium Cryptosporidium spp Cryptosporidium Do grego Kryptos = escondido, spora = Semente Coccídio ~ 4 a 8 µm de diâmetro Filo: Apicomplexa Classe: Sporozoea Ordem: Eucoccidiida Família: Cryptosporididae
1 2 Cryptosporidium Cryptosporidium spp Cryptosporidium Do grego Kryptos = escondido, spora = Semente Coccídio ~ 4 a 8 µm de diâmetro Filo: Apicomplexa Classe: Sporozoea Ordem: Eucoccidiida Família: Cryptosporididae
Aplicações de anticorpos em métodos diagnósticos
 Aula Prática Demonstrativa: Aplicações de anticorpos em métodos diagnósticos Introdução Profa. Cristina MED- 2017 Detecção de anticorpos (diagnóstico sorológico) Exemplo: detecção de anticorpos em jovem
Aula Prática Demonstrativa: Aplicações de anticorpos em métodos diagnósticos Introdução Profa. Cristina MED- 2017 Detecção de anticorpos (diagnóstico sorológico) Exemplo: detecção de anticorpos em jovem
Imunocromatografia e Dot-ELISA. Responsável Prof. Helio J. Montassier
 Imunocromatografia e Dot-ELISA Responsável Prof. Helio J. Montassier IMUNOCROMATOGRAFIA A imunocromatografia é uma técnica que começou a ser desenvolvida nos anos 60, sendo primeiro criada para o estudo
Imunocromatografia e Dot-ELISA Responsável Prof. Helio J. Montassier IMUNOCROMATOGRAFIA A imunocromatografia é uma técnica que começou a ser desenvolvida nos anos 60, sendo primeiro criada para o estudo
Imunologia Veterinária. Aula 1 A defesa do organismo
 Imunologia Veterinária Aula 1 A defesa do organismo Uma Breve História da Imunologia Veterinária Quando infecções como a varíola e a peste se espalharam pela sociedade antiga, embora muitos tenham morrido,
Imunologia Veterinária Aula 1 A defesa do organismo Uma Breve História da Imunologia Veterinária Quando infecções como a varíola e a peste se espalharam pela sociedade antiga, embora muitos tenham morrido,
Giardíase Giardia lamblia
 UNIVERSIDADE FEDERAL DO PAMPA Campus Itaqui Curso de Nutrição Parasitologia Giardíase Giardia lamblia Mestrando : Félix Munieweg felix_muniewe@hotmail.com Classificação taxonômica G. lamblia G. intestinalis
UNIVERSIDADE FEDERAL DO PAMPA Campus Itaqui Curso de Nutrição Parasitologia Giardíase Giardia lamblia Mestrando : Félix Munieweg felix_muniewe@hotmail.com Classificação taxonômica G. lamblia G. intestinalis
Imunidade Humoral. Células efectoras: Linfócitos B. (Imunoglobulinas)
 Imunidade Humoral Células efectoras: Linfócitos B (Imunoglobulinas) Determinantes antigénicos Também conhecidos como epítopos, são porções do antigénio que reúnem aspectos físicos e químicos que favorecem
Imunidade Humoral Células efectoras: Linfócitos B (Imunoglobulinas) Determinantes antigénicos Também conhecidos como epítopos, são porções do antigénio que reúnem aspectos físicos e químicos que favorecem
Giardíase. - É a principal parasitose intestinal (com maior incidência do que a ascaridíase e a amebíase).
 Giardíase Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Diplomonadida Família: Hexamitidae Gênero: Giardia Espécie: Giardia lamblia - É a principal parasitose intestinal
Giardíase Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Diplomonadida Família: Hexamitidae Gênero: Giardia Espécie: Giardia lamblia - É a principal parasitose intestinal
Giardia duodenalis Giardíase
 Parasitologia Biotecnologia Giardia duodenalis Giardíase Prof. Paulo Henrique Matayoshi Calixto Características Primeiramente descrita em 1681 por Anthon van Leeuwenhoek em suas próprias fezes; Acomete
Parasitologia Biotecnologia Giardia duodenalis Giardíase Prof. Paulo Henrique Matayoshi Calixto Características Primeiramente descrita em 1681 por Anthon van Leeuwenhoek em suas próprias fezes; Acomete
Meningoencefalomielites. Meningoencefalomielites protozoárias II. Protozoários intra-celulares. Toxoplasmose. Vias e formas infectantes 08/10/2016
 PUC Minas MV VITOR MÁRCIO RIBEIRO vitor@pucminas.br Meningoencefalomielites protozoárias II Toxoplasma, Neospora e Leishmania. Definição Meningoencefalomielites Processo inflamatório que envolve as MENINGES,
PUC Minas MV VITOR MÁRCIO RIBEIRO vitor@pucminas.br Meningoencefalomielites protozoárias II Toxoplasma, Neospora e Leishmania. Definição Meningoencefalomielites Processo inflamatório que envolve as MENINGES,
Sibele Borsuk /
 Protozoários Sibele Borsuk sibele@ufpel.tche.br / sibeleborsuk@gmail.com Classificação Protozoa Helminta Sarcodina Mastigophora Ciliata Sporozoa Trematoda Cestoda Nematoda Artropoda Insecta Protozoários
Protozoários Sibele Borsuk sibele@ufpel.tche.br / sibeleborsuk@gmail.com Classificação Protozoa Helminta Sarcodina Mastigophora Ciliata Sporozoa Trematoda Cestoda Nematoda Artropoda Insecta Protozoários
DIAGNÓSTICO DE NEOSPOROSE CANINA PELO MÉTODO DE REAÇÃO EM CADEIA DE POLIMERASE (PCR), ATRAVÉS DE LÍQUIDO CEFALORRAQUIDIANO (LÍQUOR)
 38º CONGRESSO BRASILEIRO DA ANCLIVEPA, 2017 - RECIFE/PE DIAGNÓSTICO DE NEOSPOROSE CANINA PELO MÉTODO DE REAÇÃO EM CADEIA DE POLIMERASE (PCR), ATRAVÉS DE LÍQUIDO CEFALORRAQUIDIANO (LÍQUOR) DIAGNOSIS OF
38º CONGRESSO BRASILEIRO DA ANCLIVEPA, 2017 - RECIFE/PE DIAGNÓSTICO DE NEOSPOROSE CANINA PELO MÉTODO DE REAÇÃO EM CADEIA DE POLIMERASE (PCR), ATRAVÉS DE LÍQUIDO CEFALORRAQUIDIANO (LÍQUOR) DIAGNOSIS OF
UM ESTUDO SOBRE MODELOS EPIDEMIOLÓGICOS ENVOLVENDO EQUAÇÕES DIFERENCIAIS ORDINÁRIAS
 UM ESTUDO SOBRE MODELOS EPIDEMIOLÓGICOS ENVOLVENDO EQUAÇÕES DIFERENCIAIS ORDINÁRIAS Valdir Junior Florentin de Aguiar 1 ; Maristela Missio 1 Estudante do curso de Matemática da UEMS, Unidade Universitária
UM ESTUDO SOBRE MODELOS EPIDEMIOLÓGICOS ENVOLVENDO EQUAÇÕES DIFERENCIAIS ORDINÁRIAS Valdir Junior Florentin de Aguiar 1 ; Maristela Missio 1 Estudante do curso de Matemática da UEMS, Unidade Universitária
Ms. Romeu Moreira dos Santos
 Ms. Romeu Moreira dos Santos IMUNOVIR 2017 2015 INTRODUÇÃO A imunocromatografia é uma técnica que começou a ser desenvolvida nos anos 60, sendo primeiro criada para o estudo das proteínas séricas Atualmente
Ms. Romeu Moreira dos Santos IMUNOVIR 2017 2015 INTRODUÇÃO A imunocromatografia é uma técnica que começou a ser desenvolvida nos anos 60, sendo primeiro criada para o estudo das proteínas séricas Atualmente
Palavras-chave: canino, tripanossomíase, Doença de Chagas Key-words: canine, trypanosomiasis, chagas disease
 1 OCORRÊNCIA DE ANTICORPOS ANTI-Trypanosoma cruzi EM CÃES DE UMA ÁREA RURAL NO MUNICÍPIO DE RIO BRANCO, ACRE Mirlane da Silva SANTOS 1, Carolina Couto BARQUETE 2, Michelinne Medeiros de Oliveira DANTAS
1 OCORRÊNCIA DE ANTICORPOS ANTI-Trypanosoma cruzi EM CÃES DE UMA ÁREA RURAL NO MUNICÍPIO DE RIO BRANCO, ACRE Mirlane da Silva SANTOS 1, Carolina Couto BARQUETE 2, Michelinne Medeiros de Oliveira DANTAS
Prevalência de anticorpos anti-toxoplasma gondii e anti-neospora caninum em rebanhos caprinos do município de Mossoró, Rio Grande do Norte
 Universidade de São Paulo Biblioteca Digital da Produção Intelectual - BDPI Departamento de Medicina Veterinária Prevenção e Saúde Animal Artigos e Materiais de Revistas Científicas - FMVZ/VPS - FMVZ/VPS
Universidade de São Paulo Biblioteca Digital da Produção Intelectual - BDPI Departamento de Medicina Veterinária Prevenção e Saúde Animal Artigos e Materiais de Revistas Científicas - FMVZ/VPS - FMVZ/VPS
PREVALÊNCIA DE GIARDIA LAMBLIA NA CIDADE DE BURITAMA ESTADO DE SÃO PAULO
 PREVALÊNCIA DE GIARDIA LAMBLIA NA CIDADE DE BURITAMA ESTADO DE SÃO PAULO Catierine Hirsch Werle RESUMO A Giardia está distribuída mundialmente. No Brasil sua prevalência varia de 4 a 30%, dependendo das
PREVALÊNCIA DE GIARDIA LAMBLIA NA CIDADE DE BURITAMA ESTADO DE SÃO PAULO Catierine Hirsch Werle RESUMO A Giardia está distribuída mundialmente. No Brasil sua prevalência varia de 4 a 30%, dependendo das
PROTOZOÁRIOS INTESTINAIS
 PROTOZOÁRIOS INTESTINAIS ISOSPORA BELLI INTRODUÇÃO Isospora belli é um parasito do Filo Coccidia, disseminado de mamíferos e aves e que esporadicamente infecta o homem. Foi descrito pela primeira vez por
PROTOZOÁRIOS INTESTINAIS ISOSPORA BELLI INTRODUÇÃO Isospora belli é um parasito do Filo Coccidia, disseminado de mamíferos e aves e que esporadicamente infecta o homem. Foi descrito pela primeira vez por
Febre maculosa febre carrapato
 A febre maculosa, também conhecida como febre do carrapato é uma doença infecciosa aguda causada pela bactéria Rickettsia rickettsii, que é intracelular obrigatória e tem como vetor biológico o carrapato
A febre maculosa, também conhecida como febre do carrapato é uma doença infecciosa aguda causada pela bactéria Rickettsia rickettsii, que é intracelular obrigatória e tem como vetor biológico o carrapato
ESPECIALIZAÇÃO EM MICROBIOLOGIA APLICADA UNIOESTE PROF. RAFAEL ANDRADE MENOLLI
 ESPECIALIZAÇÃO EM MICROBIOLOGIA APLICADA UNIOESTE PROF. RAFAEL ANDRADE MENOLLI Imunologia Definição: estudo do sistema imune (SI) e dos mecanismos que os seres humanos e outros animais usam para defender
ESPECIALIZAÇÃO EM MICROBIOLOGIA APLICADA UNIOESTE PROF. RAFAEL ANDRADE MENOLLI Imunologia Definição: estudo do sistema imune (SI) e dos mecanismos que os seres humanos e outros animais usam para defender
TRYPANOSOMA EVANSI EM EQUINOS
 TRYPANOSOMA EVANSI EM EQUINOS INTRODUÇÃO A trypanosomose equina, também conhecida como mal-das-cadeiras ou surra é uma doença que tem uma distribuição geográfica extremamente ampla. Ela ocorre no norte
TRYPANOSOMA EVANSI EM EQUINOS INTRODUÇÃO A trypanosomose equina, também conhecida como mal-das-cadeiras ou surra é uma doença que tem uma distribuição geográfica extremamente ampla. Ela ocorre no norte
Professor Antônio Ruas :
 1. Créditos: 60 2. Carga horária semanal: 4 3. Semestre: 2 4. Assunto: (i) (ii) (iii) (iv) (v) (vi) (vii) Universidade Estadual do Rio Grande do Sul Bacharelado em Gestão Ambiental Componente curricular:
1. Créditos: 60 2. Carga horária semanal: 4 3. Semestre: 2 4. Assunto: (i) (ii) (iii) (iv) (v) (vi) (vii) Universidade Estadual do Rio Grande do Sul Bacharelado em Gestão Ambiental Componente curricular:
Bio12. Unidade 3 Imunidade e Controlo de Doenças. josé carlos. morais
 Bio12 Unidade 3 e Controlo de Doenças Que desafios se colocam ao controlo de doenças? Capítulo 1.1. Defesas específicas e não específicas De que forma poderá o organismo humano defenderse das agressões
Bio12 Unidade 3 e Controlo de Doenças Que desafios se colocam ao controlo de doenças? Capítulo 1.1. Defesas específicas e não específicas De que forma poderá o organismo humano defenderse das agressões
Sumário ANEXO I COMUNICADO HERMES PARDINI
 Sumário ANEXO I COMUNICADO HERMES PARDINI Conteúdo MICOBACTERIUM, PCR - VETERINÁRIO NOVO EXAME... 2 PANLEUCOPENIAFELINA, PCR - VETERINÁRIO NOVO EXAME... 4 PAPILOMA VIRUS CANINO, PCR VETERINÁRIO NOVO EXAME...
Sumário ANEXO I COMUNICADO HERMES PARDINI Conteúdo MICOBACTERIUM, PCR - VETERINÁRIO NOVO EXAME... 2 PANLEUCOPENIAFELINA, PCR - VETERINÁRIO NOVO EXAME... 4 PAPILOMA VIRUS CANINO, PCR VETERINÁRIO NOVO EXAME...
Emergência do Zika vírus no Brasil: Consequências, Enfrentamento e Processo de Produção de Conhecimento
 Emergência do Zika vírus no Brasil: Consequências, Enfrentamento e Processo de Produção de Conhecimento Junho 2017 Maria Glória Teixeira Roteiro Reconhecimento do ZIKV Consequências Epidemiológicas Enfrentamento
Emergência do Zika vírus no Brasil: Consequências, Enfrentamento e Processo de Produção de Conhecimento Junho 2017 Maria Glória Teixeira Roteiro Reconhecimento do ZIKV Consequências Epidemiológicas Enfrentamento
Ferroglio et al. (2005) (70 /282) 24.8% - 1: 80 Bresciani et al. (2007) - RIFI 98 /400 (24,5%, 1:64)
 26/04/2016 1 2 3 4 5 6 NEOSPORA Neospora Caninum Extensa faixa de hospedeiros Espécies pecuárias Animais de companhia Alguns animais silvestres Encefalite e miocardite diversas espécies Aborto endêmico
26/04/2016 1 2 3 4 5 6 NEOSPORA Neospora Caninum Extensa faixa de hospedeiros Espécies pecuárias Animais de companhia Alguns animais silvestres Encefalite e miocardite diversas espécies Aborto endêmico
DOENÇAS INFECCIOSAS DE CÃES
 DOENÇAS INFECCIOSAS DE CÃES Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria DOENÇAS INFECCIOSAS MUITO COMUNS DE CÃES NO RS VERMINOSE
DOENÇAS INFECCIOSAS DE CÃES Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria DOENÇAS INFECCIOSAS MUITO COMUNS DE CÃES NO RS VERMINOSE
Comparação entre testes utilizados para pesquisa de anticorpos antitoxoplasma
 Disciplinarum Scientia. Série: Ciências da Saúde, Santa Maria, v. 6, n. 1, p.13-18, 2005. 13 ISSN 1982-2111 Comparação entre testes utilizados para pesquisa de anticorpos antitoxoplasma em gestantes 1
Disciplinarum Scientia. Série: Ciências da Saúde, Santa Maria, v. 6, n. 1, p.13-18, 2005. 13 ISSN 1982-2111 Comparação entre testes utilizados para pesquisa de anticorpos antitoxoplasma em gestantes 1
Doenças Infecciosas e Transmissão de Doenças: Conceitos Básicos
 Universidade Federal do Rio de Janeiro Instituto de Estudos em Saúde Coletiva Graduação de Saúde Coletiva Disciplina: Fundamentos de Epidemiologia Doenças Infecciosas e Transmissão de Doenças: Conceitos
Universidade Federal do Rio de Janeiro Instituto de Estudos em Saúde Coletiva Graduação de Saúde Coletiva Disciplina: Fundamentos de Epidemiologia Doenças Infecciosas e Transmissão de Doenças: Conceitos
BIOLOGIA. Identidade dos Seres Vivos Protistas e Algas Parte I. Prof. Daniele Duó
 BIOLOGIA Identidade dos Seres Vivos Protistas e Algas Parte I Prof. Daniele Duó Formado por algas e protozoários Algas uni ou pluricelulares, eucariontes, autotróficas Protozoários unicelulares, eucariontes
BIOLOGIA Identidade dos Seres Vivos Protistas e Algas Parte I Prof. Daniele Duó Formado por algas e protozoários Algas uni ou pluricelulares, eucariontes, autotróficas Protozoários unicelulares, eucariontes
MÉTODOS DE ESTUDO DE BACTÉRIAS BUCAIS
 LABORATÓRIO DE ANAERÓBIOS http://www.icb.usp.br/bmm/mariojac MÉTODOS DE ESTUDO DE BACTÉRIAS BUCAIS Prof. Dr. Mario J. Avila-Campos Para que isolar microrganismos? - Conhecer os diferentes tipos microbianos
LABORATÓRIO DE ANAERÓBIOS http://www.icb.usp.br/bmm/mariojac MÉTODOS DE ESTUDO DE BACTÉRIAS BUCAIS Prof. Dr. Mario J. Avila-Campos Para que isolar microrganismos? - Conhecer os diferentes tipos microbianos
Parasitologia VET05596 REINO PROTOZOA. Jankerle Neves Boeloni
 Parasitologia VET05596 REINO PROTOZOA Jankerle Neves Boeloni Classificação Reino Protozoa Filo Sarcomastigophora Filo Apicomplexa Classes: Sarcodina Mastigophora Classes: Coccidia Piroplasmasida Filo Apicomplexa
Parasitologia VET05596 REINO PROTOZOA Jankerle Neves Boeloni Classificação Reino Protozoa Filo Sarcomastigophora Filo Apicomplexa Classes: Sarcodina Mastigophora Classes: Coccidia Piroplasmasida Filo Apicomplexa
AMEBÍASE. e Entamoeba histolytica. Satie Katagiri. São Paulo, março de 2010.
 AMEBÍASE e Entamoeba histolytica Satie Katagiri São Paulo, março de 2010. Amebas parasitas do homem Gênero Entamoeba Classificadas conforme número de núcleos da forma cística. Com 8 núcleos: Entamoeba
AMEBÍASE e Entamoeba histolytica Satie Katagiri São Paulo, março de 2010. Amebas parasitas do homem Gênero Entamoeba Classificadas conforme número de núcleos da forma cística. Com 8 núcleos: Entamoeba
PROTOZOÁRIOS DO SANGUE E DOS TECIDOS
 PROTOZOÁRIOS DO SANGUE E DOS TECIDOS Gênero: Toxoplasma Espécie: Toxoplasma gondii INTRODUÇÃO A toxoplasmose é uma zoonose de felídeos, universalmente disseminada, infectando principalmente aves e mamíferos
PROTOZOÁRIOS DO SANGUE E DOS TECIDOS Gênero: Toxoplasma Espécie: Toxoplasma gondii INTRODUÇÃO A toxoplasmose é uma zoonose de felídeos, universalmente disseminada, infectando principalmente aves e mamíferos
AVALIAÇÃO DISCURSIVA DE BIOLOGIA 1
 CENTRO EDUCACIONAL CHARLES DARWIN AVALIAÇÃO DISCURSIVA DE BIOLOGIA 1 Primeira Avaliação 2ª Série Ensino Médio Primeiro Período 2017 Assinale com um X se estiver fazendo Progressão Parcial: Aluno(a): Série
CENTRO EDUCACIONAL CHARLES DARWIN AVALIAÇÃO DISCURSIVA DE BIOLOGIA 1 Primeira Avaliação 2ª Série Ensino Médio Primeiro Período 2017 Assinale com um X se estiver fazendo Progressão Parcial: Aluno(a): Série
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios
 Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Resposta imune adquirida
 Resposta imune adquirida Resposta imune adquirida Também denominada: - Resposta imune tardia - Resposta imune adaptativa É caracterizada por ocorrer em períodos mais tardios após o contato com um agente
Resposta imune adquirida Resposta imune adquirida Também denominada: - Resposta imune tardia - Resposta imune adaptativa É caracterizada por ocorrer em períodos mais tardios após o contato com um agente
INVESTIGAÇÃO SOROEPIDEMIOLÓGICA SOBRE A LARVA MIGRANS VISCERAL POR TOXOCARA CANIS EM USUÁRIOS DE SERVIÇOS DE SAÚDE DE GOIÂNIA GO
 INVESTIGAÇÃO SOROEPIDEMIOLÓGICA SOBRE A LARVA MIGRANS VISCERAL POR TOXOCARA CANIS EM USUÁRIOS DE SERVIÇOS DE SAÚDE DE GOIÂNIA GO Gilcilene Maria dos Santos, Simonne Almeida e Silva, Alverne Passos Barbosa
INVESTIGAÇÃO SOROEPIDEMIOLÓGICA SOBRE A LARVA MIGRANS VISCERAL POR TOXOCARA CANIS EM USUÁRIOS DE SERVIÇOS DE SAÚDE DE GOIÂNIA GO Gilcilene Maria dos Santos, Simonne Almeida e Silva, Alverne Passos Barbosa
Inquérito sorológico para toxoplasmose em equinos na região de Botucatu-SP
 Arq. Bras. Med. Vet. Zootec., v.62, n.2, p.484-488, 2010 Comunicação [Communication] Inquérito sorológico para toxoplasmose em equinos na região de Botucatu-SP [Serological survey of toxoplasmosis in horses
Arq. Bras. Med. Vet. Zootec., v.62, n.2, p.484-488, 2010 Comunicação [Communication] Inquérito sorológico para toxoplasmose em equinos na região de Botucatu-SP [Serological survey of toxoplasmosis in horses
HERPES ZOSTER DISSEMINADO EM PACIENTE IMUNOCOMPETENTE. Dra. Rosanna Carrarêtto Dr. Fabrício Prado Monteiro
 HERPES ZOSTER DISSEMINADO EM PACIENTE IMUNOCOMPETENTE Dra. Rosanna Carrarêtto Dr. Fabrício Prado Monteiro OBJETIVO Relatar o acometimento de escolar de sete anos de idade, sexo feminino, imunocompetente,
HERPES ZOSTER DISSEMINADO EM PACIENTE IMUNOCOMPETENTE Dra. Rosanna Carrarêtto Dr. Fabrício Prado Monteiro OBJETIVO Relatar o acometimento de escolar de sete anos de idade, sexo feminino, imunocompetente,
AVALIAÇÃO DA RESPOSTA IMUNE CELULAR INTRAEPITELIAL NO INTESTINO DE FRANGOS DE CORTE (Gallus gallus domesticus) INFECTADOS EXPERIMENTALMENTE
 11 a 14 de dezembro de 2012 Campus de Palmas AVALIAÇÃO DA RESPOSTA IMUNE CELULAR INTRAEPITELIAL NO INTESTINO DE FRANGOS DE CORTE (Gallus gallus domesticus) INFECTADOS EXPERIMENTALMENTE COM Eimeria maxima
11 a 14 de dezembro de 2012 Campus de Palmas AVALIAÇÃO DA RESPOSTA IMUNE CELULAR INTRAEPITELIAL NO INTESTINO DE FRANGOS DE CORTE (Gallus gallus domesticus) INFECTADOS EXPERIMENTALMENTE COM Eimeria maxima
Mecanismo de invasão do Toxoplasma gondii
 Universidade Federal de Pernambuco Centro de Ciências da Saúde Departamento de Parasitologia Mecanismo de invasão do Toxoplasma gondii Aluna: Adélia Karla F. Soares Acadêmica de Enfermagem Introdução:
Universidade Federal de Pernambuco Centro de Ciências da Saúde Departamento de Parasitologia Mecanismo de invasão do Toxoplasma gondii Aluna: Adélia Karla F. Soares Acadêmica de Enfermagem Introdução:
4ª Ficha de Trabalho para Avaliação Biologia (12º ano)
 4ª Ficha de Trabalho para Avaliação Biologia (12º ano) Ano Lectivo: 2008/2009 Nome: Nº Turma: CT Curso: CH-CT Data: 06/03/2009 Docente: Catarina Reis NOTA: Todas as Respostas são obrigatoriamente dadas
4ª Ficha de Trabalho para Avaliação Biologia (12º ano) Ano Lectivo: 2008/2009 Nome: Nº Turma: CT Curso: CH-CT Data: 06/03/2009 Docente: Catarina Reis NOTA: Todas as Respostas são obrigatoriamente dadas
CORPO HUMANO: UM TODO FORMADO POR MUITAS PARTES
 CORPO HUMANO: UM TODO FORMADO POR MUITAS PARTES NÍVEIS DE ORGANIZAÇÃO DA VIDA A Célula ( menor porção de um ser vivo) B - Tecido( Conjunto de células com funções semelhantes) C - Órgão ( Conjuntos de tecidos
CORPO HUMANO: UM TODO FORMADO POR MUITAS PARTES NÍVEIS DE ORGANIZAÇÃO DA VIDA A Célula ( menor porção de um ser vivo) B - Tecido( Conjunto de células com funções semelhantes) C - Órgão ( Conjuntos de tecidos
Imunologia da infecção pelo HIV
 Imunologia da infecção pelo HIV Histórico e epidemiologia 1981 - Em oito meses foram diagnosticados 5 casos de pneumonia pelo FUNGO (Pneumocystis jiroveci). Entre 1967 e 1979 foram diagnosticados apenas
Imunologia da infecção pelo HIV Histórico e epidemiologia 1981 - Em oito meses foram diagnosticados 5 casos de pneumonia pelo FUNGO (Pneumocystis jiroveci). Entre 1967 e 1979 foram diagnosticados apenas
Sumário ANEXO I COMUNICADO HERMES PARDINI
 Sumário ANEXO I COMUNICADO HERMES PARDINI Conteúdo PATERNIDADE DE TRIO - TUBO A, B E C ALTERAÇÃO DE INFORMAÇÕES DO HELP... 2 TRIAGEM PARA IMUNODEFICIÊNCIA COMBINADA GRAVE-SCID NOVO EXAME... 3 ANTICORPOS
Sumário ANEXO I COMUNICADO HERMES PARDINI Conteúdo PATERNIDADE DE TRIO - TUBO A, B E C ALTERAÇÃO DE INFORMAÇÕES DO HELP... 2 TRIAGEM PARA IMUNODEFICIÊNCIA COMBINADA GRAVE-SCID NOVO EXAME... 3 ANTICORPOS
