UNIVERSIDADE FEDERAL DO RIO DE JANEIRO Centro de Ciências da Saúde Faculdade de Odontologia
|
|
|
- Geovane Palhares Castilhos
- 5 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DO RIO DE JANEIRO Centro de Ciências da Saúde Faculdade de Odontologia AVALIAÇÃO DAS CARACTERÍSTICAS CLÍNICAS PERIODONTAIS E DA MICROBIOTA SUBGENGIVAL DE INDIVÍDUOS COM SAÚDE E DOENÇA PERIODONTAIS Carina Maciel da Silva Boghossian, CD, MO Rio de Janeiro 2009
2 Livros Grátis Milhares de livros grátis para download.
3 ii AVALIAÇÃO DAS CARACTERÍSTICAS CLÍNICAS PERIODONTAIS E DA MICROBIOTA SUBGENGIVAL DE INDIVÍDUOS COM SAÚDE E DOENÇA PERIODONTAIS Carina Maciel da Silva Boghossian, CD, MO Tese de Doutorado apresentada ao Programa de Pós-graduação em Odontologia (Área de Concentração: Periodontia) da Faculdade de Odontologia da Universidade Federal do Rio de Janeiro como parte dos requisitos necessários à obtenção do título de Doutor em Odontologia (Área de Concentração: Periodontia). Orientadores: Prof.ª Dr.ª Ana Paula Vieira Colombo Prof. Dr. Ronir Raggio Luiz Rio de Janeiro Dezembro de 2009
4 iii AVALIAÇÃO DAS CARACTERÍSTICAS CLÍNICAS PERIODONTAIS E DA MICROBIOTA SUBGENGIVAL DE INDIVÍDUOS COM SAÚDE E DOENÇA PERIODONTAIS Carina Maciel da Silva Boghossian Orientadores: Ana Paula Vieira Colombo Ronir Raggio Luiz Tese de Doutorado submetida ao Programa de Pós-graduação em Odontologia (Área de Concentração: Periodontia) da Faculdade de Odontologia da Universidade Federal do Rio de Janeiro como parte dos requisitos necessários à obtenção do título de Doutor em Odontologia (Área de Concentração: Periodontia). Aprovada por: Prof.ª Dr.ª Anna Thereza Leão, DO, Prof. Adjunto UFRJ Prof. Dr. Milton de Uzeda, DO, Prof. Ajunto UNESA Prof. Dr. Paulo Nadanovsky, DO, Prof. Adjunto UERJ Prof. Dr. Cassiano Kuchenbecker Rösing, DO, Prof. Adjunto UFRGS Prof.ª Dr.ª Ana Paula Vieira Colombo, DO, Prof. Adjunto UFRJ Rio de Janeiro Dezembro de 2009
5 iv Ficha Catalográfica Silva-Boghossian, Carina Maciel da Avaliação das características clínicas periodontais e da microbiota subgengival de indivíduos com saúde e doença periodontais/ Carina Maciel da Silva-Boghossian. Rio de Janeiro: UFRJ/ FO, xxi, 165 f.: il.; 29,7 cm. Orientadores: Ana Paula Vieira Colombo e Ronir Raggio Luiz Tese (Doutorado) URRJ/ FO / Programa de Pós-graduação em Odontologia, área de concentração Periodontia, Referências Bibliográficas: f Avaliação periodontal. 2. Doença periodontal. 3. Perda de inserção periodontal/ perda clinica de inserção. 4. Profundidade de sondagem. 5. Fatores/ indicadores de risco. 6. Patógenos periodontais. 7. Microbiota subgengival. 8. Checkerboard. I. Silva-Boghossian, Carina Maciel da. II. Universidade Federal do Rio de Janeiro, Faculdade de Odontologia, Programa de Pós-graduação em Odontologia. III. Título.
6 v...o caminho é a vida. (Homero - A Odisséia)
7 Dedico este trabalho à minha família. vi
8 vii AGRADECIMENTOS Agradeço a Deus por ter conduzido a minha vida até aqui. Aos meus pais que foram desde sempre os grandes incentivadores de uma trajetória de estudos. E às minhas irmãs, Solange, Clarice e Deise, pelo incentivo. A minha família carioca: Renato, Vartan e Aline, obrigada pela paciência e por suportarem minhas ausências, faltas, cansaços... Amo vocês! À família Ozon-Boghossian que também faz parte desta conquista. Agradeço especialmente à tia Esther por todo carinho, dedicação e ajuda que tem dado a mim e à minha pequena família. À minha querida orientadora Prof.ª Dr.ª Ana Paula Vieira Colombo por toda sua dedicação, orientação e amizade. Obrigada por acreditar na minha capacidade ao me acolher no laboratório de Microbiologia Oral como estagiária; agradeço, principalmente, por ter me encaminhado para e durante o doutorado. Aprendi muito com você! Ao meu orientador Prof. Dr. Ronir Raggio Luiz por sua orientação, ensinamentos e paciência. Agradeço também por ter acreditado neste projeto e por ter colocado objetividade em nossas análises. À amiga e colega de laboratório Renata Souto por sua colaboração em várias etapas da realização desta pesquisa. Obrigada pelo carinho e amizade.
9 viii À amiga e colega de laboratório e de Periodontia Débora Heller por sua colaboração na realização de exames e na execução de etapas laboratoriais. Obrigada pela amizade e por trazer energia para nosso dia-a-dia. Aos professores da Periodontia, Prof.ª Dr.ª Anna Thereza Leão, Prof.ª Dr.ª Maria Cynésia Torres, Prof. Dr. Eduardo Feres Filho, Prof. Dr. Carmelo Sansone agradeço a oportunidade de discussões que contribuíram para este trabalho. Ao Prof. Dr. Milton de Uzeda por seu apoio ao Laboratório de Microbiologia Oral, que contribuiu em grande parte para a realização experimental deste estudo. Aos professores da banca examinadora e das bancas de qualificações do projeto e da tese. Às professoras da Odontopediatria, Prof.ª Dr.ª Lucianne Maia e Prof.ª Dr.ª Glória Castro pelas parcerias em pesquisas e publicações consequentes. À minha amiga Cristine Amaral pela colaboração na elaboração do primeiro artigo deste trabalho. Odontologia. Aos colegas das turmas de mestrado e de doutorado em para me ajudar. Aos funcionários da Odontologia que sempre estiveram disponíveis
10 ix Aos colegas de laboratório: Lúcio, Deda, David, Maura, Talita, Cíntia, Natascha, Rodrigo, Fernando; e alunos de iniciação científica Raphael e Thaís. À CAPES/ UFRJ pela bolsa de estudos concedida. À FAPERJ e CNPq pelo apoio financeiro a projetos do Laboratório de Microbiologia Oral do qual participa o presente estudo. realização deste estudo. A todas as pessoas que contribuíram direta e indiretamente para a
11 x RESUMO AVALIAÇÃO DAS CARACTERÍSTICAS CLÍNICAS PERIODONTAIS E DA MICROBIOTA SUBGENGIVAL DE INDIVÍDUOS COM SAÚDE E DOENÇA PERIODONTAIS Carina Maciel da Silva-Boghossian Orientadores: Ana Paula Vieira Colombo e Ronir Raggio Luiz. Resumo da Tese de Doutorado submetida ao Programa de Pós-graduação em Odontologia, área de concentração Periodontia, Faculdade de Odontologia, Universidade Federal do Rio de Janeiro UFRJ, como parte dos requisitos necessários à obtenção do título de Doutor em Odontologia. O presente estudo objetivou avaliar as características epidemiológicas, clínicas periodontais e a microbiota subgengival de indivíduos com saúde e doença periodontal, bem como identificar indicadores de risco para a doença periodontal. A população alvo foi constituída por indivíduos que procuraram atendimento no Departamento de Clínica Odontológica da Faculdade de Odontologia da Universidade Federal do Rio de Janeiro. Um total de 559 participantes (18-77 anos de idade) foi submetido a exame periodontal completo, anamnese e coleta de biofilme subgengival para análise microbiológica através da técnica do Checkerboard. Análise logística multivariada identificou um risco maior para profundidade de sondagem (PS) e nível clínico de inserção (NCI) aumentados para indivíduos que eram fumantes, tinham > 36 anos de idade, > 10% dos sítios com sangramento à sondagem (SS), > 30% dos sítios com biofilme supragengival e 4 dentes ausentes. Além disto, idade aumentada, alta frequência do complexo vermelho, bem como membros do complexo laranja (C. rectus e F. nucleatum polymorphum), V. parvula e A. actinomycetemcomitans (Aa) associado com P. aeruginosa aumentaram o risco para doença periodontal. Além disso, indivíduos com alta frequência de Aa, A. baumannii e complexo vermelho associado com P. aeruginosa tiveram maiores chances de ter periodontite agressiva; enquanto que a elevada prevalência de S. aureus no biofilme subgengival aumentou o risco para periodontite crônica. Esta população em particular apresenta alta prevalência e extensão de doença periodontal. Idade, fumo e SS são indicadores de risco associados com PS e NCI aumentados. Espécies bacterianas usualmente não relacionadas à doença periodontal, como A. baumannii, P. aeruginosa, S. aureus e V. parvula, juntamente com membros dos complexos laranja e vermelho indicam risco aumentado de desenvolver periodontite crônica e/ ou agressiva. Palavras-chave: avaliação periodontal, doença periodontal, perda de inserção periodontal/ perda clinica de inserção, profundidade de sondagem, fatores/ indicadores de risco, patógenos periodontais, microbiota subgengival, Checkerboard. Rio de Janeiro Dezembro de 2009
12 xi ABSTRACT EVALUATION OF PERIODONTAL CLINICAL CARACTERISTICS AND SUBGINGIVAL MICROBIOTA OF SUBJECTS WITH PERIODONTAL HEALTH AND DISEASE Carina Maciel da Silva-Boghossian Orientadores: Ana Paula Vieira Colombo e Ronir Raggio Luiz. Abstract da tese de Doutorado submetida ao Programa de Pós-graduação em Odontologia, área de concentração Periodontia, Faculdade de Odontologia, Universidade Federal do Rio de Janeiro UFRJ, como parte dos requisitos necessários à obtenção do título de Doutor em Odontologia. The aim of the present study was to evaluate the epidemiological and periodontal characteristics, as well as the subgingival microbiota of subjects with periodontal health and disease. Risk indicators to periodontal disease were also investigated. Material and methods: 559 participants (14-77 years of age) who attended the Dental School of the Federal University of Rio de Janeiro were enrolled in the present study. The subjects were submitted to full-mouth periodontal clinical examination, anamnesis-questionnaires, and subgingival biofilm sampling for microbiological analysis by the Checkerboard method. Multivariate logistic analyses identified a higher risk for increased probing depth (PD) and clinical attachment level (CAL) for subjects who were smokers, older than 36-years, had > 10% of sites with bleeding on probing (BOP), and > 30% of sites with supragingival biofilm, and had 4 missing teeth. Moreover, increased age, high frequency of red complex, members of orange complex (C. rectus and F. n. sp. polymorphum), V. parvula and A. actinomycetemcomitans (Aa) associated with P. aeruginosa increased the risk for periodontal disease. Subjects with high frequencies of Aa, A. baumannii, and red complex associated with P. aeruginosa had higher chances to present aggressive periodontitis; whereas high frequency of S. aureus was related to an increased risk for chronic periodontitis. This particular population presents high prevalence and extent of severe periodontal disease. Age, smoking and BOP are risk indicators associated with increased PD and CAL. Bacterial species not usually related to periodontal disease, such as A. baumannii, P. aeruginosa, S. aureus and V. parvula, along with members of orange and red complexes indicate increased risk for chronic and/ or aggressive periodontitis. Keywords: periodontal evaluation, periodontal disease, periodontal attachment loss/ clinical attachment loss, probing depth, risk factors/ indicators, periodontal pathogens, subgingival microbiota, Checkerboard. Rio de Janeiro Dezembro de 2009
13 xii RESUMEN EVALUACIÓN DELLAS CARACTERISTICAS CLINICAS PERIODONTALES Y DA MICROBIOTA SUBGINGIVAL DE INDIVIDUOS CON SALUD Y ENFERMEDAD PERIODONTAL Carina Maciel da Silva-Boghossian Orientadores: Ana Paula Vieira Colombo e Ronir Raggio Luiz. Resumen da tese de Doutorado submetida ao Programa de Pós-graduação em Odontologia, área de concentração Periodontia, Faculdade de Odontologia, Universidade Federal do Rio de Janeiro UFRJ, como parte dos requisitos necessários à obtenção do título de Doutor em Odontologia. Este estudio tuvo como objetivos evaluar las características epidemiólogas, clínicas periodontales y la microbiota subgingival de individuos con salud y enfermedad periodontal, así como identificar indicadores del riesgo para la enfermedad periodontal. La población de estudio se constituyó por individuos que buscaron al Departamento de la Clínica Odontológica de la Universidad Federal del Río de Janeiro. A un total de 559 participantes (18-77 años de edad) se realizó examen periodontal completo, anamnese y tomada de biofilm subgingival para análisis microbiológica a través de la técnica del Checkerboard. La análisis logística multivariada identificó un riesgo mayor para la profundidad al sondaje (PS) y el nivel clínico de inserción (NCI) aumentados para los individuos que fumaban, tenían > 36 años de edad, > 10% de los sitios con sangrado al sondaje (SS), > 30% de los sitios con biofilm supragingival y para 4 dientes ausentes. Por otra parte, edad creciente, alta frecuencia del complejo rojo, así como miembros del complejo naranja (C. rectus y F. nucleatum polymorphum), V. parvula y A. actinomycetemcomitans (Aa) asociado con P. aeruginosa aumentaran el riesgo para la enfermedad periodontal. Además, individuos con alta frecuencia de Aa, A. baumannii y complejo rojo asociado con P. aeruginosa tenían mayores posibilidades de tener periodontitis agresiva; mientras la elevada prevalencia de S. aureus en el biofilm subgingival aumentó el riesgo para periodontitis crónica. Esta población en especial presenta alta prevalencia y extensión de la enfermedad periodontal. La edad, el tabaco y el SS son indicadores de riesgo asociados con PS y NCI aumentados. Especies bacterianas generalmente no relacionadas con la enfermedad periodontal, como A. baumannii, P. aeruginosa, S. aureus y V. parvula, conjuntamente con los miembros de los complejos naranja y rojo indican riesgo aumentado de desarrollo de periodontitis crónica y/ o agresiva. Palabras claves: evaluación periodontal, enfermedad periodontal, perdida de inserción periodontal/ perdida clínica de inserción, profundidad al sondaje, factores/ indicadores de riesgo, patógenos periodontales, microbiota subgingival, Checkerboard. Rio de Janeiro Dezembro de 2009
14 xiii LISTA DE ABREVIATURAS E SÍMBOLOS Aa Aggregatibacter actinomycetemcomitans C Graus Celsius/ Celsius degree AP AAP AL ATCC BD BOP CAL CAPES CI Cm CNPq CP CPI CPITN CV DNA EDTA et al. EP FAPERJ G Aggressive periodontitis American Academy of Periodontology/ Academia Americana de Periodontia Attachment loss or level American Type Culture Collection Biofilme dental Bleeding on probing Clinical attachment loss or level Coordenação de Aperfeiçoamento de Pessoal de Nível Superior Confidence interval Centímetro/ centimeter Conselho Nacional de Desenvolvimento Científico e Tecnológico Chronic periodontitis Community Periodontal Index/ Índice Periodontal Comunitário Community Periodontal Index of Treatment Needs/ Índice das Necessidades de Tratamento Periodontal Comunitário Coefficient of variance Deoxyribonucleic acid/ Ácido desoxirribonucleico Ethylenediamine tetraacetic acid/ ácido etilenodiamino tetra-acético e outros Electronic probing Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro Gingivitis
15 xiv H HIV IgG IBGE IC μl M mm mg min ml mm MP MT NCI ng Hora (s) Human immunodeficiency virus/ vírus da imunodeficiência humana Imunoglobulina G Instituto Brasileiro de Geografia e Estatística Intervalo de confiança Microlitro/ microliter Molar Mimolar/ millimolar Miligrama/ milligram Minuto/ minute Mililitro/ milliliter Milimetro/ millimeter Manual probing Missing teeth Nível clínico de inserção Nanograma/ nanogram NHANES National Health and Nutrition Examination Survey % Percentagem/ percentage PH OR p PD ph PI PS 2 Periodontal health Odds Ratio/ Razão de chances Probabilidade Probing depth Potencial hidrogeniônico Perda de inserção Profundidade de sondagem Qui-quadrado/ Chi-square
16 xv RAL RNA SB SDS SPSS SS SSC SUP TE UFRJ US$ Relative attachment level Ribonucleic acid/ Ácido ribonucleico Supragingival biofilm Sodium Dodecyl Sulphate/ Lauryl Sulfato de Sódio Statistical Package for the Social Sciences Sangramento à sondagem Saline Sodium Citrate/ citrato de salina sódica Suppuration/ supuração Tampão tris-edta Universidade Federal do Rio de Janeiro Dólar americano
17 xvi LISTA DE FIGURAS Página DELINEAMENTO DA PESQUISA Figura 1 Foto do aparato Minislot 30 (Immunetics) e esquema da preparação das amostras de biofilme dental. 25 Figura 2 Foto do aparato Miniblotter 45 (Immunetics) e esquema da hibridização das amostras com as sondas de DNA. 26 Figura 3 Imagem digitalizada de uma membrana após o 27 processamento pelo método do checkerboard. ARTIGO 1 Figure 1 Flow chart of the studies selection process. 34 ARTIGO 2 Figure 1 Bar chart of the distribution of subjects with clinical AL 5 or 7 mm in at least one site and in 10%, 20%, 30%, and 40% of sites. 42 ARTIGO 3 Figure 1 Bar chart of the distribution of subjects with periodontal probing depth (PD) 5 or 7 mm in at least one site, 10%, 20%, 30%, 40%, 50%, and 60% of the sites. 75
18 xvii ARTIGO 4 Figure 1 Clustered bar chart of percentage of sites colonized (a) and mean bacterial counts (in log 10; b) of Aggregatibacter actinomycetemcomitans (Aa), red complex, and non-oral species in subjects with periodontal health (PH), gingivitis (G), chronic (CP), and aggressive (AP) periodontitis. * p < 0.05, ** p < 0.01, refers to significant differences among groups (Kruskal- Wallis test) Figure 2 Bar chart of the frequency of subjects carrying the red complex in the subgingival microbiota. PH: periodontal health (n = 6); G: gingivitis (n = 11); CP: chronic periodontitis (n = 143); AP: aggressive periodontitis (n = 62). 2 test, p < Figure 3 Bar chart of the odds ratio (OR) for having aggressive periodontitis in comparison to chronic periodontitis conferred by the presence of Aggregatibacter actinomycetemcomitans (Aa), Acinetobacter baumannii, and Red complex + Pseudomonas aeruginosa 10 4 cells. 106 ARTIGO 5 Figure 1 Microbial profiles as mean counts log 10 transformed (left panel), percentage of the total DNA probe count (middle panel) and percentage of detection (right panel) of
19 xviii bacterial taxa in subgingival plaque samples from 51 periodontally healthy, 42 gingivitis, 219 untreated chronic periodontitis and 90 untreated aggressive periodontitis subjects.
20 xix LISTA DE TABELAS Página ARTIGO 1 Table 1 Characteristics and assessment of quality of the selected studies. 35 Table 2 Determination of the quality of the selected studies. 36 Table 3 Summary of extracted results from selected studies. 36 ARTIGO 2 Table 1 Socio-demographic and economic data of the study population. 41 Table 2 Periodontal clinical data (mean ± SE) of the study population (n = 491) according to age, gender, and smoking status. 42 Table 3 Univariate logistic regression analysis of socio-economic, demographic and clinical predictor variables for the outcome variables clinical AL 5 mm in 10% of sites and clinical AL 7 mm in at least one site. 43 Table 4 Multivariate logistic regression analysis of age, smoking status and clinical predictor variables for the outcome variables clinical AL 5 mm in 10% of sites and clinical 44
21 xx AL 7 mm in at least one site. Table 5 Estimated predicted probability (%) of clinical AL 5 and 7 mm based on the multivariate logistic model. 45 ARTIGO 3 Table 1 Distribution of the study population according to age, socio-demographic and behavioral status. 68 Table 2 Periodontal clinical data (mean ± SEM) of the study population according to age 69 Table 3 Univariate logistic regression analysis of socio-economic, demographic and clinical variables on the PD 5 mm in 10% of the sites and PD 7 mm in at least one site. 70 Table 4 Multivariate logistic regression analysis of age, smoking status and clinical predictor variables for the outcome variables PD 5 mm in 10% of the sites, and PD 7 mm in at least one site. 71 Table 5 Estimated predicted probability (%) of PD 5 mm and 7 72 mm based on the multivariate logistic model. ARTIGO 4 Table 1 Demographic and periodontal clinical data of the study population (n = 402) 99
22 xxi Table 2 Linear regression of the association between 100 demographic variables and prevalence (Analysis 1) or levels (Analysis 2) of bacterial species and periodontal clinical parameters adjusted for age and smoking status. Table 3 Logistic regression analysis (forward Wald) of 101 microbiological parameters in periodontally healthy and periodontitis/gingivitis subjects. ARTIGO 5 Table 1 Bacterial strains used for the construction of whole genomic DNA probes. 129 Table 2 Multivariate logistic regression analysis (forward Wald) of microbiological predictor variables in periodontally healthy and periodontitis subjects. 130 Table 3 Multivariate logistic regression analysis (forward Wald) of microbiological predictor variables in gingivitis and periodontitis subjects. 131 Table 4 Multivariate logistic regression analysis (forward Wald) of microbiological predictor variables in chronic and aggressive periodontitis subjects. 132
23 SUMÁRIO RESUMO... x ABSTRACT... xi RESUMEN... xii LISTA DE ABREVIATURAS E SÍMBOLOS... xiii LISTA DE FIGURAS... xvi LISTA DE TABELAS... xix 1 INTRODUÇÃO PROPOSIÇÃO DELINEAMENTO DA PESQUISA População de estudo Dados individuais Avaliação clínica Monitoramento microbiológico Coleta de material para análise laboratorial microbiológica Determinação da microbiota subgengival utilizando a técnica de Checkerboard DNA-DNA hybridization a) Preparo das membranas b) Hibridização das membranas com as sondas de DNA c) Detecção das espécies Análise estatística Artigos científicos Artigo 1: Manual and electronic probing of the periodontal attachment level in untreated periodotitis: a systematic review Artigo 2: Periodontal status, socio-demographic and behavioral indicators in subjects attending a public dental school in Brazil: analysis of clinical attachment loss Artigo 3: Risk indicators for increased periodontal probing depth in subjects attending a public dental school in Brazil Artigo 4: Association of red complex, A. Actinomycetemcomitans and extraoral bacteria with periodontal diseases Artigo 5: Subgingival microbiota as a risk indicator for periodontal
24 2 disease DISCUSSÃO CONCLUSÃO REFERÊNCIAS BIBLIOGRÁFICAS ANEXOS
25 3 1 INTRODUÇÃO Epidemiologia é o estudo da distribuição e dos determinantes dos eventos ou padrões de saúde em populações definidas, e a aplicação deste estudo para controlar problemas de saúde (BLOCH e COUTINHO, 2009). Procura também entender como a saúde e a doença podem ser influenciados pela hereditariedade, biologia, ambiente físico, ambiente social e comportamento individual. A epidemiologia analítica quantifica os fatores de risco associados com a doença, o que, por sua vez, pode levar a teorias de causalidade e testar hipóteses para sua prevenção e controle. As características essenciais da epidemiologia como um método de pesquisa, quando comparada à pesquisa clínica e estudo de casos, são: 1) grupos, ao invés do indivíduo, são o foco do estudo; e 2) pessoas com e sem a condição de interesse são incluídas nos estudos cujo objetivo é quantificar risco (AAP, 1996; BLOCH e COUTINHO, 2009). Com o passar dos anos, os estudos epidemiológicos têm contribuído para modificações importantes no modelo das doenças periodontais. Na década de 1960, o modelo prevalente de doença periodontal incluía os conceitos de que todos os indivíduos eram suscetíveis à periodontite grave, que a gengivite progrediria para periodontite com consequente perda óssea e dental, e que a suscetibilidade para a periodontite aumentava com a idade. Estudos envolvendo grandes populações em diferentes países levaram ao entendimento de que a periodontite é o resultado de uma interrelação complexa entre infecção bacteriana e resposta do hospedeiro, frequentemente modificada por fatores comportamentais (LOE et al., 1986; AAP, 1996; PAGE e EKE, 2007).
26 4 A condição clínica periodontal, relacionado ao biofilme dental, engloba, de uma forma geral, três categorias: saúde, gengivite e periodontite (ARMITAGE, 2004). Neste contexto, o diagnóstico de saúde sugere que há ausência de doença periodontal induzida por biofilme dental. Gengivite induzida por biofilme dental é a presença de inflamação gengival sem perda clínica de tecido de inserção periodontal (PI) e sem evidência radiográfica de perda óssea alveolar. Periodontite induzida por biofilme dental é a presença de inflamação gengival em sítios onde tenha ocorrido migração apical do epitélio juncional sobre a superfície radicular, acompanhada por PI e osso alveolar. Na maioria dos pacientes, profundidade de sondagem (PS) aumentada ou formação de bolsas periodontais acompanha o desenvolvimento da periodontite (ARMITAGE, 1999; ARMITAGE, 2004). As doenças periodontais destrutivas são atualmente classificadas em periodontite crônica (PC; localizada ou generalizada; leve, moderada ou avançada), periodontite agressiva (PA; localizada ou generalizada), periodontite ulcerativa-necrosante e lesões endodônticas-periodontais combinadas (ARMITAGE, 1999; SLOTS e TING, 1999). A periodontite crônica é a forma de doença periodontal destrutiva mais comum em adultos, embora possa acometer indivíduos jovens. A patologia em geral progride lentamente e apresenta relação com a presença de irritantes locais, os quais se mostram geralmente compatíveis com a gravidade da doença. A periodontite agressiva é uma forma grave da doença caracterizada por rápida perda óssea alveolar rápida e grave, podendo os indivíduos afetados apresentar pouca quantidade de biofilme e cálculo dentais aderidos às superfícies dentárias. Na periodontite agressiva localizada, os indivíduos apresentam os primeiros molares ou incisivos com PI interproximal, que pode também envolver dois dentes permanentes, além desses. Por outro
27 5 lado, a forma generalizada caracteriza-se por apresentar PI interproximal generalizada, afetando pelo menos três dentes permanentes além dos primeiros molares e incisivos. Assim como na periodontite crônica, o estabelecimento da periodontite agressiva independe da idade (TONETTI e MOMBELLI, 1999). Em função desta concepção atual de que as doenças periodontais destrutivas independem da idade do indivíduo, são poucos os estudos na literatura sobre epidemiologia da periodontite crônica em jovens, e poucos ou nenhum estudo de periodontite agressiva em indivíduos acima dos 40 anos de idade (PAPAPANOU e LINDHE, 2005). A epidemiologia das doenças periodontais tem sido estudada de uma forma mais ampla em países industrializados por uma série de razões que incluem maior disponibilidade de recursos financeiros, assim como sistemas de saúde melhor estruturados (ALBANDAR, 2002). Baseando-se nesses estudos, tem-se conhecimento de que uma pequena proporção das pessoas exibe um grau avançado de periodontite. Gengivite leve é bastante comum e a maioria dos adultos demonstra alguma perda de suporte ósseo e de inserção. Há um consenso de que a doença periodontal avançada ocorre em poucos dentes e em uma porção relativamente pequena de pessoas em qualquer faixa etária, sendo que a proporção de indivíduos afetados aumenta com a idade (SHEIHAM e NETUVELI, 2002). Dados similares também são demonstrados em vários outros trabalhos realizados em países europeus, com pequenas variações entre si. De um modo geral, a prevalência de bolsas periodontais com profundidades de sondagem 5 mm é de aproximadamente 5%. Esta prevalência é maior nos
28 6 indivíduos mais velhos, mas não ultrapassa os 20% (SODER et al., 1994; DIAMANTI-KIPIOTI et al., 1995; AHLBERG et al., 1996). Pelos dados da National Health and Nutrition Examination Survey III (NHANES III), a população dos Estados Unidos com 30 anos ou mais apresenta uma prevalência de 3,1% de periodontite avançada, 9,5% de moderada, 21,8% de leve, e 65,5% não apresentam doença. Nesta população, cerca de 50 a 60% dos indivíduos adultos apresentam um ou mais dentes com pelo menos 3 mm de PI e PS, enquanto 23 a 33% apresentam dentes com 4 mm de PI e PS (ALBANDAR, 2002). No Canadá, foi encontrada uma alta prevalência de indivíduos com sangramento gengival (81,1%), com PS 4 mm (74%) e com PS 6 mm (21,4%) (BRODEUR et al., 2001). Em contraste com Estados Unidos e Canadá, há falta de informações sobre o estado periodontal da população do México. Em uma revisão sistemática sobre a epidemiologia das doenças periodontais nas Américas Central e do Sul, Gjermo et al. (GJERMO et al., 2002) não haviam encontrado nenhum estudo epidemiológico representativo da situação da condição periodontal dos países destes continentes. O que se observa na literatura são estudos envolvendo parcelas dessas populações. Em 1988, Flores-de-Jacoby et al. (FLORES-DE-JACOBY et al., 1991) conduziram na cidade do Rio de Janeiro um levantamento da saúde periodontal da população usando o Índice das Necessidades de Tratamento Periodontal Comunitário (CPITN). Os autores observaram que a saúde periodontal diminuía com a idade, sendo que aos 65 anos, o número de sextantes saudáveis por pessoa era menor que 0,4. O número médio de sextantes com bolsas periodontais 6 mm, bem como o número de sextantes apresentando um
29 7 ou nenhum dente aumentava com a idade. Do total da população, apenas 2,5% apresentavam saúde periodontal à sondagem, 8,1% apresentavam sangramento periodontal, 23,2% tinham cálculo dental, 51,4% tinham bolsas periodontais de 4 a 5 mm e 14,7% apresentavam bolsas periodontais 6 mm. Em relação à necessidade de tratamento periodontal da população examinada, observou-se que mais de 80% dos indivíduos necessitavam de tratamento periodontal profissional, ou seja, não apenas instrução e orientação de higiene bucal. Em no Brasil foi realizado um levantamento sobre as condições de saúde bucal da população brasileira (SB 2000, 2004), utilizando as cinco regiões (Centro-Oeste, Nordenste, Norte, Sudeste e Sul) como subdivisão da apresentação dos resultados. O método de exame utilizado pelos examinadores foi o Índice Periodontal Comunitário (CPI), recomendado pela Organização Mundial de Saúde para propósitos de triagem (WHO, 1977). O CPI utiliza dentes índices (um dente por sextante) e 6 escores (de 0 a 5), sendo: 0 sextante sadio, 1 com sangramento, 2 com cálculo, 3 com bolsa periodontal de 4 5 mm, 4 com bolsa periodontal 6 mm, e 5 sextante excluído. Com relação ao escore de maior gravidade da doença, ou seja, escore 4, o porcentual encontrado para a população brasileira foi de 0,15%, 2,12% e 1,85% nas faixas etárias de anos, anos e anos, respectivamente. Na região sudeste, os valores para as mesmas faixas etárias foram de 0,17%, 2,39% e 0,76%, respectivamente. Recentemente, um estudo derivado deste levantamento nacional (PERES et al., 2007) verificou que a prevalência de doença periodontal é mais alta nas raças não-brancas (pardos e pretos) na faixa etária de anos de idade, sendo de 7,2% em brancos, 10,1% em pardos e 11,8% em pretos.
30 8 Houve associação entre a cor da pele e a condição periodontal, mesmo após ajuste para as covariáveis nível socioeconônico e região demográfica. No entanto, o índice empregado neste levantamento epidemiológico tende a subestimar a real situação da condição periodontal, uma vez que é um índice de exame parcial e não mensura o nível clínico de inserção (NCI), o qual informaria o histórico da condição periodontal do indivíduo até o momento (HANSEN et al., 1990; GJERMO, 1991; BAELUM e PAPAPANOU, 1996; SUSIN et al., 2005b; BASSANI et al., 2006). Além disto, já foi demonstrado que os dados informados pelo CPITN, por exemplo, são incapazes de identificar o aumento idade-dependente na prevalência e na gravidade da doença periodontal em uma população (BAELUM et al., 1995). Em um estudo representativo de uma parcela da população do Rio Grande do Sul, Susin e colaboradores (SUSIN et al., 2004a) demonstraram que 97%, 79% e 52% dos indivíduos examinados apresentam pelo menos um sítio com PI 3 mm, 5 mm e 7 mm, respectivamente. Quando a população foi categorizada por gênero, os homens apresentaram significativamente maior prevalência de PI 5 mm do que mulheres. A idade foi um preditor significante para a gravidade da PI; enquanto o tabagismo foi um fator de risco importante para PI moderada e avançada. Em outro estudo, esses autores calcularam a proporção de PI que poderia ser atribuída ao fumo (SUSIN et al., 2004b). Os autores constataram que 6,1% dos indivíduos apresentavam PI 5 mm em 30% dos dentes que poderia ser atribuída ao fumo, sendo que fumantes considerados pesados tinham um risco aumentado em cinco vezes de apresentar PI 5 mm. Além disto, uma alta prevalência de indivíduos com PS 5 mm (65%) e 7 mm (25%) nesta população
31 9 foi observada. A extensão de PS 5 mm e 7 mm, ou seja, porcentual médio de dentes afetados por indivíduo, foi de 19% e 5%, respectivamente. Fatores individuais, como idade elevada, gênero (homens), raça (não-branca), nível socioeconômico (baixo), tabagismo (fumantes moderados e pesados ) e visitas irregulares ao dentista, tiveram relação positiva com o aumento da prevalência e da gravidade da PS (SUSIN et al., 2005b). Em outra avaliação dessa população, indivíduos entre 14 e 29 anos de idade apresentaram uma prevalência de 5,5% de periodontite agressiva (SUSIN e ALBANDAR, 2005). Os indivíduos com periodontite agressiva tinham, em média, mais de 40% dos dentes com PI 4 mm. O risco para periodontite agressiva foi significativamente maior para as idades de 25 a 29 anos do que para 14 a 19 anos; nível socioeconômico baixo em relação a médio ou alto; fumantes moderados ou pesados do que para nãofumantes; e em indivíduos com 10% versus < 10% dos sítios com cálculo supragengival. Vale ressaltar que neste estudo foi realizado exame periodontal completo, ou seja, todos os seis sítios dos dentes tiveram suas medidas periodontais mensuradas. De uma maneira geral, os estudos relacionados acima indicam que no Brasil há uma maior prevalência e gravidade de doença periodontal quando comparado com dados periodontais da população dos Estados Unidos, por exemplo (ALBANDAR, 2002). Como mencionado anteriormente, estas diferenças existentes entre populações distintas poderiam ser explicadas pela diversidade de fatores que influenciam a doença periodontal, como aspectos ambientais, genéticos e comportamentais (PAGE e KORNMAN, 1997; PAGE e EKE, 2007). Para tanto, além dos estudos epidemiológicos sobre o estado periodontal das
32 10 várias populações mundiais, pesquisadores têm utilizado a epidemiologia clínica na busca pelos agentes etiológicos microbianos relacionados à doença periodontal. O fator etiológico primário da periodontite é a presença do biofilme subgengival periodontopatogênico (SOCRANSKY e HAFFAJEE, 1992; SOCRANSKY e HAFFAJEE, 1994). Logo, o conhecimento da microbiota periodontal é fundamental para o diagnóstico dessas doenças. Assim, ao longo do tempo, inúmeras espécies de microrganismos orais associadas à saúde periodontal, bem como a diferentes tipos de doenças periodontais foram identificadas (NEWMAN e SOCRANSKY, 1977; LISTGARTEN e HELLDEN, 1978; TANNER et al., 1979; TANNER et al., 1984; MOORE et al., 1985; DZINK et al., 1988; HAFFAJEE et al., 1988a; HAFFAJEE et al., 1988b; SOCRANSKY et al., 1988; CHRISTERSSON et al., 1992; HAFFAJEE e SOCRANSKY, 1994; SLOTS e TING, 1999; SOCRANSKY e HAFFAJEE, 2005). Em 1998, Socransky et al. demonstraram a existência de complexos microbianos que predominavam no biofilme subgengival de pacientes com e sem doença periodontal (SOCRANSKY et al., 1998). O chamado complexo vermelho consiste em três espécies [Tannerella forsythia (previamente denominada Bacteroides forsythus), Porphyromonas gingivalis e Treponema denticola] fortemente relacionadas com bolsas periodontais profundas e sangramento à sondagem. Um outro grupo, o complexo laranja, inclui as espécies Fusobacterium nucleatum, Prevotella intermedia, Prevotella nigrescens, Parvimonas micra (previamente denominada Peptostreptococcus micros), três espécies de Campylobacter, Eubacterium nodatum e Streptococcus constellatus. Os autores demonstraram que o estabelecimento do complexo laranja era
33 11 necessário para a colonização por espécies do complexo vermelho. Um terceiro grupo chamado complexo amarelo consiste em cinco espécies de Streptococcus, enquanto o quarto, complexo verde, é composto por três espécies de Capnocytophaga, Campylobacter concisus, Eikenella corrodens e Aggregatibacter actinomycetemcomitans (Aa, previamente denominada Actinobacillus actinomycetemcomitans) sorotipo a. O quinto grupo, o complexo roxo, é formado por Veillonella parvula e Actinomyces odontolyticus. Mais recentemente um sexto grupo, formado por espécies de Actinomyces ou complexo azul foi determinado (SOCRANSKY et al., 2002). Enquanto espécies dentro dos complexos estão fortemente associadas, os complexos têm também relações específicas entre si. Por exemplo, os complexos vermelho e laranja mostram uma significante associação entre si, enquanto os complexos azul, roxo, amarelo e verde parecem estar mais associados entre si que o complexo laranja e o vermelho. Isto indica, não somente relações específicas entre as espécies subgengivais, mas sugere também um possível modelo ou seqüência de colonização. Apesar disso, até o momento, somente dois microrganismos são considerados patógenos periodontais clássicos: o Aa e P. gingivalis (KINANE et al., 1999; SOCRANSKY et al., 1999; SLOTS e TING, 1999; HOLT e EBERSOLE, 2005). Como existem características clínicas periodontais dependentes da população estudada, pode-se inferir que fatores associados à etiopatogenia das doenças periodontais, como a microbiota subgengival, possam também ser bastante distintos. A fim de investigar estas possíveis diferenças, Haffajee et al. (HAFFAJEE et al., 2004) analisaram a composição da microbiota subgengival de
34 12 indivíduos com periodontite crônica dos Estados Unidos, da Suécia, do Chile e do Brasil. Os autores observaram que, quando a microbiota de indivíduos dos Estados Unidos e da Suécia foi comparada, suecos apresentaram maiores proporções de Streptococcus gordonii, Streptococcus sanguinis (previamente denominada Streptococcus sanguis), Campylobacter gracilis, Campylobacter rectus, P. micra, Eubacterium saburreum, Propionibacterium acnes e Streptococcus anginosus. A espécie P. gingivalis foi detectada em proporção significantemente maior em amostras dos Estados Unidos. Na comparação entre Chile, Suécia e Estados Unidos, encontrou-se uma proporção significativamente menor de Actinomyces naeslundii genoespécie 2 (Actinomyces viscosus), e C. gracilis na população chilena, enquanto S. gordonii, Aa, E. nodatum, Fusobacterium periodonticum, P. gingivalis, T. denticola e Treponema socranskii tiveram as mais altas proporções. Na análise envolvendo os quatro países, os brasileiros exibiram as maiores proporções médias de A. naeslundii genoespécie 1, S. gordonii, S. sanguinis, Streptococcus intermedius, S. constellatus, E. nodatum e T. denticola. Os chilenos exibiram as mais altas proporções médias de P. gingivalis e F. periodonticum, enquanto os suecos as mais altas proporções médias de C. gingivalis, C. gracilis, P. micra e Leptotrichia buccalis. Os autores atribuíram essas diferenças parcialmente aos sítios periodontais com diferentes profundidades de sondagem periodontal selecionados para a coleta, terapia periodontal prévia, uso de antibióticos, background genético, dieta, cultura, práticas de higiene e de cuidados com a saúde, status socioeconômico e acesso a tratamento odontológico. Em estudo de 2002, Colombo et al. (COLOMBO et al., 2002) já haviam demonstrado que a microbiota subgengival de indivíduos brasileiros com
35 13 periodontite é bastante complexa e variada. A avaliação envolveu pacientes com periodontite crônica que nunca tinham recebido tratamento e um grupo controle com saúde periodontal. Os microrganismos encontrados em mais de 50% dos sítios de todos os indivíduos foram os seguintes: V. parvula, S. sanguinis, Streptococcus oralis, Neisseria mucosa, A. viscosus, e Haemophilus aphrophilus. As espécies menos frequentes foram Ralstonia sp., Pseudomonas aeruginosa, Acinetobacter baumannii, Gemella haemolysans, T. denticola, e T. socranskii. O Aa apresentou uma alta prevalência nos dois grupos, estando presente em 41% dos sítios de indivíduos doentes e em 25% dos sítios dos indivíduos saudáveis. Periodonto-patógenos tais como Aa, T. forsythia, C. rectus, P. intermedia, P. nigrescens e T. denticola, e espécies não-orais, incluindo Enterococcus faecalis, Eischerichia coli e Bartonella sp. foram detectados em altos níveis e freqüência no grupo com periodontite, após ajustes para comparações múltiplas e as covariáveis idade e gênero. Esses dados reforçam o papel de patógenos periodontais prováveis na etiologia das doenças periodontais, bem como o papel da cavidade oral como um possível reservatório de espécies não-orais oportunistas. Outro achado relevante a ser destacado nese estudo foi a alta prevalência de Aa, geralmente associado à doença agressiva, nos dois grupos de indivíduos estudados, como mencionado acima. Ximenez-Fyvie et al. também encontraram altas prevalências de Aa na população mexicana, a qual 73,7% dos indivíduos com saúde periodontal e 89,7% dos indíduos com PC tinham pelo menos um sítio apresentando esta espécie (XIMENEZ-FYVIE et al., 2006b). Enquanto a prevalência média relatada em outros estudos é de aproximadamente 18% em indivíduos com PC (BOTERO et al., 2007; HERRERA et al., 2008) e de 7% em indivíduos com saúde periodontal (BOTERO et al., 2007).
36 14 A espécie Aa, em particular, é considerada o principal patógeno comumente associado à PA, principalmente à forma localizada da doença (ALBANDAR et al., 1997; TAN et al., 2001; YANG et al., 2005; XAJIGEORGIOU et al., 2006). Alguns autores até sugerem que a sua detecção em indivíduos com saúde periodontal pode ser utilizada como marcador de risco para o desenvolvimento de PA localizada (FINE et al., 2007). No entanto, em estudos realizados na América Latina, patógenos periodontais como P. gingivalis, P. intermedia, C. rectus e P. nigrescens foram mais associados com a PA do que o Aa (LOPEZ et al., 1996; GAJARDO et al., 2005; XIMENEZ-FYVIE et al., 2006b; BOTERO et al., 2007; MAYORGA-FAYAD et al., 2007). Estudos nas populações japonesa e grega também verificaram esta maior associação de P. gingivalis e outros patógenos comumente encontrados na PC com a PA (TAKEUCHI et al., 2003, KAMMA et al., 2004). O reconhecimento da placa como um biofilme leva a uma compreensão mais ampla sobre as comunidades e interações que existem entre espécies bacterianas e o ambiente (hospedeiro/ resposta imunológica) (SOCRANSKY e HAFFAJEE 2005). Assim, estudos vêm sendo realizados para procurar entender como funcionam estas relações bacterianas no biofilme subgengival, bem como investigar outras espécies, que não os patógenos periodontais consensuais, que possam estar associadas com a doença periodontal (HAFFAJEE et al., 2006; PERSSON et al., 2006; FRITSCHI et al., 2008). Espécies bacterianas como E. nodatum (HAFFAJEE et al., 2006), P. aeruginosa (PERSSON et al., 2006) e Staphylococcus aureus (FRITSCHI et al., 2008) têm sido relacionadas como preditores para periodontite.
37 15 Como demonstrado, a literatura aponta para a existência de diferenças epidemiológicas e microbiológicas relacionadas à doença periodontal entre populações, as quais poderiam ser atribuídas a diferenças econômicas, étnicas, comportamentais, entre outros fatores. Alguns autores, inclusive, propõem que a periodontite deveria ser considerada uma síndrome (BAELUM e LOPEZ, 2003). Apesar deste entendimento amplo da periodontite, as classificações propostas para esta doença têm-se baseado apenas no resultado do exame clínico (BAELUM e LOPEZ, 2003). Em virtude disto, observa-se que as pesquisas periodontais, principalmente os levantamentos epidemiológicos, procuram não atribuir uma classificação ao paciente e, sim, definir a prevalência e a extensão da PS e da PI como nos estudos anteriormente descritos acima (SODER et al., 1994; DIAMANTI-KIPIOTI et al., 1995; AHLBERG et al., 1996; BRODEUR et al., 2001; ALBANDAR, 2002; SUSIN et al., 2004a). Ao não classificarem as populações estudadas, os pesquisadores permitem que seus resultados tornem-se atemporais, pois são independentes dos sistemas de classificação das doenças periodontais, que são passíveis de modificações, pelo menos até que se chegue a um sistema definitivo. Além disto, diferenças existentes entre populações indicam a necessidade de abordagens terapêuticas distintas (COLOMBO et al., 2002). Os estudos periodontais de populações brasileiras desenvolvidos nos últimos anos vêm contribuindo para elucidar o quadro de saúde e doença periodontais. No entanto, os dados existentes ainda são insuficientes para se estabelecer um perfil tanto clínico quanto microbiológico, bem como identificar fatores de risco e determinantes do estabelecimento e progressão da doença nessa população. A necessidade de se conhecer as características epidemiológicas da população
38 16 torna-se essencial à medida que, a partir de um conhecimento abrangente da população-alvo, pode-se otimizar os recursos físicos, financeiros e humanos disponíveis. O Brasil, sendo um país de dimensões continentais, possui variações regionais muito marcantes entre seus habitantes. E mesmo dentro de suas metrópoles, também é encontrada uma grande diversidade social, cultural e econômica. É o que acontece, por exemplo, na cidade do Rio de Janeiro, cuja população é formada em parte por indivíduos provenientes de outros estados brasileiros. Dessa forma, observam-se grandes diferenças entre estes indivíduos no que tange a hábitos, background cultural, educação, acesso a serviços de saúde, nível socioeconômico e, sobretudo, variações individuais de resposta imunológica e de composição da microbiota oral, que, conseqüentemente, levam a distintos estados de saúde e doença periodontal. Dessa forma, o conhecimento da condição periodontal dessa população não é fundamental apenas para ações de saúde pública (SUSIN et al., 2004a), mas também o é para a atividade clínica, posto que a prática da clínica odontológica é dependente de dados populacionais para o estabelecimento de estratégias preventivas e terapêuticas. Além disso, utilizando-se estratégias bem definidas, potencializam-se as ações de saúde, trazendo benefícios sociais e econômicos a longo prazo (LUIZ e SZKLO, 2005).
39 17 2 PROPOSIÇÃO O presente estudo objetivou avaliar as características epidemiológicas, clínicas periodontais e a microbiota subgengival de indivíduos com saúde e doença periodontal, bem como identificar indicadores de risco que possam colaborar no diagnóstico de indivíduos portadores de doença periodontal. Destacam-se os seguintes objetivos específicos: Determinar a prevalênica, a extensão e a gravidade da PI, da PS e do SS; Caracterizar os indivíduos avaliados segundo os quadros de saúde e doença (gengivite, periodontite crônica ou agressiva) do periodonto, baseando-se nos parâmetros clínicos periodontais; Caracterizar a microbiota subgengival nos diferentes quadros de saúde e doenças periodontais; Correlacionar os parâmetros clínicos periodontais, a microbiota subgengival e as variáveis sexo, raça, idade, tabagismo e nível socioeconômico nos diferentes diagnósticos periodontais.
40 18 3 DELINEAMENTO DA PESQUISA 3.1 População de estudo A população deste estudo observacional foi composta a partir de uma amostra de conveniência, formada por indivíduos que procuraram atendimento no Departamento de Clínica Odontológica da Faculdade de Odontologia da Universidade Federal do Rio de Janeiro (UFRJ). Esses indivíduos participaram do presente estudo e de outros estudos clínicos do Departamento e foram chamados para participar desses estudos a partir da lista de espera para atendimento da Clínica Odontológica no período entre 2005 e Neste sentido, o tamanho da amostra foi obtido de maneira operacional e incluiu 559 indivíduos. Os indivíduos que participaram do estudo assinaram um consentimento livre e esclarecido explicando a natureza do estudo. Como este estudo faz parte de um projeto de pesquisa em andamento há longo tempo no Laboratório de Microbiologia Oral do Instituto de Microbiologia Paulo de Góes da UFRJ, o presente estudo está inserido nesse projeto inicial aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Clementino Fraga Filho da UFRJ sob o número 7984 (Anexo I). Para participar do estudo, os pacientes tinham que ter pelo menos 15 dentes e não poderiam: a) apresentar doenças conhecidas do sistema imunológico (ex.: HIV-positivo) ou diabetes; b) necessitar de quimioprofilaxia; c) ter feito uso de antimicrobianos nos últimos seis meses; d) ter recebido tratamento periodontal no último ano; e, e) no caso de mulheres, não estar grávida ou amamentando.
41 Dados individuais Na primeira visita, os indivíduos responderam a questionários de anamnese e dados sobre idade, gênero, raça, tabagismo, nível educacional e renda familiar foram obtidos. Para alguns indivíduos, não foi possível obter informações sócio-demográficas, ou porque não sabiam informar ou por se recusarem a fornecê-las. Assim, dados sobre cor/ raça, renda e escolaridade foram obtidos para 223, 164 e 167 indivíduos, respectivamente. A raça ou cor foi autodefinida pelos indivíduos em Branca, Preta, Parda, Amarela ou Indígena (IBGE, 2007; PERES et al., 2007). O tabagismo foi registrado como fumante, nãofumante e ex-fumante. O nível educacional foi registrado perguntando-se ao indivíduo se sabia ler e escrever e qual tinha sido o curso mais elevado que cursou, no qual tinha concluído pelo menos uma série. A renda familiar foi categorizada em cinco faixas, tendo-se como base o salário mínimo brasileiro (menor que R$ 465,00, entre R$466,00 e $600,00, entre R$601,00 e $1000,00, entre R$1001,00 e $1500,00 e mais de R$1500,00). 3.3 Avaliação clínica Os exames clínicos foram realizados por quatro examinadores calibrados, e incluíram registros dicotomizados da presença de biofilme dental supragengival (BD) e SS e/ou supuração à sondagem (SU), bem como a mensuração da PS e do NCI em mm. Primeiramente, foi feito o registro de presença de BD, através da visualização das superfícies dentárias após secagem com jato de ar em campo sob isolamento relativo. A seguir, foi realizada a sondagem periodontal em seis
42 20 sítios por elemento dentário com sonda periodontal milimetrada da Carolina do Norte (Hu-Friedy; Chicago, IL, EUA), sendo os sítios: ângulo disto-vestibular, face vestibular, ângulo mésio-vestibular, ângulo mésio-palatino ou mésio-lingual, face palatina ou lingual e ângulo disto-palatino ou disto-lingual. Durante a sondagem periodontal, a PS e o NCI foram registrados simultaneamente. Os terceiros molares foram excluídos da avaliação clínica. A calibragem dos examinadores (intra-examinador) para as variáveis NCI e PS foi realizada através da repetição dos exames em uma sub-amostra da população estudada com um intervalo de uma semana. O coeficiente de correlação intra-classe para NCI no sítio variou entre 0,90 e 0,97; e para PS, variou entre 0,80 e 0,94. A fim de avaliar a capacidade diagnóstica da sondagem manual, uma revisão sistemática sobre o tema foi realizada durante o desenvolvimento desse projeto (Artigo 1). Os indivíduos foram categorizados, segundo o exame clínico, em portadores de saúde periodontal, gengivite, periodontite crônica ou periodontite agressiva generalizada. Assim, o indivíduo com saúde periodontal deveria ter menos de 10% dos sítios com SS e PS e/ou NCI 3 mm, podendo apresentar PS ou NCI = 4 mm em até 5% dos sítios, sem SS concomitantemente. O indivíduo portador de gengivite deveria ter mais de 10% dos sítios com SS e ter PS e/ou NCI 3 mm, podendo ter PS ou NCI = 4 mm em até 5% dos sítios ou 10% dos dentes, sem SS concomitantemente. O indivíduo portador de periodontite crônica deveria ter no mínimo 10% dos dentes com NCI e/ou PS 5 mm, ou 15% dos dentes com NCI e/ou PS 4mm, e SS concomitantemente. Na periodontite
43 21 agressiva generalizada, o indivíduo deveria apresentar > 30% dos dentes com PS e/ou NCI 5 mm e SS, sendo que pelo menos um incisivo e um primeiro molar deveriam estar afetados pela doença. Somente foram considerados como portadores de periodontite agressiva indivíduos com menos de 40 anos de idade. Indivíduos com periodontite agressiva localizada não foram incluídos no estudo. Todos os indivíduos diagnosticados como doentes foram encaminhados para tratamento no Departamento de Clínica Odontológica da Faculdade de Odontologia da UFRJ. 3.4 Monitoramento microbiológico Coleta de material para análise laboratorial microbiológica A coleta de biofilme subgengival foi realizada em quatorze sítios dos pacientes com periodontite, sendo sete amostras de sítios com maiores PS e com sinais clínicos inflamatórios, e as outras sete amostras de sítios com periodonto saudável (sem PI e SS), quando possível, ou de sítios com as menores PS. Em indivíduos com saúde periodontal, foram coletadas 7 amostras de sítios sem PI > 3 mm e sem SS, enquanto que na gengivite as 7 amostras foram obtidas de sítios sem PI, mas com SS. Após a remoção de BD com gaze estéril, o biofilme subgengival foi coletado com curetas Gracey estéreis de cada sítio e colocado em tubos do tipo Eppendorf individuais contendo 150 μl de tampão tris-edta (TE; 10 mm de Tris HCl, 1 mm de EDTA, ph 7,6) Determinação da microbiota subgengival utilizando a técnica de Checkerboard DNA-DNA hybridization a) Preparo das membranas
44 22 O método para identificação dos microrganismos no biofilme subgengival foi realizado através da técnica descrita por Socransky et al. com modificações (SOCRANSKY et al., 1994). A cada tubo de Eppendorf contendo biofilme subgengival foram adicionados 0,15 ml de 0,5 M NaOH. As suspensões foram fervidas em banho-maria por 5 min, e em seguida neutralizadas pela adição de 0,8 ml de 5 M de acetato de amônia. Com isso, as células bacterianas foram lisadas e o DNA liberado na solução. Cada suspensão contendo DNA livre foi depositada nas fendas do Minislot 30 (Immunetics, Cambridge, MA, EUA) e o DNA concentrado numa membrana de nylon (15 X 15 cm) carregada positivamente (GE Healthcare Life Sciences, São Paulo, SP, Brasil) (Figura 1). A membrana foi removida do aparato e o DNA depositado na membrana fixado através da exposição à temperatura de 120 C por 20 min em forno (Fanem Ltda., São Paulo, SP, Brasil). As duas últimas canaletas do Minislot foram reservadas para a colocação dos controles, contendo uma mistura das espécies de microrganismos investigados pelas sondas de DNA, em duas concentrações, 10 5 e 10 6 células bacterianas. b) Hibridização das membranas com as sondas de DNA Após fixação do DNA nas membranas, essas foram pré-hibridizadas a 42 C por 1 h numa solução contendo 50% de formamida, 1% de caseína, 5 x SSC, 25 mm de fosfato de sódio (ph 6,5) e 0,5 mg/ml de RNA de levedura. Em seguida, cada membrana foi colocada sob a placa acrílica do Miniblotter 45 (Immunetics) com as linhas contendo o DNA fixado perpendiculares às canaletas do Miniblotter 45 (Figura 2). O Miniblotter 45 contém 45 canaletas que servem cada uma para a colocação de uma sonda de DNA. Em cada canaleta foram
45 23 colocadas 135 L de cada sonda específica diluída em solução de hibridização contendo 45% de formamida, 5 X SSC, 20 mm de fosfato de sódio (ph 6,5), 0,2 mg/ ml de RNA de levedura, 10% de sulfato de dextrano, 1% caseína e 20 ng/ ml de sonda da DNA específica. As sondas foram hibridizadas a 90 às linhas das amostras de biofilme no aparato Miniblotter 45. O aparato era então incubado a 42 C por no mínimo 16 h para hibridização. As sondas genômicas para as espécies bacterianas foram confeccionadas usando o Random Primer Digoxigenin Labeling Kit (Roche Applied Science, São Paulo, SP,Brasil) (Tabela 1 do Artigo 5). c) Detecção das espécies Após hibridização com as sondas, as membranas foram removidas do Miniblotter 45 e lavadas por 5 min em temperatura ambiente, seguidos de duas lavagens de 20 min a 65 C em solução adstringente (0,1 X SSC, 0,1% SDS), a fim de remover sondas que não hibridizaram completamente. Em seguida, as membranas foram imersas em solução bloqueadora (0,1 M de ácido maleico, 3 M de NaCl, 0,2 M de NaOH, 0,3% de Tween 20 e 0,5% de caseína, ph 8,0) por 1 h, e incubadas por 30 min na mesma solução bloqueadora contendo o anticorpo anti-digoxigenina conjugado à fosfatase alcalina (Roche Applied Science, São Paulo, SP,Brasil) numa diluição de 1/ As membranas foram, então, lavadas em solução tampão (0,1 M de ácido maleico, 3 M de NaCl, 0,2 M de NaOH, 0,3% de Tween 20, ph 8,0) duas vezes por 15 min, e uma vez por 5 min em uma solução contendo 0,2 M de Dietanolamina (ph 9,5) e 2 mm de MgCl 2. Em seguida, uma solução detectora de fluorescência (ECF, GE Healthcare Life Sciences) foi adicionada às membranas. Finalmente, as membranas foram
46 24 escaneadas e as imagens captadas pelo Sistema de Imagens Storm TM 860 (Molecular Dynamics, GE Healthcare Life Sciences), utilizando-se o software ImageQuant versão 5.2 (GE Healthcare Life Sciences) (Figura 3). Os sinais emitidos foram avaliados visualmente por comparação com os controles de 10 5 e 10 6 células bacterianas para as espécies testes na mesma membrana. Os sinais foram registrados como: 0: não detectado; 1: <10 5 células; 2: ~10 5 células; 3: células; 4: ~10 6 células; 5: >10 6 células.
47 25 Figura 1. Foto do aparato Minislot 30 (Immunetics) e esquema da preparação das amostras de biofilme dental.
48 26 Figura 2. Foto do aparato Miniblotter 45 (Immunetics) e esquema da hibridização das amostras com as sondas de DNA.
49 27 sonda amostra controle 10 5 controle 10 6 Figura 3. Imagem digitalizada de uma membrana após processamento pelo método do Checkerboard.
50 Análise estatística Todos os testes estatísticos empregados no presente estudo foram realizados utilizando-se o programa estatístico SPSS ( Statistical Package for the Social Sciences ), versão A frequência de sítios com SS, BD e SUP, assim como a média da PS e NCI foram calculadas para cada paciente, e, posteriormente, para cada um dos grupos estudados. A prevalência e a extensão do NCI e da PS foram descritas em categorias de níveis: rasos (0 4 mm), médios (5 6 mm) e profundos/avançado ( 7 mm). A extensão foi calculada como a porcentagem de sítios afetados nos diferentes níveis em cada indivíduo, posteriormente, a média dessas frequências foi calculada nos grupos. Foram também obtidas em cada grupo a média de idade e a proporção de raças, gênero, indivíduos fumantes, níveis educacionais e de renda. A frequência de indivíduos apresentando pelo menos um sítio ou mais sítios com NCI e PS 5 mm ou 7 mm também foi determinada. Diferenças significativas nos parâmetros clínicos entre os grupos com saúde e doenças periodontais foram avaliadas pelos testes de Kruskal-Wallis, e do Qui-quadrado ( 2 ) no caso de dados categóricos. Posteriormente, os dados foram analisados por modelos uni e multivariados de análise de regressão logística. Estas análises usaram como variáveis dependentes NCI e PS 5 mm presentes em mais de 10% dos sítios, e NCI e PS 7 mm em pelo menos um sítio, representando, assim, destruição periodontal moderada e avançada, respectivamente. Variáveis preditoras como SS e BD foram categorizadas em: 0 a 10%, > 10% a 30% e > 30% dos sítios acometidos. O número de dentes ausentes foi dicotomizado em 3 e 4 dentes ausentes. Apenas variáveis mostrando nível de significância de p
51 29 0,25 no modelo univariado, e com dados completos para o total dos indivíduos estudados foram incluídas no modelo multivariado a fim de se obter a Razão de Chances (OR) e o Intervalo de Confiança (IC) de 95%. A contribuição de cada variável foi avaliada pela estatística de Wald. Interações entre essas variáveis também foram analisadas nos modelos. O nível de significância considerado foi de 5%. Os dados microbiológicos foram expressos através da média da percentagem de sítios colonizados (prevalência), média do nível de colonização (número de células bacterianas) e percentagem do DNA total de cada espécie na amostra. Os dados foram obtidos para cada amostra e a média, então, calculada para cada indivíduo. Na análise de prevalência, foi considerada somente ausência ou presença do microrganismo. Os níveis de colonização das diferentes espécies foram determinados através da transformação dos escores de 0 a 5 em número de células bacterianas. A proporção de DNA de cada espécie foi calculado em relação ao DNA total detectado em cada amostra e, então, uma média foi obtida por indivíduo. As diferenças entre as médias da prevalência, dos níveis de colonização e da proporção de DNA foram avaliadas entre os grupos através dos testes Kruskal-Wallis e Mann-Whitney. Para estas análises, os valores de p foram ajustados para comparações múltiplas. Resumidamente, um valor de p total de 0,05 = 1 - (1-k) r foi computado, onde r é o número de re-testes (número de espécies testadas simultaneamente) a serem realizados e k é o valor individual de p desejado (SOCRANSKY et al., 1991). Associações entre espécies bacterianas e os parâmetros clínicos periodontais também foram testadas utilizando-se a análise de regressão linear
52 30 usando o método stepwise, controlando-se para idade e fumo. Fatores de risco bacterianos foram investigados através da análise de regressão logística multivariada (forward Wald), da qual ORs com IC de 95% foram obtidos. O nível de significância utilizado foi de 5%.
53 31 4 ARTIGOS CIENTÍFICOS 4.1 ARTIGO 1: Silva-Boghossian, C. M., Amaral, C. S. F., Maia, L. C., Luiz, R. R., Colombo, A. P. V. Manual and electronic probing of the periodontal attachment level in untreated periodontitis: a systematic review. J Dent, v. 36, p ARTIGO 2: Silva-Boghossian, C. M, Luiz, R. R., Colombo, A. P. V. Periodontal status, sociodemographic and behavioral indicators in subjects attending a Public Dental School in Brazil: analysis of clinical attachment loss. J Periodontol, v. 80, n. 12, p , Dec ARTIGO 3: Silva-Boghossian, C. M, Luiz, R. R., Colombo, A. P. V. Risk indicators for increased periodontal probing depth in subjects attending a Public Dental School in Brazil. Submetido ao periódico Community Dentistry and Oral Epidemiology. 4.4 ARTIGO 4: Silva-Boghossian, C. M, Souto, R. M., Luiz, R. R., Colombo, A. P. V. Association of red complex, A. actinomycetemcomitans and extraoral bacteria with periodontal diseases. Submetido ao periódico Journal of Clinical Periodontology. 4.5 ARTIGO 5: Silva-Boghossian, C. M, Heller, D., Luiz, R. R., Colombo, A. P. V. Subgingival microbiota as a risk indicator for periodontal disease. Será submetido ao periódico Journal of Clinical Periodontology.
54 32
55 33
56 34
57
58 36
59 37
60 38
61 39
62 40
63 41
64 42
65 43
66 44
67 45
68 46
69 47
70 48
71 49 Risk indicators for increased periodontal probing depth in subjects attending a Public Dental School in Brazil Running head: Probing depth in a Dental School in Brazil Carina M. Silva-Boghossian*; Ronir Raggio Luiz ; Ana Paula V. Colombo * Department of Dental Clinic, Division of Graduate Periodontics, Institute of Public Health Studies, Institute of Microbiology, Federal University of Rio de Janeiro, Rio de Janeiro, Brazil. Corresponding author: Carina M. Silva-Boghossian, Rua Barão de Guaratiba, 228, Glória, Rio de Janeiro, RJ, CEP , Phone/ Fax: , carinabogho@hotmail.com.
72 50 Abstract Objectives: The purpose of the present study was to assess the prevalence, extent and severity of periodontal probing depth (PD), and their association with socio-demographic and behavioral parameters in subjects attending a Public Dental School in Brazil. Methods: 559 consenting participants (18-77 years of age) were submitted to full-mouth periodontal clinical examination, assessment of missing teeth, and anamnesis-questionnaires. The data were analyzed by multivariable models using logistic regression analyses. The dependent variables were moderate ( 5 mm) and deep ( 7 mm) PD. Results: The prevalence of individuals with at least one site with PD 5 mm or 7 mm was 69% and 54%, respectively. Mean PD ranged from 2.86 to 3.08 mm, according to age. The mean frequency of sites with moderate (5-6 mm) and deep ( 7 mm) PD ranged from to 14.99%, and from 4.60 to 5.36%, respectively, according to age. Multivariate analyses identified a higher risk for having PD 5 mm in 10% of sites, and 7 mm in at least one site in subjects who were smokers (odds ratio [OR] = and 9.10, respectively), and presented > 10% of sites with bleeding on probing (BOP) (OR = 6.37 to 20.91, and 6.94 to 26.19, respectively). Age between 36 to 50 years (OR = 1.95) and > 50 years (OR = 3.15), presence of > 30% of sites with supragingival biofilm (SB) (OR = 2.80), and 4 missing teeth (OR = 2.26) were risk indicators only for PD 7 mm. Conclusions: This particular Brazilian population presented high prevalence and extent of increased periodontal probing depth. Age, smoking, BOP, SB, and tooth loss were risk indicators associated with probing depth in these individuals. Key Words: probing depth; periodontal disease; risk indicators; epidemiology
73 51 Introduction Periodontal diseases are infections associated with specific microbial complexes of the subgingival biofilm, and are characterized by chronic inflammatory lesions and destruction of the supporting periodontal tissues (1). Despite the advances in the etiopathogenesis of these diseases, periodontal diagnosis still relies primarily on clinical measurements of attachment level (CAL) and/or probing depth (PD) (2). The first parameter provides information about cumulative measure of periodontal disease, and the second about the current inflammatory status and treatment needs (2-4). Regardless of their limitations, periodontal indexes such as the Community Periodontal Index of Treatment Needs (CPITN) have been widely used to measure the periodontal status of various populations around the world (2, 3, 5, 6). In particular, periodontal epidemiological surveys in populations from developing countries are scarce (7). Flores-de-Jacoby and co-workers reported frequencies of 51.4% for PD between 4 and 5 mm, and 14.7% for PD 6 mm in individuals from a population of Rio de Janeiro, Brazil (8). Later on, a nationwide survey also employing a periodontal index reported frequencies of 0.15%, 2.12%, and 1.85% for PD between 4 and 5 mm in subjects within 15 to 19, 35 to 44, and 65 to 74 years of age, respectively (9). More recently, data from two studies using full-mouth periodontal clinical examination demonstrated a much higher prevalence of increased PD in subpopulations of the Southern region of Brazil. The prevalence of subjects with PD 4 mm, 5mm, 6 mm and 7 mm were approximately 68%, 65%, 22%, and 25%, respectively. In addition, increased PD was associated with age, gender, race, presence of supragingival calculus and smoking habit (3, 10). Most of the epidemiological studies in Brazil have been performed on representative samples of defined subpopulations or convenience samples (7). However, there is still limited information about the periodontal conditions of subpopulations
74 52 attending public dental services (8, 11). Few studies have shown that subjects seeking public oral health care are usually from low socioeconomic strata, and therefore, receive insufficient education in oral health, lack the economic resources to visit a professional, and frequently cannot acquire basic oral hygiene products (7, 11). Thus, identification of risk factors and assessment of periodontal status in these populations are important to provide data for designing strategies of prevention and treatment for public dental care (4, 12). The purpose of the present study was to determine the prevalence, extent and severity of PD, and their associations with socio-demographic and behavioral parameters in subjects attending a Public Dental School in Brazil. Material and methods Subject Population Five hundred and fifty nine subjects who sought dental treatment at the Faculty of Dentistry of the Federal University of Rio de Janeiro between 2005 and 2008 were enrolled in the present study. This department provides periodontal, endodontic, restorative, and prosthetic treatments for non-pediatric subjects. On average, approximately 400 subjects apply for treatment at the referred clinic each semester. Subjects in this study were selected from a waiting list according to the order of enrollment, before any clinical examination or treatment. All participants were informed about the nature of the study and a signed consent form was obtained from each individual prior to the entry into the study. The study protocol was reviewed and approved by the Review Committee for Human Subjects of the Clementino Fraga Filho University Hospital of the Federal University of Rio de Janeiro.
75 53 Socio-demographic and behavioral data At the first visit, subjects were submitted to anamnesis questionnaire, and data about age, gender, race (skin color), schooling (number of years of study), and family income were obtained for most of the subjects. Some individuals did not provide these socio-demographic data for they did not know or refused to reveal the information. The self-definition of skin color was used according to the Brazilian Demographic Census categories (13, 14): white people, dark-skinned black people, lighter-skinned black people, yellow people (Asian descent), and Amerindian. The monthly family income was based on the Brazilian minimum wage of June of 2008 (about U$252 per month). Smoking habit was recorded as never-smoker and smoker (current or former smokers). Clinical evaluation All subjects had at least 15 teeth. Exclusion criteria included pregnancy, nursing, periodontal therapy and use of antibiotics within the previous six months, as well as any systemic condition that could affect the progression of periodontitis. Individuals who required antibiotic coverage for routine periodontal procedures were also excluded. Clinical examinations were performed by four calibrated examiners. The intraclass correlation coefficient for PD at the site level ranged between 0.80 and Full-mouth measurements were recorded at six sites per tooth (distobuccal, buccal, mesiobuccal, distolingual, lingual, mesiolingual), excluding third molars. The parameters evaluated included probing depth (PD) and clinical attachment level or loss (CAL), measured using a North Carolina probe (Hu-Friedy, Chicago, IL), presence or absence of supragingival biofilm (SB), bleeding on probing (BOP), and suppuration (SUP). SB was recorded by
76 54 dichotomization of the Silness-Löe Plaque Index (15), in which the scores 0 and 1 were recorded as absence of SB (0), while 2 and 3 were recorded as presence of visible SB (1). Data analysis Statistical tests were performed using Statistical Package for the Social Sciences, release 16.0 (SPSS, Chicago, IL, USA). Frequency distribution, mean and standard errors were calculated to present the socio-demographic and clinical data. The prevalence and extent were described in categories for PD: shallow ( 4 mm), moderate (5-6 mm), and deep ( 7 mm); and for CAL: slight ( 4 mm), moderate (5 to 6 mm), and severe ( 7 mm). Extent was calculated as the percentage of sites affected with slight, moderate, and severe PD and CAL per subject, and then averaged within the age groups. In addition, the frequency of subjects presenting at least one site or various sites with PD 5 mm or 7 mm was also determined. Significant differences among variables were sought by Chisquare and Kruskal-Wallis tests. Further, the data were analyzed by univariate and multivariate models using logistic regression analyses. These analyses used as dependent variables PD 5 mm present in more than 10% of sites, and presence of PD 7 mm in at least one site, representing moderate and severe PD, respectively. Subjects were categorized in three age groups: 18 to 35 years, 36 to 50 years, and > 50 years. Predictor variables such as BOP and SB were transformed in categorical variables, including 0 to 10%, > 10% to 30% and > 30% of affected sites to represent extent and severity of inflammation and levels of oral hygiene. Number of missing teeth was dichotomized into 3 and 4 missing teeth. Only variables showing significance at p 0.25 in the univariate model and having information for the 559 subjects were included in the multivariate stepwise procedure to calculate odds ratio (OR) and 95% confidence intervals (CI). The
77 55 contribution of each variable to the model was evaluated by Wald statistics. Interactions were also analyzed for all tested variable. The significance level considered was 5%. Results Table 1 shows the distribution of age, gender, skin color, schooling, monthly family income, and smoking status of the study population according to age groups. Age ranged from 18 to 77 years, and most of the individuals were females in all age groups (66.8% for years; 62.5% for years; 53.7% for > 50 years). Data regarding race, schooling and family income were available for 223, 167 and 164 subjects, respectively. Individuals of white skin color were the most prevalent ones (44.8%), followed by lighter-skinned black (35.9%), and dark-skinned black people (19.3%), p = The younger age group had the highest prevalence of subjects with 12 years of education (49.2%), while the age group of years had the greatest percent of subjects with 8 years of education (41.5%), p < The majority of subjects in all age groups were in the medium income category (40.0% for years, 39.1% for years, and 54.3% for > 50 years). Surprisingly, 74.4% of the population had no history of smoking. The frequency of subjects with one or more sites presenting PD 5 mm or 7 mm is depicted in Figure 1. Sixty-nine and 54% of the individuals presented PD 5 mm and 7 mm, respectively, in at least one site. The number of subjects with PD 5 mm or 7 mm decreased with the increase of affected sites. Table 2 demonstrates the periodontal clinical parameters of this population according to age. Subjects years of age had significantly higher mean PD (3.08 ± 0.07 mm) than the other two groups, p = However, the older age group showed a higher mean CAL (3.88 ± 0.09 mm) than individuals within and years of age, p < The number of missing teeth
78 56 was higher in older subjects (8.41 ± 0.68) than the younger ones (18-35 years = 2.02 ± 0.16; years = 5.25 ± 0.29), p < Approximately 75% of this population had at least one missing tooth, and 53.5% had lost 3 teeth, excluding third molar (data not shown). Younger individuals presented lower % of SB and % of BOP compared to older subjects, p = and p < 0.001, respectively. Subjects years old showed a significantly higher frequency of sites with suppuration (4.71%), and with moderate (14.9%) and deep PD (5.36%) than the other age groups (p < 0.05). Regarding CAL, the youngest age group presented lower frequencies of moderate (12.45%) and severe (7.25%) CAL compared to older individuals, p < Univariate logistic regression analysis of the association between the two outcome variables (PD 5 mm in 10% of sites and PD 7 mm in at least one site), and socioeconomic, demographic and clinical predictor variables is shown in Table 3. A higher risk of having PD 5mm or 7mm was observed for subjects who had between 36 and 50 years of age, were dark-skinned black, had < 12 years of schooling, had < $790 monthly income, were former or current smokers, had > 10% of sites with BOP and > 30% of sites with SB, and had lost more than 4 teeth. The presence of SB in >10% of sites was associated only with PD 7 mm (OR=2.95). No significant association between gender and PD was found. Multivariate analysis (Table 4) showed that subjects with (OR = 1.95) or > 50 years of age (OR = 3.15), > 30% of sites with SB (OR = 2.80), and 4 missing teeth (OR = 2.26) were at significantly higher risk for having PD 7 mm compared to younger subjects presenting 10% of sites with BOP and 3 missing teeth. Furthermore, a higher risk for having PD 5 mm and 7 mm was seen in subjects who were smokers (OR = and 9.10, respectively), and had > 10% of sites with BOP (OR = 6.37 to 20.91, and
79 to 26.19, respectively) compared to subjects who never-smoked and presented 10% of sites with BOP. All interactions between pairs of predictor variables were tested for the two outcomes and only the ones that showed statistical significance were kept in the final multivariate analysis model. The interaction between age (> 50 years) and missing teeth ( 4 teeth) showed a significant negative correlation with the risk of presenting PD 5 mm in 10% of sites (OR = 0.14), and PD 7 mm in at least one site (OR = 0.11). Likewise, the interaction between smoker and presence of > 10% of sites with BOP showed a decrease in the chances of presenting moderate (OR = 0.06 to 0.21) or deep PD (OR = 0.07 to 0.16). Table 5 shows the estimated predicted probability of probing depth based on the multivariate logistic model. The lowest probabilities for presenting moderate or deep PD were observed in younger subjects, non-smokers, with up to 10% of sites with BOP and 30% of SB, and 3 missing teeth. For never-smokers, as age, number of sites with BOP and SB went up, there was an increase in the probabilities of having PD 5 mm or 7 mm. Smoking increased the probability of PD in individuals of all age groups with moderate BOP (up to 30% of the sites) and large amounts of plaque (SB > 30% of sites) in relation to non-smokers. Considering tooth loss 3 teeth, subjects over 50 years of age with high levels of plaque and BOP showed the highest probabilities of having sites with moderate and deep PD. Discussion This cross-sectional study evaluated subjects between 18 and 77 years of age who sought dental treatment in a public Dental School in the metropolitan area of Rio de Janeiro. This area has over 15 million inhabitants, being the second largest metropolitan
80 58 area in Brazil, and twenty-fourth in the world (16, 17). Data from the last Brazilian demographic census reported that only 25% of the population in the Southeast region of the country, where Rio de Janeiro is located, earn more than three minimum wages per month (about US$ in 2009), and approximately 20% have less than four years of schooling (18). In the present study, 29% of the population had less than eight years of education, and around 27% received more than US$790 per month, indicating socioeconomic characteristics comparable to those of the Brazilian Southeast region. Although the referred public dental institution does not receive subjects from all social segments of this society, it is considered an important reference center for dental care in the city of Rio de Janeiro. Most individuals who visit public dental institutions in Brazil come from lower socio-economic strata, and therefore may present high prevalence and severity of periodontal breakdown, as well as periodontal inflammation and poor oral hygiene (7). In fact, our data showed that the prevalence of subjects with PD 5 mm and 7 mm in at least one site was 69.0% and 54.0%, respectively. Likewise, Susin et al. [3] found a prevalence of 65% and 25% of subjects with PD 5 mm and 7 mm; whereas Corraini et al. [10] reported frequencies of 67.77% and 22.1% for PD 4 mm and 6 mm, respectively. In the current study population, the extent of affected sites with deep PD ranged from 4.6 to 5.4%, similarly to the frequency reported by Susin et al. (5%) (3). In 1991, Flores-de-Jacoby et al. [8] reported a much higher prevalence of sites (14.7%) with PD 6 mm in individuals of an urban population of Rio de Janeiro, Brazil. Conversely, a recent investigation showed a prevalence of only 2% of subjects with PD 6 mm in individuals from the Brazilian Northeast region (11). Both of these studies, however, were based on CPITN methodology. Although CPITN is recommended by the World Health
81 59 Organization, it has been criticized, specially because it is a partial examination index and reports an underestimated prevalence of periodontal disease in a given population (3, 5, 6). As demonstrated by Baelum et al. (19), CPITN findings cannot identify the age-dependent increase in the prevalence and severity of periodontal disease in a population. Differently from CAL measurement, PD is not capable of showing the amount of periodontal breakdown over time. While CAL is a cumulative measure of disease, and consequently increases with increasing age (2, 20), studies have shown that PD has a weak correlation with age (3, 10). In the present study, mean PD and % of sites with deep PD were significantly higher in subjects within years of age than individuals within or > 50 years of age (table 2). However, a clear difference could be seen regarding CAL, which was significantly greater in older subjects compared to younger individuals. The univariate analysis also showed that subjects in the age group 36 to 50 years were at higher risk for presenting PD 5 mm (OR = 1.57) and 7 mm (OR = 2.21) than younger subjects, although no significant correlation was observed for individuals > 50 years of age. In contrast, the odds ratio for having at least one site with PD 7 mm increased in older subjects (OR = 1.95 for years, and OR = 3.15 for > 50 years of age), as demonstrated in the multivariate analysis (table 4). Although these results seem to be contradictory, one could speculate that they may be related to the amount of missing teeth. For instance, when predicted probabilities for the occurrence of moderate and deep PD were estimated based on the multivariate logistic model (table 5), it was possible to observe a major impact of missing teeth on the outcome PD. The chances of having PD 5 mm and 7 mm increased with increasing age, number of sites with BOP and SB when a subject had lost up to 3 teeth, regardless of smoking status. However, if a subject had lost 4 or more teeth, the chances to have PD 5 mm and 7 mm were higher in the younger
82 60 groups. As in the present study, Susin et al. (21) also found that older subjects present significantly more missing teeth than younger individuals, which could interfere with the outcome PD. In Brazil, the rate of tooth extraction is still quite high, especially in a low socioeconomic level (21), as the only option for dental treatment. Consequently, it is conceivable that in older patients the teeth with the worst condition (for example, deep PD) were already lost, which could result in an underestimation of disease in this group (21). A high proportion of females was observed in this sample population (62.8%). The univariate analysis showed no significant association between gender and PD, corroborating the data reported by Khader et al. (12). However, this finding is in disagreement with other studies showing that males have a higher prevalence and extent of increased PD, and are at higher risk for increased PD than females (3, 10, 14). Regarding race, the subjects of this study population were classified as white, darkskinned and lighter-skinned black people based on the Brazilian census categories (14). In general, most of the subjects were classified as white (44.8%), although a higher proportion of lighter-skinned black people (43%) was observed among subjects within years of age (table 1). The univariate analysis showed that being dark-skinned increased the risk for PD 5 mm (OR = 2.37), and PD 7 mm (OR = 2.15). This is in accordance with Peres et al. (14) who reported an association between dark skin color and periodontal disease. Likewise, Susin et al. (14) found that generalized and localized PD 5 mm were associated with non-white race. Years of schooling and monthly family income were two parameters used to categorize the socioeconomic status of the subjects. Univariate analysis showed that 12 years of study was significantly associated with the presence of moderate (OR = 4.38 to 4.68), and deep PD (OR = 4.29 to 4.60). Lower monthly family income (< US$ 790) was
83 61 also associated with a higher risk for having PD 5 mm (OR = 3.53 to 5.66) and 7 mm (OR = 4.12 to 6.88). Peres et al. (14) reported odds ratios between 1.3 and 1.6 for individuals with < 12 years of schooling. These authors also found an association between low income and high risk for periodontal disease in a Brazilian population. In contrast, other investigators did not find any association between increased PD and socioeconomic status (3) or low income (10). Although the prevalence of smokers (former or current) in this population was relatively low (25.6%), our analyses showed that smokers had a quite significant higher risk for PD 5 mm (OR = 10.56) and 7 mm (OR = 9.10) compared to never-smokers, corroborating the findings reported by other studies (3, 10, 12, 22). The probabilities for having PD 5 mm or 7 mm were much higher in smokers than non-smokers of all ages presenting up to 30% of sites with BOP and large amounts of SB. In a previous study, we have also demonstrated the significant increasing effects of smoking on the chances of having CAL (20). Moreover, Haffajee & Socransky (22) showed that, on average, younger subjects who smoked lost approximately the same amount of clinical attachment that took 27 years for non-smokers to achieve. Thus, it seems that smoking habit overcome the effects of age or periodontal clinical parameters on the chances of having periodontal destruction. In contrast to these results, we observed that, among subjects with a high frequency of bleeding sites (> 30%), smokers presented lower probabilities of having moderate or deep PD than non-smokers, regardless of age, oral hygiene or number of missing teeth. Analyses of possible interactions among variables within the multivariate model were performed, and associations between older age and tooth loss, as well as BOP and smoking habit were observed. The interaction between 50 years of age and 4 missing teeth reduced significantly the risk of a subject of having moderate (OR = 0.14)
84 62 and deep PD (OR = 0.11). Of interest, the variables BOP and smoking were strong risk indicators for PD; however, the interaction between the two variables led to a significant protective effect for having PD 5 mm (OR = 0.06) and 7 mm (OR = 0.07). Accordingly to our data and other authors, smokers have usually fewer sites exhibiting BOP than neversmokers (22, 23). In addition, sites with periodontal pockets in smokers present a significantly lower volume of crevicular fluid (24). These findings indicate that smokers may have a lower vascular inflammatory response to the presence of supragingival plaque due to the vasoconstriction induced by tobacco exposure at the gingival level (24-26). Thus, if a smoker is able to bleed on probing, this could indicate that the immune system is capable of responding properly to bacterial challenge, decreasing the chances of periodontal destruction progression. This particular Brazilian population presented high prevalence and extent of increased periodontal probing depth. Age, smoking, BOP, SB, and tooth loss were risk indicators associated with probing depth in these individuals. Even within the limitations of the present study, the association between age and clinical parameters for never-smokers and smokers seems to contribute for the improvement of the sensitivity of the clinical diagnosis. Moreover, the association of those parameters with CAL should be considered for periodontal diagnosis and disease classification. Although measures of OR are predictors, they do not guarantee the percentage of subjects who will develop the disease in the future (27). Nevertheless, the definition of high risk subjects is essential to plan prevention, diagnoses, and treatment strategies. Acknowledgments
85 63 This study was supported in part by National Council for Scientific and Technological Development (CNPq), Coordination of Improvement of Higher Education Personnel (CAPES), Brasilia, Brazil; and Foundation for Research Financial Support in the State of Rio de Janeiro (FAPERJ), Rio de Janeiro, Brazil. The authors declare that they do not have any conflict of interest regarding the present study.
86 64 References 1. Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL, Jr. Microbial complexes in subgingival plaque. J Clin Periodontol 1998;25(2): Dye BA, Selwitz RH. The relationship between selected measures of periodontal status and demographic and behavioural risk factors. J Clin Periodontol 2005;32(7): Susin C, Valle P, Oppermann RV, Haugejorden O, Albandar JM. Occurrence and risk indicators of increased probing depth in an adult Brazilian population. J Clin Periodontol 2005;32(2): Holtfreter B, Schwahn C, Biffar R, Kocher T. Epidemiology of periodontal diseases in the Study of Health in Pomerania. J Clin Periodontol 2009;36(2): Baelum V, Papapanou PN. CPITN and the epidemiology of periodontal disease. Community Dent Oral Epidemiol 1996;24(6): Bassani DG, da Silva CM, Oppermann RV. Validity of the "Community Periodontal Index of Treatment Needs" (CPITN) for population periodontitis screening. Cad Saude Publica 2006;22(2): Gjermo P, Rosing CK, Susin C, Oppermann R. Periodontal diseases in Central and South America. Periodontol ;29: Flores-de-Jacoby L, Bruchmann S, Mengel R, Zafiropoulos GG. Periodontal conditions in Rio de Janeiro City (Brazil) using the CPITN. Community Dent Oral Epidemiol 1991;19(2):127-8.
87 65 9. Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de Atenção Básica. Coordenação Nacional de Saúde Bucal. Projeto SB Brasil 2003 Condições de saúde bucal da população brasileira Resultados Principais (in Portuguese). Brasilia; Corraini P, Baelum V, Pannuti CM, Pustiglioni AN, Romito GA, Pustiglioni FE. Risk indicators for increased probing depth in an isolated population in Brazil. J Periodontol 2008;79(9): Coelho Rde S, Gusmao ES, Jovino-Silveira RC, Caldas Ade F. Profile of periodontal conditions in a Brazilian adult population. Oral Health Prev Dent 2008;6(2): Khader YS, Rice JC, Lefante JJ. Factors associated with periodontal diseases in a dental teaching clinic population in northern Jordan. J Periodontol 2003;74(11): Brazilian Institute of Geography and Statistics. Demographic Census CD Questionary of the sample (in Portuguese). Available at: Accessed May, Peres MA, Antunes JL, Boing AF, Peres KG, Bastos JL. Skin colour is associated with periodontal disease in Brazilian adults: a population-based oral health survey. J Clin Periodontol 2007;34(3): Silness J, Loe H. Periodontal Disease in Pregnancy. Ii. Correlation between Oral Hygiene and Periodontal Condtion. Acta Odontol Scand 1964;22:
88 Brazilian Institute of Geography and Statistics. Population Census (in Portuguese). Available at: Accessed February 18, World: largest cities and towns and statistics of their population. Available at: Accessed February 18, Brazilian Institute of Geography and Statistics. Municipal social indicators: an analysis of the sample results from the Demographic Census Brazil and Great Regions (in Portuguese). Rio de Janeiro, Brazil; Baelum V, Manji F, Wanzala P, Fejerskov O. Relationship between CPITN and periodontal attachment loss findings in an adult population. J Clin Periodontol 1995;22(2): Silva-Boghossian CM, Luiz RR, Colombo AP. Periodontal status, sociodemographic and behavioral indicators in subjects attending a Public Dental School in Brazil: analysis of clinical attachment loss. J Periodontol DOI: /jop Susin C, Oppermann RV, Haugejorden O, Albandar JM. Tooth loss and associated risk indicators in an adult urban population from south Brazil. Acta Odontol Scand 2005;63(2): Haffajee AD, Socransky SS. Relationship of cigarette smoking to attachment level profiles. J Clin Periodontol 2001;28(4):
89 Lie MA, Timmerman MF, van der Velden U, van der Weijden GA. Evaluation of 2 methods to assess gingival bleeding in smokers and non-smokers in natural and experimental gingivitis. J Clin Periodontol 1998;25(9): Gomes SC, Piccinin FB, Oppermann RV, Susin C, Nonnenmacher CI, Mutters R, et al. Periodontal status in smokers and never-smokers: clinical findings and real-time polymerase chain reaction quantification of putative periodontal pathogens. J Periodontol 2006;77(9): Calsina G, Ramon JM, Echeverria JJ. Effects of smoking on periodontal tissues. J Clin Periodontol 2002;29(8): Dietrich T, Bernimoulin JP, Glynn RJ. The effect of cigarette smoking on gingival bleeding. J Periodontol 2004;75(1): Bouchard P, Boutouyrie P, Mattout C, Bourgeois D. Risk assessment for severe clinical attachment loss in an adult population. J Periodontol 2006;77(3):
90 68 Table 1. Distribution of the study population according to age, socio-demographic and behavioral status. Age (years) >50 Variables % (N) % (N) % (N) % (Total) Gender P value * Female 66.8 (155) 62.5 (145) 53.7 (51) 62.8 (351) Male 33.2 (77) 37.5 (87) 46.3 (44) 37.2 (208) Skin color White 53.9 (48) 31.4 (27) 52.1 (25) 44.8 (100) Dark-skinned black people 12.4 (11) 25.6 (22) 20.8 (10) 19.3 (43) Lighter-skinned black people 33.7 (30) 43.0 (37) 27.1 (13) 35.9 (80) Schooling 8 years 10.8 (7) 41.5 (27) 37.8 (14) 28.7 (48) < years 40.0 (26) 40.0 (26) 35.1 (13) 38.9 (65) 12 years 49.2 (32) 18.5 (12) 27.0 (10) 32.3 (54) Monthly family income (US$) (16) 35.9 (23) 28.6 (10) 29.9 (49) (26) 39.1 (25) 54.3 (19) 42.7 (70) > (23) 25.0 (16) 17.1 (6) 27.4 (45) Smoking status Never-smoker 89.2 (207) 63.4 (147) 65.3 (62) 74.4 (416) <0.001 Smoker 10.8 (25) 36.6 (85) 34.7 (33) 25.6 (143) 2 test.
91 69 Table 2. Periodontal clinical data (mean ± SEM) of the study population according to age. Age (years) >50 Total PD (mm) 2.86 ± ± ± ± CAL (mm) 3.03 ± ± ± ± 0.06 <0.001 N of missing teeth 2.02 ± ± ± ± 0.21 <0.001 % BOP ± ± ± ± % Suppuration 3.49 ± ± ± ± % SB ± ± ± ±1.34 <0.001 % PD 0-4 mm ± ± ± ± mm ± ± ± ± mm 4.60 ± ± ± ± % CAL 0-4 mm ± ± ± ± 1.13 < mm ± ± ± ± 0.68 < mm 7.25 ± ± ± ± 0.63 <0.001 PD=probing depth; CAL=clinical attachment loss; BOP=bleeding on probing; SB=supragingival biofilm.* Kruskal-Wallis test.
92 70 Table 3. Univariate logistic regression analysis of socio-economic, demographic and clinical variables on the PD 5 mm in 10% of the sites and PD 7 mm in at least one site. PD 5 mm PD 7 mm Variables OR (95% CI) P OR (95% CI) P Age (years) < (1.08 to 2.26) (1.52 to 3.21) <0.001 > (0.74 to 1.92) (0.90 to 2.36) Gender Female 1 1 Male 0.86 (0.61 to 1.21) (0.72 to 1.44) Skin color White 1 1 Dark-skinned black 2.37 (1.12 to 5.04) (1.04 to 4.44) Lighter-skinned black 1.80 (0.95 to 3.41) (0.69 to 2.29) Schooling years 4.38 (1.56 to 12.34) (1.85 to 11.46) years 4.68 (1.74 to 12.56) (1.80 to 10.19) years 1 1 Monthly family income (US$) (1.16 to 10.71) (1.46 to 11.57) (1.99 to 16.08) (2.58 to 18.32) <0.001 > Smoking status Never-smoker 1 1 Smoker 1.55 (1.06 to 2.28) (1.01 to 2.21) BOP (%) <0.001 < > (2.62 to 9.06) < (2.92 to 9.66) < > (7.24 to 23.04) < (9.84 to 30.53) < SB (%) <0.001 < > (0.70 to 3.69) (1.34 to 6.53) > (5.38 to 21.69) < (7.07 to 28.65) < Missing teeth* (1.31 to 2.57) < (1.49 to 2.96) < PD: probing depth, BOP: bleeding on probing, SB: supragingival biofilm; *number of missing teeth.
93 71 Table 4. Multivariate logistic regression analysis of age, smoking status and clinical predictor variables for the outcome variables PD 5 mm in 10% of the sites, and PD 7 mm in at least one site. PD 5 mm PD 7 mm Variables OR (95% CI) P OR (95% CI) P Age (years)* > 50 Smoking status# 1.09 (0.59 to 2.01) (1.04 to 3.66) (0.77 to 5.72) (1.13 to 8.80) Smoker (2.89 to 38.66) < (2.65 to 31.19) BOP (%) <0.001 <0.001 > (2.14 to 18.96) (2.56 to 18.83) <0.001 > (7.20 to 60.69) < (9.75 to 70.34) <0.001 SB (%) < > > Missing teeth 4 Interactions 0.72 (0.27 to 1.91) (0.57 to 3.76) (0.96 to 5.57) (1.16 to 6.74) (0.92 to 3.94) (1.07 to 4.75) Age (years) and missing teeth 0.58 (0.23 to 1.48) (0.19 to 1.32) by 4 missing teeth > 50 by 4 missing teeth 0.14 (0.04 to 0.49) (0..03 to 0.40) Smoking and BOP (%) < Smoker by > 10 30% 0.21 (0.05 to 0.90) (0.04 to 0.65) Smoker by > 30% 0.06 (0.01 to 0.27) < (0.02 to 0.27) <0.001 *reference: years; # reference: never smoker; reference: 0-10%; reference: 3 missing teeth; reference: years and 3 missing teeth; reference: 0-10% BOP and never-smoker; PD: probing depth; BOP: bleeding on probing; SB: supragingival biofilm.
94 72 Table 5. Estimated predicted probability (%) of PD 5 mm and 7 mm based on the multivariate logistic model. PD 5mm PD 7mm Smoking status BOP (%) SB (%) MT Age (years) Age (years) > >50 Never-smoker > > > > > > > >
95 Smoker > > > > > > > > PD: probing depth; BOP: bleeding on probing; SB: supragingival biofilm; MT: missing teeth.
96 Figure legend Figure 1. Bar chart of the distribution of subjects with periodontal probing depth (PD) 5 or 7 mm in at least one site, 10%, 20%, 30%, 40%, 50%, and 60% of the sites.
97 % of subjects 75 Figure PD 5mm PD 7mm At least one site 10% 20% 30% 40% 50% 60% Affected sites
98 76 Association of red complex, A. actinomycetemcomitans and non-oral bacteria with periodontal diseases Running title: Red complex, Aa and non-oral bacteria Carina Maciel da Silva-Boghossian 1, Renata Martins do Souto 2, Ronir R. Luiz 3, Ana Paula Vieira Colombo 2 1 Department of Dental Clinic, Division of Graduate Periodontics, Dental School, 2 Institute of Microbiology, 3 Institute of Public Health Studies, Federal University of Rio de Janeiro, Rio de Janeiro, Brazil. Corresponding author: Carina M. Silva-Boghossian, Rua Barão de Guaratiba, 228, Glória, Rio de Janeiro, RJ, Cep , Phone/ Fax: , carinabogho@hotmail.com. Key Words: pathogenic bacteria, A. actinomycetemcomitans, red complex, checkerboard, periodontal diseases Conflict of interest and source of funding: The authors declare that they have no conflict of interests. This work was supported in part by National Council for Scientific and Technological Development (CNPq), and Coordination of Improvement of Higher Education Personnel (CAPES), Brasilia, Brazil; and Foundation for Research Financial Support in the State of Rio de Janeiro (FAPERJ), Rio de Janeiro, Brazil.
99 77 Clinical relevance Scientific rationale for the study: Bacterial pathogens of medical importance have been identified in dental biofilm. Thus, it seems reasonable to investigate whether these pathogenic species not considered to be members of the oral microbiota are associated with putative periodontal pathogens and/or periodontal status. Principal findings: The data showed a high prevalence and levels of non-oral species in the subgingival biofilm of subjects with periodontal diseases. Moreover, these species were associated to Aa, red complex and clinical parameters of periodontal disease. Practical implications: These findings reinforce the understanding of the oral cavity as a possible reservoir for superinfecting bacteria. In addition to putative periodontal pathogens, non-oral species such as A. baumannii and P. aeruginosa, either in association or not with oral pathogens may play a role in the etiopathogenesis of periodontal diseases.
100 78 ABSTRACT Aim: This study evaluated the associations of the red complex, A. actinomycetemcomitans (Aa) and non-oral pathogenic bacteria in subjects with periodontal health (PH), gingivitis (G), chronic (CP) and aggressive (AP) periodontitis. Methods: Subgingival biofilm samples were obtained from 402 subjects and analyzed for the presence of Aa, P. gingivalis, T. forsythia, T. denticola, A. baumannii, E. coli, E. faecalis, P. aeruginosa, and S. aureus by the checkerboard method. Results: CP and AP subjects presented significantly higher prevalence and levels of Aa, red complex and A. baumannii than G and PH individuals (p < 0.01), whereas S. aureus was detected in lower frequency and counts in AP compared to the other groups (p < 0.001). The predictor variables age, % of red complex, A. baumannii and P. aeruginosa were strongly associated with % sites with PD and CAL 5mm. Increasing age (OR 1.08), high frequencies of red complex (OR 6.10), and Aa with P. aeruginosa (OR 1.90) increased the risk for periodontal disease (p < 0.001). Subjects harboring high frequencies of Aa, A. baumannii, and red complex with P. aeruginosa were more likely to have AP than CP (p < 0.001). Conclusion: Putative periodontal pathogens and non-oral bacteria alone or in association were strongly associated with periodontitis.
101 79 INTRODUCTION Periodontal diseases are bacterial infections associated with a complex microbiota of the dental biofilm composed predominantly of strictly anaerobic Gram-negative species (Paster et al. 2006; Socransky et al. 1998) that will induce a local and systemic inflammatory response, leading to periodontal tissue destruction (Page & Kornman 1997). Nonetheless, only few species such as Aggregatibacter actinomycetemcomitans (Aa) and Porphyromonas gingivalis have been considered putative periodontal pathogens (Moore et al. 1985; Slots & Ting 1999). Socransky et al. (1998) proposed that periodontal diseases could be associated with a consortium of organisms rather than individual pathogens at periodontal sites. They defined five microbial complexes repeatedly found together in subgingival biofilm of subjects with and without periodontal diseases (Socransky et al. 1998). The red complex, which appears later in biofilm development and comprises three species, Tannerella forsythia, P. gingivalis and Treponema denticola has been considered the most pathogenic microbial complex (Holt & Ebersole 2005; Socransky et al. 1998). Periodontal infections and oral bacteria have also been suggested to be potential risk indicators for a number of systemic diseases (Li et al. 2000; Ramseier et al. 2009; Scannapieco 1998). The teeth are the only non-shedding surface in the body, and bacterial levels can reach more than microorganisms per mg of dental biofilm, particularly in the presence of periodontitis. The anatomic closeness of this biofilm to the bloodstream can facilitate the systemic spread of bacteria and their products, as well as inflammatory mediators and immunocomplexes (Scannapieco 1998). Likewise, it is possible that the oral cavity acts as a reservoir for other pathogenic species to disseminate to distant body sites, specially in immunocompromised hosts (Botero et al. 2007a; Goncalves et al. 2007, 2009). In fact, medically important bacterial pathogens commonly associated with nosocomial infections and multi-resistance to antimicrobials have been detected in high proportions
102 80 and levels in subgingival biofilm of individuals with periodontal diseases (Botero et al. 2007b; Colombo et al. 2002; Fritschi et al. 2008; Goncalves et al. 2007; Slots et al. 1988, 1990; Souto et al. 2006). Although the role of these superinfecting pathogens in the etiology of periodontitis has not been investigated, species such as Pseudomonas aeruginosa, Staphylococcus aureus, Acinetobacter baumannii, enterococci, Escherichia coli, Enterobacter spp., Klebsiella spp. and Candida spp. have been frequently isolated from periodontal and/or periapical lesions (Colombo et al. 2002; Dahlen & Wikstrom 1995; Fritschi et al. 2008; Goncalves et al. 2007; Jacinto et al. 2007; Smith et al. 2001; Souto & Colombo 2008b; Souto et al. 2006). Moreover, some of these bacteria are key pathogens in the development of biofilms (Costerton 1999; Pratt & Kolter 1998; Rodriguez-Bano et al. 2008; Sedgley et al. 2006; Yarwood & Schlievert 2003). Medically important pathogens within the dental biofilm may be more difficult to eradicate, increasing the probability of re-infection and treatment failure (Colombo et al. 1998; Costerton 1999; Smith et al. 2001). Thus, it seems reasonable to investigate whether pathogenic species not considered to be members of the oral microbiota are related to putative periodontal pathogens and/or periodontal status. The current study evaluated the association between the red complex and Aa with the pathogens P. aeruginosa, S. aureus, A. baumannii, Enterococcus faecalis, and E. coli in the subgingival microbiota of subjects with periodontal health, gingivitis, chronic and aggressive periodontitis. MATERIAL AND METHODS Subject Population Four hundred-two sequential subjects who sought dental treatment between 2005 and 2009 at the Dental School of the Federal University of Rio de Janeiro were enrolled in
103 81 the present study. All participants were informed about the nature of the study and a signed consent form was obtained from each individual prior to the entry into the study. The study protocol was reviewed and approved by the Review Committee for Human Subjects of the Clementino Fraga Filho University Hospital of the Federal University of Rio de Janeiro. Clinical evaluation At the first visit, subjects were submitted to anamnesis questionnaire, and data about age, gender and smoking habit were obtained. Smoking status was recorded as never-smoker and smoker (current or former smokers). All subjects had at least 14 teeth and 18 years of age. Exclusion criteria included pregnancy, nursing, periodontal therapy and use of antibiotics within the previous six months, as well as any systemic condition that could affect the progression of periodontitis. Individuals who required antibiotic coverage for routine periodontal procedures were also excluded. Clinical examinations were performed by calibrated examiners. The intraclass correlation coefficient for clinical attachment level (CAL) at the site ranged between 0.90 and 0.97, and for probing depth (PD), ranged between 0.80 and Full-mouth measurements including PD, CAL, presence or absence of supragingival biofilm (SB) and bleeding on probing (BOP) were recorded at six sites per tooth (distobuccal, mesiobuccal, mesiobuccal, distolingual, lingual, mesiolingual), excluding third molars. Clinical diagnosis of periodontal status was established for all subjects based on the following criteria: periodontal health (PH), 10% of sites with BOP, no PD or CAL > 3 mm, although PD or CAL = 4 mm in up to 5% of the sites without BOP was allowed; gingivitis (G), > 10% of sites with BOP, no PD or CAL > 3 mm, although PD or CAL = 4 mm in up to 5% of the sites without BOP was allowed; chronic periodontitis (CP), > 10% of teeth with PD and/or CAL 5 mm and BOP;
104 82 aggressive periodontitis (AP), 30% of teeth with PD and/or CAL 5 mm with BOP, including at least one incisor and one first molar, and 39 years of age. Microbiological assessment Subgingival biofilm samples were taken from 7 healthy sites in PH, 7 bleeding sites in G subjects, and 14 sites (7 periodontal pockets and 7 healthy sites) in PC and PA subjects. The presence and levels of the red complex (P. gingivalis ATCC 33277, T. forsythia ATCC 43037, T. denticola FDC B1), Aa (ATCC 29523), A. baumannii (ATCC 19606), E. coli (ATCC 10799), E. faecalis (ATCC 10100), P. aeruginosa (ATCC 10145), and S. aureus (ATCC 33591) were determined in the subgingival biofilm samples by genomic DNA probes and the Checkerboard DNA-DNA hybridization method (Haffajee et al. 1997; Socransky et al. 1994). In brief, after removal of supragingival plaque, subgingival biofilm samples were taken using individual sterile Gracey curettes (Hu- Friedy, Chicago, IL, USA), and were placed in individual tubes. The cells were lysed and denatured DNA fixed on a nylon membrane (GE Healthcare Life Science, São Paulo, SP, Brazil) using the Minislot 30 device (Immunetics, Cambridge, MA, USA). The membrane was placed in a Miniblotter 45 (Immunetics) with the lanes of DNA at 90 to the lanes of the device, and hybridized against digoxigenin-labeled (Roche Applied Science, São Paulo, SP, Brazil) whole genomic DNA probes for the selected species. After hybridization, the membranes were washed at high stringency and bound probes were detected using phosphatase-conjugated antibody to digoxigenin (Roche Applied Science) and fluorescence captured by the Storm 860 imaging system (GE Healthcare Life Science). Signals were evaluated visually by comparison with the standards at 10 5 and 10 6 bacterial cells for the test species on the same membrane. They were recorded as: 0, not
105 83 detect; 1, < 10 5 cells; 2, approximately 10 5 ; 3, 10 5 to 10 6 ; 4, approximately 10 6, and 5, >10 6 cells. The sensitivity of the assay was adjusted to permit the detection of 10 4 cells of a given species by adjusting the concentration of each DNA probe. Data analysis Statistical tests were performed using the Statistical Package for the Social Sciences (SPSS, release 17.0, Chicago, IL). Frequency distribution, mean and standard errors were calculated for each subject and within the group to present the socio-demographic and clinical data. Significant differences among variables were sought by Kruskal-Wallis, Mann-Whitney and 2 tests. Microbiological data were expressed as mean % of colonized sites (prevalence) and mean counts (levels) of colonization, calculated for each species in each subject, and then within each group. In prevalence analysis, it was considered only the presence of the microorganism. The levels (scores 0 to 5) of each species in a sample were converted to absolute numbers and log 10 transformed for presentation in graphics. The presence of the red complex was considered when the three pathogens (P. gingivalis, T. denticola, and T. forsythia) were detected in the sample at the same time. Differences in the prevalence and levels of the species were determined by Kruskal-Wallis and Mann- Whitney tests. Associations between oral and non-oral bacteria and periodontal clinical parameters were evaluated by linear regression analysis using the stepwise method, controlled for age and smoking status. Bacterial risk factors for periodontitis were investigated using univariate and multivariate logistic regression analysis (forward Wald) from which ORs with 95% CI were reported. Statistical significance was reached at a 5% level.
106 84 RESULTS Table 1 shows the distribution of age, gender, and smoking status according to diagnostic groups. CP subjects were significantly older than PH, G, or AP individuals (p < 0.001). Significantly greater proportions of former and current smokers were found in the CP group in comparison with PH, G and AP patients (p < 0.001). Mean PD and CAL differed significantly (p < 0.001) among groups, except between PH and G individuals. AP subjects showed greater mean PD and CAL, as well as % of sites with PD 5 mm compared to CP patients (p < 0.001). BOP was significantly higher in the AP (64.5%) than the CP (40.9%) and G (29.4%) groups, whereas PH individuals (4%) showed the lowest prevalence (p < 0.001). Although AP subjects presented a significantly higher frequency of sites with SB (70.3%) than individuals in the PH (13.1%) and G (42.6%) groups, no difference was observed regarding the CP group (63.8%). The mean prevalence and counts of the tested bacteria are depicted in Figures 1a and 1b. Aa was found in more than 50% of the sites, whereas the red complex was detected in about 35% of the sites of AP and CP subjects. Regarding the non-oral bacteria, the most frequently detected species in all groups was E. faecalis (41.7%). The mean prevalence and levels of Aa, red complex, A. baumanii, E. faecalis, and S. aureus were significantly different among groups (Figures 1a, 1b; Kruskal-Wallis test). Aa was detected significantly more often and in higher counts in periodontitis than periodontally healthy individuals (p < 0.01; Mann-Whitney test). Diseased groups (AP, CP and G) presented significant higher frequency and levels of the red complex than the PH group (p < 0.01); however, no differences were seen between AP and CP subjects. Higher prevalence and counts of A. baumannii were seen in the periodontitis groups in relation to the G and PH groups (p < 0.01). P. aeruginosa was found in higher frequency and levels in AP and CP subjects than G individuals (p < 0.05). The AP group showed significantly lower prevalence and counts
107 85 of S. aureus than the other groups (p < 0.001). E. faecalis was detected in greater frequency and levels in CP than PH subjects (p < 0.05). Figure 2 shows the frequency of subjects harboring the red complex. Overall, 57.1% of the study population had the red complex in the subgingival microbiota. The AP group showed the highest prevalence for the red complex (72.9%), followed by CP (67.8%), G (26.1%), and PH (11.8%) (p < 0.001; 2 test). No significant differences were found between the AP and CP groups. Relationships among demographic, clinical data and bacterial species were examined by linear regression analysis using a stepwise method (Table 2). Mean % and counts of P. aeruginosa presented strong positive correlations with all periodontal clinical parameters, except % of sites with SB. Mean counts of E. faecalis showed a modest association only with SB, whereas mean % of E. coli showed an inverse correlation with BOP. Negative associations were also observed between S. aureus and % sites with PD and CAL 5 mm. Conversely, strong correlations were found between mean levels of A. baumannii and these two parameters. Regarding periodontal pathogenic species, the mean prevalence of the red complex demonstrated strong positive associations with all clinical parameters. Smoking showed a modest positive association with SB, and a weak correlation with mean % of sites with CAL 5 mm when the mean counts of bacterial species were considered. Increasing age was associated with increasing in % of sites with CAL 5 mm, % of BOP and SB, and with increasing % of sites with PD 5 mm when bacterial counts were considered in the model. The best fitted model (adjusted R 2 = 0.506) contained the predictor variables age, smoking, mean counts of A. baumannii, P. aeruginosa and S. aureus for the dependent variable mean % of sites CAL 5 mm. Logistic regression analysis (forward Wald) was used to examine the associations between the presence of bacterial species alone or in association (pairs of oral and non-oral species) and periodontal status. Table 3 shows the bacterial species included in the final model to
108 86 distinguish between periodontal disease (periodontitis and gingivitis) and periodontal health. Only species (or pairs of bacteria) that showed significant association in the univariate analysis were included in the multivariate model. All individual species and bacterial associations, except for S. aureus and S. aureus in association with Aa, as well as increasing age and smoking increased the risk for periodontal disease in the univariate analysis (data not shown). Older subjects presenting high frequencies of red complex, Aa in combination with P. aeruginosa, and low frequency of Aa associated with E. faecalis were more likely to present gingivitis/periodontitis than periodontal health (Table 3). In order to distinguish CP from AP based on microbiological parameters, multivariate logistic regression (Figure 3) was performed to assess the risk for AP including species and pairs of species that showed significance in the univariate model (data no shown). The predictor variables that were entered in the model by the forward Wald method included Aa (OR 9.14 [95% CI ], p < 0.001), A. baumannii (OR 2.29 [ ], p < 0.001), S. aureus (OR 0.26 [ ], p < 0.001), Aa + E. faecalis (OR 0.14 [ ], p < 0.001), red complex + P. aeruginosa (OR 6.80 [ ], p < 0.001), and red complex + S. aureus (OR 0.32 [ ], p = 0.025). Detection of Aa, A. baumannii and red complex associated with P. aeruginosa increased the likelihood of a subject to present AP (Figure 3) (p < 0.001), whereas subjects presenting high frequencies of Aa associated with E. faecalis, S. aureus alone and associated to red complex were more likely to have CP (p < 0.05). DISCUSSION In the last few years, several studies have focused on the relationship between periodontal diseases and/or oral bacteria and systemic diseases (Reddy 2007). Likewise, it
109 87 has been questioned if medically important pathogens are likely colonizers of the oral cavity (Botero et al. 2007b; Sedgley et al. 2004, 2006; Smith et al. 2001; Souto & Colombo 2008a,b; Souto et al. 2006). The aim of the present study was to evaluate the association between the periodontal pathogens Aa and red complex and non-oral pathogenic species in subgingival biofilm samples of subjects with PH, G, CP and AP. Our data demonstrated higher prevalence and levels of the red complex and Aa in subjects with periodontitis in comparison to subjects with periodontal health, corroborating the association of these pathogens with disease worldwide (Colombo et al. 2002; Haffajee et al. 1997, 2004; Herrera et al. 2008; Lafaurie et al. 2007; Persson et al. 2008; Socransky et al. 1998; Waraaswapati et al. 2009; Ximenez-Fyvie et al. 2006a,b). In the current study, a site was considered positive for the red complex when the three species (T. forsythia, P. gingivalis, T. denticola) were simultaneously detected. We observed a quite high frequency of the red complex in this study population (57%), especially in AP subjects (73%). The prevalence and counts of Aa including individuals with periodontal health were also markedly greater than the ones observed in other studies (Botero et al. 2007b; Herrera et al. 2008; Lafaurie et al. 2007; Slots & Ting 1999; Wara-aswapati et al. 2009; Ximenez-Fyvie et al. 2006b). Differences in methods of detection, genetic background, behavioral features and/or environmental factors may account for the data variability among these studies; however, the pathogenic role of these species in periodontitis seems to be unanimous. Although these species were individually associated with PD, CAL and BOP, when controlled for age, smoking and other bacterial species, only the prevalence of the red complex was strongly related to these periodontal clinical parameters. Regarding non-oral species, the frequency and levels of E. coli did not differ significantly among clinical groups. Higher frequencies were reported by Souto et al. (2006); however, in other studies the prevalence of E. coli and other enteric rods vary
110 88 widely (Botero et al. 2007b; Colombo et al. 2002; Dahlen & Wikstrom 1995; Lafaurie et al. 2007; Persson et al. 2008; Slots et al. 1988, 1990). When controlled for age, smoking and other bacterial species, this organism showed only a negative association with % of bleeding sites. The species E. faecalis was more prevalent in G and CP subjects, but was detected in significantly higher counts in the G group. Similar frequencies for E. faecalis in periodontitis were reported by other authors (Colombo et al. 2002; Goncalves et al. 2007; Persson et al. 2008; Souto & Colombo 2008b). Mean counts of this organism showed a modest positive correlation with supragingival biofilm, supporting the data presented by Souto & Colombo (2008b). Surprisingly, the presence of E. faecalis in association with Aa decreased the risk for periodontal disease (gingivitis/periodontitis), as well as the likelihood for presenting AP. The association of E. faecalis with CP may reflect the high frequency of this organism in this subject group. It is also possible that this species counterbalance the deleterious effects of Aa, a putative pathogen associated with AP, diminishing the risk for this form of disease. It has been shown that E. faecalis may be present in different layers of the oral biofilm, coaggregating with a large number of different oral species (Al-Ahmad et al. 2009). Moreover, the ability of E. faecalis to form biofilm, to adhere and to invade soft-tissues allows it to survive in many hostile environments such as the periodontal pocket (Subramanian & Mickel 2009). Nevertheless, the mechanisms of those interactions remain unknown. Significantly lower prevalence and levels of S. aureus were observed in AP patients compared to CP, G and PH individuals. Similarly to E. faecalis, when S. aureus was present in association with Aa, there was also a significant decrease in the risk for having AP (OR 0.150, p < 0.001). Conversely, Fritschi et al. (2008) found higher levels of S. aureus in aggressive than chronic periodontitis subjects. Moreover, S. aureus was pointed out as a contributor to the microbial profile that could differentiate between chronic and
111 89 aggressive forms of disease. Other studies demonstrated S. aureus to be detected in greater levels and prevalence in periodontitis than non-periodontitis subjects (Persson et al. 2008; Souto et al. 2006). Our data showed that the frequency and levels of S. aureus had a significant negative association with % of sites with PD and CAL 5 mm, whereas Souto et al. (2006) found a significant positive association of this species with PD, BOP and SB. Differences among these studies could be explained by the use of distinct diagnosis criteria for periodontal diseases. The pathogens A. baumannii and P. aeruginosa were more prevalent in periodontitis individuals than subjects with gingivitis or periodontal health. Moreover, high mean counts of these species were strongly related to % of sites with PD or CAL 5 mm. Other authors have also reported an association of these species with sites and/or subjects with periodontal disease (Barbosa et al. 2001; Colombo et al. 1998, 2002; Slots et al. 1988, 1990; Souto et al. 2006), particularly in HIV-infected patients (Goncalves et al. 2007). Colombo et al. (1998) demonstrated that the odds of a subject being refractory to periodontal treatment was 5.6 (p < 0.01) if A. baumannii was detected in > 4.8% of the periodontal sites. In the present study, the presence of Aa (OR 9.14, p < 0.001), A. baumannii (OR 2.29, p < 0.001) and red complex associated with P. aeruginosa (OR 6.80, p < 0.001) in the subgingival microbiota increased significantly the likelihood of a subject to have aggressive periodontitis. P. aeruginosa also seemed to have a synergism with Aa, increasing the risk for periodontal disease (OR 6.71, p < 0.001). Likewise, Persson et al. (2008) showed that P. aeruginosa might have a potential to be used as a diagnostic tool for periodontitis. These investigators evaluated the presence and levels of seventy-four bacterial species in subgingival plaque using the same method of the checkerboard, and found that only P. aeruginosa along with T. forsythia were independent predictors for periodontal disease. Although we did not intend to analyze the members of the red
112 90 complex separately, multivariate logistic regression analysis demonstrated significant associations between periodontal disease and combinations of P. aeruginosa with T. forsythia, and P. aeruginosa with T. denticola (data not shown). Recently, a study employing microarray technique reported that P. aeruginosa, although detected in low prevalence, was significantly more predominant in refractory periodontitis than in successfully treated or periodontally healthy subjects (Colombo et al. 2009). Some features of these non-oral bacteria such as the presence of cell-surface lipopolysaccharides, resistance to multiple drugs and ability to produce biofilms (Al-Ahmad et al. 2009; Costerton 1999; Lau et al. 2009; Loehfelm et al. 2008; Passador et al. 1993; Pratt & Kolter 1998; Rodriguez-Bano et al. 2008) may favor colonization in the periodontal pocket. In addition, the complex and diverse oral microbiota together with the persistent inflammatory process may provide a wide range of nutrients and binding sites for the establishment of these microorganisms (Colombo et al. 2002; Kolenbrander et al. 2006; Socransky et al. 1998; Souto & Colombo 2008a,b; Souto et al. 2006). However, reproducing the periodontal microenvironment and the complex relationships among bacteria, as well as between these organisms and host cells is a challenging task. Nevertheless, studies have shown that physical and metabolic interactions do occur between members of the oral microbiota and non-oral species in the periodontal biofilm (Kolenbrander et al. 2006). For instance, Andersen et al. (1998) reported that species of Fusobacterium coaggregate with Helicobacter pylori, whereas Johnson et al. (2006) showed coaggregation interactions between the species Fusobacterium nucleatum and E. faecalis isolated from persistent apical periodontitis. Antagonistic relationships are also observed in these complex microbial communities. Okuda et al. (2003) found that Streptococcus oralis, Streptococcus mutans, Streptococcus sobrinus, Actinomyces naeslundii, Prevotella intermedia and Prevotella nigrescens produce bacteriocin-like
113 91 inhibitory proteins against H. pylori. More recently, Watanabe et al. (2009) demonstrated that a substance denominated the new-antipseudomonal substance derived from Streptococcus sanguinis can be bactericidal against P. aeruginosa and A. baumannii. The complex and dynamic interactions that take place in the periodontal ecosystem are far from being completely unraveled. Thus, studies focused on bacterial oral ecology, particularly quorum sensing, are essential for providing a better understanding of the intricate interplay between specific bacterial species and host cells on health and disease. This information will, ultimately, lead to the development of novel and/or more adequate preventive and therapeutic approaches, as well as diagnostic applications in Periodontics. The data observed in this study support the concept that the oral cavity may be a reservoir for superinfecting bacteria. In addition to putative periodontal pathogens, nonoral species such as A. baumannii and P. aeruginosa, either associated or not with oral pathogens may also play a role in the etiopathogenesis of periodontal diseases. REFERENCES Al-Ahmad, A., Muller, N., Wiedmann-Al-Ahmad, M., Sava, I., Hubner, J., Follo, M., Schirrmeister, J. & Hellwig, E. (2009) Endodontic and salivary isolates of Enterococcus faecalis integrate into biofilm from human salivary bacteria cultivated in vitro. Journal of Endodontics 35, Andersen RN, Ganeshkumar N, Kolenbrander PE. (1998) Helicobacter pylori adheres selectively to Fusobacterium spp. Oral Microbiology and Immunology 13, Barbosa, F. C., Mayer, M. P., Saba-Chujfi, E. & Cai, S. (2001) Subgingival occurrence and antimicrobial susceptibility of enteric rods and pseudomonads from Brazilian periodontitis
114 92 patients. Oral Microbiology and Immunology 16, Botero, J. E., Arce, R. M., Escudero, M., Betancourth, M., Jaramillo, A. & Contreras, A. (2007a) Frequency of detection of periodontopathic and superinfecting bacteria in HIVpositive patients with periodontitis. Journal of International Academy of Periodontology 9, Botero, J. E., Contreras, A., Lafaurie, G., Jaramillo, A., Betancourt, M. & Arce, R. M. (2007b) Occurrence of periodontopathic and superinfecting bacteria in chronic and aggressive periodontitis subjects in a Colombian population. Journal of Periodontology 78, Colombo, A. P., Boches, S. K., Cotton, S. L., Goodson, J. M., Kent, R., Haffajee, A. D., Socransky, S. S., Hasturk, H., Van Dyke, T. E., Dewhirst, F. & Paster, B. J. (2009) Comparisons of subgingival microbial profiles of refractory periodontitis, severe periodontitis, and periodontal health using the human oral microbe identification microarray. Journal of Periodontology 80, Colombo, A. P., Haffajee, A. D., Dewhirst, F. E., Paster, B. J., Smith, C. M., Cugini, M. A. & Socransky, S. S. (1998) Clinical and microbiological features of refractory periodontitis subjects. Journal of Clinical Periodontology 25, Colombo, A. P., Teles, R. P., Torres, M. C., Souto, R., Rosalem, W. J., Mendes, M. C. & Uzeda, M. (2002) Subgingival microbiota of Brazilian subjects with untreated chronic periodontitis. Journal of Periodontology 73, Costerton, J. W. (1999) Introduction to biofilm. International Journal of Antimicrobial Agents 11, ; discussion Dahlen, G. & Wikstrom, M. (1995) Occurrence of enteric rods, staphylococci and Candida
115 93 in subgingival samples. Oral Microbiology and Immunology 10, Fritschi, B. Z., Albert-Kiszely, A. & Persson, G. R. (2008) Staphylococcus aureus and other bacteria in untreated periodontitis. Journal of Dental Research 87, Goncalves, L., Souto, R. & Colombo, A. P. (2009) Detection of Helicobacter pylori, Enterococcus faecalis, and Pseudomonas aeruginosa in the subgingival biofilm of HIVinfected subjects undergoing HAART with chronic periodontitis. European Journal of Clinical Microbiology and Infectious Diseases 28, Goncalves Lde, S., Soares Ferreira, S. M., Souza, C. O., Souto, R. & Colombo, A. P. (2007) Clinical and microbiological profiles of human immunodeficiency virus (HIV)- seropositive Brazilians undergoing highly active antiretroviral therapy and HIVseronegative Brazilians with chronic periodontitis. Journal of Periodontology 78, Haffajee, A. D., Cugini, M. A., Dibart, S., Smith, C., Kent, R. L., Jr. & Socransky, S. S. (1997) The effect of SRP on the clinical and microbiological parameters of periodontal diseases. Journal of Clinical Periodontology 24, Haffajee, A. D., Bogren, A., Hasturk, H., Feres, M., Lopez, N. & Socransky, S. S. (2004) Subgingival microbiota of chronic periodontitis subjects from different geographic locations. Journal of Clinical Periodontology 31, Herrera, D., Contreras, A., Gamonal, J., Oteo, A., Jaramillo, A., Silva, N., Sanz, M., Botero, J. E. & Leon, R. (2008) Subgingival microbial profiles in chronic periodontitis patients from Chile, Colombia and Spain. Journal of Clinical Periodontology 35, Holt, S. C. & Ebersole, J. L. (2005) Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia: the "red complex", a prototype polybacterial pathogenic consortium in periodontitis. Periodontology ,
116 94 Jacinto, R. C., Gomes, B. P., Desai, M., Rajendram, D. & Shah, H. N. (2007) Bacterial examination of endodontic infections by clonal analysis in concert with denaturing highperformance liquid chromatography. Oral Microbiology and Immunology 22, Johnson, E. M., Flannagan, S. E., Sedgley, C. M. (2006) Coaggregation interactions between oral and endodontic Enterococcus faecalis and bacterial species isolated from persistent apical periodontitis. Journal of Endodontics 32, Kolenbrander, P. E., Palmer, R. J., Jr., Rickard, A. H., Jakubovics, N. S., Chalmers, N. I. & Diaz, P. I. (2006) Bacterial interactions and successions during plaque development. Periodontology , Lafaurie, G. I., Contreras, A., Baron, A., Botero, J., Mayorga-Fayad, I., Jaramillo, A., Giraldo, A., Gonzalez, F., Mantilla, S., Botero, A., Archila, L. H., Diaz, A., Chacon, T., Castillo, D. M., Betancourt, M., Del Rosario Aya, M. & Arce, R. (2007) Demographic, clinical, and microbial aspects of chronic and aggressive periodontitis in Colombia: a multicenter study. Journal of Periodontology 78, Lau, P. C., Lindhout, T., Beveridge, T. J., Dutcher, J. R. & Lam, J. S. (2009) Differential lipopolysaccharide core capping leads to quantitative and correlated modifications of mechanical and structural properties in Pseudomonas aeruginosa biofilms. Journal of Bacteriology 191, Li, X., Kolltveit, K. M., Tronstad, L. & Olsen, I. (2000) Systemic diseases caused by oral infection. Clinical Microbiology Reviews 13, Loehfelm, T. W., Luke, N. R. & Campagnari, A. A. (2008) Identification and characterization of an Acinetobacter baumannii biofilm-associated protein. Journal of Bacteriology 190,
117 95 Moore, W. E., Holdeman, L. V., Cato, E. P., Smibert, R. M., Burmeister, J. A., Palcanis, K. G. & Ranney, R. R. (1985) Comparative bacteriology of juvenile periodontitis. Infection and Immunity 48, Okuda K, Kimizuka R, Katakura A, Nakagawa T, Ishihara K. (2003) Ecological and immunopathological implications of oral bacteria in Helicobacter pylori-infected disease. Journal of Periodontology 74, Page, R. C. & Kornman, K. S. (1997) The pathogenesis of human periodontitis: an introduction. Periodontology , Passador, L., Cook, J. M., Gambello, M. J., Rust, L. & Iglewski, B. H. (1993) Expression of Pseudomonas aeruginosa virulence genes requires cell-to-cell communication. Science 260, Paster, B. J., Olsen, I., Aas, J. A. & Dewhirst, F. E. (2006) The breadth of bacterial diversity in the human periodontal pocket and other oral sites. Periodontology , Persson, G. R., Hitti, J., Paul, K., Hirschi, R., Weibel, M., Rothen, M. & Persson, R. E. (2008) Tannerella forsythia and Pseudomonas aeruginosa in subgingival bacterial samples from parous women. Journal of Periodontology 79, Pratt, L. A. & Kolter, R. (1998) Genetic analysis of Escherichia coli biofilm formation: roles of flagella, motility, chemotaxis and type I pili. Molecular Microbiology 30, Ramseier, C. A., Kinney, J. S., Herr, A. E., Braun, T., Sugai, J. V., Shelburne, C. A., Rayburn, L. A., Tran, H. M., Singh, A. K. & Giannobile, W. V. (2009) Identification of pathogen and host-response markers correlated with periodontal disease. Journal of Periodontology 80,
118 96 Reddy, M. S. (2007) Reaching a better understanding of non-oral disease and the implication of periodontal infections. Periodontology , Rodriguez-Bano, J., Marti, S., Soto, S., Fernandez-Cuenca, F., Cisneros, J. M., Pachon, J., Pascual, A., Martinez-Martinez, L., McQueary, C., Actis, L. A. & Vila, J. (2008) Biofilm formation in Acinetobacter baumannii: associated features and clinical implications. Clinical Microbiology and Infection 14, Scannapieco, F. A. (1998) Position paper of The American Academy of Periodontology: periodontal disease as a potential risk factor for systemic diseases. Journal of Periodontology 69, Sedgley, C., Buck, G. & Appelbe, O. (2006) Prevalence of Enterococcus faecalis at multiple oral sites in endodontic patients using culture and PCR. Journal of Endodontics 32, Sedgley, C. M., Lennan, S. L. & Clewell, D. B. (2004) Prevalence, phenotype and genotype of oral enterococci. Oral Microbiology and Immunology 19, Slots, J., Feik, D. & Rams, T. E. (1990) Prevalence and antimicrobial susceptibility of Enterobacteriaceae, Pseudomonadaceae and Acinetobacter in human periodontitis. Oral Microbiology and Immunology 5, Slots, J., Rams, T. E. & Listgarten, M. A. (1988) Yeasts, enteric rods and pseudomonads in the subgingival flora of severe adult periodontitis. Oral Microbiology and Immunology 3, Slots, J. & Ting, M. (1999) Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis in human periodontal disease: occurrence and treatment. Periodontology ,
119 97 Smith, A. J., Jackson, M. S. & Bagg, J. (2001) The ecology of Staphylococcus species in the oral cavity. Journal of Medical Microbiology 50, Socransky, S. S., Haffajee, A. D., Cugini, M. A., Smith, C. & Kent, R. L., Jr. (1998) Microbial complexes in subgingival plaque. Journal of Clinical Periodontology 25, Socransky, S. S., Smith, C., Martin, L., Paster, B. J., Dewhirst, F. E. & Levin, A. E. (1994) "Checkerboard" DNA-DNA hybridization. Biotechniques 17, Souto, R. & Colombo, A. P. (2008a) Detection of Helicobacter pylori by polymerase chain reaction in the subgingival biofilm and saliva of non-dyspeptic periodontal patients. Journal of Periodontology 79, Souto, R. & Colombo, A. P. (2008b) Prevalence of Enterococcus faecalis in subgingival biofilm and saliva of subjects with chronic periodontal infection. Archives of Oral Biology 53, Souto, R., de Andrade, A. F. B., Uzeda, M. & Colombo, A. P. V. (2006) Prevalence of "non-oral" pathogenic bacteria in subgingival biofilm of subjects with chronic periodontitis. Brazilian Journal of Microbiology 37, Subramanian, K. & Mickel, A. K. (2009) Molecular analysis of persistent periradicular lesions and root ends reveals a diverse microbial profile. Journal of Endodontics 35, Wara-aswapati, N., Pitiphat, W., Chanchaimongkon, L., Taweechaisupapong, S., Boch, J. A. & Ishikawa, I. (2009) Red bacterial complex is associated with the severity of chronic periodontitis in a Thai population. Oral Diseases 15,
120 98 Watanabe, K., Senba, M., Ichinose, A., Yamamoto, T., Ariyoshi, K. & Matsumoto, K. (2009) Bactericidal activity in filtrated supernatant of Streptococcus sanguinis against multidrug-resistant Pseudomonas aeruginosa. Tohoku Journal of Experimental Medicine 219, Ximenez-Fyvie, L. A., Almaguer-Flores, A., Jacobo-Soto, V., Lara-Cordoba, M., Moreno- Borjas, J. Y. & Alcantara-Maruri, E. (2006a) Subgingival microbiota of periodontally untreated Mexican subjects with generalized aggressive periodontitis. Journal of Clinical Periodontology 33, Ximenez-Fyvie, L. A., Almaguer-Flores, A., Jacobo-Soto, V., Lara-Cordoba, M., Sanchez- Vargas, L. O. & Alcantara-Maruri, E. (2006b) Description of the subgingival microbiota of periodontally untreated Mexican subjects: chronic periodontitis and periodontal health. Journal of Periodontology 77, Yarwood, J. M. & Schlievert, P. M. (2003) Quorum sensing in Staphylococcus infections. Journal of Clinical Investigation 112, ACKNOWLEDGMENTS This study was supported in part by National Council for Scientific and Technological Development (CNPq), Coordination of Improvement of Higher Education Personnel (CAPES), Brasilia, Brazil; and Foundation for Research Financial Support in the State of Rio de Janeiro (FAPERJ), Rio de Janeiro, Brazil. The authors declare that they do not have any conflict of interest regarding the present study.
121 99 Table 1. Demographic and periodontal clinical data of the study population (n = 402). Groups PH G CP AP P Variables (n = 51) (n = 42) (n = 219) (n = 90) Gender (% females) * Non smokers (%) Former/Current Smokers (%) < * Mean (±SEM): Age 30.6 ± ± ± ± 0.6 < PD (mm) 1.8 ± ± ± ± 0.09 < CAL (mm) 1.7 ± ± ± ± 0.12 < % of sites with: BOP 4.0 ± ± ± ± 3.1 < SB 13.1 ± ± ± ± 2.5 < PD 5 mm ± ± 1.9 < PH: periodontal health; G: gingivitis: CP: chronic periodontitis; AP: aggressive periodontitis; PD: probing depth; CAL: clinical attachment level, BOP: bleeding on probing; SB: supragingival biofilm; Kruskal-Wallis test; * 2 test; Mann-Whitney test between CP and AP groups.
122 Table 2. Linear regression of the association between demographic variables and prevalence (Analysis 1) or levels (Analysis 2) of bacterial species and periodontal clinical parameters adjusted for age and smoking status. Dependent variables Predictor variables Mean % PD 5 mm Mean % CAL 5 mm Mean % BOP Mean % SB Analysis 1 Age NI (<0.001)** (0.012) (0.001) Smoking* NI NI NI (<0.001) Mean % red complex (<0.001) (<0.001) (<0.001) (<0.001) Mean % P. aeruginosa (<0.001) (<0.001) (<0.001) NI Mean % S. aureus (0.002) (0.002) NI NI Mean % E. coli NI NI (0.006) NI Adjusted R Analysis 2 Age (0.002) (<0.001) (<0.001) (<0.001) Smoking* NI (0.037) NI (<0.001) Mean counts A. baumannii (<0.001) (<0.001) NI NI Mean counts E. faecalis NI NI NI (<0.001) Mean counts P. aeruginosa (<0.001) (<0.001) (0.006) NI Mean counts S. aureus (<0.001) (<0.001) NI NI Adjusted R * Smoker = 1, Never-smoker = 0; ** standardized β coefficient (p value); NI: not included in the final model for the referred dependent variable; PD: pocket depth; CAL: clinical attachment level; BOP: bleeding on probing; SB: supragingival biofilm; Aa: Aggregatibacter actinomycetemcomitans.
123 101 Table 3. Logistic regression analysis (forward Wald) of microbiological parameters in periodontally healthy and periodontitis/gingivitis subjects. Variables β OR* Lower Upper p Constant < Age < Red complex < Interaction Aa by E < Interaction Aa by P < *Reference: Periodontally healthy; Aa: Aggregatibacter actinomycetemcomitans
124 102 Figure legends Figure 1. Clustered bar chart of percentage of sites colonized (a) and mean bacterial counts (in log 10; b) of Aggregatibacter actinomycetemcomitans (Aa), red complex, and non-oral species in subjects with periodontal health (PH), gingivitis (G), chronic (CP), and aggressive (AP) periodontitis. * p < 0.05, ** p < 0.01, refers to significant differences among groups (Kruskal-Wallis test). Figure 2. Bar chart of the frequency of subjects carrying the red complex in the subgingival microbiota. PH: periodontal health (n = 6); G: gingivitis (n = 11); CP: chronic periodontitis (n = 143); AP: aggressive periodontitis (n = 62). 2 test, p < Figure 3. Bar chart of the odds ratio (OR) for having aggressive periodontitis in comparison to chronic periodontitis conferred by the presence of Aggregatibacter actinomycetemcomitans (Aa), Acinetobacter baumannii, and Red complex + Pseudomonas aeruginosa 10 4 cells.
125 103 Figure 1a E. coli S. aureus** AP (N=90) CP (N=219) G (N=42) PH (N=51) P. aeruginosa E. faecalis* A. baumannii** red complex** Aa* mean % of sites
126 104 Figure 1b E. coli S. aureus** P. aeruginosa E. faecalis** A. baumanii** red complex** Aa** Mean counts in log 10
127 105 Figure 2 AP CP G PH % of subjects with red complex
128 106 Figure 3 Aa 9.14 Red complex + P. aeruginosa 6.80 A. baumannii OR
129 107 Subgingival microbiota as a risk indicator for periodontal disease Running title: Microbial risk indicators Carina Maciel da Silva-Boghossian 1, Débora Heller 1, Ronir R. Luiz 2, Ana Paula Vieira Colombo 3 1 Department of Dental Clinic, Division of Graduate Periodontics, Dental School; 2 Institute of Public Health Studies; 3 Institute of Microbiology, Federal University of Rio de Janeiro, Rio de Janeiro, Brazil. Corresponding author: Carina M. Silva-Boghossian, Rua Barão de Guaratiba, 228, Glória, Rio de Janeiro, RJ, Cep , Phone/ Fax: , carinabogho@hotmail.com. Key Words: subgingival microbiota; risk indicators; periodontal disease; checkerboard. Conflict of interest and source of funding: The authors declare that they have no conflict of interests. This work was supported in part by National Council for Scientific and Technological Development (CNPq), and Coordination of Improvement of Higher Education Personnel (CAPES), Brasilia, Brazil; and Foundation for Research Financial Support in the State of Rio de Janeiro (FAPERJ), Rio de Janeiro, Brazil. Clinical relevance Scientific rationale for the study: The existence of specific microbial profiles that can distinguish different forms of periodontal diseases in these populations remains controversial. Thus, it seems reasonable to determine which species could be considered microbial risk indicators for periodontal disease, and which could discriminate chronic from aggressive periodontitis subjects.
130 108 Principal findings: The data showed that P. gingivalis and T. forsythia were the species most frequently detected among studied subjects. Additionally, high frequency of detection of T. forsythia, C. rectus, F. n. sp. polymorphum, and V. parvula increased the risk for periodontitis. Furthermore, a subject had a higher risk of developing aggressive periodontitis when harboring lower prevalence of S. aureus and higher prevalence of V. parvula. Practical implications: The findings showed that S. aureus and V. parvula along with members of orange and red complexes were strongly associated with periodontitis, indicating that those species might have an important role in the dynamics of the subgingival microbiota and periodontal pathogenesis.
131 109 ABSTRACT Aim: The aim of the present study was to evaluate the subgingival microbiota of subjects with periodontal health and periodontal disease, and to investigate species that could be risk indicators for periodontal disease. Methods: Subgingival biofilm samples were obtained from 402 subjects (health = 51; gingivitis = 42; chronic periodontitis = 219; aggressive periodontitis = 90) and analyzed for the presence of 43 bacterial strains by the checkerboard method. Results: The most frequently detected species was T. forsythia (51%); whereas the levels of P. gingivalis and T. forsythia were detected in the greatest levels ( 10 6 cells). High frequency of detection of T. forsythia (Odds Ratio [OR] 1.84, p 0.007), C. rectus (OR 1.07, p = 0.002), F. n. sp. polymorphum (OR 1.04, p = 0.032), and V. parvula (OR 1.03, p = 0.010) increased the risk for periodontitis. A subject had a higher risk of developing aggressive periodontitis when harboring lower prevalence of S. aureus (OR 0.92, p = 0.046) and higher prevalence of V. parvula (OR 1.03, p = 0.044). Conclusion: Some species, as S. aureus and V. parvula along with members of orange and red complexes were strongly associated with periodontitis.
132 110 INTRODUCTION Periodontal diseases are bacterial infections associated with a complex microbiota of the dental biofilm (Socransky & Haffajee 2005) that will induce a local and systemic inflammatory response, leading to periodontal tissue destruction (Page & Eke 2007). Socransky et al (Socransky, et al. 1998) proposed that periodontal diseases are associated with a consortium of organisms rather than individual pathogens at periodontal sites. They defined five microbial complexes (red, orange, yellow, green, and purple) repeatedly found together in subgingival biofilm of subjects with and without periodontal diseases (Socransky et al. 1998). The red complex, which appears later in biofilm development, comprises three species, Tannerella forsythia, Porphyromonas gingivalis and Treponema denticola. That complex has been considered the most pathogenic microbial complex for periodontal disease (Holt & Ebersole 2005; Socransky et al. 1998). Over the years, several beneficial and pathogenic species have been recognized; however, only few species such as Aggregatibacter actinomycetemcomitans (Aa) and P. gingivalis are actually considered putative periodontal pathogens (Moore et al. 1985; Slots & Ting 1999). Worldwide studies on the periodontal microbiota have reported a great variability in the proportions and levels of many subgingival species among subjects from different geographic locations (Colombo et al. 2002; Haffajee et al. 2004; Herrera, et al. 2008; Lopez et al. 2004; Ximenez-Fyvie et al., 2006a; Ximenez-Fyvie et al., 2006b). Although much of the differences among these studies may result from differences in sampling, methods of bacterial identification and clinical criteria for defining periodontal status, it is conceivable that genetic background, cultural and behavioral factors account for some of the variability observed in the subgingival microbiota of distinct populations (Haffajee et al. 2004).
133 111 Using the same methodology for bacterial detection, our group and other investigators have demonstrated that individuals from Mexico and other Latin America countries presenting different forms of periodontitis harbor a very complex periodontal microbiota, comprising high levels of putative periodontal pathogens, as well as nonoral bacterial species (Barbosa et al. 2001; Colombo et al. 2002; de Souza Goncalves et al. 2009; Faveri et al. 2009; Goncalves Lde et al. 2007; Herrera et al. 2008; Lopez et al. 2004; Souto & Colombo 2008a; Souto & Colombo 2008b; Souto et al. 2006; Ximenez- Fyvie et al. 2006a; Ximenez-Fyvie et al. 2006b). Nevertheless, the existence of specific microbial profiles that can distinguish different forms of periodontal diseases in these populations remains controversial. Thus, it seems reasonable to determine which species could be considered microbial risk indicators for periodontal disease, and which could discriminate chronic from aggressive periodontitis subjects. The aim of the present study was to evaluate the subgingival microbiota of subjects with periodontal health and different forms of periodontal disease, and to investigate species that could be risk indicators for periodontal disease in a sample of Brazilian subjects. MATERIAL AND METHODS Subject Population Four hundred-two sequential subjects who sought dental treatment between 2005 and 2009 at the Dental School of the Federal University of Rio de Janeiro were enrolled in the present study. All participants were informed about the nature of the study and a signed consent form was obtained from each individual prior to the entry into the study. The study protocol was reviewed and approved by the Review Committee for Human
134 112 Subjects of the Clementino Fraga Filho University Hospital of the Federal University of Rio de Janeiro. Clinical evaluation At the first visit, subjects were submitted to anamnesis questionnaire, and data about age, gender and smoking habit were obtained. Smoking status was recorded as never-smoker and smoker (current or former smokers). All subjects had at least 14 teeth and 18 years of age. Exclusion criteria included pregnancy, nursing, periodontal therapy and use of antibiotics within the previous six months, as well as any systemic condition that could affect the progression of periodontitis. Individuals who required antibiotic coverage for routine periodontal procedures were also excluded. Clinical examinations were performed by calibrated examiners. The intraclass correlation coefficient for clinical attachment level (CAL) at the site ranged between 0.90 and 0.97, and for probing depth (PD), ranged between 0.80 and Full-mouth measurements including PD, CAL, presence or absence of supragingival biofilm (SB) and bleeding on probing (BOP) were recorded at six sites per tooth (distobuccal, mesiobuccal, mesiobuccal, distolingual, lingual, mesiolingual), excluding third molars. Clinical diagnosis of periodontal status was established for all subjects based on the following criteria: periodontal health (PH), 10% of sites with BOP, no PD or CAL > 3 mm, although PD or CAL = 4 mm in up to 5% of the sites without BOP was allowed; gingivitis (G), > 10% of sites with BOP, no PD or CAL > 3 mm, although PD or CAL = 4 mm in up to 5% of the sites without BOP was allowed; chronic periodontitis (CP), > 10% of teeth with PD and/or CAL 5 mm and BOP; aggressive periodontitis (AP), 30% of teeth with PD and/or CAL 5 mm with BOP, including at least one incisor and one first molar, and 39 years of age.
135 113 Microbiological assessment Subgingival biofilm samples were taken from 7 healthy sites in PH, 7 bleeding sites in G subjects, and 14 sites (7 periodontal pockets and 7 healthy sites) in PC and PA subjects. The presence and levels of bacterial species were determined in the biofilm samples by genomic DNA probes and Checkerboard DNA-DNA hybridization method (Socransky et al. 1994). The bacterial strains detected by DNA probes are described in Table 1. Aggregatibacter actinomycetemcomitans (Aa) serotypes a, b and c, and Propionibacterium acnes 1 and 2 were pooled into two DNA probes for the two species, respectively. After removal of supragingival biofilm, subgingival biofilm samples were taken using individual sterile Gracey curettes (Hu-Friedy, Chicago, IL, USA), and were placed in individual tubes. The cells were lysed and denatured DNA fixed on a nylon membrane (GE Healthcare Life Science, São Paulo, SP, Brazil) using the Minislot 30 device (Immunetics, Cambridge, MA, USA). The membrane was placed in a Miniblotter 45 (Immunetics) with the lanes of DNA at 90 to the lanes of the device, and hybridized against digoxigenin-labeled (Roche Applied Science, São Paulo, SP, Brazil) whole genomic DNA probes for the selected species. After hybridization, the membranes were washed at high stringency and bound probes were detected using phosphatase-conjugated antibody to digoxigenin (Roche Applied Science) and fluorescence captured by the Storm 860 imaging system (GE Healthcare Life Science). Signals were evaluated visually by comparison with the standards at 10 5 and 10 6 bacterial cells for the test species on the same membrane. They were recorded as: 0, not detect; 1, < 10 5 cells; 2, approximately 10 5 ; 3, 10 5 to 10 6 ; 4, approximately 10 6, and 5, >10 6 cells. The sensitivity of the assay was adjusted to permit the detection of 10 4 cells of a given species by adjusting the concentration of each DNA probe.
136 114 Statistical analysis Statistical analyses were performed using the Statistical Package for the Social Sciences (SPSS, release 17.0, Chicago, IL, USA). Microbiological data were expressed as mean prevalence, mean proportion, and mean counts of a species in a subject, and then within the clinical groups. In the prevalence analysis, only the presence of the microorganism was considered. The levels (scores 0 to 5) of each species in a sample were converted to absolute numbers and log 10 transformed for presentation in graphics. The proportion of a species in a sample was determined by calculating the proportions of a species DNA in the total DNA of a sample. Differences in the prevalence, levels or proportions of bacterial species among groups were determined by Kruskal-Wallis and Mann-Whitney tests. For those analyses, adjustments for multiple comparisons were made as described by Socransky et al. (Socransky et al. 1991). In brief, an overall p of 0.05=1-(1-k) 43 was computed where k was the desired individual p value. Thus, from this computation, a p value was considered to be statistically significant at p < Bacterial risk indicators for periodontitis were investigated using univariate and multivariate logistic regression analyses. Only variables showing significance in the univariate model were included in the multivariate stepwise (forward Wald) procedure to calculate odds ratio (OR) and 95% confidence intervals (CI). Statistical significance was reached at a 5% level. RESULTS
137 115 Demographic and periodontal clinical data of the 402 individuals from this study population (PH = 51; G = 42; CP = 219; AP = 90) is described in a previous. Figure 1 shows the mean counts (in log 10), the proportion of the total DNA probe counts, and the mean prevalence of all the species examined. Overall, the most frequently detected species was T. forsythia (51%); whereas P. gingivalis and T. forsythia were detected in the greatest counts ( 10 6 cells). The species Aa, A. gerencseriae, A. naeslundii, A. viscosus, A. odontolyticus, V. parvula, S. intermedius, S. gordonii, S. oralis, E. nodatum, C. rectus, F. nuc. ss. polymorphum, F. nuc. ss. vicentii, P. intermedia, P. micra, P. nigrescens, S. constellatus, P. gingivalis, T. forsythia, T. denticola, L. buccalis, S. noxia, P. acnes, P. melaninogenica, and S. aureus differed significantly among groups regarding mean counts, proportion of DNA probe counts and mean prevalence (adjusted p , Kruskal-Wallis test). A. israelii, C. showae, and F. nuc. ss. nucleatum differed among groups in mean counts and proportion (p ), whereas S. mitis differed in proportion and mean prevalence, and C. gingivalis only in mean prevalence (p ). Analysis between PH and G showed no differences regarding counts, proportion of DNA or prevalence of the studied species (Mann-Whitney test). On the other hand, when the microbiota of PH and periodontitis (CP + AP) subjects were compared, the species Aa, A. naeslundii, A. odontolyticus, V. parvula, S. gordonii, S. oralis, C. showae, C. sputigena, C. rectus, E. nodatum, F. polymorphum, P. intermedia, P. acnes, P. micra, P. melaninogenica, P. nigrescens, S. constellatus, P. gingivalis, T. forsythia, T. denticola, and S. noxia showed significantly higher levels, proportion and prevalence in the diseased subjects than in PH subjects, whereas, C. gingivalis and F. nuc. ss. vicentii were detected in higher counts and proportions in the PH group (p ). Other species that were significantly more prevalent in periodontitis subjects were F. nuc. ss. nucleatum, L. buccalis and S.
138 116 intermedius. When subjects with gingivitis were compared to periodontitis (CP + AP) subjects, it was observed that the periodontitis group had significantly higher levels, proportions and/or prevalence of A. naeslundii, A. viscosus, V. parvula, S. gordonii, S. oralis, E. nodatum, F. nuc. ss. vicentii, P. micra, P. nigrescens, P. gingivalis, T. forsythia, T. denticola, S. noxia, P. intermedia, P. acnes and S. constellatus. Comparisons between CP and AP subjects showed that the species A. gerencseriae and A. israelii were detected in significantly higher mean counts and proportions in the AP than CP group (p ); while S. aureus presented higher counts, proportion and prevalence in CP (p ). Logistic regression analysis (forward Wald) was used to examine the associations between the frequency of detection of bacterial species and periodontal status. Table 2 shows the bacterial species included in the final model in order to distinguish between periodontitis (CP + AP) and PH. Along with smoking and age, the species Aa, A. naeslundii, A. odontolyticus, V. parvula, C. rectus, C. gingivalis, C. showae, C. sputigena, E. corrodens, E. nodatum, F. n. sp. polymorphum, F. n. ss. vicentii, F. n. ss. nucleatum, P. intermedia, P. nigrescens, P. micra, S. constellatus, P. melaninogenica, T. forsythia, P. gingivalis, T. denticola, S. intermedius, S. gordonii, S. oralis, S. sanguinis, S. noxia, P. acnes, and L. buccalis showed significance at p < 0.05 in the univariate model and were entered in the multivariate logistic regression analysis (data not shown). Subjects presenting high frequencies of T. forsythia, C. rectus and F. n. sp. polymorphum were more likely to present periodontitis than PH (Table 2); whereas high frequencies of E. corrodens and S. sanguinis decreased the risk for disease. Table 3 shows the bacterial species included in the final model to assess the risk of having periodontitis (CP + AP) compared to gingivitis. Along with age, the species
139 117 A. naeslundii, A. viscosus, V. parvula, C. rectus, E. nodatum, F. n. ss. vicentii, P. intermedia, P. micra, P. nigrescens, S. intermedius, S. gordonii, S. oralis, P. gingivalis, T. forsythia, T. denticola, S. noxia and P. melaninogenica were entered in the multivariate logistic regression analysis (data not shown). The final step of the analysis showed that older subjects presenting high frequencies of T. forsythia and V. parvula were at higher risk for periodontitis. In order to distinguish CP from AP based on microbiological profiles, multivariate logistic regression (Table 3) was performed to assess the risk for AP including species that showed significance in the univariate model (data no shown). The species that were included in the multivariate analysis along with age and smoking were A. gerencseriae, V. parvula, E. nodatum, T. forsythia, P. micra, S. mitis, S. aureus, and E. faecalis. The predictor variables that were entered in the logistic regression model by forward Wald method indicated that younger individuals, non-smokers and with high frequencies of V. parvula had higher risk to present AP than CP. Discussion The present study evaluated the subgingival microbiota of subjects with periodontal health and disease. Moreover, additional analyses were performed to investigate species that could be risk indicators for periodontal disease. The search for microbial risk indicators can help in discriminating subjects at higher risk for periodontal disease development. Furthermore, subgingival species detection (prevalence and/or their levels) that could be confirmed as disease diagnosis-marker would make easier the establishment of the diagnosis for subjects considered to be outliers (Fritschi et al. 2008; Page & Eke 2007). For example, some subjects may
140 118 present no clear periodontal clinical features capable of distinguishing aggressive from chronic forms of disease. Another gray zone is when a gingivitis subject becomes a slight periodontitis patient. As described in a previous study by Colombo et al. (Colombo et al. 2002), the current findings showed that the target population with untreated periodontal disease harbored high prevalence and levels of periodontal pathogens in the subgingival microbiota. In fact, approximately 50% of the species tested were found in significantly higher levels and frequencies in chronic/ aggressive periodontitis subjects than health individuals. Similar data have been reported by other investigators (Haffajee et al. 2004; Herrera et al. 2008; Ximenez-Fyvie et al. 2006a; Ximenez-Fyvie et al. 2006b). Of interest, we also found the pathogenic species T. forsythia and P. gingivalis to be the most predominant species in our study population, comprising the four clinical groups. The subgingival microbiota of individuals with gingivitis presented itself as a transition form from health to periodontitis. While no significant differences of the microbiota between healthy and gingivitis subjects were found, comparisons between G and periodontitis showed that only few species (16/ 43) were significantly higher in periodontitis subjects. Considering only the species tested in the current investigation, it is in accordance with the study of Persson et al., which showed that only P. aeruginosa differed between gingivitis and periodontally healthy subjects (Persson et al. 2008). When the authors compared proportion of species in periodontitis and no periodontitis subjects, they found the same results for Aa, A. odontolyticus, P. gingivalis, S. constellatus and T. forsythia as the current study. Logistic regression analysis to evaluate the risk of a subject of having periodontitis compared to periodontal health showed that high prevalence of members
141 119 of the orange (C. rectus and F. n. sp. polymorphum) and red (T. forsythia) complexes increases the risk to disease (Table 2). On the other hand, high frequencies of E. corrodens and S. sanguinis decreased the risk for periodontal disease. Considering that streptococcal species are early colonizers followed by E. corrodens among other species, it is expected that they are more related to healthy subjects (Socransky et al. 1998). In contrast, other investigators have found a greater risk for periodontitis patients to harbor high levels of E. corrodens compared to subjects with periodontal health (Haffajee et al. 2006; Lafaurie et al. 2007). We also showed that the risk of a subject with gingivitis to have periodontitis increased when presenting high frequency of T. forsythia (OR 1.04) and V. parvula (OR 1.03). The present data corroborate the association of orange and red complexes with disease status (Holt & Ebersole 2005; Socransky et al. 1998). The association of T. forsythia and C. rectus with periodontitis was also demonstrated in Colombian subjects. The risk of harboring these bacteria was sixty and six times, respectively, higher in periodontitis subjects (Lafaurie et al. 2007). Offenbacher et al. proposed a model to predict periodontal disease and found that P. gingivalis was the best single predictor for different degrees of periodontitis (Offenbacher et al. 2007). In addition, IgG antibodies to P. gingivalis and C. rectus were the two best immunological predictors of moderate and severe periodontitis. The comparison between the subgingival microbiota of CP and AP showed that AP presented significantly greater counts and prevalence of A. gerencseriae and A. israelii but lower levels and frequency of S. aureus. Fritschi et al. (Fritschi et al. 2008) found a similar result for A. israelii, however, the authors found higher levels of S. aureus in aggressive subjects. Other studies have demonstrated that other species differed between chronic and aggressive periodontitis subjects (Ximenez-Fyvie et al. 2006b; Faveri et al. 2009; Lafaurie et al. 2007). For instance, Faveri et al. showed that
142 120 CP had higher proportion of A. naeslundii 1 than AP subjects. Moreover, generalized AP subjects presented higher proportions of F. n. sp. polymorphum and P. gingivalis compared to CP and localized AP subjects. On the other hand, localized AP subjects presented higher proportions of Aa than CP and generalized AP subjects (Faveri et al. 2009). Lafaurie et al. have also showed that Aa was significantly more frequent in the AP (30.1%) group compared to the CP (16.5%) group (Lafaurie et al. 2007). Surprisingly, we did not find significant differences regarding Aa between periodontitis groups in prevalence (47.8% in CP and 52.9% in AP), levels (log 5.3 in CP and log 5.7 in AP) and proportions (0.15% in CP and 0.45% in AP). Also, this species did not remain in the final logistic regression model of risk for AP. Overall, the prevalence and counts of Aa in our population were markedly higher than the ones observed in other study populations (Botero et al. 2007; Herrera et al. 2008; Lafaurie et al. 2007), corroborating the findings reported by Colombo et al., which had reported a mean frequency of Aa of 41% and 25% for CP and PH subjects, respectively (Colombo 2002). Differences regarding colonization of Aa and its association with aggressive forms of periodontitis might be related to geography and/or ethnic groups (Cortelli et al., 2005; Rosalem Jr. et al. 2006; Rylev & Kilian 2008). Moreover, different virulent clonal types or serotypes of Aa may predominate in different types of periodontitis (Cortelli et al. 2005; Rosalem Jr. et al. 2006; Rosalem Jr. et al. 2006; Tinoco et al. 1998). Although no significant differences between AP and CP regarding Aa were observed in the current study, it is possible that highly virulent clonal types were predominant in the AP group. A probe that could distinguish clonal types would be useful to clarify the role of Aa in the subgingival microbiota of a given population (Haffajee et al. 2006).
143 121 A decreased risk for AP was associated with a high frequency of S. aureus (OR 0.92), whereas an increased risk was related to a high frequency of V. parvula (OR 1.03). Smoking and age appeared in the final logistic regression step, however, they decreased the risk for AP. This result may be due to the fact that we had older subjects and a great proportion of smokers in the CP group. Fritschi et al. demonstrated that S. aureus along with P. intermedia had the best ability to differentiate the periodontal diagnosis when smoking was included in the analysis (Fritschi et al. 2008). Although V. parvula is usually detected in elevated proportions in the subgingival microbiota, this species is considered a host-compatible species (Colombo, et al. 2002; Haffajee et al. 2006; Ximenez-Fyvie et al. 2006a). Conversely, we showed that periodontitis subjects had higher prevalence and levels of that species compared to PH individuals. Ximenez- Fyvie et al. reported that healthy subjects harbored higher levels of V. parvula, however, periodontitis subjects presented higher prevalence (Ximenez-Fyvie et al. 2006a). In vitro studies have shown that V. parvula, a Gram-negative anaerobic microorganism, grown in biofilms in association with other species decrease their susceptibility to chlorhexidine and antimicrobials (Kara et al. 2006; Luppens et al. 2008). Furthermore, it was demonstrated that V. parvula is able to survive to antimicrobials better in dualspecies than in single-species biofilm. This data indicate that V. parvula is capable of coaggregating within the periodontal pocket with other oral species. In fact, V. parvula has been lately implicated in mixed endodontic infections more commonly than anticipated (Rocas & Siqueira 2006; Sassone et al. 2007). These complex and dynamic interactions among members of the subgingival microbiota and between those with host cells may explain the high variability in the microbiota of sites with periodontal health or disease, as well as sites and/or individuals with different forms of disease. One should also point out those difficulties in determining a precise clinical diagnosis of
144 122 disease may limit the establishment of specific microbial profiles for distinct periodontal diseases. Moreover, the recognition of the plaque as a biofilm leads to a broad comprehension about the communications and interactions that exist among bacterial species and the environment (host/ immunological response) (Socransky & Haffajee 2005). In this ecological point of view, just the presence of the putative periodontal pathogens in the biofilm is not necessarily determining disease progression or treatment failure (Colombo et al. 1998; Colombo et al. 2002). Therefore, the elimination of putative periodontal pathogens from subgingival biofilms as a goal of the periodontal therapy may be equivocated. The elimination of certain species might allow other to occupy that niche, and, as a consequence, they might be able to express their virulence. It is very likely what occurs with the old refractory periodontitis subjects, for instance, in which ecological diversity as reduced almost to a mono-infection disease (Colombo et al. 1998). In summary, the current findings showed that many species related to health and periodontal pathogens were significantly higher in diseased groups regarding levels, proportion of DNA and prevalence. On the other hand, only one classical periodontal pathogen, T. forsythia, increased significantly the risk for periodontitis in the final logistic regression model. Some species, as S. aureus and V. parvula along with members of orange (C. rectus and F. n. sp. polymorphum) and red (T. forsythia) complexes were strongly associated with periodontitis, indicating that those species might have an important role in the dynamics of the subgingival microbiota and periodontal pathogenesis. REFERENCES
145 123 Barbosa, F. C., Mayer, M. P., Saba-Chujfi, E. & Cai, S. (2001). Subgingival occurrence and antimicrobial susceptibility of enteric rods and pseudomonads from Brazilian periodontitis patients. Oral Microbiology and Immunology 16, Botero, J. E., Contreras, A., Lafaurie, G., Jaramillo, A., Betancourt, M. & Arce, R. M. (2007). Occurrence of periodontopathic and superinfecting bacteria in chronic and aggressive periodontitis subjects in a Colombian population. Journal of Periodontology 78, Colombo, A. P., Teles, R. P., Torres, M. C., Souto, R., Rosalem, W. J., Mendes, M. C. & Uzeda, M. (2002). Subgingival microbiota of Brazilian subjects with untreated chronic periodontitis. Journal of Periodontology 73, Cortelli, J. R., Cortelli, S. C., Jordan, S., Haraszthy, V. I. & Zambon, J. J. (2005). Prevalence of periodontal pathogens in Brazilians with aggressive or chronic periodontitis. Journal of Clinical Periodontology 32, de Souza Goncalves, L., Souto, R. & Colombo, A. P. (2009). Detection of Helicobacter pylori, Enterococcus faecalis, and Pseudomonas aeruginosa in the subgingival biofilm of HIV-infected subjects undergoing HAART with chronic periodontitis. European Journal of Clinical Microbiology and Infectious Diseases 28, Faveri, M., Figueiredo, L. C., Duarte, P. M., Mestnik, M. J., Mayer, M. P. & Feres, M. (2009). Microbiological profile of untreated subjects with localized aggressive periodontitis. Journal of Clinical Periodontology 36, Fritschi, B. Z., Albert-Kiszely, A. & Persson, G. R. (2008). Staphylococcus aureus and other bacteria in untreated periodontitis. Journal of Dental Research 87,
146 124 Goncalves Lde, S., Soares Ferreira, S. M., Souza, C. O., Souto, R. & Colombo, A. P. (2007). Clinical and microbiological profiles of human immunodeficiency virus (HIV)- seropositive Brazilians undergoing highly active antiretroviral therapy and HIVseronegative Brazilians with chronic periodontitis. Journal of Periodontology 78, Haffajee, A. D., Bogren, A., Hasturk, H., Feres, M., Lopez, N. J. & Socransky, S. S. (2004). Subgingival microbiota of chronic periodontitis subjects from different geographic locations. Journal of Clinical Periodontology 31, Haffajee, A. D., Teles, R. P. & Socransky, S. S. (2006). Association of Eubacterium nodatum and Treponema denticola with human periodontitis lesions. Oral Microbiology and Immunology 21, Herrera, D., Contreras, A., Gamonal, J., Oteo, A., Jaramillo, A., Silva, N., Sanz, M., Botero, J. E. & Leon, R. (2008). Subgingival microbial profiles in chronic periodontitis patients from Chile, Colombia and Spain. Journal of Clinical Periodontology 35, Holt, S. C. & Ebersole, J. L. (2005). Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia: the "red complex", a prototype polybacterial pathogenic consortium in periodontitis. Periodontology , Kara, D., Luppens, S. B. & Cate, J. M. (2006). Differences between single- and dualspecies biofilms of Streptococcus mutans and Veillonella parvula in growth, acidogenicity and susceptibility to chlorhexidine. European Journal of Oral Science, 114, Lafaurie, G. I., Contreras, A., Baron, A., Botero, J., Mayorga-Fayad, I., Jaramillo, A., Giraldo, A., Gonzalez, F., Mantilla, S., Botero, A., Archila, L. H., Diaz, A., Chacon, T.,
147 125 Castillo, D. M., Betancourt, M., Del Rosario Aya, M. & Arce, R. (2007). Demographic, clinical, and microbial aspects of chronic and aggressive periodontitis in Colombia: a multicenter study. Journal of Periodontology 78, Lopez, N. J., Socransky, S. S., Da Silva, I., Japlit, M. R. & Haffajee, A. D. (2004). Subgingival microbiota of chilean patients with chronic periodontitis. Journal of Periodontology 75, Luppens, S. B., Kara, D., Bandounas, L., Jonker, M. J., Wittink, F. R., Bruning, O., Breit, T. M., Ten Cate, J. M. & Crielaard, W. (2008). Effect of Veillonella parvula on the antimicrobial resistance and gene expression of Streptococcus mutans grown in a dual-species biofilm. Oral Microbiology and Immunology 23, Moore, W. E., Holdeman, L. V., Cato, E. P., Smibert, R. M., Burmeister, J. A., Palcanis, K. G. & Ranney, R. R. (1985). Comparative bacteriology of juvenile periodontitis. Infection and Immunity 48, Offenbacher, S., Barros, S. P., Singer, R. E., Moss, K., Williams, R. C. & Beck, J. D. (2007). Periodontal disease at the biofilm-gingival interface. Journal of Periodontology 78, Page, R. C. & Eke, P. I. (2007). Case definitions for use in population-based surveillance of periodontitis. Journal of Periodontology 78, Persson, G. R., Hitti, J., Paul, K., Hirschi, R., Weibel, M., Rothen, M. & Persson, R. E. (2008) Tannerella forsythia and Pseudomonas aeruginosa in subgingival bacterial samples from parous women. Journal of Periodontology 79,
148 126 Rocas, I. N. & Siqueira, J. F., Jr. (2006). Culture-independent detection of Eikenella corrodens and Veillonella parvula in primary endodontic infections. J Endod, 32, Rosalem Jr., W. J., Andrade, A. F. B. & Colombo, A. P. (2006). Prevalence of leukotoxic genotypes of Actinobacillus actinomycetemcomitans in Brazilians with chronic periodontitis. Brazilian Journal of Microbiology 37, Rosalem Jr., W. J., Souza, R. C., Andrade, A. F. B. & Colombo, A. P. (2006). Analysis of leukotoxin gene types of Actinobacillus actinomycetemcomitans in brazilians with aggressive periodontitis Brazilian Journal of Microbiology 37, Rylev, M. & Kilian, M. (2008). Prevalence and distribution of principal periodontal pathogens worldwide. Journal of Clinical Periodontology 35, Sassone, L., Fidel, R., Figueiredo, L., Fidel, S., Faveri, M. & Feres, M. (2007). Evaluation of the microbiota of primary endodontic infections using checkerboard DNA-DNA hybridization. Oral Microbiology and Immunology 22, Slots, J. & Ting, M. (1999). Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis in human periodontal disease: occurrence and treatment. Periodontology , Socransky, S. S. & Haffajee, A. D. (2005). Periodontal microbial ecology. Periodontology , Socransky, S. S., Haffajee, A. D., Cugini, M. A., Smith, C. & Kent, R. L., Jr. (1998). Microbial complexes in subgingival plaque. Journal of Clinical Periodontology 25,
149 127 Socransky, S. S., Haffajee, A. D., Smith, C. & Dibart, S. (1991). Relation of counts of microbial species to clinical status at the sampled site. Journal of Clinical Periodontology 18, Socransky, S. S., Smith, C., Martin, L., Paster, B. J., Dewhirst, F. E. & Levin, A. E. (1994). "Checkerboard" DNA-DNA hybridization. Biotechniques, 17, Souto, R. & Colombo, A. P. (2008a). Detection of Helicobacter pylori by polymerase chain reaction in the subgingival biofilm and saliva of non-dyspeptic periodontal patients. Journal of Periodontology 79, Souto, R. & Colombo, A. P. (2008b). Prevalence of Enterococcus faecalis in subgingival biofilm and saliva of subjects with chronic periodontal infection. Archives of Oral Biology 53, Souto, R., de Andrade, A. F. B., Uzeda, M. & Colombo, A. P. V. (2006). Prevalence of "non-oral" pathogenic bacteria in subgingival biofilm of subjects with chronic periodontitis. Brazilian Journal of Microbiology 37, Tinoco, E. M., Sivakumar, M. & Preus, H. R. (1998). The distribution and transmission of Actinobacillus actinomycetemcomitans in families with localized juvenile periodontitis. Journal of Clinical Periodontology 25, Ximenez-Fyvie, L. A., Almaguer-Flores, A., Jacobo-Soto, V., Lara-Cordoba, M., Moreno-Borjas, J. Y. & Alcantara-Maruri, E. (2006a). Subgingival microbiota of periodontally untreated Mexican subjects with generalized aggressive periodontitis. Journal of Clinical Periodontology 33, Ximenez-Fyvie, L. A., Almaguer-Flores, A., Jacobo-Soto, V., Lara-Cordoba, M., Sanchez-Vargas, L. O. & Alcantara-Maruri, E. (2006b). Description of the subgingival
150 128 microbiota of periodontally untreated Mexican subjects: chronic periodontitis and periodontal health. Journal of Periodontology 77, Acknowledgments This study was supported in part by National Council for Scientific and Technological Development (CNPq), Coordination of Improvement of Higher Education Personnel (CAPES), Brasilia, Brazil; and Foundation for Research Financial Support in the State of Rio de Janeiro (FAPERJ), Rio de Janeiro, Brazil. The authors declare that they do not have any conflict of interest regarding the present study.
151 129 Table 1. Bacterial strains used for the construction of whole genomic DNA probes. Species Strain Species Strain Aggregatibacter actinomycetemcomitans a a Parvimonas micra a Aggregatibacter actinomycetemcomitans b a Prevotella melaninogenica a Aggregactibacter actinomycetemcomitans c 625 b Porphyromonas gingivalis a Actinomyces gerensceriae a Prevotella intermedia a Actinomyces israelli a Prevotella nigrescens a Actinomyces odontolyticus a Propionibacterium acnes a Actinomyces naeslundii a Propionibacterium acnes a Actinomyces naeslundii 2 (Actinomyces viscosus) a Selenomonas noxia a Campylobacter rectus a Streptococcus anginosus a Capnocytophaga gingivalis a Streptococcus constellatus a Capnocytophaga ochracea a Streptococcus mitis a Capnocytophaga sputigena a Streptococcus oralis a Campylobacter showae a Streptococcus sanguinis a Eubacterium nodatum a Streptococcus gordonii a Eikenella corrodens a Streptococcus intermedius a Eubacterium saburreum a Tannerella forsythia a Fusobacterium periodonticum a Treponema denticola B1 b Fusobacterium nucleatum sp. polymorphum a Veillonella parvula a Fusobacterium nucleatum ss. vicentii a Acinetobacter baumannii a Fusobacterium nucleatum ss. nucleatum a Pseudomonas aeruginosa a Gemella morbillorum a Staphylococcus aureus a Leptotrichia buccalis a Enterococcus faecalis a Neisseria mucosa a Escherichia coli a a ATCC (American Type Culture Collection, Rockville, MD); b The Forsyth Institute, Boston, MA.
152 130 Table 2. Multivariate logistic regression analysis (forward Wald) of microbiological predictor variables in periodontally healthy and periodontitis subjects. Variables in the Β OR* Lower Upper p equation 95% CI 95% CI T. forsythia C. rectus E. corrodens P. gingivalis S. sanguinis F. n. sp. polymorphum Constant *Reference: Periodontally healthy.
153 131 Table 3. Multivariate logistic regression analysis (forward Wald) of microbiological predictor variables in gingivitis and periodontitis subjects. Variables in the β OR* Lower Upper p equation 95% CI 95% CI Age T. forsythia < V. parvula Constant *Reference: gingivitis.
154 132 Table 4. Multivariate logistic regression analysis (forward Wald) of microbiological predictor variables in chronic and aggressive periodontitis subjects. Variables in the β OR* Lower Upper p equation 95% CI 95% CI Smoking Age < S. aureus < V. parvula Constant < *Reference: chronic periodontitis.
155 133 Figure legend Figure 1. Microbiological profiles as mean counts log 10 transformed (left panel), percentage of the total DNA probe count (middle panel) and percentage of detection (right panel) of 43 bacterial taxa in subgingival plaque samples from 51 periodontally healthy, 42 gingivitis, 219 untreated chronic periodontitis and 90 untreated aggressive periodontitis subjects. *Significant differences at adjusted p , Kruskal-Wallis test.
156 134 Figure 1 A. gerencseriae A. israelii A. naeslundii A. viscosus A. odontolyticus V. parvula S. intermedius S. gordonii S. oralis S. sanguinis Mean counts in log 10 % DNA probe count Mean % of sites 2,5 3,5 4,5 5,5 6,5 0 0,5 1 1,5 2 2, Blue Purple Yellow * * * * * * A. gerencseriae * * * A. israelii A. naeslundii A. viscosus A. odontolyticus V. parvula S. intermedius S. gordonii S. oralis S. sanguinis * * * * * * * * A. gerencseriae A. naeslundii A. odontolyticus S. intermedius S. oralis * * * * * * * * S. mitis C. ocharacea C. gingivalis C. sputigena Green S. mitis C. ocharacea C. gingivalis C. sputigena * S. mitis C. gingivalis * * E. corrodens E. nodatum C. showae C. rectus F. periodonticum * * * E. corrodens E. nodatum C. showae C. rectus F. periodonticum * * * E. corrodens C. showae F. periodonticum * * F. nuc. polymorphum F. nuc. vicentii F.nuc. nucleatum P. intermedia P. micra P. nigrescens S. constellatus P. gingivalis T. forsythia T. denticola A. a E. saburreum Orange Red * * F. nuc. polymorphum * F. nuc. vicentii F.nuc. nucleatum * * * P. intermedia * P. micra P. nigrescens S. constellatus * * * * P. gingivalis T. forsythia T. denticola A. a E. saburreum * * * * * * F. nuc. vicentii P. intermedia P. nigrescens * * * P. gingivalis T. denticola E. saburreum * * * * * * * * * * G. morbilorum G. morbilorum L. buccalis N. mucosa * L. buccalis N. mucosa * L. buccalis * S. anginosus S. noxia P. acnes P. melaninogenica A. baumanii Others * * * S. anginosus S. noxia P. acnes P. melaninogenica A. baumanii * * * S. anginosus P. acnes A. baumanii * * * E. faecalis E. faecalis P. aeruginosa P. aeruginosa P. aeruginosa S. aureus E. coli Health * S. aureus E. coli Gingivitis * * E. coli Chronic periodontitis Aggressive periodontitis (n = 51) (n = 42) (n = 219) (n = 90)
157 135 5 DISCUSSÃO A classificação atual das doenças periodontais é basicamente dependente da avaliação dos parâmetros clínicos e radiográficos. Consequentemente, um bom exame clínico periodontal é fundamental para um diagnóstico mais preciso, principalmente, em estudos clínicos e epidemiológicos. Desta forma, é necessário que os examinadores envolvidos na coleta dos dados clínicos sejam treinados e calibrados para a mensuração dos parâmetros periodontais, a fim de se obter resultados mais fidedignos. Ao realizarmos uma revisão sistemática relacionada ao tema, pudemos observar que é possível que um examinador calibrado no exame periodontal com sonda manual possa reproduzir resultados semelhantes ao da sondagem eletrônica com relação à mensuração do NCI (SILVA-BOGHOSSIAN et al., 2008). O NCI periodontal é considerado o principal parâmetro clínico usado para avaliar a condição periodontal individual e determinar o diagnóstico, bem como avaliar os resultados clínicos pós-terapia periodontal (VILLATA e BAELUM, 1996; COLOMBO et al., 2005). Apesar de esse parâmetro permitir o registro do aumento cumulativo da prevalência e da gravidade da doença periodontal com o aumento da idade (BAELUM et al., 1995), em algumas situações o NCI isoladamente pode diagnosticar, como doentes, casos de retração gengival sem presença concomitante de inflamação periodontal. Por outro lado, a mensuração da PS isoladamente em indivíduos em idades mais avançadas pode subestimar a prevalência e a gravidade da doença na população, visto que em modelos multivariados tem se observado uma fraca correlação entre PS e idade (SUSIN et al., 2005; CORRAINI et al., 2008b). Desta forma, a metodologia diagnóstica empregada no presente estudo procurou abranger
158 136 todos estes parâmetros clínicos, principalmente para diferenciar aqueles indivíduos que se encontram no limite entre gengivite e periodontite, e entre periodontite crônica avançada e agressiva. Primeiramente, deve-se ressaltar aqui que o presente estudo envolveu a avaliação clínica e microbiológica de uma amostra de pacientes que procuram atendimento na Clínica Odontológica da Faculdade de Odontologia da UFRJ. Embora esta clínica não receba pessoas de todos os segmentos sociais, ela é considerada um centro de referência importante para a saúde odontológica da cidade do Rio de Janeiro. Entretanto, não temos a pretensão de inferir que nossos dados poderiam ser generalizados para a população do Rio de Janeiro. Por outro lado, é sabido que muitos indivíduos que procuram atendimento odontológico em instituições públicas são originários de estratos socioeconômicos mais baixos, e, portanto, podem apresentar alta prevalência e severidade de destruição periodontal, assim como inflamação gengival e higiene bucal deficiente (FLORES-DE-JACOBY et al., 1991; GJERMO et al., 2002; COELHO RDE et al., 2008). Apesar das limitações já discutidas, estudamos esta população com o objetivo de identificar indicadores de risco e marcadores microbiológicos que ajudassem no diagnóstico de indivíduos portadores de doença periodontal. Durante o processo de classificação e diagnóstico clínico dos indivíduos dessa amostra, nos deparamos com algumas dificuldades, principalmente nos casos de indivíduos com periodontite agressiva ou crônica, os quais apresentavam ausências de dentes estratégicos, tais como os primeiros molares permanentes (Quadro 1 em anexo). Como demonstramos no terceiro artigo, aproximadamente 75% da população estudada tinha pelo menos um
159 137 dente ausente, e 53,5% tinham até 3 dentes ausentes, excluindo-se terceiros molares. Inclusive, discutimos naquele artigo esta relação entre o número de dentes ausentes e o desfecho PS. Observamos que se um indivíduo tivesse perdido quatro ou mais dentes, as chances de ter PS 5 mm e 7 mm eram maiores nos grupos mais jovens. No entanto, no Brasil, a taxa de extração dentária é ainda muito alta, especialmente em níveis socioeconômicos baixos, como uma opção única de tratamento. Consequentemente, é possível que em pacientes mais velhos os dentes com as piores condições periodontais já tivessem sido perdidos por exodontia, o que resultaria em subestimativa da doença neste grupo de indivíduos (SUSIN et al., 2005). Os resultados clínicos da presente investigação demonstraram uma alta prevalência de indivíduos com NCI 5 mm (69,5%) e 7 mm (58,9%), bem como com PS 5 mm (69,0%) e 7 mm (54,0%) em pelo menos um sítio. Estas frequências são relativamente altas quando comparadas com estudos realizados em outros países, os quais reportam uma prevalência de PS 5 mm de aproximadamente 5%, sendo mais elevada em indivíduos mais velhos, porém sem ultrapassar os 20% (DIAMANTI-KIPIOTI et al., 1995; AHLBERG et al., 1996; ALBANDAR, 2002; SHEIHAM e NETUVELI, 2002). Entretanto, os resultados aqui obtidos são comparáveis a outros estudos realizados no Brasil, tanto em população urbana (SUSIN et al., 2004; SUSIN et al., 2005), quanto em população isolada (CORRAINI et al., 2008a; 2008b). Somente um estudo recente na região nordeste do Brasil mostrou que 2% dos indivíduos tinham PS 6 mm (COELHO RDE et al., 2008). Deve-se ressaltar que estudos de prevalência de doença periodontal que utilizam o CPITN, como este estudo de Coelho Rde et al, tendem a subestimar o quadro real de destruição periodontal,
160 138 pois, além de ser um exame parcial, esse índice não mensura o NCI (BAELUM e PAPAPANOU, 1996; BASSANI et al., 2006). Já há algum tempo se discute na literatura periodontal a utilização de índices de mensuração de doença em levantamentos epidemiológicos, principalmente o CPITN que foi um índice criado inicialmente para triagem de tratamento e não de vigilância (BAELUM e PAPAPANOU, 1996; PAGE e EKE, 2007). Outra limitação a ser destacada em relação ao CPITN é que este índice não é capaz de identificar o aumento na prevalência e na severidade da doença periodontal dependente da idade (BAELUM et al., 1995). De fato, em nossas avaliações encontramos um risco aumentado para perda de inserção com o aumento da idade, porém dependendo da faixa etária analisada, isto não aconteceu para a PS. Embora nossos dados demográficos sejam parciais, foi possível constatar que, de uma maneira geral, nível socioeconômico é associado à gravidade da doença periodontal. Estes parâmetros podem indicar um maior risco para NCI e PS aumentados, confirmando os achados de outros estudos (SUSIN et al., 2004; PERES et al., 2007; CORRAINI et al., 2008a). No Brasil, baixa renda é associada com saúde bucal deficiente (SUSIN et al., 2004a; CELESTE e NADANOVSKY, 2009). Com relação à raça, foi observado que pessoas de cor preta tinham maiores riscos para NCI e PS aumentados. Isto está de acordo com outros estudos na população brasileira (SUSIN et al., 2005; PERES et al., 2007). No estudo de Peres et al., o qual foi baseado em dados provenientes do Projeto SB 2000 do Ministério da Saúde (SB 2000, 2004), foi demonstrado que há uma associação entre a condição periodontal e raça na população brasileira (PERES et al., 2007).
161 139 O hábito de fumar, incluindo ex-fumantes, foi um indicador de risco importante na presente análise, tanto para NCI como para PS. As probabilidades de um indivíduo apresentar maior PI aumentaram significativamente em fumantes/ ex-fumantes, mesmo controlando para outras covariáveis como idade. Estes resultados estão de acordo com a literatura que demonstra que o fumo é um fator de risco já estabelecido para a doença periodontal. Inclusive, Haffajee e Socransky (HAFFAJEE e SOCRANSKY, 2001) mostraram que, em média, indivíduos mais jovens que fumam perdem aproximadamente a mesma quantidade de inserção periodontal que levaria 27 anos para não-fumantes alcançarem. Atualmente, duas principais formas de doença periodontal destrutiva são reconhecidas: PC e PA (ARMITAGE, 1999). Embora a AAP tenha elaborado um relatório com uma série de característica para definir estas duas entidades clínicas, a aplicabilidade destes critérios muitas vezes é problemática (PICOLOS et al., 2005). É possível que as características dos indivíduos com doença agressiva no Brasil difiram daquelas descritas pela AAP, principalmente no que se refere na quantidade de acúmulo de fatores supragengivais. Na Tabela 2 em anexo, por exemplo, é possível constatar que a porcentagem média de biofilme supragengival em indivíduos portadores de PA foi maior daquela apresentada pelos indivíduos com PC. Da mesma forma, Susin et al. também encontrou uma alta prevalência de sítios com acúmulos de placa (72%) e cálculo (38%) supragengivais em indivíduos com PA no sul do Brasil (SUSIN et al., 2005). Como demonstrado, estas características dos indivíduos portadores de PA não se parecem com aquelas descritas pela AAP, a qual considera que indivíduos com PA apresentam poucos depósitos
162 140 supragengivais, não sendo compatíveis com o grau de destruição periodontal. Assim, além de indicadores clínicos, também é necessário que outros parâmetros sejam utilizados para auxiliar no diagnóstico periodontal. Exames radiográficos são recomendados pela AAP para detecção de perda óssea alveolar (AAP, 1999). No entanto, no presente estudo, não utilizamos este exame complementar por questões de financiamento e de infra-estrutura. Por outro lado, expor o paciente à radiação para chegar a um diagnóstico não é indicado para todas as situações clínicas, tanto do ponto de vista da patologia quanto da biossegurança, assim, apenas uma parcela da amostra estudada necessitaria de exame radiográfico. Em virtude desta inadequação da aplicabilidade dos critérios da AAP na população de estudo, estipulamos outros critérios para fazer distinção entre saúde e doença periodontal, assim como diferenciar as formas desta doença. Os critérios aplicados são passíveis de modificações. Obviamente, não pretendemos propor que estes critérios sejam definitivos. Porém, acreditamos que eles se adaptam melhor à realidade da população estudada. Por exemplo, ao permitirmos algum grau de SS em indivíduos com saúde peridontal estamos mais próximos da realidade, na qual, virtualmente, todas as pessoas apresentam pelo menos um sítio com sangramento. Além disto, estamos considerando saudável um dado sítio que apresenta PI, desde que não tenha SS. Isto ocorreu, com certo grau de frequência, nos indivíduos estudados com idades mais avançadas. Com base em nossos critérios clínicos, 50% dos indivíduos estudados foram diagnosticados como portadores de PC e 23% portadores de PA. A prevalência de indivíduos com PA é um número relativamente alto, porém deve-se considerar que a clínica odontológica da FO-
163 141 UFRJ é um centro de referência para a área metropolitana do Rio de Janeiro. A prevalência e gravidade de doença nessa amostra são, provavelmente, mais altas que a da comunidade. No entanto, permanecem as mesmas questões de risco e de determinantes de diagnóstico clínico que existiriam em uma amostra representativa. Por exemplo, se observarmos simplesmente os dados clínicos obtidos dos indivíduos portadores de PC e de PA (Tabela 2 em anexo), tornase bastante difícil atribuir um diagnóstico clínico a partir de parâmetros que, em média, são bastante similares. Além do exame clínico periodontal completo, parâmetros microbiológicos têm sido rotineiramente utilizados por nosso grupo de pesquisa como um instrumento auxiliar de diagnóstico de risco periodontal. Há aproximadamente 10 anos, o Laboratório de Microbiologia Oral da UFRJ, onde parte desse trabalho foi realizado, estabeleceu a técnica do Checkerboard DNA-DNA hybridization descrita por Socransky et al. (SOCRANSKY et al., 1994). Assim como todas as outroas técnicas de identificação microbiana, esse método apresenta vantagens e limitações. Dentre as principais vantagens estão a capacidade de avaliação de um grande número de amostras e espécies simultanemente. Além disto, a técnica tem sensibilidade e especificidade aceitáveis, e fornece uma avaliação qualitativa e semi-quantitativa (SOCRANSKY et al., 2004). Desde então, inúmeros estudos da microbiota periodontal têm sido desenvolvidos por nosso grupo (COLOMBO et al., 2002; DA SILVA et al., 2005; SOUTO et al., 2006; COLOMBO et al., 2006; GONÇALVES LDE et al., 2007; DA RÓS GONÇALVES et al., 2008; SILVA- BOGHOSSIAN et al., 2008).
164 142 Como descrito em um estudo prévio (COLOMBO et al., 2002), os presentes achados mostraram que a população estudada com doença periodontal não tratada possui uma microbiota subgengival bastante complexa, incluindo altas prevalências e níveis de patógenos periodontais. De fato, muitas espécies estudadas (21 de 43 espécies) tiveram níveis e frequências de detecção significantemente maiores em indivíduos com periodontite (PC e PA) comparados a indivíduos com saúde periodontal. Estes achados estão de acordo com outras investigações que mostraram altos níveis, proporções de DNA e prevalência das espécies estudadas em indivíduos portadores de doença periodontal de outras populações (COLOMBO et al., 2002; XIMENEZ- FYVIE et al., 2006). Em particular, as prevalências e os níveis de Aa na população estudada foram visivelmente mais elevados do que aqueles relatados em outras populações (XIMENEZ-FYVIE et al., 2006; BOTERO et al., 2007; LAFAURIE et al., 2007; HERRERA et al., 2008). Neste estudo, foi encontrada uma prevalência média aproximada em indivíduos com saúde periodontal de 24%, com gengivite de 39%, com PC de 48% e com PA de 53%. No entanto, mesmo com alta frequência de detecção dos patógenos periodontais, Aa e membros do complexo vermelho, em indivíduos saudáveis, existiram diferenças significantes comparando-se aos indivíduos com periodontite. As explicações para as diferenças existentes nos perfis microbianos subgengivais entre populações são parcialmente compreendidas (HAFFAJEE et al., 2004). Porém, essas diferenças podem estar relacionadas aos sítios periodontais com diferentes profundidades de sondagem selecionados para a coleta, terapia periodontal prévia, uso de antibióticos, background genético, dieta, cultura, práticas de higiene e de cuidados com a
165 143 saúde, status socioeconômico e acesso a tratamento odontológico ( HAFFAJEE et al., 2004; LAFAURIE et al., 2007). Além disto, deve-se ressaltar que o uso indiscrimanado de antibióticos permitido no Brasil, o que, provavelmente, influencia a composição da microbiota subgengival. Portanto, é importante que se avalie esses perfis microbianos para definição de estratégias terapêuticas. Cinco espécies potencialmente patogênicas (A. baumannii, E. coli, E. faecalis, P. aeruginosa e S. aureus) consideradas como espécies não-orais foram bastante prevalentes. Destas, a espécie E. faecalis foi a mais frequentemente detectada, sendo encontrada em aproximadamente 32% (PA) a 47% (PC) dos sítios examinados. A espécie A. baumannii foi detectada em aproximadamente 25% (saúde peridontal e gengivite) a 40% (PC e PA) dos sítios estudados. Indivíduos com PA apresentaram a espécie P. aeruginosa com maior frequência (30%), enquanto S. aureus foi significantemente menos frequente (11%), comparando-se aos outros grupos. Interessantemente, E. coli foi mais frequente em sítios de indivíduos saudáveis (36%), porém não houve diferença significativa comparando-se aos grupos. Além disto, estas espécies apresentaram associação com patógenos periodontais. A espécie P. aeruginosa quando associada com Aa (OR 6,7, p < 0,001) e com o complexo vermelho (OR 6,8, p < 0,001) aumentaram significativamente o risco para doença periodontal. Da mesma forma, Persson et al. demonstraram que a P. aeruginosa pode ser um potencial auxiliar no diagnóstico de periodontite (PERSSON et al., 2008). Recentemente, foi relatado que P. aeruginosa, embora detectada em baixa prevalência, foi significantemente mais predominante em indivíduos com periodontite refratária do que em indivíduos
166 144 que responderam bem ao tratamento ou indivíduos saudáveis (COLOMBO et al., 2009). Por outro lado, a alta frequência de detecção dessas espécies nãoorais em altos níveis no biofilme subgengival de indivíduos com doença periodontal indicam que a cavidade oral pode ser um reservatório para bactérias superinfectantes (SOUTO et al., 2006; SOUTO e COLOMBO, 2008a; 2008b). Quando avaliamos todo o montante de espécies bacterianas nas amostras e submetemos os dados de prevalência a modelos de análise de regressão logística, observamos que membros dos complexos laranja (C. rectus e F. n. sp. polymorphum) e vermelho (T. forsythia), juntamente com V. parvula foram indicadores de risco para doença periodontal. Nesta avaliação, destaca-se a espécie V. parvula, usualmente considerada um membro da microbiota compatível com saúde. No entanto, deve-se ressaltar que no biofilme subgengival estas espécies mantêm interrelações bastante complexas com outros microrganismos, incluindo espécies mais patogênicas, e são bastante difíceis de serem estudadas. O entendimento disso poderia explicar a variabilidade e falta de relação de uma ou outra espécie bacteriana com doença periodontal. Por outro lado, existem estudos que relatam que V. parvula é capaz de formar biofilme com outras espécies orais (KARA et al., 2006; LUPPENS et al., 2008) e estar presente, não apenas na doença periodontal (COLOMBO et al., 2002; COLOMBO et al., 2009), mas também em lesões endodônticas (ROCAS e SIQUEIRA, 2006; SASSONE et al., 2007). Em geral, nossos achados mostraram que muitas espécies não comumente associadas à doença periodontal, bem como patógenos periodontais clássicos foram significativamente mais elevados nos grupos de indivíduos com doença
167 145 periodontal. Surpreendentemente, apenas um patógeno periodontal, T. forsythia, permaneceu no modelo final de regressão logística, aumentando o risco para periodontite. O reconhecimento da placa como um biofilme leva a uma compreensão mais ampla sobre as comunidades e interações que existem entre espécies bacterianas e o ambiente (hospedeiro/ resposta imunológica) (SOCRANSKY e HAFFAJEE 2005). Assim, estudos que procurarm entender como funcionam estas relações bacterianas no biofilme subgengival, bem como investigar outras espécies, que não os patógenos periodontais consensuais, que possam estar associadas com a doença periodontal são extremamente importantes (HAFFAJEE et al., 2006; PERSSON et al., 2006; FRITSCHI et al., 2008). Afinal, dentro de um ponto de vista ecológico, não é simplesmente a presença de um dado patógeno periodontal que irá determinar a presença ou a progressão de doença periodontal, dado que indivíduos com periodonto saudável também apresentam estes patógenos (COLOMBO et al., 1998; COLOMBO et al., 2002). Portanto, a tentativa de eliminar estas espécies do ambiente subgengival como meta da terapia periodontal, está equivocada. Visto que a eliminação de uma espécie favorecerá o estabelecimento de outra, que ocupará aquele espaço e passará a expressar um fenótipo virulento. Isto é o que ocorre, por exemplo, em indivíduos com periodontite refratária, nos quais a diversidade microbiana é bastante reduzida (COLOMBO et al., 1998). O melhor que se pode fazer, em fim, nas palavras de Socransky e Haffajee (2005) é guiar a composição desta microbiota para uma que mantenha a cavidade bucal livre de doenças. Embora seja difícil modificar a memória da comunidade clímax, deve-se tentar favorecer o estabelecimento de espécies
168 146 compatíveis com saúde e diminuir a quantidade de espécies relacionadas à doença periodontal. Isto pode ser obtido, por exemplo, com a interferência do crescimento do biofilme através de controle mecânico supra e subgengival. Dentre as limitações do presente estudo transversal, os dados indicam que esta população em particular, composta por indivíduos que procuram atendimento odontológico em uma instituição pública de ensino, apresenta uma alta prevalência e extensão de doença periodontal avançada. A idade, o fumo, o SS, presença de biofilme supragengival e baixo nível socioeconômico foram considerados indicadores de risco associados com PS e NCI aumentados. Estes dados confirmam a alta probabilidade de um indivíduo desta população ter doença periodontal com o aumento da idade, com o fumo e com maus hábitos de higiene oral. Algumas espécies usualmente não relacionadas à doença periodontal, como A. baumannii, P. aeruginosa, S. aureus e V. parvula juntamente com membros dos complexos laranja (C. rectus e F. n. sp. polymorphum) e vermelho (T. forsythia) apresentaram associações significativas com o aumento de risco para a periodontite crônica e/ou agressiva, indicando um possível papel dessas espécies na ecologia da microbiota subgengival e na patogênese da doença periodontal. De uma forma geral, a definição de indivíduos com alto risco é essencial para a formulação de medidas de prevenção e diagnóstico, assim como para o desenvolvimento de estratégias de tratamento para as doenças periodontais apresentadas por esta população.
169 147 6 CONCLUSÃO Embora ambas as sondas periodontais mostrem uma tendência a ter confiabilidade semelhante na mensuração do NCI em indivíduos com periodontite não tratados, quando realizada por um examinador calibrado, isto não é apoiado por forte evidência. O grupo estudado apresenta alta prevalência e extensão de doença periodontal caracterizada pela avançada perda de inserção e profundidade de sondagem elevada. A idade, o fumo e o sangramento à sondagem são indicadores de risco associados com perda de inserção moderada à grave nestes indivíduos, enquanto idade, fumo, sangramento à sondagem, presença de biofilme supragengival e perda dentária são indicadores de risco associados com profundidade de sondagem. Espécies bacterianas usualmente não relacionadas à doença periodontal, incluindo A. baumannii, P. aeruginosa, S. aureus e V. parvula, juntamente com membros dos complexos laranja (C. rectus e F. n. sp. polymorphum) e vermelho (T. forsythia) estão fortemente associados ao aumento de risco para a periodontite crônica e/ ou agressiva nesses indivíduos.
170 148 7 REFERÊNCIAS BIBLIOGRÁFICAS AAP. AMERICAN ACADEMY OF PERIODONTOLOGY. Position paper: epidemiology of periodontal diseases. J Periodontol, v.67, n.9, p , Sep AAP. AMERICAN ACADEMY OF PERIODONTOLOGY International International Workshop for a Classification of Periodontal Diseases and Conditions. Ann Periodontol, v.4, n.1, p.1-112, Dec AHLBERG, J.; TUOMINEN, R.; MURTOMAA, H. Periodontal status among male industrial workers in southern Finland with or without access to subsidized dental care. Acta Odontol Scand, v.54, n.3, p , Jun ALBANDAR, J. M. Periodontal diseases in North America. Periodontol 2000, v.29, p.31-69, ALBANDAR, J. M.; BROWN, L. J.; LOE, H. Putative periodontal pathogens in subgingival plaque of young adults with and without early-onset periodontitis. J Periodontol, v.68, n.10, p , Oct ARMITAGE, G. C. Development of a classification system for periodontal diseases and conditions. Ann Periodontol, v.4, n.1, p.1-6, Dec ARMITAGE, G. C. Periodontal diagnoses and classification of periodontal diseases. Periodontol 2000, v.34, p.9-21, 2004.
171 149 BAELUM, V. & LOPEZ, R. Defining and classifying periodontitis: need for a paradigm shift? Eur J Oral Sci, v.111, n.1, p.2-6, Feb BAELUM, V. et al. Relationship between CPITN and periodontal attachment loss findings in an adult population. J Clin Periodontol, v.22, n.2, p , Feb BAELUM, V. & PAPAPANOU, P. N. CPITN and the epidemiology of periodontal disease. Community Dent Oral Epidemiol, v.24, n.6, p.367-8, Dec BASSANI, D. G.; DA SILVA, C. M.; OPPERMANN, R. V. Validity of the "Community Periodontal Index of Treatment Needs" (CPITN) for population periodontitis screening. Cad Saude Publica, v.22, n.2, p , Feb BLOCH, K. V. & COUTINHO, E. S. F. Fundamentos da pesquisa epidemiológica. In: MEDRONHO RA, BLOCH KV, LUIZ RR et al. Epidemiologia. 2ª ed. São Paulo: Atheneu, Cap. 8, p BOTERO, J. E. et al. Occurrence of periodontopathic and superinfecting bacteria in chronic and aggressive periodontitis subjects in a Colombian population. J Periodontol, v.78, n.4, p , Apr BOUCHARD, P. et al. Risk assessment for severe clinical attachment loss in an adult population. J Periodontol, v.77, n.3, p , Mar
172 150 BRODEUR, J. M. et al. Periodontal diseases among Quebec adults aged 35 to 44 years. J Can Dent Assoc, v.67, n.1, p.34, Jan CALSINA, G.; RAMON, J. M.; ECHEVERRIA, J. J. Effects of smoking on periodontal tissues. J Clin Periodontol, v.29, n.8, p.771-6, Aug CELESTE, R. K. & NADANOVSKY, P. Income and oral health relationship in Brazil: is there a threshold? Community Dent Oral Epidemiol, v.37, n.4, p , Aug CHRISTERSSON, L. A. et al. Subgingival distribution of periodontal pathogenic microorganisms in adult periodontitis. J Periodontol, v.63, n.5, p , May COELHO, R. S. et al. Profile of periodontal conditions in a Brazilian adult population. Oral Health Prev Dent, v.6, n.2, p May COLOMBO, A. P. et al. Clinical and microbiological features of refractory periodontitis subjects. J Clin Periodontol, v.25, n.2, p , Feb COLOMBO, A. P. et al. Discrimination of refractory periodontitis subjects using clinical and laboratory parameters alone and in combination. J Clin Periodontol, v.26, n.9, p , Feb
173 151 COLOMBO, A. P. et al. Subgingival microbiota of Brazilian subjects with untreated chronic periodontitis. J Periodontol, v.73, n.4, p.360-9, Apr COLOMBO, A. P. et al. Effects of non-surgical mechanical therapy on the subgingival microbiota of Brazilians with untreated chronic periodontitis: 9- month results. J Periodontol, v.76, n.5, p , May COLOMBO, A. P. et al. Comparisons of subgingival microbial profiles of refractory periodontitis, severe periodontitis, and periodontal health using the human oral microbe identification microarray. J Periodontol, v.80, n.9, p , Sep COLOMBO, A. V. et al. Identification of oral bacteria associated with crevicular epithelial cells from chronic periodontitis lesions. J Med Microbiol, v.55, n.pt 5, p , May CORRAINI, P. et al. Periodontal attachment loss in an untreated isolated population of Brazil. J Periodontol, v.79, n.4, p , Apr. 2008a. CORRAINI, P. et al. Risk indicators for increased probing depth in an isolated population in Brazil. J Periodontol, v.79, n.9, p , Sep. 2008b. DA RÓS GONÇALVES, L. et al. Periodontal status of patients with dentin dysplasia type I: report of three cases within a family. J Periodontol, v.79, n.7, p , Jul
174 152 DA SILVA, C. M. et al. In vivo evaluation of the effect of essential oil-containing oral strips on salivary bacteria using the checkerboard method. J Clin Dent, v.16, n.2, p.38-43, DE SOUZA GONCALVES, L.; R. SOUTO; COLOMBO, A. P. Detection of Helicobacter pylori, Enterococcus faecalis, and Pseudomonas aeruginosa in the subgingival biofilm of HIV-infected subjects undergoing HAART with chronic periodontitis. Eur J Clin Microbiol Infect Dis, v.28, n.11, p , Nov DIAMANTI-KIPIOTI, A. et al. A radiographic survey of periodontal conditions in Greece. J Clin Periodontol, v.22, n.5, p , May DIETRICH, T. et al. The effect of cigarette smoking on gingival bleeding. J Periodontol, v.75, n.1, p.16-22, Jan DYE, B. A. & SELWITZ, R. H. The relationship between selected measures of periodontal status and demographic and behavioural risk factors. J Clin Periodontol, v.32, n.7, p , Jul DZINK, J. L.; SOCRANSKY, S. S.; HAFFAJEE, A. D. The predominant cultivable microbiota of active and inactive lesions of destructive periodontal diseases. J Clin Periodontol, v.15, n.5, p , May 1988.
175 153 FINE, D. H. et al. Aggregatibacter actinomycetemcomitans and its relationship to initiation of localized aggressive periodontitis: longitudinal cohort study of initially healthy adolescents. J Clin Microbiol, v.45, n.12, p , Dec FLORES-DE-JACOBY, L. et al. Periodontal conditions in Rio de Janeiro City (Brazil) using the CPITN. Community Dent Oral Epidemiol, v.19, n.2, p.127-8, Apr FRITSCHI, B. Z.; ALBERT-KISZELY, A.; PERSSON, G. R. Staphylococcus aureus and other bacteria in untreated periodontitis. J Dent Res, v.87, n.6, p , Jun GAJARDO, M. et al. Prevalence of periodontopathic bacteria in aggressive periodontitis patients in a Chilean population. J Periodontol, v.76, n.2, p , Feb GJERMO, P. Factors influencing the assessment of treatment needs. J Clin Periodontol, v.18, n.6, p , Jul GJERMO, P. et al. Periodontal diseases in Central and South America. Periodontol 2000, v.29, p.70-8, GONCALVES LDE, S. et al. Clinical and microbiological profiles of human immunodeficiency virus (HIV)-seropositive Brazilians undergoing highly active
176 154 antiretroviral therapy and HIV-seronegative Brazilians with chronic periodontitis. J Periodontol, v.78, n.1, p.87-96, Jan HAFFAJEE, A. D. & SOCRANSKY, S. S. Microbial etiological agents of destructive periodontal diseases. Periodontol 2000, v.5, p Jun,1994. HAFFAJEE, A. D. & SOCRANSKY, S. S. Relationship of cigarette smoking to attachment level profiles. J Clin Periodontol, v.28, n.4, p , Apr HAFFAJEE, A. D. et al. Subgingival microbiota of chronic periodontitis subjects from different geographic locations. J Clin Periodontol, v.31, n.11, p , Nov HAFFAJEE, A. D.; TELES, R. P.; SOCRANSKY, S. S. Association of Eubacterium nodatum and Treponema denticola with human periodontitis lesions. Oral Microbiol Immunol, v.21, n.5, p , Oct HANSEN, B. F.; BJERTNESS, E.; GJERMO, P. Changes in periodontal disease indicators in 35-year-old Oslo citizens from 1973 to J Clin Periodontol, v.17, n.4, p , Apr HERRERA, D. et al. Subgingival microbial profiles in chronic periodontitis patients from Chile, Colombia and Spain. J Clin Periodontol, v.35, n.2, p , Feb
177 155 HOLT, S. C. & EBERSOLE, J. L. Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia: the "red complex", a prototype polybacterial pathogenic consortium in periodontitis. Periodontol 2000, v.38, p , HOLTFRETER, B. et al. Epidemiology of periodontal diseases in the Study of Health in Pomerania. J Clin Periodontol, v.36, n.2, p , Feb IBGE. INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Censo demográfico CD Questionário da amostra. Disponível em: Acessado em maio, KAMMA, J. J. et al. Microbiological profile of early onset/aggressive periodontitis patients. Oral Microbiol Immunol, v.19, n.5, p , Oct KARA, D.; LUPPENS, S. B.; CATE, J. M. Differences between single- and dualspecies biofilms of Streptococcus mutans and Veillonella parvula in growth, acidogenicity and susceptibility to chlorhexidine. Eur J Oral Sci, v.114, n.1, p.58-63, Feb KHADER, Y. S.; RICE, J. C.; LEFANTE, J. J. Factors associated with periodontal diseases in a dental teaching clinic population in northern Jordan. J Periodontol, v.74, n.11, p , Nov
178 156 KINANE, D. F.; MOONEY, J.; EBERSOLE, J. L. Humoral immune response to Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis in periodontal disease. Periodontol 2000, v.20, p , Jun LAFAURIE, G. I. et al. Demographic, clinical, and microbial aspects of chronic and aggressive periodontitis in Colombia: a multicenter study. J Periodontol, v.78, n.4, p , Apr LISTGARTEN, M. A. & HELLDEN, L. Relative distribution of bacteria at clinically healthy and periodontally diseased sites in humans. J Clin Periodontol, v.5, n.2, p , May LOE, H. et al. Natural history of periodontal disease in man. Rapid, moderate and no loss of attachment in Sri Lankan laborers 14 to 46 years of age. J Clin Periodontol, v.13, n.5, p , May LOPEZ, N. J. et al. Effects of metronidazole plus amoxicillin as the only therapy on the microbiological and clinical parameters of untreated chronic periodontitis. J Clin Periodontol, v.33, n.9, p , Sep LOPEZ, N. J. et al. Subgingival microbiota of Chilean patients with chronic periodontitis. J Periodontol, v.75, n.5, p , May 2004.
179 157 LUIZ, R. R. & SZKLO, M. Introdução à Bioestatística e à Epidemiologia. In. LUIZ RR, COSTA AJL, NADANOVSKY P. Epidemiologia e Bioestatística na pesquisa odontológica. São Paulo: Atheneu, Cap. 3, p LUPPENS, S. B. et al. Effect of Veillonella parvula on the antimicrobial resistance and gene expression of Streptococcus mutans grown in a dualspecies biofilm. Oral Microbiol Immunol, v.23, n.3, p.183-9, Jun MAYORGA-FAYAD, I. et al. [Subgingival microbiota in chronic and aggressive periodontitis in Bogota, Colombia: an epidemiological approach]. Biomedica, v.27, n.1, p.21-33, Mar MOORE, W. E. et al. Comparative bacteriology of juvenile periodontitis. Infect Immun, v.48, n.2, p , May NEWMAN, M. G. & SOCRANSKY, S. S. Predominant cultivable microbiota in periodontosis. J Periodontal Res, v.12, n.2, p.120-8, Mar OFFENBACHER, S. et al. Periodontal disease at the biofilm-gingival interface. J Periodontol, v.78, n.10, p , Oct PAGE, R. C. & EKE, P. I. Case definitions for use in population-based surveillance of periodontitis. J Periodontol, v.78, n.7 Suppl, p , Jul
180 158 PAPAPANOU, P. & LINDHE, J. Epidemiologia das doenças periodontais. In: LINDHE J, KARRING T, LANG NP. Tratado de periodontia clínica e implantologia oral. 4ª ed. Rio de Janeiro: Guanabara Koogan, Cap. 2, p PERES, M. A. et al. Skin colour is associated with periodontal disease in Brazilian adults: a population-based oral health survey. J Clin Periodontol, v.34, n.3, p , Mar PERSSON, G. R. et al. Tannerella forsythia and Pseudomonas aeruginosa in subgingival bacterial samples from parous women. J Periodontol, v.79, n.3, p , Mar PICOLOS, D. K. et al. Infection patterns in chronic and aggressive periodontitis. J Clin Periodontol, v.32, n.10, p , Oct REDDY, M. S.; PALCANIS, K. G.; GEURS, N. C. A comparison of manual and controlled-force attachment-level measurements. J Clin Periodontol, v.24, n.12, p.920-6, Dec ROCAS, I. N. & SIQUEIRA Jr., J. F. Culture-independent detection of Eikenella corrodens and Veillonella parvula in primary endodontic infections. J Endod, v.32, n.6, p , Jun
181 159 SASSONE, L. et al. Evaluation of the microbiota of primary endodontic infections using checkerboard DNA-DNA hybridization. Oral Microbiol Immunol, v.22, n.6, p.390-7, Dec SB Condições de saúde bucal da população brasileira Resultados Principais. Brasilia-DF: Ministério da Saúde, Secretaria de Atenção à Saúde, Departamento de Atenção Básica, Coordenação Nacional de Saúde Bucal, 51p, SHEIHAM, A. & NETUVELI, G. S. Periodontal diseases in Europe. Periodontol 2000, v.29, p , SILNESS, J. & LOE, H. Periodontal Disease in Pregnancy. Ii. Correlation between Oral Hygiene and Periodontal Condtion. Acta Odontol Scand, v.22, p , Feb SILVA-BOGHOSSIAN, C. M. et al. Manual and electronic probing of the periodontal attachment level in untreated periodontitis: a systematic review. J Dent, v.36, n.8, p.651-7, Aug SILVA-BOGHOSSIAN, C. M.; R. R. LUIZ; COLOMBO, A. P. Periodontal status, socio-demographic and behavioral indicators in subjects attending a Public Dental School in Brazil: analysis of clinical attachment loss. J Periodontol DOI: /jop
182 160 SILVA-BOGHOSSIAN, C. et al. Salivary microbiota of HIV-positive children and its correlation with HIV status, oral diseases, and total secretory IgA. Int J Paediatr Dent. v.18, n.3, May, p SLOTS, J. & TING, M. Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis in human periodontal disease: occurrence and treatment. Periodontol 2000, v.20, p , Jun SOCRANSKY, S. S.; HAFFAJEE, A. D.; DZINK, J. L. Relationship of subgingival microbial complexes to clinical features at the sampled sites. J Clin Periodontol, v.15, n.7, p.440-4, Aug SOCRANSKY, S. S. et al. Relation of counts of microbial species to clinical status at the sampled site. J Clin Periodontol, v.18, n.10, p , Nov SOCRANSKY, S. S. & HAFFAJEE, A. D. The bacterial etiology of destructive periodontal disease: current concepts. J Periodontol, v.63, n.4 Suppl, p , Apr SOCRANSKY, S. S. et al. "Checkerboard" DNA-DNA hybridization. Biotechniques, v.17, n.4, p , Oct SOCRANSKY, S. S. et al. Microbial complexes in subgingival plaque. J Clin Periodontol, v.25, n.2, p , Feb
183 161 SOCRANSKY, S. S. et al. Ecological considerations in the treatment of Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis periodontal infections. Periodontol 2000, v. 20, p , SOCRANSKY, S. S.; SMITH, C.; HAFFAJEE, A. D. Subgingival microbial profiles in refractory periodontal disease. J Clin Periodontol, v.29, n.3, p , Mar SOCRANSKY, S. S. et al. Use of checkerboard DNA-DNA hybridization to study complex microbial ecosystems. Oral Microbiol Immunol, v.19, n.6, p , Dec SOCRANSKY, S. S. & HAFFAJEE, A. D. Periodontal microbial ecology. Periodontol 2000, v.38, p , SODER, P. O. et al. Periodontal status in an urban adult population in Sweden. Community Dent Oral Epidemiol, v.22, n.2, p , Apr SOUTO, R. & COLOMBO, A. P. Detection of Helicobacter pylori by polymerase chain reaction in the subgingival biofilm and saliva of non-dyspeptic periodontal patients. J Periodontol, v.79, n.1, p , Jan. 2008a. SOUTO, R. & COLOMBO, A. P. Prevalence of Enterococcus faecalis in subgingival biofilm and saliva of subjects with chronic periodontal infection. Arch Oral Biol, v.53, n.2, p , Feb. 2008b.
184 162 SOUTO, R. et al. Prevalence of "non-oral" pathogenic bacteria in subgingival biofilm of subjects with chronic periodontitis. Braz J Microbiol, v.37, p , SUSIN, C. et al. Periodontal attachment loss in an urban population of Brazilian adults: effect of demographic, behavioral, and environmental risk indicators. J Periodontol, v.75, n.7, p , Jul. 2004a. SUSIN, C. et al. Periodontal attachment loss attributable to cigarette smoking in an urban Brazilian population. J Clin Periodontol, v.31, n.11, p.951-8, Nov. 2004b. SUSIN, C. & ALBANDAR, J. M. Aggressive periodontitis in an urban population in southern Brazil. J Periodontol, v.76, n.3, p , Mar SUSIN, C. et al. Tooth loss and associated risk indicators in an adult urban population from south Brazil. Acta Odontol Scand, v.63, n.2, p.85-93, Apr. 2005a. SUSIN, C. et al. Occurrence and risk indicators of increased probing depth in an adult Brazilian population. J Clin Periodontol, v.32, n.2, p.123-9, Feb. 2005b.
185 163 TAKEUCHI, Y. et al. Prevalence of periodontopathic bacteria in aggressive periodontitis patients in a Japanese population. J Periodontol, v.74, n.10, p , Oct TAN, K. S. et al. Prevalence of Actinobacillus actinomycetemcomitans in an ethnic adult Chinese population. J Clin Periodontol, v.28, n.9, p , Sep TANNER, A. C. et al. A study of the bacteria associated with advancing periodontitis in man. J Clin Periodontol, v.6, n.5, p , Oct TANNER, A. C.; SOCRANSKY, S. S.; GOODSON, J. M. Microbiota of periodontal pockets losing crestal alveolar bone. J Periodontal Res, v.19, n.3, p , May TONETTI, M. S. & MOMBELLI, A. Early-onset periodontitis. Ann Periodontol, v.4, n.1, p.39-53, Dec VILLATA, L. & BAELUM, V. Reproducibility of attachment level recordings using an electronic and a conventional probe. J Periodontol, v.67, n.12, p , Dec WHO. WORLD HEALTH ORGANIZATION. Oral health surveys: basic methods. 3ª ed. Geneva: WHO 1987.
186 164 WORLDGAZETEER. World: largest cities and towns and statistics of their population: World Gazeteer. Disponível em: Acessado Fev XAJIGEORGIOU, C. et al. Clinical and microbiological effects of different antimicrobials on generalized aggressive periodontitis. J Clin Periodontol, v.33, n.4, p , Apr XIMENEZ-FYVIE, L. A. et al. Description of the subgingival microbiota of periodontally untreated Mexican subjects: chronic periodontitis and periodontal health. J Periodontol, v.77, n.3, p , Mar. 2006a. XIMENEZ-FYVIE, L. A. et al. Subgingival microbiota of periodontally untreated Mexican subjects with generalized aggressive periodontitis. J Clin Periodontol, v.33, n.12, p , Dec. 2006b. YANG, H. W. et al. Relationship of Actinobacillus actinomycetemcomitans serotypes to periodontal condition: prevalence and proportions in subgingival plaque. Eur J Oral Sci, v.113 n.1, p.28-33, Feb
187 ANEXOS 165
188 ANEXO I 166
189 167 ANEXO II NOME: DATA: N PACIENTE.: GRUPO: IDADE: Biofilme PS NCI SANG SUP Biofilme PS NCI SANG SUP Biofilme PS NCI SANG SUP Biofilme PS NCI SANG SUP VESTIBULAR PALATINA VESTIBULAR LINGUAL
190 168 Tabela 1. Distribuição da população estudada de acordo com os grupos estudados, idade, gênero, raça, escolaridade, renda e fumo. Grupos Variáveis Saúde Gengivite PC PA Total P * % (N) % (N) % (N) % (N) % (N) Faixa etária anos 63, , , , ,5 232 < 0, anos 26, , , , ,5 232 > 50 anos 9,7 9 5,1 3 29,9 83 0,0 0 17,0 95 Gênero Feminino 60, , , , , ,530 Masculino 39, , , , ,2 208 Raça Branca 74, , , , , ,002 Preta 5,1 2 19,4 7 25, ,7 7 19,3 43 Parda 20,5 8 44, , , ,9 80 Escolaridade 8 anos 5,7 2 19,4 6 41, ,6 9 28,7 48 < 0, anos 11,4 4 54, , , , years 82, ,8 8 20,0 15 7,7 2 32,3 54 Renda familiar mensal (US$) 320 6,5 2 35, , , ,9 49 < 0, ,1 5 35, , , ,7 70 > , ,0 9 15,1 11 3,4 1 27,4 45 Fumo Nunca fumante 91, , , , ,4 416 < 0,001 Fumante 8,6 8 16, , , ,6 143 * Teste 2 ; PC: periodontite crônica; PA: periodontite agressiva.
191 169 Tabela 2. Dados clínicos periodontais (média ± erro-padrão da média) da população estudada de acordo com os grupos (saúde, gengivite, periodontite crônica e agressiva). Grupos Variáveis Saúde Gengivite PC PA Total P * PS (mm) 1,97 ± 0,05 2,03 ± 0,03 3,04 ± 0,05 3,90 ± 0,08 2,95 ± 0,04 < 0,001 NCI (mm) 2,03 ± 0,05 2,01 ± 0,06 3,83 ± 0,08 4,31 ± 0,09 3,45 ± 0,06 < 0,001 N de dentes ausentes 1,33 ± 0,30 3,03 ± 0,51 6,16 ± 0,33 3,65 ± 0,29 4,45 ± 0,21 < 0,001 % SS 2,58 ± 0,32 28,15 ± 2,58 42,99 ± 1,54 60,36 ± 2,63 38,70 ± 1,28 < 0,001 % Supuração 0,0 0,0 4,97 ± 0,65 4,81 ± 0,93 3,79 ± 0,43 < 0,001 % BS 13,01 ± 1,50 39,43 ± 3,09 61,84 ± 1,67 64,11 ± 2,39 51,83 ± 1,34 < 0,001 % PS % NCI 0-4 mm 100,00 ± 0,00 99,27 ± 0,51 80,13 ± 1,18 66,66 ± 1,71 82,35 ± 0,87 < 0, mm 0,00 0,59 ± 0,42 14,77 ± 0,84 22,93 ± 1,16 12,70 ± 0,61 < 0,001 7 mm 0,00 0,13 ± 0,09 5,09 ± 0,49 10,41 ± 0,96 4,95 ± 0,37 < 0, mm 100,00 ± 0,00 99,65 ± 0,31 66,93 ± 1,58 58,61 ± 1,88 73,97 ± 1,13 < 0, mm 0,00 0,25 ± 0,23 21,19 ± 0,96 24,29 ± 1,09 16,17 ± 0,68 < 0,001 7 mm 0,00 0,09 ± 0,08 11,92 ± 0,96 17,09 ± 1,35 9,88 ± 0,63 < 0,001 * Teste Kruskal-Wallis; PC: periodontite crônica; PA: periodontite agressiva; PS: profundidade de sondagem; NCI: nível clínico de inserção; SS: sangramento à sondagem; BS: biofilme supragengival.
192 Quadro 1. Descrição da ordem de perda de dentária segundo o grupo. Ordem da perda Saúde Gengivite Periodontite Crônica Periodontite Agressiva 1º º º º º º º º º º º º º º º º º º º º º º º 31* º 32* º 33* 32* º 41* 33* º 42* 42* º 43* 43* Elementos dentários; * sem ausências; em vermelho estão assinalados os primeiros e segundos molares, em amarelo, os pré-molares superiores e, em verde, os incisivos.
193 171 Resumos em publicados em Anais de Congressos durante o período de doutoramento 1. SILVA-BOGHOSSIAN, C. M., SOUTO, R. M., COLOMBO, A. P. V. Associação entre complexo vermelho, A. actinomycetemcomitans e bactérias extra-orais em periodontite crônica e agressiva. In: 26ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2009, Águas de Lindóia. Brazilian Oral Research. São Paulo: Universidade de São Paulo, v.23. p Painel vencedor do grupo A8 durante a 26ª Reunião Anual da SBPqO. 2. HELLER, D., SOUTO, R. M., SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Diversidade microbiana de pacientes brasileiros com periodontite agressiva generalizada. In: 26ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2009, Águas de Lindóia. Brazilian Oral Research. São Paulo: Universidade de São Paulo, v.23. p HELLER, D., SOUTO, R. M., VARELA, V., SILVA-BOGHOSSIAN, C. M., TORRES, M. C., FERES-FILHO, E. J., COLOMBO, A. P. V. Aggregatibacter actinomycetemcomitans frequency in Brazilians with aggressive and chronic periodontitis. In: 87 th General Session and Exhibition of the IADR/ AADR/ CADR, 2009, Miami. Journal of Dental Research. Alexandria: International Association for Dental Research & American Association for Dental Research, HELLER, D., SOUTO, R. M., VARELA, V., SILVA-BOGHOSSIAN, C. M., TORRES, M. C., FERES-FILHO, E. J., COLOMBO, A. P. V. Microbial profile of aggressive and chronic periodontal diseases. In: 87 th General Session and Exhibition of the IADR/ AADR/ CADR, 2009, Miami. Journal of Dental Research. Alexandria: International Association for Dental Research & American Association for Dental Research, SILVA-BOGHOSSIAN, C. M., LUIZ, R. R., COLOMBO, A. P. V. Periodontal status and risk indicators of Brazilian subjects. In: 87 th General Session and Exhibition of the IADR/ AADR/ CADR, 2009, Miami. Journal of Dental Research. Alexandria: International Association for Dental Research & American Association for Dental Research, 2009.
194 SOUTO, R. M., ZUANAZZI, D., ZUANAZZI, M. R., SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Prevalence of Staphylococcus spp carrying meca gene in periodontitis subjects. In: 86 th General Session & Exhibition of the IADR, 2008, Toronto. Journal of Dental Research. Alexandria: International Association for Dental Research & American Association for Dental Research, SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Microbiota subgengival em diferentes condições de saúde e doença periodontais. In: XXII Congresso Brasileiro de Periodontologia, 2007, Rio de Janeiro. Home page do XXII Congresso Brasileiro de Periodontologia. Rio de Janeiro: Sobrape, SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Subgingival microbiota of Brazilians with different periodontal status. In: 85 th General Session & Exhibition of the IADR/ AADR/ CADR, 2007, New Orleans. Journal of Dental Research. Alexandria: International Association for Dental Research & American Association for Dental Research, v SOUTO, R. M., SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Unusual bacteria in subgingival biofilm of subjects with periodontal disease. In: 85 th General Session & Exhibition of the IADR/ AADR/ CADR, 2007, New Orleans. Journal of Dental Research. Alexandria: International Association for Dental Research & American Association for Dental Research, v COLOMBO, A. V., SILVA-BOGHOSSIAN, C. M., HAFFAJEE, A., COLOMBO, A. P. V. Detecção intracelular de patógenos periodontais em células epiteliais gengivais de indivíduos com periodontite crônica. In: 23ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2006, Atibaia. Brazilian Oral Research. São Paulo: Universidade de São Paulo, v.20. p Painel vencedor do grupo B8 durante a 23ª Reunião Anual da SBPqO.
195 SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Distribuição de complexos microbianos na microbiota subgengival de indivíduos com diferentes condições periodontais. In: 23ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2006, Atibaia. Brazilian Oral Research. São Paulo: Universidade de São Paulo, v.20. p BRITO, D. M., CAMEJO, F. A., SALVATERRA, A. R., SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Avaliação in vivo do efeito antimicrobiano de extratos vegetais na microbiota oral pelo método do checkerboard. In: 22ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2005, Águas de Lindóia. Brazilian Oral Research. São Paulo: Universidade de São Paulo, v.19. p COLOMBO, A. V., SILVA-BOGHOSSIAN, C. M., SOUTO, R. M., COLOMBO, A. P. V. Avaliação do efeito in vivo de fitas orais contendo óleos essenciais na microbiota oral pelo método do checkerboard. In: 21ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2004, Águas de Lindóia. Brazilian Oral Research. São Paulo: SBPqO Faculdade de Odontologia Universidade de São Paulo, v.18. p COLOMBO, A. V., SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Identificação de bactérias orais associadas às células epiteliais da bolsa periodontal pelo método do checkerboard. In: 21 a Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2004, Águas de Lindóia. Brazilian Oral Research - Pesquisa Odontológica Brasileira. São Paulo: SBPqO Faculdade de Odontologia Universidade de São Paulo, v.18. p Painel vencedor do grupo B3 durante a 21ª Reunião Anual da SBPqO.
196 174 Apresentação de trabalhos em Congressos durante o período de doutoramento 1. SILVA-BOGHOSSIAN, C. M., SOUTO, R. M., LUIZ, R. R., COLOMBO, A. P. V. Associação entre complexo vermelho, A. actinomycetemcomitans e bactérias extra-orais em periodontite crônica e agressiva, Painel apresentado durante a 26ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2009, Águas de Lindóia. Painel vencedor do grupo A8 durante a 26ª Reunião Anual da SBPqO. 2. SILVA-BOGHOSSIAN, C. M., LUIZ, R. R., COLOMBO, A. P. V. Periodontal status and risk indicators of Brazilian subjects, Painel apresentado durante o 87 th General Session and Exhibition of the IADR/ AADR/ CADR, 2009, Miami. 3. SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Microbiota subgengival em diferentes condições de saúde e doença periodontais, Tema-livre apresentado durante o XXII Congresso Brasileiro de Periodontologia, 2007, Rio de Janeiro. 4. SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Subgingival microbiota of Brazilians with different periodontal status, Painel apresentado durante o 85 th General Session & Exhibition of the IADR/ AADR/ CADR, 2007, New Orleans. 5. SILVA-BOGHOSSIAN, C. M., COLOMBO, A. P. V. Distribuição de complexos microbianos na microbiota subgengival de indivíduos com diferentes condições periodontais, Painel apresentado durante a 23ª Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2006, Atibaia. 6. COLOMBO, A. V., SILVA-BOGHOSSIAN, C. M., SOUTO, R. M., COLOMBO, A. P. V. Avaliação do efeito in vivo de fitas orais contendo óleos essenciais na microbiota oral pelo método do checkerboard, Painel apresentado durante a 21 a Reunião Anual da Sociedade Brasileira de Pesquisa Odontológica, 2004, Águas de Lindóia.
197 Publicações de trabalhos extras realizados durante o doutoramento 175
198 176
199 177
200 178
201 179
202 180
Definição. Definição. Características clínicas e laboratoriais. Características Clínicas e Microbiológicas. Doença Periodontal Agressiva:
 Doença Periodontal Agressiva Características Clínicas e Microbiológicas Prof. Dr. Marcelo de Faveri Doença Periodontal Agressiva: Definição As doenças periodontais agressivas são consideradas d infecções
Doença Periodontal Agressiva Características Clínicas e Microbiológicas Prof. Dr. Marcelo de Faveri Doença Periodontal Agressiva: Definição As doenças periodontais agressivas são consideradas d infecções
- Gengivite. Periodontal. Crônica. - Periodontite. Agressiva GENGIVITE
 Formas da Doença Periodontal Microbiologia da Doença Periodontal - Gengivite Crônica - Periodontite Agressiva SAÚDE PERIODONTAL GENGIVITE GENGIVITE PERIODONTITE CRÔNICA PERIODONTITE CRÔNICA PERIODONTITE
Formas da Doença Periodontal Microbiologia da Doença Periodontal - Gengivite Crônica - Periodontite Agressiva SAÚDE PERIODONTAL GENGIVITE GENGIVITE PERIODONTITE CRÔNICA PERIODONTITE CRÔNICA PERIODONTITE
PERIODONTITE CRÔNICA E AGRESSIVA: PREVALÊNCIA SUBGENGIVAL E FREQÜÊNCIA DE OCORRÊNCIA DE PATÓGENOS PERIODONTAIS
 Edited by Foxit PDF Editor Copyright (c) by Foxit Software Company, 2004 For Evaluation Only. PERIODONTITE CRÔNICA E AGRESSIVA: PREVALÊNCIA SUBGENGIVAL E FREQÜÊNCIA DE OCORRÊNCIA DE PATÓGENOS PERIODONTAIS
Edited by Foxit PDF Editor Copyright (c) by Foxit Software Company, 2004 For Evaluation Only. PERIODONTITE CRÔNICA E AGRESSIVA: PREVALÊNCIA SUBGENGIVAL E FREQÜÊNCIA DE OCORRÊNCIA DE PATÓGENOS PERIODONTAIS
VARIABILIDADE DO SANGRAMENTO À SONDAGEM AO REDOR DE IMPLANTES DENTÁRIOS
 VARIABILIDADE DO SANGRAMENTO À SONDAGEM AO REDOR DE IMPLANTES DENTÁRIOS Giuliano Portolese Sversutti Cesar (PIBIC/CNPq/FA/Uem), Flávia Matarazzo, e-mail: giu.cesar@hotmail.com. Universidade Estadual de
VARIABILIDADE DO SANGRAMENTO À SONDAGEM AO REDOR DE IMPLANTES DENTÁRIOS Giuliano Portolese Sversutti Cesar (PIBIC/CNPq/FA/Uem), Flávia Matarazzo, e-mail: giu.cesar@hotmail.com. Universidade Estadual de
CARACTERÍSTICAS MICROBIANAS NA SAÚDE E DOENÇA PERIODONTAL
 CARACTERÍSTICAS MICROBIANAS NA SAÚDE E DOENÇA PERIODONTAL MICROBIAL CHARACTERISTICS IN PERIODONTAL HEALTH AND DISEASE Fábio Shigueo Eto Suzane A Raslan José Roberto Cortelli Departamento de Odontologia
CARACTERÍSTICAS MICROBIANAS NA SAÚDE E DOENÇA PERIODONTAL MICROBIAL CHARACTERISTICS IN PERIODONTAL HEALTH AND DISEASE Fábio Shigueo Eto Suzane A Raslan José Roberto Cortelli Departamento de Odontologia
CARACTERIZAÇÃO MICROBIOLÓGICA DE INDIVÍDUOS PORTADORES DE DOENÇA PERIODONTAL CRÔNICA E AGRESSIVA GENERALIZADA
 CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA CARACTERIZAÇÃO MICROBIOLÓGICA DE INDIVÍDUOS PORTADORES DE DOENÇA PERIODONTAL CRÔNICA E
CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA CARACTERIZAÇÃO MICROBIOLÓGICA DE INDIVÍDUOS PORTADORES DE DOENÇA PERIODONTAL CRÔNICA E
Aspectos Microbiológicos das Doenças Periodontais. Profa Me. Gilcele Berber
 Aspectos Microbiológicos das Doenças Periodontais Profa Me. Gilcele Berber Anatomia do periodonto Função = Inserção + Proteção Gengiva Ligamento periodontal Osso alveolar Cemento Doença periodontal Doença
Aspectos Microbiológicos das Doenças Periodontais Profa Me. Gilcele Berber Anatomia do periodonto Função = Inserção + Proteção Gengiva Ligamento periodontal Osso alveolar Cemento Doença periodontal Doença
OCORRÊNCIA DE Actinobacillus actinomycetemcomitans NA DOENÇA PERIODONTAL
 Edited by Foxit PDF Editor Copyright (c) by Foxit Software Company, 24 For Evaluation Only. OCORRÊNCIA DE Actinobacillus actinomycetemcomitans NA DOENÇA PERIODONTAL OCCURRENCE OF Actinobacillus actinomycetemcomitans
Edited by Foxit PDF Editor Copyright (c) by Foxit Software Company, 24 For Evaluation Only. OCORRÊNCIA DE Actinobacillus actinomycetemcomitans NA DOENÇA PERIODONTAL OCCURRENCE OF Actinobacillus actinomycetemcomitans
21/03/2017. Microbiota Residente, Indígena ou Autóctone do Corpo Humano. Características da Microbiota Residente
 Características da Microbiota Residente Interação dinâmica entre a microbiota residente e o hospedeiro. Microbiota Residente, Indígena ou Autóctone do Corpo Humano Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac
Características da Microbiota Residente Interação dinâmica entre a microbiota residente e o hospedeiro. Microbiota Residente, Indígena ou Autóctone do Corpo Humano Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac
CLASSIFICAÇÃO E EPIDEMIOLOGIA DAS DOENÇAS PERIODONTAIS
 INAPÓS - Faculdade de Odontologia e Pós Graduação DISCIPLINA DE PERIODONTIA CLASSIFICAÇÃO E EPIDEMIOLOGIA DAS DOENÇAS PERIODONTAIS Parte II Prof.Dr. Lucinei Roberto de Oliveira http://lucinei.wikispaces.com
INAPÓS - Faculdade de Odontologia e Pós Graduação DISCIPLINA DE PERIODONTIA CLASSIFICAÇÃO E EPIDEMIOLOGIA DAS DOENÇAS PERIODONTAIS Parte II Prof.Dr. Lucinei Roberto de Oliveira http://lucinei.wikispaces.com
Microbiota Residente, Indígena ou Autóctone do Corpo Humano
 Microbiota Residente, Indígena ou Autóctone do Corpo Humano Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac Características da Microbiota Residente Interação dinâmica entre a microbiota
Microbiota Residente, Indígena ou Autóctone do Corpo Humano Prof. Dr. Mario Julio Avila-Campos http://www.icb.usp.br/bmm/mariojac Características da Microbiota Residente Interação dinâmica entre a microbiota
17/10/2016. Bactérias anaeróbias. Microbiota bucal. Fatores que regulam a microbiota bucal. Bactérias anaeróbias na cavidade bucal.
 Bactérias anaeróbias Ausência de O 2 Potencial de Eh Habitats Bactérias anaeróbias na cavidade bucal Toxidade ao O 2 Tolerância O 2 Morfologia/ Gram Profa. Dra. Viviane Arenas Anaeróbios obrigatórios Anaeróbios
Bactérias anaeróbias Ausência de O 2 Potencial de Eh Habitats Bactérias anaeróbias na cavidade bucal Toxidade ao O 2 Tolerância O 2 Morfologia/ Gram Profa. Dra. Viviane Arenas Anaeróbios obrigatórios Anaeróbios
DANIELE SALAMI LOURENÇÃO. Detecção e quantificação de bactérias no biofilme subgengival de indivíduos. com diferentes formas de doença periodontal
 DANIELE SALAMI LOURENÇÃO Detecção e quantificação de bactérias no biofilme subgengival de indivíduos com diferentes formas de doença periodontal São Paulo 2010 DANIELE SALAMI LOURENÇÃO Detecção e quantificação
DANIELE SALAMI LOURENÇÃO Detecção e quantificação de bactérias no biofilme subgengival de indivíduos com diferentes formas de doença periodontal São Paulo 2010 DANIELE SALAMI LOURENÇÃO Detecção e quantificação
TÍTULO: EFEITO DA TERAPIA PERIODONTAL NÃO CIRÚRGICA SOBRE O CONTROLE GLICÊMICO EM INDIVÍDUOS COM DIABETES TIPO2 E PERIODONTITE CRÔNICA: ENSAIO CLÍNICO
 16 TÍTULO: EFEITO DA TERAPIA PERIODONTAL NÃO CIRÚRGICA SOBRE O CONTROLE GLICÊMICO EM INDIVÍDUOS COM DIABETES TIPO2 E PERIODONTITE CRÔNICA: ENSAIO CLÍNICO CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS
16 TÍTULO: EFEITO DA TERAPIA PERIODONTAL NÃO CIRÚRGICA SOBRE O CONTROLE GLICÊMICO EM INDIVÍDUOS COM DIABETES TIPO2 E PERIODONTITE CRÔNICA: ENSAIO CLÍNICO CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS
CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA
 1 CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA AVALIAÇÃO CLÍNICA E MICROBIOLÓGICA DO USO SISTÊMICO DE METRONIDAZOL E AMOXICILINA COMO
1 CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA AVALIAÇÃO CLÍNICA E MICROBIOLÓGICA DO USO SISTÊMICO DE METRONIDAZOL E AMOXICILINA COMO
A INFLUÊNCIA DE ASPECTOS CONTEXTUAIS E INDIVIDUAIS NA DENTIÇÃO FUNCIONAL DE ADULTOS DO SUL DO BRASIL
 A INFLUÊNCIA DE ASPECTOS CONTEXTUAIS E INDIVIDUAIS NA DENTIÇÃO FUNCIONAL DE ADULTOS DO SUL DO BRASIL Annie Pozeczek Koltermann Jessye Melgarejo do Amaral Giordani Maria Teresa Anselmo Olinto Marcos Pascoal
A INFLUÊNCIA DE ASPECTOS CONTEXTUAIS E INDIVIDUAIS NA DENTIÇÃO FUNCIONAL DE ADULTOS DO SUL DO BRASIL Annie Pozeczek Koltermann Jessye Melgarejo do Amaral Giordani Maria Teresa Anselmo Olinto Marcos Pascoal
Diagnóstico avançado em Periodontia
 Diagnóstico avançado em Periodontia Carlos Marcelo S Figueredo, PhD Prof. Adjunto de Periodontia e Procientista da UERJ Pesquisador bolsista da FAPERJ e CNPq CONSULTA INICIAL 31/10/2010 7 EXAME RADIOGRÁFICO
Diagnóstico avançado em Periodontia Carlos Marcelo S Figueredo, PhD Prof. Adjunto de Periodontia e Procientista da UERJ Pesquisador bolsista da FAPERJ e CNPq CONSULTA INICIAL 31/10/2010 7 EXAME RADIOGRÁFICO
AUTOPERCEPÇÃO E GRAVIDADE DAS DOENÇAS PERIODONTAIS 1 AUTOPERCEPTION AND SEVERITY OF PERIODONTAL DISEASES
 Disciplinarum Scientia. Série: Ciências da Saúde, Santa Maria, v. 18, n. 3, p. 501-509, 2017. Recebido em: 25.09.2017. Aprovado em: 27.12.2017. ISSN 2177-3335 AUTOPERCEPÇÃO E GRAVIDADE DAS DOENÇAS PERIODONTAIS
Disciplinarum Scientia. Série: Ciências da Saúde, Santa Maria, v. 18, n. 3, p. 501-509, 2017. Recebido em: 25.09.2017. Aprovado em: 27.12.2017. ISSN 2177-3335 AUTOPERCEPÇÃO E GRAVIDADE DAS DOENÇAS PERIODONTAIS
enças sistêmicas, em especial, doença coronariana, acidente vascular cerebral, nascimento de bebês prematuros de baixo peso
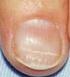 rioentes ou portadores de morbidade. Além disto, os gas -o mais bem distribuídos com saúde pública, possibilitando mais in -estimentos em áreas essenciais, na busca da melhoria "~,ida de todos e do bem-estar
rioentes ou portadores de morbidade. Além disto, os gas -o mais bem distribuídos com saúde pública, possibilitando mais in -estimentos em áreas essenciais, na busca da melhoria "~,ida de todos e do bem-estar
Um estudo de coorte de base populacional de saúde bucal no sul do Brasil: Estudo de Porto Alegre
 DOI: 10.1590/1980-5497201500020018 NOTAS E INFORMAÇÕES / NOTES AND INFORMATIONS Um estudo de coorte de base populacional de saúde bucal no sul do Brasil: Estudo de Porto Alegre A population-based cohort
DOI: 10.1590/1980-5497201500020018 NOTAS E INFORMAÇÕES / NOTES AND INFORMATIONS Um estudo de coorte de base populacional de saúde bucal no sul do Brasil: Estudo de Porto Alegre A population-based cohort
TATIANE OLIVEIRA SIROTTO
 MESTRADO EM ODONTOLOGIA Área de Concentração em Periodontia TATIANE OLIVEIRA SIROTTO RASPAGEM E ALISAMENTO RADICULAR ASSOCIADA AO METRONIDAZOL SISTÊMICO E AO BOCHECHO COM CLOREXIDINA NO TRATAMENTO DA PERIODONTITE
MESTRADO EM ODONTOLOGIA Área de Concentração em Periodontia TATIANE OLIVEIRA SIROTTO RASPAGEM E ALISAMENTO RADICULAR ASSOCIADA AO METRONIDAZOL SISTÊMICO E AO BOCHECHO COM CLOREXIDINA NO TRATAMENTO DA PERIODONTITE
UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM CLÍNICA ODONTOLÓGICA MESTRADO EM CLÍNICA ODONTOLÓGICA
 UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM CLÍNICA ODONTOLÓGICA MESTRADO EM CLÍNICA ODONTOLÓGICA PATRICIA AREZI PEIXOTO DUMER COMPARAÇÃO DA CONDIÇÃO
UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM CLÍNICA ODONTOLÓGICA MESTRADO EM CLÍNICA ODONTOLÓGICA PATRICIA AREZI PEIXOTO DUMER COMPARAÇÃO DA CONDIÇÃO
Influência das Variantes Genéticas Funcionais do Sistema Renina-Angiotensina na Doença Arterial Coronária.
 José Ramón Lanz Luces Influência das Variantes Genéticas Funcionais do Sistema Renina-Angiotensina na Doença Arterial Coronária. Tese apresentada à Faculdade de Medicina da Universidade de São Paulo para
José Ramón Lanz Luces Influência das Variantes Genéticas Funcionais do Sistema Renina-Angiotensina na Doença Arterial Coronária. Tese apresentada à Faculdade de Medicina da Universidade de São Paulo para
GRASIELLE VIEIRA CARNEIRO LEVANTAMENTO DA INCIDÊNCIA DE AGENESIAS DENTÁRIAS ENTRE 7 A 16 ANOS EM PACIENTES NA REGIÃO DE CAMPO GRANDE - MS
 GRASIELLE VIEIRA CARNEIRO LEVANTAMENTO DA INCIDÊNCIA DE AGENESIAS DENTÁRIAS ENTRE 7 A 16 ANOS EM PACIENTES NA REGIÃO DE CAMPO GRANDE - MS CAMPO GRANDE - MS 2008 GRASIELLE VIEIRA CARNEIRO LEVANTAMENTO DA
GRASIELLE VIEIRA CARNEIRO LEVANTAMENTO DA INCIDÊNCIA DE AGENESIAS DENTÁRIAS ENTRE 7 A 16 ANOS EM PACIENTES NA REGIÃO DE CAMPO GRANDE - MS CAMPO GRANDE - MS 2008 GRASIELLE VIEIRA CARNEIRO LEVANTAMENTO DA
COMPARAÇÃO ENTRE TESTE BANA E CHECKERBOARD DNA-DNA HYBRIDIZATION NO DIAGNÓSTICO PERIODONTAL INICIAL E NO MONITORAMENTO TERAPÊUTICO
 JOSÉ ALEXANDRE DE ANDRADE COMPARAÇÃO ENTRE TESTE BANA E CHECKERBOARD DNA-DNA HYBRIDIZATION NO DIAGNÓSTICO PERIODONTAL INICIAL E NO MONITORAMENTO TERAPÊUTICO Guarulhos 2005 Erro! i JOSÉ ALEXANDRE DE ANDRADE
JOSÉ ALEXANDRE DE ANDRADE COMPARAÇÃO ENTRE TESTE BANA E CHECKERBOARD DNA-DNA HYBRIDIZATION NO DIAGNÓSTICO PERIODONTAL INICIAL E NO MONITORAMENTO TERAPÊUTICO Guarulhos 2005 Erro! i JOSÉ ALEXANDRE DE ANDRADE
UNIVERSIDADE PAULISTA PREVALÊNCIA DAS DOENÇAS PERI-IMPLANTARES E SEUS INDICADORES DE RISCO ESTUDO TRANSVERSAL MULTICÊNTRICO
 UNIVERSIDADE PAULISTA PREVALÊNCIA DAS DOENÇAS PERI-IMPLANTARES E SEUS INDICADORES DE RISCO ESTUDO TRANSVERSAL MULTICÊNTRICO Dissertação apresentada ao Programa de Mestrado em Odontologia da Universidade
UNIVERSIDADE PAULISTA PREVALÊNCIA DAS DOENÇAS PERI-IMPLANTARES E SEUS INDICADORES DE RISCO ESTUDO TRANSVERSAL MULTICÊNTRICO Dissertação apresentada ao Programa de Mestrado em Odontologia da Universidade
MILENA MOREIRA DE ARAÚJO
 0 MILENA MOREIRA DE ARAÚJO CONDIÇÃO PERIODONTAL DE INDIVÍDUOS INTERNADOS EM UNIDADE DE TERAPIA INTENSIVA: ASPECTOS CLÍNICOS, EPIDEMIOLÓGICOS E MICROBIOLÓGICOS. Faculdade de Odontologia Universidade Federal
0 MILENA MOREIRA DE ARAÚJO CONDIÇÃO PERIODONTAL DE INDIVÍDUOS INTERNADOS EM UNIDADE DE TERAPIA INTENSIVA: ASPECTOS CLÍNICOS, EPIDEMIOLÓGICOS E MICROBIOLÓGICOS. Faculdade de Odontologia Universidade Federal
Classificação das periodontites em indivíduos jovens revisão da literatura e relato de casos clínicos
 24 Classificação das periodontites em indivíduos jovens revisão da literatura e relato de casos clínicos HAAS, Alex Nogueira * MORENO, Tatiana ** RÖSING, Cassiano Kuchenbecker *** RESUMO Inúmeros sistemas
24 Classificação das periodontites em indivíduos jovens revisão da literatura e relato de casos clínicos HAAS, Alex Nogueira * MORENO, Tatiana ** RÖSING, Cassiano Kuchenbecker *** RESUMO Inúmeros sistemas
Universidade do Grande Rio Prof. José de Souza Herdy UNIGRANRIO
 Universidade do Grande Rio Prof. José de Souza Herdy UNIGRANRIO Pablo Torquilho Duarte AVALIAÇÃO LONGITUDINAL DA COLONIZAÇÃO PERI-IMPLANTAR POR BACTÉRIAS ORAIS E NÃO ORAIS EM IMPLANTES DENTÁRIOS RECÉM
Universidade do Grande Rio Prof. José de Souza Herdy UNIGRANRIO Pablo Torquilho Duarte AVALIAÇÃO LONGITUDINAL DA COLONIZAÇÃO PERI-IMPLANTAR POR BACTÉRIAS ORAIS E NÃO ORAIS EM IMPLANTES DENTÁRIOS RECÉM
Paulo Henrique Marçal AVALIAÇÃO PERIODONTAL DE INDIVÍDUOS RESIDENTES NA CIDADE DE GURUPI - TO
 Paulo Henrique Marçal AVALIAÇÃO PERIODONTAL DE INDIVÍDUOS RESIDENTES NA CIDADE DE GURUPI - TO Taubaté-SP 2006 Livros Grátis http://www.livrosgratis.com.br Milhares de livros grátis para download. Paulo
Paulo Henrique Marçal AVALIAÇÃO PERIODONTAL DE INDIVÍDUOS RESIDENTES NA CIDADE DE GURUPI - TO Taubaté-SP 2006 Livros Grátis http://www.livrosgratis.com.br Milhares de livros grátis para download. Paulo
GABRIELA REZENDE AVALIAÇÃO DO POTENCIAL CARIOGÊNICO DA MALTODEXTRINA E DE SUA ASSOCIAÇÃO COM A SACAROSE. Porto Alegre, julho de 2015.
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO NÍVEL MESTRADO ÁREA DE CONCENTRAÇÃO CLÍNICA ODONTOLÓGICA CARIOLOGIA/DENTÍSTICA GABRIELA REZENDE AVALIAÇÃO DO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO NÍVEL MESTRADO ÁREA DE CONCENTRAÇÃO CLÍNICA ODONTOLÓGICA CARIOLOGIA/DENTÍSTICA GABRIELA REZENDE AVALIAÇÃO DO
UNIVERSIDADE DE TAUBATÉ Jefferson Dorighetto Bonifácio
 UNIVERSIDADE DE TAUBATÉ Jefferson Dorighetto Bonifácio AVALIAÇÃO PERIODONTAL E PRESENÇA DE PATÓGENOS PERIODONTAIS EM INDIVÍDUOS DA COMUNIDADE NEGRA (QUILOMBOLA) DE SANTO ANTÔNIO DO GUAPORÉ PAREADOS COM
UNIVERSIDADE DE TAUBATÉ Jefferson Dorighetto Bonifácio AVALIAÇÃO PERIODONTAL E PRESENÇA DE PATÓGENOS PERIODONTAIS EM INDIVÍDUOS DA COMUNIDADE NEGRA (QUILOMBOLA) DE SANTO ANTÔNIO DO GUAPORÉ PAREADOS COM
Com cálculo / Calculus presence / Con calculo. Com sangramento / Healthy gums / Con sangría
 99 4.2. Community Periodontal Index According to the Community Periodontal Index (CPI), 35% of workers are healthy. Most who present problems have calculus (40%), followed by those who have superficial
99 4.2. Community Periodontal Index According to the Community Periodontal Index (CPI), 35% of workers are healthy. Most who present problems have calculus (40%), followed by those who have superficial
AVALIAÇÃO DA EFICÁCIA CLÍNICA E MICROBIANA DE
 Braz J Periodontol - September 2013 - volume 23 - issue 03 AVALIAÇÃO DA EFICÁCIA CLÍNICA E MICROBIANA DE DOIS PROTOCOLOS TERAPÊUTICOS PERIODONTAIS Clinical and microbial efficacy of two periodontal therapeutic
Braz J Periodontol - September 2013 - volume 23 - issue 03 AVALIAÇÃO DA EFICÁCIA CLÍNICA E MICROBIANA DE DOIS PROTOCOLOS TERAPÊUTICOS PERIODONTAIS Clinical and microbial efficacy of two periodontal therapeutic
UNIVERSIDADE FEDERAL DA BAHIA FACULDADE DE MEDICINA DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
 UNIVERSIDADE FEDERAL DA BAHIA FACULDADE DE MEDICINA DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE CARVEL SUPRIEN CARACTERIZAÇÃO DAS MANIFESTAÇÕES CLÍNICAS, E RESPOSTA AO TRATAMENTO EM CRIANÇAS
UNIVERSIDADE FEDERAL DA BAHIA FACULDADE DE MEDICINA DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE CARVEL SUPRIEN CARACTERIZAÇÃO DAS MANIFESTAÇÕES CLÍNICAS, E RESPOSTA AO TRATAMENTO EM CRIANÇAS
Avaliação do osso alveolar em pacientes com doenças crônico-inflamatórias. Carlos Marcelo Figueredo
 Avaliação do osso alveolar em pacientes com doenças crônico-inflamatórias Carlos Marcelo Figueredo Carlos Marcelo Figueredo Fumo Diabetes Osteoporose AIDS Fatores de risco Fatores genéticos Síndrome de
Avaliação do osso alveolar em pacientes com doenças crônico-inflamatórias Carlos Marcelo Figueredo Carlos Marcelo Figueredo Fumo Diabetes Osteoporose AIDS Fatores de risco Fatores genéticos Síndrome de
Estudo Comparativo da Prevalência de Periodontopatógenos Suspeitos entre Mães e Filhos*
 v. Revista 32, n. de 1, Odontologia 2003 da UNESP, São Estudo Paulo, Comparativo v. 32, n. 1, 19-24, da Prevalência 2003. de Periodontopatógenos Suspeitos entre Mães e Filhos 2003 19 Estudo Comparativo
v. Revista 32, n. de 1, Odontologia 2003 da UNESP, São Estudo Paulo, Comparativo v. 32, n. 1, 19-24, da Prevalência 2003. de Periodontopatógenos Suspeitos entre Mães e Filhos 2003 19 Estudo Comparativo
CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA
 CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA PERFIL MICROBIOLÓGICO ASSOCIADO AO POLIMORFISMO DO GENE DO RECEPTOR DA VITAMINA D (VDR)
CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA PERFIL MICROBIOLÓGICO ASSOCIADO AO POLIMORFISMO DO GENE DO RECEPTOR DA VITAMINA D (VDR)
MARCEL APARÍCIO CAMPOS BERNAL
 MESTRADO EM ODONTOLOGIA Área de Concentração em Periodontia MARCEL APARÍCIO CAMPOS BERNAL AVALIAÇÃO CLÍNICA PERIODONTAL E RECOLONIZAÇÃO BACTERIANA SUBGENGIVAL APÓS RASPAGEM E ALISAMENTO RADICULAR EM INDIVÍDUOS
MESTRADO EM ODONTOLOGIA Área de Concentração em Periodontia MARCEL APARÍCIO CAMPOS BERNAL AVALIAÇÃO CLÍNICA PERIODONTAL E RECOLONIZAÇÃO BACTERIANA SUBGENGIVAL APÓS RASPAGEM E ALISAMENTO RADICULAR EM INDIVÍDUOS
JULIANA ALETHUSA VELLOSO MENDES
 MESTRADO EM ODONTOLOGIA Área de Concentração em Periodontia JULIANA ALETHUSA VELLOSO MENDES RASPAGEM E ALISAMENTO RADICULAR ASSOCIADO AO CONTROLE QUÍMICO (LOCAL E SISTÊMICO) DO BIOFILME DENTAL NO TRATAMENTO
MESTRADO EM ODONTOLOGIA Área de Concentração em Periodontia JULIANA ALETHUSA VELLOSO MENDES RASPAGEM E ALISAMENTO RADICULAR ASSOCIADO AO CONTROLE QUÍMICO (LOCAL E SISTÊMICO) DO BIOFILME DENTAL NO TRATAMENTO
MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA MARCELO DA ROCHA
 MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA MARCELO DA ROCHA EFEITOS CLÍNICOS E MICROBIOLÓGICOS DA ASSOCIAÇÃO SISTÊMICA DE AZITROMICINA À RASPAGEM E ALISAMENTO RADICULAR EM INDIVÍDUOS COM
MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA MARCELO DA ROCHA EFEITOS CLÍNICOS E MICROBIOLÓGICOS DA ASSOCIAÇÃO SISTÊMICA DE AZITROMICINA À RASPAGEM E ALISAMENTO RADICULAR EM INDIVÍDUOS COM
STELLA DE NORONHA CAMPOS MENDES
 DOUTORADO EM ODONTOLOGIA Área de Concentração em Periodontia STELLA DE NORONHA CAMPOS MENDES INFLUÊNCIA DA TERAPIA PERIODONTAL ANTIMICROBIANA LOCAL E SISTÊMICA NA COMPOSIÇÃO DA MICROBIOTA DE DIFERENTES
DOUTORADO EM ODONTOLOGIA Área de Concentração em Periodontia STELLA DE NORONHA CAMPOS MENDES INFLUÊNCIA DA TERAPIA PERIODONTAL ANTIMICROBIANA LOCAL E SISTÊMICA NA COMPOSIÇÃO DA MICROBIOTA DE DIFERENTES
Código: 6 Dados do trabalho:
 Código: 6 Dados do trabalho: Prevalência de dor em escolares da Rede Municipal de Ensino de Teutônia/RS MATIAS NOLL (UFRGS); CLÁUDIA TARRAGÔ CANDOTTI (UFRGS); BRUNA NICHELE DA ROSA (UFRGS); ADRIANE VIEIRA
Código: 6 Dados do trabalho: Prevalência de dor em escolares da Rede Municipal de Ensino de Teutônia/RS MATIAS NOLL (UFRGS); CLÁUDIA TARRAGÔ CANDOTTI (UFRGS); BRUNA NICHELE DA ROSA (UFRGS); ADRIANE VIEIRA
FABIANO ARAÚJO CUNHA
 0 FABIANO ARAÚJO CUNHA ASPECTOS EPIDEMIOLÓGICOS, CLÍNICOS E MICROBIOLÓGICOS DA ASSOCIAÇÃO ENTRE O TRANSTORNO AFETIVO BIPOLAR E PERIODONTITE FACULDADE DE ODONTOLOGIA UNIVERSIDADE FEDERAL DE MINAS GERAIS
0 FABIANO ARAÚJO CUNHA ASPECTOS EPIDEMIOLÓGICOS, CLÍNICOS E MICROBIOLÓGICOS DA ASSOCIAÇÃO ENTRE O TRANSTORNO AFETIVO BIPOLAR E PERIODONTITE FACULDADE DE ODONTOLOGIA UNIVERSIDADE FEDERAL DE MINAS GERAIS
Universidade Paulista UNIP
 Universidade Paulista UNIP Avaliação e correlação de parâmetros clínicos e microbiológicos após seis e doze meses da instalação de próteses com limites cervicais supra e subgengivais (contribuição ao estudo)
Universidade Paulista UNIP Avaliação e correlação de parâmetros clínicos e microbiológicos após seis e doze meses da instalação de próteses com limites cervicais supra e subgengivais (contribuição ao estudo)
Procedimentos Cirúrgicos de Interesse Protético/Restaurador - Aumento de Coroa Clínica - Prof. Luiz Augusto Wentz
 1 2 3 Procedimentos Cirúrgicos de Interesse Protético/Restaurador - Aumento de Coroa Clínica - Prof. Luiz Augusto Wentz Aumento de Coroa Clínica Qualquer procedimento (cirúrgico ou não-cirúrgico) que vise
1 2 3 Procedimentos Cirúrgicos de Interesse Protético/Restaurador - Aumento de Coroa Clínica - Prof. Luiz Augusto Wentz Aumento de Coroa Clínica Qualquer procedimento (cirúrgico ou não-cirúrgico) que vise
Avaliação do padrão e número de sítios de fosforilação (EPIYA) da proteína CagA de H. pylori e risco de carcinoma gástrico e úlcera duodenal
 UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS CURSO DE PÓS-GRADUAÇÃO EM MICROBIOLOGIA Avaliação do padrão e número de sítios de fosforilação (EPIYA) da proteína CagA de H. pylori
UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS CURSO DE PÓS-GRADUAÇÃO EM MICROBIOLOGIA Avaliação do padrão e número de sítios de fosforilação (EPIYA) da proteína CagA de H. pylori
PREVALÊNCIA DA PERIODONTITE AGRESSIVA NOS INDIVÍDUOS DE 15 A 30 ANOS MORADORES DE PALMAS-TO
 1 Amilton Santos PREVALÊNCIA DA PERIODONTITE AGRESSIVA NOS INDIVÍDUOS DE 15 A 30 ANOS MORADORES DE PALMAS-TO Taubaté - SP 2006 Livros Grátis http://www.livrosgratis.com.br Milhares de livros grátis para
1 Amilton Santos PREVALÊNCIA DA PERIODONTITE AGRESSIVA NOS INDIVÍDUOS DE 15 A 30 ANOS MORADORES DE PALMAS-TO Taubaté - SP 2006 Livros Grátis http://www.livrosgratis.com.br Milhares de livros grátis para
Desenvolvendo um protocolo de pesquisa. Profª Gracian Li Pereira Fundamentos de Pesquisa 4º período FACIMED 2011/2
 Desenvolvendo um protocolo de pesquisa Profª Gracian Li Pereira Fundamentos de Pesquisa 4º período FACIMED 2011/2 Carta de intenções Que pesquisa é proposta? Com que problema o projeto de pesquisa está
Desenvolvendo um protocolo de pesquisa Profª Gracian Li Pereira Fundamentos de Pesquisa 4º período FACIMED 2011/2 Carta de intenções Que pesquisa é proposta? Com que problema o projeto de pesquisa está
Avaliação clínica e microbiana da terapia periodontal mecânica em indivíduos com periodontite crônica
 Avaliação clínica e microbiana da terapia periodontal mecânica em indivíduos com periodontite crônica Clinical and microbiological evaluation of periodontal mechanical therapy in chronic periodontitis
Avaliação clínica e microbiana da terapia periodontal mecânica em indivíduos com periodontite crônica Clinical and microbiological evaluation of periodontal mechanical therapy in chronic periodontitis
NOVA CLASSIFICAÇÃO DAS PERIODONTITES ADAPTADO DO RELATÓRIO DE CONSENSO DO
 NOVA CLASSIFICAÇÃO DAS PERIODONTITES ADAPTADO DO RELATÓRIO DE CONSENSO DO 2017 WORLD WORKSHOP ON THE CLASSIFICATION OF PERIODONTAL AND PERI-IMPLANT DISEASES AND CONDITIONS NEW CLASSIFICATION OF PERIODONTITIS
NOVA CLASSIFICAÇÃO DAS PERIODONTITES ADAPTADO DO RELATÓRIO DE CONSENSO DO 2017 WORLD WORKSHOP ON THE CLASSIFICATION OF PERIODONTAL AND PERI-IMPLANT DISEASES AND CONDITIONS NEW CLASSIFICATION OF PERIODONTITIS
das Clínicas da Faculdade de Medicina da Universidade de São Paulo: características clínicas e microbiológicas
 GISELE MADEIRA DUBOC DE ALMEIDA Rhodotorula spp. isoladas de hemocultura no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo: características clínicas e microbiológicas Tese
GISELE MADEIRA DUBOC DE ALMEIDA Rhodotorula spp. isoladas de hemocultura no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo: características clínicas e microbiológicas Tese
Introdução. Doenças periodontais
 Introdução 1 O objeto de estudo da periodontia são os tecidos que suportam os dentes, o periodonto. Fazem parte do periodonto os tecidos que circundam os dentes e os fixam na maxila e na mandíbula (lat.:
Introdução 1 O objeto de estudo da periodontia são os tecidos que suportam os dentes, o periodonto. Fazem parte do periodonto os tecidos que circundam os dentes e os fixam na maxila e na mandíbula (lat.:
UNIVERSIDADE DE TAUBATÉ Camila Borges Fernandes
 UNIVERSIDADE DE TAUBATÉ Camila Borges Fernandes PREVALÊNCIA DE BACTÉRIAS PERIODONTOPATOGÊNICAS NO SULCO GENGIVAL E MUCOSAS BUCAIS EM CRIANÇAS E ADOLESCENTES E SUA ASSOCIAÇÃO COM IDADE, SEXO E CONDIÇÃO
UNIVERSIDADE DE TAUBATÉ Camila Borges Fernandes PREVALÊNCIA DE BACTÉRIAS PERIODONTOPATOGÊNICAS NO SULCO GENGIVAL E MUCOSAS BUCAIS EM CRIANÇAS E ADOLESCENTES E SUA ASSOCIAÇÃO COM IDADE, SEXO E CONDIÇÃO
IDENTIFICAÇÃO E QUANTIFICAÇÃO DE MICRORGANISMOS EM INFECÇÕES PERIAPICAIS CRÔNICAS PÓS-TERAPIA ENDODÔNTICA
 UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS DA SAÚDE PROGRAMA DE PÓS GRADUAÇÃO EM CLÍNICA ODONTOLÓGICA MESTRADO PROFISSIONAL EM CLÍNICA ODONTOLÓGICA WEDERSON TAVARES FURTADO IDENTIFICAÇÃO
UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS DA SAÚDE PROGRAMA DE PÓS GRADUAÇÃO EM CLÍNICA ODONTOLÓGICA MESTRADO PROFISSIONAL EM CLÍNICA ODONTOLÓGICA WEDERSON TAVARES FURTADO IDENTIFICAÇÃO
Temas para Sugestão de Aulas para Exame Geral de Qualificação
 1- Tecidos Periodontais - Anatomia dos tecidos periodontais - Características histológicas dos tecidos periodontais 2- Etiologia da Doença Periodontal - Fatores locais Etiologia Microbiana - Fatores locais
1- Tecidos Periodontais - Anatomia dos tecidos periodontais - Características histológicas dos tecidos periodontais 2- Etiologia da Doença Periodontal - Fatores locais Etiologia Microbiana - Fatores locais
AVALIAÇÃO CLÍNICA E MICROBIOLÓGICA DE INDIVÍDUOS TABAGISTAS E NÃO-TABAGISTAS COM PERIODONTITE CRÔNICA
 CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA AVALIAÇÃO CLÍNICA E MICROBIOLÓGICA DE INDIVÍDUOS TABAGISTAS E NÃO-TABAGISTAS COM PERIODONTITE
CENTRO DE PÓS-GRADUAÇÃO, PESQUISA E EXTENSÃO CURSO DE MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA AVALIAÇÃO CLÍNICA E MICROBIOLÓGICA DE INDIVÍDUOS TABAGISTAS E NÃO-TABAGISTAS COM PERIODONTITE
INTRODUÇÃO VOL Nº 01 - MARÇO Mestres em periodontia - UNITAU. Especialista em biologia molecular - UNITAU
 PRESENÇA DE PERIODONTO PATÓGENOS EM JOVENS E ADULTOS DA REGIÃO CENTRO-OESTE/NORTE DO BRASIL Presence of periodontal pathogens in young and adults subjects from Central-West/North regions of Brazil Paulo
PRESENÇA DE PERIODONTO PATÓGENOS EM JOVENS E ADULTOS DA REGIÃO CENTRO-OESTE/NORTE DO BRASIL Presence of periodontal pathogens in young and adults subjects from Central-West/North regions of Brazil Paulo
RESUMO OBESIDADE E ASMA: CARACTERIZAÇÃO CLÍNICA E LABORATORIAL DE UMA ASSOCIAÇÃO FREQUENTE. INTRODUÇÃO: A asma e a obesidade são doenças crônicas com
 RESUMO OBESIDADE E ASMA: CARACTERIZAÇÃO CLÍNICA E LABORATORIAL DE UMA ASSOCIAÇÃO FREQUENTE. INTRODUÇÃO: A asma e a obesidade são doenças crônicas com prevalência elevada em todo mundo. Indivíduos obesos
RESUMO OBESIDADE E ASMA: CARACTERIZAÇÃO CLÍNICA E LABORATORIAL DE UMA ASSOCIAÇÃO FREQUENTE. INTRODUÇÃO: A asma e a obesidade são doenças crônicas com prevalência elevada em todo mundo. Indivíduos obesos
MESTRADO EM ODONTOLOGIA EISLA ALLINE GOMES DE LIRA
 MESTRADO EM ODONTOLOGIA EISLA ALLINE GOMES DE LIRA ANÁLISE DA ASSOCIAÇÃO DOS NÍVEIS DE MICRORGANISMOS DO DOMÍNIO ARCHAEA E O PERFIL BACTERIANO EM AMOSTRAS DE BIOFILME SUBGENGIVAL DE INDIVÍDUOS COM PERIODONTITE
MESTRADO EM ODONTOLOGIA EISLA ALLINE GOMES DE LIRA ANÁLISE DA ASSOCIAÇÃO DOS NÍVEIS DE MICRORGANISMOS DO DOMÍNIO ARCHAEA E O PERFIL BACTERIANO EM AMOSTRAS DE BIOFILME SUBGENGIVAL DE INDIVÍDUOS COM PERIODONTITE
COMPARAÇÃO DE CRITÉRIOS DE DIAGNÓSTICO CLÍNICO DE PERIODONTITE EM DIABÉTICOS Comparison of clinical diagnostic criteria of periodontitis in diabetics
 Braz J Periodontol September 6 volume 6 issue 3 COMPARAÇÃO DE CRITÉRIOS DE DIAGNÓSTICO CLÍNICO DE PERIODONTITE EM DIABÉTICOS Comparison of clinical diagnostic criteria of periodontitis in diabetics Darcyla
Braz J Periodontol September 6 volume 6 issue 3 COMPARAÇÃO DE CRITÉRIOS DE DIAGNÓSTICO CLÍNICO DE PERIODONTITE EM DIABÉTICOS Comparison of clinical diagnostic criteria of periodontitis in diabetics Darcyla
Departamento de Pediatria Journal Club. Apresentadora: Eleutéria Macanze 26 de Julho, 2017
 Departamento de Pediatria Journal Club Apresentadora: Eleutéria Macanze 26 de Julho, 2017 Introdução Nos países em que a Malária é endémica a Organização Mundial de Saúde (OMS) recomenda testes de Malária
Departamento de Pediatria Journal Club Apresentadora: Eleutéria Macanze 26 de Julho, 2017 Introdução Nos países em que a Malária é endémica a Organização Mundial de Saúde (OMS) recomenda testes de Malária
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM ODONTOLOGIA NÍVEL MESTRADO
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM ODONTOLOGIA NÍVEL MESTRADO ÁREA DE CONCENTRAÇÃO CLÍNICA ODONTOLÓGICA - PERIODONTIA Linha de pesquisa: Epidemiologia,
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM ODONTOLOGIA NÍVEL MESTRADO ÁREA DE CONCENTRAÇÃO CLÍNICA ODONTOLÓGICA - PERIODONTIA Linha de pesquisa: Epidemiologia,
AGENESIA DO SEGUNDO PRÉ-MOLAR INFERIOR: AVALIAÇÃO OCLUSAL E RADICULAR DO CORRESPONDENTE DECÍDUO
 INSTITUTO SUPERIOR DE CIÊNCIAS DA SAÚDE NORTE DISSERTAÇÃO PARA OBTENÇÃO DO GRAU DE MESTRE EM ORTODONTIA AGENESIA DO SEGUNDO PRÉ-MOLAR INFERIOR: AVALIAÇÃO OCLUSAL E RADICULAR DO CORRESPONDENTE DECÍDUO Ana
INSTITUTO SUPERIOR DE CIÊNCIAS DA SAÚDE NORTE DISSERTAÇÃO PARA OBTENÇÃO DO GRAU DE MESTRE EM ORTODONTIA AGENESIA DO SEGUNDO PRÉ-MOLAR INFERIOR: AVALIAÇÃO OCLUSAL E RADICULAR DO CORRESPONDENTE DECÍDUO Ana
METODOLOGIA EPIDEMIOLOGICA
 METODOLOGIA EPIDEMIOLOGICA CLASSIFICAÇÃO DOS ESTUDOS EPIDEMIOLÓGICOS: ESTUDOS DESCRITIVOS Os estudos descritivos objetivam informar sobre a distribuição de um evento, na população, em termos quantitativos.
METODOLOGIA EPIDEMIOLOGICA CLASSIFICAÇÃO DOS ESTUDOS EPIDEMIOLÓGICOS: ESTUDOS DESCRITIVOS Os estudos descritivos objetivam informar sobre a distribuição de um evento, na população, em termos quantitativos.
Controle mecânico e químico da placa dentária supragengival associado à raspagem e alisamento radicular - estudo clínico e microbiológico.
 Marcelo de Faveri Controle mecânico e químico da placa dentária supragengival associado à raspagem e alisamento radicular - estudo clínico e microbiológico. Guarulhos 2005 II Marcelo de Faveri Controle
Marcelo de Faveri Controle mecânico e químico da placa dentária supragengival associado à raspagem e alisamento radicular - estudo clínico e microbiológico. Guarulhos 2005 II Marcelo de Faveri Controle
MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA
 MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA MARIA JOSEFA MESTNIK EFEITOS CLÍNICOS E MICROBIOLÓGICOS DA ASSOCIAÇÃO DE AMOXICILINA E METRONIDAZOL À RASPAGEM E ALISAMENTO RADICULAR EM INDIVÍDUOS
MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA MARIA JOSEFA MESTNIK EFEITOS CLÍNICOS E MICROBIOLÓGICOS DA ASSOCIAÇÃO DE AMOXICILINA E METRONIDAZOL À RASPAGEM E ALISAMENTO RADICULAR EM INDIVÍDUOS
RASPAGEM ASSOCIADA À AMOXICILINA E METRONIDAZOL EM PACIENTE COM PERIODONTITE CRÔNICA. AVALIAÇÃO CLÍNICA DE 11 MESES.
 RASPAGEM ASSOCIADA À AMOXICILINA E METRONIDAZOL EM PACIENTE COM PERIODONTITE CRÔNICA. AVALIAÇÃO CLÍNICA DE 11 MESES. Fábia Guimarães Paes Passos, Maria Cláudia Goulart Santos, Ana Cristina de Oliveira
RASPAGEM ASSOCIADA À AMOXICILINA E METRONIDAZOL EM PACIENTE COM PERIODONTITE CRÔNICA. AVALIAÇÃO CLÍNICA DE 11 MESES. Fábia Guimarães Paes Passos, Maria Cláudia Goulart Santos, Ana Cristina de Oliveira
Marcelo de Paiva Raffaelli ETIOLOGIA DA DOENÇA PERIODONTAL: REVISÃO DE LITERATURA. Universidade Fernando Pessoa Faculdade de Ciências da Saúde
 Marcelo de Paiva Raffaelli ETIOLOGIA DA DOENÇA PERIODONTAL: REVISÃO DE LITERATURA Universidade Fernando Pessoa Faculdade de Ciências da Saúde Porto, 2016 Marcelo de Paiva Raffaelli ETIOLOGIA DA DOENÇA
Marcelo de Paiva Raffaelli ETIOLOGIA DA DOENÇA PERIODONTAL: REVISÃO DE LITERATURA Universidade Fernando Pessoa Faculdade de Ciências da Saúde Porto, 2016 Marcelo de Paiva Raffaelli ETIOLOGIA DA DOENÇA
INTRODUÇÃO. R. Periodontia - Março Volume 19 - Número 01. Especialista em Periodontia, Departamento de Periodontia UNITAU
 R. Periodontia - Março 2009 - Volume 19 - Número 01 O IMPACTO DO HÁBITO DE FUMAR SOBRE A CONDIÇÃO CLÍNICA PERIODONTAL E A PREVALÊNCIA DE PATÓGENOS PERIODONTAIS The impact of the habit of smoking on the
R. Periodontia - Março 2009 - Volume 19 - Número 01 O IMPACTO DO HÁBITO DE FUMAR SOBRE A CONDIÇÃO CLÍNICA PERIODONTAL E A PREVALÊNCIA DE PATÓGENOS PERIODONTAIS The impact of the habit of smoking on the
Determinantes comportamentais do excesso de peso e obesidade em adolescentes de 17 anos estudo EPITeen
 Ana Sofia Pereira Azevedo Determinantes comportamentais do excesso de peso e obesidade em adolescentes de 17 anos estudo EPITeen Porto 2011 Resumo Introdução: A prevalência de obesidade tem vindo a aumentar,
Ana Sofia Pereira Azevedo Determinantes comportamentais do excesso de peso e obesidade em adolescentes de 17 anos estudo EPITeen Porto 2011 Resumo Introdução: A prevalência de obesidade tem vindo a aumentar,
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA ESPECIALIZAÇÃO EM ATENÇÃO ESPECIALIZADA EM SAÚDE / PERIODONTIA
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA ESPECIALIZAÇÃO EM ATENÇÃO ESPECIALIZADA EM SAÚDE / PERIODONTIA ANÁLISE DESCRITIVA DO PERFIL DEMOGRÁFICO E DOS PROCEDIMENTOS REALIZADOS
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA ESPECIALIZAÇÃO EM ATENÇÃO ESPECIALIZADA EM SAÚDE / PERIODONTIA ANÁLISE DESCRITIVA DO PERFIL DEMOGRÁFICO E DOS PROCEDIMENTOS REALIZADOS
UNIVERSIDADE DE TAUBATÉ Paulo Roberto Orzechowski
 UNIVERSIDADE DE TAUBATÉ Paulo Roberto Orzechowski EXISTE UMA ASSOCIAÇÃO ENTRE A COLONIZAÇÃO DE PATÓGENOS PERIODONTAIS E A FREQUÊNCIA DE SOROTIPOS ESPECÍFICOS DE AGGREGATIBACTER ACTINOMYCETEMCOMITANS? Taubaté
UNIVERSIDADE DE TAUBATÉ Paulo Roberto Orzechowski EXISTE UMA ASSOCIAÇÃO ENTRE A COLONIZAÇÃO DE PATÓGENOS PERIODONTAIS E A FREQUÊNCIA DE SOROTIPOS ESPECÍFICOS DE AGGREGATIBACTER ACTINOMYCETEMCOMITANS? Taubaté
Tamanho: Cor: Limites: Consistência: Base: Bordas: Superfície: Dor: Tempo de evolução: Fator etiológico provável:
 Uso do laboratório M / REQUISIÇÃO DE EXAME MICROBIOLÓGICO Material recebido em: / / Visto: 1. INFORMAÇÕES DO PACIENTE Nome: Matrícula ou Prontuário: Idade: C.P.F. Sexo (M/F): Raça: Cor: Profissão: Estado
Uso do laboratório M / REQUISIÇÃO DE EXAME MICROBIOLÓGICO Material recebido em: / / Visto: 1. INFORMAÇÕES DO PACIENTE Nome: Matrícula ou Prontuário: Idade: C.P.F. Sexo (M/F): Raça: Cor: Profissão: Estado
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA TRABALHO DE CONCLUSÃO DE CURSO DE ODONTOLOGIA
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA TRABALHO DE CONCLUSÃO DE CURSO DE ODONTOLOGIA Natália Morsch Beier Thais Scussel Guarda AVALIAÇÃO DA INFLUÊNCIA DE DOIS TIPOS DE AMARRILHOS
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL FACULDADE DE ODONTOLOGIA TRABALHO DE CONCLUSÃO DE CURSO DE ODONTOLOGIA Natália Morsch Beier Thais Scussel Guarda AVALIAÇÃO DA INFLUÊNCIA DE DOIS TIPOS DE AMARRILHOS
MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA TAMIRES SZEREMESKE DE MIRANDA
 MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA TAMIRES SZEREMESKE DE MIRANDA METRONIDAZOL E AMOXICILINA SISTÊMICOS ADJUNTOS À RASPAGEM E ALISAMENTO RADICULAR NO TRATAMENTO DE PERIODONTITE
MESTRADO EM ODONTOLOGIA ÁREA DE CONCENTRAÇÃO EM PERIODONTIA TAMIRES SZEREMESKE DE MIRANDA METRONIDAZOL E AMOXICILINA SISTÊMICOS ADJUNTOS À RASPAGEM E ALISAMENTO RADICULAR NO TRATAMENTO DE PERIODONTITE
Periodontite crônica em pacientes adultos fumantes e não fumantes
 crônica em pacientes adultos fumantes e não fumantes Maitê Michel Piazza Aluna de graduação da Faculdade Meridional-IMED, Rua Major Cândido Cony - 488, Getúlio Vargas, RS, Brasil. E-mail: .
crônica em pacientes adultos fumantes e não fumantes Maitê Michel Piazza Aluna de graduação da Faculdade Meridional-IMED, Rua Major Cândido Cony - 488, Getúlio Vargas, RS, Brasil. E-mail: .
Delineamento de estudo caso-controle
 Delineamento de estudo caso-controle EXPOSTOS EXPOSIÇÃO AO FATOR DE RISCO CASOS/CONTROLES POPULAÇÃO SIM NÃO SIM NÃO TEMPO PESQUISA CASOS (Apresentam a doença) CONTROLES (Não apresentam a doença) Estimativa
Delineamento de estudo caso-controle EXPOSTOS EXPOSIÇÃO AO FATOR DE RISCO CASOS/CONTROLES POPULAÇÃO SIM NÃO SIM NÃO TEMPO PESQUISA CASOS (Apresentam a doença) CONTROLES (Não apresentam a doença) Estimativa
Doenças gengivais induzidas por placa
 Doenças gengivais induzidas por placa Classificação (AAP 1999) Doenças Gengivais Induzidas por placa Não induzidas por placa MODIFICADA Associada só a placa Fatores sistêmicos Medicação Má nutrição Classificação
Doenças gengivais induzidas por placa Classificação (AAP 1999) Doenças Gengivais Induzidas por placa Não induzidas por placa MODIFICADA Associada só a placa Fatores sistêmicos Medicação Má nutrição Classificação
TÍTULO: EFEITO DO CONSUMO CRÔNICO DE ÁLCOOL NO TECIDO ÓSSEO EM EXPERIMENTO COM RATOS
 Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: EFEITO DO CONSUMO CRÔNICO DE ÁLCOOL NO TECIDO ÓSSEO EM EXPERIMENTO COM RATOS CATEGORIA: CONCLUÍDO
Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: EFEITO DO CONSUMO CRÔNICO DE ÁLCOOL NO TECIDO ÓSSEO EM EXPERIMENTO COM RATOS CATEGORIA: CONCLUÍDO
EDUARDO SOUZA DE LOBÃO VERAS. Avaliação de possíveis novos patógenos periodontais: estudos de Associação e Eliminação
 Doutorado em Odontologia Área de concentração em Periodontia EDUARDO SOUZA DE LOBÃO VERAS Avaliação de possíveis novos patógenos periodontais: estudos de Associação e Eliminação Guarulhos 2013 EDUARDO
Doutorado em Odontologia Área de concentração em Periodontia EDUARDO SOUZA DE LOBÃO VERAS Avaliação de possíveis novos patógenos periodontais: estudos de Associação e Eliminação Guarulhos 2013 EDUARDO
PLACA BACTERIANA DENTAL COMO UM BIOFILME DENTAL BACTERIAL PLAQUE AS A BIOFILM. Resumo. Abstract. Unitermos
 PLACA BACTERIANA DENTAL COMO UM BIOFILME 8Paula Milena Melo Casais* Iolanda Souza Moreira* Luiz Gaudencio Passos Moreira* Marcos Luan Lima Oliveira* Érica Del Peloso Ribeiro** Gisela Estela Rapp*** Unitermos
PLACA BACTERIANA DENTAL COMO UM BIOFILME 8Paula Milena Melo Casais* Iolanda Souza Moreira* Luiz Gaudencio Passos Moreira* Marcos Luan Lima Oliveira* Érica Del Peloso Ribeiro** Gisela Estela Rapp*** Unitermos
AVALIAÇÃO DA RESPOSTA IMUNE EM PACIENTES COM LEISHMANIOSE MUCOSA TRATADOS COM ANTIMONIAL
 RESUMO AVALIAÇÃO DA RESPOSTA IMUNE EM PACIENTES COM LEISHMANIOSE MUCOSA TRATADOS COM ANTIMONIAL PENTAVALENTE E PENTOXIFILINA Introdução: A leishmaniose mucosa (LM) é uma forma grave de apresentação da
RESUMO AVALIAÇÃO DA RESPOSTA IMUNE EM PACIENTES COM LEISHMANIOSE MUCOSA TRATADOS COM ANTIMONIAL PENTAVALENTE E PENTOXIFILINA Introdução: A leishmaniose mucosa (LM) é uma forma grave de apresentação da
A PROMOÇÃO DE AÇÕES ODONTOLÓGICAS PREVENTIVAS COMO CONSEQUÊNCIA DE LEVANTAMENTO EPIDEMIOLÓGICO EM ESCOLARES DE PALMAS TO¹
 A PROMOÇÃO DE AÇÕES ODONTOLÓGICAS PREVENTIVAS COMO CONSEQUÊNCIA DE LEVANTAMENTO EPIDEMIOLÓGICO EM ESCOLARES DE PALMAS TO¹ SANTOS, M. A.²; BORGES, T. S.³; CAVALCANTE, M. P. R. 4 ¹Parte do Projeto Situação
A PROMOÇÃO DE AÇÕES ODONTOLÓGICAS PREVENTIVAS COMO CONSEQUÊNCIA DE LEVANTAMENTO EPIDEMIOLÓGICO EM ESCOLARES DE PALMAS TO¹ SANTOS, M. A.²; BORGES, T. S.³; CAVALCANTE, M. P. R. 4 ¹Parte do Projeto Situação
IRINEU GREGNANIN PEDRON
 IRINEU GREGNANIN PEDRON DETECÇÃO POR PCR DE Porphyromonas gingivalis E DOS GENÓTIPOS fima II, IV E ragb+ NO BIOFILME SUBGENGIVAL, ANTES E 180 DIAS APÓS O TRATAMENTO PERIODONTAL CONVENCIONAL E ASSOCIADO
IRINEU GREGNANIN PEDRON DETECÇÃO POR PCR DE Porphyromonas gingivalis E DOS GENÓTIPOS fima II, IV E ragb+ NO BIOFILME SUBGENGIVAL, ANTES E 180 DIAS APÓS O TRATAMENTO PERIODONTAL CONVENCIONAL E ASSOCIADO
Doenças Periodontais. Doenças periodontais. Saúde Periodontal. Saúde Periodontal 16/10/2018
 Doenças Periodontais Doenças periodontais Profa. Dra. Marcia P.A.Mayer Universidade de São Paulo Instituto de Ciências Biomédicas Departamento de Microbiologia Laboratório de Microbiologia Oral Inflamação
Doenças Periodontais Doenças periodontais Profa. Dra. Marcia P.A.Mayer Universidade de São Paulo Instituto de Ciências Biomédicas Departamento de Microbiologia Laboratório de Microbiologia Oral Inflamação
DOS TECIDOS BUCAIS. Periodontopatias. Pulpopatias. Periapicopatias TIPOS: -INCIPIENTE -CRÔNICA -HIPERPLÁSICA. Causada pelo biofilme bacteriano
 LESÕES INFLAMATÓRIAS DOS TECIDOS BUCAIS PERIODONTOPATIAS PERIODONTOPATIAS DOENÇAS DO PERIODONTO Periodontopatias Pulpopatias Periapicopatias Inflamação limitada aos tecidos moles que circundam os dentes(tec.peridentais).
LESÕES INFLAMATÓRIAS DOS TECIDOS BUCAIS PERIODONTOPATIAS PERIODONTOPATIAS DOENÇAS DO PERIODONTO Periodontopatias Pulpopatias Periapicopatias Inflamação limitada aos tecidos moles que circundam os dentes(tec.peridentais).
ODONTOLOGIA PREVENTIVA. Saúde Bucal. Periodontite. Sua saúde começa pela boca!
 ODONTOLOGIA PREVENTIVA Saúde Bucal Periodontite. Sua saúde começa pela boca! O que é doença periodontal ou periodontite? ESMALTE DENTINA GENGIVAS POLPA PERIODONTITE OSSO ALVEOLAR CEMENTO NERVOS E VASOS
ODONTOLOGIA PREVENTIVA Saúde Bucal Periodontite. Sua saúde começa pela boca! O que é doença periodontal ou periodontite? ESMALTE DENTINA GENGIVAS POLPA PERIODONTITE OSSO ALVEOLAR CEMENTO NERVOS E VASOS
Estudo Epidemiológico de Saúde Bucal em Trabalhadores da Indústria
 Estudo Epidemiológico de Saúde Bucal em Trabalhadores da Indústria Epidemiologic Study of Oral Health in Industry Workers Estudio Epidemiológico de Salud Bucal en Trabajadores de la Industria PRESID NCIA
Estudo Epidemiológico de Saúde Bucal em Trabalhadores da Indústria Epidemiologic Study of Oral Health in Industry Workers Estudio Epidemiológico de Salud Bucal en Trabajadores de la Industria PRESID NCIA
Consultoria para realizar pesquisa para estimar a prevalência de nascimentos pré-termo no Brasil e explorar possíveis causas
 ANEXO 2 UNICEF Brasil Consultoria para realizar pesquisa para estimar a prevalência de nascimentos pré-termo no Brasil e explorar possíveis causas Documento técnico com análise dos fatores associados à
ANEXO 2 UNICEF Brasil Consultoria para realizar pesquisa para estimar a prevalência de nascimentos pré-termo no Brasil e explorar possíveis causas Documento técnico com análise dos fatores associados à
A influência do sexo e da idade na prevalência de bolsas periodontais. The influence of gender and age on the prevalence of periodontal pockets
 Pesq Odont Bras v. 14, n. 1, p. 33-37, jan./mar. 2000. Periodontia A influência do sexo e da idade na prevalência de bolsas periodontais The influence of gender and age on the prevalence of periodontal
Pesq Odont Bras v. 14, n. 1, p. 33-37, jan./mar. 2000. Periodontia A influência do sexo e da idade na prevalência de bolsas periodontais The influence of gender and age on the prevalence of periodontal
Efeito do controle do biofilme supragengival na condição periodontal de pacientes tabagistas uma revisão sistemática
 REVISÃO DE LITERATURA Efeito do controle do biofilme supragengival na condição periodontal de pacientes tabagistas uma revisão sistemática Effect of supragingival plaque control on periodontal disease
REVISÃO DE LITERATURA Efeito do controle do biofilme supragengival na condição periodontal de pacientes tabagistas uma revisão sistemática Effect of supragingival plaque control on periodontal disease
Consumo de alimentos ultraprocessados e nível socioeconômico: uma análise transversal do Estudo Longitudinal de Saúde do Adulto (ELSA-Brasil)
 ERRATum erratum In the article "Consumption of ultra-processed foods and socioeconomic position: a crosssectional analysis of the Brazilian Longitudinal Study of Adult Health", with DOI: 10.1590/0102-311X000197,
ERRATum erratum In the article "Consumption of ultra-processed foods and socioeconomic position: a crosssectional analysis of the Brazilian Longitudinal Study of Adult Health", with DOI: 10.1590/0102-311X000197,
FERNANDA SAMPAIO RAMIRO
 MESTRADO EM ODONTOLOGIA ÀREA DE CONCENTRAÇÃO EM PERIODONTIA FERNANDA SAMPAIO RAMIRO ANÁLISE QUANTITATIVA DOS NÍVEIS DE MICRORGANISMOS DO DOMÍNIO ARCHAEA PRESENTES NO BIOFILME SUBGENGIVAL DE INDIVÍDUOS
MESTRADO EM ODONTOLOGIA ÀREA DE CONCENTRAÇÃO EM PERIODONTIA FERNANDA SAMPAIO RAMIRO ANÁLISE QUANTITATIVA DOS NÍVEIS DE MICRORGANISMOS DO DOMÍNIO ARCHAEA PRESENTES NO BIOFILME SUBGENGIVAL DE INDIVÍDUOS
IMPACTO DA UTILIZAÇÃO DE DIFERENTES CRITÉRIOS CLÍNICOS DIAGNÓSTICOS NA PREVALÊNCIA, ASSOCIAÇÃO CAUSAL E EXTENSÃO DA DOENÇA PERIODONTAL
 Alessandra Neves Guimarães IMPACTO DA UTILIZAÇÃO DE DIFERENTES CRITÉRIOS CLÍNICOS DIAGNÓSTICOS NA PREVALÊNCIA, ASSOCIAÇÃO CAUSAL E EXTENSÃO DA DOENÇA PERIODONTAL UNIVERSIDADE FEDERAL DE MINAS GERAIS BELO
Alessandra Neves Guimarães IMPACTO DA UTILIZAÇÃO DE DIFERENTES CRITÉRIOS CLÍNICOS DIAGNÓSTICOS NA PREVALÊNCIA, ASSOCIAÇÃO CAUSAL E EXTENSÃO DA DOENÇA PERIODONTAL UNIVERSIDADE FEDERAL DE MINAS GERAIS BELO
Prevalência de periodontite agressiva em adolescentes e adultos jovens do Vale do Paraíba
 Pesqui Odontol Bras 2002;16(2):163-168 Periodontia Prevalência de periodontite agressiva em adolescentes e adultos jovens do Vale do Paraíba Prevalence of aggressive periodontitis in adolescents and young
Pesqui Odontol Bras 2002;16(2):163-168 Periodontia Prevalência de periodontite agressiva em adolescentes e adultos jovens do Vale do Paraíba Prevalence of aggressive periodontitis in adolescents and young
RAFAELA CALLEGARI CARNEIRO. PREVALÊNCIA DE DEPRESSÃO EM IDOSOS NO BRASIL: Uma Revisão de Literatura
 RAFAELA CALLEGARI CARNEIRO PREVALÊNCIA DE DEPRESSÃO EM IDOSOS NO BRASIL: Uma Revisão de Literatura Belo Horizonte 2010 RAFAELA CALLEGARI CARNEIRO PREVALÊNCIA DE DEPRESSÃO EM IDOSOS NO BRASIL: Uma Revisão
RAFAELA CALLEGARI CARNEIRO PREVALÊNCIA DE DEPRESSÃO EM IDOSOS NO BRASIL: Uma Revisão de Literatura Belo Horizonte 2010 RAFAELA CALLEGARI CARNEIRO PREVALÊNCIA DE DEPRESSÃO EM IDOSOS NO BRASIL: Uma Revisão
&CONDIÇÕES DE HIGIENE BUCAL E HÁBITOS
 R e s u m o E x p a n d i d o &CONDIÇÕES DE HIGIENE BUCAL E HÁBITOS EM PACIENTES COM FISSURA LABIOPALATINA Marcos Roberto Tovani Palone 1 Thaieny Ribeiro da Silva 2 Cristiane Denise da Silva Moralejo 3
R e s u m o E x p a n d i d o &CONDIÇÕES DE HIGIENE BUCAL E HÁBITOS EM PACIENTES COM FISSURA LABIOPALATINA Marcos Roberto Tovani Palone 1 Thaieny Ribeiro da Silva 2 Cristiane Denise da Silva Moralejo 3
MESTRADO EM ODONTOLOGIA ANTÔNIO CARLOS GARCIA DE OLIVEIRA
 MESTRADO EM ODONTOLOGIA ANTÔNIO CARLOS GARCIA DE OLIVEIRA Caracterização do perfil microbiológico do biofilme subgengival de indivíduos com periodontite crônica e com saúde periodontal por meio do estudo
MESTRADO EM ODONTOLOGIA ANTÔNIO CARLOS GARCIA DE OLIVEIRA Caracterização do perfil microbiológico do biofilme subgengival de indivíduos com periodontite crônica e com saúde periodontal por meio do estudo
