Eylea. aflibercept. O que é o Eylea? Para que é utilizado o Eylea? Resumo do EPAR destinado ao público
|
|
|
- Mario Derek Gameiro Avelar
- 7 Há anos
- Visualizações:
Transcrição
1 EMA/677928/2015 EMEA/H/C/ Resumo do EPAR destinado ao público aflibercept Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité dos Medicamentos para Uso Humano (CHMP) avaliou o medicamento a fim de emitir um parecer favorável à concessão de uma autorização de introdução no mercado, bem como as suas recomendações sobre as condições de utilização do. O que é o? O é um medicamento que contém a substância ativa aflibercept. Está disponível sob a forma de solução para injeção intravítrea em seringas pré-cheias ou frascos para injetáveis. Para que é utilizado o? O é utilizado para o tratamento de adultos com: a forma «húmida» da degenerescência macular relacionada com a idade (DMI), uma doença que afeta a parte central da retina (chamada mácula) no fundo do olho. A forma húmida da DMI é causada pela neovascularização coroideia (crescimento anormal de vasos sanguíneos sob a mácula) que pode provocar derrame de fluido e sangue e causar inchaço; diminuição da visão devido a edema (inchaço) macular causado pelo bloqueio da veia principal que transporta o sangue da retina (denominado oclusão da veia central da retina, OVCR) ou pelo bloqueio de ramificações mais pequenas da veia central (denominado oclusão de ramo da veia retiniana, ORVR); diminuição da visão devido a edema macular causado pela diabetes; diminuição da visão devido a neovascularização coroideia causada por miopia patológica (um tipo grave de miopia em que o globo ocular continua a crescer, atingindo um tamanho superior ao que deveria ter). 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 A mácula é responsável pela visão central necessária para ver os pormenores essenciais à realização de tarefas quotidianas, tais como conduzir, ler e reconhecer rostos. A doença causa a perda gradual da parte central da visão. O medicamento só pode ser obtido mediante receita médica. Como se utiliza o? O deve ser administrado na forma de uma injeção intravítrea (injeção no humor vítreo, o líquido gelatinoso no interior do olho) por um médico qualificado, com experiência na administração de injeções intravítreas. Na DMI húmida, o tratamento consiste numa injeção de 2 mg por mês no olho afetado, durante três meses consecutivos, seguida de uma injeção de dois em dois meses. Após um ano de tratamento, as injeções podem ser administradas com menos frequência, dependendo da resposta ao mesmo. No edema macular causado por OVCR ou ORVR, o tratamento é iniciado com injeções mensais de 2 mg no olho afetado, podendo o intervalo entre as injeções ser alargado dependendo da resposta do doente. Caso os doentes não respondam ao tratamento, este não deve ser prosseguido. No edema macular diabético, o tratamento consiste numa injeção de 2 mg por mês no olho afetado, durante cinco meses consecutivos, seguida de uma injeção de dois em dois meses. Após um ano de tratamento, as injeções podem ser administradas com menos frequência, dependendo da resposta ao mesmo. Caso os doentes não respondam ao tratamento, este deve ser interrompido. Na neovascularização coroideia causada por miopia patológica, o tratamento é de uma única injeção de 2 mg no olho afetado. Em caso de persistência da doença, podem ser administradas injeções adicionais, não devendo o intervalo entre as mesmas ser inferior a um mês. O procedimento deve ser realizado em condições estéreis. A seringa e o frasco para injetáveis destinam-se apenas a uma única utilização. A seringa pré-cheia contém uma quantidade superior à dose recomendada. Por conseguinte, ao preparar a injeção, o médico deve expelir o volume em excesso e assegurar a injeção da dose correta. Após a injeção, é necessário verificar a pressão no interior do olho. Como funciona o? O aflibercept é uma proteína produzida por engenharia genética que foi concebida especificamente para se fixar a uma substância chamada fator de crescimento endotelial vascular A (VEGF-A) e bloquear os seus efeitos. Pode também fixar-se a outras proteínas, como o fator de crescimento placentar (PlGF). O VEGF-A e o PlGF estão envolvidos na estimulação do crescimento anormal de vasos sanguíneos em doentes com DMI, em certos tipos de edema macular e na neovascularização coroidea causada por miopatia patológica. Ao bloquear estes fatores, o aflibercept reduz o crescimento dos vasos sanguíneos e controla o derrame de fluido e o inchaço. Como foi estudado o? O foi analisado em dois estudos principais que incluíram cerca de 2400 doentes com a forma húmida de DMI. Os estudos compararam o (administrado na dose de 0,5 mg de quatro em quatro semanas, 2 mg de quatro em quatro semanas ou 2 mg de oito em oito semanas, todas após três doses mensais iniciais) com o ranibizumab, um outro tratamento para a DMI, administrado na EMA/677928/2015 Página 2/5
3 forma de injeção intravítrea de quatro em quatro semanas. O principal parâmetro de eficácia foi a percentagem de doentes que manteve a visão (definida como a perda de menos de 15 letras num teste de visão padrão) após o primeiro ano de tratamento. Estes dois estudos analisaram também a manutenção do efeito no segundo ano de tratamento, durante o qual o número de injeções e o intervalo entre as mesmas foram ajustados em função da visão e das alterações no interior do olho. O foi também investigado em dois outros estudos principais que incluíram um total de 366 doentes com edema macular causado por OVCR. Estes estudos compararam as injeções mensais de na dose de 2 mg com uma injeção simulada utilizando uma seringa sem agulha. Um outro estudo principal que incluiu 181 doentes com edema macular causado por ORVR comparou as injeções mensais de 2 mg com o tratamento com laser. Em todos os estudos, o principal parâmetro de eficácia foi a percentagem de doentes que responderam ao tratamento e cuja visão melhorou em 15 ou mais letras num teste de visão após 24 semanas de tratamento. Os estudos nos doentes com edema macular causado por OVCR também analisaram os efeitos do tratamento efetuado de acordo com a necessidade após 24 semanas. Dois estudos adicionais que incluíram 872 doentes com edema macular diabético analisaram o efeito do em comparação com o tratamento com laser. O foi administrado uma vez por mês ou de dois em dois meses após as primeiras cinco injeções mensais. O principal parâmetro de eficácia nos dois estudos foi a alteração no número de letras que podia ser lido num teste de visão após um ano de tratamento. Na neovascularização coroideia causada por miopatia patológica, o foi estudado em 122 doentes num estudo que comparou o com uma injeção simulada. O principal parâmetro de eficácia foi a alteração no número de letras que podia ser lido num teste de visão após 24 semanas de tratamento. Qual o benefício demonstrado pelo durante os estudos? O demonstrou ser tão eficaz como o ranibizumab na manutenção da visão nos doentes com DMI húmida: considerando os resultados dos dois estudos em conjunto, as percentagens de doentes que mantiveram a visão corresponderam a 96,1 % (517 em 538), 95,4 % (533 em 559) e 95,3 % (510 em 535) no caso, respetivamente, de 0,5 mg de de quatro em quatro semanas, 2 mg de de quatro em quatro semanas e 2 mg de de oito em oito semanas, em comparação com 94,4 % (508 em 538) dos doentes tratados com o ranibizumab de quatro em quatro semanas. De um modo geral, a eficácia manteve-se durante o segundo ano de tratamento, tendo a maioria dos doentes recebido injeções num intervalo entre doses alargado de 10 semanas, apesar de um número pequeno de doentes ter ocasionalmente necessitado de injeções mais frequentes (por exemplo, mensalmente). O também melhorou significativamente a visão em doentes com edema macular causado por OVCR e ORVR. Na OVCR, globalmente, cerca de 60 % dos doentes tratados com o registaram uma melhoria de 15 ou mais letras no teste de visão à semana 24, comparativamente a 17 % dos doentes que receberam as injeções simuladas. O benefício do tratamento efetuado de acordo com a necessidade manteve-se, em larga medida, até 52 semanas, embora parte do benefício pareça ter-se perdido nos doentes tratados e seguidos durante períodos mais longos. Na ORVR, globalmente, cerca de 53 % dos doentes tratados com o registaram uma melhoria de 15 ou mais letras no teste de visão à semana 24, comparativamente a 27 % dos doentes que receberam o tratamento com laser. Este efeito manteve-se até 52 semanas, apesar de uma administração menos frequente do entre a semana 24 e 52. EMA/677928/2015 Página 3/5
4 Nos doentes com edema macular diabético, o número médio de letras que conseguiam ler num teste de visão antes do tratamento era de cerca de 59 a 60; nos doentes tratados com o mensalmente, este número aumentou cerca de 12 letras e, nos tratados com o de dois em dois meses, cerca de 11 letras. Em comparação, nos doentes tratados com laser, a melhoria após um ano foi de apenas 1 letra. No estudo na neovascularização coroideia causada por miopia patológica, o número médio de letras que os doentes podiam ler num teste de visão antes do tratamento era de cerca de 56; os doentes tratados com o podiam ler, em média, mais doze letras após 24 semanas de tratamento, comparativamente a uma diminuição, em média, de duas letras, nos doentes que receberam a injeção simulada. Qual é o risco associado ao? Os efeitos secundários mais frequentes (que afetam pelos menos 1 em cada 20 doentes) comunicados relativamente ao são hemorragia conjuntival (hemorragia dos pequenos vasos sanguíneos na superfície do olho no local da injeção), diminuição da visão, dor ocular, descolamento do vítreo (descolamento da substância gelatinosa no interior do olho), catarata (turvação do cristalino), flocos vítreos (pequenas partículas ou manchas na visão) e aumento da pressão intraocular (aumento da pressão no interior do olho). Os efeitos secundários graves (que ocorreram em menos de 1 em cada 2200 injeções) incluem cegueira, endoftalmite (inflamação no interior do olho), catarata, aumento da pressão intraocular, hemorragia do vítreo (hemorragia no fluido gelatinoso no olho, causando perda temporária da visão) e descolamento do vítreo ou da retina. Para a lista completa dos efeitos secundários comunicados relativamente ao, consulte o Folheto Informativo. O é contraindicado em doentes que têm ou que se pensa terem infeções oculares ou perioculares (infeções nos olhos ou em torno destes) ou em doentes com inflamação grave no interior do olho. Para a lista completa de restrições de utilização do, consulte o Folheto Informativo. Por que foi aprovado o? O CHMP observou que, na DMI húmida, o foi tão eficaz como o ranibizumab na manutenção da visão dos doentes após o primeiro ano de tratamento. Além disso, o CHMP considerou que o tem um efeito benéfico na melhoria da visão dos doentes com edema macular devido a OVCR, ORVR ou diabetes, bem como em doentes com neovascularização coroideia causada por miopia patológica. O CHMP constatou também não existirem preocupações de segurança significativas ou inesperadas com o. Por conseguinte, o CHMP concluiu que os benefícios do são superiores aos seus riscos e recomendou a concessão de uma autorização de introdução no mercado para o medicamento. Que medidas estão a ser adotadas para garantir a utilização segura do? Foi desenvolvido um plano de gestão dos riscos para garantir a utilização segura do. Com base neste plano, foram incluídas informações de segurança no Resumo das Características do Medicamento e no Folheto Informativo do, incluindo as precauções apropriadas a observar pelos profissionais de saúde e pelos doentes. A empresa responsável pelo fabrico do fornecerá também material educativo atualizado aos médicos (para minimizar os riscos associados à injeção ocular) e aos doentes (para que estes possam reconhecer qualquer efeito secundário grave e saibam quando devem consultar o seu médico com EMA/677928/2015 Página 4/5
5 urgência). Além disso, a empresa realizará um estudo para investigar a utilização do a intervalos mais alargados em doentes com edema macular diabético, bem como um estudo para analisar os efeitos do tratamento com o quando administrado de acordo com a necessidade na DMI húmida. Outras informações sobre o Em 22 de novembro de 2012, a Comissão Europeia concedeu uma Autorização de Introdução no Mercado, válida para toda a União Europeia, para o medicamento. O EPAR completo relativo ao pode ser consultado no sítio Internet da Agência em: ema.europa.eu/find medicine/human medicines/european public assessment reports. Para mais informações sobre o tratamento com o, leia o Folheto Informativo (também parte do EPAR) ou contacte o seu médico ou farmacêutico. Este resumo foi atualizado pela última vez em EMA/677928/2015 Página 5/5
O Pradaxa é um medicamento que contém a substância ativa etexilato de dabigatran. Está disponível em cápsulas (75, 110 e 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Resumo do EPAR destinado ao público etexilato de dabigatran Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo
EMA/47517/2015 EMEA/H/C/000829 Resumo do EPAR destinado ao público etexilato de dabigatran Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo
No mieloma múltiplo, um cancro de um tipo de glóbulos brancos denominados células plasmáticas, o Revlimid é utilizado:
 EMA/113870/2017 EMEA/H/C/000717 Resumo do EPAR destinado ao público lenalidomida Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a Agência
EMA/113870/2017 EMEA/H/C/000717 Resumo do EPAR destinado ao público lenalidomida Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a Agência
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
Para obter informações práticas sobre a utilização do Opdivo, os doentes devem ler o Folheto Informativo ou contactar o seu médico ou farmacêutico.
 EMA/691693/2017 EMEA/H/C/003985 Resumo do EPAR destinado ao público nivolumab Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a Agência
EMA/691693/2017 EMEA/H/C/003985 Resumo do EPAR destinado ao público nivolumab Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a Agência
Materiais educacionais para profissionais de saúde e doentes que utilizam o medicamento para a diabetes Suliqua
 19 de janeiro de 2017 EMA/747766/2016 Materiais educacionais para profissionais de saúde e doentes que utilizam o medicamento para a diabetes Medidas destinadas a reduzir o risco de confusão entre duas
19 de janeiro de 2017 EMA/747766/2016 Materiais educacionais para profissionais de saúde e doentes que utilizam o medicamento para a diabetes Medidas destinadas a reduzir o risco de confusão entre duas
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM
 INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM PERDA DA VISÃO DEVIDA A NEOVASCULARIZAÇÃO COROIDEIA ASSOCIADA À MIOPIA PATOLÓGICA (NVC MIÓPICA) Este medicamento está sujeito a monitorização
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM PERDA DA VISÃO DEVIDA A NEOVASCULARIZAÇÃO COROIDEIA ASSOCIADA À MIOPIA PATOLÓGICA (NVC MIÓPICA) Este medicamento está sujeito a monitorização
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
O Metacam é um medicamento veterinário que contém a substância ativa meloxicam.
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Resumo do EPAR destinado ao público meloxicam Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a
EMA/CVMP/259397/2006 EMEA/V/C/000033 Resumo do EPAR destinado ao público meloxicam Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM
 INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM PERDA DA VISÃO DEVIDA A EDEMA MACULAR DIABÉTICO (EMD) Este medicamento está sujeito a monitorização adicional Versão 1 EMD (outubro/2014)
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM PERDA DA VISÃO DEVIDA A EDEMA MACULAR DIABÉTICO (EMD) Este medicamento está sujeito a monitorização adicional Versão 1 EMD (outubro/2014)
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM RECOMENDAÇÕES PARA O MÉDICO
 INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM RECOMENDAÇÕES PARA O MÉDICO Este medicamento está sujeito a monitorização adicional Versão 6, outubro 2016 INFORMAÇÕES GERAIS Antes do início do tratamento
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM RECOMENDAÇÕES PARA O MÉDICO Este medicamento está sujeito a monitorização adicional Versão 6, outubro 2016 INFORMAÇÕES GERAIS Antes do início do tratamento
Deliberação n.º 62/CD/2017
 Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Eylia (aflibercepte) Bayer S.A. Solução injetável 40 mg/ml
 Eylia (aflibercepte) Bayer S.A. Solução injetável 40 mg/ml EYLIA aflibercepte APRESENTAÇÕES: Eylia (aflibercepte) apresenta-se em forma de em frascos-ampola. Cada frasco-ampola contém um volume de enchimento
Eylia (aflibercepte) Bayer S.A. Solução injetável 40 mg/ml EYLIA aflibercepte APRESENTAÇÕES: Eylia (aflibercepte) apresenta-se em forma de em frascos-ampola. Cada frasco-ampola contém um volume de enchimento
Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento
 23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 25 January 2018 EMA/PRAC/35596/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião do
25 January 2018 EMA/PRAC/35596/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião do
TEMA: USO DO RANIBIZUMABE NA OCLUSÃO DE DE VEIA RETINIANA CENTRAL
 NOTA TÉCNICA 141/2014 Solicitante Emerson Chaves Motta Juíza de Direito - Comarca de Teófilo Otoni - MG. Processo número: 0686 14 010142-5 Data: 18/07/2014 Medicamento X Material Procedimento Cobertura
NOTA TÉCNICA 141/2014 Solicitante Emerson Chaves Motta Juíza de Direito - Comarca de Teófilo Otoni - MG. Processo número: 0686 14 010142-5 Data: 18/07/2014 Medicamento X Material Procedimento Cobertura
A EMA confirma as recomendações para minimizar o risco da infeção cerebral LMP com Tysabri
 25/04/2016 EMA/266665/2016 A EMA confirma as recomendações para minimizar o risco da infeção cerebral LMP com Deve considerar-se a realização mais frequente de exames de IRM para os doentes de maior risco
25/04/2016 EMA/266665/2016 A EMA confirma as recomendações para minimizar o risco da infeção cerebral LMP com Deve considerar-se a realização mais frequente de exames de IRM para os doentes de maior risco
Vacina pneumocócica polissacárida conjugada (13-valente, adsorvida)
 EMA/90006/2015 EMEA/H/C/001104 Resumo do EPAR destinado ao público Vacina pneumocócica polissacárida conjugada (13-valente, adsorvida) Este é um resumo do Relatório Público Europeu de Avaliação (EPAR)
EMA/90006/2015 EMEA/H/C/001104 Resumo do EPAR destinado ao público Vacina pneumocócica polissacárida conjugada (13-valente, adsorvida) Este é um resumo do Relatório Público Europeu de Avaliação (EPAR)
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 10 November 2016 EMA/PRAC/730053/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC Adotado na reunião do PRAC de 24-27 de
10 November 2016 EMA/PRAC/730053/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC Adotado na reunião do PRAC de 24-27 de
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Eylea 40 mg/ml solução injetável em seringa pré-cheia 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 ml de solução injetável contém
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Eylea 40 mg/ml solução injetável em seringa pré-cheia 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 ml de solução injetável contém
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE SAÚDE SUBSECRETARIA JURÍDICA NÚCLEO DE ASSESSORIA TÉCNICA EM AÇÕES DE SAÚDE
 PARECER TÉCNICO/SES/SJ/NAT Nº 3760/2017 Rio de Janeiro, 14 de dezembro de 2017. O presente parecer visa atender à solicitação de informações técnicas do 1 o Juizado Especial Fazendário da Comarca da Capital
PARECER TÉCNICO/SES/SJ/NAT Nº 3760/2017 Rio de Janeiro, 14 de dezembro de 2017. O presente parecer visa atender à solicitação de informações técnicas do 1 o Juizado Especial Fazendário da Comarca da Capital
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 15 September 2016 EMA/PRAC/603540/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
15 September 2016 EMA/PRAC/603540/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
Conselhos atualizados relativos à utilização de ibuprofeno de dose alta
 22 de maio de 2015 EMA/325007/2015 Conselhos atualizados relativos à utilização de ibuprofeno de dose alta Revisão confirma risco cardiovascular pequeno com doses diárias iguais ou superiores a 2400 mg
22 de maio de 2015 EMA/325007/2015 Conselhos atualizados relativos à utilização de ibuprofeno de dose alta Revisão confirma risco cardiovascular pequeno com doses diárias iguais ou superiores a 2400 mg
Este documento apresenta respostas às perguntas mais frequentes recebidas pela Agência Europeia de Medicamentos (EMA).
 13 de fevereiro de 2017 EMA/527628/2011 Rev. 1 Direção Este documento apresenta respostas às perguntas mais frequentes recebidas pela Agência Europeia de Medicamentos (EMA). Caso não encontre aqui resposta
13 de fevereiro de 2017 EMA/527628/2011 Rev. 1 Direção Este documento apresenta respostas às perguntas mais frequentes recebidas pela Agência Europeia de Medicamentos (EMA). Caso não encontre aqui resposta
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
 25 February 2016 EMA/PRAC/137770/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
25 February 2016 EMA/PRAC/137770/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
Guia de Tratamento com JETREA (Ocriplasmina) para o doente
 Guia de Tratamento com JETREA (Ocriplasmina) para o doente [Contém informação de segurança importante] Este medicamento está sujeito a monitorização adicional. 3ª versão aprovada pelo INFARMED, I.P. em
Guia de Tratamento com JETREA (Ocriplasmina) para o doente [Contém informação de segurança importante] Este medicamento está sujeito a monitorização adicional. 3ª versão aprovada pelo INFARMED, I.P. em
O Avastin é utilizado em associação com outros medicamentos contra o cancro no tratamento de adultos com os seguintes tipos de cancro:
 EMA/175824/2015 EMEA/H/C/000582 Resumo do EPAR destinado ao público bevacizumab Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
EMA/175824/2015 EMEA/H/C/000582 Resumo do EPAR destinado ao público bevacizumab Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
Agência Europeia de Medicamentos recomenda alterações à utilização da metoclopramida
 20 de dezembro de 2013 EMA/13239/2014 Corr. 1 Agência Europeia de Medicamentos recomenda alterações à utilização da As alterações destinam-se principalmente a reduzir o risco de efeitos secundários neurológicos
20 de dezembro de 2013 EMA/13239/2014 Corr. 1 Agência Europeia de Medicamentos recomenda alterações à utilização da As alterações destinam-se principalmente a reduzir o risco de efeitos secundários neurológicos
403/2014. Ranibizumabe (Lucentis ) para tratamento da Retinopatia diabética
 05/07/2014 403/2014 Ranibizumabe (Lucentis ) para tratamento da Retinopatia diabética SOLICITANTE : Dr Leopoldo Mameluque. Juiz de Direito da Comarca de Montes Claros/MG NÚMERO DO PROCESSO: 433.14.026306-5
05/07/2014 403/2014 Ranibizumabe (Lucentis ) para tratamento da Retinopatia diabética SOLICITANTE : Dr Leopoldo Mameluque. Juiz de Direito da Comarca de Montes Claros/MG NÚMERO DO PROCESSO: 433.14.026306-5
Manual do utilizador para notificações na internet
 Proteção da saúde do doente O presente manual do utilizador para notificações na internet fornece informações sobre os elementos de dados, o esquema, a interpretação e as funcionalidades da notificação
Proteção da saúde do doente O presente manual do utilizador para notificações na internet fornece informações sobre os elementos de dados, o esquema, a interpretação e as funcionalidades da notificação
LUCENTIS (ranibizumabe)
 LUCENTIS (ranibizumabe) Novartis Biociências SA Solução para injeção 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3
LUCENTIS (ranibizumabe) Novartis Biociências SA Solução para injeção 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3
URGÊNCIAS EM OFTALMOLOGIA
 URGÊNCIAS EM OFTALMOLOGIA SEGMENTO POSTERIOR Ana Vergamota, José Pedro Silva SEGMENTO POSTERIOR ESCLERA Íris Córnea PUPILA CRISTALINO CONJUNTIVA Vítreo Coróide Nervo óptico Mácula RE T IN A SINTOMAS Diminuição
URGÊNCIAS EM OFTALMOLOGIA SEGMENTO POSTERIOR Ana Vergamota, José Pedro Silva SEGMENTO POSTERIOR ESCLERA Íris Córnea PUPILA CRISTALINO CONJUNTIVA Vítreo Coróide Nervo óptico Mácula RE T IN A SINTOMAS Diminuição
Lucentis. (ranibizumabe) Novartis Biociências SA Solução Injetável 10 mg/ml
 Lucentis (ranibizumabe) Novartis Biociências SA Solução Injetável 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Solução para injeção a 10 mg/ml. Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe
Lucentis (ranibizumabe) Novartis Biociências SA Solução Injetável 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Solução para injeção a 10 mg/ml. Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe
GUIA PARA O TRATAMENTO COM LUCENTIS (RANIBIZUMAB)
 GUIA PARA O TRATAMENTO COM LUCENTIS (RANIBIZUMAB) Para a perda de visão devida a neovascularização coroideia (NVC) Informação importante para o doente SECÇÃO 1 SOBRE LUCENTIS Este caderno de informação
GUIA PARA O TRATAMENTO COM LUCENTIS (RANIBIZUMAB) Para a perda de visão devida a neovascularização coroideia (NVC) Informação importante para o doente SECÇÃO 1 SOBRE LUCENTIS Este caderno de informação
LUCENTIS ranibizumabe
 LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada
LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM
 INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE (DMI) NEOVASCULAR (HÚMIDA) Este medicamento está sujeito a monitorização adicional Versão
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE (DMI) NEOVASCULAR (HÚMIDA) Este medicamento está sujeito a monitorização adicional Versão
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 OZURDEX ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Implante biodegradável para uso oftálmico (intravítreo) dexametasona 0,7 mg BULA PARA O PACIENTE Bula para o Paciente APRESENTAÇÕES Implante biodegradável para
OZURDEX ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Implante biodegradável para uso oftálmico (intravítreo) dexametasona 0,7 mg BULA PARA O PACIENTE Bula para o Paciente APRESENTAÇÕES Implante biodegradável para
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 12 October 2017 EMA/PRAC/662569/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião do
12 October 2017 EMA/PRAC/662569/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião do
APROVADO EM INFARMED. Folheto informativo: Informação para o utilizador
 Folheto informativo: Informação para o utilizador ILUVIEN 190 microgramas implante intravítreo em aplicador Acetonido de fluocinolona Leia com atenção todo este folheto antes de começar a utilizar este
Folheto informativo: Informação para o utilizador ILUVIEN 190 microgramas implante intravítreo em aplicador Acetonido de fluocinolona Leia com atenção todo este folheto antes de começar a utilizar este
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR ditebooster Suspensão injectável, seringa pré-cheia Vacina para difteria e tétano (adsorvida, reduzido conteúdo antigénico) Leia atentamente este folheto
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR ditebooster Suspensão injectável, seringa pré-cheia Vacina para difteria e tétano (adsorvida, reduzido conteúdo antigénico) Leia atentamente este folheto
NOVO ROL DA ANS TRATAMENTO OCULAR QUIMIOTERÁPICO COM ANTIANGIOGÊNICO 2018 / 2019
 NOVO ROL DA ANS TRATAMENTO OCULAR QUIMIOTERÁPICO COM ANTIANGIOGÊNICO 2018 / 2019 DMRI EMD OVC ORVC DMRI COBERTURA OBRIGATÓRIA PARA PACIENTES COM DIAGNÓSTICO DE DEGENERAÇÃO MACULAR RELACIONADA A IDADE (DMRI)
NOVO ROL DA ANS TRATAMENTO OCULAR QUIMIOTERÁPICO COM ANTIANGIOGÊNICO 2018 / 2019 DMRI EMD OVC ORVC DMRI COBERTURA OBRIGATÓRIA PARA PACIENTES COM DIAGNÓSTICO DE DEGENERAÇÃO MACULAR RELACIONADA A IDADE (DMRI)
APROVADO EM INFARMED. Folheto informativo: Informação para o utilizador. Ceretec 0,5 mg Pó para solução injetável Exametazima
 Folheto informativo: Informação para o utilizador Ceretec 0,5 mg Pó para solução injetável Exametazima Leia com atenção todo este folheto antes de começar a utilizar este medicamento - Conserve este folheto.
Folheto informativo: Informação para o utilizador Ceretec 0,5 mg Pó para solução injetável Exametazima Leia com atenção todo este folheto antes de começar a utilizar este medicamento - Conserve este folheto.
Água para Preparações Injectáveis Basi 100% solvente/veículo para uso parentérico
 Folheto informativo: Informação para o utilizador Água para Preparações Injectáveis Basi 100% solvente/veículo para uso parentérico Água para Preparações Injectáveis Leia com atenção todo este folheto
Folheto informativo: Informação para o utilizador Água para Preparações Injectáveis Basi 100% solvente/veículo para uso parentérico Água para Preparações Injectáveis Leia com atenção todo este folheto
SABER MAIS SOBRE DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE
 SABER MAIS SOBRE DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE FICHA TÉCNICA EDIÇÃO Clínicas Leite, Lda Ver. 01 / Jan 2016 REDAÇÃO/DOCUMENTAÇÃO Mariana Coimbra (Marketing e Comunicação) 1 DEGENERESCÊNCIA
SABER MAIS SOBRE DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE FICHA TÉCNICA EDIÇÃO Clínicas Leite, Lda Ver. 01 / Jan 2016 REDAÇÃO/DOCUMENTAÇÃO Mariana Coimbra (Marketing e Comunicação) 1 DEGENERESCÊNCIA
FOLHETO INFORMATIVO: Informação para o utilizador
 FOLHETO INFORMATIVO: Informação para o utilizador INFLOC 2% pomada Fusidato de sódio Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém informação importante para
FOLHETO INFORMATIVO: Informação para o utilizador INFLOC 2% pomada Fusidato de sódio Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém informação importante para
Folheto informativo: Informação para o utilizador. alerjon 0,25 mg/ml colírio, solução Cloridrato de oximetazolina
 FOLHETO INFORMATIVO Folheto informativo: Informação para o utilizador alerjon 0,25 mg/ml colírio, solução Cloridrato de oximetazolina Leia com atenção todo este folheto antes de começar a utilizar este
FOLHETO INFORMATIVO Folheto informativo: Informação para o utilizador alerjon 0,25 mg/ml colírio, solução Cloridrato de oximetazolina Leia com atenção todo este folheto antes de começar a utilizar este
2. O que precisa de saber antes de lhe ser administrado APROKAM
 Folheto informativo: Informação para o utilizador APROKAM 50 mg pó para solução injetável Cefuroxima Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação
Folheto informativo: Informação para o utilizador APROKAM 50 mg pó para solução injetável Cefuroxima Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Lucentis 10 mg/ml solução injetável 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml contém 10 mg de ranibizumab*. Cada frasco para
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Lucentis 10 mg/ml solução injetável 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml contém 10 mg de ranibizumab*. Cada frasco para
Guia para a gestão dos riscos associados às injeções intravítreas durante o tratamento com Lucentis
 Guia para a gestão dos riscos associados às injeções intravítreas durante o tratamento com Lucentis Informação para o médico oftalmologista Introdução O guia de informação do médico é um dos materiais
Guia para a gestão dos riscos associados às injeções intravítreas durante o tratamento com Lucentis Informação para o médico oftalmologista Introdução O guia de informação do médico é um dos materiais
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
 17 December 2015 EMA/PRAC/835764/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
17 December 2015 EMA/PRAC/835764/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
1. O que é Kanakion MM Pediátrico e para que é utilizado. Kanakion MM Pediátrico é uma vitamina lipossolúvel com propriedades antihemorrágicas.
 Folheto informativo: Informação para o utilizador Kanakion MM Pediátrico 2mg/0,2 ml solução injetável Fitomenadiona Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois
Folheto informativo: Informação para o utilizador Kanakion MM Pediátrico 2mg/0,2 ml solução injetável Fitomenadiona Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois
List of nationally authorised medicinal products
 9 June 2017 EMA/367573/2017 Human Medicines Evaluation Division Active substance: bromhexine Procedure no.: PSUSA/00000437/201609 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone
9 June 2017 EMA/367573/2017 Human Medicines Evaluation Division Active substance: bromhexine Procedure no.: PSUSA/00000437/201609 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone
Câmara Técnica de Medicina Baseada em Evidências. Avaliação de Tecnologias em Saúde
 Câmara Técnica de Medicina Baseada em Evidências Avaliação de Tecnologias em Saúde Aflibercepte (Eylia) vs Ranibizumabe (Lucentis) na Doença Macular Relacionada a Idade Canoas, Março de 2014. Câmara Técnica
Câmara Técnica de Medicina Baseada em Evidências Avaliação de Tecnologias em Saúde Aflibercepte (Eylia) vs Ranibizumabe (Lucentis) na Doença Macular Relacionada a Idade Canoas, Março de 2014. Câmara Técnica
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR. Finasterida Generis 1 mg comprimidos revestidos por película Finasterida
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Finasterida Generis 1 mg comprimidos revestidos por película Finasterida Leia com atenção todo este folheto antes de começar a tomar este medicamento pois
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Finasterida Generis 1 mg comprimidos revestidos por película Finasterida Leia com atenção todo este folheto antes de começar a tomar este medicamento pois
FOLHETO INFORMATIVO INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO INFORMAÇÃO PARA O UTILIZADOR APROVADO EM OPTONE 0,13 ml/ml Solução para lavagem oftálmica Água de Hamamélis Este folheto contém informações importantes para si. Leia-o atentamente.
FOLHETO INFORMATIVO INFORMAÇÃO PARA O UTILIZADOR APROVADO EM OPTONE 0,13 ml/ml Solução para lavagem oftálmica Água de Hamamélis Este folheto contém informações importantes para si. Leia-o atentamente.
Kaloba 8 g/9,75 ml gotas orais, solução Extrato de raízes de Pelargonium sidoides DC (1:8-10) (EPs 7630)
 Folheto informativo: Informação para o doente Kaloba 8 g/9,75 ml gotas orais, solução Extrato de raízes de Pelargonium sidoides DC (1:8-10) (EPs 7630) Leia com atenção todo este folheto antes de começar
Folheto informativo: Informação para o doente Kaloba 8 g/9,75 ml gotas orais, solução Extrato de raízes de Pelargonium sidoides DC (1:8-10) (EPs 7630) Leia com atenção todo este folheto antes de começar
Se não se sentir melhor ou se piorar, tem de consultar um médico.
 Folheto informativo: Informação para o utilizador Lacryvisc 3 mg/g gel oftálmico Carbómero 974P Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação importante
Folheto informativo: Informação para o utilizador Lacryvisc 3 mg/g gel oftálmico Carbómero 974P Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação importante
APROVADO EM INFARMED. Folheto informativo: Informação para o utilizador
 Folheto informativo: Informação para o utilizador ILUVIEN 190 microgramas implante intravítreo em aplicador Acetonido de fluocinolona Leia com atenção todo este folheto antes de começar a utilizar este
Folheto informativo: Informação para o utilizador ILUVIEN 190 microgramas implante intravítreo em aplicador Acetonido de fluocinolona Leia com atenção todo este folheto antes de começar a utilizar este
APROVADO EM INFARMED
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Simdax 2,5 mg/ml concentrado para solução para perfusão levossimendano Leia atentamente este folheto antes de utilizar este medicamento. Conserve este
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Simdax 2,5 mg/ml concentrado para solução para perfusão levossimendano Leia atentamente este folheto antes de utilizar este medicamento. Conserve este
Anexo III. Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo
 Anexo III Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo Nota: As alterações ao Resumo das Características do Medicamento e ao Folheto Informativo
Anexo III Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo Nota: As alterações ao Resumo das Características do Medicamento e ao Folheto Informativo
SABER MAIS SOBRE RETINOPATIA DIABÉTICA
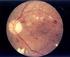 SABER MAIS SOBRE RETINOPATIA DIABÉTICA FICHA TÉCNICA EDIÇÃO Clínicas Leite, Lda Ver. 01 / Jan 2016 REDAÇÃO/DOCUMENTAÇÃO Mariana Coimbra (Marketing e Comunicação) 1 RETINOPATIA DIABÉTICA O que é a retinopatia
SABER MAIS SOBRE RETINOPATIA DIABÉTICA FICHA TÉCNICA EDIÇÃO Clínicas Leite, Lda Ver. 01 / Jan 2016 REDAÇÃO/DOCUMENTAÇÃO Mariana Coimbra (Marketing e Comunicação) 1 RETINOPATIA DIABÉTICA O que é a retinopatia
Revolade. eltrombopag. O que é o Revolade? Para que é utilizado o Revolade? Resumo do EPAR destinado ao público
 EMA/33466/2016 EMEA/H/C/001110 Resumo do EPAR destinado ao público eltrombopag Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
EMA/33466/2016 EMEA/H/C/001110 Resumo do EPAR destinado ao público eltrombopag Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
MabThera. rituximab. O que é o MabThera? Para que é utilizado o MabThera? Resumo do EPAR destinado ao público
 EMA/614203/2010 EMEA/H/C/000165 Resumo do EPAR destinado ao público rituximab Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
EMA/614203/2010 EMEA/H/C/000165 Resumo do EPAR destinado ao público rituximab Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
436/2014. Ranibizumabe (Lucentis ) para tratamento da DMRI
 28/07/2014 436/2014 Ranibizumabe (Lucentis ) para tratamento da DMRI SOLICITANTE : Dra Renata Abranches Perdigão. Juiza de Direito da Comarca de Campo Belo/MG NÚMERO DO PROCESSO: 112.14.005843-2 SOLICITAÇÃO/
28/07/2014 436/2014 Ranibizumabe (Lucentis ) para tratamento da DMRI SOLICITANTE : Dra Renata Abranches Perdigão. Juiza de Direito da Comarca de Campo Belo/MG NÚMERO DO PROCESSO: 112.14.005843-2 SOLICITAÇÃO/
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 1 October 2018 1 EMA/PRAC/621110/2018 Corr 2 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
1 October 2018 1 EMA/PRAC/621110/2018 Corr 2 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
Regras dos procedimentos relativos à organização e ao desenrolar das audições públicas no Comité de Avaliação do Risco de Farmacovigilância (PRAC)
 13 de abril de 2016 EMA/389929/2016 Regras dos procedimentos relativos à organização e ao desenrolar das audições públicas no Comité de Avaliação do Risco de Farmacovigilância (PRAC) 1. Princípios fundamentais
13 de abril de 2016 EMA/389929/2016 Regras dos procedimentos relativos à organização e ao desenrolar das audições públicas no Comité de Avaliação do Risco de Farmacovigilância (PRAC) 1. Princípios fundamentais
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 16 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Paramyxo P201 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose de 0,25 ml: Substância ativa: Antigénio
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 16 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Paramyxo P201 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose de 0,25 ml: Substância ativa: Antigénio
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 7 Conclusões científicas Resumo da avaliação científica do Kantos Master e nomes associados
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 7 Conclusões científicas Resumo da avaliação científica do Kantos Master e nomes associados
Anexo IV. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
Requerente Nome (de fantasia) Dosagem Forma Farmacêutica. Simvastatin Vale 20 mg/5 ml Suspension zum Einnehmen
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de do(s) medicamento(s), titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Áustria 20 mg/5
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de do(s) medicamento(s), titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Áustria 20 mg/5
Mini ebook DOENÇAS OFTALMOLÓGICAS NA TERCEIRA IDADE ALERTAS E RECOMENDAÇÕES
 Mini ebook DOENÇAS OFTALMOLÓGICAS NA TERCEIRA IDADE ALERTAS E RECOMENDAÇÕES A manutenção da saúde ocular está diretamente relacionada com os exames de rotina realizados por um médico oftalmologista, em
Mini ebook DOENÇAS OFTALMOLÓGICAS NA TERCEIRA IDADE ALERTAS E RECOMENDAÇÕES A manutenção da saúde ocular está diretamente relacionada com os exames de rotina realizados por um médico oftalmologista, em
Se algumas das situações referidas se aplica a si ou se não tem a certeza fale com o
 Folheto Informativo: Informação para o utilizador Topotecano Generis 1 mg Pó para solução para perfusão Topotecano Generis 4 mg Pó para solução para perfusão Topotecano Leia com atenção todo este folheto
Folheto Informativo: Informação para o utilizador Topotecano Generis 1 mg Pó para solução para perfusão Topotecano Generis 4 mg Pó para solução para perfusão Topotecano Leia com atenção todo este folheto
Alocução introdutória sobre o Programa de Trabalho da Agência 2015
 7 Agosto 2015 EMA/372774/2015 Vice-diretor executivo Alocução introdutória sobre o Programa de Trabalho da Agência 2015 Pelo Vice-diretor executivo, Andreas Pott Prioridades e influências-chave da EMA
7 Agosto 2015 EMA/372774/2015 Vice-diretor executivo Alocução introdutória sobre o Programa de Trabalho da Agência 2015 Pelo Vice-diretor executivo, Andreas Pott Prioridades e influências-chave da EMA
Folheto informativo: Informação para o utilizador. Bridion 100 mg/ml solução injetável sugamadex
 Folheto informativo: Informação para o utilizador Bridion 100 mg/ml solução injetável sugamadex Leia com atenção todo este folheto antes de lhe ser administrado este medicamento, pois contém informação
Folheto informativo: Informação para o utilizador Bridion 100 mg/ml solução injetável sugamadex Leia com atenção todo este folheto antes de lhe ser administrado este medicamento, pois contém informação
1. O que é Noradrenalina Labesfal e para que é utilizado. 2. O que precisa de saber antes de utilizar Noradrenalina Labesfal
 Folheto informativo: Informação para o utilizador Noradrenalina-Labesfal 1 mg/ml solução injetável Noradrenalina, tartarato Leia com atenção todo este folheto antes de começar a utilizar este medicamento
Folheto informativo: Informação para o utilizador Noradrenalina-Labesfal 1 mg/ml solução injetável Noradrenalina, tartarato Leia com atenção todo este folheto antes de começar a utilizar este medicamento
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Maltofer, 100 mg/ 5ml, solução oral Dose unitária Ferro (III) na forma de Complexo de hidróxido férrico-polimaltose Leia com atenção todo este folheto
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Maltofer, 100 mg/ 5ml, solução oral Dose unitária Ferro (III) na forma de Complexo de hidróxido férrico-polimaltose Leia com atenção todo este folheto
TEMA: Anti-angiogênico (Eylia - aflibercepte) no tratamento de edema macular na obstrução da veia central da retina
 Data: 03/03/2016 NT 07/2016 Solicitante: Juiz de Direito Sérgio Castro da Cunha Peixoto 1ª Unidade Jurisdicional Cível Juizado de Consumo da Comarca de Belo Horizonte Número do processo: 9014825.22.2016.813.0024
Data: 03/03/2016 NT 07/2016 Solicitante: Juiz de Direito Sérgio Castro da Cunha Peixoto 1ª Unidade Jurisdicional Cível Juizado de Consumo da Comarca de Belo Horizonte Número do processo: 9014825.22.2016.813.0024
Folheto informativo: Informação para o utilizador. APROKAM 50 mg pó para solução injetável Cefuroxima
 Folheto informativo: Informação para o utilizador APROKAM 50 mg pó para solução injetável Cefuroxima Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação
Folheto informativo: Informação para o utilizador APROKAM 50 mg pó para solução injetável Cefuroxima Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica de Quixil Antecedentes O Quixil
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica de Quixil Antecedentes O Quixil
Azyter contém azitromicina, um antibiótico pertencente à classe dos macrólidos.
 Folheto informativo: Informação para o utilizador Azyter 15 mg/g colírio, solução em recipiente unidose Azitromicina di-hidratada Leia com atenção todo este folheto antes de começar a utilizar este medicamento,
Folheto informativo: Informação para o utilizador Azyter 15 mg/g colírio, solução em recipiente unidose Azitromicina di-hidratada Leia com atenção todo este folheto antes de começar a utilizar este medicamento,
Anexo II. Conclusões científicas e fundamentos para o parecer positivo apresentados pela Agência Europeia de Medicamentos
 Anexo II Conclusões científicas e fundamentos para o parecer positivo apresentados pela Agência Europeia de Medicamentos 6 Conclusões científicas Resumo da avaliação científica do Yvidually e nomes associados
Anexo II Conclusões científicas e fundamentos para o parecer positivo apresentados pela Agência Europeia de Medicamentos 6 Conclusões científicas Resumo da avaliação científica do Yvidually e nomes associados
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Supofen 125 mg supositórios Supofen 250 mg supositórios Supofen 500 mg supositórios Paracetamol APROVADO EM Este folheto contém informações importantes
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Supofen 125 mg supositórios Supofen 250 mg supositórios Supofen 500 mg supositórios Paracetamol APROVADO EM Este folheto contém informações importantes
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 PILOCARPINA ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de pilocarpina 1%-2%-4% BULA PARA O PACIENTE Bula para o Paciente APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico
PILOCARPINA ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril cloridrato de pilocarpina 1%-2%-4% BULA PARA O PACIENTE Bula para o Paciente APRESENTAÇÃO Solução Oftálmica Estéril Frasco plástico
Folheto informativo: Informação para o utilizador. Fucidine 20 mg/g pomada Fusidato de sódio
 Folheto informativo: Informação para o utilizador Fucidine 20 mg/g pomada Fusidato de sódio Leia com atenção todo este folheto antes de utilizar este medicamento pois contém informação importante para
Folheto informativo: Informação para o utilizador Fucidine 20 mg/g pomada Fusidato de sódio Leia com atenção todo este folheto antes de utilizar este medicamento pois contém informação importante para
Zidoril contém ácidos gordos polinsaturados ómega 3 altamente purificados.
 Folheto informativo: Informação para o utilizador Zidoril 1000 mg cápsulas moles Ésteres etílicos 90 do ácido ómega-3 Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém
Folheto informativo: Informação para o utilizador Zidoril 1000 mg cápsulas moles Ésteres etílicos 90 do ácido ómega-3 Leia com atenção todo este folheto antes de começar a tomar este medicamento pois contém
Anexo II. Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica do Leflunomide Apotex (ver Anexo I) O organismo
Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica do Leflunomide Apotex (ver Anexo I) O organismo
Este medicamento é apenas para uso em diagnóstico. É somente utilizado para ajudar a identificar doenças.
 Folheto informativo: Informação para o doente Macrotec 2 mg/frasco Kit para Preparação de Injeção de Macroagregados de Albumina Humana 99m Tc, Pó para Suspensão Injectável Macroagregados de Albumina Humana
Folheto informativo: Informação para o doente Macrotec 2 mg/frasco Kit para Preparação de Injeção de Macroagregados de Albumina Humana 99m Tc, Pó para Suspensão Injectável Macroagregados de Albumina Humana
Folheto informativo: Informação para o utilizador
 Folheto informativo: Informação para o utilizador Bescil 10 mg/g Creme vaginal Nitrato de Isoconazol Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém informação
Folheto informativo: Informação para o utilizador Bescil 10 mg/g Creme vaginal Nitrato de Isoconazol Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois contém informação
Opticrom 20mg/ml Colírio, Solução em frasco conta-gotas multidose Cromoglicato de sódio
 Folheto informativo: Informação para o utilizador Opticrom 20mg/ml Colírio, Solução em frasco conta-gotas multidose Cromoglicato de sódio Leia com atenção todo este folheto antes de começar a utilizar
Folheto informativo: Informação para o utilizador Opticrom 20mg/ml Colírio, Solução em frasco conta-gotas multidose Cromoglicato de sódio Leia com atenção todo este folheto antes de começar a utilizar
Milton Ruiz Alves. Medida da Acuidade Visual em Ambulatório de Saúde Ocupacional
 Medida da Acuidade Visual em Ambulatório de Saúde Ocupacional Milton Ruiz Alves O apresentador declara não apresentar conflitos de interesse que possam ser relacionados à sua apresentação As funções visuais
Medida da Acuidade Visual em Ambulatório de Saúde Ocupacional Milton Ruiz Alves O apresentador declara não apresentar conflitos de interesse que possam ser relacionados à sua apresentação As funções visuais
Vol. 1. Saúde Ocular na Melhor Idade. Oftalmologista Dr Cleiton A. Noll
 Vol. 1 Saúde Ocular na Melhor Idade Oftalmologista Dr Cleiton A. Noll Enxergar bem para viver mais, porém com qualidade de vida... Com a expectativa de vida da população aumentando a cada década, as pessoas
Vol. 1 Saúde Ocular na Melhor Idade Oftalmologista Dr Cleiton A. Noll Enxergar bem para viver mais, porém com qualidade de vida... Com a expectativa de vida da população aumentando a cada década, as pessoas
Disocor é indicado no tratamento da deficiência da carnitina, resultante de defeitos congénitos do metabolismo.
 Folheto informativo: Informação para o doente Disocor 1000 mg/10 ml solução oral Levocarnitina Leia com atenção todo este folheto antes de começar a tomar este medicamento, pois contém informação importante
Folheto informativo: Informação para o doente Disocor 1000 mg/10 ml solução oral Levocarnitina Leia com atenção todo este folheto antes de começar a tomar este medicamento, pois contém informação importante
APROVADO EM INFARMED. Folheto informativo: Informação para o utilizador Fluotest Multidose, 2,5 mg/ml + 4 mg/ml, Colírio, solução
 Folheto informativo: Informação para o utilizador Fluotest Multidose, 2,5 mg/ml + 4 mg/ml, Colírio, solução Fluoresceína sódica, Cloridrato de Oxibuprocaína Leia com atenção todo este folheto antes de
Folheto informativo: Informação para o utilizador Fluotest Multidose, 2,5 mg/ml + 4 mg/ml, Colírio, solução Fluoresceína sódica, Cloridrato de Oxibuprocaína Leia com atenção todo este folheto antes de
APROVADO EM INFARMED
 FOLHETO INFORMATIVO, colírio, solução Leia atentamente este folheto antes de tomar o medicamento Conserve este Folheto Informativo. Pode ter necessidade de o reler. Caso ainda tenha dúvidas, consulte o
FOLHETO INFORMATIVO, colírio, solução Leia atentamente este folheto antes de tomar o medicamento Conserve este Folheto Informativo. Pode ter necessidade de o reler. Caso ainda tenha dúvidas, consulte o
