RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
|
|
|
- Rafael Machado Paiva
- 6 Há anos
- Visualizações:
Transcrição
1 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM seringa pré-cheia contendo 0,165 ml de solução injetável * * doseada a 10 mg/ml Lucentis 1 frasco para injetáveis contendo 0,23 ml de solução * * injetável doseada a 10 mg/ml * Os preços foram comunicados aos Hospitais do Serviço Nacional de Saúde Novartis Europharm Limited Data do relatório: 30/12/2016 Data de autorização de utilização: 13/12/2016 Duração da autorização de utilização 2 anos Estatuto quanto à dispensa Medicamento Sujeito a Receita Médica Restrita, alínea a) do Artigo 118º do Decreto-Lei n.º 176/2006, de 30 de agosto Medicamento órfão: Sim Não Classificação Farmacoterapêutica: Medicamentos usados em afecções oculares - Outros medicamentos e produtos usados em oftalmologia - Outros medicamentos Código ATC: S01LA04 ranibizumab Indicações Terapêuticas constantes do RCM: Lucentis está indicado em adultos no: - tratamento da degenerescência macular relacionada com a idade (DMI) neovascular (húmida). - tratamento da perda de visão devida a edema macular diabético (EMD). - tratamento da perda de visão devida a edema macular secundário a oclusão da veia retiniana (Oclusão de Ramo da Veia Retiniana (ORVR) ou Oclusão da Veia Central da Retina (OVCR)). - Tratamento da perda de visão devida a neovascularização coroideia (NVC) secundária a miopia patológica (MP). Indicações terapêuticas para as quais foi solicitada avaliação - Lucentis está indicado em adultos no: - tratamento da perda de visão devida a neovascularização coroideia (NVC) secundária a miopia patológica (MP). Indicações terapêuticas para as quais esta avaliação é válida - todas as indicações para as quais foi solicitada avaliação (vide secção anterior). Nota: Algumas informações respeitantes ao medicamento podem ser revistas periodicamente. Para informação actualizada, consultar o Infomed. M-APH-003/5 1 / 5
2 1. CONCLUSÕES DA AVALIAÇÃO Considerou-se haver valor terapêutico acrescentado com o ranibizumab no tratamento da perda de visão devida a neovascularização coroideia (NVC) secundária a miopia patológica (MP), uma vez que há superioridade em eficácia de ranibizumab em relação à terapêutica fotodinâmica com verteporfina na maioria dos doentes (terapêutica padrão à data da avaliação). Na avaliação económica, concluiu-se que ranibizumab é uma alternativa dominante em comparação com a terapêutica fotodinâmica com verteporfina no tratamento da perda de visão devida a neovascularização coroideia (NVC) secundária a miopia patológica (MP). 2. AVALIAÇÃO FARMACOTERAPÊUTICA Propriedades farmacológicas O ranibizumab é um fragmento de anticorpo monoclonal recombinante humanizado cujo alvo é o fator de crescimento endotelial vascular humano A (VEGF-A). O ranibizumab liga-se com elevada afinidade às isoformas do VEGF-A (ex. VEGF110, VEGF121 e VEGF165), impedindo assim a ligação do VEGF-A aos seus receptores VEGFR-1 e VEGFR-2. A ligação do VEGF-A aos seus receptores leva à proliferação das células endoteliais e neovascularização, assim como a exsudação vascular, que se pensa que contribuem para a progressão da forma neovascular da degenerescência macular relacionada com a idade, miopia patológica e NVC ou à perda de visão devida tanto a edema macular diabético como a edema macular secundário a OVR. Para informação adicional sobre o perfil farmacológico e farmacocinético, consultar o RCM disponível no Infomed. Comparador selecionado Terapia fotodinâmica com verteporfina (TFD), que é o tratamento padrão actual (à data da avaliação). Embora nas lesões não subfoveais possa ser usada a fotocoagulação com laser, a terapia fotodinâmica com verteporfina é o tratamento padrão actual. Geralmente estabiliza a visão (estudo VIP, um ensaio multicêntrico, aleatorizado controlado por placebo). A verteporfina é um corante fotorreactivo que produz radicais livres quando exposto a luz vermelha não térmica. É a única intervenção farmacológica aprovada para tratamento da NVC miópica, especificamente na forma de lesões na zona subfoveal. O uso de fotocoagulação com laser está limitado ao tratamento de lesões não subfoveais e geralmente atinge a estabilização da melhor acuidade visual corrigida (MAVC); todavia, aproximadamente 60% dos doentes recidiva após a terapia a laser, sendo o aumento progressivo das cicatrizes oculares um problema de segurança grave. M-APH-003/5 2 / 5
3 As terapêuticas anti-angiogénicas, pegaptanib e aflibercept, estão a ser estudadas para o tratamento da NVC miópica; os dados reportados ainda são limitados. Valor terapêutico acrescentado A segurança e eficácia clínica de Lucentis em doentes com perda de visão devida a NVC na MP foram avaliadas com base nos dados de 12 meses do estudo principal aleatorizado, em dupla ocultação, controlado, F2301 (RADIANCE). Este estudo foi desenhado para avaliar dois regimes de administração diferentes de 0,5 mg de ranibizumab, administrado como injeção intravítrea, em comparação com terapêutica fotodinâmica com verteporfina (vtfd, terapêutica fotodinâmica com Visudyne). Os 277 doentes foram aleatorizados para um dos seguintes grupos de tratamento: - Grupo I (ranibizumab 0,5 mg, regime de tratamento determinado por critérios de estabilidade, definido como não alteração da MAVC comparativamente com as avaliações dos dois meses anteriores). - Grupo II (ranibizumab 0,5 mg, regime de tratamento determinado por critérios de atividade de doença, definido como perda de visão atribuível a fluido intra ou subretiniano ou extravasamento ativo devido a lesão NVC, avaliada por TCO e/ou AF). - Grupo III (vtfd mas os doentes puderam receber tratamento com ranibizumab no mês 3, o que aconteceu com 38 doentes). Durante os 12 meses do estudo, os doentes receberam em média 4,6 injeções (intervalo 1-11) no Grupo I e 3,5 injeções (intervalo 1-12) no Grupo II. No Grupo II, que corresponde à posologia recomendada (ver secção 4.2), 50,9% dos doentes necessitaram de 1 ou 2 injeções; 34,5% necessitaram de 3 a 5 injeções e 14,7% necessitaram de 6 a 12 injeções durante o período de 12 meses do estudo. No Grupo II, 62,9% dos doentes não necessitaram de injeções nos segundos 6 meses do estudo. Este ensaio clínico RADIANCE (ranibizumab and PDT (verteporfin) evaluation in myopic choroidal neovascularization) foi um estudo de fase 3 com um período de seguimento de 12 meses, aleatorizado, com dupla ocultação, multicêntrico, com controlo activo (terapia fotodinâmica com verteporfina (TFD)). O braço de estudo com a verteporfina incluiu um número reduzido de doentes. Verifica-se que o ranibizumab foi significativamente mais eficaz que a terapêutica fotodinâmica (RCM de Lucentis): M-APH-003/5 3 / 5
4 No que respeita à segurança, os eventos adversos foram os esperados tendo em atenção o uso do ranibizumab noutras indicações terapêuticas. Existe ainda o estudo REPAIR (ranibizumab for treatment of CNV secondary to pathological myopia: an individualised regimen), de fase 2, aberto, de braço único, multicêntrico, com duração de 12 meses, realizado no Reino Unido. Tendo em conta estas características, não foi considerado suficientemente relevante para a avaliação deste medicamento. São ainda apresentadas séries de casos e casos isolados como suporte à manutenção da eficácia e segurança a três anos. Evidentemente que o nível de evidência é baixo, pelo que consideramos não haver evidência científica robusta de efeitos a longo prazo. Há valor terapêutico acrescentado com o ranibizumab no tratamento da perda de visão devida a neovascularização coroideia (NVC) secundária a miopia patológica (MP), uma vez que há superioridade em eficácia do medicamento em avaliação em relação à terapêutica actual (terapêutica fotodinâmica com verteporfina na maioria M-APH-003/5 4 / 5
5 dos doentes e nalguns doentes com laser). De referir que há um estudo comparativo directo entre o ranibizumab e a terapêutica fotodinâmica, demonstrando-se maior eficácia para o ranibizumab 3. AVALIAÇÃO ECONÓMICA Termos de comparação Tipo de análise Vantagem económica Ranibizumab vs terapia fotodinâmica com verteporfina Análise de custo-efetividade e custo-utilidade De acordo com as conclusões famacoterapêutica e farmacoeconómica, e atendendo aos resultados da dominância de ranibizumab em relação ao comparador e após negociação de condições para utilização pelos hospitais e entidades do SNS, admite-se a utilização do medicamento em meio hospitalar. 4. CONDIÇÕES CONTRATUAIS O acesso do medicamento ao mercado hospitalar foi objeto de um contrato entre o INFARMED I.P. e o representante do titular de AIM, ao abrigo do disposto no artigo 6.º do Decreto-Lei n.º 97/2015, de 1 de junho. 5. REFERÊNCIAS BIBLIOGRÁFICAS 1. Agência Europeia do Medicamento - Resumo das características do medicamento Lucentis 2. Agência Europeia do Medicamento Scientific Discussion Lucentis 3. Tufail et al., Ranibizumab in myopic choroidal neovascularization: the 12-month results from the REPAIR study. Ophthalmology 2013;120(9): Iacono et al., Intravitreal ranibizumab versus bevacizumab for treatment of myopic choroidal neovascularization. Retina 2012; 32(8): The Cochrane Library (Novembro de 2013); 6. Medline/PubMed; 7. Processo de Avaliação Prévia de LUCENTIS (Ranibizumab) no Tratamento da Perda de Visão resultante da Neovascularização Coroideia Secundária a Miopia Patológica. Novartis. Agosto de 2013 [não publicado] M-APH-003/5 5 / 5
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI LAPATINIB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Embalagem
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI LAPATINIB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Embalagem
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ustecinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5279062
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ustecinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5279062
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI carfilzomib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5688304 Frasco para injetáveis
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI carfilzomib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5688304 Frasco para injetáveis
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pertuzumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pertuzumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI atalureno N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5644729 suspensão
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI atalureno N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5644729 suspensão
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5586623 5586631 Relvar Ellipta 30
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5586623 5586631 Relvar Ellipta 30
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Secucinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5635107
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Secucinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5635107
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI brodalumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5721956 Kyntheum 2 unidades de 1,5ml/
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI brodalumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5721956 Kyntheum 2 unidades de 1,5ml/
Eylea. aflibercept. O que é o Eylea? Para que é utilizado o Eylea? Resumo do EPAR destinado ao público
 EMA/677928/2015 EMEA/H/C/002392 Resumo do EPAR destinado ao público aflibercept Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
EMA/677928/2015 EMEA/H/C/002392 Resumo do EPAR destinado ao público aflibercept Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como o Comité
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI crizotinib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5479316
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI crizotinib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5479316
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Lucentis 10 mg/ml solução injetável 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml contém 10 mg de ranibizumab*. Cada frasco para
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Lucentis 10 mg/ml solução injetável 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml contém 10 mg de ranibizumab*. Cada frasco para
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI palmitato de paliperidona N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5683974
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI palmitato de paliperidona N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5683974
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Eylea 40 mg/ml solução injetável em seringa pré-cheia 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 ml de solução injetável contém
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Eylea 40 mg/ml solução injetável em seringa pré-cheia 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 ml de solução injetável contém
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI panitumumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5077144
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI panitumumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5077144
TEMA: USO DO RANIBIZUMABE NA OCLUSÃO DE DE VEIA RETINIANA CENTRAL
 NOTA TÉCNICA 141/2014 Solicitante Emerson Chaves Motta Juíza de Direito - Comarca de Teófilo Otoni - MG. Processo número: 0686 14 010142-5 Data: 18/07/2014 Medicamento X Material Procedimento Cobertura
NOTA TÉCNICA 141/2014 Solicitante Emerson Chaves Motta Juíza de Direito - Comarca de Teófilo Otoni - MG. Processo número: 0686 14 010142-5 Data: 18/07/2014 Medicamento X Material Procedimento Cobertura
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI Micafungina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI Micafungina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE SAÚDE SUBSECRETARIA JURÍDICA NÚCLEO DE ASSESSORIA TÉCNICA EM AÇÕES DE SAÚDE
 PARECER TÉCNICO/SES/SJ/NAT Nº 3760/2017 Rio de Janeiro, 14 de dezembro de 2017. O presente parecer visa atender à solicitação de informações técnicas do 1 o Juizado Especial Fazendário da Comarca da Capital
PARECER TÉCNICO/SES/SJ/NAT Nº 3760/2017 Rio de Janeiro, 14 de dezembro de 2017. O presente parecer visa atender à solicitação de informações técnicas do 1 o Juizado Especial Fazendário da Comarca da Capital
Ranibizumab no Tratamento da Neovascularização Coroideia Secundária a Miopia Patológica: 24 Meses De Follow-Up
 Oftalmologia - Vol. 35: pp.319-326 Artigo Original Ranibizumab no Tratamento da Neovascularização Coroideia Secundária a Miopia Patológica: 24 Meses De Follow-Up Nuno Franqueira 1, Pedro Fonseca 2, Maria
Oftalmologia - Vol. 35: pp.319-326 Artigo Original Ranibizumab no Tratamento da Neovascularização Coroideia Secundária a Miopia Patológica: 24 Meses De Follow-Up Nuno Franqueira 1, Pedro Fonseca 2, Maria
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI tafamidis N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5424411 Vyndaqel
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI tafamidis N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5424411 Vyndaqel
LUCENTIS ranibizumabe
 LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada
LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI sacubitril + valsartan N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5682760
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI sacubitril + valsartan N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5682760
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI reslizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5688734 5715024 Cinqaero 1 frasco
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI reslizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5688734 5715024 Cinqaero 1 frasco
403/2014. Ranibizumabe (Lucentis ) para tratamento da Retinopatia diabética
 05/07/2014 403/2014 Ranibizumabe (Lucentis ) para tratamento da Retinopatia diabética SOLICITANTE : Dr Leopoldo Mameluque. Juiz de Direito da Comarca de Montes Claros/MG NÚMERO DO PROCESSO: 433.14.026306-5
05/07/2014 403/2014 Ranibizumabe (Lucentis ) para tratamento da Retinopatia diabética SOLICITANTE : Dr Leopoldo Mameluque. Juiz de Direito da Comarca de Montes Claros/MG NÚMERO DO PROCESSO: 433.14.026306-5
TEMA: Anti-angiogênico (Eylia - aflibercepte) no tratamento de edema macular na obstrução da veia central da retina
 Data: 03/03/2016 NT 07/2016 Solicitante: Juiz de Direito Sérgio Castro da Cunha Peixoto 1ª Unidade Jurisdicional Cível Juizado de Consumo da Comarca de Belo Horizonte Número do processo: 9014825.22.2016.813.0024
Data: 03/03/2016 NT 07/2016 Solicitante: Juiz de Direito Sérgio Castro da Cunha Peixoto 1ª Unidade Jurisdicional Cível Juizado de Consumo da Comarca de Belo Horizonte Número do processo: 9014825.22.2016.813.0024
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM RECOMENDAÇÕES PARA O MÉDICO
 INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM RECOMENDAÇÕES PARA O MÉDICO Este medicamento está sujeito a monitorização adicional Versão 6, outubro 2016 INFORMAÇÕES GERAIS Antes do início do tratamento
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM RECOMENDAÇÕES PARA O MÉDICO Este medicamento está sujeito a monitorização adicional Versão 6, outubro 2016 INFORMAÇÕES GERAIS Antes do início do tratamento
NOVO ROL DA ANS TRATAMENTO OCULAR QUIMIOTERÁPICO COM ANTIANGIOGÊNICO 2018 / 2019
 NOVO ROL DA ANS TRATAMENTO OCULAR QUIMIOTERÁPICO COM ANTIANGIOGÊNICO 2018 / 2019 DMRI EMD OVC ORVC DMRI COBERTURA OBRIGATÓRIA PARA PACIENTES COM DIAGNÓSTICO DE DEGENERAÇÃO MACULAR RELACIONADA A IDADE (DMRI)
NOVO ROL DA ANS TRATAMENTO OCULAR QUIMIOTERÁPICO COM ANTIANGIOGÊNICO 2018 / 2019 DMRI EMD OVC ORVC DMRI COBERTURA OBRIGATÓRIA PARA PACIENTES COM DIAGNÓSTICO DE DEGENERAÇÃO MACULAR RELACIONADA A IDADE (DMRI)
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Pede-se aos profissionais
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Opicapona N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5686670 10 cápsulas
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Opicapona N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5686670 10 cápsulas
Câmara Técnica de Medicina Baseada em Evidências. Avaliação de Tecnologias em Saúde
 Câmara Técnica de Medicina Baseada em Evidências Avaliação de Tecnologias em Saúde Aflibercepte (Eylia) vs Ranibizumabe (Lucentis) na Doença Macular Relacionada a Idade Canoas, Março de 2014. Câmara Técnica
Câmara Técnica de Medicina Baseada em Evidências Avaliação de Tecnologias em Saúde Aflibercepte (Eylia) vs Ranibizumabe (Lucentis) na Doença Macular Relacionada a Idade Canoas, Março de 2014. Câmara Técnica
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
Ranibizumabe para Degeneração Macular Relacionada à Idade
 Ministério da Saúde Secretaria de Ciência, Tecnologia e Insumos Estratégicos Departamento de Gestão e Incorporação de Tecnologias em Saúde Ranibizumabe para Degeneração Macular Relacionada à Idade Outubro
Ministério da Saúde Secretaria de Ciência, Tecnologia e Insumos Estratégicos Departamento de Gestão e Incorporação de Tecnologias em Saúde Ranibizumabe para Degeneração Macular Relacionada à Idade Outubro
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Abiraterona N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Abiraterona N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco
Milton Ruiz Alves. Medida da Acuidade Visual em Ambulatório de Saúde Ocupacional
 Medida da Acuidade Visual em Ambulatório de Saúde Ocupacional Milton Ruiz Alves O apresentador declara não apresentar conflitos de interesse que possam ser relacionados à sua apresentação As funções visuais
Medida da Acuidade Visual em Ambulatório de Saúde Ocupacional Milton Ruiz Alves O apresentador declara não apresentar conflitos de interesse que possam ser relacionados à sua apresentação As funções visuais
Deliberação n.º 1772/2006, de 23 de Novembro (DR, 2.ª série, n.º 244, de 21 de Dezembro de 2006)
 (DR, 2.ª série, n.º 244, de 21 de Dezembro de 2006) Define os requisitos formais do pedido de avaliação prévia de medicamentos para uso humano em meio hospitalar nos termos do Decreto- Lei n.º 195/2006,
(DR, 2.ª série, n.º 244, de 21 de Dezembro de 2006) Define os requisitos formais do pedido de avaliação prévia de medicamentos para uso humano em meio hospitalar nos termos do Decreto- Lei n.º 195/2006,
I. Recomendações para o Diagnóstico e Tratamento da DMI. Na visita inicial, o diagnóstico deverá ser estabelecido considerando:
 Os mecanismos associados ao envelhecimento que constituem o estímulo patológico para a neovascularização não são completamente conhecidos. Sabe-se, contudo, que o fator de crescimento vascular endotelial
Os mecanismos associados ao envelhecimento que constituem o estímulo patológico para a neovascularização não são completamente conhecidos. Sabe-se, contudo, que o fator de crescimento vascular endotelial
Ranibizumabe para Degeneração Macular Relacionada à Idade
 Ministério da Saúde Secretaria de Ciência, Tecnologia e Insumos Estratégicos Departamento de Gestão e Incorporação de Tecnologias em Saúde Ranibizumabe para Degeneração Macular Relacionada à Idade Abril
Ministério da Saúde Secretaria de Ciência, Tecnologia e Insumos Estratégicos Departamento de Gestão e Incorporação de Tecnologias em Saúde Ranibizumabe para Degeneração Macular Relacionada à Idade Abril
436/2014. Ranibizumabe (Lucentis ) para tratamento da DMRI
 28/07/2014 436/2014 Ranibizumabe (Lucentis ) para tratamento da DMRI SOLICITANTE : Dra Renata Abranches Perdigão. Juiza de Direito da Comarca de Campo Belo/MG NÚMERO DO PROCESSO: 112.14.005843-2 SOLICITAÇÃO/
28/07/2014 436/2014 Ranibizumabe (Lucentis ) para tratamento da DMRI SOLICITANTE : Dra Renata Abranches Perdigão. Juiza de Direito da Comarca de Campo Belo/MG NÚMERO DO PROCESSO: 112.14.005843-2 SOLICITAÇÃO/
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Lixisenatido N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5551502 5551528 Lyxumia
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Lixisenatido N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5551502 5551528 Lyxumia
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI regorafenib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5579479 Stivarga 84 comprimidos
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI regorafenib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5579479 Stivarga 84 comprimidos
Terapia antiangiogênica em membranas miópicas
 CASOS CLÍNICOS DISCUTIDOS http://eoftalmo.org.br Antiangiogenic therapy in myopic membranes Terapia antiangiogénica en membranas miópicas Francyne Veiga Reis Cyrino - Universidade de Ribeirão Preto UNAERP,
CASOS CLÍNICOS DISCUTIDOS http://eoftalmo.org.br Antiangiogenic therapy in myopic membranes Terapia antiangiogénica en membranas miópicas Francyne Veiga Reis Cyrino - Universidade de Ribeirão Preto UNAERP,
Câmara Técnica de Medicina Baseada em Evidências. Avaliação de Tecnologias em Saúde
 Câmara Técnica de Medicina Baseada em Evidências Avaliação de Tecnologias em Saúde Implante intravítreo de polímero farmacológico de liberação controlada no tratamento de edema macular nas oclusões venosas
Câmara Técnica de Medicina Baseada em Evidências Avaliação de Tecnologias em Saúde Implante intravítreo de polímero farmacológico de liberação controlada no tratamento de edema macular nas oclusões venosas
GUIA PARA O TRATAMENTO COM LUCENTIS (RANIBIZUMAB)
 GUIA PARA O TRATAMENTO COM LUCENTIS (RANIBIZUMAB) Para a perda de visão devida a neovascularização coroideia (NVC) Informação importante para o doente SECÇÃO 1 SOBRE LUCENTIS Este caderno de informação
GUIA PARA O TRATAMENTO COM LUCENTIS (RANIBIZUMAB) Para a perda de visão devida a neovascularização coroideia (NVC) Informação importante para o doente SECÇÃO 1 SOBRE LUCENTIS Este caderno de informação
SABER MAIS SOBRE DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE
 SABER MAIS SOBRE DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE FICHA TÉCNICA EDIÇÃO Clínicas Leite, Lda Ver. 01 / Jan 2016 REDAÇÃO/DOCUMENTAÇÃO Mariana Coimbra (Marketing e Comunicação) 1 DEGENERESCÊNCIA
SABER MAIS SOBRE DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE FICHA TÉCNICA EDIÇÃO Clínicas Leite, Lda Ver. 01 / Jan 2016 REDAÇÃO/DOCUMENTAÇÃO Mariana Coimbra (Marketing e Comunicação) 1 DEGENERESCÊNCIA
Eylia (aflibercepte) Bayer S.A. Solução injetável 40 mg/ml
 Eylia (aflibercepte) Bayer S.A. Solução injetável 40 mg/ml EYLIA aflibercepte APRESENTAÇÕES: Eylia (aflibercepte) apresenta-se em forma de em frascos-ampola. Cada frasco-ampola contém um volume de enchimento
Eylia (aflibercepte) Bayer S.A. Solução injetável 40 mg/ml EYLIA aflibercepte APRESENTAÇÕES: Eylia (aflibercepte) apresenta-se em forma de em frascos-ampola. Cada frasco-ampola contém um volume de enchimento
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Oftalmologia Vol. 42: pp RESUMO
 Oftalmologia Vol. 42: pp. 000-000 RESUMO Introdução: O edema macular diabético (EMD), uma manifestação da retinopatia diabética, é a principal causa de perda da acuidade visual em doentes com Diabetes
Oftalmologia Vol. 42: pp. 000-000 RESUMO Introdução: O edema macular diabético (EMD), uma manifestação da retinopatia diabética, é a principal causa de perda da acuidade visual em doentes com Diabetes
Despacho n.º B/2001, de 31 de Maio 1 (DR, 2.ª série n.º 148, de 28 de Junho de 2001)
 1 (DR, 2.ª série n.º 148, de 28 de Junho de 2001) Regulamentação das autorizações de utilização especial de medicamentos (Revogado pelo Despacho n.º 9114/2002, de15 de Março) O despacho n.º 17 495/2000,
1 (DR, 2.ª série n.º 148, de 28 de Junho de 2001) Regulamentação das autorizações de utilização especial de medicamentos (Revogado pelo Despacho n.º 9114/2002, de15 de Março) O despacho n.º 17 495/2000,
LUCENTIS (ranibizumabe)
 LUCENTIS (ranibizumabe) Novartis Biociências SA Solução para injeção 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3
LUCENTIS (ranibizumabe) Novartis Biociências SA Solução para injeção 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Visudyne 15 mg pó para solução para perfusão 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada frasco para injetáveis contém 15 mg
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Visudyne 15 mg pó para solução para perfusão 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada frasco para injetáveis contém 15 mg
Deliberação n.º 1028/2009, de 7 de Janeiro (DR, 2.ª série, n.º 68, de 7 de Abril de 2009)
 (DR, 2.ª série, n.º 68, de 7 de Abril de 2009) Instruções aos requerentes de pedidos de comparticipação de medicamentos de uso humano O crescente desenvolvimento do mercado de medicamentos genéricos nos
(DR, 2.ª série, n.º 68, de 7 de Abril de 2009) Instruções aos requerentes de pedidos de comparticipação de medicamentos de uso humano O crescente desenvolvimento do mercado de medicamentos genéricos nos
Comissão de Ética para a Saúde do SESARAM,EPE
 Comissão de Ética para a Saúde do SESARAM,EPE Questionário de Submissão Estudos Envolvendo Experimentação Humana (Medicamentos, Técnicas) 1. IDENTIFICAÇÃO DO PROJECTO a) Título do projecto (de estudo,
Comissão de Ética para a Saúde do SESARAM,EPE Questionário de Submissão Estudos Envolvendo Experimentação Humana (Medicamentos, Técnicas) 1. IDENTIFICAÇÃO DO PROJECTO a) Título do projecto (de estudo,
Prescrição Off-Label: Análise Científica tendo como Exemplo a Utilização de Bevacizumab em Oftalmologia
 Prescrição Off-Label: Análise Científica tendo como Exemplo a Utilização de Bevacizumab em Oftalmologia Off-Label Prescribing: Scientific Analysis Taking the Use of Bevacizumab in Ophthalmology as an Example
Prescrição Off-Label: Análise Científica tendo como Exemplo a Utilização de Bevacizumab em Oftalmologia Off-Label Prescribing: Scientific Analysis Taking the Use of Bevacizumab in Ophthalmology as an Example
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI everolímus N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5410725 Blister - 30 unidade(s),
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI everolímus N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5410725 Blister - 30 unidade(s),
Comparação da Eficácia entre Bevacizumab e Ranibizumab no Edema Macular Associado à Oclusão Venosa da Retina
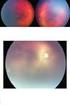 Oftalmologia - Vol. 38: pp.1-6 Artigo de Revisão Comparação da Eficácia entre Bevacizumab e Ranibizumab no Edema Macular Associado à Oclusão Venosa da Retina Renata Rothwell 1, Sofia Fonseca 2, Lígia Ribeiro
Oftalmologia - Vol. 38: pp.1-6 Artigo de Revisão Comparação da Eficácia entre Bevacizumab e Ranibizumab no Edema Macular Associado à Oclusão Venosa da Retina Renata Rothwell 1, Sofia Fonseca 2, Lígia Ribeiro
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI nivolumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Frasco de
Degenerescência Macular da Idade (DMI) Guidelines de Tratamento
 Volume 42 N 1 Suplemento 1 Janeiro-Março 2018 Degenerescência Macular da Idade (DMI) Guidelines de Tratamento Estratégias Terapêuticas para a DMI Neovascular pag 12 Abordagem de Neovascularização Corodeia
Volume 42 N 1 Suplemento 1 Janeiro-Março 2018 Degenerescência Macular da Idade (DMI) Guidelines de Tratamento Estratégias Terapêuticas para a DMI Neovascular pag 12 Abordagem de Neovascularização Corodeia
Despacho n.º /2000, de 10 de Agosto (DR, 2.ª Série, n.º 198, de 28 de Agosto de 2000) (Revogado pelo Despacho n.º B/2001, de 31 de Maio)
 Despacho n.º 17 495/2000, de 10 (DR, 2.ª Série, n.º 198, de 28 de 2000) (Revogado pelo Despacho n.º 13 484-B/2001, de 31 de Maio) De acordo com o artigo 60.º do Decreto-Lei n.º 72/91, de 8 de Fevereiro,
Despacho n.º 17 495/2000, de 10 (DR, 2.ª Série, n.º 198, de 28 de 2000) (Revogado pelo Despacho n.º 13 484-B/2001, de 31 de Maio) De acordo com o artigo 60.º do Decreto-Lei n.º 72/91, de 8 de Fevereiro,
LUCENTIS ranibizumabe
 LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada
LUCENTIS ranibizumabe APRESENTAÇÕES Lucentis 10 mg/ml de solução para injeção - embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada
IDENTIFICAÇÃO DO PROJECTO. Promotor (Indivíduo ou entidade responsável pela execução do estudo)
 IDENTIFICAÇÃO DO PROJECTO 1. Título do projecto (de estudo, investigação, etc.) 2. Autores / Promotor Promotor (Indivíduo ou entidade responsável pela execução do estudo) Investigador principal (juntar
IDENTIFICAÇÃO DO PROJECTO 1. Título do projecto (de estudo, investigação, etc.) 2. Autores / Promotor Promotor (Indivíduo ou entidade responsável pela execução do estudo) Investigador principal (juntar
Avaliação dos Resultados do Tratamento Antiangiogénico na Neovascularização Coroideia Associada à Miopia Patológica
 Avaliação dos Resultados do Tratamento Antiangiogénico na Neovascularização Coroideia Associada à Miopia Patológica Evaluation of Antiangiogenic Treatment Results in Choroidal Neovascularization Related
Avaliação dos Resultados do Tratamento Antiangiogénico na Neovascularização Coroideia Associada à Miopia Patológica Evaluation of Antiangiogenic Treatment Results in Choroidal Neovascularization Related
PROJECTO DE LEI N.º 346/XI ESTABELECE O REGIME DE PREÇOS DE MEDICAMENTOS PARA EFEITO DA SUA AQUISIÇÃO PELOS HOSPITAIS DO SERVIÇO NACIONAL DE SAÚDE
 Grupo Parlamentar PROJECTO DE LEI N.º 346/XI ESTABELECE O REGIME DE PREÇOS DE MEDICAMENTOS PARA EFEITO DA SUA AQUISIÇÃO PELOS HOSPITAIS DO SERVIÇO NACIONAL DE SAÚDE Exposição de motivos Desde 2006, que
Grupo Parlamentar PROJECTO DE LEI N.º 346/XI ESTABELECE O REGIME DE PREÇOS DE MEDICAMENTOS PARA EFEITO DA SUA AQUISIÇÃO PELOS HOSPITAIS DO SERVIÇO NACIONAL DE SAÚDE Exposição de motivos Desde 2006, que
INFARMED Gabinete Jurídico e Contencioso
 Procede à quarta alteração ao Decreto-Lei n.º 48-A/2010, de 13 de maio, que aprova o regime geral das comparticipações do Estado no preço dos medicamentos, e à terceira alteração ao Decreto-Lei n.º 112/2011,
Procede à quarta alteração ao Decreto-Lei n.º 48-A/2010, de 13 de maio, que aprova o regime geral das comparticipações do Estado no preço dos medicamentos, e à terceira alteração ao Decreto-Lei n.º 112/2011,
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM
 INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM PERDA DA VISÃO DEVIDA A NEOVASCULARIZAÇÃO COROIDEIA ASSOCIADA À MIOPIA PATOLÓGICA (NVC MIÓPICA) Este medicamento está sujeito a monitorização
INFORMAÇÃO DE SEGURANÇA SOBRE O TRATAMENTO COM GUIA DO DOENTE COM PERDA DA VISÃO DEVIDA A NEOVASCULARIZAÇÃO COROIDEIA ASSOCIADA À MIOPIA PATOLÓGICA (NVC MIÓPICA) Este medicamento está sujeito a monitorização
URGÊNCIAS EM OFTALMOLOGIA
 URGÊNCIAS EM OFTALMOLOGIA SEGMENTO POSTERIOR Ana Vergamota, José Pedro Silva SEGMENTO POSTERIOR ESCLERA Íris Córnea PUPILA CRISTALINO CONJUNTIVA Vítreo Coróide Nervo óptico Mácula RE T IN A SINTOMAS Diminuição
URGÊNCIAS EM OFTALMOLOGIA SEGMENTO POSTERIOR Ana Vergamota, José Pedro Silva SEGMENTO POSTERIOR ESCLERA Íris Córnea PUPILA CRISTALINO CONJUNTIVA Vítreo Coróide Nervo óptico Mácula RE T IN A SINTOMAS Diminuição
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Empagliflozina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5607411 5607403 5607429
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Empagliflozina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5607411 5607403 5607429
Colírio, solução. Solução oleosa, amarelo claro com aspeto límpido e cheiro característico.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Diomicete 10 mg/ml colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml de solução contém 10 mg de clotrimazol. Excipientes com
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Diomicete 10 mg/ml colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml de solução contém 10 mg de clotrimazol. Excipientes com
Despacho n.º 9114/2002, de 15 de Março (DR, 2.ª série, n.º 102, de 3 de Maio de 2002)
 Despacho n.º 9114/2002, de 15 de Março (DR, 2.ª série, n.º 102, de 3 de Maio de 2002) Regulamentação das autorizações de utilização especial de medicamentos (Revogado pelo Decreto-Lei n.º 176/2006, de
Despacho n.º 9114/2002, de 15 de Março (DR, 2.ª série, n.º 102, de 3 de Maio de 2002) Regulamentação das autorizações de utilização especial de medicamentos (Revogado pelo Decreto-Lei n.º 176/2006, de
2013/2014. Sara Duarte Viana Ribeiro
 MESTRADO INTEGRADO EM MEDICINA 2013/2014 ARTIGO DE REVISÃO BIBLIOGRÁFICA O USO OFF-LABEL NA DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE: ANÁLISE COMPARATIVA DOS FÁRMACOS ANTIANGIOGÉNICOS RANIBIZUMAB
MESTRADO INTEGRADO EM MEDICINA 2013/2014 ARTIGO DE REVISÃO BIBLIOGRÁFICA O USO OFF-LABEL NA DEGENERESCÊNCIA MACULAR RELACIONADA COM A IDADE: ANÁLISE COMPARATIVA DOS FÁRMACOS ANTIANGIOGÉNICOS RANIBIZUMAB
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI NIVOLUMAB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5655865 5655873 Opdivo Concentrado
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI NIVOLUMAB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5655865 5655873 Opdivo Concentrado
APROVADO EM INFARMED
 FOLHETO INFORMATIVO, colírio, solução Leia atentamente este folheto antes de tomar o medicamento Conserve este Folheto Informativo. Pode ter necessidade de o reler. Caso ainda tenha dúvidas, consulte o
FOLHETO INFORMATIVO, colírio, solução Leia atentamente este folheto antes de tomar o medicamento Conserve este Folheto Informativo. Pode ter necessidade de o reler. Caso ainda tenha dúvidas, consulte o
DEGENERAÇÃO MACULAR RELACIONADA A IDADE. A degeneração macular relacionada à idade (DMRI) é a doença
 DEGENERAÇÃO MACULAR RELACIONADA A IDADE Paulo Augusto de Arruda Mello Filho INTRODUÇÃO A degeneração macular relacionada à idade (DMRI) é a doença ocular que acomete as regiões da retina e coróide responsáveis
DEGENERAÇÃO MACULAR RELACIONADA A IDADE Paulo Augusto de Arruda Mello Filho INTRODUÇÃO A degeneração macular relacionada à idade (DMRI) é a doença ocular que acomete as regiões da retina e coróide responsáveis
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona
 Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Idelalisib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5622741
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Idelalisib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5622741
Lucentis. (ranibizumabe) Novartis Biociências SA Solução Injetável 10 mg/ml
 Lucentis (ranibizumabe) Novartis Biociências SA Solução Injetável 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Solução para injeção a 10 mg/ml. Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe
Lucentis (ranibizumabe) Novartis Biociências SA Solução Injetável 10 mg/ml LUCENTIS ranibizumabe APRESENTAÇÕES Solução para injeção a 10 mg/ml. Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
Lista de documentos para submissão de projetos à Comissão de Ética do CNS
 Lista de documentos para submissão de projetos à Comissão de Ética do CNS 1. Pedido de parecer dirigido à Comissão de Ética do CNS; 2. Questionário à Comissão de Ética (página seguinte); 3. Projeto de
Lista de documentos para submissão de projetos à Comissão de Ética do CNS 1. Pedido de parecer dirigido à Comissão de Ética do CNS; 2. Questionário à Comissão de Ética (página seguinte); 3. Projeto de
MELANOMA DA COROIDEIA: DIFERENTES APRESENTAÇOES
 MELANOMA DA COROIDEIA: DIFERENTES APRESENTAÇOES Cristina Santos; Ana Rita Azevedo; Susana Pina; Mário Ramalho; Catarina Pedrosa; Mara Ferreira; João Cabral Comunicação Livre Oncologia Ocular Hospital Prof.
MELANOMA DA COROIDEIA: DIFERENTES APRESENTAÇOES Cristina Santos; Ana Rita Azevedo; Susana Pina; Mário Ramalho; Catarina Pedrosa; Mara Ferreira; João Cabral Comunicação Livre Oncologia Ocular Hospital Prof.
Conclusões científicas
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV) INFORMAÇÃO DE SEGURANÇA
Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV) INFORMAÇÃO DE SEGURANÇA
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco
 Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
INFARMED Gabinete Jurídico e Contencioso
 Decreto-Lei n.º 195/2006, de 3 de Outubro Estabelece as regras a que obedece a avaliação prévia, para efeitos da sua aquisição pelos hospitais do Serviço Nacional de Saúde, de medicamentos que devam ser
Decreto-Lei n.º 195/2006, de 3 de Outubro Estabelece as regras a que obedece a avaliação prévia, para efeitos da sua aquisição pelos hospitais do Serviço Nacional de Saúde, de medicamentos que devam ser
RELATÓRIO DE AVALIAÇÃO PRÉVIA DE MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DE MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI RALTITREXEDO Medicamento PVH PVH com IVA Titular de AIM TOMUDEX Embalagem contendo 1 frasco com pó para solução injectável
RELATÓRIO DE AVALIAÇÃO PRÉVIA DE MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI RALTITREXEDO Medicamento PVH PVH com IVA Titular de AIM TOMUDEX Embalagem contendo 1 frasco com pó para solução injectável
Despacho n.º 18419/2010, de 2 de Dezembro (DR, 2.ª série, n.º 239, de 13 de Dezembro de 2011)
 (DR, 2.ª série, n.º 239, de 13 de Dezembro de 2011) Determina que os medicamentos destinados ao tratamento de doentes com artrite reumatóide, espondilite anquilosante, artrite psoriática, artrite idiopática
(DR, 2.ª série, n.º 239, de 13 de Dezembro de 2011) Determina que os medicamentos destinados ao tratamento de doentes com artrite reumatóide, espondilite anquilosante, artrite psoriática, artrite idiopática
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Lucentis 10 mg/ml solução injetável 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml contém 10 mg de ranibizumab*. Cada frasco para
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1 1. NOME DO MEDICAMENTO Lucentis 10 mg/ml solução injetável 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml contém 10 mg de ranibizumab*. Cada frasco para
Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram
 ( ) Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação
( ) Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação
Deliberação n.º 638/98, de 3 de Dezembro (DR, 2.ª série, n.º 294, de 22 de Dezembro de 1998)
 (DR, 2.ª série, n.º 294, de 22 de Dezembro de 1998) Instruções aos requerentes de pedidos de comparticipação de medicamentos para uso humano (Revogado pela Deliberação n.º 1028/2009, de 7 de Janeiro) Para
(DR, 2.ª série, n.º 294, de 22 de Dezembro de 1998) Instruções aos requerentes de pedidos de comparticipação de medicamentos para uso humano (Revogado pela Deliberação n.º 1028/2009, de 7 de Janeiro) Para
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI Emtricitabina + Tenofovir N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5253281 Truvada Frasco
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI Emtricitabina + Tenofovir N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5253281 Truvada Frasco
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. DENOMINAÇÃO DO MEDICAMENTO BETADINE 100mg/ml solução cutânea 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Princípio activo: Iodopovidona 10g Lista completa de excipientes,
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. DENOMINAÇÃO DO MEDICAMENTO BETADINE 100mg/ml solução cutânea 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Princípio activo: Iodopovidona 10g Lista completa de excipientes,
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Vacina Anti-rábica, suspensão injetável para cães, gatos e bovinos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada dose de 1 ml
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Vacina Anti-rábica, suspensão injetável para cães, gatos e bovinos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada dose de 1 ml
DELIBERAÇÃON.o3lto /CA/2006
 '" ""!EF Mini,tério da Saúde DELIBERAÇÃON.o3lto /CA/2006 o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que: A Comissão Europeia proferiu a Decisão
'" ""!EF Mini,tério da Saúde DELIBERAÇÃON.o3lto /CA/2006 o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que: A Comissão Europeia proferiu a Decisão
Injeção simulada Lucentis 0,5 mg (n = 240) Perda de < 15 letras na acuidade visual (%) a. Mês 12 62% 95% (Manutenção da visão)
 LUCENTIS ranibizumabe APRESENTAÇÕES Solução para injeção a 10 mg/ml. Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada do conteúdo
LUCENTIS ranibizumabe APRESENTAÇÕES Solução para injeção a 10 mg/ml. Embalagem com 1 frasco-ampola contendo 2,3 mg de ranibizumabe em 0,23 ml de solução, uma agulha com filtro para retirada do conteúdo
