DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA COM ÊNFASE À IMUNOISTOQUÍMICA E PCR.
|
|
|
- Sonia Gorjão Paranhos
- 6 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE ODONTOLOGIA e CURSO DE MEDICINA VETERINÁRIA CÂMPUS DE ARAÇATUBA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA COM ÊNFASE À IMUNOISTOQUÍMICA E PCR. Juliana de Assis Bióloga ARAÇATUBA SP 2008
2 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE ODONTOLOGIA e CURSO DE MEDICINA VETERINÁRIA CÂMPUS DE ARAÇATUBA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA COM ÊNFASE À IMUNOISTOQUÍMICA E PCR. Juliana de Assis ORIENTADORA: Profa. Dra. Wilma Aparecida Starke Buzetti CO-ORIENTADORA: Profa. Dra. Cáris Maroni Nunes Dissertação apresentada à Faculdade de Odontologia Unesp, Curso de Medicina Veterinária, Câmpus de Araçatuba, como parte dos requisitos para as exigências para a obtenção do título de Mestre em Ciência Animal (Medicina Veterinária Preventiva e Produção Animal). ARAÇATUBA SP 2008
3 Ficha Catalográfica elaborada pela Biblioteca da FOA / UNESP Assis, Juliana de A848d Diagnóstico da leishmaniose visceral canina com ênfase a imunoistoquímica e PCR / Juliana de Assis. Araçatuba: [s.n.], f. : il. + CD ROM Dissertação (Mestrado) Universidade Estadual Paulista, Faculdade de Odontologia, Curso de Medicina Veterinária, Araçatuba, Orientador: Profa. Dra. Wilma Aparecida Starke Buzetti Co-orientador: Profa. Dra. Cáris Maroni Nunes 1. Leishmania. 2. Cães. 3. Reação em cadeia da polimerase. 4. Imunoistoquímica CDD
4
5 DADOS CURRICULARES DO AUTOR JULIANA DE ASSIS nascida em Ilha Solteira SP no dia 19 de outubro de Ingressou no Curso de Licenciatura em Ciências Biológicas da Faculdade de Engenharia de Ilha Solteira Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP no ano de 2002, colando grau em dezembro de Em fevereiro de 2007, foi admitida no Programa de Pós-Graduação em Ciência Animal do Curso de Medicina Veterinária da FOA Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP Campus de Araçatuba.
6 Sem sonhos, as perdas se tornam insuportáveis, as pedras do caminho se tornam montanhas, os fracassos se transformam em golpes fatais. Mas, se você tiver grandes sonhos... Seus erros produzirão crescimento, seus desafios produzirão oportunidades, seus medos produzirão coragem. Augusto Cury
7 Dedico... Em primeiro lugar a Deus pela vida e proteção. A todos que possam usufruir deste trabalho. Aos cães vítimas da leishmaniose.
8 AGRADECIMENTOS À Deus pela vida, por me dar forças para finalizar mais uma etapa e principalmente nos momentos em que tudo parecia não ter saída, que não foram poucos. À Profa. Dra. Wilma Aparecida Starke Buzetti por me orientar a seguir o melhor caminho, pela confiança, pela compreensão, pelo incentivo nos momentos difíceis e pela paciência. Além da importante colaboração na finalização da dissertação, a qual serei eternamente grata. Impossível não mencionar a minha admiração pela sua garra, determinação e sabedoria. À Profa. Dra. Cáris Maroni Nunes pela co-orientação, pelo fundamental apoio na pesquisa e paciência. À Profa. Dra. Rosangela Machado Zacharias pela fundamental colaboração em parte dos experimentos. À Dra. Trícia Maria F. S. Oliveira pela fundamental colaboração em parte dos experimentos. À Profa. Dra. Maria Francisca Neves por aceitar o convite para compor a banca de defesa e pelas sugestões. À Profa. Dra. Luzia Helena Queiroz por aceitar o convite para compor a banca de defesa e pelas sugestões. À Profa. Dra. Kátia Denise Saraiva Brasciani por aceitar o convite para compor a banca do exame de qualificação e pelas sugestões.
9 À Profa. Dra. Mary Marcondes Feitosa por aceitar o convite para compor a banca do exame de qualificação e pelas sugestões. À todos os professores do Curso de Pós - graduação em Ciência Animal pelos ensinamentos. À Nina Marí Gual Pimenta de Queiroz grande companheira nesta etapa desafiadora, minha irmã científica, a qual lutou ao meu lado do começo ao fim sempre com pensamentos positivos e serenidade me incentivando a cada momento para a elaboração das nossas pesquisas em parceria e amizade. Além da importante colaboração na finalização da dissertação, a qual serei eternamente grata. Em especial a minha avó Josefina Borges de Assis e meu avô João Paulino de Assis pelo apoio constante e conforto nas palavras de incentivo e carinho, sempre me estimulando a seguir em frente quando o desânimo persistia. Aos meus pais, José Batista de Assis e Elsa Yoshie Koguchi de Assis, por me apoiarem nas minhas decisões e pelo suporte quando precisei. À tia Nilza Maria de Assis Oliveira, tio Antônio Edson de Oliveira, Talita de Assis Oliveira e Amanda de Assis Oliveira por muitas vezes permitir que eu desfrutasse dos momentos em família e ao mesmo tempo pelo apoio fundamental na elaboração da dissertação, os quais muitas vezes deixaram seus afazeres para me ajudar sempre que precisei. À Keley Cristina de Assis, amiga de tantos anos que mesmo a distância sempre esteve presente em alma, pela amizade e pelas palavras de carinho.
10 As colegas de mestrado e também de república Dayana Ribeiro, Vivian Alves, Bianca Paludeto e Fernanda Gottardi pelas conversas, por compartilhar risadas, diversões e momentos de angústia. As minhas tias, tios e primos da minha imensa família pela força. As alunas de graduação do curso de Ciências Biológicas da UNESP Campus de Ilha Solteira Michely S. Tenório, Silvana de Cássia Paulan, Karen Ingrid Tasca, Flávia Luna Lima pela colaboração no início do experimento e auxílio. À equipe do Departamento de Biologia e Zootecnia (DBZ) e aos funcionários do laboratório de Parasitologia pela prestação de serviços. À Valquíria R. Gazola, Érica S. Ribeiro e Pedro Florindo, equipe do Laboratório de Bioquímica e Biologia Molecular (LBBMA) da UNESP Campus de Araçatuba, pelo auxílio na realização em parte dos experimentos. À equipe da seção de pós-graduação, Valéria Q. M. Zagatto e Diogo Luís Reatto, pela prestação de serviços e paciência. À equipe da biblioteca da UNESP Campus de Araçatuba pelas correções, sugestões e serviços em geral. A todas as pessoas que direta ou indiretamente contribuíram para a construção deste trabalho. Meus sinceros agradecimentos!
11 SUMÁRIO Página LISTA DE TABELAS LISTA DE FIGURAS RESUMO SUMMARY 1 INTRODUÇÃO E REVISÃO DE LITERATURA OBJETIVOS Objetivo Geral Objetivos Específicos MATERIAL E MÉTODO Local Animais Sinais Clínicos e Anatomopatológicos dos Cães Colheita de Amostras Sangue Tecidos Reação em Cadeia pela Polimerase (PCR) Histologia Exames Sorológicos Ensaio Imunoenzimático (ELISA) Descrição da Técnica Tratamento dos Dados Reação de Imunofluorescência Indireta (RIFI) Descrição da RIFI Exames Parasitológicos Histoquímica (HE) Imunoistoquímica (IMIQ) Reação em Cadeia pela Polimerase (PCR) Extração de DNA de Amostras de Sangue Extração de DNA de Amostras de Baço, Linfonodo e Fígado Concentração e Pureza do DNA Amplificação do DNA Amplificação de DNA de Cão Eletroforese em Gel de Poliacrilamida a 8% Interpretação dos Resultados Diagnósticos Análise Estatística RESULTADO Sinais Clínicos e Anatomopatológicos Exames Sorológicos (ELISA e RIFI) e Parasitológicos (HE e IMIQ) Cães Assintomáticos (A) Cães Oligossintomáticos (O) Cães Polissintomáticos (P) Reação em Cadeia pela Polimerase (PCR)...58
12 4. 4 Comparação dos Testes Diagnósticos DISCUSSÃO CONCLUSÃO...77 REFERÊNCIAS...78 ANEXOS...89
13 LISTA DE TABELAS Tabela 1 - Resultados do diagnóstico de Leishmaniose Visceral Canina por exames sorológicos ELISA e RIFI, histoquímico (HE) e imunoistoquímico (IMIQ) nos tecidos do baço, linfonodo e fígado de cães assintomáticos (A) naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP (Araçatuba - SP, 2008)...49 Tabela 2 - Resultados do diagnóstico de Leishmaniose Visceral Canina por exames sorológicos ELISA e RIFI, histoquímicos (HE) e imunoistoquímicos (IMIQ) nos tecidos do baço, linfonodo e fígado de cães oligossintomáticos (O) naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP. (Araçatuba - SP, 2008)...51 Tabela 3 - Resultados do diagnóstico de Leishmaniose Visceral Canina por exames sorológicos ELISA e RIFI, histoquímicos (HE) e imunoistoquímicos (IMIQ) nos tecidos do baço, linfonodo e fígado de cães polissintomáticos (P) naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP. (Araçatuba - SP, 2008)...53 Tabela 4 - Resultados do diagnóstico por PCR realizada em tecidos do baço, linfonodo, fígado e no sangue dos cães considerados suspeitos e negativos para LVC, pelos testes ELISA indireto, RIFI, histoquímico (HE) e imunoistoquímico (IMIQ). (Araçatuba - SP, 2008)...61 Tabela 5 - Resultados em número de cães e porcentagens (%) da PCR realizada com o sangue dos 34 cães naturalmente infectados por Leishmania spp no município de Ilha Solteira SP. (Araçatuba SP, 2008)...63 Tabela 6 - Resultados em números e porcentagens (%) dos cães positivos e negativos para Leishmaniose Visceral Canina pelos exames sorológicos (ELISA e RIFI), parasitológicos (HE e IMIQ) e PCR para LVC, realizados em cães no município de Ilha Solteira SP. (Araçatuba - SP, 2008)...64
14 Tabela 7 - Resultados do teste IMIQ no tecido do baço comparado aos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados pelo teste Kappa...66 Tabela 8 - Resultados do teste IMIQ no tecido do linfonodo comparado aos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados pelo teste Kappa...66 Tabela 9 - Resultados do teste IMIQ no tecido do fígado comparado aos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados pelo teste Kappa...67 Tabela 10 - Resultados dos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados entre si pelo teste Kappa...67
15 LISTA DE FIGURAS FIGURA 1 - Sinais clínicos e anatomopatológicos em cães oligossintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP...47 FIGURA 2 - Sinais clínicos e anatomopatológicos em cães polissintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP...47 FIGURA 3 - Corte histológico de baço de cão polissintomático para LVC, ilustrando macrófagos infectados com amastigotas de L. (L.) chagasi em cão do município de Ilha Solteira - SP. (HE, Obj. 100X)...54 FIGURA 4 - Corte histológico de linfonodo de cão polissintomático para LVC, ilustrando macrófagos infectados com amastigotas de L. (L.) chagasi em cão do município de Ilha Solteira - SP. (HE, Obj. 100X)...54 FIGURA 5 - Corte histológico de fígado de cão polissintomático para LVC, ilustrando macrófagos infectados com amastigotas de L. (L.) chagasi em cão do município de Ilha Solteira - SP. (HE, Obj. 100X)...55 FIGURA 6 - Coloração imunoistoquímica de baço de cão polissintomático para LVC, ilustrando as formas amastigotas de L. (L.) chagasi coradas em vermelho tijolo pelo substrato da enzima peroxidase, em tecido de cão do município de Ilha Solteira - SP. (Obj. 100X)...55 FIGURA 7 - Coloração imunoistoquímica de linfonodo de cão polissintomático para LVC, ilustrando as formas amastigotas de L. (L.) chagasi coradas em vermelho tijolo pelo substrato da enzima peroxidase, em tecido de cão do município de Ilha Solteira - SP. (Obj. 100X)...56
16 FIGURA 8 - Coloração imunoistoquímica de fígado de cão polissintomático para LVC, ilustrando as formas amastigotas de L. (L.) chagasi coradas em vermelho tijolo pelo substrato da enzima peroxidase, em tecido de cão do município de Ilha Solteira - SP. (Obj. 100X)...56 FIGURA 9 - Porcentagens (%) de cães positivos, suspeitos e negativos para Leishmaniose Visceral Canina pelos resultados dos testes sorológicos (RIFI e ELISA) e parasitológicos (HE e IMIQ), naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP...57 FIGURA 10 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp, por PCR no baço dos cães classificados como suspeitos (1, 2, 4, 9, 18, 23, 28) e negativos (11, 14, 20 e 22) e ausência de banda de DNA nos cães suspeitos (6 e 21) e negativo (13) para LVC pelos exames sorológicos e parasitológicos; PM: marcador em escala de 100pb (Invitrogen ); C+: DNA extraído do baço de cão naturalmente infectado por Leishmania spp; C-: DNA extraído do baço de cão negativo para LVC e NO: sem DNA...59 FIGURA 11 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp, por PCR no linfonodo dos cães classificados como suspeitos (1, 2, 4, 9, 18, 23, 28) e negativos (11, 13 e 14) e ausência de banda de DNA nos cães suspeitos (6 e 21) e negativos (20 e 22) para LVC pelos exames sorológicos e parasitológicos; PM: marcador em escala de 100pb (Invitrogen ); C+: DNA extraído do linfonodo de cão naturalmente infectado por Leishmania spp; C-: DNA extraído do linfonodo de cão negativo para LVC e NO: sem DNA...60 FIGURA 12 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp, por PCR no fígado dos cães classificados como suspeitos (1, 2, 4, 9, 18, 23 e 28) e negativos (11, 14, 20 e 22) e ausência de banda de DNA nos cães suspeitos (6 e 21) e negativo (13) para LVC pelos exames sorológicos e parasitológicos; PM: marcador em escala de 100pb (Invitrogen ); C+: DNA extraído do fígado de cão naturalmente infectado por Leishmania spp; C-: DNA extraído do fígado de cão negativo para LVC e NO: sem DNA...60 FIGURA 13 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp por PCR no sangue dos cães (1, 2, 3, 4, 5, 6, 7, 8, 10, 13, 15, 16, 17, 19 e 20); ausência de banda de DNA no cão (9); PM: marcador em escala de 100pb (Invitrogen ); C-: DNA extraído do sangue de cão negativo para LVC; C+: DNA
17 extraído do sangue de cão naturalmente infectado por Leishmania spp e NO: sem DNA...62 FIGURA 14 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp por PCR no sangue dos cães (11, 12, 18, 28, 32, 22, 23, 24, 25, 26, 27, 29, 30 e 31); ausência de banda de DNA nos cães (14 e 21); PM: marcador em escala de 100pb (Invitrogen ); C-: DNA extraído do sangue de cão negativo para LVC; C+: DNA extraído do sangue de cão naturalmente infectado por Leishmania spp e NO: sem DNA...62 FIGURA 15 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp por PCR no sangue dos cães (33 e 34); PM: marcador em escala de 100pb (Invitrogen )...63 FIGURA 16 - Porcentagens (%) de cães positivos para Leishmaniose Visceral Canina pelos testes ELISA, RIFI, HE, IMIQ e PCR, naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP...65
18 ASSIS, J. Diagnóstico da Leishmaniose Visceral Canina com ênfase à Imunoistoquímica e PCR f. Dissertação (Mestrado em Ciência Animal) Faculdade de Odontologia e Curso de Medicina Veterinária, Universidade Estadual Paulista, Araçatuba, RESUMO - Leishmaniose Visceral Canina (LVC) é uma enfermidade parasitária causada no Brasil pelo protozoário Leishmania (Leishmania) chagasi, tendo o cão como o principal hospedeiro doméstico. O presente estudo objetivou realizar os testes sorológicos como a reação imunoenzimática (ELISA) e a reação de imunofluorescência indireta (RIFI), além dos testes parasitológicos como a histoquímica (HE) e imunoistoquímica (IMIQ) para diagnosticar LVC em cães com diferentes sinais clínicos. Além disso, a reação em cadeia pela polimerase (PCR) do sangue e dos tecidos foi utilizada para comparar e confirmar os diagnósticos não conclusivos pelos métodos sorológicos e parasitológicos. A análise comparativa entre os testes utilizados também foi realizada. Para este estudo, foram utilizados 34 cães com diferentes manifestações clínicas da LVC classificados em assintomáticos, oligossimtomáticos e polissintomáticos, submetidos à eutanásia pelo Centro de Controle de Zoonoses (CCZ) de Ilha Solteira, SP. Dentre os órgãos analisados, o baço e o linfonodo, foram os que se apresentaram intensamente parasitados. Pelos métodos sorológicos (ELISA e RIFI) e parasitológicos (HE e IMIQ), o maior número de cães positivos para LVC foram os polissintomáticos (92,0%), seguido pelos oligossintomáticos (57,0%) e assintomáticos (12,5%). Os métodos sorológicos e parasitológicos diagnosticaram 60,0% dos cães como positivos, 15,0% como negativos e 26,5% como suspeitos. A PCR do sangue confirmou os resultados positivos pelas outras técnicas e detectou DNA do parasita nos tecidos em 100% dos cães negativos e 89,0% dos suspeitos, elevando para 97,0% a positividade. Os índices de positividades para ELISA, IMIQ, RIFI e HE foram de 65,0%, 62,0%, 56,0% e 56,0%, respectivamente. Pela análise comparativa entre os métodos, a concordância foi leve entre PCR versus RIFI, ELISA e IMIQ, mas muito boa entre RIFI e IMIQ no baço e fígado e boa no linfonodo. A PCR foi o método mais sensível para o diagnóstico definitivo quando os testes parasitológicos e sorológicos não foram capazes de detectar cães positivos para LVC. Palavras-Chave: Leishmania (L.) chagasi, diagnóstico, cães, PCR, Imunoistoquímica.
19 ASSIS, J. Diagnosis of the Canine Visceral Leishmaniasis with emphasis to Immunohistochemistry and PCR f. Dissertação (Mestrado em Ciência Animal) Faculdade de Odontologia e Curso de Medicina Veterinária, Universidade Estadual Paulista, Araçatuba, SUMMARY - Canine Visceral Leishmaniasis (CVL) is caused in Brazil by a protozoa parasite of the Leishmania (Leishmania) chagasi species, which dog is the main domestic host. The purpose of the present study was to evaluate the CVL diagnosis by ELISA indirect, the indirect fluorescence antibody test (IFAT), histochemical (HE) and immunohistochemical (IMHC) tests in 34 dogs with different clinical signs. In addition, polymerase chain reaction (PCR) was done in blood and in liver, spleen and lymph node tissues in order to compare and confirm no conclusive diagnosis by the methods parasitological and serological. A comparative analysis among tests was also evaluated. For this study, the dogs were divided according to clinical signs as asymptomatic, oligosymptomatic and polisymptomatic Leishmania-infected dogs euthanized by the Control Center of Zoonotic Diseases (CCZ) from Ilha Solteira, SP, Brazil. The more intense parasite load of intact amastigotes was seen in spleen and lymph node tissues followed by the liver with the lowest parasite load. By serological tests (RIFI and ELISA) and parasite direct microscopic examination (HE and IMHC), the highest numbers of positive dogs were seen in polisymptomatic (92.0%) followed by oligosymptomatic dogs (57.0%) and asymptomatic (12.5%). In addition, 60.0% dogs were positives, 15.0% were negatives, but 26.5% were classified as suspect because of serological and parasitological inconclusive results. Furthermore, PCR confirmed the positive results and detected DNA in tissues from 100% of negative dogs and 89.0% suspects raising the animal positivism index up to The positivism indexes of ELISA, IMHC, RIFI and HE were 65.0%, 62.0%, 56.0% and 56.0%, respectively. By comparative analysis, it was observed a low level of concordance among PCR and IFAT, ELISA or IMHC, but very good between IFAT and IMHC in spleen and liver and good in lymph node. PCR was the most sensitive and a valuable method for a definitive diagnosis when serological and parasitological tests were not able to detect positive dogs for this disease. Keywords: Leishmania (L.) chagasi, diagnosis, dogs, PCR, Immunohistochemistry.
20 19 1 INTRODUÇÃO E REVISÃO DE LITERATURA A Leishmaniose Visceral Canina (LVC) é uma enfermidade crônica causada por protozoários pertencentes à ordem Kinetoplastida, família Trypanosomatidae e gênero Leishmania (ROSS, 1903). O parasito pode ser visualizado sob duas formas principais, sendo uma flagelada ou promastigota, encontrada no tubo digestivo do inseto vetor e em alguns meios de cultura artificiais, e outra aflagelada ou amastigota, que é intracelular obrigatória, sendo encontrada nas células do sistema fagocítico mononuclear do hospedeiro vertebrado (REY, 2001). A leishmaniose visceral (LV) é uma doença que tem como agente etiológico as espécies Leishmania (Leishmania) donovani na Índia, Leishmania (Leishmania) infantum na Europa e na bacia do Mediterrâneo, o chamado Velho Mundo, e a espécie Leishmania (Leishmania) chagasi nas Américas, o Novo Mundo (LAISON; SHAW, 1987). Pelas espécies de L. (L.) chagasi e L. (L.) infantum serem morfologicamente semelhantes, alguns autores compararam suas estruturas em estudos bioquímicos e moleculares e sugeriram que as espécies podem ser consideradas como uma única espécie, permitindo assim que denominem de L. (L.) infantum o agente etiológico desta zoonose também nas Américas (MAURÍCIO et al., 1999). De acordo com a Organização Mundial da Saúde (OMS) 1990, cerca de 12 milhões de pessoas estão infectadas por leishmaniose no mundo e cerca de novos casos aparecem a cada ano, sendo que mais de 90% deles ocorrem no Brasil, Bangladesh, Índia e Sudão. No Brasil, dentre os Estados com maior incidência estão o Nordeste (92,0%), seguido pela região Sudeste (4,0%), Norte (3,0%) e Centro-Oeste (1,0%) (FUNASA, 2001).
21 20 As formas amastigotas de L. (L.) chagasi podem ainda ser encontradas no interior de vacúolos das células de Kupffer do fígado, nas células reticuladas e macrófagos do baço, da medula óssea e dos linfonodos, que são os órgãos extremamente ricos em células, como também nos rins, supra-renais, intestinos, pulmões e pele (REY, 2001). As amastigotas possuem um núcleo grande e arredondado e citoplasma com um cinetoplasto, uma estrutura mitocondrial em forma de bastonete, composto por estruturas filamentosas que correspondem ao ácido desoxirribonucléico. Já as formas promastigotas são alongadas, com um flagelo inserido na porção anterior, livre e longo, um núcleo arredondado e um cinetoplasto em forma de bastão. Ambas as formas reproduzem-se por divisão binária simples, no sentido antero-posterior (MICHALICK, 2005). A principal forma de transmissão do parasito para o homem e outros hospedeiros mamíferos é pela picada de fêmeas infectadas de dípteros hematófagos da espécie Lutzomyia longipalpis de tamanho bastante reduzido, cerca de 2 a 3 mm (DEANE; DEANE, 1955). Além deste inseto a espécie Lutzomyia cruzi foi incriminada como vetor no Estado do Mato Grosso do Sul (GALATI et al., 1997). As formas imaturas desenvolvem-se em ambientes terrestres úmidos, ricos em matéria orgânica e de baixa incidência luminosa, fato que dificulta o combate desses vetores (SANTA ROSA; OLIVEIRA, 1997). O mosquito palha ao repousar sobre o hospedeiro vertebrado pica-o através da pele e ingere com o sangue as formas amastigotas, as quais no intestino médio sofrem divisão binária, modificam-se em promastigotas e migram para o intestino anterior. Na parede do intestino anterior fixadas pelo flagelo sofrem multiplicação e diferenciação, transformando-se em promastigotas metacíclicas infectantes que são inoculadas na pele de outro hospedeiro pela probóscide, durante o repasto sanguíneo (KILLICK- KENDRICK, 2002). Na epiderme do hospedeiro, as formas promastigotas são fagocitadas pelas células do sistema mononuclear fagocitário. No interior dos macrófagos, no vacúolo parasitóforo, se diferenciam em amastigotas e multiplicam-se
22 21 intensamente até o rompimento das células. As amastigotas livres são fagocitadas por novos macrófagos em um processo contínuo, ocorrendo então à disseminação hematogênica e linfática para outros tecidos ricos em células do sistema mononuclear fagocitário, como linfonodos, fígado, baço e medula óssea (MICHALIK, 2005). Na ausência de flebotomíneos no ciclo de transmissão, alguns autores associaram a participação de ectoparasitas de cães como o carrapato Rhipicephalus sanguineus na transmissão da LVC (COUTINHO et al., 2005). No ambiente urbano, o cão é considerado o principal reservatório de parasitos de Leishmania spp. pelos registros de casos caninos serem maiores do que os casos humanos e pelo grande número de parasitos encontrados na pele dos cães do que em humanos, sendo assim considerados importantes na epidemiologia da doença (DEANE; DEANE, 1955). Já na área silvestre, os canídeos (Cerdocyon thous e Lycalopex vetulus), marsupiais (Didelphis albiventris e Didelphis marsupialis) e roedores (Proechymis oris) são incriminados como os reservatórios (SANTA ROSA; OLIVEIRA, 1997). Estudos sugerem ainda o gato (Felis domesticus), uma vez que, é um hospedeiro para diferentes espécies de Leishmania spp., possível reservatório no ciclo de transmissão das leishmanioses, porém não existem dados que confirme o gato como fonte de infecção para a LV (ROSSI, 2007). A co-infecção com outras doenças é outro fator que contribui com o aumento da LV principalmente em crianças e pessoas imunodeprimidas, especialmente com HIV (ALVAR, 1999). A elevada freqüência desta associação é devido tanto à reativação da infecção quanto a uma forma alternativa (antroponótica) de infecção primária, decorrente da inoculação intravenosa de Leishmania sp, por meio de compartilhamento de agulhas e seringas na transmissão inter-humana. Cerca de 90% da ocorrência atinge o sexo masculino usuários de drogas intravenosas (SÃO PAULO, 2003). A LVC já foi considerada uma doença rural, tipicamente silvestre. Todavia, as modificações ambientais causadas pelo homem e a constante migração das populações da zona rural para as zonas urbanas tem promovido
23 22 a urbanização e a expansão da doença (MARZOCHI; MARZOCHI, 1994). A dinâmica da LVC na área urbana é pouco conhecida, sendo o processo desordenado da ocupação urbana e a destruição ambiental, fatores que também podem ter influenciado a emergência da leishmaniose neste meio (FRANÇA-SILVA et al., 2005). Outros fatores estão associados com o aparecimento da doença, em destaque a coleta de lixo e o sistema de esgotos irregulares ou ausentes, criação de pássaros em gaiolas e ainda a presença de porcos (MORENO et al., 2005) e galinhas no peridomicílio (BARBOZA et al., 2006; MOREIRA JUNIOR et al., 2003). A predisposição genética é outro fator determinante de diferentes respostas imunológicas nos cães, sendo a raça Ibizan Hound a única raça conhecida atualmente resistente à doença (SOLANO-GALLEGO et al., 2000). O primeiro caso de LV, do Brasil, foi descrito por Migone em 1913 no Paraguai em um paciente que após viajar para o Mato Grosso do Sul passou a apresentar sintomas da doença e teve o diagnóstico da doença confirmado (ALENCAR, 1977). Já na região Sudeste, o primeiro registro de suspeita de autoctonia de caso humano de leishmaniose visceral americana no Estado de São Paulo ocorreu em 1978 na Grande São Paulo (IVERSSON et al., 1979). No ano de 1998, foram registrados os primeiros casos caninos na região de Araçatuba (LUVIZZOTO et al., 1999) e em 1999 casos humanos da doença na mesma região (GALIMBERTTI et al., 1999). A partir destes primeiros casos, encontrou-se o vetor Lutzomyia longipalpis, até meados de 2006, em 68 municípios das regiões administrativas de Araçatuba, Bauru, Marília, Presidente Prudente e São João da Boa Vista. Em 45 destes municípios constatou-se a transmissão da enfermidade em cães, e em 34 foram detectados também casos humanos (BRASIL, 2006), principalmente os municípios localizados ao longo da Rodovia Marechal Rondon (LINDOSO; GOTO, 2006). Recentemente, no município de Ilha Solteira, entre meados de 2006 a 2007 foram observados 355 cães positivos para LVC, ou seja, 9,3% dentre os 3798 cães examinados, confirmando a expansão da doença em área urbana (ASSIS et al., 2008).
24 23 Nas últimas décadas alguns dos municípios mais atingidos pela LVC foram São Luís (MA) (MENDES et al., 2002), Belo Horizonte (MG) (ALVES; BEVILACQUA, 2004), Salvador (BA) (BARBOZA et al., 2006), Três Lagoas (MS) (OLIVEIRA et al., 2006) e Araçatuba (SP) (ANDRADE et al., 2008; FEITOSA et al., 2000). Considerando isto, o diagnóstico precoce dos animais acometidos é importante, tanto sob o ponto de vista do monitoramento e controle dos casos humanos e subseqüente adoção de medidas para o controle da doença, quanto para a avaliação do quadro clínico destes animais (COSTA-VAL et. al., 2006). O programa de eliminação canina não tem reduzido a incidência da LVC, por isso os prováveis fatores que têm levado à ineficiência da medida são a incapacidade dos métodos diagnósticos para identificar todos os cães infectados, a reposição dos cães por filhotes susceptíveis ou por cães já infectados, e a possível existência de outros reservatórios (MILES et al., 1999). Em recentes estudos, Nunes (2007) observou que a reposição de uma considerável parcela de cães submetidos à eutanásia contribuiu para o processo de transmissão por manter os hospedeiros susceptíveis na área, não contribuindo assim com o controle da LVC, além de manter animais soronegativos no ambiente e que possivelmente com parasitas albergados na pele. As manifestações sintomatológicas dos cães com LVC ocorrem de forma variada. As alterações cutâneas comumente observadas nos cães são dermatites com excessiva descamação e despigmentação que normalmente se desenvolve na cabeça e se difunde para outras regiões do corpo, prurido, pelame seco, queda dos pêlos e áreas de hiperqueratose e lignificação, principalmente em locais correspondentes à saliências ósseas, além de úlceras e pequenos nódulos intradérmicos (FEITOSA et al., 2000) provavelmente decorrentes da multiplicação das formas amastigotas na epiderme, produzindo um processo inflamatório local, ou de uma vasculite necrotizante causada pela deposição de imunocomplexos (SANTA ROSA; OLIVEIRA, 1997). Também são observados sinais gerais como apatia, anorexia, êmese, hemorragia
25 24 intestinal, coriza, edema de membros, blefarite, alopecia (FEITOSA et al., 2000; FERRER et al., 2002) alterações digestórias, cardiorrespiratórias, renais, locomotoras, linfadenomegalia, hiporexia, onicogrifose, emaciação, anemia, pneumonia e comprometimento do sistema urinário e hepático e sinais de alterações neurológicas (FEITOSA et al., 2000). Alguns cães podem ainda apresentar sinais oculares (conjuntivite, edema e uveíte), emagrecimento, hipertermia, diarréia, melena e hepatoesplenomegalia (AGUIAR et al., 2007; FEITOSA et al., 2000). No entanto, a maioria dos cães infectados não apresenta qualquer sinal clínico (CABRAL et al., 1998; SIDERIS et al., 1999). A doença pode evoluir no hospedeiro para a forma latente, e até mesmo a cura espontânea (PINELLI et al., 1999). Em torno de 60 a 80% dos cães pertencentes à área endêmica podem ter contato com o parasito e não desenvolver sinais clínicos da doença (FERRER, 1999) e há evidências que a taxa de prevalência da infecção em cães assintomáticos pode ser mais alta do que aquelas obtidas por estudos sorológicos (SOLANO-GALLEGO et al., 2001b). Desta forma, os cães assintomáticos consistem em um reservatório perigoso que merece atenção quanto à expansão da leishmaniose visceral (CABRAL et al., 1998; SIDERIS et al., 1999; SILVA et al., 2001). Em estudos com a pele clinicamente normal de cães com leishmaniose foram demonstrados parasitos albergados e que provavelmente existe a chance de transmissão da doença (SOLANO- GALLEGO et al., 2004). Alguns estudos demonstraram ainda que, cães resistentes à LVC produzem baixos títulos de anticorpos (menor ou igual a 1:80) pela RIFI enquanto os cães susceptíveis apresentam títulos elevados (1:320 ou mais). Desta forma, a observação de cães de áreas endêmicas pode elucidar importantes dúvidas sobre o comportamento da doença e suas implicações na epidemiologia (PINELLI et al., 1994). A explicação para este fato está no tipo de resposta imune promovida pelo hospedeiro, a qual é regulada por distintos grupos de citocinas que as células T liberam no primeiro contato com as células apresentadoras de antígenos infectadas por parasitas, as quais são os
26 25 macrófagos, as células dendríticas e as células de Langerhans. Estudos sobre a resposta imunológica têm revelado que as células T constituem-se de duas principais subpopulações as células CD4+ auxiliares do tipo 1 (Ta1) e tipo 2 (Ta2) e as células citotóxicas CD8+ e que as citocinas produzidas por estas células, determinam se a infecção resultará em uma resposta imune protetora ou a evolução da doença (PINELLI et al., 1999). Caso as células Ta1 sejam ativadas ocorrerá a produção de citocinas pré-inflamatórias que são a interleucina-2 (IL-2), interferon gama (IFN-γ) e fator de necrose tumoral (TNF) os quais aumentarão a resistência dos macrófagos promovendo uma resposta imune celular protetora, controlando o parasitismo nas células. Por outro lado, se a infecção estiver associada com a produção de Ta2, ocorrerá a liberação de citocinas anti-inflamatórias, IL-4, 5, 6, 10 e 13, as quais desencadearão a proliferação das células B com produção de imunoglobulinas e deposição de imunocomplexos nos tecidos, desencadeando uma resposta imune humoral não protetora (FEITOSA et al., 2000). Em infecção experimental em cães pela inoculação intradermal de promastigotas de Leishmania sp foi observada a fagocitose dos parasitas por neutrófilos e macrófagos no início da infecção, além da progressão da doença com o desaparecimento destas células infectadas na pele e a presença de amastigotas no linfonodo após três meses da inoculação, sugerindo que as formas promastigotas foram transformadas em amastigotas. Contudo, foi sugerido que as células de Langerhans têm o papel de capturar os parasitos da pele e fazer o transporte até o linfonodo para a apresentação às células T e na iniciação da resposta imune (SANTOS-GOMES et al., 2000). Em outros estudos, foi observado que a pele é o local crucial e o ponto chave para a disseminação da doença pelo corpo. Em animais susceptíveis, os parasitos são rapidamente disseminados para o linfonodo, baço e medula óssea nas primeiras horas. Do contrário, em animais resistentes, os parasitos permanecem localizados na pele ou próximos ao linfonodo (FERRER, 2002). Além disso, Tafuri et al. (2004) observaram a ausência de amastigotas na pele da orelha, focinho e abdômen de um cão sintomáticos para LVC, sugerindo que
27 26 a pele pode não ser um bom órgão indicador de parasitas em órgãos ou viceversa. Na LVC as lesões histopatológicas são principalmente associadas a hipertrofias e hiperplasias observadas nas células do sistema mononuclear fagocitário. São descritas lesões acometendo órgãos como fígado, baço, linfonodos, pulmões, medula óssea, rins, intestino, tegumento e vasos (LIMA et al., 2004; TAFURI et al., 1996). Na histopatologia do baço de cães infectados por Leishmania sp, uma intensa reação granulomatosa inflamatória tem sido observada associada com a hipertrofia e hiperplasia do sistema mononuclear, indicando a característica clássica da doença, com alteração da polpa vermelha e a presença de linfócitos aumentados na polpa branca. Já na polpa vermelha pode ser observada também a proliferação de macrófagos, às vezes formando agregados ou nódulos celulares intensamente parasitados (TAFURI et al.,1996). Nos linfonodos ocorre o aumento em número e tamanho de folículos linfóides, com a proliferação de linfócitos e células reticuloendotelial, responsáveis pela resposta imune, e ainda lesões hipertróficas e hiperplásicas nas regiões corticais e medulares com macrófagos medulares infectados com amastigotas o que explica a causa da linfoadenomegalia (LIMA et al., 2004). Ainda em outros estudos foram observados a hipertrofia e hiperplasia na zona cortical e medular dos linfonodos em cães assintomáticos, e atrofia da zona cortical nos linfonodos em cães sintomáticos, além da alta densidade parasitária (GIUNCHETTI et al., 2007). Nos tecidos hepáticos de cães assintomáticos e oligossintomáticos foi observada uma reação inflamatória crônica envolvendo o trato portal, veias centrais, ou espaços perisinusoidais com células de Kupffer hipertróficas e hiperplásicas, com amastigotas. Neste órgão havia também congestão dos vasos sinusóides, além de muitos granulomas intralobulares de vários tamanhos, constituídos por macrófagos com ou sem amastigotas de L. (L.) chagasi, algumas células epitelióides, poucos linfócitos, plasmócitos e raros
28 27 neutrófilos. Além disso, o maior número de granulomas foi observado nos cães assintomáticos do que nos oligossintomáticos e sintomáticos, sugerindo assim, uma melhor resposta imune (SANT ANA et al., 2007). A LVC pode desenvolver variados sinais clínicos não específicos em cães, assim técnicas laboratoriais são indispensáveis para obter dados de diagnósticos adicionais visando à identificação da infecção (INIESTA et al., 2002). Além de que, o diagnóstico precoce da doença em humanos e cães é de grande importância, pois a doença pode ser fatal para os humanos e contribui com o controle de cães no meio urbano pela prática da eutanásia (ALVES; BEVILACQUA, 2004). Os métodos comumente utilizados no diagnóstico da LVC estão fundamentados na visualização dos aspectos clínicos juntamente com auxílio de exames parasitológicos que incluem o esfregaço de aspirado de baço, medula óssea, linfonodos e de biópsia hepática e também o isolamento do parasito em meio de cultura e/ou por inoculação intraperitoneal em hamsters de material aspirado (SANTA ROSA; OLIVEIRA, 1997), por provas sorológicas na detecção de anticorpos anti-leishmania (BRASIL, 2003) e por exames moleculares para amplificação de DNA de Leishmania spp. (MANNA et al., 2004). Nos últimos anos uma grande melhoria tem se observado nas técnicas de diagnóstico para LVC, porém nenhum tem apresentado 100% de sensibilidade e especificidade (GONTIJO; MELO, 2004). A suspeita de cães com LVC não se baseia somente na sintomatologia, uma vez que podem mimetizar outras doenças, tais como, malária, esquistossomose hepatoesplênica, doença de Chagas, brucelose e febre tifóide dificultando o diagnóstico. Além disso, a histopatologia não é específica apresentando ainda lesões microscópicas similares a lesões observadas em outras infecções e doenças imunomediadas (FERRER, 1999; GRADONI et al., 2002; MARZOCHI et al., 1981). O cultivo de amastigotas por meio de inoculação intraperitoneal em hamsters é dificultoso e demorado, ainda exige cuidados especiais com estes animais. Entretanto, o cultivo de amastigotas obtidos de animais de laboratório
29 28 e ainda esfregaços de aspirados de linfonodo e medula óssea, são considerados como padrão-ouro para o diagnóstico, porém geralmente são utilizados para o isolamento e identificação do parasita e é pouco usado na rotina de diagnóstico clínico, ainda assim, este método apresenta baixa sensibilidade, de 60% para esfregaços de medula óssea e menor que 30% para esfregaços de linfonodos (FERRER et al., 1999). Ainda assim, a sensibilidade dos testes parasitológicos depende do grau de parasitemia, do tipo de material biológico coletado, da coloração e do tempo de leitura. Dependendo do tempo de leitura das lâminas na procura do parasito, a sensibilidade passa a ser no máximo de 80% em cães sintomáticos e menos que esta porcentagem em cães soropositivos assintomáticos (BRASIL, 2003). Os testes sorológicos mais utilizados para o diagnóstico incluem a reação de fixação de complemento, o convencional Ensaio Imunoenzimático (ELISA), dot-elisa, ELISA competitivo, o Teste de Aglutinação Direta (DAT), Western blot (WB), teste Látex e a Reação de Imunofluorescência Indireta (RIFI) (GRADONI et al., 2002). No entanto, a sensibilidade e a especificidade dos testes sorológicos são influenciadas pelo tipo de antígeno e protocolo experimental empregados (REITHINGER et al., 2002), além das alterações dos valores do ponto de corte (BRASIL, 2003). Contudo, os métodos sorológicos falham ao detectar cães infectados no período pré-patente, antes da soroconversão, aqueles que nunca se converteram e cães soropositivos que se converteram em soronegativos, mas permaneceram infectados (PINELLI et al., 1994). Estes exames podem ainda falhar ao apresentar reações cruzadas com outras doenças (VEXENATE et al., 1996). A RIFI, no Brasil, é o teste recomendado atualmente pelo Ministério da Saúde para o inquérito epidemiológico canino com o título do ponto de corte igual ou superior a 1:40 (BRASIL, 2003). O teste RIFI é ideal por ser de fácil execução, rápido, barato, além de apresentar boa sensibilidade que varia de 90 a 100% e especificidade de 80 a 100% (ALVES; BEVILACQUA, 2004). Já Mettler et al. (2005) em estudos com grupos de cães, observaram maior
30 29 sensibilidade da RIFI de 90,0% para os cães sintomáticos do que em cães assintomáticos 29,0%. Na técnica RIFI, a especificidade é prejudicada devido à ocorrência de reações cruzadas de Leishmania sp com Trypanosoma cruzi (ALVES; BEVILACQUA, 2004; FERREIRA et al., 2007; ZANETTE, 2006;), Toxoplasma gondii e Ehrlichia spp (FERREIRA et al., 2007; ZANETTE, 2006). Pode ocorrer também a reação cruzada de Leishmania sp com malária, esquistossomose e tuberculose pulmonar (SUNDAR; RAI, 2002) e ainda da espécie L. (L.) chagasi com Leishmania (Leishmania) brasiliensis e Leishmania (Leishmania) mexicana (COSTA et al., 1991). O teste ELISA indireto apresenta vantagens como a elevada sensibilidade, por permitir a detecção de baixos títulos de anticorpos, de fácil execução da leitura e rápido (GONTIJO; MELO, 2004). A sensibilidade do ELISA pode variar de 94,0% a 99,5% e a especificidade de 84,4% a 100% (ZANETTE, 2006). No entanto, a especificidade pode ser prejudicada devido à ocorrência de reações cruzadas com doenças causadas por outros tripanossomatídeos e microorganismos (ROSÁRIO et al., 2005). Existem trabalhos que apontam a ocorrência de reação cruzada entre Leishmania sp e T. cruzi (FERREIRA et al., 2007; ROSYPAL et al., 2007; SCALONE et al., 2002; ZANETTE, 2006), e ainda com L. (L.) brasiliensis e Ehrlichia canis (FERREIRA et al., 2007). Em avaliação de cães de área endêmica para LVC, Almeida et al. (2005) testaram o RIFI e o ELISA e observaram que um melhor diagnóstico seria obtido em cães sintomáticos e oligossintomáticos com o uso simultâneo de ambos os testes. Assim, Lira et al. (2006) observaram uma sensibilidade e uma especificidade de 72,0% e 87,5% para o ELISA e de 68,0% e 87,5% para a RIFI, respectivamente, além da alta sensibilidade (92,0%) e especificidade (75,0%) quando usados em paralelo, reduzindo assim o número de resultados falso-negativos, além de apresentarem uma ótima concordância. Reithinger et al. (2002) ao avaliarem o exame do ELISA indireto, observaram uma alta sensibilidade de 88,0% comparada à sensibilidade da
31 30 PCR (64,0%) em amostras de sangue de cães de área endêmica de Minas Gerais. Em estudos com grupos de cães, Barrouin-Melo et al. (2006) observaram que no grupo de cães sintomáticos em comparação ao grupo de assintomáticos o nível de anticorpos foi alto, tanto pela RIFI como pelo ELISA. A imunoistoquímica é uma técnica simples, não precisa de equipamentos especiais, é mais sensível e específica, em relação à técnica parasitológica direta, além de diminuir as reações cruzadas com outros tripanossomídeos, como o T. cruzi (BOURDOISEAU et al., 1997; FERRER et al., 1988; LIVNI et al., 1983). Além disso, a técnica de imunorreação tem mostrado ser um competente suplemento para confirmar os diagnósticos de Leishmania sp em tecidos caninos, quando a técnica histoquímica não permite a identificação de parasitas em tecidos como o linfonodo (BOURDOISEAU et al., 1997). Já em outros estudos com tecidos caninos Tafuri et al. (2001) observaram que a técnica de histoquímica com coloração por hematoxilina e eosina (HE) apresenta resultados inconclusivos, os quais não permitiram uma identificação clara do parasita. Assim, com o auxílio da imunoistoquímica, a visualização dos parasitas pode ser melhorada nos tecidos do baço, fígado e na pele dos cães, sendo que nesta última a positividade é aumentada em 50% quando comparada à histoquímica (TAFURI et al., 2004). O cinetoplasto é uma organela presente nos kinetoplastidas, os quais possuem cerca de minicírculos de DNA (kdna), com 600 a 800 pb nos membros do gênero Leishmania spp. (RODRIGUEZ et al., 2002). Rodgers et al. (1990) adotando primers iniciadores de reação sugeriram ser possível a amplificação in vitro do fragmento da região conservada do kdna a partir de um único parasito presente na amostra, sendo a amplificação da região conservada 10 vezes mais sensível do que a região variável. Desta forma, o diagnóstico molecular é baseado na amplificação feita por primers anelados na região alvo do kdna de cepas de Leishmania spp. por Reação em Cadeia pela Polimerase (PCR), a qual tem sido muito utilizada para efeito de
32 31 diagnóstico da LVC (FISA et al., 2001; GOMES et al., 2007; IKONOMOPOULOS et al., 2003; LACHAUD et al., 2002; MANNA et al., 2004; NUNES et al., 2007; OLIVEIRA et al., 2005; QUINNEL et al., 2001; REALE et al., 1999; RODGERS et al., 1990; SOLANO-GALLEGO et al., 2001a; XAVIER et al., 2006). As amostras clínicas freqüentemente selecionadas para a detecção de DNA de Leishmania spp. pela PCR podem ser os aspirados ou as biópsias de linfonodo, baço, medula óssea, e fígado. Já as amostras de sangue, pele e conjuntiva podem favorecer a uma colheita menos invasiva e apresentar melhores resultados para o teste (IKONOMOPOULOS et al., 2003; LACHAUD et al., 2002; MANNA et al., 2004; STRAUSS-AYALI et al., 2004). Este método constitui-se em uma nova perspectiva para o diagnóstico da LV, pois apresenta 94,0% de sensibilidade, a qual é influenciada pela área endêmica, o tipo de amostra, o alvo do DNA utilizado para amplificação, o método de extração do DNA, entre outros (BRASIL, 2003). Assim a técnica da PCR pode ser utilizada no diagnóstico diferencial das Leishmanioses e ainda contribuir com os programas de vigilância e controle da doença (GOMES et al., 2007). Além disso, pode auxiliar no diagnóstico diferencial de Leishmania spp. em cães assintomáticos (NUNES et al., 2007). Embora a aplicação da técnica PCR seja de alto custo, tem mostrado resolver os problemas de diagnóstico devido à baixa sensibilidade dos exames microscópicos ou para prever os valores da sorologia, devido à persistência de anticorpos falso-positivos ou falso-negativos e por apresentar alta concordância com o teste RIFI (IKONOMOPOULOS et al., 2003). Interessados em analisar o desempenho do diagnóstico por PCR de acordo com os sinais clínicos de cães utilizando amostras de sangue e medula óssea, Quinnel et al. (2001) observaram que a sensibilidade da PCR variou (78,0 a 88,0%) na evolução da doença e de indivíduo para indivíduo. Sendo que, o teste parasitológico e a PCR foram mais sensíveis no início da doença e em cães assintomáticos enquanto o exame parasitológico e sorológico ELISA
33 32 foram mais sensíveis em cães sintomáticos, sendo que a sensibilidade do ELISA variou de 93,0 a 100%. Analisando os tecidos pela histoquímica e imunoistoquímica Moreira et al. (2007) observaram maior número de amastigotas de Leishmania sp nos tecidos dos linfonodos do que no baço e fígado, e ainda uma baixa sensibilidade destas técnicas nos grupos de cães. No entanto, quando a PCR foi realizada nestes tecidos, a sensibilidade foi de 100% no grupo de cães sintomáticos, 96,0% em cães oligossintomáticos e 95,6% nos cães assintomáticos e 100% de especificidade em todos os grupos, sugerindo ser a PCR um eficiente método para o diagnóstico da LVC. Utilizando a técnica da PCR para o diagnóstico da LVC em sangue de cães, Nunes et al. (2007) revelaram que esta técnica apresentou uma sensibilidade de 55,0% e uma especificidade de 66,3%, em relação à reação de imunofluorescência indireta (RIFI). Em outros estudos, o mesmo foi observado ao analisarem a positividade da LVC em cães de área endêmica da Grécia, em que a positividade foi maior pela PCR (63,0%) do que pela RIFI (12,3%) (LEONTIDES et al., 2002). Ao estudarem tecidos de cães pela PCR, Manna et al. (2004) observaram alta positividade em amostras de aspirados de linfonodos (99%), pele (95,0%) além do sangue (94,0%), o que aumentou a positividade da PCR para 100% comparada à RIFI (85,0%). Além disso, consideraram a pele a melhor amostra para a realização da PCR por ser de colheita fácil, menos invasiva e por conter mais parasitos do que no sangue, o qual possui a tendência a um decréscimo da carga parasitária no decorrer do curso da infecção. Já Solano-Gallego et al. (2001a) utilizando a pele e outros tecidos de cães revelaram menor positividade pela PCR na pele (51,0%) e em outras amostras como a conjuntiva (32,0%) e medula óssea (17,8%) de cães. Nunes (2007) realizando o monitoramento de cães para LVC observou que a maior positividade foi para a PCR (78,1%), seguido do ELISA com 42,2% e exame parasitológico com baixa positividade (33,9%), não descartando ainda a hipótese de contaminação ou de DNA residual de Leishmania spp. em macrófagos.
34 33 Baseado nas informações da literatura, evidenciando a dificuldade no diagnóstico da LVC, que muitas vezes é inconclusivo, pela presença de cães com diferentes manifestações clínicas e grau de imunidade, formulou-se a hipótese de que as técnicas de imunoistoquímica e PCR, realizadas em amostras de tecido esplênico, hepático e de linfonodo e da PCR no sangue, poderiam ser boas alternativas para complementar, confirmar e concluir o diagnóstico da LVC, quando associadas aos exames parasitológicos diretos e sorológicos (ELISA e RIFI).
35 34 2 OBJETIVOS 2. 1 Objetivo Geral Objetivou-se a utilização da PCR e da imunoistoquímica em amostras de tecido esplênico, hepático e de linfonodo e da PCR em sangue de cães assintomáticos, oligossintomáticos e polissintomáticos para LVC, provenientes do município de Ilha Solteira-SP, com a finalidade de elucidar casos inconclusivos pelas outras técnicas diagnósticas rotineiramente utilizadas, como as sorológicas e as parasitológicas Objetivos Específicos Realizar exames sorológicos (ELISA e RIFI) para a LVC em todos os cães Realizar exames parasitológicos pela identificação direta de formas amastigotas de Leishmania sp pela coloração histoquímica (HE) e imunoistoquímica (IMIQ) em tecido esplênico, hepático e do linfonodo Realizar a PCR com amostras teciduais do baço, linfonodo e fígado de animais que foram classificados em suspeitos e negativos (diagnóstico inconclusivo) pelas provas sorológicas e pela histoquímica Realizar a PCR com amostras de sangue dos 34 cães para confirmar o diagnosticado positivo pelos testes sorológicos e parasitológicos (HE e IMIQ) Realizar a análise comparativa entre todos os testes.
36 35 3 MATERIAL E MÉTODO 3. 1 Local Os cães do presente trabalho pertenciam ao município de Ilha Solteira localizado na região noroeste do Estado de São Paulo, a uma latitude 20º25'58" Sul e a uma longitude 51º20'33" Oeste. Possui uma área de 659,4 km², com uma população humana estimada em habitantes (IBGE, 2007) e a de cães de (segundo o veterinário responsável pelo Centro de Controle de Zoonoses (CCZ) em comunicação pessoal). Os exames das amostras biológicas coletadas dos cães foram realizados em três diferentes locais: no Laboratório de Parasitologia/Imunologia do Departamento de Biologia e Zootecnia da Faculdade de Engenharia de Ilha Solteira - Universidade Estadual Paulista (FEIS-UNESP), as técnicas de histoquímica e imunoistoquímica, no Laboratório de Imunoparasitologia da Faculdade de Ciências Agrárias e Veterinárias Universidade Estadual Paulista (FCAV-UNESP) Campus de Jaboticabal, as técnicas de RIFI e ELISA indireto e no Laboratório de Bioquímica e Biologia Molecular da Faculdade de Odontologia de Araçatuba Universidade Estadual Paulista (FOA-UNESP), realizou-se a PCR Animais Os 34 cães entregues ao CCZ eram de várias idades, raças e sexo indefinidos e positivos para Leishmaniose Visceral Canina pela RIFI (kit Bio
37 36 Manguinhos, título 1:20). Os cães foram sacrificados e as amostras foram colhidas no período de agosto a novembro de Estes cães foram submetidos à eutanásia pelo CCZ, em cumprimento ao Decreto no do Ministério da Saúde do Brasil, de 14 de março de 1963, o qual estabelece que animais domésticos portadores de leishmaniose devem ser submetidos à eutanásia. Para este procedimento os cães foram anestesiados com pentobarbital sódico (15 mg/kg/iv) e ainda em plano anestésico, aplicou-se uma ampola de cloreto de potássio a 19,1% (Samtec Biotecnologia), por via intravenosa, seguindo as recomendações da Resolução nº. 714, de 20 de junho de 2002, do Conselho Federal de Medicina Veterinária, que dispõe sobre procedimentos e métodos de eutanásia de animais Sinais Clínicos e Anatomopatológicos dos Cães Antes da eutanásia, os animais foram examinados quanto aos sinais clínicos ou exames físicos (anatomopatológicos) no momento da necropsia e assim separados em três grupos: assintomáticos (A), cães sem alterações aos exames (n = 8); oligossintomáticos (O), cães que possuíam até três sinais clínicos, ou comprometimento de até três órgãos (n = 14) e polissintomáticos (P), cães com mais de três sinais clínicos ou com mais de três órgãos acometidos, independente da gravidade ou dos órgãos acometidos (n = 12) Colheita de Amostras Sangue Antes da eutanásia, foram colhidas duas amostras de sangue por venopunção da veia cefálica, sendo que uma foi colhida com EDTA (sangue total) e armazenada a -70ºC para a realização da PCR, e a outra foi colhida sem EDTA, para obtenção de soro e realização dos exames sorológicos.
38 Tecidos Reação em Cadeia pela Polimerase (PCR) Após a eutanásia, parte das amostras de fragmentos de baço, fígado e linfonodos (poplíteo, submandibular ou pré-escapular) foram colhidas e armazenadas em sacos plásticos, mergulhadas em nitrogênio líquido e armazenada em freezer a -70ºC, até a extração do DNA Histologia A outra parte dos tecidos foi fixada em solução tamponada de formol a 10% ou em solução de Bouin, por 12 horas. Os tecidos presentes nas soluções fixadoras foram em seguida lavados três vezes em álcool 70% e armazenados neste álcool até o uso. Para a confecção das amostras estes fragmentos foram emblocados em parafina e submetidos a cortes de 5 µm em micrótomo para a confecção das lâminas histológicas Exames Sorológicos Ensaio Imunoenzimático (ELISA) O teste ELISA indireto foi realizado de acordo com a técnica descrita por Machado et al. (1997) e adaptado por Oliveira et al.(2008) para L. (L.) chagasi Descrição da Técnica O antígeno solúvel bruto de L. (L.) chagasi foi obtido após ciclos de congelamento e descongelamento das formas promastigotas. As amastigotas foram colhidas por punção de medula óssea de cão sintomático para LVC e
39 38 mantidas em meio de cultura RPMI até o desenvolvimento para a forma promastigota. Em cada cavidade das microplacas de fundo plano (Nunclon TM Surface, Nunc. Denmark) ELISA foram adicionados 100µL do antígeno solúvel de L. (L.) chagasi (na concentração 5µg/ml, diluído em tampão carbonato-bicarbonato de sódio 0,05M, ph 9,6). Após a incubação da placa por 8 a 10 horas em câmara úmida a 4 º C, o excesso de antígeno foi removido por três lavagens consecutivas com tampão PBS 0,01M, ph 7,4, contendo 0,05% de Tween 20 (PBS-Tween 20). As placas foram previamente bloqueadas com PBS-Tween 20 acrescido de 6% de leite em pó, em câmara úmida, a 37 º C por 90 minutos. Após nova lavagem para retirada do bloqueador, foram adicionados, em duplicata, 100µL dos soros testes e dos soros de referência positivos e negativos nas suas diluições de 1:100 em PBS-Tween 20, com 5% de leite em pó desnatado. As placas foram então novamente incubadas e lavadas. Em seguida, 100 µl do conjugado anti-cão (IgG de coelho anti IgG de cão, acoplada à fosfatase alcalina, SIGMA A-0793) foi diluído 1: em tampão PBS-Tween 20, contendo 5% de soro de coelho, foi adicionado a cada cavidade da placa, seguindo-se nova incubação e lavagem como as anteriores. O substrato da enzima fosfatase alcalina (paranitrofenilfosfato diluído a 1mg/mL em tampão dietanolamina ph 9,8; SIGMA N-9389) foi adicionado, incubando-se a reação por 45 minutos à temperatura ambiente. Decorrido esse período, a leitura da reação foi realizada em um leitor de microplacas de ELISA (Microplate Reader MRX TC Plus, Dynex Technology), a um comprimento de onda de 405 nm Tratamento dos Dados Os valores de Densidade Óptica média (D.O.) dos soros foram agrupados em níveis de ELISA (NE), os quais variaram de 0 (zero) a 9 (nove) (Anexo 1). O ponto de corte foi para o NE 3.
40 39 O limite máximo do nível zero foi determinado pela média das D.O. de animais negativos para L. (L.) chagasi, acrescido de dois desvios padrão. A partir desse limite, os intervalos entre os outros níveis de ELISA foram definidos por acréscimo de 35,0%, e o ponto de corte do teste de ELISA correspondeu a duas vezes e meia o valor médio das D.O. dos soros de referência negativos, conforme preconizado por Machado et al. (1997). A atividade imunológica de cada soro testado foi calculada mediante a determinação do valor A/P (amostra em relação ao positivo), considerando-se os soros de referência negativos e positivos de acordo com a seguinte equação: Absorbância média - Absorbância média do da amostra soro de referência negativo A/P = Absorbância média do - Absorbância média do soro de referência positivo soro de referência negativo Reação de Imunofluorescência Indireta (RIFI) A RIFI foi realizada conforme a técnica utilizada pelo Centro de Pesquisas René Rachou/FIOCRUZ, de Belo Horizonte-MG, para o diagnóstico de animais infectados por L. (L.) chagasi, adaptada por Oliveira et al. (2008) Descrição da RIFI As lâminas contendo o antígeno (promastigotas de L. (L.) chagasi) foram retiradas do freezer e descongeladas à temperatura ambiente. Em cada círculo contendo o antígeno, foram dispensados 10µL de cada soro teste diluído na concentração de 1:40. As lâminas foram então incubadas, em câmara úmida a 37 o C, por 30 minutos e, a seguir, submetidas a três lavagens
41 40 em PBS por imersão, de cinco minutos cada. Após secagem à temperatura ambiente, os círculos das lâminas foram recobertos com 10µL do anticorpo anti-igg de cão conjugado ao isotiocianato de fluoresceína (KPL cat n o ), diluído a 1:30, em solução de PBS, contendo azul de Evans 1mg%. As lâminas foram novamente incubadas e lavadas conforme descrito acima. Após a secagem das lâminas, estas foram montadas com lamínula, utilizando-se glicerina tamponada a uma relação de 9:1 de glicerina/tampão carbonatobicarbonato 0,5M ph 9,6 e, posteriormente, observadas em microscópio para fluorescência (Olympus, BX-FLA). Após a leitura em microscópio para fluorescência, foram consideradas positivas as reações fluorescentes em soros com diluição > 1: Exames Parasitológicos Histoquímica (HE) Após a confecção dos tecidos em lâminas pela técnica histológica padrão, foi realizado a coloração por hematoxilina e eosina (HE) e a avaliação do grau parasitário dos tecidos. Os tecidos foram avaliados conforme a visualização de formas amastigotas de Leishmania sp da seguinte forma: tecido negativo (-), sem amastigotas; tecido suspeito (+), quando a coloração não permitiu visualizar claramente os parasitas no tecido; tecidos positivos, quando os parasitas foram visualizados dentro ou fora de macrófagos, sendo considerado: tecido fraco positivo (++), quando os parasitas estavam distribuídos esparsamente no tecido; tecido moderado positivo (+++), quando os parasitas estavam presentes em torno de 50% do tecido e tecido forte positivo (++++), quando os parasitas estavam presentes em > 50% do tecido. Os animais só foram considerados negativos ou suspeitos após a análise de no mínimo cinco cortes teciduais.
42 Imunoistoquímica (IMIQ) Na coloração das formas amastigotas de Leishmania sp presentes nos tecidos do baço, linfonodo e fígado foram adotados os procedimentos, segundo Tafuri et al. (2004), com algumas modificações. O anticorpo primário foi o soro hiperimune de cães naturalmente e comprovadamente infectados com L. (L.) chagasi (RIFI com título = 1: 2560) e como anticorpo secundário anti-igg biotinilado de coelho produzida em cabra. O procedimento para o método imunoistoquímico foi da seguinte maneira: as secções teciduais foram previamente hidratadas em passagens sucessivas em xilol e álcool etílico. Antes de adicionar o anticorpo primário, a enzima peroxidase endógena foi bloqueada usando-se a solução de peróxido de hidrogênio (H 2 O 2 ) a 0,3% diluído em 0,01M de solução salina fosfatada tamponada (PBS) e as reações inespecíficas do anticorpo secundário foram inibidas usando-se o soro normal de coelho na diluição 1/50. O anticorpo primário foi incubado sobre o tecido a ser analisado em uma câmara úmida a 4 º C por aproximadamente 12 horas. Após os enxágües em PBS, o anticorpo secundário foi usado na diluição 1:500 e incubado por 30 minutos à temperatura ambiente. Como modificação da técnica de Tafuri et al. (2004), utilizou-se o seguinte procedimento. O anticorpo secundário foi o anti-igg de coelho produzido em cabra conjugado à biotina e o complexo Avidin-Biotin Peroxidase (Vectstain ABC Kit; Vector Laboratories Inc, Burlingame, CA, USA) foi usado para detecção da reação imunológica. Após os devidos enxágües em PBS, as lâminas foram imersas por 7-15 minutos em uma solução preparada a fresco de substrato cromógeno específico para peroxidase (Substrato New Red - Vector Laboratories). Após outro enxágüe, mas em água destilada, os tecidos foram corados pela hematoxilina de Mayer, desidratados e montados em bálsamo do Canadá entre lâmina e lamínula. O controle negativo consistiu deste procedimento, mas sem o anticorpo primário ou o secundário. Duas lâminas para cada grupo de animal foram analisadas imunoistoquimicamente. Os soros e os tecidos de cães sadios também foram testados como controle
43 42 negativo da reação. Os parasitas quando presentes nos tecidos coraram-se na cor vermelho tijolo Reação em Cadeia pela Polimerase (PCR) Extração de DNA de Amostras de Sangue A extração do DNA de amostras de sangue de cães foi realizada segundo o protocolo de extração utilizado pelo laboratório de Bioquímica e Biologia Molecular UNESP Campus de Araçatuba. Na extração, 700µL de sangue foi congelado a -20ºC. Após o descongelamento, foram adicionados 800µL de tampão SSC (3M NaCl, 0,3 citrato de sódio, ph = 7,0) e centrifugado por dois minutos a 8000g. O sobrenadante foi descartado, no material resultante foi adicionado 1mL de tampão SSC, seguido de agitação, centrifugação por dois minutos a 8000g e descarte do sobrenadante. No sedimento, foi adicionada uma solução de lise contendo 375µL de acetato de sódio (0,2M), 25µL de duodecil sulfato de sódio - SDS (10%) e 5µL de proteinase K (0,2 mg/ml em água). Após vigorosa agitação a mistura foi incubada a 56ºC por duas horas. Posteriormente foi adicionado 400µL da solução de fenol/clorofórmio/álcool isoamílico (25:24:1), agitado vigorosamente por 30 segundos e, em seguida, centrifugando-se por três minutos, com remoção cuidadosa do sobrenadante e transferência para outro tubo de 1,5mL. À camada aquosa obtida no passo anterior adicionou-se 1,0mL de álcool etílico absoluto gelado, misturando as fases por inversão e em seguida incubando a amostra a -20ºC durante 30 minutos. Após a incubação, centrifugou-se por dois minutos e removeu-se o líquido sobrenadante por decantação. No sedimento, foram adicionados 180 µl de tampão TE (10mM Tris-base, 1 mm EDTA, ph 7,5) agitando-se vigorosamente e levado ao banho Maria a 56ºC por 10 minutos. Após esse
44 43 período, adicionaram-se 20µL de acetato de sódio 2M, com agitação vigorosa por 5 segundos. Logo, foram adicionados 500 µl de álcool etílico absoluto gelado e misturado gentilmente até atingir uma solução homogênea, centrifugou-se por dois minutos e removeu-se o líquido sobrenadante por decantação. Ao sedimento adicionou-se 1mL de álcool etílico absoluto 70% à temperatura ambiente, e centrifugou-se por um minuto removendo-se, logo após, o líquido sobrenadante por decantação. Em seguida, o material obtido foi submetido à centrífuga a vácuo por 10 minutos a 30ºC. Logo após a secagem, o sedimento resultante foi ressuspendido em 100µL de TE. O DNA extraído foi homogeneizado e conservado a -20ºC Extração de DNA de Amostras de Baço, Linfonodo e Fígado Na extração do DNA de tecido do baço, linfonodo e fígado de cães foi usado o protocolo utilizado pelo fabricante do Kit QIAamp DNA Mini Kit (S QIAGEN, USA). As amostras foram previamente conservadas à -80ºC. A extração seguiu diferentes processos: fragmentos de 30mg (linfonodo e fígado) ou 10mg (baço) sofreram lavagem rápida com tampão fosfato-salina (PBS) sendo depositados em tubos de 1,5mL. Os tecidos foram macerados com o auxílio de pistilo de plástico, foram adicionados 180µL de Buffer ATL e 20µg/mL de Proteinase K, sendo as misturas intensamente homogeneizadas (Vortex ) e incubadas a 56ºC por três horas e agitadas a intervalos de 15 minutos ou over night. Após a incubação, as amostras foram homogeneizadas por 15 segundos e adicionou-se 200µL de Buffer AL seguindo-se de nova agitação e incubação a 70ºC por 10 minutos. Após este procedimento, adicionou-se 200µL de álcool etílico absoluto gelado, seguida de nova agitação por 15 segundos e deposição da mistura no centro da coluna de cromatografia contida no kit, que foi centrifugada por 6.000g por dois minutos. O tubo contendo o líquido eluído foi descartado, sendo substituído por outro igual. Foram adicionados 500µL de Buffer AW1 à coluna de cromatografia, que foi submetida à centrifugação a
45 g por dois minutos. O mesmo procedimento de descarte e substituição foi realizado e, após a adição de 500µL de Buffer AW2 foi realizada a centrifugação da coluna contendo a amostra a g por três minutos, o descarte do líquido e nova centrifugação por mais um minuto. A coluna, contendo o DNA aderido, foi introduzida em um tubo de 1,5mL, onde foram adicionados 50µL de Tampão AE e em seguida incubada a temperatura ambiente por cinco minutos, com subseqüente centrifugação, a 6000g por dois minutos. Este procedimento foi realizado novamente sendo o DNA eluído da coluna em volume final de 100µL Concentração e Pureza do DNA A concentração de DNA extraído foi avaliada por espectrofotômetro, para a referência foi determinada na D.O. de 260 nm, e/ou por eletroforese em gel de agarose, enquanto a pureza do DNA foi determinada pela razão de D.O. de 260 a 280 nm Amplificação do DNA Na reação utilizou-se o par de oligonucleotídeos para o gênero Leishmania descrito por Rodgers et al. (1990): 13A 5 -dgtg GGG GAG GGG CGT TCT-3 e 13B 5 -datt TTA CAC CAA CCC CCA GTT-3 como iniciadores para a amplificação de fragmentos de DNA de 120 pares de base (pb) conservados do minicírculo do cinetoplasto. As reações foram constituídas de 1 U de DNA polimerase Platinum Taq (Invitrogen-Carlsbad-Califórnia), 15,25µL de água ultra pura, tampão de PCR 1X, 1,5mM de MgCl2, 0,31mM de cada dntp (datp, dctp, dgtp e dttp), 0,26µM de Primer Foward, 0,26µM Primer Reverse e 2,5 µl de DNA extraído da amostra, sendo que a quantidade de DNA variou de 50ng a 300ng nas reações, num volume final de 25µL. Os DNAs das amostras foram submetidos a ciclos de temperaturas pelo aparelho termociclador (MJ Research Thermal Cycler GMI, Inc. Ramsey-
46 45 Minnesota) com desnaturação inicial a 95 C por 5 minutos e 35 ciclos de 95 C por 30 segundos para desnaturação, 63 C por 45 segu ndos para associação, 72 C por 30 segundos para extensão e 5 minutos por 72 C para extensão final. Os controles positivos foram DNA de Leishmania spp extraído do sangue segundo Nunes et al. (2007), de tecidos do baço, linfonodo e fígado de cães naturalmente infectados por Leishmania spp e os controles negativos foram DNA extraído de sangue, baço, linfonodo e fígado de cãos sadios de área não endêmica para leishmaniose visceral. Cada controle foi utilizado nas reações para cada tipo de tecido e uma mistura de 22,5µL de reagentes, sem DNA, foi utilizada para o controle de reação Amplificação de DNA de Cão Para a amplificação de fragmento de DNA de cão foram utilizados os mesmos reagentes para a amplificação do DNA de Leishmania spp. Na reação foi utilizado um par de oligonucleotídeos com a seguinte sequência: 1AS 5 dtgcaatgaaacactgggacacc 3 2S 5 daccctccagttccatccctgtt 3 (NUNES, 2007) para a amplificação de um fragmento de 202 pb do DNA ribossomal de cão. O objetivo deste procedimento foi para a avaliação da integridade do DNA extraído das amostras dos tecidos do baço, linfonodo e fígado Eletroforese em Gel de Poliacrilamida a 8% Para averiguar os resultados das reações 8µL dos produtos amplificados foram submetidos à eletroforese em gel de poliacrilamida a 8%, por 3 horas e meia, a 100 V, em tampão TBE (89 mm Tris borato, 2 mm EDTA, ph 8,3). Como controle foi adicionado também o peso molecular de 100pb em cada gel. Após a corrida o gel foi corado com nitrato de prata e fotografado com câmera digital (Cyber-shot de 7.2 Mega pixels, modelo DSC-W70 SONY).
47 Interpretação dos Resultados Diagnósticos. Após a realização dos exames sorológicos (RIFI e ELISA) e parasitológicos (HE e IMIQ) os cães foram classificados de acordo com os resultados obtidos, da seguinte forma: cães positivos, quando todos os resultados dos exames foram positivos; cães suspeitos, quando ambos os resultados dos exames sorológicos foram negativos e com tecidos suspeitos e/ou negativos ou até mesmo quando apenas um dos exames sorológicos foi negativo e com tecidos suspeitos e/ou negativos; cães negativos, quando todos os resultados dos exames foram negativos Análise Estatística As análises comparativas dos exames diagnósticos foram realizadas pelo Índice Kappa de concordância, para o intervalo de confiança de 95,0%, do programa BioEstat (versão 4.0) (AYRES et al., 2005).
48 47 4 RESULTADO 4. 1 Sinais Clínicos e Anatomopatológicos De acordo com os sinais clínicos e anatomopatológicos os cães foram subdivididos em três grupos: cães assintomáticos (n=8), oligossintomáticos (n=14) e polissintomáticos (n=12). Desta forma, no grupo dos assintomáticos os cães apresentaram aparência saudável. Os cães oligossintomáticos apresentaram até três sinais clínicos ou comprometimento de até três órgãos, sendo que os sinais clínicos com maior porcentagem foram os seguintes: alterações gerais de pele 10/14 (71,0%), mucosas pálidas 5/14 (36,0%) e emagrecimento 2/14 (14,0%). A Figura 1 mostra a relação da porcentagem de lesões observadas em cães oligossintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP. Já os cães polissintomáticos apresentaram-se com o estado clínico bastante comprometido, com alterações gerais de pele em 12/12 (100%), esplenomegalia em 10/12 (83,0%), fígado ictérico em 9/12 (75,0%), emagrecimento em 7/12 (58,0%), linfonodos hipertróficos e onicogrifose em 6/12 (50,0%) e ainda alterações oculares e mucosas pálidas em 4/12 (33,0%). Os sinais clínicos observados nos cães polissintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP estão ilustrados na Figura 2 e Anexo 3.
49 48 FIGURA 1 - Sinais clínicos e anatomopatológicos em cães oligossintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP. FIGURA 2 - Sinais clínicos e anatomopatológicos em cães polissintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP.
50 Exames Sorológicos (ELISA e RIFI) e Parasitológicos (HE e IMIQ) Cães Assintomáticos (A) Os dados comparativos dos resultados dos exames sorológicos e parasitológicos realizados com os tecidos do baço, linfonodo e fígado dos cães considerados assintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP encontram-se na Tabela 1. Neste grupo, apenas um cão foi positivo em todos os exames, o cão 19, pois embora assintomático este animal apresentou altos títulos de anticorpos anti-l. (L.) chagasi pelo ELISA e RIFI (Anexo 2), e grau parasitário, variando de moderado a intenso positivo nos tecidos do baço e fígado, respectivamente. Sendo assim, neste grupo apenas 1/8 (12,5%) dos cães foi positivo. Já os cães 02, 04, 13 e 18, foram classificados como suspeitos no estudo. No entanto, dentre estes cães, o cão 04 foi positivo pela imunorreação no linfonodo e o cão 13 fraco positivo no fígado pela HE, mas permaneceram na classificação de cães suspeitos por apresentarem resultados negativos em ambos os exames sorológicos e com suspeitas de parasitas nos demais tecidos pela HE. Já o cão 02 também foi suspeito por ser negativo pela HE no tecido do linfonodo e pela não realização da IMIQ nos tecidos do baço e linfonodo. Os cães classificados como negativos foram os cães 01, 20 e 22, pois apresentaram resultados negativos em todos os exames realizados. Sendo assim, a porcentagem de cães assintomáticos negativos foi de apenas 3/8 (37,5%).
51 50 Tabela 1 - Resultados do diagnóstico de Leishmaniose Visceral Canina por exames sorológicos ELISA e RIFI, histoquímico (HE) e imunoistoquímico (IMIQ) nos tecidos do baço, linfonodo e fígado de cães assintomáticos (A) naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP (Araçatuba - SP, 2008). Resultados dos Exames Tecidos Cães (A) ELISA RIFI Baço Linfonodo Fígado HE IMIQ HE IMIQ HE IMIQ 01 N N - N - N - N 02 N N + NR - NR + N 04 N N + N + P + N 13 N N + N + N ++ N 18 N N + N + N + N 19 P P ++++ P + P +++ P 20 N N - N - N - N 22 N N - N - N - N P: Positivo; N: Negativo; NR: Não Realizado; - : tecido negativo; +: tecido suspeito; ++: tecido fraco positivo; +++: tecido moderado positivo; ++++: tecido forte positivo Cães Oligossintomáticos (O) Os dados comparativos dos resultados dos exames sorológicos e parasitológicos realizados com os tecidos do baço, linfonodo e fígado de cães considerados oligossintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP encontram-se na Tabela 2. Neste grupo, pelos exames sorológicos 7/14 (50,0%) dos cães foram positivos em ambos os exames (ELISA e RIFI), mas em quatro cães houve discordância entre os exames, ou seja, um cão foi positivo pela RIFI e negativo pelo ELISA e três cães foram positivos pelo ELISA e negativos pela RIFI. Estes três cães negativos somente na RIFI apresentaram os tecidos do baço, linfonodo e fígado negativos pela IMIQ e/ou suspeitos pela HE. Analisando-se todos os dados da Tabela 2 observou-se que a positividade dos cães neste grupo foi de 8/14 (57,0%), mesmo com
52 51 discordância de resultados entre os exames sorológicos no cão 33 e variação da intensidade parasitária de órgão para órgão em cada animal do grupo. O destaque dentre os animais positivos foram os cães 07, 08, 12, 33 e 34 pela intensa carga parasitária nos tecidos, sendo o cão 12 o que apresentou maior carga parasitária, por apresentar-se forte positivo no baço e linfonodo, moderado positivo no fígado, e positivo nos tecidos pela IMIQ, e ainda nos exames sorológicos foram observados altos títulos de anticorpos (Anexo 2). Comparando os resultados dos exames HE e IMIQ, observou-se que o baço e o linfonodo, foram os órgãos mais fáceis de visualizar as formas amastigotas de Leishmania sp, e em função disso, uma maior intensidade parasitária foi observada nestes órgãos. Já nos tecidos hepáticos de alguns cães houve maior dificuldade na identificação dos parasitas, sendo assim alguns tecidos foram negativos, suspeitos ou fraco positivos. Pela imunorreação, observou-se um maior contraste na coloração dos parasitos em vermelho tijolo nos tecidos comparado aos tecidos corados pela HE, o que facilitou a visualização dos parasitas nos tecidos, inclusive no fígado. Desta forma o exame IMIQ pôde comprovar a positividade do teste HE e ainda verificar que os tecidos negativos e suspeitos pelo HE eram positivos no teste IMIQ. Dentre os animais deste grupo 4/14 (28,5%) dos cães foram classificados como suspeitos (cães 06, 09, 14 e 21), pois além de ter ocorrido discordância entre os exames sorológicos, apresentaram tecidos (+) e (-) pela HE e foram negativos pela IMIQ. Além disso, apenas 2/14 (14,3%) cães foram considerados negativos em todas as provas sorológicas e parasitológicas realizadas (cães 11 e 23) (Tabela 2).
53 52 Tabela 2 - Resultados do diagnóstico de Leishmaniose Visceral Canina por exames sorológicos ELISA e RIFI, histoquímicos (HE) e imunoistoquímicos (IMIQ) nos tecidos do baço, linfonodo e fígado de cães oligossintomáticos (O) naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP. (Araçatuba - SP, 2008) Resultados dos Exames Tecidos Cães (O) ELISA RIFI Baço Linfonodo Fígado HE IMIQ HE IMIQ HE IMIQ 03 P P NR NR +++ P + P 06 P N + N + N - N 07 P P ++ P ++ P ++ P 08 P P ++ P ++ NR + P 09 P N + N + N - N 10 P P - P + N - P 11 N N - N - N - N 12 P P ++++ P ++++ P +++ P 14 N N + N + N + N 15 P P ++ P ++ P + P 21 P N + N + N - N 23 N N - N - N - N 33 N P ++++ P + N + P 34 P P +++ N +++ P + N P: Positivo; N: Negativo; NR: Não Realizado; -: tecido negativo; +: tecido suspeito; ++: tecido fraco positivo; +++: tecido moderado positivo; ++++: tecido forte positivo Cães Polissintomáticos (P) Os dados comparativos dos resultados dos exames sorológicos e parasitológicos realizados com os tecidos do baço, linfonodo e fígado de cães considerados polissintomáticos naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP encontram-se na Tabela 3. A positividade neste grupo foi de 11/12 (92,0%) dos cães. Na maioria dos animais, observou-se predomínio de moderado a intenso parasitismo nos
54 53 tecidos hepáticos, esplênicos e nos linfonodos, mesmo havendo discordância entre a RIFI e ELISA, particularmente nos cães 05 e 31 (Tabela 3). Neste grupo, o animal em destaque foi o cão 28, com vários sinais clínicos característicos para LVC, mas negativo nos exames sorológicos, com os tecidos do baço, linfonodo e fígado com uma cruz pela HE e negativos pela IMIQ, sendo assim o único cão classificado como suspeito. Dentre os tecidos analisados, o baço e o linfonodo foram os mais parasitados, que variaram de fraco a forte positivo pela HE na maioria dos cães e positivos pela IMIQ. No fígado de alguns animais positivos, o grau parasitário foi de tecidos com uma cruz e suspeito pela HE, embora positivos pela IMIQ. No entanto, em outros animais, como os cães 26, 27 e 31, o grau parasitário no fígado foi tão alto quanto o observado no baço e no linfonodo da maioria dos cães polissintomáticos (Tabela 3). Nas Figuras de 3 a 5, podem ser visualizadas as formas amastigotas de L. (L.) chagasi coradas pela HE em amostras de tecidos esplênicos (Figura 3), de linfonodos (Figura 4) e hepáticos (Figura 5) de cães polissintomáticos para LVC do município de Ilha Solteira - SP. Já nas Figuras de 6 a 8, encontram-se as ilustrações também de tecidos de cães polissintomáticos, mostrando a maior intensidade e contraste de coloração pela técnica da IMIQ das formas amastigotas de L. (L.) chagasi nos tecidos dos cães. Os parasitas intactos estão corados em vermelho tijolo em função do cromógeno utilizado. As Figuras 6, 7 e 8 mostram, respectivamente, os tecidos do baço, linfonodo e fígado.
55 54 Tabela 3 - Resultados do diagnóstico de Leishmaniose Visceral Canina por exames sorológicos ELISA e RIFI, histoquímicos (HE) e imunoistoquímicos (IMIQ) nos tecidos do baço, linfonodo e fígado de cães polissintomáticos (P) naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP. (Araçatuba - SP, 2008) Resultados dos Exames Tecidos Cães (P) ELISA RIFI Baço Linfonodo Fígado HE IMIQ HE IMIQ HE IMIQ 05 N P +++ P ++ P ++ P 16 P P + P +++ P - P 17 P P + N + N +++ P 24 P P ++ P ++ N + P 25 P P ++++ P +++ P ++ P 26 P P ++ P ++ P ++++ P 27 P P ++++ P ++++ P ++++ P 28 N N + N + N + N 29 P P ++ P +++ P + P 30 P P ++++ P ++++ P - P 31 P N +++ P ++++ P +++ P 32 P P ++++ P ++++ P + P P: Positivo; N: Negativo; NR: Não Realizado; -: tecido negativo; +: tecido suspeito; ++: tecido fraco positivo; +++: tecido moderado positivo; ++++: tecido forte positivo
56 55 10µm FIGURA 3 - Corte histológico de baço de cão polissintomático para LVC, ilustrando macrófagos infectados com amastigotas de L. (L.) chagasi em cão do município de Ilha Solteira - SP. (HE, Obj. 100X). 10µm FIGURA 4 - Corte histológico de linfonodo de cão polissintomático para LVC, ilustrando macrófagos infectados com amastigotas de L. (L.) chagasi em cão do município de Ilha Solteira - SP. (HE, Obj. 100X).
57 56 10µm FIGURA 5 - Corte histológico de fígado de cão polissintomático para LVC, ilustrando macrófagos infectados com amastigotas de L. (L.) chagasi em cão do município de Ilha Solteira - SP. (HE, Obj. 100X). 10µm FIGURA 6 - Coloração imunoistoquímica de baço de cão polissintomático para LVC, ilustrando as formas amastigotas de L. (L.) chagasi coradas em vermelho tijolo pelo substrato da enzima peroxidase, em tecido de cão do município de Ilha Solteira - SP. (Obj. 100X).
58 57 10µm FIGURA 7 - Coloração imunoistoquímica de linfonodo de cão polissintomático para LVC, ilustrando as formas amastigotas de L. (L.) chagasi coradas em vermelho tijolo pelo substrato da enzima peroxidase, em tecido de cão do município de Ilha Solteira - SP. (Obj. 100X). 10µm FIGURA 8 - Coloração imunoistoquímica de fígado de cão polissintomático para LVC, ilustrando as formas amastigotas de L. (L.) chagasi coradas em vermelho tijolo pelo substrato da enzima peroxidase, em tecido de cão do município de Ilha Solteira - SP. (Obj. 100X).
59 Reação em Cadeia pela Polimerase (PCR) Os exames iniciais sorológicos (RIFI e ELISA) e parasitológicos (HE e IMIQ) apresentaram resultados pelos quais foi possível diagnosticar 20/34 (60,0%) dos cães como positivos. No entanto, nem todos os resultados apresentaram concordância, assim como no exame da HE em que vários tecidos apresentaram resultados inconclusivos, desta forma 9/34 (26,5%) dos cães foram classificados suspeitos e 5/34 (15,0%) cães negativos. Os resultados em porcentagem dos exames sorológicos e parasitológicos realizados com os tecidos do baço, linfonodo e fígado dos cães naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP encontram-se ilustrados na Figura 9. FIGURA 9 - Porcentagens (%) de cães positivos, suspeitos e negativos para Leishmaniose Visceral Canina pelos resultados dos testes sorológicos (RIFI e ELISA) e parasitológicos (HE e IMIQ), naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP.
60 59 Desta forma, foi realizada a técnica da PCR com as amostras de tecidos do baço, linfonodos e fígado com a intenção de elucidar os casos dos cães suspeitos e negativos e também com as amostras de sangue dos 34 cães para complementar o diagnóstico dos cães suspeitos e negativos e ainda confirmar os diagnósticos positivos dos cães deste estudo. A PCR foi realizada, portanto nos cães suspeitos (02, 04, 06, 09, 13, 14, 18, 21 e 28) e negativos (01, 11, 20, 22 e 23) para LVC em amostras teciduais do baço, linfonodo e fígado. Na Figura 10, estão ilustradas as amplificações de DNA pela PCR do baço, dentre as quais apenas não apresentaram bandas de DNA os cães 06, 13 e 21. Já na Figura 11, estão ilustradas a PCR realizada com amostras do linfonodo, mostrando que apenas os cães 06, 20, 21 e 22 não apresentaram bandas de DNA. E na Figura 12, está ilustrado o resultado da PCR em amostras hepáticas, dentre as quais apenas não apresentaram bandas de DNA os cães 06, 13 e 21, concordando com os resultados das amplificações com as amostras do baço dos cães. Dentre os 14 (47,6%) cães suspeitos ou negativos, a PCR revelou-se positiva em quase todos os cães 13/14 (93,0%), com exceção apenas para um cão, ou seja, o cão 21, que foi considerado suspeito pelas outras provas diagnósticas, mas negativo em todos os tecidos pela PCR. Os resultados da PCR nos tecidos do baço, linfonodo e fígado dos cães suspeitos e negativos para LVC pelos testes sorológicos e parasitológicos encontram-se na Tabela 4. Além dos órgãos, a PCR foi realizada também com o sangue total dos 34 cães. Nas Figuras 13, 14 e 15 estão ilustradas as amplificações de DNA pela PCR do sangue de todos estes cães, dentre as quais apenas nos cães 09, 14 e 21 não foram visualizadas bandas de DNA. Desta forma, observou-se que a positividade da PCR apenas no sangue dos cães foi de 31/34 (91,0%). Os resultados da PCR no sangue dos 34 cães naturalmente infectados por Leishmania spp no município de Ilha Solteira - SP encontram-se na Tabela 5. Desta forma, incluindo os resultados da PCR do sangue dos 34 cães, juntamente com os resultados da PCR dos três tecidos dos cães suspeitos e negativos para auxiliar no diagnóstico dos testes sorológicos (ELISA e RIFI) e
61 60 parasitológicos (HE e IMIQ), verificou-se que a positividade dos cães para a LVC, no estudo foi alta, ou seja, 33/34 (97,0%) cães. Assim a PCR elucidou os casos dos cães suspeitos e negativos para o diagnóstico da LVC em amostras de tecidos do baço, linfonodo, fígado e sangue. PM C C- NO 120pb FIGURA 10 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp, por PCR no baço dos cães classificados como suspeitos (1, 2, 4, 9, 18, 23, 28) e negativos (11, 14, 20 e 22) e ausência de banda de DNA nos cães suspeitos (6 e 21) e negativo (13) para LVC pelos exames sorológicos e parasitológicos; PM: marcador em escala de 100pb (Invitrogen ); C+: DNA extraído do baço de cão naturalmente infectado por Leishmania spp; C-: DNA extraído do baço de cão negativo para LVC e NO: sem DNA.
62 61 PM C C- NO 120pb FIGURA 11 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp, por PCR no linfonodo dos cães classificados como suspeitos (1, 2, 4, 9, 18, 23, 28) e negativos (11, 13 e 14) e ausência de banda de DNA nos cães suspeitos (6 e 21) e negativos (20 e 22) para LVC pelos exames sorológicos e parasitológicos; PM: marcador em escala de 100pb (Invitrogen ); C+: DNA extraído do linfonodo de cão naturalmente infectado por Leishmania spp; C-: DNA extraído do linfonodo de cão negativo para LVC e NO: sem DNA. PM C C- NO 120pb FIGURA 12 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp, por PCR no fígado dos cães classificados como suspeitos (1, 2, 4, 9, 18, 23 e 28) e negativos (11, 14, 20 e 22) e ausência de banda de DNA nos cães suspeitos (6 e 21) e negativo (13) para LVC pelos exames sorológicos e parasitológicos; PM: marcador em escala de 100pb (Invitrogen ); C+: DNA extraído do fígado de cão naturalmente infectado por Leishmania spp; C-: DNA extraído do fígado de cão negativo para LVC e NO: sem DNA.
63 62 Tabela 4 - Resultados do diagnóstico por PCR realizada em tecidos do baço, linfonodo, fígado e no sangue dos cães considerados suspeitos e negativos para LVC, pelos testes ELISA indireto, RIFI, histoquímico (HE) e imunoistoquímico (IMIQ). (Araçatuba - SP, 2008) Cães Resultado da PCR Tecidos Sangue Baço Linfonodo Fígado Suspeitos 2 P P P P 4 P P P P 6 N N N P 9 P P P N 13 N P N P 14 P P P N 18 P P P P 21 N N N N 28 P P P P Negativos 1 P P P P 11 P P P P 20 P N P P 22 P N P P 23 P P P P P: Positivo; N: Negativo
64 63 PM C C+ NO 120pb FIGURA 13 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp por PCR no sangue dos cães (1, 2, 3, 4, 5, 6, 7, 8, 10, 13, 15, 16, 17, 19 e 20); ausência de banda de DNA no cão (9); PM: marcador em escala de 100pb (Invitrogen ); C-: DNA extraído do sangue de cão negativo para LVC; C+: DNA extraído do sangue de cão naturalmente infectado por Leishmania spp e NO: sem DNA. PM C C+ NO 120pb FIGURA 14 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp por PCR no sangue dos cães (11, 12, 18, 28, 32, 22, 23, 24, 25, 26, 27, 29, 30 e 31); ausência de banda de DNA nos cães (14 e 21); PM: marcador em escala de 100pb (Invitrogen ); C-: DNA extraído do sangue de cão negativo para LVC; C+: DNA extraído do sangue de cão naturalmente infectado por Leishmania spp e NO: sem DNA.
65 64 PM pb FIGURA 15 - Eletroforese em gel de poliacrilamida 8% corado com nitrato de prata. Produtos de amplificação de fragmento de 120pb de DNA de Leishmania spp por PCR no sangue dos cães (33 e 34); PM: marcador em escala de 100pb (Invitrogen ). Tabela 5 - Resultados em número de cães e porcentagens (%) da PCR realizada com o sangue dos 34 cães naturalmente infectados por Leishmania spp no município de Ilha Solteira SP. (Araçatuba SP, 2008) PCR (Sangue) Número de cães Porcentagem (%) Positivo 31 91,0 Negativo 3 9,0 Total
66 Comparação dos Testes Diagnósticos Os resultados em números e porcentagens de cães positivos e negativos pelos testes sorológicos (RIFI e ELISA), parasitológicos (HE e IMIQ) e PCR realizados em cães naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP estão ilustrados na Tabela 06 e Figura 16. Nestes resultados foi observado que os testes PCR, ELISA, IMIQ, RIFI e HE apresentaram as seguintes positividades: 97,0%, 65,0%, 62,0%, 56,0% e 56,0%, respectivamente. Tabela 6 - Resultados em números e porcentagens (%) dos cães positivos e negativos para Leishmaniose Visceral Canina pelos exames sorológicos (ELISA e RIFI), parasitológicos (HE e IMIQ) e PCR para LVC, realizados em cães no município de Ilha Solteira SP. (Araçatuba - SP, 2008) Resultados dos Exames Diagnósticos Número (%) ELISA RIFI HE IMIQ PCR Positivo 22 (65,0) 19 (56,0) 19 (56,0) 21 (62,0) 33 (97,0) Negativo 12 (35,0) 15 (44,0) 15 (44,0) 13 (38,0) 1 (3,0) Total 34 (100) 34 (100) 34 (100) 34 (100) 34 (100)
67 66 FIGURA 16 - Porcentagens (%) de cães positivos para Leishmaniose Visceral Canina pelos testes ELISA, RIFI, HE, IMIQ e PCR, naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira - SP. Os resultados destes testes foram em seguida comparados dois a dois e submetidos ao teste Kappa para a análise de concordância. Os resultados da comparação da IMIQ em cada tecido (baço, linfonodo e fígado) com a RIFI, ELISA e PCR no sangue em porcentagem de concordância, coeficiente Kappa e valor de p estão ilustrados nas Tabelas 7, 8 e 9, respectivamente. Além disso, a comparação também foi realizada entre os testes sorológicos (RIFI e ELISA) e com a PCR do sangue. Os resultados da porcentagem de concordância, coeficiente Kappa e valor de p estão ilustrados na Tabela 10. Estas análises comparativas revelaram concordância muito boa entre RIFI e IMIQ no baço e fígado e boa no linfonodo. E entre o ELISA e IMIQ no fígado a concordância também foi boa, assim como entre o teste ELISA e RIFI no sangue. Já uma leve concordância foi observada entre a PCR e IMIQ no baço e fígado e fraca no linfonodo.
68 67 A maioria dos métodos de diagnósticos apresentou concordância estatisticamente significante, apenas com exceção na comparação do teste ELISA versos a PCR no sangue em que a replicabilidade foi inexistente. Tendo em vista que o teste parasitológico HE não foi conclusivo em muitas amostras de tecidos analisadas, optou-se por não incluí-lo na análise comparativa dos métodos empregados. Tabela 7 - Resultados do teste IMIQ no tecido do baço comparado aos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados pelo teste Kappa Baço (n = 32) Testes de Diagnósticos IMIQ x RIFI IMIQ x ELISA IMIQ x PCR Concordância (%) 91,0 78,0 62,5 p 0,05* Kappa 0,8110 0,5556 0,2099 p <0,0001* 0,0007* 0,0264* Tabela 8 - Resultados do teste IMIQ no tecido do linfonodo comparado aos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados pelo teste Kappa Linfonodo (n = 32) Testes de Diagnósticos IMIQ x RIFI IMIQ x ELISA IMIQ x PCR Concordância (%) 78,0 75,0 59,0 p 0,05* Kappa 0,6141 0,5000 0,1875 p 0,0003* 0,0017* 0,0344*
69 68 Tabela 9 - Resultados do teste IMIQ no tecido do fígado comparado aos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados pelo teste Kappa Fígado (n = 34) Testes de Diagnósticos IMIQ x RIFI IMIQ x ELISA IMIQ x PCR Concordância (%) 94,0 82,0 65,0 p 0,05* Kappa 0,8887 0,6370 0,2184 p <0,0001* <0,0001* 0,0206* Tabela 10 - Resultados dos testes RIFI, ELISA e PCR realizados com o sangue dos cães comparados entre si pelo teste Kappa Sangue (n = 34) Testes de Diagnósticos ELISA x RIFI PCR x RIFI ELISA x PCR Concordância (%) 82,0 65,0 59,0 p 0,05* Kappa 0,6370 0,2184-0,0215 p <0,0001* 0,0206* 0,4274
70 69 5 DISCUSSÃO O presente estudo enfocou grupos de cães com diferentes sinais clínicos, os quais foram diagnosticados para LVC, por observação clínica e por diversos exames. Inicialmente foram realizados exames sorológicos para detecção de anticorpos anti-leishmania sp e em seguida os parasitas intactos nos tecidos do baço, linfonodo e fígado foram visualizados por métodos parasitológicos histoquímicos e imunoistoquímicos. Finalmente, para a confirmação de casos inconclusivos, a PCR foi utilizada por apresentar alta sensibilidade em amostras de cães, já demonstrada em outros estudos. Diante dos diversos sinais clínicos e anatomopatológicos observados nos cães naturalmente infectados por L. (L.) chagasi no município de Ilha Solteira SP foram agrupados em: assintomáticos, oligossintomáticos e polissintomáticos. De acordo com Sideris et al. (1999), muitos cães infectados podem não apresentar nenhum sinal clínico. Assim, os animais podem permanecer aparentemente saudáveis por toda a vida, desenvolvendo uma adequada resposta imune celular, tornando-se resistentes à doença (PINELLI et al., 1994). Na presente pesquisa, 8/34 (23,5%) dos cães eram assintomáticos e dentre estes, apenas um cão (12,5%) foi soropositivo e com os tecidos (baço, linfonodo e fígado) altamente parasitados (positivos pela HE e IMIQ). No entanto, pela PCR identificou-se 100% dos cães assintomáticos como positivos, embora não tenha sido possível identificar amastigotas íntegras nos tecidos, com exceção dos tecidos do cão 19. Segundo Nunes (2007), o tempo médio para os cães inicialmente negativos ao exame parasitológico e ELISA apresentarem pelo menos um sinal clínico compatível com LVC foi ao redor de
71 70 seis meses. Estes dados indicam a necessidade de mais de um método de diagnóstico para levantamentos epidemiológicos para que os cães assintomáticos possam ser diagnosticados precocemente. O grupo oligossintomático, teve o maior número de cães em nosso estudo, com 14/34 (41,0%) cães. Desta forma, neste grupo, pelos testes sorológicos (ELISA ou RIFI), 50,0% dos cães foram positivos, mas com discordâncias entre os dois testes de 28,5% e 14,3% negativos. Estes cães apresentaram até três sinais clínicos da LVC, que incluíam alterações gerais de pele, emagrecimento, esplenomegalia, fígado com manchas brancas, fígado ictérico, linfonodos hipertróficos e mucosas pálidas. No entanto, estes sinais poderiam ser mascarados com sinais clínicos de outras enfermidades de origem bacteriana ou virótica, ou mesmo parasitárias, dificultando a interpretação dos resultados diagnósticos. As infecções simultâneas por doença de Chagas, leishmaniose tegumentar (COSTA et al., 1991; COUTINHO et al., 1985; FERREIRA et al., 2007) e erlichiose (FERREIRA et al., 2007) foram observadas simultaneamente em muitos cães com LVC. Assim, em função da reação cruzada com outros microorganismos que podem ainda ser observadas em testes sorológicos, alguns autores sugerem cautela nas campanhas de saúde pública, em relação à prevalência do Calazar canino (COSTA et al., 1991), principalmente nos cães oligossintomáticos. Após a realização da PCR, foi constatado que apenas o cão 21 classificado como suspeito pelas provas sorológicas e parasitológicas, foi negativo em todos os tecidos inclusive no sangue, sendo assim, este foi o único cão negativo do estudo, elevando a positividade do grupo dos cães oligossintomáticos para 93,0%. Já com relação ao grupo dos cães polissintomáticos 93,0% foram positivos para LVC pelos exames sorológicos e parasitológicos, além disso, todos os cães apresentavam-se com um grau bastante avançado da doença, com diversas manifestações clínicas muito evidentes. Desta forma, notou-se a presença de várias alterações gerais de pele como o achado mais freqüente em 100% dos cães. As alterações cutâneas são bem freqüentes em cães com
72 71 LVC, as quais aparecem de acordo com a resposta imune do cão ou de vigência com outras enfermidades (FERRER et al., 1999). Além disso, 83,0% apresentaram esplenomegalia resultados estes que concorda com os obtidos por Ciaramella et al. (1997) que verificaram que o comprometimento deste órgão é comum em cães com sinais clínicos para LVC. Outro órgão comprometido foi o fígado apresentando-se ictéricos, com manchas brancas e hepatomegalia. Concordantemente com o presente estudo no fígado os parasitos se desenvolvem nos tecidos dentro de macrófagos induzindo às alterações granulares, com conseqüente alteração deste tecido (NOLI, 1999). As demais alterações observadas como de emagrecimento, linfonodos hipertróficos, onicogrifose, alterações oculares e mucosas pálidas caracterizam a presença da doença nestes cães. Além disso, o diagnóstico foi mais fácil no grupo dos cães polissintomáticos em função da positividade em todos os testes realizados, além do intenso grau parasitário nos tecidos tanto do baço, quanto do linfonodo e do fígado. A surpresa neste grupo foi apenas o cão 28, classificado como suspeito pelas provas sorológicas e parasitológicas, o qual apresentou diversas alterações gerais de pele generalizadas pelo corpo, negativo na sorologia e com tecidos suspeitos para LVC, mas pela PCR foi positivo em todos os tecidos inclusive no sangue. Uma provável explicação para a negatividade dos testes sorológicos pode ter sido em função do tratamento deste cão contra sarna, que pode eliminar o parasita dos tecidos e do sangue e conseqüentemente diminuir a quantidade de anticorpos. Provavelmente o tratamento contra a sarna dificultou o diagnóstico da doença neste cão, o qual já havia sido realizado por algum tempo pelos proprietários. As características das técnicas diagnósticas são parâmetros importantes na escolha do teste a ser utilizado num programa de controle da LVC, principalmente quando a eliminação do cão positivo é uma das medidas adotadas (ALVES; BEVILACQUA, 2004). A RIFI e o ELISA são os testes geralmente utilizados na detecção de anticorpos anti-leishmania sp em soros de cães no diagnóstico canino, porém têm ocorrido muitos problemas de
73 72 reações cruzadas nestes testes (COSTA et al., 1991; COUTINHO et al., 1985; VEXENATE et al., 1996). No presente estudo, não foi avaliado o índice de especificidade e sensibilidade dos testes sorológicos, pois isso já foi objeto de muitas pesquisas, mostrando diferenças e controvérsias entre os resultados. A divergência de resultados entre exames sorológicos possivelmente ocorre em função dos diferentes protocolos utilizados (METTLER et al., 2005; NUNES, 2007; ROSÁRIO et al., 2005). Além disso, no presente trabalho, os testes ELISA e RIFI apresentaram respectivamente as positividades de 71,0% e 57,0% nos animais oligossintomáticos e de 12,5% e 83,0% para ambos os testes, nos animais assintomáticos e polissintomáticos, respectivamente. Verificou-se também que o ELISA apresentou uma positividade de (65,0%), seguido pela IMIQ (62,0%), RIFI e HE (56,0%). No geral, quando o teste sorológico apresentava altos níveis de anticorpos anti-leishmania sp, os tecidos também se encontravam fortemente parasitados, principalmente nos cães polissintomáticos. Assim, 85,0% dos tecidos com grau parasitário variando com três a quatro cruzes pela HE e positivos pela IMIQ, pertenciam aos animais com altos títulos de anticorpos. Isto significa que a resposta humoral, com alta produção de anticorpos, não protegeu os animais desta infecção parasitária. Nos casos onde os cães desenvolvem a LVC de uma forma severa e progressiva, a doença está associada com uma resposta do tipo Th2, predominantemente imune-humoral que é incapaz de conter a infecção (PINELLI et al., 1994). Concordante com o presente resultado, outros autores têm demonstrado altos títulos de anticorpos e intensa carga parasitária em tecidos do baço, fígado, linfonodo, pele e medula óssea em cães sintomáticos, comparado aos cães assintomáticos com baixos níveis de anticorpos e parasitas (REIS et al., 2006). No entanto, a observação acima não é regra, pois, diferentemente dos outros cães assintomáticos, o cão 19, apresentou uma elevada produção de anticorpos anti-l. (L.) chagasi, além de forte e moderado parasitismo no baço e fígado, respectivamente, pela HE. Este cão poderia estar no início da infecção patente (PINELLI et al., 1994) ou indicar ainda um equilíbrio da interação
74 73 hospedeiro-parasito (OLIVEIRA et al., 1993), o que favoreceria o encontro do grande número de parasitos intactos nos tecidos. Segundo Madeira et al. (2006), o maior obstáculo para a interpretação dos dados sorológicos é a ausência de informações parasitológicas. Assim, no presente estudo, foram realizados estudos paralelos com os métodos parasitológicos HE e IMIQ para auxiliar na interpretação dos resultados dos testes ELISA e RIFI. O método IMIQ de visualização direta dos parasitas nos tecidos é muito importante em função de sua maior especificidade em relação ao HE, no entanto oferece dificuldade nos cães assintomáticos, onde há poucos parasitas nos tecidos, dificultando o diagnóstico (FERRER et al., 1999). Desta forma, para aqueles cães com dúvidas na identificação das formas amastigotas pela técnica da HE, decidiu-se por classificá-los na categoria de suspeitos, para serem confirmados posteriormente pela técnica IMIQ, por oferecer a vantagem de maior contraste entre o parasita e os tecidos dos cães, favorecendo a uma melhor visualização das formas amastigotas (TAFURI et al., 2004). Sugere-se aqui que a distribuição desigual dos parasitos no organismo dos cães durante a infecção natural pode ter contribuído para a dificuldade de detecção dos parasitos e com a divergência de resultados obtidos pelos testes. Quando a técnica IMIQ foi utilizada pôde-se comprovar a positividade pela HE e ainda elucidar os casos suspeitos e negativos por este teste, possibilitando uma maior detecção dos parasitos que foi de 62,0% e 56,0%, respectivamente para os exames da IMIQ e HE, considerando os diagnósticos nos três tecidos analisados. Desta forma, a realização da IMIQ em amostras de tecido esplênico, linfonodo ou mesmo do fígado pode ser de grande ajuda no auxílio de estudos para a pesquisa do parasito em cães assintomáticos e oligossintomáticos os quais geralmente apresentam discordância de resultados diagnósticos que muitas vezes são incompletos ou suspeitos. No entanto, pela discordância de resultados entre o ELISA, RIFI, e na dificuldade de detecção de amastigotas nos tecidos, do total de cães estudados, 20/34 (60,0%) foram positivos, 9/34 (26,5%) permaneceram ainda
75 74 na categoria de suspeitos e 5/34 (15,0%) negativos. Como a PCR tem demonstrado ser uma técnica altamente sensível para o diagnóstico clínico da LVC e por ser capaz de amplificar o kdna de Leishmania spp a partir de um único parasito presente na amostra (MANNA et al., 2004; NUNES et al., 2007; RODGERS et al., 1990; SOLANO-GALLEGO et al., 2004;), optou-se por utilizar esta técnica em amostras teciduais dos três órgãos dos cães suspeitos e negativos além do sangue de todos os cães para confirmar a positividade dos demais testes. Solano-Gallego et al. (2004) mostraram que os cães assintomáticos e negativos na IMIQ foram positivos na PCR para Leishmania spp, indicando que o número de parasitas baixo nos tecidos dificultaria a identificação, mesmo empregando técnicas tão sensíveis como a IMIQ. Na PCR realizada com o sangue dos 34 cães foi observada uma positividade de 31/34 (91,0%). Já em outra pesquisa semelhante realizada com 95 cães com LVC na Itália, Manna et al. (2004) verificaram uma positividade do sangue pela PCR de 94,0%, bem próximo dos dados obtidos neste trabalho, além da sensibilidade desta técnica de 100%. Já Nunes (2007) verificou pela PCR, a positividade variando de 78,0 a 86,0% no sangue (inferiores aos encontrados na presente pesquisa) e 100% nos tecidos do linfonodo poplíteo, baço e pele. Nesta pesquisa, nos tecidos (baço, linfonodo e fígado) a PCR confirmou o resultado positivo pelas outras técnicas e ainda detectou DNA do parasita em 93,0% dos cães com diagnósticos inconclusivos, ou seja, 100% dos cães negativos e em 89,0% dos suspeitos. Isto mostrou que apenas um dentre os 34 cães estudados nesta pesquisa realmente encontrava-se negativo para LVC pela PCR, elevando para 97,0% a positividade dos cães. Destacamos que, todos os cuidados necessários para evitar a contaminação das amostras foram tomados durante os procedimentos da técnica, por isso as chances de ocorrência de resultados falso-positivos à PCR foram mínimas. Como Ilha Solteira pertence a uma área considerada endêmica para LVC, não foi surpresa observar esta alta positividade pela PCR entre os cães analisados. Por ser o teste IMIQ, bastante específico (FERRER et al., 1999; TAFURI et al., 2004) e de fácil visualização das amastigotas intactas nos tecidos,
76 75 decidiu-se por escolhê-lo como o teste padrão para fazer a análise comparativa entre os demais testes. Por esta análise comparativa percebeu-se que os melhores resultados foram obtidos quando comparados ao exame RIFI, tanto no baço (Kappa = 0,8110), como no fígado (Kappa = 0,8887) e linfonodo (Kappa = 0,6141). Sendo que, apresentaram ainda uma concordância muito boa no baço e fígado e boa no linfonodo. Além disso, é evidente a alta concordância (78% a 94%) entre os testes para a detecção de anticorpos tanto no soro como em tecidos de cães, mesmo sendo amostras biológicas de regiões distintas do cão. Por outro lado, o nível de concordância entre o ELISA versus IMIQ (Kappa = 0,6370) nos tecidos foi boa (Kappa variando de 0,50 a 0,64), significando que esta comparação apresentou melhores resultados do que a RIFI versus IMIQ. Semelhante a este valor foi o coeficiente Kappa observado na comparação do ELISA versus RIFI com uma concordância boa. Concordante a essas observações, Zanette (2006) observou também uma boa concordância entre os testes sorológicos, validando a comprovação de que estes dois testes podem apresentar em alguns casos, resultados divergentes no diagnóstico da LVC. A PCR do sangue destes cães foi também comparada com os mesmos testes (RIFI, ELISA e IMIQ com os três tecidos) e as análises comparativas revelaram leve concordância entre a PCR e os demais exames, com porcentagens variando de 59,0% a 65,0% e com valores baixos dos coeficientes Kappa, ou seja, variando de 0,4274 a 0,0206. Estas discordâncias podem ser explicadas com a alta positividade apresentada pela PCR no sangue comparada aos demais testes no presente trabalho. Outros estudos já haviam também observado baixos valores do coeficiente Kappa entre o ELISA e PCR, com exceção apenas para os cães severamente infectados, em que a concordância foi moderada (NUNES, 2007). Desta forma, a PCR deve ser analisada com cautela nas campanhas epidemiológicas, pois detecta apenas o DNA do parasita no sangue ou nos tecidos e não necessariamente a doença
77 76 no animal, diferentemente do exame parasitológico que detecta o parasita intacto nos tecidos. Os resultados da presente pesquisa revelaram que nenhuma prova diagnóstica quando testada isoladamente identificou adequadamente os cães infectados com LVC, reforçando assim as observações de outros autores (NUNES, 2007; QUINNELL et al., 2001). Por isso, existe sempre a necessidade da associação de técnicas, pois os resultados dos diagnósticos variam muito com a evolução da doença e com a resposta imune desenvolvida pelo cão.
78 77 6 CONCLUSÃO Os resultados da presente pesquisa permitiram concluir que: Houve a necessidade da associação de várias provas diagnósticas para o diagnóstico da LVC nos cães, por ser uma enfermidade complexa pela diversidade clínica, parasitológica e imunológica; O conjunto de exames sorológicos, parasitológicos e molecular foi de grande importância para o diagnóstico definitivo da LVC nos cães assintomáticos, oligossintomáticos e polissintomáticos; A PCR no sangue foi a técnica que apresentou a maior positividade, pois diagnosticou 97,0% dos casos, sendo considerada importante para o diagnóstico definitivo quando os testes sorológicos e parasitológicos não foram capazes de detectar os cães positivos para a doença. As análises comparativas revelaram índices de concordância variando de muito bom a bom entre RIFI e IMIQ, nos tecidos estudados (baço, fígado e linfonodo). Além disso, os índices de concordância do teste ELISA versus IMIQ no fígado e dos sorológicos ELISA versus RIFI foram bons.
79 78 REFERÊNCIAS AGUIAR, P. H. P.; SANTOS, S. O.; PINHEIRO, A. A.; BITTENCOURT, D. V. V.; COSTA, R. L. G.; JULIÃO, F. S.; SANTOS, W. L. C.; BARROUIN-MELO, S. M. Quadro clínico de cães Infectados naturalmente por Leishmania chagasi em uma área endêmica do estado da Bahia. Brasil. Revista Brasileira de Saúde e Produção Animal, v. 8, n. 4, p , ALENCAR, J. E. Leishmaniose Visceral no Brasil. Revista de Medicina da Universidade Federal do Ceará, v. 17, n. 18, p , ALMEIDA, M. A. O.; JESUS, E. E. V.; SOUSA-ATTA, M. L. B.; ALVES, L. C.; BERNE, M. E.; ATTA, A. M. Clinical and serological aspects of visceral leishmaniasis in northeast Brazilian dogs naturally infected with Leishmania chagasi. Veterinary Parasitology, v. 127, n. 3-4, p , ALVAR, J. Leishmania and HIV co-infection in the Mediterranean countries, In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, Barcelona. Proceedings... Barcelona, p ALVES, W. A.; BEVILACQUA, P. D. Reflexões sobre a qualidade do diagnóstico da leishmaniose visceral canina em inquéritos epidemiológicos: o caso da epidemia de Belo Horizonte, Minas Gerais, Brasil, Caderno de Saúde Pública, v. 20, n. 1, p , ANDRADE, A. M.; QUEIROZ, L. H.; PERRI, S. H. V.; NUNES, C. M. Estudo descritivo da estrutura populacional canina da área urbana de Araçatuba, São Paulo, Brasil, no período de 1994 a Caderno de Saúde Pública, v. 24, n. 4, p , ASSIS, J.; QUEIROZ, N. M. G. P. Q.; STARKE-BUZETTI, W. A.; TENÓRIO, M. S.; NORONHA-JUNIOR, A. C. F. Leishmaniose Visceral Canina: Novos Casos no Município de Ilha Solteira-SP. In: Semana de Divulgação Científica da Unesp de Araçatuba, 8., Anais... Araçatuba: SEDIC, AYRES, M.; AYRES JUNIOR, M; AYRES, D. L.; SANTOS, A. A. S. BioEstat - Aplicações estatísticas nas áreas das ciências bio-médicas. Versão Instituto de desenvolvimento sustentável Mamirauá, Belém, Pará, Brasil. BARBOZA, D. C. P. M.; GOMES NETO, C. M. B.; LEAL, D. C.; BITTENCOURT, D. V. V.; CARNEIRO, A. J. B.; SOUZA, B. M. P. S.; OLIVEIRA, L. S.; JULIÃO, F. S.; SOUZA, V. M. M.; FRANKE, C. R. Estudo de
80 79 coorte em áreas de risco para leishmaniose visceral canina, em municípios da Região Metropolitana de Salvador, Bahia, Brasil. Revista Brasileira de Saúde e Produção Animal, v. 7, n. 2, p , BARROUIN-MELO, S. M.; LARANJEIRA, D. F.; FILHO, F. A. A.; TRIGO, J.; JULIÃO, F. S.; FRANKE, C. R.; AGUIAR, P. H. P.; SANTOS, W. L. C.; PONTES-DE-CARVALHO, L. Can spleen aspirations be safely used for the parasitological diagnosis of canine visceral leishmaniosis? A study on assymptomatic and polyssintomatic animals. The Veterinary Journal, v. 171, n. 2, p , BOURDOISEAU, G.; MARCHAL, T.; MAGNOL, J.P. Immunohistochemical detection of Leismania infantum in formalin-fixed, paraffin-embedded sections of canine skin and lymph nodes. Journal Veterinary Diagnostic Investigation, v. 2, n. 9, p , BRASIL. Ministério da Saúde. Manual de vigilância e controle da Leishmaniose Visceral Americana do Estado de São Paulo. Série A. Normas e manuais técnicos. Brasília: Ministério da Saúde p. BRASIL. Ministério da Saúde. Manual de vigilância e controle da Leishmaniose Visceral: normas e manuais técnicos. Brasília: Ministério da Saúde p CABRAL, M.; O GRADY, J. E.; GOMES, S.; SOUSA, J. C.; THOMPSON, H.; ALEXANDER, J. The immunology of canine leishmaniosis: strong evidence for a developing disease spectrum from asymptomatic dogs. Veterinary Parasitology, v. 3, n. 76, p , CIARAMELLA, P.; OLIVA, G.; DE LUNA, R.; GRADONI, L.; AMBROSIO, R.; CORTESE, L.; SCALONE, A.; PERSECHINO, A. A retrospective clinical study of canine leishmaniasis in 150 dogs naturally infected by Leishmania infantum. Veterinary Record, v. 141, n. 21, p , COSTA, C. A.; GENARO, O.; LANA, M.; MAGALHÃES, P. A.; DIAS, M.; MICHALIK, M. S. M; MELO, M. N; COSTA, R. T.; ROCHA, N. M. M.; MAYRINK, W. Leishmaniose visceral canina: avaliação da metodologia sorológica utilizada em inquéritos epidemiológicos. Revista da Sociedade Brasileira de Medicina Tropical, v. 24, n. 1, p , COSTA-VAL, A. P.; AMORIM, I. F. G.; MICHALIK, M. S. M.; FREITAS, E.; LALA, D. S.; MELO, M. N. Leishmaniose Visceral Canina: estudo comparativo no diagnóstico parasitológico. In: CONGRESSO BRASILEIRO DE PARASITOLOGIA VETERINÁRIA, 2006, Ribeirão Preto. Anais... Ribeirão Preto: CBPV, 2006.
81 80 COUTINHO, M. T. Z.; BUENO, L. L.; STERZIK, A.; FUJIWARA, R. T.; BOTELHO, J. R.; MARIA, M. DE; ODAIR, G.; LINARD, P. M. Participation of Rhipicephalus sanguineus (Acari: Ixodidae) in the epidemiology of canine visceral leishmaniasis. Veterinary Parasitology, v. 128, n. 1-2, p , COUTINHO, S. G.; NUNES, M. P.; MARZOCHI, M. C. A.; TRAMONTANO, N. A survey for American Cutaneous and Visceral Leishmaniasis among 1,342 dogs from areas in rio de Janeiro (Brazil) where the human diseases occcur. Memórias do Instituto Oswaldo Cruz, v. 80, n. 1, p , DEANE, L. M.; DEANE, M. P. Leishmaniose visceral urbana (no cão e no homem) em Sobral, Ceará. O Hospital, v. 47, p.75-87, FEITOSA, M. M.; IKEDA, F. A.; LUVIZOTTO, M. C. R.; PERRI, S. H. V. Aspectos clínicos de cães com leishmaniose visceral no município de Araçatuba São Paulo (Brasil). Clínica Veterinária, v. 5, n. 28, p , FERREIRA, E. C.; LANA, M.; CARNEIRO, M.; REIS, A. B.; PAES, D. V.; SILVA, E. S.; SCHALLIG, H.; GONTIJO, C. M. F. Comparison of serological assays for the diagnosis of canine visceral leishmaniasis in animals presenting different clinical manifestations. Veterinary Parasitology, v. 146, n. 3-4, p , FERRER, L. M. Clinical aspect of canine leishmaniasis. In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, Barcelona. Proceedings... Barcelona, p FERRER, L. The pathology of canine leishmaniasis. In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, 2002, Sevilla. Proceeding Sevilla, p FERRER, L.; RABANAL, R. M.; DOMINGO, M. Identification of Leishmania donovani amastigotes in canine tissues by immuneperoxidase staining. Research Veterinary Science, v. 2, n. 44, p , FISA, R.; RIERA, C.; GÁLLEGO, M.; MANUBENS, J.; PORTUS, M. Nested PCR for diagnosis of canine leishmaniosis in peripheral blood, lymph node and boné marrow. Veterinary Parasitology, v. 99, n. 2, p , FRANÇA-SILVA, J. C.; BARATA, R. A.; COSTA, R. T. DE; MONTEIRO, É. M.; MACHADO-COELHO, G. L. L.; VIEIRA, E. P.; PRATA, A.; MAYRINK, W.; NASCIMENTO, E.; FORTES-DIAS, C. L.; SILVA, J. C. DA; DIAS, E. S. Importance of Lutzomyia longipalpis in the dinamics of transmission of canine visceral leishmaniasis in the endemic area of Porteirinha Municipality, Minas Gerais, Brazil. Veterinary Parasitology, v. 131, n. 3-4, p , 2005.
82 81 FUNDAÇÃO NACIONAL DE SAÚDE Vigilância Epidemiológica-Situação da prevenção e controle das doenças transmissíveis no Brasil. Brasília: Ministério da Saúde, p. 27. GALATI, E. A. B.; NUNES, V. B. L.; REGO JUNIOR, F. A.; OSHIRO, E. T.; RODRIGUES CHANG, M. Estudo de flebotomíneos (Diptera: Psychodidae) em foco de leishmaniose visceral no Estado de Mato Grosso do Sul, Brasil. Revista de Saúde Pública, v. 31, n. 4, p , GALIMBERTTI, M. Z.; KATZ, G.; CAMARGO-NEVES, V. L. F.; RODAS, L. A. C.; CASANOVA, C.; COSTA, A. I.; ARAUJO, M. F. L.; TANICUCHI, H. H.; BARBOSA, J. A. R.; BARBOSA, J. E. R.; TOLEZANO, J. E.; PINTO, P. L. S. Leishmaniose visceral americana no Estado de São Paulo. Revista da Sociedade Brasileira de Medicina Tropical, v. 33, supl. 32, p. 217, GIUNCHETTI, R.C.; MARTINS-FILHO, O.A.; CARNEIRO, C.M.; MAYRINK, W.; MARQUES, M.J.; TAFURI, W.L.; CORRÊA-OLIVEIRA, R.; REIS, A.B. Histopathology, parasite density and cell phenotypes of the popliteal lymph node in canine visceral leishmaniasis. Veterinary Immunology and Immunopathology, v. 121, n. 1-2, p , GOMES, A. H. S.; FERREIRA, I. M. R.; LIMA, M. L. S. R.; CUNHA, E. A.; GARCIA, A. S.; ARAÚJO, M. F. L.; PEREIRA-CHIOCCOLA, V. L. PCR identification of Leishmania in diagnosis and control of canine leishmaniasis. Veterinary Parasitology, v. 144, n. 3-4, p , GONTIJO, C. M. F.; MELO, M. N. Leishmaniose Visceral no Brasil: quadro atual, desafios e perspectivas. Revista Brasileira de Epidemiologia, v. 7, n. 3, p , GRADONI, L. The diagnosis of canine leishmaniasis. In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, Sevilla, Spain. Canine Leishmaniasis: moving towards a solution. Proceedings Salamanca: Intervet Internacional, p IBGE Instituto Brasileiro de Geografia e Estatística do Ministério Brasileiro do Planejamento, Orçamento e Gestão, IKONOMOPOULOS, J.; KOKOTAS, S.; GAZOULI, M.; ZAVRAS, A.; STOITSIOU, M.; GORGOULIS, V. G. Molecular diagnosis of leishmaniosis in dogs: comparative application of traditional diagnostic methods and the proposed assay on clinical samples. Veterinary Parasitology, v. 113, n. 2, p , INIESTA, V.; GÓMEZ-NIETO, L.; MOLANO, C.; MOHEDANO, I.A.; CARCELÉM, J.; MIRON, C.; ALONSO, C.; CORRALIZA, I. Arginase I induction
83 82 in macrophages, triggered by Th2-type cytokines, supports the growth of intracellular Leishmania parasites. Parasite Immunology, v. 3, p , IVERSSON, L. B.; CAMARGO, M. E.; ROCHA-SILVA, E. O.; CHIEFFI, P. P.; BARROS J. A. C. Investigação epidemiológica de um caso de leishmaniose visceral autócnes da Grande São Paulo, Brasil. Revista de Saúde Pública, v. 13, n. 2, p , KILLICK-KENDRICK, R. The life-cicle of Leishmania in the sand fly and transmission of leishmaniasis by bite. In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, Sevilla. Prooceding Sevilla, p LACHAUD, L.; MARCHERGUI-HAMMAMI, S.; CHABBERT, E.; DEREURE, J.; DEDET, J. P.; BASTIEN, P. Comparison of six PCR methods using peripheral blood for detection of canine visceral leishmaniasis. Journal of Clinical Microbiology, v. 40, n. 1, p , LAINSON, R.; SHAW, J. J. Evolution, classification and geographical distribution. In: PETERS, W. KILLICK-KENDRICK, R. The Leishmaniasis in biology and medicine. New York: Academic Press, v. 1, p LEONTIDES, L. S.; SARIDOMICHELAKIS, M. N.; BILLINIS, C.; KONTOS, V.; KOUTINAS, A. F.; GALATOS, A. D.; MYLONAKIS, M. E. A cross-sectional study of Leishmania spp. Infection in clinically healthy dogs with polymerase chain reaction and serology in Greece. Veterinary Parasitology, v. 109, n. 1-2, p , LIMA, W. G.; MICHALICK, M. S. M.; MELO, M. N.; TAFURI, W. L.; TAFURI, W. L. Canine visceral leishmaniasis a histopathological study of lympho nodes. Acta Tropica, v. 92, n. 1, p , LINDOSO, J. A. L.; GOTO, H. Leishmaniose visceral: situação atual e perspectivas futuras. Boletim Epidemiológico Paulista, v. 3, n. 26, p. 7-11, Disponível em: < Acesso em: 5 maio LIRA, R. A.; CAVALCANTE, M. P.; NAKAZAWA, M.; FERREIRA, A. G. P.; SILVA, E. D.; ABATH, F. G. C.; ALVES, L. C.; SOUZA, W. V.; GOMES, Y. M. Canine visceral leishmaniosis: A comparative analysis of the EIE-leishmaniosevisceral-canina-bio-Manguinhos and the IFI-leishmaniose-visceral-canina-Bio- Manguinhos kits. Veterinary Parasitology, v. 137, n. 1-2, p , 2006.
84 83 LIVNI, N.; ABRAMOWITZ, A.; LONDNER, M.; OKON, E.; MORAG, A. Imunoperoxidase method of identification of Leishmania in routinely prepeared histological sections. Virchows Archiv Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin, v. 401, p. 147, LUVIZOTTO, M. C. R.; BIAZZONO, L.; EUGÊNIO, F. R.; ANDRADE, A. L. Leishmaniose visceral canina autóctone no município de Araçatuba-SP. In: CONGRESSO BRASILEIRO DE CLÍNICOS VETERINÁRIOS DE PEQUENOS ANIMAIS, 20., 1999, Águas de Lindóia. Anais... Águas de Lindóia, p MACHADO, R. Z.; MONTASSIER, H. J.; PINTO, A. A.; LEMOS, E. G.; MACHADO, M. R.; VALADÃO, I. F.; BARCI, L. G.; MALHEIROS, E. B. An enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against Babesia bovis in cattle. Veterinary Parasitology, v. 71, n. 1, p , MADEIRA, M. F.; SCHUBACH, A. O.; SCHUBACH, T. M. P.; PEREIRA, S. A.; FIGUEIREDO, F. B.; BAPTISTA, C.; LEAL, C. A.; MELO, C. X.; CONFORT, E. M.; MARZOCHI, M. C. A. Post mortem parasitological evolution of dogs seroreactive for Leishmania from Rio de Janeiro, Brazil. Veterinary Parasitology, v. 138, n. 3-4, p , MANNA, L.; VITALE, F.; REALE, S.; CARACAPPA, S.; PAVONE, L.M.; MORTE, R. D.; CRINGOLI, G. Comparision of different tissue sampling for PCR-based diagnosis and follow-up of canine visceral leishmaniosis. Veterinary Parasitology, v. 125, n. 3-4, p , MARZOCHI, M. C. A.; MARZOCHI, K. B. F. Tegumentary and visceral leishmaniases in Brazil emerging anthropozoonosis and possibilities for their control. Caderno de Saúde Pública, v. 10, suppl. 2, p. S359-S375, MARZOCHI, M. C. A.; COUTINHO, S. G.; SOUZA, W. J.; AMENDOEIRA, M. R. Leishmaniose Visceral (Calazar). Jornal Brasileiro de Medicina, v. 41, n. 5, p , MAURÍCIO, I. L.; HOWARD, M. K.; STOTHARD, J. R.; MILES, M. A. genomic diversity in the Leishmania donovani complex. Parasitology, v. 119, pt 3, p , MENDES, W. L.; SILVA, A. A. M.; TROVÃO, J. R.; SILVA, A. R.; COSTA, J. M. L. Expansão espacial da leishmaniose visceral americana em São Luís, Maranhão, Brasil. Revista da Sociedade Brasileira de Medicina Tropical, v. 35, n. 3, p , 2002.
85 84 METTLER, M.; GRIMM, F.; CAPELLI, G.; CAMP, H.; DEPLAZES, P. Evaluation of enzyme-linked immunosorbent assays, an immunofluorescent-antibody test, and two rapid tests (immunochromatographic-dipstick and gel tests) for serological diagnosis of symptomatic and asymptomatic Leishmania infections in dogs. Journal Clinical Microbiology, v. 43, n. 11, p , MICHALIK, M. S. M. Gênero leishmania. In: NEVES, D. P. Parasitologia humana. 11. ed. São Paulo: Atheneu, p MILES, M. A.; VEXENAT, J. A.; FURTADO CAMPOS, J. H.; FONSECA DE CASTRO, J. A. Canine leishmaniasis in Latin America: control strategies for visceral leishmaniasis. Canine leishmaniasis: na update. In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, Barcelona. Proceedings... Barcelona, p MOREIRA JUNIOR, E. D.; SOUZA, V. M. M.; SREENIVASAN, M.; LOPES, N.; BARRETO, R. B.; CARVALHO, L. P. Peridomestic risk factors for canine leishmaniosis in urban dwellings: new findings from a prospective study in Brazil. Americam Journal of Tropipal Medicine and Hygiene, v. 69, n. 4, p , MOREIRA, M. A. B.; LUVIZOTTO, M. C. R.; GARCIA, J. F.; CORBETT, C. E. P.; LAURENTI, M. D. Comparison of parasitological, immunological and molecular methods for the diagnosis of Leishmaniasis in dogs with different clinical signs. Veterinary Parasitology, v. 145, n. 3-4, p , MORENO, E. C.; MELO, M. N.; GENARO, O.; LAMBERTUCCI, J. R.; SEFURO, J. C.; ANDRADE, A. S. R.; ANTUNES, C. M. F.; CARNEIRO, M. Risck factors for Leishmania chagasi infection in na urban área of Minas Gerais State. Revista da Sociedade Brasileira de Medicina Tropical, v. 38, n. 6, p , NOLI, C. Leishmaniosis canina. Waltham Focus, v. 9, n. 2, p , NUNES, C. M. Avaliação da dinâmica de reposição e susceptibilidade de cães à leishmaniose visceral em área endêmica f. Tese (Livre- Docência) - Faculdade de Odontologia e curso de Medicina Veterinária. Universidade Estadual Paulista (UNESP), Araçatuba, NUNES, C. M.; DIAS, A. K. K.; GOTTARDI, F. P.; PAULA, H. B.; AZEVEDO, M. A. A.; LIMA, V. M. F.; GARCIA, J. F. Avaliação da reação em cadeia pela polimerase para diagnóstico da leishmaniose visceral em sangue de cães. Revista Brasileira de Parasitologia Veterinária, v. 16, n. 1, p. 5-9, OLIVEIRA, A. L. L.; PANIAGO, A. M. M.; DORVAL, M. E. C.; OSHIRO, E. T.; LEAL, C. R.; SANCHES, M.; CUNHA, R. V.; BÓIA, M. N. Foco emergente de
86 85 leishmaniose visceral em Mato Grosso do Sul. Revista da Sociedade Brasileira de Medicina Tropical, v. 39, n. 5, p , OLIVEIRA, G. G. S.; SANTORO, F.; SADIGURSKY, M. The subclinical form of experimental visceral leishmaniasis in dogs. Memórias do Instituto Oswaldo Cruz, v. 88, n. 2, p , OLIVEIRA, T. M. F. S.; FURUTA, P. I.; CARVALHO, D.; MACHADO, R. Z. A study of cross-reactivity in serum samples from dogs positive for Leishmania sp., Babesia canis and Ehrlichia canis in enzyme-linked immunosorbent assay and indirect fluorescent antibody test. Revista Brasileira de Parasitologia Veterinária, v. 17, n. 1, p. 7-11, ORGANIZAÇÃO MUNDIAL DE LA SALUD (OMS). Lucha contra las leishmaniasis. Informe de um comité de expertos de la OMS. Serie de informes técnicos 793. Genebra, PINELLI, E.; RUTTEN, V. P. M. G.; RUITENBERG, E. J. Cellular immune response in canine leishmaniasis. In: INTERNATIONAL CANINE LEISHMANIASIS FORUM, Barcelona. Proceedings... Barcelona, p PINELLI, E.; KILLICK-KENDRICK, R.; WAGENAAR, J.; BERNADINA, W.; REAL, G.; RUITENBERG, J. Cellular and Humoral Immune Responses in Dogs Experimentally and Naturally Infected with Leishmania infantum. Infection and Immunity, v. 62, n. 1, p , QUINNEL, R. J.; COURTNAY, O.; DAVIDSON, S.; GARCEZ, L.; LAMBSON, B.; RAMOS, P.; SHAW, J. J.; DYE, C. Detection of Leishmania infantum by PCR, serology and cellular immune response in a cohort study of Brazilian dogs. Parasitology, v. 122, n. 4, p , REALE, S.; MAXIA, L.; VITALE, F.; GLORIOSO, N. S.; CARACAPPA, S.; VESGO, G. Detection of Leishmania infantum in Dogs by PCR with Lymph Node Aspirates and Blood. Journal of Clinical Microbiology, v. 37, n. 9, p , REIS, A. B.; MARTINS-FILHO, O. A.; TEIXEIRA-CARVALHO, A.; CARVALHO, M. G.; MAYRINK, W.; FRANÇA-SILVA, J. C.; GIUNCHETTI, R. C.; GENARO, O.; CORRÊA-OLIVEIRA, R. Parasite density and impaired biochemical hematological status are associated with severe clinical aspects of canine visceral leishmaniasis. Research Veterinary Science, v. 81, n. 1, p , REITHINGER, R.; QUINNELL, R. J.; ALEXANDER, B.; DAVIES, C. R. Rapid detection of Leishmania infantum infection in dogs: comparative study using na
87 86 immunochromatographic dipstick test, enzyme-linked immunosorbent assay and PCR. Journal of Clinical Microbiology, v. 40, n. 7, p , REY, L. Parasitos e doenças parasitárias do homem nas Américas e na África. In:. Parasitologia. 3. ed. Rio de Janeiro: Guanabara Koogan, p RODGERS, M. R.; POPPER, S. J.; WIRTH, D. F. Amplification of kinetoplast as tool in the detection and diagnosis of Leishmania. Experimental Parasitology, v. 71, n. 3, p , RODRIGUEZ, E. H. G.; BRITO, M. E. F.; MENDONÇA, M. G.; WERKHAUSER, R. P.; COUTINHO, E. M.; SOUZA, W. V.; ALBUQUERQUE, M. F. P. M.; JARDIM, M. L.; ABATH, F. G. C. Evaluation of PCR for diagnosis of american cutaneous leishmaniasis in an area of endemicity in Northeastern Brazil. Journal of Clinical Microbiology, v. 40, n. 10, p , ROSÁRIO, E. Y.; GENARO, O.; FRANÇA-SILVA, J. C.; COSTA, R. T.; MAYRINK, W.; REIS, A. B.; CARNEIRO, M. Evaluation of enzyme-linked immunosorbent assy using crude Leishmania and recombinant antigens as a diagnostic marker for canine visceral leishmaniasis. Memórias do Instituto Oswaldo Cruz, v. 100, n. 2, p , ROSSI, C. N. Ocorrência de Leishmania sp em gatos do Município de Araçatuba São Paulo Brasil f. Dissertação (Mestrado) - Universidade Estadual Paulista. Faculdade de Ciências Agrárias e Veterinárias, Jaboticabal, ROSS, R. Note on the bodies recently described by Leishman-Donovan and Further notes on Leishman s bodies. British Medical Journal, v. 2, p ROSYPAL, A. C.; CORTÉS-VECINO, J. A.; GENNARI, S. M.; DUBEY, J. P.; TIDWELL, R. R.; LINDSAY, D. S. Serological survey of Leishmania infantum and trypanosome cruzy in dogs from urban areas of Brazil and Colombia. Veterinary Parasitology, v. 149, n. 3-4, p , SANT ANA, J. A. P.; LIMA, W. G.; OLIVEIRA, M. R.; SIMÕES, L. A.; MICHALICK, M. S. M.; MELO, M. N.; TAFURI, W. L.; TAFURI, W. L. Hepatic granulomas in canine visceral leishmaniasis and clinical status. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 59, n. 5, p , SANTA ROSA, I. C. A.; OLIVEIRA, I. C. S. Leishmaniose Visceral. Clínica Veterinária, v. 2, n. 11, p , 1997.
88 87 SANTOS-GOMES, G. M.; CAMPINO, L.; ABRANCHES, P. Canine Experimental Infection: Intradermal Inoculation of Leishmania infantum Promastigotes. Memórias do Instituto Oswaldo Cruz, v. 95, n. 2, p , SÃO PAULO (Estado). Secretaria de Estado da Saúde. Leishmaniose visceral Americana: II Informe técnico. São Paulo: Secretaria de Estado da Saúde, p. Disponível em: < Acesso em 28 abr SCALONE, A.; LUNA, R.; OLIVA, G.; BALDI, L.; SATTA, G.; VESGO, G.; MIGNONE, W.; TURILLI, C.; MONDESIRE, R. R.; SIMPSON, D.; DONOGHUE, A. R.; FRANK, G. R.; GRADONI, L. Evaluation of the Leishmania recombinant k39 antigen as a diagnostic marker for canine leishmaniasis and validation of a standatized enzyme-linked immunosorbent assy. Veterinary Parasitology, v. 104, n. 4, p , SIDERIS, V.; PAPADOPOULOU, G.; DOTSIKA, E.; KARAGOUNI, E. Asymptomatic canine leishmaniasis in Greater Athens area, Greece, European Journal of Epidemiology, v. 3, n. 15, p , SILVA, E. S.; GONTIJO, C. M. F.; PACHECO, R. S.; FIUZA, V. O. P.; BRAZIL, R. P. Visceral leishmaniasis in the Metropolitan Region of Belo Horizonte, State of Minas Gerais, Brasil. Memórias do Instituto Oswaldo Cruz, v. 96, n. 3, p , SOLANO-GALLEGO, L.; MORELL, P.; ARBOIX, M.; ALBEROLA, J.; FERRER, L. Prevalence of Leishmania infantum infection in dogs living in an area of canine leishmaniasis endemicity using PCR on several tissues and serology. Journal of Clinical Microbiology. v. 39, n. 2, p , 2001(a). SOLANO-GALLEGO, L.; FERNANDEZ-BELLON, H.; MORELL, P.; FONDEVILLA, D.; ALBEROLA, J.; RAMIS, A.; FERRER, L. Histological and Immunoistochemical Study of Clinically Normal Skin of Leishmania infantuminfected Dogs. Journal Comparative of Pathology, v. 130, n. 1, p. 7-12, SOLANO-GALLEGO, L.; LlULL, J.; RAMOS, G.; RIERA, C. ARBOIX, M.; ALBEROLA, J.; FERRER, L. The Ibizian hound presents a predominantly cellular immune response against natural Leishmania infection. Veterinary Parasitology, v. 90, n. 1-2, p , SOLANO-GALLEGO, L.; RIERA, C.; ROURA, X.; INIESTA, L.; GALLEGO, M.; VALLADARES, J. E.; FISA, R.; CASTILLEJO, S.; ALBEROLA, J.; FERRER, L.; ARBOIX, M.; PORTÚS, M. Leishmaniasis infantum specific IgG, IgG1 and IgG2 antibody responses in healthy and ill dogs from endemic areas. Evolution
89 88 in the course of infection and after treatment. Veterinary Parasitology, v. 96, n. 4, p , 2001(b). STRAUSS-AYALI, D.; JAFFE, C. L.; BURSHTAIN, O.; GONEN, L.; BANETH, G. Polymerase chain Reaction Using Noninvasively Obtained Samples, for the Detection of Leishmania infantum DNA Dogs. The Journal of Infectious Diseases, v. 189, n. 9, p , SUNDAR, S.; RAY, M. Laboratory diagnosis of visceral leishmaniasis. Clinical and Diagnostic Laboratory Immunology, v. 9, n. 5, p , TAFURI, W. L.; OLIVEIRA, M. R.; MELO, M. N.; TAFURI, W. L. Canine visceral leishmaniosis: a remarkable histopathological picture of one case reported from Brazil. Veterinary Parasitology, v. 96, n. 3, p , TAFURI, W. L.; SANTOS, R. L.; ARANTES, R. M. E.;GONÇALVES, R.; MELO, M. N.; MICHALIK, M. S. M. An alternative immunohistochemical method for detecting Leishmania amastigotes in parafiin-embedded canine tissues. Journal of Immunological Methods, v. 1-2, n. 292, p , TAFURI, L. W.; TAFURI, L. W.; BARBOSA, A. J. A.; MICHALICK, M. S. M.; GENARO, O.; FRANÇA-SILVA, J. C.; MAYRINK, W.; NASCIMENTO, E. Histophatology and Immunocitochemical study of type 3 and type 4 complement receptors in the liver and spleen of dogs naturally and experimentally infected with Leishmania (Leishmania) chagasi. Revista do Instituto de Medicina Tropical de São Paulo, v. 38, n. 2, p , VEXENAT, A. C.; SANTANA, J. M.; TEIXEIRA, A. R. L. Cross-reactivity of antibodies in human infections by the kinetoplastid protozoa Trypanosoma cruzi, Leishmania chagasi and Leishmania (Viannia) braziliensis. Revista do Instituto de Medicina Tropical de São Paulo, v. 38, n. 3, p , XAVIER, S. C.; ANDRADE, H. M.; MONTE, S. J. H.; CHIARELLI, I. M.; LIMA, W. G.; MICHALICK, M. S. M.; TAFURI, W. L.; TAFURI, W. L. Comparison of paraffin embedded skin biopsies from different anatomical regions as sampling methods for detection of Leishmania infection in dog using histological, immunohistochemical and PCR methods. BMC Veterinary Research, v. 2, n. 17, p. 1-7, ZANETTE, M. F. Comparação entre os métodos de ELISA, imunofluorescência indireta e imunocromatografia para o diagnóstico da leishmaniose visceral canina. Dissertação (Mestrado) - Faculdade de Odontologia e Curso de Medicina Veterinária. Universidade Estadual Paulista (UNESP), Araçatuba, 2006.
90 89 ANEXOS ANEXO 1 - Escala de Níveis de ELISA (NE). NE Valor de absorbância (D.O.) 0,000-0,146 0,147-0,196 0,197-0,265 0,266-0,358 0,359-0,483 0,484-0,652 0,653-0,881 0,882-1,189 1,190-1,605 > 1,606
91 90 ANEXO 2 - Resultados dos exames sorológicos (ELISA indireto e RIFI) para o diagnóstico de Leishmaniose Visceral (LV) em 34 cães provenientes de área endêmica. (Araçatuba - SP, 2008) Exames Sorológicos para Diagnóstico da LVC Cães Sinais Clínicos ELISA / D.O. (NE) RIFI 01 A 0,253 (NE 2) Negativo Negativo 02 A 0,234 (NE 2) Negativo Negativo 03 O 0,361 (NE 4) Positivo 1: Positivo 04 A 0,262 (NE 2) Negativo Negativo 05 P 0,205 (NE 2) Negativo 1:160 - Positivo 06 O 0,403 (NE 4) Positivo Negativo 07 O 0,539 (NE 5) Positivo 1:1280 Positivo 08 O 0,677 (NE 6) Positivo 1:1280 Positivo 09 O 0,363 (NE 4)Positivo Negativo 10 O 0,431 (NE 4) Positivo 1:640 Positivo 11 O 0,174 (NE 1) Negativo Negativo 12 O 0,818 (NE 6) Positivo 1:1280 Positivo 13 A 0,264 (NE 2) Negativo Negativo 14 O 0,131 (NE 0) Negativo Negativo 15 O 0,401 (NE 4) Positivo 1:320 Positivo 16 P 0,682 (NE 6) Positivo 1:1280 Positivo 17 P 0,576 (NE 5) Positivo 1:1280 Positivo 18 A 0,134 (NE 0) Negativo Negativo 19 A 0,461 (NE 4) Positivo 1:1280 Positivo 20 A 0,155 (NE 1) Negativo Negativo 21 O 0,464 (NE 4) Positivo Negativo 22 A 0,158 (NE 1) Negativo Negativo 23 O 0,294 (NE 2) Negativo Negativo 24 P 0,728 (NE 6) Positivo 1:1280 Positivo 25 P 0,861 (NE 6) Positivo 1:280 Positivo 26 P 0,593 (NE 5) Positivo 1:1280 Positivo 27 P 0,558 (NE 5) Positivo 1:1280 positivo 28 P 0,177 (NE 0) Negativo Negativo 29 P 0,755 (NE 6) Positivo 1:1280 Positivo 30 P 0,362 (NE 4) Positivo 1:2560 Positivo 31 P 0,754 (NE 6) Positivo Negativo RIFI: Titulação de 1:40 a 1:1280 (Ponte de Corte = 1:40). ELISA (Ponte de corte NE = 3). A = Assintomático; MS = Moderadamente Sintomático; S = Sintomático.
92 91 Continuação ANEXO 2 - Resultados dos exames sorológicos (ELISA indireto e RIFI) para o diagnóstico de Leishmaniose Visceral (LV) em 34 cães provenientes de área endêmica. (Araçatuba - SP, 2008) Exames Sorológicos para Diagnóstico da LVC Cães Sinais Clínicos ELISA / D.O. (NE) RIFI 32 P 0,494 (NE 5) Positivo 1:1280 Positivo 33 O 0, 260 (NE 2) Negativo 1:320 positivo 34 O 0,531 (NE 5) Positivo 1:640 Positivo RIFI: Titulação de 1:40 a 1:1280 (Ponte de Corte = 1:40). ELISA (Ponte de corte NE = 3). A = Assintomático; MS = Moderadamente Sintomático; S = Sintomático.
93 92 A B C D E F ANEXO 3 - Sinais clínicos em cães polissintomáticos para LVC de área endêmica para a doença. A Magreza, B Alterações de pele, C Sinais oculares, D Lesões de ponta de orelha, E Onicogrifose, F - Baço com nódulo e esplenomegalia. (Araçatuba - SP, 2008).
Gênero Leishmania. século XIX a febre negra ou Kala-azar era temida na Índia. doença semelhante matava crianças no Mediterrâneo
 Leishmaniose Leishmaniose é um espectro de doenças produzidas por Leishmania sp. cuja manifestação clínica varia de infecção assintomática tica à morte Gênero Leishmania Histórico século XIX a febre negra
Leishmaniose Leishmaniose é um espectro de doenças produzidas por Leishmania sp. cuja manifestação clínica varia de infecção assintomática tica à morte Gênero Leishmania Histórico século XIX a febre negra
Leishmaniose. Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi, causador de Chagas).
 Leishmaniose Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Kinetoplastida (porque tem cinetoplasto) Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi,
Leishmaniose Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Kinetoplastida (porque tem cinetoplasto) Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi,
11 a 14 de dezembro de 2012 Campus de Palmas
 SENSIBILIDADE E ESPECIFICIDADE DA IMUNOFLUORESCÊNCIA INDIRETA UTILIZANDO CEPA DE LEISHMANIA SPP. ISOLADA DE CÃO DA CIDADE DE ARAGUAÍNA-TO NO DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA. Emerson Danillo
SENSIBILIDADE E ESPECIFICIDADE DA IMUNOFLUORESCÊNCIA INDIRETA UTILIZANDO CEPA DE LEISHMANIA SPP. ISOLADA DE CÃO DA CIDADE DE ARAGUAÍNA-TO NO DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA. Emerson Danillo
Palavras- chave: Leishmaniose; qpcr; cães. Keywords: Leishmaniases; qpcr; dogs.
 CONFIRMAÇÃO DO PRIMEIRO CASO DE INFECÇÃO CANINA POR Leishmania infantum NO MUNICÍPIO DE LAVRAS MG. Guilherme Campos de CASTRO¹; Carlos Alberto Silvestre SANTOS²; Thiago Pasqua NARCISO³, Ricardo Toshio
CONFIRMAÇÃO DO PRIMEIRO CASO DE INFECÇÃO CANINA POR Leishmania infantum NO MUNICÍPIO DE LAVRAS MG. Guilherme Campos de CASTRO¹; Carlos Alberto Silvestre SANTOS²; Thiago Pasqua NARCISO³, Ricardo Toshio
MÉTODOS DE DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA
 MÉTODOS DE DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA DOTTA, Silvia Cristina Nardy Discente do Curso de Medicina Veterinária da FAMED Garça LOT, Rômulo Francis Estangari ZAPPA, Vanessa Docentes da Associação
MÉTODOS DE DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA DOTTA, Silvia Cristina Nardy Discente do Curso de Medicina Veterinária da FAMED Garça LOT, Rômulo Francis Estangari ZAPPA, Vanessa Docentes da Associação
Relações Parasitas e Hospedeiros. Aula 06 Profº Ricardo Dalla Zanna
 Relações Parasitas e Hospedeiros Aula 06 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 2 Hemoparasitoses o Seção 2.1 Toxoplasmose e Doença de Chagas o Seção 2.2 Leishmaniose oseção 2.3 Malária
Relações Parasitas e Hospedeiros Aula 06 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 2 Hemoparasitoses o Seção 2.1 Toxoplasmose e Doença de Chagas o Seção 2.2 Leishmaniose oseção 2.3 Malária
SITUAÇÃO ATUAL DA LEISHMANIOSE VISCERAL NO ESTADO DO CEARÁ
 SITUAÇÃO ATUAL DA LEISHMANIOSE VISCERAL NO ESTADO DO CEARÁ Ana Paula Cunha Gomes Bouty Médica Veterinária Assessora Técnica GT-Leishmanioses NUVET/COVIG/SESA Leishmaniose Visceral A leishmaniose visceral
SITUAÇÃO ATUAL DA LEISHMANIOSE VISCERAL NO ESTADO DO CEARÁ Ana Paula Cunha Gomes Bouty Médica Veterinária Assessora Técnica GT-Leishmanioses NUVET/COVIG/SESA Leishmaniose Visceral A leishmaniose visceral
Complexo Leishmania donovani Forte tendência a visceralização (baço, fígado, medula óssea e órgãos linfóides).
 ORDEM: KINETOPLASTIDA FAMÍLIA: TRYPANOSOMATIDAE GÊNERO: Leishmania Classificações: A) SUBGÊNEROS: Leishmania Viannia B) COMPLEXOS: Parasitologia (Nutrição) Aula 4 (26/03) Leishmania Profa. Adriana Pittella
ORDEM: KINETOPLASTIDA FAMÍLIA: TRYPANOSOMATIDAE GÊNERO: Leishmania Classificações: A) SUBGÊNEROS: Leishmania Viannia B) COMPLEXOS: Parasitologia (Nutrição) Aula 4 (26/03) Leishmania Profa. Adriana Pittella
ASSOCIAÇÃO DA CARGA PARASITÁRIA NO EXAME CITOLÓGICO DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO COM O PERFIL CLÍNICO DE CÃES COM LEISHMANIOSE VISCERAL.
 ASSOCIAÇÃO DA CARGA PARASITÁRIA NO EXAME CITOLÓGICO DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO COM O PERFIL CLÍNICO DE CÃES COM LEISHMANIOSE VISCERAL. WALESSON DE ARAUJO ABREU 1 ; HELCILEIA DIAS SANTOS
ASSOCIAÇÃO DA CARGA PARASITÁRIA NO EXAME CITOLÓGICO DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO COM O PERFIL CLÍNICO DE CÃES COM LEISHMANIOSE VISCERAL. WALESSON DE ARAUJO ABREU 1 ; HELCILEIA DIAS SANTOS
Módulo: Nível Superior Dezembro/2014 GVDATA
 Módulo: Nível Superior Dezembro/2014 GVDATA Classificada no grupo de doenças extremamente negligenciadas Leishmanioses Volta Redonda Barra Mansa Rio de Janeiro Niterói Definição de Caso suspeito Todo individuo
Módulo: Nível Superior Dezembro/2014 GVDATA Classificada no grupo de doenças extremamente negligenciadas Leishmanioses Volta Redonda Barra Mansa Rio de Janeiro Niterói Definição de Caso suspeito Todo individuo
Trypanosoma cruzi Doença de Chagas
 Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
Aula Prática II: Protozoários - Família Trypanosomatidae.
 UFF Universidade Federal Fluminense. PUNF - Polo Universitário de Nova Friburgo. Curso de Biomedicina. Disciplina: Parasitologia Professora: Aline Caseca Volotão. Monitora: Lorraine Herdy Heggendornn.
UFF Universidade Federal Fluminense. PUNF - Polo Universitário de Nova Friburgo. Curso de Biomedicina. Disciplina: Parasitologia Professora: Aline Caseca Volotão. Monitora: Lorraine Herdy Heggendornn.
Universidade de São Paulo -USP. Leishmanioses. Luciana Benevides. Ribeirão Preto- 2013
 Universidade de São Paulo -USP Leishmanioses Luciana Benevides Ribeirão Preto- 2013 Tópicos abordados Definição Leishmaniose Vetores Parasita Manifestações clínicas Epidemiologia Classificação das doenças
Universidade de São Paulo -USP Leishmanioses Luciana Benevides Ribeirão Preto- 2013 Tópicos abordados Definição Leishmaniose Vetores Parasita Manifestações clínicas Epidemiologia Classificação das doenças
Agente etiológico. Leishmania brasiliensis
 Leishmaniose Agente etiológico A leishmaniose é causada por protozoários flagelados chamados Leishmania brasiliensis e Leishmania chagasi, que invadem e se reproduzem dentro das células que fazem parte
Leishmaniose Agente etiológico A leishmaniose é causada por protozoários flagelados chamados Leishmania brasiliensis e Leishmania chagasi, que invadem e se reproduzem dentro das células que fazem parte
Leishmanioses. Zoonoses e Administração em Saúde Pública Universidade Federal de Pelotas. Prof. Fábio Raphael Pascoti Bruhn
 Leishmanioses Zoonoses e Administração em Saúde Pública Universidade Federal de Pelotas Prof. Fábio Raphael Pascoti Bruhn Porque estudar a leishmaniose? Leishmaniose visceral Doença negligenciada associada
Leishmanioses Zoonoses e Administração em Saúde Pública Universidade Federal de Pelotas Prof. Fábio Raphael Pascoti Bruhn Porque estudar a leishmaniose? Leishmaniose visceral Doença negligenciada associada
LEISHMANIOSE CANINA Prof. Rafael Fighera
 LEISHMANIOSE CANINA Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Leishmaniose
LEISHMANIOSE CANINA Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Leishmaniose
TÍTULO: OCORRÊNCIA DE LEISHMANIA SP DETECTADA POR PCR EM LABORATÓRIO DE PATOLOGIA CLÍNICA PARTICULAR DE SP
 Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: OCORRÊNCIA DE LEISHMANIA SP DETECTADA POR PCR EM LABORATÓRIO DE PATOLOGIA CLÍNICA PARTICULAR
Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: OCORRÊNCIA DE LEISHMANIA SP DETECTADA POR PCR EM LABORATÓRIO DE PATOLOGIA CLÍNICA PARTICULAR
LEISHMANIOSE CANINA (continuação...)
 LEISHMANIOSE CANINA (continuação...) Prof. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria CRITÉRIOS CLÍNICOS PARA SUSPEITA DE
LEISHMANIOSE CANINA (continuação...) Prof. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria CRITÉRIOS CLÍNICOS PARA SUSPEITA DE
INFECÇÃO SIMULTÂNEA POR Leishmania chagasi E Ehrlichia canis EM CÃES NATURALMENTE INFECTADOS EM SÃO LUÍS, MARANHÃO, BRASIL
 INFECÇÃO SIMULTÂNEA POR Leishmania chagasi E Ehrlichia canis EM CÃES NATURALMENTE INFECTADOS EM SÃO LUÍS, MARANHÃO, BRASIL SIMULTANEOUS INFECTION BY Leishmania chagasi AND Ehrlichia canis IN NATURALLY
INFECÇÃO SIMULTÂNEA POR Leishmania chagasi E Ehrlichia canis EM CÃES NATURALMENTE INFECTADOS EM SÃO LUÍS, MARANHÃO, BRASIL SIMULTANEOUS INFECTION BY Leishmania chagasi AND Ehrlichia canis IN NATURALLY
LEISHMANIOSE VISCERAL REVISÃO DE LITERATURA VISCERAL LEISHMANIASIS REVIEW
 LEISHMANIOSE VISCERAL REVISÃO DE LITERATURA VISCERAL LEISHMANIASIS REVIEW BRANDÃO, Talita Galvão Evaristo Acadêmica do curso de Medicina Veterinária da Faculdade de Medicina Veterinária e Zootecnia de
LEISHMANIOSE VISCERAL REVISÃO DE LITERATURA VISCERAL LEISHMANIASIS REVIEW BRANDÃO, Talita Galvão Evaristo Acadêmica do curso de Medicina Veterinária da Faculdade de Medicina Veterinária e Zootecnia de
RESPONSABILIDADE NA CONDUTA TERAPÊUTICA EM CASOS DE LVC. Dra Liliane Carneiro Diretora do CENP/IEC/MS CRMV/PA Nº 1715
 RESPONSABILIDADE NA CONDUTA TERAPÊUTICA EM CASOS DE LVC Dra Liliane Carneiro Diretora do CENP/IEC/MS CRMV/PA Nº 1715 A leishmaniose visceral canina (LVC) é uma doença infecciosa provocada pelo protozoário
RESPONSABILIDADE NA CONDUTA TERAPÊUTICA EM CASOS DE LVC Dra Liliane Carneiro Diretora do CENP/IEC/MS CRMV/PA Nº 1715 A leishmaniose visceral canina (LVC) é uma doença infecciosa provocada pelo protozoário
Diagnóstico da Leishmaniose Visceral Canina pelas técnicas de imunoistoquímica e PCR em tecidos cutâneos em associação com a RIFI e ELISA-teste
 doi:0.4322/rbpv.090006 Rev. Bras. Parasitol. Vet., Jaboticabal, v. 9, n., p. 34-40, jan.-mar. 200 ISSN 003-846X (impresso) / ISSN 984-296 (eletrônico) Artigo Review Completo Article Diagnóstico da Leishmaniose
doi:0.4322/rbpv.090006 Rev. Bras. Parasitol. Vet., Jaboticabal, v. 9, n., p. 34-40, jan.-mar. 200 ISSN 003-846X (impresso) / ISSN 984-296 (eletrônico) Artigo Review Completo Article Diagnóstico da Leishmaniose
NOVO CONCEITO. Nova proposta para a prevenção da Leishmaniose Visceral Canina UMA DUPLA PROTEÇÃO PARA OS CÃES. CONTRA O VETOR E O PATÓGENO!
 NOVO CONCEITO Nova proposta para a prevenção da Leishmaniose Visceral Canina UMA DUPLA PROTEÇÃO PARA OS CÃES. CONTRA O VETOR E O PATÓGENO! Repelente de uso tópico para cães Vacina recombinante contra Leishmaniose
NOVO CONCEITO Nova proposta para a prevenção da Leishmaniose Visceral Canina UMA DUPLA PROTEÇÃO PARA OS CÃES. CONTRA O VETOR E O PATÓGENO! Repelente de uso tópico para cães Vacina recombinante contra Leishmaniose
AVALIAÇÃO HISTOLÓGICA DE LEISHMANIOSE VISCERAL EM GATOS DOMÉSTICOS (Felis catus domesticus).
 AVALIAÇÃO HISTOLÓGICA DE LEISHMANIOSE VISCERAL EM GATOS DOMÉSTICOS (Felis catus domesticus). Alves, M. L.¹,* ; Alves-Martin, M. F.²; Silva, D. T.¹; Ferreira, A. G. 1 ; Lucheis, S. B.³; Buzetti, W. A. S.¹;
AVALIAÇÃO HISTOLÓGICA DE LEISHMANIOSE VISCERAL EM GATOS DOMÉSTICOS (Felis catus domesticus). Alves, M. L.¹,* ; Alves-Martin, M. F.²; Silva, D. T.¹; Ferreira, A. G. 1 ; Lucheis, S. B.³; Buzetti, W. A. S.¹;
Métodos de Pesquisa e Diagnóstico dos Vírus
 Métodos de Pesquisa e Diagnóstico dos Vírus Estratégias Isolamento em sistemas vivos Pesquisa de antígeno viral Pesquisa de anticorpos Pesquisa do ácido nucléico viral (DNA ou RNA) Pré requisitos para
Métodos de Pesquisa e Diagnóstico dos Vírus Estratégias Isolamento em sistemas vivos Pesquisa de antígeno viral Pesquisa de anticorpos Pesquisa do ácido nucléico viral (DNA ou RNA) Pré requisitos para
Artigo Completo. Resumo. Abstract
 Rev. Bras. Parasitol. Vet., Jaboticabal, v. 18, n. 1, p. 27-33, jan.-mar. 2009 ISSN 1984-2961 (eletrônico) Artigo Completo Exames parasitológicos, imunoistoquímicos e histopatológicos para detecção de
Rev. Bras. Parasitol. Vet., Jaboticabal, v. 18, n. 1, p. 27-33, jan.-mar. 2009 ISSN 1984-2961 (eletrônico) Artigo Completo Exames parasitológicos, imunoistoquímicos e histopatológicos para detecção de
Eficiência da PCR convencional na detecção de Leishmania spp em sangue, pele e tecidos linfoides
 Eficiência da PCR convencional na detecção de Leishmania spp em sangue, pele e tecidos linfoides Aluna: Carina de Mattos Soares Orientadora: Dra Cídia Vasconcellos Supervisora: Dra Vânia Lucia Ribeiro
Eficiência da PCR convencional na detecção de Leishmania spp em sangue, pele e tecidos linfoides Aluna: Carina de Mattos Soares Orientadora: Dra Cídia Vasconcellos Supervisora: Dra Vânia Lucia Ribeiro
26 a 29 de novembro de 2013 Campus de Palmas
 SENSIBILIDADE E ESPECIFICIDADE DA REAÇÃO EM CADEIA DE POLIMERASE (PCR) UTILIZANDO AMOSTRAS DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO DE CÃES PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL Gessica Hoanna Cunha
SENSIBILIDADE E ESPECIFICIDADE DA REAÇÃO EM CADEIA DE POLIMERASE (PCR) UTILIZANDO AMOSTRAS DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO DE CÃES PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL Gessica Hoanna Cunha
LUIZ CLAUDIO FERREIRA
 COMPARAÇÃO DA SENSIBILIDADE ENTRE AS TÉCNICAS DE HIBRIDIZAÇÃO IN SITU, HISTOPATOLOGIA E IMUNO-HISTOQUÍMICA PARA DIAGNÓSTICO DE LEISHMANIOSE TEGUMENTAR AMERICANA EM AMOSTRAS DE PELE LUIZ CLAUDIO FERREIRA
COMPARAÇÃO DA SENSIBILIDADE ENTRE AS TÉCNICAS DE HIBRIDIZAÇÃO IN SITU, HISTOPATOLOGIA E IMUNO-HISTOQUÍMICA PARA DIAGNÓSTICO DE LEISHMANIOSE TEGUMENTAR AMERICANA EM AMOSTRAS DE PELE LUIZ CLAUDIO FERREIRA
INFORME TÉCNICO PARA MÉDICOS VETERINÁRIOS LEISHMANIOSE VISCERAL AMERICANA
 PREFEITURA MUNICIPAL DE CAMPINAS SECRETARIA MUNICIPAL DE SAÚDE COORDENADORIA DE VIGILÂNCIA EM SAÚDE Avenida Anchieta, 200 11º andar Centro CEP: 13015-904 Tel. (19) 2116-0187 / 0286 E-mail: covisa@campinas.sp.gov.br
PREFEITURA MUNICIPAL DE CAMPINAS SECRETARIA MUNICIPAL DE SAÚDE COORDENADORIA DE VIGILÂNCIA EM SAÚDE Avenida Anchieta, 200 11º andar Centro CEP: 13015-904 Tel. (19) 2116-0187 / 0286 E-mail: covisa@campinas.sp.gov.br
FAMÍLIA TRYPANOSOMATIDAE
 FAMÍLIA TRYPANOSOMATIDAE CLASSIFICAÇÃO: FILO SARCOMASTIGOPHORA(flagelos, pseudópodes ou ambos) SUBFILO MASTIGOPHORA (protozoários com 1 ou + flagelos) FAMÍLIA TRYPANOSOMATIDAE: São nove gêneros que parasitam
FAMÍLIA TRYPANOSOMATIDAE CLASSIFICAÇÃO: FILO SARCOMASTIGOPHORA(flagelos, pseudópodes ou ambos) SUBFILO MASTIGOPHORA (protozoários com 1 ou + flagelos) FAMÍLIA TRYPANOSOMATIDAE: São nove gêneros que parasitam
Leishmaniose Tegumentar Americana
 Leishmaniose Tegumentar Americana (Leishmania) Prfª. M.Sc. Yara Bandeira Azevedo UNIFAN Leishmania Filo: Sarcomastigophora Subfilo: Mastigophora Ordem: Kinetoplastida Família: Trypanosomatidae Gênero:
Leishmaniose Tegumentar Americana (Leishmania) Prfª. M.Sc. Yara Bandeira Azevedo UNIFAN Leishmania Filo: Sarcomastigophora Subfilo: Mastigophora Ordem: Kinetoplastida Família: Trypanosomatidae Gênero:
Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2017
 Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2017 OMS doenças tropicais negligenciadas Bouba Doença de Chagas Dengue Dracunculíase Equinococose (Hidatidose)
Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2017 OMS doenças tropicais negligenciadas Bouba Doença de Chagas Dengue Dracunculíase Equinococose (Hidatidose)
DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA PELAS TÉCNICAS DE IMUNOISTOQUÍMICA E PCR EM TECIDOS CUTÂNEOS EM ASSOCIAÇÃO COM A RIFI E ELISA-TESTE
 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE ODONTOLOGIA - CAMPUS DE ARAÇATUBA Curso de Medicina Veterinária DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA PELAS TÉCNICAS DE IMUNOISTOQUÍMICA
UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE ODONTOLOGIA - CAMPUS DE ARAÇATUBA Curso de Medicina Veterinária DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA PELAS TÉCNICAS DE IMUNOISTOQUÍMICA
PUBVET, Publicações em Medicina Veterinária e Zootecnia. Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil
 PUBVET, Publicações em Medicina Veterinária e Zootecnia. Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil Otamires Alves da Silva* e Geovania Maria da Silva
PUBVET, Publicações em Medicina Veterinária e Zootecnia. Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil Otamires Alves da Silva* e Geovania Maria da Silva
14/06/12. Esta palestra não poderá ser reproduzida sem a referência do autor
 14/06/12 Esta palestra não poderá ser reproduzida sem a referência do autor ESTA PALESTRA NÃO PODERÁ SER REPRODUZIDA SEM A REFÊNCIA DO AUTOR. LEISHMANIOSE VISCERAL TRANSMISSÃO EM BANCO DE SANGUE Dra. Margarida
14/06/12 Esta palestra não poderá ser reproduzida sem a referência do autor ESTA PALESTRA NÃO PODERÁ SER REPRODUZIDA SEM A REFÊNCIA DO AUTOR. LEISHMANIOSE VISCERAL TRANSMISSÃO EM BANCO DE SANGUE Dra. Margarida
RAFAEL ANTONIO DO NASCIMENTO RAMOS
 RAFAEL ANTONIO DO NASCIMENTO RAMOS Avaliação da Reação em Cadeia da Polimerase (PCR) e da PCR em tempo real (qpcr) no diagnóstico da Leishmaniose Visceral Canina utilizando diferentes amostras biológicas
RAFAEL ANTONIO DO NASCIMENTO RAMOS Avaliação da Reação em Cadeia da Polimerase (PCR) e da PCR em tempo real (qpcr) no diagnóstico da Leishmaniose Visceral Canina utilizando diferentes amostras biológicas
Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain
 67 4.2 Estudo II Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain Enquanto anticorpos anti-t. gondii são
67 4.2 Estudo II Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain Enquanto anticorpos anti-t. gondii são
Ciclo. A Leishmaniose. Leevre. A Leishmaniose canina é causada, no Brasil, pela Leishmania infantum chagasi (L. chagasi), um protozoário intracelular
 é a coleira da Ourofino Saúde Animal que acompanha o cão para o que der e vier, protegendo-o das picadas do vetor da Leishmaniose e de infestações por carrapatos e pulgas nos ambientes que ele frequenta.
é a coleira da Ourofino Saúde Animal que acompanha o cão para o que der e vier, protegendo-o das picadas do vetor da Leishmaniose e de infestações por carrapatos e pulgas nos ambientes que ele frequenta.
LEISHMANIOSES 31/08/2015. Leishmanioses: etiologia. Leishmanioses: distribuição mundial
 LEISHMANIOSES L E I S H M A N I O S E T E G U M E N T A R A M E R I C A N A L E I S H M A N I O S E V I S C E R A L http://www.zoonoses.org.br/ Fonte: http://www.mdsaude.com/ Fonte: http://www.wspabrasil.org/
LEISHMANIOSES L E I S H M A N I O S E T E G U M E N T A R A M E R I C A N A L E I S H M A N I O S E V I S C E R A L http://www.zoonoses.org.br/ Fonte: http://www.mdsaude.com/ Fonte: http://www.wspabrasil.org/
Leishmaniose Visceral
 Leishmaniose Visceral Introdução As Leishmanioses são protozooses de grande importância em nosso meio Causadas por protozoários do gênero Leishmania São zoonoses e que afetam o homem acidentalmente Trasmitidas
Leishmaniose Visceral Introdução As Leishmanioses são protozooses de grande importância em nosso meio Causadas por protozoários do gênero Leishmania São zoonoses e que afetam o homem acidentalmente Trasmitidas
Nota Técnica nº 13 LEISHIMANIOSE VICERAL
 CENTRO DE INFORMAÇÕES ESTRATÉGICAS E RESPOSTA EM VIGILÂNCIA EM SAÚDE Nota Técnica nº 13 LEISHIMANIOSE VICERAL Centro de Informações Estratégicas e Resposta em Vigilância em Saúde Departamento de Epidemiologia/
CENTRO DE INFORMAÇÕES ESTRATÉGICAS E RESPOSTA EM VIGILÂNCIA EM SAÚDE Nota Técnica nº 13 LEISHIMANIOSE VICERAL Centro de Informações Estratégicas e Resposta em Vigilância em Saúde Departamento de Epidemiologia/
SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE EM CÃES ERRANTES NO MUNICÍPIO DE IJUÍ RIO GRANDE DO SUL 1
 SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE EM CÃES ERRANTES NO MUNICÍPIO DE IJUÍ RIO GRANDE DO SUL 1 Franciele Ceratti Dortzbacher 2, Francini Palha 3, Leonardo Sasso Bernardi 4, Luciana Mori Viero 5, Cristiane
SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE EM CÃES ERRANTES NO MUNICÍPIO DE IJUÍ RIO GRANDE DO SUL 1 Franciele Ceratti Dortzbacher 2, Francini Palha 3, Leonardo Sasso Bernardi 4, Luciana Mori Viero 5, Cristiane
Medico Vet..: HAYANNE K. N. MAGALHÃES Idade...: 11 Ano(s) CRMV...: 2588 Data da conclusão do laudo.:05/08/2019
 Análise Clínica No.005053808 Data de Coleta: 18/07/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Análise Clínica No.005053808 Data de Coleta: 18/07/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
COMPARAÇÃO DOS RESULTADOS DOS MÉTODOS DE IMUNOFLUORESCÊNCIA INDIRETA E ELISA INDIRETO NO DIAGNÓSTICO SOROLÓGICO DA LEISHMANIOSE FELINA
 COMPARAÇÃO DOS RESULTADOS DOS MÉTODOS DE IMUNOFLUORESCÊNCIA INDIRETA E ELISA INDIRETO NO DIAGNÓSTICO SOROLÓGICO DA LEISHMANIOSE FELINA COMPARISON THE RESULTS OF THE INDIRECT IMMUNOFLUORESCENCE AND INDIRECT
COMPARAÇÃO DOS RESULTADOS DOS MÉTODOS DE IMUNOFLUORESCÊNCIA INDIRETA E ELISA INDIRETO NO DIAGNÓSTICO SOROLÓGICO DA LEISHMANIOSE FELINA COMPARISON THE RESULTS OF THE INDIRECT IMMUNOFLUORESCENCE AND INDIRECT
Unir forças para não expandir
 Alerta à População A leishmaniose visceral (LV) é uma doença grave, causada por um parasito transmitido para pessoas e cães por meio da picada de um inseto (vetor) muito pequeno, conhecido como mosquito
Alerta à População A leishmaniose visceral (LV) é uma doença grave, causada por um parasito transmitido para pessoas e cães por meio da picada de um inseto (vetor) muito pequeno, conhecido como mosquito
RESUMOS DE PROJETOS
 181 RESUMOS DE PROJETOS... 182 RESUMOS DE PROJETOS 182 ATIVIDADE ANTIPARASITÁRIA DE BYRSONIMA INTERMEDIA SOBRE FORMAS EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 183 EFEITO IN VITRO DE INIBIDORES DE PROTEASES
181 RESUMOS DE PROJETOS... 182 RESUMOS DE PROJETOS 182 ATIVIDADE ANTIPARASITÁRIA DE BYRSONIMA INTERMEDIA SOBRE FORMAS EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 183 EFEITO IN VITRO DE INIBIDORES DE PROTEASES
Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2018
 Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2018 OMS doenças tropicais negligenciadas Bouba Doença de Chagas Dengue Dracunculíase Equinococose (Hidatidose)
Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2018 OMS doenças tropicais negligenciadas Bouba Doença de Chagas Dengue Dracunculíase Equinococose (Hidatidose)
[ERLICHIOSE CANINA]
![[ERLICHIOSE CANINA] [ERLICHIOSE CANINA]](/thumbs/46/23432057.jpg) [ERLICHIOSE CANINA] 2 Erlichiose Canina A Erlichiose Canina é uma hemoparasitose causada pela bactéria Erlichia sp. Essa bactéria parasita, geralmente, os glóbulos brancos (neste caso, Erlichia canis)
[ERLICHIOSE CANINA] 2 Erlichiose Canina A Erlichiose Canina é uma hemoparasitose causada pela bactéria Erlichia sp. Essa bactéria parasita, geralmente, os glóbulos brancos (neste caso, Erlichia canis)
Palavras-chave: Leishmaniose, canino, sistema nervoso central.
 MENINGOENCEFALITE GRANULOMATOSA POR Leishmania ssp. EM CÃO: RELATO DE CASO Helen Cristina Gomes de LIMA 1* ; Kalinne Stephanie BEZERRA 1 ; Luciana Curtio SOARES 1 ; Gabriela Morais MADRUGA 1 ;.Aline de
MENINGOENCEFALITE GRANULOMATOSA POR Leishmania ssp. EM CÃO: RELATO DE CASO Helen Cristina Gomes de LIMA 1* ; Kalinne Stephanie BEZERRA 1 ; Luciana Curtio SOARES 1 ; Gabriela Morais MADRUGA 1 ;.Aline de
Leishmanioses. Silvia Reni B. Uliana ICB - USP
 Leishmanioses Silvia Reni B. Uliana ICB - USP Síndromes clínicas Localizada L. braziliensis L. amazonensis etc. Leishmaniose tegumentar Mucocutânea Disseminada L. braziliensis L. braziliensis Difusa L.
Leishmanioses Silvia Reni B. Uliana ICB - USP Síndromes clínicas Localizada L. braziliensis L. amazonensis etc. Leishmaniose tegumentar Mucocutânea Disseminada L. braziliensis L. braziliensis Difusa L.
Análise Clínica No Data de Coleta: 22/03/2019 1/5 Prop...: RAIMUNDO JURACY CAMPOS FERRO Especie...: CANINA Fone...: 0
 Análise Clínica No.005048230 Data de Coleta: 22/03/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Análise Clínica No.005048230 Data de Coleta: 22/03/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Toxoplasmose. Zoonose causada por protozoário Toxoplasma gondii. Único agente causal da toxoplasmose. Distribuição geográfica: Mundial
 Toxoplasmose Zoonose causada por protozoário Toxoplasma gondii Único agente causal da toxoplasmose Distribuição geográfica: Mundial Hospedeiros: a) Hospedeiros finais ou definitivos: - felideos (gato doméstico
Toxoplasmose Zoonose causada por protozoário Toxoplasma gondii Único agente causal da toxoplasmose Distribuição geográfica: Mundial Hospedeiros: a) Hospedeiros finais ou definitivos: - felideos (gato doméstico
MALÁRIA. Agentes etiológicos (Protozoários) Plasmodium vivax Plasmodium falciparum Plasmodium malariae Plasmodium ovale
 MALÁRIA Agentes etiológicos (Protozoários) Plasmodium vivax Plasmodium falciparum Plasmodium malariae Plasmodium ovale Vetores (Insetos) Culicidae gênero Anopheles A. (Nyssorhincus) darlingi A. (N) aquasalis
MALÁRIA Agentes etiológicos (Protozoários) Plasmodium vivax Plasmodium falciparum Plasmodium malariae Plasmodium ovale Vetores (Insetos) Culicidae gênero Anopheles A. (Nyssorhincus) darlingi A. (N) aquasalis
ALERTA EPIDEMIOLÓGICO
 ALERTA EPIDEMIOLÓGICO Gerência de Vigilância Epidemiológica - Diretoria de Vigilância em Saúde SMS Florianópolis, SC 13 de dezembro de 2017 Leishmaniose Visceral Humana Em 08/12/2017 foi confirmado mais
ALERTA EPIDEMIOLÓGICO Gerência de Vigilância Epidemiológica - Diretoria de Vigilância em Saúde SMS Florianópolis, SC 13 de dezembro de 2017 Leishmaniose Visceral Humana Em 08/12/2017 foi confirmado mais
Profa. Carolina G. P. Beyrodt
 Profa. Carolina G. P. Beyrodt Agente etiológico: Toxoplasma gondii (Protozoário coccídeo do Filo Apicomplexa) Histórico Isolado em 1908 de um roedor do deserto: Ctenodactylus gondii 1923 descrição do primeiro
Profa. Carolina G. P. Beyrodt Agente etiológico: Toxoplasma gondii (Protozoário coccídeo do Filo Apicomplexa) Histórico Isolado em 1908 de um roedor do deserto: Ctenodactylus gondii 1923 descrição do primeiro
Semi-Árido (UFERSA). 2 Farmacêutico bioquímico, Mestre em Ciência Animal. UFERSA 3
 DIAGNÓSTICO CITOPATOLÓGICO DE LEISHMANIOSE VISCERAL CANINA EM REGIÃO ENDÊMICA DO NORDESTE DO BRASIL CITOPATHOLOGICAL DIAGNOSIS OF CANINE VISCERAL LEISHMANIOSIS IN NORTHEAST BRAZIL'S ENDEMIC REGION Yannara
DIAGNÓSTICO CITOPATOLÓGICO DE LEISHMANIOSE VISCERAL CANINA EM REGIÃO ENDÊMICA DO NORDESTE DO BRASIL CITOPATHOLOGICAL DIAGNOSIS OF CANINE VISCERAL LEISHMANIOSIS IN NORTHEAST BRAZIL'S ENDEMIC REGION Yannara
Audiência Pública 17/08/2015. Projeto de Lei 1.738/2011
 Audiência Pública 17/08/2015 Projeto de Lei 1.738/2011 Prof. Vitor Márcio Ribeiro PUC Minas A LEISHMANIOSE VISCERAL NO BRASIL O primeiro caso no Brasil foi descrito por Migone L.E.,em 1913 O paciente era
Audiência Pública 17/08/2015 Projeto de Lei 1.738/2011 Prof. Vitor Márcio Ribeiro PUC Minas A LEISHMANIOSE VISCERAL NO BRASIL O primeiro caso no Brasil foi descrito por Migone L.E.,em 1913 O paciente era
RESUMOS COM RESULTADOS ARTIGOS COMPLETOS (RESUMOS)
 217 RESUMOS COM RESULTADOS... 218 ARTIGOS COMPLETOS (RESUMOS)... 220 RESUMOS COM RESULTADOS 218 ATIVIDADE ANTIPARASITÁRIA DA VIOLETA GENCIANA SOBRE EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 219 219 Pesquisa
217 RESUMOS COM RESULTADOS... 218 ARTIGOS COMPLETOS (RESUMOS)... 220 RESUMOS COM RESULTADOS 218 ATIVIDADE ANTIPARASITÁRIA DA VIOLETA GENCIANA SOBRE EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 219 219 Pesquisa
PLANILHA GERAL - BASES BIOLÓGICAS DA PRÁTICA MÉDICA III 2º 2018
 PLANILHA GERAL - BASES BIOLÓGICAS DA MÉDICA III 2º 2018 Dia Data Hora Professor/GAD Sala Conteúdo Módulo Aula inaugural: Apresentação da UC, Plano de Ensino e Critérios 07:05 de Avaliação Regulação genética
PLANILHA GERAL - BASES BIOLÓGICAS DA MÉDICA III 2º 2018 Dia Data Hora Professor/GAD Sala Conteúdo Módulo Aula inaugural: Apresentação da UC, Plano de Ensino e Critérios 07:05 de Avaliação Regulação genética
Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública
 Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública LEISHMANIOSE CANINA Leishmanose Tegumentar America LTA Leishmania Visceral - LV Adivaldo
Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública LEISHMANIOSE CANINA Leishmanose Tegumentar America LTA Leishmania Visceral - LV Adivaldo
Imunologia. Diferenciar as células e os mecanismos efetores do Sistema imune adquirido do sistema imune inato. AULA 02: Sistema imune adquirido
 Imunologia AULA 02: Sistema imune adquirido Professor Luiz Felipe Leomil Coelho Departamento de Ciências Biológicas E-mail: coelho@unifal-mg.edu.br OBJETIVO Diferenciar as células e os mecanismos efetores
Imunologia AULA 02: Sistema imune adquirido Professor Luiz Felipe Leomil Coelho Departamento de Ciências Biológicas E-mail: coelho@unifal-mg.edu.br OBJETIVO Diferenciar as células e os mecanismos efetores
PUBVET, Publicações em Medicina Veterinária e Zootecnia.
 PUBVET, Publicações em Medicina Veterinária e Zootecnia. O papel do Rhipicephalus sanguineus na transmissão da Leishmaniose Visceral Canina: aspectos epidemiológicos. Otamires Alves da Silva 1 e Geovania
PUBVET, Publicações em Medicina Veterinária e Zootecnia. O papel do Rhipicephalus sanguineus na transmissão da Leishmaniose Visceral Canina: aspectos epidemiológicos. Otamires Alves da Silva 1 e Geovania
Febre maculosa febre carrapato
 A febre maculosa, também conhecida como febre do carrapato é uma doença infecciosa aguda causada pela bactéria Rickettsia rickettsii, que é intracelular obrigatória e tem como vetor biológico o carrapato
A febre maculosa, também conhecida como febre do carrapato é uma doença infecciosa aguda causada pela bactéria Rickettsia rickettsii, que é intracelular obrigatória e tem como vetor biológico o carrapato
1º EM BIOLOGIA PROFESSOR JOÃO C5, 8 H19, 29, 30 PROTOZOOSES. Biologia Professor João
 1º EM BIOLOGIA PROFESSOR JOÃO PROTOZOOSES Biologia Professor João DOENÇA DE CHAGAS Sinônimo: Tripanossomíase americana Agente Etiológico: Trypanosoma cruzi (protozoário flagelado) Vetor (transmissor):
1º EM BIOLOGIA PROFESSOR JOÃO PROTOZOOSES Biologia Professor João DOENÇA DE CHAGAS Sinônimo: Tripanossomíase americana Agente Etiológico: Trypanosoma cruzi (protozoário flagelado) Vetor (transmissor):
VIGILÂNCIA EPIDEMIOLÓGICA DAS DOENÇAS NEGLIGENCIADAS E DAS DOENÇAS RELACIONADAS À POBREZA 2018
 VIGILÂNCIA EPIDEMIOLÓGICA DAS DOENÇAS NEGLIGENCIADAS E DAS DOENÇAS RELACIONADAS À POBREZA 2018 OMS doenças tropicais negligenciadas Bouba* Doença de Chagas Dengue Dracunculíase* Equinococose (Hidatidose)
VIGILÂNCIA EPIDEMIOLÓGICA DAS DOENÇAS NEGLIGENCIADAS E DAS DOENÇAS RELACIONADAS À POBREZA 2018 OMS doenças tropicais negligenciadas Bouba* Doença de Chagas Dengue Dracunculíase* Equinococose (Hidatidose)
LEISHMANIOSE LEISHMANIOSE LEISHMANIOSE LEISHMANIOSE. Protista SUB-REINO: REINO: Protozoa FILO: Sarcomastigophora SUBFILO: Mastigophora CLASSE:
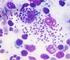 PROTOZOÁRIOS Sarcomastigophora Apicomplexa Ciliophora Mastigophora Sarcodina Babesia Balantidium Trypanosoma Giardia Entamoeba Acanthamoeba Naegleria Eimeria Isospora Sarcocystis Trichomonas Endolimax
PROTOZOÁRIOS Sarcomastigophora Apicomplexa Ciliophora Mastigophora Sarcodina Babesia Balantidium Trypanosoma Giardia Entamoeba Acanthamoeba Naegleria Eimeria Isospora Sarcocystis Trichomonas Endolimax
PERFIL EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL CANINA NO MUNICÍPIO DE SELVÍRIA/MS DE 2011 A 2015
 PERFIL EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL CANINA NO MUNICÍPIO DE SELVÍRIA/MS DE 2011 A 2015 Talita Barbosa de Amorim Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas FITL/AEMS
PERFIL EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL CANINA NO MUNICÍPIO DE SELVÍRIA/MS DE 2011 A 2015 Talita Barbosa de Amorim Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas FITL/AEMS
Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Grupo de Pesquisa de Protozoários Coccídeos. Prof. Luís Fernando Pita Gondim
 Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Grupo de Pesquisa de Protozoários Coccídeos Prof. Luís Fernando Pita Gondim Email: pita@ufba.br Sarcocystis neurona (principal agente)
Universidade Federal da Bahia Escola de Medicina Veterinária e Zootecnia Grupo de Pesquisa de Protozoários Coccídeos Prof. Luís Fernando Pita Gondim Email: pita@ufba.br Sarcocystis neurona (principal agente)
PREFEITURA MUNICIPAL DE RIO BONITO- RJ DECISÃO DOS RECURSOS CONTRA GABARITO PRELIMINAR I DOS RECURSOS
 PREFEITURA MUNICIPAL DE RIO BONITO- RJ DECISÃO DOS RECURSOS CONTRA GABARITO PRELIMINAR I DOS RECURSOS Trata-se de recursos interpostos pelos candidatos infra relacionados, concorrentes ao cargo, VETERINÁRIO
PREFEITURA MUNICIPAL DE RIO BONITO- RJ DECISÃO DOS RECURSOS CONTRA GABARITO PRELIMINAR I DOS RECURSOS Trata-se de recursos interpostos pelos candidatos infra relacionados, concorrentes ao cargo, VETERINÁRIO
ESTUDO DO PERFIL EPIDEMIOLÓGICO DA LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE
 ESTUDO DO PERFIL EPIDEMIOLÓGICO DA LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE Raquel Costa e Silva 1 ; Karla Gomes Cunha 2 ; Gerlane Guedes Delfino da Silva³; Lucas Ermando Ricardo da Silva 4 ; Josimar dos
ESTUDO DO PERFIL EPIDEMIOLÓGICO DA LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE Raquel Costa e Silva 1 ; Karla Gomes Cunha 2 ; Gerlane Guedes Delfino da Silva³; Lucas Ermando Ricardo da Silva 4 ; Josimar dos
Simone Baldini Lucheis
 Simone Baldini Lucheis Tripanossomatídeos em cães de pacientes chagásicos crônicos, habitantes de Botucatu (SP) e região, avaliados pelos métodos de xenodiagnóstico artificial, hemocultura e Reação em
Simone Baldini Lucheis Tripanossomatídeos em cães de pacientes chagásicos crônicos, habitantes de Botucatu (SP) e região, avaliados pelos métodos de xenodiagnóstico artificial, hemocultura e Reação em
PLANILHA GERAL - BASES BIOLÓGICAS DA PRÁTICA MÉDICA III - 1º 2018
 PLANILHA GERAL - BASES BIOLÓGICAS DA MÉDICA III - 1º 2018 Dia Data Hora Professor/GAD Sala Conteúdo Módulo Aula inaugural: Apresentação da UC, Plano de Ensino e Critérios de Paulo Granjeiro - GAD Bioquímica
PLANILHA GERAL - BASES BIOLÓGICAS DA MÉDICA III - 1º 2018 Dia Data Hora Professor/GAD Sala Conteúdo Módulo Aula inaugural: Apresentação da UC, Plano de Ensino e Critérios de Paulo Granjeiro - GAD Bioquímica
VANESSA FIGUEREDO PEREIRA. Uso de suabe conjuntival na detecção de Leishmaniose Visceral Canina por PCR
 VANESSA FIGUEREDO PEREIRA Uso de suabe conjuntival na detecção de Leishmaniose Visceral Canina por PCR Pirassununga 2013 VANESSA FIGUEREDO PEREIRA Uso de suabe conjuntival na detecção de Leishmaniose Visceral
VANESSA FIGUEREDO PEREIRA Uso de suabe conjuntival na detecção de Leishmaniose Visceral Canina por PCR Pirassununga 2013 VANESSA FIGUEREDO PEREIRA Uso de suabe conjuntival na detecção de Leishmaniose Visceral
MSc. Romeu Moreira dos Santos
 MSc. Romeu Moreira dos Santos 2017 2015 INTRODUÇÃO As células do sistema imune (SI) inato e adaptativo estão presentes como: células circulantes no sangue e na linfa; aglomerados anatomicamente definidos
MSc. Romeu Moreira dos Santos 2017 2015 INTRODUÇÃO As células do sistema imune (SI) inato e adaptativo estão presentes como: células circulantes no sangue e na linfa; aglomerados anatomicamente definidos
Giardíase Giardia lamblia
 UNIVERSIDADE FEDERAL DO PAMPA Campus Itaqui Curso de Nutrição Parasitologia Giardíase Giardia lamblia Mestrando : Félix Munieweg felix_muniewe@hotmail.com Classificação taxonômica G. lamblia G. intestinalis
UNIVERSIDADE FEDERAL DO PAMPA Campus Itaqui Curso de Nutrição Parasitologia Giardíase Giardia lamblia Mestrando : Félix Munieweg felix_muniewe@hotmail.com Classificação taxonômica G. lamblia G. intestinalis
Palavras-chave: Diagnostico molecular; Mosquito-palha; Epidemiologia; Leishmania spp.
 IMPLEMENTAÇÃO DE REAÇÃO EM CADEIA DA POLIMERASE EM TEMPO REAL PARA DETECÇÃO E QUANTIFICAÇÃO DE LEISHMANIOSE VISCERAL Resumo Vinicius Proença da Silveira 1 Patrícia de Freitas Salla 2 Nilo Ikuta 3 Vagner
IMPLEMENTAÇÃO DE REAÇÃO EM CADEIA DA POLIMERASE EM TEMPO REAL PARA DETECÇÃO E QUANTIFICAÇÃO DE LEISHMANIOSE VISCERAL Resumo Vinicius Proença da Silveira 1 Patrícia de Freitas Salla 2 Nilo Ikuta 3 Vagner
DISTRIBUIÇÃO DA LEISHMANIOSE VISCERAL CANINA NA CIDADE DE PRESIDENTE PRUDENTE, ESTADO DE SÃO PAULO.
 EIXO TEMÁTICO: ( ) Biodiversidade e Unidade de Conservação ( ) Gestão e Gerenciamento dos Resíduos ( ) Campo, Agronegócio e as Práticas Sustentáveis ( ) Planejamento e Gestão dos Recursos Hídricos ( )
EIXO TEMÁTICO: ( ) Biodiversidade e Unidade de Conservação ( ) Gestão e Gerenciamento dos Resíduos ( ) Campo, Agronegócio e as Práticas Sustentáveis ( ) Planejamento e Gestão dos Recursos Hídricos ( )
Disciplina de Parasitologia
 Disciplina de Parasitologia Curso de Medicina 2018 Tema: Leishmanioses Profa. Dra. Juliana Quero Reimão Generalidades O que é Leishmaniose? Doença infecciosa, de manifestação cutânea ou visceral, causada
Disciplina de Parasitologia Curso de Medicina 2018 Tema: Leishmanioses Profa. Dra. Juliana Quero Reimão Generalidades O que é Leishmaniose? Doença infecciosa, de manifestação cutânea ou visceral, causada
Aprimorando em Medicina Veterinária, Fundação Educacional de Ituverava Faculdade Dr. Francisco Maeda (FAFRAM),
 LEVANTAMENTO EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL AMERICANA, NOS ANOS DE 2009 E 2010 EM MUNICÍPIO DE REGIÃO ENDÊMICA DO NOROESTE DO ESTADO DE SÃO PAULO. Karine Lopes PINTO 1 ; Aline Gomes de CAMPOS
LEVANTAMENTO EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL AMERICANA, NOS ANOS DE 2009 E 2010 EM MUNICÍPIO DE REGIÃO ENDÊMICA DO NOROESTE DO ESTADO DE SÃO PAULO. Karine Lopes PINTO 1 ; Aline Gomes de CAMPOS
AVALIAÇÃO DA REAÇÃO EM CADEIA PELA POLIMERASE PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL EM SANGUE DE CÃES
 AVALIAÇÃO DA REAÇÃO EM CADEIA PELA POLIMERASE PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL EM SANGUE DE CÃES CÁRIS M. NUNES 1, ANA KARINA K. DIAS 2, FERNANDA PATRICIA GOTTARDI 1, HENRIQUE B. DE PAULA 1 ;
AVALIAÇÃO DA REAÇÃO EM CADEIA PELA POLIMERASE PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL EM SANGUE DE CÃES CÁRIS M. NUNES 1, ANA KARINA K. DIAS 2, FERNANDA PATRICIA GOTTARDI 1, HENRIQUE B. DE PAULA 1 ;
HIPERSENSIBILIDADE DO TIPO IV. Professor: Drº Clayson Moura Gomes Curso: Fisioterapia
 HIPERSENSIBILIDADE DO TIPO IV Professor: Drº Clayson Moura Gomes Curso: Fisioterapia Doenças de Hipersensibilidade Classificação de Gell e Coombs Diferentes mecanismos imunes envolvidos Diferentes manifestações
HIPERSENSIBILIDADE DO TIPO IV Professor: Drº Clayson Moura Gomes Curso: Fisioterapia Doenças de Hipersensibilidade Classificação de Gell e Coombs Diferentes mecanismos imunes envolvidos Diferentes manifestações
SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE VISCERAL NA PARAÍBA: UMA QUESTÃO DE SAÚDE PÚBLICA
 SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE VISCERAL NA PARAÍBA: UMA QUESTÃO DE SAÚDE PÚBLICA EPIDEMIOLOGICAL SITUATION OF VISCERAL LEISHMANIASIS IN PARAÍBA: A PUBLIC HEALTH QUESTION Suzanna Cavalcante LINS
SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE VISCERAL NA PARAÍBA: UMA QUESTÃO DE SAÚDE PÚBLICA EPIDEMIOLOGICAL SITUATION OF VISCERAL LEISHMANIASIS IN PARAÍBA: A PUBLIC HEALTH QUESTION Suzanna Cavalcante LINS
AVALIAÇÃO EPIDEMIOLOGICA DA LEISHMANIOSE VISCERAL NA CIDADE DE IMPERATRIZ, MARANHÃO. Natã Silva dos Santos 1 Graduando em Enfermagem
 AVALIAÇÃO EPIDEMIOLOGICA DA LEISHMANIOSE VISCERAL NA CIDADE DE IMPERATRIZ, MARANHÃO. Natã Silva dos Santos 1 Graduando em Enfermagem Universidade Federal do Maranhão-natan.silva0@gmail.com Gustavo de Almeida
AVALIAÇÃO EPIDEMIOLOGICA DA LEISHMANIOSE VISCERAL NA CIDADE DE IMPERATRIZ, MARANHÃO. Natã Silva dos Santos 1 Graduando em Enfermagem Universidade Federal do Maranhão-natan.silva0@gmail.com Gustavo de Almeida
SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M CALAZAR GERMANO DA SILVA DE SOUZA R 2
 SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M EM PEDIATRIA CALAZAR GERMANO DA SILVA DE SOUZA R 2 www.paulomargotto.com.br CALAZAR DEFINIÇÃO ÃO: Zoonose
SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M EM PEDIATRIA CALAZAR GERMANO DA SILVA DE SOUZA R 2 www.paulomargotto.com.br CALAZAR DEFINIÇÃO ÃO: Zoonose
MSc. Romeu Moreira dos Santos
 MSc. Romeu Moreira dos Santos 2018 2015 INTRODUÇÃO As células do sistema imune (SI) inato e adaptativo estão presentes como: células circulantes no sangue e na linfa; aglomerados anatomicamente definidos
MSc. Romeu Moreira dos Santos 2018 2015 INTRODUÇÃO As células do sistema imune (SI) inato e adaptativo estão presentes como: células circulantes no sangue e na linfa; aglomerados anatomicamente definidos
TRYPANOSOMA EVANSI EM EQUINOS
 TRYPANOSOMA EVANSI EM EQUINOS INTRODUÇÃO A trypanosomose equina, também conhecida como mal-das-cadeiras ou surra é uma doença que tem uma distribuição geográfica extremamente ampla. Ela ocorre no norte
TRYPANOSOMA EVANSI EM EQUINOS INTRODUÇÃO A trypanosomose equina, também conhecida como mal-das-cadeiras ou surra é uma doença que tem uma distribuição geográfica extremamente ampla. Ela ocorre no norte
OTIMIZAÇÃO DE ENSAIOS DE PCR PARA A DETECÇÃO ESPECÍFICA DE Leishmania chagasi
 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL OTIMIZAÇÃO DE ENSAIOS DE PCR PARA A DETECÇÃO ESPECÍFICA DE Leishmania chagasi Osvaldo José da Silveira Neto
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL OTIMIZAÇÃO DE ENSAIOS DE PCR PARA A DETECÇÃO ESPECÍFICA DE Leishmania chagasi Osvaldo José da Silveira Neto
MARIA RAILMA VIEIRA DE FREITAS ANÁLISE MACROSCÓPICA DAS PRINCIPAIS VÍSCERAS ACOMETIDAS POR LEISHMANIOSE VISCERAL CANINA
 UNIVERSIDADE ESTADUAL DA PARAÍBA CAMPUS V MINISTRO ALCIDES CARNEIRO CENTRO DE CIÊNCIAS BIOLÓGICAS E SOCIAIS APLICADAS CURSO DE BACHARELADO EM CIÊNCIAS BIOLÓGICAS MARIA RAILMA VIEIRA DE FREITAS ANÁLISE
UNIVERSIDADE ESTADUAL DA PARAÍBA CAMPUS V MINISTRO ALCIDES CARNEIRO CENTRO DE CIÊNCIAS BIOLÓGICAS E SOCIAIS APLICADAS CURSO DE BACHARELADO EM CIÊNCIAS BIOLÓGICAS MARIA RAILMA VIEIRA DE FREITAS ANÁLISE
Palavras-chave: canino, tripanossomíase, Doença de Chagas Key-words: canine, trypanosomiasis, chagas disease
 1 OCORRÊNCIA DE ANTICORPOS ANTI-Trypanosoma cruzi EM CÃES DE UMA ÁREA RURAL NO MUNICÍPIO DE RIO BRANCO, ACRE Mirlane da Silva SANTOS 1, Carolina Couto BARQUETE 2, Michelinne Medeiros de Oliveira DANTAS
1 OCORRÊNCIA DE ANTICORPOS ANTI-Trypanosoma cruzi EM CÃES DE UMA ÁREA RURAL NO MUNICÍPIO DE RIO BRANCO, ACRE Mirlane da Silva SANTOS 1, Carolina Couto BARQUETE 2, Michelinne Medeiros de Oliveira DANTAS
11 a 14 de dezembro de 2012 Campus de Palmas
 CORRELAÇÃO DAS LESÕES ENCONTRADAS EM VÍSCERAS, LINFONODOS E SNC DE CÃES COM LEISHMANIA SP. EM ARAGUAÍNA- TO Cinthian Cássia Mendonça 1 ; Adriano Tony Ramos 2 1 Aluno do Curso de Medicina Veterinária; Campus
CORRELAÇÃO DAS LESÕES ENCONTRADAS EM VÍSCERAS, LINFONODOS E SNC DE CÃES COM LEISHMANIA SP. EM ARAGUAÍNA- TO Cinthian Cássia Mendonça 1 ; Adriano Tony Ramos 2 1 Aluno do Curso de Medicina Veterinária; Campus
PLANILHA GERAL - BASES BIOLÓGICAS DA PRÁTICA MÉDICA III - 2º 2017
 PLANILHA GERAL - BASES BIOLÓGICAS DA MÉDICA III - 2º 2017 Dia Data Hora Professor/GAD Sala Conteúdo Módulo SEGUNDA 07/08/2017 TERÇA 08/08/2017 SEXTA 11/08/2017 SEGUNDA 14/08/2017 11:50 Dante-GAD Fisiologia
PLANILHA GERAL - BASES BIOLÓGICAS DA MÉDICA III - 2º 2017 Dia Data Hora Professor/GAD Sala Conteúdo Módulo SEGUNDA 07/08/2017 TERÇA 08/08/2017 SEXTA 11/08/2017 SEGUNDA 14/08/2017 11:50 Dante-GAD Fisiologia
Herica MAKINO 1, Karoline Silva CAMPIOLO 2, Karolina Gonçalves NUNES 2, Valéria Régia Franco SOUSA 3, Arleana do Bom Parto Ferreira de ALMEIDA 3
 CO-INFECÇÃO LEISHMANIA CHAGASI, TRYPANOSOMA CANINUM E EHRLICHIA CANIS EM CÃO CO-INFECTION LEISHMANIA CHAGASI, TRYPANOSOMA CANINUM E EHRLICHIA CANIS IN DOG Herica MAKINO 1, Karoline Silva CAMPIOLO 2, Karolina
CO-INFECÇÃO LEISHMANIA CHAGASI, TRYPANOSOMA CANINUM E EHRLICHIA CANIS EM CÃO CO-INFECTION LEISHMANIA CHAGASI, TRYPANOSOMA CANINUM E EHRLICHIA CANIS IN DOG Herica MAKINO 1, Karoline Silva CAMPIOLO 2, Karolina
Portaria de Instauração de Procedimento Administrativo
 REPRESENTANTE: ASSOCIAÇÃO NACIONAL DE CLÍNICOS VETERINÁRIOS DE PEQUENOS ANIMAIS REPRESENTADOS: MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO E MINISTÉRIO DA SAÚDE Portaria de Instauração de Procedimento
REPRESENTANTE: ASSOCIAÇÃO NACIONAL DE CLÍNICOS VETERINÁRIOS DE PEQUENOS ANIMAIS REPRESENTADOS: MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO E MINISTÉRIO DA SAÚDE Portaria de Instauração de Procedimento
UNIVERSIDADE ESTADUAL PAULISTA CÂMPUS DE ILHA SOLTEIRA
 1 UNIVERSIDADE ESTADUAL PAULISTA CÂMPUS DE ILHA SOLTEIRA FATORES DE RISCOS ASSOCIADOS À LEISHMANIOSE VISCERAL CANINA NA ÁREA DE CINTURÃO VERDE DE ILHA SOLTEIRA, SP. Julio Cesar Pereira Spada Médico Veterinário
1 UNIVERSIDADE ESTADUAL PAULISTA CÂMPUS DE ILHA SOLTEIRA FATORES DE RISCOS ASSOCIADOS À LEISHMANIOSE VISCERAL CANINA NA ÁREA DE CINTURÃO VERDE DE ILHA SOLTEIRA, SP. Julio Cesar Pereira Spada Médico Veterinário
Leishmaniose visceral: Complexidade na relação Homemanimal-vetor-ambiente
 Leishmaniose visceral: Complexidade na relação Homemanimal-vetor-ambiente em municípios de Minas Gerais Eduardo Sergio da Silva silvaedu@ufsj.edu.br Agosto de 2016 Introdução Epidemiologia das Leishmanioses
Leishmaniose visceral: Complexidade na relação Homemanimal-vetor-ambiente em municípios de Minas Gerais Eduardo Sergio da Silva silvaedu@ufsj.edu.br Agosto de 2016 Introdução Epidemiologia das Leishmanioses
Giardia duodenalis Giardíase
 Parasitologia Biotecnologia Giardia duodenalis Giardíase Prof. Paulo Henrique Matayoshi Calixto Características Primeiramente descrita em 1681 por Anthon van Leeuwenhoek em suas próprias fezes; Acomete
Parasitologia Biotecnologia Giardia duodenalis Giardíase Prof. Paulo Henrique Matayoshi Calixto Características Primeiramente descrita em 1681 por Anthon van Leeuwenhoek em suas próprias fezes; Acomete
DÚVIDAS FREQUENTES: LEISHMANIOSE VISCERAL CANINA
 DÚVIDAS FREQUENTES: LEISHMANIOSE VISCERAL CANINA Porque houve a substitução do protocolo diagnóstico da leishmaniose visceral canina (LVC)? Na Nota Técnica conjunta n 01/2011 - CGDT-CGLAB/DEVIT/SVS/MS
DÚVIDAS FREQUENTES: LEISHMANIOSE VISCERAL CANINA Porque houve a substitução do protocolo diagnóstico da leishmaniose visceral canina (LVC)? Na Nota Técnica conjunta n 01/2011 - CGDT-CGLAB/DEVIT/SVS/MS
Anais do 38º CBA, p.1478
 1 HEMOPARASITOSES EM CÃES DOMICILIADOS ATENDIDOS EM HOSPITAL VETERINÁRIO NO MUNICÍPIO DE MOSSORÓ-RN, BRASIL HEMOPARASITOSES IN DOMICILED DOGS TAKEN IN A VETERINARY HOSPITAL IN THE CITY OF MOSSORÓ-RN, BRASIL
1 HEMOPARASITOSES EM CÃES DOMICILIADOS ATENDIDOS EM HOSPITAL VETERINÁRIO NO MUNICÍPIO DE MOSSORÓ-RN, BRASIL HEMOPARASITOSES IN DOMICILED DOGS TAKEN IN A VETERINARY HOSPITAL IN THE CITY OF MOSSORÓ-RN, BRASIL
AVALIAÇÃO DA FREQUÊNCIA DE CASOS DE LESISHMANIOSE VISCERAL CANINA NA REGIÃO DE BEBEDOURO
 71 AVALIAÇÃO DA FREQUÊNCIA DE CASOS DE LESISHMANIOSE VISCERAL CANINA NA REGIÃO DE BEBEDOURO PAZZINI, J. M. 1 WANDERLEY, M. C. 2 Recebido em: 2010-01-30 Aprovado em: 2010-04-28 ISSUE DOI: 10.3738/1982.2278.326
71 AVALIAÇÃO DA FREQUÊNCIA DE CASOS DE LESISHMANIOSE VISCERAL CANINA NA REGIÃO DE BEBEDOURO PAZZINI, J. M. 1 WANDERLEY, M. C. 2 Recebido em: 2010-01-30 Aprovado em: 2010-04-28 ISSUE DOI: 10.3738/1982.2278.326
