Estrutura da Matéria Prof. Fanny Nascimento Costa
|
|
|
- Aníbal Sebastião Maranhão Quintão
- 6 Há anos
- Visualizações:
Transcrição
1 Estrutura da Matéria Prof. Fanny Nascimento Costa Aula 03 Gases e suas propriedades; Conservação de massa e volume (teoria cinética).
2 Gases Os gases são o estado mais simples da matéria. as ligações entre as propriedades das moléculas e da matéria são relativamente simples de identificar. A atmosfera terrestre é composta por vários gases que estão presos à sua superfície pela ação da gravidade. a fina camada de gases é essencial à manutenção da vida. nos protege da radiação de alta energia. fornece substâncias necessárias à vida: oxigênio, nitrogênio, CO 2, H 2 O.
3 Volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando moléculas) que preenchem o volume de seu recipiente e exercem pressão sobre suas paredes. Outra característica de um gás é sua pequena densidade comparada com líquidos ou sólidos As três variáveis: consequências do movimento dos átomos O volume é um resultado da liberdade que os átomos têm para se espalhar através do recipiente A pressão é um resultado das colisões dos átomos com as paredes do recipiente A temperatura está relacionada com a energia cinética (velocidade) dos átomos
4 Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Podem ser confinados em um volume menor do que seu volume original. São muito mais compressíveis que os sólidos e os líquidos, sugerindo que há muito espaço livre entre as moléculas dos gases. Ocupam todo espaço disponível > isto sugere que as moléculas se movem rapidamente. Quando um gás é submetido à pressão, seu volume diminui. A pressão dentro de um recipiente é a mesma em todas as direções. Características dos gases inferimos que o movimento das moléculas é caótico (nenhuma direção é favorecida). Os gases sempre formam misturas homogêneas com outros gases. No ar que respiramos as moléculas ocupam somente cerca de 0,1 % do volume total, com o restante sendo espaço vazio.
5 Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Podem ser confinados em um volume menor do que seu volume original. São muito mais compressíveis que os sólidos e os líquidos, sugerindo que há muito espaço livre entre as moléculas dos gases. Ocupam todo espaço disponível > isto sugere que as moléculas se movem rapidamente. Quando um gás é submetido à pressão, seu volume diminui. A pressão dentro de um recipiente é a mesma em todas as direções. Características dos gases inferimos que o movimento das moléculas é caótico (nenhuma direção é favorecida). Os gases sempre formam misturas homogêneas com outros gases. No ar que respiramos as moléculas ocupam somente cerca de 0,1 % do volume total, com o restante sendo espaço vazio.
6 Alguns exemplos de gases
7 Pressão A pressão é a força atuando em um objeto por unidade de área: Unidades SI: 1 N = 1 kg m s -2 ; 1 Pa = 1 N m -2 = 1 kg m -1 s -2 P Se o gás é um conjunto muito grande de moléculas que se move aleatoriamente em todas as direções, pode-se entender a pressão que o gás exerce sobre as paredes do recipiente que o contém como o resultado das colisões das moléculas com a superfície do recipiente. F A A pressão corresponde a uma média da força, provocada pelo enorme números de moléculas que estão constantemente colidindo com a parede. Quanto mais forte forem as colisões das moléculas sobre a superfície, maior será a força e, consequentemente, a pressão.
8 Pressão Atmosférica A gravidade exerce uma força sobre a atmosfera terrestre. Uma coluna de ar de 1 m 2 de seção transversal exerce uma força de 10 5 N. A pressão de uma coluna de ar de 1 m 2 é de 100 kpa. P = F A = 105 N 1 m 2 = 105 Pa = 1 atm
9 Pressão atmosférica e o barômetro A pressão atmosférica é medida com um barômetro. Se um tubo é inserido em um recipiente de mercúrio aberto à atmosfera, o mercúrio subirá 760 mm no tubo A pressão atmosférica padrão é a pressão necessária para suportar 760 mm de Hg em uma coluna 1 atm = 760 mmhg = 760 torr = 14,7 lb in 2 (psi) 1 bar = 10 5 Pa = 100 kpa 1 atm = 1, Pa = 101,325 kpa
10 Relação entre a pressão atmosférica e a altura h A: área transversal da coluna. O volume de Hg V = ha A massa, m, pode ser encontrada através da densidade: m = ρv = ρha A força da gravidade é F = mg. P = F A = ρhag A = ρhg
11 Exercícios 1) Se a altura de coluna de mercúrio em um barômetro é 760 mm Hg, qual é a pressão atmosférica em Pascals? Dados: ρ = kg.m -3 g = 9,80 m/s 2 P = ρhg = (13546 kg.m -3 )(0,760m)(9,80 m/s 2 ) P = 1,01 x10 5 kg.m -1.s -2 = 1,01 x10 5 Pa 2) Qual é a pressão atmosférica se a altura da coluna de mercúrio, em um barômetro é 756mm? 3) A densidade da água em 200 C é 0,998 g.cm -3. Que altura tem a coluna de líquido de um barômetro de água quando a pressão atmosférica corresponde a 760mm de mercúrio? sites.google.com/site/alyssonferrari
12 As leis dos gases Relação pressão-volume: lei de Boyle A Lei de Boyle: o volume de uma quantidade fixa de gás é inversamente proporcional à sua pressão Boyle usou um manômetro para executar o experimento Matematicamente: Um gráfico de V versus P é um hiperbolóide Da mesma forma, um gráfico de V versus 1/P deve ser uma linha reta passando pela origem
13 As leis dos gases Relação pressão-volume: lei de Boyle A Lei de Boyle: o volume de uma quantidade fixa de gás é inversamente proporcional à sua pressão. Usando um tubo em formato de J, Boyle verteu mercúrio, prendendo ar no lado menor do tubo. Quanto mais mercúrio ele adicionava, mais o gás era comprimido! Boyle concluiu que o volume de uma quantidade fixa de gás (ar, neste caso) diminui quando a pressão sobre ele aumenta.
14 As leis dos gases Relação pressão-volume: lei de Boyle Os gráficos mostram a dependência da pressão (P) com o volume (V) e com o inverso do volume (1/V). P = cte 1 V
15 As leis dos gases Relação pressão-volume: lei de Boyle A lei de Boyle resume o efeito da pressão sobre o volume de uma quantidade fixa de gás em temperatura constante. Para uma temperatura constante, a pressão é inversamente proporcional ao volume. P = cte 1 V PV = constante
16 As leis dos gases Relação pressão-volume: lei de Boyle Quando um gás é comprimido, suas moléculas são confinadas em um volume menor. Aumenta a concentração de partículas no interior do recipiente (número de moléculas/volume) e consequentemente, o número de colisões entre as moléculas e as paredes aumenta. Isso dá origem alta. à pressão mais
17 As leis dos gases Relação temperatura-volume: lei de Charles Sabemos que balões de ar quente expandem quando são aquecidos A lei de Charles: o volume de uma quantidade fixa de gás à pressão constante aumenta com o aumento da temperatura Matematicamente:
18 As leis dos gases Relação temperatura-volume: lei de Charles V = constante T P = constante T Uma expressão semelhante resume a variação da pressão de uma amostra de um gás que é aquecido em um recipiente de volume fixo. A pressão varia linearmente com a temperatura e os dados experimentais podem ser extrapolados para pressão zero em é -273,15 C.
19 As leis dos gases Relação temperatura-volume: lei de Charles Um gráfico de V versus T é uma linha reta. Quando T é medida em C, a intercepção no eixo da temperatura é -273,15 C. Definimos o zero absoluto, 0 K = -273,15 C. Esta é a temperatura mais baixa possível, já que não existe volume negativo. A temperatura em Kelvin (K) pode ser obtida somando-se -273,15 à temperatura em graus Celsius ( C). Na prática, todos os gases condensam e se tornam líquidos antes de alcançar esta temperatura. Observe que o valor da constante reflete as suposições: quantidade de gás e pressão Diferentes gases
20 As leis dos gases Efeito da temperatura sobre a pressão de um gás... Se a temperatura está relacionada com a velocidade com que as moléculas do gás se deslocam, quando a temperatura de um gás aumenta, a velocidade média das moléculas aumenta. As moléculas chocam-se com as paredes com frequência maior e exercem uma força maior nas paredes, logo a pressão aumenta. Para explicar o efeito da temperatura sobre o volume de um gás a pressão constante, usamos o mesmo raciocínio. Como a velocidade das moléculas aumenta se aumenta a temperatura, para impedir o aumento de pressão, o volume do gás deve aumentar, para que menos moléculas se choquem com as paredes do recipiente.
21 As leis dos gases Relação quantidade-volume: Princípio de Avogadro A lei de Gay-Lussac de volumes combinados: a uma determinada temperatura e pressão, os volumes dos gases que reagem são proporções de números inteiros pequenos
22 As leis dos gases Relação quantidade-volume: Princípio de Avogadro A hipótese de Avogadro: volumes iguais de gases à mesma temperatura e pressão conterão o mesmo número de moléculas. A hipótese de Avogadro: o volume de gás a uma dada temperatura e pressão é diretamente proporcional à quantidade de matéria do gás. 22,4 L de qualquer gás a 0C (273 K) contém 6, moléculas de gás.
23 A equação dos gases ideais Considere as expressões obtidas até agora: Lei de Boyle: Lei de Charles: Lei de Avogadro: Podemos combiná-las em uma lei geral dos gases: Se n e T são constantes temos a Lei de Boyle. Se P e n são constantes temos a Lei de Charles. Se P e T são constantes temos o princípio de Avogadro.
24 A equação do gás ideal Se R é a constante de proporcionalidade (chamada de constante dos gases), então: A equação do gás ideal é:
25 A equação do gás ideal Definimos TPP (temperatura e pressão padrão) = 0C, 273,15 K, 1 atm O volume de 1 mol de gás na TPP é:
26 Relacionando a equação do gás ideal e as leis dos gases Se PV = nrt e n e T são constantes, então PV = constante e temos a lei de Boyle Outras leis podem ser criadas de modo similar Em geral, se temos um gás sob dois grupos de condições, então: P1 V n T P2 V n T 2 2 2
27 Aplicações adicionais da equação do gás ideal Densidades de gases e massa molar A densidade tem unidades de massa por unidades de volume. Reajustando a equação ideal dos gases com M como massa molar, teremos: PV n V nm V P RT nrt d PM RT
28 A equação do gás ideal Densidades de gases e massa molar A massa molar de um gás pode ser determinada como se segue: M drt P Volumes de gases em reações químicas A equação dos gases ideais relaciona P, V e T ao número de mols do gás O n pode então ser usado em cálculos estequiométricos
29 Mistura de gases e pressões parciais Muitos gases que conhecemos são misturas. A atmosfera é uma mistura de nitrogênio,oxigênio, argônio, dióxido de carbono e outros gases.precisamos incorporar no nosso modelo de gás, as propriedades das misturas de gases. Uma vez que as moléculas de gás estão tão separadas, podemos supor que elas comportam-se independentemente Fazendo alguns experimentos Dalton enunciou a lei das pressões parciais: em uma mistura gasosa, a pressão total é dada pela soma das pressões parciais de cada componente: P total P1 P2 P3 Cada gás obedece à equação ideal dos gases: P i n i RT V
30 Mistura de gases e pressões parciais Combinando as equações: P total n n n RT V Pressões parciais e frações molares Considere n i a quantidade de matéria de gás i exercendo uma pressão parcial P i, então: Pi i P total onde i é a fração molar (n i /n t )
31 Mistura de gases e pressões parciais A lei de pressões parciais é consistente com o nosso modelo para gases. Vimos que a pressão surge como choque das moléculas contra as paredes do recipiente. Os choques vêm de todas as moléculas da mistura. Moléculas do tipo A e B exercem pressão. A pressão total é a soma dessas pressões individuais Ganhamos mais uma informação: As moléculas de A não são afetadas pelas moléculas de B e vice-versa (não há interação).
32 Difusão e Efusão A difusão é a dispersão gradual de uma substância em outra substância (criptônio se dispersando em uma atmosfera de neônio). Ela explica, por exemplo, a expansão dos perfumes e dos feromônios. A efusão é a fuga de um gás para o vácuo através de um orifício pequeno. O gás escapa pela abertura porque ocorrem mais colisões com o orifício do lado de alta pressão do que do lado de baixa pressão
33 Velocidade de Efusão Thomas Graham descobriu que quando a temperatura é constante, a velocidade de efusão de um gás é inversamente proporcional à raiz quadrada de sua massa molar. velocidade de efusão Esta é a Lei de Efusão de Graham 1 1 massa molar M velocidade de efusão A velocidade de efusão B M M B A Ela também sugere fortemente que a velocidade média de moléculas de um gás é inversamente proporcional à raiz quadrada de sua massa molar. velocidade média das moléculas A velocidade média das moléculas B M M B A
34 Velocidade de Efusão Experimentos em temperaturas diferentes mostram que a velocidade de efusão cresce quando aumenta a temperatura a velocidade de efusão para um determinado gás aumenta com a raiz quadrada da temperatura. velocidade de efusão em T velocidade de efusão em T Como a velocidade de efusão é proporcional à velocidade média das moléculas, a velocidade média das moléculas de um gás é proporcional à raiz quadrada da temperatura. velocidade média das moléculas em T velocidade média das moléculas em T T T T 2 2 T 1 1 velocidade média das molécula s em um gás T M
35 Teoria cinética molecular Teoria desenvolvida para explicar o comportamento dos gases Teoria de moléculas em movimento Suposições: Os gases consistem de um grande número de moléculas em movimento aleatório constante; O volume de moléculas individuais é desprezível comparado ao volume do recipiente; As forças intermoleculares (forças entre moléculas de gases) são insignificantes.
36 Teoria cinética molecular Suposições: A energia pode ser transferida entre as moléculas, mas a energia cinética total é constante à temperatura constante. A energia cinética média das moléculas é proporcional à temperatura. A teoria molecular cinética nos fornece um entendimento sobre a pressão e a temperatura em nível molecular A pressão de um gás resulta do número de colisões por unidade de tempo nas paredes do recipiente.
37 Teoria cinética molecular A ordem de grandeza da pressão é dada pela freqüência e pela força da colisão das moléculas. As moléculas de gás têm uma energia cinética média. Cada molécula tem uma energia diferente.
38 Teoria cinética molecular À medida que a energia cinética aumenta, a velocidade das moléculas do gás aumenta. A velocidade média quadrática, u, é a velocidade de uma molécula do gás que tem energia cinética média. A energia cinética média,, está relacionada à velocidade quadrática média: 1 mu 2 2
39 Teoria cinética molecular Aplicação das leis de gases À medida que o volume aumenta à temperatura constante, a energia cinética média do gás permanece constante. Consequentemente, u é constante. Entretanto, o volume aumenta fazendo com que as moléculas do gás tenham que viajar mais para atingirem as paredes do recipiente. Portanto, a pressão diminui. Se a temperatura aumenta com volume constante, a energia cinética média das moléculas do gás aumenta. Conseqüentemente, há mais colisões com as paredes do recipiente e a pressão aumenta.
40 Gases reais: desvios do comportamento ideal Da equação do gás ideal, temos: PV RT n Para 1 mol de gás, PV/RT = 1 para todas as pressões. Em um gás real, PV/RT varia significativamente de 1. Quanto maior for a pressão, maior será o desvio do comportamento ideal.
41 Gases reais: desvios do comportamento ideal À medida que a pressão em um gás aumenta, as moléculas são forçadas a se aproximar. À medida que as moléculas ficam mais próximas, o volume do recipiente torna-se menor. Quanto menor for o recipiente, mais espaço as moléculas de gás começam a ocupar. Como consequência, quanto maior for a pressão, o gás se torna menos semelhante ao gás ideal. À medida que as moléculas de gás ficam mais unidas, diminui a distância intermolecular
42 Gases reais: desvios do comportamento ideal Desvio do ideal Forças Intermoleculares
43 Gases reais: desvios do comportamento ideal Da equação do gás ideal, temos: PV RT Para 1 mol de gás, PV/RT = 1 a todas as temperaturas. n À medida que a temperatura aumenta, os gases se comportam de maneira mais ideal. As suposições na teoria cinética molecular mostram onde o comportamento do gás ideal falha: as moléculas de um gás têm volume finito; as moléculas de um gás se atraem.
44 Gases reais: desvios do comportamento ideal
45 Gases reais: desvios do comportamento ideal Quanto menor for a distância entre as moléculas de gás, maior a chance das forças de atração se desenvolverem entre as moléculas. Consequentemente, menos o gás se assemelha com um gás ideal. À medida que a temperatura aumenta, as moléculas de gás se movem mais rapidamente e se distanciam mais entre si. Altas temperaturas significam também mais energia disponível para a quebra das forças intermoleculares. Consequentemente, quanto maior for a temperatura, mais ideal é o gás.
46 Gases reais: desvios do comportamento ideal A equação de van der Waals Adicionamos dois termos à equação do gás ideal: um para corrigir o volume das moléculas e o outro para corrigir as atrações intermoleculares. Os termos de correção geram a equação de van der Waals: P nrt V nb n V 2 a 2 onde a e b são constantes empíricas.
47 Gases reais: desvios do comportamento ideal A equação de van der Waals P nrt V nb n V 2 a 2 Correção para o volume das moléculas Correção para a atração molecular Forma geral da equação de van der Waals: P n 2 V 2 a V nb nrt
48 Constantes de van der Waals As constantes a e b são empíricas, ou seja, são determinadas por medidas em laboratório, medindo o comportamento de gases reais.
49 Formalismo microscópico do gás ideal Um gás é constituído de partículas (moléculas) idênticas. As moléculas são dotadas de movimento desordenado e obedecem às leis de Newton. O número de moléculas no gás é grande. O volume da molécula é uma fração desprezível do volume ocupado. As forças que atuam sobre a molécula são desprezíveis, exceto durante uma colisão. As colisões são elásticas e de duração desprezível.
50 Formalismo microscópico do gás ideal Vamos calcular a pressão P da teoria microscópica. P P i Nm V v 2 x I I i i ta p mv ( mv ) 2mv 1 N 2 V i ( Avxidt) N v At 2V Nmv V 2 xi xi xi xi 2 PV NE K 3 N o médio de colisões com a parede no intervalo de tempo Δt N mv At 2 i xi i xi 2mvxi v v v v v 3 v rms x y z x V N mv P P N v V V 2 i xi m 2 i i xi 1 N 2 N 1 P mv mv 3 V 3 V rms rms
51 Modelo Atômico de Dalton (1808) Toda a matéria é feita de pequenas partículas indivisíveis e indestrutíveis chamadas de átomos. No entanto: qual o tamanho exato do átomo? quanto pesa um átomo? por que os átomos se combinam entre si da forma que se combinam? ISSO A QUÍMICA NÃO ERA CAPAZ DE DIZER! sites.google.com/site/alyssonferrari
52 O resumo de todo este problema é: como determinar o número de Avogrado? N A = 6, Esse cubo de 22,4l, em condições normais de T e P, contêm um mol de moléculas. Se soubermos quanto vale N A, sabemos contar exatamente quantos átomos estão contido aqui dentro! Sabemos que 1 mol = N A átomos de carbono-12 pesam 12g. Quanto pesa um átomo de carbono? m C = 12g N A Se conhecemos N A, podemos pesar o átomo de carbono! Se o número de Avogrado não puder ser determinado com precisão, podemos ser céticos quanto à real existência do átomo. Afinal, como crer na existência de uma partícula que não podemos determinar o tamanho, a massa, etc...? sites.google.com/site/alyssonferrari
53 Tentativas Johann Josef Loschmidt foi o primeiro a estimar, basedo em experiências, o número de Avogrado em O seu cálculo foi basicamente correto em ordem de magnitude. N A 0, Os seus experimentos não eram ainda precisos o suficiente para fornecer um cálculo confiável de N A. Apenas a partir de 1910 físicos como Milikan e Perrin desenvolveram técnicas experimentais que permitiram calcular o número de Avogrado, obtendo essencialmente o valor que conhecemos hoje. Um dos trabalhos que efetivamente convenceu os mais céticos que N A podia ser calculado a partir de experimentos, foi o artigo de Einstein de 1905 sobre o movimento Browniano. sites.google.com/site/alyssonferrari
54 Movimento Browniano MOVIMENTO BROWNIANO: um movimento errático, aparentemente aleatório, executado por pequenas partículas quando suspensas num líquido. Relatado por Jan Ingenhousz em 1785, observando partículas de carvão flutuando em álcool. Re-descoberto por Robert Brown em 1827, observando partículas de pólem mergulhados em água. EXPLICAÇÃO: o choque constante das partículas observadas com as moléculas que compõem o líquido, que são muito menores e se movem aleatoriamente, provoca este movimento. Einstein estudou o movimento browniano e, em 1905, encontrou uma fórmula que relacionava o movimento browniano com o número de Avogrado. Como este movimento podia ser diretamente observado por microscópio, pode-se assim calcular precisamente o valor de N A.
55 Movimento Browniano Perrin foi o primeiro a fazer as observações propostas por Einstein em 1908, e conseguiu o valor N A Ao longo das primeiras décadas do século XX, Einstein e outros propuseram outras formas de determinar N A, usando os mais diversos fenômenos físicos. Todos estes esperimentos indicavam o mesmo valor de N A, próximo do que conhecemos hoje. sites.google.com/site/alyssonferrari Jean Perrin ganhou o prêmio Nobel de 1926 pelos seus diversos experimentos para a determinação do número de Avogrado.
56 Medidas da constante de Avogadro realizadas por diferentes cientistas Ano Cientista Valor (n o /mol) x Avogadro desconhecido 1811 Ampère desconhecido 1866 Loschmidt 0, Rayleigh 1873 Maxwell 4, Planck 6, Einstein 6, Perrin 6,5 6, Boltwood & Rutherford 6, Millikan 1914 Fletcher 1914 Perrin 6, Westgren 1917 Millikan 1930 Bond 1935 Bearden 4 6,062 0,012 6,03 0,12 6,85 0,02 6,064 0,006 6,05 0,03 6,0221 0,0005
57 Hipótese atômica A existência do átomo é uma idéia que surgiu há mais de anos, e que só foi cientificamente concretizada nas primeiras décadas do século XX, culminando o trabalho de muitos químicos e físicos por mais de dois séculos. Hoje em dia, já não se questiona a existência do átomo, e sim procura-se maneiras de manipulá-lo de formas que seja mais conveniente. Em 1990, cientistas trabalhando na IBM conseguiram manipular átomos individuais, depositando-os sobre uma superfície metálica para formar as letras I B M. Hoje, é possível manipular átomos individualmente! sites.google.com/site/alyssonferrari
58 Bibliografia Theodore L. Brown, H. Eugene LeMay Jr., Bruce E. Bursten, Julia R. Burdge, Química a Ciência Central, Pearson Education do Brasil, Cap. 3, 9ª. Ed., Paul A. Tipler, Física Moderna, Guanabara dois, 2ª Ed., Peter Atkins, Loretta Jones, Príncipios de Química: Questinando a Vida Moderna e o Meio Ambiente, Bookman, 3 a. Ed., Francis W. Sears, Gerhard L. Salinger, Termodinâmica: teoria cinética e termodinâmica estatística, Editora Reverté, 2ª Ed., Física Moderna, Origens Clássicas e Fundamentos Quânticos, F. Caruso e V. Oguri, Editora Campus (em inglês) Pesquisar a Wikipedia (em inglês) sobre: Avogrado's number, Brownian Motion.
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
Características dos gases
 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO
 AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
QUÍMICA I Gases
 QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Gases. Compostos orgânicos de baixa massa molar são gases a temperatura ambiente. CH 4 (metano gás natural), C 3 H 8
 Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Gases UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG120. Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI
 UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
COMPORTAMENTO DOS GASES
 BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
Físico-Química I. Profa. Dra. Carla Dalmolin. Gases. Gás perfeito (equações de estado e lei dos gases) Gases reais
 Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
A teoria Cinética dos Gases
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II A teoria Cinética dos Gases Prof. Bruno Farias Gases Um gás é formado de átomos (isolados
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II A teoria Cinética dos Gases Prof. Bruno Farias Gases Um gás é formado de átomos (isolados
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
Teoria Cinética dos Gases
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias Introdução Termodinâmica é o estudo das transformações
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias Introdução Termodinâmica é o estudo das transformações
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS
 ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
Moléculas em Movimento
 Físico-Química II Profa. Dra. Carla Dalmolin Moléculas em Movimento Modelo Cinético dos Gases Modelo Cinético dos Gases A única contribuição para a energia do gás vem das energias cinéticas das moléculas
Físico-Química II Profa. Dra. Carla Dalmolin Moléculas em Movimento Modelo Cinético dos Gases Modelo Cinético dos Gases A única contribuição para a energia do gás vem das energias cinéticas das moléculas
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
ATMOSFERA. Volume molar; constante de Avogadro
 ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
Capítulo 10. 2005 by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Gases David P. White Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
QUÍMICA A Ciência Central 9ª Edição Gases David P. White Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Química da atmosfera...
 Atmosfera é a camada de ar que envolve a Terra do grego atmos = vapor do latim sphaera = invólucro. Assim, a palavra atmosfera pode significar: invólucro de vapor. Química - O estudo das propriedades e
Atmosfera é a camada de ar que envolve a Terra do grego atmos = vapor do latim sphaera = invólucro. Assim, a palavra atmosfera pode significar: invólucro de vapor. Química - O estudo das propriedades e
Soluções e Gases III. Gases
 Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Estudo dos gases. Prof. Leandro Zatta - Química Geral 1
 Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Capítulo 11 - Teoria Cinética dos Gases. O número de Avogrado é número de moléculas contido em 1 mol de qualquer substãncia
 Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
4. Propriedades dos gases experimentos e modelo microscópico simples para a temperatura
 PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal.
 Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana.
 Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Teoria Cinética dos gases
 Estrutura da Matéria Unidade II: A matéria fragmentada Aula 5: Origem estatística e corpuscular da termodinâmica http://professor.ufabc.edu.br/~pieter.westera/estrutura.html Teoria Cinética dos gases Bernoulli
Estrutura da Matéria Unidade II: A matéria fragmentada Aula 5: Origem estatística e corpuscular da termodinâmica http://professor.ufabc.edu.br/~pieter.westera/estrutura.html Teoria Cinética dos gases Bernoulli
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
Metal, Não Metal e Metaloide
 Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
Termodinâmica 7. Alexandre Diehl. Departamento de Física - UFPel
 Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
UFABC - BC Prof. Germán Lugones. AULA 7 Teoria Cinética dos Gases I
 UFABC - BC0205 - Prof. Germán Lugones AULA 7 Teoria Cinética dos Gases I Teoria cinética dos gases o Um gás consiste em partículas (e.g. átomos ou moléculas) que preenchem o volume de seu recipiente e
UFABC - BC0205 - Prof. Germán Lugones AULA 7 Teoria Cinética dos Gases I Teoria cinética dos gases o Um gás consiste em partículas (e.g. átomos ou moléculas) que preenchem o volume de seu recipiente e
Capítulo 1. Propriedades dos Gases
 Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Termodinâmica II - FMT 259
 Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2009 Lista 3 GABARITO (revisado em 22/04/0). Se as moléculas contidas em,0 g de água fossem distribuídas uniformemente sobre a superfície
Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2009 Lista 3 GABARITO (revisado em 22/04/0). Se as moléculas contidas em,0 g de água fossem distribuídas uniformemente sobre a superfície
DURAÇÃO DA PROVA Manual da disciplina, livros de Química, computador, Trabalho Escrito. Conteúdos Objetivos e/ou Competências Estrutura Cotações
 ÉPOCA ESPECIAL DE EXAMES ANO LETIVO 2011/2012 MATRIZ DO EXAME DO MÓDULO QM6 Estado Físico das Substâncias e Interações Moleculares. Estado Gasoso. Química MATERIAL A UTILIZAR TIPO DE PROVA DURAÇÃO DA PROVA
ÉPOCA ESPECIAL DE EXAMES ANO LETIVO 2011/2012 MATRIZ DO EXAME DO MÓDULO QM6 Estado Físico das Substâncias e Interações Moleculares. Estado Gasoso. Química MATERIAL A UTILIZAR TIPO DE PROVA DURAÇÃO DA PROVA
Estrutura da Matéria Hipótese Atômica 1. Hipótese na antiquidade 2.Conceito de elementos e lei da proporções 3.Hipótese de Avogadro 4.
 Estrutura da Matéria Hipótese Atômica 1. Hipótese na antiquidade 2.Conceito de elementos e lei da proporções 3.Hipótese de Avogadro 4.Massa Atômica e molecular 5.Lei dos gases ideais 6.Lei de Van der Waals
Estrutura da Matéria Hipótese Atômica 1. Hipótese na antiquidade 2.Conceito de elementos e lei da proporções 3.Hipótese de Avogadro 4.Massa Atômica e molecular 5.Lei dos gases ideais 6.Lei de Van der Waals
FUNDAMENTOS FÍSICOS DO AR COMPRIMIDO
 DEFINIÇÃO: O ar é incolor, insípido e é uma mistura de diversos gases. Composição percentual do ar seco padrão: (ISO 2533). Elementos Percentual em volume Percentual em massa Nitrogênio 78,08 75,52 Oxigênio
DEFINIÇÃO: O ar é incolor, insípido e é uma mistura de diversos gases. Composição percentual do ar seco padrão: (ISO 2533). Elementos Percentual em volume Percentual em massa Nitrogênio 78,08 75,52 Oxigênio
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que:
 01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
Conceitos Básicos sobre gases
 Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
25/Fev/2015 Aula 2. 20/Fev/2015 Aula 1
 /Fe/15 Aula 1 Temperatura e a Lei Zero da Termodinâmica Sistema Termodinâmico Termómetros e Escalas de Temperatura Descrição macroscópica dos gases ideais Equação dos gases ideais 5/Fe/15 Aula Teoria Cinética
/Fe/15 Aula 1 Temperatura e a Lei Zero da Termodinâmica Sistema Termodinâmico Termómetros e Escalas de Temperatura Descrição macroscópica dos gases ideais Equação dos gases ideais 5/Fe/15 Aula Teoria Cinética
2. Conceitos e Definições
 2. Conceitos e Definições Sistema e Volume de Controle Sistema Termodinâmico: região do espaço delimitada fisicamente por superfícies geométricas arbitrárias reais ou imaginárias, que podem ser fixas ou
2. Conceitos e Definições Sistema e Volume de Controle Sistema Termodinâmico: região do espaço delimitada fisicamente por superfícies geométricas arbitrárias reais ou imaginárias, que podem ser fixas ou
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011
 André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
Teoria e Física do Calor
 Teoria e Física do Calor Aula 2: Átomos e moléculas e teoria cinética Curso de Cultura e Extensão 21 a 25 de julho de 2008 Instituto de Física - Universidade de São Paulo Mário José de Oliveira Instituto
Teoria e Física do Calor Aula 2: Átomos e moléculas e teoria cinética Curso de Cultura e Extensão 21 a 25 de julho de 2008 Instituto de Física - Universidade de São Paulo Mário José de Oliveira Instituto
AS PROPRIEDADES DOS GASES. Apresentar as propriedades dos gases; explicitar as diferentes propriedades dos gases reais e dos gases perfeitos;
 AS PROPRIEDADES DOS GASES Metas Apresentar as propriedades dos gases; explicitar as diferentes propriedades dos gases reais e dos gases perfeitos; Objetivos Ao final desta aula, o aluno deverá: compreender
AS PROPRIEDADES DOS GASES Metas Apresentar as propriedades dos gases; explicitar as diferentes propriedades dos gases reais e dos gases perfeitos; Objetivos Ao final desta aula, o aluno deverá: compreender
ELEMENTOS DE TERMODINÂMICA
 ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
Neste modelo o gás é estudado de uma forma microscópica, onde a temperatura, a pressão e a. o resultado do movimento dos átomos e moléculas.
 TEORIA CINÉTICA Neste modelo o gás é estudado de uma forma microscópica, onde a temperatura, a pressão e a energia interna são interpretadas como o resultado do movimento dos átomos e moléculas. Pressão
TEORIA CINÉTICA Neste modelo o gás é estudado de uma forma microscópica, onde a temperatura, a pressão e a energia interna são interpretadas como o resultado do movimento dos átomos e moléculas. Pressão
Elementos de Termodinâmica
 TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir uma escala de temperaturas
TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir uma escala de temperaturas
baixa pressão e alta temperatura
 É um dos estados da matéria, não tem forma e volume definidos, e consiste em uma coleção de partículas cujos os movimentos são aproximadamente aleatórios. As forças de coesão entre as partículas que formam
É um dos estados da matéria, não tem forma e volume definidos, e consiste em uma coleção de partículas cujos os movimentos são aproximadamente aleatórios. As forças de coesão entre as partículas que formam
6/Mar/2013 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
11/08/2014. Lei de Avogadro. Equação de Clayperon. CNTP 1 atm 0 C 273K
 Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
AULA 8 Teoria Cinética dos Gases II
 UFABC - BC0205 Prof. Germán Lugones AULA 8 Teoria Cinética dos Gases II James Clerk Maxwell 1831-1879 A Distribuição de Velocidades Moleculares A velocidade média quadrática V rms nos fornece uma ideia
UFABC - BC0205 Prof. Germán Lugones AULA 8 Teoria Cinética dos Gases II James Clerk Maxwell 1831-1879 A Distribuição de Velocidades Moleculares A velocidade média quadrática V rms nos fornece uma ideia
Capitulo 1 Propriedades fundamentais da água
 Capitulo 1 Propriedades fundamentais da água slide 1 Propriedades fundamentais da água A palavra hidráulica vem de duas palavras gregas: hydor (que significa água ) e aulos (que significa tubo ). É importante
Capitulo 1 Propriedades fundamentais da água slide 1 Propriedades fundamentais da água A palavra hidráulica vem de duas palavras gregas: hydor (que significa água ) e aulos (que significa tubo ). É importante
Física Geral II. Aula 1 - Teoria cinética dos gases. D. Valin 1. Universidade do Estado de Mato Grosso. Sinop-MT, April 25, 2017
 Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Física II Teoria Cinética dos Gases
 Física II Teoria Cinética dos Gases João Francisco Fuzile Rodrigues Garcia -- 8549323 Maiara Fernanda Moreno -- 8549344 Otávio Massola Sumi -- 8549452 Ex. 18.63 Explique, em termos do movimento molecular,
Física II Teoria Cinética dos Gases João Francisco Fuzile Rodrigues Garcia -- 8549323 Maiara Fernanda Moreno -- 8549344 Otávio Massola Sumi -- 8549452 Ex. 18.63 Explique, em termos do movimento molecular,
2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor dessa pressão em atm e kpa?
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
MASSA ATÔMICA. 1u corresponde a 1, g, que equivale aproximadamente à massa de um próton ou de um nêutron.
 Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
Capítulo 21 Temperatura
 Capítulo 21 Temperatura 21.1 Temperatura e equilíbrio térmico Mecânica: lida com partículas. Variáveis microscópicas: posição, velocidade, etc. Termodinâmica: lida com sistemas de muitas partículas. Variáveis
Capítulo 21 Temperatura 21.1 Temperatura e equilíbrio térmico Mecânica: lida com partículas. Variáveis microscópicas: posição, velocidade, etc. Termodinâmica: lida com sistemas de muitas partículas. Variáveis
Temática: Reconsiderando as Interpretações de Dalton.
 Aula: 8. Temática: Reconsiderando as Interpretações de Dalton. Estamos iniciando a segunda unidade de nossa disciplina. Apesar de curta, 3 aulas apenas, não é uma unidade de menos importância, nela discorrerá
Aula: 8. Temática: Reconsiderando as Interpretações de Dalton. Estamos iniciando a segunda unidade de nossa disciplina. Apesar de curta, 3 aulas apenas, não é uma unidade de menos importância, nela discorrerá
Estado Gasoso. Características. Expansibilidade compressibilidade. Situação de um gás. Variáveis de estado
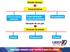 Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
CAPITULO 1 Propriedades dos gases. PGCEM Termodinâmica dos Materiais UDESC
 CAPITULO 1 Propriedades dos gases PGCEM Termodinâmica dos Materiais UDESC Referência Bibliográfica ATKINS, P.; Paula, J. de. Fisico-Química, Vol 1. 8ª ed., Editora LTC, Rio de Janeiro, 2006, cap 1. Ball,
CAPITULO 1 Propriedades dos gases PGCEM Termodinâmica dos Materiais UDESC Referência Bibliográfica ATKINS, P.; Paula, J. de. Fisico-Química, Vol 1. 8ª ed., Editora LTC, Rio de Janeiro, 2006, cap 1. Ball,
Estado Gasoso. Classe: 2 2 a série. Exercícios Complementares - Recuperação Paralela PARTE A
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
= 6, mol de moléculas de um gás possui aproximadamente 6, moléculas deste gás, ou seja, seiscentos e dois sextilhões de moléculas;
 TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
ESTEQUIOMETRIA. 1. Introdução
 ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
Notas de aula - Profa. Zélia Aulas 07,08,09 e 10. Capítulo 3 Relações formais e sistemas amostrais (exemplares)
 Notas de aula - Profa. Zélia Aulas 07,08,09 e 10 Livro texto: Thermodynamics and an Introduction to Thermostatistics (2nd edition) H. B. Callen. Capítulo 3 Relações formais e sistemas amostrais (exemplares)
Notas de aula - Profa. Zélia Aulas 07,08,09 e 10 Livro texto: Thermodynamics and an Introduction to Thermostatistics (2nd edition) H. B. Callen. Capítulo 3 Relações formais e sistemas amostrais (exemplares)
Química Prof. Giacometto
 Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
Termodinâmica Lista de Problemas 1.1
 Termodinâmica - 2018.2 - Lista de Problemas 1.1 1 Termodinâmica Lista de Problemas 1.1 Departamento de Física de Ji-Paraná Universidade Federal de Rondônia Prof. Marco Polo Questão 01 A pressão necessária
Termodinâmica - 2018.2 - Lista de Problemas 1.1 1 Termodinâmica Lista de Problemas 1.1 Departamento de Física de Ji-Paraná Universidade Federal de Rondônia Prof. Marco Polo Questão 01 A pressão necessária
Lista Básica Transformações Gasosas
 1. (Pucrj 2017) Uma certa quantidade de gás ideal ocupa inicialmente um volume 0 com pressão P 0. Se sobre esse gás se realiza um processo isotérmico dobrando sua pressão para 2 P 0. qual será o volume
1. (Pucrj 2017) Uma certa quantidade de gás ideal ocupa inicialmente um volume 0 com pressão P 0. Se sobre esse gás se realiza um processo isotérmico dobrando sua pressão para 2 P 0. qual será o volume
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA PARAÍBA Campus Princesa Isabel. Fluidos. Disciplina: Física Professor: Carlos Alberto
 INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA PARAÍBA Campus Princesa Isabel Fluidos Disciplina: Física Professor: Carlos Alberto Objetivos de aprendizagem Ao estudar este capítulo você aprenderá:
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA PARAÍBA Campus Princesa Isabel Fluidos Disciplina: Física Professor: Carlos Alberto Objetivos de aprendizagem Ao estudar este capítulo você aprenderá:
Mecânica dos Fluidos 1ª parte
 Mecânica dos Fluidos 1ª parte Introdução à Mecânica dos Fluidos Prof. Luís Perna 2010/11 Noção de Fluido Fluido é toda a substância que macroscopicamente apresenta a propriedade de escoar. Essa maior ou
Mecânica dos Fluidos 1ª parte Introdução à Mecânica dos Fluidos Prof. Luís Perna 2010/11 Noção de Fluido Fluido é toda a substância que macroscopicamente apresenta a propriedade de escoar. Essa maior ou
Química B Extensivo V. 7
 Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
GERAL. Unidade 1. Princípios. Elementares
 QUÍMICA GERAL Unidade 1 Princípios Elementares em Química O estudo da química A perspectiva molecular da química A matéria é constituída de relativamente poucos elementos. No nível microscópico, a matéria
QUÍMICA GERAL Unidade 1 Princípios Elementares em Química O estudo da química A perspectiva molecular da química A matéria é constituída de relativamente poucos elementos. No nível microscópico, a matéria
Universidade Estadual do Sudoeste da Bahia
 Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais Mecânica dos Fluidos Física II Prof. Roberto Claudino Ferreira ÍNDICE ) - Introdução; ) - Densidade; 3) - Pressão;
Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais Mecânica dos Fluidos Física II Prof. Roberto Claudino Ferreira ÍNDICE ) - Introdução; ) - Densidade; 3) - Pressão;
Equações-chave FUNDAMENTOS. Seção A. Seção E. Seção F. Seção G. mv 2. E c E P. mgh. Energia total energia cinética energia potencial, ou E E c.
 Equações-chave FUNDAMENTOS Seção A 3 A energia cinética de uma partícula de massa m relaciona-se com sua velocidade v, por: E c mv 2 4 Um corpo de massa m que está a uma altura h da Terra tem energia potencial
Equações-chave FUNDAMENTOS Seção A 3 A energia cinética de uma partícula de massa m relaciona-se com sua velocidade v, por: E c mv 2 4 Um corpo de massa m que está a uma altura h da Terra tem energia potencial
GASES PERFEITOS AULA INTRODUÇÃO
 AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
