AGRUPAMENTO DE CLARA DE RESENDE COD COD
|
|
|
- Ana Júlia Castelhano Casqueira
- 7 Há anos
- Visualizações:
Transcrição
1 CRITÉRIOS ESPECÍFICOS DE AVALIAÇÃO ( Aprovados em Conselho Pedagógico de 21 de Outubro de 2014 ) No caso específico da disciplina de Química, do 12ºano de escolaridade, a avaliação incidirá ainda ao nível de desempenho nas seguintes áreas: CONTEÚDOS CONHECIMENTOS DOMÍNIOS DE REFERÊNCIA/ CAPACIDADES OBJETIVOS/ METAS CURRICULARES UNIDADE I METAIS E LIGAS METÁLICAS 1-Estrutura e propriedades dos metais - Compreender a estrutura e as propriedades dos metais, comparando as com as de sólidos iónicos, moleculares e covalentes: Compreende conceitos e princípios Interpreta leis, teorias e modelos científicos Analisa dados recolhidos à luz de determinados modelos ou quadro teórico 70 % 1.1.Um outro olhar sobre a Tabela Periódica dos elementos 1.2. Ligação química nos metais e noutros sólidos 1. Concluir que os metais são uma materia prima muito utilizada e discutir a sua importância tecnológica e económica. 2. Associar afinidade electrónica à energia libertada na formação de uma mole de iões negativos a partir de uma mole de átomos no estado gasoso. 3. Identificar os elementos metálicos como aqueles que apresentam baixa energia de ionização e os não metálicos como aqueles que apresentam elevada afinidade eletrónica. 4. Relacionar as posições dos elementos metálicos de transição na Tabela Periódica com as configurações electrónicas dos respectivos átomos. 1. Interpretar a ligação metálica como resultado da partilha dos electrões de valência deslocalizados pelos átomos do metal, relacionando a estabilidade da ligação com as interacções entre esses electrões e os cernes dos átomos do metal. 2. Associar a ocorrência de ligação metálica a átomos que apresentam baixa energia de ionização, várias orbitais de valência vazias e um número de electrões de valência menor do que o número de orbitais de valência. 3. Interpretar as propriedades dos metais (condutividade elétrica, brilho, maleabilidade e ductilidade) com base nos electrões de valência do metal. 4. Distinguir sólidos metálicos de sólidos nao metálicos (iónicos, covalentes e Explora saberes para formular questões Seleciona estratégias de resolução de problemas Interpreta fenómenos Aplica os conhecimentos adquiridos em novos contextos e novos problemas Utiliza a linguagem materna e científica de forma correta Pesquisa e seleciona informação Realiza autonomamente os trabalhos/ pesquisas propostos Colabora nos trabalhos de grupo partilhando saberes e responsabilidades Revela espírito crítico de rigor e confiança nos seus raciocínios Respeita a opinião dos outros, normas e regras de trabalho em sala de aula.
2 moleculares), com base no tipo de ligação entre as suas unidades estruturais. 5. Associar cristal a um material no qual as unidades estruturais se encontram organizadas de uma forma repetida e regular no espaço tridimensional, dando exemplos de cristais metálicos, iónicos, covalentes e moleculares. 6. Identificar a sílica, a grafite, os grafenos e os nanotubos de carbono como exemplos de cristais covalentes. 7. Identificar os cristais moleculares como substâncias sólidas constituídas por moléculas organizadas de maneira regular que se mantêm unidas por ligações intermoleculares. 8. Justificar propriedades físicas de sólidos iónicos, covalentes e moleculares (por exemplo dureza do diamante, condutividade eléctrica na grafite, etc.). 9. Relacionar a importância da reciclagem e da revalorização de metais com a limitação de recursos naturais e a diminuição de resíduos e de consumos energéticos. 10. Associar a possibilidade de reciclar metais de forma repetida e sucessiva com a não degradação da estrutura metálica. 2-Degradação dos metais 2.1. Corrosão: uma oxidação indesejada - Consolidar e ampliar conhecimentos sobre reacções de oxidação redução como transformações que envolvem transferência de electrões e energia eléctrica: 1. Indicar que a maioria dos metais de transição apresenta uma grande variedade de estados de oxidação e que essa variedade resulta da perda de electrões de orbitais d. 2. Associar a corrosão atmosférica ao processo natural de oxidação dos metais numa atmosfera rica em oxigénio que é facilitado por um meio aquoso. 3. Relacionar a corrosão dos metais com fenómenos de oxidação-redução que conduzem à formação de óxidos, hidróxidos, sulfuretos ou carbonatos (ferrugem, verdetes ou patine). 4. Interpretar a sequência de processos físico químicos que estão na origem da formação de ferrugem, identificando as condições ambientais que a favorecem. 5. Interpretar o processo de corrosão contínua do ferro com o facto da ferrugem, óxido de ferro (III) hidratado, de composição variável ser permeável, permitindo que o ferro continue exposto ao ar e à humidade. 6. Interpretar o aumento da corrosão de metais pela presença de ácidos ou bases e de poluentes como, por exemplo, o dióxido de enxofre (SO2) e ainda meios com iões
3 cloreto (Cl ). 7. Interpretar o efeito do ph do meio na corrosão dos metais. 8. Acerta equações de oxidação redução em meio ácido. 2.2 Pilhas e baterias: uma oxidação útil 1. Associar pilha (célula galvânica) a um dispositivo em que é produzida corrente eléctrica a partir de um reação de oxidação redução espontânea. 2. Distinguir entre os dois tipos de células eletroquímicas: galvânica e eletrolítica. 3. Interpretar a reacção da célula electroquímica com base em duas semirreações (reações de elétrodo). 4. Relacionar o ânodo de uma célula electroquímica com o local (ou elétrodo) onde ocorre a oxidação e o cátodo com o local (ou elétrodo) onde ocorre a redução. 5. Associar o ânodo de uma célula galvânica ao eléctrodo negativo e o cátodo ao eléctrodo positivo. 6. Interpretar a função da ponte salina como componente de algumas células galvânicas. 7. Indicar e justificar o sentido do fluxo dos electrões no circuito exterior que liga os elétrodos e o sentido dos iões na ponte salina. 8. Associar elétrodo inerte a um elétrodo que não é oxidado o reduzido na reação eletroquímica que ocorre na sua superfície. 9. Representar uma célula galvânica pelo diagrama de célula. 10. Associar a força eletromotriz de uma célula galvânica (ou tensão da célula) à diferença de potencial eléctrico entre os dois elétrodos, medida num voltímetro. 11. Indicar que a diferença de potencial de uma célula galvânica depende da temperatura, da natureza dos elétrodos e da concentração dos iões envolvidos na reação. 12. Associar a tensão padrão de uma célula galvânica à diferença de potencial medida em condições padrão: concentração 1 mol dm- 3 para as soluções e pressão 1, Pa para gases. 13. Identificar o par H + /H2 como termo de comparação para potenciais padrão de redução, associando lhe o potencial zero. 14. Interpretar o conceito de potencial padrão de redução. 15. Prever a maior ou menor extensão de uma reacção de oxidação redução com base na série electroquímica de potenciais padrão de redução. 16. Determinar a força eletromotriz de uma célula eletroquímica em condições padrão
4 a partir de valores dos potenciais padrão de redução Proteção de metais 3. Metais, ambiente e vida 3.2. Metais, complexos e cor 1. Identificar alguns metais e ligas metálicas com elevada resistência à corrosão. 2. Interpretar o processo de protecção catódica e o papel do ânodo de sacrifício em aplicações correntes como, por exemplo, protecção de oleodutos (pipelines), termoacumuladores e navios. 3. Identificar a galvanoplastia como uma técnica de revestimento para protecção de metais e interpretar o processo a partir de série eletroquímica. 4. Identificar a anodização do alumínio como um processo que aproveita o facto de o alumínio ser naturalmente protegido da oxidação pela formação de uma camada Impermeável de óxido de alumínio. Conhecer e compreender a relevância dos metais no ambiente e no organismo humano, designadamente na forma de complexos e como catalisadores: 1. Caracterizar um complexo com base na sua estrutura: ião metálico central rodeado de aniões ou moléculas neutras, designados por ligandos. 2. Indicar que os ligandos têm como característica comum a presença de, pelo menos, um par de electrões não partilhado (não ligante), designando o átomo do ligando que possui o par de eletrões por átomo dador. 3. Interpretar a ligação química que se estabelece entre o metal e os ligandos com base na partilha do par de eletrões não ligantes entre o dador e o metal. 4. Associar o número de coordenação ao número de átomos dadores que envolve o átomo do metal. 5. Caracterizar um ligando polidentado, ou quelante, como um ligando que pode coordenar se ao ião metálico central por mais do que um átomo dador, identificandoo com base na sua estrutura. 6. Justificar a utilização do ácido etilenodiaminotetra acético (EDTA) na complexação de metais em situações em que estes são prejudiciais, como, por exemplo, na Indústria alimentar, em detergentes, e na terapia de envenenamento por metais pesados. 7. Identificar, com base em informação selecionada, o papel dos complexos em diversas áreas como, por exemplo, em aplicações terapêuticas anticancerígenas (complexos de platina), imagiologia médica (complexos de gadolínio e gálio), e
5 sistemas luminescentes (complexos de európio). 8. Indicar que a cor de complexos está relacionada com transições eletrónicas envolvendo eletrões de orbitais d Os metais no organismo humano 3.4. Os metais como catalisadores 1. Identificar, a partir de informação selecionada, alguns metais essenciais à vida (Fe, Mg, Ca, K, Na, etc.) e indicar a sua função. 2. Relacionar a toxicidade de alguns metais (Pb, Cr, Hg, etc.) com os efeitos no organismo humano. 3. Indicar que a hemoglobina é uma proteína que contém, por cada molécula, quatro Grupos hemo, identificando cada um destes grupos como um complexo de ferro. 4. Interpretar a Ligação da hemoglobina ao oxigénio como cooperativa, concluindo que quanto mais oxigénio estiver ligado mais fácil será a incorporação de moléculas adicionais de oxigénio e que, inversamente, se estiver presente pouco oxigénio a sua dissociação será mais rápida. 5. Interpretar a influência do ph do meio na fixação de oxigénio pela hemoglobina. 6. Identificar a capacidade da hemoglobina para formar um complexo muito estável com o monóxido de carbono por troca com o oxigénio. 7. Interpretar as propriedade básicas ou ácidas de uma solução de um sal com base na hidrólise de iões, relacionando-- as com os valores das constantes de acidez ou de basicidade dos iões do sal. 8. Explicitar o significado de grau de ionização de ácidos e bases. 9. Relacionar as constantes de acidez e de basicidade com o grau de ionização. 10. Associar o efeito tampão de uma solução à capacidade desta manter o seu ph sensivelmente constante, mesmo quando se adicionam pequenas quantidades de ácido forte ou base forte. 11. Interpretar o papel do CO2 como regulador do ph do sangue com base no par CO2 /HCO Relacionar o efeito tampão de uma solução com a sua composição. 1. Associar a importância dos catalisadores em química, bioquímica na actividade industrial com a necessidade de acelerar reações que se dão em condições de temperatura e/ou concentrações comparativamente baixas. 2. Identificar as enzimas como catalisadores bioquímicos indispensáveis para que as reações químicas em sistemas biológicos ocorram em tempo útil.
6 3. Associar a ação de um catalisador numa reação química à alteração da velocidade da reacção sem alterar a sua extensão. 4. Distinguir catálise homogénea e heterogénea com base estado físico dos reagentes e do catalisador. 5. Identificar, com base em informação selecionada, a predominância dos metais de transição na composição de catalisadores utilizados para os mais diversos fins. UNIDADE II- COMBUSTÍVEIS, ENERGIA E AMBIENTE 1-Combustíveis fósseis: o carvão, o crude e o gás natural - Compreender processos de obtenção de combustíveis e outros derivados do petróleo na indústria petrolífera e relaciona a estrutura de compostos orgânicos com algumas das suas propriedades físicas e químicas: 1.1.Do crude ao gás de petróleo liquefeito (GPL) e aos fuéis: destilação fraccionada e craking do petróleo 1. Justificar a utilização da técnica de destilação fracionada para obter as principais frações do petróleo bruto. 2. Identificar, com base em informação selecionada, as principais frações obtidas na destilação fracionada do petróleo bruto com base no intervalo de temperatura de recolha e tamanho da cadeia carbonada, indicando as principais aplicações. 3. Associar o cracking do petróleo a reacções em que moléculas grandes de hidrocarbonetos são transformadas em moléculas mais pequenas, por aquecimento e ação de catalisadores. 4. Associar as reações de isomerização à obtenção d hidrocarbonetos ramificados a partir de hidrocarbonetos lineares, por aquecimento e utilizando catalisadores. 5. Aplicar princípios de nomenclatura para atribuir nomes e escrever fórmulas de estrutura de alcanos, cicloalcanos, alcenos e alcinos. 6. Aplicar princípios de nomenclatura da para atribuir nomes e escrever fórmulas de estrutura de álcoois e éteres. 7. Identificar isómeros como compostos que apresentam a mesma fórmula molecular e diferem na fórmula de estrutura e, por essa razão, também nas propriedades físicas e químicas. 8. Identificar isomeria de cadeia, de posição e de grupo funcional. 9. Identificar hidrocarbonetos aromáticos. 10. Verificar a existência, para algumas moléculas, de várias estruturas de Lewis que
7 1.2. Os combustíveis gasosos, líquidos e sólidos: compreender as diferenças seguem a regra do octeto (híbridos de ressonância). 11. Interpretar os conceitos de ressonância e de deslocalização eletrónica com base nas estruturas de Kekulé para o benzeno. 12. Interpretar a igualdade dos comprimentos de ligação C C, na molécula de benzeno, da ligação S O, na molécula de dióxido de enxofre, e da ligação O-O, na molécula de ozono, com base em estruturas de ressonância. 13. Identificar a polaridade das moléculas com a existência de uma distribuição assimétrica de carga à qual se associa um dipolo elétrico. 14. Classificar moléculas de alcanos, alcenos, cicloalcanos, benzeno, álcoois e éteres quanto à polaridade. 1. Interpretar e aplicar a equação de estado dos gases ideais. 2. Indicar a unidade SI de pressão e outras unidades de uso corrente (torricelli, atmosfera e bar), efectuando conversões entre as mesmas. 3. Associar o conceito de gás ideal aos gases que obedecem à equação dos gases ideais (ou perfeitos) e de gás real aos gases que se afastam daquele comportamento, à medida que a pressão aumenta ou a temperatura diminui. 4. Relacionar a massa volúmica de um gás ideal com a pressão e com a temperatura, por aplicação da equação de estado de um gás ideal. 5. Indicar que nos estados condensados da matéria (líquido e sólido), ao contrário do que acontece nos gases ideais, não se pode desprezar nem o tamanho das suas unidades estruturais nem as interacções entre elas para determinar as suas propriedades. 6. Relacionar a variação de algumas propriedades físicas dos alcanos (estado físico, ponto de fusão e ponto de ebulição) com o tamanho e forma das respectivas moléculas e a intensidade das ligações intermoleculares que se estabelecem. 7. Relacionar propriedades de combustíveis (estado físico, ponto de ebulição e massa volúmica) com processos de transporte, armazenamento e utilização, incluindo medidas de segurança. 8. Discutir, com base em informação selecionad papel da investigação em química na optimização da produção de combustíveis alternativos e na procura dos combustíveis do futuro. 2.De onde vem a energia dos - Ampliar conhecimentos sobre conversões e trocas de energia em reacções
8 combustíveis químicas, em particular no caso dos combustíveis: UNIDADE III- PLÁSTICOS, VIDROS E NOVOS MATERIAIS 1- Os plásticos e os materiais poliméricos 1. Identificar a entalpia como uma grandeza característica de cada estado de um sistema, concluindo que a sua variação é independente da forma como o sistema evolui entre dois estados. 2. Associar entalpia padrão de reação à variação de entalpia numa reação que ocorre nas condições padrão. 3. Associar designações específicas para a entalpia padrão quando associada a reações específicas: por exemplo, entalpia padrão de formação, entalpia padrão de combustão, entalpia padrão de dissolução. 4. Relacionar a entalpia padrão de combustão com o poder energético dos combustíveis. 5. Determinar a entalpia padrão de uma reacção a partir das entalpias padrão de formação dos reagentes e produtos da reação. 6. Determinar, aplicando a Lei de Hess, a entalpia padrão de uma reação. 7. Interpretar o facto de, regra geral, combustíveis oxigenados como álcoois e éteres terem menor poder energético do que os combustíveis de hidrocarbonetos. - Caraterizar os polímeros como uma classe de materiais constituídos por macromoléculas e distingui polímeros naturais, artificiais e sintéticos: 1. Caracterizar um polímero como um material constituído por macromoléculas. 2. Distinguir macromolécula de outras moléculas com número elevado de átomos por serem constituídas por muitas unidades pequenas ligadas umas às outras por ligações covalentes. 3. Distinguir polímeros naturais, artificiais e sintéticos e dar exemplos destes tipos de polímeros. 2 Polímeros sintéticos e a indústria dos polímeros - Compreender como se obtêm polímeros sintéticos e reconhecer que a sua estrutura determina as suas propriedades: 1. Caracterizar uma reação de polimerização como uma reação química em cadeia
9 entre moléculas de monómeros. 2. Distinguir homo e co polímeros com base no número e no tipo de moléculas (monómeros) envolvidas na sua formação. 3. Identificar a unidade estrutural (motivo) de um polímero e relacionar com a estrutura do(s) monómero(s). 4. Associar o grau de polimerização ao número de vezes que a unidade estrutural (motivo) do polímero se repete. 5. Identificar grupos funciona de várias famílias químicas de compostos orgânicos: ácidos carboxílicos, cloretos de ácido, aminas, amidas, éteres, ésteres, aldeídos e cetonas. 6. Distinguir reações de polimerização de adição e de condensação com base na estrutura do(s) monómero(s), e dar exemplos de polímeros de adição e de condensação. 7. Identificar famílias de polímeros (poliolefinas, poliacrílicos, poliuretanos, poliamidas, poliésteres), associando a designação dessas famílias aos grupos funcionais dos monómeros. 8. Concluir que a estrutura (linear, ramificada ou reticulada) da cadeia polimérica determina as propriedades físicas dos polímeros. 9. Discutir, com base em informação selecionada, vantagens e limitações da reciclagem de plásticos. 3. Novos materiais - Conhecer alguns biomateriais e sua aplicações e reconhecer vantagens e limitações da utilização de materiais de base sustentável: 1. Identificar um biomaterial como um material com aplicações biomédicas que implicam interacções com estruturas biológicas com as quais apresenta elevada compatibilidade. 2. Identificar, com base em informação selecionada, aplicações de biomateriais em medicina (cardiologia, ortopedia, oftalmologia e libertação controlada de fármacos). 3. Associar materiais de base sustentável àqueles que, sendo economicamente viáveis, conjugam as seguintes características: são renováveis, recicláveis e biodegradáveis. 4. Pesquisar e analisar informação sobre investigação actual em novos materiais e materiais de base sustentável.
10 DESCRITORES DA AVALIAÇÃO DA DIMENSÃO PRÁTICA/ LABORATORIAL ATIVIDADE OBJETIVOS/ METAS ESPECÍFICAS DAS A.L. e A.P.L. CAPACIDADES D I M E N S Ã O E X P R I M E N T A L ( 30 % ) A.L.I.2 - Um ciclo de Cobre A.P.L. 1-Construção de uma pilha com determinada diferença de potencial elétrico - Compreender como reciclar um metal usando processos químicos: 1. Interpretar e seguir um procedimento que, em condições de segurança, permita realizar uma sequência de reacções envolvendo a utilização de cobre metálico e sua regeneração. 2. Identificar diferentes tipos de reacções presentes num ciclo de cobre e traduzi las por equações químicas. 3. Avaliar a qualidade da execução laboratorial através da determinação do rendimento do ciclo. 4. Identificar alguns problemas de poluição relacionados com a reciclagem do cobre neste processo. - Conceber e fundamentar um percurso investigativo para dar resposta à questão problema: Como construir uma pilha com uma determinada diferença de potencial eléctrico: 1. Apresentar e discutir o percurso investigativo concebido. 2. Executar o procedimento laboratorial proposto. 3. Discutir os resultados obtidos com base nas hipóteses de trabalho: Relacionar quantitativamente a força eletromotriz de uma célula eletroquímica, fora das condições padrão, com as concentrações dos reagentes e produtos e com a temperatura, usando a equação de Nernst. Selecionar um par redox que permita construir uma pilha, com diferença de potencial eléctrico pré definida, a partir de potenciais padrão de redução. Ajustar a concentração das soluções usadas na construção da pilha para obter a diferença de potencial eléctrico pré definida, com base nas previsões fornecidas pela equação de Nernst. *Medir a diferença de potencial eléctrico nos terminais da pilha construída e comparar o valor previsto teoricamente, apontando causas de eventuais desfasamentos. Capacidade de planeamento de experiências/pesquisas para responder a uma questão-problema Capacidade de formulação de hipóteses e previsão de resultados Capacidade de interpretação e critica de resultados no contexto dos problemas Capacidade de registo e organização de observações Desenvolvimento de atitudes e valores inerentes ao trabalho em Ciência Desenvolvimento de sentido crítico na defesa e melhoria da qualidade de vida e do ambiente Desenvolvimento do espírito de tolerância e de cooperação Pesquisa e seleciona informação Planeia e executa atividades e experiências Identifica e seleciona material e equipamento de laboratório Desenvolve trabalho laboratorial com rigor e método Interpreta dados e reformula experiências/pesquisas Elabora relatórios/sínteses das atividades realizadas Realiza autonomamente os trabalhos/ pesquisas propostos Colabora nos trabalhos de grupo partilhando saberes e responsabilidades Revela espírito crítico de rigor e confiança nos seus raciocínios Respeita a opinião dos outros, normas e
11 regras de trabalho em sala de aula e laboratório Relacionar o esgotamento de uma pilha com o estado de equilíbrio do sistema. Medir a diferença de potencial eléctrico nos terminais da pilha construída e comparar o valor obtido com o valor previsto teoricamente, apontando causas de eventuais desfasamentos. Adequa ritmos de trabalho aos objetivos das atividades A.L A cor e a composição quantitativa de soluções com iões metálicos A.L.I.6 Funcionamento de um sistema tampão - Determinar a concentração de uma solução corada pela intensidade da sua cor, utilizando um espetrofotómetro: 1. Aplicar a Lei de Lambert Beer para determinar a concentração de um ião metálico. 2. Traçar uma curva de calibração (absorvência em função da concentração). 3. Determinar a concentração da solução problema a partir da curva de calibração. 4. Verificar desvios à proporcionalidade descrita pela Lei de Lambert Beer para soluções muito concentradas. 5. Identificar e avaliar erros associados a determinações colorimétricas. - Determinar experimentalmente o efeito de um sistema tampão: 1. Realizar uma titulação potenciométrica de um ácido forte base fraca e traçar a respectiva curva de titulação. 2. Identificar zonas tampão e pontos de equivalência. 3. Explicar a existência das zonas tampão na titulação. 4. Identificar os pares de espécie químicas responsáveis pelo efeito tampão. A.L Destilação fraccionada de uma mistura de três componentes - Compreender porque é possível obter do petróleo frações distintas, realizando uma destilação fracionada: 1. Realizar uma destilação fraccionada de uma mistura de composição desconhecida com três componentes. 2. Elaborar um gráfico da temperatura em função do volume de destilado para a destilação realizada. 3. Interpretar o gráfico obtido na destilação fracionada, identificando os componentes da mistura através de consulta de tabelas de pontos de ebulição. 4. Justificar recurso à destilação fraccionada para obter fracções distintas do petróleo.
12 A.L Determinação da entalpia de neutralização da reacção NaOH (aq) + HCl (aq) - Determinar a variação de entalpia na reacção de neutralização de soluções aquosas de hidróxido de sódio e de ácido clorídrico: 1. Realiza uma titulação termométrica. 2. Elaborar o gráfico de temperatura em função do volume de titulante adicionado. 3. Identificar o ponto de equivalência e associá lo à temperatura mais elevada registada no decorrer da titulação. 4. Determinar a entalpia de neutralização. 5. Determinar o erro percentual. A.L Determinação da entalpia de combustão de diferentes álcoois - Investigar a influência da posição do grupo OH e do comprimento da cadeia carbonada de álcoois na energia libertada durante a combustão: 1. Calcular a variação de entalpia de combustão para cada um dos álcoois. 2. Traçar e interpretar o gráfico da variação de entalpia de combustão em função do número de átomos de carbono dos álcoois. 3. Identificar erros que possam ter afetado as medições efetuadas. 4. Concluir qual é a relação entre a variação de entalpia de combustão e a estrutura dos álcoois (comprimento da cadeia carbonada e a posição do grupo OH). A.L Síntese de um polímero - Sintetizar um polímero de condensação: 1. Identificar os monómeros na reacção de síntese e o motivo do polímero. 2. Escrever a equação química que traduz a reacção de síntese a partir das fórmulas químicas dos monómeros. 3. Interpretar e realizar um procedimento que permita sintetizar um polímero por condensação. 4. Explicar o processo de polimerização e avaliar a biodegradabilidade do polímero obtido. NOTA: De acordo com as orientações relativas às metas curriculares homologadas: MEC
Metais e ligas metálicas Estrutura e propriedades dos metais
 AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL Documento(s) Orientador(es): Programa de Química / Metas Curriculares ENSINO SECUNDÁRIO 12º ANO-QUÍMICA DOMÍNIO/SUBDOMÍNIO
AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL Documento(s) Orientador(es): Programa de Química / Metas Curriculares ENSINO SECUNDÁRIO 12º ANO-QUÍMICA DOMÍNIO/SUBDOMÍNIO
PLANIFICAÇÃO ANUAL Documentos Orientadores: Programa e Metas Curriculares
 Química/12º Ano/Secundário Página 1 de 6 PLANIFICAÇÃO ANUAL Documentos Orientadores: Programa e Metas Curriculares Metais e ligas metálicas Estrutura e propriedades dos metais Um outro olhar sobre a Tabela
Química/12º Ano/Secundário Página 1 de 6 PLANIFICAÇÃO ANUAL Documentos Orientadores: Programa e Metas Curriculares Metais e ligas metálicas Estrutura e propriedades dos metais Um outro olhar sobre a Tabela
METAIS E LIGAS METÁLICAS
 DEPARTAMENTO DE C. Físico-Químicas DISCIPLINA: Química COMPETÊNCIAS/CONTEÚDOS 12º ano... Domínios / Objetivos Conceitos/ Conteúdos Calendarização (blocos) METAIS E LIGAS METÁLICAS METAIS E LIGAS METÁLICAS
DEPARTAMENTO DE C. Físico-Químicas DISCIPLINA: Química COMPETÊNCIAS/CONTEÚDOS 12º ano... Domínios / Objetivos Conceitos/ Conteúdos Calendarização (blocos) METAIS E LIGAS METÁLICAS METAIS E LIGAS METÁLICAS
P L A N I F I C A Ç Ã O A N U A L
 P L A N I F I C A Ç Ã O A N U A L DEPARTAMENTO: MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS ÁREA DISCIPLINAR: 510 - CIÊNCIAS FÍSICO-QUÍMICAS DISCIPLINA: Química NÍVEL DE ENSINO: Secundário CURSO: Ciências e Tecnologias
P L A N I F I C A Ç Ã O A N U A L DEPARTAMENTO: MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS ÁREA DISCIPLINAR: 510 - CIÊNCIAS FÍSICO-QUÍMICAS DISCIPLINA: Química NÍVEL DE ENSINO: Secundário CURSO: Ciências e Tecnologias
P L A N I F I C A Ç Ã O A N U A L
 P L A N I F I C A Ç Ã O A N U A L DEPARTAMENTO: MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS ÁREA DISCIPLINAR: 510 - CIÊNCIAS FÍSICO-QUÍMICAS DISCIPLINA: Química NÍVEL DE ENSINO: Secundário CURSO: Ciências e Tecnologias
P L A N I F I C A Ç Ã O A N U A L DEPARTAMENTO: MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS ÁREA DISCIPLINAR: 510 - CIÊNCIAS FÍSICO-QUÍMICAS DISCIPLINA: Química NÍVEL DE ENSINO: Secundário CURSO: Ciências e Tecnologias
2017/2018-1º Período
 2017/2018-1º Período DISCIPLINA: Química ANO: 12º CURSO: Ciências e Tecnologias Total de aulas previstas: 39 Domínio: Metais e ligas metálicas Subdomínio: Estrutura e propriedades dos metais Objetivo Geral:
2017/2018-1º Período DISCIPLINA: Química ANO: 12º CURSO: Ciências e Tecnologias Total de aulas previstas: 39 Domínio: Metais e ligas metálicas Subdomínio: Estrutura e propriedades dos metais Objetivo Geral:
Escola Secundária de Lagoa. Ficha de Trabalho 4. Química 12º Ano Paula Melo Silva. Conteúdos e Metas
 Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 4 Combustíveis, energia e ambiente Conteúdos e Metas Combustíveis fósseis: o carvão, o crude e o gás natural Compreender processos
Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 4 Combustíveis, energia e ambiente Conteúdos e Metas Combustíveis fósseis: o carvão, o crude e o gás natural Compreender processos
ESCOLA SECUNDÁRIA/3 RAINHA SANTA ISABEL ESTREMOZ 12 º ANO (PLANO A LONGO PRAZO) Maria Guiomar Cabacinho. Ano Letivo 2017/2018
 ESCOLA SECUNDÁRIA/3 RAINHA SANTA ISABEL 40643 ESTREMOZ 1 º ANO (PLANO A LONGO PRAZO) Maria Guiomar Cabacinho Ano Letivo 017/018 Plano a Longo Prazo ( Química 1º Ano ) 017 /018. Página 1 de 7 FINALIDADES
ESCOLA SECUNDÁRIA/3 RAINHA SANTA ISABEL 40643 ESTREMOZ 1 º ANO (PLANO A LONGO PRAZO) Maria Guiomar Cabacinho Ano Letivo 017/018 Plano a Longo Prazo ( Química 1º Ano ) 017 /018. Página 1 de 7 FINALIDADES
MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina Química Módulos 1,2,3
 Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
para as soluções e pressão para gases. Identificar o par
 Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina Química Módulo 1
 Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina Química Módulo 2
 Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
Guiões de exploração de recursos multimédia
 Guiões de recursos multimédia Novo 12Q O é uma ferramenta inovadora que possibilita, em sala de aula, a fácil exploração do projeto Novo 12Q através das novas tecnologias. Permite o acesso a um vasto conjunto
Guiões de recursos multimédia Novo 12Q O é uma ferramenta inovadora que possibilita, em sala de aula, a fácil exploração do projeto Novo 12Q através das novas tecnologias. Permite o acesso a um vasto conjunto
Componente escrita minutos Componente prática minutos
 Informação 2016 Prova de Equivalência à Frequência de QUÍMICA Código 342 Cursos Científico-Humanísticos 12.º Ano de Escolaridade Tipo de Prova Escrita e Prática Duração 180 + 30 minutos Componente escrita...
Informação 2016 Prova de Equivalência à Frequência de QUÍMICA Código 342 Cursos Científico-Humanísticos 12.º Ano de Escolaridade Tipo de Prova Escrita e Prática Duração 180 + 30 minutos Componente escrita...
Componente escrita minutos Componente prática minutos (tolerância)
 Informação 2017 Prova de Equivalência à Frequência de QUÍMICA Código 342 Cursos Científico-Humanísticos 12.º Ano de Escolaridade Tipo de Prova Escrita e Prática Duração 180 + 30 minutos (tolerância) Componente
Informação 2017 Prova de Equivalência à Frequência de QUÍMICA Código 342 Cursos Científico-Humanísticos 12.º Ano de Escolaridade Tipo de Prova Escrita e Prática Duração 180 + 30 minutos (tolerância) Componente
PLANIFICAÇÃO A LONGO PRAZO
 º ANO PLANIFICAÇÃO A LONGO PRAZO Ano Letivo 08-09 QUÍMICA Docente: Sandra Isabe Coelho Barradas Planificação Longo Prazo Química.º Ano (08/09) ÍNDICE. Aprendizagens Essenciais da disciplina de Química.
º ANO PLANIFICAÇÃO A LONGO PRAZO Ano Letivo 08-09 QUÍMICA Docente: Sandra Isabe Coelho Barradas Planificação Longo Prazo Química.º Ano (08/09) ÍNDICE. Aprendizagens Essenciais da disciplina de Química.
MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina Química Módulo 3
 Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2018/2019 Disciplina
Componente escrita minutos Componente prática minutos (tolerância)
 Informação 2018 Prova de Equivalência à Frequência de QUÍMICA Código 342 Cursos Científico-Humanísticos 12.º Ano de Escolaridade Tipo de Prova Escrita e Prática Duração 180 + 30 minutos (tolerância) Componente
Informação 2018 Prova de Equivalência à Frequência de QUÍMICA Código 342 Cursos Científico-Humanísticos 12.º Ano de Escolaridade Tipo de Prova Escrita e Prática Duração 180 + 30 minutos (tolerância) Componente
Compreender como se obtêm polímeros sintéticos e reconhecer que a sua estrutura determina as suas propriedades.
 Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 12 Plásticos, Vidros e Novos Materiais Conteúdos e Metas Os plásticos e os materiais poliméricos Caracterizar os polímeros
Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 12 Plásticos, Vidros e Novos Materiais Conteúdos e Metas Os plásticos e os materiais poliméricos Caracterizar os polímeros
SECRETARIA REGIONAL DA EDUCAÇÃO E CULTURA Direção Regional da Educação
 Informação-Prova de Equivalência à Frequência (De acordo com o Capítulo III, Artigo 23º do Despacho Normativo n.º 4-A/2018, de 14 de fevereiro de 2018) Curso(s)/Componente de Formação: X Científico-Humanístico
Informação-Prova de Equivalência à Frequência (De acordo com o Capítulo III, Artigo 23º do Despacho Normativo n.º 4-A/2018, de 14 de fevereiro de 2018) Curso(s)/Componente de Formação: X Científico-Humanístico
PROVA DE INGRESSO ANO LETIVO 2018/2019 PROVA DE QUÍMICA OBJETIVOS
 UNIVERSIDADE DE CABO VERDE PROVA DE INGRESSO ANO LETIVO 2018/2019 PROVA DE QUÍMICA OBJETIVOS OBJETIVOS Reconhecer o átomo de hidrogénio como átomo mais simples. Conhecer o espetro de emissão de hidrogénio.
UNIVERSIDADE DE CABO VERDE PROVA DE INGRESSO ANO LETIVO 2018/2019 PROVA DE QUÍMICA OBJETIVOS OBJETIVOS Reconhecer o átomo de hidrogénio como átomo mais simples. Conhecer o espetro de emissão de hidrogénio.
Química 12.º Ano Carlos Alberto da Silva Ribeiro de Melo TEMAS OBJECTIVOS DE APRENDIZAGEM SITUAÇÕES E EXPERIÊNCIAS EDUCATIVAS AULAS
 Química 12.º Ano Carlos Alberto da Silva Ribeiro de Melo TEMAS OBJECTIVOS DE APRENDIZAGEM SITUAÇÕES E EXPERIÊNCIAS EDUCATIVAS AULAS 1. Metais e ligas metálicas 1.1. Metais e ligas metálicas 1.1.1. A importância
Química 12.º Ano Carlos Alberto da Silva Ribeiro de Melo TEMAS OBJECTIVOS DE APRENDIZAGEM SITUAÇÕES E EXPERIÊNCIAS EDUCATIVAS AULAS 1. Metais e ligas metálicas 1.1. Metais e ligas metálicas 1.1.1. A importância
Informação-Prova de Equivalência à Frequência (De acordo com o Capítulo III, Artigo 23º do Despacho normativo nº 1-A/2017, de 10 de fevereiro)
 Informação-Prova de Equivalência à Frequência (De acordo com o Capítulo III, Artigo 23º do Despacho normativo nº 1-A/2017, de 10 de fevereiro) Curso(s)/Componente de Formação: X Científico-Humanístico
Informação-Prova de Equivalência à Frequência (De acordo com o Capítulo III, Artigo 23º do Despacho normativo nº 1-A/2017, de 10 de fevereiro) Curso(s)/Componente de Formação: X Científico-Humanístico
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular)
 Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Sumário. 1 Introdução: matéria e medidas 1. 2 Átomos, moléculas e íons Estequiometria: cálculos com fórmulas e equações químicas 67
 Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
MATRIZ DA PROVA DE EXAME A NÍVEL DE ESCOLA AO ABRIGO DO DECRETO-LEI Nº
 MATRIZ DA PROVA DE EXAME A NÍVEL DE ESCOLA AO ABRIGO DO DECRETO-LEI Nº 357 / 2007, de 29 de Outubro (Duração: 90minutos + 30 minutos de tolerância) 12º ano Química (Cursos Científico-Humanísticos Decreto-lei
MATRIZ DA PROVA DE EXAME A NÍVEL DE ESCOLA AO ABRIGO DO DECRETO-LEI Nº 357 / 2007, de 29 de Outubro (Duração: 90minutos + 30 minutos de tolerância) 12º ano Química (Cursos Científico-Humanísticos Decreto-lei
Informação-Prova de Equivalência à Frequência de. Química 12º ano. Ano Letivo: 2016/2017 Código da Prova: 342
 Química 12º ano Modalidade da Prova: Escrita e Prática Duração da Prova: Prova Escrita: 90 minutos Prova Prática: 90 minutos Caracterização da Prova: A prova de exame integra itens de tipologia diversificada,
Química 12º ano Modalidade da Prova: Escrita e Prática Duração da Prova: Prova Escrita: 90 minutos Prova Prática: 90 minutos Caracterização da Prova: A prova de exame integra itens de tipologia diversificada,
Agrupamento de Escolas de S. Pedro do Sul Escola-sede: Escola Secundária de São Pedro do Sul
 Agrupamento de Escolas de S. Pedro do Sul 161780 Escola-sede: Escola Secundária de São Pedro do Sul INFORMAÇÃO PROVA DE EQUIVALÊNCIA À FREQUÊNCIA ENSINO SECUNDÁRIO ANO LETIVO: 2014/2015 1 ª fase CÓDIGO
Agrupamento de Escolas de S. Pedro do Sul 161780 Escola-sede: Escola Secundária de São Pedro do Sul INFORMAÇÃO PROVA DE EQUIVALÊNCIA À FREQUÊNCIA ENSINO SECUNDÁRIO ANO LETIVO: 2014/2015 1 ª fase CÓDIGO
3. Misturas, Substâncias Simples e Compostas e Processos de Separação de Misturas.
 Conteúdo 1. Elementos, modelos atômicos e representações: modelos atômicos de Dalton, Tomson, Rutherford-Bohr. Elemento químico. Número atômico e número de massa. Prótons, elétrons e nêutrons. Distribuição
Conteúdo 1. Elementos, modelos atômicos e representações: modelos atômicos de Dalton, Tomson, Rutherford-Bohr. Elemento químico. Número atômico e número de massa. Prótons, elétrons e nêutrons. Distribuição
Agrupamento de Escolas de S. Pedro do Sul Escola sede: Escola Secundária de São Pedro do Sul
 Agrupamento de Escolas de S. Pedro do Sul 161780 Escola sede: Escola Secundária de São Pedro do Sul INFORMAÇÃO PROVA DE EQUIVALÊNCIA À FREQUÊNCIA 12º ANO ENSINO SECUNDÁRIO ANO LETIVO: 2016/2017 1 ª/2ª
Agrupamento de Escolas de S. Pedro do Sul 161780 Escola sede: Escola Secundária de São Pedro do Sul INFORMAÇÃO PROVA DE EQUIVALÊNCIA À FREQUÊNCIA 12º ANO ENSINO SECUNDÁRIO ANO LETIVO: 2016/2017 1 ª/2ª
1. Reconhecer o átomo de hidrogénio como o Átomo mais simples.
 PROVA DE INGRESSO ANO LECTIVO 2016/2017 QUÍMICA 1. Reconhecer o átomo de hidrogénio como o Átomo mais simples. 2. Conhecer o espectro de emissão de hidrogénio. 3. Compreender como os resultados do estudo
PROVA DE INGRESSO ANO LECTIVO 2016/2017 QUÍMICA 1. Reconhecer o átomo de hidrogénio como o Átomo mais simples. 2. Conhecer o espectro de emissão de hidrogénio. 3. Compreender como os resultados do estudo
FÍSICA E QUÍMICA A 10º ANO
 DEPARTAMENTO DE MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS Planificação das Aprendizagens Essenciais Elaborada no âmbito do Projeto de Autonomia e Flexibilidade Curricular (PAFC) FÍSICA E QUÍMICA A 10º ANO 2018
DEPARTAMENTO DE MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS Planificação das Aprendizagens Essenciais Elaborada no âmbito do Projeto de Autonomia e Flexibilidade Curricular (PAFC) FÍSICA E QUÍMICA A 10º ANO 2018
INTRODUÇÃO 12.º ANO ENSINO SECUNDÁRIO QUÍMICA APRENDIZAGENS ESSENCIAIS ARTICULAÇÃO COM O PERFIL DOS ALUNOS
 APRENDIZAGENS ESSENCIAIS ARTICULAÇÃO COM O PERFIL DOS 12.º ANO ENSINO SECUNDÁRIO QUÍMICA INTRODUÇÃO A disciplina de Química integra a componente específica do plano de estudos do Curso Científico-Humanístico
APRENDIZAGENS ESSENCIAIS ARTICULAÇÃO COM O PERFIL DOS 12.º ANO ENSINO SECUNDÁRIO QUÍMICA INTRODUÇÃO A disciplina de Química integra a componente específica do plano de estudos do Curso Científico-Humanístico
QUÍMICA Objeto de avaliação. Prova º Ano de Escolaridade (Decreto-Lei n.º 139/2012, de 5 de julho)
 INFORMAÇÃO-PROVA DE EQUIVALÊNCIA À FREQUÊNCIA QUÍMICA 2018 Prova 342 12.º Ano de Escolaridade (Decreto-Lei n.º 139/2012, de 5 de julho) O presente documento divulga informação relativa à Prova de Equivalência
INFORMAÇÃO-PROVA DE EQUIVALÊNCIA À FREQUÊNCIA QUÍMICA 2018 Prova 342 12.º Ano de Escolaridade (Decreto-Lei n.º 139/2012, de 5 de julho) O presente documento divulga informação relativa à Prova de Equivalência
UNIVERSIDADE DO ESTADO DO PARÁ QUIMICA PRISE/PROSEL- 1ª ETAPA
 UNIVERSIDADE DO ESTADO DO PARÁ QUIMICA PRISE/PROSEL- 1ª ETAPA EIXO-TEMÁTICO: MATÉRIA, TRASFORMAÇÕES QUÍMICAS E AMBIENTE COMPETÊNCIAS HABILIDADES CONTEÚDO Descrever as transformações químicas em linguagem
UNIVERSIDADE DO ESTADO DO PARÁ QUIMICA PRISE/PROSEL- 1ª ETAPA EIXO-TEMÁTICO: MATÉRIA, TRASFORMAÇÕES QUÍMICAS E AMBIENTE COMPETÊNCIAS HABILIDADES CONTEÚDO Descrever as transformações químicas em linguagem
A prova tem por referência o Programa da disciplina de Química de 12º ano.
 INFORMAÇÃO PROVA de Equivalência à Frequência Química ABRIL de 2015 Prova 342 2015 ENSINO SECUNDÁRIO (Decreto-Lei n.º 139/2012, de 5 de julho) O presente documento divulga informação relativa à prova de
INFORMAÇÃO PROVA de Equivalência à Frequência Química ABRIL de 2015 Prova 342 2015 ENSINO SECUNDÁRIO (Decreto-Lei n.º 139/2012, de 5 de julho) O presente documento divulga informação relativa à prova de
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
1.O B J E T O D E A V A L I A Ç Ã O :
 data: 18. 05. 2018 informação-prova de equivalência à frequência 342 QUÍMICA PROVA ESCRITA e PROVA PRÁTICA 12.ºano de escolaridade (anual) /formação específica curso científico-humanístico de Ciências
data: 18. 05. 2018 informação-prova de equivalência à frequência 342 QUÍMICA PROVA ESCRITA e PROVA PRÁTICA 12.ºano de escolaridade (anual) /formação específica curso científico-humanístico de Ciências
ESCOLA BÁSICA DE MAFRA 2016/2017 FÍSICO-QUÍMICA
 7º ano Espaço Materiais Energia Atividades Práticas Compreender globalmente a constituição e a caracterização do Universo e do Sistema Solar e a posição que a Terra ocupa nesses sistemas. Saber associar
7º ano Espaço Materiais Energia Atividades Práticas Compreender globalmente a constituição e a caracterização do Universo e do Sistema Solar e a posição que a Terra ocupa nesses sistemas. Saber associar
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
ESCOLA SALESIANA DE MANIQUE FICHA DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011
 ESCOLA SALESIANA DE MANIQUE FICHA DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011 Nome: 12.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. A maioria das reacções químicas ocorre com
ESCOLA SALESIANA DE MANIQUE FICHA DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011 Nome: 12.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. A maioria das reacções químicas ocorre com
Objeto de avaliação INFORMAÇÃO EXAME DE EQUIVALÊNCIA À FREQUÊNCIA QUÍMICA PROVA º ANO DE ESCOLARIDADE
 INFORMAÇÃO EXAME DE EQUIVALÊNCIA À FREQUÊNCIA QUÍMICA PROVA 342 12º ANO DE ESCOLARIDADE O presente documento divulga informação relativa à prova de equivalência à frequência do ensino secundário da disciplina
INFORMAÇÃO EXAME DE EQUIVALÊNCIA À FREQUÊNCIA QUÍMICA PROVA 342 12º ANO DE ESCOLARIDADE O presente documento divulga informação relativa à prova de equivalência à frequência do ensino secundário da disciplina
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª Série
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª Série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª Série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
1.O B J E T O D E A V A L I A Ç Ã O :
 data: 02. 05. 2017 informação-prova de equivalência à frequência 342 QUÍMICA PROVA ESCRITA e PROVA PRÁTICA 12.ºano de escolaridade (anual) /formação específica curso científico-humanístico de Ciências
data: 02. 05. 2017 informação-prova de equivalência à frequência 342 QUÍMICA PROVA ESCRITA e PROVA PRÁTICA 12.ºano de escolaridade (anual) /formação específica curso científico-humanístico de Ciências
METAS CURRICULARES DE QUÍMICA 12.º ano
 METAS CURRICULARES DE QUÍMICA 12.º ano Curso científico- humanístico de Ciências e Tecnologias Coordenadores gerais Carlos Fiolhais (coordenação científica), Isabel Festas, Helena Damião (coordenação pedagógica)
METAS CURRICULARES DE QUÍMICA 12.º ano Curso científico- humanístico de Ciências e Tecnologias Coordenadores gerais Carlos Fiolhais (coordenação científica), Isabel Festas, Helena Damião (coordenação pedagógica)
Módulo 1. CONTEÚDOS E OBJETIVOS
 Módulo 1. CONTEÚDOS E OBJETIVOS CONTEÚDOS OBJETIVOS 1. Elementos químicos e sua organização: - Massa e tamanho dos átomos: - Massa isotópica e massa atómica relativa média Quantidade de matéria e massa
Módulo 1. CONTEÚDOS E OBJETIVOS CONTEÚDOS OBJETIVOS 1. Elementos químicos e sua organização: - Massa e tamanho dos átomos: - Massa isotópica e massa atómica relativa média Quantidade de matéria e massa
342 QUÍMICA escrita e prática 12.ºano de escolaridade
 informação-prova de equivalência à frequência data:. 0 5. 20 342 QUÍMICA escrita e prática 12.ºano de escolaridade curs o cien t íf ico -h um an ístic o de CIÊNCIAS E TECNOLOGIAS formação específica 20
informação-prova de equivalência à frequência data:. 0 5. 20 342 QUÍMICA escrita e prática 12.ºano de escolaridade curs o cien t íf ico -h um an ístic o de CIÊNCIAS E TECNOLOGIAS formação específica 20
Ano Letivo 2017/ Matriz do Teste de Avaliação de Física e Química A 10º Ano. 2 de fevereiro de minutos
 Matriz do Teste de Avaliação de Física e Química A 10º Ano 2 de fevereiro de 2018 120 minutos Objeto de avaliação O teste tem por referência as metas curriculares definidas para o 10.º ano do ensino secundário
Matriz do Teste de Avaliação de Física e Química A 10º Ano 2 de fevereiro de 2018 120 minutos Objeto de avaliação O teste tem por referência as metas curriculares definidas para o 10.º ano do ensino secundário
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011
 ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011 Nome: 12.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: GRUPO I 1. A revolução industrial foi construída
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011 Nome: 12.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: GRUPO I 1. A revolução industrial foi construída
MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2016/2017 Disciplina Química Módulos 1,2,3
 Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2016/2017 Disciplina
Agrupamento de Escolas de Rio Tinto nº 3 Escola Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS MATRIZ DE PROVA DE AVALIAÇÃO (Avaliação em regime não presencial) Ano Letivo 2016/2017 Disciplina
UNIVERSIDADE DO ESTADO DO PARÁ PROCESSO SELETIVO - QUÍMICA PROSEL/ PRISE 1ª ETAPA
 UNIVERSIDADE DO ESTADO DO PARÁ PROCESSO SELETIVO - QUÍMICA PROSEL/ PRISE 1ª ETAPA EIXO TEMÁTICO: MATÉRIA. VIDA E AMBIENTE CONTEÚDO COMPETÊNCIAS HABILIDADES - Aplicar conhecimentos sobre a evolução dos
UNIVERSIDADE DO ESTADO DO PARÁ PROCESSO SELETIVO - QUÍMICA PROSEL/ PRISE 1ª ETAPA EIXO TEMÁTICO: MATÉRIA. VIDA E AMBIENTE CONTEÚDO COMPETÊNCIAS HABILIDADES - Aplicar conhecimentos sobre a evolução dos
PROTECÇÃO DOS METAIS
 PROTECÇÃO DOS METAIS FORMAÇÃO DE LIGAS Neste caso associase o metal a proteger a outro, originando uma liga altamente resistente à corrosão. Exemplo: aço inox PROTECÇÃO CATÓDICA A protecção catódica é
PROTECÇÃO DOS METAIS FORMAÇÃO DE LIGAS Neste caso associase o metal a proteger a outro, originando uma liga altamente resistente à corrosão. Exemplo: aço inox PROTECÇÃO CATÓDICA A protecção catódica é
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Escola Secundária de Lagoa. Ficha de Trabalho 15. Física e Química A 11º Ano Paula Melo Silva. Escola Secundária de Lagoa Paula Melo Silva Página 1
 Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva AL 1.1. Síntese do Ácido Acetilsalicílico. Objetivo geral: Realizar a síntese do ácido acetilsalicílico e determinar o rendimento.
Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva AL 1.1. Síntese do Ácido Acetilsalicílico. Objetivo geral: Realizar a síntese do ácido acetilsalicílico e determinar o rendimento.
ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA
 ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA CURSOS PROFISSIONAIS Disciplina: FÍSICA E QUÍMICA Módulo (*) : Q4 Equilíbrio Ácido-base + E.Q4 Titulações Ácido-base (*) e extensão do módulo, se aplicável.
ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA CURSOS PROFISSIONAIS Disciplina: FÍSICA E QUÍMICA Módulo (*) : Q4 Equilíbrio Ácido-base + E.Q4 Titulações Ácido-base (*) e extensão do módulo, se aplicável.
Cronograma de Aulas 1º SEMESTRE. Data Frente Aula Professor 05/03 e 12/03
 Faculdade de Odontologia de Araçatuba Cursinho Daca Cronograma de Aulas 1º SEMESTRE Área de Conhecimento: Ciências da Natureza e Suas Tecnologias Curso: Extensivo Disciplina: Química Data Frente Aula Professor
Faculdade de Odontologia de Araçatuba Cursinho Daca Cronograma de Aulas 1º SEMESTRE Área de Conhecimento: Ciências da Natureza e Suas Tecnologias Curso: Extensivo Disciplina: Química Data Frente Aula Professor
IPV.ESA Volume de Trabalho Total (horas): 132 Total Horas de Contacto: 60 T TP P PL Competências
 Unidade Curricular: Química Geral Área Científica: Ciências Químicas Curso / Ciclo: Engenharia Alimentar 1º Ciclo Docente Responsável: Fernando Jorge Andrade Gonçalves Ano Regime Tipo 1º Semestral Obrigatória
Unidade Curricular: Química Geral Área Científica: Ciências Químicas Curso / Ciclo: Engenharia Alimentar 1º Ciclo Docente Responsável: Fernando Jorge Andrade Gonçalves Ano Regime Tipo 1º Semestral Obrigatória
Química 12º ano Ano Letivo: 2014/2015 Código da Prova: 342
 Modalidade da Prova: Escrita e Prática Duração da Prova: Prova Escrita: 90 minutos Prova Prática: 90 minutos +30 minutos (tolerância) Caracterização da Prova: A prova de exame integra itens de tipologia
Modalidade da Prova: Escrita e Prática Duração da Prova: Prova Escrita: 90 minutos Prova Prática: 90 minutos +30 minutos (tolerância) Caracterização da Prova: A prova de exame integra itens de tipologia
Metais no Organismo Humano
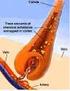 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Química. divulgação. Comparativos curriculares. Material de. A coleção Ser Protagonista Química e o currículo do Estado de São Paulo.
 Comparativos curriculares SM Química Ensino médio Material de divulgação de Edições SM A coleção Ser Protagonista Química e o currículo do Estado de São Paulo Apresentação Professor, Devido à inexistência
Comparativos curriculares SM Química Ensino médio Material de divulgação de Edições SM A coleção Ser Protagonista Química e o currículo do Estado de São Paulo Apresentação Professor, Devido à inexistência
Agrupamento de Escolas da Senhora da Hora
 Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Gestão de Equipamentos Informáticos Informação Prova da Disciplina de Física e Química - Módulo: 10 Equilíbrio de ácido-base.
Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Gestão de Equipamentos Informáticos Informação Prova da Disciplina de Física e Química - Módulo: 10 Equilíbrio de ácido-base.
Do crude ao GPL e aos fuéis: destilação fraccionada e cracking do petróleo O Petróleo
 Do crude ao GPL e aos fuéis: destilação fraccionada e cracking do petróleo O Petróleo 2.1. Combustíveis fósseis: o carvão, o crude e o gás natural Actualmente o petróleo (crude) é um dos recursos naturais
Do crude ao GPL e aos fuéis: destilação fraccionada e cracking do petróleo O Petróleo 2.1. Combustíveis fósseis: o carvão, o crude e o gás natural Actualmente o petróleo (crude) é um dos recursos naturais
ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA. Técnico Auxiliar de Saúde (cursos iniciados em 2015/2016)
 ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA CURSOS PROFISSIONAIS Disciplina: FÍSICA E QUÍMICA Módulo: Q5 + EQ5 EQUILIBRIO DE OXIDAÇÃO REDUÇÃO; ELETROQUÍMICA Matriz válida para os cursos: Técnico
ESCOLA SECUNDÁRIA FERREIRA DIAS, AGUALVA - SINTRA CURSOS PROFISSIONAIS Disciplina: FÍSICA E QUÍMICA Módulo: Q5 + EQ5 EQUILIBRIO DE OXIDAÇÃO REDUÇÃO; ELETROQUÍMICA Matriz válida para os cursos: Técnico
EXAME ENSINO PROFISSIONAL
 AGRUPAMENTO DE ESCOLAS DE OLIVEIRA DE FRADES EXAME ENSINO PROFISSIONAL Disciplina: Física e Química Módulo: Q5 Tipo de Prova: Escrita Duração: 90 minutos Ano letivo: 2012/2013 Conteúdos Objetivos Estrutura
AGRUPAMENTO DE ESCOLAS DE OLIVEIRA DE FRADES EXAME ENSINO PROFISSIONAL Disciplina: Física e Química Módulo: Q5 Tipo de Prova: Escrita Duração: 90 minutos Ano letivo: 2012/2013 Conteúdos Objetivos Estrutura
QUÍMICA. a) linha horizontal. b) órbita. c) família. d) série. e) camada de valência.
 13 QUÍMICA A posição dos elementos na Tabela Periódica permite prever as fórmulas das substâncias que contêm esses elementos e os tipos de ligação apropriados a essas substâncias. Na Tabela Periódica atual,
13 QUÍMICA A posição dos elementos na Tabela Periódica permite prever as fórmulas das substâncias que contêm esses elementos e os tipos de ligação apropriados a essas substâncias. Na Tabela Periódica atual,
PILHAS ELETROQUÍMICAS
 PILHAS ELETROQUÍMICAS As pilhas eletroquímicas são dispositivos capazes de produzir energia elétrica à custa de uma reação redox espontânea. Como as primeiras pilhas foram construídas por Galvani e Volta,
PILHAS ELETROQUÍMICAS As pilhas eletroquímicas são dispositivos capazes de produzir energia elétrica à custa de uma reação redox espontânea. Como as primeiras pilhas foram construídas por Galvani e Volta,
INFORMAÇÃO DE PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Ano 2015/2016
 AGRUPAMENTO DE ESCOLAS POETA ANTÓNIO ALEIXO INFORMAÇÃO DE PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Ano 2015/2016 Despacho normativo nº1-d/2016 de 4 de março Despacho normativo nº1-g/2016 de 6 de abril 1ª e 2.ª
AGRUPAMENTO DE ESCOLAS POETA ANTÓNIO ALEIXO INFORMAÇÃO DE PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Ano 2015/2016 Despacho normativo nº1-d/2016 de 4 de março Despacho normativo nº1-g/2016 de 6 de abril 1ª e 2.ª
AGRUPAMENTO DE ESCOLAS DE PÓVOA DE LANHOSO INFORMAÇÃO-PROVA DE EQUIVALÊNCIA À FREQUÊNCIA DE QUÍMICA - CÓDIGO 342
 INFORMAÇÃO-PROVA DE EQUIVALÊNCIA À FREQUÊNCIA DE QUÍMICA - CÓDIGO 342 (Decreto lei 139/2012, de 05 de julho) 1ª e 2ª FASES MODALIDADE DA PROVA: ESCRITA + PRÁTICA Ano letivo: 2012/2013 Ano de escolaridade:
INFORMAÇÃO-PROVA DE EQUIVALÊNCIA À FREQUÊNCIA DE QUÍMICA - CÓDIGO 342 (Decreto lei 139/2012, de 05 de julho) 1ª e 2ª FASES MODALIDADE DA PROVA: ESCRITA + PRÁTICA Ano letivo: 2012/2013 Ano de escolaridade:
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
PLANO DE ESTUDOS 9.º ano CFQ
 PLANO DE ESTUDOS 9.º ano CFQ 2015-2016 O aluno, no final do 9.º ano, deve ser capaz de: - Compreender movimentos no dia-a-dia, descrevendo-os por meio de grandezas físicas. - Compreender a ação das forças,
PLANO DE ESTUDOS 9.º ano CFQ 2015-2016 O aluno, no final do 9.º ano, deve ser capaz de: - Compreender movimentos no dia-a-dia, descrevendo-os por meio de grandezas físicas. - Compreender a ação das forças,
AGRUPAMENTO DE ESCOLAS DR.ª LAURA AYRES QUARTEIRA
 AGRUPAMENTO DE ESCOLAS DR.ª LAURA AYRES QUARTEIRA ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS CAPITALIZÁVEIS (Portaria n.º 242/2012, de 10 de agosto) REGIME NÃO PRESENCIAL MATRIZ DO EXAME DE QUÍMICA 12º ANO
AGRUPAMENTO DE ESCOLAS DR.ª LAURA AYRES QUARTEIRA ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS CAPITALIZÁVEIS (Portaria n.º 242/2012, de 10 de agosto) REGIME NÃO PRESENCIAL MATRIZ DO EXAME DE QUÍMICA 12º ANO
Reacções de Oxidação-Redução
 Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Disciplina: Física e Química A Módulo 6
 Agrupamento de Escolas de Rio Tinto nº 3 Escola Básica e Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS CAPITALIZÁVEIS MATRIZ DE PROVA DE AVALIAÇÃO EM REGIME NÃO PRESENCIAL Disciplina:
Agrupamento de Escolas de Rio Tinto nº 3 Escola Básica e Secundária de Rio Tinto ENSINO SECUNDÁRIO RECORRENTE POR MÓDULOS CAPITALIZÁVEIS MATRIZ DE PROVA DE AVALIAÇÃO EM REGIME NÃO PRESENCIAL Disciplina:
Prova Escrita 2016 Decreto-Lei nº 139/2012 de 5 julho
 Informações - Prova de Equivalência à Frequência de Química 12º ano Código 342 Ensino Secundário Prova Escrita 2016 Decreto-Lei nº 139/2012 de 5 julho 1. Introdução O presente documento visa divulgar as
Informações - Prova de Equivalência à Frequência de Química 12º ano Código 342 Ensino Secundário Prova Escrita 2016 Decreto-Lei nº 139/2012 de 5 julho 1. Introdução O presente documento visa divulgar as
Obs.: foram analisadas 90 questões dos últimos cinco anos
 Conteúdo Nº de questões % Química ambiental 16 17,78 INORGÂNICA (Química Solucionada) Estequiometria 06 6,67% Cálculos químicos 01 1,11% Reações inorgânicas 05 5,55% Química elementar 07 7,78% Funções
Conteúdo Nº de questões % Química ambiental 16 17,78 INORGÂNICA (Química Solucionada) Estequiometria 06 6,67% Cálculos químicos 01 1,11% Reações inorgânicas 05 5,55% Química elementar 07 7,78% Funções
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2014-2015 18 de Junho de 2015 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Diferentes modelos de ligação química
 Ligação covalente Diferentes modelos de ligação química A grande diversidade de substâncias resulta da combinação de átomos dos elementos químicos através de diferentes modelos de ligação: covalente, iónica
Ligação covalente Diferentes modelos de ligação química A grande diversidade de substâncias resulta da combinação de átomos dos elementos químicos através de diferentes modelos de ligação: covalente, iónica
DGEstE - Direção de Serviços da Região Norte AGRUPAMENTO DE ESCOLAS N.º 1 DE MARCO DE CANAVESES (150745) NIPC
 Prova 342 INFORMAÇÃO PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Química 2018 12.º ano de Escolaridade O presente documento divulga informação relativa à prova de equivalência à frequência da disciplina de Química,
Prova 342 INFORMAÇÃO PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Química 2018 12.º ano de Escolaridade O presente documento divulga informação relativa à prova de equivalência à frequência da disciplina de Química,
Síntese da Planificação da Disciplina de Físico-Química - 7º Ano- 2018/2019
 Síntese da Planificação da Disciplina de Físico-Química - 7º Ano- 2018/2019 Período Dias de aulas previstos 2.ª 3.ª 4.ª 5.ª 6.ª 1.º Período 13 13 13 12 12 2.º Período 12 12 12 14 14 3.º Período 6 8 7 7
Síntese da Planificação da Disciplina de Físico-Química - 7º Ano- 2018/2019 Período Dias de aulas previstos 2.ª 3.ª 4.ª 5.ª 6.ª 1.º Período 13 13 13 12 12 2.º Período 12 12 12 14 14 3.º Período 6 8 7 7
Temas de Química em espiral Gil, V e Paiva, J. C.
 Disciplina de Didáctica da Química I Temas de Química em espiral Gil, V e Paiva, J. C. 1 2 3. TEMAS DE QUÍMICA - Nomenclatura Química - Fórmulas e Equações Químicas - Estrutura dos Átomos - Tabela Periódica
Disciplina de Didáctica da Química I Temas de Química em espiral Gil, V e Paiva, J. C. 1 2 3. TEMAS DE QUÍMICA - Nomenclatura Química - Fórmulas e Equações Químicas - Estrutura dos Átomos - Tabela Periódica
Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 6 01/06/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL
 AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL Documento(s) Orientador(es): Programa de Física e Química A/ Metas Curriculares, MEC-2014 ENSINO SECUNDÁRIO 11º ANO-FQ-A
AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL Documento(s) Orientador(es): Programa de Física e Química A/ Metas Curriculares, MEC-2014 ENSINO SECUNDÁRIO 11º ANO-FQ-A
INFORMAÇÃO DE PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Ano
 AGRUPAMENTO DE ESCOLAS POETA ANTÓNIO ALEIXO INFORMAÇÃO DE PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Ano 2016-2017 (Despacho normativo n.º 1-A/2017, de 10 de fevereiro) 1ª e 2ª Fases (Código) Disciplina: (342)
AGRUPAMENTO DE ESCOLAS POETA ANTÓNIO ALEIXO INFORMAÇÃO DE PROVA DE EQUIVALÊNCIA À FREQUÊNCIA Ano 2016-2017 (Despacho normativo n.º 1-A/2017, de 10 de fevereiro) 1ª e 2ª Fases (Código) Disciplina: (342)
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 30 de Junho de 2003 Versão 1
 Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
3ª Adjalma / Daniella / Marcelo
 Química 3ª Adjalma / Daniella / Marcelo 2ª Série E.M. Competência Objeto de aprendizagem Habilidade Competência 1: Dominar a leitura, a interpretação e a capacidade de produção de textos em diferentes
Química 3ª Adjalma / Daniella / Marcelo 2ª Série E.M. Competência Objeto de aprendizagem Habilidade Competência 1: Dominar a leitura, a interpretação e a capacidade de produção de textos em diferentes
Física e Química. Planificação. Curso Vocacional
 Física e Química Planificação Curso Vocacional 1º ano-2013/2014 2º ano-2014/2015 1º ano - Física Módulo Conteúdos Competências Avaliação Nº de aulas 1. A medida 1. Estimar grandezas físicas: - Estimativas
Física e Química Planificação Curso Vocacional 1º ano-2013/2014 2º ano-2014/2015 1º ano - Física Módulo Conteúdos Competências Avaliação Nº de aulas 1. A medida 1. Estimar grandezas físicas: - Estimativas
REVALIDAÇÃO DE ESTUDOS PLANO DE ESTUDOS. 1 Conteúdos Estruturantes e Específicos conforme Proposta Curricular:
 INSTITUTO DE EDUCAÇÃO ESTADUAL DE MARINGÁ Ensino Fundamental, Médio, Normal e Profissional Resolução 3455/81 Rua Martim Afonso, n. 50 Fone: (044) 3226-4346 www.ieem.com.br REVALIDAÇÃO DE ESTUDOS PLANO
INSTITUTO DE EDUCAÇÃO ESTADUAL DE MARINGÁ Ensino Fundamental, Médio, Normal e Profissional Resolução 3455/81 Rua Martim Afonso, n. 50 Fone: (044) 3226-4346 www.ieem.com.br REVALIDAÇÃO DE ESTUDOS PLANO
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
COLÉGIO SANTA TERESINHA R. Madre Beatriz 135 centro Tel. (33)
 EU CONFIO COLÉGIO SANTA TERESINHA R. Madre Beatriz 135 centro Tel. (33) 3341-1244 www.colegiosantateresinha.com.br PLANEJAMENTO DE AÇÕES Do 1ºano = 3 ª ETAPA 2018 Professora : Raquel Munhões Período da
EU CONFIO COLÉGIO SANTA TERESINHA R. Madre Beatriz 135 centro Tel. (33) 3341-1244 www.colegiosantateresinha.com.br PLANEJAMENTO DE AÇÕES Do 1ºano = 3 ª ETAPA 2018 Professora : Raquel Munhões Período da
2ª Adjalma / Daniella / Marcelo. 2ª Série E.M. Competência Objeto de aprendizagem Habilidade
 Química 2ª Adjalma / Daniella / Marcelo 2ª Série E.M. Competência Objeto de aprendizagem Habilidade Competência 1: Dominar a leitura, interpretação e a capacidade de produção de textos em diferentes formas
Química 2ª Adjalma / Daniella / Marcelo 2ª Série E.M. Competência Objeto de aprendizagem Habilidade Competência 1: Dominar a leitura, interpretação e a capacidade de produção de textos em diferentes formas
DADOS DO COMPONENTE CURRICULAR Nome: Química Curso: Técnico em Meio Ambiente Integrado ao Ensino Médio Série: 1 Ano Carga Horária: 67 h (80 aulas)
 DADOS DO COMPONENTE CURRICULAR Nome: Química Curso: Técnico em Meio Ambiente Integrado ao Ensino Médio Série: 1 Ano Carga Horária: 67 h (80 aulas) Docente Responsável: Rubens Rodrigues Teles EMENTA Matéria
DADOS DO COMPONENTE CURRICULAR Nome: Química Curso: Técnico em Meio Ambiente Integrado ao Ensino Médio Série: 1 Ano Carga Horária: 67 h (80 aulas) Docente Responsável: Rubens Rodrigues Teles EMENTA Matéria
Universidade Federal do Espírito Santo Projeto Pedagógico de Curso Engenharia Civil ano 2007 DEPARTAMENTO DE ENGENHARIA CIVIL CENTRO TECNOLÓGICO
 UFES DEPARTAMENTO DE ENGENHARIA CIVIL CENTRO TECNOLÓGICO DISCIPLINA Código Denominação Carga Horária Semestral Cr. Nat. CIV QUÍMICA APLICADA À ENGENHARIA CIVIL T: 45 h, L: 30 h, E: 0 h 5 OBR OBJETIVO DA
UFES DEPARTAMENTO DE ENGENHARIA CIVIL CENTRO TECNOLÓGICO DISCIPLINA Código Denominação Carga Horária Semestral Cr. Nat. CIV QUÍMICA APLICADA À ENGENHARIA CIVIL T: 45 h, L: 30 h, E: 0 h 5 OBR OBJETIVO DA
O diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura.
 13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
Reacções de oxidação-redução em solução aquosa. Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p.
 Reacções de oxidação-redução em solução aquosa Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p. 116 até ao final REACÇÕES de OXIDAÇÃO-REDUÇÃO reacções que envolvem troca de
Reacções de oxidação-redução em solução aquosa Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p. 116 até ao final REACÇÕES de OXIDAÇÃO-REDUÇÃO reacções que envolvem troca de
CURSO DE FARMÁCIA Reconhecido pela Portaria MEC nº 220 de , DOU de PLANO DE CURSO
 CURSO DE FARMÁCIA Reconhecido pela Portaria MEC nº 220 de 01.11.12, DOU de 06.11.12 Componente Curricular: Química Orgânica Farmacêutica I Código: FAR 202 Pré-requisito: Química Geral e Inorgânica Período
CURSO DE FARMÁCIA Reconhecido pela Portaria MEC nº 220 de 01.11.12, DOU de 06.11.12 Componente Curricular: Química Orgânica Farmacêutica I Código: FAR 202 Pré-requisito: Química Geral e Inorgânica Período
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS Ficha Formativa de FQA 24. janeiro. 2018 10º Ano Turma B Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
ESCOLA SECUNDÁRIA DE CASQUILHOS Ficha Formativa de FQA 24. janeiro. 2018 10º Ano Turma B Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2015-2016 / Candidatos oriundos de outros sistemas de ensino 2015/2016 15 de Junho de 2016 10h00 12h30 ATENÇÃO: assinale ou apresente cuidadosamente
Eletroquímica. Eletroquímica: Pilhas Galvânicas. Potencial de redução. Força eletromotriz. Equação de Nernst. Electrólise.
 Eletroquímica IX Eletroquímica: Pilhas Galvânicas. Potencial de redução. Força eletromotriz. Equação de Nernst. Electrólise. Eletroquímica A Eletroquímica estuda a relação entre a eletricidade e as reações
Eletroquímica IX Eletroquímica: Pilhas Galvânicas. Potencial de redução. Força eletromotriz. Equação de Nernst. Electrólise. Eletroquímica A Eletroquímica estuda a relação entre a eletricidade e as reações
