JULIANA DANTAS RODRIGUES SANTOS
|
|
|
- Lorenzo Valdomiro Caetano da Cunha
- 9 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE ESTADUAL DO CEARA FACULDADE DE VETERINA RIA PROGRAMA DE PO S-GRADUAC A O EM CIE NCIAS VETERINA RIAS MESTRADO ACADÊMICO EM CIÊNCIAS VETERINA RIAS JULIANA DANTAS RODRIGUES SANTOS EXPRESSÃO DE ÁCIDO HIALURÔNICO SINTASE-2, RECEPTORES GONADOTRÓFICOS E CONEXINA 43 EM CÉLULAS DO CUMULUS DE OÓCITOS CAPRINOS FORTALEZA CEARÁ 2015
2 JULIANA DANTAS RODRIGUES SANTOS EXPRESSÃO DE ÁCIDO HIALURÔNICO SINTASE-2, RECEPTORES GONADOTRÓFICOS E CONEXINA 43 EM CÉLULAS DO CUMULUS DE OÓCITOS CAPRINOS Dissertação apresentada ao Curso de Mestrado Acadêmico em Ciências Veterinárias do Programa de Pós-Graduação em Ciências Veterinárias da Faculdade de Veterinária da Universidade Estadual do Ceará, como requisito parcial para obtenção do título de mestre em Ciências Veterinárias. Área de Concentração: Reprodução e Sanidade Animal. Orientadora: Profa. Dra. Luciana Magalhães Melo. FORTALEZA - CEARÁ 2015
3 Dados Internacionais de Catalogação na Publicação Universidade Estadual do Ceará Sistema de Bibliotecas Santos, Juliana Dantas Rodrigues. Expressão de ácido hialurônico sintase-2, receptores gonadotróficos e conexina 43 em células do cumulus de oócitos caprinos [recurso eletrônico] / Juliana Dantas Rodrigues Santos CD-ROM: il.; 4 ¾ pol. CD-ROM contendo o arquivo no formato PDF do trabalho acadêmico com 89 folhas, acondicionado em caixa de DVD Slim (19 x 14 cm x 7 mm). Dissertação (mestrado acadêmico) Universidade Estadual do Ceará, Faculdade de Veterinária, Programa de Pós-Graduação em Ciências Veterinárias, Fortaleza, Área de concentração: Reprodução e Sanidade Animal. Orientação: Prof.ª Ph.D. Luciana Magalhães Melo. 1. Expressão gênica. 2. Competência ao desenvolvimento. 3. Maturação oocitária. 4. Tratamento hormonal. 5. Caprinos. I. Título.
4
5 Aos meus pais, Julival Pereira e Rita de Cássia Dantas, por serem o alicerce da minha vida, Dedico.
6 AGRADECIMENTOS À Universidade Estadual do Ceará (UECE) e ao Programa de Pós-Graduação em Ciências Veterinárias (PPGCV) pela oportunidade de capacitação e crescimento profissional. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo financiamento do projeto, e à Coordenação de Aperfeiçoamentode Pessoal de Nível Superior (CAPES) pela bolsa de estudo concedida. À Deus pelo dom da vida, por ter me concebido força, paciência e saúde para chegar ao final desta etapa. À toda minha família, especialmente aos meus pais, Rita de Cássia Dantas Rodrigues Santos e Julival Pereira dos Santos, bem como meu irmão Lázaro Dantas Rodrigues Santos, pelo apoio, pelo amor sem limites, por sempre acreditar em mim e incentivar as minhas escolhas, e por serem o alicerce da minha vida! À meu namorado Alexandre Rodrigues de Paula Junior, por todo o companheirismo, pelos maravilhosos momentos que dividimos e por ter sido fundamental para a conclusão dessa etapa. À minha orientadora Prof. Dra. Luciana Magalhães Melo que com sua competência e seu espírito de pesquisa desempenhou brilhantemente seu exercício de orientação. Obrigada pelos ensinamentos, pelo empenho e responsabilidade. Ao Prof. Dr. Vicente José de Figueirêdo Freitas pela oportunidade e recepção em seu laboratório, pelo aprendizado e atenção à mim concebidos. Às minhas amigas queridas Lívia Correia Magalhães (Duplinha) e Iana Sales Campelo, pelos vários momentos agradáveis que passamos juntas, pela alegria contagiante, pela disposição em ajudar e por ter tornado os meus dias no laboratório mais leves. Ao meu amigo Ribrio Ivan Tavares Pereira Batista, pela sua dedicação à meu trabalho, pelo conhecimento transmitido e pelos incontáveis conselhos e momentos formidáveis que compartilhamos. Agradeço também a Maajid Hassan Bhat pela amizade e auxílio com a tradução do artigo científico. Aos pós-graduandos e amigos do laboratório, Dowglish Ferreira Chaves, Samara Silva de Souza, Carla Fabiana Gomes de Jesus, Thais Thatiane dos Santos Souza, Fabiana Aparecida Santilli Brandão, aos atuais e ex-alunos de iniciação científica, Bruna Raquel Cavalcante Barroso, Rodrigo Râbelo de Castro Sousa, Caique Teixeira
7 Ramos, Jeferson Lucas Sousa Freitas, Kalil Andrade Mubarac Romcy, Lina Castelo Branco Motta, Maria Eduarda Monteiro Temporal Agostinho, Aniele dos Santos Bezerra, Yara Pereira Diógenes, Ana Lídia Melo Matias, Mirelly Mirna Alves de Sousa Silva, Carlos Eduardo das Neves Barbosa e em especial a Matheus Soares Alves. Muita obrigada pela troca de experiências, conhecimento e parceria, vocês tornaram a convivência mais agradável e minha caminhada mais feliz, levarei um pouco de cada um! Aos funcionários e professores do PPGCV que fizeram parte dessa trajetória, em especial ao Prof. Dr. Dárcio Ítalo Alves Teixeira, e os funcionários Adriana Maria Albuquerque e Antonio Cesar Camelo, pelo entusiasmo e carinho com os alunos além de total disponibilidade para ajudar. Aos meus amigos de mestrado, que compartilharam alguns meses de suas vidas. Aos funcionários do Laboratório de Fisiologia e Controle da Reprdução (LFCR), Carlos Antonio de Lima Silva (Seu Carlinhos) e Selmar Alves da Silva, pelos auxílios nas atividades a campo. À toda equipe LFCR, por todos os momentos compartilhados, pelo conhecimento adquirido, e por ter me propiciando construir boas amizades. À todos aqueles, que de alguma forma, contribuíram para a realização desse trabalho. Muito obrigada!
8 RESUMO A maturação oocitária é uma importante etapa da produção in vitro de embriões, sendo dependente da qualidade do oócito, a qual determina sua competência ao desenvolvimento. A estimulação hormonal ovariana com gonadotrofinas pode influenciar a expressão gênica nas células cumulus (CCs) de complexos cumulusoócito (CCOs) e, consequentemente, a qualidade oocitária. Adicionalmente, a maturação in vitro (MIV) dos CCOs envolve a síntese de ácido hialurônico para que haja a expansão do cumulus. Nesse evento, também ocorre a regulação da expressão de conexinas, as quais compõem as junções gap existentes entre o cumulus e o oócito. Assim, no presente trabalho, em paralelo à classificação morfológica (GI/II ou GIII) e avaliação da taxa de MIV, investigou-se a expressão dos genes que codificam a enzima ácido hialurônico sintase-2 (HAS2), os receptores gonadotróficos do hormônio folículo estimulante (FSHR) e do luteinizante (LHR) e a conexina 43 em CCs oriundas de CCOs caprinos obtidos após estimulação hormonal ovariana com múltiplas doses de FSH (MD) ou única dose de FSH/eCG (Oneshot - OS). Adicionalmente, CCOs bovinos oriundos de abatedouro foram utilizados como grupo controle. O tratamento MD produziu maior número de folículos grandes (>4 mm), CCOs com melhor aspecto morfológico (GI/II) e melhor taxa de MIV que OS. O tratamento OS produziu CCOs com CCs que apresentaram maior nível de transcritos para todos os genes analisados. Esta maior expressão gênica também foi observada em CCs de CCOs com aspecto morfológico inferior (GIII). Por outro lado, os níveis de RNAm tornaram-se mais semelhantes entre os grupos após a MIV, principalmente com o decréscimo dos transcritos para FSHR e LHR. Alguns eventos que ocorreram durante a MIV bovina, como a expansão das células, o aumento de HAS2 e decréscimo de Cx43, foram menos evidentes ou não observados na MIV caprina. Em conclusão, o tratamento OS produziu CCOs com maior nível de transcritos para HAS2, receptores gonadotróficos e conexina 43, comparado a MD. Contudo, esse maior nível de transcritos não conferiu maior competência meiótica aos oócitos e pode estar relacionado a uma regulação deficiente da expressão gênica por oócitos de menor qualidade. Finalmente, a expansão, o aumento da expressão de HAS2 e o decréscimo da síntese de Cx43, parecem ser eventos mais evidentes nas CCs de CCOs durante a MIV bovina que na caprina. Estudos adicionais são ainda necessários para investigar a importância de outras isoformas de HAS ou de conexinas em CCOs caprinos. Palavras-chave: Expressão gênica. Competência ao desenvolvimento. Maturação oocitária. Tratamento hormonal. Caprinos.
9 ABSTRACT The oocyte maturation is an important step of in vitro embryo production, being dependent on oocyte quality, which determines their competence development. Ovarian stimulation with gonadotropins can influence gene expression in the cumulus cells (CCs) of cumulus-oocyte complexes (COCs) and, consequently, the oocyte quality. Additionally, in vitro maturation (IVM) of COCs involves hyaluronic acid synthesis for cumulus expansion. In this event, there is also the regulation of connexin expression, which make up the gap junctions existing between the cumulus and oocyte. In the present work, in parallel with the morphological classification (GI/II or GIII) and evaluation of IVM rate, we investigated the expression of genes encoding the enzyme hyaluronic acid synthase-2 (HAS2), the gonadotropic receptors of follicle stimulating hormone (FSHR) and luteinizing hormone (LHR) and connexin 43 in CCs derived from COCs goats obtained after ovarian hormonal stimulation with multiple doses of FSH (MD) or a single dose of FSH/eCG (OS). The MD treatment produced higher number of large follicles, COCs with great morphological aspects and IVM rate than OS. Additionally, bovine COCs originating from slaughterhouse were used as control group. The MD treatment produced higher number of large follicles (>4 mm), COCs with great morphological aspects and IVM rate than OS. The OS treatment produced COCs with more HAS2, FSHR, LHR and Cx43 transcripts. This gene expression pattern was also observed in CCs of COCs showing poor morphological characteristics. On the other hand, the mrna levels becomes more similar between groups after IVM, mainly decreasing FSHR and LHR transcripts. Some events that occurred during the bovine IVM, such as the expansion of the cells, the increase of HAS2 and decrease of Cx43 were less apparent or not observed in goat IVM. In conclusion, the OS treatment produced COCs with a higher level of transcripts for HAS2, gonadotropic receptors and connexin 43, compared to MD. However, increasing in HAS2, FSHR, LHR and Cx43 expressions in goat COCs do not confer more meiotic competence to oocytes. Instead, it may be resulted from a poor regulation of gene expression in CCs by lower quality oocytes. Finally, cumulus expansion together with HAS2 upregulation and Cx43 downregulation seems to be more important IVM events for bovine than for goat COCs. Further studies are needed to investigate the importance of other HAS isoforms or connexins in goat COCs. Keywords: Gene expression. Development competence. Oocyte maturation. Hormonal treatment. Goats.
10 LISTA DE FIGURAS REVISÃO DE LITERATURA Figura 1 Representação esquemática das conexinas e junções gap. (A): Domínios transmembrana (TM1-4), duas alças extracelulares (AE), uma alça citoplasmática (AC) e uma cauda citoplasmática C- Terminal (CT). (B): As propriedades de permeabilidade das junções gap que podem ser (1): homomérico-homotípico; (2): homoméricoheterotípico; (3): heteromérico-heterotípico. Fonte: WINTERHAGER E KIDDER, CAPÍTULO 1 Figure 1 Figure 2 Expression of HAS2, Cx43, FSHR and LHR in caprine and bovine cumulus cells from graded cumulus-oocyte complexes (COCs). Goat COCs were obtained after multidose (MD) or one-shot (OS) in vivo FSH treatment for ovarian stimulation. Shown are the fold differences in mrna expression in the GI/II and GIII COCs after normalization to the reference genes (GAPDH, HAS2 and UXT). The mrna levels in GI/II of goat MD cumulus cells were arbitrarily set to one-fold. Morphological grades were compared within the goat hormonal treatments or for cattle as a group (A,B: P < 0.05). Bovine (BOV) and goat (MD or OS) groups were compared within the same grade (a,b: P < 0.05). 70 Expression of HAS2, Cx43, FSHR and LHR in caprine and bovine cumulus cells from in vitro pre-maturation and post-maturation cumulus-oocyte complexes (COCs). Goat COCs were obtained after multidose (MD) or one-shot (OS) in vivo FSH treatment for ovarian stimulation. Cumulus cells were derived from pre-ivm or post-ivm COCs with germinal vesicle (GV) or metaphase II (MII) oocytes, respectively. Shown are the fold differences in mrna expression after normalization to the reference genes (GAPDH, HAS2 and UXT). The mrna levels in GV of goat MD cumulus cells were
11 arbitrarily set to one-fold. Pre-IVM and post-ivm stages were compared within the goat hormonal treatments or for cattle as a group (A,B: P < 0.05). Bovine (BOV) and goat (MD or OS) groups were compared separately for the pre-ivm and post-ivm stages (a,b: P < 0.05)... 71
12 LISTA DE TABELAS CAPÍTULO 1 Table 1 Table 2 Table 3 Primers used in quantitative real-time PCR of gene expression in goat and bovine cumulus cells Number of collected and graded cumulus-oocyte complexes (COCs) and the in vitro maturation (IVM) rates in goats hormonally treated for ovarian stimulation Quantitative RT-PCR amplification parameters for gene expression analysis in goat and bovine cumulus cells. 74
13 LISTA DE ABREVIATURAS E SIGLAS AH AMPc ANOVA BSA CAPES CCOs CCs : Ácido hialurônico : Adenosina monofosfato cíclico : Análise de variância : Bovine serum albumin (Albumina sérica bovina) : Coordenação de Aperfeiçoamento de Pessoal de Nível Superior : Complexos cumulus-oócito : Células do cumulus CDK1 : Cyclin-dependent kinase 1 (Quinase dependente de ciclina 1) CIV CJG CNPq CO 2 COL Cx ecg EGF FIV FSH FSHR GDF9 GI/II GIII GnRH H HAS2 : Cultivo in vitro : Comunicação junção gap : Conselho Nacional de Desenvolvimento Científico e Tecnológico : Dióxido de Carbono : Colheita de oócitos por laparoscopia : Conexina : Equine chorionic gonadotrophin (Gonadotrofina coriônica eqüina) : Epidermal growth factor (Fator de crescimento epidermal) : Fecundação in vitro : Follicle Stimulating Hormone (Hormônio Folículo Estimulante) : Follicle Stimulating Hormone Receptor (Receptor do Hormônio Folículo Estimulante) : Growth differentiation factor 9 (Fator de crescimento e diferenciação 9) : Grau I e II : Grau III : Gonadotropin-releasing hormone (Hormônio liberador de gonadotrofina) : Hora : Hyaluronic acid synthase-2 (Ácido hialurônico sintase-2)
14 hcg KDa Kg LH LHR MAPK MD mg MII Min MIV ml Mm mm mmhg MPF mrna N 2 O 2 OS : Human chorionic gonadotropin (Gonadotrofina coriônica humana) : Quilo Dalton : Quilograma : Luteinizing hormone (Hormônio Luteinizante) : Luteinizing Hormone Receptor (Receptor do Hormônio Luteinizante) : Mitogen-activated protein kinase (Proteína quinase ativada por mitógenos) : Tratamento hormonal com múltiplas doses : Miligrama : Metaphase II (Metáfase II) : Minuto : Maturação in vitro : Mililitro : Milímetro : Milimolar : Milímetro de mercúrio : Maturation Promoting Factor (Fator Promoter da Maturação) : Messenger Ribonucleic Acid (Ácido Ribonucléico mensageiro) : Nitrogênio : Oxigênio : Oneshot - Tratamento hormonal com dose única P < 0,05 : Probabilidade de erro menor que 5% ph PIVE : Potencial hidrogeniônico : Produção in vitro de embriões PKA : Protein kinase A (Proteína quinase A) S SD SEM : Segundos : Standard deviation (Desvio padrão) : Standard error of means (Erro padrão da média)
15 SFB SOF TCM-199 TGF-β UI VG : Soro fetal bovino : Synthetic oviduct fluid (Fluido sintético do oviduto) : Tissue culture medium (Meio de cultivo tecidual-199) : Transforming growth factor-β (Fator de crescimento e transformação - β) : Unidade internacional : Vesícula germinativa º C : Grau Celsius μg μl μm : Micrograma : Microlitro : Micromolar % : Porcentagem
16 SUMÁRIO 1 INTRODUÇÃO REVISÃO DE LITERATURA Biotécnicas reprodutivas em caprinos Tratamentos de superestimulação ovariana Colheita de oócitos por laparoscopia Maturação in vitro de oócitos (MIV) Fatores que influenciam a qualidade e a maturação oocitárias Gonadotrofinas e seus receptores Ácido hialurônico Junções do tipo gap e conexinas no complexo cumulus-oócito JUSTIFICATIVA HIPÓTESE CIENTÍFICA OBJETIVOS Objetivo Geral Objetivos Específicos CAPÍTULO CONCLUSÕES PERSPECTIVAS REFERÊNCIAS BIBLIOGRÁFICAS... 77
17 17 1 INTRODUÇÃO As biotecnologias de reprodução assistida em ruminantes são ferramentas fundamentais para a maximização do potencial reprodutivo animal. Nessa perspectiva, é extremamente necessário o aperfeiçoamento de técnicas já conhecidas, para que haja o incremento da produtividade do rebanho, bem como o melhoramento genético de animais zootecnicamente superiores. Nas últimas décadas, a produção in vitro de embriões (PIVE) tornou-se uma valiosa ferramenta de pesquisa, que levou a um maior enfoque na qualidade do material biológico, sejam esses gametas ou embriões (HYTTEL et al., 2001). Nesse contexto, vários estudos vêm se concentrando nos mecanismos que ocorrem intrinsecamente no gameta feminino, o complexo cumulus-oócito (CCO). Um desses mecanismos é a expansão das células do cumulus (CCs) que supostamente propicia a maturação citoplasmática (GANDOLFI E GANDOLFI, 2000). Além disso, a comunicação que ocorre entre as células do cumulus e o oócito, ou nas células do cumulus entre si, por meio de junções gap, tem sido amplamente investigada. As junções gap são canais transmembrana que permitem a passagem de íons e pequenas moléculas e são formadas pela aposição de hemicanais compostos por seis proteínas chamadas conexinas (RACKAUSKAS et al., 2010). Dentre as conexinas (Cx), destaca-se a Cx43, por está relacionada com o processo de maturação oocitária (SHIMADA et al., 2001). A expansão de CCs também tem sido considerada um importante evento para a maturação e se caracteriza por modificações conformacionais, que resultam na deposição de ácido hialurônico no espaço extracelular. Esse polissacarídeo é sintetizado por enzimas ácido hialurônico sintase (HAS), com destaque para a isoenzima HAS2 presente em células da granulosa/cumulus (SCHOENFELDER E EINSPANIER, 2003). Essa expansão do cumulus ocorre após o pico pré-ovulatório de gonadotrofinas, que estimula a produção de ácido hialurônico (SALUSTRI et al., 1990). Desta forma, estudos têm correlacionado a expansão do cumulus com a competência oocitária, e HAS2 como um potencial marcador molecular de qualidade do oócito (MCKENZIE et al., 2004; ASSIDI et al., 2008; ZHANG et al., 2013). Para alcançar bons resultados na PIVE, a maturação oocitária in vitro (MIV) deve ser realizada com uma taxa satisfatória de eficiência, entre 70-80% (SOUZA- FABJAN et al., 2014). A grande discrepância entre o número de oócitos submetidos à
18 18 fecundação in vitro (FIV) e o número de embriões em desenvolvimento para o estágio de blastocisto (aproximadamente 30-40%), apela à mais pesquisas para a melhoria das condições de maturação oocitária, de forma a mimetizar o desenvolvimento in vivo do oócito (OPIELA et al., 2014). Fisiologicamente, os CCOs são mantidos no estádio de vesícula germinativa (VG) no ambiente folicular até que ocorra o pico pré-ovulatório de LH, que irá estimular a maturação do oócito e induzir alterações fisiológicas na atividade das CCs (FAIR, 2003). Contudo, a influência de fontes hormonais exógenas in vivo, utilizadas em tratamentos hormonais de estimulação ovariana, na sinalização celular e na maturação oocitária ainda não está bem esclarecida. Nesse contexto, estudos acerca dos mecanismos moleculares envolvidos na competência ao desenvolvimento e na maturação oocitária são muito importantes para a PIVE. A influência do estímulo hormonal exógeno é uma abordagem interessante para aprimorar a MIV e fornecer suporte para o sucesso das demais etapas de PIVE na espécie caprina.
19 19 2 REVISÃO DE LITERATURA 2.1 Biotécnicas reprodutivas em caprinos As biotecnologias da reprodução têm apresentado múltiplas aplicações para a pecuária mundial, sendo ferramentas potenciais para melhoria genética de rebanhos, através da seleção de características que viabilizam a aplicação comercial para essas técnicas (AMOAH E GELAYE, 1997), como o aumento da qualidade de carne e leite. Na espécie caprina, diversas técnicas já estão sendo realizadas com sucesso, como inseminação artificial (HOUDEAU et al., 2008), produção in vitro de embriões (KHATUN et al., 2011; ROMANGUERA et al., 2011; SOUZA et al., 2013), clonagem (ZOU et al., 2001; WAN et al., 2012) e transgênese animal aplicada a produção de proteínas recombinantes terapêuticas (ZHANG et al., 2010; FREITAS et al., 2012). Essas biotecnologias podem garantir a preservação de espécies pela formação de bancos de sêmen, oócitos ou embriões (MORATÓ et al., 2011; PUROHIT et al., 2012; KÜÇÜK et al., 2014), permite a organização do rebanho através de procedimentos de sexagem, sem contar que algumas destas técnicas impedem a disseminação de doenças (POMP et al., 1995; MALIK et al., 2015). Técnicas moleculares também têm ganhado espaço como sistemas complementares, uma vez que são altamente sensíveis e a maioria delas são menos invasivas quando comparadas com àquelas tradicionais. A obtenção de resultados satisfatórios tem impulsionado a pesquisa básica para o progresso de tais técnicas. Dentre essas biotecnologias reprodutivas, a produção in vitro de embriões destaca-se principalmente por reduzir o intervalo entre gerações, maximizando a produtividade dos rebanhos, além de possibilitar a utilização de fêmeas pré-púberes (KOEMAN et al., 2003), e/ou com problemas de fertilidade, melhorando o desempenho reprodutivo desses animais, e conseqüentemente assumindo importância fundamental para a pesquisa básica (HOSHI, 2003; PARAMIO, 2010). A PIVE compreende várias etapas: colheita e seleção oocitária, maturação in vitro (MIV) dos oócitos, fecundação in vitro (FIV) dos oócitos maturados com espermatozoides viáveis e cultivo in vitro (CIV) dos presumíveis zigotos, até alcançarem o estádio de blastocisto. Os embriões produzidos podem ser transferidos
20 20 para fêmeas receptoras sincronizadas, criopreservados ou utilizados em pesquisas científicas. O sucesso dessa biotecnologia depende da execução bem-sucedida de todas as etapas, com destaque para a maturação oocitária in vitro, pois é nessa etapa que o complexo cumulus-oócito (CCO) adquire a competência ao desenvolvimento e prossegue para fases subseqüentes. Além disso, alguns aspectos como avaliação visual do ovário e folículos a serem aspirados, colheita eficiente dos oócitos e a qualidade oocitária são destacados como características importantes para o procedimento de PIVE (COGNIÉ et al., 2003). É sabido que a boa qualidade oocitária, relacionada à presença de camadas de células do cumulus (CCs) e homogeneidade do citoplasma, tem uma forte influência no desenvolvimento embrionário inicial (RODRIGUEZ et al., 2006). Destaca-se também como fator determinante da qualidade oocitária, a fase do ciclo estral na qual os CCOs são colhidos. Além disso, o acúmulo de produtos gênicos específicos (como proteínas e RNAm), no citoplasma durante o crescimento do oócito, também suportam o desenvolvimento embrionário inicial (SIRARD et al., 2007). Desta forma, é primordial o conhecimento da fisiologia e desenvolvimento de oócitos para sua utilização em técnicas moleculares com o objetivo final de promover melhorias na PIVE. Em bovinos, muitos estudos relacionados à PIVE já foram realizados e por esse motivo ocorreu o desenvolvimento dos protocolos e melhoria dos resultados experimentais (HOSHI, 2003). Contudo, a PIVE em caprinos ainda precisa ser otimizada, de maneira que as condições in vitro (sistema de cultivo, suplementação dos meios com fatores de crescimento, vitaminas e outros micronutrientes) favoreçam melhores resultados. Assim, o conhecimento da maquinaria molecular do CCO que promove a expansão do cumulus e maturação oocitária é um passo primordial para elucidar a sinalização das diversas cascatas que ocorrem durante esses eventos e assim fornecer recursos para otimizar a PIVE Tratamentos de superestimulação ovariana O principal objetivo de técnicas de reprodução assistida é a obtenção de prenhez. Para tanto é importante o aumento do número de oócitos para que se tenha maiores chances de fecundação. Existem várias alternativas para o controle do
21 21 desenvolvimento folicular, dentre elas os processos hormonais (BURATINI et al., 2000; AVELAR et al., 2012), que otimizam a produção in vivo e in vitro de embriões. A estimulação hormonal ovariana é um procedimento rotineiro para a aplicação das biotécnicas reprodutivas, esta é realizada com o intuito de estimular o crescimento de múltiplos folículos capazes de produzir oócitos viáveis através da aplicação de gonadotrofinas em animais doadores de oócitos previamente submetidos a sincronização estral (GAD et al., 2011). Normalmente, os protocolos de estimulação ovariana são precedidos por sincronização do ciclo estral que tem por objetivo evitar o crescimento de folículos grandes e conseqüentemente a ovulação através de feedback negativo com o eixo hipotalâmico-hipofisário. Essa sincronização se dá pela a aplicação de dispositivos intravaginais ou implantes auriculares impregnados com progestágeno ou progesterona que perduram por cerca de 10 dias (MENCHACA et al., 2002; SOUSA et al., 2011; AVELAR et al., 2012). Com os animais devidamente sincronizados associa-se a estimulação ovariana com a administração de gonadotrofinas, maximizando a quantidade de oócitos para PIVE, ou para programas de múltipla ovulação e transferência de embriões (FONSECA et al., 2011; KOEMAN et al., 2003). Este procedimento usualmente é realizado à base do Hormônio Folículo Estimulante (FSH) (ALMEIDA et al., 2010; SOUZA-FABJAN et al., 2014) ou Gonadotrofina Coriônica Equina (ecg) (SOUSA et al., 2011; PEREIRA et al., 2012). O FSH tem sido distribuído em protocolos com dosagens distintas (5 e 3 doses), e resultou em um número equivalente de oócitos GI/II, no entanto, a taxa de maturação foi superior em estruturas obtidas no protocolo com 5 doses (ALMEIDA et al., 2010). Avelar et al. (2012) não observaram diferenças entre os tratamentos com 5 doses, 3 doses e dose única quanto ao número de estruturas recuperadas, contudo, a taxa de maturação no tratamento hormonal com 5 doses se mostrou superior aos demais. A fim de reduzir a quantidade de aplicações de FSH nos protocolos hormonais, tem sido proposto com sucesso o protocolo que combina uma alta dose de FSH com uma dose menor de ecg administrados em um único momento. Baldassarre et al. (2003) utilizou com êxito esse protocolo para obtenção de oócitos por laparoscopia e aplicação em programa de transgênese. A estimulação ovariana é bastante útil quando associada a colheita oocitária por laparoscopia, uma vez que potencializa o número de estruturas colhidas,
22 22 viabilizando o uso em larga escala para as tecnologias de PIVE e transgênese (BALDASSARRE et al., 2002). Todavia, o estado ovariano dos animais no início do protocolo hormonal é bastante importante, uma vez que o equilíbrio das populações foliculares no momento da estimulação culmina com o crescimento de todos esses folículos, já que a carga hormonal exógena administrada supre a demanda desses folículos em crescimento (BALDASSARRE et al., 1996), e a presença de folículos dominantes no início do tratamento pode também prejudicar o recrutamento folicular (RUBIANES E MENCHACA, 2003). A maneira de administração da dose total de FSH também pode influenciar a resposta ovulatória, visto que a utilização de protocolo com doses decrescentes obteve melhor resultado quanto a quantidade de folículos quando comparado com protocolo com doses constantes. No entanto, a taxa de blastocisto foi superior no protocolo com doses constantes evidenciando que este tratamento produz oócitos de melhor qualidade (BERLINGUER et al., 2004). Abdullah et al. (2008) estudaram o efeito do intervalo entre a estimulação ovariana e o procedimento de colheita de oócitos (36, 60 e 72 horas) na qualidade e competência ao desenvolvimento de oócitos, e foi possível constatar que um intervalo mais prolongado entre o tratamento hormonal e a colheita oocitária (72) permite melhores resultados em relação as taxas de recuperação, maturação e clivagem, aprimorando o rendimento de oócitos e a produção de embriões. A repetibilidade do tratamento hormonal pode interferir na resposta ovulatória, devido a possível formação de anticorpos, como anti-ecg, após uso prolongado desses hormônios gonadotróficos (DRION et al., 2001). Além disso, características como variabilidade da resposta ao estímulo hormonal dos animais tratados também pode ser um entrave. Apesar de recentes avanços nos protocolos de estimulação ovariana, ainda é perceptível que o rendimento e a qualidade de embriões obtidos de oócitos colhidos após tratamentos hormonais são variáveis e podem ser influenciados por efeitos do oócito durante o desenvolvimento folicular (SIRARD et al., 2006). Adicionalmente, o tamanho do folículo aspirado pode determinar a competência ao desenvolvimento do oócito (CASTILHO et al., 2007), sendo essencial a execução bem-sucedida dos tratamentos hormonais de estimulação ovariana.
23 Colheita de oócitos por laparoscopia Uma das possíveis técnicas para a obtenção de CCOs viáveis para as etapas de PIVE é a colheita de oócitos por laparoscopia (COL). A COL foi desenvolvida como procedimento para pequenos ruminantes, sendo inicialmente realizada em ovelhas (SNYDER E DUKELOW, 1974) e, anos mais tarde, em cabras (BALDASSARRE et al., 2003); Esta técnica consiste na punção folicular sob observação laparoscópica com auxílio de agulha para aspiração oocitária mediante linha de vácuo acoplada a um tubo de colheita. Em pequenos ruminantes, a COL tem apresentado bons resultados para recuperação de oócitos, sendo um processo mais rápido e menos traumático quando comparado aos procedimentos cirúrgicos. Koeman et al. (2003), obtiveram cerca de 82% e 88% na recuperação de oócitos de animais jovens e adultos, respectivamente. É relatado que esta técnica é eficiente tanto em relação à quantidade de estruturas colhidas quanto em relação à qualidade dos oócitos recuperados. Além disso, essa técnica permite a realização de repetidas sessões de aspiração folicular com poucos prejuízos à fertilidade (STANGL et al., 1999), podendo ser utilizada em fêmeas gestantes, pré-púberes, púberes, senis e com problemas de fertilidade (GIBBONS et al., 2008). Uma maneira de otimizar o número de oócitos colhidos é através de sincronização estral e estimulação ovariana por hormônios exógenos seguida de sucessivas colheitas de oócitos em intervalos relativamente curtos (BALDASSARRE, 2007; GIBBONS et al., 2008). A estimulação hormonal em pequenos ruminantes tem sido realizada por diferentes estratégias, sendo as mais utilizadas aquelas que abrangem várias injeções de FSH ou uma única injeção de ecg. Ambos os protocolos apresentam similar eficiência quanto à taxa de colheita, sendo essa, em média, 88,77% (BALDASSARRE et al., 2002; 2007). Em caprinos, a COL seguida de PIVE e transferência de embrião pode ser uma das maneiras mais eficientes para produção em larga escala de animais geneticamente selecionados em um menor intervalo de tempo (BALDASSARRE E KARATZAS, 2004) Maturação in vitro de oócitos (MIV) A maturação oocitária é definida como uma sequência de eventos fisiológicos que promovem as alterações desde o estágio de vesícula germinativa até a parada na
24 24 segunda divisão meiótica. A maturação envolve tanto a modificação nuclear quanto as modificações citoplasmática e molecular. A alteração nuclear concerne a formação do fuso meiótico, enquanto que o rearranjo das organelas e a síntese de RNA mensageiro se relacionam com as alterações citoplasmáticas e moleculares. Então, logo após a finalização desses processos, o oócito estará apto à fecundação por um espermatozoide viável (SIRARD et al., 2006; KHATUN et al., 2011). Durante a vida fetal ocorre o armazenamento de oócitos primários no ovário. Estes oócitos permanecem bloqueados na primeira prófase meiótica, devido a fatores sintetizados pelas células da granulosa (VAN DEN HURK E ZHAO, 2005). Conforme ocorra o crescimento e o acúmulo de material necessário para suportar o futuro desenvolvimento embrionário inicial, estes oócitos retomam a divisão meiótica através do estímulo gonadotrófico (LH). Então, as células da granulosa se tornam responsivas ao LH e secretam fatores que mediam a ação do mesmo. Aliado a isso ocorre o transporte de substâncias indutoras da meiose através da comunicação célula do cumulus-oócito, via junções gap (GILULA et al., 1978). Com o progresso da meiose, ocorrem diversas alterações metabólicas que incluem a síntese proteica e a reorganização de organelas no citoplasma, que acarretam na maturação citoplasmática do oócito (GOTTARDI E MINGOTI, 2009). Vinculado à redistribuição de organelas ocorre a migração de grânulos corticais da área perinuclear para zona periférica do oócito. Os grânulos corticais apresentam grande importância para a fecundação, pois promovem o bloqueio da polispermia por meio da destruição da ZP3, o principal sítio de ligação do espermatozoide à zona pelúcida, por enzimas que se encontram no interior desses grânulos (FAIR et al., 1997). Segundo Crozet et al. (1995) somente uma pequena proporção de oócitos maturados in vitro podem completar a maturação citoplasmática, possuindo a capacidade de suportar o desenvolvimento embrionário inicial. Durante o período de quiescência meiótica ocorre a maturação molecular do oócito. Essa maturação molecular abrange a transcrição e armazenamento de RNAm que, ao serem traduzidos em proteínas, fornecerão o suporte necessário para a embriogênese inicial (GANDOLFI E GANDOLFI, 2001; SIRARD et al., 2006). Este processo não está totalmente elucidado, uma vez que as modificações nem sempre podem ser verificadas em nível ultraestrutural. Algumas moléculas como AMPc (adenosina 3-5 monofosfato cíclico) e MPF (Fator Promotor da Maturação) ganham destaque nesta etapa por desempenhar importante função no desenvolvimento
25 25 meiótico. O AMPc pode ser fornecido pelas CCs e transportado para o oócito por meio de junções gap ou ser produzido pelo próprio oócito. O aumento na concentração intraoocitária desse mensageiro celular está relacionado ao bloqueio meiótico (DEKEL et al., 1981; KAWAMURA et al., 2004). Quando o AMPc se encontra em nível basal ocorre a ativação do MPF. Então, esse fator realizará a fosforilação de determinadas proteínas, que são responsáveis pela condensação cromossômica e reorganização do citoesqueleto (DEKEL, 1996; JONES, 2004). Por sua vez, a maturação nuclear do oócito envolve algumas características fisiológicas relevantes, como a desorganização do envelope nuclear, a condensação da cromatina e a extrusão do primeiro corpúsculo polar (CROCOMO et al., 2011). Além disso, existem evidências que a expansão das células da granulosa/cumulus auxilia a maturação, uma vez que essas células secretam fatores inibidores, com o crescimento folicular ocorre um afastamento dessas células e perda da comunicação intercelular, impedindo a transferência desses inibidores da maturação ao oócito (LI e ALBERTINI, 2013). A maturação oocitária in vitro mimetiza todo esse processo em condições artificiais que possibilitam ao CCO um desenvolvimento adequado, tornando-o fertilizável. Para tanto, é necessária uma análise cautelosa das exigências dos CCOs de acordo com a espécie. Apesar dessa complexidade, diversos meios utilizados para a MIV já foram descritos, com aceitáveis taxas de maturação para a espécie caprina (KATSKA- KSIAZKIEWICZ et al., 2007; SOUZA-FABJAN et al., 2014). É sabido que ao retirar o CCO do ambiente folicular ocorre uma retomada espontânea da meiose com consequente maturação nuclear, acarretando em uma assincronia entre a maturação citoplasmática e molecular com a maturação do núcleo. Por esse motivo, estudos recentes têm direcionado sua atenção para o uso de substâncias que proporcionem o crescimento do oócito e/ou o bloqueio meiótico quando acrescidas ao meio de maturação. Entre essas estão os inibidores da maturação nuclear, que podem promover uma melhor sincronia entre a maturação do núcleo e do citoplasma, aumentando a competência ao desenvolvimento dos CCOs (GHARIBI et al., 2013; SALAVATI et al., 2013; PEREIRA et al., 2014). Os meios MEM (Minimum Essential Medium), DMEM (Dulbecco's Modification of Eagle's Medium), TCM-199 (Tissue Culture Medium- 199), dentre
26 26 outros, podem ser utilizados como meio base para MIV. Contudo, o meio mais comumente utilizado é o TCM-199. O sucesso da composição do meio de maturação depende da similaridade com condições intrafoliculares (WRENZYCKI E STINSHOFF, 2013). Diante disso, se torna crucial a suplementação com outras substâncias, como hormônios (FSH, LH, estradiol), fatores de crescimento, peptídeos, proteínas, metabólitos energéticos e fatores indefinidos, como soro fetal bovino ou soro de cabra em estro (MOOR E TROUNSON, 1977; COGNIÉ et al., 2004; COCERO et al., 2011). Ainda é necessária a identificação precisa de fatores provenientes das células foliculares que regulam a aquisição da competência oocitária para o desenvolvimento, a fim de melhorar os meios de maturação. Infelizmente, tais fatores permanecem pouco conhecidos, devido à complexa comunicação intercelular e os diversos mecanismos metabólicos envolvidos no processo (BEVERS et al., 1997; WANG et al., 2009). Além do meio de maturação utilizado, outras condições, como temperatura, atmosfera de gases e período de incubação, apresentam importância fundamental nos resultados finais do processo. Avaliações acerca das condições de cultivo constataram que utilizar uma temperatura de 38,5ºC, em atmosfera umidificada com 5% de CO 2 por h pode promover boas taxas de maturação oocitária (COGNIÉ et al., 2004). 2.2 Fatores que influenciam a qualidade e a maturação oocitárias Uma maneira para aprimorar a produção in vitro de embriões é determinar quais características folicular e/ou oocitária são associadas com o aumento da competência ao desenvolvimento. A progressão do oócito até o estádio de metáfase da segunda divisão meiótica é marcada por uma série de transformações que envolvem o núcleo e o citoplasma do oócito, durante esse percurso diversas proteínas, fatores de crescimento e segundos mensageiros são envolvidos no processo (ADONA et al., 2013). As moléculas de AMPc, MAPK e MPF são alguns dos fatores que regulam a retomada meiótica. AMPc é um segundo mensageiro celular ativado ou inibido por proteínas G. A enzima adenil ciclase promove o aumento das concentrações intracelulares de AMPc, que irá regular outras proteínas como a proteína quinase A
27 27 (PKA) responsável por expressar substâncias indutoras da expansão do cumulus e maturação meiótica (SU et al., 2003; CROCOMO et al., 2011). O MPF é uma quinase que regula a retomada meiótica, atuando na condensação dos cromossomos e ruptura da membrana nuclear (KRISCHEK E MEINECKE, 2002). A ativação de MPF é complicada e está ligada a formação de um complexo com a subunidade quinase, seja CDK1 ou p34 cdc2, e subunidade regulatória (ciclina B1). A ativação desse complexo ocorre com a fosforilação/desfosforilação de alguns aminoácidos (MERMILLOD et al., 2000). Já a proteína quinase ativada por mitógenos (MAPK) pertence a família das quinases serina/treonina (KUBELKA et al., 2000), e está envolvida na maturação nuclear com formação do fuso meiótico e organização dos microtúbulos (SU et al., 2003). Essa proteína é ativada por sinais extracelulares. A fosforilação das quinases tirosina e treonina pela MEK (proteína ativadora de MAPK) é responsável pela ativação da MAPK, que irá promover a ativação e estabilização de MPF (SAGATA, 1997). Um dos fatores cruciais que afetam o potencial do desenvolvimento embrionário é a qualidade do oócito. Estudos apontam mecanismos intrínsecos que envolvem fatores de crescimento e acúmulo de RNAm e proteínas como diferencial de qualidade oocitária e obtenção da competência meiótica (SIRARD et al., 2006). GDF9, um membro da superfamília TGF-β é um fator parácrino secretado pelo oócito que regula várias enzimas nas células da granulosa envolvidas na expansão do cumulus, este fator de crescimento propicia um microambiente ideal para a aquisição da competência ao desenvolvimento do oócito (PANGAS E MATZUK, 2005). O GDF9 induz a produção de HAS2 em CCs (ELVIN et al., 1999) que estimula a produção de ácido hialurônico e resulta na expansão do cumulus (BUCCIONE et al., 1990). Além desses fatores as oscilações dos hormônios gonadotróficos exercem influência fundamental ao longo da foliculogênese e maturação oocitária (HARPER E BRACKETT, 1993; HAUGHIAN et al., 2004) Gonadotrofinas e seus receptores As gonadotrofinas pituitárias, LH e FSH, são glicoproteínas fundamentais para o controle de processos fisiológicos no ovário, ligados ao desenvolvimento folicular e maturação do oócito. Estes hormônios são produzidos e secretados pela hipófise anterior através de estímulo realizado pelo GnRH (hormônio liberador de
28 28 gonadotrofinas) e fornecem os mecanismos primários para o controle da seleção e dominância folicular através de ciclos de feedback com o eixo hipotalâmicohipofisário (HUNTER et al., 2004). O crescimento folicular e a seleção do folículo dominante são eventos associados às modificações da concentração de FSH circulante. Para que haja a onda folicular é necessário o aumento da concentração de FSH no plasma. Após a dominância folicular ocorre a supressão da liberação de FSH controlada por produtos secretados do folículo dominante (ADAMS et al., 1992). Os receptores de FSH, ao longo da foliculogênese, estão presentes nas células da granulosa, enquanto que os receptores de LH estão localizados tanto em células da granulosa quanto em células da teca na parede dos folículos antrais. A seleção do folículo dominante acontece pela razão de que folículos dominantes adquirem mais receptores gonadotróficos quando comparado com seus subordinados, por isso são hábeis para continuar crescendo nessa fase de dependência gonadotrófica, enquanto ocorre a regressão dos folículos subordinados (ADAMS et al., 2008). A responsividade de folículos ao estímulo de FSH tem sido bem caracterizada em folículos maiores que 4 mm, no entanto quando se trata de folículos antrais pequenos e pré-antrais essa questão ainda precisa ser melhor elucidada. Tanaka et al. (2001) sugerem que o hormônio FSH desempenha funções no desenvolvimento folicular inicial em folículos pré-antrais e antrais pequenos produzidos in vivo. Outros hormônios, como estradiol promovem o aumento da sensibilidade para FSH e LH nas células da granulosa, havendo indícios de aumento de receptores de LH devido a regulação desse hormônio (HILLIER, 2001). A aquisição da competência do oócito ocorre de maneira gradual e sincronizada com os eventos foliculares (BEVERS et al., 1997). In vivo, os oócitos de folículos em crescimento e dominantes estão bloqueados no estágio da primeira prófase meiótica, para que haja a maturação oocitária é necessário o pico préovulatório de LH que ocorre em oócitos que estão completamente crescidos, ou seja, inclusos em folículos dominantes (VAN DER HURK E ZHAO, 2005). Esse fenômeno ressalta a importância dos receptores gonadotróficos ao longo do desenvolvimento folicular e oocitário. A expressão de receptor de FSH e outros genes em CCs humanas, funcionou como marcador molecular preditivo de competência ao desenvolvimento para a injeção intracitoplasmática de espermatozoides, uma vez que permitiu a seleção de
29 29 oócitos de boa qualidade que prosseguiram o desenvolvimento até o estádio de blastocisto com boa taxa de implantação e nascimento (EKART et al., 2013). A influência das gonadotrofinas sobre o crescimento folicular e oocitário, bem como a quantidade e funcionalidade de seus receptores é uma abordagem interessante, visto que essas gonadotrofinas são freqüentemente adicionadas a meios de cultivo para melhorar a eficiência da maturação oocitária in vitro, através da expansão do cumulus e, consequentemente, a maturação citoplasmática (PANDEY et al., 2010; DELL'AQUILA et al., 2004). Assim, é pertinente mensurar a expressão de receptores gonadotróficos em células da granulosa/cumulus, visto que há uma comunicação e sinalização parácrina entre essas estruturas e o oócito, sendo útil certificar a real necessidade de altas concentrações dessas gonadotrofinas nos meios de MIV de acordo com a capacidade de receptores dessas estruturas. Segundo Eppig (1982), o estímulo hormonal gonadotrófico exerce influência sobre a produção de ácido hilurônico (AH) e expansão do cumulus. Kimura et al. (2002) também consideram o FSH um fator chave para a regulação desses eventos. Adicionalmente, a enzima HAS2 também é expressa em resposta ao efeito combinado de FSH e GDF9 (fator secretado pelo oócito) (DRAGOVIC et al., 2005). Já foi constatada a expressão de receptores de LH em CCs de camundongas (CHEN et al., 1994) e em células da teca bovinas (VAN TOL et al., 1996). Já os receptores de FSH foram expressos em células da granulosa de ratas (LAPOLT et al., 1992), humanas (SHI et al., 2010), em CCs bovinas (NUTTINCK et al., 2004). Além disso, em estudo com CCOs bovinos foi possível verificar uma maior abundância de FSHR e LHR em estruturas de melhor qualidade (CALDER et al., 2003). Pandey et al. (2010) observaram um decréscimo de FSHR no CCO e oócito desnudo bubalinos ao longo da maturação (após 6 horas de cultivo) e pode constatar que CCOs expressam mais FSHR que oócitos desnudos, evidenciando subjetivamente a expressão maciça em CCs. Já receptores de LH apresentaram uma tendência ao aumento com a progressão meiótica, com expressão abundante em CCOs quando comparado com oócito desnudos Ácido hialurônico O ácido hialurônico (AH) é um polissacarídeo de alto peso molecular que pertence a família dos glicosaminoglicanos. Esse carboidrato foi primeiramente
30 30 isolado a partir de humor vítreo por Meyer e Palmer em O AH é abundantemente encontrado em tecidos conjuntivos e fluidos articulares (LAURENTE FRASER, 1992). Sua síntese ocorre na superfície interna da membrana plasmática e ao longo da formação de cadeias de AH, este é extruído através de estruturas semelhantes a poros para o espaço extracelular (PREHM, 1984). A maior produção desse composto ocorre durante a proliferação celular, sendo associada a processos mitóticos (BRECHT et al., 1986). A enzima ácido hialurônico sintase (HAS) é responsável por sintetizar o AH. Existem diferentes tipos da enzima HAS que são capazes de sintetizar o AH, são elas HAS1, HAS2 e HAS3, estas apresentam similaridade na seqüência de aminoácidos e características estruturais; no entanto, diferem nas suas atividades biológicas de síntese de AH (ITANO et al., 1999). Essa síntese de AH pelas CCs parece ser controlada pelos níveis de transcrição de RNAm para ácido hialurônico sintase-2 (HAS2) (FULOP et al., 1997), sobretudo em CCOs da espécie bovina (SCHOENFELDER E EINSPANIER, 2003). Diversas funções têm sido atribuídas ao ácido hialurônico, Laurent e Fraser (1986) consideram que a medida que o AH cresce para o meio externo da célula provoca um deslocamento de maneira que facilita a divisão da mesma. Dentre suas funções, ainda desempenha importante papel na regulação da adesão, migração e diferenciação celular (KNUDSON E KNUDSON, 1993). Na reprodução animal, também assume relevância crucial, pois auxilia na expansão das CCs durante a maturação oocitária. Fisiologicamente ocorre o pico de LH ou administração de hcg in vitro, que estimula o início de uma notável série de eventos, inclusive a síntese e organização de AH na matriz extracelular das CCs, e o desprendimento dos CCOs expandidos da parede do folículo (SALUSTRI et al., 1992). O AH é caracterizado como o principal componente envolvido na formação da matriz extracelular durante essa expansão do cumulus (MAREI et al., 2012). Há uma forte correlação da expansão de CCs com a maturação oocitária, devido à mecanismos de ruptura da comunicação via junções gap entre o oócito e as células somáticas circundantes, uma vez que a expansão do cumulus promove a interrupção da transferência de fatores inibidores da meiose (ZHANG et al., 2007). A produção de AH no espaço extracelular viabiliza essa expansão do cumulus e conseqüentemente a retomada meiótica. Assim, a quantificação relativa da enzima HAS2 em CCs tem sido considerada um valioso marcador indireto da competência
31 31 oocitária na espécie bovina (ASSIDI et al., 2008). Essa síntese de AH também está relacionada com a secreção de fatores solúveis do oócito (VANDERHYDEN, 1993). A técnica molecular de qpcr é bastante utilizada para análises de expressão gênica em CCs com o intuito de predizer características relacionadas a maturação e qualidade oocitárias, por ser uma técnica não-invasiva, rápida e de alta sensibilidade. Assim, McKenzie et al. (2004) analisando a expressão de HAS2 em CCs humanas constataram que há uma correlação entre embriões de boa qualidade com CCs que expressam maior quantidade de HAS2. Yokoo et al. (2007) demonstraram que interações insuficientesde AH e seu receptor CD44 durante maturação in vitro pode diminuir a capacidade de fecundação e o desenvolvimento dos oócitos maturados in vitro. Essa interação AH e CD44 resulta no fechamento das junções gap e a suspensão do transporte de AMPc das células da granulosa para o oócito e por conseguinte desencadeia a ativação de MPF e retomada meiótica. Kimura et al. (2002) observaram um efeito sinérgico positivo de ecg e fluido folicular suíno na expansão das CCs, havendo abundante expressão de RNAm para HAS2. Aviezer et al. (1994) demonstraram que o AH circundante ao oócito atua como uma capa protetora, e também como um reservatório para diferentes fatores de crescimento. Por esses motivos, Saito et al. (2000) pode constatar que a concentração de AH no fluido folicular prediz a capacidade de fecundação do oócito Junções do tipo gap e conexinas no complexo cumulus-oócito Junções gap são canais transmembrana que permitem a comunicação direta de íons inorgânicos e pequenas moléculas que incluem nutrientes, metabólitos e segundos mensageiros entre células adjacentes, proporcionando uma propagação metabólica e elétrica entre essas células vizinhas (BRUZZONE et al., 1996). Essas junções do tipo gap são áreas altamente especializadas, através das quais se estabelece a coordenação das atividades celulares, de forma a manter a homeostasia dos órgãos durante o desenvolvimento de organismos (GOODENOUGH et al., 1996). Cada junção gap é formada pela aposição de hemicanais denominados conexons, que são arranjos hexagonais constituídos por seis subunidades proteicas chamadas conexinas. Estes conexons podem ser constituídos de diferentes Cxs, e esta composição irá determinar a atividade da junção gap através de características como
32 32 permeabilidade, condutância de íons e propagação química no canal gap formado (KUMAR E GILULA et al., 1996). No tocante as Cxs, estas possuem uma estrutura básica com quatro domínios transmembrana, duas alças extracelulares, uma alça citoplasmática, uma cauda citoplasmática C-terminal e uma cauda citoplasmática N-terminal, que permite o contato entre as células adjacentes (Figura 1) (YEAGER E HARRIS, 2007). A regulação de suas atividades é bastante complexa e envolve processos que estão sob controle restrito, como a transcrição, tradução, modificações pós-traducionais e degradação (NIELSEN et al., 2012). Até o momento já foram identificadas 21 conexinas no genoma humano e 20 conexinas em ratos (OYAMADA et al., 2005), exercendo as mais diversas e complexas funções. As Cxs são nomeadas de acordo com seu peso molecular (LOEWENSTEIN, 1979), uma conexina que possui 43 KDa é então denominada Cx43. Essa nomenclatura se torna confusa quando há proteínas funcionalmente homólogas mencionadas de maneira diferente. Dessa forma pode ser utilizada uma nomenclatura alternativa que leva em conta uma subdivisão de grupos (α, β, γ, δ, ε) de acordo com similaridade das seqüências de aminoácidos (O BRIEN et al., 1998). Para esta abreviatura emprega-se a sigla GJ do inglês gap junction acrescida do grupo em que a mesma pertence e por fim a ordem de descoberta dessa proteína, por exemplo, a Cx43 tem por nome GJα1, pois esta pertence ao grupo α e foi a primeira Cx descoberta desse grupo (BRUZZONNE et al.,1996; NIELSEN et al., 2012). As junções gap podem ser formadas de diferentes maneiras de acordo com seus conexons e as conexinas presentes em sua composição. Denomina-se conexon heteromérico aquele que apresenta em sua estrutura diferentes tipos de Cxs, sendo nomeado homomérico quando é composto por único tipo de conexina. Existe ainda a classificação quanto à similaridade do canal gap, onde este pode ser homotípico quando há o acoplamento de conexons semelhantes. Quando há diferença entre a composição dos conexons estes serão denominados heterotípicos (KUMAR E GILULA, 1996) (Figura 1).
33 33 Figura 1: Representação esquemática das conexinas e junções gap. (A): Domínios transmembrana (TM1-4), duas alças extracelulares (AE), uma alça citoplasmática (AC) e uma cauda citoplasmática C-Terminal (CT). (B): As propriedades de permeabilidade das junções gap que podem ser (1): homomérico-homotípico; (2): homomérico-heterotípico; (3): heteromérico-heterotípico. AE1 AE2 AC Fonte: WINTERHAGER E KIDDER, As Cxs desempenham diversas funções biológicas em numerosos tipos celulares e tecidos, estando envolvidas em diferentes processos fisiológicos, como o ciclo celular, diferenciação e proliferação de células, homeostasia de tecidos, dentre outras atribuições. Várias Cxs tem sido identificadas em estruturas reprodutivas de diversas espécies, como humanos (WANG et al., 2009), suínos (NITTA et al., 2014), bovinos (KOLLE et al., 2003) e eqüinos (MARCHAL et al., 2003). Especificamente, em ovários mamíferos, algumas Cxs já foram descobertas; as Cxs 26, 30.3, 32, 37, 40, 43, 45 e 57 tem sido detectadas em diferentes espécies incluindo, camundongos, ratos, ovinos, bovinos e suínos (GERSHON et al., 2008). No complexo cumulus-oócito ocorrem várias alterações desde a vida fetal, que persistem por todo o desenvolvimento folicular, culminando com um oócito maduro e apto a ser fecundado. Durante o desenvolvimento folicular as junções gap são envolvidas em alguns processos da regulação e maturação meiótica no complexo cumulus-oócito (WIESEN E MIDGLEY, 1993). Essa comunicação via junções gap (CJG) proporciona um contínuo acoplamento das células foliculares circundantes durante todo o desenvolvimento oocitário (KIDDER E MHAWI, 2002), formando
34 34 uma rede de fortes ligações mecânicas que interligam as células da granulosa ao oócito, e a perda dessas junções pode facilitar a dissociação do oócito e sua liberação a partir do folículo ovariano (KALMA et al., 2004). O progresso da maturação oocitária se dá pela ruptura das junções gap entre as CCs e destas com o oócito, a perda CJG entre esses compartimentos celulares não permite o transporte de algumas moléculas e segundos mensageiros inibidores da meiose. Uma molécula sinalizadora primordial para o processo é a AMPc (Adenosina Monofosfato Cíclico), dependendo da sua transmissão das CCs para o oócito, pode haver a inibição da maturação meiótica (THOMAS et al., 2004). Dentre vários estudos no âmbito de junções gap na maturação de CCOs, a espécie suína tem despertado maior interesse, devido a um período mais extenso para a quebra espontânea da vesícula germinativa, que é mais lenta quando comparado a outros mamíferos, sendo esse período útil para decifrar a cascata de sinalização da retomada meiótica (THOMAS et al., 2004), mas na espécie caprina até o momento nenhum estudo abordou a CJG no CCO. De acordo com Santiquet et al. (2013) as principais Cxs encontradas no CCO suíno foram as Cxs 43 (abundantemente expressa em CCs), 45 (expressa no oócito e CCs), e a Cx60 (amplamente expressa no oócito), estas Cxs foram identificadas durante as primeiras 4,5 horas de MIV, ainda nesse estudo foi analisada a influência de hormônios (ecg e hcg) sobre os transcritos das Cxs 43 e 45 durante as primeiras 8,5 horas de MIV e foi constatado que ecg juntamente com hcg atuam sinergicamente para o aumento da Cx43, enquanto que ocorre um decréscimo da Cx45 independente do hormônio nas primeiras horas de MIV, sugerindo que as gonadotrofinas têm um grande impacto na tradução da Cx43. Ainda em CCOs suínos foi verificada a expressão majoritária das Cxs 45 e 60 através das técnicas de hibridização in situ e imunomarcação, demonstrando que há diversos genes de Cxs expressos em oócitos de mamíferos realizando essa CJG (NITTA et al., 2014). A Cx43 é uma proteína transmembrana pertencente ao grupo GJα1, que está presente em pelo menos 34 tecidos e 46 tipos celulares (SOLAN E LAMPE, 2009). Por esse motivo essa Cx é amplamente estudada e tem sido foco de vários grupos de pesquisa, a fim de descobrir as diversas funções que a mesma desempenha. Essa Cx tem mostrado função relevante para a retomada meiótica, uma vez que o seu decréscimo no complexo cumulus-oócito estimula o início da maturação oocitária
35 35 (HASEGAWA et al., 2007), tornando as junções gap moduladoras desse processo fisiológico (KIDDER E MHAWI, 2002). O nocaute da Cx43 em camundongos fêmeas indicou que na ausência dessa proteína ocorre uma diminuição do acoplamento intercelular entre as células da granulosa, sugerindo que a Cx43 é necessária para o contínuo crescimento folicular. Diversas anormalidades morfológicas foram observadas em oócitos oriundos de folículos mutantes, essas alterações variam desde o afinamento da zona pelúcida, maior presença de vacúolos e ausência de grânulos corticais, resultando em um crescimento retardado do oócito. Assim a Cx43 é essencial para a expansão de células da granulosa no desenvolvimento folicular inicial (ACKERT et al., 2001). O FSH está relacionado com os mecanismos finais do desenvolvimento folicular, daí a importância de estudos que desvendem o seu envolvimento com a comunicação intercelular durante esse período. Foi comprovado que o FSH aumenta os níveis de RNAm das principais conexinas expressas no compartimento oocitário, acelerando o desenvolvimento do oócito (EL-HAYEK E CLARKE, 2015). A importante expressão da Cx43 nos processos de maturação abrange numerosas espécies, dentre elas a Bubalis, na qual foi constatada uma superioridade na expressão da Cx43 em CCOs quando comparada a oócitos desnudos em diferentes tempos da MIV, havendo uma acentuada expressão durante as primeiras horas (0-6 horas) (PANDEY et al., 2010). Diante do exposto é evidente a importância da CJG e das Cxs para os processos de maturação oocitária com subseqüente competência ao desenvolvimento dos oócitos envolvidos, sendo o conhecimento desses mecanismos primordiais para a biotecnologia de PIVE.
36 36 3 JUSTIFICATIVA A produção in vitro de embriões tem alcançado significativos avanços nos últimos anos, esta biotécnica reprodutiva desempenha um importante papel na pesquisa básica, bem como em aspectos produtivos e econômicos em algumas espécies animais, como a bovina; no entanto quando se trata da espécie caprina esta biotecnologia ainda necessita de estudos para obtenção de melhores resultados. Um aspecto relevante para alcançar resultados satisfatórios na PIVE é obtenção de oócitos competentes ao desenvolvimento, e conseqüentemente boas taxas de maturação oocitária in vitro. A maturação envolve complexos mecanismos citoplasmáticos, nucleares e moleculares (WATSON, 2007), estes últimos têm despertado a atenção da literatura recente, uma vez que podem determinar o adequado desenvolvimento do oócito e do embrião. Alguns fatores influenciam na maturação oocitária, como a produção de ácido hialurônico e as concentrações de gonadotrofinas, que irão promover a expansão das CCs, através da formação de uma matriz extracelular. Esses eventos podem está associados a maturação citoplasmática (OPIELA et al., 2014; NUTTINCK et al., 2004). Além disso, a comunicação via junções gap também pode interferir na maturação através da transferência de substâncias inibidores da meiose (ISOBE et al., 1998). Nessa perspectiva, a abordagem de tais moléculas, HAS2, receptores gonadotróficos e Cx43, é especialmente útil, pois fornece informações cruciais que podem refletir na competência ao desenvolvimento do oócito. Adicionalmente, uma vez que fizemos variar quanti e qualitativamente as fontes exógenas de gonadotrofinas (FSH e ecg) em dois protocolos hormonais de estimulação ovariana, é interessante investigar a influência desses hormônios na maturação e qualidade oocitárias. As CCs foi o tipo celular escolhido para estudo, pois estas permanecem adjuntas ao oócito durante o desenvolvimento folicular antral e após a ovulação, dessa maneira estas células recebem destacada atenção quando a meta subseqüente é a PIVE. Assim como vem ocorrendo em outras espécies, a investigação de HAS2, receptores gonadotróficos e Cx43 em CCs de CCOs caprinos, objetivando elucidar os mecanismos que envolvem a maturação e o potencial de qualidade dos oócitos produzidos, é uma abordagem promissora para melhoria da PIVE dessa importante espécie de produção.
37 37 4 HIPÓTESE CIENTÍFICA A expressão de HAS2, de receptores gonadotróficos (FSHR e LHR) e de conexina 43 em CCs de COCs caprinos é influenciada pelo tratamento hormonal de estimulação ovariana, pela MIV e/ou pelos graus de qualidade morfológica do oócito.
38 38 5 OBJETIVOS 5.1 OBJETIVO GERAL Investigar a expressão gênica em CCs de COCs obtidos de cabras após tratamento hormonal de estimulação ovariana. 5.2 OBJETIVOS ESPECÍFICOS Analisar a influência do tratamento hormonal de estimulação ovariana sobre a expressão de ácido hialurônico sintase-2 (HAS2), de receptores gonadotróficos (FSHR e LHR) e de Cx43 em CCs de COCs caprinos e comparar com CCs de COCs bovinos. Comparar os níveis de transcritos de HAS2, FSHR, LHR e Cx43 em CCs oriundas de COCs caprinos de diferentes graus morfológicos (GI/II versus GIII), tendo CCs de COCs bovinos como controle. Investigar as modificações de expressão gênica oriundas do processo de MIV em COCs caprinos e bovinos.
39 39 6 CAPÍTULO 1 Superexpressão de ácido hialurônico sintase-2 e receptores gonadotróficos em células do cumulus de cabras submetidas ao tratamento hormonal one-shot FSH/eCG para estimulação ovariana Overexpression of hyaluronic acid synthase-2 and gonadotropin receptors in cumulus cells of goat subjected to one-shot ecg/fsh hormonal treatment for ovarian stimulation Periódico: Animal Reproduction Science (Submetido em 30/11/15) Qualis: A2
40 40 Overexpression of hyaluronic acid synthase-2 and gonadotropin receptors in cumulus cells of goats subjected to one-shot ecg/fsh hormonal treatment for ovarian stimulation Juliana D. R. Santos a, Ribrio I. T. P. Batista a, Livia C. Magalhães a, Alexandre R. Paula Junior a, Samara S. Souza a, Daniel F. Salamone b, Maajid H. Bhat a, Dárcio I. A. Teixeira a, Vicente J. F. Freitas a, Luciana M. Melo a* a Laboratory of Physiology and Control of Reproduction. Veterinary School. State University of Ceará, Av. Doutor Silas Munguba, 1700, Campus do Itaperi, Fortaleza- CE, Brazil, b Laboratory of Animal Biotechnology. School of Agronomy. Buenos Aires University, Av. San Martín 4453, C1417, Buenos Aires, Argentina. *Corresponding author: Luciana M. Melo. Tel.: ; fax: address: [email protected]
41 41 ABSTRACT Hormonal ovarian stimulation may affect transcripts in somatic cells of cumulusoocyte complexes (COCs) and affect the resulting oocyte quality. Here, in parallel with morphological classification and in vitro maturation (IVM) rate analysis, we investigated the expression of hyaluronic acid synthase-2 (HAS2), gonadotropic receptors (FSHR and LHR) and connexin 43 (Cx43) in cumulus cells (CCs) from goat COCs after multi-dose FSH (MD) or one-shot FSH/eCG (OS) treatments and pared the responses with those of bovine COCs. The MD treatment produced more large follicles, and the resulting COCs had a better morphology and IVM rate than were obtained with OS. The OS treatment produced COCs with increased HAS2, FSHR, LHR and Cx43 expression. This gene expression pattern was also observed in the CCs of COCs that showed poor morphological characteristics. On the other hand, the mrna levels were more similar between groups after IVM; FSHR and LHR were the main genes that showed decreased expression. Compared to bovine COCs, some events that occurred in CCs during IVM, such as cell expansion, increased HAS2 expression and decreased Cx43 expression, were less evident or did not occur in goat COCs. In conclusion, increasing HAS2, FSHR, LHR and Cx43 expression in goat COCs does not confer greater meiotic competence to oocytes. Instead, it may result from poor regulation of gene expression in CCs by lower quality oocytes. Finally, cumulus expansion, together with HAS2 upregulation and Cx43 downregulation, seems to be more important for bovine COCs than for goat COCs. Additional studies are needed to investigate the importance of other HAS isoforms and connexins in goat COCs. Keywords: HAS2; FSHR; LHR; connexin 43; cumulus cell; oocyte maturation.
42 42 1. Introduction In several ruminant species, in vitro embryo production (IVP) technology has become more widely used (van Wagtendonk-de Leeuw, 2006; Cox and Alfaro, 2007), especially in cattle, a species for which it has already reached commercial application (Pontes et al., 2011). However, there seems to be a consensus that in vitro maturation (IVM) is an important step for the success of IVP, i.e., it is necessary to produce competent mature oocytes that reach the blastocyst stage (for a review: Kane, 2003). The IVM of oocytes precedes and is required for successful in vitro fertilization (IVF). The cumulus cells (CCs) surrounding the immature oocyte have an important function in oocyte development. One of their functions is the channeling of metabolites and nutrients to the oocyte to help stimulate germinal vesicle breakdown and direct development to metaphase II. In fact, it has been widely reported for several species that one of the first morphological indicators of successful oocyte maturation is expansion of the cumulus mass away from the oocyte (Lonergan and Fair, 2016). One of the principal components of the expanded cumulus-oocyte complexes (COCs) is the glycosaminoglycan (GAG) hyaluronic acid (HA), which is synthesized at the cell membrane by hyaluronic acid synthases (HAS; Weigel et al., 1997). In mammals, Watanabe and Yamaguchi (1996) found that the HAS family consists of three known isoenzymes (HAS-1 to 3). In bovine CCs, the action of the HAS2 isoform is the most source of HA (Schoenfelder and Einspanier, 2003). The process of cumulus expansion is accompanied by modifications of gap junctions (Pandey et al., 2009), which contain transmembrane channels formed by hexamers of proteins belonging to the connexin family (for review: Nielsen et al.,
43 ). Connexin 43 (Cx43) is the main protein that builds these junctions between CCs of several animal species (Santiquet et al., 2013; Li et al., 2015). Gap junction communication between an oocyte and adjacent CCs and communication between somatic cells is critical for both nuclear and cytoplasmic maturation (Vozzi et al., 2001). In equine and porcine CCs, the beginning of meiotic resumption has been associated with the reduction of the connexin 43 protein level (Marchal et al., 2003). It has long been known that during IVM of bovine COCs, the connexin 43-positive gap junctions disappear (Sutovsky et al., 1993). Gonadotropins are often added to IVM media to induce cytoplasmic maturation and CC expansion. Follicle stimulating hormone (FSH) induces the expansion of mouse COCs in vitro (Salustri et al., 1990) and improves bovine IVF (Izadyar et al., 1998). Luteinizing hormone (LH) has beneficial effects on bovine oocyte maturation (Zulke and Brackett, 1990). Nonetheless, for gonadotropins to act in vitro, the COCs must express mrnas encoding the FSH and LH receptors (FSHR and LHR). In goats, information is lacking regarding the IVM process. Thus, the aim of this study was to investigate, before and after IVM, gene expression (HAS2, gonadotrophin receptors and connexin 43) in the CCs of goat COCs obtained by laparoscopic ovum collection after ovarian stimulation with multi-dose FSH (MD) or one-shot FSH/eCG (OS) treatments. We compared the results with those of bovine COCs. 2. Materials and methods 2.1. Animal ethics and management
44 44 All procedures in this study were performed in compliance with the Ethics Committee on Animal Use at the State University of Ceará (Number protocol /2014). A total of 14 Canindé goats aged one to three years (mean body weight ± SEM, 32.6 ± 1.92 kg) were selected as oocyte donors. All animals were maintained indoors in groups of five per pen under controlled nutrition. They had access to a Tifton (Cynodon dactylon) pasture in the morning and received Tifton during the afternoon. Additionally, goats were supplemented with good-quality concentrate (20% crude protein) and free access to water and minerals. Bovine ovaries, goat ovaries and goat brain tissues were obtained from a local slaughterhouse Hormone treatments The animals were subjected to two ovarian stimulation protocols. Each hormonal treatment was performed in four sessions with seven animals per session per protocol. The estrous cycles of all oocyte donors were synchronized using intravaginal sponges impregnated with medroxyprogesterone acetate (60 mg; Progespon; Syntex, Buenos Aires, Argentina), which were inserted for 10 days, combined with an intramuscular (im) luteolytic injection of cloprostenol (50 µg; Ciosin; Coopers, São Paulo, Brazil) on the 7 th day of progestagen treatment. The ovarian stimulation consisted of two experimental groups: the standard ovarian stimulation was carried out using multiple doses (MD) of pfsh (120 mg; Folltropin- V; Bioniche, Belleville, Canadá) distributed across five injections (30/30; 20/20; 20 mg) at 12 h intervals starting on the 7 th day of progestagen treatment. The one-shot treatment (OS) used pfsh (70 mg) and a single dose of ecg (200 IU; Novormon; Syntex, Buenos Aires, Argentina) administered 36 h before sponge removal.
45 Cumulus-oocyte complex recovery Follicle aspiration for oocyte harvest was performed through the laparoscopic method, as previously described by Baldassarre et al. (2003). In brief, goats were fasted for 36 h from food and water prior to oocyte recovery by laparoscopy (LOR). LOR was performed under general anesthesia, starting with an intravenous anesthetic induction using thiopental at a dose of 20 mg/kg (Tiopentax 2.5%; Cristália, São Paulo, Brazil). Deep anesthesia was maintained with 3% isoflurane (Isoforine, Cristália, São Paulo, Brazil) with the help of inhalation anesthesia equipment (HB Hospital, São Paulo, Brazil). The COCs were aspirated from follicles > 2 mm and 8 mm in diameter that were visible on the ovary s surface using a 22-gauge needle (Watanabe, São Paulo, Brazil) and a vacuum pump (WTA, Cravinhos, São Paulo, Brazil). The vacuum pressure was regulated at 35 mmhg. The collection medium used was TCM199 (Nutricell, Campinas, Brazil) buffered with 10 mm HEPES and supplemented with 20 UI/mL heparin, 0.2 mm pyruvate, 100 U penicillin, 100 μg/ml streptomycin and 0.25 μg/ml amphotericin (Sigma-Aldrich, St. Louis, USA), and 10% fetal bovine serum (Life Technologies, New York, USA). Bovine ovaries were transported from the slaughterhouse to the laboratory in a warmed (30 to 35 ºC) 0.9% NaCl solution supplemented with 40 μg/ml gentamicin (Sigma-Aldrich, St. Louis, USA). The COCs were aspirated gently from follicles using an 18-gauge needle attached to a 10-mL syringe and recovered in the same collection medium used for goats COC grading, IVM and sampling
46 46 The COCs from each ovarian stimulation procedure were selected under a stereomicroscope and graded from GI to GIV based on cellular layers and cytoplasmic uniformity, as described by Avelar et al. (2012). Thus, the GI COCs were multilayered, compact CCs with a finely granulated oocyte cytoplasm. The GII structures showed one to three layers of CCs and a finely granulated oocyte cytoplasm. The GIII COCs showed incomplete, no CCs, or a heterogeneous oocyte cytoplasm. The GIV COCs showed abnormal shapes and a heterogeneous oocyte cytoplasm or apoptotic oocytes in a jelly like cumulus-corona cell vestment. For IVM, COCs were pooled into two groups (GI/GII and GIII) from each stimulation protocol, and they were washed and incubated in maturation medium (500 µl) in four-well plates. The medium used for the maturation of goat COCs was TCM199 (Nutricell, Campinas, Brazil) buffered with 10 mm HEPES, which contained 10 ng/ml EGF, 100 µm cysteamine, 0.2 mm pyruvate, 1 μg/ml estradiol, 100 U penicillin, 100 μg/ml streptomycin and 0.25 μg/ml amphotericin (Sigma- Aldrich, St. Louis, USA), 20 μg/ml FSH/LH (Calier laboratories, Barcelona, Spain) and 10% serum from goats in estrus. Bovine structures were matured in a similar medium, with replacement of the goat serum in estrus by 10% fetal bovine serum (Life Technologies, New York, USA). The IVM conditions were 5% CO 2 in humidified air at 38.5 C for 24 h. After maturation, CCs were removed from each individual oocyte by repeatedly pipetting in the presence of 10 mg/ml hyaluronidase (Sigma-Aldrich, St. Louis, USA). The oocytes were stained with Hoechst (15 µg/ml) (Sigma- Aldrich, St. Louis, USA) and evaluated on an inverted microscope (TE2000, Nikon, Tokyo, Japan). Oocytes showing the first polar body and the metaphase plate with no apparent sign of degeneration were considered mature (MII). Oocytes without visible
47 47 polar bodies were classified as non-competent. Oocytes subjected to the same steps but not to IVM were considered to be at the germinal vesicle stage (GV). CCs from MII and GV oocytes were used for RNA extraction. CCs from non-competent oocytes were discarded Collection of experimental samples The CCs of GI/GII and GIII COCs containing immature (GV) or mature (MII) oocytes were collected separately for real-time PCR analyses as described by Almeida et al. (2010). Briefly, CCs from 30 graded COCs (GI/II or GIII) and classified oocyte (GV or MII) were pooled separately in individual tubes, quickly spun, snap-frozen with 25 µl of RLT buffer and stored at -80 C until RNA extraction. In all of the goat groups, COCs were obtained from at four sessions of ovarian stimulation/laparoscopic recovery. Groups of bovine CCs were prepared by the same way and were obtained from at least three slaughter sessions with 10 animals each Total RNA extraction After the culture medium was removed from the CCs by washing with PBS (made with DEPC-water), total RNA was extracted using the RNeasy micro kit (Qiagen Inc., Valencia, USA) according to the manufacturer s instructions. In brief, each frozen sample was resuspended in 50 µl of RLT Plus buffer and mixed with an equal volume of 70% ethanol. The mixture was then transferred to an RNeasy MinElute spin column from the RNeasy Micro kit for RNA to bind to the column. RNA purification included an RNAse-free DNase treatment for 15 min at room temperature. After three washes, the RNA was eluted with 12 µl of RNAse-free water.
48 48 Tissues and cells known to express each target gene were also used as positive controls. Thus, because Cx43 has been described in brain cells (Wu et al., 2015), total RNA was extracted from goat brain samples using Trizol reagent (Invitrogen, Califórnia, USA) following the manufacturer s instructions. Additionally, RNA samples from bovine CCs and the goat ovarian cortex were used as positive controls for HAS2 (Kimura et al., 2002) and FSH/LH (Nuttinck et al., 2004) expression, respectively. Then, RNA samples from bovine CCs were prepared using the RNeasy micro kit as described above for goats. Additionally, RNA from the goat ovarian cortex was obtained by using the ReliaPrep RNA Tissue Miniprep System (Promega, Madison, USA) according to the manufacturer's instructions. For all samples, RNA quantification was performed using a Qubit 2.0 Fluorometer and Quant-iT RNA assay kit (Invitrogen, Califórnia, USA) Reverse transcription Reverse transcription was performed by adding the following to each RNA sample: oligo-dt primer (20 µm; Promega, Madison, USA); 1 µl of Improm II (1 µl; Promega, Madison, USA); dntps (0.5 mm of each; Promega, Madison, USA); Recombinant RNasin (2 U/µL; Promega, Madison, USA); and RNase-free water for a final reaction volume of 20 µl. Reactions were heated to 70 C for 5 min and then placed on ice. Reverse transcription was performed at 42 C for 60 min and then at 70 C for 15 min. The first strand cdna products were then stored at -80 C for later use as templates for real-time PCR. Negative controls and RT blanks were prepared under the same conditions, but without the inclusion of reverse transcriptase Real-time PCR
49 49 Specific primers for the amplification of each gene (Table 1) were designed using Primer-BLAST (Ye et al., 2012) and by multiple sequence alignment of goat and bovine sequences using ClustalW2 (Larkin et al., 2007). Relative quantification was performed in triplicate for the Cx43, HAS2, FSHR, LHR, GAPDH (glyceraldehyde 3-phosphate dehydrogenase), UXT (ubiquitously expressed transcript protein) and H2A (histone 2A) genes using a MasterCycler ep Realplex 4S (Eppendorf, Hamburg, Germany). Reactions (15 µl total volume) contained the following: 2 Fast SYBR Green Master Mix (7.5 µl; Applied Biosystems, California, USA), each primer (0.3 µm for GAPDH, H2A, FSHR, and LHR, and 0.6 µm for UXT and Cx43, and 1.0 µm for HAS2) and cdna (2 to 2.5 ng of RNA, corresponding to the amount of cells around 1 COC). Template cdnas were denatured at 95 C for 2 min followed by 40 cycles of an amplification program of 95 C for 15 s, 60 C for 30 s and 95 C for 15 s. Fluorescence data were acquired during the 72 C extension steps. The specificity of each reaction was ascertained after completion of the amplification protocol. After each PCR run, a melting curve analysis was performed for each sample to confirm that a single, specific product was generated Data and statistical analyses GraphPad InStat 3.10 (GraphPad Software, Inc., La Jolla, USA) was used for all statistical analysis. The percentages of follicle size, graded COCs and maturation were analyzed using Fisher s exact test. The relative quantification of the gene expression was performed using the 2 - Ct method (Livak and Schmittgen, 2001). Target gene expression was normalized against the geometric mean of the GAPDH, H2A and UXT transcript levels. The threshold and threshold cycle (Ct) values were
50 50 automatically determined by Realplex 2.2 (Eppendorf, Hamburg, Germany) using the default parameters. Expression profiles were expressed as the mean (± SD) of relative mrna abundance and were compared using one-way ANOVA followed by a Tukey test and paired t-test. The melting temperature (Tm) data were expressed as the mean (± SD) of three measurements. A value of P < 0.05 was set as the limit for statistical significance. 3. Results 3.1. COC collection and IVM Qualitative and quantitative aspects of COCs produced by the two hormone treatments were compared (Table 2). At the end of the four hormonal sessions for the MD treatment, 307 punctured follicle yielded 231 COCs, resulting in a recovery rate of 75.2% (231/307). In the OS treatment, 172 COCs were obtained from 237 aspired follicles, representing a recovery rate of 72.6% (172/237). The MD treatment produced a greater amount (P < 0.05) of COCs with good morphology (77.5% GI/II) than the OS treatment (50.0% GI/II). COCs from the MD treatment had a greater maturation rate than the OS treatment (81.8% vs. 63.6%, P < 0.05) Gene expression in graded COCs Initially, validation of the qpcr amplification conditions was performed for each gene (Cx43, FSHR, LHR, HAS2, GAPDH, H2A and UXT) by constructing standard curves based on serial dilutions of cdnas from different cells and tissues. Thus, the amplification parameters, such as the efficiency and linearity (Table 3), ensured that the qpcr conditions were suitable for subsequent quantitative analyses.
51 51 Regarding HAS2 expression (Fig. 1), goat CCs derived from the OS treatment had higher transcript levels (P < 0.05) compared to both the MD and the bovine group, regardless of the grading in morphological classification. Expression of this gene in MD goat CCs did not differ from the expression measured in bovine cells (P > 0.05) for both GI/II and GIII. Additionally, the GI/II CCs showed more HAS2 expression than that of GIII (P < 0.05) in both species. For FSHR, bovine GI/II CCs (Fig. 1) showed greater expression (P < 0.05) than goat CCs (from MD or OS). In addition, CCs from the OS group had more transcripts than CCs from the MD group (P < 0.05). For the grade III structures, the expression of this receptor was also higher in bovine CCs than in goats in the MD group (P < 0.05), but not in comparison to the OS CCs (P > 0.05). In the same group, receptor expression was similar between MD and OS (P > 0.05). Additionally, CCs of GI/II structures showed increased FSHR mrna levels (P < 0.05) compared to the GIII CCs for OS and bovine structures, but not for MD. Transcripts for LHR (Fig. 1) were more abundant in CCs from the OS treatment than in cells from the MD treatment (P < 0.05) or the bovine COCs (P < 0.05), independent of the morphological grade. However, LHR gene expression was similar between the MD and bovine groups (P > 0.05) for both GI/II and GIII COCs. Finally, when comparing GI/II and GIII structures, the levels of the LHR transcripts were also equivalent (P > 0.05) for each group. The mrna levels for Cx43 (Fig. 1) were higher (P < 0.05) in the GI/II CCs obtained from OS treatment in comparison to MD. Moreover, the expression levels in bovine structures were similar (P > 0.05) to both goat treatments. With respect to the GIII structures, the OS treatment showed increased levels of Cx43 transcripts compared to the bovine group (P < 0.05). However, the CCs of the MD group showed
52 52 similar expression levels to the OS (P > 0.05) and bovine (P > 0.05) groups. The mrna levels of this connexin in goat CCs were also similar (P > 0.05) between GI/II and GIII COCs. However, bovine CCs showed more Cx43 transcripts in GI/II than in GIII structures (P < 0.05) Gene expression in pre- and post-ivm COCs The mrna levels were also compared between pre- and post-ivm COCs, which contained GV and MII oocytes, respectively. Thus, the HAS2 mrna levels strongly increased in bovine CCs (P < 0.05) after IVM. However, the transcript levels slightly diminished in goat CCs following OS treatment (MII vs GV, P < 0.05) and did not change in CCs following MD treatment (MII vs GV, P > 0.05) during IVM. Moreover, post-ivm bovine CCs had higher HAS2 expression (P < 0.05) than goat structures at the same maturation stage. In addition, HAS2 transcripts were similar between MD and OS post-ivm COCs (P > 0.05). Lower levels of FSHR transcripts were obtained in CCs of MII oocytes compared to GV (P < 0.05), except for the structures obtained from MD treatment (P > 0.05). In mature COCs, FSHR expression in CCs was similar between goat hormonal treatments (P > 0.05), and both treatments were superior to the bovine group (P < 0.05). The IVM process also reduced the LHR expression (P < 0.05) in CCs from both the OS and MD groups, but it did not change in bovine CCs, which remained null. Additionally, comparing only CCs of MII oocytes, the LHR mrna level was slightly higher in the MD group than in the OS group (P < 0.05) and bovine group (P < 0.05), the latter two of which were similar to each other (P > 0.05).
53 53 The expression of Cx43 (Fig. 2) was similar between the MII- and GV-stage goat groups (P > 0.05). In the bovine group, the CCs of the MII oocytes had slightly lower expression (P < 0.05) than the CCs of the GV structures. Finally, in post-ivm COCs, bovine CCs showed Cx43 expression at a slightly lower level (P < 0.05) than goat cells at the same stage, but the hormonal treatments were similar to each other (P > 0.05). 4. Discussion In the present study, we analyzed the influence of gonadotropin-based ovarian stimulation on the expression of HAS2, gonadotropin receptors (FSHR and LHR) and Cx43 in goat CCs and pared the results with the corresponding results in cows. Additionally, we analyzed transcript levels in CCs with respect to the morphology of COCs (GI/II or GIII COCs) and the nuclear maturation stage of the oocyte (GV or MII). The production of hyaluronic acid (HA) occurs at the end of folliculogenesis and is increased by gonadotropic hormone stimulus (Kimura et al., 2002). In CCs, HA is synthesized by the enzymatic action of hyaluronic acid synthase, HAS (Sutton- McDowall et al., 2010), in glucose metabolism. Although there are three HAS isoenzymes (HAS-1, -2 and -3) that differ in their ability to synthesize HA (Dicker et al., 2014), HAS2 has been found to be the main enzyme responsible for the synthesis of HA in bovine CCs (Schoenfelder and Einspanier, 2003). We found higher expression of HAS2 after OS treatment compared to the other groups; this was true in both the GI/II and GIII structures. Additionally, freshly collected COCs, despite being in the GV stage, showed slightly expanded CC
54 54 populations. Previous studies have attributed the increased HA synthesis in CCs through in vitro expansion of COCs to the actions of gonadotropin (Schoenfelder and Einspanier, 2003). Kimura et al. (2002) observed a great expansion of porcine CCs produced by the synergistic effect of ecg with the follicular fluid of COCs cultured in vitro. Our findings indicate a possible in vivo action of ecg in OS treatment; ecg stimulated HA synthesis in the CCs of freshly collected COCs. Similar results have already been described in swine and mouse. Thus, Kawashima et al. (2008) observed an increase in the HAS2 expression of CCs from COCs derived from sows treated with ecg or ecg/hcg compared to the untreated group. Similarly, the hormonal ovarian stimulation of mice with ecg/hcg resulted in COCs with higher levels of HAS2 mrna (Fulop et al., 1997; Adriaenssens et al., 2011). In women treated with hcg, Jeppesen et al. (2012) reported that the cumulus of pre-ivm COCs presented a compact or expanded morphology immediately after isolation. Although the authors did not investigate HAS expression, we hypothesize that the slight expansion observed in goat COCs derived from OS treatment was produced by increased HA synthesis after in vivo ecg action, which did not occur in the MD protocol. During follicular development, there are gonadotropin-dependent stages in which FSH and LH can act on receptors (FSHR and LHR) in the somatic cells surrounding the oocyte (Byskov et al., 1997; Mihm and Austin, 2002). We produced quantitative and qualitative variations in an exogenous source of gonadotropins (FSH and ecg) through two hormonal protocols for goat ovarian stimulation (MD and OS). Thereafter, we investigated the expression of FSHR and LHR in CCs of the obtained COCs. The CCs of goat COCs obtained after OS treatment showed higher expression of FSHR than after the MD treatment, especially in the GI/II structures. Despite the
55 55 lack of studies on the in vivo effects of ecg (or ecg/fsh) on the expression of FSH receptors in goats, it is possible that the in vivo stimulation of this gonadotropin in the OS group caused the increased expression of FSHR. This in vivo effect was previously reported in rats treated with ecg in which there was an increase in FSHR expression in CCs, as revealed by immunohistochemistry of the ovary (Guan et al., 2015). The importance of the upregulation of FSH receptors in both the recruitment and selection steps during follicular waves has been widely reported in monovulatory species, such as cattle, humans and horses (Mihm and Evans, 2008). If the dominance is mediated by an FSH-dependent effect, it may be weakened by the administration of exogenous FSH (Driancourt, 2001; Gonzalez-Bulnes and Veiga-Lopez, 2008; Aerts and Bols, 2010) and eased FSHR expression in large follicles may not occur. Our investigation can explain the higher expression of FSHR in bovine CCs than in goats (MD and OS) based on the fact that COCs were collected from the largest follicles of cows without previous hormonal treatment, in which follicle dominance can take place. In addition, goat structures derived from the OS treatment showed higher LHR expression than those derived from bovine cells (no detectable RNAm level) or MD treatment. In pre-ovulatory follicles, LHR expression has been described in granulosa cells (Eppig et al., 1997; Marsters et al., 2015) and found to be low or undetectable in CCs (Jeppesen et al., 2012). Thus, a higher level of LHR in CCs is an unexpected finding, which we believe to be related to the lower quality of the COCs. A study by Vigone et al. (2015) using mice showed that analysis of LHR expression by real-time qpcr can differentiate between CCs associated with competent or incompetent in vitro development of an oocyte. Hence, LHR was increased in the CCs of COCs with
56 56 poor-quality oocytes. Similarly, Eppig et al. (1997) reported that murine CCs only upregulated LHR transcripts in the absence of oocytes. In addition, LHR transcription was prevented by paracrine factors secreted by isolated oocytes. Thus, it is possible that poor-quality oocytes failed to provide signaling to maintain low LHR levels in the CCs of terminal antral follicles. This statement is also compatible with the low IVM rates that we observed in structures from OS treatment and COCs displaying the worst morphology (GIII). Finally, the difference in LHR levels among post-ivm structures was absent because gene expression measurements were restricted to the CCs of successfully matured oocytes. During IVM, the COCs showed reduced LHR levels in CCs, irrespective of the hormonal treatment used before COL, and LHR remained absent in bovine CCs. The expansion of cumulus cells appears to be essential for cytoplasmic oocyte maturation and quires the synthesis and organization of an extracellular matrix, of which HA is the main component (Chen et al., 1994; Schoenfelder and Einspanier, 2003). Therefore, we analyzed whether IVM could influence the expression of HAS2 in goat CCs. In the CCs of cattle, we observed that in post-ivm structures, the expression of this enzyme is much higher than in pre-ivm COCs. Conversely, the mrna levels were maintained (or reduced) during IVM in goat structures (MD and OS). These findings corroborate previous reports on the importance of the expansion of CCs in bovine IVM (Caixeta et al., 2013). This phenomenon is less morphologically evident in goats than in bovine IVM COCs. Hence, we hypothesized that bovine COCs have a higher capacity for cumulus expansion than goats due to higher levels of HAS2 transcripts and greater accumulation of extracellular matrix during the IVM process. It is possible that these phenomena have different degrees of importance for IVM depending on the animal species. Thus, as we observed in goats,
57 57 HAS2 expression in sheep COCs was similar before and after IVM (Kyasari et al., 2012). Possibly, the synthesis of HA and expansion of CCs is not as important in goat and sheep IVM as it is in cattle. It is important to note that despite lower HAS2 expression, the goat IVM rates had the expected values based on previous reports for this species (Khatun et al., 2011; Abdullah et al., 2008). FSHR in the CCs plays an important role in triggering the physiological mechanisms involved in IVM in species, such as swine and cattle (Liu et al., 1998; Nuttinck et al., 2004). In cattle, FSH and other factors secreted by the oocyte are responsible for events such as CCs expansion, increased HAS2 expression (Gui and Joyce, 2005) and meiotic resumption (Ali and Sirard, 2005). In our experiments, we observed that FSHR expression decreased in CCs during IVM of both goats and cattle COCs. Our findings are similar to various reports for animals, such as cattle (Nuttinck et al, 2004; Salhab et al, 2011, Khan et al, 2015) and buffalo (Pandey et al., 2010). These findings make clear the importance of this gonadotropin receptor in the process of maturation and the loss of its function in subsequent steps of oocyte in vitro development. Some studies have reported the roles of gonadotropic hormones, especially FSH and LH, in regulating the expression of Cx43 in ovarian follicular cells (Sommersberg et al., 2000; Granot and Dekel, 2002; Johnson et al., 2002). Cx43 is the main protein that builds gap junctions between CCs of COCs in several animal species (Dell'Aquila et al., 2004; Pant et al., 2005; Wang et al., 2009; Santiquet et al., 2013; Li et al., 2015). These cellular communications play a crucial role in folliculogenesis and oocyte maturation (Ackert et al., 2001; Luciano et al., 2004; El- Hayek and Clarke, 2015). Thus, we investigated the influence of gonadotropic OS
58 58 and MD treatments on Cx43 expression in goat CCs and estigated possible changes in the transcript levels caused by IVM. Cattle were used as a control group. Regarding the effects of gonadotropin in vivo, we found that, in general, Cx43 expression was slightly higher in goat structures derived from OS treatment than those from MD treatment and those from cattle. Evidence for stimulatory FSH (Sommersberg et al., 2000; Wang et al., 2013) and inhibitory LH (Granot and Dekel, 1994; Kalma et al., 2004) effects on the abundance of Cx43 in granulosa ovarian cells of some species have been reported. Interestingly, in our study, ecg/fsh (OS treatment) was more effective in inducing Cx43 expression in goat CCs than FSH alone in MD. Because ecg in non-equine mammals exerts biological activity in both FSH and LH receptors (Murphy and Martinuk, 1991), it is relatively difficult to dissociate the effects of these two receptors in OS treatment. More intense or lasting action of ecg on FSHR could explain the higher levels of connexin transcripts in OS structures. This statement is consistent with the widespread use of ecg, which is replacing FSH multiple-dose treatment as an alternate protocol for ovarian overstimulation (Sousa et al., 2011). Another possibility is that the in vivo gonadotropic action varies the expression of connexin according to follicular size. Thus, Johnson et al. (2002) proposed that FSH promotes an increase in the number of gap junctions in granulosa cells obtained from small follicles, but not in medium or large follicles in cattle. Taking into account that more than half of COCs following OS treatment are recovered from small follicles (2-3 mm), in vivo gonadotropic stimulation and the resulting Cx43 expression may have favored this group compared to MD. When we analyzed connexin expression according to the IVM process, we found that the Cx43 mrna levels slightly decreased only in bovine structures, but not
59 59 in goat CCs. Some studies conducted in pigs and horses have pointed to an important role played by connexins in the maintenance of meiotic arrest of the oocyte (Marchal et al., 2003). The downregulation of connexin or rupturing of gap junctions may have been associated with meiotic resumption because they prevented inhibitory signals from passing from CCs to oocytes (Isobe et al., 1998). Our findings for cattle are in agreement with previously described results, in that the IVM process caused a decrease in Cx43 transcript levels in COCs (Sutovský et al., 1993). We do not know if the gap junctions play a similar role in goat COC IVM because the Cx43 levels remained unchanged in CCs during this process, although oocyte nuclear maturation was completed. Though it is unlikely, a connexin other than Cx43 could be involved in gap junctions in goat CCs. Finally, we also investigated the influence of hormonal treatments on the quantitative yields of COCs for IVM and sured meiotic competence. The results showed that MD treatment produced greater amounts of large follicles and GI/II COCs than the OS protocol. Moreover, oocytes from MD COCs showed improved meiotic competence, reflected by a higher IVM rate. In previous study (Almeida et al., 2010), we compared MD treatment with another treatment consisting of three doses (TD) of FSH. Despite obtaining similar quantities of GI/II COCs, the IVM rate was greater in the MD treatment than in TD. In sum, we concluded that ovarian stimulation of goats with multiple FSH doses produces a greater number of follicles available for LOR and produces structures that are suitable for IVM (GI/II). This explains the improved IVM rates compared to a low number of FSH administrations or treatment with a single dose of FSH/eCG. In conclusion, somatic cells of goat COCs produced after hormonal treatment for ovarian stimulation with a single dose of FSH/eCG have higher levels of HAS2,
60 60 gonadotropin receptors (FSHR and LHR) and Cx43 compared to conventional multiple-dose FSH treatment. These transcription patterns did not confer greater meiotic competence to the oocytes. Instead, they may result from the poor regulation of gene expression in low-quality oocytes. Finally, some events that occurred in CCs during IVM of bovine COCs, such as cell expansion, increased HAS2 expression and decreased Cx43 expression, seem to be less evident in goat COCs. Additional studies are still needed to investigate whether other isoforms of hyaluronic acid synthase or connexin are more important for goat COCs, which could reflect species-specific differences in molecular biology. Conflict of interest The authors declare no conflicts of interest. Acknowledgments This research was supported by grants from the CNPq (Brasília, Brazil). Juliana D.R. Santos is a recipient of a grant from CAPES (Brasília, Brazil). References Abdullah, R.B., Liow, S.L., Rahman, A.N., Chan, W.K., Wan-Khadijah, W.E., Ng, S.C., Prolonging the interval from ovarian hyperstimulation to laparoscopic ovum pick-up improves oocyte yield, quality, and developmental competence in goats. Theriogenology 70, Ackert, C.L., Gittens, J.E., O'Brien, M.J., Eppig, J.J., Kidder, G.M., Intercellular communication via connexin43 gap junctions is required for ovarian folliculogenesis in the mouse. Dev. Biol. 233,
61 61 Adriaenssens, T., Segers, I., Wathlet, S., Smitz, J., The cumulus cell gene expression profile of oocytes with different nuclear maturity and potential for blastocyst formation. J. Assist. Reprod. Genet. 28, Aerts, J.M.J., Bols, P.E.J., Ovarian follicular dynamics. A review with emphasis on the bovine species. Part II: antral development, exogenous influence and future prospects. Reprod. Dom. Anim. 45, Ali, A., Sirard, M.A., Protein kinases influence bovine oocyte competence duringshort-term treatment with recombinant human folliclestimulating hormone. Reproduction 130, Almeida, K.C., Pereira, A.F., Alcântara Neto, A.S., Avelar, S.R., Bertolini, L.R., Bertolini, M., Freitas, V.J., Melo, L.M., Real-time qrt-pcr analysis of EGF receptor in cumulus-oocyte complexes recovered by laparoscopy in hormonally treated goats. Zygote 19, Avelar, S.R.G., Moura, R.R., Sousa, F.C., Pereira, A.F., Almeida, K. C., Melo, C.H.S., Teles-Filho, A.C.A., Baril, G., Melo, L.M., Teixeira, D.I.A., Freitas, V.J.F., Oocyte production and in vitro maturation in Canindé goats followinghormonal ovarian stimulation. Anim. Reprod. 9, Baldassarre, H., Keefer, C., Wang, B., Lazaris, A., Karatzas, C.N., Nuclear transfer in goats using in vitro matured oocytes recovered by laparoscopic ovum pick-up. Cloning Stem Cells 5, Byskov, A.G., Yding Andersen, C., Hossaini, A., Guoliang, X., Cumulus cells of oocyte-cumulus complexes secrete a meiosis-activating substance when stimulated with FSH. Mol. Reprod. Dev. 46, Caixeta, E.S., Sutton-McDowall, M.L., Gilchrist, R.B., Thompson, J.G., Price, C.A., Machado, M.F., Lima, P.F., Buratini, J., Bone morphogenetic protein 15
62 62 and fibroblast growth factor 10 enhance cumulus expansion, glucose uptake, and expression of genes in the ovulatory cascade during in vitro maturation of bovine cumulus-oocyte complexes. Reproduction 146, Chen, L., Russell, P.T., Larsen, W.J., Sequential effects of follicle-stimulating hormone and luteinizing hormone on mouse cumulus expansion in vitro. Biol. Reprod. 51, Cox, J.F., Alfaro, V., In vitro fertilization and development of OPU derived goat and sheep oocytes. Reprod. Domest. Anim. 42, Dell'Aquila, M.E., Caillaud, M., Maritato, F., Martoriati, A., Gérard, N., Aiudi, G., Minoia, P., Goudet, G., Cumulus expansion, nuclear maturation and connexin 43, cyclooxygenase-2 and FSH receptor mrna expression in equine cumulus-oocyte complexes cultured in vitro in the presence of FSH and precursors for hyaluronic acid synthesis. Reprod. Biol. Endocrinol. 2, 44. Dicker, K.T., Gurski, L.A., Pradhan-Bhatt, S., Witt, R.L., Farach-Carson, M.C., Jia, X., Hyaluronan: a simple polysaccharide with diverse biological functions. Acta Biomater. 10, Driancourt, M.A., Regulation of ovarian follicular dynamics in farm animals. Implications for manipulation of reproduction. Theriogenology 55, El-Hayek, S., Clarke, H.J., Follicle-Stimulating hormone increases gap junctional communication between somatic and germ-line follicular compartments during murine oogenesis. Biol. Reprod. 93, 47. Eppig, J.J., Wigglesworth, K., Pendola, F., Hirao, Y., Murine oocytes suppress expression of luteinizing hormone receptor messenger ribonucleic acid by granulosa cells. Biol. Reprod. 56,
63 63 Fulop, C., Salustri, A., Hascall, V.C., Coding sequence of a hyaluronan synthase homologue expressed during expansion of the mouse cumulus-oocyte complex. Arch. Biochem. Biophys. 337, Gonzalez-Bulnes, A., Veiga-Lopez, A., Evidence of intraovarian follicular dominance effects during controlled ovarian stimulation in a sheep model. Fertil. Steril. 89, Granot, I., Dekel, N., Phosphorylation and expression of connexin-43 ovarian gap junction protein are regulated by luteinizing hormone. J. Biol. Chem. 269, 48. Granot, I., Dekel, N., The ovarian gap junction protein connexin 43: regulation by gonadotropins. Trends. Endocrinol. Metab. 13, Guan, S., Guo, L., Zhang, T., Zhu, B., Wang, X., Zhang, C., Effects of gonadotropin on Fas and/or FasL expression and proliferation in rat ovary. Theriogenology 83, Gui, L.M., Joyce, I.M., RNA interference evidence that growth differentiation factor-9 mediates oocyte regulation of cumulus expansion in mice. Biol. Reprod. 72, Isobe, N., Maeda, T., Terada, T., Involvement of meiotic resumption in the disruption of gap junctions between cumulus cells attached to pig oocytes. J. Reprod. Fertil. 113, Izadyar, F., Zeinstra, E., Bevers, M.M., Follicle stimulating hormone and growth hormone act differently on nuclear maturation while both enhance developmental competence of in vitro matured bovine oocytes. Mol. Reprod. Dev. 51, Jeppesen, J.V., Kristensen, S.G., Nielsen, M.E., Humaidan, P., DalCanto, M., Fadini, R., Schmidt, K.T., Ernst, E., Yding Andersen, C., LH-receptor gene
64 64 expression in human granulosa and cumulus cells from antral and preovulatory follicles. J. Clin. Endocrinol. Metab. 97, E Johnson, M.L., Redmer, D.A., Reynolds, L.P., Bilski, J.J., Grazul-Bilska, A.T., Gap junctional intercellular communication of bovine granulosa and thecal cells from antral follicles: effects of luteinizing hormone and follicle-stimulating hormone. Endocrine 18, Kalma, Y., Granot, I., Galiani, D., Barash, A., Dekel, N., Luteinizing hormoneinduced connexin 43 down-regulation: inhibition of translation. Endocrinology 145, Kane, M.T., A review of in vitro gamete maturation and embryo culture and potential impact on future animal biotechnology. Anim. Reprod. Sci. 79, Kawashima, I., Okazaki, T., Noma, N., Nishibori, M., Yamashita, Y., Shimada, M., Sequential exposure of porcine cumulus cells to FSH and/or LH is critical for appropriate expression of steroidogenic and ovulation-related genes that impact oocyte maturation in vivo and in vitro. Reproduction 136, Khan, D.R., Guillemette, C., Sirard, M.A., Richard, F.J., Characterization of FSH signalling networks in bovine cumulus cells: a perspective on oocyte competence acquisition. Mol. Hum. Reprod. 21, Khatun, M., Bhuiyan, M.M., Ahmed, J.U., Haque, A., Rahman, M.B., Shamsuddin, M., In vitro maturation and fertilization of prepubertal and pubertal black Bengal goat oocytes. J. Vet. Sci. 12, Kimura, N., Konno, Y., Miyoshi, K., Matsumoto, H., Sato, E., Expression of hyaluronan synthases and CD44 messenger RNAs in porcine cumulus-oocyte complexes during in vitro maturation. Biol. Reprod. 66,
65 65 Kyasari, O.R., Valojerdi, M.R., Farrokhi, A., Ebrahimi, B., Expression of maturation genes and their receptors during in vitro maturation of sheep COCs in the presence and absence of somatic cells of cumulus origin. Theriogenology 77, Larkin, M.A., Blackshields, G., Brown, N.P., Chenna, R., McGettigan, P.A., McWilliam, H., Valentin, F., Wallace, I.M., Wilm, A., Lopez, R., Thompson, J.D., Gibson, T.J., Higgins, D.G., Clustal W and Clustal X version 2.0. Bioinformatics 23, Li, S.H., Lin, M.H., Hwu, Y.M., Lu, C.H., Yeh, L.Y., Chen, Y.J., Lee, R.K.K., Correlation of cumulus gene expression of GJA1, PRSS35, PTX3, and SERPINE2 with oocyte maturation, fertilization, and embryo development. Reprod. Biol. Endocrinol. 13, 93. Liu, J., Aronow, B.J., Witte, D.P., Pope, W.F., La Barbera, A.R., Cyclic and maturation-dependent regulation of follicle-stimulating hormone receptor and luteinizing hormone receptor messenger ribonucleic acid expression in the porcine ovary. Biol. Reprod. 58, Livak, K.J., Schmittgen, T.D., Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Δ ΔCT) Method. Methods 25, Lonergan, P., Fair, T., Maturation of oocytes in vitro. Annu. Rev. Anim. Biosci. 4, Luciano, A.M., Modina, S., Vassena, R., Milanesi, E., Lauria, A., Gandolfi, F., Role of intracellular cyclic adenosine 3',5'-monophosphate concentration and oocyte-cumulus cells communications on the acquisition of the developmental competence during in vitro maturation of bovine oocyte. Biol. Reprod. 70,
66 66 Marchal, R., Caillaud, M., Martoriati, A., Gerard, N., Mermillod, P., Goudet, G., Effect of growth hormone (GH) on in vitro nuclear and cytoplasmic oocyte maturation, cumulus expansion, hyaluronan synthases, and connexins 32 and 43 expression, and GH receptor messenger RNA expression in equine and porcine species. Biol. Reprod. 69, Marsters, P., Kendall, N.R., Campbell, B.K., Pre-translational regulation of luteinizing hormone receptor in follicular somatic cells of cattle. Anim. Reprod. Sci. 163, Mihm, M., Austin, E.J., The final stages of dominant follicle selection in cattle. Domest. Anim. Endocrinol. 23, Mihm, M., Evans, A.C.O., Mechanisms for dominant follicle selection in monovulatory species: A comparison of morphological, endocrine and intraovarian events in cows, mares and women. Reprod. Dom. Anim. 43, Murphy, B.D., Martinuk, S.D., Equine chorionic gonadotropin. Endocr. Rev. 12, Nielsen, M.S., Axelsen, L.N., Sorgen, P.L., Verma, V., Delmar, M., Holstein-Rathlou, N.H., Gap junctions. Compr. Physiol. 2, Nuttinck, F., Charpigny, G., Mermillod, P., Loosfelt, H., Meduri, G., Freret, S., Grimard, B., Heymanb, Y., Expression of components of the insulin-like growth factor system and gonadotropin receptors in bovine cumulus oocyte complexes during oocyte maturation. Domest. Anim. Endocrinol. 27, Pandey, A., Gupta, N., Gupta, S.C., Improvement of in vitro oocyte maturation with lectin supplementation and expression analysis of Cx43, GDF-9, FGF-4 and fibronectin mrna transcripts in buffalo (Bubalus bubalis). J. Assist. Reprod. Genet. 26,
67 67 Pandey, A., Gupta, S.C., Gupta, N., Effect of FSH and LH hormones on oocyte maturation of buffalo and gene expression analysis of their receptors and Cx43 in maturing oocytes. Zygote 18, Pant, D., Reynolds, L.P., Luther, J.S., Borowicz, P.P., Stenbak, T.M., Bilski, J.J., Weigl, R.M., Lopes, F., Petry, K., Johnson, M.L., Redmer, D.A., Grazul-Bilska, A.T., Expression of connexin 43 and gap junctional intercellular communication in the cumulus-oocyte complex in sheep. Reproduction 129, Pontes, J.H., Melo Sterza, F.A., Basso, A.C., Ferreira, C.R., Sanches, B.V., Rubin, K.C., Seneda, M.M., Ovum pick up, in vitro embryo production, and pregnancy rates from a large-scale commercial program using Nelore cattle (Bos indicus) donors. Theriogenology 75, Salhab, M., Tosca, L., Cabau, C., Papillier, P., Perreau, C., Dupont, J., Mermillod, P., Uzbekova, S., Kinetics of gene expression and signaling in bovine cumulus cells throughout IVM in different mediums in relation to oocyte developmental competence, cumulus apoptosis and progesterone secretion. Theriogenology 75, Salustri, A., Yanagishita, M., Hascall, V.C., Mouse oocytes regulate hyaluronic acid synthesis and mucification by FSH-stimulated cumulus cells. Dev. Biol. 138, Santiquet, N., Robert, C., Richard, F.J., The dynamics of connexin expression, degradation and localisation are regulated by gonadotropins during the early stages of in vitro maturation of swine oocytes. PLoS One 8, e68456.
68 68 Schoenfelder, M., Einspanier, R., Expression of hyaluronan synthases and corresponding hyaluronan receptors is differentially regulated during oocyte maturation in cattle. Biol. Reprod. 69, Sommersberg, B., Bulling, A., Salzer, U., Fröhlich, U., Garfield, R.E., Amsterdam, A., Mayerhofer, A., Gap junction communication and connexin 43 gene expression in a rat granulosa cell line: regulation by follicle-stimulating hormone. Biol. Reprod. 63, Sousa, F.C., Sousa, C.H.M., Filho, A.C.A.T., Avelar, S.R., Moura, A.A.A., Martins, J.A., Figueirêdo, V.J.F., Teixeira, D.Í., Ovarian follicular response to different hormonal stimulation treatments in Canindé goats. Anim. Reprod. Sci. 125, Sutovský, P., Fléchon, J.E., Fléchon, B., Motlik, J., Peynot, N., Chesné, P., Heyman, Y., Dynamic changes of gap junctions and cytoskeleton during in vitro culture of cattle oocyte cumulus complexes. Biol. Reprod. 49, Sutton-McDowall, M.L., Gilchrist, R.B., Thompson, J.G., The pivotal role of glucose metabolism in determining oocyte developmental competence. Reproduction 139, van Wagtendonk-de Leeuw, A.M., Ovum pick up and in vitro production in the bovine after use in several generations: a 2005 status. Theriogenology 65, Vigone, G., Merico, V., Redi, C.A., Mazzini, G., Garagna, S., Zuccotti, M., FSH and LH receptors are differentially expressed in cumulus cells surrounding developmentally competent and incompetent mouse fully grown antral oocytes. Reprod. Fertil. Dev. 27,
69 69 Vozzi, C., Formenton, A., Chanson, A., Senn, A., Sahli, R., Shaw, P., Nicod, P., Germond, M., Haefliger, J.A., Involvement of connexin 43 in meiotic maturation of bovine oocytes. Reproduction 122, Wang, H.X., Tong, D., El-Gehani, F., Tekpetey, F.R., Kidder, G.M., Connexin expression and gap junctional coupling in human cumulus cells: contribution to embryo quality. J. Cell. Mol. Med. 13, Wang, H.X., Gillio-Meina, C., Chen, S., Gong, X.Q., Li, T.Y., Bai, D., Kidder, G.M., The canonical WNT2 pathway and FSH interact to regulate gap junction assembly in mouse granulosa cells. Biol. Reprod. 89, 39. Watanabe, K., Yamaguchi, Y., Molecular identification of a putative human hyaluronan synthase. J. Biol. Chem. 271, Weigel, P.H., Hascall, V.C., Tammi, M., Hyaluronan synthases. J. Biol. Chem. 272, Wu, L., Yu, X., Feng, L., Connexin 43 stabilizes astrocytes in a stroke-like milieu to facilitate neuronal recovery. Acta Pharmacol. Sin. 36, Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I., Rozen, S., Madden, T., Primer- BLAST: A tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics 13, 134. Zuelke, K.A., Brackett, B., Luteinizing hormone-enhanced in vitro maturation of bovine oocytes with and without protein supplementation. Biol. Reprod. 43,
70 70 Fig. 1. Expression of HAS2, Cx43, FSHR and LHR in caprine and bovine cumulus cells from graded cumulus-oocyte complexes (COCs). Goat COCs were obtained after multidose (MD) or one-shot (OS) in vivo FSH treatment for ovarian stimulation. Shown are the fold differences in mrna expression in the GI/II and GIII COCs after normalization to the reference genes (GAPDH, HAS2 and UXT). The mrna levels in GI/II of goat MD cumulus cells were arbitrarily set to one-fold. Morphological grades were compared within the goat hormonal treatments or for cattle as a group (A,B: P < 0.05). Bovine (BOV) and goat (MD or OS) groups were compared within the same grade (a,b: P < 0.05).
71 71 Fig. 2. Expression of HAS2, Cx43, FSHR and LHR in caprine and bovine cumulus cells from in vitro pre-maturation and post-maturation cumulus-oocyte complexes (COCs). Goat COCs were obtained after multidose (MD) or one-shot (OS) in vivo FSH treatment for ovarian stimulation. Cumulus cells were derived from pre-ivm or post-ivm COCs with germinal vesicle (GV) or metaphase II (MII) oocytes, respectively. Shown are the fold differences in mrna expression after normalization to the reference genes (GAPDH, HAS2 and UXT). The mrna levels in GV of goat MD cumulus cells were arbitrarily set to one-fold. Pre-IVM and post-ivm stages were compared within the goat hormonal treatments or for cattle as a group (A,B: P < 0.05). Bovine (BOV) and goat (MD or OS) groups were compared separately for the pre-ivm and post-ivm stages (a,b: P < 0.05).
72 72 Table 1 Primers used in quantitative real-time PCR of gene expression in goat and bovine cumulus cells. Gene Primer Nucleotide sequence (5-3 ) Product size GenBank (bp) Cx43 SE AAGCTTTGTAGGCCTGACCC 94 XM_ AS TGTGGGCCTTGTCTGAACTC HAS2 SE GCTGAGTCTGGGCTATGCAA 241 XM_ AS ACCCCTGTAGAAGAGCTGGAT FSHR SE ATCAACTCCTGTGCCAACCC 105 XM_ AS GGCTTGCACTTCATAGCAGC LHR SE GATTTCACCTGCATGGCACC 130 XM_ AS ACGGATTGGCGCATGAATTG GAPDH* SE-1 TTCAACGGCACAGTCAAGG 119 NM_ AS-1 ACATACTCAGCACCAGCATCAC SE-2 TTCCACGGCACAGTCAAGG 120 AJ AS-2 ACGTACTCAGCACCAGCATCAC UXT SE GCGCTACGAGGCTTTCATCT 129 XM_ AS TCCTGGAGTCGCTCAATGAC H2A SE TCCGGAAAGGCCAAGACAAA 81 XM_ AS GTGTCGATGAATACGGCCCA *Specific primers were designed to amplify the bovine (SE-1 and AS-1) and goat (SE-2 and AS-2) GAPDH genes.
73 73 Table 2 Number of collected and graded cumulus-oocyte complexes (COCs) and the in vitro maturation (IVM) rates in goats hormonally treated for ovarian stimulation. Hormonal Aspired Follicle size (%) Collected Graded COCs (%) IVM rate treatment follicles Small (2-3 mm) Medium (3-4 mm) Large (>4 mm) COCs GI/II GIII (%) MD a 32.6 a 24.8 a a 15.1 a 81.8 a OS b 21.1 a 17.7 b 172* 50.0 b 27.3 b 63.6 b Values with different letters (a,b) in the same column are significantly different (P < 0.05). *Some COCs from OS treatment showed a slight expansion of CCs immediately after laparoscopic recovery.
74 74 Table 3 Quantitative RT-PCR amplification parameters for gene expression analysis in goat and bovine cumulus cells. Gene Slope Y-Intercept Efficiency R 2 cdna* Mean Tm (ºC) ± SD Cx Goat brain 76.0 ± 0.30 FSHR Goat ovary 79.0 ± 0.37 LHR Goat ovary 78.3 ± 0.27 HAS Bovine CCs 79.8 ± 0.36 GAPDH Bovine embryo 82.7 ± 0.26 GAPDH Goat COCs 81.7 ± 0.10 H2A Bovine embryo 83.9 ± 0.27 UXT Goat brain 81.3 ± 0.30 *Positive controls were obtained from tissues or cells known to abundantly express each target gene.
75 75 7 CONCLUSÕES O tratamento com múltiplas doses de FSH (MD) para estimulação ovariana caprina, comparado àquele com dose única de FSH/eCG (OS), produz: a) maior número de folículos grandes (>4 mm); b) CCOs com melhor aspecto morfológico (graus I/II); c) melhor taxa de maturação in vitro. O tratamento com dose única de FSH/eCG produz complexos cumulus-oócito com mais alta expressão dos genes que codificam a enzima ácido hialurônico sintase (HAS2), os receptores de gonadotrofinas (FSHR e LHR) e a conexina 43 (Cx43). No entanto, esse maior nível de transcritos não confere maior competência meiótica aos oócitos e pode está associado a uma pobre regulação da expressão gênica promovida por oócitos de baixa qualidade. Finalmente, a expansão, o aumento da expressão de HAS2 e o decréscimo da síntese de Cx43, são eventos que ocorrem nas CCs durante a MIV de CCOs bovinos e que parecem ser menos evidentes ou não ocorrem na espécie caprina.
76 76 8 PERSPECTIVAS Os resultados obtidos no presente trabalho permitiram analisar a expressão de alguns genes envolvidos em mecanismos moleculares importantes para a foliculogênese e a maturação oocitária in vitro na espécie caprina. Estudos adicionais são ainda necessários para investigar a presença e a importância de outras isoenzimas da família ácido hialurônico sintase e outras conexinas em CCOs caprinos.
77 77 9 REFERÊNCIAS BIBLIOGRÁFICAS ABDULLAH, R. B.; LIOW, S. L.; RAHMAN, A. N. M. A.; CHAN, W. K.; WAN- KHADIJAH, W. E.; NG, S. C. Prolonging the interval from ovarian hyperstimulation to laparoscopic ovum pick-up improves oocyte yield, quality, and developmental competence in goats. Theriogenology, v. 70, p , ACKERT, C. L.; GITTENS, J. E.; O'BRIEN, M. J., EPPIG, J. J.; KIDDER, G. M. Intercellular communication via connexin43 gap junctions is required for ovarian folliculogenesis in the mouse. Developmental Biology, v. 233, p , ADAMS, G. P.; JAISWAL, R.; SINGH, J.; MALHI, P. Progress in understanding ovarian follicular dynamics in cattle. Theriogenology, v. 69, p , ADAMS, G. P.; MATTERI, R. L.; KASTELIC, J. P.; KO, J. C.; GINTHER, O. J. Association between surges of follicle-stimulating hormone and the emergence of follicular waves in heifers. Journal of Reproduction and Infertility, v. 94, p , ADONA, P. R.; MONZANI, P. S.; GUEMRA, S.; MIRANDA, M. S.; OHASHIC, O. M. Ovogênese e Foliculogênese em Mamíferos. UNOPAR Científica Ciências Biológicas e da Saúde, v. 15, p , ALMEIDA, K. C.; PEREIRA, A. F.; ALCÂNTARA NETO, A. S.; AVELAR, S. R. G.; BERTOLINI, L.; BERTOLINI, M.; FREITAS, V. J. F.; MELO, L. M. Real time qrt-pcr analysis of EGF receptor in cumulus-oocyte complexes recovered by laparoscopy in hormonally treated goats. Zygote, v. 19, p , AMOAH, E. A.; GELAYE, S. Biotechnological advances in goat reproduction. Journal of Animal Science, v. 75, p , ASSIDI, M.; DUFORT, I.; ALI, A.; HAMEL, M.; ALGRIANY, O.; DIELEMANN, S.; SIRARD, M. A. Identification of potential markers of oocyte competence expressed in bovine cumulus cells matured with follicle-stimulating hormone and/or phorbol myristate acetate in vitro. Biology of Reproduction, v. 79, p , AVELAR, S. R. G.; MOURA, R. R.; SOUSA, F. C.; PEREIRA, A. F.; ALMEIDA, K. C.; MELO, C. H. S.; TELES-FILHO, A. C. A.; BARIL, G.; MELO, L. M.; TEIXEIRA, D. I. A.; FREITAS, V. J. F. Oocyte production and in vitro maturation in Canindé goats following hormonal ovarian stimulation. Animal Reproduction, v. 9, p , AVIEZER, D.; LEVY, E.; SAFRAN, M.; SVAHN, C.; BUDDECKE, E.; SCHMIDT, A.; DAVID, G.; VLODAVSKY, I.; YAYON A. Differential structural requirements of heparin and heparan sulfate proteoglycans that promote binding of basic fibroblast growth factor to its receptor. The Journal of Biological Chemistry, v. 269, p , 1994.
78 78 BALDASSARRE, H. Aplicaciones practicas de la produccion de embriones in vitro en la especie caprina. Revista Brasileira de Reprodução Animal, v. 31, p , BALDASSARRE, H.; FURNUS, C. C.; DE MATOS, D. G.; PESSI, H. In vitro production of sheep embryos using laparoscopic folliculocentesis: alternative gonadotrophic treatments for stimulation of oocyte donors. Theriogenology. v. 45, p , BALDASSARRE, H.; KARATZAS, C. N. Advanced assisted reproduction technologies (ART) in goats. Animal Reproduction Science, v.82-83, p , BALDASSARRE, H.; KEEFER, C.; WANG, B.; LAZARIS, A.; KARATZAS, C. N. Nuclear transfer in goats using in vitro matured oocytes recovered by laparoscopic ovum pick-up. Cloning Stem Cells, v. 5, p , BALDASSARRE, H.; WANG, B.; KAFIDI, N.; KEEFER, C.; LAZARIS, A.; KARATZAS, C. N. Advances in the production and propagation of transgenic goats using laparoscopic ovum pick-up and in vitro embryo production technologies. Theriogenology, v. 57, p , BERLINGUER, F.; LEONI, G.; BOGLIOLO, L.; PINTUS, P. P.; ROSATI, I.; LEDDA, S.; NAITANA, S. FSH different regimes affect the developmental capacity and cryotolerance of embryos derived from oocytes collected from ovum pick-up in donor sheep. Theriogenology, v. 61, p , BEVERS, M. M.; DIELEMAN, S. J.; VAN DEN HURK, R.; IZADYAR, F. Regulation and modulation of oocyte maturation in the bovine. Theriogenology, v. 47, p , BRECHT, M.; MAYER, U.; SCHLOSSER, E.; PREHM, P. Increased hyaluronate synthesis is required for fibroblast detachment and mitosis. Biochemical Journal, v. 239, p , BRUZZONE, R.; WHITE, T. W.; PAUL, D. L. Connections with connexins: the molecular basis of direct intercellular signaling. European Journal of Biochemistry, v. 238, p. 1-27, BUCCIONE, R.; VANDERHYDEN, B. C.; CARON, P. J.; EPPIG, J. J. FSH-induced expansion of the mouse cumulus oophorus in vitro is dependent upon a specific factor(s) secreted by the oocyte. Developmental Biology, v. 138, p , BURATINI, J. J. R.; PRICE, C. A.; VISINTIN, J. A.; BÓ, G. A. Effects of dominant follicle aspiration and treatment with recombinant bovine somatotropin (bst) on ovarian follicular development in nelore (Bos indicus) heifers. Theriogenology, v. 54, p , CALDER, M. D.; CAVENEY, A. N.; SMITH, L. C.; WATSON, A. J. Responsiveness of bovine cumulus-oocyte-complexes (COC) to porcine and
79 79 recombinant human FSH, and the effect of COC quality on gonadotropin receptor and Cx43 marker gene mrnas during maturation in vitro. Reproductive Biology and Endocrinology, v. 1, p , CASTILHO, C.; ASSIS, G. S.; GARCIA, J. M. Influência do diâmetro e da fase folicular sobre a competência in vitro de oócitos obtidos de novilhas da raça Nelore. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 59, p , CHEN, L.; RUSSELL, P. T.; LARSEN, W. J. Sequential effects of folliclestimulating hormone and luteinizing hormone on mouse cumulus expansion in vitro. Biology of Reproduction, v. 51, p , COCERO, M. J.; ALABART, J. L.; HAMMAMI, S.; MARTÍ, J. I.; LAHOZ, B.; SÁNCHEZ, P.; ECHEGOYEN, E.; BECKERS, J. F.; FOLCH, J. The efficiency of in vitro ovine embryo production using an undefined or a defined maturation medium is determined by the source of the oocyte. Reproduction in Domestic Animals, v. 46, p , COGNIÉ, Y.; BARIL, G.; POULIN, N.; MERMILLOD, P. Current status of embryos technologies in sheep and goats. Theriogenology, v. 59, p , COGNIÉ, Y.; POULIN, N.; LOCATELLI, Y.; MERMILLOD, P. State-of-the-art production, conservation and transfer of in-vitro-produced embryos in small ruminants. Reproduction, Fertility and Development, v. 16, p , CROCOMO, L. F.; FILHO, W. C. M.; ALVARENGA, F. C. L.; BICUDO, S. D. Aspectos bioquímicos e ultraestruturais da maturação oocitária. Veterinária e Zootecnia, v. 18, p , CROZET, N.; AHMED-ALI, M.; DUBOS, M.P. Developmental competence of goat oocyte from follicle of different size categories following maturation, fertilization and culture in vitro. Journal of Reproduction and Fertility, v. 103, p , DEKEL, N. Protein phosphorylation/dephosphorylation in the meiotic cell cycle of mammalian oocytes. Reviews of Reproduction, v. 1, p , DEKEL, N.; LAWRENCE, T. S.; GILULA, N. B.; BEERS, W. H. Modulation of cell- to-cell communication in the cumulus-oocyte complex and the regulation of oocyte maturation by LH. Developmental Biology, v. 86, p , DELL'AQUILA, M. E.; CAILLAUD, M.; MARITATO, F.; MARTORIATI, A.; GÉRARD, N.; AIUDI, G.; MINOIA, P.; GOUDET G. Cumulus expansion, nuclear maturation and connexin 43, cyclooxygenase-2 and FSH receptor mrna expression in equine cumulus-oocyte complexes cultured in vitro in the presence of FSH and precursors for hyaluronic acid synthesis. Reproductive Biology and Endocrinology, v. 2, p. 44, DRAGOVIC, R. A.; RITTER, L. J.; SCHULZ, S. J.; AMATO, F.; ARMSTRONG, D. T.; GILCHRIST, R. B. Role of oocyte-secreted growth differentiation factor 9 in the regulation of mouse cumulus expansion. Endocrinology, v. 146, p , 2005.
80 80 DRION, P. V.; FURTOSS, V.; BARIL, G.; MANFREDI, E.; BOUVIER, F.; POUGNARD, J. L.; BERNELAS, D.; CAUGNON, P.; MCNAMARA, E. M.; REMY, B.; SULON, J.; BECKERS, J. F.; BODIN, L.; LEBCEUF, B. Four year of induction/synchronization of estrus in dairy goats: effect on the evolution of ecg binding rate in relation with parameters of reproduction. Reproduction Nutrition Development, v. 41, p , EKART, J.; MCNATTY, K.; HUTTON, J.; PITMAN, J. Ranking and selection of MII oocytes in human ICSI cycles using gene expression levels from associated cumulus cells. Human Reproduction, v. 28, p , EL-HAYEK, S.; CLARKE, H. J. Follicle-stimulating hormone increases gap junctional communication between somatic and germ-line follicular compartments during murine oogenesis. Biology of Reproduction, v. 93, p. 47, ELVIN, A. J.; CLARK, A. T.; WANG, P.; WOLFMAN, N. M.; MATZUK, M. M. Paracrine actions of growth differentiation factor-9 in the mammalian ovary. Molecular Endocrinology, v. 13, p , EPPIG, J. J. The relationship between cumulus cell-oocyte coupling, oocyte meiotic maturation, and cumulus expansion. Developmental Biology, v. 89, p , FAIR, T. Follicular oocyte growth and acquisition of developmental competence. Animal Reproduction Science, v. 78, p , FAIR, T.; HULSHOF, S. C. J.; HYTTEL, P.; BOLAND, M.; GREVE T. Bovine oocyte ultrastructure in primordial to tertiary follicles. Anatomy and Embryology, v. 195, p , FONSECA, J. F.; OLIVEIRA, M. E. F.; VIANA, J. H. M. Uso de procedimentos não cirúrgicos para a produção, recuperação e inovulação de embriões em pequenos ruminantes. Revista Brasileira de Reprodução Animal, v. 35, p , FREITAS, V. J. F.; SEROVAB, I. A.; MOURA, R. R.; ANDREEVA, L. E.; MELO, L. M.; TEIXEIRA, D. I. A.; PEREIRA, A F.; LOPES-JR, E. S.; DIASE, L. P. B.; NUNES-PINHEIRO, D. C.; SOUSA, F. C.; ALCÂNTARA-NETO, A. S.; ALBUQUERQUE, E. S.; MELO, C. H. S.; RODRIGUES, V. H. V.; BATISTA, R. I. T. P.; DVORYANCHIKOVG, G. A.; SEROV, O. L. The establishment of two transgenic goat lines for mammary gland hg-csf expression. Small Ruminant Research, v. 105, p , FULOP, C.; SALUSTRI, A.; HASCALL, V. C. Coding sequence of a hyaluronan synthase homologue expressed during expansion of the mouse cumulus- oocyte complex. Archives of Biochemistry and Biophysics, v. 337, p , GAD, A.; BESENFELDER, U.; RINGS, F.; GHANEM, N.; SALILEW-WONDIM, D.; HOSSAIN, M. M.; TESFAYE, D.; LONERGAN, P.; BECKER, A.; CINAR, U.; SCHELLANDER, K.; HAVLICEK, V.; HÖLKER, M. Effect of reproductive tract environment following controlled ovarian hyperstimulation treatment on embryo
81 81 development and global transcriptome profile of blastocysts: implications for animal breeding and human assisted reproduction. Human Reproduction, v. 26, p , GANDOLFI, T. A. L. B.; GANDOLFI, F. The maternal legacy to the embryo: cytoplasmic components and their effects on early development. Theriogenology, v. 55, p , GERSHON, E.; PLAKS, V.; DEKEL, N. Gap junctions in the ovary: Expression, localization and function. Molecular and Cellular Endocrinology, v. 282, p , GHARIBI, S. H.; HAJIAN, M.; OSTADHOSSEINI, S.; HOSSEINI, S. M.; FOROUZANFAR, M.; NASR-ESFAHANI, M. H. Effect of phosphodiesterase type 3 inhibitor on nuclear maturation and in vitro development of ovine oocytes. Theriogenology, v. 80, p , GIBBONS, A.; BONNET, F. P.; CUETO, M. I.; SALAMONE D.; CATALA M. Colheita de oócitos guiada por laparoscopia em caprinos e ovinos. Acta Scientiae Veterinariae, v. 36, p , GILULA, N. B.; EPSTEIN, M. L.; BEERS, W. H. Cell-to-cell communication and ovulation: A Study of the cumulus-oocyte complex. Journal of Cell Biology, v. 78, p , GOODENOUGH, D. A.; GOLIGER, J. A.; PAUL, D. L. Connexins, connexons, and intercellular communication. Annual Review of Biochemistry, v. 65, p , GOTTARDI, F. P.; MINGOTI, G. Z. Maturação de oócitos bovinos e influência na aquisição da competência para o desenvolvimento do embrião. Revista Brasileira de Reprodução Animal, v. 33, p , HARPER, K. M.; BRACKETT, B. G. Bovine blastocyst development after folliclestimulating hormone and platelet-derived growth factor treatment for oocyte maturation in vitro. Zygote, v. 1, p , HASEGAWA, J.; YANAIHARA, A.; IWASAKI, S.; MITSUKAWA, K.; NEGISHI, M.; OKAI, T. Reduction of connexin 43 in human cumulus cells yields good embryo competence during ICSI. Journal of Assisted Reproduction and Genetics, v. 24, p , HAUGHIAN, J. M.; GINTHER, O. J.; KOT, K.; WILTBANK, M. C. Relationships between FSH patterns and follicular dynamics and the temporal associations among hormones in natural and GnRH-induced gonadotropin surges in heifers. Reproduction, v.127, p , HILLIER, S. G. Gonadotropic control of ovarian follicular growth and development. Molecular and Cellular Endocrinology, v. 179, p , 2001.
82 82 HOSHI, H. In vitro production of bovine embryos and their application for embryo transfer. Theriogenology, v. 59, p , HOUDEAU, E.; FURSTOSS, V.; FORGERIT, Y.; BONNE, J. L.; LEBOEUF, B. Short-duration insemination with frozen semen increases fertility rate in nulliparous dairy goats. Animal, v. 2, p , HUNTER, M. G.; ROBINSON, R. S.; MANN, G. E.; WEBB, R. Endocrine and paracrine control of follicular development and ovulation rate in farm species. Animal Reproduction Science, v , p , HYTTEL, P.; VIUFF, D.; FAIR, T.; LAURINCIK, J.; THOMSEN, P. D.; CALLESEN, H.; VOS, P. L. A. M.; HENDRIKSEN, P. J. M.; DIELEMAN, S. J.; SCHELLANDER, K.; BESENFELDER, U.; GREVE, T. Ribosomal RNA gene expression and chromosome aberrations in bovine oocytes and preimplantation embryos. Reproduction, v. 122, p , ISOBE, N.; MAEDA, T.; TERADA, T. Involvement of meiotic resumption in the disruption of gap junctions between cumulus cells attached to pig oocytes. Journal of Reproduction and Infertility, v.113, p , ITANO, N.; SAWAI, T.; YOSHIDA, M.; LENAS, P.; YAMADA, Y.; IMAGAWA, M.; SHINOMURA, T.; HAMAGUCHI, M.; YOSHIDA, Y.; OHNUKI, Y.; MIYAUCHI, S.; SPICER, A. P.; MCDONALD, J. A.; KIMATA, K. Three isoforms of mammalian hyaluronan synthases have distinct enzymatic properties. The Journal of Biological Chemistry, v. 274, p , JONES, K. T. Turning it on and off: M-phase promoting factor during meiotic maturation and fertilization. Molecular Human Reproduction, v. 10, p. 1-5, KALMA, Y.; GRANOT, I.; GALIANI, D.; BARASH, A.; DEKEL, N. Luteinizing hormone-induced connexin 43 down-regulation: inhibition of translation. Endocrinology, v. 145, p , KATSKA-KSIAZKIEWICZ, L.; OPIELA, J.; RYNSKA, B. Effects of oocyte quality, semen donor and embryo co-culture system on the efficiency of blastocyst production in goats. Theriogenology, v. 68, p , KAWAMURA, K.; KUMAGAI, J.; SUDO, S.; CHUN, S. Y.; PISARSKA, M.; MORITA, H.; TOPPARI, J.; FU, P.; WADE, J. D.; BATHGATE, R. A. D.; HSUEH, A. J. W. Paracrine regulation of mammalian oocyte maturation and male germ cell survival. Proceedings of the National Academy of Sciences, v. 101, p , KHATUN, M.; BHUIYAN, M. M.; AHMED, J. U.; HAQUE, A.; RAHMAN, M. B.; SHAMSUDDIN, M. In vitro maturation and fertilization of prepubertal and pubertal black Bengal goat oocytes. Journal of Veterinary Science, v. 12, p , KIDDER, G. M.; MHAWI, A. A. Gap junctions and ovarian folliculogenesis. Reproduction, v. 123, p , 2002.
83 83 KIMURA, N.; KONNO, Y.; MIYOSHI, K.; MATSUMOTO, H.; SATO E. Expression of hyaluronan synthases and CD44 messenger RNAs in porcine cumulusoocyte complexes during in vitro maturation. Biology of Reproduction, v. 66, p , KNUDSON, C. B.; KNUDSON, W. Hyaluronan-binding proteins in development, tissue homeostasis, and disease. The FASEB Journal, v. 7, p , KOEMAN, J.; KEEFER, C. L.; BALDASSARRE, H.; DOWNEY, B. R. Developmental competence of prepubertal and adult goat oocytes cultured in semidefined media following laparoscopic recovery. Theriogenology, v. 60, p , KÖLLE, S.; STOJKOVIC, M.; BOIE, G.; WOLF, E.; SINOWATZ, F. Growth hormone-related effects on apoptosis, mitosis, and expression of connexin 43 in bovine in vitro maturation cumulus-oocyte complexes. Biology of Reproduction, v. 68, p , KRISCHEK, C.; MEINECKE, B. In vitro maturation of bovine oocytes requires polyadenylation of mrnas coding proteins for chromatin condensation, spindle assembly, MPF and MAP kinase activation. Animal Reproduction Science, v. 73, p , KUBELKA, M.; MOTLIK, J.; SCHULTZ, R. M.; PAVLOK, A. Butyrolactone I reversibly inhibits meiotic maturation of bovine oocytes, without influencing chromosome condensation activity. Biology of Reproduction, v. 62, p , KÜÇÜK, N.; AKSOY, M.; UÇAN, U.; AHMAD, E.; NASEER, Z.; CEYLAN, A.; SERIN, I. Comparison of two different cryopreservation protocols for freezing goat semen. Cryobiology, v. 68, p , KUMAR, N. M.; GILULA, N. B. The Gap Junction Communication Channel. Cell, v. 84, p , LAPOLT, P. S.; TILLY, J. L.; AIHARA, T.; NISHIMORI, K.; HSUEH, A. J. Gonadotropin-induced up- and down-regulation of ovarian follicle-stimulating hormone (FSH) receptor gene expression in immature rats: effects of pregnant mare's serum gonadotropin, human chorionic gonadotropin, and recombinant FSH. Endocrinology, v. 130, p , LAURENT, T. C.; FRASER, J. R. The properties and turnover of hyaluronan. Ciba Foundation Symposium, v. 124, p. 9-29, LAURENT, T. C.; FRASER, J. R. Hyaluronan. The FASEB Journal, v. 6, p , LI, R.; ALBERTINI, D. F. The road to maturation: somatic cell interaction and selforganization of the mammalian oocyte. Nature Reviews Molecular Cell Biology, v. 14, p , 2013.
84 84 LOEWENSTEIN, W. R. Junctional intercellular communication and the control of growth. Biochimica et Biophysica Acta, v. 560, p. 1-65, MALIK, H. N.; SINGHAL, D. K.; SAUGANDHIKA, S.; DUBEY, A.; MUKHERJEE, A.; SINGHAL, R.; KUMAR, S.; KAUSHIK, J. K.; MOHANTY, A. K.; DAS, B. C.; BAG, S.; BHANJA, S. K.; MALAKAR, D. Generation of parthenogenetic goat blastocysts: effects of different activation methods and culture media. Zygote, v. 23, p , MARCHAL, R.; CAILLAUD, M.; MARTORIATI, A.; GERARD, N.; MERMILLOD, P.; GOUDET, G. Effect of growth hormone (GH) on in vitro nuclear and cytoplasmic oocyte maturation, cumulus expansion, hyaluronan synthases, and connexins 32 and 43 expression, and GH receptor messenger RNA expression in equine and porcine species. Biology of Reproduction, v. 69, p , MAREI, W. F.; GHAFARIC, F.; FOULADI-NASHTA, A. A. Role of hyaluronic acid in maturation and further early embryo development of bovine oocytes. Theriogenology, v. 78, p , MCKENZIE, L. J.; PANGAS, S. A.; CARSON, S. A.; KOVANCI, E.; CISNEROS, P.; BUSTER, J. E.; AMATO, P.; MATZUK, M. M. Human cumulus granulosa cell gene expression: a predictor of fertilization and embryo selection in women undergoing IVF. Human Reproduction, v. 19, p , MENCHACA, A.; PINCZAK, A.; RUBIANES, E. Follicular recruitment and ovulatory response to FSH treatment initiated on day 0 or day 3 postovulation in goats. Theriogenology, v. 58, p , MERMILLOD, P.; TOMANEK, M.; MARCHAL, R.; MEIJER, L. High developmental competence of cattle oocytes maintained at the germinal vesicle stage for 24 hours in culture by specific inhibition of MPF kinase activity. Molecular Reproduction and Development, v. 55, p , MEYER, K.; PALMER, J. W. The polysaccharide of the vitreous humor. Journal of Biological Chemistry, v. 107, p , MOOR, R. M.; TROUNSON, A. O. Hormonal and follicular factors affecting maturation of sheep oocytes in vitro and their subsequent developmental capacity. Journal of reproduction and fertility, v. 49, p , MORATÓ, R.; ROMAGUERA, R.; IZQUIERDO, D.; PARAMIO, M. T.; MOGAS, T. Vitrification of in vitro produced goat blastocysts: effects of oocyte donor age and development stage. Cryobiology, v. 63, p , NIELSEN, M. S.; AXELSEN, L. N.; SORGEN, P. L.; VERMA, V.; Delmar, M.; HOLSTEIN-RATHLOU, N. H. Gap Junctions. Comprehensive Physiology, v. 2, p , 2012.
85 85 NITTA, M.; YOGO, K.; OHASHI, M.; AKIYAMA, M.; KUNITOMO, Y.; OGAWA, T.; ISHIDA-KITAGAWA, N.; MIYOSHI, J.; SATO, E.; TAKEYA, T. Identification and expression analysis of connexin-45 and connexin-60 as major connexins in porcine oocytes. Journal of Animal Science, v. 88, p , NUTTINCK, F.; CHARPIGNY, G.; MERMILLOD, P.; LOOSFELT, H.; MEDURI, G.; FRERET, S.; GRIMARD, B.; HEYMANB, Y. Expression of components of the insulin-like growth factor system and gonadotropin receptors in bovine cumulus oocyte complexes during oocyte maturation. Domestic Animal Endocrinology, v. 27, p , O'BRIEN, J.; BRUZZONE, R.; WHITE, T. W.; AL-UBAIDI, M. R.; RIPPS, H. Cloning and expression of two related connexins from the perch retina define a distinct subgroup of the connexin family. The Journal of Neuroscience, v. 18, p , OPIELA, J.; ROMANEK, J.; LIPINSKI, D.; SMORDG, Z. Effect of hyaluronan on developmental competence and quality of oocytes and obtained blastocysts from in vitro maturation of bovine oocytes. BioMed Research International, , OYAMADA, M.; OYAMADA, Y.; TAKAMATSU, T. Regulation of connexin expression. Biochimica et Biophysica Acta, v. 1719, p. 6-23, PANDEY, A.; GUPTA, S. C.; GUPTA, N. Effect of FSH and LH hormones on oocyte maturation of buffalo and gene expression analysis of their receptors and Cx43 in maturing oocytes. Zygote, v. 18, p , PANGAS, S. A.; MATZUK, M. M. The art and artifact of GDF9 activity: cumulus expansion and the cumulus expansion-enabling factor. Biology of Reproduction, v. 73, p , PARAMIO, M. T. In vivo and in vitro embryo production in goats. Small Ruminant Research, v. 89, p , PEREIRA, A. F.; ALCÂNTARA NETO, A. S.; ALBUQUERQUE, E. S.; LUCIANO, M. C.; TEIXEIRA, D. I.; FREITAS, V. J.; MELO, L. M. Goat oocyte production by standard or one-shot FSH treatments and quantitative analysis of transcripts for EGF ligands and its receptor after in vitro maturation. Reproduction in Domestic Animals, v. 47, p , PEREIRA, G. R.; LORENZO, P. L.; CARNEIRO, G. F.; GOESEELS, S. B.; KASTELIC, J.; LIU, I. K. M. A specific adenylyl cyclase inhibitor (DDA) and a cyclic AMP-dependent protein kinase inhibitor (H-89) block the action of equine growth hormone on in vitro maturation of equine oocytes. Zygote, v. 23, p , POMP, D.; GOOD, B. A.; GEISERT, R. D.; CORBIN, C. J.; CONLEY, A. J.Sex identification in mammals with polymerase chain reaction and its use to examine sex effects on diameter of day-10 or -11 pig embryos. Journal of Animal Science, v. 73, p , 1995.
86 86 PREHM, P. Hyaluronate is synthesized at plasma membranes. Biochemical Journal, v. 220, p , PUROHIT, G. N.; MEENA, H.; SOLANKI, K. Effects of vitrification on immature and in vitro matured, denuded and cumulus compact goat oocytes and their subsequent fertilization. Journal of Reproduction and Infertility, v. 13, p , RACKAUSKAS, M.; NEVERAUSKAS, V.; SKEBERDIS, V. A. Diversity and properties of connexin gap junction channels. Medicina (Kaunas), v. 46, p. 1-12, RODRIGUEZ, C.; ANEL, L.; ALVAREZ, M.; ANEL, E.; BOIXO, J. C.; CHAMORRO, C. A.; PAZ, P. Ovum pick-up in sheep: a comparison between different aspiration devices for optimal oocyte retrieval. Reproduction in Domestic Animals, v. 41, p , ROMAGUERA, R.; MOLL, X.; MORATÓ, R.; ROURA, M.; PALOMO, M. J.; CATALÁ, M. G.; JIMÉNEZ-MACEDO, A. R.; HAMMAMI, S.; IZQUIERDO, D.; MOGAS, T.; PARAMIO, M. T. Prepubertal goat oocytes from large follicles result in similar blastocyst production and embryo ploidy than those from adult goats. Theriogenology, v. 76, p. 1-11, RUBIANES, E.; MENCHACA, A. The pattern and manipulation of ovarian follicular growth in goats. Animal Reproduction Science, v. 78, p , SAGATA, N. What does Mos do in oocytes and somatic cells? Bioessays, v. 19, p , SAITO, H.; KANEKO, T.; TAKAHASHI, T.; KAWACHIYA, S.; SAITO, T.; HIROI M. Hyaluronan in follicular fluids and fertilization of oocytes. Fertility and Sterility, v. 74, p , SALAVATI, M.; GHAFARI, F.; ZHANG, T.; FOULADI-NASHTA, A. A. Influence of caffeine pretreatment on biphasic in vitro maturation of dog oocytes. Theriogenology, v. 80, p , SALUSTRI, A.; YANAGISHITA, M.; HASCALL, V. C. Mouse oocytes regulate hyaluronic acid synthesis and mucification by FSH-stimulated cumulus cells. Developmental Biology, v. 138, p , SALUSTRI, A.; YANAGISHITA, M.; UNDERHILL, C. B.; LAURENT, T. C.; HASCALL, V. C. Localization and synthesis of hyaluronic acid in the cumulus cells and mural granulosa cells of the preovulatory follicle. Developmental Biology, v. 151, p , SANTIQUET, N.; ROBERT, C.; RICHARD, F. J. The dynamics of connexin expression, degradation and localisation are regulated by gonadotropins during the early stages of in vitro maturation of swine oocytes. PLoS One, v. 8, e68456, 2013.
87 87 SCHOENFELDER, M.; EINSPANIER, R. Expression of hyaluronan synthases and corresponding hyaluronan receptors is differentially regulated during oocyte maturation in cattle. Biology of Reproduction, v. 69, p , SHI, J.; YOSHINO, O.; OSUGA, Y.; NISHII, O.; YANO, T.; TAKETANI Y. Bone morphogenetic protein 7 (BMP-7) increases the expression of follicle-stimulating hormone (FSH) receptor in human granulosa cells. Fertility and Sterility, v. 93, p , SHIMADA, M.; MAEDA, T.; TERADA, T. Dynamic changes of connexin-43, gap junctional protein, in outer layers of cumulus cells are regulated by PKC and PI 3- kinase during meiotic resumption in porcine oocytes. Biology of Reproduction, v. 64, p , SIRARD, M. A.; RICHARD, F.; BLONDIN, P.; ROBERT, C. Contribution of the oocyte to embryo quality. Theriogenology, v. 65, p , SIRARD, M. A.; DESROSIER, S.; ASSIDI, M. In vivo and in vitro effects of FSH on oocyte maturation and developmental competence. Theriogenology, v. 68, p , SNYDER, D. A.; DUKELOW, W. R. Laparoscopic studies of ovulation, pregnancy diagnosis, and follicle aspiration in sheep. Theriogenology, v. 2, p , SOLAN, J. L.; LAMPE, P. D. Connexin 43 phosphorylation structural changes and biological effects. Biochemical Journal, v. 419, p , SOUSA, F. C.; MELO, C. H. S.; TELES FILHO, A. C. A.; AVELAR, S. R.; MOURA, A. A. A.; MARTINS, J. A.; FREITAS, V. J. F.; TEIXEIRA, D. Í. Ovarian follicular response to different hormonal stimulation treatments in Canindé goats. Animal Reproduction Science, v. 125, p , SOUZA, J. M.; DUFFARD, N.; BERTOLDO, M. J.; LOCATELLI, Y.; CORBIN, E.; FATET, A.; FREITAS, V. J.; MERMILLOD P. Influence of heparin or the presence of cumulus cells during fertilization on the in vitro production of goat embryos. Animal Reproduction Science, v. 138, p , SOUZA-FABJAN, J. M.; LOCATELLI, Y.; DUFFARD, N.; CORBIN, E.; TOUZÉ, J. L.; PERREAU, C.; BECKERS, J. F.; FREITAS, V. J.; MERMILLOD, P. In vitro embryo production in goats: Slaughterhouse and laparoscopic ovum pick up-derived oocytes have different kinetics and requirements regarding maturation media. Theriogenology, v. 81, p , STANGL, M.; KÜHHOLZER, B.; BESENFELDER, U.; BREM, G. Repeated endoscopic ovum pick-up in sheep. Theriogenology, v. 52, p , SU, Y. Q.; DENEGRE, J. M.; WIGGLESWORTH, K.; PENDOLA, F. L.; O'BRIEN, M. J.; EPPIG, J. J. Oocyte-dependent activation of mitogen-activated protein kinase (ERK1/2) in cumulus cells is required for the maturation of the mouse oocytecumuluscell complex. Developmental Biology, v. 263, p , 2003.
88 88 TANAKA, Y.; NAKADA, K.; MORIYOSHI, M.; SAWAMUKAI, Y. Appearance and number of follicles and change in the concentration of serum FSH in female bovine fetuses. Reproduction, v. 121, p , THOMAS, R. E.; ARMSTRONG, D. T.; GILCHRIST, R. B. Bovine cumulus celloocyte gap junctional communication during in vitro maturation in response to manipulation of cell-specific cyclic adenosine 3',5'-monophosophate levels. Biology of Reproduction, v. 70, p , VAN DEN HURK, R.; ZHAO, J. Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles. Theriogenology, v. 63, p , VAN TOL, H. T.; VAN EIJK, M. J.; MUMMERY, C. L.; VAN DEN HURK, R.; BEVERS, M. M. Influence of FSH and hcg on the resumption of meiosis of bovine oocytes surrounded by cumulus cells connected to membrana granulosa. Molecular Reproduction and Development, v. 45, p , VANDERHYDEN, B. C. Species differences in the regulation of cumulus expansion by an oocyte-secreted factor(s). Journal of Reproduction and Fertility, v. 98, p , WAN, Y. J.; ZHANG, Y. L.; ZHOU, Z. R.; JIA, R. X.; LI, M.; SONG, H.; WANG, Z. Y.; WANG, L. Z.; ZHANG, G. M.; YOU, J. H.; WANG, F. Efficiency of donor cell preparation and recipient oocyte source for production of transgenic cloned dairy goats harboring human lactoferrin. Theriogenology, v. 78, p , WANG, H. X.; TONG, D.; EL-GEHANI, F.; TEKPETEY, F. R.; KIDDER, G. M. Connexin expression and gap junctional coupling in human cumulus cells: contribution to embryo quality. Journal of Cellular and Molecular Medicine, v. 13, p , WATSON, A. J. Oocyte cytoplasmic maturation: A key mediator of oocyte and embryo developmental competence. Journal of Animal Science, v. 85, (E. Suppl.):E1- E3, WIESEN, J. F.; MIDGLEY, A. R. J. R. Changes in expression of connexin 43 gap junction messenger ribonucleic acid and protein during ovarian follicular growth. Endocrinology. v. 133, p , WINTERHAGER, E.; KIDDER, G. M. Gap junction connexins in female reproductive organs: implications for women s reproductive health. Human Reproduction Update, v. 21, p , WRENZYCKI, C.; STINSHOFF, H. Maturation environment and impact on subsequent developmental competence of bovine oocytes. Reproduction in Domestic Animals, v. 48, p , 2013.
89 89 YEAGER, M.; HARRIS, A. L. Gap Junction Channel Structure in the Early 21st Century: Facts and Fantasies. Current Opinion in Cell Biology, v. 19, p , YOKOO, M.; SHIMIZU, T.; KIMURA, N.; TUNJUNG, W. A.; MATSUMOTO, H.; ABE, H.; SASADA, H.; RODRIGUEZ-MARTINEZ, H.; SATO E. Role of the hyaluronan receptor CD44 during porcine oocyte maturation. Journal of Reproduction and Development, v. 53, p , ZHANG, M.; XIA, G.; ZHOU, B.; WANG, C. Gonadotropin-controlled mammal oocyte meiotic resumption. Frontiers in Bioscience, v. 12, p , ZHANG, Y. L.; WAN, Y. J.; WANG, Z. Y.; XU, D.; PANG, X. S.; MENG, L.; WANG, L. H.; ZHONG, B. S.; WANG, F. Production of dairy goat embryos, by nuclear transfer, transgenic for human acid beta-glucosidase. Theriogenology, v. 73, p , ZHANG, G. M.; GU, C. H.; ZHANG, Y. L.; SUN, H. Y.; QIAN, W. P.; ZHOU, Z. R.; WAN, Y. J.; JIA, R. X.; WANG, L. Z.; WANG, F. Age-associated changes in gene expression of goat oocytes. Theriogenology, p. 1-9, ZOU, X.; CHEN, Y.; WANG, Y.; LUO, J.; ZHANG, Q.; ZHANG, X.; YANG, Y.; JU, H.; SHEN, Y.; LAO, W.; XU, S.; DU M. Production of cloned goats from enucleated oocytes injected with cumulus cell nuclei or fused with cumulus cells. Cloning, v. 3, p , 2001.
Produção in vitro de embriões
 Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões Vicente
Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões Vicente
Competência Oocitária
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Laboratório de Reprodução Animal -EMBRAPA Competência Oocitária Lucas Hax Médico Veterinário Doutorando em Biotecnologia
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Laboratório de Reprodução Animal -EMBRAPA Competência Oocitária Lucas Hax Médico Veterinário Doutorando em Biotecnologia
Produção in vitro de embriões
 Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós- Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões
Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós- Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões
Produção in vitro de embriões ovinos
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Produção in vitro de embriões ovinos Apresentadores: Mauri Mazurek Rodrigo C. de C. de Azambuja Orientação: Liziane Lemos Viana Small Ruminant Resarch
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Produção in vitro de embriões ovinos Apresentadores: Mauri Mazurek Rodrigo C. de C. de Azambuja Orientação: Liziane Lemos Viana Small Ruminant Resarch
GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS. Profª Msc. Tatiane da Silva Poló
 GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS Profª Msc. Tatiane da Silva Poló ou OOGÊNESE ou OVULOGÊNESE e FOLICULOGÊNESE DEFINIÇÃO OVOGÊNESE: É uma sequência de eventos através dos quais as células germinativas
GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS Profª Msc. Tatiane da Silva Poló ou OOGÊNESE ou OVULOGÊNESE e FOLICULOGÊNESE DEFINIÇÃO OVOGÊNESE: É uma sequência de eventos através dos quais as células germinativas
Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca
 Topicos Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca Fertilizacao e desenvolvimento embrionario Cerebro
Topicos Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca Fertilizacao e desenvolvimento embrionario Cerebro
Coleta, Classificação e Maturação in vitrode Oócitos
 Universidade Federal de Pelotas Graduação em Biotecnologias Disciplina de Manipulação de Gametas e Embriões 2ª Aula: Coleta, Classificação e Maturação in vitrode Oócitos Priscila M. M. de Leon Doutoranda
Universidade Federal de Pelotas Graduação em Biotecnologias Disciplina de Manipulação de Gametas e Embriões 2ª Aula: Coleta, Classificação e Maturação in vitrode Oócitos Priscila M. M. de Leon Doutoranda
ENDOCRINOLOGIA REPRODUTIVA. M. V. Doutorando Lucas Balinhas Farias
 ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
FORMAÇÃO DE RECURSOS HUMANOS NO LFCR
 FORMAÇÃO DE RECURSOS HUMANOS NO LFCR PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS 1998 Pós-Graduando Marcelo Ivan Rojas Burgoa Tânia Vasconcelos Cavalcante Título do trabalho Momento do pique pré-ovulatório
FORMAÇÃO DE RECURSOS HUMANOS NO LFCR PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS 1998 Pós-Graduando Marcelo Ivan Rojas Burgoa Tânia Vasconcelos Cavalcante Título do trabalho Momento do pique pré-ovulatório
Fisiologia da Reprodução
 Texto de Referência Fisiologia da Reprodução Conhecimentos de anatomia e fisiologia são imprescindíveis para o Médico Veterinário que pretende trabalhar de forma correta e tirar o máximo proveito da técnica
Texto de Referência Fisiologia da Reprodução Conhecimentos de anatomia e fisiologia são imprescindíveis para o Médico Veterinário que pretende trabalhar de forma correta e tirar o máximo proveito da técnica
O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas Apresentadores: Andressa Stein Maffi Mauri Mazurek
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas Apresentadores: Andressa Stein Maffi Mauri Mazurek
Fisiologia celular I. Fisiologia Prof. Msc Brunno Macedo
 celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
SINCRONIZE CICLO ESTRAL: Vaca Poliéstrica, ou seja, manifesta vários cios durante o ano, sendo interrompido pela gestação.
 SINCRONIZE CICLO ESTRAL: Vaca Poliéstrica, ou seja, manifesta vários cios durante o ano, sendo interrompido pela gestação. Estro caracteriza-se pela receptividade sexual da fêmea e é nesta fase que ocorre
SINCRONIZE CICLO ESTRAL: Vaca Poliéstrica, ou seja, manifesta vários cios durante o ano, sendo interrompido pela gestação. Estro caracteriza-se pela receptividade sexual da fêmea e é nesta fase que ocorre
Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes Lucas Hax e Patrícia Mattei Pelotas, 18 de
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes Lucas Hax e Patrícia Mattei Pelotas, 18 de
Embriologia (BMH120) - Biologia Noturno. Aula 1
 Embriologia (BMH120) - Biologia Noturno Aula 1 Introdução das Bases Moleculares e Celulares: Sinalização Intracelular Prof. Rodrigo A. P. Martins ICB - LaNCE - HUCFF - UFRJ Objetivos Ao final desta aula
Embriologia (BMH120) - Biologia Noturno Aula 1 Introdução das Bases Moleculares e Celulares: Sinalização Intracelular Prof. Rodrigo A. P. Martins ICB - LaNCE - HUCFF - UFRJ Objetivos Ao final desta aula
ENDOCRINOLOGIA DA REPRODUÇÃO. Elisângela Mirapalheta Madeira Medica Veterinária, MC
 ENDOCRINOLOGIA DA REPRODUÇÃO Elisângela Mirapalheta Madeira Medica Veterinária, MC Introdução Glândulas Endócrinas Hipotálamo Hipófise Gônadas Glândula pineal Glândulas Endócrinas Hipotálamo Glândulas
ENDOCRINOLOGIA DA REPRODUÇÃO Elisângela Mirapalheta Madeira Medica Veterinária, MC Introdução Glândulas Endócrinas Hipotálamo Hipófise Gônadas Glândula pineal Glândulas Endócrinas Hipotálamo Glândulas
Os programas para sincronização da ovulação têm como princípio básico controlar a vida do corpo lúteo (CL) com utilização de PGF 2α, induzir o
 Os programas para sincronização da ovulação têm como princípio básico controlar a vida do corpo lúteo (CL) com utilização de PGF 2α, induzir o desenvolvimento folicular e a sincronização da ovulação, prevenindo
Os programas para sincronização da ovulação têm como princípio básico controlar a vida do corpo lúteo (CL) com utilização de PGF 2α, induzir o desenvolvimento folicular e a sincronização da ovulação, prevenindo
EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS
 1 EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS EFFECT OF TYPE OF CULTURE SYSTEM ON THE IN VITRO DEVELOPMENT OF ISOLATED CAPRINE PREANTRAL
1 EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS EFFECT OF TYPE OF CULTURE SYSTEM ON THE IN VITRO DEVELOPMENT OF ISOLATED CAPRINE PREANTRAL
Fertilização. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Fertilização Prof a. Marta G. Amaral, Dra. Embriologia molecular Geralmente ocorre na ampola da trompa uterina. Não ocorre no útero. Sêmen Formado pelos espermatozoides e mistura de secreções testiculares,
Fertilização Prof a. Marta G. Amaral, Dra. Embriologia molecular Geralmente ocorre na ampola da trompa uterina. Não ocorre no útero. Sêmen Formado pelos espermatozoides e mistura de secreções testiculares,
BIOLOGIA. Moléculas, Células e Tecidos Gametogênese. Prof. Daniele Duó
 BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
ENDOCRINOLOGIA REPRODUTIVA. M.S. Cássio Cassal Brauner FAEM-UFPel
 ENDOCRINOLOGIA REPRODUTIVA M.S. Cássio Cassal Brauner Prof. DZ-FAEM FAEM-UFPel ENDOCRINOLOGIA REPRODUTIVA Endocrinologia é parte das ciências médicas que trata da secreção das glândulas internas (hormônios)
ENDOCRINOLOGIA REPRODUTIVA M.S. Cássio Cassal Brauner Prof. DZ-FAEM FAEM-UFPel ENDOCRINOLOGIA REPRODUTIVA Endocrinologia é parte das ciências médicas que trata da secreção das glândulas internas (hormônios)
Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução
 Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução Apresentadores: Med. Vet. Andressa Stein Maffi Kauana Soares FI: 1,79 Qual
Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução Apresentadores: Med. Vet. Andressa Stein Maffi Kauana Soares FI: 1,79 Qual
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular
 Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACAS: UM ESTUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULAS DA GRANULOSA
 REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACA: UM ETUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULA DA GRANULOA Douglas Peraoli & Francielle Bado Augusto chneider FI: 3.300
REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACA: UM ETUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULA DA GRANULOA Douglas Peraoli & Francielle Bado Augusto chneider FI: 3.300
hormônios do sistema genital masculino gônadas masculinas
 Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Gametogênese Ovogênese. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese Ovogênese Prof a. Marta G. Amaral, Dra. Embriologia molecular Cél germinativa primordial (CGP) CGP Oogônias Inicia antes do nascimento Depois entra em repouso Na puberdade termina a diferenciação
Gametogênese Ovogênese Prof a. Marta G. Amaral, Dra. Embriologia molecular Cél germinativa primordial (CGP) CGP Oogônias Inicia antes do nascimento Depois entra em repouso Na puberdade termina a diferenciação
Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente desenvolvimento folicular em fetos de ovelhas
 Universidade Federal de Pelotas Faculdade de Veterinária Núcleo de Pesquisa Ensino e Extensão em Pecuária Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente
Universidade Federal de Pelotas Faculdade de Veterinária Núcleo de Pesquisa Ensino e Extensão em Pecuária Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR. Sinalização Celular SALVADOR - BA 2016
 UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
Expressão Gênica em Oócitos e Embriões
 Universidade Federal de Pelotas Graduação em Biotecnologias Manipulação de Gametas e Embriões Expressão Gênica em Oócitos e Embriões Prof. Tiago Collares Prof a. Priscila M. M. de Leon Janeiro, 2013 Análise
Universidade Federal de Pelotas Graduação em Biotecnologias Manipulação de Gametas e Embriões Expressão Gênica em Oócitos e Embriões Prof. Tiago Collares Prof a. Priscila M. M. de Leon Janeiro, 2013 Análise
Fases do ciclo celular O ciclo celular dos eucariotos está dividido em quatro fases separadas: M, G 1
 CICLO CELULAR A vida das células é formada por dois períodos: INTÉRFASE: inicia no fim da mitose e estende até iniciar a próxima mitose. MITOSE: Reprodução celular, com as seguintes finalidades: Nos unicelulares:
CICLO CELULAR A vida das células é formada por dois períodos: INTÉRFASE: inicia no fim da mitose e estende até iniciar a próxima mitose. MITOSE: Reprodução celular, com as seguintes finalidades: Nos unicelulares:
APRIMORAMENTO DA EFICIÊNCIA REPRODUTIVA NO PÓS-PARTO DE BOVINOS
 APRIMORAMENTO DA EFICIÊNCIA REPRODUTIVA NO PÓS-PARTO DE BOVINOS Prof. Dr. Rodolfo Cassimiro de Araujo Berber Universidade Federal de Mato Grosso Campus Sinop BIOTÉCNICAS DA REPRODUÇÃO MELHORAMENTO GENÉTICO
APRIMORAMENTO DA EFICIÊNCIA REPRODUTIVA NO PÓS-PARTO DE BOVINOS Prof. Dr. Rodolfo Cassimiro de Araujo Berber Universidade Federal de Mato Grosso Campus Sinop BIOTÉCNICAS DA REPRODUÇÃO MELHORAMENTO GENÉTICO
Conceitos fundamentais de Biologia Celular
 Conceitos fundamentais de Biologia Celular Principais estruturas da célula eucariótica O NÚCLEO Contém nos cromossomos todo o genoma (DNA) das células; Responsável pela síntese e processamento dos RNAs
Conceitos fundamentais de Biologia Celular Principais estruturas da célula eucariótica O NÚCLEO Contém nos cromossomos todo o genoma (DNA) das células; Responsável pela síntese e processamento dos RNAs
SISTEMA REPRODUTOR FEMININO
 Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR FEMININO Histologia e Embriologia Geral Veterinária Profa. Janaina Serra Azul Monteiro Evangelista SISTEMA REPRODUTOR FEMININO
Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR FEMININO Histologia e Embriologia Geral Veterinária Profa. Janaina Serra Azul Monteiro Evangelista SISTEMA REPRODUTOR FEMININO
5.COMUNICAÇÃO CELULAR
 DEPARTAMENTO DE CIÊNCIAS FISIOLÓGICAS-DFS CURSO DE ESPECIALIZAÇÃO EM FISIOLOGIA HUMANA 5.COMUNICAÇÃO CELULAR PROF. DRA. MARIA IDA B.R. SPEZIALI UNIVERSIDADE ESTADUAL DE MARINGÁ-UEM Comunicação célula-célula
DEPARTAMENTO DE CIÊNCIAS FISIOLÓGICAS-DFS CURSO DE ESPECIALIZAÇÃO EM FISIOLOGIA HUMANA 5.COMUNICAÇÃO CELULAR PROF. DRA. MARIA IDA B.R. SPEZIALI UNIVERSIDADE ESTADUAL DE MARINGÁ-UEM Comunicação célula-célula
Gametogênese Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado
 Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado A gametogênese é o processo de produção dos gametas, as células reprodutoras. Esta produção ocorre nas gônadas e seu principal evento é a meiose, responsável
Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado A gametogênese é o processo de produção dos gametas, as células reprodutoras. Esta produção ocorre nas gônadas e seu principal evento é a meiose, responsável
Princípios. Gerais da Fisiologia Endócrina. Diego Veras Wilke
 Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular
 Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Bloco X- Testes- Células germinativas
 Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Bases Moleculares do Desenvolvimento II
 Faculdade de Medicina de Ribeirão Preto - USP Módulo de Embriologia Geral Bases Moleculares do Desenvolvimento II Prof. Carolina Gonçalves Santos Questões da Biologia do Desenvolvimento 1 - Morfogênese
Faculdade de Medicina de Ribeirão Preto - USP Módulo de Embriologia Geral Bases Moleculares do Desenvolvimento II Prof. Carolina Gonçalves Santos Questões da Biologia do Desenvolvimento 1 - Morfogênese
Interações hormonais relacionadas com a reprodução. Professor: Arturo Arnáez Vaella
 Interações hormonais relacionadas com a reprodução Professor: Arturo Arnáez Vaella 1. a paralisação (diplóteno) Fonte: Carlson, B. (2014). Embriologia humana e biologia do desenvolvimento (5 ed.) 1. a
Interações hormonais relacionadas com a reprodução Professor: Arturo Arnáez Vaella 1. a paralisação (diplóteno) Fonte: Carlson, B. (2014). Embriologia humana e biologia do desenvolvimento (5 ed.) 1. a
Reprodução em Bubalinos. Prof. Raul Franzolin Neto FZEA/USP
 Reprodução em Bubalinos Prof. Raul Franzolin Neto FZEA/USP 1 Reprodução em Bubalinos Introdução Aspectos Anátomo-fisiológicos dos Órgãos Reprodutivos do macho e da fêmea Características Reprodutivas Puberdade
Reprodução em Bubalinos Prof. Raul Franzolin Neto FZEA/USP 1 Reprodução em Bubalinos Introdução Aspectos Anátomo-fisiológicos dos Órgãos Reprodutivos do macho e da fêmea Características Reprodutivas Puberdade
Inseminação artificial em tempo - fixo (IATF) utilizando estradiol e progesterona em vacas Bos indicus: Estratégias e fatores que afetam a fertilidade
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Inseminação artificial em tempo - fixo (IATF) utilizando estradiol e progesterona em vacas Bos indicus: Estratégias e fatores que afetam a fertilidade
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Inseminação artificial em tempo - fixo (IATF) utilizando estradiol e progesterona em vacas Bos indicus: Estratégias e fatores que afetam a fertilidade
HORMÔNIOS VEGETAIS. Katia Christina Zuffellato-Ribas
 HORMÔNIOS VEGETAIS Katia Christina Zuffellato-Ribas HORMÔNIO VEGETAL COMPOSTO ORGÂNICO, NÃO NUTRIENTE, DE OCORRÊNCIA NATURAL, PRODUZIDO NA PLANTA, O QUAL, EM BAIXAS CONCENTRAÇÕES (10-4 A 10-6 M), PROMOVE,
HORMÔNIOS VEGETAIS Katia Christina Zuffellato-Ribas HORMÔNIO VEGETAL COMPOSTO ORGÂNICO, NÃO NUTRIENTE, DE OCORRÊNCIA NATURAL, PRODUZIDO NA PLANTA, O QUAL, EM BAIXAS CONCENTRAÇÕES (10-4 A 10-6 M), PROMOVE,
Ciclo Celular e Controle do Ciclo Celular
 Ciclo Celular e Controle do Ciclo Celular Profa. Dra. Maria Tercília Vilela de Azeredo Oliveira Profa. Dra. Ester Tartarotti MSc. Rita Luiza Peruquetti Divisão Celular Deve ser regulada e Coordenada Ciclo
Ciclo Celular e Controle do Ciclo Celular Profa. Dra. Maria Tercília Vilela de Azeredo Oliveira Profa. Dra. Ester Tartarotti MSc. Rita Luiza Peruquetti Divisão Celular Deve ser regulada e Coordenada Ciclo
Integração. Sistema Nervoso. Glândula Endócrina. Hormônio. Órgão ou Tecido alvo
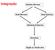 Integração Sistema Nervoso Sinal Nervosa Sinal Química Glândula Endócrina Hormônio Órgão ou Tecido alvo Nível Corporal Regulação e integração de: -Balanço de íons e líquidos -Balanço de energia (metabolismo)
Integração Sistema Nervoso Sinal Nervosa Sinal Química Glândula Endócrina Hormônio Órgão ou Tecido alvo Nível Corporal Regulação e integração de: -Balanço de íons e líquidos -Balanço de energia (metabolismo)
Membrana Celular (Membrana Plasmática)
 Partes da Célula: Membrana Celular (Membrana Plasmática) Citoplasma - citosol - organelas (compartimentalização funcional) Núcleo A Membrana Plasmática: estrutura geral O Modelo do Mosaico Fluido A Membrana
Partes da Célula: Membrana Celular (Membrana Plasmática) Citoplasma - citosol - organelas (compartimentalização funcional) Núcleo A Membrana Plasmática: estrutura geral O Modelo do Mosaico Fluido A Membrana
Gametogênese ESPERMATOGÊNESE. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas em desenvolvimento.
Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas em desenvolvimento.
Gametogênese e fecundação
 Gametogênese e fecundação Objetivos os estudantes deverão ser capazes de descrever as etapas da meiose (meiose I e meiose II) e explicar a função do processo meiótico descrever o processo de formação dos
Gametogênese e fecundação Objetivos os estudantes deverão ser capazes de descrever as etapas da meiose (meiose I e meiose II) e explicar a função do processo meiótico descrever o processo de formação dos
Introdução à Fisiologia Celular
 Introdução à Fisiologia Celular Uma boa compreensão da Fisiologia Humana, acontece paulatinamente com a ampliação da visão de que estuda e pesquisa da maquinaria celular. Decorar tudo é dispensável, entretanto,
Introdução à Fisiologia Celular Uma boa compreensão da Fisiologia Humana, acontece paulatinamente com a ampliação da visão de que estuda e pesquisa da maquinaria celular. Decorar tudo é dispensável, entretanto,
GAMETOGÊNESE. Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS.
 GAMETOGÊNESE 1 GAMETOGÊNESE Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS. Gameta masculino Espermatozóide. Gameta feminino Ovócito. Os gametas possuem metade
GAMETOGÊNESE 1 GAMETOGÊNESE Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS. Gameta masculino Espermatozóide. Gameta feminino Ovócito. Os gametas possuem metade
CONTROLE NEUROENDÓCRINO DA REPRODUÇÃO HIPÓFISE
 CONTROLE NEUROENDÓCRINO DA REPRODUÇÃO HIPÓFISE HIPÓFISE DE MAMÍFEROS Células gonadotrópicas Hipófise dos teleósteos Neurohipófise Ramos da NH NH não invade a hipófise Hipófise de pirarucu Eminência média?
CONTROLE NEUROENDÓCRINO DA REPRODUÇÃO HIPÓFISE HIPÓFISE DE MAMÍFEROS Células gonadotrópicas Hipófise dos teleósteos Neurohipófise Ramos da NH NH não invade a hipófise Hipófise de pirarucu Eminência média?
Aspectos gerais da estrutura celular
 Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Doenças Metabólicas. Interação Metabolismo x Reprodução. Bruna Mion
 Doenças Metabólicas Interação Metabolismo x Reprodução Bruna Mion Interação Metabolismo x Reprodução Reprodução Processos fisiológicos Produção de leite Processos imunes Mantença Interação Metabolismo
Doenças Metabólicas Interação Metabolismo x Reprodução Bruna Mion Interação Metabolismo x Reprodução Reprodução Processos fisiológicos Produção de leite Processos imunes Mantença Interação Metabolismo
MIR-142-3P AS A BIOMARKER OF BLASTOCYST IMPLANTATION FAILURE A PILOT STUDY
 MIR-142-3P AS A BIOMARKER OF BLASTOCYST IMPLANTATION FAILURE A PILOT STUDY Edson Borges Jr 1 ; Amanda Setti Raize 1, Daniela Paes de Almeida Ferreira Braga 1 ; Murilo Vieira Geraldo 2 ; Rita de Cássia
MIR-142-3P AS A BIOMARKER OF BLASTOCYST IMPLANTATION FAILURE A PILOT STUDY Edson Borges Jr 1 ; Amanda Setti Raize 1, Daniela Paes de Almeida Ferreira Braga 1 ; Murilo Vieira Geraldo 2 ; Rita de Cássia
Inter-relações da nutrição, hormônios metabólicos e reinicio da ovulação em vacas de corte multíparas amamentando manejadas em pastagem subtropical
 Inter-relações da nutrição, hormônios metabólicos e reinicio da ovulação em vacas de corte multíparas amamentando manejadas em pastagem subtropical Apresentadores: Andressa Stein Maffi Tiago Garlet Pelotas,
Inter-relações da nutrição, hormônios metabólicos e reinicio da ovulação em vacas de corte multíparas amamentando manejadas em pastagem subtropical Apresentadores: Andressa Stein Maffi Tiago Garlet Pelotas,
Eficiência do Sistema de Produção de Gado de Corte
 Eficiência do Sistema de Produção de Gado de Corte Produção Carne Reprodução Melhoramento Genético Nutrição Taxa de Desfrute = Desempenho do Rebanho TD = UA abatidas/ua existentes + TCR 240 230 220 210
Eficiência do Sistema de Produção de Gado de Corte Produção Carne Reprodução Melhoramento Genético Nutrição Taxa de Desfrute = Desempenho do Rebanho TD = UA abatidas/ua existentes + TCR 240 230 220 210
Mecanismos de comunicação celular 26/05/2015
 Mecanismos de comunicação celular 26/05/2015 Alvos terapêuticos Hopkins & Groom (2002) Nature Reviews Drug Discovery 1:727 Elementos da comunicação celular LIGANTE RECEPTOR Há dois tipos de receptores
Mecanismos de comunicação celular 26/05/2015 Alvos terapêuticos Hopkins & Groom (2002) Nature Reviews Drug Discovery 1:727 Elementos da comunicação celular LIGANTE RECEPTOR Há dois tipos de receptores
BIOLOGIA. Moléculas, células e tecidos. Gametogênese Parte 2. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Parte 2 Professor: Alex Santos Tópicos em abordagem: Parte 2 Ovocitogênese: I A Ovocitogênese; II Quadro comparativo de gametogêneses; I Ovocitogênese: 1.1 Visão geral:
BIOLOGIA Moléculas, células e tecidos Parte 2 Professor: Alex Santos Tópicos em abordagem: Parte 2 Ovocitogênese: I A Ovocitogênese; II Quadro comparativo de gametogêneses; I Ovocitogênese: 1.1 Visão geral:
Universidade Federal de Minas Gerais Escola de veterinária Programa de Pós-Graduação em Ciência Animal
 Universidade Federal de Minas Gerais Escola de veterinária Programa de Pós-Graduação em Ciência Animal EFEITO DE UM MEIO CONDICIONADO POR CÉLULAS DO CUMULUS OOPHORUS DE BOVINOS NA MATURAÇÃO E NO POTENCIAL
Universidade Federal de Minas Gerais Escola de veterinária Programa de Pós-Graduação em Ciência Animal EFEITO DE UM MEIO CONDICIONADO POR CÉLULAS DO CUMULUS OOPHORUS DE BOVINOS NA MATURAÇÃO E NO POTENCIAL
BIOLOGIA. Moléculas, células e tecidos. Estrutura e fisiologia da Membrana Plasmática - Parte 1. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 1 Professor: Alex Santos Tópicos em abordagem: Estrutura e fisiologia da Membrana Plasmática - Parte 1 Parte
BIOLOGIA Moléculas, células e tecidos Estrutura e fisiologia da Membrana Plasmática - Parte 1 Professor: Alex Santos Tópicos em abordagem: Estrutura e fisiologia da Membrana Plasmática - Parte 1 Parte
FECUNDAÇÃO ESPERMATOZOIDE
 FECUNDAÇÃO Basicamente, fecundação (ou fertilização, termo usado como sinônimo), nada mais é do que o encontro dos gametas masculino e feminino (ambos haploides), e a união dos materiais genéticos desses
FECUNDAÇÃO Basicamente, fecundação (ou fertilização, termo usado como sinônimo), nada mais é do que o encontro dos gametas masculino e feminino (ambos haploides), e a união dos materiais genéticos desses
A Célula Humana. Disciplina: Anatomia e Fisiologia. Samara Cristina Ferreira Machado. Programa Nacional de Formação em Radioterapia
 Disciplina: Anatomia e Fisiologia A Célula Humana Samara Cristina Ferreira Machado Programa Nacional de Formação em Radioterapia Abordagem Celular - Estrutura Celular - Função Celular - Ciclo Celular Estrutura
Disciplina: Anatomia e Fisiologia A Célula Humana Samara Cristina Ferreira Machado Programa Nacional de Formação em Radioterapia Abordagem Celular - Estrutura Celular - Função Celular - Ciclo Celular Estrutura
Bases Genéticas da Síntese e da Diversidade dos Anticorpos
 UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Bases Genéticas da Síntese e da Diversidade dos Anticorpos Bióloga Mariana Monezi Borzi Mestre
UNIVERSIDADE ESTADUAL PAULISTA - UNESP FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV CAMPUS DE JABOTICABAL Bases Genéticas da Síntese e da Diversidade dos Anticorpos Bióloga Mariana Monezi Borzi Mestre
Divisão celular. A única situação em que dividir e multiplicar significam a mesma coisa
 Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
Criopreservação de embriões
 Laboratório de Fisiologia e Controle da Reprodução Dr. Ribrio Ivan Tavares Pereira Batista 09/10/2014 SUMÁRIO 1. INTRODUÇÃO 2. PRINCÍPIOS DA CRIOPRESERVAÇÃO 3. TÉCNICAS DE CRIOPRESERVAÇÃO DE EMBRIÕES 4.
Laboratório de Fisiologia e Controle da Reprodução Dr. Ribrio Ivan Tavares Pereira Batista 09/10/2014 SUMÁRIO 1. INTRODUÇÃO 2. PRINCÍPIOS DA CRIOPRESERVAÇÃO 3. TÉCNICAS DE CRIOPRESERVAÇÃO DE EMBRIÕES 4.
Atua como um sistema de controle e regulação (juntamente com o sistema nervoso)
 Fisiologia do Sistema Endócrino Sistema hormonal Atua como um sistema de controle e regulação (juntamente com o sistema nervoso) Os dois sistemas de controle agem de maneira integrada, garantindo a homeostasia
Fisiologia do Sistema Endócrino Sistema hormonal Atua como um sistema de controle e regulação (juntamente com o sistema nervoso) Os dois sistemas de controle agem de maneira integrada, garantindo a homeostasia
Fisiologia do Sistema Endócrino. Introdução e Conceitos Gerais. Profa. Dra. Rosângela F. Garcia
 Fisiologia do Sistema Endócrino Introdução e Conceitos Gerais Profa. Dra. Rosângela F. Garcia SISTEMA ENDÓCRINO 1- INTRODUÇÃO SISTEMA DE CONTROLE HOMEOSTASE MENSAGEIROS HORMÔNIOS *não formam um sistema
Fisiologia do Sistema Endócrino Introdução e Conceitos Gerais Profa. Dra. Rosângela F. Garcia SISTEMA ENDÓCRINO 1- INTRODUÇÃO SISTEMA DE CONTROLE HOMEOSTASE MENSAGEIROS HORMÔNIOS *não formam um sistema
MANUAL DE INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO
 MANUAL DE INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO INTRODUÇÃO A Inseminação Artificial em Tempo Fixo (IATF) é uma tecnologia que permite realizar a inseminação artificial em um horário preestabelecido, eliminando
MANUAL DE INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO INTRODUÇÃO A Inseminação Artificial em Tempo Fixo (IATF) é uma tecnologia que permite realizar a inseminação artificial em um horário preestabelecido, eliminando
Biologia Celular e Molecular:
 Disciplina: Biologia Celular e Molecular: Prof.Dr. Antonio Augusto L. Barboza Diferenciação Celular EUCARIONTES Célula Animal Célula Vegetal Células procariontes Pobreza de membranas (somente a membrana
Disciplina: Biologia Celular e Molecular: Prof.Dr. Antonio Augusto L. Barboza Diferenciação Celular EUCARIONTES Célula Animal Célula Vegetal Células procariontes Pobreza de membranas (somente a membrana
ANEXO A CICLO CELULAR DIVISÃO CELULAR
 ANEXO A CICLO CELULAR DIVISÃO CELULAR CICLO CELULAR DIVISÃO CELULAR 1 CICLO CELULAR: processo em que o material celular é duplicado. 2 PERÍODOS: interfase (G 1, S, G 2 ), divisão celular mitose (prófase,
ANEXO A CICLO CELULAR DIVISÃO CELULAR CICLO CELULAR DIVISÃO CELULAR 1 CICLO CELULAR: processo em que o material celular é duplicado. 2 PERÍODOS: interfase (G 1, S, G 2 ), divisão celular mitose (prófase,
Efeito de dois diferentes protocolos para congelação lenta de embriões bovinos produzidos in vitro na região da Amazônia Legal
 Efeito de dois diferentes protocolos para congelação lenta de embriões bovinos produzidos in vitro na região da Amazônia Legal Karina Almeida Maciel 1 ; Márcio Gianordoli Teixeira Gomes 2 ; Francisca Elda
Efeito de dois diferentes protocolos para congelação lenta de embriões bovinos produzidos in vitro na região da Amazônia Legal Karina Almeida Maciel 1 ; Márcio Gianordoli Teixeira Gomes 2 ; Francisca Elda
Biologia 12º ano Reprodução e manipulação da fertilidade
 Escola Básica e Secundária Prof. Reynaldo dos Santos Biologia 12º ano Reprodução e manipulação da fertilidade Teste de Avaliação Leia atentamente os textos das perguntas, observe as imagens e responda
Escola Básica e Secundária Prof. Reynaldo dos Santos Biologia 12º ano Reprodução e manipulação da fertilidade Teste de Avaliação Leia atentamente os textos das perguntas, observe as imagens e responda
Engenharia Genética; Transgênicos e OGM s
 Dogma Central da Biologia Molecular Engenharia Genética; Transgênicos e OGM s Prof. Msc. Lucas Silva de Faria Engenharia Genética Conjunto de tecnologias que permitem a manipulação (modificação) do material
Dogma Central da Biologia Molecular Engenharia Genética; Transgênicos e OGM s Prof. Msc. Lucas Silva de Faria Engenharia Genética Conjunto de tecnologias que permitem a manipulação (modificação) do material
Leia atentamente os textos e as questões que se seguem e indique a letra da opção correta no local indicado na folha de respostas no final.
 Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia e Geologia - 11º ano - Teste de Avaliação Outubro 2017 Tema 6 Biologia: DNA, Síntese de Proteínas, Ciclo celular, Mitose, Diferenciação Leia
Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia e Geologia - 11º ano - Teste de Avaliação Outubro 2017 Tema 6 Biologia: DNA, Síntese de Proteínas, Ciclo celular, Mitose, Diferenciação Leia
28/04/2010. Espermatozóides são formados e lançados no espaço do tubos. Tubos Seminíferos. Epidídimo. Testículo Células em divisão (mitose x meiose)
 GAMETOGÊNESE - -OVOGÊNESE [email protected] Tubos Seminíferos Espermatozóides são formados e lançados no espaço do tubos Epidídimo Testículo Células em divisão (mitose x meiose) 1 EPIDÍDIMO (armazena
GAMETOGÊNESE - -OVOGÊNESE [email protected] Tubos Seminíferos Espermatozóides são formados e lançados no espaço do tubos Epidídimo Testículo Células em divisão (mitose x meiose) 1 EPIDÍDIMO (armazena
Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal
 Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal Disciplina de Reprodução Humana Departamento de Ginecologia e Obstetrícia FMRP - USP Profa Dra
Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal Disciplina de Reprodução Humana Departamento de Ginecologia e Obstetrícia FMRP - USP Profa Dra
Sincronização de Estro
 Universidade Estadual do Ceará Faculdade de Veterinária SINCRONIZAÇÃO DE ESTRO E OVULAÇÃO: Princípios e técnicas Joanna Maria Gonçalves de Souza Fortaleza, 2013 Objetivo Sincronização de Estro Induzir
Universidade Estadual do Ceará Faculdade de Veterinária SINCRONIZAÇÃO DE ESTRO E OVULAÇÃO: Princípios e técnicas Joanna Maria Gonçalves de Souza Fortaleza, 2013 Objetivo Sincronização de Estro Induzir
Fertilização. Professor: Arturo Arnáez Vaella
 Fertilização Professor: Arturo Arnáez Vaella Introdução Fonte: http://biologia-no-vestibular.blogspot.com.br/2012/06/ufpb-reproducao-humana.html Introdução Para poder fertilizar o ovócito o espermatozoide
Fertilização Professor: Arturo Arnáez Vaella Introdução Fonte: http://biologia-no-vestibular.blogspot.com.br/2012/06/ufpb-reproducao-humana.html Introdução Para poder fertilizar o ovócito o espermatozoide
Regulação da Expressão Gênica em Eucariotos
 Regulação da Expressão Gênica em Eucariotos Regulação da Expressão Gênica Trajetória da expressão de um gene Principal ponto de regulação Núcleo Citoplasma mrna inativo DNA RNA transcrito mrna mrna PROTEÍNA
Regulação da Expressão Gênica em Eucariotos Regulação da Expressão Gênica Trajetória da expressão de um gene Principal ponto de regulação Núcleo Citoplasma mrna inativo DNA RNA transcrito mrna mrna PROTEÍNA
Reprodução de Búfalas
 Reprodução de Búfalas Número de bubalinos inseminados no Brasil Taxa de prenhez 1 a IA = 50% dos animais 2 a IA = + 25% dos animais Total com 2 IA = 75% Doses de sêmen vendidas ao ano 10.000 doses
Reprodução de Búfalas Número de bubalinos inseminados no Brasil Taxa de prenhez 1 a IA = 50% dos animais 2 a IA = + 25% dos animais Total com 2 IA = 75% Doses de sêmen vendidas ao ano 10.000 doses
Regulação da expressão gênica. John Wiley & Sons, Inc.
 Regulação da expressão gênica Cada célula tem todos os genes, mas em um tecido apenas parte deles está ativa REGULAÇÃO DA EXPRESSÃO GÊNICA Diferenciação celular: diferentes tipos celulares em um mesmo
Regulação da expressão gênica Cada célula tem todos os genes, mas em um tecido apenas parte deles está ativa REGULAÇÃO DA EXPRESSÃO GÊNICA Diferenciação celular: diferentes tipos celulares em um mesmo
DIVISÃO CELULAR. Multiplicação celular:
 DIVISÃO CELULAR Multiplicação celular: Para que uma célula se multiplique o genoma também precisa se multiplicar REPLICAÇÃO do DNA precede multiplicação celular DIVISÃO CELULAR MITOSE: divisão das células
DIVISÃO CELULAR Multiplicação celular: Para que uma célula se multiplique o genoma também precisa se multiplicar REPLICAÇÃO do DNA precede multiplicação celular DIVISÃO CELULAR MITOSE: divisão das células
Reprodução e Manipulação da fertilidade
 Bio12 Unidade 1 Reprodução e Manipulação da fertilidade De que modo os processos reprodutivos interferem na qualidade de vida dos seres humanos? Capítulo 1. Anatomia, gametogénese e controlo hormonal Em
Bio12 Unidade 1 Reprodução e Manipulação da fertilidade De que modo os processos reprodutivos interferem na qualidade de vida dos seres humanos? Capítulo 1. Anatomia, gametogénese e controlo hormonal Em
