Novas Regras para Rotulagem Medicamentos
|
|
|
- Ana Lívia Aquino de Sá
- 10 Há anos
- Visualizações:
Transcrição
1 XV ENCONTRO TÉCNICO E XI ENCONTRO EMPRESARIAL - ABRASP Novas Regras para Rotulagem Medicamentos RESOLUÇÃO-RDC Nº 71/2009 Carolina K. Rodrigues 21/09/2010
2 RESOLUÇÃO-RDC Nº 71/2009 DOU de 23/12/2009 Estabelece regras para a rotulagem de medicamentos Aprimorar a forma e o conteúdo dos rótulos de todos os medicamentos registrados e comercializados no Brasil, visando garantir o acesso à informação segura e adequada em prol do uso racional de medicamentos Em vigor desde: 23/12/2009 Prazo para implementação : 16/06/2011
3 RESOLUÇÃO-RDC Nº 71/2009 DOU de 23/12/2009 Algumas novidades desta nova regulamentação: Definições referente a destinação (comercial, hospitalar, institucional, profissional/empresa especializada); embalagem (transporte e envoltório intermediário); restrição (de uso, prescrição, destinação) e uso restrito a hospitais. Rastreabilidade de Medicamentos. Informações para pessoas portadoras de deficiência visual (Braile). Medicamentos com destinação institucional. Informações mínimas para as caixas de transporte.
4 RESOLUÇÃO-RDC Nº 71/2009 DOU de 23/12/2009 Ficam revogadas: - Artigos 4 e 5 da Portaria nº 802, de 8 de outubro de1998: Art. 4º - Código de barra para identificação do produto; Art. 5º - Tinta reativa. 3º As Soluções Parenterais de Grande Volume, destinadas apenas para unidades ambulatorias, hospitais ou casas de saúde, estão dispensadas da apresentação da tinta reativa, assim como os produtos dos laboratórios oficiais que não sejam destinados à comercialização no varejo. - Resolução - RDC nº 9, de 2 de janeiro de 2001; Regulamento Técnico de Soluções Parenterais de Pequeno Volume.
5 RESOLUÇÃO-RDC Nº 71/2009 DOU de 23/12/2009 Ficam revogadas: - Resolução - RDC nº 333, de 19 de novembro de - Resolução - RDC nº 333, de 19 de novembro de 2003, com exceção do item 3 do Anexo, referente à regulamentação de nomes comerciais, e do item 17 do Anexo, cuja vigência foi restabelecida pela Resolução - RDC nº 60 de 26 de novembro de 2009 durante o período de transição de 90 dias.
6 Soluções Parenterais de Grande Volume (SPGV) Solução Parenteral de Grande Volume (SPGV) solução estéril e apirogênica, destinada à aplicação parenteral em dose única, cujo volume é de 100mL ou superior. Estão incluídas nesta definição as soluções para irrigação e soluções para diálise peritoneal. Resolução - RDC Nº 17/10
7 Os requisitos para embalagens primárias das SPGV sem embalagem secundária
8 RDC nº 333/03 Modelo de rótulo em bolsa de SPGV Nome comercial nome genérico / concentração Peso ou volume Forma Farmacêutica SISTEMA FECHADO (RDC 29/07) Composição quali e quantitativa dos ativos Conteúdo eletrolítico (meq/l mmol/l) Osmolaridade Informações ao paciente, indicações, contra-indicações e precauções: vide bula Uso pediátrico ou Uso adulto Cuidados de conservação TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS Via de Administração Farmacopéia Brasileira ou Farm. Bras. ou Medicamento Farmacopêico Farmacêutico Responsável CRF nº Reg. MS com 13 dígitos Nome e endereço do detentor do registro CNPJ SAC Indústria Brasileira se nacional / Código de barras Nome do fabricante e local de fabricação EMBALAGEM HOSPITALAR VENDA SOB PRECRIÇÃO MÉDICA LOGOMARCA Código de barras: Lote: Fab.: (Mês/ Ano) Val.: (Mês/ Ano)
9 SOLUÇÃO FISIOLÓGICA cloreto de sódio a 0,9% SISTEMA FECHADO RDC nº 71/09 USO ADULTO E PEDIÁTRICO Cada 100 ml contém: cloreto de sódio mg água para injeção qsp ml sódio 154 meq/l cloreto 154 meq/l Osmolaridade (aprox.): 308 mosmol/l ph (aprox.) 5,0 USO INTRAVENOSO SOLUÇÃO ESTÉRIL E APIROGÊNICA Informações ao profissional de saúde, indicações, contra-indicações e precauções: vide bula Modelo de rótulo em bolsa de SPGV Manter a temperatura ambiente (15 C a 30 C). TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. USO RESTRITO A HOSPITAIS. VENDA SOB PRESCRIÇÃO MÉDICA. Farm.Resp. Carolina Rodrigues CRF-SP N MS X.XXXX.XXXX.XXX-X Fabricado e embalado por: Abrasp R, Alvorada, 1280 São Paulo SP - Brasil CNPJ XX.XXX.XXX/XXXX-X SAC: XX XX XX Código de barras: INDÚSTRIA BRASILEIRA Lote: Fab.: (Mês/ Ano) Val.: (Mês/ Ano)
10 RDC nº 333/03 Modelo de rótulo em frasco de SPGV Nome comercial nome genérico / concentração Peso ou volume Forma Farmacêutica SISTEMA FECHADO Composição quali e quantitativa dos ativos Conteúdo eletrolítico (meq/l mmol/l) Osmolaridade Informações ao paciente, indicações, contra-indicações e precauções: vide bula Uso pediátrico ou Uso adulto Cuidados de conservação TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS Via de Administração Farmacopéia Brasileira ou Farm. Bras. ou Medicamento Farmacopêico Farmacêutico Responsável CRF nº Reg. MS com 13 dígitos Nome e endereço do detentor do registro CNPJ SAC Indústria Brasileira se nacional / Código de barras Nome do fabricante e local de fabricação EMBALAGEM HOSPITALAR Venda sob prescrição médica LOGOMARCA Lote: Fab.: (Mês/ Ano) Val.: (Mês/ Ano)
11 SOLUÇÃO FISIOLÓGICA cloreto de sódio a 0,9% SISTEMA FECHADO RDC nº 71/09 USO ADULTO E PEDIÁTRICO Cada 100 ml contém: cloreto de sódio mg água para injeção qsp ml sódio 154 meq/l cloreto 154 meq/l Osmolaridade (aprox.): 308 mosmol/l ph (aprox.) 5,0 USO INTRAVENOSO SOLUÇÃO ESTÉRIL E APIROGÊNICA Informações ao profissional de saúde, indicações, contra-indicações e precauções: vide bula Modelo de rótulo em frasco de SPGV Manter a temperatura ambiente (15 C a 30 C). TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. Farm.Resp. Carolina Rodrigues CRF-SP N MS X.XXXX.XXXX.XXX-X Fabricado e embalado por: Abrasp R, Alvorada, 1280 São Paulo SP - Brasil CNPJ XX.XXX.XXX/XXXX-X SAC: XX XX XX Código de barras INDÚSTRIA BRASILEIRA Venda sob prescrição médica Lote: Fab.: (Mês/ Ano) Val.: (Mês/ Ano)
12 Os requisitos para embalagens primárias das SPGV sem embalagem secundária e com envoltório intermediário
13 SOLUÇÃO FISIOLÓGICA cloreto de sódio a 0,9% SISTEMA FECHADO RDC nº 71/09 USO ADULTO E PEDIÁTRICO Cada 100 ml contém: cloreto de sódio mg água para injeção qsp ml sódio 154 meq/l cloreto 154 meq/l Osmolaridade (aprox.): 308 mosmol/l ph (aprox.) 5,0 USO INTRAVENOSO SOLUÇÃO ESTÉRIL E APIROGÊNICA Informações ao profissional de saúde, indicações, contra-indicações e precauções: vide bula Modelo de rótulo em bolsa de SPGV com envoltório intermediário Apenas remover o envoltório para o uso Manter a temperatura ambiente (15 C a 30 C). TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. USO RESTRITO A HOSPITAIS. VENDA SOB PRESCRIÇÃO MÉDICA. Farm.Resp. Carolina Rodrigues CRF-SP N MS X.XXXX.XXXX.XXX-X Fabricado e embalado por: Abrasp R, Alvorada, 1280 São Paulo SP - Brasil CNPJ XX.XXX.XXX/XXXX-X SAC: XX XX XX Código de barras: INDÚSTRIA BRASILEIRA Lote: Fab.: (Mês/ Ano) Val.: (Mês/ Ano)
14 Os requisitos para embalagens primárias das SPGV sem embalagem secundária que possuem apenas um sítio de injeção
15 SOLUÇÃO FISIOLÓGICA cloreto de sódio a 0,9% SISTEMA FECHADO RDC nº 71/09 USO ADULTO E PEDIÁTRICO Cada 100 ml contém: cloreto de sódio mg água para injeção qsp ml sódio 154 meq/l cloreto 154 meq/l Osmolaridade (aprox.): 308 mosmol/l ph (aprox.) 5,0 Modelo de rótulo de SPGV apenas com um sítio de injeção USO INTRAVENOSO SOLUÇÃO ESTÉRIL E APIROGÊNICA Informações ao profissional de saúde, indicações, contra-indicações e precauções: vide bula Não é indicada a adição de outro medicamento. Manter a temperatura ambiente (15 C a 30 C). TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. USO RESTRITO A HOSPITAIS. VENDA SOB PRESCRIÇÃO MÉDICA. Farm.Resp. Carolina Rodrigues CRF-SP N MS X.XXXX.XXXX.XXX-X Fabricado e embalado por: Abrasp R, Alvorada, 1280 São Paulo SP - Brasil CNPJ XX.XXX.XXX/XXXX-X SAC: XX XX XX Código de barras: INDÚSTRIA BRASILEIRA Lote: Fab.: (Mês/ Ano) Val.: (Mês/ Ano)
16 Solução Parenteral de Pequeno Volume (SPPV) Solução Parenteral de Pequeno Volume (SPPV): Solução estéril e apirogênica, acondicionada em recipiente com capacidade inferior a 100 ml, para administração por via parenteral. Pendências desta norma: publicação de norma específica referente a padronização de cores para gravação dos dizeres. A impossibilidade de fazer constar na embalagem primária todas as informações, deve ser justificada no momento da notificação, registro ou pós-registro.
17 Solução Parenteral de Pequeno Volume O nome genérico deve corresponder a 50% do nome comercial. Marca nome genérico Concentração do(s) princípio(s) ativo(s) por unidade de medida Via de administração Nome do titular do registro ou Campo para lote e validade Restrição de venda SAC
18 Como imprimir os dados da embalagem primária das SPPV
19 Como imprimir os dados da embalagem primária das SPPV
20 Como imprimir os dados da embalagem primária das SPPV
21 Dos medicamentos com destinação institucional Embalagens primárias e secundárias "PROIBIDA VENDA AO COMÉRCIO Substituição da palavra "VENDA" por "USO (restrição de venda) Posicionamento GGMED em 02/06/2010 (Sindusfarma) Da mesma forma que para bulas, em razão das dificuldades técnicas apresentadas, este item será revisto. Deve permanecer na embalagem secundária e possivelmente será aceita a gravação ink jet, desde que este atenda as demais condições, compreensível, legível e principalmente indelével. Não deve haver diminuição do tamanho para garantir o destaque. Em estudo também a possibilidade de não determinar o local da gravação apenas que seja na face principal. Prazo de implementação: 16/06/2011
22 Rastreabilidade de Medicamentos Embalagens de medicamentos devem conter mecanismos de identificação e segurança que possibilitem o rastreamento do produto desde a fabricação até o momento da dispensação. A embalagens devem conter: Lote, data de fabricação (mês/ano) e data de validade (mês/ano). É facultativo imprimir nas embalagens primárias a data de fabricação (mês/ano). Lacre ou selo de segurança (embalagens secundárias e medicamentos disponibilizados exclusivamente em embalagem primária).
23 Rastreabilidade de Medicamentos É facultativo incluir nas embalagens secundárias de medicamentos ou, na sua ausência, nas embalagens primárias: o código de barras GTIN; tinta reativa e sob a mesma a palavra "Qualidade" e a logomarca da empresa titular do registro.* Caso elas contenham mecanismos de identificação e segurança que possibilitem o rastreamento do produto desde a fabricação até o momento da dispensação. (*) 3º Art 5º da Portaria 802/98 isentava a tinta reativa nas SPGV.
24 Informações da caixa de transporte Informações obrigatórias: Nome Comercial DCB do princípio ativo Concentração de cada princípio ativo Forma farmacêutica Titular do registro ou logomarca Cuidados de conservação Número do lote (RDC 81/08) Fabricante (RDC 81/08)
25 Informações para pessoas portadoras de deficiência visual Embalagens secundárias de medicamentos que são dispensados para o paciente devem conter em sistema Braille: o nome comercial do medicamento ou, DCB de cada princípio ativo Posicionamento GGMED em 02/06/2010 (Sindusfarma) A inserção em Braile só é possivel nas embalagens secundárias. Produtos comercializados em embalagens múltiplas não precisa dispor de Braile na embalagem secundária.
26 ALTERAÇÕES DE ROTULAGENS DE MEDICAMENTOS COM IMPLEMENTAÇÃO IMEDIATA Atualização de DCB Atualização ao Vocabulário Controlado Novo enquadramento dos medicamentos quanto à restrição de uso e prescrição Inclusão de frases de alerta Dizeres Legais: SAC, responsável técnico, razão social das empresas internacionais e nacionais Prazo: 180 dias para começar a fabricar medicamentos com os novos rótulos a partir da data da notificação, sendo este o tempo previsto para esgotamento de estoque.
27 ALTERAÇÕES DE ROTULAGENS RELACIONADAS AO PÓS-REGISTRO E RENOVAÇÃO Prazo de 180 dias: após qualquer aprovação de alteração de pósregistro e renovação que envolva adequação de informação na rotulagem. Frase "Nova Fórmula" (alterações qualitativas excipientes, mantendo o nome comercial e a mesma indicação terapêutica) por no mínimo um ano depois de aprovada a alteração.
28 INCLUSÃO DE INFORMAÇÕES NÃO PREVISTAS Será necessário: Peticionar uma alteração de rotulagem acompanhada de justificativa técnica e aguardar aprovação (DOU). Prazo: 180 dias para começarem a fabricar medicamentos com os novos rótulos a partir da data da publicação (DOU), sendo este o tempo previsto para esgotamento de estoque.
29 INCLUSÃO DE RÓTULO PARA APRESENTAÇÕES COM NOVA DESTINAÇÃO Para incluir novo rótulo para apresentação de medicamento anteriormente registrada que contemplará nova destinação, deve ser peticionada a inclusão de rotulagem. O novo rótulo poderá diferir do rótulo aprovado anteriormente apenas no que se refere às informações específicas exigidas para a nova destinação.
30 DISPOSIÇÕES FINAIS E TRANSITÓRIAS Os rótulos de medicamentos devem: adequados já registrados ser disponibilizados no mercado a partir de 16/06/2011. Informações em conformidade com as aprovadas no registro, pós-registro ou renovação dos medicamentos. ser disponibilizados no prazo de 16/06/2011. independentemente de manifestação prévia da ANVISA. As notificações de adequação das rotulagens serão verificadas durante a análise de pós-registro e renovações de registro.
31 Dúvidas?
32 Obrigada! contato:
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 21, DE 28 DE MARÇO DE 2012
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 21, DE 28 DE MARÇO DE
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 21, DE 28 DE MARÇO DE
MANUAL DE EMBALAGENS DE MEDICAMENTOS
 MANUAL DE EMBALAGENS DE MEDICAMENTOS Ministério da Saúde 1 MANUAL Medicamentos 205x180.indd 1 1/26/12 6:45 PM 2 Manual de Identidade Visual para Embalagens MANUAL Medicamentos 205x180.indd 2 sumário medicamentos
MANUAL DE EMBALAGENS DE MEDICAMENTOS Ministério da Saúde 1 MANUAL Medicamentos 205x180.indd 1 1/26/12 6:45 PM 2 Manual de Identidade Visual para Embalagens MANUAL Medicamentos 205x180.indd 2 sumário medicamentos
Diário Oficial da União Seção 1 DOU 29 de março de 2012 [Página 104-112]
![Diário Oficial da União Seção 1 DOU 29 de março de 2012 [Página 104-112] Diário Oficial da União Seção 1 DOU 29 de março de 2012 [Página 104-112]](/thumbs/39/18752589.jpg) *Este texto não substitui o publicado do Diário Oficial da União* Diário Oficial da União Seção 1 DOU 29 de março de 2012 [Página 104-112] RESOLUÇÃO - RDC Nº 21, DE 28 DE MARÇO DE 2012 Institui o Manual
*Este texto não substitui o publicado do Diário Oficial da União* Diário Oficial da União Seção 1 DOU 29 de março de 2012 [Página 104-112] RESOLUÇÃO - RDC Nº 21, DE 28 DE MARÇO DE 2012 Institui o Manual
RDC 60. Perguntas e Respostas. RDC nº 60, RDC 60 - PERGUNTAS E RESPOSTAS
 Regulamentação SOBRE AMOSTRAS GRÁTIS DE MEDICAMENTOS RDC 60 Perguntas e Respostas RDC nº 60, de 26 de NOVEmbro de 2009 1 Regulamentação SOBRE AMOSTRAS GRÁTIS RDC 60 Perguntas e Respostas RDC nº 60, de
Regulamentação SOBRE AMOSTRAS GRÁTIS DE MEDICAMENTOS RDC 60 Perguntas e Respostas RDC nº 60, de 26 de NOVEmbro de 2009 1 Regulamentação SOBRE AMOSTRAS GRÁTIS RDC 60 Perguntas e Respostas RDC nº 60, de
RDC nº 71, DE 22 DE DEZEMBRO DE 2009
 RDC nº 71, DE 22 DE DEZEMBRO DE 2009 Estabelece regras para a rotulagem de medicamentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária - Anvisa, no uso da atribuição que lhe confere
RDC nº 71, DE 22 DE DEZEMBRO DE 2009 Estabelece regras para a rotulagem de medicamentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária - Anvisa, no uso da atribuição que lhe confere
Procedimentos Simplificados para Registro de Medicamentos CLONES
 SUMED Procedimentos Simplificados para Registro de Medicamentos CLONES IV Symposium Sindusfarma IPS/FIP-Anvisa Novas Fronteiras Farmacêuticas nas ciências, tecnologia, regulamentação e sistema de qualidade
SUMED Procedimentos Simplificados para Registro de Medicamentos CLONES IV Symposium Sindusfarma IPS/FIP-Anvisa Novas Fronteiras Farmacêuticas nas ciências, tecnologia, regulamentação e sistema de qualidade
RDC Nº 71 DE 22 DE DEZEMBRO DE 2009 DOU DE 23/12/2009
 RDC Nº 71 DE 22 DE DEZEMBRO DE 2009 DOU DE 23/12/2009 Estabelece regras para a rotulagem de medicamentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária - Anvisa, no uso da atribuição
RDC Nº 71 DE 22 DE DEZEMBRO DE 2009 DOU DE 23/12/2009 Estabelece regras para a rotulagem de medicamentos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária - Anvisa, no uso da atribuição
Nº 245, quarta-feira, 23 de dezembro de 2009 1 75 ISSN 1677-7042
 Nº 245, quarta-feira, 23 de dezembro de 2009 1 75 ISSN 1677-7042 CAPÍTULO III DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS Art. 48. Fica concedido o prazo de 2 (dois) anos a contar da data de publicação desta
Nº 245, quarta-feira, 23 de dezembro de 2009 1 75 ISSN 1677-7042 CAPÍTULO III DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS Art. 48. Fica concedido o prazo de 2 (dois) anos a contar da data de publicação desta
Agência Nacional de Vigilância Sanitária ANVISA
 Agência Nacional de Vigilância Sanitária ANVISA Coordenação do Comitê Gestor da Implantação do Sistema Nacional de Controle de Medicamentos SNCM Portaria nº 176, de 10/02/2014 NOTA TÉCNICA Nº 01/2015 Considerando
Agência Nacional de Vigilância Sanitária ANVISA Coordenação do Comitê Gestor da Implantação do Sistema Nacional de Controle de Medicamentos SNCM Portaria nº 176, de 10/02/2014 NOTA TÉCNICA Nº 01/2015 Considerando
Adota a seguinte Consulta Pública e eu, Diretora-Presidente Substituta, determino a sua publicação:
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 14, de 16 de março de 2011. D.O.U de 21/03/2011 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 14, de 16 de março de 2011. D.O.U de 21/03/2011 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso
Diário Oficial da União Seção 1 DOU 11 de dezembro de 2013 [Páginas 76-77]
![Diário Oficial da União Seção 1 DOU 11 de dezembro de 2013 [Páginas 76-77] Diário Oficial da União Seção 1 DOU 11 de dezembro de 2013 [Páginas 76-77]](/thumbs/21/1240689.jpg) *Este texto não substitui o publicado do Diário Oficial da União* Diário Oficial da União Seção 1 DOU 11 de dezembro de 2013 [Páginas 76-77] RESOLUÇÃO - RDC Nº 54, DE10 DE DEZEMBRO DE 2013 Dispõe sobre
*Este texto não substitui o publicado do Diário Oficial da União* Diário Oficial da União Seção 1 DOU 11 de dezembro de 2013 [Páginas 76-77] RESOLUÇÃO - RDC Nº 54, DE10 DE DEZEMBRO DE 2013 Dispõe sobre
adota a seguinte Consulta Pública e eu, Diretor Presidente, determino a sua publicação:
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 19, de 6 de maio de 2009. D.O.U de 11/05/09 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 19, de 6 de maio de 2009. D.O.U de 11/05/09 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
RESOLUÇÃO RDC Nº 59, DE 10 DE OUTUBRO DE 2014. Dispõe sobre os nomes dos medicamentos, seus complementos e a formação de famílias de medicamentos.
 RESOLUÇÃO RDC Nº 59, DE 10 DE OUTUBRO DE 2014 Dispõe sobre os nomes dos medicamentos, seus complementos e a formação de famílias de medicamentos. A Diretoria Colegiada da Agência Nacional de Vigilância
RESOLUÇÃO RDC Nº 59, DE 10 DE OUTUBRO DE 2014 Dispõe sobre os nomes dos medicamentos, seus complementos e a formação de famílias de medicamentos. A Diretoria Colegiada da Agência Nacional de Vigilância
Ministério da Agricultura, Pecuária e Abastecimento
 Ministério da Agricultura, Pecuária e Abastecimento D.O.U. Nº 225, sexta-feira, 24 de novembro de 2006. Pág. 10 SECRETARIA DE DEFESA AGROPECUÁRIA INSTRUÇÃO NORMATIVA No- 65, DE 21 DE NOVEMBRO
Ministério da Agricultura, Pecuária e Abastecimento D.O.U. Nº 225, sexta-feira, 24 de novembro de 2006. Pág. 10 SECRETARIA DE DEFESA AGROPECUÁRIA INSTRUÇÃO NORMATIVA No- 65, DE 21 DE NOVEMBRO
Frutas e Hortaliças embaladas Aspectos Legais
 Frutas e Hortaliças embaladas Aspectos Legais A embalagem é instrumento de identificação, proteção, movimentação e exposição das frutas e hortaliças frescas. Ela identifica o produto e o seu responsável.
Frutas e Hortaliças embaladas Aspectos Legais A embalagem é instrumento de identificação, proteção, movimentação e exposição das frutas e hortaliças frescas. Ela identifica o produto e o seu responsável.
MEDICAMENTOS SIMILARES
 MEDICAMENTOS SIMILARES Fica assegurado o direito de registro de medicamentos similares a outros já registrados, desde que satisfaçam as exigências estabelecidas nesta Lei. (Art. 21 da Lei 6360/76) MEDICAMENTOS
MEDICAMENTOS SIMILARES Fica assegurado o direito de registro de medicamentos similares a outros já registrados, desde que satisfaçam as exigências estabelecidas nesta Lei. (Art. 21 da Lei 6360/76) MEDICAMENTOS
Fortaleza, 17 e 18 de junho de 2010.
 Fracionamento de medicamentos para dispensadores Parcerias: Defensoria Pública do Estado do Ceará; Agência Nacional de Vigilância Sanitária - ANVISA Conselho Regional de Farmácia - CRF- CE Sindicato do
Fracionamento de medicamentos para dispensadores Parcerias: Defensoria Pública do Estado do Ceará; Agência Nacional de Vigilância Sanitária - ANVISA Conselho Regional de Farmácia - CRF- CE Sindicato do
LACRIFILM (carmelose sódica)
 LACRIFILM (carmelose sódica) União Química Farmacêutica Nacional S.A. solução oftálmica 5 mg/ml LACRIFILM carmelose sódica Solução oftálmica estéril IDENTIFICAÇÃO DO PRODUTO FORMA FARMACÊUTICA E APRESENTAÇÕES
LACRIFILM (carmelose sódica) União Química Farmacêutica Nacional S.A. solução oftálmica 5 mg/ml LACRIFILM carmelose sódica Solução oftálmica estéril IDENTIFICAÇÃO DO PRODUTO FORMA FARMACÊUTICA E APRESENTAÇÕES
Amostra grátis de remédios: ANVISA regula a produção e dispensação
 Amostra grátis de remédios: ANVISA regula a produção e dispensação Profª Dra Roseli Calil / DEC Enfº Adilton D. Leite / SADP A ANVISA, através da RDC (RESOLUÇÃO DA DIRETORIA COLEGIADA da Agência Nacional
Amostra grátis de remédios: ANVISA regula a produção e dispensação Profª Dra Roseli Calil / DEC Enfº Adilton D. Leite / SADP A ANVISA, através da RDC (RESOLUÇÃO DA DIRETORIA COLEGIADA da Agência Nacional
Guia de Submissão Eletrônica de Texto de Bula
 Agência Nacional de Vigilância Sanitária Guia de Submissão Eletrônica de Texto de Bula Gerência-geral de Medicamentos - GGMED www.anvisa.gov.br Brasília, 13 de janeiro de 2014 Agência Nacional de Vigilância
Agência Nacional de Vigilância Sanitária Guia de Submissão Eletrônica de Texto de Bula Gerência-geral de Medicamentos - GGMED www.anvisa.gov.br Brasília, 13 de janeiro de 2014 Agência Nacional de Vigilância
adota a seguinte Consulta Pública e eu, Diretor Presidente, determino a sua publicação:
 Consulta Pública nº 34, de 28 de junho de 2011. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o inciso IV do art. 11 e o art. 35 do Regulamento
Consulta Pública nº 34, de 28 de junho de 2011. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o inciso IV do art. 11 e o art. 35 do Regulamento
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO RDC Nº 2, DE 17 DE JANEIRO DE 2012
 AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO RDC Nº 2, DE 17 DE JANEIRO DE 2012 Institui o protocolo eletrônico para emissão de Certificado de Registro de Medicamento e Certidão de Registro para
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA RESOLUÇÃO RDC Nº 2, DE 17 DE JANEIRO DE 2012 Institui o protocolo eletrônico para emissão de Certificado de Registro de Medicamento e Certidão de Registro para
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 14, DE 5 DE ABRIL DE 2011.
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 14, DE 5 DE ABRIL DE 2011.
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 14, DE 5 DE ABRIL DE 2011.
RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015
 RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015 Define os requisitos do cadastro de produtos médicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe conferem
RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015 Define os requisitos do cadastro de produtos médicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe conferem
Consulta Pública n. 72, de 14 de julho de 2010. Estabelece os critérios de aceitabilidade de nomes comerciais de medicamentos.
 Consulta Pública n. 72, de 14 de julho de 2010. Estabelece os critérios de aceitabilidade de nomes comerciais de medicamentos. Versão Consolidada n. 07, de 27 de maio de 2013. Para Audiência Pública Resolução
Consulta Pública n. 72, de 14 de julho de 2010. Estabelece os critérios de aceitabilidade de nomes comerciais de medicamentos. Versão Consolidada n. 07, de 27 de maio de 2013. Para Audiência Pública Resolução
adota a seguinte Consulta Pública e eu, Diretor Presidente, determino a sua publicação:
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 8, de 12 de março de 2009. D.O.U de 13/03/09 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 8, de 12 de março de 2009. D.O.U de 13/03/09 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
Prescrição e Dispensação de Medicamentos Genéricos e Similares Destaques da Legislação Vigente
 Prescrição e Dispensação de Medicamentos Genéricos e Similares Destaques da Legislação Vigente Brasília, 21 de outubro de 2013. Processo nº: 25351.584974/2013-59 Tema da Agenda Regulatória 2013/2014 nº:
Prescrição e Dispensação de Medicamentos Genéricos e Similares Destaques da Legislação Vigente Brasília, 21 de outubro de 2013. Processo nº: 25351.584974/2013-59 Tema da Agenda Regulatória 2013/2014 nº:
ORIENTAÇÃO SOBRE INFORMAÇÕES OBRIGATÓRIAS EM VESTIMENTAS DE PROTEÇÃO INDIVIDUAL PARA RISCO QUÍMICO COM AGROTÓXICOS
 ORIENTAÇÃO SOBRE INFORMAÇÕES OBRIGATÓRIAS EM VESTIMENTAS DE PROTEÇÃO INDIVIDUAL PARA RISCO QUÍMICO COM AGROTÓXICOS MÉTODO UTILIZADO As orientações constantes deste documento são uma compilação das exigências
ORIENTAÇÃO SOBRE INFORMAÇÕES OBRIGATÓRIAS EM VESTIMENTAS DE PROTEÇÃO INDIVIDUAL PARA RISCO QUÍMICO COM AGROTÓXICOS MÉTODO UTILIZADO As orientações constantes deste documento são uma compilação das exigências
Secretaria-Executiva da Câmara de Regulação do Mercado de Medicamentos - CMED. São Paulo 17 de março de 2015
 Secretaria-Executiva da Câmara de Regulação do Mercado de Medicamentos - CMED São Paulo 17 de março de 2015 Procedimentos para submissão de documentos à SCMED Ato legal: Comunicado nº 7, de 31 de julho
Secretaria-Executiva da Câmara de Regulação do Mercado de Medicamentos - CMED São Paulo 17 de março de 2015 Procedimentos para submissão de documentos à SCMED Ato legal: Comunicado nº 7, de 31 de julho
SALSEP cloreto de sódio Solução nasal 9 mg/ml
 SALSEP cloreto de sódio Solução nasal 9 mg/ml USO INTRANASAL USO ADULTO E PEDIÁTRICO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
SALSEP cloreto de sódio Solução nasal 9 mg/ml USO INTRANASAL USO ADULTO E PEDIÁTRICO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
Rastreabilidade de medicamentos - dentro e fora do hospital - Nilson Gonçalves Malta
 Rastreabilidade de medicamentos - dentro e fora do hospital - Nilson Gonçalves Malta Hospital Israelita Albert Einstein Abril 2015 Requisitos para rastreabilidade Códigos de barras em todos os produtos
Rastreabilidade de medicamentos - dentro e fora do hospital - Nilson Gonçalves Malta Hospital Israelita Albert Einstein Abril 2015 Requisitos para rastreabilidade Códigos de barras em todos os produtos
RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015. (DOU Seção 1, nº 164, pag. 47, 27.08.2015) (Retificação DOU Seção 1, nº 165, pag. 69, 28.08.
 RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015 (DOU Seção 1, nº 164, pag. 47, 27.08.2015) (Retificação DOU Seção 1, nº 165, pag. 69, 28.08.2015) Define os requisitos do cadastro de produtos médicos. A
RESOLUÇÃO - RDC Nº 40, DE 26 DE AGOSTO DE 2015 (DOU Seção 1, nº 164, pag. 47, 27.08.2015) (Retificação DOU Seção 1, nº 165, pag. 69, 28.08.2015) Define os requisitos do cadastro de produtos médicos. A
ANEXO I REGULAMENTO TÉCNICO ACERCA DA EMBALAGEM, ROTULAGEM E PROPAGANDA DE PRODUTOS DESTINADOS À ALIMENTAÇÃO ANIMAL
 ANEXO I REGULAMENTO TÉCNICO ACERCA DA EMBALAGEM, ROTULAGEM E PROPAGANDA DE PRODUTOS DESTINADOS À ALIMENTAÇÃO ANIMAL CAPÍTULO I DAS DISPOSIÇÕES PRELIMINARES Art. 1º Este Regulamento estabelece normas específicas
ANEXO I REGULAMENTO TÉCNICO ACERCA DA EMBALAGEM, ROTULAGEM E PROPAGANDA DE PRODUTOS DESTINADOS À ALIMENTAÇÃO ANIMAL CAPÍTULO I DAS DISPOSIÇÕES PRELIMINARES Art. 1º Este Regulamento estabelece normas específicas
Solução Glicofisiológica
 Solução Glicofisiológica Solução injetável cloreto de sódio + glicose 9 mg/ml + 50 mg/ml 1 Forma farmacêutica e apresentações: Solução injetável MODELO DE BULA Solução Glicofisiológica cloreto de sódio
Solução Glicofisiológica Solução injetável cloreto de sódio + glicose 9 mg/ml + 50 mg/ml 1 Forma farmacêutica e apresentações: Solução injetável MODELO DE BULA Solução Glicofisiológica cloreto de sódio
REGISTRO DE MEDICAMENTOS
 REGISTRO DE MEDICAMENTOS Deborah Masano Cavaloti Manira Georges Soufia 1 Como a Anvisa avalia o registro de medicamentos novos no Brasil Brasília, 20 de janeiro de 2005 No Brasil, os medicamentos são registrados
REGISTRO DE MEDICAMENTOS Deborah Masano Cavaloti Manira Georges Soufia 1 Como a Anvisa avalia o registro de medicamentos novos no Brasil Brasília, 20 de janeiro de 2005 No Brasil, os medicamentos são registrados
Rotulagem de alimentos embalados. Prof. Ismar Araújo de Moraes Departamento de fisiologia e Farmacologia da UFF Medico Veterinário S/SUBVISA-RIO
 Rotulagem de alimentos embalados Prof. Ismar Araújo de Moraes Departamento de fisiologia e Farmacologia da UFF Medico Veterinário S/SUBVISA-RIO Rotulagem É toda inscrição, legenda, imagem ou toda matéria
Rotulagem de alimentos embalados Prof. Ismar Araújo de Moraes Departamento de fisiologia e Farmacologia da UFF Medico Veterinário S/SUBVISA-RIO Rotulagem É toda inscrição, legenda, imagem ou toda matéria
Novas Medidas de Regulação do Mercado de Medicamentos Câmara de Regulação do Mercado de Medicamentos (CMED)
 Novas Medidas de Regulação do Mercado de Medicamentos Câmara de Regulação do Mercado de Medicamentos (CMED) Ministério da Saúde e Agência de Vigilância Sanitária Brasília, 27 de fevereiro Contexto Lei
Novas Medidas de Regulação do Mercado de Medicamentos Câmara de Regulação do Mercado de Medicamentos (CMED) Ministério da Saúde e Agência de Vigilância Sanitária Brasília, 27 de fevereiro Contexto Lei
ZINCOLOK ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 ZINCOLOK ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Frasco plástico gotejador contendo 10 ml de solução oftálmica estéril de sulfato de zinco e cloridrato de nafazolina APRESENTAÇÃO Solução Oftálmica Estéril
ZINCOLOK ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Frasco plástico gotejador contendo 10 ml de solução oftálmica estéril de sulfato de zinco e cloridrato de nafazolina APRESENTAÇÃO Solução Oftálmica Estéril
RASTREAMENTO DE MEDICAMENTOS
 RASTREAMENTO DE MEDICAMENTOS COORDENAÇÃO DO GRUPO DE TRABALHO PORTARIAS Nº 255/2011 E Nº 535/2011 PROPOSTA DE RESOLUÇÃO 40ª Reunião Ordinária do Conselho Consultivo Anvisa Brasília, 13 de junho de 2013
RASTREAMENTO DE MEDICAMENTOS COORDENAÇÃO DO GRUPO DE TRABALHO PORTARIAS Nº 255/2011 E Nº 535/2011 PROPOSTA DE RESOLUÇÃO 40ª Reunião Ordinária do Conselho Consultivo Anvisa Brasília, 13 de junho de 2013
Guia de Submissão Eletrônica de Rótulos
 Agência Nacional de Vigilância Sanitária Guia de Submissão Eletrônica de Rótulos Superintendência de Medicamentos e Produtos Biológicos SUMED www.anvisa.gov.br Brasília, 31 de outubro de 2014. Agência
Agência Nacional de Vigilância Sanitária Guia de Submissão Eletrônica de Rótulos Superintendência de Medicamentos e Produtos Biológicos SUMED www.anvisa.gov.br Brasília, 31 de outubro de 2014. Agência
Genéricos - Guia Básico. Autor: Cesar Roberto CRF-RJ: 7461
 Autor: Cesar Roberto CRF-RJ: 7461 Versão 3.00 2001 Introdução: Este guia visa a orientar o profissional farmacêutico sobre os genéricos, e como este deve proceder na hora de aviar uma receita nesta nova
Autor: Cesar Roberto CRF-RJ: 7461 Versão 3.00 2001 Introdução: Este guia visa a orientar o profissional farmacêutico sobre os genéricos, e como este deve proceder na hora de aviar uma receita nesta nova
JAIME CÉSAR DE MOURA OLIVEIRA
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 27, de 06 de abril de 2015 D.O.U de 08/04/2015 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 27, de 06 de abril de 2015 D.O.U de 08/04/2015 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
1.5. Dados pessoais que devem constar na receita médica. 1.6. Validade das receitas de medicamentos antimicrobianos
 Atualizado: 10 / 05 / 2013 FAQ AI 1. Controle de medicamentos antimicrobianos (antibióticos) 1.1. Informações gerais 1.2. Uso contínuo (tratamento prolongado) 1.3. Retenção da segunda via da receita médica
Atualizado: 10 / 05 / 2013 FAQ AI 1. Controle de medicamentos antimicrobianos (antibióticos) 1.1. Informações gerais 1.2. Uso contínuo (tratamento prolongado) 1.3. Retenção da segunda via da receita médica
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 343, DE 13 DE DEZEMBRO DE 2005.
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 343, DE 13 DE DEZEMBRO
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 343, DE 13 DE DEZEMBRO
Agência Nacional de Vigilância Sanitária REGISTRO DE MEDICAMENTOS
 REGISTRO DE MEDICAMENTOS GERÊNCIA GERAL DE MEDICAMENTOS - SETORES A Gerência Geral de Medicamentos está em fase de reestruturação, portanto as divisões setoriais são provisórias; Gerência de Pesquisas,
REGISTRO DE MEDICAMENTOS GERÊNCIA GERAL DE MEDICAMENTOS - SETORES A Gerência Geral de Medicamentos está em fase de reestruturação, portanto as divisões setoriais são provisórias; Gerência de Pesquisas,
RESOLUÇÃO - RDC Nº 120, DE 25 DE ABRIL DE 2002
 RESOLUÇÃO - RDC Nº 120, DE 25 DE ABRIL DE 2002 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o inciso IV do art. 11 do Regulamento da ANVISA, aprovado
RESOLUÇÃO - RDC Nº 120, DE 25 DE ABRIL DE 2002 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o inciso IV do art. 11 do Regulamento da ANVISA, aprovado
Anvisa - Alimentos - Informes Técnicos
 Página 1 de 7 English Español Institucional Anvisa Publica Serviços Áreas de Atuação Legislação Buscar Informes Técnicos Informe Técnico nº. 36, de 27 de junho de 2008 Orientações sobre a declaração da
Página 1 de 7 English Español Institucional Anvisa Publica Serviços Áreas de Atuação Legislação Buscar Informes Técnicos Informe Técnico nº. 36, de 27 de junho de 2008 Orientações sobre a declaração da
DÚVIDAS MAIS FREQUENTES NO BALCÃO DA FARMÁCIA
 DÚVIDAS MAIS FREQUENTES NO BALCÃO DA FARMÁCIA Neste módulo vamos tratar de situações que envolvem dúvidas quanto à melhor maneira de agir e as práticas permitidas ou não pela legislação, mas que, comumente,
DÚVIDAS MAIS FREQUENTES NO BALCÃO DA FARMÁCIA Neste módulo vamos tratar de situações que envolvem dúvidas quanto à melhor maneira de agir e as práticas permitidas ou não pela legislação, mas que, comumente,
RESOLUÇÃO - RDC Nº 23, DE 4 DE ABRIL DE 2012
 RESOLUÇÃO - RDC Nº 23, DE 4 DE ABRIL DE 2012 Dispõe sobre a obrigatoriedade de execução e notificação de ações de campo por detentores de registro de produtos para a saúde no Brasil. A Diretoria Colegiada
RESOLUÇÃO - RDC Nº 23, DE 4 DE ABRIL DE 2012 Dispõe sobre a obrigatoriedade de execução e notificação de ações de campo por detentores de registro de produtos para a saúde no Brasil. A Diretoria Colegiada
Rastreabilidade e Autenticidade de Medicamentos
 AUDIÊNCIA PÚBLICA CCT - SENADO FEDERAL Assunto: Instruir o PLS 521/2007 Sen. Valdir Raupp Rastreabilidade e Autenticidade de Medicamentos Consulta Pública nº 08, de 04/03/2008 DOU de 05/03/08 Histórico
AUDIÊNCIA PÚBLICA CCT - SENADO FEDERAL Assunto: Instruir o PLS 521/2007 Sen. Valdir Raupp Rastreabilidade e Autenticidade de Medicamentos Consulta Pública nº 08, de 04/03/2008 DOU de 05/03/08 Histórico
considerando a necessidade de implementar ações que venham contribuir para a melhoria da qualidade da assistência à saúde;
 Resolução - RDC nº 132, de 29 de maio de 2003 D.O.U de 02/06/2003 Dispõe sobre o registro de medicamentos específicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária no uso da atribuição
Resolução - RDC nº 132, de 29 de maio de 2003 D.O.U de 02/06/2003 Dispõe sobre o registro de medicamentos específicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária no uso da atribuição
RESOLUÇÃO - RDC Nº 132, DE 29 DE MAIO DE 2003(*) Republicada no D.O.U de 02/10/2003
 RESOLUÇÃO - RDC Nº 132, DE 29 DE MAIO DE 2003(*) Republicada no D.O.U de 02/10/2003 Dispõe sobre o registro de medicamentos específicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária,
RESOLUÇÃO - RDC Nº 132, DE 29 DE MAIO DE 2003(*) Republicada no D.O.U de 02/10/2003 Dispõe sobre o registro de medicamentos específicos. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária,
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 16, DE 21 DE MARÇO DE 2012
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 16, DE 21 DE MARÇO DE 2012
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 16, DE 21 DE MARÇO DE 2012
Semana da Alimentação: CEAGESP Rotulagem e Segurança Alimentar Auditório Nélson Loda 25 de outubro de 2012 14 horas
 Semana da Alimentação: CEAGESP Rotulagem e Segurança Alimentar Auditório Nélson Loda 25 de outubro de 2012 14 horas Subgerência de Alimentos Martha Virgínia Gewehr Machado Maria Cristina Junqueira de Castro
Semana da Alimentação: CEAGESP Rotulagem e Segurança Alimentar Auditório Nélson Loda 25 de outubro de 2012 14 horas Subgerência de Alimentos Martha Virgínia Gewehr Machado Maria Cristina Junqueira de Castro
Regulamentação de Bulas de Medicamentos no Brasil RDC n 47/2009n
 Regulamentação de Bulas de Medicamentos no Brasil RDC n 47/2009n Janeiro de 2011 Motivação para a nova regra para as bulas Necessidade de definir novo marco regulatório para: traçar regra única para as
Regulamentação de Bulas de Medicamentos no Brasil RDC n 47/2009n Janeiro de 2011 Motivação para a nova regra para as bulas Necessidade de definir novo marco regulatório para: traçar regra única para as
AQUECEDORES DE ÁGUA A GÁS, DOS TIPOS INSTANTÂNEOS E DE ACUMULAÇÃO. Portarias Inmetro nº 119/2007, 67/2008, 182/2012 e 390/2013 Códigos 3379 e 3380
 MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR - MDIC INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA- INMETRO Diretoria da Qualidade Dqual Divisão de Fiscalização e Verificação
MINISTÉRIO DO DESENVOLVIMENTO, INDÚSTRIA E COMÉRCIO EXTERIOR - MDIC INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA- INMETRO Diretoria da Qualidade Dqual Divisão de Fiscalização e Verificação
LASTACAFT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 LASTACAFT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril Alcaftadina (0,25%) BULA PARA O PACIENTE Bula para o Paciente - CCDS 2.0 Nov2014 Pág. 1 de 6 APRESENTAÇÃO Solução Oftálmica Estéril
LASTACAFT ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril Alcaftadina (0,25%) BULA PARA O PACIENTE Bula para o Paciente - CCDS 2.0 Nov2014 Pág. 1 de 6 APRESENTAÇÃO Solução Oftálmica Estéril
SINUSTRAT cloreto de sódio 9 mg/ml
 SINUSTRAT cloreto de sódio 9 mg/ml AVERT LABORATÓRIOS LTDA. SOLUÇAO NASAL Avert Sinustrat (Paciente) 11/2013 1 MODELO DE BULA DO PACIENTE SINUSTRAT cloreto de sódio IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES:
SINUSTRAT cloreto de sódio 9 mg/ml AVERT LABORATÓRIOS LTDA. SOLUÇAO NASAL Avert Sinustrat (Paciente) 11/2013 1 MODELO DE BULA DO PACIENTE SINUSTRAT cloreto de sódio IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES:
Rastreabilidade e Autenticidade de. Ricardo Yugue
 Rastreabilidade e Autenticidade de Medicamentos Ricardo Yugue O Conceito de Rastreabilidade Rastreabilidade éa capacidade de recuperação do histórico, da aplicação ou da localização de uma entidade (ou
Rastreabilidade e Autenticidade de Medicamentos Ricardo Yugue O Conceito de Rastreabilidade Rastreabilidade éa capacidade de recuperação do histórico, da aplicação ou da localização de uma entidade (ou
CIRCULAR SUSEP N o 265, de 16 de agosto de 2004.
 CIRCULAR SUSEP N o 265, de 16 de agosto de 2004. Disciplina os procedimentos relativos à adoção, pelas sociedades seguradoras, das condições contratuais e das respectivas disposições tarifárias e notas
CIRCULAR SUSEP N o 265, de 16 de agosto de 2004. Disciplina os procedimentos relativos à adoção, pelas sociedades seguradoras, das condições contratuais e das respectivas disposições tarifárias e notas
colas. Qualidade e segurança
 Curso Tecnologia Pós-Colheita P e Processamento Mínimo M de Produtos Hortofrutícolas colas. Qualidade e segurança Legislação respeitante à produção e comercialização de produtos minimamente processados
Curso Tecnologia Pós-Colheita P e Processamento Mínimo M de Produtos Hortofrutícolas colas. Qualidade e segurança Legislação respeitante à produção e comercialização de produtos minimamente processados
Informe Técnico n. 67, de 1º de setembro de 2015.
 Informe Técnico n. 67, de 1º de setembro de 2015. Assunto: Orientações sobre os procedimentos para solicitação de alterações na lista de alimentos alergênicos. I. Introdução. A Resolução de Diretoria Colegiada
Informe Técnico n. 67, de 1º de setembro de 2015. Assunto: Orientações sobre os procedimentos para solicitação de alterações na lista de alimentos alergênicos. I. Introdução. A Resolução de Diretoria Colegiada
Em Distribuidora de Medicamentos, Correlatos, Cosméticos e Saneantes Domissanitários.
 Em Distribuidora de Medicamentos, Correlatos, Cosméticos e Saneantes Domissanitários. Nº PROCESSO REQUERIMENTO RAZÃO SOCIAL IDENTIFICAÇÃO DO ESTABELECIMENTO NOME DE FANTASIA NÚMERO DO CNPJ NÚMERO ÚLTIMO
Em Distribuidora de Medicamentos, Correlatos, Cosméticos e Saneantes Domissanitários. Nº PROCESSO REQUERIMENTO RAZÃO SOCIAL IDENTIFICAÇÃO DO ESTABELECIMENTO NOME DE FANTASIA NÚMERO DO CNPJ NÚMERO ÚLTIMO
DECRETO Nº 4.074, DE 04 DE JANEIRO DE 2002:
 Circular nº 006/2.002 São Paulo, 09 de Janeiro de 2.002 DECRETO Nº 4.074, DE 04 DE JANEIRO DE 2002: REGULAMENTA A LEI Nº 7.802, DE 11 DE JULHO DE 1989, QUE DISPÕE SOBRE A PESQUISA, A EXPERIMENTAÇÃO, A
Circular nº 006/2.002 São Paulo, 09 de Janeiro de 2.002 DECRETO Nº 4.074, DE 04 DE JANEIRO DE 2002: REGULAMENTA A LEI Nº 7.802, DE 11 DE JULHO DE 1989, QUE DISPÕE SOBRE A PESQUISA, A EXPERIMENTAÇÃO, A
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
 REFRESH ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril sem conservante álcool polivinílico 1,4% povidona 0,6% BULA PARA O PACIENTE APRESENTAÇÃO Solução Oftálmica Estéril Lubrificante, sem
REFRESH ALLERGAN PRODUTOS FARMACÊUTICOS LTDA Solução Oftálmica Estéril sem conservante álcool polivinílico 1,4% povidona 0,6% BULA PARA O PACIENTE APRESENTAÇÃO Solução Oftálmica Estéril Lubrificante, sem
2. Conforme exigido no Anexo II, item 1.4 do edital os produtos devem atender às Normas Regulamentadoras do Ministério do Trabalho e emprego.
 Ilmo. Sr. Dr. Pregoeiro SESI/BA Pregão Eletrônico 20/2012 Objeto: Razões de Recurso IMUNOSUL DISTRIBUIDORA DE VACINAS E PRODUTOS MÉDICOS HOSPITALARES LTDA, já qualificada, em face do Pregão Presencial
Ilmo. Sr. Dr. Pregoeiro SESI/BA Pregão Eletrônico 20/2012 Objeto: Razões de Recurso IMUNOSUL DISTRIBUIDORA DE VACINAS E PRODUTOS MÉDICOS HOSPITALARES LTDA, já qualificada, em face do Pregão Presencial
Consulta Pública nº 21/2013. Recolhimento de. Suzany Portal S. Moraes Gerência Geral de Alimentos. Brasília, 3 de abril de 2014.
 Consulta Pública nº 21/2013 Recolhimento de Suzany Portal S. Moraes Gerência Geral de Alimentos Brasília, 3 de abril de 2014. Consulta Pública nº. 21/2013 Prazo para envio das contribuições: encerrado
Consulta Pública nº 21/2013 Recolhimento de Suzany Portal S. Moraes Gerência Geral de Alimentos Brasília, 3 de abril de 2014. Consulta Pública nº. 21/2013 Prazo para envio das contribuições: encerrado
MODELO DE BULA. USO ADULTO E PEDIÁTRICO (crianças acima de dois anos de idade)
 MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
RESOLUÇÃO - RDC Nº 55, DE 10 DE NOVEMBRO DE 2009
 DOU Nº 217, de 13/11/2009 Seção 1 RESOLUÇÃO - RDC Nº 55, DE 10 DE NOVEMBRO DE 2009 Dispõe sobre Regulamento Técnico para Produtos Saneantes Categorizados como Água Sanitária e Alvejantes à Base de Hipoclorito
DOU Nº 217, de 13/11/2009 Seção 1 RESOLUÇÃO - RDC Nº 55, DE 10 DE NOVEMBRO DE 2009 Dispõe sobre Regulamento Técnico para Produtos Saneantes Categorizados como Água Sanitária e Alvejantes à Base de Hipoclorito
Ministério da Saúde Agência Nacional de Vigilância Sanitária INSTRUÇÃO NORMATIVA Nº 6, DE 18 DE AGOSTO DE 2014
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária INSTRUÇÃO NORMATIVA Nº 6, DE 18 DE AGOSTO DE 2014 Dispõe sobre a
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária INSTRUÇÃO NORMATIVA Nº 6, DE 18 DE AGOSTO DE 2014 Dispõe sobre a
MANUAL DE BOAS PRÁTICAS DE RECEPÇÃO DE PRODUTOS PARA A SAÚDE DE USO CIRÚRGICO EM CENTRO DE MATERIAIS
 1 MANUAL DE BOAS PRÁTICAS DE RECEPÇÃO DE PRODUTOS PARA A SAÚDE DE USO CIRÚRGICO EM CENTRO DE MATERIAIS 2 Apresentação Menos de dez meses depois de ter sido criada pela Associação Médica Brasileira, a Câmara
1 MANUAL DE BOAS PRÁTICAS DE RECEPÇÃO DE PRODUTOS PARA A SAÚDE DE USO CIRÚRGICO EM CENTRO DE MATERIAIS 2 Apresentação Menos de dez meses depois de ter sido criada pela Associação Médica Brasileira, a Câmara
Art. 3º As empresas produtoras ficam obrigadas a informar, em cada unidade produzida para a venda final:
 Portaria n.º 802, de 08 de outubro de 1998(*) D.O. 7/4/1999 O Secretário de Vigilância Sanitária do Ministério da Saúde no uso das atribuições que lhe são conferidas pelos dispositivos legais vigentes:
Portaria n.º 802, de 08 de outubro de 1998(*) D.O. 7/4/1999 O Secretário de Vigilância Sanitária do Ministério da Saúde no uso das atribuições que lhe são conferidas pelos dispositivos legais vigentes:
SECRETARÍA DEL MERCOSUR RESOLUCIÓN GMC Nº 26/01 ARTÍCULO 10 FE DE ERRATAS ORIGINAL
 MERCOSUL/GMC/RES. N 56/02 SECRETARÍA DEL MERCOSUR DIRETRIZES PARA ELABORAÇÃO E REVISÃO DE REGULAMENTOS TÉCNICOS MERCOSUL E PROCEDIMENTOS MERCOSUL DE AVALIAÇÃO DA CONFORMIDADE (REVOGAÇÃO DAS RES. GMC N
MERCOSUL/GMC/RES. N 56/02 SECRETARÍA DEL MERCOSUR DIRETRIZES PARA ELABORAÇÃO E REVISÃO DE REGULAMENTOS TÉCNICOS MERCOSUL E PROCEDIMENTOS MERCOSUL DE AVALIAÇÃO DA CONFORMIDADE (REVOGAÇÃO DAS RES. GMC N
PROJETO DE LEI DO SENADO Nº 276, DE 2015
 PROJETO DE LEI DO SENADO Nº 276, DE 2015 Altera a Lei nº 11.903, de 14 de janeiro de 2009, para aumentar os prazos de implantação do Sistema Nacional de Controle de Medicamentos. O CONGRESSO NACIONAL decreta:
PROJETO DE LEI DO SENADO Nº 276, DE 2015 Altera a Lei nº 11.903, de 14 de janeiro de 2009, para aumentar os prazos de implantação do Sistema Nacional de Controle de Medicamentos. O CONGRESSO NACIONAL decreta:
CONTRATAÇÃO DE SERVIÇOS DE TERCEIRIZAÇÃO PARA PRODUTOS FARMACÊUTICOS NO ÂMBITO DO MERCOSUL
 MERCOSUL/GMC/RES. Nº 50/02 CONTRATAÇÃO DE SERVIÇOS DE TERCEIRIZAÇÃO PARA PRODUTOS FARMACÊUTICOS NO ÂMBITO DO MERCOSUL TENDO EM VISTA: O Tratado de Assunção, o Protocolo de Ouro Preto, as Resoluções Nº
MERCOSUL/GMC/RES. Nº 50/02 CONTRATAÇÃO DE SERVIÇOS DE TERCEIRIZAÇÃO PARA PRODUTOS FARMACÊUTICOS NO ÂMBITO DO MERCOSUL TENDO EM VISTA: O Tratado de Assunção, o Protocolo de Ouro Preto, as Resoluções Nº
MEDICAMENTOS. CAPACITAÇÃO EM FARMACOLOGIA PARA AS EQUIPES DE SAÚDE BUCAL Auxiliares e Técnicos em Saúde Bucal 2015
 MEDICAMENTOS CAPACITAÇÃO EM FARMACOLOGIA PARA AS EQUIPES DE SAÚDE BUCAL Auxiliares e Técnicos em Saúde Bucal 2015 Parceria: Farmácia Escola da UFRGS - Programa Farmácia Popular Programa de Pós-Graduação
MEDICAMENTOS CAPACITAÇÃO EM FARMACOLOGIA PARA AS EQUIPES DE SAÚDE BUCAL Auxiliares e Técnicos em Saúde Bucal 2015 Parceria: Farmácia Escola da UFRGS - Programa Farmácia Popular Programa de Pós-Graduação
adota a seguinte Consulta Pública e eu, Diretor-Presidente Substituto, determino a sua publicação:
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 48, de 13 de julho de 2012. D.O.U de 23/07/12 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública nº 48, de 13 de julho de 2012. D.O.U de 23/07/12 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
b) preparado contendo laranja (fruta) e banana (fruta) corresponde a um ingrediente característico;
 MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO GABINETE DO MINISTRO INSTRUÇÃO NORMATIVA Nº 17, DE 19 DE JUNHO DE 2013 O MINISTRO DE ESTADO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, no uso da atribuição
MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO GABINETE DO MINISTRO INSTRUÇÃO NORMATIVA Nº 17, DE 19 DE JUNHO DE 2013 O MINISTRO DE ESTADO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, no uso da atribuição
CLORETO DE SÓDIO 0,9%
 FORMA FARMACÊUTICA E APRESENTAÇÕES: Solução injetável. SISTEMA FECHADO Solução de cloreto de sódio 0,9% (cloreto de sódio 9 mg/ml): Frascos de plástico transparente com 50 ml, 100 ml, 250 ml, 500 ml e
FORMA FARMACÊUTICA E APRESENTAÇÕES: Solução injetável. SISTEMA FECHADO Solução de cloreto de sódio 0,9% (cloreto de sódio 9 mg/ml): Frascos de plástico transparente com 50 ml, 100 ml, 250 ml, 500 ml e
QUADRO PADRONIZADO PARA APRESENTAÇÃO DE SUGESTÕES E COMENTÁRIOS
 QUADRO PADRONIZADO PARA APRESENTAÇÃO DE SUGESTÕES E COMENTÁRIOS Remetente: Signatário: CIRCULAR PROPOSTA SUGESTÃO DE ALTERAÇÃO JUSTIFICATIVA OU COMENTÁRIO CIRCULAR SUSEP N.º de 2004., de Disciplina os
QUADRO PADRONIZADO PARA APRESENTAÇÃO DE SUGESTÕES E COMENTÁRIOS Remetente: Signatário: CIRCULAR PROPOSTA SUGESTÃO DE ALTERAÇÃO JUSTIFICATIVA OU COMENTÁRIO CIRCULAR SUSEP N.º de 2004., de Disciplina os
RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 80, DE 11 DE MAIO DE 2006.
 RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 80, DE 11 DE MAIO DE 2006. Diretor-Presidente da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o inciso IV do art. 13 do Regulamento
RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 80, DE 11 DE MAIO DE 2006. Diretor-Presidente da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o inciso IV do art. 13 do Regulamento
RESOLUÇÃO N 24, DE 08 DE JUNHO DE 2015
 RESOLUÇÃO N 24, DE 08 DE JUNHO DE 2015 Dispõe sobre recolhimento de alimentos e sua comunicação à Anvisa e aos consumidores. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
RESOLUÇÃO N 24, DE 08 DE JUNHO DE 2015 Dispõe sobre recolhimento de alimentos e sua comunicação à Anvisa e aos consumidores. A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RDC N 24, DE 8 DE JUNHO DE 2015
 AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RDC N 24, DE 8 DE JUNHO DE 2015 Dispõe sobre o recolhimento de alimentos e sua comunicação à Anvisa e aos consumidores. A Diretoria Colegiada
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RDC N 24, DE 8 DE JUNHO DE 2015 Dispõe sobre o recolhimento de alimentos e sua comunicação à Anvisa e aos consumidores. A Diretoria Colegiada
REFERÊNCIA SIM SIM NÃO. Inovando para o seu bem-estar.
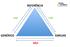 REFERÊNCIA SIM SIM GENÉRICO SIMILAR NÃO SIM SIM NÃO RDC 58 de 13/10/14 Intercambialidade entre medicamento similar e referência O que muda? A intercambialidade entre o similar e o referência já pode ser
REFERÊNCIA SIM SIM GENÉRICO SIMILAR NÃO SIM SIM NÃO RDC 58 de 13/10/14 Intercambialidade entre medicamento similar e referência O que muda? A intercambialidade entre o similar e o referência já pode ser
ROTULAGEM DE PRODUTOS COSMÉTICOS
 Gerência Geral de Cosméticos ROTULAGEM DE PRODUTOS COSMÉTICOS NORMAS DE ROTULAGEM REFERÊNCIAS LEGAIS DECRETO 79.094/77 (Art. 4º e 93-111) DECRETO 83.239/79 (Altera os Art. 17, 93, 94 e 96 do Decreto 79.094/77)
Gerência Geral de Cosméticos ROTULAGEM DE PRODUTOS COSMÉTICOS NORMAS DE ROTULAGEM REFERÊNCIAS LEGAIS DECRETO 79.094/77 (Art. 4º e 93-111) DECRETO 83.239/79 (Altera os Art. 17, 93, 94 e 96 do Decreto 79.094/77)
TETMOSOL Sabonete sulfiram. Sabonete com 4 g de sulfiram em embalagem contendo 1 sabonete de 80 g.
 TETMOSOL Sabonete sulfiram I) IDENTIFICAÇÃO DO MEDICAMENTO TETMOSOL Sabonete sulfiram APRESENTAÇÕES Sabonete com 4 g de sulfiram em embalagem contendo 1 sabonete de 80 g. USO TÓPICO USO ADULTO E PEDIÁTRICO
TETMOSOL Sabonete sulfiram I) IDENTIFICAÇÃO DO MEDICAMENTO TETMOSOL Sabonete sulfiram APRESENTAÇÕES Sabonete com 4 g de sulfiram em embalagem contendo 1 sabonete de 80 g. USO TÓPICO USO ADULTO E PEDIÁTRICO
O consumidor deve estar atento às informações do rótulo?
 Os consumidores têm o direito de conhecer as características e a composição nutricional dos alimentos que adquirem. A legislação nacional estabelece algumas normas para registro dessas informações na rotulagem
Os consumidores têm o direito de conhecer as características e a composição nutricional dos alimentos que adquirem. A legislação nacional estabelece algumas normas para registro dessas informações na rotulagem
Medicamento O que é? Para que serve?
 Medicamento O que é? Para que serve? Os Medicamentos são produtos farmacêuticos, tecnicamente obtidos ou elaborados, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico (Lei nº
Medicamento O que é? Para que serve? Os Medicamentos são produtos farmacêuticos, tecnicamente obtidos ou elaborados, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico (Lei nº
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 45, DE 19 DE SETEMBRO DE 2011. (Alterada pela Resolução RDC n 48, de 25 de setembro de 2014.
 1 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 45, DE 19 DE SETEMBRO DE 2011. (Alterada pela Resolução RDC n 48, de 25 de setembro de 2014.) D.O.U. de 22/09/2011 Dispõe sobre o regulamento técnico para fórmulas
1 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC Nº 45, DE 19 DE SETEMBRO DE 2011. (Alterada pela Resolução RDC n 48, de 25 de setembro de 2014.) D.O.U. de 22/09/2011 Dispõe sobre o regulamento técnico para fórmulas
Resolução DC/ANVISA nº 45, de 19.09.2011 - DOU de 21.09.2011
 Resolução DC/ANVISA nº 45, de 19.09.2011 - DOU de 21.09.2011 Dispõe sobre o regulamento técnico para fórmulas infantis para lactentes destinadas a necessidades dietoterápicas específicas e fórmulas infantis
Resolução DC/ANVISA nº 45, de 19.09.2011 - DOU de 21.09.2011 Dispõe sobre o regulamento técnico para fórmulas infantis para lactentes destinadas a necessidades dietoterápicas específicas e fórmulas infantis
RESOLUÇÃO - RDC Nº. 176, DE 21 DE SETEMBRO DE 2006.
 RESOLUÇÃO - RDC Nº. 176, DE 21 DE SETEMBRO DE 2006. Aprova o Regulamento Técnico Contratação de Terceirização para Produtos de Higiene Pessoal, Cosméticos e Perfumes. A Diretoria Colegiada da Agência Nacional
RESOLUÇÃO - RDC Nº. 176, DE 21 DE SETEMBRO DE 2006. Aprova o Regulamento Técnico Contratação de Terceirização para Produtos de Higiene Pessoal, Cosméticos e Perfumes. A Diretoria Colegiada da Agência Nacional
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 6, DE 30 DE JANEIRO DE 2012
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 6, DE 30 DE JANEIRO DE
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC N 6, DE 30 DE JANEIRO DE
Os 1 Item(ns) da lista de documentos que não foram cumprido(s):
 Agência Nacional de Vigilância Sanitária Unidade de Atendimento e Protocolo - UNIAP Listagem de Encaminhamento de Documentação em Caráter Precário Data: 14.11.05 EMPRESA: ANCHIETA INDÚSTRIA E COMÉRCIO
Agência Nacional de Vigilância Sanitária Unidade de Atendimento e Protocolo - UNIAP Listagem de Encaminhamento de Documentação em Caráter Precário Data: 14.11.05 EMPRESA: ANCHIETA INDÚSTRIA E COMÉRCIO
Agência Nacional de Vigilância Sanitária. www.anvisa.gov.br. Consulta Pública n 18, de 10 de março de 2015 D.O.U de 11/03/2015
 Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 18, de 10 de março de 2015 D.O.U de 11/03/2015 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
Agência Nacional de Vigilância Sanitária www.anvisa.gov.br Consulta Pública n 18, de 10 de março de 2015 D.O.U de 11/03/2015 A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das
