Governador do Estado do Tocantins. Secretária de Estado da Saúde. Diretora de Vigilância e Proteção à Saúde
|
|
|
- Maria dos Santos Vilarinho Angelim
- 8 Há anos
- Visualizações:
Transcrição
1
2 Governador do Estado do Tocantins Secretária de Estado da Saúde Diretora de Vigilância e Proteção à Saúde MÁRCIA CRISTINA ALVES BRITO SAYÃO LOBATO Coordenadora do LACEN-TO
3 Agradecimento Especial A todos os servidores do LACEN pela colaboração na ocasião de coleta das informações contidas neste anua.
4 SUMÁRIO 1-APRESENTAÇÃO RELAÇÃO DE EXAMES PRAZO DE ENTREGA COLETA Recepção de Paciente Amostra Coleta de Amostra Cuidados Preliminares Condições para a coleta: Ordem de Coleta Equipamentos de Proteção Individual EPI Equipamentos de Proteção Coletiva EPC Lavagem das Mãos Limpeza da Bancada de Trabalho REQUISIÇÕES, FICHAS DE NOTIFICAÇÃO E FORMULÁRIOS PARA AUTORIZAÇÃO DE PROCEDIMENTOS DE ALTO CUSTO (BPA I) Requisição de Fichas de Notificação Coleta de Sangue Condições do paciente Procedimentos anteriores à coleta Posicionamento do Braço Garroteamento Seleção da Região de Punção Assepsia PREPARO DO SISTEMA DE COLETA À VACUO Punção Venosa DESCARTE DE MATERIAIS
5 6.1- Preparo da Amostra Preparo dos tubos Centrifugação / Separação do Soro ou Plasma Identificação da Amostra Acondicionamento Para Transporte Para Transporte de Curta distância Para transporte de longa distância Condições de transporte nas ambulâncias: EXAMES REALIZADOS NO LACEN HIV CD4/CD Carga Viral do HIV Genotipagem para HIV CHAGAS DENGUE - SOROLOGIA DENGUE - Isolamento Viral - Cultura de Células ou Isolamento do Vírus DENGUE em Caso de Óbito : DENGUE Amostra de Tecidos- PCR ou Isolamento Viral DENGUE - Isolamento Viral em caso de óbito DENGUE - Sorologia em caso de óbito ESQUISTOSSOMOSE MANSÔNIA FEBRE AMARELA Febre Amarela - Caso de Óbito: Febre Amarela - Cultura de células ou isolamento de vírus FEBRE AMARELA - Isolamento Viral em caso de óbito Febre Amarela - Sorologia em caso de óbito
6 7.6 - FEBRE MACULOSA HEPATITES VIRAIS (A,B,C) Quantificação do RNA do vírus da Hepatite C (HCV-RNA), Quantificação do dna do vírus da Hepatite B (HBV-DNA) ou Carga Viral do HBV e Genotipagem do vírus da Hepatite C (Genotipagem HCV) INFLUENZA LEISHMANIOSES Leishmaniose Visceral Canina Leishmaniose Visceral Humana LEPTOSPIROSE MENINGITES Instruções para uso do KIT Hemocultura ROTAVIRUS RUBÉOLA E SARAMPO Rubéola e Sarampo - Isolamento viral TUBERCULOSE- Baciloscopia, Cultura e Teste de Sensibilidade Coleta Recomendada pelo Ministério da Saúde: ENTEROINFECÇÕES Coprocultura Geral Protocolo Para Coleta de Espécimes Fecais Para Análise de Vibrio Cholerae Colera Coleta de Amostras Para Investigação de Indivíduos Assintomáticos Provenientes de Áreas Com Circulação de Vibrio Cholerae COLINESTERASE SÍFILIS EXAMES MICOLOGICOS Procedimentos para Coleta Recomendações Gerais para Coleta e Transporte de Amostra
7 Transporte de Amostras Coletado ao LACEN COQUELUCHE Coleta de Secreção Nasofaringe para Coqueluche Transporte de Amostra Coletado ao LACEN AMOSTRAS EMCAMINHADAS PARA REFERÊNCIAS CONTROLE DE QUALIDADE Formas de Conservação Envio de Lâminas EXAMES PARA CONTROLE DE QUALIDADE Hanseníase Leishmaniose Tegumentar Malária e Chagas Tuberculose Meningites RECOMENDAÇÕES IMPORTANTES ROTEIRO E AVALIAÇÃO DO CONTROLE DE QUALIDADE CRITÉRIOS PARA PARTICIPAÇÃO CRITÉRIOS PARA AVALIAÇÃO BENEFÍCIOS...77 ANEXOS REFERÊNCIAS BIBLIOGRÁFICAS
8 1 - APRESENTAÇÃO Este Manual tem por finalidade sistematizar as orientações para coleta, preparo e transporte de amostras biológicas, se adequando às exigências do Programa de Qualidade e as Normas de Biossegurança nos Serviços de Saúde, bem como atender ao princípio do SUS de divulgação de informações quanto ao potencial dos serviços de saúde e a sua utilização pelo usuário (Lei 8080(0/90, cap. 2 inciso VI). Para que o laboratório possa oferecer resultados confiáveis, não basta que as técnicas sejam executadas de forma correta, é necessário que se receba uma boa amostra e entende-se como boa amostra aquela obtida em quantidade suficiente, em recipiente adequado, bem identificado e corretamente transportado. Se as orientações aqui apresentadas forem bem observadas, as circunstâncias para as análises serão mais favoráveis, e tal iniciativa deverá criar procedimentos básicos comuns, para que os usuários possam ter confiança, de que receberão atendimento semelhante independentemente do local em que sejam atendidos. Com a participação incansável dos nossos profissionais e o desejo de apresentar um trabalho de qualidade, que possa direcionar os trabalhos dos nossos usuários, que são os profissionais que atuam na Rede Estadual de Laboratórios Públicos e Privados conveniados ao SUS, e minorar as dificuldades quanto a qualidade das amostras que são encaminhadas ao LACEN, é que nos deu a determinação para realizar este Manual de Coleta e Transporte de Amostras Biológicas. Dessa maneira, temos o prazer de encaminhar o presente Manual, para que todos tenham o conhecimento dos procedimentos que o LACEN utiliza, podendo, antecipadamente, ajustar sua instituição aos critérios preconizados por estes. Portanto, este Manual deve ser consultado freqüentemente por todos os usuários Sistema de Vigilância em Saúde, que fazem uso dos serviços de diagnóstico laboratorial do LACEN - TO. Direção do LACEN-TO 8
9 2 - RELAÇÃO DE EXAMES PRAZO DE ENTREGA Exames Prazo de Entrega Exames Prazo de Entrega Anti-HAV IgM Elisa 10 dias úteis VDRL 10 dias úteis Anti-HBc total Elisa 10 dias úteis HIV Imunoblot Rápido 10 dias úteis Anti-HBc total Eletroquimioluminescência 10 dias úteis HIV EIA 1-Elisa Teste Rápido 07 dias úteis Anti-HBc IgM Elisa 10 dias úteis HIV CD4/CD8 15 dias úteis Anti-HBs Eletroquimioluminescência 10 dias úteis HIV Carga Viral 15 dias úteis HBsAg Elisa 10 dias úteis Influenza - IFI 07 dias úteis HBsAg Eletroquimioluminescência 10 dias úteis Leishmaniose Canina Elisa 15 dias úteis Anti-HCV Elisa 10 dias úteis Leishmaniose Canina DPP 10 dias úteis Anti-HCV Leishmaniose Humana Teste 10 dias úteis Eletroquimioluminescência Rápido (Urgência) 01 dia útil Micologia-Cultura 30 dias úteis Leishmaniose Humana-IFI 04 dias úteis Chagas Elisa 07 dias úteis Leptospirose Elisa 05 dias úteis Chagas HAI 07 dias úteis Meningite Cultura de líquor 10 dias corridos Chagas IFI 07 dias úteis Meningite Cultura de Liquor 10 dias corridos Colinesterase 07 dias úteis Meningite Hemocultura 10 dias corridos Cultura de Fungos 30 dias corridos Meningite Látex 03 dias corridos Coqueluche 10 dias úteis Rede RM (Identificação e TSA- Resistência 10 dias corridos Dengue IgM Elisa 05 dias úteis Rubéola IgM Elisa 07 dias úteis Dengue IgM Mac Elisa 07 dias úteis Rubéola IgG Elisa 07 dias úteis Dengue Isolamento viral 30 dias corridos Rotavírus - Elisa 07 dias úteis Esquistossomose Kato-Katz 03 dias úteis Sarampo IgM Elisa 07 dias úteis Enterobacterias 15 dias corridos Sarampo IgG Elisa 07 dias úteis Febre Amarela Mac Elisa 07 dias úteis Febre Maculosa - IFI 07 dias úteis Sífilis FTA-Abs 07 dias úteis HBV Carga Viral HCV- Carga Viral e Tuberculose Cultura 45 a 60 dias 15 dias úteis Genotipagem Teste de Sensibilidade corridos OBS: Os prazos acima serão atendidos mediante condições ideais de trabalho. Em caso de problemas técnicos como equipamento com defeito, falta de kit e/ ou reagentes, amostras encaminhadas ao Laboratório de Referência Nacional ou Regional, os prazos poderão ser prolongados. Os prazos dos exames de Inquéritos Sorológicos para investigação epidemiológicas e/ ou ambientais serão acordados com a equipe de investigadores da SESAU e LACEN/TO 9
10 3 COLETA Recepção do Paciente O paciente deve ser recebido com cortesia e cordialidade. O profissionalismo é importante para que o paciente tenha uma boa primeira impressão. Sorria, seja amigável, mas seja profissional falando com o paciente, dedicando-lhe atenção, explicando os procedimentos aos quais ele vai ser submetido, de modo a transmitir-lhe tranqüilidade e segurança. No momento em que o paciente é chamado, a identidade deve ser conferida fazendo-lhe uma ou duas perguntas e confirmando através da ficha de entrada Amostra Considera-se como amostra todo material biológico, líquidos, secreções, excreções, fragmentos de tecidos, obtidos do corpo humano e que possam ser analisados, sendo o sangue mais utilizado. Do ponto de vista da sua constituição, o sangue é considerado, como um sistema complexo e relativamente constante, constituído de elementos sólidos (células sanguíneas), substâncias líquidas (soro ou plasma) e elementos gasosos (O 2 e CO 2 ) Para obtê-lo o procedimento é conhecido por punção venosa, venipunção ou flebotomia. Embora não seja necessário conhecer todos os detalhes sobre os procedimentos analíticos dos testes, é essencial conhecer o tipo de amostras necessárias para cada teste: Bioquímica: Soro ou Plasma Hemograma e Grupo Sangüíneo: Sangue Total com EDTA Glicemia de Jejum: Plasma com Fluoreto Coagulação: Plasma com Citrato de Sódio Coleta de Amostras Cuidados Preliminares Ao iniciar os trabalhos, o técnico deve ter todas as condições para uma boa coleta, organizar seu material de acordo com a amostra a ser coletada, estar portando seus Equipamentos de Proteção Individual - EPI, ter seus Equipamentos de Proteção Coletiva - EPC à disposição, conferir todos os dados da requisição e preparar a identificação da amostra. 10
11 Condições para a coleta: Sala bem iluminada e ventilada Pia Cadeira reta com braçadeira regulável ou maca Garrote Algodão hidrófilo Álcool a 70% Agulha descartável Sistema a vácuo: Suporte, Tubo e Agulha descartável. Tubos de ensaio com tampa Pinça Pipetas Pasteur Etiquetas para identificação de amostras Canetas esferográficas Descarte com parede rígida Avental e Máscara Luvas descartáveis Estantes para tubos Ordem de Coleta A "ordem de coleta" recomendada, segundo a NCCLS (National Committee for Clinical Laboratory Standard), quando há necessidade de se coletar várias amostras de um mesmo paciente, durante uma mesma punção venosa, é a seguinte: Tubo para hemocultura (quando houver); Tubo sem aditivo (soro); Tubo com citrato (coagulação); Tubo com heparina (para plasma); Tubo com EDTA-K3 (hematologia); Tubo com fluoreto de sódio (glicemia). 11
12 Equipamentos de Proteção Individual EPI São roupas ou equipamentos utilizados para proteger o trabalhador, do contato com agentes infecciosos, tóxicos, corrosivos, calor excessivo e outros perigos, bem como o seu experimento ou produto definidos pela Port. 32/4-NR-6-MT 08/06/78. Jaleco: uso em todos os tipos de procedimentos, com as seguintes características: manga longa com elástico no punho, comprimento mínimo na altura dos joelhos, abertura frontal e de tecido preferencialmente de algodão ou tecido não inflamável; Luvas: para coleta, manuseio, acondicionamento de materiais biológicos; pode ser de procedimento ou cirúrgica, em látex; Óculos de proteção: usar em situações de risco de formação de aerossóis, salpicos de material contaminado ou quebras de vidraria; Máscara de Proteção Respiratória e Facial: usar em situações de risco de formação de aerossóis e salpicos de material potencialmente contaminado. Óculos de proteção Máscara Jaleco Luvas Figura 1:Equipamento de Proteção Individual Equipamentos de Proteção Coletiva EPC São equipamentos que possibilitam a proteção do trabalhador, do meio ambiente e do produto ou pesquisa desenvolvida. Dispositivos de Pipetagem Nunca usar a boca para pipetar, porque além do risco de aspiração, torna mais fácil a inalação de aerossóis. Utilizar um dos vários tipos de bulbos, pêra ou pipetadores (Figura 2); 12
13 Figura 2: Equipamentos de Proteção Coletiva EPC Cabines de Segurança Biológica CSB são usadas como barreira primária para evitar fuga de aerossóis, dando proteção ao manipulador, ao meio ambiente e à amostra ou procedimento; Kit para limpeza (saco para autoclave, pá, escova, balde, etiquetas, protetores de sapatos) - para casos de derramamentos e quebras de materiais contaminados; Kit de Primeiros Socorros Lavagem das Mãos Deve haver uma pia exclusivamente para lavagem das mãos, colocada em local estratégico; Lavar as mãos sempre antes e após o uso de luvas; Lavar as mãos sempre ao término das atividades Limpeza da Bancada de Trabalho Deve ser feita com álcool a 70% no início e no término das atividades ou sempre que houver necessidade; Quando houver derramamento de material biológico, limpar imediatamente com solução de hipoclorito a 2% em preparação diária. Notas: Se não houver álcool 70% pronto, realizar o preparo a partir do álcool 96º (álcool comercial), na proporção de 73 ml do álcool para 27 ml água; No uso de água sanitária a 2%, observar sempre o prazo de validade e não manter a embalagem aberta ou com furo na tampa, porque o hipoclorito evapora e em diluições menores, perde sua função desinfetante. 13
14 4 - REQUISIÇÕES, FICHAS DE NOTIFICAÇÃO E FORMULÁRIOS PARA AUTORIZAÇÃO DE PROCEDIMENTOS DE ALTO CUSTO (BPA I) Requisições e Fichas de Notificação Para que o LACEN realize os exames, é importante que a requisição as amostras estejam cadastrada no GAL, a ficha de notificação e os formulários de BPAI estejam preenchidos corretamente, sem rasuras, com as condições e dados a seguir: Com letra bem legível: os dados da requisição e/ou ficha de notificação são registrados no computador ou em livros de registros. Se não forem perfeitamente legíveis, podem ocorrer troca de nome, de exames ou envio para locais errados; Com nome, endereço e cidade da instituição: para que o resultado seja enviado para o local de origem é necessário que estes dados estejam na requisição ou na ficha; Com nome do paciente completo: a quantidade de exames é muito grande e o número de nomes iguais é comum, portanto quanto mais dados mais segurança. O nome completo para todos os exames facilita na hora de pesquisar o resultado no computador. Com data de nascimento (dd/mm/aa) e sexo: além de serem mais dados relacionados com o paciente, o que diminui a margem de erros, são dados importantes para a Vigilância Epidemiológica; Com nome e carimbo do solicitante: o resultado é enviado para quem solicitou o exame, logo é necessário que seja legível na requisição; Com descrição do material coletado - soro, sangue, líquor (Líquido Céfalo Raquidiano LCR), medula óssea, lavado brônquico, fezes, urina, secreções, raspado de pele e outros; Com a descrição dos exames(s) solicitados(s): a descrição do(s) exame(s) solicitado(s) deve ser bem legível. O material deve ser adequado ao exame a que se destina; Com as datas: da requisição;do início dos sintomas da coleta, dados epidemiológicos quando aplicável. Este dado é significativamente importante na análise do resultado do exame; Nas requisições para HIV, não deixar de citar a forma de transmissão (sexual, sanguínea, perinatal, e outras); 14
15 Nas requisições para CD4/CD8, Carga Viral, HCV Qualitativo, HCV Quantitativo e HCV Genotipagem, HBV-DNA, preencher completamente os espaços de informações sobre o paciente; sobre os dados laboratoriais e clínicos (motivo pelo qual o exame está sendo solicitado, nº de vezes que fez os referidos exames, resultados anteriores, estágio clínico e se está em tratamento) e dados sobre o médico solicitante; Número da notificação (Vigilância Epidemiológica) ; Telefone para contato; Nota Importante: Os dados que os laboratórios fornecem para as Vigilâncias Epidemiológicas são de suma importância na tomada de ações de Saúde Públicas tanto municipais quanto estaduais e principalmente federais, portanto é necessário que os dados sejam completos, legíveis e corretos. As fichas de notificação necessárias para os exames no LACEN estão disponíveis na internet, no Sistema de Informação de Notificação de Agravos SINAN Coleta de Sangue Condições do paciente O jejum é necessário para os exames de dosagens bioquímicas (Ex: glicose, colesterol, triglicerídeos e outros); Para os demais exames, é suficiente que seja coletado antes das principais refeições e principalmente antes da realização de exercícios físicos (se o paciente veio caminhando ou pedalando de longa distância, esperar até que ele se sinta descansado para fazer a coleta) Procedimentos anteriores à coleta Numero do código de barra-gerado pelo sistema GAL NOME COMPLETO DO PACIENTE NOME DA UNIDADE/ MUNICIPIO Maria Aparecida do PS COMBINADO Figura 3: Modelo de etiqueta Nota: A etiqueta deve ser colocada de maneira que se possa visualizar a amostra. Se for amostra líquida (sangue total, soro, plasma) o nível da amostra não pode ficar coberto (Figura 3). 15
16 Posicionamento do Braço O braço do paciente deve ser posicionado em uma linha reta do ombro ao punho, de maneira que as veias fiquem mais acessíveis e o paciente o mais confortável possível. O cotovelo não deve estar dobrado e a palma da mão voltada para cima. (Fig 04). Figura Garroteamento O garrote é utilizado durante a coleta de sangue para facilitar a localização das veias, tornando-as proeminentes e deve ser colocado no braço do paciente próximo ao local da punção (4 a 5 dedos ou 10 cm acima do local de punção), sendo que o fluxo arterial não poderá ser interrompido. Para tal, basta verificar a pulsação do paciente. Mesmo garroteado, o pulso deverá continuar palpável. O garrote não deve ser deixado no braço do paciente por mais de um minuto. Deve-se retirar ou afrouxar o garrote logo após a punção venosa, pois o garroteamento prolongado pode acarretar alterações nas análises. ( Fig.05). Figura 5 16
17 Seleção da Região de Punção A regra básica para uma punção bem sucedida é examinar cuidadosamente o braço do paciente. As características individuais de cada um poderão ser reconhecidas através de exame visual e/ou apalpação das veias. Deve-se sempre que for realizar uma punção venosa, escolher as veias do braço para a mão, pois neste sentido encontram-se as veias de maior calibre e em locais menos sensíveis à dor. As veias são tubos nos quais o sangue circula, da periferia para o centro do sistema circulatório, que é o coração e podem ser classificadas em: veias de grande, médio e pequeno calibre, e vênulas. De acordo com a sua localização, as veias podem ser superficiais ou profundas. As veias superficiais são subcutâneas e com freqüência visível por transparência da pele, sendo mais calibrosas nos membros. Devido à sua situação subcutânea que permite a visualização ou sensação táctil, são nessas veias que se fazem normalmente à coleta de sangue. Escolher uma região de punção envolve algumas considerações: Selecionar uma veia que é facilmente palpável; Não selecionar um local no braço ao lado de uma mastectomia (retirada total ou parcial da mama); Não selecionar um local no braço onde o paciente foi submetido a uma infusão intravenosa; Não selecionar um local com hematoma, edema ou contusão; Não selecionar um local com múltiplas punções. Havendo dificuldade em localizar uma veia: Recomenda-se utilizar uma bolsa de água quente por mais ou menos cinco minutos sobre o local da punção e em seguida garrotear; Nos casos mais complicados, colocar o paciente deitado com o braço acomodado ao lado do corpo e garrotear com o esfigmomanômetro (em P.A. média) por um minuto. OBS: NUNCA aplicar tapinhas no local a ser puncionado, principalmente em idosos, pois se forem portadores de ateroma poderá haver deslocamentos das placas acarretando sérias conseqüências. 17
18 Veia Cefálica Veia basílica Veia mediana cubital Veia mediana cefálica Veia mediana basílica Veia longitudinal Figura 6 A Veia marginal da mão Veia do dorso da mão Figura 6 B Assepsia: Fazer assepsia do local da punção venosa com algodão embebido em álcool 70º. Primeiro do centro do local de perfuração para fora em sentido espiral e após de baixo para cima forçando uma vascularização local. 18
19 OBS.: NUNCA toque o local da punção após anti-sepsia, exceto com luvas estéreis. 5 - PREPARO DO SISTEMA DE COLETA À VACUO Conectá-la ao adaptador (Fig.8). Estar certo de que a agulha esteja firme para assegurar que não solte durante o uso (Fig. 08/A). Remover a capa superior da agulha múltipla, mantendo o bisel voltado para cima (Fig. 08/B) Punção Venosa Colocar o garrote Figura 09 19
20 O sistema agulha-adaptador deve ser apoiado na palma da mão e seguro firmemente entre o indicador e o polegar, conforme figura (Fig. 09) Figura 10 No ato da punção, com o indicador ou polegar de uma das mãos, esticar a pele do paciente firmando a veia escolhida e com o sistema agulha-adaptador na outra mão, puncionar a veia com precisão e rapidez (Fig. 11). Figura 11 O sistema agulha-adaptador deve estar em um ângulo de coleta de 15º em relação ao braço do paciente (Fig. 12) Figura 12 Segurando firmemente o sistema agulha-adaptador com uma das mãos, com a outra pegar o tubo de coleta a ser utilizado e conectá-lo ao adaptador. 20
21 NOTA: Sempre que possível, a mão que estiver puncionando deverá controlar o sistema, pois durante a coleta, a mudança de mão poderá provocar alteração indevida na posição da agulha (Fig. 13). Figura 13 Com o tubo de coleta dentro do adaptador, pressione-o com o polegar, até que a tampa tenha sido penetrada (Fig. 14A e 14B). NOTA: Sempre manter o tubo pressionado pelo polegar assegurando um ótimo preenchimento. Tão logo o sangue flua para dentro do tubo coletor, o garrote deve ser retirado. Porém, se a veia for muito fina o garrote poderá ser mantido. Quando o tubo estiver cheio e o fluxo sangüíneo cessar, remova-o do adaptador trocando-o pelo seguinte (Fig. 15) Figura 15 21
22 Acoplar o tubo subseqüente em ordem específica a cada um dos exames solicitados, sempre seguindo a seqüência correta de coleta (Fig. 16A e 16B). Figura 16 A Figura 16B A medida que forem preenchidos os tubos, homogeneizá-los gentilmente por inversão (4 a 6 vezes) (Fig. 17). NOTA: Agitar vigorosamente pode causar espuma ou hemólise. Não homogeneizar ou homogeneizar insuficientemente os tubos de sorologia pode resultar em uma demora na coagulação. Nos tubos com anticoagulante, homogeneização inadequada pode resultar em agregação plaquetária e/ou microcoágulos. Figura 17 Tão logo termine a coleta do último tubo retirar a agulha (Fig. 18). Figura 18 22
23 Figura 18 Com uma mecha de algodão exercer pressão sobre o local da punção, sem dobrar o braço, até parar de sangrar (Fig. 19). Figura 19 A Figura 19 B Uma vez estancado o sangramento aplicar um curativo. A agulha deve ser descartada em recipiente próprio para materiais infecto contaminantes.(fig. 20/ A) Figura DESCARTE DE MATERIAIS Agulhas, seringas, tubos quebrados, tubos contendo sangue ou soro devem ser desprezados em recipientes de paredes rígidas com tampa (latas de leite em pó ou similares podem ser utilizadas) e sinalizadas como INFECTANTE ou em caixas coletoras próprias para material infectante, conforme Figura 19; 23
24 Papéis, luvas, gaze, algodão e outros, devem ser recolhidos em lixeiras com tampa, com pedal, contendo saco para lixo específico para material infectante (cor branca leitosa) Figura 21 Notas: Se não houver no município coleta de lixo especial para este tipo de resíduo, este deverá ser autoclavado antes do descarte em lixo comum. Todo resíduo gerado por materiais altamente contaminantes como as culturas, amostras da tuberculose e outros devem ser autoclavados em sacos próprios para autoclave, antes do descarte (Figura 20). Para a autoclavação, o saco deve ser preenchido somente até dois terços da sua capacidade e recomenda-se abri-lo dentro do autoclave para melhor penetração do vapor no seu conteúdo. Figura 22: Saco de autoclave Preparo da Amostra MATERIAL: Soro ou plasma 24
25 Preparo dos Tubos Para cada exame de sangue solicitado preparar um Eppendorf, para armazenar cada fração de soro ou plasma (1 ml) (Fig. 23); Escrever na etiqueta os dados do paciente de acordo com o item 6.3; Colar horizontalmente ou verticalmente a etiqueta no Eppendorf,, de maneira que apareça o nível da amostra; Figura 23 Eppendorf, com etiqueta Centrifugação / Separação do Soro ou Plasma Colocar luvas; Abrir a centrífuga e colocar os tubos com o sangue nas caçapas, tomando o cuidado de equilibrá-los; Fechar a tampa da centrífuga, marcar 3000 a 4000 rpm e ligar por 5 minutos; Não abrir a tampa da centrífuga antes de parar totalmente de rodar e nem tentar parar com a mão ou instrumentos (recomenda-se não abrir a centrífuga imediatamente após parar, devido a formação de aerossóis que podem ser infectantes, por isto, deve-se esperar alguns minutos para que as partículas sedimentem); Retirar os tubos das caçapas com auxílio de uma pinça e colocar em estante própria; Verificar o aspecto da amostra. O soro ou plasma deve estar livre de resíduos de hemácias. Se o soro estiver fortemente hemolisado ou lipêmico, nova coleta deve ser providenciada. 25
26 Se o aspecto do soro ou plasma estiver de acordo, passar (de preferência com pipetador ou pipeta plástica - também chamada de Pipeta Pasteur descartável ou pipeta de transferência) para o Eppendorf,, previamente identificados. Cobrir todo o Eppendorf, com parafilm (evitar o uso de esparadrapo e fita crepe) IDENTIFICAÇÕES DA AMOSTRA Qualquer amostra deve vir identificada com etiqueta autocolante, em letra legível contendo: Numero do código de barra-gerado pelo sistema GAL NOME COMPLETO DO PACIENTE NOME DA UNIDADE/ MUNICIPIO Maria Aparecida do Santos Oliveira Figura 24: Modelo de etiqueta Acondicionamento Para Transporte Para Transporte de Curta distância Para transporte rápido, de curta distância, os tubos com amostras (geralmente sangue total, soro ou plasma) podem vir em estantes devidamente identificada(s) e etiquetada(s). e transportados em caixas térmicas com gelo reciclável (gelox) Para transporte de longa distância Quando as amostras de sangue total, soro, plasma e outras similares são procedentes de locais mais distantes, o LACEN sugere o seguinte procedimento: Colocar os eppendorf(s) com as amostra(s), devidamente identificada(s) e etiquetada(s). Colocar os eppendorf em estantes; Colocar dentro de uma caixa térmica; Colocar o gelo reciclável dentro da caixa; Colocar papel amassado por cima, de maneira que as amostras e o gelo não se toquem; Fechar e vedar bem a caixa; 26
27 Colocar as requisições correspondentes, devidamente preenchidas, dentro de um envelope, por fora da caixa; Identificar com destinatário, remetente; Enviar ao laboratório. Notas: Gelo: o gelo deve ser preferencialmente reciclável, para não haver risco de perda da amostra. Caixa Térmica: é a caixa para transporte de amostra que deve ser de polietileno ou de isopor FIG.26. Deve ser lavável, resistir a desinfecção e portar a identificação de Infectante ou Risco Biológico, conforme FIG.27, juntamente com o nome, telefone e endereço da pessoa que deve ser avisada em caso de acidente com a(s) amostra(s). Figura 25 Figura 26 27
28 Condições de transporte nas ambulâncias: O material para exame deve vir separado dos pacientes quando transportados na mesma ambulância; As caixas térmicas ou de isopor devem vir bem vedadas e fixadas para não virar durante o transporte e protegidas do sol e de umidade; O motorista deve ser orientado de como proceder em caso de acidente com as amostras; Deve possuir na viatura um Kit com: EPIs - jaleco e luvas e EPCs - uma pá com escova (caso tenha que recolher material espalhado), pano de limpeza, um pequeno frasco com álcool 70% para limpeza do local e das mãos, saco para lixo infectante e fita adesiva; Ao final todos os materiais recolhidos e utilizados na operação devem ser colocados no saco para lixo infectante, bem fechado com a fita adesiva,para que mais tarde sejam esterilizados e descartados adequadamente; Deve avisar para a pessoa responsável pela remessa, cujo nome, telefone e endereço devem constar na caixa térmica ou de isopor HIV 7 - EXAMES REALIZADOS NO LACEN a) Exame: Sorologia para HIV b) Método: ELISA Enzimaimuoensaio Imunoblot Rápido - Imunocromatografia c) Amostra Biológica: Soro d) Volume Ideal: 2 ml e) Período ideal de coleta: Não se aplica f) Orientação para coleta de amostra De preferência soro colhido em jejum de 8 h. A amostra deverá ser enviada em ependorff. O paciente deve apresentar documento de identidade, com foto, no ato da coleta da amostra. Caso não possua, o responsável pela coleta deverá certificar-se que se trata da mesma pessoa cujo o nome consta no pedido médico e que esteja solicitando sorologia para HIV. 28
29 g) Conservação da amostra até o envio e acondicionamento para transporte A amostra deverá ser enviada até 7 dias se mantida em temperatura de 2 a 8 C. Se for armazenada em freezer -20 C, poderá enviar até 15 dias.transportar em caixa de isopor ou térmica com gelo reciclável: enviar ofício e requisição do GAL. Critérios de rejeição de amostras Amostra que não seja soro; Amostra fora da temperatura; Amostra com menos de 1 ml ; Amostra desacompanhada da ficha de requisição ou ficha de remessa; Amostra hiperlipêmica ou hemolisada; Amostra com identificação incorreta; Amostra com mais de 30 dias de coleta. Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra CD4/CD8 a) Exame: Contagem de linfócitos T CD4 / CD8/ CD3/ CD45 b) Metodologia: Citometria de Fluxo ( 4 parâmetros) c) Amostra Biológica: Sangue total contendo anticoagulante EDTA K3 (tubo com tampa roxa, usar tubos pediátricos para volume inferiores a 2,5ml. Obs: Os tubos devem ser homogeneizados adequadamente após a coleta para evitar a formação de coágulos que tornam a amostra inadequada. Não utilizar homogeneizador mecânico. d) Volume ideal: 01 tubo de 5 ml de sangue total e) Período ideal de coleta: Não se aplica f) Orientação para coleta de amostra: Não é necessária a preparação especial do paciente antes de iniciar a coleta das amostras, mas recomenda-se ( não obrigatório) um jejum de 8 horas. Nunca usar tubos de coleta reciclados; 29
30 Manusear as amostras como potencialmente infectantes. Após a coleta o sangue deverá ser mantido em temperatura ambiente (20 a 25 C). Não refrigerar as amostras. Não usar tubos de EDTA com gel. g) Formulários requeridos Enviar BPA-I devidamente preenchida com todos os dados do paciente, da unidade solicitante e do médico cadastrado no SISCEL. Atenção: No teste de Contagem de Linfócitos T CD4/CD8, utiliza-se o sangue total, que nunca deve ser colocado em geladeira ou congelador. O correto é manter sempre o sangue em temperatura ambiente, não excedendo 37 C. Esta coleta é realizada no LACEN de Palmas/HDT-Araguaína e Policlinica de Gurupi Carga Viral do HIV a) Exame: Quantificação do RNA do HIV-1 (CARGA VIRAL) b) Métodologia: RT- PCR em tempo real c) Amostra Biológica: Sangue total contendo anticoagulante EDTA K3 (tubo com tampa roxa) para obtenção do plama. d) Volume ideal: Coletar 02 tubo de 5 ml de sangue total com EDTA. Separar o plasma após a centrifugação, enviar 02 alíquotas de 01ml de plasma em Eppendorfs livres de RNAse e DNAse, usar ponteira com filtro e) Período ideal de coleta: Não se aplica f) Orientação para coleta de amostra: Não é necessário a preparação especial do paciente antes de iniciar a coleta das amostras, mas recomenda-se ( não obrigatório) um jejum de 8 horas. O manuseio correto das amostras é imprescindível para proteger o RNA viral do HIV-1 de degradação; Nunca usar tubos de coleta reciclados; Manusear as amostras como potencialmente infectantes. Não usar tubos de EDTA com gel. 30
31 Após a coleta, o sangue total colhido deverá ser conservado no tubo original antes da centrifugação por um período máximo de até 4 horas à temperatura ambiente, após este período centrifugar e acondicionar o plasma em 02 alíquotas em Eppendorf livres de RNAse e DNAse, e armazená-los a temperatura de -65 C a -80 C, até a utilização. Não congelar e descongelar o plasma por mais de 02 vezes. OBS: O transporte pode ser realizado em até 24 horas com gelo reciclável mantendo a temperatura de recepção inferior a 5 C. g) Formulários requeridos Enviar BPA-I devidamente preenchida com todos os dados do paciente, da unidade solicitante e do médico cadastrado no SISCEL. Nota: Esta coleta é realizada no LACEN de Palmas/HDT- Araguaína e Policlínica de Gurupi Genotipagem para HIV a) Exame: Amplificação por PCR/ Purificação por PAGE Sequenciamento do Genoma b) Amostra Biológica: Sangue total contendo anticoagulante EDTA K3 (tubo com tampa roxa) c) Volume ideal: 02 tubos de 5 ml de sangue total com EDTA. Separar o plasma após a centrifugação. enviar 02 alíquotas de 1ml de plasma em Eppendorf livres de RNAse e DNAse, usar ponteira com filtro d) Período ideal de coleta: Não se aplica e) Orientação para coleta de amostra: Não é necessário a preparação especial do paciente antes de iniciar a coleta das amostras, mas recomenda-se ( não obrigatório) um jejum de 8 horas. Nunca usar tubos de coleta reciclados; Manusear as amostras como potencialmente infectantes. Não usar tubos de EDTA com gel. Após a coleta, o sangue total colhido deverá ser conservado no tubo original antes da centrifugação por um período máximo de até 4 horas à temperatura ambiente, após este período centrifugar e acondicionar o plasma em 02 alíquotas de 1ml em Eppendorf livres de RNAse e DNAse, e armazená-los a temperatura de -65 C a -80 C, até a utilização. Não congelar e descongelar o plasma por mais de 02 vezes. 31
32 f) Formulários requeridos Enviar formulário para solicitação de exame de genotipagem de HIV devidamente preenchida com todos os dados do paciente, da unidade solicitante e do médico de referência em Genotipagem MRG, devidamente carimbado pelo médico solicitante (Anexo I da Nota Técnica Nº 543/2013) Nota: Esta coleta é realizada no LACEN de Palmas/HDT-Araguaína e Policlínica de Gurupi 7.2 CHAGAS a) Exame: Sorologia para Chagas b) Metodologia: ELISA Ensaio Imunoenzimático IFI- Imunofluorescência Indireta HAI Hemaglutinação indireta c) Amostra Biológica: Soro d) Volume Ideal: 2 ml e) Período ideal de coleta: Sorologia: fase aguda e fase crônica f) Orientação para coleta de amostra De preferência soro colhido em jejum de 8 h, A amostra deverá ser enviada em Eppendorf. g) Conservação da amostra até o envio e acondicionamento para transporte Transportar em caixa de isopor ou térmica com gelo reciclável: enviar oficio e requisição do GAL. A mostra deverá ser enviada até 7 dias mantendo em temperatura de 2 a 8 C e se for em freezer -20 C até 15 dias. h) Formulários requeridos Fase Aguda: Ficha de Investigação epidemiológica Critérios de Rejeição de Amostras Amostra que não seja soro Amostra com menos de 1 ml 32
33 Amostra desacompanhada da ficha de requisição ou ficha de remessa Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra com mais de 30 dias de coleta Amostra fora da temperatura Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra. 7.3 DENGUE Sorologia a) Exame: Sorologia para Dengue b) Métodologia: ELISA- Ensaio de Imunoenzimático c) Amostra Biológica: Soro d) Volume Ideal: 2 ml e) Período ideal de coleta: Sorologia: a partir do 6 (sexto) dia após o inicio dos sintomas f) Orientação para coleta de amostra De preferência soro colhido em jejum de 8 h; A mostra deverá ser enviada em Eppendorf; Coletar a partir do 6 (sexto) dia após o inicio dos sintomas; g) Conservação da amostra até o envio e acondicionamento para transporte Para Sorologia a amostra poderá permanecer em geladeira por até 7 dias e em seguida deve ser congelado em freezer (-20 C) até o momento do transporte A amostra deve ser encaminhada ao laboratório no máximo 15 dias após a data da coleta. Transportar em caixa de isopor ou térmica com gelo reciclável: enviar oficio e requisição do GAL. h) Formulários requeridos As amostras deverão ser acompanhadas das fichas epidemiológicas Notificação. Todo caso suspeito deve ser notificado através da ficha de notificação (SINAN). Esta ficha 33
34 pose ser adquirida na GRS do município Preencher os campos de manifestações hemorrágicas e o valor de plaquetas, sinais e sintomas. Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta: sorologia a partir do 6 (sexto) dia e isolamento viral até o 6 (sexto) dia do aparecimento dos primeiros sintomas. Não deixar de preencher estas datas, pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito i) Critérios de rejeição de amostras Amostra que não seja soro Amostra fora da temperatura preconizada Amostra com menos de 1 ml de soro Amostra desacompanhada da ficha de requisição ou ficha de remessa Amostra hiperlipêmica ou hemolisada Amostra com identificação incorreta Amostra coletada antes do 6 dia de sintomas Amostra com mais de 30 dias de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra DENGUE - Isolamento Viral - Cultura de Células ou Isolamento do Vírus a) Exame: Isolamento Viral b) Métodologia: Isolamento viral em cultura de células C6/36 c) Amostra Biológica: Sangue Total sem anticoagulante ou Soro e) Volume Ideal: 1 ml f) Período ideal de coleta: Isolamento: Coletar do 1 (primeiro) ao 5º(quinto) dia após aparecimento dos primeiros sintomas g) Orientação para coleta de amostra Deve ser colhido em tubo estéril, hermeticamente fechado ou em tubos à vácuo sem anticoagulante.. Deve se coletar o sangue até o 5 (quinto) dia do aparecimento dos primeiros sintomas. Toda amostra coletada para isolamento viral, deve-se colher uma segunda amostra, a partir do 6 (sexto) dia do início dos sintomas, para processar a sorologia 34
35 h) Conservação da amostra até o envio e acondicionamento para transporte Soro: Se for possível o ENVIO em até 8 horas, manter o soro refrigerado (2 a 8 C) até o momento do envio. Se não for possível encaminhar no mesmo dia, conservar em nitrogênio líquido ou freezer 70 C. Enviar em caixa de isopor com bastante gelo reciclável para locais próximos do Lacen (aproximadamente 2 horas de percurso). Para os locais distantes, enviar as amostras em nitrogênio. Sangue Total: Armazenar e encaminhar em nitrogênio líquido. i) Formulários requeridos Ficha de notificação ou de investigação devidamente preenchida, Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta: sorologia a partir do 6 dia e isolamento até o 5 dia do aparecimento dos primeiros sintomas. Não deixar de preencher estas datas, pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito j) Critérios de rejeição de amostras Amostra fora da temperatura Amostra com menos de 0,5 ml Amostra desacompanhada da ficha de requisição ou ficha de remessa Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra com mais de 05 dias de início dos sintomas Amostra sem especificação de início de sintomas Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra DENGUE em Caso de Óbito a) Exame: Histopatológico, Imunohistoquímica ou Técnicas Moleculares b) Tipo de material: Tecido ( fígado,rins,coração,baço,linfonodos,) necropsia ou punção c) Quantidade: fragmento de 2 cm 35
36 d) Período da coleta: Logo após o óbito. Menos de 12 horas, máximo de 24 horas e) Recipiente: Frasco estéril de plástico ou vidro estéril com tampa de rosca f) Armazenamento/Conservação: em formalina tamponada a 10% g) Transporte: Temperatura ambiente em até 24 horas DENGUE Para amostra de tecido PCR ou Isolamento Viral a) Tipo de material: Tecido ( fígado,rins,coração,baço,linfonodos) necropsia ou punção b) Quantidade: 2 (dois) fragmento de 2 cm cada c) Período da coleta: Logo após o óbito. Menos de 12 horas, máximo de 24 horas. d) Recipiente: Frasco estéril de plástico ou vidro estéril com tampa de rosca. Material fresco e) Armazenamento/Conservação: Freezer 70 ou nitrogênio líquido f) Transporte: Em nitrogênio liquido ou gelo seco DENGUE - Isolamento Viral em caso de óbito a) Isolamento Viral Sangue ou Soro- obtenção da amostra: punção venosa ou punção intracardiana (óbito) b) Quantidade: criança 5ml, adulto 10 ml c) Período da coleta: Logo após o óbito menos de 12 horas máximo de 24 horas d) Recipiente: Em tubo estéril de plástico resistente com tampa de rosca e) Armazenamento: Em freezer -70 C ou nitrogênio liquido f) Transporte: Em nitrogênio liquido ou gelo seco e menos de 24 horas após a coleta DENGUE - Sorologia em caso de óbito a) Sorologia- Sangue e Soro- Obtenção da amostra: punção venosa ou punção intracardiana (óbito) 36
37 b) Quantidade: criança 5 ml, adulto 10 ml c) Período da coleta: Logo após o óbito menos de 12 horas máximo de 24 horas d) Recipiente: Em tubo estéril de plástico resistente com tampa de rosca e) Armazenamento: Em freezer 20 C até o envio f) Transporte: Enviar em gelox ESQUISTOSSOMOSES MANSÔNIA a) Exame: - KATO KATZ b) Amostra Biológica: Fezes Inatura c) Volume Ideal: 10ml d) Orientação para coleta de amostra Coletar em frasco estéril de plástico com tampa de rosca. e) Conservação da amostra até o envio e acondicionamento para transporte Conservar a amostra até o envio em geladeira de (4ºC a 8ºC) até 24 h Transportar em caixa de isopor com gelo reciclável; enviar ofício e requisição do GAL listando o nome dos pacientes e tipo de exames solicitados. Anexar a ficha de investigação epidemiológica contendo os dados do paciente. f) Critérios de rejeição de amostras Coleta com mais de 24 h Identificação incorreta Amostra fora da temperatura Amostra desacompanhada da ficha de requisição, ficha de remessa ou ficha de investigação Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra FEBRE AMARELA a) Exame: Sorologia para Febre Amarela 37
38 b) Métodologia: - Mac- Elisa c) Amostra Biológica: Soro d) Volume Ideal: 2 ml e) Período ideal de coleta: Para sorologia a partir do 6 (sexto) dia após o início dos sintomas), para isolamento até o 4 (quarto) dia após o inicio dos sintomas f) Orientação para coleta de amostra De preferência soro colhido em jejum de 8 h, amostra deverá ser enviada em eppendorff Para Sorologia: Coletar a partir do 6 (sexto) dia após o início dos sintomas Para Isolamento: do 1 (primeiro) ao 5 (quinto) dia após o aparecimento dos primeiros sintomas e segue as mesmas orientações para coleta de isolamento para dengue. g) Conservação da amostra até o envio e acondicionamento para transporte Por se tratar de uma doença de Notificação Compulsória Imediata, as amostras de casos suspeitos de Febre Amarela devem ser encaminhadas ao Lacen o mais rápido possível após identificação do caso, deverão ser mantidas em temperatura de 2 C a 8 C até o envio. Para sorologia transportar em caixa de isopor ou térmica com gelo reciclável: enviar oficio e requisição do GAL. Para Isolamento segue o mesmo acondicionamento para isolamento de Dengue. h) Formulários requeridos Ficha de notificação ou de investigação devidamente preenchida. Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta: sorologia a partir do 6 dia e isolamento até o 5 dia do aparecimento dos primeiros sintomas. Não deixar de preencher estas datas, pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito i) Critérios de rejeição de amostras Amostra fora da temperatura Amostra com menos de 1 ml 38
39 Amostra desacompanhada da ficha de requisição do GAL, ou ficha de notificação Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra fora do período de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra Febre Amarela - Caso de Óbito: a) Exame: Histopatológico, Imunohistoquímica ou Técnicas Moleculares b) Tipo de material: Tecido ( fígado,rins,coração,baço,linfonodos, cérebro) necropsia ou punção c) Quantidade: fragmento de 2 cm e) Período da coleta: Logo após o óbito. Menos de 8 horas, máximo de 12 horas. f) Recipiente: Frasco estéril de plástico ou vidro estéril com tampa de rosca g) Armazenamento/Conservação: em formalina tamponada a 10% h) Transporte: Temperatura ambiente em até 24 horas Febre Amarela - Cultura de células ou isolamento de vírus- PCR a) Tipo de material: Tecido ( fígado,rins,coração,baço,linfonodos, cérebro) necropsia ou punção b) Quantidade: fragmento de 2 cm c) Período da coleta: Logo após o óbito. Menos de 12 horas, máximo de 24 horas d) Recipiente: Frasco estéril de plástico ou vidro estéril com tampa de rosca. Material fresco e) Armazenamento/Conservação: Freezer 70 ou nitrogênio liquido f) Transporte: Em nitrogênio liquido ou gelo seco e menos de 24 horas após a coleta 39
40 7.5.3 Febre Amarela - Isolamento Viral em caso de óbito a) Isolamento Viral Sangue e Soro - obtenção da amostra: punção venosa ou punção intracardiana(óbito) b) Quantidade: criança 5ml, adulto 10 ml c) Período da coleta: Logo após o óbito menos de 12 horas máximo de 24 horas d) Recipiente: Em tubo estéril de plástico resistente com tampa de rosca e) Armazenamento: Em freezer -70 C até o envio e nitrogênio liquido f) Transporte: Em nitrogênio liquido ou gelo seco e menos de 24 horas após a coleta Febre Amarela - Sorologia em caso de óbito a) Sorologia- Sangue e Soro- Obtenção da amostra: punção venosa ou punção intracardiana (óbito) b) Quantidade: criança 5 ml, adulto 10 ml c) Período da coleta: Logo após o óbito menos de 12 horas máximo de 24 horas d) Recipiente: Em tubo estéril de plástico resistente com tampa de rosca e) Armazenamento: Em freezer 20 C até o envio f) Transporte: Enviar em gelo FEBRE MACULOSA a) Exame: Sorologia Para Febre Maculosa b) Metodologia: Imunofluorescência Indireta IFI Imunohistoquimica em caso de óbito PCR e Isolamento Somente com consulta prévia e autorização c) Amostra Biológica: Soro, duas amostras de soro ( amostras pareadas) 2ml cada d) Volume Ideal: 2 ml de soro, para PCR coágulos ou sangue total em EDTA, tecidos (pele) e vísceras 40
41 e) Período ideal de coleta: Duas amostras de soro (amostras pareadas) 2ml cada uma, sendo a primeira colhida após o 7 dia do início dos sintomas e a segunda de14 a 21 dias após a coleta da primeira amostra. f) Orientação para coleta de amostra De preferência soro colhido em jejum de 8 h, Soro: 1ª amostra: após o 7 dia do início dos sintomas e a 2ª amostra: de 14 a 21 dias após a coleta da primeira g) Conservação da amostra até o envio e acondicionamento para transporte Soro: a 1ª amostra deverá ser mantida a -20 C, aguardando a coleta da 2ª segunda, feita a segunda coleta enviar no prazo de dois dias ao LACEN em embalagem térmica ou caixa de transporte com gelo reciclável. Caso não possa ser encaminhado, conservá-los no freezer na temperatura de -20 C, até o momento do transporte. Enviar ofício e ficha de remessa ou requisição do GAL, anexar à ficha de investigação epidemiológica contendo os dados do paciente, dado do inicio dos sintomas, data da coleta e primeira suspeita. h) Formulários requeridos Ficha de notificação ou de investigação devidamente preenchida. Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta, pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito i) Critérios de rejeição de amostras Amostra única para RIFI, exceto em caso de óbito Amostra fora da temperatura Amostra com menos de 1 ml Amostra desacompanhada da ficha de requisição, ficha de remessa ou ficha de notificação. Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra fora do período de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra 41
42 7.7 - HEPATITES VIRAIS ( A, B, e C) a) Exame: Hepatite A- Anti - HAV IgM Hepatite B - HbsAg; HBeAg; Anti-HBc IgM; Anti-HBs; Anti-HBc: Anti-HBe Hepatire C - Anti - HCV b) Métodologia: - Enzimaimunoensaio - ELISA e Quimioluminescência c) Amostra Biológica: Soro d) Volume Ideal: 2ml, nos casos de suspeita de hepatite A, mais de 3ml para os outros marcadores e) Período ideal de coleta: Suspeita Clinica f) Orientação para coleta de amostra: De preferência soro colhido em jejum de 8 h, para minimizar fenômeno com lipemia. g) Conservação da amostra até o envio e acondicionamento para transporte Até o envio da amostra ao laboratório a mesma deverá ser mantida em temperatura de 2 a 8 C e em freezer -20 C até 15 dias. Transportar em caixa de isopor ou térmica com gelo reciclável Enviar ofício e ficha de remessa ou requisição do GAL, anexar a ficha epidemiológica contendo os dados do paciente, dado do inicio dos sintomas, data da coleta e primeira suspeita. Aconselha-se não congelar e descongelar mais de 2 vezes as amostras. h) Formulários requeridos As amostras deverão ser acompanhadas das fichas epidemiológicas ou notificação. Todo caso suspeito deve ser notificado através da ficha de notificação (SINAN). Esta ficha pose ser adquirida na GRS do município Informar as datas dos primeiros sintomas e coleta,e todos os dados pedidos na ficha de notificação, respeitando o prazo de coleta: pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito 42
43 i) Critérios de rejeição de amostras Amostra fora da temperatura Amostra com menos de 1 ml Amostra desacompanhada da ficha de requisição, ficha de remessa ou ficha de notificação. Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra fora do período de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra Quantificação do RNA do vírus da Hepatite C (HCV-RNA), Quantificação do DNA do vírus da Hepatite B (HBV-DNA) ou Carga Viral do HBV e Genotipagem do Vírus da Hepatite C (Genotipagem HCV) a) Metodologia: RT-PCR (para HCV-RNA) em tempo real e PCR em tempo real para HBV-DNA b) Amostra Biológica: Sangue total contendo anticoagulante EDTA K3 para obtenção de plasma. c) Volume Ideal: 2 ml de plasma (sendo 02 eppendorfs com 1 ml cada, livres de RNAse e DNAse) usar ponteira com filtro. Coletar 02 tubos de 5 ml de sangue total com EDTA para cada exame solicitado. Separar o plasma após centrifugação e enviar 02 alíquotas de 1 ml de plasma. d) Período ideal de coleta: Não se aplica e) Orientação para coleta de amostra: Não é necessária a preparação especial do paciente antes de iniciar a coleta das amostras, mas recomenda-se ( não obrigatório) um jejum de 8 horas. O manuseio correto das amostras é imprescindível para proteger o RNA viral de degradação; Nunca usar tubos de coleta reciclados; Manusear as amostras como potencialmente infectantes. Não usar tubos de EDTA com gel. 43
44 f) Conservção da Amostra até o Envio: As amostras recentemente colhidas (sangue total) podem ser mantidas entre 2 C a 30 C por até 6 horas, antes da centrifugação. Após a centrifugação as amostras de plasma podem ser armazenadas em 15 C a 30 C por até 24 horas, entre 2 C a 8 C por até 3 dias ou a -70 C por período prolongado. g) Transporte: As amostras de plasma congeladas devem ser transportadas dentro de recipientes com gelo seco ou reciclável. h) Formulário: BPA-I específico devidamente preenchido ( HCV-RNA ou HBV-DNA) ou Genotipagem para HCV. NOTA: Esta coleta é realizada no LACEN-Palmas/HDT-Araguaína e Policlínica de Guripi 7.8 INFLUENZA a) Metodologia: Reação de imunofluorescência Indireta RT- PCR em Tempo Real. b) Amostra Biológica: Secreção de naso orofaríngea a vácuo coletada por aspiração ou swab combinado c) Volume Ideal: ANF: Secreção 3ml Swab combinado: 3 swabs em 3ml do meio de transporte ( em único tubo) fornecido pelo LACEN. d) Período ideal de coleta: Até o Sétimo dia após o inicio dos sintomas, preferencialmente nos três primeiros dias. e) Orientação para coleta de amostra: Coletor plástico descartável de secreções com volume de 20mL acoplado com sonda nº 6 1/2 e com controle de vácuo, ou equipo de soro para administração parenteral com sonda plástica uretral nº 6 estéril; Swabs 15cm descartáveis com haste flexível e extremidade preferencialmente em poliéster, estéreis, acondicionados individualmente para coleta de espécimes clínicos; Tubos 17mm x 119mm de polipropileno, transparentes, descartáveis e graduados de 15mL com tampa de rosca ; 44
45 Meio de transporte viral. Bomba de aspiração portátil High volume vacum pressure pump ou vácuo de parede; f) Coleta de Aspirado de Nasofaringe Com o coletor descartável ou equipo de soro acoplado à sonda uretral nº 6, aspirar a secreção de nasofaringe das duas narinas. A aspiração deve ser realizada com bomba aspiradora portátil ou vácuo de parede; não utilizar uma pressão de vácuo muito forte; Durante a coleta, a sonda é inserida através da narina até atingir a região da nasofaringe, quando então o vácuo é aplicado, aspirando a secreção para o interior do coletor ou equipo. Este procedimento deve ser realizado em ambas as narinas, mantendo movimentação da sonda para evitar que haja pressão diretamente sobre a mucosa, provocando sangramento. Alternar a coleta nas duas fossas nasais até obter um volume de aproximadamente 1mL de secreção. A quantidade de secreção a ser colhida dependerá da etiologia da IRA, fase evolutiva do quadro clínico e do grau de hidratação do paciente. Pacientes febris apresentam secreção espessa. Após nebulização com soro fisiológico a secreção é mais fluida, abundante e conseqüentemente mais fácil de ser obtida. Não insistir se a coleta não alcançar o volume desejado 1mL pois poderá ocasionar lesão de mucosa; Após aspirar a secreção nasofaríngea com o coletor próprio, inserir a sonda de aspiração no frasco, contendo 3mL de meio de transporte viral. Aspirar todo o meio para dentro do coletor. Retirar a tampa com as sondas e desprezar como resíduo biológico, em lixeira. Fechar o frasco coletor utilizando a tampa plástica que se encontra na parte inferior do coletor. Vedar esta tampa com plástico aderente tipo Parafilm e manter refrigerado a 4 0 C não congelar. Não havendo disponibilidade de Parafilm, vedar o frasco com esparadrapo; Caso a amostra seja coletada com equipo, não deve ser adicionado o meio de transporte viral após a coleta. O equipo, com a sonda, devem ser colocados em um saco plástico, lacrado e identificado. Manter refrigerado a 4 C não congelar. Figura 27 Aspirado nasofaringeo Atenção: Esta amostra não poderá ser congelada. 45
46 g) Coleta de Swab Nasal / Oral Combinado (SC) Deverão ser coletados três swabs, um swab de orofaringe e dois swabs de nasofaringe, sendo um de cada narina e Swab de nasofaringe A coleta deve ser realizada com a fricção do swab na região posterior do meato nasal tentando obter um pouco das células da mucosa. Colher swab nas duas narinas um swab para cada narina. Figura 28 swab nasal h) Swab de orofaringe Colher swab na área posterior da faringe e tonsilas, evitando tocar na língua. Figura 29 swab oral Após a coleta, inserir os três swabs em um mesmo tubo de polipropileno dar preferência para utilização de frasco plástico tentando evitar a ação da RNAse contendo 3mL de meio de transporte viral. Lacrar e identificar adequadamente o frasco. Manter refrigerado a 4ºC. Excepcionalmente, estes poderão ser estocados e preservados a 4ºC, por período não superior a 24h. Os swabs a serem usados devem ser estéreis e possuir haste de plástico 46
47 Atenção: Não deverão ser usados swabs com haste de madeira e/ou com alginato de cálcio. i) Conservação da amostra até o envio e acondicionamento para transporte Na Unidade Sentinela, a amostra de nasofaringe deverá ser acondicionada em geladeira 4 C, não devendo ser congelada. Encaminhar no mesmo dia ao LACEN em isopor contendo gelo. Para o transporte, o coletor, equipo ou os tubos contendo os swabs deverão ser identificados e acondicionados individualmente em sacos plásticos e transportados em caixas de isopor contendo gelo reciclável. No caso de envio da amostra utilizando-se o transporte aéreo, atender as normas de biossegurança universal da Associação Internacional de Transporte Aéreo (IATA). Em caso suspeito de Influenza H1N1 requisitar o meio de transporte ao Lacen e após a coleta a amostra deverá ser encaminhada imediatamente ao laboratório para que a mesma seja armazenada em freezer 70 C até o envio para o laboratório de referencia. j) Formulários requeridos Ficha de notificação ou de investigação devidamente preenchida. Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta, pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito 7.9 LEISHMANIOSES Leishmaniose Visceral Canina a Metodologia: Teste Rápido DPP Ensaio Imunoenzimático (ELISA). b) Amostra Biológica: Soro para ELISA Sangue Total para TR-DPP décimo terceiro dia. c) Volume Ideal: 2ml d) Período ideal para coleta: A partir de suspeita ou investigação epidemiológica. e) Orientação para coleta de amostra 47
48 Coletar amostra de sangue através de punção venosa, transferir o material obtido para um tubo para fazer a centrifugação e extrair o soro e transferir para um eppendorf estéril, identificado e devidamente lacrado. f) Conservação da amostra até o envio e acondicionamento para transporte Conservar a amostra até o envio em geladeira de (2ºC a 8ºC) até 05 dias e em freezer 20 C até 15 dias Transportar em caixa de isopor com gelo reciclável; enviar ofício e requisição do GAL. g) Critérios de rejeição de amostras Amostra fora da temperatura Amostra com menos de 1 ml Amostra desacompanhada da ficha de requisição, ficha de remessa ou ficha de notificação Amostra hiperlipêmica ou hemolisada Amostra com identificação incorreta Amostra fora do período de coleta Amostra enviada com mais de trinta dias de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra Leishmaniose Visceral Humana a) Metodologia: Teste Rápido Imunofluorêscencia Indireta(RIFI) b) Amostra Biológica: Soro c) Volume Ideal: 2ml d) Período ideal para coleta: A partir de suspeita clinica ou investigação epidemiológica. e) Orientação para coleta de amostra: De preferência soro colhido em jejum de 8 h, para minimizar fenômeno com lipemia e transferir o soro para uma eppendorf. f) Conservação da amostra até o envio e acondicionamento para transporte 48
49 Conservar a amostra até o envio em geladeira de (2ºC a 8ºC) até 07 dias e em freezer 20 C até 15 dias Transportar em caixa de isopor com gelo reciclável; enviar ofício e requisição do GAL g) Formulários requeridos Ficha de notificação ou de investigação devidamente preenchida. Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta, pois elas influenciam no diagnóstico laboratorial. No caso de óbito incluir evolução do óbito. h) Critérios de rejeição de amostras Amostra fora da temperatura Amostra com menos de 1 ml Amostra desacompanhada da ficha de requisição, ficha de remessa ou ficha de notificação Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra fora do período de coleta Amostra enviada com mais de trinta dias de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra LEPTOSPIROSE a) Exame: Sorologia para Leptospirose b) Metodologia: ELISA IgM c) Material: 2 ml de soro d) Amostra Biológica: Soro e) Volume Ideal: 2 ml 49
50 f) Período ideal para coleta: ELISA-IgM: A partir do quinto dia após o inicio dos sintomas. g) Orientação para coleta de amostra Recomenda-se a coleta de amostras pareadas. A primeira na fase aguda e a segunda após duas a três semanas (no máximo 60 dias) a partir da primeira coleta De preferência soro colhido em jejum de 8 h, para minimizar o lipemia. h) Conservação da amostra até o envio e acondicionamento para transporte Conservar a amostra até o envio em geladeira de (2ºC a 8ºC) até 05 (cinco) dias após este período em freezer 20 C; Transportar em caixa de isopor com gelo reciclável; Enviar ofício e requisição do GAL. i) Formulários requeridos: Ficha de notificação ou de investigação devidamente preenchida. Informar as datas dos primeiros sintomas e coleta, respeitando o prazo de coleta, pois elas influenciam no diagnóstico laboratorial. OBS: Em caso de óbito incluir evolução do óbito. j) Critérios de rejeição de amostras Amostra com menos de 1 ml e em temperatura ambiente Amostra desacompanhada da ficha de requisição do GAL, ou ficha de notificação Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra fora do período ideal de coleta(quinto dia após início de sintomas) Amostra enviada com mais de trinta dias de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra MENINGITES COMPOSIÇÃO DO KIT (formecido pelo LACEN através de previa solicitação) 01 tubo com meio de cultura Ágar chocolate; 50
51 02 frascos estéreis para coleta de líquor para realização da citoquímica, bacterioscopia e Látex; 02 lâminas para bacterioscopia; Bula explicativa Instruções para uso e transporte do KIT Meningite CULTURA de LCR Deixar o tubo com o meio de cultura ágar chocolate adquirir a temperatura ambiente antes de semear; Identificar os tubos do kit com o nome completo do paciente e a data da punção; Fazer assepsia dos frascos com álcool a 70% antes de abri-los para coleta, Inocular, no momento da punção, 5 a 10 gotas de LCR no tubo contendo o ágar chocolate, e o restante do líquor deve ser coletado nos frascos vazios Colocar imediatamente o tubo com o meio de cultura já semeado em uma estante dentro de uma jarra de anaerobiose contendo um chumaço de algodão umedecido em água destilada; lembrando de deixar a tampa do tubo com o meio de cultura ágar chocolate levemente desrosqueado; Utilizar uma vela dentro da jarra de anaerobiose, e acendê-la; Fechar a jarra de anaerobiose; Incubar em estufa (35 +/- 2ºC); Enviar ao LACEN-TO preferencialmente 24 horas após a coleta e incubação, respeitando o tempo máximo de 72 horas e observando o horário de funcionamento do LACEN; Manter um termômetro dentro da estufa e registrar diariamente a temperatura; Retirar o tubo de ágar chocolate da estufa somente no momento de enviar ao LACEN; Abrir a jarra de anaerobiose, rosquear a tampa do tubo, acender a vela e fechar a jarra; 51
52 Tomar o cuidado de manter o tubo semeado sempre na posição vertical dentro da jarra (para não quebrar e/ ou derramar) O transporte da cultura deve ser feito à temperatura ambiente. LÁTEX: Conservar um dos frascos estéreis para coleta do líquor in natura no congelador devidamente vedado até o momento do envio ao LACEN; O transporte para envio do frasco com LCR para látex deve ser feito em caixa térmica com gelox. HEMOCULTURA: Deixar o frasco para hemocultura adquirir a temperatura ambiente antes de inocular o sangue; Identificar o frasco com o nome completo do paciente e a data da punção; Fazer assepsia da tampa do frasco com álcool a 70% e deixar secar, sem retirar o lacre de metal, antes de inocular o sangue; Garrotear o braço do paciente e selecionar uma veia adequada; Limpar o local que será feita a punção com algodão ou gaze esterilizada contendo álcool a 70%; Afrouxar o garrote temporariamente; Aplicar uma solução de iodo PVP-I a partir do local da punção; Remover o iodo residual do braço do paciente utilizando álcool a 70%; Preparar os frascos de hemocultura. Apertar o garrote; Colher a amostra com seringa e agulha descartáveis e transferir para o frasco ou tubo apropriado, sem trocar a agulha; Homogeneizar por inversão; Incubar o frasco em estufa à (35 +/- 2ºC); BACTERISCOPIA: Em amostras de líquor turvos ou sanguinolentos, pode-se realizar o esfregaço sem a necessidade de centrifugação. Para líquor moderadamente turvo ou límpido, recomenda-se centrifugar a r.p.m/5 minutos, fazer um esfregaço satisfatório com o sedimento (deixar secar e fixar rapidamente a chama), filtrar os corantes, principalmente o cristalvioleta, antes de iniciar a coloração. 52
53 QUIMIOCITOLÓGICO: Realizar o exame o mais rápido possível; O líquor utilizado para as determinações da proteína total, glicose e cloretos deve estar isento de células ou hemácias, as determinações devem ser realizadas, após a centrifugação do líquor a r.p.m. durante 5 minutos; Informar os resultados ao LACEN através da ficha de encaminhamento de amostras ENVIAR AO LACEN A lâmina corada positiva ou negativa, resultado encontrado, devidamente informado na ficha de encaminhamento de amostras suspeitas de meningite; A lâmina sem corar com o esfregaço devidamente confeccionado; O frasco para hemocultura à temperatura ambiente; (nem sempre solicitado) O tubo com meio de cultura ágar chocolate semeado em jarra de anaerobiose à temperatura ambiente; LCR in natura para látex em caixa de isopor com gelox; Ficha de encaminhamento com o laudo dos exames e informações sobre o paciente ROTAVIRUS a) Metodologia - ELISA - Enzima Imunoensaio b) Material: 5 a 10 ml / 5 gramas / 1 colher de chá de fezes in natura c) Amostra Biológica: fezes in natura d) Período ideal para coleta: Amostras devem ser coletadas até 8 dias de sintomas e) Orientação para coleta de amostra Coletar em coletores universais com tampa rosqueada, limpos e secos (sem conservantes). Identificar com nome completo. Acondicionar em saco plástico. Figura 30 - Coletor Universal 53
54 f) Conservação da amostra até o envio e acondicionamento para transporte Conservação para envio: Armazenar em geladeira (2ºC e 8ºC) ou em freezer a -20º C até 3 (três), até o envio ao LACEN Transportar em caixa de isopor com gelo reciclável; enviar ofício e requisição do GAL e notificação. g) Critérios de rejeição de amostras Temperatura Ambiente (Com mais de 12 horas de coleta) Amostras coletadas após 8 dias de inicio de sintomas. Identificação incorreta Amostra insuficiente Amostra coletada com conservante Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra RUBÉOLA E SARAMPO a) Exame: Sorologia IgM e IgG b) Metodologia: Enzima Imunoensaio ELISA c) Material: 2 ml de soro d) Amostra Biológica: Soro e) Volume Ideal: 2 ml f) Período ideal para coleta: O soro no primeiro atendimento do paciente ou, no máximo, em até 28 dias após o aparecimento do exantema. g) Orientação para coleta de amostra: Soro De preferência soro colhido em jejum de 8 h, para minimizar fenômeno com lipêmia após a separação do soro por centrifugação transferir o soro para uma eppendorf mantendo refrigerado. h) Conservação da amostra até o envio e acondicionamento para transporte Conservar o Soro até o envio em geladeira de (2ºC a 8ºC) até 02 (dois) dias 48 horas após este período em freezer 20 C. Enviar amostra junto com a ficha epidemiológica e requisição do Gal. 54
55 i) Critérios de rejeição de amostras Amostra fora da temperatura Amostra com menos de 1 ml Amostra desacompanhada da ficha de requisição do GAL, e ficha de notificação Amostra hiperlipêmicas ou hemolisadas Amostra com identificação incorreta Amostra fora do período de coleta Amostra enviada com mais de trinta dias de coleta Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra Rubéola e Sarampo Isolamento Viral NOTA: as amostras para isolamento viral e PCR somente serão coletadas quando orientado pela Vigilância Epidemiológica Estadual. a) Exame Isolamento viral b) Material: Urina e Secreção Nasofaringe ou Sangue Total c) Período ideal para coleta: até o 5 (quinto) dia a partir do aparecimento do exantema, preferencialmente nos primeiros três dias. Excepcionalmente, em casos com IgM positivo, este período poderá ser atendido. d) Orientação para coleta, conservação da amostra até o envio e acondicionamento para transporte. Urina: Coletar de 15 a 100 ml de urina, em frasco estéril, de preferência a primeira urina da manhã após higiene íntima desprezando o primeiro jato, logo após a coleta colocar a urina em caixa de isopor com gelo reciclável e enviar ao LACEN dentro de 24 a 48 horas, no máximo para evitar que o crescimento de bactérias diminua a possibilidade de isolamento do vírus, a urina não deve ser congelada. Secreção nasofaringe: Coletar 03 amostras de swab, uma amostra de cada narina e uma da garganta, com uso de fricção para obter as células de mucosa, uma vez que o vírus está estreitamente associado as células. Colocar os 03 swabs em um tubo contendo 3ml de meio de transporte viral (Earle, Dulbecco, Salina, etc.) meio este que é fornecido pelo LACEN. Após a coleta podem os tubos podem ser conservado em geladeira por 24 a 48 horas. Não devem ser 55
56 congelados, enviar em gelo reciclável ao LACEN.. Enviar amostra junto com a ficha epidemiológica e requisição do GAL. Obs: Exame para Isolamento viral o Material é encaminhado para Fio Cruz - Rio de Janeiro, para diagnostico. O meio de transporte é fornecido pelo LACEN 7.14 TUBERCULOSE Baciloscopia, Cultura e Teste de Sensibilidade Para Volume, Transporte e Conservação e Tipo de Amostra ver Anexo I e J (Pag. 82 e 83) Enviar ofício e ficha de requisição do GAL, anexar a ficha de investigação epidemiológica contendo todos os dados do paciente. a) Critérios de rejeição de amostras Temperatura Ambiente (exceto para o sangue) Identificação incorreta Dados da amostra incompatível com a requisição Acondicionamento inadequado da Amostra Em qualquer dos casos citados acima é preciso solicitar nova coleta de amostra. OBSERVAÇÔES PARA COLETA DE ESCARRO E SANGUE TOTAL a) Escarro A amostra deve ser coletada pelo próprio paciente; Em local aberto; De preferência ao ar livre ou em sala bem arejada. Veja: Anexo K pag. 84 (Orientações para coleta de escarro 1ª amostra) Anexo L pag. 85 (Orientações para coleta de escarro 2ª amostra) b) Sangue Total Coletar de 4 a 10 ml de sangue venoso em tubo com anticoagulante: em crianças muito pequenas, quando não for possível colher o volume indicado, colher no mínimo 3 ml. 56
57 Logo após a coleta, colocar o tubo com o sangue em caixa de isopor com gelo reciclável e enviar ao LACEN, em 24 horas, no máximo; não congelar o sangue coletado. E não coletar com EDTA. Veja o Anexo J pag Coleta recomendada pelo Ministério da Saúde: Duas amostras, a) ESCARRO PARA BACILOSCOPIA E ESCARRO PARA CULTURA A primeira amostra no momento da consulta médica; A segunda amostra no dia posterior, ao despertar; em jejum; e após enxágüe bucal com água. b) COLETA DE ESCARRO POR INDUÇÃO: É feita após a realização de nebulização com solução hipertônica a 3% durante no mínimo 5 e no máximo 20 minutos. A nebulização fluidifica a secreção no pulmão e provoca uma irritação que leva à tosse e facilita a expulsão do escarro. E esse procedimento deve ser acompanhado por pessoal treinado e em unidade de saúde equipada. c) LAVADO GÁSTRICO: Requer hospitalização. Colher ao acordar, em jejum. Utilizar carbonato de sódio 1mg/ml ao lavado para neutralizar o suco gástrico. Este método é indicado para crianças, pois essas deglutem o escarro. Deve-se colher pelo menos duas amostras em dias consecutivos, em recipiente limpo. d) LAVADO E ASPIRADO BRÔNQUICO (traqueobrônquico bronco alveolar).: São colhidos por pessoal médico. e) URINA: Colher toda a urina da primeira micção da manhã; em frasco limpo; de boca larga (de 300 a 500ml); após higiene íntima com água e sabão. Utiliza-se um número mínimo de três e máximo de seis amostras colhidas em dias consecutivos. f) LÍQUIDOS ASSÉPTICOS (Líquor, líquidos Pleural, Ascítico, Sinovial, Pericárdico, Peritoneal): Esses materiais são colhidos assepticamente por pessoal médico, no maior volume possível, e colocados em frascos estéreis. 57
58 g) AMOSTRA DE RESSECÇÃO, BIÓPSIA: Esses materiais são colhidos assepticamente por pessoal médico, em frasco com água destilada ou salina fisiológica estéril. Não utilizar formol. Em caso de pleuris o fragmento de pleura deve ser colhido sempre que possível, pois apresenta positividade em cultura notoriamente superior ao líquido pleural. h) PUS: Esse material, quando proveniente de cavidade fechada, é colhido através de punção, por pessoal médico e deve ser colocado em recipiente estéril e transportado adequadamente até o laboratório. Quando o material é de cavidade aberta geralmente é colhido através de swab e este deve ser imerso em água destilada ou salina fisiológica, em tubo estéril. i) SANGUE: Esse material deve ser colhido assepticamente com anticoagulante(heparina e não EDTA) em volume de 2 a 5 ml. Em criança quando não for possível colher o volume indicado, colher no mínimo 3 ml. Enviar em temperatura ambiente, não refrigerado. j) TECIDO UTERINO: é indicada a biópsia de endométrio. l) FEZES: Indicada a biópsia do intestino. NOTA: Proteger as amostras de luz solar e acondicioná-las de forma adequada para que não haja risco de derramamento; Quanto mais rápido a amostra chegar ao laboratório, maior a possibilidade de isolamento do micobacterium tuberculoses. Embalar as amostras em saco plástico individual; Nunca acondicionar formulários no mesmo recipiente que as amostras. Uma amostra Pulmonar, a) ESCARRO e/ou LAVADO BRÔNQUICO PARA TESTE RÁPIDO MOLECULAR PARA TUBERCULOSE (TRM-TB); Quanto aos procedimentos de coleta e envio de material biológico, seguir as orientações anteriormente descritas para escarro e lavado brônquico. O TRM-TB poderá ser utilizado em amostras de adultos e crianças; sendo necessário o envio entre 3 a 5 ml para realização deste ensaio laboratorial. NOTA: - Limitações do ensaio: Quanto mais salivar for à amostra, reduzirá as chances de detecção para Mycobacterium tuberculosis; A Presença excessiva de sangue 58
59 poderá interferir no teste; O TRM-TB não detecta Micobactérias não causadoras de tuberculoses ( MNTs) - O TRM-TB não poderá ser utilizado para controle de tratamento; neste caso a amostra deverá ser submetido a baciloscopia; - O Teste Rápido Molecular para Tuberculose (TRM-TB) não substituirá a Baciloscopia (técnica em Ziehl-Neelsen) ENTEROINFECÇÕES Coprocultura Geral a) Material: SWAB FECAL/SWAB RETAL b) Coleta Orientar o paciente para colher as fezes em um recipiente limpo e seco; Com o auxílio do swab, transferir uma porção das fezes (preferencialmente partes com muco e/ou sanguinolenta) de aproximadamente o tamanho de um caroço de azeitona (se for líquida embeber bem o swab) e introduzir no Cary&Blair sem deixar sobras na superfície; Pacientes seriamente debilitados podem ter a coleta feita através de um swab retal: Umedecer o swab em soro fisiológico estéril; Introduzir na ampola retal comprimindo-o em movimentos rotatórios suaves, em toda a extensão da ampola retal; Inocular em meio de transporte. Caso não possua meio de transporte, coletar as fezes em frasco estéril e enviar ao laboratório até 1 (uma) hora após a coleta não refrigerar a amostra; No caso de recém-natos e crianças pequenas que usem fraldas, a amostra deverá ser imediatamente transferida da fralda para o Cary& Blair assim que a criança evacuar amostras contaminadas com urina prejudicam a análise. Não utilizar. Todas as amostras devem ser apropriadamente rotuladas, identificadas e acompanhadas de informações clínicas, epidemiológicas e transportadas para o laboratório; 59
60 Envolver os espécimes clínicos em sacos plásticos ou papel no interior da caixa isotérmica (isopor) Manter as fichas contendo as informações clínicas e/ou epidemiológicas à parte das amostras. Figura: 31- Meio de transporte semi-sólido Cary & Blair c) Conservação: Conservar em temperatura ambiente, caso a temperatura ambiente esteja acima de 30 C conservar em caixa isotérmica com gelo reciclável. Encaminhar ao LACEN em até 72 horas; Caso não seja possível encaminhar ao LACEN em até 72 horas, conservar a amostra sob refrigeração (4 a 8ºC) e encaminhar ao LACEN em até 06 dias. d) Transporte Unidade de Saúde/Hospital para o LACEN: Transportar sob refrigeração em caixa isotérmica com gelo reciclável caso a temperatura esteja superior a 30ºC ou se o tempo de coleta exceder 72 horas. e) Critérios de rejeição de amostras Amostra de fezes coletada em swab sem meio de transporte; 60
61 Amostra coletada em swab com meio de transporte, mas mantido em temperatura ambiente por tempo superior a 72 horas. Amostra coletada em swab com meio de transporte, mas encaminhada ao LACEN tempo superior a 07 dias. RECOMENDAÇÕES: Coletar a amostra preferencialmente na fase aguda e antes do início do tratamento com antibiótico; As amostras para coprocultura deverão vir acompanhadas da ficha de remessa e da ficha de Notificação e Investigação Protocolo Para Coleta de Espécimes Fecais para Análise de Vibrio Cholerae Cólera a) COLETA DE SWAB FECAL/ SWAB RETAL As fezes devem ser colhidas antes da administração de antibióticos ao paciente; Recolher preferencialmente de 3 a 5 gramas de fezes, diarréicas ou não, em recipiente de boca larga, limpos e/ou esterilizados (não utilizar substâncias químicas); Evitar recolher amostras fecais contidas nas roupas do paciente, na superfície de camas ou no chão; Swab Fecal: Passar o swab nas fezes (procurar partes com muco e/ sanguinolenta) com movimentos rotatórios por alguns segundos. Retirar o swab e introduzir imediatamente no tubo contendo o meio de transporte semi-sólido (Cary&Blair). Identificar o tubo com nome completo. Acondicionar em saco plástico. Swab retal: Introduzir o swab além do esfíncter anal, realizar movimentos rotatórios suaves por alguns segundos. Esse procedimento é realizado, normalmente, por uma equipe médica. Retirar o swab e introduzir imediatamente no meio de transporte semi-sólido (Cary&Blair). Identificar o tubo com nome completo. Acondicionar em saco plástico. 61
62 Recomenda-se a coleta de 2 a 3 amostras por paciente, desde que haja disponibilidade suficiente de material para coleta e capacidade de processamento laboratorial de todas as amostras encaminhadas. Figura: 32 - Meio de transporte semi-sólido Cary&Blair Coleta de Amostras para Investigação de Indivíduos Assintomáticos Provenientes de Áreas com Circulação de Vibrio Cholerae Segundo a OPAS/OMS, a eliminação do Vibrio cholerae é intermitente, portanto, é necessário a coleta de 03 amostras em dias consecutivos. O indivíduo que obtiver pelo menos uma coprocultura positiva para Vibrio cholerae será considerado portador assintomático; Passar o swab nas fezes recém coletadas (procurar partes com muco e/ sanguinolenta) com movimentos rotatórios por alguns segundos. Retirar o swab e introduzir imediatamente no tubo contendo o meio de transporte semi-sólido (Cary&Blair). Identificar o tubo com nome completo. Acondicionar em saco plástico a) Conservação Conservar as amostras sob refrigeração (4 a 8ºC) e encaminhar ao LACEN imediatamente após a terceira coleta. b) Transporte Unidade de Saúde/Hospital para o LACEN: Transportar sob refrigeração em caixa isotérmica com gelo reciclável. 62
63 7.16- COLINESTERASE a) Exame: Fotométrico Cinético b) Amostra Biológica: Soro c) Tubo de coleta: com anticoagulante Heparina ou EDTA (para análise plasmática e/ou eritrocitária) ; com gel separador ou tubo seco (para somente análise plasmática)* d) Volume Ideal: 3 ml de sangue total com anticoagulante (para análise plasmática e/ou eritrocitária) ou 1 ml de soro (para somente análise plasmática). e) Orientação para coleta de amostra: Necessário jejum de no mínimo de 4 horas f) Conservação da amostra até o envio e acondicionamento para transporte Conservar a amostra até o envio em geladeira de (2ºC a 8ºC) ou conservá-la refrigerada por no máximo 5 dias. Transportar em caixa de isopor com gelo reciclável; enviar ofício e requisição do GAL, enviar o formulário de requisição de protocolo para colinesterase sanguínea devidamente preenchida com todas as informações necessárias. OBS: Protocolo de requisição em anexo g) Critérios de rejeição de amostras Amostra apresentando vazamento; Amostra com Identificação incorreta; Amostra sem protocolo de requisição; Amostra em temperatura ambiente; Amostra hemolisada SÍFILIS a) Exame FTA- ABS Imunofluorescência Indireta VDRL Floculação b) Material: Soro c) Volume Ideal: 2ml d) Período ideal para coleta: Não especificado. e) Orientação para coleta de amostra Recomenda-se jejum prévio, para minimizar fenômenos como lipemia. f) Conservação da amostra até o envio e acondicionamento para transporte 63
64 Conservar a amostra até o envio em geladeira de (2ºC a 8ºC) até 05 (cinco) dias. Após este período, manter a amostra em freezer 20 C Transportar em caixa de isopor com gelo reciclável; enviar ofício e requisição do GAL. g) Critérios de rejeição de amostras Amostra apresentando vazamento Amostra com Identificação incorreta Amostra em temperatura ambiente Amostra hemolisada/ lipêmica Amostra com volume inferior EXAMES MICÓLOGICOS Nota: Demonstração do fungo no material examinado pela microscopia e cultura Procedimento para Coleta Aspirado Gástrico, Aspirado Traqueal e Broncoscopia: Aspirar o maior volume possível (acima de 2ml) de suco gástrico, através de sonda nasogástrica pela manhã, em jejum. O material colhido deve ser colocado em recipiente estéril. Procedimento realizado por médico treinado Escarro: Coletar em pote plástico transparente, de boca larga e com tampa de rosca. O volume ideal é de 2 a 5 ml, proveniente da árvore brônquica. A coleta deve ocorrer logo após o despertar pela manhã e o paciente deve ser orientado a lavar bem a boca antes de produzir a amostra. Não deve conter saliva. Fezes: Coletar em frasco estéril, sem conservantes ou fixadores; Fragmentos de tecidos (biópsias), secreções ganglionares e nódulos: são coletados assepticamente por pessoal médico, em frascos com água destilada (ou solução salina) estéril. Não utilize conservantes ou fixadores. 64
65 Lesão de nariz e Seios Paranasais: Coletar secreção, material necrótico ou tecido obtido por biópsia em frascos com água destilada (ou solução salina) estéril. Não utilize conservantes ou fixadores. Líquidos Corporais (pleural, ascítico, pericárdico, sinovial): Fazer assepsia rigorosa no local da punção. Coletar o maior volume possível (acima de 2ml) de líquido em recipiente estéril. Liquor: Fazer assepsia rigorosa no local da punção. Coletar 1 ml ou mais, por punção lombar, assepticamente, para exame microscópico e cultura para fungos. Entretanto, a coleta da amostra em tubos específicos para cada um desses exames, aumenta a sensibilidade do exame micológico e, por isso, deve ser recomendada. Material de Micose Ocular: O melhor método para recuperação de fungos, requer raspado de córnea, aspiração de líquido intra-ocular ou biópsia. A coleta com auxílio de swab estéril não é indicada em local de drenagem. O material colhido deve ser colocado em recipiente estéril. Procedimento realizado por médico treinado. Mucosa Oral e Orofaringe: Coletar, com swab estéril, o material de lesão de mucosa oral, papilas linguais ou região tonsilar. Mergulhar o swab estéril umedecido em salina estéril, em frasco estéril, e enviar o tubo ao laboratório. Pus e Material de Abscesso: Devem ser colhidos de preferência, por aspiração, de abscesso fechado, com seringa e agulha estéril. Se a lesão for aberta, limpar o local, com gaze esterilizada embebida em salina estéril, para eliminar os exsudatos superficiais que são altamente, contaminados com bactérias. A seguir colher o material com swab estéril. Mergulhar o swab estéril umedecido em salina estéril e enviar o tubo ao laboratório.o teto das vesículas (pele que cobre as vesículas) deve ser retirado com pinça. Sangue e Aspirado de Medula Óssea: Fazer assepsia rigorosa no local da punção e coletar cerca de 5 a 6ml de sangue venoso, que deverá ser injetado diretamente em frasco contendo meio de cultura que são incubados em 65
66 sistemas semi-automatizados ou automatizados.. A última gota de material deve ser distendida em uma lâmina de microscopia, para coloração de Giemsa.. Secreção Vaginal: Com auxílio de especulo, coletar o material da lesão ou do fundo de saco vaginal com swab estéril.. Mergulhar o swab umedecido em salina estéril e enviar o tubo ao laboratório. Urina: A amostra biológica mais apropriada para o diagnóstico de micose do trato urinário é obtida por sondagem ou citoscopia. Quando não for possível e para evitar contaminação com microrganismo presentes nas áreas vizinhas, fazer higiene íntima com água e sabão. Desprezar o primeiro jato de urina da manhã, e colher 3 a 5 ml de urina em tubo de ensaio estéril. Coleções de 24 horas não têm valor para diagnostico micológico. Recomendações Gerais para Coleta e Transporte de Amostras Sempre que possível, coletar amostras antes do início da terapia específica. A amostra deve ser identificada com o nome do paciente, número de registro do GAL, tipo de amostra e data da coleta. Coletar a amostra biológica com assepsia e colocar-la em recipiente estéril e vedado sempre em quantidade suficiente para permitir todos os procedimentos laboratoriais necessários. Os swabs usados para coleta de material de ouvido, nasofaringe e orofaringe, secreção vaginal e lesões abertas, devem ser colocados em tubos contendo salina estéril para o transporte, de modo a evitar a dessecação da amostra. A requisição médica que acompanha a amostra deve conter, sempre que possível as hipóteses diagnósticas que auxiliarão o micologista na escolha da coloração e do meio de cultura mais adequado para o isolamento do agente etiológico. 66
67 Os materiais ditos contaminados, tais como urina, pus, secreções de feridas ou trato respiratório, devem ser enviados em gelo ao laboratório, o mais rápido possível. Liquor, sangue e medula óssea devem ser mantidos à temperatura ambiente e encaminhados com urgência ao laboratório para processamento imediato. Sangue e material de punção de medula óssea são os únicos materiais biológicos que devem ser semeados diretamente, em frascos contendo meio de cultura que são incubados em sistemas semi-automatizados ou automatizados de modo a evitar coagulação e conseqüente diminuição da sensibilidade do exame. Em pacientes imunodeprimidos ou muito debilitado o estudo de mesmo tipo de amostra biológica, coletada em 2 ou 3 dias consecutivas, é importante para a interpretação correta de resultados positivos para fungos considerados como saprófitas, ou seja, contaminantes do meio ambiente, ou mesmo, constituinte da microbiota normal do paciente. Nestes pacientes, os fungos saprófitas podem se tornar oportunistas e comportarem-se como patógeno Transporte do Material Coletado ao LACEN Material biológico Aspirado traqueal Escarro, Fezes Fragmentos de tecidos (biópsias) Lavado Gástrico, Bronquico Líquido pleural, peritoneal, sinovial, ascítico e pericárdico Urina Líquido Cefalorraquidiano ou líquor (LRC) Medula óssea Sangue Transporte Transportar sob refrigeração, entre 2ºC a 8º C, em até 24 horas após a coleta. Transportar em temperatura ambiente, em frasco bem fechado, imediatamente, após a coleta 67
68 COQUELUCHE Nota: A coqueluche também conhecida como tosse comprida é uma doença imunoprevinível causada pela Bordetella pertussis, compromete especificamente o trato respiratório e se caracteriza por paroxismos de tosse seca, geralmente afebril ou com febre baixa. Em crianças de até 6 meses, além da tosse paroxística pode cursar com vômitos, apnéia, cianose e parada respiratória. Nos adultos a única manifestação clínica pode ser a tosse persistente, nem sempre característica. A coqueluche ocorre de forma endêmica mas pode se disseminar e se apresentar na forma de surtos, com a possibilidade de complicação e de mortes Coleta de Secreção Nasofaringe para Coqueluche Realizar preferencialmente na fase aguda da doença; Realizar antes do início do tratamento com antimicrobiano ou, no máximo, até três dias após instituição; Utilizar swab fino com haste flexível, estéril e alginatado; Retirar os tubos com meio de transporte da geladeira e deixá-los atingir a temperatura ambiente antes de usá-lo; Coletar o material de uma narina; Utilizar um tubo de ensaio com meio de transporte específico (Regan-Lowe), com antibiótico; Identificar o tubo com o nome e idade, indicando se é caso suspeito ou comunicante, bem como a data e horário da coleta; Introduzir o swab na narina até encontrar resistência na parede posterior da nasofaringe; Manter o swab em contato com a nasofaringe por cerca de 10 segundos e, em seguida, retirá-lo; 68
69 Após a coleta, estriar o swab na superfície levemente inclinada do tubo (+2cm) e, a seguir, introduzir na base do meio de transporte e perfurar todo o meio (Cortar excesso da haste com tesoura antes de fechar o tubo). Atenção O swab deve permanecer dentro do respectivo tubo Transporte de Amostra Coletado ao LACEN O material deverá ser encaminhado ao laboratório imediatamente após a coleta, sob refrigeração de 4ºC em caixa de isopor (Não congelar). Cada espécime clínico deverá ser acompanhado da ficha de encaminhamento de amostra ou de cópia da ficha de investigação epidemiológica da coqueluche, conforme definição no âmbito estadual. Se a opção for a ficha de investigação epidemiológica, deve-se anotar se o material (swab com secreção nasofaríngea) é do caso suspeito ou de comunicante. Na impossibilidade do envio imediato após a coleta, incubar em estufa bacteriológica com umidade (chumaço de algodão úmido) à temperatura de 35ºC a 37ºC por um período máximo de 48 horas. Encaminhar, em seguida, sob refrigeração (4ºC) em caixa de isopor. Atenção Os tubos com meio de transporte que não forem utilizados no mesmo dia devem ser mantidos na geladeira até o momento da coleta. Verificar sempre, o prazo de validade do meio de transporte antes de utilizá-lo Estabelecer com o laboratório uma rotina referente ao envio de amostras (horário e local de entrega de material), fluxo de resultados e avaliação periódica da qualidade das amostras enviadas, bem como outras questões pertinentes. 69
70 Figura: 33 - Coleta de material do nariz 8 - AMOSTRAS EMCAMINHADAS PARA REFERÊNCIAS Arboviroses Botulismo Agravo Exames Material Biológico e Transporte para o Envio Inibição da Hemaglutinação, Isolamento Viral CULTURA Soro, Sangue total congelado; (Congelado) Swab de lesões profundas; (Temperatura Ambiente) Soro; Fezes (2 C a 8 C) Referência IEC PA IAL-SP Brucelose Soroaglutinação Soro (2 C a 8 C) LSPA-TO Carbúnculo (antraz) CULTURA Líquido de Vesículas e Pústulas; Crosta de Lesões; (2 C a 8 C) FIOCRUZ-RJ Chagas Agudo IFI- IgM e IgG Soro (2 C a 8 C) FUNED-MG Chagas PCR PCR Plasma (Congelado) Hemaglutinação indireta Cisticercose (HGI), Fixação de Complemento (FC), Imunofluorescência Soro (2 C a 8 C) Indireta (IFI), Elisa e Imunoblot Citomegalovírus PCR Soro e Urina (2 C a 8 C) Coxiela Febre Q PCR Plasma (2 C a 8 C) FUNED-MG IAL-SP IEC - PA FIOCRUZ-RJ 70
71 Agravo Exames Material Biológico e Temperatura para o Envio Líquor Líquido Céfalo Raquidiano Imunoblot (WB); (LCR) (Congelado) Referência USP/ HOSPITAL DAS CLÍNICAS Doença de Creusztfeld Jacob-dcj Enteroparasitoses Oportunistas Febre Tifoide Sequenciamento Genético (SANGUE) (HPLC) Neuropatológicos Imunohistoquímica (Tecidos Cerebrais) Centrifugação e Extração pelo Formol Éter Modificado, Coloração Auramina, Coloração Ziehl Nieelsen Cultura Sangue com Anticoagulante (EDTA) (2 C a 8 C) Tecido Cerebral (Em Formol a10%.) Tecido Cerebral (Em Bloco de Parafina) Fezes in natura (2 C a 8 C) Fezes Coleta no SWAB -Com Meio 03 Amostras Consecutivas (Temperatura Ambiente) INSTITUTO LUDWIG - SP UFRJ /-RJ LABORATÓRIO DE PATOLOGIA IAL-SP FIOCRUZ-RJ Granuloma Ocular Histopatológico Biopsia Ocular (Em Formol a10%.) FIOCRUZ-RJ Influenza H1N1 (Kit Fornecido pelo LACEN) Genotipagem para HIV PCR em Tempo Real e Isolamento Ampliação por PCR Purificação por PAGE- Seqüenciamento do Genoma Aspirado Nasofaringe ou Swab Nasal/Oral Combinado-(2 C a 8 C) até o LACEN Plasma (Congelado) IAL-SP LACEN-DF 71
72 Agravo Exames Material Biológico e Temperatura para o Envio Referência Hantavírus ELISA IgM e IgG Soro (2 C a 8 C) Leishmaniose Tegumentar Leishmaniose Canina Contra- Prova Leishmaniose Visceral Humana Leptospirose Micoses Sistêmicas: Paracoccidioidomicoses, Histoplasmose, Coccidiodes, Aspergilose Histopatológico ELISA e IFI Cultura Celular Aglutinação para leptospira (microaglutinação) Imunodifusão Radial Dupla Biopsia de lesões cutâneas (Formol a 10%.) Soro (2 C a 8 C) Punção de Medula óssea (2 C a 8 C) Soro- 2 C a 8 C Soro (2 C a 8 C) IEC-PA FIOCRUZ-RJ FUNED-MG Núcleo de Medicina Tropical UNB-DF IEC-PA FIOCRUZ-RJ Mononucleose(Epstein Barr) ELISA IGM Soro (2 C a 8 C) IEC-PA Oncocercose ELISA- IgG Soro ( 2 C a 8 C) Fezes in natura Paralisia flácida aguda Isolamento Viral (2 C a 8 C) até o LACEN Parvovírus ELISA IgG e IgM Soro (2 C a 8 C) Psitacose IFI Soro (2 C a 8 C) Raiva Canina- Cérebro IFD, Isolamento Viral Cérebro (Congelado) Raiva Humana Titulação Microtécnica de de Soroneutralização em Anticorpos/neutralizantes Cultivo Celular Soro (2 C a 8 C) Rotavírus Genotipagem Fezes in natura (2 C a 8 C) Swab com secreção Rubéola Isolamento Viral Nasofaringe e Swab com secreção Orofaringe ou Urina- (2 C a 8 C) Swab com secreção Sarampo Isolamento Viral Nasofaringe e Orofaringe em meio L15 Fornecido pelo LACEN (2 C a 8 C) Instituto de Medicina Tropical - SP IEC PA IEC-PA USP-SP CCZ - DF Instituto PASTEUR FIOCRUZ-RJ FIOCRUZ-RJ FIOCRUZ-RJ 72
73 Agravo Ex ames Material Biológico e Temperatura para o Envio Referência Toxocaríase ELISA-IgG Soro (2 C a 8 C) CCZ-SP Tuberculose Teste de Sensibilização Escarro de Expectoração; Lavado Gástrico; Lavado Brônquico; Urina; Líquor, Líquido Pleural; Líquido Ascítico; Líquido sinovial; Líquido Pericárdico; Líquido Peritoneal; Material de ressecção- Biópsia; Pus; Sangue. Centro de Referência Professor Hélio Fragas - RJ Varíola Bovina - Humana Isolamento Viral em Cultivo Celular (Temperatura Ambiente) Líquido de Vesículas ; Crosta de Lesões; Coleta em SWAB com meio de Cultura, Fornecido pelo LACEN,Fezes (2 C a 8 C) FIOCRUZ-RJ Varicela ELISA Soro (2 C a 8 C) IEC-PA Vísceras (Cérebro, Rins, Fígado, Coração, Pulmão)- Formol. Vísceras (Cérebro, Rins, Fígado, Coração, Pulmão) Congeladas. Histopatológico Isolamento Viral Vísceras (Cérebro, Rins, Fígado, Coração, Pulmão) em Formol a 10%. Vísceras (Cérebro, Rins, Fígado, Coração, Pulmão) - Congeladas. IEC-PA IEC-PA 9 - CONTROLE DE QUALIDADE O controle de qualidade dos exames de baciloscopia se realiza mediante um procedimento de supervisão técnica indireta, que consiste na releitura de uma amostra representativa não selecionada, das lâminas de baciloscopia realizadas na rotina dos laboratórios que realizam esta técnica. Para efetuar este procedimento, os laboratórios devem seguir as seguintes instruções: 73
74 9.1 - Formas de Conservação Depois da leitura, retirar o excesso de óleo de imersão emborcando a lamina sobre papel absorvente, sem prejudicar o esfregaço, acondicionar as laminas na caixa porta lamina etiquetadas com as iniciais do paciente e número de ordem e data da coleta Envio de Lâminas Enviar as lâminas na caixa porta - laminas ou tuites, juntamente com o formulário Relação de Lâminas do Controle de Qualidade com as iniciais do paciente, número de ordem, município, laboratório, mês/ano de referência, número de laminas enviadas, positivas e negativas, sempre anexando a cópia do livro a este formulário EXAMES PARA CONTROLE DE QUALIDADE Hanseníase Material: Linfa Forma de coleta: Paciente com lesão: colher no Lóbulo da Orelha Direita (LOD), no Lóbulo da Orelha Esquerda (LOE), no Cotovelo Direito (CD) e na lesão. Paciente sem lesão, colher do Cotovelo Esquerdo (CE). Seleção de lâminas: Selecionar 100% das lâminas positivas e 100% das negativas; Leishmaniose Tegumentar Material: Linfa Forma de coleta: Comprimir a lesão para não sangrar. Seleção de lâminas: Selecionar 100% das lâminas positivas e 100% das negativas; Malária e Chagas Material: Sangue Forma de coleta: Punção da parte lateral do segundo ou terceiro dedo esquerdo, lóbulo da orelha ou em lactentes o dedo grande do pé ou o calcanhar. Seleção de lâminas: Selecionar 100% das lâminas positivas e 100% das negativas; 74
75 9.3.4 Tuberculose Material: Escarro Forma de coleta: Colher de 5 a 10 ml de amostra de escarro obtida após esforço de tosse, sendo duas amostras: a primeira, no momento da consulta médica e a segunda, no dia posterior, ao despertar;em jejum e após enxágüe bucal com água. Seleção de lâminas: Selecionar 100% das lâminas positivas e 100% das negativas; Meningites a) Exame Bacterioscópico Fazer 02 esfregaços, fixá-los e identificá-los; Proceder à coloração de um deles fazendo leitura e interpretação; Remeter ao LACEN:a lâmina sem corar; a lâmina corada e o resultado obtido. b) Diagnóstico pela Cultura Enviar ao laboratório hierárquicamente superior as cepas isoladas para confirmação e sua identificação; Laboratório hierárquicamente superior remeter cepas desconhecidas para sua identificação (AEQ) RECOMENDAÇÕES IMPORTANTES: Não desprezar as lâminas de bacterioscopias de LCR antes de completar o diagnóstico final. Guardá-las para serem enviadas ao Controle de Qualidade. Não desprezar os LCR antes do diagnóstico final. Estocá-los em freezer a 20º C para Controle de Qualidade da reação e reagentes da CIE e látex ROTEIRO E AVALIAÇÃO DO CONTROLE DE QUALIDADE LABORATORIAL Para participar do Controle de Qualidade Laboratorial para Agravos de Saúde Pública, oferecidos pelo LACEN, segundo a instrução Normativa Nº 005 de 28/06/04 da Secretaria de Estado da Saúde, todos os laboratórios que realizam estes exames deverão cumprir os critérios CRITÉRIOS PARA PARTICIPAÇÃO 75
76 Realizar estes exames. Ser cadastrado com o LACEN. Enviar todas as lâminas dos exames realizados, mensalmente, até o 5º dia útil de cada mês, acompanhada de cópia do livro de registro das baciloscopias referente ao mês e ofício em duas vias CRITÉRIOS PARA AVALIAÇÃO: As análises das lâminas são feitas por meio de sorteio de 10 a 100% das negativas dependendo da demanda do laboratório e 100% das positivas, onde sã analisada os seguintes parâmetros da técnica da baciloscopia: coleta, preparo da lamina, coloração, leitura e liberação do resultado; Envio de lâminas todos os meses do ano vigente ou caso o laboratório não tenha realizado exame naquele mês, envio da notificação negativa do referido mês. Obtenção de 90 a 100% de concordância de resultado. É aceitável uma margem de até 10% entre discordâncias e insatisfatórios BENEFÍCIOS: Cumprimento da Portaria Estadual; Recebimento de certificado com relatório de avaliação gratuito; É uma forma de monitorar a qualidade dos exames do seu laboratório como também divulgação e marketing de sua empresa; 76
77 ANEXOS ANEXO A LACEN-TO - (LABORATÓRIO CENTRAL DE SAÚDE PÚBLICA DO ESTADO DO TOCANTINS) ENDEREÇO: LABORATÓRIO CENTRAL DE SAÚDE PÚBLICA 601 Sul, Av. LO 15, Conj. 02, Lote 01, Plano Diretor Sul, CEP lacen@saude.to.gov.br Fone (63) Fax (63) LABORATÓRIO DE SAÚDE PÚBLICA DE ARAGUAÍNA Rua G esquina com a F, nº10, Setor rodoviário, CEP , Araguaína-TO. Fone/Fax: (63) LACEN-TO conta também com os Laboratórios de Referencia Macrorregional e Centros de Referência Nacional no diagnóstico dos agravos de Saúde Pública não realizados no Estado. CONTATOS: Recepção (63) Responsável pelo o Setor de Ações Operacionais: Dianay (63) Responsável pelo o Setor de Recebimento de Amostras Biológicas: Mary Lângela (63) Responsável pelo o Setor de Recebimento de Amostras Ambientais e Produtos: Elke Sandra (63)
78 ANEXO B 78
79 ANEXO C 79
80 ANEXO D 80
81 ANEXO E 81
82 ANEXO F 82
83 SECRETARIA DA SAÚDE DO ESTADO DO TOCANTINS Laboratório Central de Saúde Pública 601 Sul, Av. LO 15 Conj 02 Lt 01 Plano Diretor Sul CEP Fone (63) fax (63) Palmas Tocantins ANEXO G Requisição: Avaliação de anticorpos anti-rábicos em amostras de soros humanos 1. Requisitante Unidade: DIR: Cidade: Estado: Fone( ) Fax: ( ) 2. Identificação da amostra Tipo: ( ) Sangue ( ) Soro ( ) Liquor Data da coleta: / / 3.Identificação do paciente Nome: RG: Data de nascimento / / Sexo: ( ) Masculino ( ) Feminino Portador de doença crônica: ( ) Não ( ) Sim Qual? Faz uso contínuo de medicação: ( ) Não ( ) Sim Qual? Exerce atividade com risco de exposição à raiva? ( ) Não ( ) Sim Qual? Sofreu acidente com risco de exposição à raiva: ( ) Não ( ) Sim Em qual cidade/estado? 4. Motivo da solicitação do exame ( ) Primeira sorologia após conclusão de esquema pré-exposição ( ) Sorologia de controle periódico (esquema pré-exposição) ( ) Sorologia após reforço recente ( ) Sorologia, após acidente, de paciente já submetido a esquema pós- exposição ( ) Sorologia, após acidente, de paciente já submetido a esquema pré-exposição ( ) Sorologia de paciente suspeito de raiva 5. Histórico das vacinações contra a Raiva: 1ª VACINAÇÃO: Data / / Esquema: ( ) Pré-exposição ( ) Pós-exposição Via de administração: ( ) Intramuscular ( ) Intradérmica Número de doses: Fez uso de soro: ( ) Sim ( ) Não Tipo de vacina: ( ) Fuenzalida&Palácios ( ) Cultivo Celular (VERO, HDCV) REVACINAÇÃO: Data / / Esquema: ( ) Pré-exposição ( ) Pós-exposição Via de administração: ( ) Intramuscular ( ) Intradérmica Número de doses: Tipo de vacina: ( ) Fuenzalida&Palácios ( ) Cultivo Celular (VERO, HDCV) OBS Responsável pela solicitação (Assinatura e carimbo) 83
84 ANEXO H 84
85 ANEXO I 85
86 ANEXO J 86
87 ANEXO K 87
88 ANEXO L 88
89 ANEXO M 89
Hematologia Clínica. Anticoagulantes e venopunção.
 Aula nº 01 Anticoagulantes e venopunção. Turma: Biomedicina Laboratório: Hematologia Clínica Hematologia Clínica Anticoagulantes e venopunção. Amostras Considera-se material biológico (amostra), líquidos,
Aula nº 01 Anticoagulantes e venopunção. Turma: Biomedicina Laboratório: Hematologia Clínica Hematologia Clínica Anticoagulantes e venopunção. Amostras Considera-se material biológico (amostra), líquidos,
PERGUNTAS E RESPOSTAS SOBRE INFLUENZA A(H1N1)
 PERGUNTAS E RESPOSTAS SOBRE INFLUENZA A(H1N1) P1 QUAIS OS CUIDADOS DE BIOSSEGURANÇA NA RECEPÇÃO / ATENÇÃO AO PACIENTE COM QUEIXA E SINTOMATOLOGIA DE INFLUENZA A(H1N1), NO DOMICÍLIO, NA UNIDADE BÁSICA DE
PERGUNTAS E RESPOSTAS SOBRE INFLUENZA A(H1N1) P1 QUAIS OS CUIDADOS DE BIOSSEGURANÇA NA RECEPÇÃO / ATENÇÃO AO PACIENTE COM QUEIXA E SINTOMATOLOGIA DE INFLUENZA A(H1N1), NO DOMICÍLIO, NA UNIDADE BÁSICA DE
AUXILIAR DE LABORATÓRIO
 UFF UNIVERSIDADE FEDERAL FLUMINENSE CCM CENTRO DE CIÊNCIAS MÉDICAS HUAP HOSPITAL UNIVERSITÁRIO ANTONIO PEDRO AUXILIAR DE LABORATÓRIO Parte I: Múltipla Escolha 01 Assinale a opção com o equipamento freqüentemente
UFF UNIVERSIDADE FEDERAL FLUMINENSE CCM CENTRO DE CIÊNCIAS MÉDICAS HUAP HOSPITAL UNIVERSITÁRIO ANTONIO PEDRO AUXILIAR DE LABORATÓRIO Parte I: Múltipla Escolha 01 Assinale a opção com o equipamento freqüentemente
MANIPULAÇÃO DE QUIMIOTERÁPICOS
 MANIPULAÇÃO DE QUIMIOTERÁPICOS ANTINEOPLÁSICOS SÃO POTENCIALMENTE: Mutagênicos Carcinogênicos Teratogênicos Fetotóxicos Esterilizantes RISCOS OCUPACIONAIS Exposição aguda: Retirada de solução do frasco-ampola
MANIPULAÇÃO DE QUIMIOTERÁPICOS ANTINEOPLÁSICOS SÃO POTENCIALMENTE: Mutagênicos Carcinogênicos Teratogênicos Fetotóxicos Esterilizantes RISCOS OCUPACIONAIS Exposição aguda: Retirada de solução do frasco-ampola
Introdução à patologia. Profª. Thais de A. Almeida 06/05/13
 Introdução à patologia Profª. Thais de A. Almeida 06/05/13 Patologia Definição: Pathos: doença. Logos: estudo. Estudo das alterações estruturais e funcionais nas células, tecidos e órgãos visando explicar
Introdução à patologia Profª. Thais de A. Almeida 06/05/13 Patologia Definição: Pathos: doença. Logos: estudo. Estudo das alterações estruturais e funcionais nas células, tecidos e órgãos visando explicar
DOENÇA DE CHAGAS AGUDA
 DOENÇA DE CHAGAS AGUDA CID 10: B57 CARACTERISTICAS GERAIS DESCRIÇÃO Doença infecciosa, causada por protozoário flagelado, de curso clínico crônico, que se caracteriza por fase inicial aguda, com sinais
DOENÇA DE CHAGAS AGUDA CID 10: B57 CARACTERISTICAS GERAIS DESCRIÇÃO Doença infecciosa, causada por protozoário flagelado, de curso clínico crônico, que se caracteriza por fase inicial aguda, com sinais
MANUAL COLHEITA E REMESSA DE MATERIAL
 MANUAL COLHEITA E REMESSA DE MATERIAL CITOPATOLOGIA O exame citológico oferece inúmeras vantagens, sendo atualmente um método que auxilia o médico veterinário no diagnóstico, prognóstico e procedimentos
MANUAL COLHEITA E REMESSA DE MATERIAL CITOPATOLOGIA O exame citológico oferece inúmeras vantagens, sendo atualmente um método que auxilia o médico veterinário no diagnóstico, prognóstico e procedimentos
PROCEDIMENTO OPERACIONAL PADRÃO
 Nº: 45/2014 Data de emissão: Março/2014 Setor Tipo TAREFA Executante Resultados esperados Recursos necessários PROCEDIMENTO OPERACIONAL PADRÃO Revisão: 01 Data revisão: Centros de Saúde Assistencial COLETA
Nº: 45/2014 Data de emissão: Março/2014 Setor Tipo TAREFA Executante Resultados esperados Recursos necessários PROCEDIMENTO OPERACIONAL PADRÃO Revisão: 01 Data revisão: Centros de Saúde Assistencial COLETA
Guia Sanitário de Navios de Cruzeiro - Alterações
 Guia Sanitário de Navios de Cruzeiro - Alterações Salvador, 26 de setembro de 2013 Noemi Melo Cabral Especialista em Regulação e VISA Coordenação de Saúde do Viajante COSVI/GIMTV/GGPAF Motivações Alguns
Guia Sanitário de Navios de Cruzeiro - Alterações Salvador, 26 de setembro de 2013 Noemi Melo Cabral Especialista em Regulação e VISA Coordenação de Saúde do Viajante COSVI/GIMTV/GGPAF Motivações Alguns
INFORME EBOLA (10/10/2014)
 INFORME EBOLA (10/10/2014) O vírus Ebola foi identificado pela primeira vez em 1976, no Zaire (atual República Democrática do Congo), e, desde então foi responsável por alguns surtos, restritos a algumas
INFORME EBOLA (10/10/2014) O vírus Ebola foi identificado pela primeira vez em 1976, no Zaire (atual República Democrática do Congo), e, desde então foi responsável por alguns surtos, restritos a algumas
PROTOCOLO LABORATORIAL PARA DIAGNÓSTICO DA TUBERCULOSE - Teste Rápido (PCR em tempo real), Cultura, Teste de Sensibilidade e Baciloscopia.
 PROTOCOLO LABORATORIAL PARA DIAGNÓSTICO DA TUBERCULOSE - Teste Rápido (PCR em tempo real), Cultura, Teste de Sensibilidade e Baciloscopia. QUANTO A SOLICITAÇÃO DO EXAME - Para todo sintomático respiratório
PROTOCOLO LABORATORIAL PARA DIAGNÓSTICO DA TUBERCULOSE - Teste Rápido (PCR em tempo real), Cultura, Teste de Sensibilidade e Baciloscopia. QUANTO A SOLICITAÇÃO DO EXAME - Para todo sintomático respiratório
1ª RETIFICAÇÃO PREGÃO SRP Nº 105 2013 - CPL 04 - FUNDHACRE OBJETO: AQUISIÇÃO DE TUBOS DE COLETA DE SANGUE A VÁCUO
 1ª RETIFICAÇÃO PREGÃO SRP Nº 105 2013 - CPL 04 - FUNDHACRE OBJETO: AQUISIÇÃO DE TUBOS DE COLETA DE SANGUE A VÁCUO A PREGOEIRA DA COMISSÃO PERMANENTE DE LICITAÇÃO CPL 04 comunica aos interessados que o
1ª RETIFICAÇÃO PREGÃO SRP Nº 105 2013 - CPL 04 - FUNDHACRE OBJETO: AQUISIÇÃO DE TUBOS DE COLETA DE SANGUE A VÁCUO A PREGOEIRA DA COMISSÃO PERMANENTE DE LICITAÇÃO CPL 04 comunica aos interessados que o
Medidas de Prevenção da Transmissão Nosocomial do Vírus da Gripe Aviária (GA)
 Serviço de Doenças Infecciosas Medidas de Prevenção da Transmissão Nosocomial do Vírus da Gripe Aviária (GA) Filomena Coelho Medidas de Gerais de Prevenção da Transmissão Nosocomial (GA) Vacinação (V.
Serviço de Doenças Infecciosas Medidas de Prevenção da Transmissão Nosocomial do Vírus da Gripe Aviária (GA) Filomena Coelho Medidas de Gerais de Prevenção da Transmissão Nosocomial (GA) Vacinação (V.
GUIA PARA A REALIZAÇÃO DE ESTUDOS DE ESTABILIDADE DE PRODUTOS SANEANTES
 GUIA PARA A REALIZAÇÃO DE ESTUDOS DE ESTABILIDADE DE PRODUTOS SANEANTES A estabilidade de produtos saneantes depende de fatores ambientais como temperatura, umidade e luz, e de outros inerentes ao produto
GUIA PARA A REALIZAÇÃO DE ESTUDOS DE ESTABILIDADE DE PRODUTOS SANEANTES A estabilidade de produtos saneantes depende de fatores ambientais como temperatura, umidade e luz, e de outros inerentes ao produto
Coleta de Sangue Veterinária
 Coleta de Sangue Veterinária Animais de Pequeno, Médio e Grande Porte Produtos BD www.grupoalfalab.com Tel: (21) 2557-4590 contato@grupoalfalab.com (21) 2205-6847 Animais de Pequeno Porte Cuidado com a
Coleta de Sangue Veterinária Animais de Pequeno, Médio e Grande Porte Produtos BD www.grupoalfalab.com Tel: (21) 2557-4590 contato@grupoalfalab.com (21) 2205-6847 Animais de Pequeno Porte Cuidado com a
Gabriela Sousa de Araújo Gerência Técnica
 1/69 ELABORADO POR: Ronaldo Costa Coordenação de Patologia Clínica REVISADO POR: Gabriela Sousa de Araújo Gerência Técnica APROVADO POR: Symonara Karina M. Faustino Diretora Data: / / SUMÁRIO APRESENTAÇÃO...
1/69 ELABORADO POR: Ronaldo Costa Coordenação de Patologia Clínica REVISADO POR: Gabriela Sousa de Araújo Gerência Técnica APROVADO POR: Symonara Karina M. Faustino Diretora Data: / / SUMÁRIO APRESENTAÇÃO...
MÓDULO IV SEGURANÇA NA UTILIZAÇÃO DE PRODUTOS FITOFARMACÊUTICOS
 Programa de formação sobre a aplicação de MÓDULO IV SEGURANÇA NA UTILIZAÇÃO DE PRODUTOS FITOFARMACÊUTICOS TEMA 1 ASPECTOS TOXICOLÓGICOS DA APLICAÇÃO DE PRODUTOS FITOFARMACÊTICOS TENDO EM CONSIDERAÇÃO A
Programa de formação sobre a aplicação de MÓDULO IV SEGURANÇA NA UTILIZAÇÃO DE PRODUTOS FITOFARMACÊUTICOS TEMA 1 ASPECTOS TOXICOLÓGICOS DA APLICAÇÃO DE PRODUTOS FITOFARMACÊTICOS TENDO EM CONSIDERAÇÃO A
Orientações sobre o Manejo de Resíduos Perigosos no HC/UFTM
 APRESENTAÇÃO ccih@he.uftm.edu.br Tel: 34 3318-5261 Orientações sobre o Manejo de Resíduos Perigosos no HC/UFTM Uberaba, 2012 Esta cartilha tem como objetivo levar informações imprescindíveis sobre o Plano
APRESENTAÇÃO ccih@he.uftm.edu.br Tel: 34 3318-5261 Orientações sobre o Manejo de Resíduos Perigosos no HC/UFTM Uberaba, 2012 Esta cartilha tem como objetivo levar informações imprescindíveis sobre o Plano
COLETA DE ASPIRADO TRAQUEAL FISIOTERAPIA
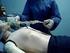 1- OBJETIVO Padronizar o procedimento de coleta de secreção brônquica através de aspirado traqueal. 2- ABRANGÊNCIA Centro de Tratamento Intensivo Adulto (CTI), Unidade de Cuidados Especiais (UCE), Emergência
1- OBJETIVO Padronizar o procedimento de coleta de secreção brônquica através de aspirado traqueal. 2- ABRANGÊNCIA Centro de Tratamento Intensivo Adulto (CTI), Unidade de Cuidados Especiais (UCE), Emergência
Nome do produto: MC Injekt 2300 PLUS (A) FISPQ nº: 1057 Data da última revisão: 02/04/2007
 Página 1 de 5 1. Identificação do produto e da empresa - Nome do produto: MC Injekt 2300 PLUS (Parte A) - Código interno do produto: 1057/ 1118/ 1146 - Nome da empresa: MC-Bauchemie Brasil Indústria e
Página 1 de 5 1. Identificação do produto e da empresa - Nome do produto: MC Injekt 2300 PLUS (Parte A) - Código interno do produto: 1057/ 1118/ 1146 - Nome da empresa: MC-Bauchemie Brasil Indústria e
Febre amarela. Alceu Bisetto Júnior. Divisão de Doenças Transmitidas por Vetores
 Febre amarela Alceu Bisetto Júnior Divisão de Doenças Transmitidas por Vetores Agente etiológico - Virus amarilico, arbovirus do gênero Flavivirus e família Flaviviridae. E um RNA virus. Vetores/reservatórios
Febre amarela Alceu Bisetto Júnior Divisão de Doenças Transmitidas por Vetores Agente etiológico - Virus amarilico, arbovirus do gênero Flavivirus e família Flaviviridae. E um RNA virus. Vetores/reservatórios
DIVISÃO DE LABORATÓRIO CENTRAL HC FMUSP PARAMETRIZAÇÃO DE COLETA
 Cultura Antraz (Carbúnculo) Material suspeito Conforme orientações do Laboratório de Referência. Conforme orientações do Laboratório de Referência. 20 dias Sorologia ELISA Arboviroses (Chinkungunya e outros)
Cultura Antraz (Carbúnculo) Material suspeito Conforme orientações do Laboratório de Referência. Conforme orientações do Laboratório de Referência. 20 dias Sorologia ELISA Arboviroses (Chinkungunya e outros)
Colheita de produtos biológicos destinados à investigação laboratorial virológica
 Infecção pelo novo vírus da gripe A(H1N1) Período de Alerta Pandémico Colheita de produtos biológicos destinados à investigação laboratorial virológica 1. Condições de segurança Os produtos biológicos
Infecção pelo novo vírus da gripe A(H1N1) Período de Alerta Pandémico Colheita de produtos biológicos destinados à investigação laboratorial virológica 1. Condições de segurança Os produtos biológicos
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS - FISPQ
 FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS - FISPQ SEÇÃO 1: IDENTIFICAÇÃO DA EMPRESA E DO PRODUTO Produto: Empresa: OIA MULTI-USO OFFICER OFFICER INDÚSTRIA QUíMICA LTDA R.Senador Giovanni Agnelli,
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS - FISPQ SEÇÃO 1: IDENTIFICAÇÃO DA EMPRESA E DO PRODUTO Produto: Empresa: OIA MULTI-USO OFFICER OFFICER INDÚSTRIA QUíMICA LTDA R.Senador Giovanni Agnelli,
Serviço de Edição e Informação Técnico-Científica/abril 2012 SISTEMA DE INFORMAÇÃO DO CÂNCER (SISCAN)
 Serviço de Edição e Informação Técnico-Científica/abril 2012 SISTEMA DE INFORMAÇÃO DO CÂNCER (SISCAN) 1 O que é a versão web SISCAN? É a versão em plataforma web que integra os Sistemas de Informação do
Serviço de Edição e Informação Técnico-Científica/abril 2012 SISTEMA DE INFORMAÇÃO DO CÂNCER (SISCAN) 1 O que é a versão web SISCAN? É a versão em plataforma web que integra os Sistemas de Informação do
NORMAS DE SEGURANÇA EM LABORATÓRIO
 NORMAS DE SEGURANÇA EM LABORATÓRIO 1. INTRODUÇÃO Toda e qualquer atividade prática a ser desenvolvida dentro de um laboratório apresenta riscos e estão propensas a acidentes. Devemos então utilizar normas
NORMAS DE SEGURANÇA EM LABORATÓRIO 1. INTRODUÇÃO Toda e qualquer atividade prática a ser desenvolvida dentro de um laboratório apresenta riscos e estão propensas a acidentes. Devemos então utilizar normas
Serviço Público Federal CONCURSO PÚBLICO 2014 INSTRUÇÕES GERAIS. Nº do doc. de identificação (RG, CNH etc.): Assinatura do(a) candidato(a):
 Serviço Público Federal UNIVERSIDADE FEDERAL DE ALAGOAS CONCURSO PÚBLICO 2014 PROVA TIPO 1 Cargo de Nível Médio: Código: 09 Técnico de Laboratório HABILIDADES E COMPETÊNCIAS EM ENFERMAGEM 2014 Universidade
Serviço Público Federal UNIVERSIDADE FEDERAL DE ALAGOAS CONCURSO PÚBLICO 2014 PROVA TIPO 1 Cargo de Nível Médio: Código: 09 Técnico de Laboratório HABILIDADES E COMPETÊNCIAS EM ENFERMAGEM 2014 Universidade
Capacitação para a realização do teste rápido Alere para diagnóstico sorológico da leishmaniose visceral canina (LVC)
 Capacitação para a realização do teste rápido Alere para diagnóstico sorológico da leishmaniose visceral canina (LVC) Leishmaniose Visceral Epidemiologia Cerca de 400 mil novos casos por ano no mundo.
Capacitação para a realização do teste rápido Alere para diagnóstico sorológico da leishmaniose visceral canina (LVC) Leishmaniose Visceral Epidemiologia Cerca de 400 mil novos casos por ano no mundo.
9/19/2013. Marília Peres. Marília Peres
 1 2 1 Vias de entrada no organismo Produtos químicos perigosos Efeitos toxicológicos da exposição a produtos químicos Incompatibilidades entre produtos químicos Informação sobre perigos químicos 3 Inalação
1 2 1 Vias de entrada no organismo Produtos químicos perigosos Efeitos toxicológicos da exposição a produtos químicos Incompatibilidades entre produtos químicos Informação sobre perigos químicos 3 Inalação
01 de 05. FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTO QUÍMICO Data da última revisão: 23/03/2013 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA
 FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTO QUÍMICO Data da última revisão: 23/03/2013 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Tinta Carimbo. CARACTERÍSTICA: Tinta TC 42 ml nas cores: Azul, preta, vermelha,
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTO QUÍMICO Data da última revisão: 23/03/2013 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Tinta Carimbo. CARACTERÍSTICA: Tinta TC 42 ml nas cores: Azul, preta, vermelha,
Sumário ANEXO I COMUNICADO HERMES PARDINI
 Sumário ANEXO I COMUNICADO HERMES PARDINI Conteúdo FOSFATIDILSERINA, ANTICORPOS IgM, IgG e IgA ALTERAÇÃO DE LAYOUT... 2 TESTE DO PEZINHO ESTENDIDO - INCLUSÃO DE EXAME... 3 TEMPO DE TROMBINA - ALTERAÇÕES
Sumário ANEXO I COMUNICADO HERMES PARDINI Conteúdo FOSFATIDILSERINA, ANTICORPOS IgM, IgG e IgA ALTERAÇÃO DE LAYOUT... 2 TESTE DO PEZINHO ESTENDIDO - INCLUSÃO DE EXAME... 3 TEMPO DE TROMBINA - ALTERAÇÕES
PREVENÇÃO E CONTROLE DE INFECÇÃO DO TRATO URINÁRIO
 Comissão de controle de infecção hospitalar PREVENÇÃO E CONTROLE DE INFECÇÃO DO TRATO URINÁRIO Eva Cláudia Venâncio de Senne Luciana Paiva Patrícia Borges Peixoto EPIDEMIOLOGIA Trato urinário representa
Comissão de controle de infecção hospitalar PREVENÇÃO E CONTROLE DE INFECÇÃO DO TRATO URINÁRIO Eva Cláudia Venâncio de Senne Luciana Paiva Patrícia Borges Peixoto EPIDEMIOLOGIA Trato urinário representa
COLETA DE EFLUENTES E ÁGUAS GERAIS
 Página 1 de 5 1 1. DESCRIÇÃO E CUIDADOS : A técnica a ser adotada para a coleta de amostras depende da matriz a ser amostrada, do tipo de amostra a ser analisada e da natureza do ensaio solicitado. Porém,
Página 1 de 5 1 1. DESCRIÇÃO E CUIDADOS : A técnica a ser adotada para a coleta de amostras depende da matriz a ser amostrada, do tipo de amostra a ser analisada e da natureza do ensaio solicitado. Porém,
NOTA TÉCNICA DVS/DVE/SESACRE Nº 09/2009 INFLUENZA A (H1N1)
 Governo do Estado do Acre Secretaria de Estado de Saúde Departamento de Vigilância em Saúde Divisão de Vigilância Epidemiológica Av. Antônio da Rocha Viana, nº 1294, Bairro Vila Ivonete E-mail: vgepidem.dabs@ac.gov.br
Governo do Estado do Acre Secretaria de Estado de Saúde Departamento de Vigilância em Saúde Divisão de Vigilância Epidemiológica Av. Antônio da Rocha Viana, nº 1294, Bairro Vila Ivonete E-mail: vgepidem.dabs@ac.gov.br
Consultório On-line. Tudo o que você precisa em um só lugar.
 1) ACESSO AO SISTEMA Digite o endereço www.unimedbh.com.br/consultorio em qualquer computador com acesso à internet. Preencha os campos com o seu usuário e a senha. Para o login, digite as letras ADM,
1) ACESSO AO SISTEMA Digite o endereço www.unimedbh.com.br/consultorio em qualquer computador com acesso à internet. Preencha os campos com o seu usuário e a senha. Para o login, digite as letras ADM,
SABÃO LIQUIDO SANDOMIS Detergente para lavar roupas
 Página 1 de 5 FICHA DE INFORMAÇÃO DE SEGURANÇA DE PRODUTOS QUÍMICOS SABÃO LIQUIDO SANDOMIS Detergente para lavar roupas 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Produto: Nome Comercial: Empresa: Detergente
Página 1 de 5 FICHA DE INFORMAÇÃO DE SEGURANÇA DE PRODUTOS QUÍMICOS SABÃO LIQUIDO SANDOMIS Detergente para lavar roupas 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Produto: Nome Comercial: Empresa: Detergente
DESINFETANTE. Mistura de substância tensoativas e bactericidas.
 Pag. 1 de 5 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome Comercial do Produto : Identificação da Empresa: VALÊNCIA IND. E COMÉRCIO DE MATERIAIS DE LIMPEZA LTDA. Telefone FAX: (11) 2967-7070 e-mail: valencialimp@uol.com.br
Pag. 1 de 5 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome Comercial do Produto : Identificação da Empresa: VALÊNCIA IND. E COMÉRCIO DE MATERIAIS DE LIMPEZA LTDA. Telefone FAX: (11) 2967-7070 e-mail: valencialimp@uol.com.br
Doença infecto-contagiosa, mais comum do Sistema Nervoso Central, causadas por bactérias, fungos e vírus.
 Doença infecto-contagiosa, mais comum do Sistema Nervoso Central, causadas por bactérias, fungos e vírus. Inflamação das meninges membranas que recobrem e protegem o sistema nervoso central (cérebro e
Doença infecto-contagiosa, mais comum do Sistema Nervoso Central, causadas por bactérias, fungos e vírus. Inflamação das meninges membranas que recobrem e protegem o sistema nervoso central (cérebro e
FISPQ (Ficha de Informações de Segurança de Produtos Químicos)
 Página 1 de 6 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA: Nome: Água Sanitária Lavandina Código interno: 09500 (1L) / 19281 (2L) / 19280 (5L) Empresa: BOMBRIL S/A Endereço: Marginal Direita da Via Anchieta
Página 1 de 6 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA: Nome: Água Sanitária Lavandina Código interno: 09500 (1L) / 19281 (2L) / 19280 (5L) Empresa: BOMBRIL S/A Endereço: Marginal Direita da Via Anchieta
RioCard Saúde Presente
 Sumário 1) Acesso ao Sistema... 2 1.1) Esqueci minha senha... 2 1.2) Alteração de Senha... 3 1.3) Seleção de Perfil de Acesso e Local de Atendimento... 3 2) Home... 5 3) Menu Cadastro... 5 3.1) Cadastrar
Sumário 1) Acesso ao Sistema... 2 1.1) Esqueci minha senha... 2 1.2) Alteração de Senha... 3 1.3) Seleção de Perfil de Acesso e Local de Atendimento... 3 2) Home... 5 3) Menu Cadastro... 5 3.1) Cadastrar
NORMAS INTERNAS DA UTILIZAÇÃO DO LABORATÓRIO DE MICROBIOLOGIA DO CÂMPUS DE AQUIDAUANA - UFMS/CPAq
 Serviço Público Federal Ministério da Educação Fundação Universidade Federal de Mato Grosso do Sul NORMAS INTERNAS DA UTILIZAÇÃO DO LABORATÓRIO DE MICROBIOLOGIA DO CÂMPUS DE AQUIDAUANA - UFMS/CPAq Define
Serviço Público Federal Ministério da Educação Fundação Universidade Federal de Mato Grosso do Sul NORMAS INTERNAS DA UTILIZAÇÃO DO LABORATÓRIO DE MICROBIOLOGIA DO CÂMPUS DE AQUIDAUANA - UFMS/CPAq Define
SEGURANÇA EM LABORATÓRIO
 SEGURANÇA EM LABORATÓRIO Débora Cristina Kranzfeld Diretoria de Segurança do Trabalho Instituto de Química Unicamp Telefone 3521-3015 Bloco B Sala 126 contato: dstma@iqm.unicamp.br ou csetica@iqm.unicamp.br
SEGURANÇA EM LABORATÓRIO Débora Cristina Kranzfeld Diretoria de Segurança do Trabalho Instituto de Química Unicamp Telefone 3521-3015 Bloco B Sala 126 contato: dstma@iqm.unicamp.br ou csetica@iqm.unicamp.br
Aula 03 - Equipamentos de proteção individual - EPI
 Equipamentos de Proteção Individual EPI O que são EPIs Os Equipamentos de Proteção Individual EPI são considerados elementos de contenção primária ou barreiras primárias e podem reduzir ou eliminar a exposição
Equipamentos de Proteção Individual EPI O que são EPIs Os Equipamentos de Proteção Individual EPI são considerados elementos de contenção primária ou barreiras primárias e podem reduzir ou eliminar a exposição
PROCEDIMENTO OPERACIONAL PADRÃO POP ASSUNTO: Coleta de Sangue para Exames Laboratoriais
 1 de 5 1- Situação de Revisão: Situação Data Alteração 0.0 06/09/2010 Validação 2- Referência: 01 CCIH Higienização das Mãos 40 DE-EP Punção de Acesso Venoso Periférico 3- Em que consiste? Consiste na
1 de 5 1- Situação de Revisão: Situação Data Alteração 0.0 06/09/2010 Validação 2- Referência: 01 CCIH Higienização das Mãos 40 DE-EP Punção de Acesso Venoso Periférico 3- Em que consiste? Consiste na
1. Orientações gerais
 ESTADO DE SANTA CATARINA SISTEMA ÚNICO DE SAÚDE SECRETARIA DE ESTADO DA SAÚDE SUPERINTENDENCIA DE VIGILÂNCIA EM SAÚDE DIRETORIA DE VIGILÂNCIA EPIDEMIOLÓGICA HOSPITAL NEREU RAMOS HOSPITAL REGIONAL DR. HOMERO
ESTADO DE SANTA CATARINA SISTEMA ÚNICO DE SAÚDE SECRETARIA DE ESTADO DA SAÚDE SUPERINTENDENCIA DE VIGILÂNCIA EM SAÚDE DIRETORIA DE VIGILÂNCIA EPIDEMIOLÓGICA HOSPITAL NEREU RAMOS HOSPITAL REGIONAL DR. HOMERO
Equipamentos de aplicação o de agrotóxicos. Luiz Antonio Palladini EPAGRI/Estação Experimental de Caçador
 Equipamentos de aplicação o de agrotóxicos Luiz Antonio Palladini EPAGRI/Estação Experimental de Caçador Proceder à manutenção periódica, e uma calibração anual no início do ciclo; os operadores devem
Equipamentos de aplicação o de agrotóxicos Luiz Antonio Palladini EPAGRI/Estação Experimental de Caçador Proceder à manutenção periódica, e uma calibração anual no início do ciclo; os operadores devem
da tuberculose, entre outras), fungos, vírus, etc.
 SUPERINTENDÊNCIA DE VIGILÂNCIA EPIDEMIOLÓGICA E AMBIENTAL COORDENAÇÃO DE EPIDEMIOLOGIA DIVISÃO DE TRANSMISSÍVEIS E IMUNOPREVENÍVEIS GERÊNCIA DE DOENÇAS IMUNOPREVENÍVEIS E DE TRANSMISSÃO RESPIRATÓRIA MENINGITE
SUPERINTENDÊNCIA DE VIGILÂNCIA EPIDEMIOLÓGICA E AMBIENTAL COORDENAÇÃO DE EPIDEMIOLOGIA DIVISÃO DE TRANSMISSÍVEIS E IMUNOPREVENÍVEIS GERÊNCIA DE DOENÇAS IMUNOPREVENÍVEIS E DE TRANSMISSÃO RESPIRATÓRIA MENINGITE
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS
 Página: 1/5 1- Identificação do produto e da empresa - Nome do produto: FOSFATO DE POTÁSSIO MONOBÁSICO ANIDRO - Código interno de identificação do produto: F1030 - Nome da empresa: Labsynth Produtos para
Página: 1/5 1- Identificação do produto e da empresa - Nome do produto: FOSFATO DE POTÁSSIO MONOBÁSICO ANIDRO - Código interno de identificação do produto: F1030 - Nome da empresa: Labsynth Produtos para
Augusto de Lima, 1715, Belo Horizonte, Minas Gerais. 1 Laboratório de Pesquisas Clínicas, Centro de Pesquisas René Rachou, Fundação Oswaldo Cruz. Av.
 Estudo da implantação e estimativa de custo direto de testes diagnósticos para Leishmaniose Visceral Humana em Ribeirão das Neves, Minas Gerais, Brasil Tália Machado de Assis; Paloma Nogueira Guimarães;
Estudo da implantação e estimativa de custo direto de testes diagnósticos para Leishmaniose Visceral Humana em Ribeirão das Neves, Minas Gerais, Brasil Tália Machado de Assis; Paloma Nogueira Guimarães;
Ficha de Informações de Segurança de Produtos Químicos - FISPQ
 Nome da Empresa: Guimarães Produtos Químicos e de Limpeza Ltda Telefones da Empresa: Fone: (48) 3623-1175 Fax: (48) 3623-0041 e-mail: guimaraespl@terra.com.br Ficha de Informações de Segurança de Produtos
Nome da Empresa: Guimarães Produtos Químicos e de Limpeza Ltda Telefones da Empresa: Fone: (48) 3623-1175 Fax: (48) 3623-0041 e-mail: guimaraespl@terra.com.br Ficha de Informações de Segurança de Produtos
Ficha de Informações de Segurança de Produto Químico Conforme NBR14725, de julho/2005 e 1907/2006/EC
 1 1 Identificação do produto e da empresa Produto : Alfa numérico: ------- Fabricante: Diversey Brasil Indústria Química LTDA Departamento de informações: Rua Nossa Senhora do Socorro, 125 Socorro São
1 1 Identificação do produto e da empresa Produto : Alfa numérico: ------- Fabricante: Diversey Brasil Indústria Química LTDA Departamento de informações: Rua Nossa Senhora do Socorro, 125 Socorro São
CURSO PARA REMETENTES 2011. Módulo VII Perguntas Freqüentes e Ferramentas
 Módulo VII Agosto 2011 Página 2 de 18 Perguntas freqüentes Perguntas freqüentes Página 3 de 18 1. Onde comprar embalagens para expedição? 2. Como se faz a expedição de nitrogênio líquido refrigerado? 3.
Módulo VII Agosto 2011 Página 2 de 18 Perguntas freqüentes Perguntas freqüentes Página 3 de 18 1. Onde comprar embalagens para expedição? 2. Como se faz a expedição de nitrogênio líquido refrigerado? 3.
CAPACITAÇÃO TÉCNICA PARA COLETA DE MATERIAL GENÉTICO EM CARTÃO FTA DURANTE AUDIÊNCIA
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA (UDESC) Laboratório de Análises Genéticas (Lab. DNA UDESC) Programa DNA em Audiência em SC (PRODNASC) CAPACITAÇÃO TÉCNICA PARA COLETA DE MATERIAL GENÉTICO EM CARTÃO
UNIVERSIDADE DO ESTADO DE SANTA CATARINA (UDESC) Laboratório de Análises Genéticas (Lab. DNA UDESC) Programa DNA em Audiência em SC (PRODNASC) CAPACITAÇÃO TÉCNICA PARA COLETA DE MATERIAL GENÉTICO EM CARTÃO
Telefone laboratório Fax Email. Telefone (Chefe laboratório) Pessoal? Trabalho? Contacto Coordenador Regional o Distrital
 - Checklist Pré-Instalação Xpert Parte 1:Perfil laboratório Data da Avaliação/Auditoria Nome(s) e Afiliação do Assessor (es) Nome (s) contacto laboratório Telefone/email Nome laboratório Distrito Região
- Checklist Pré-Instalação Xpert Parte 1:Perfil laboratório Data da Avaliação/Auditoria Nome(s) e Afiliação do Assessor (es) Nome (s) contacto laboratório Telefone/email Nome laboratório Distrito Região
Aprovação: P&D Químico: Adelice F. de Moraes CRQ n o : 004215189. Elaborado: 27/07/2011 Revisão: 00 Página 1 de 6. Elaboração: P&D Solange Hernandes
 Página 1 de 6 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do Produto: Códigos internos: Flor de Lavanda com Avelã (24/500ml): 13005 Flor de Lavanda com Avelã - Refil (24/500ml): 13006 Flor de Lilly com
Página 1 de 6 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do Produto: Códigos internos: Flor de Lavanda com Avelã (24/500ml): 13005 Flor de Lavanda com Avelã - Refil (24/500ml): 13006 Flor de Lilly com
Papel do Laboratório de Microbiologia no Diagnóstico Laboratorial: Orientações para a Prática e
 Papel do Laboratório de Microbiologia no Diagnóstico Laboratorial: Orientações para a Prática e Conduta. QUESTÕES DE PROVAS; CONTEÚDO DAS PRÓXIMAS AULAS; HORÁRIO DE ATENDIMENTO ON-LINE; blog do professor:
Papel do Laboratório de Microbiologia no Diagnóstico Laboratorial: Orientações para a Prática e Conduta. QUESTÕES DE PROVAS; CONTEÚDO DAS PRÓXIMAS AULAS; HORÁRIO DE ATENDIMENTO ON-LINE; blog do professor:
PROCEDIMENTO OPERACIONAL PADRÃO
 Nº: 54/14 Data de emissão: Novembro/2014 Setor Tipo TAREFA Executante PROCEDIMENTO OPERACIONAL PADRÃO 00 Data da revisão: Centro de Saúde Assistencial, Vigilância em Saúde Teste rápido para detecção de
Nº: 54/14 Data de emissão: Novembro/2014 Setor Tipo TAREFA Executante PROCEDIMENTO OPERACIONAL PADRÃO 00 Data da revisão: Centro de Saúde Assistencial, Vigilância em Saúde Teste rápido para detecção de
Orientações Para o Preenchimento do Formulário de Inscrição Preliminar dos Projetos
 Orientações Para o Preenchimento do Formulário de Inscrição Preliminar dos Projetos O presente documento tem como objetivo apresentar as diretrizes e orientar no preenchimento do formulário de inscrição
Orientações Para o Preenchimento do Formulário de Inscrição Preliminar dos Projetos O presente documento tem como objetivo apresentar as diretrizes e orientar no preenchimento do formulário de inscrição
Cateterismo Vesical Intermitente
 Manual de Orientações Cateterismo Vesical Intermitente Educação em Saúde VOL. 15 Cateterismo Vesical Intermitente Manual de Orientações Cristiane Tavares Borges - Enfermeira do Serviço de Enfermagem Cirúrgica
Manual de Orientações Cateterismo Vesical Intermitente Educação em Saúde VOL. 15 Cateterismo Vesical Intermitente Manual de Orientações Cristiane Tavares Borges - Enfermeira do Serviço de Enfermagem Cirúrgica
2. COMPOSIÇÃO E INFORMAÇÕES SOBRE OS INGREDIENTES
 1. IDENTIFICAÇÃO DO PRODUTO E EMPRESA Nome do produto: Ligas de zinco Nome comercial: Zamac 3, Zamac 5, Zamac 8. Código interno de identificação do produto: D001,D002 e D004 Nome da Empresa: Endereço:
1. IDENTIFICAÇÃO DO PRODUTO E EMPRESA Nome do produto: Ligas de zinco Nome comercial: Zamac 3, Zamac 5, Zamac 8. Código interno de identificação do produto: D001,D002 e D004 Nome da Empresa: Endereço:
WIBRALOX SELO VERMELHO
 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do Produto: Wibralox Selo Vermelho Nome da Empresa: Rebarba, Brilhos Ind. Com. de Prod. de Polimento Ltda Fone/Fax: (1) 4043-3151/4043-3202 E-mail: comercial@rebarba.com.br
1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do Produto: Wibralox Selo Vermelho Nome da Empresa: Rebarba, Brilhos Ind. Com. de Prod. de Polimento Ltda Fone/Fax: (1) 4043-3151/4043-3202 E-mail: comercial@rebarba.com.br
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS (FISPQ)
 FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS (FISPQ) Nome do produto: SURGISTAIN FISPQ nº SURG001/16 Pagina 01/06 Data da última revisão: 13/04/2016 1. Identificação do produto e da empresa Nome
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUÍMICOS (FISPQ) Nome do produto: SURGISTAIN FISPQ nº SURG001/16 Pagina 01/06 Data da última revisão: 13/04/2016 1. Identificação do produto e da empresa Nome
Ficha de Informações de Segurança de Produto Químico Conforme NBR14725, de julho/2005 e 1907/2006/EC
 1 1 Identificação do produto e da empresa Produto : Alfa numérico: ------- Fabricante: Diversey Brasil Indústria Química LTDA Departamento de informações: Rua Nossa Senhora do Socorro, 125 Socorro São
1 1 Identificação do produto e da empresa Produto : Alfa numérico: ------- Fabricante: Diversey Brasil Indústria Química LTDA Departamento de informações: Rua Nossa Senhora do Socorro, 125 Socorro São
3) Preencher Ficha de Cadastro da Instituição de Acolhimento. 3.1) Promotoria da Instituição de Acolhimento
 3) Preencher Ficha de Cadastro da Instituição de Acolhimento Para o preenchimento correto das informações referentes à Instituição de Acolhimento que está sendo cadastrada, siga os passos descritos nos
3) Preencher Ficha de Cadastro da Instituição de Acolhimento Para o preenchimento correto das informações referentes à Instituição de Acolhimento que está sendo cadastrada, siga os passos descritos nos
COLETA DE ÁGUAS SUPERFICIAIS
 Página 1 de 7 1 1. DESCRIÇÃO E CUIDADOS GERAIS: A técnica a ser adotada para a coleta de amostras depende da matriz a ser amostrada, do tipo de amostra a ser efetuada e da natureza do ensaio solicitado.
Página 1 de 7 1 1. DESCRIÇÃO E CUIDADOS GERAIS: A técnica a ser adotada para a coleta de amostras depende da matriz a ser amostrada, do tipo de amostra a ser efetuada e da natureza do ensaio solicitado.
Para a Lei 11.788/2008, a jornada de estágio é de, no máximo 6 horas diárias, e semanalmente no mínimo 20 e no máximo 30 horas.
 1. A partir de quando posso estagiar? Alunos dos Cursos Superiores: a partir do segundo período. Alunos dos Cursos Técnicos Integrados: a partir do segundo ano. Alunos dos Cursos Técnicos Subsequentes:
1. A partir de quando posso estagiar? Alunos dos Cursos Superiores: a partir do segundo período. Alunos dos Cursos Técnicos Integrados: a partir do segundo ano. Alunos dos Cursos Técnicos Subsequentes:
INSTRUÇÕES PARA SOLICITAÇÃO DE VISITA TÉCNICA
 INSTRUÇÕES PARA SOLICITAÇÃO DE VISITA TÉCNICA Orientações aos servidores da UTFPR Câmpus Francisco Beltrão com relação aos procedimentos para solicitação de visitas técnicas. O presente documento visa
INSTRUÇÕES PARA SOLICITAÇÃO DE VISITA TÉCNICA Orientações aos servidores da UTFPR Câmpus Francisco Beltrão com relação aos procedimentos para solicitação de visitas técnicas. O presente documento visa
Ministério da Educação UNIVERSIDADE FEDERAL DO PARANÁ Setor de Ciências Biológicas Curso de Fisioterapia
 REGULAMENTO E MANUAL PARA USO DO LABORATÓRIO DO CURSO DE FISIOTERAPIA Aprovado pelo Colegiado do em 23/02/2016 CAPÍTULO I DAS DISPOSIÇÕES PRELIMINARES Art. 1º- O laboratório de ensino do destina-se prioritariamente
REGULAMENTO E MANUAL PARA USO DO LABORATÓRIO DO CURSO DE FISIOTERAPIA Aprovado pelo Colegiado do em 23/02/2016 CAPÍTULO I DAS DISPOSIÇÕES PRELIMINARES Art. 1º- O laboratório de ensino do destina-se prioritariamente
Ficha de informação de segurança de produto químico (FISPQ) LIMPA PEDRAS MALTEX
 01/05 1. IDENTIFICAÇÃO DO PRODUTO E DO DISTRIBUIDOR Nome do produto:. Aplicação: O limpa pedras foi elaborado para a limpeza de pedras e pisos rústicos que possuam sujeiras dos mais diversos tipos, tais
01/05 1. IDENTIFICAÇÃO DO PRODUTO E DO DISTRIBUIDOR Nome do produto:. Aplicação: O limpa pedras foi elaborado para a limpeza de pedras e pisos rústicos que possuam sujeiras dos mais diversos tipos, tais
Determinação de Lipídios em Leite Desidratado pelo Butirômetro de Leite
 Página 1 de 6 1 Escopo Este método tem por objetivo determinar lipídios em leite desidratado integral ou semidesnatado, modificado ou não, usando o butirômetro de leite. 2 Fundamentos Baseia-se no ataque
Página 1 de 6 1 Escopo Este método tem por objetivo determinar lipídios em leite desidratado integral ou semidesnatado, modificado ou não, usando o butirômetro de leite. 2 Fundamentos Baseia-se no ataque
Procedimentos de Gestão da Qualidade Código: PGQ-0026-2. NOME FUNÇÃO ASSINATURA DATA Dr. Ivo Fernandes Sobreiro
 Elaborado por De acordo Versão: 2 Pg.: 1/7 NOME FUNÇÃO ASSINATURA DATA Dr. Ivo Fernandes Sobreiro Gerente da Qualidade 25/11/2014 Dr. Augustos Carrozino Diretor ADM 28/11/2014 Dr. Jose Carlos Aprovado
Elaborado por De acordo Versão: 2 Pg.: 1/7 NOME FUNÇÃO ASSINATURA DATA Dr. Ivo Fernandes Sobreiro Gerente da Qualidade 25/11/2014 Dr. Augustos Carrozino Diretor ADM 28/11/2014 Dr. Jose Carlos Aprovado
MANEJO CLÍNICO DE PACIENTE COM SUSPEITA DE DENGUE
 Guia Prático MANEJO CLÍNICO DE PACIENTE COM SUSPEITA DE DENGUE Estado de São Paulo 2015 Divisão de Dengue e Chikungunya Centro de Vigilância Epidemiológica Prof. Alexandre Vranjac CCD COORDENADORIA DE
Guia Prático MANEJO CLÍNICO DE PACIENTE COM SUSPEITA DE DENGUE Estado de São Paulo 2015 Divisão de Dengue e Chikungunya Centro de Vigilância Epidemiológica Prof. Alexandre Vranjac CCD COORDENADORIA DE
Preparação e administração Vacina BCG do Japan BCG Laboratory
 Preparação e administração Vacina BCG do Japan BCG Laboratory Documento de apoio à Norma nº 001/2016 de 12/02/2016 Vacinação de crianças (
Preparação e administração Vacina BCG do Japan BCG Laboratory Documento de apoio à Norma nº 001/2016 de 12/02/2016 Vacinação de crianças (
COLETA E TRANSPORTE DE AMOSTRAS BIOLÓGICAS
 COLETA E TRANSPORTE DE AMOSTRAS BIOLÓGICAS Dra Maria Salete Sartori Biomédica / Bióloga Supervisora técnica da STLAC Mestrado em Metabolismo e Nutrição Seção Técnica de Laboratório de Análises Clínicas
COLETA E TRANSPORTE DE AMOSTRAS BIOLÓGICAS Dra Maria Salete Sartori Biomédica / Bióloga Supervisora técnica da STLAC Mestrado em Metabolismo e Nutrição Seção Técnica de Laboratório de Análises Clínicas
EQUIPAMENTO DE PROTEÇÃO INDIVIDUAL (EPI)
 EQUIPAMENTO DE PROTEÇÃO INDIVIDUAL (EPI) Débora Cristina Kranzfeld Diretoria de Segurança do Trabalho Instituto de Química Unicamp Telefone 3521-3015 Bloco B Sala 126 contato: dstma@iqm.unicamp.br ou csetica@iqm.unicamp.br
EQUIPAMENTO DE PROTEÇÃO INDIVIDUAL (EPI) Débora Cristina Kranzfeld Diretoria de Segurança do Trabalho Instituto de Química Unicamp Telefone 3521-3015 Bloco B Sala 126 contato: dstma@iqm.unicamp.br ou csetica@iqm.unicamp.br
HEPATITE A. Doença viral aguda. Manifestações clínicas variadas. Fulminante (menos 10% casos) Piora clínica de acordo com idade
 HEPATITES HEPATITE A Doença viral aguda Manifestações clínicas variadas Fulminante (menos 10% casos) Piora clínica de acordo com idade Transcurso da doença apresenta períodos distintos! HEPATITE A Incubação
HEPATITES HEPATITE A Doença viral aguda Manifestações clínicas variadas Fulminante (menos 10% casos) Piora clínica de acordo com idade Transcurso da doença apresenta períodos distintos! HEPATITE A Incubação
FISPQ (Ficha de Informações de Segurança de Produtos Químicos) PALHA DE AÇO ( BRILLO )
 Página 1 de 6 I - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA: Nome: PALHA DE AÇO ( Brillo 00, 0, 1 e 2) Códigos Internos: 2219 (n 00 - Palha Super fina); 2216 (n 0 - Palha Fina); 2217 (n 1 - Palha Média); 2218
Página 1 de 6 I - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA: Nome: PALHA DE AÇO ( Brillo 00, 0, 1 e 2) Códigos Internos: 2219 (n 00 - Palha Super fina); 2216 (n 0 - Palha Fina); 2217 (n 1 - Palha Média); 2218
INFORME TÉCNICO SOBRE A GRIPE CAUSADA PELO VÍRUS INFLUENZA A/H1N1
 INFORME TÉCNICO SOBRE A GRIPE CAUSADA PELO VÍRUS INFLUENZA A/H1N1 As características do vírus da influenza A (H1N1) e seu comportamento nos diversos países, o definem como de altíssima importância para
INFORME TÉCNICO SOBRE A GRIPE CAUSADA PELO VÍRUS INFLUENZA A/H1N1 As características do vírus da influenza A (H1N1) e seu comportamento nos diversos países, o definem como de altíssima importância para
PROCEDIMENTO OPERACIONAL PADRÃO
 Nº: 38/2014 Data de emissão: Março/2014 Setor Tipo TAREFA Executante Resultados esperados Recursos necessários Periodicidade Monitoramento Descrição da Ação PROCEDIMENTO OPERACIONAL PADRÃO Revisão: 01
Nº: 38/2014 Data de emissão: Março/2014 Setor Tipo TAREFA Executante Resultados esperados Recursos necessários Periodicidade Monitoramento Descrição da Ação PROCEDIMENTO OPERACIONAL PADRÃO Revisão: 01
Folha de protocolo do QIAsymphony SP
 Folha de protocolo do QIAsymphony SP Protocolo VirusBlood200_V5_DSP Informações gerais Para utilização em diagnóstico in vitro. Este protocolo destina-se à purificação de ADN viral de sangue total humano
Folha de protocolo do QIAsymphony SP Protocolo VirusBlood200_V5_DSP Informações gerais Para utilização em diagnóstico in vitro. Este protocolo destina-se à purificação de ADN viral de sangue total humano
Constituição 1- N do protocolo da SES 2- Tipo do CNPJ 3- Natureza da pessoa. Solicitação
 1 Formulário de Solicitação da Vigilância Sanitária Leia as instruções Constituição 1- N do protocolo da SES 2- Tipo do CNPJ 3- Natureza da pessoa 4- Tipo do Estabelecimento 5- Razão Social ( ) Matriz
1 Formulário de Solicitação da Vigilância Sanitária Leia as instruções Constituição 1- N do protocolo da SES 2- Tipo do CNPJ 3- Natureza da pessoa 4- Tipo do Estabelecimento 5- Razão Social ( ) Matriz
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUIMICOS FISPQ. Data da revisão: 12/09/2006. ALUMAX 200
 FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUIMICOS FISPQ. Data da revisão: 12/09/2006. ALUMAX 200 1. Identificação do produto e da empresa - Produto: Limpeza de alumínio - Código Produto: ALUMAX 200
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTOS QUIMICOS FISPQ. Data da revisão: 12/09/2006. ALUMAX 200 1. Identificação do produto e da empresa - Produto: Limpeza de alumínio - Código Produto: ALUMAX 200
Atualização do Cartão Nacional de Saúde para o Siscan
 Atualização do Cartão Nacional de Saúde para o Siscan Quando um novo exame é requisitado no Siscan é necessário inserir o CNS do paciente para preenchimento dos campos do cadastro. Estes dados estão armazenados
Atualização do Cartão Nacional de Saúde para o Siscan Quando um novo exame é requisitado no Siscan é necessário inserir o CNS do paciente para preenchimento dos campos do cadastro. Estes dados estão armazenados
Ficha de segurança para resíduos químicos FDSR
 Ficha de segurança para resíduos químicos FDSR O que é a FDSR? É a ficha com dados de segurança de resíduos químicos (FDSR) com o seu respectivo rótulo. Foi criada pela ABNT NBR 16725: Resíduo químico
Ficha de segurança para resíduos químicos FDSR O que é a FDSR? É a ficha com dados de segurança de resíduos químicos (FDSR) com o seu respectivo rótulo. Foi criada pela ABNT NBR 16725: Resíduo químico
SICLOM Mapa Mensal. 1 Mapa Mensal. Versão: 2012. Manual de preenchimento do mapa mensal no SICLOM Gerencial
 1 Mapa Mensal SICLOM Mapa Mensal Manual de preenchimento do mapa mensal no SICLOM Gerencial Versão: 2012 2 Mapa Mensal 3 Mapa Mensal Índice.. Introdução. 5 Como Acessar o SICLOM Gerencial. 5 Menu Geral.
1 Mapa Mensal SICLOM Mapa Mensal Manual de preenchimento do mapa mensal no SICLOM Gerencial Versão: 2012 2 Mapa Mensal 3 Mapa Mensal Índice.. Introdução. 5 Como Acessar o SICLOM Gerencial. 5 Menu Geral.
VIA FÁCIL - BOMBEIROS
 SECRETARIA DO ESTADO DOS NEGÓCIOS DA SEGURANÇA PÚBLICA POLÍCIA MILITAR DO ESTADO DE SÃO PAULO CORPO DE BOMBEIROS VIA FÁCIL - BOMBEIROS MANUAL DO USUÁRIO Versão V1.0 1 Índice A INTRODUÇÃO, 4 B USUÁRIO NÃO
SECRETARIA DO ESTADO DOS NEGÓCIOS DA SEGURANÇA PÚBLICA POLÍCIA MILITAR DO ESTADO DE SÃO PAULO CORPO DE BOMBEIROS VIA FÁCIL - BOMBEIROS MANUAL DO USUÁRIO Versão V1.0 1 Índice A INTRODUÇÃO, 4 B USUÁRIO NÃO
SERVIÇO PÚBLICO ESTADUAL. Portaria nº 237 de 31 de janeiro de 2008. O SECRETÁRIO DA SAÚDE DO ESTADO DA BAHIA no uso de suas atribuições:
 SERVIÇO PÚBLICO ESTADUAL Portaria nº 237 de 31 de janeiro de 2008 O SECRETÁRIO DA SAÚDE DO ESTADO DA BAHIA no uso de suas atribuições: Considerando o inciso XI, do artigo 17, da Lei nº 8.080 de 19/09/1990,
SERVIÇO PÚBLICO ESTADUAL Portaria nº 237 de 31 de janeiro de 2008 O SECRETÁRIO DA SAÚDE DO ESTADO DA BAHIA no uso de suas atribuições: Considerando o inciso XI, do artigo 17, da Lei nº 8.080 de 19/09/1990,
MATÉRIAS PRIMAS NA ALIMENTAÇÃO. Prof. Ana Paula Lopes
 MATÉRIAS PRIMAS NA ALIMENTAÇÃO. Prof. Ana Paula Lopes Definição de Alimento De acordo com o Código Nacional de Saúde, Decreto-Lei 986/1969, alimento é toda substância ou mistura de substâncias, no estado
MATÉRIAS PRIMAS NA ALIMENTAÇÃO. Prof. Ana Paula Lopes Definição de Alimento De acordo com o Código Nacional de Saúde, Decreto-Lei 986/1969, alimento é toda substância ou mistura de substâncias, no estado
LAUDO PARA SOLICITAÇÃO, AVALIAÇÃO E AUTORIZAÇÃO DE MEDICAMENTOS DO COMPONENTE ESPECIALIZADO DA ASSISTÊNCIA FARMACÊUTICA INSTRUÇÕES DE PREENCHIMENTO
 LAUDO PARA SOLICITAÇÃO, AVALIAÇÃO E AUTORIZAÇÃO DE MEDICAMENTOS DO COMPONENTE ESPECIALIZADO DA ASSISTÊNCIA FARMACÊUTICA INSTRUÇÕES DE PREENCHIMENTO SOLICITAÇÃO DO MEDICAMENTO Campo 1 - Nome do Paciente:
LAUDO PARA SOLICITAÇÃO, AVALIAÇÃO E AUTORIZAÇÃO DE MEDICAMENTOS DO COMPONENTE ESPECIALIZADO DA ASSISTÊNCIA FARMACÊUTICA INSTRUÇÕES DE PREENCHIMENTO SOLICITAÇÃO DO MEDICAMENTO Campo 1 - Nome do Paciente:
INSTRUÇÃO DE TRABALHO
 1. Titulo: CUIDADOS PÓS- EXTRAVASAMENTO DE CONTRASTE 2. Definição: Escape das drogas (vesicantes) do vaso sanguíneo para os tecidos circunjacentes, onde seus efeitos tóxicos locais variam podem causar:
1. Titulo: CUIDADOS PÓS- EXTRAVASAMENTO DE CONTRASTE 2. Definição: Escape das drogas (vesicantes) do vaso sanguíneo para os tecidos circunjacentes, onde seus efeitos tóxicos locais variam podem causar:
Protocolo coleta de solos
 MATERIAL NECESSÁRIO - Sacos plásticos reforçados com capacidade para 2kg - Esparadrapo - Marcador permanente - Trado Holandês - Espátula - Terçado - Lima - Pano úmido ONDE COLETAR 1) A coleta deve ser
MATERIAL NECESSÁRIO - Sacos plásticos reforçados com capacidade para 2kg - Esparadrapo - Marcador permanente - Trado Holandês - Espátula - Terçado - Lima - Pano úmido ONDE COLETAR 1) A coleta deve ser
Universidade Federal de Sergipe Centro de Ciências Exatas e Tecnologia Departamento de Engenharia Mecânica
 Instrução Normativa N 01/2016/DMEC REGULAMENTAÇÃO DOS LABORATÓRIOS DE ENSINO E PESQUISA DO CURSO DE ENGENHARIA MECÂNICA CAPÍTULO I DAS CARACTERÍSTICAS Artigo 1º O presente regulamento estabelece critérios
Instrução Normativa N 01/2016/DMEC REGULAMENTAÇÃO DOS LABORATÓRIOS DE ENSINO E PESQUISA DO CURSO DE ENGENHARIA MECÂNICA CAPÍTULO I DAS CARACTERÍSTICAS Artigo 1º O presente regulamento estabelece critérios
ORIENTAÇÃO PARA ELABORAÇÃO DO RELATÓRIO DE ESTÁGIO
 ORIENTAÇÃO PARA ELABORAÇÃO DO RELATÓRIO DE ESTÁGIO Este documento tem por objetivo orientar a estruturação e formatação do relatório de estágio. O texto está dividido em duas partes: 1) Normas de formatação,
ORIENTAÇÃO PARA ELABORAÇÃO DO RELATÓRIO DE ESTÁGIO Este documento tem por objetivo orientar a estruturação e formatação do relatório de estágio. O texto está dividido em duas partes: 1) Normas de formatação,
Determinação de lipídios em leite e produtos lácteos pelo método butirométrico
 Página 1 de 10 1 Escopo Este método tem como objetivo determinar a porcentagem de lipídios em leite e produtos lácteos pelo método butirométrico (Gerber). 2 Fundamentos Baseia-se na separação e quantificação
Página 1 de 10 1 Escopo Este método tem como objetivo determinar a porcentagem de lipídios em leite e produtos lácteos pelo método butirométrico (Gerber). 2 Fundamentos Baseia-se na separação e quantificação
