UMA PROPOSTA EXPERIMENTAL PARA O ENSINO DE ELETROQUÍMICA USANDO MATERIAL DE BAIXO CUSTO Apresentação: Comunicação Oral
|
|
|
- Marcos Cabreira Machado
- 6 Há anos
- Visualizações:
Transcrição
1 UMA PROPOSTA EXPERIMENTAL PARA O ENSINO DE ELETROQUÍMICA USANDO MATERIAL DE BAIXO CUSTO Apresentação: Comunicação Oral Julliete Cristina Maia Bezerra Ramos 1 ; Ismael Dionísio Souto 2 ; Francisco Emanoel Ferreira de Almeida 3 Resumo O presente trabalho foi realizado no laboratório de Química do Instituto Federal de Educação, Ciência e Tecnologia da Paraíba IFPB, Campus João Pessoa, tendo como objetivo principal o de desenvolver uma proposta de ensino experimental que permita fomentar o aprendizado da eletroquímica a partir de uma prática construída com materiais de baixo custo. Essa pesquisa baseou-se no fenômeno da corrosão em arruelas comerciais de aço carbono em três situações distintas: ensaio estático e sem decapagem, ensaio estático com decapagem e ensaio aerado com decapagem. Após a otimização do experimento, essa prática experimental foi aplicada no contexto da educação como experimentação no ensino de Química, o método de estudo foi executado em uma turma de Eletrotécnica do ensino médio integrado do IFPB, onde foi utilizado, como recurso prévio e posterior de avaliação, a Evocação Livre de Palavras. Esse método consiste na solicitação, aos alunos, que escrevem, em ordem de importância, as cinco primeiras palavras que lhes surgem à mente acerca de determinado assunto. Para efeito de aplicação, o ensaio estático e sem decapagem foi o escolhido, em virtude de sua facilidade de aplicação e seus resultados satisfatórios. Na conclusão desse trabalho o sistema mostrou-se ser de fácil montagem, permitiu a sua otimização e levou a visualização dos fenômenos associados a corrosão na forma quantitativa e qualitativa e contribuiu para a melhoria do grau de aprendizado dos discentes envolvidos nessa pesquisa. Através da comparação dos três ensaios, observou-se que o processo corrosivo é mais acentuado quando o meio eletroquímico é submetido à aeração forçada em consequência da maior presença de oxigênio no sistema, o que destaca a importância desse gás nas reações químicas. Palavras-Chave: Corrosão, Ensino de Química, Materiais de baixo custo. Introdução A contextualização dos diversos conteúdos abordados no ensino médio é, muitas vezes, inexistente, fazendo com que o aprendizado dos estudantes fique comprometido. Para dar 1 Química, IFPB, julliete.quimicaifpb@gmail.com 2 Química, IFPB, Ismaelquimicaifpb@hotmail.com 3 Doutor, IFPB,
2 significado a um determinado conteúdo é necessário que o discente possa associar o que é visto em sala de aula a algo fora dela. No entanto, alguns professores, principalmente os mais tradicionais, não fazem essa ponte, e o aluno, por si só, pode não conseguir estabelecer alguma relação entre o que estuda na escola e acontecimentos que ocorrem no seu dia a dia. Um fenômeno de fácil observação é a corrosão, sobretudo em regiões litorâneas e em lugares com ocorrência de neve, em que se percebe largamente a deterioração de alguns materiais metálicos. Assim, esse fenômeno torna-se um instrumento interessante para contextualização em aulas de Química, pois é uma temática que está relacionada ao estudo da eletroquímica e que oportuniza ao discente adquirir o conhecimento teórico daquilo que ele presencia no seu cotidiano, bem como permite ao professor fazer uso da experimentação. A experimentação traz uma contribuição que pode potencializar o aprendizado dos estudantes, pois a utilização de experimentos, principalmente no ensino de Química, que é uma ciência de cunho essencialmente experimental, desperta alguns órgãos dos sentidos, tornando a aprendizagem mais atraente e significativa. A evocação livre de palavras é uma ferramenta que permite obter a representação social de um determinado grupo de pessoas, ou seja, através da evocação de cinco palavras escritas em ordem de prioridade sobre um determinado tema, é possível entender qual o pensamento do grupo como um todo. Fundamentação Teórica EXPERIMENTAÇÃO NO ENSINO DE QUÍMICA É comum encontrar nas escolas um quantitativo significativo de alunos que relatam queixas quando são indagados sobre o que eles acham de estudar Química. Para alguns é considerada uma matéria chata, sem importância e sem aplicação no dia-a-dia. Para a melhoria do ensino, uma das sugestões é um maior número de aulas práticas (CARDOSO; COLINVAUX, 2000). A experimentação pode, também, servir como uma porta de entrada para que o professor simule um problema do cotidiano e que seja da realidade do aluno, proporcionando, assim, maior estímulo e questionamento com senso investigativo (GUIMARÃES, 2009). UTILIZAÇÃO DE MATERIAIS DE BAIXO CUSTO COMO RECURSO DIDÁTICO Oliveira (2009) defende que, na utilização de materiais de baixo custo, o aluno interage com a materialização de um equipamento ausente, pois a construção de um equipamento proveniente de materiais de baixo custo substitui o equipamento técnico de laboratório. Outro fator importante
3 dentro desse contexto é que o discente estabelece um relacionamento com o significado do objeto, e não apenas com o objeto em si. Além disso, o aprendizado pode ser de qualidade quando se utiliza materiais que fazem parte do convívio dos alunos com a função de construir um instrumento que objetiva a experimentação. EVOCAÇÃO LIVRE DE PALAVRAS A técnica da Evocação Livre de Palavras (ELP) consiste na solicitação, aos alunos, da evocação de, geralmente, cinco palavras, que lhes surgem à mente imediatamente, a partir de um tema predeterminado, denominado termo indutor. Essas cinco palavras devem ser citadas em ordem de importância, onde a primeira palavra o sujeito julga como a mais importante e a última a menos importante. Essa técnica tem como objetivo identificar os elementos centrais de uma representação social, isto é, determinar conceitos sobre um assunto que é significativo para um grupo de indivíduos. As cinco palavras são, então, organizadas considerando-se a frequência e a ordem média de evocação (OME). Com isso, é possível identificar o núcleo central da representação, de acordo com os termos citados pelos discentes segundo sua importância (CORTES JUNIOR; CORIO; FERNADEZ, 2009). Os parâmetros utilizados para a ELP são frequência(f) e OME: A frequência (f) representa o número total de vezes que a mesma palavra aparece nas evocações dos alunos. A ordem média de evocação (OME) representa o posicionamento que a mesma palavra ocupa dentro das evocações (...). Para o cálculo da OME utiliza-se a seguinte relação: FIGURA 1 - Equação para cálculo da OME. Fonte CORTES JUNIOR et al. (2009). Após o cálculo da frequência e da OME, as palavras são agrupadas em conjuntos de acordo com o quadro 1 a seguir. QUADRO 1 Critérios utilizados para definição dos elementos centrais, intermediários e periféricos a partir da evocação livre de palavras. Fonte: CORTES JUNIOR et al. (2009):
4 Os elementos centrais são determinados pelas palavras que apresentaram OME mais próxima da primeira posição como mais importante e frequência acima da média das frequências. Os elementos intermediários podem tem duas classificações: a primeira, quando as palavras possuem frequência maior que a média das freqüências e a OME possui valores mais distantes das primeiras posições, e são, portanto, mais próximos de 5; e a segunda, que considera também as palavras com frequência abaixo da média das freqüências e OME mais próximas das primeiras posições, ou seja, próximas de 1. Os elementos periféricos incluem as palavras que obtiveram a frequência menor que a média das frequências e OME maiores que a média, próximas de 1. PILHAS Em uma pilha é necessário que as espécies metálicas envolvidas possuam potenciais de redução, representado por E, com valores diferentes. O potencial de redução indica a tendência que uma determinada espécie tem de sofrer redução, ou seja, ganhar elétrons. Se uma espécie sofre redução é porque uma outra espécie sofreu oxidação, que consiste na perda de elétrons A espécie que sofre redução é o catodo em uma pilha, e a espécie que sofre oxidação é o anodo (CHANG; GOLDSBY, 2013). CORROSÃO A corrosão é um fenômeno visualmente frequente e, quando se trata de corrosão em materiais metálicos, é facilmente observada através da coloração marrom-avermelhada, comumente chamada de ferrugem. Contudo, a corrosão não ocorre apenas em superfícies metálicas, mas pode atingir também o concreto, polímeros orgânicos, dentre outros, e consiste no dano causado a um determinado material em consequência da ação do meio externo (MERÇON; GUIMARÃES; MAINIER, 2004). Dentro do contexto econômico a corrosão desempenha um papel de destaque, pois se faz necessária a troca e reparo de estruturas e, só nos Estados Unidos, os custos com corrosão chegaram a atingir uma quantia superior a 200 bilhões de dólares por ano. Outros problemas também estão associados à corrosão, como a deterioração da estrutura de prédios, pontes, navios e esculturas históricas, além do risco de provocar acidentes com perdas humanas (CHANG; GOLDSBY, 2013).
5 Metodologia EXPERIMENTAL A construção do experimento e a aplicação foram executadas no Instituto Federal de Educação, Ciência e Tecnologia da Paraíba IFPB Câmpus João Pessoa. Para a realização da parte experimental foram necessários 28 dias para cada ensaio. Os materiais de baixo custo utilizados foram arruelas comerciais de aço carbono, fio de náilon, bomba de aquário, garrafas PET, recipientes de plástico e cloreto de sódio (NaCl). A metodologia empregada possibilitou a realização de analises qualitativa e quantitativa com levantamento e tratamentos de dados. Para as análises qualitativas o experimento proporciona o vislumbre do fenômeno da corrosão através do aspecto deteriorado das arruelas. As análises quantitativas permitem, através da precisão da pesagem, quantificar a perda de massa sofrida pela arruela em decorrência do processo corrosivo. Esse estudo seguiu como referência o trabalho de Merçon, Guimarães e Mainier (2011), com modificações nos parâmetros de montagem do experimento. O experimento consistiu no mergulho de arruelas de aço carbono em recipientes contendo solução de NaCl a 3,5%, simulando o ambiente salino das águas oceânicas (CLAVICO; GOMES, 2005) em três situações distintas: Ensaio estático sem decapagem; Ensaio estático com decapagem e Ensaio aerado com decapagem. A decapagem consiste em um tratamento prévio realizado sobre a superfície de uma peça metálica para remoção de carepas e óxidos que são formados durante o processo de fabricação, através da elevada temperatura e a reação do oxigênio atmosférico com o metal base (SIDERURGIA BRASIL, 2007). Neste trabalho a decapagem foi realizada através da imersão de cada arruela em uma solução de ácido clorídrico (HCl 1,0 mol/l) por um período de 15 segundos, lavagem com água corrente e água destilada e imersa em solução de hidróxido de potássio (KOH 1,0 mol/l) por 15 segundos e novamente lavada com água corrente e destilada. Para as arruelas que não foram submetidas ao processo de decapagem, o procedimento adotado foi o de pesagem antes do acondicionamento em solução salina e, após o intervalo predeterminado, lavagem com água corrente, lavagem com água destilada, secagem e nova pesagem para aferição da massa. As arruelas decapadas foram pesadas somente após a secagem completa posterior ao processo de decapagem. Depois de pesadas foram dispostas na solução salina e ao final do respectivo intervalo, lavadas com água corrente e destilada, secas e novamente pesadas para obtenção da nova massa. ENSAIO ESTÁTICO SEM DECAPAGEM: as arruelas foram submersas nas soluções salinas, conforme citado anteriormente, através de um fio de náilon preso em um palito de madeira na parte externa da garrafa PET fechada.
6 ENSAIO ESTÁTICO COM DECAPAGEM: após o processo de decapagem as arruelas foram acondicionadas através de submersão total na solução através de fios de náilon. ENSAIO AERADO COM DECAPAGEM: após a etapa da decapagem as arruelas foram submetidas à solução salina dispostas em recipientes plásticos abertos conectados à mangueiras, nas quais estas, por sua vez, ligavam-se a uma bomba de aquário para lançar oxigênio nos recipientes. APLICAÇÃO A aplicação foi realizada em uma turma do terceiro ano do ensino médio do curso de Mecânica e contou com a participação de 23 alunos durante 2 aulas. O trabalho foi realizado conforme descrito nas etapas a seguir: Avaliação inicial da turma utilizando a ELP; Planejamento e execução das aulas expositivo-dialogadas sobre eletroquímica e corrosão, com a utilização de recursos visuais, abordando a temática da corrosão e seus aspectos econômicos e sociais; Demonstração experimental do fenômeno da corrosão através do ensaio estático sem decapagem; Avaliação final da turma utilizando a ELP. Resultados e Discussão ENSAIO ESTÁTICO SEM DECAPAGEM As figuras 1 e 2, mostram as imagens das arruelas de aço carbono quando submetidas ao ataque corrosivo com cloreto de sódio, sem o sistema de aeração, nos tempos de 7 e 28 dias e 7 e 14, respectivamente. Verifica-se que a oxidação foi mais intensa para a arruela com maior tempo de exposição ao agente químico. Verificou-se também sobre a superfície do metal uma fina camada do produto de corrosão nas figuras 1 e 2. Figura 1 Estado inicial, após 7 e 28 dias, respectivamente.
7 Figura 2 Estado inicial, após 7 e 14 dias, respectivamente. Na figura 3, é possível verificar o efeito da aeração com bombeamento de oxigênio no recipiente. A amostra foi submetida ao ataque corrosivo por um tempo de 14 e 28 dias e constata-se, nitidamente, que o aumento da oxigenação da solução eletrolítica contribuiu no aumento da taxa de corrosão. Figura 3 Estado inicial, após 14 e 28 dias, respectivamente. Os gráficos 1 e 2, mostram os a perda de massa em função do tempo de exposição ao meio corrosivo num processo não decapado e decapado, respectivamente. Observa-se nitidamente através do gráfico 2, que a velocidade de corrosão é inversamente proporcional à quantidade do produto de corrosão formado. Isso ocorre quando o produto de corrosão é insolúvel e adere à superfície metálica. No gráfico 2, a velocidade cresce rapidamente. Ocorre quando os produtos de corrosão são solúveis e a área do metal aumenta. GRÁFICO 1 Representação da taxa de corrosão para o ensaio estático e sem decapagem.
8 Fonte: Própria. GRÁFICO 2 Representação do ensaio estático e com decapagem. Fonte: Própria. Para o ensaio aerado e com decapagem constatou-se que, já entre os primeiros sete dias iniciais, há um aumento significativo no processo corrosivo quando comparado com os outros ensaios. É possível verificar uma taxa de variação de massa mais proeminente durante todo o processo de estudo em comparação com os ensaios anteriores, ou seja, a perda de massa foi sempre crescente, sem apresentar uma tendência linear. A decapagem, que promoveu a limpeza da superfície das arruelas em conjunto com o fornecimento de oxigênio, através da bomba de aquário, intensificaram a perda de massa, acelerando o efeito corrosivo. GRÁFICO 3 Representação do ensaio aerado e com decapagem. Fonte: Própria. APLICAÇÃO DIDÁTICA Na primeira aula, foi solicitado aos alunos que escrevessem cinco palavras que, na opinião deles, estivessem relacionadas com a corrosão, conforme mostra o quadro 2, abaixo. As cinco palavras
9 evocadas deveriam ser escritas em ordem de prioridade, onde a primeira palavra o discente classificou como mais importante e assim sucessivamente. Através desse levantamento inicial foi possível calcular a frequência da evocação de cada palavra, a ordem média de evocação (OME) e a média das freqüências e OME. Com esses dados foi possível construir a tabela 1 a seguir. TABELA 1 Palavras evocadas e cálculos de frequência e ordem de evocação prévia. Fonte: Própria. Palavra 1ºlugar 2ºlugar 3ºlugar 4ºlugar 5ºlugar F %F OME tinta ,8 2,5 temperatura ,8 1,5 oxigênio ,8 2,2 ferrugem ,5 3,2 oxidação ,2 2,2 material ,7 2,0 deterioração ,7 3,0 desgaste ,0 2,1 custo ,8 2,5 reação química ,9 1,0 velocidade ,9 1,0 composição ,9 2,0 detrimento ,9 2,0 atrito ,9 2,0 química ,8 2,5 armazenamento ,9 2,0 metal ,2 4,0 inutilidade ,9 2,0 ferro ,9 3,0 ácido ,5 3,8 aço ,8 3,5 degradação ,5 3,8 umidade ,9 3,0 elementos ,9 3,0 perda ,9 3,0 mecânica ,9 3,0 água ,8 3,5 proteção ,9 3,0 redutor ,8 4,0 moléculas ,7 4,3 crescimento ,9 4,0 qualidade ,9 4,0 ar ,9 4,0 tratamento térmico ,9 5,0 tratamento químico ,9 5,0
10 diminuição ,9 5,0 origem ,9 5,0 alteração ,9 5,0 natural ,9 5,0 tratamento ,9 5,0 agentes externos ,9 5,0 MEDIA 2,68 2,4 3,2 TOTAL ,0 Com base nos dados fornecidos na tabela 1, foi possível classificar as palavras citadas como inseridas nos elementos pertencentes ao núcleo central. Nesse primeiro momento foi obtida uma frequência correspondente a 2,4. Para a OME o valor encontrado foi de 3,2. Figura 4 - Representação dos elementos centrais. Os elementos centrais foram: oxigênio, oxidação, material, deterioração, desgaste e ferrugem, pois apresentaram frequência maior que a média das frequências e uma OME menor que a média, indicando que essas palavras foram citadas mais próximas da primeira posição, sendo consideradas, portanto, como as mais importantes, como observado na figura 4. Após a realização das aulas e do procedimento experimental no laboratório, foi solicitado, novamente, que os alunos evocassem cinco palavras, em ordem de prioridade, que eles julgassem ter relação com o fenômeno da corrosão.
11 TABELA 2 Palavras evocadas e cálculos de frequência e ordem de evocação posterior. Fonte: Própria. Palavra 1ºlugar 2ºlugar 3ºlugar 4ºlugar 5ºlugar frequência %F OME oxirredução ,9 2,0 redução ,9 2,2 oxigênio ,3 1,0 oxidação ,2 1,7 água ,8 3,0 eletroquímica ,1 3,1 reação química ,8 3,7 reparos ,3 2,0 catodo ,8 3,0 degradação ,3 4,0 troca de elétrons ,3 3,0 produção ,3 3,0 anodo ,8 4,0 íons ,3 4,0 ferrugem ,1 4,3 exploracão ,3 4,0 metais ,5 4,5 economia ,5 5,0 custo ,5 3,0 MEDIA 5,3 3,2 TOTAL ,0 Com base nos dados obtidos na tabela 2, realizados para evocação de palavras posterior, foi possível constatar uma frequência = 5,3 e o valor para a OME= 3,2. Com isso, foi possível fazer a classificação dos elementos centrais. Figura 5 Representação dos elementos centrais após a realização das aulas. Os elementos centrais encontrados ao analisar a figura 5 foram: oxirredução, redução, oxidação e eletroquímica, por apresentarem frequência maior do que a média das frequências e OME menor do que a média, indicando que tais palavras estavam próximas da posição número um. Como é possível observar, os elementos centrais citados no segundo momento concordam com os conceitos químicos
12 relacionados à corrosão descritos ao longo do trabalho, demonstrando, assim, que os estudantes conseguiram associar os fenômenos presentes durante a corrosão com novos conceitos. Conclusões Através do processo corrosivo foi possível verificar que com o aumento do teor de oxigênio, através da aeração, ocasionou o aumento no valor da velocidade de corrosão, o que está de acordo com a literatura. Este trabalho também oportunizou aos estudantes envolvidos na pesquisa a observação e compreensão de um fenômeno comum, a corrosão, bem como o conhecimento os fatores que contribuem e previnem a corrosão. Além do aspecto cognitivo, aulas com caráter experimental são, também, motivadoras e estimulantes para os estudantes, pois desperta nestes alguns dos órgãos dos sentidos como a visão, facilitando a união entre o incentivo e o aprendizado, a teoria e a prática. Referências CARDOSO, Sheila Pressentin; COLINVAUX, Dominique. Explorando a motivação para estudar química. Química Nova, São Paulo, v. 23, n. 3, mai./jun., Disponível em: < Acesso em: 9 maio CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. Ed. Porto Alegre: Bookman, p. CORTES JUNIOR, Lailton Passos; CORIO, Paola; FERNANDEZ, Carmen. As representações sociais de Química Ambiental dos alunos iniciantes na graduação em Química. Química Nova na Escola, v.31, n. 1, p , fevereiro GUIMARÃES, Cleidson Carneiro. Experimentação no Ensino de Química: caminhos e descaminhos rumo à aprendizagem significativa. Química Nova na Escola, v. 31, n. 3, p , agosto MERÇON, Fábio; GUIMARÃES, Pedro Ivo Canesso; MAINIER, Fernando Benedito. Corrosão: um exemplo usual de fenômeno químico. Química Nova na Escola, n. 19, p , Disponível em: < Acesso em: 15 abril OLIVEIRA, Noé de. As atividades de experimentação lúdicas AEL f. Tese (Doutorado em Química do Cerrado e do Pantanal) Universidade Federal de Goiás, Goiânia. Disponível em: < Acesso em: 23 março SIDERURGIA BRASIL. Decapagem de bobinas de aço carbono. Ação da Armco. n. 9, jan./abr., Disponível em: < materias39/375-decapagem-de-bobinas-de-aco-carbono> Acesso em: 28 abril 2015.
Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle
 Curso Técnico Integrado em Química Físico-química III VÍDEO AULA Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle 1 Professor: Me. Sebastião Junior T. Vasconcelos
Curso Técnico Integrado em Química Físico-química III VÍDEO AULA Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle 1 Professor: Me. Sebastião Junior T. Vasconcelos
TÍTULO: AVALIAÇÃO DO USO DO IMIDAZOL COMO INIBIDOR DE CORROSÃO DO AÇO 420-R.
 TÍTULO: AVALIAÇÃO DO USO DO IMIDAZOL COMO INIBIDOR DE CORROSÃO DO AÇO 420-R. CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: QUÍMICA INSTITUIÇÃO: FACULDADE DE SÃO BERNARDO DO CAMPO - FASB
TÍTULO: AVALIAÇÃO DO USO DO IMIDAZOL COMO INIBIDOR DE CORROSÃO DO AÇO 420-R. CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: QUÍMICA INSTITUIÇÃO: FACULDADE DE SÃO BERNARDO DO CAMPO - FASB
ESTUDO DO PROCESSO DE CORROSÃO DE AÇO CARBONO EXPOSTO A MISTURAS DE PETRÓLEO E ÁGUAS SALINAS
 ESTUDO DO PROCESSO DE CORROSÃO DE AÇO CARBONO EXPOSTO A MISTURAS DE PETRÓLEO E ÁGUAS SALINAS Felipe Augusto Cordeiro de Melo 1 ; Severino Leopoldino Urtiga Filho 2 1 Estudante do Curso de Engenharia de
ESTUDO DO PROCESSO DE CORROSÃO DE AÇO CARBONO EXPOSTO A MISTURAS DE PETRÓLEO E ÁGUAS SALINAS Felipe Augusto Cordeiro de Melo 1 ; Severino Leopoldino Urtiga Filho 2 1 Estudante do Curso de Engenharia de
01) O elemento X reage com o elemento Z, conforme o processo: Nesse processo: Z 3 + X Z 1 + X 2. b) X ganha elétrons de Z. d) X e Z perdem elétrons.
 SECRETARIA DE SEGURANÇA PÚBLICA/SECRETARIA DE EDUCAÇÃO POLÍCIA MILITAR DO ESTADO DE GOIÁS COMANDO DE ENSINO POLICIAL MILITAR COLÉGIO DA POLÍCIA MILITAR NADER ALVES DOS SANTOS SÉRIE/ANO: TURMA(S): 2º anos
SECRETARIA DE SEGURANÇA PÚBLICA/SECRETARIA DE EDUCAÇÃO POLÍCIA MILITAR DO ESTADO DE GOIÁS COMANDO DE ENSINO POLICIAL MILITAR COLÉGIO DA POLÍCIA MILITAR NADER ALVES DOS SANTOS SÉRIE/ANO: TURMA(S): 2º anos
ELETRODO OU SEMIPILHA:
 ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ESTUDO DA CORROSÃO DO Al RECICLADO DA INDÚSTRIA DE BEBIDAS
 ESTUDO DA CORROSÃO DO Al RECICLADO DA INDÚSTRIA DE BEBIDAS T. SILVA 1, D. MIRANDA 1, G. ALVES 3, O.L ROCHA 2, J.C. CARDOSO FILHO 1 1 Universidade Federal do Pará/ Laboratório de Corrosão 2 Instituto Federal
ESTUDO DA CORROSÃO DO Al RECICLADO DA INDÚSTRIA DE BEBIDAS T. SILVA 1, D. MIRANDA 1, G. ALVES 3, O.L ROCHA 2, J.C. CARDOSO FILHO 1 1 Universidade Federal do Pará/ Laboratório de Corrosão 2 Instituto Federal
O PROCESSO DA OXIRREDUÇÃO NA MARESIA: UM ESTUDO NO PROJETO INTEGRADOR
 O PROCESSO DA OXIRREDUÇÃO NA MARESIA: UM ESTUDO NO PROJETO INTEGRADOR Luca, Anelise Grünfeld de 1 ; Borba, Eliakin Sato de 2 ; Filho, Erich Grünfeld 3 ; Nascimento, Lara Santana 4 : Graciano, Mariane Rodrigues
O PROCESSO DA OXIRREDUÇÃO NA MARESIA: UM ESTUDO NO PROJETO INTEGRADOR Luca, Anelise Grünfeld de 1 ; Borba, Eliakin Sato de 2 ; Filho, Erich Grünfeld 3 ; Nascimento, Lara Santana 4 : Graciano, Mariane Rodrigues
Corrosão Metálica. Introdução. O que é corrosão? Classificação dos processos de corrosão. Principais tipos de corrosão
 Corrosão Metálica Introdução O estudo da corrosão de superfícies é importante para a solução de problemas de peças e equipamentos. Ter o conhecimento dos tipos de corrosão existentes, compreender os seus
Corrosão Metálica Introdução O estudo da corrosão de superfícies é importante para a solução de problemas de peças e equipamentos. Ter o conhecimento dos tipos de corrosão existentes, compreender os seus
ATIVIDADES EXPERIMENTAIS E INVESTIGATIVAS: UMA PROPOSTA PARA O ENSINO DE ELETROQUÍMICA
 ATIVIDADES EXPERIMENTAIS E INVESTIGATIVAS: UMA PROPOSTA PARA O ENSINO DE ELETROQUÍMICA Amanda Glycia Silva Moreira da Costa, Ana Larissa Silva de Farias, Lívia Cristina dos Santos, Maria do Socorro S.
ATIVIDADES EXPERIMENTAIS E INVESTIGATIVAS: UMA PROPOSTA PARA O ENSINO DE ELETROQUÍMICA Amanda Glycia Silva Moreira da Costa, Ana Larissa Silva de Farias, Lívia Cristina dos Santos, Maria do Socorro S.
e - Zinco ZnSO 4 Zn(s) Zn 2 Zn(s) Zn 2+ (aq) + 2 e - + 0,76 V Cu(s) Cu 2+ (aq) + 2 e - - 0,34 V
 Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
USANDO A EXPERIMENTAÇÃO NO ENSINO DO CONTEÚDO DE CORROSÃO: DETERIORAÇÃO DE METAIS
 USANDO A EXPERIMENTAÇÃO NO ENSINO DO CONTEÚDO DE CORROSÃO: DETERIORAÇÃO DE METAIS Évany Silva dos Santos (1); Iure Laurindo de Oliveira (1); Unidade Acadêmica de Biologia e Química (UABQ), Campus de Cuité,
USANDO A EXPERIMENTAÇÃO NO ENSINO DO CONTEÚDO DE CORROSÃO: DETERIORAÇÃO DE METAIS Évany Silva dos Santos (1); Iure Laurindo de Oliveira (1); Unidade Acadêmica de Biologia e Química (UABQ), Campus de Cuité,
Disciplina: Química Professor: Lourival Neto Cidade: Uberlândia
 Disciplina: Química Professor: Lourival Neto Cidade: Uberlândia Introdução Corrosão Tipos de corrosão Corrosão Eletroquímica Exemplos e reações Corrosão Química Exemplos e reações Corrosão Eletrolítica
Disciplina: Química Professor: Lourival Neto Cidade: Uberlândia Introdução Corrosão Tipos de corrosão Corrosão Eletroquímica Exemplos e reações Corrosão Química Exemplos e reações Corrosão Eletrolítica
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
RELATÓRIO: EXPERIMENTOS SOBRE ELETROQUÍMICA ENTREGA EM
 RELATÓRIO: EXPERIMENTOS SOBRE ELETROQUÍMICA ENTREGA EM 08-12-2017 IMPORTANTE Esse documento apresenta o roteiro que você deve seguir para elaborar o relatório sobre os experimentos de eletroquímica. Organize
RELATÓRIO: EXPERIMENTOS SOBRE ELETROQUÍMICA ENTREGA EM 08-12-2017 IMPORTANTE Esse documento apresenta o roteiro que você deve seguir para elaborar o relatório sobre os experimentos de eletroquímica. Organize
OXIDAÇÃO DE METAIS INTRODUÇÃO
 OXIDAÇÃO DE METAIS INTRODUÇÃO Oxidação é uma palavra do âmbito da química que significa a perda de elétrons, mesmo que não seja causada pelo oxigênio. Indica também o processo de oxidar, ou seja, de combinar
OXIDAÇÃO DE METAIS INTRODUÇÃO Oxidação é uma palavra do âmbito da química que significa a perda de elétrons, mesmo que não seja causada pelo oxigênio. Indica também o processo de oxidar, ou seja, de combinar
Abrange todos processo químicos que envolvem transferência de elétrons.
 Abrange todos processo químicos que envolvem transferência de elétrons. Quando um processo químico ocorre, produzindo transferência de elétrons, é chamado de pilha ou bateria. 1 2 Anodo: eletrodo negativo,
Abrange todos processo químicos que envolvem transferência de elétrons. Quando um processo químico ocorre, produzindo transferência de elétrons, é chamado de pilha ou bateria. 1 2 Anodo: eletrodo negativo,
Aula 20 Eletrodeposição
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
FÍSICO QUÍMICA AULA 5 - ELETRÓLISE
 FÍSICO QUÍMICA AULA 5 - ELETRÓLISE Em nossas aulas anteriores aprendemos como reações de óxidoredução podem ser utilizadas para se obter energia. Nas pilhas ocorrem reações químicas capazes de produzir
FÍSICO QUÍMICA AULA 5 - ELETRÓLISE Em nossas aulas anteriores aprendemos como reações de óxidoredução podem ser utilizadas para se obter energia. Nas pilhas ocorrem reações químicas capazes de produzir
Resumo de Química: Pilhas e eletrólise
 Resumo de Química: Pilhas e eletrólise Número de oxidação (NOX) Nox fixo:1a(+1), 2A (+2), Al +3, Zn +2 e Ag + Nox usual: Hidrogênio (+1), exceto nos hidretos metálicos (-1) e Oxigênio (-2), exceto nos
Resumo de Química: Pilhas e eletrólise Número de oxidação (NOX) Nox fixo:1a(+1), 2A (+2), Al +3, Zn +2 e Ag + Nox usual: Hidrogênio (+1), exceto nos hidretos metálicos (-1) e Oxigênio (-2), exceto nos
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Aluno (a): Data: / / Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta à caneta, organizada e completa.
 Disciplina: Química Turma: 2 série Escola SESI Jundiaí Professor: Rosilene Paulino da Silva Aluno (a): Data: / / 2018. Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta
Disciplina: Química Turma: 2 série Escola SESI Jundiaí Professor: Rosilene Paulino da Silva Aluno (a): Data: / / 2018. Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta
TÍTULO: ESTUDO E AVALIAÇÃO DA SUSCETIBILIDADE À CORROSÃO DE AÇOS INOXIDÁVEIS AUSTENÍTICOS EM AMBIENTE INDUSTRIAL
 TÍTULO: ESTUDO E AVALIAÇÃO DA SUSCETIBILIDADE À CORROSÃO DE AÇOS INOXIDÁVEIS AUSTENÍTICOS EM AMBIENTE INDUSTRIAL CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: QUÍMICA INSTITUIÇÃO: UNIVERSIDADE
TÍTULO: ESTUDO E AVALIAÇÃO DA SUSCETIBILIDADE À CORROSÃO DE AÇOS INOXIDÁVEIS AUSTENÍTICOS EM AMBIENTE INDUSTRIAL CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS EXATAS E DA TERRA SUBÁREA: QUÍMICA INSTITUIÇÃO: UNIVERSIDADE
As contribuições das práticas laboratoriais no processo de Ensino-Aprendizagem na área de Química
 As contribuições das práticas laboratoriais no processo de Ensino-Aprendizagem na área de Química Monialine Santos de Sousa 1, Juliana da Conceição Souza Lima 1, Andressa Marques Leite 1, Raíla Vieira
As contribuições das práticas laboratoriais no processo de Ensino-Aprendizagem na área de Química Monialine Santos de Sousa 1, Juliana da Conceição Souza Lima 1, Andressa Marques Leite 1, Raíla Vieira
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Índice. Agradecimentos... Prefácio da Edição Revisada... Prefácio...
 Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
CORROSÃO PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES. Prof. Mazer AULA 05
 AULA 05 Prof. Mazer PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES 2 FUNDAMENTOS GERAIS: O concreto protege a armadura de duas formas: - Confere uma barreira física separando o aço do meio-ambiente - A água no
AULA 05 Prof. Mazer PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES 2 FUNDAMENTOS GERAIS: O concreto protege a armadura de duas formas: - Confere uma barreira física separando o aço do meio-ambiente - A água no
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
Apresentação do produto final MATERIAL DE APOIO PARA O ENSINO DE ELETROQUÍMICA NO ENSINO MÉDIO POR MEIO DE ATIVIDADE EXPERIMENTAL
 Apresentação do produto final MATERIAL DE APOIO PARA O ENSINO DE ELETROQUÍMICA NO ENSINO MÉDIO POR MEIO DE ATIVIDADE EXPERIMENTAL Organizadores: Kathynne Carvalho de Freitas Ferri e Carlos Cézar da Silva.
Apresentação do produto final MATERIAL DE APOIO PARA O ENSINO DE ELETROQUÍMICA NO ENSINO MÉDIO POR MEIO DE ATIVIDADE EXPERIMENTAL Organizadores: Kathynne Carvalho de Freitas Ferri e Carlos Cézar da Silva.
Química. Eletroquímica
 CIC Colégio Imaculada Conceição Química Eletroquímica Msc. Camila Soares Furtado Couto Eletrólise Inverso da Pilha; Reação de oxi-redução que é provocada pela corrente elétrica; Não espontânea!!!! Eletrólise
CIC Colégio Imaculada Conceição Química Eletroquímica Msc. Camila Soares Furtado Couto Eletrólise Inverso da Pilha; Reação de oxi-redução que é provocada pela corrente elétrica; Não espontânea!!!! Eletrólise
ESTUDO DA CORROSÃO ÁCIDA DE FERRO FUNDIDO CINZENTO E AÇO VISANDO A PRODUÇÃO DE HIDROGÊNIO
 ESTUDO DA CORROSÃO ÁCIDA DE FERRO FUNDIDO CINZENTO E AÇO VISANDO A PRODUÇÃO DE HIDROGÊNIO P.O.B.FERREIRA 1, A. F. LIMA 1 e S.C. DANTAS 1 1 Universidade Federal Do Triângulo Mineiro, Faculdade de Engenharia
ESTUDO DA CORROSÃO ÁCIDA DE FERRO FUNDIDO CINZENTO E AÇO VISANDO A PRODUÇÃO DE HIDROGÊNIO P.O.B.FERREIRA 1, A. F. LIMA 1 e S.C. DANTAS 1 1 Universidade Federal Do Triângulo Mineiro, Faculdade de Engenharia
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Prof André Montillo
 Prof André Montillo www.montillo.com.br Reações de Oxido-Redução Definição: São as reações químicas onde ocorre a variação dos números de oxidação (Nox) das substâncias envolvidas. Portanto haverá transferência
Prof André Montillo www.montillo.com.br Reações de Oxido-Redução Definição: São as reações químicas onde ocorre a variação dos números de oxidação (Nox) das substâncias envolvidas. Portanto haverá transferência
Palavras chave: aulas experimentais, fluidos, viscosidade, viscosímetro
 ELABORAÇÃO E APLICABILIDADE DE DISPOSITIVO CONSTRUÍDO COM MATERIAL DE BAIXO CUSTO DESTINADO A MEDIR A VISCOSIDADE DE FLUIDOS Francisco F. Emanoel Almeida¹, Jônatas Souza Barbosa de Morais², Tállyson da
ELABORAÇÃO E APLICABILIDADE DE DISPOSITIVO CONSTRUÍDO COM MATERIAL DE BAIXO CUSTO DESTINADO A MEDIR A VISCOSIDADE DE FLUIDOS Francisco F. Emanoel Almeida¹, Jônatas Souza Barbosa de Morais², Tállyson da
O USO DO JOGO MOLÉCULAS DE HIDROCARBONETOS COMO MÉTODO SIGNIFICATIVO PARA O ENSINO DE QUÍMICA
 O USO DO JOGO MOLÉCULAS DE HIDROCARBONETOS COMO MÉTODO SIGNIFICATIVO PARA O ENSINO DE QUÍMICA Renato do Nascimento (1), Givanildo Freire da Costa (1), Jaqueline dos Santos Fidelis (2), Maria Betania Hermenegildo
O USO DO JOGO MOLÉCULAS DE HIDROCARBONETOS COMO MÉTODO SIGNIFICATIVO PARA O ENSINO DE QUÍMICA Renato do Nascimento (1), Givanildo Freire da Costa (1), Jaqueline dos Santos Fidelis (2), Maria Betania Hermenegildo
02/10/2017 ELETRÓLISE AQUOSA
 ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
Experiência 11 PILHA DE DANIELL PILHA DE DANIELL
 PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
Atividades experimentais no campo das Ciências Exatas: problematizando uma aula prática envolvendo destilação com materiais alternativos
 Atividades experimentais no campo das Ciências Exatas: problematizando uma aula prática envolvendo destilação com materiais alternativos Simone Stülp stulp@univates.br Ieda Maria Giongo - igiongo@univates.br
Atividades experimentais no campo das Ciências Exatas: problematizando uma aula prática envolvendo destilação com materiais alternativos Simone Stülp stulp@univates.br Ieda Maria Giongo - igiongo@univates.br
Química Aplicada. Professor Willyan Machado Giufrida
 Tópicos especiais Corrosão na construção civil Corrosão no Concreto e no Aço Química Aplicada 1 Professor Willyan Machado Giufrida Introdução Desde o início da utilização do concreto armado, nos meados
Tópicos especiais Corrosão na construção civil Corrosão no Concreto e no Aço Química Aplicada 1 Professor Willyan Machado Giufrida Introdução Desde o início da utilização do concreto armado, nos meados
Questão 1. (X pontos) Expectativa de resposta
 Questão 1. (X pontos) A acidez e a basicidade de compostos orgânicos podem ser influenciadas por diversos fatores, dentre os quais a ressonância, citada como um exemplo de fator intrínseco. No esquema
Questão 1. (X pontos) A acidez e a basicidade de compostos orgânicos podem ser influenciadas por diversos fatores, dentre os quais a ressonância, citada como um exemplo de fator intrínseco. No esquema
O BAFÔMETRO COMO RECURSO FACILITADOR DO ENSINO DAS REAÇÕES DE OXI-REDUÇÃO E DA CONCIENTIZAÇÃO DOS DISCENTES
 O BAFÔMETRO COMO RECURSO FACILITADOR DO ENSINO DAS REAÇÕES DE OXI-REDUÇÃO E DA CONCIENTIZAÇÃO DOS DISCENTES Jaqueline dos Santos Fidelis; Círio Samuel Cardoso da Silva; Fabrícia Bezerra Vieira do Nascimento;
O BAFÔMETRO COMO RECURSO FACILITADOR DO ENSINO DAS REAÇÕES DE OXI-REDUÇÃO E DA CONCIENTIZAÇÃO DOS DISCENTES Jaqueline dos Santos Fidelis; Círio Samuel Cardoso da Silva; Fabrícia Bezerra Vieira do Nascimento;
PROMILITARES 20/09/2018 QUÍMICA. Professora Caroline Azevedo ELETROQUÍMICA. Eletroquímica. Você precisa saber o que é oxidação e redução!
 QUÍMICA Professora Caroline Azevedo ELETROQUÍMICA Eletroquímica Você precisa saber o que é oxidação e redução! Pilha É o nome dado ao dispositivo que aproveita a transferência de elétrons em uma reação
QUÍMICA Professora Caroline Azevedo ELETROQUÍMICA Eletroquímica Você precisa saber o que é oxidação e redução! Pilha É o nome dado ao dispositivo que aproveita a transferência de elétrons em uma reação
DRAFT. Química CONCURSO PETROBRAS. Questões Resolvidas TÉCNICO(A) DE OPERAÇÃO JÚNIOR. Produzido por Exatas Concursos
 CONCURSO PETROBRAS TÉCNICO(A) DE OPERAÇÃO JÚNIOR Química Questões Resolvidas QUESTÕES RETIRADAS DE PROVAS DA BANCA CESGRANRIO Produzido por Exatas Concursos www.exatas.com.br rev.3a Índice de Questões
CONCURSO PETROBRAS TÉCNICO(A) DE OPERAÇÃO JÚNIOR Química Questões Resolvidas QUESTÕES RETIRADAS DE PROVAS DA BANCA CESGRANRIO Produzido por Exatas Concursos www.exatas.com.br rev.3a Índice de Questões
Química Geral e Inorgânica. QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin. Eletroquímica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Departamento de Química Inorgânica IQ / UFRJ IQG 128 / IQG ELETRÓLISE
 10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
(MACK-SP) Na eletrólise ígnea de NaCl, verificase
 (MACK-SP) Na eletrólise ígnea de NaCl, verificase que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição de NaCl. e) no cátodo,
(MACK-SP) Na eletrólise ígnea de NaCl, verificase que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição de NaCl. e) no cátodo,
O que esses dispositivos tem em comum? São dispositivos móveis. O que faz os dispositivos móveis funcionarem?
 O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
4 Fundamentação Teórica (27,28,29)
 4 Fundamentação Teórica (27,28,29) Com base no levantamento bibliográfico percebeu-se que o uso de agentes cloretantes é uma alternativa pouco explorada e com pouca apreciação teórica. Para realizar um
4 Fundamentação Teórica (27,28,29) Com base no levantamento bibliográfico percebeu-se que o uso de agentes cloretantes é uma alternativa pouco explorada e com pouca apreciação teórica. Para realizar um
O Valor da Remanufatura de Rolamentos
 O Valor da Remanufatura de Rolamentos Excelência no Reparo de Rolamentos Experiência em que você confia Os serviços de manutenção industrial da Timken estão fundados em nosso conhecimento de movimento,
O Valor da Remanufatura de Rolamentos Excelência no Reparo de Rolamentos Experiência em que você confia Os serviços de manutenção industrial da Timken estão fundados em nosso conhecimento de movimento,
Equilíbrio químico, pilha e eletrólise.
 Ciências da Natureza Química 2 Gabriela Rosa TRABALHO DE RECUPERAÇÃO FINAL 3ª 35 pts 22,8 pts 12 18 3º A/B Equilíbrio químico, pilha e eletrólise. Instruções: Leia atentamente cada questão antes de resolvê-la.
Ciências da Natureza Química 2 Gabriela Rosa TRABALHO DE RECUPERAÇÃO FINAL 3ª 35 pts 22,8 pts 12 18 3º A/B Equilíbrio químico, pilha e eletrólise. Instruções: Leia atentamente cada questão antes de resolvê-la.
Quí. Quí. Monitor: Rodrigo Pova
 Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
4. Articulação com outras disciplinas, contextos ou áreas do conhecimento
 Sequência Didática Oxirredução com um problemão Autores: Karoline dos Santos Tarnowski e Cleomar Copatti Série: 2 ano do Ensino Médio Número de aulas: 3 de 40 min Origem: Trabalho apresentado à disciplina
Sequência Didática Oxirredução com um problemão Autores: Karoline dos Santos Tarnowski e Cleomar Copatti Série: 2 ano do Ensino Médio Número de aulas: 3 de 40 min Origem: Trabalho apresentado à disciplina
Corrosão e degradação de materiais. Modificação aparência. Interação Comprometimento pp mecânicas
 Corrosão e degradação de materiais Modificação aparência Interação Comprometimento pp mecânicas Deterioração é diferente para os diversos tipos de materiais: M Dissolução (corrosão) Formação de crosta
Corrosão e degradação de materiais Modificação aparência Interação Comprometimento pp mecânicas Deterioração é diferente para os diversos tipos de materiais: M Dissolução (corrosão) Formação de crosta
ELETROQUÍMICA. paginapessoal.utfpr.edu.br/lorainejacobs. Profª Loraine Jacobs DAQBI
 lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI CORROSÃO Corrosão Processo espontâneo Contato do metal com um eletrólito Reações Anódicas e Catódicas Frequente
lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI CORROSÃO Corrosão Processo espontâneo Contato do metal com um eletrólito Reações Anódicas e Catódicas Frequente
Assunto: Eletroquímica Folha 4.1 Prof.: João Roberto Mazzei
 01. (UEL 2009) A clássica célula galvânica ou pilha de Daniel é representada por: Zn (s) / Zn +2 (aq) / / Cu +2 (aq) / Cu (s) No laboratório de uma escola, o professor e seus alunos fizeram duas alterações
01. (UEL 2009) A clássica célula galvânica ou pilha de Daniel é representada por: Zn (s) / Zn +2 (aq) / / Cu +2 (aq) / Cu (s) No laboratório de uma escola, o professor e seus alunos fizeram duas alterações
Físico-Química. Eletroquímica Prof. Jackson Alves
 Físico-Química Eletroquímica Prof. Jackson Alves 1. Pilhas Processo espontâneo de conversão de energia química em energia elétrica. Observe o esquema a seguir: Lâmina de zinco Semicela Zn / Zn 2+ ponte
Físico-Química Eletroquímica Prof. Jackson Alves 1. Pilhas Processo espontâneo de conversão de energia química em energia elétrica. Observe o esquema a seguir: Lâmina de zinco Semicela Zn / Zn 2+ ponte
Ocorrência de reações
 Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA
 GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA Aulas de Apoio Química 3ª Série Eletroquímica II 1.
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA Aulas de Apoio Química 3ª Série Eletroquímica II 1.
OFICINA TEMÁTICA NO CAMPO DE ESTÁGIO: MÉTODOS DE SEPARAÇÃO DE MATERIAIS E SUAS RELAÇÕES COM A SOCIEDADE. Apresentação: Pôster
 OFICINA TEMÁTICA NO CAMPO DE ESTÁGIO: MÉTODOS DE SEPARAÇÃO DE MATERIAIS E SUAS RELAÇÕES COM A SOCIEDADE Danilo Oliveira de Souza 1 140; Richardson Apresentação: Pôster Robério da Silva 2141; Bruna Herculano
OFICINA TEMÁTICA NO CAMPO DE ESTÁGIO: MÉTODOS DE SEPARAÇÃO DE MATERIAIS E SUAS RELAÇÕES COM A SOCIEDADE Danilo Oliveira de Souza 1 140; Richardson Apresentação: Pôster Robério da Silva 2141; Bruna Herculano
Catálogo de produtos
 Catálogo de produtos Galvanização a fogo (zincagem por imersão a quente) - Conforme NBR 6323 O processo de zincagem por imersão a quente é o mesmo que qualquer produto, podendo variar na espessura da camada
Catálogo de produtos Galvanização a fogo (zincagem por imersão a quente) - Conforme NBR 6323 O processo de zincagem por imersão a quente é o mesmo que qualquer produto, podendo variar na espessura da camada
1 Introdução Princípios Básicos da Corrosão Eletroquímica... 5
 Sumário 1 Introdução................................ 1 2 Princípios Básicos da Corrosão Eletroquímica........ 5 2.1 POTENCIAIS ELETROQUÍMICOS............................ 5 2.2 PILHAS DE CORROSÃO...................................17
Sumário 1 Introdução................................ 1 2 Princípios Básicos da Corrosão Eletroquímica........ 5 2.1 POTENCIAIS ELETROQUÍMICOS............................ 5 2.2 PILHAS DE CORROSÃO...................................17
Centro de Pesquisas de Energia Elétrica. Corrosão e Proteção Anticorrosiva. Cristina Amorim. Laboratório de Corrosão do Cepel
 Centro de Pesquisas de Energia Elétrica Corrosão e Proteção Anticorrosiva Cristina Amorim Laboratório de Corrosão do Cepel Departamento de Laboratórios do Fundão (DLF) Departamento de Materiais, Eficiência
Centro de Pesquisas de Energia Elétrica Corrosão e Proteção Anticorrosiva Cristina Amorim Laboratório de Corrosão do Cepel Departamento de Laboratórios do Fundão (DLF) Departamento de Materiais, Eficiência
pilha de Volta pilha Galvânica pilha voltaica rosário
 Em 1786, o anatomista italiano Luigi Galvani (1737-1798) dissecou uma rã e observou contrações nos músculos do animal. As contrações ocorreram no momento em que seu assistente por acaso tocou com a ponta
Em 1786, o anatomista italiano Luigi Galvani (1737-1798) dissecou uma rã e observou contrações nos músculos do animal. As contrações ocorreram no momento em que seu assistente por acaso tocou com a ponta
Ciências da Natureza e Matemática
 1 CEDAE Acompanhamento Escolar 2 CEDAE Acompanhamento Escolar 3 CEDAE Acompanhamento Escolar 1.(UnB/DF) O processo de fabricação dos circuitos integrados impressos, usados na construção de microcomputadores,
1 CEDAE Acompanhamento Escolar 2 CEDAE Acompanhamento Escolar 3 CEDAE Acompanhamento Escolar 1.(UnB/DF) O processo de fabricação dos circuitos integrados impressos, usados na construção de microcomputadores,
FICHA 4 PORQUE É QUE MARTE É VERMELHO? 30:00 * Nível aconselhado. Resultados pretendidos de aprendizagem. Questão-Problema.
 FICHA 4 PORQUE É QUE MARTE É VERMELHO? UMA VIAGEM ATRAVÉS DO SISTEMA SOLAR 30:00 * Nível aconselhado * em aulas diferentes 4.º Ano Resultados pretendidos de aprendizagem * Ficar a saber que o planeta Marte
FICHA 4 PORQUE É QUE MARTE É VERMELHO? UMA VIAGEM ATRAVÉS DO SISTEMA SOLAR 30:00 * Nível aconselhado * em aulas diferentes 4.º Ano Resultados pretendidos de aprendizagem * Ficar a saber que o planeta Marte
a) Disponha todos os elementos do Grupo 1 em ordem decrescente de reatividade e explique a sequência.
 QUÍMICA 1 O desenvolvimento da Tabela Periódica culminou na disposição sistemática dos elementos em grupos de acordo com características químicas similares entre si. Os elementos metálicos pertencentes
QUÍMICA 1 O desenvolvimento da Tabela Periódica culminou na disposição sistemática dos elementos em grupos de acordo com características químicas similares entre si. Os elementos metálicos pertencentes
Exercício de Revisão III Unidade. Eletroquímica
 1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
REVISÃO DE QUÍMICA CEIS Prof. Neif Nagib
 REVISÃO DE QUÍMICA CEIS 2017 Prof. Neif Nagib CÁLCULO DO ph e do poh EXERCÍCIOS DE FIXAÇÃO 01. O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de ph no
REVISÃO DE QUÍMICA CEIS 2017 Prof. Neif Nagib CÁLCULO DO ph e do poh EXERCÍCIOS DE FIXAÇÃO 01. O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de ph no
ESTUDO DO EFEITO DA DENSIDADE DE CORRENTE NO PROCESSO DE ELETRODEPOSIÇÃO DA LIGA Fe-W
 ESTUDO DO EFEITO DA DENSIDADE DE CORRENTE NO PROCESSO DE ELETRODEPOSIÇÃO DA LIGA Fe-W Victória Maria dos Santos Pessigty¹; Lorena Vanessa Medeiros Dantas; Luana Sayuri Okamura; José Anderson Oliveira;
ESTUDO DO EFEITO DA DENSIDADE DE CORRENTE NO PROCESSO DE ELETRODEPOSIÇÃO DA LIGA Fe-W Victória Maria dos Santos Pessigty¹; Lorena Vanessa Medeiros Dantas; Luana Sayuri Okamura; José Anderson Oliveira;
Eletroquímica. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Eletroquímica Professora: Melissa Soares Caetano Disciplina QUI 217 Eletroquímica estuda as relações
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Eletroquímica Professora: Melissa Soares Caetano Disciplina QUI 217 Eletroquímica estuda as relações
Cursos Técnicos Integrados ao Ensino Médio
 Cursos Técnicos Integrados ao Ensino Médio Referência: BROWN, THEODORE L.; LEMAY JR., H. EUGENE; BURSTEN, BRUCE E.; BURDGE, JULIA R.. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005.
Cursos Técnicos Integrados ao Ensino Médio Referência: BROWN, THEODORE L.; LEMAY JR., H. EUGENE; BURSTEN, BRUCE E.; BURDGE, JULIA R.. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005.
Atividade prática - Como se forma a ferrugem? Parte 3
 Atividade prática - Como se forma a ferrugem? Parte 3 1º e 2º ANOS DO ENSINO MÉDIO Objetivo Vivenciar alguns testes para a determinação das causas do surgimento da ferrugem, ou seja, da oxidação dos objetos
Atividade prática - Como se forma a ferrugem? Parte 3 1º e 2º ANOS DO ENSINO MÉDIO Objetivo Vivenciar alguns testes para a determinação das causas do surgimento da ferrugem, ou seja, da oxidação dos objetos
QUESTÃO 46 QUESTÃO 47 QUESTÃO 48 QUESTÃO 49 PROVA DE QUÍMICA I
 17 PROVA DE QUÍMICA I QUESTÃO 46 O alumínio metálico, obtido na indústria à alta temperatura na forma líquida, reage com vapor d`água da atmosfera, produzindo óxido de alumínio e gás hidrogênio, conforme
17 PROVA DE QUÍMICA I QUESTÃO 46 O alumínio metálico, obtido na indústria à alta temperatura na forma líquida, reage com vapor d`água da atmosfera, produzindo óxido de alumínio e gás hidrogênio, conforme
Falhas prematuras de esquemas de pintura aplicados em aço galvanizado novo - Principais causas - Fábio Kränkel
 Falhas prematuras de esquemas de pintura aplicados em aço galvanizado novo - Principais causas - Fábio Kränkel EXPECTATIVA DE DURABILIDADE Aço galvanizado x Intempéries A durabilidade das estruturas galvanizadas
Falhas prematuras de esquemas de pintura aplicados em aço galvanizado novo - Principais causas - Fábio Kränkel EXPECTATIVA DE DURABILIDADE Aço galvanizado x Intempéries A durabilidade das estruturas galvanizadas
E-books PCNA. Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS
 E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS 1 QUÍMICA ELEMENTAR CAPÍTULO 3 SUMÁRIO Apresentação -------------------------------------------- 3 Capítulo 3 ------------------------------------------------
E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 3 REAÇÕES INORGÂNICAS 1 QUÍMICA ELEMENTAR CAPÍTULO 3 SUMÁRIO Apresentação -------------------------------------------- 3 Capítulo 3 ------------------------------------------------
Aplicação de Estratégias de Ensino na Abordagem do Conteúdo de Eletroquímica
 Aplicação de Estratégias de Ensino na Abordagem do Conteúdo de Eletroquímica Ewerton Santos 1, Gabriela Ferreira dos Santos 1, Valdirene Santos Silva 2, Rosanne Pinto de Albuquerque Melo 3, Francisco Luiz
Aplicação de Estratégias de Ensino na Abordagem do Conteúdo de Eletroquímica Ewerton Santos 1, Gabriela Ferreira dos Santos 1, Valdirene Santos Silva 2, Rosanne Pinto de Albuquerque Melo 3, Francisco Luiz
LIMPEZA QUÍMICA E PASSIVAÇÃO. Em Sistemas Críticos de Alta Pureza
 LIMPEZA QUÍMICA E PASSIVAÇÃO Em Sistemas Críticos de Alta Pureza TIPOS DE CONTAMINAÇÃO (FONTES) Contaminação Orgânica Sujidade oriunda de resíduos dos produtos, gorduras, proteínas, óleos, etc. Contaminação
LIMPEZA QUÍMICA E PASSIVAÇÃO Em Sistemas Críticos de Alta Pureza TIPOS DE CONTAMINAÇÃO (FONTES) Contaminação Orgânica Sujidade oriunda de resíduos dos produtos, gorduras, proteínas, óleos, etc. Contaminação
01. (UFV-MG) Considere a pilha, em funcionamento, esquematizada a seguir:
 01. (UFV-MG) Considere a pilha, em funcionamento, esquematizada a seguir: A equação da reação total desta pilha é: a) Zn 0 + 2 Ag 0 Zn +2 + Ag + b) Zn 0 + 2 Ag + Zn +2 + 2 Ag 0 c) Zn +2 + 2 Ag 0 Zn 0 +
01. (UFV-MG) Considere a pilha, em funcionamento, esquematizada a seguir: A equação da reação total desta pilha é: a) Zn 0 + 2 Ag 0 Zn +2 + Ag + b) Zn 0 + 2 Ag + Zn +2 + 2 Ag 0 c) Zn +2 + 2 Ag 0 Zn 0 +
Thiago Pereira da Silva¹ Universidade Estadual da Paraíba- Campus I
 DIAGNÓSTICO DAS DIFICULDADES DE APRENDIZAGEM APRESENTADAS POR DE UMA ESCOLA PÚBLICA DO MUNICÍPIO DE CAMPINA GRANDE-PB PARA O CONTEÚDO DE POLARIDADE. Thiago Pereira da Silva¹ E-mail:thiagoellisson@yahoo.com.br
DIAGNÓSTICO DAS DIFICULDADES DE APRENDIZAGEM APRESENTADAS POR DE UMA ESCOLA PÚBLICA DO MUNICÍPIO DE CAMPINA GRANDE-PB PARA O CONTEÚDO DE POLARIDADE. Thiago Pereira da Silva¹ E-mail:thiagoellisson@yahoo.com.br
Força relativa de oxidantes e redutores
 Força relativa de oxidantes e redutores Os metais comportam-se como redutores nas reações de oxidação-redução e a sua oxidação está associada à sua corrosão. Reação ácido-metal Se colocarmos uma placa
Força relativa de oxidantes e redutores Os metais comportam-se como redutores nas reações de oxidação-redução e a sua oxidação está associada à sua corrosão. Reação ácido-metal Se colocarmos uma placa
08/04/2016. Aulas 8 12 Setor B
 Aulas 8 12 Setor B 1 Eletroquímica estuda os fenômenos envolvidos na transferência de elétrons ocorrida nas reações de oxirredução. ELETROQUÍMICA PILHAS E BATERIAS ELETRÓLISE REAÇÃO ESPONTÂNEA CORRENTE
Aulas 8 12 Setor B 1 Eletroquímica estuda os fenômenos envolvidos na transferência de elétrons ocorrida nas reações de oxirredução. ELETROQUÍMICA PILHAS E BATERIAS ELETRÓLISE REAÇÃO ESPONTÂNEA CORRENTE
PRO-REITORIA DE ENSINO, PESQUISA E PÓS GRADUAÇÃO DIREÇÃO DE ENSINO COORDENAÇÃO DE ENSINO TÉCNICO PLANO DE ENSINO
 PLANO DE ENSINO 1 IDENTIFICAÇÃO Curso: Licenciatura em Ciências Biológicas Componente Curricular: Química Geral Professor (nome e titulação): Kathia Regina Kunzler Bechlin/Licenciada em Química/Especialista
PLANO DE ENSINO 1 IDENTIFICAÇÃO Curso: Licenciatura em Ciências Biológicas Componente Curricular: Química Geral Professor (nome e titulação): Kathia Regina Kunzler Bechlin/Licenciada em Química/Especialista
ELECTROQUÍMICA E CORROSÃO
 Valentim M B Nunes, 2003 ELECTROQUÍMICA E CORROSÃO CORROSÃO 1. Corrosão Podemos definir como corrosão a interacção físico-química de um metal com o meio do qual resultam alterações das propriedades do
Valentim M B Nunes, 2003 ELECTROQUÍMICA E CORROSÃO CORROSÃO 1. Corrosão Podemos definir como corrosão a interacção físico-química de um metal com o meio do qual resultam alterações das propriedades do
Atividade prática - Como se forma a ferrugem? Parte 2
 Atividade prática - Como se forma a ferrugem? Parte 2 1º e 2º anos do Ensino Médio Objetivo Vivenciar alguns testes para a determinação das causas do surgimento da ferrugem, ou seja, da oxidação dos objetos
Atividade prática - Como se forma a ferrugem? Parte 2 1º e 2º anos do Ensino Médio Objetivo Vivenciar alguns testes para a determinação das causas do surgimento da ferrugem, ou seja, da oxidação dos objetos
Factores Influentes na Corrosão e Protecção de Metais. Química 12º Ano
 Factores Influentes na Corrosão e Protecção de Metais Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
Factores Influentes na Corrosão e Protecção de Metais Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
EXERCÍCIOS DE ELETROQUÍMICA
 Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
A CONTEXTUALIZAÇÃO NO ENSINO DE QUÍMICA: a Cinética Química em foco
 A CONTEXTUALIZAÇÃO NO ENSINO DE QUÍMICA: a Cinética Química em foco Fabricia Rejane Gomes da Silva; Ingrid Vieira Machado; Tatiane Pereira Cardoso; Rejane Dias Pereira Mota Eixo 08: Relato de Experiência
A CONTEXTUALIZAÇÃO NO ENSINO DE QUÍMICA: a Cinética Química em foco Fabricia Rejane Gomes da Silva; Ingrid Vieira Machado; Tatiane Pereira Cardoso; Rejane Dias Pereira Mota Eixo 08: Relato de Experiência
Oxirredução IDENTIFICAÇÃO O QUE SOFRE ENTIDADE O QUE FAZ. Oxidante ganha e - ( NOX) oxida o redutor redução
 Eletroquímica Oxirredução ENTIDADE IDENTIFICAÇÃO O QUE FAZ O QUE SOFRE Oxidante ganha e - ( NOX) oxida o redutor redução Redutor perde e - ( NOX) reduz o oxidante oxidação Todas as reações que têm substâncias
Eletroquímica Oxirredução ENTIDADE IDENTIFICAÇÃO O QUE FAZ O QUE SOFRE Oxidante ganha e - ( NOX) oxida o redutor redução Redutor perde e - ( NOX) reduz o oxidante oxidação Todas as reações que têm substâncias
QUÍMICA. Transformações Químicas e Energia. Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday - Parte 4
 QUÍMICA Transformações Químicas e Energia Eletroquímica: Oxirredução, Potenciais Padrão de Redução, - Parte 4 Prof ª. Giselle Blois 1. (CESGRANRIO-RJ) Considere a pilha representada abaixo. Cu(s) Cu 2+
QUÍMICA Transformações Químicas e Energia Eletroquímica: Oxirredução, Potenciais Padrão de Redução, - Parte 4 Prof ª. Giselle Blois 1. (CESGRANRIO-RJ) Considere a pilha representada abaixo. Cu(s) Cu 2+
PMT AULAS 1 E 2 Augusto Camara Neiva. PMT Augusto Neiva
 PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28
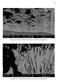 60 Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28 Fotografia 30 - Microestrutura destacada em amarelo na Fotografia 28 61 Tabela 11- Composição química do revestimento da chapa L
60 Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28 Fotografia 30 - Microestrutura destacada em amarelo na Fotografia 28 61 Tabela 11- Composição química do revestimento da chapa L
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele. d) KMnO 4 + H 2 C 2 O 4 + H 2 SO 4 K 2 SO 4 + MnSO 4 + CO 2 + H 2 O
 REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
REVISÃO QUÍMICA 4 ELETROQUÍMICA - Prof Emanuele 1) Os números de oxidação dos halogênios nos compostos NaCl, NaClO 3, KI, I 2, NH 4 IO 3 são, respectivamente: a) +1, +3, 0, -2, +4 b) +1, -5, -1, 0, +5
Centro Educacional Colúmbia 2000
 Discente: Centro Educacional Colúmbia 2000 Tri. 1º/2017 Dependência Docente: Marcos Vinicius Machado Rio, / / Ens. Médio Turma: 2º ano Disciplina: QUÍMICA Nº 1) O gráfico representa as curvas de solubilidade
Discente: Centro Educacional Colúmbia 2000 Tri. 1º/2017 Dependência Docente: Marcos Vinicius Machado Rio, / / Ens. Médio Turma: 2º ano Disciplina: QUÍMICA Nº 1) O gráfico representa as curvas de solubilidade
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
PROPOSTA DE ESTRATÉGIA DIDÁTICA COM A UTILIZAÇÃO DE JOGOS COMPUTACIONAIS NO ENSINO DE QUÍMICA. Apresentação: Pôster
 PROPOSTA DE ESTRATÉGIA DIDÁTICA COM A UTILIZAÇÃO DE JOGOS COMPUTACIONAIS NO ENSINO DE QUÍMICA Apresentação: Pôster Richardson Robério da Silva 1 ; Arthur Fernandes da Rocha Pimentel 2 ; Cláudio Felipe
PROPOSTA DE ESTRATÉGIA DIDÁTICA COM A UTILIZAÇÃO DE JOGOS COMPUTACIONAIS NO ENSINO DE QUÍMICA Apresentação: Pôster Richardson Robério da Silva 1 ; Arthur Fernandes da Rocha Pimentel 2 ; Cláudio Felipe
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015
 PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
Nitretação em banho de sal Durferrit TF 1 (BR) processo TENIFER. Dados relativos aos Sais e ao processo TENIFER
 Nitretação em banho de sal Durferrit TF 1 (BR) processo TENIFER Generalidades O tratamento de nitretação (processo TENIFER) em banho de sais é uma rara opção para se obter peças e ferramentas com alta
Nitretação em banho de sal Durferrit TF 1 (BR) processo TENIFER Generalidades O tratamento de nitretação (processo TENIFER) em banho de sais é uma rara opção para se obter peças e ferramentas com alta
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PC1. [D] SOLUÇÃO PRATIQUE EM CASA Teremos: 2 3 Cr 2O 7 (aq) 14H (aq) 6e 2Cr (aq) 7H2O( ); 0 E 1,33 V C O 4 (aq) 2H (aq) 2e C O 3 (aq) H2O( ); 0 E 1,23 V + 1,33 V > +1,23 V Então: 2 3 Cr 2O 7 (aq)
SOLUÇÃO PC1. [D] SOLUÇÃO PRATIQUE EM CASA Teremos: 2 3 Cr 2O 7 (aq) 14H (aq) 6e 2Cr (aq) 7H2O( ); 0 E 1,33 V C O 4 (aq) 2H (aq) 2e C O 3 (aq) H2O( ); 0 E 1,23 V + 1,33 V > +1,23 V Então: 2 3 Cr 2O 7 (aq)
