UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
|
|
|
- Yago Marques Taveira
- 6 Há anos
- Visualizações:
Transcrição
1 1 l UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS ISADORA MACHADO TEIXEIRA LIMA DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS NA PRESENÇA DE KIT LIGAND (KL) E PROTEÍNA MORFOGENÉTICA ÓSSEA 15 (BMP-15) FORTALEZA 2012
2 2 ISADORA MACHADO TEIXEIRA LIMA DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS NA PRESENÇA DE KIT LIGAND (KL) E PROTEÍNA MORFOGENÉTICA ÓSSEA 15 (BMP-15) Tese apresentada ao Programa de Pós-Graduação em Ciências Veterinárias da Faculdade de Veterinária da Universidade Estadual do Ceará, como requisito parcial para obtenção do título de Doutor em Ciências Veterinárias. Área de concentração: Reprodução e Sanidade Animal. Linha de pesquisa: Reprodução e Sanidade de Pequenos Ruminantes. Orientadora: Profa. Dra. Ana Paula Ribeiro Rodrigues. FORTALEZA 2012
3 3 L732d Lima, Isadora Machado Teixeira Desenvolvimento in vitro de folículos pré-antrais caprinos na presença de kit ligand (KL) e proteína morfogenetica óssea 15 (BMP-15) / Isadora Machado Teixeira Lima f. : il. color, enc. ; 30 cm. Tese (Doutorado) Universidade Estadual do Ceará, Faculdade de Veterinária, Curso de Doutorado em Ciências Veterinárias, Fortaleza, Área de Concentração: Reprodução e Sanidade Animal. Orientação: Profª. Drª. Ana Paula Ribeiro Rodrigues. Co-orientação: Prof. Dr. José Ricardo de Figueiredo 1. KL. 2. BMP Folículos pré-antrais. 4. Cultivo in vitro. 5. Caprinos I. Título. CDD:
4 4 ISADORA MACHADO TEIXEIRA LIMA DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS NA PRESENÇA DE KIT LIGAND (KL) E PROTEÍNA MORFOGENÉTICA ÓSSEA 15 (BMP-15) Tese apresentada ao Programa de Pós-Graduação em Ciências Veterinárias da Faculdade de Veterinária da Universidade Estadual do Ceará, como requisito parcial para obtenção do título de Doutor em Ciências Veterinárias. Aprovada em: 15 / 05 / 2012 BANCA EXAMINADORA Profa. Dra. Ana Paula Ribeiro Rodrigues Universidade Estadual do Ceará (Orientadora) Prof. Dr. Marcelo Marcondes Seneda Universidade Estadual de Londrina (Examinador) Prof. Dr. Marcelo Bertolini Universidade de Fortaleza (Examinador) Profa. Dra. Juliana Jales de Hollanda Celestino Universidade da Integração Internacional da Lusofonia Afro-Brasileira (Examinadora) Dra. Ana Beatriz Graça Duarte Universidade Estadual do Ceará (Examinadora)
5 5 Aos meus pais, Célia e Otacílio; Ao meu irmão, Otávio; Ao meu esposo, Atualpa Júnior, por tudo que representam em minha vida. Com amor, dedico.
6 6 AGRADECIMENTOS Agradeço a Deus, primeiramente, por sempre iluminar os meus caminhos, me dando serenidade e força para seguir em frente, sem nunca desistir dos meus objetivos. Embora muitas vezes eu tenha falhado e deixado de agradecer por todas as Suas bênçãos, Ele tem permanecido aqui, sempre ao meu lado. Aos meus amados pais, Célia Maria Machado de Brito e Otacílio Teixeira Lima Neto, por sempre me incentivarem a crescer profissionalmente e, sobretudo, por todo o amor, carinho e educação, fundamentais para a construção do meu caráter. Sem a dedicação e o amor deles, provavelmente eu não teria alcançado mais essa conquista. Ao meu irmão, Otávio Machado Teixeira Lima, simplesmente por existir e por fazer parte de momentos tão importantes da minha vida, me apoiando e me incentivando. Aos meus outros irmãos, Emiliano Cavalcante Teixeira Lima, Vitório Cavalcante Teixeira Lima e Maria Júlia do Nascimento Teixeira Lima, por todo amor e carinho que sempre me proporcionaram, apesar da distância e da pouca convivência. Ao meu esposo, Francisco Atualpa Soares Júnior, pelo amor, compreensão e companheirismo essenciais ao longo dessa trajetória. Muito obrigada, principalmente, pelo apoio e incentivo nos momentos de angústia, dificuldade e desânimo, e pela serenidade de sempre me mostrar o melhor caminho em todas as situações. Sem o seu apoio, teria sido ainda mais difícil prosseguir. A todos os meus familiares, incluindo minha avó (Vó Coló), tios e primos, pelo estímulo constante às minhas atividades acadêmicas e de pesquisa e, especialmente, pela alegria e união de nossa família que me dá uma base firme e estruturada para buscar a realização dos meus objetivos. À minha orientadora, Profa. Dra. Ana Paula Ribeiro Rodrigues, que acompanhou esta caminhada desde o início com muita dedicação, paciência e amizade, se mostrando sempre disposta a me ajudar e a contribuir com os meus trabalhos em tudo que fosse necessário. Agradeço, sobretudo, pelas conversas, conselhos e por sempre ter estado disposta a me ouvir e compreender quando eu precisei.
7 7 Ao meu co-orientador, Prof. Dr. José Ricardo de Figueiredo, pela oportunidade de ingressar em sua equipe, pela confiança depositada, por todos os ensinamentos e aprendizados e, além de tudo, por acreditar no meu trabalho. Serei eternamente grata não apenas por isso, mas também por todo o crescimento profissional adquirido ao longo desses anos, que será certamente imprescindível para abrir muitas portas na minha vida. Aos colaboradores, Prof. Dr. José Roberto Viana Silva, Prof. Dr. Claudio Cabral Campello, Profa. Dra. Christina Alves Peixoto, MSc. Mariana Aragão Matos Donato e Msc. José Jackson do Nascimento Costa, por terem contribuído de forma valiosa para a realização de nossas pesquisas e elaboração dos artigos dessa tese. Aos membros da banca examinadora, pelo aceite do convite e pela disposição para analisar este trabalho. A toda a equipe do LAMOFOPA, desde os técnicos até os pós-doutorandos, por toda a colaboração concedida durante a execução dos meus experimentos, por todos os ensinamentos e pelos bons momentos vividos juntos. Agradeço especialmente a alguns membros queridos que compõem ou compuseram essa grande equipe e que, mais do que colegas de trabalho, tornaram-se grandes amigos para uma vida inteira: Livia Schell Wanderley, Hiédely Kenia Machado Luz, Ivina Rocha Brito, Rafael Rossetto, Márcia Viviane Alves Saraiva, Luciana Rocha Faustino, Juliana Jales de Hollanda Celestino, Giovanna Quintino Rodrigues, Cleidson Manoel Gomes da Silva, Anderson Pinto Almeida e Cláudio Afonso Pinho Lopes. Nossos momentos de alegria, descontração e amizade foram muito importantes para me ajudar a seguir em frente, mesmo diante dos maiores obstáculos! À minha ex-aluna de iniciação científica, Sarah Tavares de Melo, por tudo que aprendi com a sua co-orientação, pelos bons momentos compartilhados e pela grande amizade que construímos. Ao aluno de iniciação científica Emmanuel Teles Sales, pela incondicional ajuda na execução dos experimentos dessa tese e pelo exemplo de dedicação e amor ao trabalho. Ao Programa de Pós-Graduação em Ciências Veterinárias (PPGCV), especialmente ao coordenador Prof. Dr. Davide Rondina, ao ex-coordenador Prof. Dr. Marcos Fábio Gadelha Rocha e à funcionária Adriana Maria Sales Albuquerque, por todo o auxílio fornecido a nós alunos durante todos os anos de vínculo a este programa. Agradeço ainda ao funcionário
8 8 Antônio César Camelo, cujo auxílio e cooperação foram de grande valia para a realização deste trabalho. À Coordenação de Aperfeiçoamento do Pessoal de Nível Superior (CAPES) pelo apoio financeiro concedido durante todo o curso de doutorado. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), à Rede Nordeste de Biotecnologia (RENORBIO) e à Financiadora de Estudos e Projetos (FINEP), pelo suporte finaceiro às nossas pesquisas. Agradeço, enfim, a todos que contribuíram ou mesmo torceram para a efetivação deste sonho. Muito Obrigada!
9 9 A mente que se abre a uma nova idéia jamais voltará ao seu tamanho original. Albert Einstein
10 10 RESUMO Esse estudo teve como objetivos: 1) quantificar os níveis de RNAm para os receptores de kit ligand (KL) e proteína morfogenética óssea 15 (BMP-15) em folículos ovarianos caprinos utilizando RT-PCR em tempo real; 2) investigar o papel do KL, associado ou não ao hormônio folículo estimulante (FSH) em meio dinâmico, sobre a sobrevivência, ativação e crescimento de folículos pré-antrais caprinos cultivados in situ; 3) avaliar os efeitos do KL e da BMP-15 sobre a sobrevivência, formação de antro e crescimento in vitro de folículos secundários caprinos isolados, bem como sobre a retomada da meiose de seus oócitos. Para o cultivo in situ, fragmentos ovarianos foram cultivados por 16 dias em meio α-mem + contendo KL (50 ng/ml) e/ou FSH (50 ng/ml) dos dias 0 a 8 e/ou 8 a 16 de cultivo. Antes e após o cultivo, os fragmentos foram analisados por histologia, microscopia eletrônica de transmissão e microscopia de fluorescência, sendo os folículos mensurados e classificados em primordiais, transição, primários e secundários, bem como em normais ou atrésicos. Quanto ao cultivo de folículos isolados, folículos secundários foram microdissecados e cultivados por 18 dias em α-mem + suplementado ou não com diferentes concentrações de BMP-15 (10, 50 ou 100 ng/ml) ou KL (50 ou 100 ng/ml), sendo este último fator testado na ausência ou presença de FSH. Após o cultivo, os oócitos foram destinados à maturação in vitro e posteriormente avaliados quanto à viabilidade e retomada da meiose. Os resultados da RT- PCR mostraram que, com a progressão de folículos primários para secundários, houve uma redução nos níveis de RNAm para o receptor do KL (c-kit) e para um receptor da BMP-15 (BMPRII). Além disso, maiores níveis de RNAm foram observados para c-kit nos complexos cumulus-oócito de pequenos e grandes folículos antrais em comparação às suas respectivas células da granulosa/teca, ocorrendo o mesmo para o BMPRII nos grandes folículos antrais. Verificou-se ainda níveis maiores de RNAm para o receptor tipo I da BMP-15 (BMPRIB) nas células da granulosa/teca de grandes folículos antrais em comparação àquelas de pequenos antrais. Após 16 dias de cultivo in situ, observou-se que o meio dinâmico contendo KL até o dia 8 e FSH do dia 8 ao dia 16 manteve a integridade ultraestrutural e induziu a ativação e o crescimento folicular. Quanto aos folículos isolados, a adição de 50 e/ou 100 ng/ml de KL ao cultivo, na ausência de FSH, promoveu a sobrevivência e melhorou a formação de antro, crescimento oocitário e retomada da meiose após 18 dias. Já 50 ng/ml de BMP-15 manteve a ultraestrutura e estimulou a formação de antro e o crescimento de folículos isolados. Em conclusão, os resultados deste estudo mostraram que os RNAm para c-kit, BMPRIB e
11 11 BMPRII foram detectados em todas as categorias foliculares e tipos celulares investigados. A utilização de KL e FSH de forma dinâmica em cultivo in situ, bem como de KL (50 e/ou 100 ng/ml) e BMP-15 (50 ng/ml) em cultivo de folículos secundários isolados, promoveu a manutenção da sobrevivência folicular e o desenvolvimento de folículos pré-antrais caprinos. Palavras-chave: KL. BMP-15. Folículos pré-antrais. Cultivo in vitro. Caprinos.
12 12 ABSTRACT The aims of this study were: 1) to quantify the mrna levels for kit ligand (KL) and bone morphogenetic protein 15 (BMP-15) receptors in goat ovarian follicles by real time RT-PCR; 2) to investigate the role of KL alone or associated with follicle stimulating hormone (FSH) in a dynamic medium on the survival, activation and growth of goat preantral follicles cultured in situ; 3) to evaluate the effects of KL and BMP-15 on the in vitro survival, antrum formation and growth of goat isolated secondary follicles, and on the meiotic resumption of their oocytes. For the in situ culture, ovarian fragments were cultured for 16 days in α-mem + containing KL (50 ng/ml) and/or FSH (50 ng/ml) from days 0 to 8 and/or 8 to 16 of culture. Before and after culture, the fragments were analysed by histology, transmission electron microscopy and fluorescence microscopy, and the follicles were measured and classified as primordial, intermediate, primary and secondary, as well as normal or atretic. For the isolated follicles, secondary follicles were microdissected and cultured for 18 days in α-mem + supplemented or not with different concentrations of BMP-15 (10, 50 or 100 ng/ml) or KL (50 or 100 ng/ml), with the latter factor being tested in the absence or presence of FSH. After culture, the oocytes were used for in vitro maturation and subsequently evaluated for viability and meiotic resumption. RT-PCR results showed that, with the progression of primary to secondary follicles, a reduction was observed in the mrna levels for KL receptor (c-kit) and one type of BMP-15 receptor (BMPRII). Moreover, higher mrna levels were observed for c- kit in cumulus-oocyte complexes from small and large antral follicles compared with their respective granulosa/theca cells, which also occurred for BMPRII in the large antral follicles. Higher mrna levels were also seen for BMP-15 type I receptor (BMPRIB) in the granulosa/theca cells from large antral follicles compared with those from small antral follicles. After 16 days of in situ culture, the dynamic medium containing KL until day 8 and FSH from day 8 to day 16 maintained the ultrastructural integrity and induced activation and follicular growth. For the isolated follicles, the addition of 50 and/or 100 ng/ml of KL to the culture, in the absence of FSH, promoted follicle survival and improved antrum formation, oocyte growth and meiotic resumption after 18 days. BMP-15 (50 ng/ml) maintained the ultrastructure and stimulated antrum formation and growth in isolated follicles. In conclusion, the results of this study showed that mrnas for c-kit, BMPRIB and BMPRII were detected in all follicular categories and cellular types investigated. The use of KL and FSH dynamically in in situ culture, and the use of KL (50 and/or 100 ng/ml) and BMP-15 (50
13 13 ng/ml) in culture of isolated secondary follicles, promoted the maintenance of follicular survival and the development of caprine preantral follicles. Keywords: KL. BMP-15. Preantral follicles. In vitro culture. Caprine.
14 14 LISTA DE FIGURAS Revisão de Literatura Figura 1. Representação esquemática do ovário mamífero...34 Figura 2. Classificação dos folículos ovarianos de acordo com a sua morfologia em préantrais (primordiais, transição, primários e secundários) e antrais (terciários e préovulatórios)...36 Figura 3. Esquema ilustrativo demonstrando a participação de fatores inibitórios (-) e estimulatórios (+) na ativação de folículos primordiais...42 Figura 4. Desenho esquemático ilustrando alguns dos fatores de crescimento, peptídeos e hormônios que participam da progressão de folículos primários até o estágio antral...46 Capítulo 1 Figura 1. Esquema ilustrando o nó de cisteína e a ponte bissulfídica da maioria dos membros da superfamília TGF-β. Note os seis resíduos de cisteína conservada (1, 2, 3, 5, 6 e 7) envolvidos na formação do nó de cisteína (estrutura tridimensional) e o resíduo 4 implicado na formação da ponte bissulfídica responsável pela constituição de dímeros ligados covalentemente...72 Figura 2. Estrutura e dimerização da BMP-15. A BMP-15 apresenta-se inicialmente como uma pré-proproteína dotada de um sinal peptídico (S-P), uma pró-região (ProR) e uma região madura (R-M). Após a remoção do S-P, ocorre a dimerização da pró-proteína através de ligações não-covalentes entre as R-M das subunidades. Em seguida, enzimas proteolíticas clivam a pró-proteína no sítio RXXR, separando a ProR da R-M, o que resulta na formação da proteína madura dimérica bioativa...73
15 15 Figura 3. Via de sinalização da BMP-15. A BMP-15 se liga primariamente ao receptor ALK- 6, ao qual apresenta maior afinidade, e em seguida recruta o receptor BMPR-II constitutivamente fosforilado. O BMPR-II, por sua vez, transfosforila o ALK-6 previamente ligado à BMP-15, induzindo a fosforilação das proteínas de sinalização intracelular, denominadas Smads 1, 5 e 8. Os Smads 1, 5 e 8 fosforilados interagem com o Smad 4 e o complexo formado é translocado para o núcleo, onde interage com fatores transcricionais e regula a expressão de genes-alvo, determinando a ação da proteína...75 Figura 4. Estrutura das isoformas do KL. O KL-1 e o KL-2 encontram-se inicialmente ancorados à membrana, sendo dotados de um domínio extracelular, um domínio transmembranário hidrofóbico e uma pequena cauda citoplasmática. O KL-1, contudo, sofre proteólise devido à presença de um sítio de clivagem codificado pelo exon 6, resultando na liberação de seu domínio extracelular (forma solúvel). Já o KL-2 permanece estavelmente ancorado à membrana, em virtude da ausência do exon 6 e do sítio de clivagem proteolítica...80 Figura 5. Via de sinalização do KL. A fosfatase lipídica específica do oócito (PTEN) atua como um regulador negativo do padrão PI3K/AKT, induzindo a ativação do fator de transcrição FKHRL1 e o consequente bloqueio do desenvolvimento oocitário (quiescência). A ativação do sistema KL/c-kit, por sua vez, ativa o padrão PI3K/AKT, ocasionando a supressão do FKHRL1 e resultando no estímulo ao desenvolvimento e crescimento do oócito...83 Figura 6. Interação entre BMP-15 e KL. A BMP-15 atua em seu receptor (R) presente nas células da granulosa, estimulando a expressão de KL. O KL, por sua vez, age no c-kit expresso no oócito suprimindo a expressão da BMP-15. Esta interação mostra a existência de um sistema de feedback negativo entre as células da granulosa e o oócito...88 Capítulo 2 Figure 1. Tested treatments according to supplementation of the medium for the in vitro culture of caprine ovarian tissues...110
16 16 Figure 2. Histological sections of normal preantral follicles from the fresh control ( a ) or tissue cultured for 16 days with KL (KL/KL) ( b ) and of degenerated preantral follicles cultured for 16 days in α-mem + alone ( c ) or in FSH+KL/FSH ( d ). n = Oocyte nucleus; gc = granulosa cell; o = oocyte. Note the pyknotic nuclei (dark arrows), retracted oocytes (light arrows), and disorganized granulosa cells (dgc) Figure 3. Electron micrographs of follicles before and after 16 days of culture. Normal preantral follicle from noncultured ovarian tissue (fresh control) ( a ). Normal preantral follicle after in vitro culture in the KL/FSH treatment ( b ). Degenerated follicle after in vitro culture in α-mem + alone ( c ). o = Oocyte; n = oocyte nucleus; nu = nucleolus; gc = granulosa cell; er = endoplasmic reticulum; m = mitochondria; v = vacuole. 119 Figure 4. Viability assessment of caprine preantral follicles using fluorescent probes. Viable preantral follicles from noncultured ovarian tissue (fresh control) ( a ) and after in vitro culture in the KL/FSH treatment ( b ), both labeled with calcein-am (green fluorescence). Nonviable preantral follicle cultured in α-mem + alone ( c ) labeled with ethidium homodimer-1 (red fluorescence).120 Capítulo 3 Figure 1. Levels of c-kit mrna in goat ovarian follicles (mean ± SD). (A) Primordial, primary, and secondary follicles, (B) COCs from small and large antral follicles, (C) granulosa/theca cells from small and large antral follicles, (D) COCs and granulosa/theca cells from small antral follicles, and (E) COCs and granulosa/theca cells from large antral follicles Figure 2. (A) Caprine preantral follicle at day 0, and (B) antral follicle after 18 days of in vitro culture with 50 ng/ml KL..144 Figure 3. Caprine preantral follicles cultured in vitro for 18 days in the absence (control) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 2 culture medium without FSH. (A) Percentage of follicle survival; (B) percentage of antrum formation; (C) oocyte diameter (mean ± SD).145
17 17 Figure 4. Caprine preantral follicles cultured in vitro for 18 days in the absence (control FSH) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 3 culture medium containing FSH. (A) Percentage of follicle survival; (B) percentage of antrum formation; (C) oocyte diameter (mean ± SD).148 Figure 5. Fluorescence of oocytes from caprine preantral follicles cultured in vitro for 18 days. (A) Viable oocyte labeled by calcein AM (green fluorescence) after culture with 100 ng/ml KL and (B) non-viable oocyte marked with ethidium homodimer-1 (red fluorescence) after culture in control FSH; fully grown oocyte from preantral follicle cultured with 50 ng/ml KL showing (C) the chromatin in intact germinal vesicle and (D) metaphase II after staining with Hoechst (400x magnification) Capítulo 4 Figure 1. Levels of BMPRIB mrna in goat ovarian follicles (mean ± SD). (a) Primordial, primary, and secondary follicles; (b) COCs from small and large antral follicles; (c) Granulosa/theca cells from small and large antral follicles; (d) COCs and granulosa/theca cells from small antral follicles; and (e) COCs and granulosa/theca cells from large antral follicles Figure 2. Levels of BMPRII mrna in goat ovarian follicles (mean ± SD). (a) Primordial, primary, and secondary follicles; (b) COCs from small and large antral follicles; (c) Granulosa/theca cells from small and large antral follicles; (d) COCs and granulosa/theca cells from small antral follicles; and (e) COCs and granulosa/theca cells from large antral follicles 174 Figure 3. Stereomicrography of caprine preantral follicles cultured in vitro. (a) Caprine preantral follicles at day 0; (b) Healthy follicle after 6 days of culture, showing an initial antral cavity; (c, d) Healthy follicles with well-defined antral cavities after 12 and 18 days of in vitro culture, respectively 175
18 18 Figure 4. Caprine preantral follicles cultured in vitro for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml). (a) Percentage of follicle survival; (b) Percentage of antrum formation.176 Figure 5. Fluorescence of oocytes from caprine preantral follicles cultured in vitro for 18 days. (a) Cumulus oocyte complexes (COCs) obtained from grown follicles; (b) Non-stained oocyte (diameter 110 µm) mechanically denuded after maturation; (c) Viable oocyte marked with calcein-am (green fluorescence); (d) Non-viable oocyte marked with ethidium homodimer-1 (red fluorescence); (e) Fully grown oocyte labeled with Hoechst showing an intact nuclear membrane (germinal vesicle stage), (f) Germinal vesicle breakdown, (g) Metaphase I, and (h) Metaphase II Figure 6. TEM micrographs of follicles. (a, b) Follicles from the fresh control showing normal ultrastructure, with a regular zona pellucida, cytoplasm and nucleus. (c, d) Follicles cultured in the BMP-15 [50] treatment for 18 days showing ultrastructure similar to the fresh control. (e, f) Follicles cultured in the control medium (α-mem + without BMP-15) for 18 days, exhibiting some features of cellular stress. n: nucleus; nu: nucleolus; m: mitochondria; ri: ribosome; r: endoplasmic reticulum; cg: cortical granule; zp: zona pellucida; v: vacuoles; l: lipid droplets. Magnifications: 4.400x (a, c, e) and x (b, d, f); bars: 5 µm (a, c, e) and 1 µm (b, d, f).. 182
19 19 LISTA DE TABELAS Capítulo 2 Table 1. Percentages (mean ± SEM) of morphologically normal preantral follicles in noncultured tissues (fresh control) and tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH..115 Table 2. Percentages (mean ± SEM) of primordial and growing follicles in noncultured tissues (fresh control) and tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH..116 Table 3. Follicle diameters (mean ± SEM) in noncultured tissues (control) and in tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH 118 Table 4. Oocyte diameters (mean ± SEM) in noncultured tissues (fresh control) and tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH 118 Capítulo 3 Table 1. Oligonucleotide primers used for PCR analysis of goat cells and tissues 139 Table 2. Follicular diameter (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 2 - culture medium without FSH Table 3. Meiotic stages of caprine oocytes from preantral follicles cultured for 18 days in the absence (control) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 2 - culture medium without FSH.147 Table 4. Follicular diameter (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control FSH) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 3 - culture medium containing FSH
20 20 Table 5. Meiotic stages of caprine oocytes from preantral follicles cultured for 18 days in the absence (control FSH) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 3 - culture medium containing FSH.150 Capítulo 4 Table 1. Oligonucleotide primers used for real-time PCR analysis of goat cells Table 2. Follicular diameter (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml)..177 Table 3. Daily follicular growth (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml).178 Table 4. Meiotic stages of caprine oocytes from preantral follicles cultured for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml).180
21 21 LISTA DE ABREVIATURAS E SIGLAS % : Porcentagem ~ : Aproximadamente < : Menor que > : Maior que ± : Mais ou menos : Maior ou igual C : Graus Celsius µg : Micrograma µl : Microlitro µm : Micrômetros μm µmol ACK-2 AFX : Micromolar : Micromol : Anticorpo anti-c-kit : Acute- lymphocytic-leukaemia-1 fused gene from chromosome X AI : Anaphase I (Anáfase I) AKT : Protein kinase B (Proteína quinase B) ALK-6 AMH ANOVA ART as ATP : Activin receptor-like kinase-6 (Quinase semelhante ao receptor da ativina-6) : Anti-Müllerian hormone (Hormônio anti-mülleriano) : Analysis of variance (Análise de variância) : Assisted reproduction technologies (Tecnologias de reprodução assistida) : Antisense (Anti-senso) : Adenosine-5'-triphosphate (Adenosina-5 -trifosfato)
22 22 Bak Bax : Bcl-2 antagonist killer (Antagonista assassino de Bcl-2) : Bcl-2 associated X protein (Proteína x associada ao Bcl-2) Bcl-2 : B-cell lymphoma 2 (Linfoma de células B 2) Bcl-xL Bid Bik BMP-4, -7, -15 BMPRIB, -II BSA Ca 2+ CaCl 2 CAPES cdna CETENE cg CGO CGP c-kit CNPq CO 2 COCs : Bcl-2 related protein, long isoform (Proteína relacionada ao Bcl-2 de longa isoforma) : BH3 interacting domain death agonist (Agonista de morte com domínio de interação BH3) : Bcl-2 interacting killer (Proteína exterminadora que interage com Bcl- 2) : Bone morphogenetic protein-4, -7, -15 (Proteína morfogenética óssea- 4, -7, -15) : Type IB and II of bone morphogenetic protein receptor (receptor de proteína morfogenética óssea do tipo IB, II) : Bovine serum albumin (Albumina sérica bovina) : Íon cálcio : Cloreto de cálcio : Coordenação de Aperfeiçoamento do Pessoal de Nível Superior : Complementary deoxyribonucleic acid (Ácido desoxirribonucléico complementar) : Centro de Tecnologias Estratégicas do Nordeste : Cortical granules (Grânulos da cortical) : Complexo células da granulosa-oócito : Células germinativas primordiais : Kit ligand receptor (Receptor para kit ligand) : Conselho Nacional de Desenvolvimento Científico e Tecnológico : Dióxido de carbono : Cumulus oocyte complexes (Complexos cumulus-oócito)
23 23 CPqAM CT dgc DNA DNAse dntp Dr. Dra. DTT e.g. ECD EGF er Fas FecX : Centro de Pesquisa Aggeu Magalhães : Cycle threshold : Disorganized granulosa cells (Células da granulosa desorganizadas) : Deoxyribonucleic acid (Ácido desoxirribonucléico) : Desoxirribonuclease : Deoxy-nucleotide-triphophates (Desoxinucleotídeo trifosfato) : Doutor : Doutora : Dithiothreitol (Ditiotreitol) : Exempli gratia (Por exemplo) : Extracellular domain (Domínio extracelular) : Epidermal growth factor (Fator de crescimento epidermal) : Endoplasmic reticulum (Retículo endoplasmático) : Fatty acid synthetase (Sintetase de ácidos graxos) : Locus de um gene de fecundidade ligado ao cromossomo X FGF-2,-7,-8,-8B,-10 : Fibroblast growth factor-2, -7, -8, -8B, -10 (Fator de crescimento fibroblástico-2, -7, -8, -8B, -10) FGFb FGFR-2b,-3c Fig. FIGα FINEP FIOCRUZ FIV : Basic fibroblast growth factor (Fator de crescimento fibroblástico básico) : Fibroblast growth factor receptor-2b, -3c (Receptor do fator de crescimento fibroblástico-2b, -3c) : Figura : Factor in the germ-line alpha (Fator de linha germinal alfa) : Financiadora de Estudos e Projetos : Fundação Oswaldo Cruz : Fecundação in vitro
24 24 FKHR : Forkhead transcription factor FKHRL1 : Forkhead transcription factor like 1 Foxl2 : Forkhead box protein L2 Foxo1, 3a, 4 : Forkhead box-o transcription factors 1, 3a, 4 FSC FSH g GAPDH gc GDF-9,-9B GDNF GH GI GLM GT GV GVBD HC HGF : Fator stem cell (Fator de células-tronco) : Follicle stimulating hormone (Hormônio folículo estimulante) : Gravidade : Glyceraldehydes-2-phophate dehydrogenase (Gliceraldeído-2-fosfato desidrogenase) : Granulosa cells (Células da granulosa) : Growth diferentiation factor-9, -9B (Fator de crescimento e diferenciação-9, -9B) : Glial cell-derived neurotrophic factor (Fator neurotrófico derivado da célula glial) : Growth hormone (Hormônio do crescimento) : GenInfo identifier (GenInfo identificador) : General linear models (Modelos lineares generalizados) : Granulosa/theca cells (Células da granulosa e teca) : Germinal vesicle (Vesícula germinal) : Germinal vesicle breakdown (Rompimento da vesícula germinativa) : Histologia clássica : Hepatocyte growth factor (Fator de crescimento de hepatócito) i.e. : id est (isto é) IA IBGE IGF-1,-2 : Inseminação artificial : Instituto Brasileiro de Geografia e Estatística : Insulin-like growth factor-1, -2 (Fator de crescimento semelhante à insulina-1, -2)
25 25 IGFBPs ITS IVM kg KGF : Insulin-like growth factor-binding proteins (Proteínas de ligação dos fatores de crescimento semelhantes à insulina) : Insulin, tranferrin and selenium (Insulina, transferrina e selênio) : In vitro maturation (Maturação in vitro) : Quilograma : Keratinocyte growth factor (Fator de crescimento keratinócito) KL-1,-2 : Kit ligand-1, -2 Kv l LAMOFOPA LH : Quilovolts : Lipid droplets (Gotas lipídicas) : Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais : Luteinizing hormone (Hormônio luteinizante) LHX8 : LIM-homeobox protein 8 LIF m M MA MAPK : Leukemia inhibitory factor (Fator inibidor de leucemia) : mitochondria (mitocôndria) : Molar : Massachusetts : Mitogen-activated protein kinase (Proteína quinase ativada por mitógenos) MEM MET mg : Minimal essential medium (Meio essencial mínimo) : Microscopia eletrônica de transmissão : Miligramas MI : Metaphase I (Metáfase I) MII Min ml mm : Metaphase II (Metáfase II) : Minuto : Mililitro : Milímetro
26 26 mm mm 3 mmol MN MO MOIFOPA : Milimolar : Milímetro cúbico : Milimol : Minneapolis : Missouri : Manipulação de Oócitos Inclusos em Folículos Ovarianos Pré- Antrais mosm/l mrna Msc. n Na + ng NGF nm NOBOX nu NUBIS o : Miliosmol/litro : Messenger ribonucleic acid (Ácido ribonucléico mensageiro) : Master of Science (Mestre em Ciências) : Nucleus (Núcleo) : Íon sódio : Nanograma : Nerve growth factor (Fator de crescimento do nervo) : Nanômetro : Newborn ovary homeobox gene : Nucleolus (Nucléolo) : Núcleo de Biotecnologia de Sobral : Oocyte (Oócito) P<0.05 : Probabilidade de erro menor do que 5% P>0.05 : Probabilidade de erro maior do que 5% p. : Página p27 P450scc PBS : Proteína inibidora de quinase dependente de ciclina : Cholesterol side-chain cleavage enzyme (Enzima de clivagem da cadeia lateral do colesterol) : Phosphate buffer saline (Tampão fosfato salino)
27 27 PCR PDGF PGC ph PI3K PPGCV Prof. Profa. ProR : Polimerase chain reaction (Reação em cadeia de polimerase) : Platelet-derived growth factor (Fator de crescimento derivado de plaquetas) : Primordial germ cells (Células germinativas primordiais) : Potencial hidrogeniônico : Phosphoinositide 3-kinase (Fosfatidilinositol 3-quinase) : Programa de Pós-Graduação em Ciências Veterinárias : Professor : Professora : Pró-região PTEN : Phosphatase and tensin homolog deleted on chromosome 10 (Fosfatase e tensina homóloga com deleção no cromossomo 10) qrt-pcr r RENORBIO rfsh : Quantitative reverse transcription polymerase chain reaction (Reação em cadeia de polimerase via transcrição reversa quantitativa) : Endoplasmic reticulum (Retículo endoplasmático) : Rede Nordeste de Biotecnologia : Recombinant follicle stimulating hormone (Hormônio folículo estimulante recombinante) ri rigf-i R-M RNA RNAm RNAse RT-PCR : Ribosome (Ribossomo) : Recombinant insulin-like growth factor-1 (Fator de crescimento semelhante à insulina-1 recombinante) : Região madura : Ribonucleic acid (Ácido ribonucléico) : Messenger ribonucleic acid (Ácido ribonucléico mensageiro) : Ribonuclease : Reverse transcription-polimerase chain reaction (Reação em cadeia de polimerase via transcrição reversa)
28 28 RXXR s SAS SB SC1494 SD Sec SEM Sl : Sítio de clivagem proteolítica : Sense (Senso) : Statistical analysis system (Sistema de análise estatística) : Inibidor de receptores ALK : Anticorpo anti-c-kit : Standard deviation (Desvio padrão) : Second (Segundo) : Standard error of means (Erro padrão da média) : Gene Steel Smads 1,4,5,8 : Small mother against decapentaplegic 1, 4, 5, 8 SNK SP S-P StAR : Student Newman Keuls : São Paulo : Sinal Peptídico : Steroidogenic acute regulatory protein (Proteína reguladora aguda da esteroidogênese) TCM199 : Tissue Culture Medium 199 (Meio de cultivo tecidual 199) TE TEM TGF-β : Transferência de embriões : Transmission electronic microscopy (Microscopia eletrônica de transmissão) : Transforming growth factor beta (Fator de crescimento transformante beta) TI : Telophase I (Telófase I) TrkB : Tyrosine kinase receptor B (Receptor tirosina-quinase B) Tsc-1 U UECE : Tuberous sclerosis protein 1 (Proteína do complexo tuberose esclerose 1) : Unidade : Universidade Estadual do Ceará
29 29 UK USA v : United Kingdom (Reino Unido) : United States of America (Estados Unidos da América) : Vacuoles (Vacúolos) v. : Volume VEGF : Vascular endothelial growth factor (Fator de crescimento do endotélio vascular) VIP vs. zp α-mem α-mem + : Vasoactive intestinal peptide (Peptídeo intestinal vasoativo) : Versus : Zona pellucida (Zona pelúcida) : Alpha minimal essential medium (Meio essencial mínimo alfa) : Supplemented alpha minimal essential medium (Meio essencial mínimo alfa suplementado)
30 30 SUMÁRIO 1 INTRODUÇÃO REVISÃO DE LITERATURA O ovário mamífero Foliculogênese e classificação dos folículos ovarianos Regulação das diferentes fases da foliculogênese Formação de folículos primordiais Transição de folículos primordiais para primários Progressão de folículos primários para secundários Progressão de folículos secundários para antrais Implicações da biotécnica de MOIFOPA Sistemas de cultivo in vitro para o desenvolvimento de folículos pré-antrais Estado atual do cultivo in vitro de folículos pré-antrais Importância da composição do meio de cultivo sobre o desenvolvimento folicular in vitro Técnicas para análise folicular antes e após o cultivo in vitro Histologia clássica Microscopia eletrônica de transmissão Microscopia de fluorescência Biologia molecular JUSTIFICATIVA HIPÓTESES CIENTÍFICAS OBJETIVOS Objetivo geral Objetivos específicos CAPÍTULO 1 Papel da proteína morfogenética óssea 15 (BMP-15) e kit ligand (KL) na regulação da foliculogênese em mamíferos CAPÍTULO 2 Meio dinâmico contendo kit ligand e hormônio folículo estimulante promove sobrevivência, ativação e crescimento folicular durante cultivo in vitro de longa
31 31 duração de folículos pré-antrais caprinos CAPÍTULO 3 Presença de RNAm para c-kit em ovários caprinos e melhoria da sobrevivência e desenvolvimento in vitro de folículos pré-antrais com kit ligand CAPÍTULO 4 Níveis de expressão de RNAm para BMPRIB e BMPRII em folículos ovarianos caprinos e os efeitos in vitro da BMP-15 sobre o desenvolvimento de folículos préantrais CONCLUSÕES PERSPECTIVAS REFERÊNCIAS BIBLIOGRÁFICAS
32 32 1 INTRODUÇÃO O rebanho caprino no Brasil é estimado em aproximadamente de cabeças, sendo destas (93%) localizadas na região Nordeste do país (IBGE, 2009). Embora esses números sejam notoriamente expressivos, a caprinocultura do Nordeste brasileiro ainda exibe baixos índices de produtividade, o que se mostra diretamente relacionado, dentre outros fatores (por exemplo, manejo sanitário e nutricional deficientes e criações de caprinos visando apenas a subsistência do pequeno produtor), à elevada rusticidade dos métodos de reprodução comumente adotados. Nesse contexto, faz-se necessária a utilização de biotécnicas reprodutivas sofisticadas a fim de aumentar a eficiência reprodutiva da espécie caprina, e ainda promover a melhoria e preservação da genética desses animais. Dentre as biotécnicas que podem contribuir para o incremento da reprodução em caprinos, destacam-se a inseminação artificial (IA), a fecundação in vitro (FIV), a transferência de embriões (TE), a clonagem e a manipulação de oócitos inclusos em folículos ovarianos pré-antrais (MOIFOPA). Esta última biotécnica, também conhecida como Ovário Artificial, tem recebido merecido enfoque nos últimos anos em virtude do seu papel significativo na otimização do potencial reprodutivo de fêmeas domésticas. Como nas demais espécies, o ovário da fêmea caprina mantém a sua fertilidade na forma de um estoque de oócitos imaturos inclusos em milhares de folículos pré-antrais, que em sua grande maioria irão se tornar atrésicos durante o seu crescimento e maturação. A MOIFOPA, em contrapartida, visa prevenir a morte destes folículos por atresia e promover a recuperação de um grande número de oócitos inclusos em folículos pré-antrais, no intuito de permitir o seu crescimento e completa maturação utilizando sistemas de cultivo in vitro (FIGUEIREDO et al., 2007). Por meio de tal alvo, a MOIFOPA será capaz de contribuir, decisivamente, no sentido de oferecer condições propícias para a conservação e multiplicação de animais de alto valor genético e/ou em vias de extinção (FIGUEIREDO et al., 2008). Sabendo que a espécie caprina apresenta vasto interesse econômico como importante fonte de carne, leite e pele, especialmente na região Nordeste do Brasil, a implementação de sistemas de cultivo in vitro capazes de proporcionar o aproveitamento do potencial oocitário destes animais torna-se de grande valia e relevância. Nesse contexto, inúmeras pesquisas dentro do âmbito da MOIFOPA vêm sendo desenvolvidas a fim de aprimorar as técnicas de cultivo e maturação in vitro na espécie caprina, além de melhor compreender a foliculogênese
33 33 ovariana nesta espécie, ainda pouco elucidada. Com base nessas pesquisas, tem-se evidenciado o envolvimento orquestrado de diferentes substâncias de origem hipofisária e gonadal na indução do crescimento folicular pré-antral in vitro. Dentre essas substâncias, merecem importante destaque o kit ligand (KL) e a proteína morfogenética óssea 15 (BMP- 15), uma vez que ambas têm demonstrado papel significativo na regulação e controle da foliculogênese em diversas espécies, atuando positivamente sobre funções cruciais, como a ativação, o crescimento e a sobrevivência folicular (HUTT; MCLAUGHLIN; HOLLAND, 2006; OTSUKA, 2010; CELESTINO et al., 2011). Para uma melhor compreensão da importância deste trabalho, a revisão de literatura a seguir contemplará aspectos relacionados ao ovário mamífero, regulação da foliculogênese, implicações da biotécnica de MOIFOPA, sistemas de cultivo folicular, estado atual do cultivo in vitro, importância da composição do meio de cultivo, com enfoque para as substâncias avaliadas na presente tese, e técnicas utilizadas para análise folicular antes e após o cultivo in vitro.
34 34 2 REVISÃO DE LITERATURA 2.1 O ovário mamífero Em todas as espécies mamíferas, o ovário é composto de duas regiões distintas, uma cortical e outra medular, e é circundado externamente por uma superfície epitelial, comumente conhecida como epitélio germinativo. A região medular é localizada na porção mais interna do ovário, com exceção dos equídeos, e contém nervos, vasos sanguíneos e linfáticos responsáveis pela nutrição e sustentação do ovário. Já o córtex ovariano é composto de tecido conjuntivo (fibroblastos, colágeno e fibras reticulares), folículos ovarianos em diferentes estágios de desenvolvimento, bem como corpos lúteos, albicans e hemorrágicos (SILVA, 2005; Figura 1). Figura 1. Representação esquemática do ovário mamífero. Adaptado de O ovário desempenha duas funções prioritárias para o sistema reprodutivo de fêmeas, sendo responsável pela diferenciação e liberação de um oócito maturo para a fecundação
35 35 (MCGEE; HSUEH, 2000), bem como pela síntese e secreção de hormônios e fatores de crescimento (HIRSHFIELD, 1991), eventos estes que caracterizam, respectivamente, as funções gametogênica e endócrina do ovário. As substâncias de origem ovariana, associadas a hormônios e peptídeos provenientes da corrente sanguínea, estão envolvidas na formação de um sistema bastante complexo que regula o desenvolvimento folicular e a ciclicidade, contribuindo para a manutenção das funções reprodutivas das fêmeas mamíferas (HIRSHFIELD, 1991; JUNQUEIRA; CARNEIRO, 2004a). 2.2 Foliculogênese e classificação dos folículos ovarianos A foliculogênese pode ser definida como o processo de formação, crescimento e maturação folicular, iniciando-se com a gênese do folículo primordial e culminando com o estágio de folículo pré-ovulatório (VAN DEN HURK; ZHAO, 2005). Na maioria das espécies, a foliculogênese se inicia ainda na vida fetal. Entretanto, em roedores, este processo tem início durante os primeiros dias após o nascimento (FORTUNE, 2003). O folículo é considerado a unidade morfofuncional do ovário e é constituído de um oócito circundado por células da granulosa e células tecais, que proporcionam as condições ideais para a manutenção da viabilidade, crescimento e liberação de um oócito maturo no processo de ovulação (KNIGHT; GLISTER, 2006; NILSSON et al., 2011). Ao longo do desenvolvimento folicular, a morfologia dos folículos é alterada, sendo verificado o crescimento do oócito, a multiplicação e diferenciação das células da granulosa, bem como o aparecimento das células tecais (BRISTOL-GOULD; WOODRUFF, 2006). Com base nas mudanças morfológicas observadas durante a progressão folicular, os folículos podem ser classificados em: i) pré-antrais ou não-cavitários, que abrangem os folículos primordiais, de transição, primários e secundários; e em ii) antrais ou cavitários, compreendendo os folículos terciários e de De Graaf ou pré-ovulatórios (SILVA et al., 2004a; Figura 2). Vale ressaltar que os folículos pré-antrais representam 90% da população folicular e são responsáveis pela renovação contínua de folículos antrais no ovário (KATSKA- KSIAZKIEWICZ, 2006). Uma vez formados os folículos primordiais, o desenvolvimento dos folículos pré-antrais subvidide-se em três diferentes fases (FORTUNE, 2003): ativação dos folículos primordiais, resultando na formação dos folículos primários; progressão de folículos
36 36 primários para folículos secundários; e desenvolvimento de folículos secundários até folículos antrais. Figura 2. Classificação dos folículos ovarianos de acordo com a sua morfologia em préantrais (primordiais, transição, primários e secundários) e antrais (terciários e préovulatórios). 2.3 Regulação das diferentes fases da foliculogênese Formação de folículos primordiais O início do desenvolvimento ovariano em mamíferos é caracterizado pela migração de células germinativas primordiais (CGP) a partir do saco vitelínico para a gônada primitiva, com sua posterior colonização (BRISTOL-GOULD; WOODRUFF, 2006). Tal migração é controlada por sinais quimiotáticos produzidos pela própria crista gonadal em desenvolvimento (OKTEM; OKTAY, 2008), e incluem a participação de integrinas (ANDERSON et al., 1999) e do sistema de sinalização kit ligand/c-kit (BUEHR et al., 1993). À medida que as CGP atingem as gônadas, estas são incorporadas em cordões sexuais (SMITZ; CORTVRINDT, 2002), e multiplicam-se ativamente por mitose, diferenciando-se em oogônias. As oogônias adquirem então um maior número de organelas intracelulares (ABIR et al., 2006) e dividem-se sucessivamente por mitose, formando ninhos de oogônias interligados por pontes intercelulares (PEPLING, 2006). Após a parada das mitoses, as oogônias entram na primeira divisão meiótica e diferenciam-se em oócitos primários (SUH;
37 37 SONNTAG; ERICKSON, 2002). Em seguida, os oócitos perdem suas pontes intercelulares e são circundados por uma camada de células somáticas planas, também conhecidas como células da pré-granulosa, originárias do mesonefron e/ou epitélio ovariano (MCNATTY et al., 2000; JUENGEL et al., 2002). A partir desse momento, são formados os folículos primordiais, dando início ao processo de foliculogênese. Após a formação dos folículos primordiais, os oócitos sofrem uma parada da meiose no estádio de diplóteno ou vesícula germinativa (prófase I) e as células da pré-granulosa interrompem sua multiplicação, atingindo uma fase de quiescência. A progressão da divisão meiótica ocorre somente na puberdade, com o pico pré-ovulatório dos hormônios folículo estimulante (FSH) e luteinizante (LH), formação dos oócitos secundários e outra parada da meiose na fase de metáfase II (GORDON, 1994). A meiose será retomada novamente somente após a fecundação do oócito pelo espermatozóide, originando, ao final, o oócito haplóide fecundado (FIGUEIREDO et al., 2008). Evidências sugerem o envolvimento de importantes moléculas e fatores de transcrição na formação dos folículos primordiais. Dentre estes, pode-se destacar o fator de linhagem germinal α (FIGα), detectado em oócitos ainda na fase embrionária, e considerado um dos primeiros fatores identificados com atuação efetiva nesse processo. Experimentos com camundongos nocaute para o gene do FIGα têm revelado que este fator é crucial para a formação de folículos primordiais, uma vez que a inibição de FIGα funcional resultou na ausência de folículos primordiais ao nascimento e consequente esterilidade (SOYAL; AMLEH; DEAN, 2000). Outro fator que vem demonstrando importante papel durante o processo de formação folicular é o LHX8. Esse fator está envolvido no padrão de formação e sobrevivência do folículo primordial, sendo preferencialmente expresso no oócito de ovários de camundongas. Estudos recentes demonstraram que camundongas com ausência de expressão de LHX8 falharam em manter os folículos primordiais e que estes desapareceram na primeira semana de vida (CHOI et al., 2008). As neurotrofinas podem também estar envolvidas na sinalização entre CGP e células somáticas no momento da formação dos folículos primordiais. Essa afirmativa foi formulada com base nas mudanças observadas ao longo do desenvolvimento no padrão de expressão da neurotrofina 4 e do seu receptor de alta afinidade (TrkB) em oócitos de humanos e ovários de ratas (ANDERSON et al., 2002). Estudos in vitro sugerem que o fator de crescimento do nervo (NGF) pode estar envolvido não apenas na inervação ovariana, mas também na formação folicular em ratas e camundongas (OJEDA et al., 2000). Além disso, em
38 38 camundongas, o NGF parece participar da diferenciação de células mesenquimais envolvidas na formação dos folículos primordiais (DISSEN et al., 2001). Em contraste, outros estudos têm demonstrado que hormônios como a progesterona e o estrógeno inibem a formação folicular (KEZELE; SKINNER, 2003), e que mudanças nos níveis desses hormônios nos ovários em desenvolvimento contribuem para regular o momento do processo de formação dos folículos primordiais (CHEN et al., 2007; YANG; FORTUNE, 2008; NILSSON; SKINNER, 2009). Aliado a isto, Nilsson et al. (2011) reportaram recentemente o envolvimento do hormônio anti-mulleriano (AMH) na inibição da formação folicular, destacando o seu papel na redução do tamanho da reserva inicial de folículos primordiais em ovários de ratas Transição de folículos primordiais para primários Em mamíferos, os folículos primordiais representam cerca de 95% da grande totalidade de folículos presentes no ovário. Até alguns anos atrás, acreditava-se que os folículos primordiais formados durante a vida intrauterina ou logo após o nascimento (roedores) constituíam o pool de células germinativas disponíveis durante toda a vida reprodutiva de uma fêmea (EPIFANO; DEAN, 2002). Esse dogma foi primeiramente descrito em 1870 (WALDEYER, 1870), e reforçado em 1951 (ZUCKERMAN, 1951), quando então passou a ser amplamente conhecido e aceito pela comunidade científica mundial. Contudo, estudos mais aprofundados acerca desse tema demonstraram mecanismos envolvidos na síntese de novos oócitos e folículos no ovário de mulheres (BUKOVSKY et al., 2004) e camundongas (JOHNSON et al., 2004, 2005) durante a vida adulta, por meio de células germinativas intra e extraovarianas, desafiando a idéia do estoque finito de folículos ao nascimento. Atualmente, a possibilidade da nova formação folicular (ou neofoliculogênese) tem se tornado algo bem estabelecido mundialmente, uma vez que estudos recentes associando técnicas in vitro e in vivo têm comprovado, em ovários de camundongas (ZOU et al., 2009) e mulheres (WHITE et al., 2012), o surgimento de novos oócitos e folículos a partir de células-tronco germinativas ovarianas, resultando até mesmo na obtenção de nascimentos em camundongas após a fecundação desses oócitos (ZOU et al., 2009). Os folículos primordiais podem permanecer meses a anos em estado quiescente até serem recrutados para iniciar o crescimento (OKTEM; URMAN, 2010; NILSSON et al., 2011). O início do crescimento dos folículos primordiais, também conhecido como ativação,
39 39 caracteriza-se pelo crescimento oocitário, multiplicação das células da granulosa e transformação da morfologia dessas células da forma pavimentosa para a cúbica (FIGUEIREDO et al., 2008; AERTS; BOLS, 2010a). Durante esta fase, podem existir folículos contendo células da granulosa pavimentosas associadas com células cúbicas, sendo estes denominados folículos de transição (SILVA et al., 2004a). Quando o oócito é circundado por uma camada completa de células da granulosa de morfologia cúbica, os folículos atingem um estágio mais avançado de desenvolvimento e são classificados como primários (GOUGEON; BUSSO, 2000). Nesse tipo de folículo, as células da granulosa aumentam em número e tornam-se mais volumosas, passando a manter um estreito contato com o oócito mediado por endocitose (VAN DEN HURK; BEVERS; BECKER, 1997). Na espécie caprina, os folículos primários possuem diâmetro de aproximadamente 50 m e são inicialmente observados por volta do 71 dia de vida fetal (BEZERRA et al., 1998). Sabe-se que o desenvolvimento folicular inicial, incluindo a transição de folículo primordial para folículo primário, é independente de gonadotrofinas e que é regulado, principalmente, por fatores intraovarianos (VAN DEN HURK; ZHAO, 2005; ZUCOTTI et al., 2011). Segundo diversos estudos (PICTON; BRIGGS; GOSDEN, 1998; FORTUNE, 2003; AERTS; BOLS, 2010a), a ativação de folículos primordiais é controlada por um delicado balanço entre fatores inibitórios e estimulatórios presentes no próprio ovário. Nesse sentido, tem sido sugerido que a prevalência de fatores inibitórios no ambiente ovariano influencia a permanência dos folículos primordiais em seu pool de reserva, bloqueando a progressão folicular, e contribuindo para a preservação da vida reprodutiva das fêmeas (FORTUNE et al., 1998; O BRIEN; PENDOLA; EPPIG, 2003; BROEKMANS et al., 2007). Pesquisas nesse tema, utilizando camundongos geneticamente modificados, têm de fato relatado a atuação de algumas moléculas inibidoras da ativação folicular, incluindo a Tsc-1, PTEN, Foxo3a, p27 e Foxl2. De acordo com tais pesquisas, a perda da função dessas moléculas inibitórias resultou na ativação prematura do pool de folículos primordiais (CASTRILLON et al., 2003; RAJAREDDY et al., 2007; REDDY et al., 2008; ADHIKARI et al., 2010), causando uma inevitável exaustão da reserva folicular e falha ovariana prematura. Outra importante substância intraovariana de ação inibitória é o AMH. Esse hormônio corresponde a um dos membros da superfamília do fator de crescimento transformante (TGF- ) e é sintetizado pelas células da granulosa de folículos em crescimento (WEENEN et al., 2004). Em camundongos com nocaute para o gene do AMH, verificou-se um aumento no recrutamento de folículos primordiais, associado a um maior número de folículos em
40 40 crescimento no ovário (DURLINGER et al., 1999, 2002). Tais achados foram posteriormente reforçados por estudos utilizando folículos de vacas (GIGLI et al., 2005) e mulheres (CARLSSON et al., 2006), os quais também constataram o papel inibitório do AMH sobre o crescimento dos folículos primordiais. Contudo, apesar da maioria dos trabalhos convergirem para tal efeito do AMH, existem relatos na literatura que defendem a atuação positiva desse hormônio no início do desenvolvimento de folículos primordiais em humanos (SCHMIDT et al., 2005). Além dos sinais inibitórios que bloqueiam a ativação prematura dos folículos primordiais, há também outros sinais no ovário, os estimulatórios, que promovem a transição desses folículos para o estágio primário. Tais sinais correspondem, principalmente, a fatores de crescimento originados de diferentes compartimentos foliculares, incluindo oócitos, células somáticas (granulosa e teca) e estroma, que atuam de maneira coordenada e sinérgica para promover o início do crescimento dos folículos (OKTEM; URMAN, 2010). Dentre os fatores de crescimento conhecidamente efetivos na ativação de folículos primordiais, destaca-se o kit ligand (KL). O KL é sintetizado pelas células da granulosa e atua em seu receptor (c-kit) expresso no oócito e células intersticiais/tecais (PARROTT; SKINNER, 1999; NILSSON; SKINNER, 2001), regulando o início do crescimento folicular. Aliado a isto, o KL exerce um efeito antiapoptótico sobre as CGP, oogônias, oócitos e folículos pré-antrais, e ainda controla o crescimento dos oócitos e o recrutamento de células da teca (DRIANCOURT et al., 2000; HUTT; MCLAUGHLIN; HOLLAND, 2006). Quando adicionado em meios de cultivo in vitro, o KL promoveu, de modo efetivo, a ativação folicular em diversas espécies, incluindo ratas (NILSSON; SKINNER, 2004), hamsters (WANG; ROY, 2004) e cabras (CELESTINO et al., 2010). Além disso, foi demonstrado que camundongas portando mutações nos genes que codificam o KL ou o c-kit apresentaram inúmeros problemas de fertilidade, variando de ausência de CGP no ovário até a inabilidade para iniciar o crescimento folicular (YOSHIDA et al., 1997; HUTT; MCLAUGHLIN; HOLLAND, 2006). Tais achados comprovam a elevada importância da interação KL/c-kit no ovário, suportando o papel central desse sistema durante o desenvolvimento folicular inicial (GOUGEON, 2010). O fator inibidor de leucemia (LIF) e o fator de crescimento fibroblástico 2 (FGF-2 ou FGF básico), sintetizados pelas células da granulosa e pelo oócito, respectivamente, também possuem papel comprovado na ativação dos folículos primordiais, sendo capazes ainda de estimular a expressão do KL nas células da granulosa e, deste modo, otimizar o crescimento de folículos até o estágio primário (NILSSON; KEZELE; SKINNER, 2002; NILSSON;
41 41 SKINNER, 2004). Aliado a isso, peptídeos sintetizados por células mesenquimais que circundam os folículos primordiais (células precursoras da teca), conhecidos como fator de crescimento queratinócito (KGF) e fator de crescimento do hepatócito (HGF), podem também atuar nas células da pré-granulosa e/ou células da granulosa aumentando a expressão do KL e amplificando assim seus efeitos positivos no desenvolvimento folicular (KEZELE; NILSSON; SKINNER, 2005; GUGLIELMO et al., 2011). Além dessas substâncias, diversos membros da superfamília TGF-, como as proteínas morfogenéticas ósseas 4, 7 e 15 (BMP-4, BMP-7 e BMP-15) e o fator de crescimento e diferenciação 9 (GDF-9), secretados por células do estroma/mesenquimais (BMP-4 e BMP-7) e pelo oócito (BMP-15 e GDF-9), também têm demonstrado papéis críticos na ativação de folículos primordiais (VITT et al., 2000; LEE et al., 2001; NILSSON; SKINNER, 2003; MARTINS et al., 2008; CELESTINO et al., 2011). Segundo Nilsson e Skinner (2003), a exposição de ovários de ratas à BMP-4 in vitro aumentou o número de folículos primários em crescimento, ao passo que a neutralização desse fator resultou em redução do volume ovariano e perda progressiva de folículos primordiais. Já estudos utilizando a BMP-7 in vivo e in vitro demonstraram uma redução no número de folículos primordiais, associada a um concomitante aumento no número de folículos primários, secundários e antrais em roedores (LEE et al., 2001, 2004). Quanto ao papel dos fatores oocitários BMP-15 e GDF-9 no processo de ativação, estudos in vitro demonstraram que o cultivo de folículos primordiais na presença dessas substâncias (individualmente) promoveu o significativo aumento do número de folículos primários em ovários caprinos (MARTINS et al., 2008; CELESTINO et al., 2011). Além disso, a expressão de BMP-15 e GDF-9 (proteína e RNAm), bem como de seus receptores em folículos primordiais de algumas espécies, tem sugerido a participação direta dessas substâncias na ativação folicular (SILVA et al., 2004b; MERY et al., 2007; SUN et al., 2010; CELESTINO et al., 2011; ALMEIDA et al., 2011). Através do cultivo in vitro de folículos ovarianos, foi demonstrada ainda a participação de outras proteínas, como a insulina (KEZELE; NILSSON; SKINNER, 2002; CHAVES et al., 2011) e o fator de crescimento derivado de plaquetas (PDGF - NILSSON; DETZEL; SKINNER, 2006) no início do crescimento de folículos primordiais. Além disso, outros autores também citam a participação de genes estimulatórios na ativação folicular, como por exemplo, o gene oócito-específico NOBOX (CASTRILLÓN et al., 2003; RAJKOVIC et al., 2004). Um estudo utilizando ratas com nocaute para o NOBOX indicou a sua importância no processo de ativação, uma vez que na ausência desse gene os folículos não
42 42 sofreram transição para o estágio primário (RAJKOVIC et al., 2004). Este efeito possivelmente está associado ao fato do NOBOX regular a expressão de genes oócitoespecíficos, como o GDF-9 e a BMP-15, com ações documentadas sobre o crescimento dos folículos primordiais. A figura a seguir (Figura 3) mostra os fatores inibitórios e estimulatórios envolvidos na ativação folicular. Figura 3. Esquema ilustrativo demonstrando a participação de fatores inibitórios (-) e estimulatórios (+) na ativação de folículos primordiais. Adaptado de Knight e Glister, Progressão de folículos primários para secundários Com o crescimento dos folículos primários, inicia-se a formação dos chamados folículos secundários ou multilaminados (PICTON; BRIGGS; GOSDEN, 1998). Tais folículos são caracterizados pela presença de duas ou mais camadas de células da granulosa cúbicas localizadas em torno do oócito, bem como pela formação de uma camada de células tecais envolvendo a membrana basal folicular (VAN DEN HURK; ZHAO, 2005). À medida que o folículo cresce, a camada de células tecais se estratifica e se diferencia em duas partes distintas. A parte mais periférica, denominada teca externa, é composta de células não diferenciadas, ao passo que as células localizadas mais internamente, formando a teca interna,
43 43 contêm algumas células precursoras de fibroblastos capazes de se diferenciar e secretar esteróides (GOUGEON, 2010). As células da teca interna correspondem à porção vascularizada do folículo e são definidas quando há a formação de quatro ou mais camadas de células da granulosa (LUCCI et al., 2001). Outra importante característica que marca a passagem de folículos primários para o estágio de folículos secundários corresponde à nítida identificação da zona pelúcida ao redor do oócito (LUCCI et al., 2001; VAN DEN HURK; ZHAO, 2005). Além disso, nos folículos secundários as células da granulosa apresentam uma extensiva rede de junções do tipo gap ou junções intercomunicantes, que correspondem a canais membranários que permitem a passagem de nutrientes, íons inorgânicos, segundos mensageiros e pequenos metabólitos entre as células (KIDDER; MHAWI, 2002; GOUGEON, 2010), fundamentais para manter a funcionalidade do folículo. Nesse estágio, os oócitos entram em extensiva fase de crescimento, resultando em uma complexa organização citoplasmática dependente da síntese de novos produtos gênicos e organelas, bem como da modificação e redistribuição das organelas já existentes (PICTON; BRIGGS; GOSDEN, 1998). Além do expressivo aumento no número de ribossomos, mitocôndrias e outras organelas, os oócitos em crescimento acumulam grânulos glicogênicos, proteínas e lipídios, e sofrem ainda um incremento na síntese de RNA e proteínas, considerados importantes para garantir a futura competência meiótica (VAN DEN HURK; ZHAO, 2005). O desenvolvimento de folículos secundários com multicamadas a partir de folículos primários é um processo lento que pode demandar meses. Vários estudos in vivo e in vitro têm demonstrado que o número de folículos secundários, seu tamanho, número de células e taxa de atresia são influenciados por gonadotrofinas, das quais o FSH é o fator de sobrevivência predominante, atuando ainda no estímulo à formação de junções gap entre as células da granulosa (VAN DEN HURK; BEVERS; BECKERS, 1997; VAN DEN HURK et al., 2000). Embora os folículos primários e secundários sejam responsivos às gonadotrofinas, estes podem se desenvolver com níveis mínimos de FSH circulante ou na ausência de receptores funcionais para esse hormônio, o que torna duvidoso o significativo papel in vivo do FSH nessa fase (VAN DEN HURK et al., 2000; VAN DEN HURK; ZHAO, 2005; OKTEM; URMAN, 2010). Por outro lado, diversos fatores intraovarianos, neurotrofinas e neurotransmissores vêm demonstrando relevante atuação na formação de folículos secundários em diferentes espécies (Figura 4).
44 44 Entre as neurotrofinas e neurotransmissores, o NGF e o peptídeo intestinal vasoativo (VIP), respectivamente, têm se mostrado bons candidatos para estimular a transição de folículos primários para secundários. Na presença de níveis séricos normais de FSH, ovários de camundongas deficientes em NGF exibiram números acentuadamente reduzidos de folículos primários e secundários, havendo ainda uma marcada diminuição na proliferação de células da granulosa após o cultivo dos tecidos ovarianos dessas camundongas (DISSEN et al., 2001). O VIP também tem sido apontado como um importante regulador do desenvolvimento de folículos primários e secundários iniciais em bovinos (HULSHOF et al., 1994), além de ter sido implicado na função esteroidogênica das células da granulosa em estágios foliculares iniciais e mais avançados em roedores (DISSEN; LES; OJEDA, 1993; MCGEE; HSUEH, 2000). Além destas substâncias, Yang e Fortune (2006, 2007) relataram ainda a influência da testosterona e do fator de crescimento do endotélio vascular (VEGF) na transição de folículos primários para secundários, o que foi constatado após cultivos in vitro utilizando folículos pré-antrais bovinos. Dentre os fatores de crescimento envolvidos na formação dos folículos secundários, pode-se dar enfoque ao GDF-9 e à BMP-15. Tais substâncias são consideradas essenciais para a progressão até folículos secundários, uma vez que animais geneticamente deficientes para esses fatores mostraram um bloqueio do desenvolvimento folicular além do estágio de folículo primário (DONG et al., 1996; MCNATTY et al., 2007). Além disso, estudos recentes em folículos pré-antrais caprinos evidenciaram a importância da atuação do GDF-9 (MARTINS et al., 2008) e da BMP-15 (CELESTINO et al., 2011) na progressão de folículos primários até o estágio secundário in vitro, destacando ainda os seus efeitos positivos sobre a manutenção da viabilidade folicular nesta fase. Além desses fatores, o KL também tem sido associado a uma série de eventos relativos à formação dos folículos secundários, incluindo a proliferação das células da granulosa, regulação da esteroidogênese e recrutamento de células da teca (PARROTT; SKINNER, 1997, 2000; REYNAUD et al., 2000). Por meio do estímulo de alguns fatores, como a BMP-15 e o LIF, o KL sofre aumento da sua expressão nas células da granulosa foliculares (OTSUKA; SHIMASAKI, 2002; NILSSON; KEZELE; SKINNER, 2002), o que pode culminar na influência positiva do KL sobre a formação dos folículos secundários (DRIANCOURT et al., 2000). Mais detalhes sobre a atuação do KL e da BMP-15 no desenvolvimento folicular, bem como sobre os efeitos da interação dessas duas substâncias, serão abordados no Capítulo 1 desta tese.
45 45 Vários outros fatores de crescimento intraovarianos, como o TGF-, fator de crescimento epidermal (EGF), ativina e FGF-2, têm sido implicados na formação, desenvolvimento e também sobrevivência de folículos secundários em roedores e espécies domésticas, o que tem sido constatado por meio de estudos in vitro que identificaram a influência positiva destas substâncias sobre a proliferação das células da granulosa e/ou inibição da apoptose celular (ROBERTS; ELLIS, 1999; SARAGUETA; LANUZA; BARANAO, 2002; ZHOU; ZHANG, 2005; OKTEM; OKTAY, 2007). Em contraste, outros estudos apontam o papel negativo do AMH não somente na formação e ativação folicular, mas também no desenvolvimento de folículos primários até o estágio secundário e demais estágios foliculares (OKTEM; URMAN, 2010) Progressão de folículos secundários para antrais Após o crescimento dos folículos secundários e organização das células da granulosa em várias camadas, ocorre a formação de uma cavidade repleta de líquido folicular denominada antro. A partir deste estágio, os folículos passam a ser denominados antrais ou cavitários. O crescimento dos folículos durante a fase antral é caracterizado pela proliferação e diferenciação das células da granulosa e da teca, aumento da vascularização folicular, crescimento do oócito e aumento do espaço contendo o fluido antral. Tal fluido corresponde ao ambiente ao qual o oócito é submetido durante o seu desenvolvimento e maturação, e é composto de substâncias reguladoras derivadas do sangue ou de secreções das células foliculares (VAN DEN HURK; ZHAO, 2005). Entre essas substâncias, estão presentes gonadotrofinas, esteróides, fatores de crescimento, enzimas, proteoglicanas e lipoproteínas, consideradas fundamentais para a determinação da qualidade oocitária (WU et al., 2007). Os sinais e mecanismos que regulam a formação da cavidade antral durante o desenvolvimento dos folículos secundários ainda não são plenamente compreendidos. Contudo, sabe-se que além da participação de aquaporinas presentes nas células da granulosa, bem como de ácido hialurônico e versicano produzidos por essas células, há ainda o envolvimento de hormônios e fatores de crescimento na formação antral (VAN DEN HURK; ZHAO, 2005; RODGERS; IRVING-RODGERS, 2010). De fato, estudos in vitro utilizando FSH (MAO et al., 2002; SARAIVA et al., 2011), LH (CORTVRINDT; HU, SMITZ, 1998), hormônio do crescimento (GH - MAGALHÃES et al., 2011), fator de crescimento semelhante à insulina 1 (IGF-1 - MAGALHÃES-PADILHA et al., 2012), ativina (ZHAO et al., 2001),
46 46 KL (REYNAUD et al., 2000) e EGF (GUTIERREZ et al., 2000) têm comprovado os efeitos destas substâncias na formação de antro em folículos secundários em crescimento. Aliado a isto, outros fatores locais, como o TGF- (LIU et al., 1999), FGF-2 (ROBERTS; ELLIS, 1999), GDF-9 (HAYASHI et al., 1999) e BMP-15 (OTSUKA et al., 2000) têm sido considerados estimuladores da proliferação das células da granulosa nesta fase, evento fundamental para a ocorrência da progressão folicular. Em ratas, bovinos e primatas, o neutransmissor VIP foi apontado ainda como um importante regulador do desenvolvimento de folículos secundários (VAN DEN HURK et al., 2000; MCGEE; HSUEH, 2000). A Figura 4 a seguir ilustra resumidamente as diferentes substâncias envolvidas no crescimento folicular desde o estágio primário até a formação do folículo antral. Figura 4. Desenho esquemático ilustrando alguns dos fatores de crescimento, peptídeos e hormônios que participam da progressão de folículos primários até o estágio antral. Adaptado de Knight e Glister, Os folículos antrais são primeiramente observados em ovários caprinos no 110 dia de crescimento fetal (BEZERRA et al., 1998). É importante destacar que pequenos folículos antrais podem ter diâmetros similares aos dos folículos secundários (~200 µm), embora aumentem rapidamente em tamanho com o contínuo acúmulo de fluido folicular (BRISTOL- GOULD; WOODRUFF, 2006). Em roedores, com o desenvolvimento do antro é possível identificar o crescimento e a aquisição da competência meiótica do oócito (EPPIG; SCHROEDER, 1989). Já em humanos e bovinos, o desenvolvimento da competência meiótica não é estritamente relacionado à formação do antro, mas há uma correlação direta
47 47 entre a capacidade do oócito superar o bloqueio da meiose e o tamanho folicular nestas espécies (TROUNSON; ANDERIESZ; JONES, 2001). Em caprinos, a competência meiótica completa é adquirida em folículos de 3 mm, os quais correspondem a um oócito de aproximadamente 110 μm de diâmetro (HYTTEL et al., 2002). O desenvolvimento dos folículos antrais é caracterizado por uma fase de crescimento, recrutamento, seleção e dominância (VAN DEN HURK; ZHAO, 2005), sendo a formação de folículos pré-ovulatórios um pré-requisito para a ovulação e formação do corpo lúteo, bem como para manutenção da fertilidade (DRUMMOND, 2006). A fase antral é dependente das gonadotrofinas, FSH e LH, que induzem o recrutamento e o crescimento sincronizado de folículos antrais em ondas foliculares (FORTUNE et al., 2001). Além das gonadotrofinas, peptídeos sintetizados localmente desempenham papel-chave na regulação da fase antral, tanto por meio de mecanismos parácrinos como endócrinos (WEBB et al., 2003; FORTUNE; RIVERA; YANG, 2004). Dentre esses peptídeos, merecem destaque o sistema IGF, incluindo os fatores IGF-1, IGF-2 e as proteínas de ligação dos IGFs (IGFBPs), além de alguns membros da família FGF, como o FGF-2, FGF-7 (ou KGF), FGF-8 e FGF-10 (FORTUNE; RIVERA; YANG, 2004; BURATINI et al., 2004, 2005a; BURATINI, 2007). Os IGFs são sinérgicos ao FSH na promoção do crescimento folicular e produção de estradiol (FORTUNE; RIVERA; YANG, 2004). Ademais, a interação entre os FGFs e o FSH contribui positivamente para a manutenção do crescimento folicular nessa fase, uma vez que o FSH estimula a expressão dos receptores para os FGFs (FGFR-2b e FGFR-3c) em células da granulosa, sensibilizando as células de folículos recém-recrutados à ação mitogênica dos FGFs (BURATINI et al., 2005a,b). O aumento das concentrações plasmáticas de FSH constitui o estímulo necessário para o recrutamento e emergência da onda folicular (ADAMS et al., 1992). Em espécies monovulatórias, apenas um folículo é selecionado dentre os recrutados para continuar a crescer e diferenciar-se em folículo ovulatório, enquanto os demais têm como destino a atresia. O folículo selecionado é conhecido como folículo dominante e suprime ativamente o crescimento dos subordinados pela secreção de estradiol e inibina (FORTUNE, 1994; GINTHER et al., 1996). Segundo Baker e Spears (1999), o aparecimento de folículos subordinados e dominantes é resultante de uma complexa interação entre ações endócrinas indiretas, resultantes da secreção de estradiol e inibina pelos grandes folículos selecionados, e regulações intraovarianas diretas, que envolvem a participação de fatores de crescimento locais e iniciam ou exarcebam a diferença entre folículos.
48 48 Na fase final do desenvolvimento folicular, ocorre uma diminuição dos níveis circulantes de FSH em resposta ao alto nível de estradiol e inibina produzidos pelo folículo. Nesse momento, o LH passa a otimizar a foliculogênese, acelerando o desenvolvimento folicular e determinando uma redução nas exigências de FSH pelos folículos (FILICORI et al., 2001). Observa-se então a formação do folículo pré-ovulatório, caracterizado por um oócito circundado por células da granulosa especializadas, denominadas células do cumulus. Em resposta ao LH, as células da granulosa dos folículos pré-ovulatórios param de se multiplicar e iniciam o programa final de diferenciação. Com o pico pré-ovulatório de LH durante a puberdade, o oócito retoma a meiose e progride da prófase I para a metáfase II, proporcionando a ovulação de um oócito maturo (HILLIER, 2001; AERTS; BOLS, 2010b). Diante da complexidade dos eventos que regem a foliculogênese e da nítida importância dos fatores de crescimento intraovarianos para a regulação desse processo, especialmente na fase pré-antral (FORTUNE, 2003; VAN DEN HURK; ZHAO, 2005), diversos pesquisadores têm focado suas investigações no teste de inúmeras concentrações e/ou associações de fatores de crescimento em sistemas de cultivo in vitro desenvolvidos para folículos pré-antrais de diferentes espécies. Nesse contexto, e com o intuito de estudar os efeitos de importantes fatores de crescimento no desenvolvimento folicular em caprinos, experimentos com cultivo in vitro de folículos pré-antrais foram realizados nesta espécie utilizando as substâncias KL e BMP-15, e serão abordados nos Capítulos 2 a 4 desta tese. 2.4 Implicações da biotécnica de MOIFOPA Conforme mencionado previamente, em todas as espécies mamíferas os folículos são recrutados do pool de reserva ovariano, no qual se encontram quiescentes, para iniciar uma dinâmica e complexa fase de crescimento que culminará, em condições favoráveis, no fenômeno de ovulação. No entanto, já é bem estabelecido na literatura que apenas 0,1% dos folículos ovarianos irão ovular ao longo da vida reprodutiva da fêmea, sendo a sua grande maioria destinada à morte por atresia folicular (mais informações acerca desse tema serão descritas posteriormente, no tópico População e atresia folicular abordado no Capítulo 1 da presente tese). Tendo em vista essa expressiva perda folicular que ocorre naturalmente in vivo em diferentes espécies, e na tentativa de utilizar de maneira eficiente o potencial de gametas
49 49 femininos no futuro, vem sendo desenvolvida a biotécnica de MOIFOPA ou Ovário Artificial. Esta biotécnica visa o resgate de folículos pré-antrais do ambiente ovariano, seguido das etapas de conservação (resfriamento ou criopreservação) e/ou cultivo in vitro até o estágio de maturação folicular (FIGUEIREDO et al., 2008), prevenindo assim, a ocorrência da atresia. Uma vez que os folículos pré-antrais representam cerca de 90 a 95% de toda a população folicular ovariana, a MOIFOPA torna-se uma alternativa para o fornecimento de milhares de oócitos viáveis, inicialmente inclusos em folículos pré-antrais em diferentes estágios de desenvolvimento, para as biotécnicas de fecundação in vitro e clonagem (TELFER, 1996), contribuindo assim para a produção in vitro de embriões em larga escala. Além disso, o desenvolvimento pleno de um adequado sistema de cultivo in vitro para folículos pré-antrais, alvo maior dessa biotécnica, será bastante útil para compreender o complexo mecanismo que regula a foliculogênese inicial, além de disponibilizar ferramentas essenciais para a multiplicação de animais domésticos e para o tratamento da infertilidade em humanos (FIGUEIREDO et al., 2011). Para promover o desenvolvimento de folículos ovarianos pré-antrais in vitro é necessário o estabelecimento de um sistema de cultivo ideal para cada etapa do crescimento folicular. Com esse intuito, vários sistemas de cultivo in vitro foram desenvolvidos nas últimas décadas e os resultados têm se mostrado dependentes do tipo de meio, protocolo utilizado e da espécie animal investigada (FORTUNE, 2003; PICTON et al., 2008). 2.5 Sistemas de cultivo in vitro para o desenvolvimento de folículos pré-antrais Diferentes métodos têm sido desenvolvidos para a manutenção da viabilidade e do crescimento de folículos pré-antrais in vitro (PICTON et al., 2008). Em roedores, a pequena dimensão dos ovários possibilita o cultivo do órgão inteiro, o que tem sido bastante útil para o estudo da foliculogênese inicial em pequenos mamíferos (O BRIEN; PENDOLA; EPPIG, 2003). Por outro lado, em animais domésticos de médio e grande porte, devido às grandes dimensões dos ovários, este modelo torna-se inviável. Nestes animais, o cultivo de pequenos fragmentos do córtex ovariano tem sido realizado para o estudo da ativação e crescimento folicular em diferentes espécies, incluindo caprinos (SILVA et al., 2004a), bovinos (BRAW- TAL; YOSSEFI, 1997), babuínos (WANDJI et al., 1997) e humanos (ZHANG et al., 2004). Ambos os métodos de cultivo in vitro supracitados (ovário inteiro e fragmentos ovarianos)
50 50 são caracterizados pelo cultivo de folículos inclusos no próprio tecido ovariano, sendo, desta forma, classificados como sistemas de cultivo in situ. Além da praticidade, o cultivo in situ tem a vantagem de manter o contato celular (ABIR et al., 2006) e a integridade tridimensional dos folículos, fornecendo um complexo sistema de suporte que se assemelha ao ovário in vivo (PICTON et al., 2008). No entanto, neste tipo de sistema, embora haja uma significativa ativação folicular, poucos folículos primários cultivados progridem até o estágio de folículo secundário (FORTUNE, 2003). Além do cultivo in situ, existe ainda um sistema desenvolvido para cultivo de folículos isolados. Para a realização desse sistema, procedimentos enzimáticos e/ou mecânicos são utilizados a fim de isolar folículos pré-antrais a partir do córtex ovariano antes de submetê-los ao cultivo in vitro. O isolamento enzimático envolve a exposição do tecido ovariano à ação de enzimas, como a colagenase, a pronase e a DNAse, e tem sido realizado em várias espécies, incluindo caprinos (RAJARAJAN et al., 2006), bubalinos (GUPTA et al., 2007), ovinos (MURUVI et al., 2005) e murinos (PARK et al., 2005). Este tipo de isolamento permite a recuperação de um grande número de folículos pré-antrais, porém pode danificar a membrana basal ou células da teca, principalmente quando o tempo de incubação não é rigorosamente controlado (DEMEESTERE et al., 2005). Paralelamente aos procedimentos enzimáticos, métodos mecânicos têm sido comumente adotados para o isolamento de folículos pré-antrais em ovários bovinos (ITOH et al., 2002), caprinos (MAO et al., 2002) e ovinos (AMORIM et al., 2000; ARUNAKUMARI et al., 2007), sendo mais frequentemente utilizadas as técnicas de microdissecção (TAMILMANI et al., 2005) e dissociação mecânica com o tissue chopper (MARTINEZ-MADRID et al., 2004). A grande vantagem do isolamento mecânico é que, ao contrário do enzimático, este mantém a integridade da estrutura folicular, a membrana basal intacta, e ainda as interações entre oócito, células da granulosa e células da teca (DEMEESTERE et al., 2005). Contudo, os métodos mecânicos são considerados mais lentos e laboriosos, permitindo, em geral, a recuperação de um número inferior de folículos (TELFER et al., 2000). Vale salientar que a associação de métodos mecânicos e enzimáticos também pode ser realizada, sendo considerada uma alternativa interessante para o isolamento de folículos pré-antrais (GUPTA et al., 2008). O cultivo de folículos isolados apresenta a vantagem de permitir o acompanhamento individual dos folículos durante o cultivo, além de favorecer uma maior perfusão de meio para o folículo (ABIR et al., 2006). Este sistema pode ser realizado na forma bidimensional (EPPIG; SCHROEDER 1989; CORTVRINDT; SMITZ; VAN STEIRTEGHEM, 1996), em
51 51 que o folículo é cultivado diretamente sobre o suporte de plástico ou sobre uma matriz extracelular, ou ainda na forma tridimensional, na qual o folículo é incluso em uma matriz natural ou sintética, como por exemplo, o colágeno (CARROLL; WHITTINGHAM; WOOD, 1991; HIRAO et al., 1994) e o alginato (XU et al., 2006, 2009; WEST et al., 2007). O modelo de cultivo tridimensional evita a aderência das células foliculares ao suporte plástico e, consequentemente, a perda da integridade morfológica do folículo (NAYUDU; OSBORN, 1992; SMITZ et al., 2010). Além disso, esse modelo mimetiza o microambiente do estroma ovariano, sendo capaz de melhor suportar o crescimento e a maturação dos folículos secundários isolados de grandes animais domésticos, primatas e humanos (KREEGER et al., 2007; XU et al., 2009). Além dos sistemas anteriormente descritos (in situ e isolado), pode ser realizado ainda um modelo de cultivo em dois passos, associando esses dois sistemas. Nesse modelo, é efetuado inicialmente o cultivo in situ no intuito de maximizar a ativação folicular e o crescimento dos folículos pré-antrais iniciais, e em seguida realiza-se o isolamento e cultivo dos folículos secundários crescidos in vitro (O BRIEN; PENDOLA; EPPIG, 2003; TELFER et al., 2008). Em 2003, O Brien e sua equipe realizaram um cultivo em dois passos com camundongas (iniciando com ovários inteiros cultivados por 8 dias, seguido do cultivo de folículos isolados a partir desses ovários por mais 14 dias) e obtiveram uma taxa de retomada da meiose de 62%, além de uma significativa produção de embriões e nascimentos. Considerando o grande sucesso obtido nesse estudo com a ativação in vitro de folículos primordiais e o seu posterior crescimento, nos últimos anos este modelo de cultivo em dois passos vem sendo bastante utilizado por diferentes grupos de pesquisadores (TELFER et al., 2008; JIN et al., 2010; MCLAUGHLIN; TELFER, 2010). A grande vantagem desse sistema é que este mantém a interação celular entre o estroma e os folículos nos estágios mais iniciais, sendo capaz de garantir uma boa ativação e fornecer um maior número de folículos secundários para a utilização em cultivos isolados (JIN et al., 2010; SMITZ et al., 2010). 2.6 Estado atual do cultivo in vitro de folículos pré-antrais Ao longo das últimas décadas, progressos extraordinários têm sido observados no cultivo in vitro de folículos pré-antrais em diferentes espécies. Os resultados mais satisfatórios até o momento foram obtidos a partir de estudos com folículos pré-antrais de camundongas,
52 52 os quais demonstraram que é possível a obtenção de crias vivas a partir de oócitos oriundos de folículos cultivados in vitro (EPPIG; O BRIEN, 1996; O BRIEN; PENDOLA; EPPIG, 2003; HASEGAWA et al., 2006). Já em animais de produção, como caprinos (SARAIVA et al., 2010; MAGALHÃES et al., 2011), ovinos (ARUNAKUMARI; SHANMUGASUNDARAM; RAO, 2010), bubalinos (GUPTA et al., 2008) e suínos (WU; EMERY; CARRELL, 2001), o cultivo in vitro de folículos secundários resultou na produção de oócitos maturos, os quais foram fecundados in vitro gerando embriões. Contudo, nestas espécies, a quantidade de embriões produzidos a partir de oócitos provenientes de folículos pré-antrais crescidos in vitro ainda é limitada. Nas espécies bovina (GUTIERREZ et al., 2000; ITOH et al., 2002), humana (ROY; TREACY, 1993) e canina (SERAFIM et al., 2010), folículos pré-antrais isolados foram cultivados in vitro e se desenvolveram somente até o estágio antral. Já em gatas (JEWGENOW; STOLTE, 1996) e gambás (BUTCHER; ULLMAN, 1996), já foi observado o crescimento de folículos pré-antrais isolados após o cultivo in vitro, porém sem a formação de antro, o que reflete diretamente a dificuldade da técnica e a diferença entre as espécies. De fato, diferenças espécie-específicas importantes têm sido sugeridas como alguns dos fatores relacionados ao sucesso limitado do cultivo in vitro de folículos pré-antrais, repercutindo na obtenção de nascimentos apenas em animais de laboratório. Dentre essas diferenças, podem ser citadas: i) duração da foliculogênese e oogênese; ii) tamanho dos folículos ovulatórios e dos oócitos maturos; e iii) natureza, concentrações e efeitos dos fatores de crescimento que regulam os folículos e a produção de oócitos in vivo (PICTON et al., 2008). Tais diferenças são extremamente relevantes quando se deseja desenvolver sistemas e meios de cultivo in vitro eficientes que suportem o completo crescimento folicular e oocitário nas mais variadas espécies. Independente do sistema de cultivo empregado, deve-se sempre preconizar a utilização de meios de cultivo ricos, capazes de fornecer os nutrientes e fatores de crescimento necessários para o desenvolvimento dos folículos pré-antrais (PICTON et al., 2008).
53 Importância da composição do meio de cultivo sobre o desenvolvimento folicular in vitro A composição do meio é um fator fundamental para o sucesso do cultivo in vitro de folículos ovarianos, e pode ser influenciada pela adição de diferentes substâncias, incluindo antibióticos, tampões, substratos nutricionais (lipídeos, proteínas, aminoácidos, ácidos nucléicos, vitaminas, monossacarídeos, etc.), diferentes fontes protéicas, antioxidantes, hormônios e diversos fatores de crescimento (FIGUEIREDO et al., 2008; PICTON et al., 2008). Além disso, diferentes meios comerciais podem influenciar o cultivo in vitro de folículos ovarianos, estimulando a sobrevivência e o crescimento folicular. Dentre os meios de cultivo de base comumente utilizados para folículos pré-antrais, destacam-se o Meio Essencial Mínimo (MEM) simples (MATOS et al., 2007a) ou alfa-modificado (α-mem SILVA et al., 2011), o Meio de Cultivo Tecidual 199 (TCM199 RAJARAJAN et al., 2006), e os meios Waymouth (MURUVI et al., 2005) e McCoy s (TELFER et al., 2008). Estudos têm demonstrado que a adição de diferentes suplementos ao meio de cultivo, como piruvato, glutamina, hipoxantina e ITS (Insulina, Transferrina e Selênio), aumenta o percentual de folículos morfologicamente normais e estimula o crescimento folicular (SILVA et al., 2004c; DEMEESTERE et al., 2005). Além disso, tem-se observado que o ácido ascórbico, importante antioxidante, também atua beneficamente sobre a foliculogênese, promovendo uma redução da apoptose em folículos pré-antrais de camundongos (MURRAY et al., 2001) e estimulando a manutenção da viabilidade folicular em caprinos após cultivo de longa duração (ROSSETTO et al., 2009; SILVA et al., 2011). Por outro lado, a inclusão de soro homólogo ou heterólogo em meios de cultivo in vitro para folículos pré-antrais tem levantado considerável debate. O soro contém proteínas, aminoácidos, carboidratos, hormônios, fatores de crescimento e componentes da matriz extracelular que promovem adesão e proliferação celular (DEMEESTERE et al., 2005). Aliado a isto, o soro atua como uma importante fonte de albumina, considerada essencial para equilibrar a osmolaridade e sequestrar moléculas potencialmente nocivas e íons metálicos, que podem agir como fontes de radicais livres. Além das funções já citadas, o soro atua ainda fornecendo precursores para a biosíntese de esteróides pelo folículo (HULSHOF et al., 1995; PICTON et al., 2008). No entanto, apesar de todos os efeitos positivos do soro, muitos pesquisadores evitam a sua utilização durante o cultivo in vitro de folículos pré-antrais, uma vez que ele reduz a resposta das células foliculares em proliferação às doses fisiológicas dos
54 54 fatores de crescimento (PICTON et al., 2008) e ainda impede o total controle das substâncias que irão influenciar o crescimento dos folículos in vitro, em virtude da sua composição indefinida. Quando opta-se pelo cultivo in vitro na ausência de soro, é sugerida a suplementação do meio com albuminas séricas purificadas, tais como a albumina sérica bovina (BSA), no intuito de utilizá-las como moléculas carreadoras de partículas e íons nocivos (PICTON et al., 2008). Recentemente, têm sido verificados os efeitos benéficos da BSA sobre a sobrevivência e o desenvolvimento in vitro de folículos pré-antrais caprinos após cultivo de longa duração (RODRIGUES et al., 2010). Além de todos os suplementos supracitados, estudos in vivo e in vitro têm destacado a grande importância da utilização de hormônios e fatores de crescimento no meio de cultivo folicular para a promoção do completo e eficiente desenvolvimento dos folículos pré-antrais in vitro. Tais substâncias podem ser adicionadas ao cultivo isoladamente ou associadas, originando, nesse último caso, meios de cultivo não-dinâmicos (quando as substâncias são adicionadas simultaneamente) ou dinâmicos (quando cada substância ou combinação de substâncias é adicionada em momentos diferentes do cultivo para suprir as necessidades específicas dos diferentes estágios foliculares). Nesse contexto, diversos autores têm investigado os efeitos destas substâncias (hormônios e fatores de crescimento), adicionadas isoladamente ou em associação, no cultivo in vitro de folículos pré-antrais tanto de animais de laboratório como de animais domésticos, dando grande ênfase ao teste de fatores de crescimento intraovarianos. Dentre os fatores de crescimento sintetizados pelas células foliculares, que atuam modulando o efeito das gonadotrofinas e regulando o desenvolvimento dos folículos ovarianos, destacam-se o KL e a BMP-15. Ambos os fatores correspondem ao foco da presente tese e, conforme mencionado previamente, terão suas características e funções detalhamente descritas no Capítulo Técnicas para análise folicular antes e após o cultivo in vitro As técnicas de avaliação da qualidade de folículos pré-antrais antes e após o cultivo permitem o monitoramento das alterações morfológicas ocorridas in vitro, sendo, portanto, de grande importância para a melhoria dos sistemas de crescimento in vitro de folículos préantrais (MATOS et al., 2007b). Nesse contexto, diferentes técnicas podem ser utilizadas isoladamente ou em associação para a precisa avaliação da qualidade, bem como da
55 55 funcionalidade folicular. Dentre estas técnicas, podem ser destacadas: a histologia clássica, a microscopia eletrônica de transmissão e a microscopia de fluorescência. Além destas ferramentas, pode-se fazer uso ainda de técnicas de biologia molecular, essenciais para a avaliação da expressão e quantificação de genes, transcritos e proteínas envolvidos na foliculogênese, contribuindo expressivamente para uma melhor elucidação desse processo Histologia clássica A histologia clássica (HC) é uma importante técnica de análise folicular após o cultivo in vitro, pois além de permitir uma análise quantitativa, ou seja, de um grande número de folículos cultivados, permite ainda verificar a mudança na morfologia das células da granulosa de pavimentosa para cúbica, por ocasião da ativação folicular, além de analisar a integridade morfológica do oócito e das células da granulosa. Tal técnica permite, portanto, a classificação dos folículos quanto ao seu estágio de desenvolvimento (primordial, transição, primário ou secundário), e ainda quanto às suas características morfológicas (normais ou atrésicos). Entretanto, a HC possui como desvantagens não permitir a avaliação da integridade das membranas plasmática e nuclear, bem como das organelas citoplasmáticas. Vale salientar que tal técnica pode ser realizada tanto em folículos isolados, como naqueles inclusos em fragmentos de córtex ovariano (MATOS et al., 2007b). Nesse último caso, para que os folículos isolados não sejam perdidos durante o processamento histológico, estes devem ser previamente encapsulados em uma matriz de colágeno ou alginato e corados com azul de alcian (PARSHAD; KAURR; NATT, 2008). Inúmeros estudos têm utilizado a HC como ferramenta para avaliação da qualidade e do crescimento folicular, associando-a em muitos casos a outras técnicas complementares, como as microscopias eletrônica e de fluorescência, e a marcação tecidual com azul de tripan (MATOS et al., 2007a; BRUNO et al., 2009; ROSSETTO et al., 2009; CARVALHO et al., 2011; CELESTINO et al., 2011). Segundo observado em alguns trabalhos, a HC pode fornecer resultados similares aos de viabilidade folicular utilizando marcadores fluorescentes e ainda mostrar resultados de morfologia folicular equivalentes aos obtidos nas análises sob microscópio eletrônico, porém sem a mesma precisão e o mesmo detalhamento de imagens e estruturas (AMORIM et al., 2003; ROSSETTO et al., 2009; CELESTINO et al., 2011; CHAVES et al., 2011).
56 Microscopia eletrônica de transmissão A microscopia eletrônica de transmissão (MET) é considerada uma técnica qualitativa e acurada que se baseia na análise detalhada de amostras por meio de um equipamento versátil (microscópio eletrônico), capaz de fornecer informações estruturais e químicas, produzindo imagens de altíssima resolução. Tal sistema tem como base a interação de elétrons com átomos presentes nos componentes teciduais, gerando partículas e radiação que podem ser usadas para formar uma imagem ampliada (superiores a 10 6 vezes) ou realizar análise química da amostra (WILLIAMS; CARTER, 1996; JUNQUEIRA; CARNEIRO, 2004b). Por meio destes recursos, a MET é capaz de permitir uma precisa avaliação da integridade de membranas celulares e ainda avaliar importantes características de organelas citoplasmáticas (SALEHNIA; MOGHADAM; VELOJERDI, 2002). A MET é considerada uma ferramenta valiosa para detectar modificações morfológicas iniciais decorrentes da atresia, as quais podem ser observadas apenas em nível ultraestrutural antes de se tornarem mais visíveis e possíveis de serem identificadas por microscopia óptica. Assim, tal técnica serve para confirmar se realmente houve a manutenção da integridade morfológica após análise histológica. Além disso, a MET pode também revelar a ocorrência de alterações estruturais e moleculares durante o desenvolvimento oocitário, que podem afetar a capacidade do oócito para a fecundação e o subsequente desenvolvimento embrionário (HYTTEL et al., 1997). Deste modo, estudos ultraestruturais utilizando a MET são muito importantes para avaliar a qualidade dos oócitos inclusos nos folículos primordiais ativados in vitro e compreender o que determinará ou não o seu crescimento, sendo também indispensáveis para avaliar a qualidade das células da granulosa após o cultivo in vitro (LUCCI et al., 2001; ANDRADE et al., 2011) Microscopia de fluorescência Outra técnica empregada para avaliar a viabilidade folicular após o cultivo in vitro é a microscopia de fluorescência, a qual utiliza marcadores fluorescentes que, quando excitados com radiação de baixo comprimento de onda, absorvem energia e emitem luz de comprimento de onda maior (JUNQUEIRA; CARNEIRO, 2004b). A microscopia de fluorescência é considerada uma técnica confiável, prática e rápida para avaliação da viabilidade folicular antes ou após estudos de cultivo in vitro (CORTVRINDT; SMITZ, 2001; LOPES et al., 2009)
57 57 e, em virtude dessas importantes vantagens, vem sendo comumente adotada para análise de folículos pré-antrais (ROSSETTO et al., 2009; BRUNO et al., 2009; CELESTINO et al., 2011; MAGALHÃES et al., 2012). Nesses trabalhos, os folículos e/ou oócitos foram analisados por fluorescência com base na detecção simultânea de células vivas e mortas marcadas por calceína-am e pelo etídio homodímero-1, respectivamente. O etídio homodímero-1 marca ácidos nucléicos em células não-viáveis, indicando a perda da integridade da membrana plasmática das células, enquanto a calceína-am marca células viáveis através da detecção da atividade de enzimas esterases no citoplasma celular (LOPES et al., 2009). A microscopia de fluorescência é ainda empregada no intuito de avaliar a configuração da cromatina de oócitos oriundos de folículos pré-antrais, indicando assim o estágio meiótico alcançado após terem sido cultivados e maturados in vitro (SARAIVA et al., 2010). Para tal finalidade, utiliza-se o marcador Hoescht 33342, que penetra em células vivas e se intercala entre as bases nitrogenadas do DNA Biologia molecular Aliadas à biotécnica de MOIFOPA, técnicas de biologia molecular vêm sendo largamente empregadas e desenvolvidas na tentativa de melhor compreender o processo de foliculogênese ovariana, especialmente na fase inicial. Através dessas técnicas, é possível detectar alterações nos padrões de expressão gênica de diferentes substâncias, incluindo fatores de crescimento (ligantes) e seus receptores, que ocorrem em resposta a fenômenos relacionados à sobrevivência, ao crescimento e à diferenciação celular (ZAMORANO; MAHESH; BRANN, 1996). Atualmente, são inúmeras as técnicas de biologia molecular disponíveis e, dependendo do objetivo do estudo, estas podem ser aplicadas isoladamente ou em associação (ALMEIDA et al., 2010). Dentre as técnicas mais comumente adotadas, pode-se citar: hibridização in situ, Southern, Northern e Western blotting, reação em cadeia de polimerase (PCR), reação de transcriptase reversa em cadeia de polimerase (RT-PCR), ensaio de proteção de ribonuclease e microarranjos de DNA. Dentro do contexto da foliculogênese, as técnicas de RT-PCR, Northern blotting, hibridização in situ e ensaio de proteção de ribonuclease podem ser utilizadas para investigar a expressão de RNAm tanto de ligantes quanto de receptores associados às diferentes fases do desenvolvimento folicular. Já técnicas como o Southern
58 58 blotting e a PCR podem ser aplicadas para a identificação da presença de sequências gênicas específicas nos diversos tipos celulares presentes nos folículos. Por outro lado, o Western blotting pode ser utilizado para investigar a expressão de diferentes proteínas foliculares, enquanto os microarranjos de DNA podem detectar e mensurar milhares de genes simultaneamente em células de folículos em crescimento (ALMEIDA et al., 2010). Nos últimos anos, a técnica mais amplamente utilizada para quantificar a expressão de RNAm tem sido a RT-PCR em tempo real (qrt-pcr) (KREUZER; MASSEY, 2002). A qrt-pcr corresponde a uma variante da RT-PCR convencional e permite uma análise precisa da quantificação da expressão gênica em determinado tecido ou amostra biológica. Esse método utiliza um sistema fluorescente em plataforma, capaz de detectar a luz oriunda da reação de amplificação de um determinado gene no momento real da amplificação (BUSTIN, 2002). Através desta técnica, já foi possível identificar a presença e os níveis de expressão de diferentes substâncias intraovarianas (CELESTINO et al., 2010, 2011; FROTA et al., 2011; ALMEIDA et al., 2011, 2012; MAGALHÃES et al., 2012), bem como de receptores (BRITO et al., 2011), em folículos ovarianos caprinos.
59 59 3 JUSTIFICATIVA Os folículos pré-antrais representam cerca de 90 a 95% de toda a população folicular e, desta forma, armazenam a grande maioria dos oócitos presentes em ovários de espécies mamíferas. Entretanto, a grande maioria destes folículos (99,9%) não evolui até a fase ovulatória, sendo eliminada através do processo de atresia folicular. Tal fenômeno reduz de maneira expressiva o número de oócitos potencialmente ovuláveis, diminuindo, em consequência, a produção de oócitos maturos e viáveis durante a vida reprodutiva de uma fêmea. Considerando a grande relevância econômica que a espécie caprina representa especialmente para o Nordeste brasileiro, aliado ao aproveitamento ainda incipiente de sua capacidade reprodutiva, é de extrema importância o desenvolvimento de um sistema de cultivo in vitro capaz de promover a manutenção da viabilidade, crescimento e maturação de folículos pré-antrais caprinos, otimizando a utilização do potencial oocitário destes animais e incrementando a sua eficiência reprodutiva. Assim, oócitos oriundos destes folículos poderão, futuramente, ser destinados à produção in vitro de embriões e clonagem, contribuindo para a multiplicação de caprinos de alto valor zootécnico e/ou em vias de extinção, bem como para a implantação de bancos de germoplasma animal. Somado a isto, o desenvolvimento de um sistema de cultivo in vitro eficiente para folículos pré-antrais caprinos também poderá fornecer subsídios para uma melhor compreensão da foliculogênese na fase pré-antral, importante para garantir a sobrevivência e o crescimento folicular nesta espécie. Na busca por um sistema ideal para cultivo de folículos pré-antrais e visando a exequibilidade desses sistemas in vitro em animais de laboratório e animais domésticos, como os caprinos, diversas substâncias e fatores intraovarianos vêm sendo estudados por equipes de todo o mundo. Contudo, embora seja bem estabelecida a importância dos fatores KL e BMP- 15 na regulação da foliculogênese em algumas espécies, ainda não haviam sido avaliados os efeitos de um cultivo in situ de longa duração utilizando KL em meio dinâmico sobre as características estruturais e ultraestruturais de folículos pré-antrais caprinos. Além disso, não eram conhecidos os efeitos de diferentes concentrações de KL e BMP-15 sobre o cultivo in vitro de folículos secundários caprinos isolados, bem como sobre a maturação dos oócitos oriundos desses folículos. Para este fim, no presente trabalho foi empregada, além da técnica de histologia clássica, a microscopia eletrônica de transmissão e/ou de fluorescência a fim de determinar a viabilidade de folículos pré-antrais e oócitos caprinos cultivados in vitro e, deste
60 60 modo, melhor avaliar a eficiência dos meios e sistemas de cultivo testados. Paralelamente, foram também utilizadas ferramentas de biologia molecular (RT-PCR em tempo real) no intuito de determinar a expressão quantitativa de RNAm para os receptores de KL e BMP-15 em folículos ovarianos caprinos crescidos in vivo, contribuindo valiosamente para desvendar a foliculogênese nesta espécie.
61 61 4 HIPÓTESES CIENTÍFICAS Diante do exposto, foram formuladas as seguintes hipóteses científicas: 1) Os níveis de expressão de RNAm para os receptores de KL e BMP-15 em folículos caprinos variam em função do estágio e tamanho folicular, bem como de acordo com os tipos celulares que compõem o folículo. 2) O KL, associado ao FSH em meio dinâmico, mantém a viabilidade folicular e promove a ativação e o crescimento de folículos pré-antrais caprinos após cultivo in situ de longa duração. 3) A adição de KL ou BMP-15 ao meio de cultivo in vitro influencia positivamente a sobrevivência, a formação de antro e o crescimento de folículos secundários caprinos isolados, permitindo o desenvolvimento de oócitos meioticamente competentes.
62 62 5 OBJETIVOS 5.1 OBJETIVO GERAL 1) Investigar os níveis de expressão de RNAm para os receptores de KL e BMP-15 em folículos ovarianos caprinos. 2) Verificar os efeitos do KL e da BMP-15 sobre o desenvolvimento in vitro de folículos préantrais caprinos. 5.2 OBJETIVOS ESPECÍFICOS 1) Quantificar, através de RT-PCR em tempo real, a expressão de RNAm para os receptores de KL e BMP-15 em folículos caprinos de diferentes categorias (primordial, primário e secundário) e em diferentes compartimentos de folículos antrais (granulosa, teca e complexo cumulus-oócito). 2) Estabelecer o efeito do KL, associado ou não ao FSH em meio dinâmico, sobre a morfologia, viabilidade, ultraestrutura, ativação e crescimento in vitro de folículos pré-antrais caprinos submetidos a um cultivo in situ de longa duração (16 dias). 3) Verificar a influência de duas concentrações de KL (50 ou 100 ng/ml), na presença ou ausência de FSH, sobre a sobrevivência, formação de antro e crescimento in vitro de folículos secundários caprinos isolados e cultivados por 18 dias. 4) Determinar o efeito de diferentes concentrações de BMP-15 (10, 50 ou 100 ng/ml) sobre a sobrevivência, ultraestrutura, formação de antro e crescimento de folículos secundários caprinos isolados e cultivados in vitro por 18 dias. 5) Avaliar as taxas de viabilidade e maturação dos oócitos oriundos dos folículos secundários isolados e cultivados in vitro com KL e BMP-15.
63 63 Nas páginas seguintes, serão apresentados quatros capítulos referentes aos artigos científicos e de revisão que compõem esta tese. Vale salientar que todos os artigos já se encontram publicados, estando a revisão disponível em periódico incluso no Qualis CAPES B3 e os três artigos científicos publicados em periódicos inseridos no Qualis CAPES A1 (um artigo) e A2 (dois artigos).
64 64 6 CAPÍTULO 1 Papel da Proteína Morfogenética Óssea 15 (BMP-15) e Kit Ligand (KL) na regulação da foliculogênese em mamíferos (Role of Bone Morphogenetic Protein 15 (BMP-15) and Kit Ligand (KL) in the regulation of folliculogenesis in mammalian) Periódico: Revista Brasileira de Reprodução Animal, v.34, p.3-20, 2010.
65 65 Resumo A foliculogênese é coordenada por diversos fatores de crescimento e hormônios responsáveis por garantir o sucesso do desenvolvimento folicular e oocitário. Para a obtenção de oócitos competentes, é necessária uma perfeita interação entre as células somáticas foliculares e o oócito, sendo esta potencialmente regulada por fatores parácrinos produzidos no ovário. Dentre estes fatores, destacam-se a BMP-15 e o KL, sintetizados pelo oócito e pelas células da granulosa, respectivamente. Este artigo revisa o importante papel da BMP-15 e do KL na foliculogênese, enfocando suas características, sítios de expressão, receptores e vias de sinalização, bem como a interação entre estas duas substâncias. Palavras-chave: BMP-15. KL. Foliculogênese. Ovário.
66 66 Papel da Proteína Morfogenética Óssea 15 (BMP-15) e Kit Ligand (KL) na regulação da foliculogênese em mamíferos (Role of Bone Morphogenetic Protein 15 (BMP-15) and Kit Ligand (KL) in the regulation of folliculogenesis in mammalian) Isadora Machado Teixeira Lima, Juliana Jales de Hollanda Celestino, José Ricardo de Figueiredo, Ana Paula Ribeiro Rodrigues Laboratório de Manipulação de Oócitos e Folículos Ovarianos Pré-antrais LAMOFOPA - Universidade Estadual do Ceará (UECE), Fortaleza, Ceará * Endereço de correspondência: Programa de Pós-Graduação em Ciências Veterinárias (PPGCV) Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais (LAMOFOPA) Universidade Estadual do Ceará (UECE) Av. Paranjana, 1700, Campus do Itaperi. Fortaleza CE Brasil. CEP: Tel.: ; Fax: dora.uece@gmail.com (Isadora Machado Teixeira Lima)
67 67 Resumo A foliculogênese é coordenada por diversos fatores de crescimento e hormônios responsáveis por garantir o sucesso do desenvolvimento folicular e oocitário. Para a obtenção de oócitos competentes, é necessária uma perfeita interação entre as células somáticas foliculares e o oócito, sendo esta potencialmente regulada por fatores parácrinos produzidos no ovário. Dentre estes fatores, destacam-se a BMP-15 e o KL, sintetizados pelo oócito e pelas células da granulosa, respectivamente. Este artigo revisa o importante papel da BMP-15 e do KL na foliculogênese, enfocando suas características, sítios de expressão, receptores e vias de sinalização, bem como a interação entre estas duas substâncias. Palavras-chave: BMP-15, KL, foliculogênese, ovário. Abstract Folliculogenesis is coordinated by many growth factors and hormones responsible for ensuring the success of follicular and oocyte development. To obtain competent oocytes is necessary to have a perfect interaction between follicular somatic cells and the oocyte, which is potentially regulated by paracrine factors produced in the ovary. Among these factors, we highlight BMP-15 and KL, synthesized by the oocyte and granulosa cells, respectively. This article reviews the important role of BMP-15 and KL in folliculogenesis, focusing on their characteristics, sites of expression, receptors and signaling pathways, as well as the interaction between these two substances. Keywords: BMP-15, KL, folliculogenesis, ovary. Introdução O folículo ovariano é a unidade morfofuncional do ovário e consiste de um oócito circundado por uma ou mais camadas de células somáticas (Knight e Glister, 2006). Durante a foliculogênese, processo que corresponde à formação e ao desenvolvimento de folículos primordiais até o estágio pré-ovulatório, a morfologia folicular é alterada, sendo verificados o crescimento do oócito e a multiplicação e diferenciação de suas células circundantes (Bristol- Gould e Woodruff, 2006). Como consequência, os oócitos inclusos nos folículos em
68 68 desenvolvimento se tornam progressivamente maduros e competentes para garantir o sucesso dos fenômenos de ovulação e fertilização (Hutt et al., 2006b). Nos estágios iniciais da foliculogênese, fatores de crescimento produzidos localmente, tais como a Ativina, o Kit Ligand, o Fator de Crescimento Epidermal (EGF) e as Proteínas Morfogenéticas Ósseas (BMPs), exercem um papel determinante na manutenção da viabilidade e do crescimento folicular. Após a formação do antro, os folículos tornam-se progressivamente dependentes das gonadotrofinas, e os fatores de crescimento locais atuam inibindo ou potencializando a ação destes hormônios (Fortune, 2003). Adicionalmente, evidências indicam que as interações parácrinas entre o oócito e as células somáticas mediadas pelos fatores de crescimento são cruciais para assegurar o perfeito desenvolvimento destes dois tipos celulares ao longo da foliculogênese (Eppig, 2001; Eppig et al., 2002; Matzuk et al., 2002). Dentre os fatores de crescimento, destacam-se a Proteína Morfogenética Óssea 15 (BMP-15) e o Kit Ligand (KL), os quais são considerados importantes fatores intraovarianos relacionados à foliculogênese em mamíferos. A BMP-15 é secretada pelo oócito e apresenta um significativo papel mitogênico sobre as células da granulosa, contribuindo positivamente para o desenvolvimento folicular durante as fases iniciais e finais da foliculogênese (Otsuka et al., 2000; Juengel et al., 2004). O KL, por sua vez, é expresso nas células da granulosa e tem sido implicado na migração, proliferação e sobrevivência de células germinativas primordiais (Zama et al., 2005), na proliferação das células da granulosa (Otsuka e Shimasaki, 2002), no crescimento e sobrevivência do oócito (Jin et al., 2005) e na ativação de folículos primordiais (Parrott e Skinner, 1999), dentre outras funções. Ambos os fatores de crescimento, quando inativados por mutações, têm afetado negativamente o desenvolvimento folicular e a fertilidade de espécies mamíferas, incluindo ovinos e camundongos (Driancourt et al., 2000; Galloway et al., 2000). Dentro desse contexto, a presente revisão abordará aspectos relacionados à foliculogênese, população e atresia folicular, enfatizando o papel da BMP-15 e do KL nestes processos, bem como suas características estruturais, sítios de expressão, receptores e vias de sinalização celular. Além disso, nesta revisão, serão também descritos os efeitos resultantes das interações entre BMP-15 e KL, caracterizando esta importante comunicação entre oócito e células da granulosa.
69 69 Foliculogênese Em mamíferos, os estágios iniciais do desenvolvimento folicular são caracterizados pela migração de células germinativas primordiais a partir do saco vitelínico para a gônada primitiva, com sua posterior colonização (Bristol-Gould e Woodruff, 2006). Nas gônadas, as células germinativas primordiais multiplicam-se ativamente por mitose e diferenciam-se em oogônias, as quais adquirem um maior número de organelas intracelulares (Abir et al., 2006) e passam a ser denominadas oócitos primários após o início da primeira divisão meiótica (Suh et al., 2002). Em seguida, uma camada de células somáticas planas, também conhecidas como células da pré-granulosa, originárias do mesonefro e/ou epitélio ovariano (McNatty et al., 2000; Juengel et al., 2002c), circundam os oócitos primários, formando os folículos primordiais, e iniciando, assim, a foliculogênese (Eppig et al., 2004). A foliculogênese pode ser definida como o processo contínuo de formação, crescimento e maturação folicular, tendo início com a gênese do folículo primordial e culminando com o estágio de folículo pré-ovulatório (Van den Hurk e Zhao, 2005). De acordo com o estágio de desenvolvimento, os folículos ovarianos podem ser divididos em: a) folículos pré-antrais ou não cavitários, que abrangem os folículos primordiais, de transição, primários e secundários e b) folículos antrais ou cavitários, compreendendo os folículos terciários, de De Graaf ou pré-ovulatórios (Silva et al., 2004a). Os folículos primordiais constituem o reservatório de folículos quiescentes, representando a maioria (95%) da população folicular presente no ovário mamífero. O início do crescimento dos folículos primordiais, processo denominado ativação (McLaughlin e McIver, 2009), caracteriza-se pelo crescimento oocitário, pela multiplicação das células da granulosa e pela transformação da morfologia dessas células da forma pavimentosa para a forma cúbica (Skinner, 2005). A transição do estágio primordial para primário pode ser prolongada, e folículos com células da granulosa de morfologia pavimentosa e cúbica são frequentemente observados, sendo classificados como folículos de transição (Silva et al., 2004a). Os folículos primários contêm uma única camada de células da granulosa com morfologia cúbica circundando o oócito. Nesse tipo de folículo, as células da granulosa aumentam em número e tornam-se mais volumosas (Van den Hurk et al., 1997), culminando com o desenvolvimento dos chamados folículos secundários (Picton et al., 1998). Tais folículos são caracterizados pela presença de duas ou mais camadas de células da granulosa cúbicas localizadas em torno do oócito, bem como pela formação de uma camada de células
70 70 tecais envolvendo a membrana basal folicular (Van den Hurk e Zhao, 2005). Estas células da teca são recrutadas a partir do estroma ovariano sob o estímulo de fatores de crescimento parácrinos, tais como o KL e o Fator de Crescimento Fibroblástico básico (FGFb), os quais são sintetizados pelas células da granulosa e pelo oócito, respectivamente, e apresentam atuação mútua neste processo (Knight e Glister, 2006). Após o crescimento dos folículos secundários e a organização das células da granulosa em várias camadas, ocorre a formação de uma cavidade repleta de líquido folicular denominada antro. A partir desse estágio, os folículos passam a ser denominados antrais ou cavitários. Os grandes folículos antrais geralmente possuem diâmetro acima de 3 mm e contêm células da granulosa, diferenciadas em células do cumulus e células murais, muitas camadas de células da teca e um grande espaço contendo líquido folicular, além do oócito. O desenvolvimento dos folículos antrais é caracterizado por uma fase de crescimento, recrutamento, seleção e dominância (van den Hurk e Zhao, 2005), sendo a formação de folículos pré-ovulatórios um pré-requisito para a ovulação e formação do corpo lúteo, bem como para manutenção da fertilidade (Drummond, 2006). População e atresia folicular Em muitos mamíferos, a população folicular ovariana é estabelecida ainda na vida intrauterina (primatas e ruminantes; Knight e Glister, 2006) ou em um curto período de tempo após o nascimento (roedores) (Ojeda et al., 2000). Por outro lado, pesquisas têm demonstrado os mecanismos envolvidos na formação de novas células germinativas e de folículos em mulheres (Bukovsky et al., 2004) e camundongas adultas (Johnson et al., 2004), resultantes da atuação de células-tronco possivelmente presentes na superfície do epitélio ovariano. Independente da formação de novos folículos na fase adulta, a quantidade total de folículos presentes no ovário mamífero difere entre espécies e indivíduos (Katska- Ksiazkiewicz, 2006), observando-se, aproximadamente, folículos na camundonga (Shaw et al., 2000), na vaca (Betteridge et al., 1989), na ovelha (Amorim et al., 2000), na cabra (Lucci et al., 1999) e em torno de na mulher (Erickson, 1986). Apesar da grande população folicular existente no ovário, a quase totalidade dos folículos (99,9%) não chega até a ovulação, pois morre por um processo natural denominado atresia, o qual ocorre por via apoptótica ou pelo processo degenerativo de necrose (Van Cruchten e Van den Broeck, 2002).
71 71 A apoptose ou morte celular programada é um processo determinado geneticamente que depende da expressão de genes pró e antiapoptóticos e tem como característica marcante a fragmentação do DNA a cada pares de base (Hussein, 2005). De acordo com o estímulo inicial, a apoptose pode ocorrer por intermédio de receptores de superfície celular (receptores de morte), constituindo a via extrínseca, ou ainda por meio da mitocôndria, constituindo esta a via intrínseca (Joza et al., 2002; Elmore, 2007). Independente da via, duas famílias importantes regulam o processo apoptótico: a família das caspases, consideradas as executoras principais da via apoptótica, e a família Bcl-2, a qual compreende tanto membros antiapoptóticos (Bcl-2, Bcl-xL) quanto membros pró-apoptóticos (Bax, Bid, Bik; Hussein, 2005; Greenfeld et al., 2007). Já no que se refere ao processo degenerativo de necrose, este é iniciado por uma perda da homeostase celular e é caracterizado pela lise e desintegração da célula (Bras et al., 2005). Em geral, a necrose é iniciada por mecanismos não celulares como isquemia, deficiência na concentração de ATP (Bathia, 2004) e traumas, levando à danos irreversíveis na célula (McCully et al., 2004). Além disso, trabalhos têm sugerido que mecanismos ativos, como uma sobrecarga de Na +, acúmulo de Ca 2+ e mudanças na permeabilidade da mitocôndria, podem também participar e levar ao processo necrótico (Padanilam, 2003). Independente da via efetora, apoptótica ou degenerativa (necrose), a atresia é observada em qualquer estágio do desenvolvimento folicular, sendo, no entanto, predominante na fase antral (Markström et al., 2002). Além de ser regulada por fatores endócrinos, como os hormônios folículo estimulante (FSH) e luteinizante (LH), fatores parácrinos também influenciam na decisão da morte celular durante a foliculogênese. Segundo Jin et al. (2005), o KL é capaz de inibir a apoptose nos oócitos de folículos primordiais por meio do aumento na expressão de proteínas antiapoptóticas, como a Bcl-2 e a Bcl-xL. Outros estudos têm demonstrado ainda que o KL previne a ocorrência de sinais de degeneração em oócitos de folículos pré-antrais após cultivo in vitro (Klinger e De Felici, 2002). Trabalhos utilizando a BMP-15, por sua vez, também têm verificado seu importante papel na prevenção da atresia em células somáticas foliculares (Hussein et al., 2005; Yoshino et al., 2006). Tendo em vista a importância da BMP-15 e do KL no controle da atresia e do desenvolvimento folicular, será feita a seguir uma abordagem mais detalhada acerca da atuação de tais fatores nestes processos.
72 72 Proteína Morfogenética Óssea 15 (BMP-15) Características estruturais e sítios de expressão da proteína BMP-15 A proteína BMP-15, também conhecida como Fator de Crescimento e Diferenciação 9B (GDF-9B), corresponde a um dos 35 membros da superfamília TGF-β, a qual é composta pelo hormônio antimulleriano (AMH) e pelos constituintes das subfamílias TGF-β, ativina/inibina, GDF, GDNF e BMP, sendo esta última formada por aproximadamente 20 membros (BMP-1, -2, -3, -4, -6, -7 e -15, dentre outros; Knight e Glister, 2006). Uma característica comum da maioria dos ligantes da superfamília TGF-β é a presença de sete resíduos de cisteína conservada, dentre os quais seis estão envolvidos na formação de uma estrutura tridimensional conhecida como nó de cisteína. O resíduo não envolvido na constituição desta estrutura forma uma ponte bissulfídica entre duas subunidades, resultando na formação de um dímero ligado covalentemente (Vitt et al., 2001; Fig. 1). A BMP-15, de modo interessante, apresenta apenas seis das sete cisteínas conservadas, sendo privada do quarto resíduo de cisteína, responsável pela dimerização das subunidades (Dube et al., 1998). Essa característica, contudo, não interfere na formação de estruturas diméricas da proteína, visto que as subunidades podem também interagir por meio de ligações do tipo não covalente (Liao et al., 2003). Figura 1. Esquema ilustrando o nó de cisteína e a ponte bissulfídica da maioria dos membros da superfamília TGF-β. Note os seis resíduos de cisteína conservada (1, 2, 3, 5, 6 e 7) envolvidos na formação do nó de cisteína (estrutura tridimensional) e o resíduo 4 implicado
73 73 na formação da ponte bissulfídica responsável pela constituição de dímeros ligados covalentemente. A BMP-15, como os demais membros da superfamília TGF-β, é traduzida como uma pré-proproteína composta de um sinal peptídico, uma pró-região e uma região madura, sendo esta última dotada dos resíduos de cisteína (Dube et al., 1998; Juengel e McNatty, 2005). Após a remoção do sinal peptídico, a pró-proteína sofre dimerização e é posteriormente clivada por enzimas proteolíticas em um sítio específico (RXXR), resultando na geração da proteína madura bioativa (Shimasaki et al., 2004; Fig. 2). Durante a dimerização, a região madura da BMP-15 pode se ligar a outra molécula idêntica, formando homodímeros, ou a um outro membro da superfamília TGF-β, caracterizando a formação de heterodímeros. Tal informação foi de fato demonstrada por Liao et al. (2003), os quais verificaram a formação de homodímeros e heterodímeros da BMP-15 e do Fator de Crescimento e Diferenciação 9 (GDF-9) em linhas celulares transfectadas. Figura 2. Estrutura e dimerização da BMP-15. A BMP-15 apresenta-se inicialmente como uma pré-proproteína dotada de um sinal peptídico (S-P), uma pró-região (ProR) e uma região madura (R-M). Após a remoção do S-P, ocorre a dimerização da pró-proteína através de ligações não-covalentes entre as R-M das subunidades. Em seguida, enzimas proteolíticas
74 74 clivam a pró-proteína no sítio RXXR, separando a ProR da R-M, o que resulta na formação da proteína madura dimérica bioativa. No ovário da maioria das espécies, a proteína e o RNAm para a BMP-15 são encontrados exclusivamente no oócito (Laitinen et al., 1998; Eckery et al., 2002; Juengel et al., 2002a), sugerindo esta estrutura como fonte primária da BMP-15 neste órgão. A proteína foi primeiramente observada nos oócitos de folículos primários de ovinos (Galloway et al., 2000), humanos (Aaltonen et al., 1999), ratos (Jaatinen et al., 1999) e camundongos (Laitinen et al., 1998) e em folículos primordiais de pequenos marsupiais (Eckery et al., 2002). Em caprinos, a presença da BMP-15 foi mostrada nos oócitos de todas as categorias foliculares, bem como nas células da granulosa de folículos primários, secundários e antrais (Silva et al., 2004b). Além do ovário, o RNAm para a BMP-15 já foi identificado na hipófise (Otsuka e Shimasaki, 2002) e rete testis (Aaltonen et al., 1999; Galloway et al., 2000) de algumas espécies, indicando possíveis ações desta proteína em outros órgãos e sistemas. Receptores e vias de sinalização celular da BMP-15 A maioria dos membros da superfamília TGF-β, com exceção da subfamília do fator neurotrófico derivado de células gliais (GDNF) e da inibina, exerce seus efeitos sobre as células-alvo por meio da ligação com dois receptores serina/treonina quinase presentes na superfície celular, denominados de receptores Tipo I e Tipo II (Chang et al., 2002). Até o presente momento, sete receptores Tipo I e cinco receptores Tipo II já foram identificados em mamíferos. Dentre estes, o ALK-6 (quinase do tipo receptor de ativina 6 - Tipo I) e o BMPR- II (Tipo II) têm sido caracterizados como os receptores de maior afinidade para a BMP-15 (Moore e Shimasaki, 2005; Knight e Glister, 2006). Em ovelhas, a proteína e o RNAm para ALK-6 e BMPR-II foram detectados tanto nas células da granulosa quanto nos oócitos de folículos pré-antrais (Wilson et al., 2001; Souza et al., 2002). De modo similar, em cabras foi verificada a expressão do RNAm para estes dois receptores nos oócitos e nas células da granulosa de folículos antrais (Silva et al., 2004b), sugerindo, assim, um importante papel da BMP-15 na regulação da função destes dois tipos celulares durante o desenvolvimento folicular. Durante sua ação biológica na célula, a BMP-15 se liga primariamente ao receptor ALK-6 e, em seguida, promove o recrutamento do receptor BMPR-II para o complexo pré-
75 75 formado (Moore et al., 2003; Shimasaki et al., 2004). Este último receptor, por conseguinte, induz à fosforilação do ALK-6 já previamente ligado à proteína, determinando a fosforilação de moléculas de sinalização intracelular denominadas Smads. Essas moléculas, classificadas como Smads 1, 5 e 8, interagem com outra molécula (Smad 4), resultando na formação de um complexo sinalizador que é translocado para o núcleo a fim de regular a transcrição de genesalvo e, deste modo, determinar a ação da proteína (Moore e Shimasaki, 2005; Fig. 3). Figura 3. Via de sinalização da BMP-15. A BMP-15 se liga primariamente ao receptor ALK- 6, ao qual apresenta maior afinidade, e em seguida recruta o receptor BMPR-II constitutivamente fosforilado. O BMPR-II, por sua vez, transfosforila o ALK-6 previamente ligado à BMP-15, induzindo a fosforilação das proteínas de sinalização intracelular, denominadas Smads 1, 5 e 8. Os Smads 1, 5 e 8 fosforilados interagem com o Smad 4 e o complexo formado é translocado para o núcleo, onde interage com fatores transcricionais e regula a expressão de genes-alvo, determinando a ação da proteína. Além da via de sinalização celular mediada pelos Smads, evidências indicam que outras vias sinalizadoras também estão envolvidas na ação da BMP-15 e de outras BMPs (Von Bubnoff e Cho, 2001; Nohe et al., 2002). Nesse contexto, estudos têm demonstrado que proteínas-quinases ativadas por mitógenos (MAPK) podem modular a transdução de sinais
76 76 das BMPs por meio da atuação em pontos comuns com a via Smad. De fato, tem-se verificado que moléculas MAPK ativadas podem transduzir positivamente os sinais de proteínas BMPs (Su et al., 2002) ou atuar como inibidores da sinalização Smad (Von Bubnoff e Cho, 2001). Segundo Moore et al. (2003), os efeitos positivos da BMP-15 sobre a proliferação e diferenciação das células da granulosa são dependentes da atuação de moléculas específicas da família MAPK, o que reforça a existência de uma via alternativa para regulação da ação da BMP-15. Adicionalmente, verificou-se que a folistatina, importante proteína de ligação expressa nas células da granulosa, pode bloquear a bioatividade da BMP-15 (Otsuka et al., 2001a), consistindo em uma via complementar de regulação da proteína. Papel da BMP-15 na foliculogênese e fertilidade A BMP-15 tem sido considerada um importante regulador do desenvolvimento folicular e da ovulação em mamíferos (Galloway et al., 2000; Shimasaki et al., 2004; Juengel et al., 2004; McNatty et al., 2005a). Inicialmente, estudos realizados em roedores caracterizaram a BMP-15 como um potente estimulador da proliferação das células da granulosa, demonstrando intensa capacidade de aumentar a incorporação da timidina-h 3 e o número de células foliculares in vitro (Otsuka et al., 2000). Posteriormente, essa ação da BMP-15 foi confirmada em estudos com células da granulosa de humanos (Di Pasquale et al., 2004) e ruminantes (McNatty et al., 2005b), nos quais também foi verificada sua intensa atividade mitótica nestas células. Além dessa característica, a BMP-15 pode estimular o desenvolvimento de folículos primordiais e primários em roedores (Otsuka et al., 2000; Fortune, 2003) e aumentar a expressão do KL nas células da granulosa de ratas (Otsuka e Shimasaki, 2002). A proteína BMP-15 tem sido reconhecida ainda como um importante inibidor da expressão do receptor de FSH em células da granulosa, determinando o bloqueio da síntese de progesterona induzida pelo FSH e inibindo também a expressão de proteínas (StAR e P450scc) envolvidas na esteroidogênese e estimuladas por esta gonadotrofina (Otsuka et al., 2001b). Essa característica tem sido intrinsecamente relacionada à habilidade da BMP-15 em induzir à inibição do processo de luteinização precoce (Otsuka et al., 2001b; Shimasaki et al., 2004). Em ovelhas (Juengel et al., 2002a) e peixes (Clelland et al., 2006), observou-se que a BMP-15 apresenta um papel relevante no desenvolvimento folicular até o estágio ovulatório, sugerindo a efetiva participação desta proteína durante os estágios iniciais e finais da
77 77 foliculogênese. De fato, estudos com imunização passiva contra a BMP-15 revelaram que ovelhas imunizadas apresentavam quantidade reduzida de folículos em estágios superiores ao primário e ainda baixa taxa de formação de antro e ovulação (Juengel et al., 2002a, b). Ovelhas Inverdale e Hanna, por apresentarem mutações inativadoras da BMP-15 (FecX I e FecX H ), constituem modelo interessante para a compreensão do papel desta proteína no controle da foliculogênese, bem como na determinação da fertilidade e da taxa de ovulação. Nestes animais, a mutação em homozigose causa infertilidade com bloqueio da foliculogênese no estágio de folículo primário e, quando em heterozigose, resulta em aumento significativo na taxa de ovulação (Galloway et al., 2000). Acredita-se que a ausência de bioatividade da BMP-15 nas ovelhas homozigotas comprometeria a proliferação das células da granulosa e o subsequente desenvolvimento folicular, culminando com o bloqueio no estágio de folículo primário. Contudo, nas ovelhas heterozigotas, as maiores taxas ovulatórias possivelmente seriam resultantes do aumento da sensibilidade ao FSH, já que a BMP-15 inibe a expressão de receptores para essa gonadotrofina (Otsuka et al., 2001b). O FSH, por sua vez, atuaria acelerando o desenvolvimento folicular e induzindo à ovulação precoce nos pequenos folículos em crescimento (Shimasaki et al., 2004). A importante atuação da BMP-15 na fertilidade de ovelhas foi confirmada em estudos complementares nesta espécie, nos quais se observou que mutações adicionais no gene que codifica a proteína BMP-15 (FecX B, FecX G e FecX L ) foram determinantes do mesmo fenótipo de ovelhas Inverdale e Hanna, resultando similarmente em alta taxa de ovulação nas ovelhas heterozigotas e infertilidade nas homozigotas (Hanrahan et al., 2004; McNatty et al., 2005c). Em humanos, uma mutação neste gene tem sido também verificada em mulheres com infertilidade ocasionada por falha ovariana hipergonadotrófica (Di Pasquale et al., 2004). De fato, a proteína recombinante com esta mutação não apresentou atividade biológica e ainda desenvolveu um papel antagonista à proteína BMP-15 sem mutação (Di Pasquale et al., 2004). Outros estudos em humanos têm identificado mutações no gene da BMP-15 associadas com falha ovariana prematura (Di Pasquale et al., 2006; Dixit et al., 2006) ou, mais precisamente, com insuficiência ovariana primária (Welt, 2008). No entanto, os mecanismos pelos quais tais mutações afetam a estrutura e a função da proteína permanecem ainda desconhecidos (McMahon et al., 2008). Diferentemente de ovinos e humanos, o papel da BMP-15 na foliculogênese em camundongos tem se mostrado menos significativo. Nesta espécie, a deleção completa do segundo exon do gene codificador da BMP-15 resultou apenas em subfertilidade nos animais
78 78 homozigotos, com ausência de alterações detectáveis nos heterozigotos (Yan et al., 2001). Uma avaliação histológica nos ovários dos camundongos homozigotos mostrou que a ausência de BMP-15 bioativa não comprometeu o desenvolvimento folicular normal, sendo a subfertilidade observada nestes indivíduos resultante de defeitos somente na ovulação e fertilização (Yan et al., 2001). Considerando a importante atuação da BMP-15 na foliculogênese e na fertilidade de humanos e ovinos (espécies monovulatórias), e os mínimos efeitos desta proteína em camundongos (espécie poliovulatória), tem-se sugerido a ocorrência de diferenças espécie-específicas relacionadas aos efeitos causados pelas mutações no gene da BMP-15 (Yan et al., 2001; Galloway et al., 2002). De fato, um estudo recente demonstrou que existem diferenças entre espécies mono e poliovulatórias e que estas podem ser atribuídas ao momento do processamento da pró-proteína BMP-15 em sua forma madura (ativa; Yoshino et al., 2006). Segundo tal estudo, em mamíferos monovulatórios, este processamento ocorre desde o início da foliculogênese, enquanto nas espécies poliovulatórias, ele é iniciado apenas no momento da ovulação. Com o intuito de potencializar os efeitos individuais da BMP-15 e assim reforçar sua atuação sobre a foliculogênese, esta proteína tem sido frequentemente associada ao GDF-9 (McNatty et al., 2005a, b). Um efeito potencializado desses dois fatores de crescimento foi evidenciado em células da granulosa de ratas, nos quais a BMP-15 e o GDF9 (ambos de origem ovina), atuando isoladamente, foram incapazes de estimular a incorporação da timidina-h 3, mas, quando associados, aumentaram de quatro a nove vezes a incorporação deste marcador. Aliada a isto, a combinação de BMP-15 e GDF-9 inibiu significativamente a produção de progesterona e estimulou a síntese de inibina-α, o que não foi observado quando ambos os fatores foram adicionados separadamente (McNatty et al., 2005a). De modo similar, efeitos cooperativos da BMP-15 e do GDF-9 também foram observados em alguns parâmetros relacionados às células da granulosa de bovinos e ovinos, incluindo a incorporação da timidina-h 3 e a inibição da síntese de progesterona (McNatty et al., 2005b). Visto que a BMP-15 e o GDF-9 são secretados pelo oócito durante todo o crescimento folicular, evidências sugerem que estes dois fatores de crescimento interagem entre si, atuando nas células-alvo como um único complexo funcional (Juengel e McNatty, 2005). A interação entre BMP-15 e GDF-9 foi adicionalmente relatada em estudos com cultivo de complexos cumulus-oócitos (COCs) bovinos, nos quais se observou que os COCs tratados com estes dois fatores de crescimento apresentaram aumento no potencial de desenvolvimento oocitário até o estágio de blastocisto (Hussein et al., 2006). Neste mesmo
79 79 trabalho, também foi constatada uma redução na competência do desenvolvimento oocitário após a utilização de antagonistas da BMP-15 (folistatina) ou do GDF-9 (SB431542) durante o cultivo in vitro. Outros estudos com cultivo de COCs revelaram a importante atuação da BMP-15 sobre a expansão das células do cumulus em camundongos (Yoshino et al., 2006), bem como sobre a indução da glicólise e expressão gênica de enzimas glicolíticas nestas células (Sugiura et al., 2007). Esta última função foi atribuída à BMP-15 em associação com outro fator de crescimento secretado pelo oócito, denominado Fator de Crescimento Fibroblástico 8B (FGF8B). Considerando-se que os oócitos de mamíferos são deficientes na realização da via glicolítica e dependem de produtos da glicólise oriundos das células do cumulus, a BMP-15 e o FGF8B, por causarem efeitos positivos sobre o processo glicolítico, apresentam presumivelmente um papel relevante sobre o desenvolvimento do oócito in vivo (Sugiura et al., 2007; Li et al., 2008). Kit Ligand (KL) Características estruturais e sítios de expressão da proteína KL O KL, também conhecido como Fator Stem Cell (FSC), é um fator de crescimento pluripotente envolvido na diferenciação e no crescimento de algumas linhagens de célulastronco hematopoiéticas, neuroblastos, melanoblastos e células germinativas primordiais (Galli et al., 1994). A proteína KL, codificada pelo gene Steel (Sl), é expressa como uma molécula solúvel (KL-1) ou como uma molécula associada à membrana (KL-2), dependendo de como o RNAm é processado após a transcrição (Huang et al., 1992). Inicialmente, o KL-1 e o KL-2 encontram-se associados à membrana, apresentando em sua estrutura um domínio extracelular, um domínio transmembranário hidrofóbico e uma pequena cauda citoplasmática (Hutt et al., 2006b). Como mostrado na Fig. 4, o KL-1 é eficientemente clivado, liberando seu domínio extracelular como um produto solúvel devido à presença de um sítio de clivagem proteolítico em sua estrutura, codificado por um exon específico (exon 6). Já o KL-2 não apresenta este sítio de clivagem, em decorrência da ausência do exon 6, permanecendo estavelmente ancorado à membrana (Huang et al., 1992).
80 80 Figura 4. Estrutura das isoformas do KL. O KL-1 e o KL-2 encontram-se inicialmente ancorados à membrana, sendo dotados de um domínio extracelular, um domínio transmembranário hidrofóbico e uma pequena cauda citoplasmática. O KL-1, contudo, sofre proteólise devido à presença de um sítio de clivagem codificado pelo exon 6, resultando na liberação de seu domínio extracelular (forma solúvel). Já o KL-2 permanece estavelmente ancorado à membrana, em virtude da ausência do exon 6 e do sítio de clivagem proteolítica. Sob condições fisiológicas, o KL se apresenta em sua forma monomérica (Hsu et al., 1997). No entanto, evidências sugerem que as atividades biológicas de ambas as isoformas do KL (KL-1 e KL-2) são dependentes da formação de homodímeros ligados não covalentemente (Arakawa et al., 1991; Hsu et al., 1997). Aliado a isto, tem-se hipotetizado que a dimerização regula a ativação do receptor e influencia a afinidade de ligação da proteína, refletindo em sua atividade (Zhang et al., 2000). A atividade biológica do KL tem sido relacionada ainda à presença de resíduos de aminoácidos em sua molécula (Langley et al., 1994; Matous et al., 1996), bem como à formação de sítios de glicosilação (Lu et al., 1992; Hutt et al., 2006b). Os aminoácidos, dentre outras funções, desempenham importante papel no transporte do KL para a superfície celular. De fato, Paulhe et al. (2004) verificaram que o transporte de KL para a membrana plasmática necessita de um resíduo de valina C- terminal localizado próximo aos domínios transmembrana e citoplasmático.
81 81 No ovário, a expressão do RNAm para o KL já foi mostrada nas células da granulosa de diversas espécies, incluindo humanos (Hoyer et al., 2005), roedores (Manova et al., 1993; Ismail et al., 1996), ovinos (Tisdall et al., 1997) e caprinos (Silva et al., 2006). Em camundongas (Manova et al., 1993) e ovelhas (Tisdall et al., 1997), a expressão do KL foi detectada nas células da granulosa em todos os estágios do desenvolvimento folicular. Similarmente, em ovários de fetos humanos, a presença dessa proteína foi identificada nas células da granulosa tanto de folículos pré-antrais quanto de folículos antrais iniciais (Hoyer et al., 2005). Já em caprinos, a proteína e o RNAm para o KL e para o seu receptor (c-kit) foram verificados em todas as categorias foliculares e ainda no corpo lúteo, na superfície do epitélio ovariano e no tecido medular do ovário (Silva et al., 2006), sugerindo um importante papel do KL sobre a foliculogênese e a atividade luteal, bem como sobre a regulação de outros processos locais. Adicionalmente, alguns estudos com folículos murinos detectaram a expressão do KL no oócito. No entanto, acredita-se que essa localização da proteína tenha resultado da endocitose mediada pelo c-kit, estavelmente expresso nessa estrutura (Kang et al., 2003; Hutt et al., 2006b). Receptores e vias de sinalização celular do KL O KL exerce seus efeitos biológicos por meio da ligação com um receptor tirosinaquinase, denominado c-kit. Durante o desenvolvimento ovariano pós-natal, o RNAm e a proteína do c-kit são encontrados nos oócitos em todos os estágios do desenvolvimento folicular, bem como em células intersticiais e tecais de folículos antrais de roedores (Motro e Bernstein, 1993), ovinos (Clark et al., 1996) e caprinos (Silva et al., 2006). Além disso, o c-kit também tem sido identificado em células germinativas primordiais de roedores (Manova et al., 1990) e ovinos (Clark et al., 1996) durante a migração para a gônada e o processo de multiplicação por mitose (Hutt et al., 2006b). Durante a ligação do KL ao seu receptor c-kit, diferentes padrões de sinalização podem ser ativados. Nesse contexto, diversos estudos têm contribuído para elucidar melhor o padrão de sinalização do sistema KL/c-kit via PI3K-AKT-FKHRL1 e PTEN (Fig. 5). A fosfatidilinositol 3-quinase (PI3K) é um padrão de sinalização fundamental para a regulação da proliferação, sobrevivência, migração e metabolismo celular, além de ter um importante papel na regulação da ativação de folículos primordiais (Cantley, 2002; John et al., 2009). Em estudos realizados por Reddy et al. (2005) utilizando ovários de camundongas e ratas,
82 82 observou-se que o padrão PI3K no oócito é regulado pelo KL oriundo das células da granulosa, sendo este padrão de grande importância para o desenvolvimento folicular inicial. Esses estudos sugerem que as ações do KL na transição de folículos primordiais para primários e no seu posterior desenvolvimento podem envolver a ativação da AKT e a inibição da atividade do FKHRL1 no oócito. De fato, a ativação da PI3K nos oócitos leva à fosforilação da AKT serina/treonina-quinase e do fator de transcrição FKHRL1 em oócitos de camundongas e ratas, resultando na ativação da AKT e na supressão do FKHRL1 (Reddy et al., 2005). A AKT é uma molécula sinalizadora conhecida por aumentar a proliferação e a sobrevivência celular, bem como a síntese de glicogênio e proteína (Blume-Jensen e Hunter, 2001). O FKHRL1 (Foxo3a), por sua vez, corresponde a um membro da subfamília FOXO de fatores de transcrição, a qual consiste do Foxo3a, Foxo1 (FKHR) e Foxo4 (AFX), todos efetores negativos do padrão PI3K/AKT/PTEN (Tran et al., 2003). Além disso, o FKHRL1, substrato da AKT, é um fator transcricional que leva à apoptose e à parada do ciclo celular. Portanto, tem sido sugerido que a AKT estimula o desenvolvimento do oócito, enquanto o FKHRL1 o inibe. Vale ressaltar que, além do FKHRL1 (Foxo 3a), o Foxo1 e o Foxo4 também podem ser fosforilados pela via PI3K, resultando na inibição da apoptose e na ativação do ciclo celular (Accili e Arden, 2004). Recentemente, John et al. (2008) também demonstraram que o padrão PI3K AKT, ativado pela interação KL/c-kit, tem um papel chave no início do crescimento do oócito e atua via FKHRL1. A ablação da fosfatase lipídica específica do oócito, PTEN (fosfatase e tensina homóloga com deleção no cromossomo 10), resultou na hiperativação da AKT, hiperfosforilação e exportação nuclear do FKHRL1, culminando na ativação global dos folículos primordiais e em falha ovariana prematura. Aliadas a isto, evidências genéticas de camundongas com ausência de PTEN (maior regulador negativo do padrão PI3K) nos oócitos mostraram que houve ativação de todo o reservatório de folículos primordiais no ovário (Castrillon et al., 2003), demonstrando o relevante papel do padrão de sinalização PI3K, estimulado pelo KL, sobre o desenvolvimento oocitário e folicular.
83 83 Figura 5. Via de sinalização do KL. A fosfatase lipídica específica do oócito (PTEN) atua como um regulador negativo do padrão PI3K/AKT, induzindo a ativação do fator de transcrição FKHRL1 e o consequente bloqueio do desenvolvimento oocitário (quiescência). A ativação do sistema KL/c-kit, por sua vez, ativa o padrão PI3K/AKT, ocasionando a supressão do FKHRL1 e resultando no estímulo ao desenvolvimento e crescimento do oócito. Interação KL/c-kit durante a oogênese e o desenvolvimento folicular O sistema KL/c-kit possui diversos papéis sobre a oogênese e a foliculogênese em espécies mamíferas (Thomas e Vanderhyden, 2006; Hutt et al., 2006b; Celestino et al., 2009). No que diz respeito à oogênese, vários estudos com embriões têm observado a participação da proteína KL e de seu receptor na migração de células germinativas primordiais (CGP) em direção à gônada ovariana primitiva (Matsui et al., 1990; Keshet et al., 1991; Molyneaux e Wylie, 2004). Evidências indicam que o KL, expresso em células somáticas ao longo da via migratória (Fleischman, 1993), interage com o receptor c-kit presente na superfície das CGP, direcionando a sua migração. Essa hipótese tem sido reforçada por estudos com embriões de camundongos, nos quais mutações nos genes do KL e do c-kit (Steel e White spotting) determinaram falhas ou alterações na migração das CGP até a gônada primitiva (McCoshen e McCallion, 1975; Buehr et al., 1993). Trabalhos realizados in vitro e in vivo demonstraram a participação do KL também na proliferação e sobrevivência de CGP (Dolci et al., 1991; Matsui et al., 1991; Sakata et al., 2003). Segundo Sakata et al. (2003), a atuação do KL sobre a sobrevivência deste tipo celular
84 84 ocorre em virtude dos seus efeitos negativos sobre a apoptose mediada pelo ligante Fas. Estes pesquisadores mostraram que a ativação do receptor c-kit regula negativamente a apoptose nas CGP induzida pelo Fas e que a adição in vitro de KL exógeno suprime a expressão deste ligante (Sakata et al., 2003). Outro importante estudo também tem sugerido que o KL, em sinergismo com o Fator de Crescimento semelhante à Insulina I (IGF-I) e com o Fator Inibidor da Leucemia (LIF), promove a entrada das CGP na primeira divisão meiótica, o que possivelmente está associado ao efeito positivo do KL sobre a sobrevivência das células germinativas (Lyrakou et al., 2002). Adicionalmente, um papel antiapoptótico do sistema KL/c-kit tem sido observado em oogônias e oócitos derivados de gônadas fetais (Driancourt et al., 2000). O KL, em associação ao seu receptor c-kit, tem sido considerado um dos reguladoreschave do crescimento folicular, atuando na ativação de folículos primordiais e no seu desenvolvimento além do estágio primário. Essa informação foi inicialmente demonstrada por Yoshida et al. (1997) em um experimento in vivo utilizando camundongas tratadas com anticorpo anti-c-kit (ACK-2). Nesse experimento, observou-se que o bloqueio da função do receptor afetou o recrutamento de folículos primordiais, e ainda o crescimento de folículos primários, a formação de antro e o desenvolvimento de folículos pré-ovulatórios. Posteriormente, Parrott e Skinner (1999) comprovaram a atuação do KL sobre o desenvolvimento de folículos primordiais por meio do cultivo in vitro de tecido ovariano de ratas. De modo similar ao experimento in vivo, os resultados desse estudo mostraram que a inclusão do anticorpo ACK-2 no meio de cultivo bloqueou o início do crescimento folicular, enquanto a adição de KL induziu a um aumento no percentual de folículos em desenvolvimento. Mais recentemente, estudos in vitro também observaram os efeitos do KL sobre a ativação folicular em outras espécies, como humanos (Carlsson et al., 2006) e caprinos (Celestino et al., 2010). Nesta última espécie, além da ativação, a adição de KL (50 ng/ml) in vitro também promoveu a manutenção da sobrevivência folicular. Embora este conjunto de achados demonstre a atuação do KL na ativação de folículos primordiais, tem-se verificado que outros fatores de crescimento estão envolvidos juntamente com o KL na potencialização deste processo, destacando-se o FGFb e o Fator de Crescimento Queratinócito (KGF). Estudos têm demonstrado que o FGFb e o KGF agem nas células da granulosa estimulando a expressão de KL, o qual, por sua vez, passa a atuar sinergicamente com estes dois fatores na ativação folicular (Nilsson e Skinner, 2004; Kezele et al., 2005). Além destes, outros fatores de crescimento também parecem estar implicados no processo de ativação,
85 85 incluindo as Proteínas Morfogenéticas Ósseas 4 e 7 (BMP-4 e BMP-7) e o LIF (Nilsson et al., 2002; Nilsson e Skinner, 2003; Lee et al., 2004). O sistema KL/c-kit também tem sido implicado na indução do crescimento oocitário durante os estágios iniciais da foliculogênese. Packer et al. (1994), utilizando ovários de camundongas com 8 dias de idade, verificaram que o tratamento in vitro de folículos com KL aumentou significativamente a taxa de crescimento dos oócitos. Contrariamente, Cecconi e Colonna (1996) não observaram efeitos deste fator sobre oócitos de camundongas de 12 dias de idade, sugerindo que o KL pode ter variações em sua função de acordo com as fases de desenvolvimento oocitário. Mais recentemente, Hutt et al. (2006a) identificaram a atuação estimulatória do KL sobre o crescimento de oócitos de camundongas recém-nascidas e de coelhas jovens, demonstrando nesse estudo que este fator pode agir diferentemente entre espécies. Nas camundongas, o aumento no diâmetro oocitário induzido pelo KL foi significativo apenas em folículos primordiais e primários iniciais. Nas coelhas, contudo, o KL exógeno induziu ao crescimento dos oócitos em fases mais avançadas do desenvolvimento folicular, atuando tanto em folículos iniciais (primordiais e primários) quanto em folículos primários em crescimento. Mudanças na concentração das isoformas do KL têm resultado em efeitos distintos sobre o desenvolvimento oocitário. Um estudo inicial realizado por Thomas et al. (2005) revelou que, em complexos células da granulosa-oócito (CGO) cultivados em baixas concentrações de FSH, a proporção KL-1/KL-2 é reduzida em decorrência da elevação na concentração de RNAm para KL-2. Este padrão de expressão resultou em aumento do diâmetro dos oócitos, sugerindo que o correto equilíbrio entre estas duas isoformas é necessário para o adequado desenvolvimento oocitário in vitro e que o KL-2 seria presumivelmente a principal isoforma envolvida no crescimento dos oócitos. Essa hipótese foi posteriormente confirmada em outro estudo desta mesma equipe, no qual se verificou que o aumento no diâmetro oocitário ocorreu somente quando oócitos foram cultivados em meio contendo KL-2 e que a inibição da expressão desta isoforma induziu prejuízo ao crescimento dos oócitos (Thomas et al., 2008). Além de tais resultados, este estudo também demonstrou uma atuação do KL-2 sobre a sobrevivência oocitária in vitro, corroborando com demais trabalhos nos quais o KL influenciou positivamente a sobrevivência de oócitos (Jin et al., 2005) e de outros tipos celulares (Caceres-Cortes et al., 1994; Carson et al., 1994; Packer et al., 1995).
86 86 O KL tem sido associado ainda a uma série de eventos foliculares, incluindo proliferação das células da granulosa, regulação da esteroidogênese e recrutamento de células da teca. Reynaud et al. (2000) mostraram que, em folículos pré-antrais de camundongas, o KL na concentração de 50 ng/ml aumentou significativamente a multiplicação das células da granulosa. Aliado a isto, estes autores também constataram que a adição de um inibidor do c- kit (SC1494) durante o cultivo in vitro reduziu a atividade da enzima aromatase nas células da granulosa, evidenciando a participação do sistema KL/c-kit sobre a esteroidogênese ovariana. Estudos adicionais com a proteína KL também constataram os seus efeitos positivos sobre o recrutamento de células da teca em folículos pré-antrais de roedores e bovinos (Parrott e Skinner, 1997, 2000; Huang et al., 2001). Nesta última espécie, verificou-se que o KL promove a formação de células da teca ao redor de pequenos folículos pré-antrais (Parrott e Skinner, 2000) e ainda estimula a sua proliferação, bem como a síntese local de esteroides local (Parrott e Skinner, 1997, 2000). Uma vez que a camada da teca é formada, inicia-se a produção de KGF e de testosterona pelas células tecais, os quais influenciam a função e o crescimento das células da granulosa e a própria expressão do KL (Parrott e Skinner, 1998; Joyce et al., 1999). Estudos realizados em roedores têm constatado um papel adicional do KL sobre a inibição da maturação meiótica de oócitos. Ismail et al. (1996) mostraram que oócitos cultivados por 24 horas na presença de concentrações de KL variando de 50 a 500 ng/ml apresentaram um bloqueio transitório na retomada do processo meiótico. Posteriormente, o mesmo grupo de pesquisadores verificou que a inativação do receptor c-kit em oócitos de ratas com interrupção da meiose aumentou a habilidade destes oócitos em reiniciar tal processo (Ismail et al., 1997). Deste modo, sugeriu-se que oócitos completamente desenvolvidos, já próximos à maturação, inibem a expressão do KL nas células do cumulus, bloqueando os consequentes efeitos deste fator sobre a interrupção da meiose (Joyce et al., 1999, 2000). Mais recentemente, Ye et al. (2009) demonstraram, após cultivo in vitro, que o KL atua diretamente em oócitos de folículos pré-ovulatórios, promovendo a extrusão do primeiro corpúsculo polar. Com base nessas informações, pode-se inferir que a interação entre o KL e o seu receptor c-kit exerce importante papel sobre o controle da maturação nuclear do oócito (Driancourt et al., 2000; Hutt et al., 2006b).
87 87 Papel diferencial da isoforma KL-2 Estudos de expressão gênica têm mostrado que a concentração de RNAm para KL-1 e KL-2 varia entre tecidos (Huang et al., 1992), entre ovários de camundongas de diferentes idades (Manova et al., 1993) e entre populações de células da granulosa (Ismail et al., 1997), indicando possíveis diferenças nos papéis biológicos destas duas isoformas. O KL-2, estavelmente ancorado à membrana, tem sido considerado a isoforma mais potente do KL em virtude de sua capacidade de induzir ativação mais persistente (por um tempo mais prolongado) do receptor c-kit (Kurosawa et al., 1996). De fato, estudos in vivo constataram que a sobrevivência de células germinativas primordiais é suportada pelo KL-2, enquanto a forma solúvel (KL-1) apresenta apenas efeito limitado sobre a sobrevivência desse tipo celular (Dolci et al., 1991). Além disso, observou-se que o KL-1 requer também a participação da forma associada à membrana para regular a proliferação dessas células (Kawase et al., 2004). Mutações no gene Steel evidenciaram ainda o papel potencial do KL-2 sobre a fertilidade de camundongos, mostrando que indivíduos que sintetizavam somente KL-1 eram estéreis, devido a uma deficiência no desenvolvimento das células germinativas, enquanto aqueles que produziam exclusivamente KL-2 apresentavam-se férteis (Flanagan et al., 1991; Tajima et al., 1998). Além deste papel, o KL-2 também tem sido implicado no estímulo ao crescimento de oócitos e na manutenção da sobrevivência oocitária in vitro. Segundo Thomas et al. (2008), o efeito positivo do KL-2 sobre o crescimento dos oócitos é resultante do aumento na expressão do receptor c-kit induzido por esta isoforma, o que, ao contrário, não ocorre na presença de KL-1 exógeno. O KL-1, apesar de previamente associado ao aumento no crescimento oocitário (Packer et al., 1994), resultou apenas em crescimento limitado dos oócitos in vitro. Esses achados evidenciam, portanto, que a forma do KL associada à membrana apresenta de fato uma atividade mais potente e com resultados mais significativos em relação à forma solúvel da proteína. Interações entre BMP-15 e KL Embora a BMP-15 e o KL apresentem papéis distintos e específicos durante o desenvolvimento folicular, importantes interações entre estes dois fatores de crescimento já
88 88 foram descritas na literatura (Otsuka e Shimasaki, 2002; Thomas et al., 2005). A primeira evidência concreta da interação entre BMP-15 e KL e dos efeitos deste fenômeno sobre a foliculogênese foi obtida a partir de um estudo utilizando cocultivo de oócitos e células da granulosa de ratas. Nesse estudo, observou-se que a BMP-15 estimula a expressão de KL nas células da granulosa, enquanto o KL inibe a expressão de BMP-15 nos oócitos, determinando a existência de um sistema de feedback negativo entre estes dois fatores de crescimento (Fig. 6). Além disso, observou-se que as atividades mitóticas tanto da BMP-15 quanto do KL são dependentes deste sistema de comunicação entre oócito e células da granulosa (Otsuka e Shimasaki, 2002). Figura 6. Interação entre BMP-15 e KL. A BMP-15 atua em seu receptor (R) presente nas células da granulosa, estimulando a expressão de KL. O KL, por sua vez, age no c-kit expresso no oócito suprimindo a expressão da BMP-15. Esta interação mostra a existência de um sistema de feedback negativo entre as células da granulosa e o oócito. Outros trabalhos mostraram que oócitos com crescimento incompleto, isolados de ovários de camundongas jovens, aumentaram a expressão do KL quando cocultivados com células da granulosa, sugerindo que o estímulo à expressão do KL tenha sido resultante da produção de BMP-15 pelos oócitos (Packer et al., 1994; Joyce et al., 1999). Mais recentemente, Thomas et al. (2005) verificaram que a BMP-15 aumentou a expressão de
89 89 ambas as isoformas do KL durante o cultivo in vitro de oócitos e células da granulosa, o que forneceu importantes evidências sobre a relação molecular entre BMP-15 e KL. Considerações finais Várias evidências indicam que as interações entre o oócito e as células da granulosa são críticas para assegurar a perfeita coordenação do desenvolvimento oocitário e folicular. Nesse contexto, diversas pesquisas têm sido desenvolvidas a fim de se estabelecer sistemas in vitro e in vivo que revelem características e funções de diferentes proteínas, incluindo a BMP- 15 e o KL, diretamente envolvidas na comunicação entre oócitos e células da granulosa. Estas duas proteínas, abordadas na presente revisão, possuem papel crucial sobre a foliculogênese e fertilidade em mamíferos, apresentando ações regulatórias sobre o oócito e as células somáticas foliculares, fundamentais para garantir a maturação oocitária e subsequente ovulação. No entanto, embora haja um grande número de pesquisas envolvendo estes dois fatores de crescimento, os conhecimentos sobre seus papéis específicos na reprodução da fêmea mamífera são ainda limitados. Desta forma, torna-se essencial a elucidação dos complexos mecanismos de atuação da BMP-15 e do KL, bem como de suas interações, sobre a função ovariana a fim de, futuramente, estabelecer novas metodologias e técnicas in vitro para otimizar a fertilidade de animais domésticos e de humanos. Referências bibliográficas Aaltonen J, Laitinen MP, Vuojolainen K, Jaatinen R, Horelli-Kuitunen N, Seppa L, Louhio H, Tuuri T, Sjoberg J, Butzow R. Human growth differentiation factor 9 (GDF-9) and its novel homolog GDF-9B are expressed in oocytes during early folliculogenesis. J Clin Endocrinol Metab, v.84, p , Abir R, Nitke S, Ben-Haroush A, Fisch B. In vitro maturation of human primordial ovarian follicles: Clinical significance, progress in mammals, and methods for growth evaluation. Histol Histopathol, v.21, p , Accili D, Arden KC. FoxOs at the crossroads of cellular metabolism, differentiation, and transformation. Cell, v.117, p , 2004.
90 90 Amorim CA, Rodrigues APR, Lucci CM, Figueiredo JR, Gonçalves PBD. Effect of sectioning on the number of isolated ovine preantral follicles. Small Rumin Res, v.37, p , Arakawa T, Yphantis DA, Lary JW, Narhi LO, Lu HS, Prestrelski SJ, Clogston CL, Zsebo KM, Mendiaz EA, Wypych J. Glycosylated and unglycosylated recombinant-derived human stem cell factors are dimeric and have extensive regular secondary structure. J Biol Chem, v.266, p , Betteridge KJ, Smith C, Stubbings RB, Xu KP, King WA. Potential genetic improvement of cattle by fertilization of fetal oocytes in vitro. J Reprod Fertil, v.38, p.87-98, Bhatia M. Apoptosis versus necrosis. Am J Physiol Renal Physiol, v.284, p , Blume-Jensen P, Hunter T. Oncogenic kinase signalling. Nature, v.411, p , Bras M, Queenan B, Susin SA. Programmed cell death via mitochondria: different modes of dying. Biochemistry, v.70, p , Bristol-Gould S, Woodruff TK. Folliculogenesis in the domestic cat (Felis catus). Theriogenology, v.66, p.5-13, Buehr M, McLaren A, Bartley A, Darling S. Proliferation and migration of primordial germ cells in We/We mouse embryos Dev Dyn, v.198, p , Bukovsky A, Caudle MR, Svetlikova M, Upadhyaya NB. Origin of germ cells and formation of new primary follicles in adult human ovaries. Reprod Biol Endocrinol, v.4, p.2-20, Caceres-Cortes J, Rajotte D, Dumouchel J, Haddad P, Hoang T. Product of the steel locus suppresses apoptosis in hemopoietic cells. J Biol Chem, v.269, p , Cantley LC. The Phosphoinositide 3-Kinase Pathway. Science, v.296, p.1655, Carlsson IB, Laitinen MPE, Scott JE, Louhio H, Velentzis L, Tuuri T, Aaltonen J, Ritvos O, Winston RML, Hovatta O. Kit ligand and c-kit are expressed during early human ovarian follicular development and their interaction is required for the survival of follicles in long-term culture. Reproduction, v.131, p , Carson WE, Haldar S, Baiocchi RA, Croce CM, Caligiuri MA. The c-kit ligand suppresses apoptosis of human natural killer cells through the upregulation of bcl 2. Proc Nat Acad Sci USA, v.91, p , Castrillon DH, Miao L, Kollipara R, Horner JW, DePinho RA. Suppression of ovarian follicle activation in mice by the transcription factor Foxo3a. Science, v.301, p , 2003.
91 91 Cecconi S, Colonna R. Influence of granulosa cells and of different somatic cell types on mammalian oocyte development in vitro. Zygote, v.4, p , Celestino JJH, Bruno JB, Lima-Verde IB, Matos MHT, Saraiva MVA, Chaves RN, Martins FS, Almeida AP, Cunha RMS, Lima LF, Name KO, Campello CC, Silva JRV, Báo SN, Figueiredo JR. Steady-State Level of Kit Ligand mrna in goat ovaries and the role of Kit ligand in preantral follicle survival and growth in vitro. Mol Reprod Dev, v.77, p , Celestino JJH, Matos MHT, Saraiva MVA, Figueiredo JR. Regulation of ovarian folliculogenesis by Kit Ligand and the c-kit system in mammals. Anim Reprod, v.6, p , Chang H, Brown CW, Matzuk MM. Genetic analysis of the mammalian transforming growth factor-b superfamily. Endocr Rev, v.23, p , Clark DE, Tisdall DJ, Fidler AE, McNatty KP. Localization of mrna encoding c-kit during the initiation of folliculogenesis in ovine fetal ovaries. J Reprod Fertil, v.106, p , Clelland E, Kohli G, Campbell RK, Sharma S, Shimazaki S, Peng C. Bone morphogenetic protein-15 in the zebrafish ovary: complementary deoxyribonucleic acid cloning, genomic organization, tissue distribution, and role in oocyte maturation. Endocrinology, v.147, p , Di Pasquale E, Beck-Peccoz P, Persani L. Hypergonadotropic ovarian failure associated with an inherited mutation of human bone morphogenetic protein-15 (BMP15) gene. Am J Hum Genet, v.75, p , Di Pasquale E, Rossetti R, Marozzi A, Bodega B, Borgato S, Cavallo L, Einaudi S, Radetti G, Russo G, Sacco M, Wasniewska M, Cole T, Beck-Peccoz P, Nelson LM, Persani L. Identification of new variants of human BMP15 gene in a large cohort of women with premature ovarian failure. J Clin Endocrinol Metab, v.91, p , Dixit H, Rao LK, Padmalatha VV, Kanakavalli M, Deenadayal M, Gupta N, Chakrabarty B, Singh L. Missense mutations in the BMP15 gene are associated with ovarian failure. Hum Genet, v.119, p , Dolci S, Williams DE, Ernst MK, Resnick JL, Brannan CI, Lock LF, Lyman SD, Boswell HS, Donovan PJ. Requirement for mast cell growth factor for primordial germ cell survival in culture. Nature, v.352, p , 1991.
92 92 Driancourt M, Reynaud K, Cortvrindt R, Smitz J. Roles of KIT and KIT LIGAND in ovarian function. Rev Reprod, v.5, p , Drummond AE. The role of steroids in follicular growth. Reprod Biol Endocrinol, v.4, p.1-11, Dube JL, Wang P, Elvin J, Lyons KM, Celeste AJ, Matzuk MM. The bone morphogenetic protein 15 gene is X-linked and expressed in oocytes. Mol Endocrinol, v.12, p , Eckery DC, Whale LJ, Lawrence SB, Wylde KA, McNatty KP, Juengel JL. Expression of mrna encoding growth differentiation factor 9 and bone morphogenetic protein 15 during follicular formation and growth in a marsupial, the brushtail possum (Trichosurus vulpecula). Mol Cell Endocrinol, v.92, p , Elmore S. Apoptosis: A review of programmed cell death. Toxicol Pathol, v.35, p , Eppig JJ. Oocyte control of ovarian follicular development and function in mammals. Reproduction, v.122, p , Eppig JJ, Viveiros MM, Bivens CM, De La Fuente R. Regulation of mammalian oocyte maturation. In: Leung PC, Adashi EY. (Ed.). The Ovary. San Diego: Elsevier, p Eppig JJ, Wigglesworth K, Pendola FL. The mammalian oocyte orchestrates the rate of ovarian follicular development. Proc Natl Acad Sci USA, v.99, p , Erickson GF. An analysis of follicle development and ovum maturation. Semin Reprod Endocrinol, v.4, p , Flanagan JG, Chan DC, Leder P. Transmembrane form of the kit ligand growth factor is determined by alternative splicing and is missing in the Sld mutant. Cell, v.64, p , Fleischman RA. From white spots to stem cells: the role of the kit receptor in mammalian development. Trends Genet, v.9, p , Fortune JE. The early stages of follicular development: activation of primordial follicles and growth of preantral follicles. Anim Reprod Sci, v.78, p , Galli SJ, Zsebo KM, Geissler EN. The kit ligand, stem cell factor. Adv Immunol, v.55, p.1-96, Galloway SM, Gregan SM, Wilson T, McNatty KP, Juengel JL, Ritvos O, Davis GH. Bmp15 mutations and ovarian function. Mol Cell Endocrinol, v.191, p.15-18, 2002.
93 93 Galloway SM, Mcnatty KP, Cambridge LM, Ritvos O. Mutations in an oocyte derived growth factor gene (BMP-15) cause increased ovulation rate and infertility in a dosagesensitive manner. Nat Gen, v.25, p , Greenfeld CR, Pepling ME, Babus JK, Furth PA, Flaws JA. BAX regulates follicular endowment in mice. Reproduction, v.133, p , Hanrahan JP, Gregan SM, Mulsant P, Mullen M, Davis GH, Powell R, Galloway SM. Mutations in the genes for oocyte derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep (Ovis aries). Biol Reprod, v.70, p , Hoyer PE, Byskov AG, Mollgard K. Stem cell factor and c-kit in human primordial germ cells and fetal ovaries. Mol Cell Endocrinol, v.234, p.1 10, Hsu YR, Wu GM, Mendiaz EA, Syed R, Wypych J, Toso R, Mann MB, Boone TC, Narhi LO, Lu HS, Langley KE. The majority of stem cell factor exists as monomer under physiological conditions. Implications for dimerization mediating biological activity. J Biol Chem, v.272, p , Huang CT, Weitsman SR, Dykes BN, Magoffin DA. Stem cell factor and insulin-like growth factor-i stimulate luteinizing hormone-independent differentiation of rat ovarian theca cells. Biol Reprod, v.64, p.451 6, Huang EJ, Nocka KH, Buck J, Besmer P. Differential expression and processing of two cell associated forms of the Kit-Ligand: KL-1 and KL-2. Mol Biol Cell, v.3, p , Hussein MR. Apoptosis in the ovary: molecular mechanisms. Hum Reprod Update, v.11, p , Hussein TS, Froiland DA, Amato F, Thompson JG, Gilchrist RB. Oocytes prevent cumulus cell apoptosis by maintaining a morphogenic paracrine gradient of bone morphogenetic proteins. J Cell Sci, v.118, p , Hussein TS, Thompson JG, Gilchrist RB. Oocyte-secreted factors enhance oocyte developmental competence. Dev Biol, v.296, p , Hutt KJ, McLaughlin EA, Holland MK. KIT/KIT Ligand in mammalian oogenesis and folliculogenesis: roles in rabbit and murine ovarian follicle activation and oocyte growth. Biol Reprod, v.75, p , 2006a. Hutt K, McLaughlin EA, Holland MK. KL and KIT have diverse roles during mammalian oogenesis. Mol Hum Reprod, v.12, p.61-69, 2006b.
94 94 Ismail RS, Dube M, Vanderhyden BC. Hormonally regulated expression and alternative splicing of kit ligand may regulate kit-induced inhibition of meiosis in rat oocytes. Dev Biol, v.184, p , Ismail RS, Okawara Y, Fryer JN, Vanderhyden BC. Hormonal regulation of the ligand for c-kit in the rat ovary and its effects on spontaneous oocyte meiotic maturation Mol Reprod Dev, v.43, p , Jaatinen R, Laitinen MP, Vuojolainen K, Aaltonen J, Louhio H, Heikinheimo K, Lehtonen E, Ritvos O. Localization of growth differentiation factor-9 (GDF-9) mrna and protein in rat ovaries and cdna cloning of rat GDF-9 and its novel homolog GDF-9B. Mol Cell Endocrinol, v.156, p , Jin X, Han CS, Yu FQ, Wei P, Hu ZY, Liu YX. Anti-apoptotic action of stem cell factor on oocytes in primordial follicles and its signal transduction. Mol Reprod Dev, v.70, p.82-90, John GB, Gallardo TD, Shirley LJ, Castrillon DH. Foxo3 is a PI3K-dependent molecular switch controlling the initiation of oocyte growth. Dev Biol, v.321, p , John GB, Shidler MJ, Besmer P, Castrillon DH. Kit signaling via PI3K promotes ovarian follicle maturation but is dispensable for primordial follicle activation. Dev Biol, v.331, , Johnson J, Bagley J, Skaznik-Wikiel M, Lee HJ, Adams GB, Niikura Y, Tschudy KS, Tilly JC, Cortes ML, Forkert R. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell, v.122, p , Joyce IM, Clark AT, Pendola FL, Eppig JJ. Comparison of recombinant growth differentiation factor-9 and oocyte regulation of KIT ligand messenger ribonucleic acid expression in mouse ovarian follicles. Biol Reprod, v.63, p , Joyce IM, Pendola FL, Wigglesworth K, Eppig JJ. Oocyte regulation of kit ligand expression in mouse ovarian follicles. Dev Biol, v.214, p , Joza N, Kroemer G, Penninger JM. Genetic analysis of the mammalian cell death machinery. Trends Genetic, v.18, p , Juengel JL, Bodensteiner KJ, Heath DA, Hudson NL, Moeller CL, Smith P, Galloway SM, Davis GH, Sawyer HR, McNatty KP. Physiology of GDF9 and BMP15 signalling molecules. Anim Reprod Sci, v.82/83, p , Juengel JL, Hudson NL, Heath DA, Smith P, Reader KL, Lawrence SB, O Connell AR, Laitinen MP, Cranfield M, Groome NP. Growth differentiation factor 9 and bone
95 95 morphogenetic protein 15 are essential for ovarian follicular development in sheep. Biol Reprod, v.67, p , 2002a. Juengel JL, Hudson NL, Smith P, Reader KL, McNatty KP. Bone morphogenetic protein 15 is essential for both the early and late stages of follicle development in sheep. Biol Reprod, v.66, suppl. 1, p.110, 2002b. Abstract, 31. Juengel JL, McNatty KP. The role of proteins of the transforming growth factor- β superfamily in the intraovarian regulation of follicular development. Hum Reprod Update, v.11, p , Juengel JL, Sawyer HR, Smith PR, Quirke LD, Heath DA, Lun S, Wakefield SJ, McNatty KP. Origins of follicular cells and ontogeny of steroidogenesis in ovine fetal ovaries. Mol Cell Endocrinol, v.191, p.1-10, 2002c. Kang JS, Lee CJ, Lee JM, Rha JY, Song KW, Park MH. Follicular expression of c- Kit/SCF and inhibin-alpha in mouse ovary during development. J Histochem Cytochem, v.51, p , Katska-Ksiazkiewicz L. Recent achievements in vitro culture and preservation of ovarian follicles in mammals. Reprod Biol, v.6, p.3-16, Kawase E, Hashimoto K, Pedersen RA. Autocrine and paracrine mechanisms regulating primordial germ cell proliferation. Mol Reprod Dev, v.68, p.5-16, Keshet E, Lyman SD, Williams DE, Anderson DM, Jenkins NA, Copeland NG, Parada LF. Embryonic RNA expression patterns of the c-kit receptor and its cognate ligand suggest multiple functional roles in mouse development. Embo J, v.10, p , Kezele P, Nilsson EE, Skinner MK. Keratinocyte growth factor acts as a mesenchymal factor that promotes ovarian primordial to primary follicle transition. Biol Reprod, v.73, p , Klinger FG, De Felici M. In vitro development of growing oocytes from fetal mouse oocytes: stage-specific regulation by stem cell factor and granulosa cells. Dev Biol, v.244, p.85-95, Knight PG, Glister C. TGF-β superfamily members and ovarian follicle development. Reproduction, v.132, p , Kurosawa K, Miyazawa K, Gotoh A, Katagiri T, Nishimaki J, Ashman LK, Toyama K. Immobilized anti-kit monoclonal antibody induces ligand independent dimerization and activation of steel factor receptor: biologic similarity with membrane-bound form of steel factor rather than its soluble form. Blood, v.87, p , 1996.
96 96 Laitinen M, Vuojolainen K, Jaatinen R, Ketola I, Aaltonen J, Lehtonen E, Heikinheimo M, Ritvos O. A novel growth differentiation factor-9 (GDF-9) related factor is co-expressed with GDF-9 in mouse oocytes during folliculogenesis. Mech Dev, v.78, p , Langley KE, Mendiaz EA, Liu N, Narhi LO, Zeni L, Parseghian CM, Clogston CL, Leslie I, Pope JA, Lu HS. Properties of variant forms of human stem cell factor recombinantly expressed in Escherichia coli. Arch Biochem Biophys, v.311, p.55-61, Lee WS, Yoon SJ, Yoon TK, Cha KY, Lee SH, Shimasaki S, Lee S, Lee KA. Effects of bone morphogenetic protein-7 (BMP-7) on primordial follicular growth in the mouse ovary. Mol Reprod Dev, v.69, p , Li Q, McKenzie LJ, Matzuk MM. Revisiting oocyte somatic cell interactions: in search of novel intrafollicular predictors and regulators of oocyte developmental competence. Mol Hum Reprod, v.14, p , Liao WX, Moore RK, Otsuka F, Shimasaki S. Effect of intracellular interactions on the processing and secretion of bone morphogenetic protein-15 (BMP-15) and growth and differentiaton factor-9: implication of the aberrant ovarian phenotype of BMP-15 mutant sheep. J Biol Chem, v.278, p , Lu HS, Clogston CL, Wypych J, Parker VP, Lee TD, Swiderek K, Baltera RF, Patel AC, Chang DC, Brankow DW. Post-translational processing of membrane-associated recombinant human stem cell factor expressed in Chinese hamster ovary cells. Arch Biochem Biophys, v.298, p , Lucci CM, Amorim CA, Báo SN, Figueiredo JR, Rodrigues APR, Silva JR, Gonçalves PBD. Effect of the interval of serial sections of ovarian in the tissue chopper on the number of isolated caprine preantral follicles. Anim Reprod Sci, v.56, p.39-49, Lyrakou S, Hulten MA, Hartshorne GM. Growth factors promote meiosis in mouse fetal ovaries in vitro. Mol Hum Reprod, v.8, p , Manova K, Huang EJ, Angeles M, De Leon V, Sanchez S, Pronovost SM, Besmer P, Bachvarova RF. The expression pattern of the c-kit ligand in gonads of mice supports a role for the c-kit receptor in oocyte growth and in proliferation of spermatogonia. Dev Biol, v.157, p.85-99, Manova K, Nocka K, Besmer P, Bachvarova RF. Gonadal expression of c-kit encoded at the W locus of the mouse. Development, v.110, p , 1990.
97 97 Markström E, Svensson EC, Shao R, Svanberg B, Billig H. Survival factors regulating ovarian apoptosis - dependence on follicle differentiation. Reproduction, v.123, p.23-30, Matous JV, Langley K, Kaushansky K. Structure-function relationships of stem cell factor: an analysis based on a series of human-murine stem cell factor chimera and the mapping of a neutralizing monoclonal antibody. Blood, v. 88, p , Matsui Y, Toksoz D, Nishikawa S, Williams D, Zsebo K, Hogan BL. Effect of Steel factor and leukaemia inhibitory factor on murine primordial germ cells in culture. Nature, v.353, p , Matsui Y, Zsebo KM, Hogan BL. Embryonic expression of a haematopoietic growth factor encoded by the Sl locus and the ligand for c-kit. Nature, v.347, p , Matzuk MM, Burns KH, Viveiros MM, Eppig JJ. Intercellular communication in the mammalian ovary: oocytes carry the conversation. Science, v.296, p , McCoshen JA, McCallion DJ. A study of the primordial germ cells during their migratory phase in Steel mutant mice. Experientia, v.31, p , McCully JD, Wakiyama H, Hsieh YJ, Jones M, Levitsky S. Differential contribution of necrosis and apoptosis in myocardial ischemia-reperfusion injury. Am J Physiol Heart Circ Physiol, v.286, p , McLaughlin EA, McIver SC. Awakening the oocyte: controlling primordial follicle development. Reproduction, v.137, p.1-11, McMahon HE, Sharma S, Shimasaki S. Phosphorylation of bone morphogenetic Protein-15 and growth and differentiation factor-9 plays a critical role in determining agonistic or antagonistic functions. Endocrinology, v.149, p , McNatty KP, Fidler AE, Juengel JL, Quirke LD, Smith PR, Heath DA, Lundy T, O Connell A, Tisdall DJ. Growth and paracrine factors regulating follicular formation and cellular function. Mol Cell Endocrinol, v.163, p.11-20, McNatty KP, Juengel JL, Reader KL, Lun S, Myllymaa S, Lawrence SB, Western A, Meerasahib MF, Mottershead DG, Groome N. Bone morphogenetic protein 15 and growth differentiation factor 9 co-operate to regulate granulosa cell function. Reproduction, v.129, p , 2005a. McNatty KP, Juengel JL, Reader KL, Lun S, Myllymaa S, Lawrence SB, Western A, Meerasahib MF, Mottershead DG, Groome NP, Ritvos O, Laitinen, MPE. Bone
98 98 morphogenetic protein 15 and growth differentiation factor 9 co-operate to regulate granulosa cell function in ruminants. Reproduction, v.129, p , 2005b. McNatty KP, Smith P, Moore LG, Reader K, Lun S, Hanrahan JP, Groome NP, Laitinen M, Ritvos O, Juengel JL. Oocyte-expressed genes affecting ovulation rate. Mol Cell Endocrinol, v.234, p.57-66, 2005c. Molyneaux K, Wylie C. Primordial germ cell migration. Int J Dev Biol, v.48, p , Moore RK, Otsuka F, Shimasaki S. Molecular basis of bone morphogenetic protein-15 signaling in granulosa cells. J Biol Chem, v.278, p , Moore RK, Shimasaki S. Molecular biology and physiological role of the oocyte factor, BMP-15. Mol Cell Endocrinol, v.234, p.67-73, Motro B, Bernstein A. Dynamic changes in ovarian c-kit and syeel expression during the estrous reproductive cycle. Dev Dyn, v.197, p.69-79, Nilsson EE, Kezele P, Skinner MK. Leukemia inhibitory factor (LIF) promotes the primordial to primary follicle transition in rat ovaries. Mol Cell Endocrinol, v.188, p.65-73, Nilsson EE, Skinner MK. Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and and promotes primordial follicle development. Biol Reprod, v.69, p , Nilsson EE, Skinner MK. Kit ligand and basic fibroblast growth factor interactions in the induction of ovarian primordial to primary follicle transition. Mol Cell Endocrinol, v.214, p.19-25, Nohe A, Hassel S, Ehrlich M, Neubauer F, Sebald W, Henis YI, Knaus P. The mode of bone morphogenetic protein (BMP) receptor oligomerization determines different BMP-2 signaling pathways. J Biol Chem, v.277, p , Ojeda SR, Romero C, Tapia V, Dissen GA. Neurotrophic and cell-cell dependent control of early follicular development. Mol Cell Endocrinol, v.163, p.67-71, Otsuka F, Moore RK, Iemura S-I, Ueno N, Shimasaki S. Follistatin inhibits the function of the oocyte-derived factor BMP-15. Biochem Biophys Res Commun, v.289, p , 2001a. Otsuka F, Shimasaki S. A negative feedback system between oocyte bone morphogenetic protein 15 and granulosa cell kit ligand: its role in regulating granulosecell mitosis. Proc Natl Acad Sci USA, v.99, p , 2002.
99 99 Otsuka F, Yamamoto S, Erickson GF, Shimasaki S. Bone morphogenetic protein-15 inhibits follicle-stimulating hormone (FSH) action by suppressing FSH receptor expression. J Biol Chem, v.276, p , 2001b. Otsuka F, Yao Z, Lee T-H, Yamamoto S, Erickson GF, Shimasaki S. Bone morphogenetic protein-15: identification of target cells and biological functions. J Biol Chem, v.275, p , Packer AI, Besmer P and Bachvarova RF. Kit ligand mediates survival of type A spermatogonia and dividing spermatocytes in postnatal mouse testes. Mol Reprod Dev, v.42, p , Packer AI, Hsu YC, Besmer P, Bachvarova RF. The ligand of the c-kit receptor promotes oocyte growth. Dev Biol, v.161, p , Padanilam BJ. Cell death induced by acute renal injury: a perspective on the contributions of apoptosis and necrosis. Am J Physiol Renal Physiol, v.284, p.f608-f627, Parrott JA, Skinner MK. Direct actions of kit-ligand on theca cell growth and differentiation during follicle development. Endocrinology, v.138, p , Parrott JA, Skinner MK. Kit ligand actions on ovarian stromal cells: effects on theca cell recruitment and steroid production. Mol Reprod Dev, v.55, p.55-64, Parrott JA, Skinner MK. Kit-ligand/stem cell factor induces primordial follicle development and initiates folliculogenesis. Endocrinology, v.140, p , Parrott JA, Skinner MK. Thecal cell-granulosa cell interactions involve a positive feedback loop among keratinocyte growth factor, hepatocyte growth factor, and Kit ligand during ovarian follicular development. Endocrinology, v.139, p , Paulhe F, Imhof BA, Wehrle-Haller B. A specific endoplasmic reticulum export signal drives transport of stem cell factor (Kitl) to the cell surface. J Biol Chem, v.279, p , Picton H, Briggs D, Gosden R. The molecular basis of oocyte growth and development. Mol Cell Endocrinol, v.145, p.27-37, Reddy P, Shen L, Ren C, Boman K, Lundin E, Ottander U, Lindgren P, Liu Y-x, Sun Q- y, Liu K. Activation of Akt (PKB) and suppression of FKHRL1 in mouse and rat oocytes by stem cell factor during follicular activation and development. Dev Biol, v.281, p , 2005.
100 100 Reynaud K, Cortvrindt R, Smitz J, Driancourt MA. Effects of Kit Ligand and anti-kit antibody on growth of cultured mouse preantral follicles. Mol Reprod Dev, v.56, p , Sakata S, Sakamaki K, Watanabe K, Nakamura N, Toyokuni S, Nishimune Y, Mori C, Yonehara S. Involvement of death receptor Fas in germ cell degeneration in gonads of Kitdeficient Wv/Wv mutant mice. Cell Death Differ, v.10, p , Shaw JM, Oranratnachai A, Trounson AO. Fundamental cryobiology of mammalian oocytes and ovarian tissue. Theriogenology, v.53, p.59-72, Shimasaki S, Moore RK, Otsuka F, Erickson GF. The bone morphogenetic protein system in mammalian reproduction. Endocr Rev, v.25, p , Silva JRV, van den Hurk R, Matos MHT, Santos RR, Pessoa C, Moraes MO, Figueiredo, JR. Influences of FSH and EGF on primordial follicles during in vitro culture of caprine ovarian cortical tissue. Theriogenology, v.61, p , 2004a. Silva JRV, van den Hurk R, Van Tol HTA, Roelen BAJ, Figueiredo JR. Expression of Growth Differentiation Factor 9 (GDF9), Bone Morphogenetic Protein 15 (BMP15) and BMP Receptors in the Ovaries of Goats. Mol Reprod Dev, v.70, p.11-19, 2004b. Silva JRV, van den Hurk R, Van Tol HTA, Roelen BAJ, Figueiredo JR. The Kit ligand/c- Kit receptor system in goat ovaries: gene expression and protein localization. Zygote, v.14, p , Skinner MK. Regulation of primordial follicle assembly and development. Hum Reprod Update, v.11, p , Souza CJ, Campbell BK, McNeilly AS, Baird DT. Effect of bone morphogenetic protein 2 (BMP2) on oestradiol and inhibin A production by sheep granulosa cells, and localization of BMP receptors in the ovary by immunohistochemistry. Reproduction, v.123, p , Su Y-Q, Wigglesworth K, Pendola FL, O Brien MJ, Eppig JJ. Mitogen-activated protein kinase activity in cumulus cells is essential for gonadotropin-induced oocyte meiotic resumption and cumulus expansion in the mouse. Endocrinology, v.143, p , Sugiura K, Su Y-Q, Diaz FJ, Pangas SA, Sharma S, Wigglesworth K, O Brien MJ, Matzuk MM, Shimasaki S, Eppig JJ. Oocyte-derived BMP15 and FGFs cooperate to promote glycolysis in cumulus cells. Development, v.134, p , Suh CS, Sonntag B, Erickson GF. The ovarian life cycle: a contemporany view. Rev Endocr Metab Disord, v.3, p.5-12, 2002.
101 101 Tajima Y, Moore MA, Soares V, Ono M, Kissel H, Besmer P. Consequences of exclusive expression in vivo of kit ligand lacking the major proteolytic cleavage site. Proc Natl Acad Sci USA, v.95, p , Thomas FH, Ethier JF, Shimasaki S, Vanderhyden BC. Follicle stimulating hormone regulates oocyte growth by modulation of expression of oocyte and granulosa cell factors. Endocrinology, v.146, p , Thomas FH, Ismail RS, Jiang J, Vanderhyden BC. Kit ligand 2 promotes murine oocyte growth in vitro. Biol Reprod, v.78, p , Thomas FH, Vanderhyden BC. Oocyte-granulosa cell interactions during mouse follicular development: regulation of kit ligand expression and its role in oocyte growth. Reprod Biol Endocrinol, v.4, p.1-8, Tisdall DJ, Quirke LD, Smith P and McNatty KP. Expression of the ovine stem cell factor gene during folliculogenesis in late fetal and adult ovaries. J Mol Endocrinol, v.18, p , Tran H, Brunet A, Griffith EC, Greenberg ME. The many forks in FOXO's road. Sci STKE, n.172, re5, Van Cruchten S, Van den Broeck W. Morphological and biochemical aspects of apoptosis, oncosis and necrosis. Anat Histol Embryol, v.31, p , Van den Hurk R, Bevers MM, Becker JF. Et al and in vitro development of preantral follicles. Theriogenology, v.47, p.73-82, Van den Hurk R, Zhao J. Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles. Theriogenology, v.63, p , Vitt UA, Hsu SY, Hsueh AJW. Evolution and classification of cystine knot-containing hormones and related extracellular signaling molecules. Mol Endocrinol, v.15, p , Von Bubnoff A, Cho KWY. Intracellular BMP signaling regulation in vertebrates: pathway or network? Dev Biol, v.239, p.1-14, Welt CK. Primary ovarian insufficiency: a more accurate term for premature ovarian failure. Clin Endocrinol (Oxf), v.68, p , Wilson T, Wu XY, Juengel JL, Ross IK, Lumsden JM, Lord EA, Dodds KG, Walling GA, McEwan JC, O Connell AR, McNatty KP, Montgomery GW. Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic
102 102 protein IB receptor (ALK-6) that is expressed in both oocytes and granulosa cells. Biol Reprod, v.64, p , Yan C, Wang P, Demayo J, Demayo FJ, Elvin JA, Carino C, Prasad SV, Skinner SS, Dunbar BS, Dube JL, Celeste AJ, Matzuk MM. Synergistic roles of bone morphogenetic protein 15 and growth differentiation factor 9 in ovarian function. Mol Endocrinol, v.15, p , Ye Y, Kawamura K, Sasaki M, Kawamura N, Groenen P, Gelpke MDS, Rauch R, Hsueh AJW, Tanaka T. Kit ligand promotes first polar body extrusion of mouse preovulatory oocytes. Reprod Biol Endocrinol, v.7, p.26, Yoshida H, Takakura N, Nataoka H, Kunisada T, Okamura H, Nishikawa SI. Stepwise requirement of c-kit tyrosine kinase in mouse ovarian follicle development. Dev Biol, v.184, p , Yoshino O, McMahon HE, Sharma S, Shimasaki S. A unique preovulatory expression pattern plays a key role in the physiological functions of BMP-15 in the mouse. Proc Natl Acad Sci USA, v.103, p , Zama AM, Hudson FP, Bedell MA. Analysis of Hypomorphic Kitlsl mutants suggests different requirements for kitl in proliferation and migration of mouse primordial germ cells. Biol Reprod, v.73, p , Zhang Z, Zhang R, Joachimiak A, Schlessinger J, Kong XP. Crystal structure of human stem cell factor: implication for stem cell factor receptor dimerization and activation. Proc Natl Acad Sci USA, v.97, p , 2000.
103 103 7 CAPÍTULO 2 Meio dinâmico contendo kit ligand e hormônio folículo estimulante promove sobrevivência, ativação e crescimento folicular durante cultivo in vitro de longa duração de folículos pré-antrais caprinos (Dynamic Medium Containing Kit Ligand and Follicle-Stimulating Hormone Promotes Follicular Survival, Activation, and Growth during Long-Term in vitro Culture of Caprine Preantral Follicles) Periódico: Cells Tissues Organs, v. 195, p , 2012.
104 104 Resumo O objetivo desse estudo foi avaliar os efeitos de um meio dinâmico contendo kit ligand (KL) e hormônio folículo estimulante (FSH) sobre o cultivo in vitro de folículos pré-antrais caprinos por 16 dias. Fragmentos ovarianos foram cultivados em α-mem + contendo ou não KL (50 ng/ml) e/ou FSH (50 ng/ml) adicionados durante a primeira (dia 0 a dia 8) e/ou segunda metade (dia 8 a dia 16) do período de cultivo. Os fragmentos ovarianos não-cultivados (controle) e cultivados foram processados para avaliação histológica e ultraestrutural. Após 1 dia de cultivo, somente os tratamentos realizados com KL ou FSH mantiveram um percentual de folículos normais similar ao controle. Após 16 dias, todos os tratamentos utilizando KL até o dia 8 (KL/KL, KL/FSH e KL/FSH+KL) e somente FSH durante todo o período de cultivo (FSH/FSH) mostraram maiores taxas de sobrevivência folicular em comparação ao α-mem + sozinho. Após 1 e 8 dias, os tratamentos inicialmente cultivados com KL aumentaram o percentual de ativação folicular em comparação ao α-mem + sozinho e aos demais tratamentos. O maior diâmetro folicular após 16 dias foi observado nos folículos cultivados com KL até o dia 8, seguido pelo FSH (KL/FSH). Além disso, esse tratamento promoveu logo no primeiro dia de cultivo um aumento no crescimento oocitário em comparação ao α-mem + sozinho. A análise ultraestrutural confirmou a integridade dos folículos cultivados em KL/FSH após 16 dias. Em conclusão, um meio dinâmico contendo KL e FSH manteve a integridade folicular e promoveu a ativação e o crescimento durante cultivo in vitro de longa duração de folículos pré-antrais caprinos. Palavras-chave: KL. FSH. Desenvolvimento folicular. Cabra.
105 105 Dynamic Medium Containing Kit Ligand and Follicle Stimulating Hormone Promotes Follicular Survival, Activation and Growth During Long-Term In Vitro Culture of Caprine Preantral Follicles I.M.T. Lima a*, J.J.H. Celestino a, L.R. Faustino a, D.M. Magalhães-Padilha a, R. Rossetto a, I.R. Brito a, M.A.M. Donato b, C.A.P. Lopes a, C.C. Campello a, C.A. Peixoto b, J.R. Figueiredo a, A.P.R. Rodrigues a a Laboratory of Manipulation of Oocytes and Preantral Follicles (LAMOFOPA), Faculty of Veterinary, State University of Ceará, Fortaleza, CE, Brazil; b Laboratory of Ultrastructure, CPqAM/Fiocruz, Federal University of Pernambuco, Recife, PE, Brazil. * Correspondence should be addressed to: Programa de Pós-Graduação em Ciências Veterinárias (PPGCV) Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais (LAMOFOPA) Universidade Estadual do Ceará (UECE) Av. Paranjana, 1700, Campus do Itaperi. Fortaleza CE Brasil. CEP: Tel.: ; Fax: address: dora.uece@gmail.com (Isadora Machado Teixeira Lima)
106 106 Abstract The aim of this study was to evaluate the effects of a dynamic medium containing kit ligand (KL) and follicle stimulating hormone (FSH) on the in vitro culture of caprine preantral follicles for 16 days. Ovarian fragments were cultured in α-mem + containing or not KL (50 ng/ml) and/or FSH (50 ng/ml) added during the first (day 0 to day 8) and/or second half (day 8 to day 16) of the culture period. Non-cultured (control) and cultured fragments were processed for histological and ultrastructural evaluation. After 1 day of culture, only the treatments performed with KL or FSH maintained a percentage of normal follicles similar to the control. After 16 days, all treatments using KL until day 8 (KL/KL, KL/FSH and KL/FSH+KL) and only FSH during the entire culture period (FSH/FSH) showed higher rates of follicular survival compared to α-mem + alone. After 1 and 8 days, the treatments initially cultured with KL increased the percentage of follicular activation in comparison to α-mem + alone and other treatments. The highest follicular diameter after 16 days was observed in the follicles cultured with KL until day 8 followed by FSH (KL/FSH). Furthermore, this treatment promoted as early as one day of culture an increase in oocyte growth compared to α-mem + alone. Ultrastructural analysis confirmed the integrity of follicles cultured in KL/FSH after 16 days. In conclusion, a dynamic medium containing KL and FSH maintained follicular integrity and promoted follicular activation and growth during the long-term in vitro culture of caprine preantral follicles. Key words: KL, FSH, follicular development, goat.
107 107 Introduction At birth, the mammalian ovary is constituted by thousands of primordial follicles, considered to be the resting follicle pool. Throughout the female s reproductive life span, a small number of primordial follicles are stimulated to grow in a process known as follicular activation, and a vast majority (99.9%) become atretic toward ovulation (Skinner, 2005). Despite the high rate of atresia in primordial follicles during in vivo growth and maturation, these follicles may be a valuable source for studies on the in vitro development of oocytes and eventual embryo production (Carroll et al., 1990; O Brien et al., 2003). Nevertheless, until recently, little was known about how primordial follicles are activated and stimulated to grow and develop. Moreover, it is known that in larger species, early follicular development follows a very lengthy and complex process (Gougeon, 1996). Therefore, an extended culture period may be required for preantral follicle development. However, few long-term in vitro culture studies have been able to achieve follicular activation (sheep: Muruvi et al., 2005; human: Sadeu et al., 2006; goat: Rossetto et al., 2009). This fact could be related to the use of simple culture media, without the serial addition of growth factors and/or gonadotropins that can meet the demands required by follicles during their different growth phases. Several substances are thought to regulate the process of follicular activation. Among these, kit ligand (KL), also called stem cell factor (SCF), is one of the first discovered growth factors with a recognized role in this process (Celestino et al., 2009). KL is also known for acting directly in the maintenance of female mouse fertility, avoiding abnormalities in oogenesis and folliculogenesis (Driancourt et al., 2000). In follicles, KL mrna expression has been detected in the granulosa cells of different species (rat: Ismail et al., 1996; sheep: Tisdall et al., 1999; human: Carlsson et al., 2006; goat: Silva et al., 2006, Celestino et al., 2010), whereas its receptor (c-kit) has been identified in oocytes at all stages of follicular development as well as in the interstitial and theca cells of antral follicles (Motro and Bernstein, 1993; Clark et al., 1996; Silva et al., 2006). Numerous studies have shown that the interaction between KL and c-kit is important for several ovarian processes, including primordial follicle activation (Celestino et al., 2010), oocyte growth and survival (Jin et al., 2005), granulosa cell proliferation (Otsuka and Shimasaki, 2002), theca cell recruitment and ovarian steroidogenesis regulation (Hutt et al., 2006a). Moreover, a recent in vitro study using 50 ng/ml KL for seven days demonstrated that KL is able to maintain the ultrastructural integrity of caprine preantral follicles (Celestino et al., 2010).
108 108 Other substances commonly used for the in vitro culture of preantral follicles are the gonadotropins, such as follicle stimulating hormone (FSH). FSH acts by binding to its receptor expressed in granulosa cells (O Shaughnessy et al., 1996; Ulloa-Aguirre et al., 2003) from the primary follicle stage onward (Oktay et al., 1997). Although FSH receptors are not present at the primordial stage, it does not exclude the possibility that FSH has an indirect effect on the very early follicle development. This indirect effect may be performed via paracrine factors released by larger follicles or ovarian stroma cells, such as insulin-like growth factor-i (IGF-I) and activin (van den Hurk and Zhao, 2005). In addition, FSH regulates the expression of KL and other growth factors in granulosa cells from murine preantral follicles (Joyce et al., 1999; Thomas et al., 2005), which are essential in follicle activation and growth. Several in vitro studies have verified that the addition of FSH to the culture medium promotes the maintenance of preantral follicle viability and growth in goats (Matos et al., 2007; Magalhães et al., 2009) as well as antrum formation and steroidogenesis in different species (mouse: Cortvrindt et al., 1997, 1998; Spears et al., 1998; sheep: Cecconi et al., 1999; cattle: Gutierrez et al., 2000; human: Wu et al., 2002; pig: Wu and Tian, 2007). Despite the importance of KL and FSH revealed by the in vitro studies, there are no reports about the interaction of these substances during the culture of caprine preantral follicles for a long period. Therefore, the aim of this study was to investigate the effect of a dynamic medium containing KL and FSH on the survival, activation and in vitro growth of caprine preantral follicles during long-term culture. Materials and Methods Chemicals Unless mentioned otherwise, the culture media and other chemicals used in the present study were purchased from Sigma Chemical Co. (St Louis, MO, USA). Source of ovaries Ovarian cortical tissues (n=10 ovaries) were collected at a local slaughterhouse from five adult (1 to 3 years old), cross-breed goats (Capra hircus). Immediately postmortem, the
109 109 ovaries were washed in 70% alcohol for 10 seconds followed by two washes in minimum essential medium (MEM) supplemented with 100 µg/ml penicillin and 100 µg/ml streptomycin. The ovary pairs were transported within 1 hour to the laboratory in MEM at 4 C (Chaves et al., 2008). Experimental protocol The organ culture system utilized herein was previously described in detail (Matos et al. 2007; Celestino et al., 2010). In the laboratory, the ovaries from each animal were stripped of surrounding fat tissue and ligaments. Subsequently, ovarian cortex tissue samples from each ovarian pair were cut into 19 slices (approximate size: 3 x 3 mm, with 1 mm thickness) using a scalpel under sterile conditions. The tissue pieces were then either fixed for histological and ultrastructural analysis (fresh control) or placed in culture for 1, 8 or 16 days. Caprine tissues were transferred to 24-well culture dishes containing 1 ml of culture media. Culture was performed at 39 C in 5% CO 2 in a humidified incubator and all the media were incubated for 1 hour prior to use. The basic culture medium consisted of α-mem (ph 7.2 to 7.4) supplemented with ITS (10 µg/ml insulin, 5.5 µg/ml transferrin and 5 ng/ml selenium), 2 mm glutamine, 2 mm hypoxanthine, 1.25 mg/ml bovine serum albumin (BSA) and 50 µg/ml ascorbic acid, which was called α-mem + (culture control). For the experimental conditions, the medium was supplemented with recombinant human KL (50 ng/ml) (Cell Sciences, Canton, MA, USA), recombinant bovine FSH (50 ng/ml) (rfsh, Nanocore, Brazil) or KL and FSH in different combinations (Fig. 1). Each treatment was repeated five times and the culture media were replenished every other day. The concentrations of KL and FSH used in this work were chosen based on previous studies of our laboratory (Magalhães et al., 2009; Celestino et al., 2010), which demonstrated that 50 ng/ml of these substances maintained the ultrastructural integrity of caprine preantral follicles, promoted primordial follicle activation and further follicular growth during a seven-day culture period.
110 110 Fig. 1. Tested treatments according to supplementation of the medium for the in vitro culture of caprine ovarian tissues. Morphological analysis and assessment of in vitro follicular growth Before culture (fresh control) and after 1, 8 or 16 days in culture, all tissue pieces were fixed in Carnoy s solution for 12 hours and then dehydrated in increasing concentrations of ethanol. After paraffin embedding (Synth, São Paulo, Brazil), the caprine ovarian cortex tissues were cut into 7- m sections, which were mounted on glass slides and stained by Periodic Acid Schiff (PAS) - hematoxylin. Follicle stage and morphology were assessed microscopically on serial sections. Coded anonymized slides were examined by a microscope (Nikon, Tokyo, Japan) under 400x magnification. The developmental stages of follicles have been defined previously (Silva et al., 2004) as primordial (one layer of flattened granulosa cells around the oocyte) or growing follicles (intermediate: one layer of flattened and cuboidal granulosa cells; primary: one layer of cuboidal granulosa cells; and secondary: two or more layers of cuboidal granulosa cells around the oocyte). Only the preantral follicles (primordial, intermediate, primary and secondary) were considered in the analysis, and the antral stage was not included because of the very small number of antral follicles present in the ovarian fragments. The preantral
111 111 follicles were also classified individually as histologically normal when an intact oocyte was present, surrounded by granulosa cells that were well organized in one or more layers and lacked a pyknotic nucleus. Degenerated follicles were defined as those with a retracted oocyte, pyknotic nucleus, and/or disorganized granulosa cells detached from the basement membrane. Overall, 150 follicles were evaluated for each treatment (30 follicles per treatment in one repetition x five repetitions = 150 follicles). To evaluate follicular activation, the percentages of healthy primordial and growing follicles were calculated before (fresh control) and after culture in each medium. In addition, follicle and oocyte diameters were measured in healthy follicles only. Follicle diameter was recorded from edge to edge of the outer layer of granulosa cells or from the outside edge of the theca cell layer when present. Oocyte diameter was recorded from edge to edge of the oocyte membrane. Two perpendicular diameters were recorded in each measurement and the average of these two values was calculated. Each follicle was examined in every section in which it appeared and matched with the same follicle on adjacent sections to avoid double counting, thus ensuring that each follicle was only counted once. Ultrastructural analysis of caprine preantral follicles To better evaluate follicular morphology, ultrastructural analysis was performed on preantral follicles from non-cultured tissue (fresh control), follicles cultured in α-mem + alone as well as on the follicles cultured in the treatments that had the best results for morphology, activation, and growth. Briefly, small pieces (1 mm 3 ) of caprine ovarian tissues were fixed for 4 hours at room temperature in karnovsky fixative (2.5% glutaraldehyde and 4% formaldehyde in 0.1 M cacodylate buffer, ph 7.2). After fixation, the samples were washed twice in 0.1 M cacodylate buffer, post-fixed in 1% osmium tetroxide, 2 mm CaCl 2 and 0.8% potassium ferricyanide in 0.1 M cacodylate buffer, dehydrated in acetone, and embedded in Spin-pon resin (Sigma, St. Louis, MO, USA). Afterwards, semi-thin sections (3 µm) were cut using an ultramicrotome (Reichert-Jung Ultra-cut , Leica Microsystems, Wetzlar, Germany), stained with toluidine blue and analyzed by light microscopy under 400x magnification. Ultra-thin sections (60 to 70 nm) were obtained from preantral follicles classified as morphologically normal in semi-thin sections, according to the criteria adopted for histological analysis. Subsequently, ultra-thin sections were contrasted with uranyl acetate and lead citrate, and examined under a transmission electron microscope (Morgani-FEI,
112 112 Oregon, USA) operating at 80 Kv (Donato et al., 2009). Parameters such as the density and integrity of ooplasmic and granulosa cell organelles, vacuolization and integrity of the basement membrane were evaluated. Assessment of preantral follicle viability by fluorescence microscopy To confirm the results of the morphological and ultrastructural analyses, the viability of follicles from fresh control, follicles cultured in α-mem + alone and cultured in the treatments that provided the best outcome was further analyzed using a more accurate method of assessment based on fluorescent probes. Additional pairs of goat ovaries (n = 4) were cut into fragments, one of which was immediately processed for follicle isolation. Goat preantral follicles were isolated from the ovarian fragments using the mechanical method described by Lucci et al. (1999). Briefly, using a tissue chopper (The Mickle Laboratory Engineering Co., Gomshal, Surrey, UK) adjusted for a sectioning interval of 75 µm, samples were cut into small pieces, placed in MEM, resuspended 40 times using a large Pasteur pipette (approximate diameter of 1600 μm) and resuspended again 40 times with a smaller Pasteur pipette (approximate diameter of 600 µm) in order to dissociate preantral follicles from stroma. The material obtained was passed through 100-μm nylon mesh filters, resulting in a suspension containing preantral follicles of less than 100 μm in diameter. This procedure was carried out at room temperature within a 10-min time frame. Preantral follicles were analyzed using a two-color fluorescence cell viability assay based on the simultaneous detection of live and dead cells with calcein-am and ethidium homodimer-1, respectively. While the first probe detects intracellular esterase activity in viable cells, the latter labels nucleic acids in non-viable cells with disrupted plasma membranes. The test was performed by adding 4 μm calcein-am and 2 μm ethidium homodimer-1 (Molecular Probes, Invitrogen, Karlsruhe, Germany) to a suspension of isolated follicles, which were then incubated at 37 C for 15 minutes. After being labeled, the follicles were washed once by centrifugation at 100 g for 5 minutes and resuspension in MEM. The cells were then mounted on glass microscope slides in 5 μl of anti-fading medium (DABCO, Sigma, Deisenhofen, Germany) to prevent photobleaching, and examined using a fluorescence microscope (Nikon, Eclipse 80i, Tokyo, Japan). The emitted fluorescence signals of calcein-am and ethidium homodimer-1 were collected at 488 and 568 nm, respectively. Oocytes and granulosa cells were considered viable if their cytoplasm stained
113 113 positively with calcein-am (green) and their chromatin was not labeled with ethidium homodimer-1 (red). Statistical analysis Initially, all data were submitted to Shapiro-Wilk and Bartlett tests to confirm normal distribution and homoscedasticity, respectively. The percentages of morphologically normal preantral follicles and different follicular classes (primordial and growing follicles) were then submitted to analysis of variance (ANOVA) using the GLM procedure of SAS (1999), followed by the Student-Newman-Keuls test for a comparison of the means. Follicles and oocytes diameters did not show homogeneity of variance, even after transformation, and were analyzed by Kruskal-Wallis non-parametric test. Data of follicular viability assessed through fluorescence microscopy were analyzed as dispersion of frequencies using the chi square test. Differences among groups were considered to be significant when p<0.05 and results were expressed as the mean ± standard error of means (SEM). Results Caprine preantral follicle survival before and after in vitro culture A total of 2,850 preantral follicles were analyzed by classical histology. Figures 2a and b shows normal follicles from the fresh control and after culture in α-mem + supplemented only with KL (KL/KL), while Figure 2c and d illustrates degenerated follicles after culture in α-mem + alone or in the FSH+KL/FSH treatment, all after 16 days of culture. In the degenerated follicles, retracted oocytes, pyknotic nuclei and disorganized granulosa cells were observed. The percentage of morphologically normal preantral follicles in the fresh control and after 1, 8 or 16 days of in vitro culture is shown in Table 1. After 1 day of culture, there was a significant reduction (p<0.05) in the percentage of normal follicles in all treatments compared to the fresh control (92.67%), except when the culture was performed only with FSH (81.33%) or KL (82%) (p>0.05). In contrast, after 8 and 16 days of culture, all treatments significantly decreased the percentage of normal follicles in comparison to the fresh control (p<0.05). When the treatments were compared to α-mem + alone (38.33%), there was a higher
114 114 percentage of normal follicles after 16 days in all treatments performed with KL in the first half of the culture period, i.e. day 0 to day 8 (KL/KL: 64.17%; KL/FSH: 58%; KL/FSH+KL: 57.33%) and FSH for all the culture (FSH/FSH: 55.56%) (p<0.05). Moreover, after 16 days, the KL/KL treatment showed the highest percentage of normal follicles (64.17%). Nevertheless, no significant differences were observed among KL/KL, KL/FSH (58%), KL/FSH+KL (57.33%) and FSH/FSH (55.56%) (p>0.05), all of which showed higher percentages of normal follicles than those observed in the treatment cultured with FSH+KL until day 8 followed by FSH (FSH+KL/FSH: 32.5%) (p<0.05). With progression of the culture period from 1 to 8 days, a significant decrease (p<0.05) in the percentage of normal follicles was observed in all treatments. However, only the cultures performed with α-mem + alone and FSH+KL in the first half of the culture period (FSH+KL/FSH+KL, FSH+KL/FSH and FSH+KL/KL) showed a further decrease (p<0.05) in the percentage of normal follicles from day 8 to day 16 of culture. Fig. 2. Histological sections of normal preantral follicles from the fresh control ( a ) or tissue cultured for 16 days with KL (KL/KL) ( b ) and of degenerated preantral follicles cultured for 16 days in α-mem + alone ( c ) or in FSH+KL/FSH ( d ). n = Oocyte nucleus; gc = granulosa
115 115 cell; o = oocyte. Note the pyknotic nuclei (dark arrows), retracted oocytes (light arrows), and disorganized granulosa cells (dgc). Table 1. Percentages (mean ± SEM) of morphologically normal preantral follicles in noncultured tissues (fresh control) and tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH Groups initially cultured with the same substances (KL, FSH, or FSH+KL) have the same values on days 1 and 8. a c Differs significantly among treatments (except α-mem + ) on the same day of culture (p < 0.05). 1 Differs significantly from the fresh control (p < 0.05). 2 Differs significantly from α- MEM + alone on the same day of culture (p < 0.05). 3 Differs significantly from the values on day 1 (p < 0.05). 4 Differs significantly from the values on day 8 (p < 0.05). Activation of caprine primordial follicles after in vitro culture As early as after 1 day of culture, a reduction in the percentage of primordial follicles concomitant with a significant increase of growing follicles was observed in all treatments when compared to the fresh control (Table 2; p<0.05). Similar results were obtained after 1 and 8 days of culture in the follicles cultured with KL during the first half of the culture period (KL/KL, KL/FSH and KL/FSH+KL) (p<0.05) compared to α-mem + alone and the other treatments. After 16 days, except FSH/FSH+KL, FSH+KL/FSH and FSH+KL/KL, all other treatments promoted higher proportions of growing follicles compared to α-mem + alone (p<0.05). In addition, in the same period, the KL/KL and KL/FSH treatments showed the highest percentages of growing follicles, resulting in 67.44% and 75.86% of primary follicles,
116 116 respectively (data not shown). Nevertheless, no significant differences were observed among these treatments and KL/FSH+KL, FSH/FSH, FSH/KL and FSH+KL/FSH+KL (p>0.05). With progression of the culture period from 8 to 16 days, there was a significant decrease in the percentage of primordial follicles concomitant with an increase in growing follicles for FSH/FSH, KL/FSH and FSH+KL/FSH+KL treatments (p<0.05). From day 1 to day 16, similar results were verified in all treatments (p<0.05), except in α-mem + alone (p>0.05). Table 2. Percentages (mean ± SEM) of primordial and growing follicles in noncultured tissues (fresh control) and tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH Groups initially cultured with the same substances (KL, FSH, or FSH+KL) have the same values on days 1 and 8. a c Differs significantly among treatments (except α-mem + ) on the same day of culture (p < 0.05). 1 Differs significantly from the fresh control (p < 0.05). 2 Differs significantly from α- MEM + alone on the same day of culture (p < 0.05). 3 Differs significantly from the values on day 1 (p < 0.05). 4 Differs significantly from the values on day 8 (p < 0.05). In vitro growth of caprine preantral follicles According to Table 3, as early as after 1 day of culture, there was an increase in follicular diameter in all treatments compared to the fresh control (p<0.05), except in α- MEM + alone (p>0.05). Moreover, after 1, 8 and 16 days of culture, the follicular diameter significantly increased in all treatments in comparison to α-mem + alone (p<0.05). When the
117 117 treatments were compared to each other for the same culture period, on days 1 and 8, follicles cultured with KL or FSH+KL during the first half of culture had a larger follicular diameter than did those initially cultured with FSH only (p<0.05). After 16 days, the treatment performed with KL until day 8 followed by FSH (KL/FSH) significantly increased the follicular diameter when compared to the other treatments (p<0.05). From day 1 to day 16 of culture all treatments, except FSH+KL/KL (p>0.05), caused a significant increase in follicular diameter (p<0.05). Nevertheless, from day 8 to day 16 of culture, only FSH/FSH, FSH/KL, KL/FSH, and α-mem + promoted a significant increase in follicular diameter (p<0.05). After 1 and 8 days of culture, there was an increase in oocyte diameter in all treatments, except α-mem + alone (Table 4; p>0.05), compared to the fresh control (p<0.05). On the same days, the treatments performed with KL significantly increased the oocyte diameter in comparison to α-mem + alone (p<0.05). After 16 days, similar results were observed in KL/KL and KL/FSH treatments (p<0.05). When comparisons were made among all treatments at the end of culture, KL/FSH showed the largest oocyte diameter. However, no significant differences were observed among this treatment and the other groups cultured initially with KL (KL/KL, KL/FSH+KL) and the group cultured with FSH only (FSH/FSH) (p>0.05). As the culture period progressed from 1 to 8 days, there was a significant increase in oocyte diameter in the culture performed with KL only (p<0.05). In addition, when the follicles were cultured in KL/KL, KL/FSH and FSH/FSH, oocyte diameter further increased throughout the culture (from day 1 to day 16) (p<0.05).
118 118 Table 3. Follicle diameters (mean ± SEM) in noncultured tissues (control) and in tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH Groups initially cultured with the same substances (KL, FSH, or FSH+KL) have the same values on days 1 and 8. a e Differs significantly among treatments (except α-mem + ) on the same day of culture (p < 0.05). 1 Differs significantly from the fresh control (p < 0.05). 2 Differs significantly from α- MEM + alone on the same day of culture (p < 0.05). 3 Differs significantly from the values on day 1 (p < 0.05). 4 Differs significantly from the values on day 8 (p < 0.05). Table 4. Oocyte diameters (mean ± SEM) in noncultured tissues (fresh control) and tissues cultured for 1, 8, or 16 days in α-mem + alone or α-mem + containing KL and/or FSH Groups initially cultured with the same substances (KL, FSH, or FSH+KL) have the same values on days 1 and 8. a d Differs significantly among treatments (except α-mem + ) on the same day of culture (p < 0.05). 1 Differs significantly from the fresh control (p < 0.05). 2 Differs significantly from α-
119 119 MEM + alone on the same day of culture (p < 0.05). 3 Differs significantly from the values on day 1 (p < 0.05). 4 Differs significantly from the values on day 8 (p < 0.05). Ultrastructural features of caprine preantral follicles To better evaluate follicular integrity, ultrastructural analysis was performed in preantral follicles from fresh control, follicles cultured for 16 days in α-mem + (cultured control), and follicles cultured in the KL/FSH treatment. This treatment was chosen for ultrastructural analysis because it showed satisfactory results in all parameters evaluated by the histological analysis and yielded the best results for follicular growth. The ultrastructural features of follicles evaluated in the fresh control or cultured for 16 days in the KL/FSH treatment were normal and showed preserved oocytes, and intact plasma and nuclear membranes as well as large oocyte nuclei (Fig. 3a,b, respectively). In addition, the organelles, especially mitochondria and endoplasmic reticulum, were uniformly distributed in the ooplasm. Granulosa cells were ultrastructurally normal and well organized around the oocytes, showing elongated and large nuclei with irregular membranes and a high proportion of nuclei-to-cytoplasm. In contrast, the follicles cultured in α-mem + (cultured control) showed signs of degeneration, such as high levels of cytoplasmic vacuolization, absence of basement membrane integrity and disorganized granulosa cells (Fig. 3c). Fig. 3. Electron micrographs of follicles before and after 16 days of culture. Normal preantral follicle from noncultured ovarian tissue (fresh control) ( a ). Normal preantral follicle after in vitro culture in the KL/FSH treatment ( b ). Degenerated follicle after in vitro culture in α- MEM + alone ( c ). o = Oocyte; n = oocyte nucleus; nu = nucleolus; gc = granulosa cell; er = endoplasmic reticulum; m = mitochondria; v = vacuole.
120 120 Assessment of preantral follicle viability In this study, 90 caprine preantral follicles were analyzed by fluorescence microscopy before (fresh control) and after 16 days of culture in α-mem + alone (cultured control) and in the KL/FSH treatment. Figures 4a and b shows follicles from the fresh control and after culture in KL/FSH stained with calcein-am (green fluorescence), while Figure 4c illustrates a follicle stained with ethidium homodimer-1 (red fluorescence) after culture in α-mem + alone. Based on a quantitative analysis, it was verified that follicles cultured in KL/FSH had a high percentage of follicle viability, similar to that of the fresh control (80.0% vs. 90.0%, respectively) (p>0.05). However, follicles cultured in the absence of KL and FSH (only in α- MEM + ) showed a reduced percentage of viability (63.3%) compared to the fresh control (p<0.05). Fig. 4. Viability assessment of caprine preantral follicles using fluorescent probes. Viable preantral follicles from noncultured ovarian tissue (fresh control) ( a ) and after in vitro culture in the KL/FSH treatment ( b ), both labeled with calcein-am (green fluorescence). Nonviable preantral follicle cultured in α-mem + alone ( c ) labeled with ethidium homodimer-1 (red fluorescence). Discussion The present study demonstrated for the first time the positive effects of a dynamic medium containing KL and FSH on the survival, activation and growth of caprine preantral follicles during long-term in vitro culture. This finding proved that for greater efficiency of the in vitro culture of goat preantral follicles, it is necessary to change the composition of the medium to meet the specifics needs of the different follicular stages. In this study, a high
121 121 percentage of normal follicles was verified in the groups treated with KL in the first half of culture or with FSH during the entire culture period. KL is known to be responsible for promoting the survival of different cell types involved in the processes of hematopoiesis, melanogenesis and gametogenesis, including primordial germ cells (PGC) and oogonia (Reynaud and Driancourt, 2000; Reynaud et al., 2001). Moreover, KL is also involved in oocyte and preantral follicle survival (mouse: Reynaud et al., 2000; rat: Jin et al., 2005). In mice, KL inhibited the apoptosis of oocytes from primordial follicles after in vitro culture (Jin et al., 2005) through an increase in the expression of the anti-apoptotic proteins Bcl-2 and Bcl-xL and a reduction in the expression of the pro-apoptotic factor Bax. Other authors have also demonstrated that inhibition of the KL/c-kit interaction increased the proportion of atretic follicles at days 7 and 14 of culture in humans (Carlsson et al., 2006) and promoted oocyte death in mouse (Reynaud et al., 2000; Doneda et al., 2002; Moniruzzaman et al., 2007). In our study, KL addition until day 8 of culture was important for maintaining follicle and oocyte growth regardless of the substance tested from days 8 to 16 of culture. This finding demonstrated that the role of KL in follicular viability is essential during the very early follicular development in goats, but could be less necessary in more advanced follicular stages. With respect to FSH, many studies have reported that this hormone is very effective in maintaining follicle viability (Saha et al., 2000; Matos et al., 2007; Magalhães et al., 2009). Indeed, FSH is known to inhibit apoptosis in preantral follicles cultured in vitro in different species (mouse: Baker and Spears, 1997; rat: McGee et al., 1997; human: Whright et al., 1999; pig: Mao et al., 2002). In mice, the omission of FSH from the culture medium resulted in follicular cell death and reduction in granulosa cell vitality (Cortvrindt et al., 1997). In the present study, the supplementation with FSH throughout the culture maintained the follicular survival, which demonstrates that FSH is able to act in the different follicle stages, promoting survival in the initial preantral phase as well as in growing follicles. Although not identified the presence of FSH receptors in primordial follicles, its action during the initial preantral phase may occur indirectly via factors released by larger follicles or ovarian stroma cells (van den Hurk and Zhao, 2005). After 1 and 8 days of culture, only the treatments initially performed with KL increased the percentage of follicular activation. Similar to our results, many studies have shown that KL promotes primordial follicle activation in vitro. Yoshida et al. (1997) demonstrated that blockade of c-kit using a monoclonal antibody affects primordial follicle
122 122 development. Furthermore, Parrott and Skinner (1999) verified that KL (100 ng/ml) increased the transition from primordial to primary follicles in rats after five days of culture. Similarly, in goat preantral follicles, different concentrations of KL (1, 10, 50, 100 or 200 ng/ml) promoted follicular activation as early as after one day of in vitro culture (Celestino et al., 2010). Nevertheless, in humans, KL did not have an effect on preantral follicle development after seven days of culture (Carlsson et al., 2006), indicating that the roles of KL differ between species. In the present study, after 8 days of culture the presence of KL in vitro as well as its replacement by FSH plus KL or FSH alone maintained (KL/KL and KL/FSH+KL) or significantly increased (KL/FSH) the percentage of follicular activation until day 16. Although some studies have suggested that follicular activation is a FSH-independent process (Silva et al., 2004; Kreeger et al., 2005), gonadotropins can promote in vitro early follicular development in sheep (Andrade et al., 2005) and goats (Magalhães et al., 2009). In addition, FSH was shown to regulate the expression of several growth factors, such as kit ligand, growth and differentiation factor-9 and bone morphogenetic protein-15, which have important roles in the activation of primordial follicles and further follicular growth (Joyce et al., 1999; Thomas et al., 2005). The expression evaluation of some growth factors during the culture is a useful tool to better understand the in vitro folliculogenesis and also how the expression patterns change in response to the addition of exogenous substances (in this case, KL and FSH). However, in our work an expression study was considered unfeasible due to the differences among the ovarian fragments regarding the number of enclosed follicles. These differences would make difficult the interpretation of the results (with possible mistakes during the evaluation) since the growth factors and as well as their receptors are mostly synthesized in the ovarian follicles. Although this evaluation has not been performed, according to our results of follicle culture, it is likely that the in vitro addition of KL or FSH only has increased or at least maintained at great levels the endogenous expression of KL (ligand and receptor) and FSH (receptor), causing significant and positive effects on follicular development. In relation to growth, large follicle and oocyte diameters were observed in the treatment performed with KL until day 8 followed by FSH (KL/FSH). In early follicular stages, it has been suggested that KL synthesized by granulosa cells binds to c-kit present in the oocyte, thereby promoting oocyte growth (Packer et al., 1994). Hutt et al. (2006b) working with mouse and rabbit preantral follicles demonstrated that 50 and 150 ng/ml KL promoted oocyte growth after 8 days of in vitro culture. Moreover, Klinger and De Felici
123 123 (2002) reported a significant increase in mouse oocyte diameter after four days of culture in the presence of 50 or 100 ng/ml KL. In contrast, other works did not observe any effect of KL on oocyte growth (mouse: Cecconi and Colonna, 1996; Reynaud et al., 2000; pig: Moniruzzaman and Miyano, 2007), suggesting that this factor may have different actions at each stage of oocyte development or under different culture conditions. In addition, some studies verified the role of KL in granulosa cell proliferation (Reynaud et al., 2000; Otsuka and Shimasaki, 2002) and theca cell growth (Parrott and Skinner, 1997, 2000; Huang et al., 2001). In this study, it was demonstrated the importance of a dynamic medium containing KL in the beginning of culture and FSH in the final culture period for an increase in preantral follicle growth. Indeed, it has been observed that paracrine factors such as KL regulate the activation and growth during early preantral stages, whereas FSH, although able to act on initial follicles, essentially controls the events involving growing preantral follicles (Fortune, 2003; van den Hurk and Zhao, 2005). According to some studies, FSH binds to its receptor expressed in granulosa cells from the primary stage onward (O Shaughnessy et al., 1996; Ulloa-Aguirre et al., 2003) and plays a crucial action in the stimulation of both follicle growth and differentiation (McNeilly et al., 1992; Campbell et al., 1998). Furthermore, FSH is able to regulate the transzonal connections between the oocyte and surrounding granulosa cells, which contributes to the exchange of important compounds for follicular growth (Albertini et al., 2001). In our study, individual effects of KL and FSH at specific times of culture were observed on goat preantral follicles. However, not as expected, the in vitro culture with their association (KL+FSH) did not promote an enhanced effect when compared to their individual effects. We believe that to obtain beneficial results from their association, the use of other combinations of concentrations of both substances is necessary. Furthermore, it is possible that the stimulatory effect provided by individual use of the tested substances (KL and FSH) reached the optimal level, not resulting in an additional follicular response, when they were used in combination. Our results in relation to follicular viability based on classical histology were confirmed by ultrastructural analysis. This method is considered an important tool to detect damage to cellular membranes and organelles that are not visible by light microscopy, providing more accurate information about the quality of follicles and oocytes (Lucci et al., 2001). In the present study, preantral follicles from the fresh control and those cultured in the KL/FSH treatment for 16 days showed intact oocytes and granulosa cells, which contained
124 124 important structures preserved, such as mitochondria, endoplasmic reticulum, basement, plasma and nuclear membranes, proving to be ultrastructurally normal. In addition to the ultrastructural analysis, preantral follicles were further analyzed using a more accurate method based on fluorescent probes. The fluorescent probes calcein-am and ethidium homodimer-1 have been successfully used to assess the viability of bovine (Schotanus et al., 1997) and caprine (Bruno et al., 2009; Silva et al., 2010) preantral follicles. In the current study, the results of this assay were similar to those obtained by ultrastructural analysis, precisely confirming our results for follicular survival. In conclusion, the present study provides the first evidence that the association between KL and FSH in a dynamic medium plays an important role in the early folliculogenesis in goats by maintaining follicular survival and promoting the activation of primordial follicles and their subsequent growth during long-term culture. The dynamic culture system used in our work may be very useful to study the role of other substances, particularly hormones and growth factors, in the development of early follicles in vitro aiming to better understand the folliculogenesis process. Acknowledgments This work was supported by the National Council for Scientific and Technological Development (CNPq, Brazil, grant number: / RENORBIO), the Coordination for the Improvement of Higher Education Personnel (CAPES) and the Brazilian Innovation Agency (FINEP). Isadora Machado Teixeira Lima is a recipient of a grant from CAPES. The authors thank Patrícia Magalhães de Andrade for her technical support in histology. References Albertini, D.F., C.M. Combelles, E. Benecchi, M.J. Carabatsos (2001) Cellular basis for paracrine regulation of ovarian follicle development. Reproduction 121: Andrade, E.R, M.M. Seneda, A.A. Alfieri, J.A. Oliveira, A.P.F.R.L. Bracarense, J.R. Figueiredo, R. Toniolli (2005) Interactions of indole acetic acid with EGF and FSH in the culture of ovine preantral follicles. Theriogenology 64: Baker, S.J., N. Spears (1997) Follicle stimulating hormone inhibits apoptosis in pre- and early-antral murine follicles in vitro. J Reprod Fertil 40:
125 125 Bruno, J.B., J.J.H. Celestino, I.B. Lima-Verde, L.F. Lima, M.H.T. Matos, V.R. Araújo, M.V.A. Saraiva, F.S. Martins, K.P.O. Name, C.C. Campello, S.N. Báo, J.R. Silva, J.R. Figueiredo (2009) Expression of vascular endothelial growth factor (VEGF) receptor in goat ovaries and improvement of in vitro caprine preantral follicle survival and growth with VEGF. Reprod Fertil Dev 21: Campbell, B., H. Dobson, R. Scaramuzzi (1998) Ovarian function in ewes made hypogonadal with GnRH antagonist and stimulated with FSH in the presence or absence of low amplitude LH pulses. J Endocrinol 156: Carlsson, I.B., M.P.E Laitinen, J.E. Scott, H. Louhio, L. Velentzis, T. Tuuri, J. Aaltonen, O. Ritvos, R.M.L. Winston, O. Hovatta (2006) Kit ligand and c-kit are expressed during early human ovarian follicular development and their interaction is required for the survival of follicles in long-term culture. Reproduction 131: Carroll, J., D.G. Whittingham, M.J. Wood, E. Telfer, R.G. Gosden (1990) Extraovarian production of mature viable mouse oocytes from frozen primary follicles. J Reprod Fertil 90: Cecconi, S., B. Barboni, M. Coccia, M. Mattioli (1999) In vitro development of sheep preantral follicles. Biol Reprod 60: Cecconi, S., R. Colonna (1996) Influence of granulosa cells and of different somatic cell types on mammalian oocyte development in vitro. Zygote, 4: Celestino, J.J.H., J.B. Bruno, I.B. Lima-Verde, M.H.T. Matos, M.V.A. Saraiva, R.N. Chaves, F.S. Martins, A.P. Almeida, R.M.S. Cunha, L.F. Lima, K.O. Name, C.C. Campello, J.R.V. Silva, S.N. Báo, J.R. Figueiredo (2010) Steady-state level of kit ligand mrna in goat ovaries and the role of kit ligand in preantral follicle survival and growth in vitro. Mol Reprod Dev 77: Celestino, J.J.H., M.H.T. Matos, M.V.A. Saraiva, J.R. Figueiredo (2009) Regulation of ovarian folliculogenesis by Kit Ligand and the c-kit system in mammals. Anim Reprod 6: Chaves, R.N., F.S. Martins, M.V. Saraiva, J.J. Celestino, C.A. Lopes, J.C. Correia, I.B. Verde, M.H. Matos, S.N. Báo, K.P. Name, C.C. Campello, J.R.V. Silva, J.R. Figueiredo (2008) Chilling ovarian fragments during transportation improves viability and growth of goat preantral follicles cultured in vitro. Reprod Fertil Dev 20:
126 126 Clark, D.E., D.J. Tisdall, A.E. Fidler, K.P. McNatty (1996) Localization of mrna encoding c-kit during the initiation of folliculogenesis in ovine fetal ovaries. J Reprod Fertil 106: Cortvrindt, R.; Y. Hu, J. Smitz (1998) Recombinant luteinizing hormone as a survival and differentiation factor increases oocyte maturation in recombinant follicle stimulating hormone-supplemented mouse preantral follicle culture. Hum Reprod 13: Cortvrindt, R., J. Smitz, A.C. Van Steirteghem (1997) Assessment of the need for follicle stimulating hormone in early preantral mouse follicle culture in vitro. Hum Reprod 12: Donato, M.A.M., K.L.A. Saraiva, A.K.S. Silva, M.I. Wanderley, C.A. Peixoto (2009) Follicle development and luteal cell morphology altered by phosphodiesterase-5 inhibitor. Micron 40: Doneda, L., F.G. Klinger, L. Larizza, M. De Felici (2002) KL/KIT coexpression in mouse fetal oocytes. Int J Dev Biol 46: Driancourt, M., K. Reynaud, R. Cortvrindt, J. Smitz (2000) Roles of KIT and KIT LIGAND in ovarian function. Rev Reprod 5: Fortune, J.E. (2003) The early stages of follicular development: activation of primordial follicles and growth of preantral follicles. Anim Reprod Sci 78: Gougeon, A. (1996) Regulation of ovarian follicular development in primates: facts and hypotheses. Endocr Rev 17: Gutierrez, C.G., J.H. Ralph, E.E. Telfer, I. Wilmut, R. Webb (2000) Growth and antrum formation of bovine preantral follicles in long-term culture in vitro. Biol Reprod 62: Huang, C.T., S.R. Weitsman, B.N. Dykes, D.A. Magoffin (2001) Stem cell factor and insulinlike growth factor-i stimulate luteinizing hormone-independent differentiation of rat ovarian theca cells. Biol Reprod 64: Hutt, K., E.A. McLaughlin, M.K. Holland (2006a) KL and KIT have diverse roles during mammalian oogenesis. Mol Hum Reprod 12: Hutt, K.J., E.A. Mclaughlin, M.K. Holland (2006b) KIT/KIT Ligand in mammalian oogenesis and folliculogenesis: roles in rabbit and murine ovarian follicle activation and oocyte growth. Biol Reprod 75:
127 127 Ismail, R.S., Y. Okawara, J.N. Fryer, B.C. Vanderhyden (1996) Hormonal regulation of the ligand for c-kit in the rat ovary and its effects on spontaneous oocyte meiotic maturation. Mol Reprod Dev 43: Jin, X., C.S. Han, F.Q. Yu, P. Wei, Z.Y. Hu, Y.X. Liu (2005) Anti-apoptotic action of stem cell factor on oocytes in primordial follicles and its signal transduction. Mol Reprod Dev 70: Joyce, I.M., F.L. Pendola, K. Wigglesworth, J.J. Eppig (1999) Oocyte regulation of kit ligand expression in mouse ovarian follicles. Dev Biol 214: Klinger, F.G., M. De Felici (2002) In vitro development of growing oocytes from fetal mouse oocytes: stage-specific regulation by stem cell factor and granulosa cells. Dev Biol 244: Kreeger, P.K., N.N. Fernandes, T.K. Woodruff, L.D. Shea (2005) Regulation of mouse follicle development by follicle-stimulating hormone in a three-dimensional in vitro culture system is dependent on follicle stage and dose. Biol Reprod 73: Lucci, C.M., C.A. Amorim, S.N. Báo, J.R. Figueiredo, A.P.R. Rodrigues, J.R. Silva, P.B.D. Gonçalves (1999) Effect of the interval of serial sections of ovarian in the tissue chopper on the number of isolated caprine preantral follicles. Anim Reprod Sci 56: Lucci, C.M., R.V. Silva, C.A. Carvalho, J.R. Figueiredo, S.N. Báo (2001) Light microscopical and ultrastrutural characterization of goat preantral follicles. Small Rumin Res 41: Magalhães, D.M., V.R. Araújo, I.B. Lima-Verde, M.H.T. Matos, R.C. Silva, C.M. Lucci, S.N. Báo, C.C. Campello, J.R. Figueiredo (2009) Different Follicle-Stimulating Hormone (FSH) sources influence caprine preantral follicle viability and development in vitro. Braz J Vet Res Anim Sci 46: Mao, J., G. Wu, M.F. Smith, T.C. McCauley, T.C. Cantley, R.S. Prather, B.A. Didion, B.N. Day (2002) Effects of culture medium, serum type, and various concentrations of folliclestimulating hormone on porcine preantral follicular development and antrum formation in vitro. Biol Reprod 67: Matos, M.H.T., I.B. Lima-Verde, M.C.A. Luque, J.E. Maia, J.R.V. Silva, J.J.H. Celestino, F.S. Martins, S.N. Bao, C.M. Lucci, J.R. Figueiredo (2007) Essential role of follicle stimulating hormone in the maintenance of caprine preantral follicle viability in vitro. Zygote 15:
128 128 McGee, E., N. Spears, S. Minami, S.Y. Hsu, S.Y. Chun, H. Billig, A.J. Hsueh (1997) Preantral ovarian follicles in serum-free culture: suppression of apoptosis after activation of the cyclic guanosine 3-5-monophosphate pathway and stimulation of growth and differentiation by follicle-stimulating hormone. Endocrinology 138: McNeilly, A., W. Crow, J. Brooks, G. Evans (1992) Luteinizing-hormone pulses, folliclestimulating hormone and control of follicle selection in sheep. J Reprod Fertil Suppl 45: Moniruzzaman, M., K. Sakamaki, Y. Akazawa, T. Miyano (2007) Oocyte growth and follicular development in KIT-deficient Fas-Knockout mice. Reproduction 133: Moniruzzaman, M.; T. Miyano (2007) KIT-KIT Ligand in the growth of porcine oocytes in primordial follicles. J Reprod Dev 53: Motro, B., A. Bernstein (1993) Dynamic changes in ovarian c-kit and steel expression during the estrous reproductive cycle. Dev Dyn 197: Muruvi, W., H.M. Picton, R.G. Rodway, I.M. Joyce (2005) In vitro growth of oocytes from primordial follicles isolated from frozen-thawed lamb ovaries. Theriogenology 64: O Brien, M.J., J.K. Pendola, J.J. Eppig (2003) A revised protocol for in vitro development of mouse oocyte from primordial follicles dramatically improves their development competence. Biol Reprod 68: O Shaughnessy, P.J., K. Dudley, W.R. Rajapaksha (1996) Expression of follicle stimulating hormone receptor mrna during gonadal development. Mol Cell Endocrinol 125: Oktay, K., D. Briggs, R.G. Gosden (1997) Ontogeny of follicle-stimulating hormone receptor gene expression in isolated human ovarian follicles. J Clin Endocrinol Metab 82: Otsuka, F., S. Shimasaki (2002) A negative feedback system between oocyte bone morphogenetic protein 15 and granulosa cell kit ligand: its role in regulating granulose cell mitosis. Proc Natl Acad Sci USA 99: Packer, A.I., Y.C. Hsu, P. Besmer, R.F. Bachvarova (1994) The ligand of the c-kit receptor promotes oocyte growth. Dev Biol 161: Parrott, J.A., M.K. Skinner (1997) Direct actions of kit-ligand on theca cell growth and differentiation during follicle development. Endocrinology 138:
129 129 Parrott, J.A., M.K. Skinner (2000) Kit ligand actions on ovarian stromal cells: effects on theca cell recruitment and steroid production. Mol Reprod Dev 55: Parrott, J.A., M.K. Skinner (1999) Kit-ligand/stem cell factor induces primordial follicle development and initiates folliculogenesis. Endocrinology 140: Rossetto, R., I.B. Lima-Verde, M.H.T. Matos, M.V.A. Saraiva, F.S. Martins, L.R. Faustino, V.R. Araújo, C.M.G. Silva, K.P.O. Name, S.N. Báo, C.C. Campello, J.R. Figueiredo, H. Blume (2009) Interaction between ascorbic acid and follicle-stimulating hormone maintains follicular viability after long-term in vitro culture of caprine preantral follicles. Dom Anim Endocrinol 37: Reynaud, K., R. Cortvrindt, J. Smitz, F. Bernex, J.J. Panthier, M.A. Driancourt (2001) Alterations in ovarian function of mice with reduced amounts of KIT receptor. Reproduction, 121: Reynaud, K., R. Cortvrindt, J. Smitz, M.A. Driancourt (2000) Effects of Kit Ligand and anti- Kit antibody on growth of cultured mouse preantral follicles. Mol Reprod Dev 56: Reynaud, K., M.A. Driancourt (2000) Oocyte attrition. Mol Cell Endocrinol, 163: Sadeu, J.C., R. Cortvrindt, R. Ron-El, E. Kasterstein, J. Smitz (2006) Morphological and ultrastructural evaluation of cultured frozen thawed human fetal ovarian tissue. Fertil Steril 85: Saha, S., M. Shimizu, M. Geshi, Y. Izaike (2000) In vitro culture of bovine preantral follicles. Anim Reprod Sci 63: Schotanus K., W.J. Hage, H. Vanderstichele, R. Van Den Hurk (1997) Effects of conditioned media from murine granulose cell lines on the growth of isolated bovine preantral follicles. Theriogenology 48: Silva, C.M.G., M.H.T. Matos, G.Q. Rodrigues, L.R. Faustino, L.C. Pinto, R.N. Chaves, V.R. Araújo, C.C. Campello, J.R. Figueiredo (2010) In vitro survival and development of goat preantral follicles in two different oxygen tensions. Anim Reprod Sci 117: Silva, J.R.V., R. van den Hurk, M.H.T. Matos, R.R. Santos, C. Pessoa, M.O. Moraes, J.R. Figueiredo (2004) Influences of FSH and EGF on primordial follicles during in vitro culture of caprine ovarian cortical tissue. Theriogenology 61: Silva, J.R.V., R. van den Hurk, H.T.A. Van Tol, B.A.J. Roelen, J.R. Figueiredo (2006) The Kit ligand/c-kit receptor system in goat ovaries: gene expression and protein localization. Zygote 14:
130 130 Skinner, M.K. (2005) Regulation of primordial follicle assembly and development. Hum Reprod Update 11: Spears, N., A.A. Murray, V. Alisson, N.I. Boland, R.G. Gosden (1998) Role of gonadotrofins and ovarian steroids in the development of mouse follicles in vitro. J Reprod Fertil 113: Thomas, F.H., J.F. Ethier, S. Shimasaki, B.C. Vanderhyden (2005) Follicle stimulating hormone regulates oocyte growth by modulation of expression of oocyte and granulosa cell factors. Endocrinology 146: Tisdall, D.J., A.E. Fidler, P. Smith, L.D. Quirke, V.C. Stent, D.A. Heath, K.P. Mcnatty (1999) Stem cell factor and c-kit gene expression and protein localization in the sheep ovary during fetal development. J Reprod Fertil 116: Ulloa-Aguirre, A., C. Timossi, J. Barrios-de-Tomasi, A. Maldonado, P. Nayudu (2003) Impact of carbohydrate heterogeneity in function of FSH: studies derived from in vitro and in vivo models. Biol Reprod 69: Van den Hurk, R., J. Zhao (2005) Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles. Theriogenology 63: Wright, C.S., O. Hovatta, R. Margara, G. Trew, R.M.L. Winston, S. Franks, K. Hardy (1999) Effects of follicle-stimulating hormone and serum substitution on the in-vitro growth of human ovarian follicles. Hum Reprod 14: Wu, J., Y. Chen, T. Li (2002) Expression of Fas, p53 and AFP in development of human fetal germ cells in vitro. Zygote 10: Wu, J., Q. Tian (2007) Role of follicle stimulating hormone and epidermal growth factor in the development of porcine preantral follicle in vitro. Zygote 15: Yoshida, H., N. Takakura, H. Nataoka, T. Kunisada, H. Okamura, S.I. Nishikawa (1997) Stepwise requirement of c-kit tyrosine kinase in mouse ovarian follicle development. Dev Biol 184:
131 131 8 CAPÍTULO 3 Presença de RNAm para c-kit em ovários caprinos e melhoria da sobrevivência e desenvolvimento in vitro de folículos pré-antrais com kit ligand (Presence of c-kit mrna in goat ovaries and improvement of in vitro preantral follicle survival and development with kit ligand) Periódico: Molecular and Cellular Endocrinology, v. 345, p , 2011.
132 132 Resumo Esse estudo avaliou os níveis de RNAm para c-kit em folículos caprinos e os efeitos do kit ligand (KL) sobre o desenvolvimento in vitro de folículos pré-antrais cutivados. Folículos pré-antrais isolados do córtex ovariano de cabras foram cultivados por 18 dias em α-mem + suplementado com KL (0, 50 ou 100 ng/ml) na ausência ou presença de hormônio folículo estimulante (FSH). A PCR em tempo real mostrou que o RNAm para c-kit foi maior em folículos primordiais e primários em relação ao estágio secundário. No que diz respeito ao cultivo, a adição de KL na ausência de FSH melhorou a sobrevivência folicular, a formação de antro, o crescimento oocitário e a retomada da meiose. Efeitos positivos do KL não foram observados na presença de FSH. Em conclusão, os RNAm para c-kit são detectados em todas as categorias foliculares. O KL promove a sobrevivência e a formação de cavidade antral em folículos pré-antrais caprinos após o cultivo in vitro, bem como o crescimento e a retomada da meiose de seus oócitos na ausência de FSH. Palavras-chave: RNAm para c-kit. KL. Cultivo in vitro. Caprinos. Ovário.
133 133 Presence of c-kit mrna in goat ovaries and improvement of in vitro preantral follicle survival and development with kit ligand I.M.T. Lima a *, I.R. Brito a, G.Q. Rodrigues a, C.M.G. Silva a, D.M. Magalhães-Padilha a, L.F. Lima a, J.J.H. Celestino a, C.C. Campello a, J.R.V. Silva b, J.R. Figueiredo a, A.P.R. Rodrigues a a Faculty of Veterinary, Laboratory of Manipulation of Oocyte and Preantral Follicles (LAMOFOPA), State University of Ceará, Fortaleza, CE, Brazil b Biotechnology Nucleus of Sobral (NUBIS), Federal University of Ceará, Sobral, CE, Brazil *Corresponding address: Programa de Pós-Graduação em Ciências Veterinárias (PPGCV) Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais (LAMOFOPA) Universidade Estadual do Ceará (UECE) Av. Paranjana, 1700, Campus do Itaperi. Fortaleza CE Brasil. CEP: Tel.: ; Fax: address: dora.uece@gmail.com (Isadora Machado Teixeira Lima)
134 134 Abstract This study evaluated the levels of c-kit mrna in goat follicles and the effects of kit ligand (KL) on the in vitro development of cultured preantral follicles. Preantral follicles isolated from goat ovarian cortex were cultured for 18 days in α-mem + supplemented with KL (0, 50 or 100 ng/ml) in the absence or presence of follicle stimulating hormone (FSH). Real-time PCR showed that c-kit mrna was higher in primordial and primary follicles than in secondary stage. Regarding the culture, KL addition in the absence of FSH improved the follicular survival, antrum formation, oocyte growth and meiotic resumption. KL-positive effects were not observed in the presence of FSH. In conclusion, c-kit mrnas are detected in all follicular categories. KL promotes the survival and antral cavity formation of caprine preantral follicles after in vitro culture, as well as the growth and meiotic resumption of their oocytes in the absence of FSH. Keywords: c-kit mrna; KL; In vitro culture; Caprine; Ovary.
135 Introduction Several assisted reproduction technologies (ART), including in vitro embryo production, nuclear transfer and transgenic animal production, depend on the availability of mature oocytes. However, current methods of obtaining mature oocytes have low success rates, mainly because they use antral follicles, which provide a restricted number of these structures. Thus, there is considerable interest in in vitro technologies that aim to produce fully-grown, developmentally competent oocytes from preantral follicles, as these follicles represent about 90% of the follicular population in the mammalian ovary and, therefore, are able to provide thousands of oocytes that can grow and mature after in vitro culture (Muruvi et al., 2005). Progress has occurred in the ability to culture preantral follicles in different species, resulting in antrum cavity formation in hamster (Roy and Greenwald, 1989), cattle (Gutierrez et al., 2000), woman (Roy and Treacy, 1993; Telfer et al., 2008) and bitch (Serafim et al., 2010), as well as the embryo production in pig (Wu et al., 2001), buffalo (Gupta et al., 2008), sheep (Arunakumari et al., 2010) and goats (Magalhães et al., 2011a). Nevertheless, among all species studied to date, the birth of live offspring from oocytes of cultured preantral follicles was achieved only in the mouse (Eppig and Schroeder, 1989; O Brien et al., 2003). Therefore, a great deal of effort is still required to improve the rate of embryo production and births from preantral follicles. The in vitro culture of preantral follicles is influenced by various substances, including hormones, peptides and growth factors. Among growth factors, kit ligand (KL), also known as stem cell factor, steel factor or mast cell growth factor, has demonstrated an essential role in follicular development, acting at different follicle stages (Celestino et al., 2009). In the ovary, the KL mrna expression has been detected in the granulosa cells of many species (human: Carlsson et al., 2006; rat: Ismail et al., 1996; goat: Silva et al., 2006, Celestino et al., 2010; sheep: Tisdall et al., 1999), and it can be expressed as either a membrane-bound (KL-1) or a soluble protein (KL-2) (Huang et al., 1992). Both KL isoforms influence target cells by binding to a tyrosine kinase receptor, c-kit. c-kit mrna and protein are expressed in oocytes at all stages of follicular development, as well as in the interstitial and theca cells of antral follicles in mice (Motro and Bernstein, 1993), sheep (Clark et al., 1996) and goats (Silva et al., 2006). However, in goats, quantification of the levels of c-kit mrna during different follicle stages has not been performed yet.
136 136 In vivo and in vitro studies have shown that the functions of the KL/c-kit system in the ovary include the establishment of primordial germ cells (PGC), primordial follicle activation, oocyte survival and growth, granulosa cell proliferation, theca cell recruitment and maintenance of meiotic competence (Hutt et al., 2006a; Thomas et al., 2008). In addition, some studies have reported that KL inhibits the expression of BMP-15 by the oocytes, increasing the expression of FSH receptors (Otsuka and Shimasaki, 2002; Thomas et al., 2005). FSH is known to regulate the KL expression in the granulosa cells in a biphasic manner, with a low concentration of FSH decreasing the ratio of KL-1/KL-2 mrna and a high concentration of this hormone increasing such a ratio (Thomas et al., 2005). Another study also reported an interrelationship between KL and FSH, showing a significant increase in the oocyte diameter of rabbit preantral follicles after in vitro culture with these both substances (Hutt et al., 2006b). However, although several studies have been performed, little is known about the role of KL associated or not with FSH during the in vitro development of caprine preantral follicles. Therefore, the aims of the present study were (1) to determine the levels of c-kit mrna during different follicular stages in goat ovaries, and (2) to investigate the effects of different KL concentrations in the absence and presence of FSH on the survival and development of isolated caprine preantral follicles after the in vitro culture, as well as on the ability of oocytes to undergo meiotic resumption. 2. Materials and methods This work was divided into three experiments: the quantification of c-kit mrna in goat ovaries (Experiment 1) and the in vitro culture of caprine preantral follicles in medium supplemented with KL (50 ng/ml or 100 ng/ml) in the absence (Experiment 2) and presence of FSH (Experiment 3) in the basic medium. The KL and FSH concentrations used herein were chosen based on previous studies conducted in our laboratory (Celestino et al., 2010; Saraiva et al., in press) Chemicals Recombinant human KL and recombinant bovine FSH were purchased from Cell Sciences (Canton, MA, USA) and Nanocore (São Paulo, SP, Brazil), respectively. The culture
137 137 media and other chemicals used in the present study were purchased from Sigma Chemical Co. (St Louis, MO, USA) unless mentioned otherwise Source of ovaries A total of 106 ovaries were collected from adult cross-breed goats (Capra hircus) from a local slaughterhouse. Collections occurred on 12 different days during the non-rainy season (4 days per experiment). Some of the ovaries (n=26) were used in Experiment 1, while the remaining (n=80) were used in Experiments 2 and 3. Immediately after the slaughter, the ovaries were washed in 70% alcohol for 10 sec, followed by two washes in Minimum Essential Medium (MEM) buffered with HEPES (MEM-HEPES) and supplemented with penicillin (100 µg/ml) and streptomycin (100 µg/ml). Subsequently, the ovaries were transported at 4 C to the laboratory within one hour (Chaves et al., 2008) Experiment 1: Levels of c-kit mrna in goat ovarian follicles Ten ovaries were used for the mechanical isolation of primordial, primary and secondary follicles. From the other samples (n=16), COCs and mural cells (granulosa and theca cells) were collected from small (1 3 mm) and large (3 6 mm) antral follicles. Primordial and primary follicles were isolated using a previously described mechanical procedure (Lucci et al., 1999), while secondary follicles ( µm) were microdissected from the ovarian cortex. After isolation, these follicles (30 per category, obtained in 4 replicates) were washed several times and were then placed by category into separate Eppendorf tubes in groups of 10. This procedure was completed within two hours, and all samples were stored at -80 C until the RNA was extracted. From the second group of ovaries, COCs were aspirated from small and large antral follicles. Compact COCs were selected from the follicle content as described by van Tol and Bevers (1998). Thereafter, groups of 10 COCs were stored at -80 C until RNA extraction. To collect mural granulosa and theca cell complexes, small (n=10) and large antral follicles (n=10) were isolated from ovaries and dissected free from stromal tissue using 26-G needles. The follicles were then divided in half to eliminate the follicular fluid and COC and to collect the granulosa / theca cells, which were subsequently stored at -80 C.
138 138 Isolation of total RNA was performed using the Trizol Plus purification kit (Invitrogen, São Paulo, Brazil). According to the manufacturer s instructions, 1 ml of Trizol solution was added to each frozen sample, and the lysate was aspirated through a 20-G needle before centrifugation at 10,000 g for 3 min at room temperature. Thereafter, all lysates were diluted 1:1 with 70% ethanol and subjected to a mini-column to retain total RNA in this column. After binding of the RNA to the column, DNA digestion was performed using RNAse-free DNAse (340 Kunitz units/ml) for 15 min at room temperature. After washing the column three times, the RNA was eluted with 30 µl RNAse-free water. Prior to reverse transcription, the eluted RNA samples were incubated for 5 min at 70 C and chilled on ice. Reverse transcription was then performed in a total volume of 20 µl, which comprised of 10 µl of sample RNA, 4 µl 5X reverse transcriptase buffer (Invitrogen), 8 U RNAse-out, 150 U Superscript III reverse transcriptase, U random primers (Invitrogen), 10 mm DTT and 0.5 mm of each dntp. The mixture was incubated for one hour at 42 C, for 5 min at 80 C, and then stored at -20 C. Negative controls were prepared under the same conditions but without the inclusion of the reverse transcriptase. Quantification of c-kit mrna was performed using SYBR Green. PCR reactions contained 1 µl cdna as a template in 7.5 µl of SYBR Green Master Mix (PE Applied Biosystems, Foster City, CA), 5.5 µl of ultra-pure water and 0.5 µm of each primer. The primers were designed to perform amplification of c-kit mrna. GAPDH and -actin (Table 1) were used as endogenous controls for the normalization of the mrna levels. The thermal cycling profile for the first round of PCR was as follows: initial denaturation and activation of the polymerase for 15 min at 94 C, followed by 40 cycles of 15 sec at 94 C, 30 sec at 60 C, and 45 sec at 72 C. The final extension was for 10 min at 72 C. All reactions were performed in a real-time PCR Mastercycler (Eppendorf, Germany). The delta-delta-ct method and the genorm software program were used to transform CT values into the normalized relative levels of mrna. The genorm program uses the geometric mean of more than one reference gene in order to reduce the variations and errors in the analysis of the final expression. The normalization of data was based on two reference genes ( -actin and GAPDH), and such genes were used to determine a normalization factor, that is basically the geometric mean of the transcription levels of these reference genes (Vandesompele et al., 2002).
139 139 Table 1. Oligonucleotide primers used for PCR analysis of goat cells and tissues Target Primer sequence (5 3 ) Sense Position GenBank accession nº gene GAPDH TGTTTGTGATGGGCGTGAACCA s GI: (2005) Capra ATGGCGTGGACAGTGGTCATAA as hircus GAPDH β-actin ACCACTGGCATTGTCATGGACTCT s GI: (2003) Capra TCCTTGATGTCACGGACGATTTCC as hircus β-actin c-kit AGTTTCCCAGGAACAGGCTGAGTT s GI: (2006) Capra CGTTCTGTTAAATGGGCGCTTGGT as hircus c-kit s, sense; as, antisense 2.4. Preantral follicle isolation and selection The remaining ovaries (n=80) were equally divided between Experiments 2 and 3. In the laboratory, fine fragments of the ovarian cortex (1 to 2 mm thick) were obtained with a sterile scalpel blade. Then, the ovarian cortex slices were placed in a fragmentation medium consisting of HEPES-buffered MEM. Caprine preantral follicles with approximately 150 to 300 µm in diameter were visualized under a stereomicroscope (SMZ 645 Nikon, Tokyo, Japan) and manually dissected from strips of the ovarian cortex using 26-gauge (26 G) needles. After isolation, follicles were transferred to 100 µl drops containing fresh medium under mineral oil to further evaluate follicular quality. Follicles with a visible oocyte (approximately 60 µm in diameter) that were surrounded by granulosa cells and had an intact basement membrane and no antral cavity were selected for culture in both experiments Experiment 2: Culture of caprine preantral follicles with KL (basic medium without FSH) After selection, the follicles were individually cultured (one per drop) in 100 µl drops of culture medium in Petri dishes (60 x 15 mm, Corning, USA) under mineral oil for 18 days at 39 C and 5% CO 2 in air. The basic culture medium consisted of α-mem (ph ) supplemented with 3 mg/ml bovine serum albumin (BSA), ITS (10 µg/ml insulin, 5.5
140 140 µg/ml transferrin and 5 ng/ml selenium), 2 mm glutamine, 2 mm hypoxanthine and 50 μg/ml ascorbic acid in the absence (control) or presence of KL at 50 ng/ml (KL 50) or 100 ng/ml (KL 100). Every other day, 60 µl of the culture media were replaced with fresh medium in each drop, except at days 6 and 12 of culture, in which total medium replenishment (100 µl) was performed. The culture was replicated four times and a final total of at least 40 follicles were used for each treatment (approximately 10 follicles/replicate) Experiment 3: Culture of caprine preantral follicles with KL (basic medium containing FSH) For this experiment, we used the same basic medium as in Experiment 2, except for the sequential addition of recombinant FSH: 100 ng/ml from day 0 to day 6, 500 ng/ml from day 6 to day 12 and 1000 ng/ml from day 12 to day 18 of culture (Saraiva et al., in press). Total medium replacements (100 µl) were performed on days 6 and 12 of culture and partial replacements (60 µl) were performed every other day. The preantral follicles were randomly distributed among the treatments: control FSH (only sequential FSH) or sequential FSH supplemented with 50 or 100 ng/ml KL (KL 50 (FSH) and KL 100 (FSH), respectively), and a final total of at least 40 follicles were used for each treatment (total of four replicates: approximately 10 follicles/replicate). The follicles were individually cultured for 18 days under the same conditions as previously described for Experiment Morphological evaluation of follicular development Follicles were classified according to their morphological aspect, and only those showing intact basement membrane, bright and homogeneous granulosa cells and absence of morphological signs of degeneration, such as darkness of the oocytes and surrounding cumulus cells, or misshapen oocytes, were classified as surviving follicles. Follicular diameter was measured only in surviving follicles every six days of culture (days 0, 6, 12 and 18) by mean of two perpendicular measures of each follicle using an ocular micrometer (100 x magnification) inserted into a stereomicroscope (SMZ 645 Nikon, Tokyo, Japan). Antral cavity formation was defined as the occurrence of a visible translucent cavity within the granulosa cell layers, regardless of its dimension. This event was also considered a survival
141 141 characteristic, since follicles without antrum formation after in vitro culture were classified as degenerated In vitro maturation (IVM) of caprine oocytes from in vitro cultured preantral follicles At the end of the culture period, the oocytes were recovered from follicles using 26-G needles. These structures were washed twice with TCM199 medium buffered with HEPES (TCM199-HEPES) and were measured to include the zona pellucida, as described for the follicles. It is important to note that only oocytes 110 µm (Crozet et al., 2000), with a homogeneous cytoplasm and surrounded by at least one compact layer of cumulus cells were selected for the maturation procedures. The recovery rate was calculated by dividing the number of oocytes 110 µm by the number of follicles cultured in each treatment and multiplying this number by 100. The selected cumulus-oocyte complexes were washed three times in maturation medium composed of TCM199 supplemented with 0.5 µg/ml FSH, 5 µg/ml LH, 1 µg/ml 17β-estradiol, 10 ng/ml recombinant epidermal growth factor (EGF), mmol/l pyruvate, 100 µmol/l cysteamine, 50 ng/ml recombinant insulin-like growth factor I (IGF-I) and 1% BSA. The oocytes were grouped into different treatments and were cultured in 100 µl drops of medium on culture dishes (30 x 15 mm) under mineral oil for 40 hours in an incubator at 39 C with 5% CO 2 in air Assessment of oocyte viability and chromatin configuration Fluorescence microscopy was used to analyze the viability of oocytes isolated from caprine preantral follicles after 18 days of culture. Briefly, the oocytes were incubated in 100 µl drops of TCM199-HEPES supplemented with 4 µm calcein-am, 2 µm ethidium homodimer-1 (Molecular Probes, Invitrogen, Karlsruhe, Germany) and 10 µm Hoechst (Sigma, Deisenhofen, Germany) at 37 C for 15 minutes. After incubation, the oocytes were washed three times with TCM199-HEPES and were evaluated under a fluorescence microscope (Nikon, Eclipse 80i, Tokyo, Japan). Oocytes were considered to be alive if the cytoplasm was stained positively with calcein-am (green) and if the chromatin was not labeled with ethidium homodimer-1 (red). Hoechst was used to analyze the oocyte chromatin configuration by observing the intact germinal vesicle (GV), meiotic resumption (including
142 142 germinal vesicle breakdown - GVBD, metaphase I - MI, anaphase I - AI or telophase I - TI) and nuclear maturation (metaphase II - MII) Statistical Analysis Data referring to c-kit mrna expression in primordial, primary and secondary follicles were analyzed using the Kruskal-Wallis test (SAS, 2002), whereas the t-test was used for paired comparisons of mrna expression in the small and large antral follicles (P<0.05). Data concerning follicular survival, fully grown oocytes, antrum formation and meiotic resumption after in vitro culture were analyzed as dispersion of frequency, expressed in percentages and compared using the Chi-square test. Data on follicle and oocyte diameters after culture did not show homoscedasticity, even after transformation, and were then compared using the non-parametric Kruskal-Wallis test (SAS, 2002). The results were expressed as the mean values ± standard deviation (SD), and differences were considered to be significant when P< Results 3.1. Experiment 1: Levels of c-kit mrna in goat ovarian follicles Quantification of mrna demonstrated a significant decrease in the level of c-kit mrna during the transition from the primary to the secondary follicle stage (P<0.05), but no significant difference was observed between primordial and primary follicles (P>0.05; Fig. 1A). When the levels of c-kit mrna were compared between cumulus oocyte complexes (COCs) collected from small and large antral follicles, no significant difference was observed (P>0.05; Fig. 1B). A similar level of c-kit mrna was also observed in granulosa/theca cells from small antral follicles and large antral follicles (P>0.05; Fig. 1C). On the other hand, realtime PCR demonstrated that COCs from small and large antral follicles exhibited higher levels of c-kit mrna than their respective granulosa/theca cells (P<0.05; Fig. 1D and E).
143 143 Fig. 1. Levels of c-kit mrna in goat ovarian follicles (mean ± SD). (A) Primordial, primary, and secondary follicles, (B) COCs from small and large antral follicles, (C) granulosa/theca cells from small and large antral follicles, (D) COCs and granulosa/theca cells from small antral follicles, and (E) COCs and granulosa/theca cells from large antral follicles. A and B (P < 0.05).
144 Experiment 2: Culture of caprine preantral follicles with KL (basic medium without FSH) Effects of kit ligand addition on follicular survival and antrum formation Preantral follicles selected for culture had a centrally located oocyte and normal granulosa cells enclosed by an intact basal membrane (Fig. 2A). The effects of different KL concentrations (50 ng/ml and 100 ng/ml) on follicular survival and antral cavity formation were evaluated at 0, 6, 12 and 18 days of culture and are shown in Fig. 3A and B, respectively. In the control and KL 50, follicular survival was maintained up to 6 days of culture when compared to day 0. As the culture progressed from 6 to 12 days, a significant decrease in follicular survival was observed in all treatments (P<0.05), with the percentage of normal follicles remaining constant from day 12 to day 18 of culture. When compared to the other treatments, KL 50 showed a higher percentage of surviving follicles than the control medium at the end of culture (P<0.05). Antral follicles were observed as early as day 6 of culture in all treatments, with large antral cavities visualized at day 18 (Fig. 2B). According to Fig. 3B, no significant difference was observed in the rate of antrum formation among days of culture in all treatments from day 6 onwards (P>0.05). Nevertheless, after comparing all treatments in the same culture period, KL 50 showed a higher percentage of antrum formation than the control and KL 100 at day 6 of culture (P<0.05). Moreover, the rate of antrum formation was significantly higher in KL treatments (KL 50 and KL 100) than in the control from day 12 onwards (P<0.05). Fig. 2. (A) Caprine preantral follicle at day 0, and (B) antral follicle after 18 days of in vitro culture with 50 ng/ml KL.
145 145 Fig. 3. Caprine preantral follicles cultured in vitro for 18 days in the absence (control) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 2 culture medium without FSH. (A) Percentage of follicle survival; (B) percentage of antrum formation; (C) oocyte diameter (mean ± SD). A and B indicates significant differences among treatments in the same culture period. a and b indicates significant differences among days of culture in the same treatment Follicle and oocyte growth after in vitro culture with kit ligand Values related to follicular growth during in vitro culture of isolated caprine preantral follicles are described in Table 2. A progressive and significant increase in follicular diameter was observed up to day 18 of culture regardless of the treatment used (P<0.05). However, no significant differences in follicular diameter were observed when the treatments were compared to each other on the same day of culture (P>0.05). Fig. 3C presents the results of oocyte growth after 18 days of follicle culture for all treatments tested (control, KL 50 and KL 100). It was observed that the KL 100 treatment
146 146 resulted in a larger oocyte diameter compared to the control ( ± µm vs ± 8.78 µm; P<0.05), but did not differ from KL 50 treatment ( ± µm; P>0.05). Table 2. Follicular diameter (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 2 - culture medium without FSH. Follicular diameter (µm) Treatments Days of culture Control (n=42) KL 50 (n=42) KL 100 (n=42) Day ± d ± d ± d Day ± c ± c ± c Day ± b ± b ± b Day ± a ± a ± a a,b,c,d: indicate significant differences among days of culture into the same treatment (P<0.05). There was no significant difference among treatments (P>0.05) Ability of oocytes grown in vitro to undergo meiotic resumption The percentages of oocytes acceptable for IVM (fully grown oocytes 110 µm) after 18 days of culture were significantly higher in normal follicles cultured in both KL treatments (KL 50: 57.14%; KL 100: 61.90%) than in the control (35.71%) (P<0.05; Table 3). Regarding oocyte viability evaluated using the fluorescent markers calcein-am and ethidium homodimer-1 (Fig. 5A and B), no differences were observed among treatments (P>0.05), which showed high percentages of viable oocytes stained in green fluorescence. The assessment of chromatin configuration showed that grown oocytes from follicles cultured in the control medium had a higher percentage of intact germinal vesicles (Fig. 5C) than those cultured in KL 50 and KL 100 (P<0.05). On the other hand, both KL treatments significantly increased the percentage of meiotic resumption (KL 50: 62.50%; KL 100: 69.23%) in comparison to the control (33.33%; P<0.05). It is important to note that 8.33% of oocytes grown in the KL 50 treatment reached metaphase II, which indicates the occurrence of nuclear maturation (Fig. 5D).
147 147 Table 3. Meiotic stages of caprine oocytes from preantral follicles cultured for 18 days in the absence (control) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 2 - culture medium without FSH. Number of oocytes (%) Treatments Number of cultured follicles Fully grown * (%) Viable oocytes (%) GV (%) Meiotic resumption (%) MII (%) Control 42 15/42 (35.71) B 14/15 (93.33) A 10/15 (66.67) A 5/15 (33.33) B 0/15 (0.0) KL /42 (57.14) A 24/24 (100) A 7/24 (29.17) B 15/24 (62.50) A 2/24 (8.33) KL /42 (61.90) A 24/26 (92.30) A 8/26 (30.77) B 18/26 (69.23) A 0/26 (0.0) GV: germinal vesicle; Meiotic resumption: includes germinal vesicle breakdown (GVBD), metaphase I (MI), anaphase I (AI) and telophase I (TI); MII: metaphase II. *Only oocytes 110 µm were selected for the in vitro maturation procedure. A,B indicate significant differences among treatments Experiment 3: Culture of caprine preantral follicles with KL (basic medium containing FSH) Effects of kit ligand addition on follicular survival and antrum formation Preantral follicles selected for culture in this experiment had the same morphology of the follicles used in Experiment 2 (Fig. 2A). The results of follicular survival in the different days of culture (days 0, 6, 12 and 18) are depicted in Fig. 4A. Compared to day 0, the follicular survival in control FSH and KL 50 (FSH) was maintained up to 6 days of culture (P>0.05). After the progression of culture period from 6 to 18 days, a significant decrease in follicular survival was observed in all treatments (P<0.05). In addition, no difference was observed among treatments regarding the percentage of surviving follicles at various days of culture (P>0.05). Similar to the observations of Experiment 2, antral follicles were observed as early as day 6 of culture in all treatments, and they formed large antral cavities at day 18 (Fig. 2B). Fig. 4B shows the percentage of antral cavity formation after the culture of preantral follicles with different KL concentrations. A significant increase was observed in the rate of antrum
148 148 formation up to 6 days of culture in control FSH and KL 100 (FSH) (P<0.05). From 6 to 12 days, only the KL 50 (FSH) showed a significant increase in the percentage of antrum formation (P<0.05). Comparing all treatments within the same culture period, the rate of antrum formation was significantly higher in KL 50 (FSH) than in control FSH on day 12 (P<0.05). Fig. 4. Caprine preantral follicles cultured in vitro for 18 days in the absence (control FSH) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 3 culture medium containing FSH. (A) Percentage of follicle survival; (B) percentage of antrum formation; (C) oocyte diameter (mean ± SD). A and B indicates significant differences among treatments in the same culture period. a and b indicates significant differences among days of culture in the same treatment Follicle and oocyte growth after in vitro culture with kit ligand A progressive and significant increase in follicular diameter was observed up to day 18 of culture in control FSH and KL 50 (FSH) (P<0.05). In KL 100 (FSH), the significant
149 149 increase in follicular growth only occurred until day 12 (P<0.05). In addition, no significant differences in follicular diameter were observed among treatments in the various days of culture (P>0.05; Table 4). Similarly, no difference in oocyte growth was observed among all treatments (control FSH, KL 50 (FSH) and KL 100 (FSH)) after 18 days of follicular culture (P>0.05; Fig. 4C). Table 4. Follicular diameter (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control FSH) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 3 - culture medium containing FSH. Follicular diameter (µm) Treatments Days of culture Control FSH KL 50 (FSH) KL 100 (FSH) (n=41) (n=40) (n=40) Day ± d ± d ± c Day ± c ± c ± b Day ± b ± b ± a Day ± a ± a ± a a,b,c,d: indicate significant differences among days of the culture into the same treatment (P<0.05). There was no significant difference among treatments (P>0.05) Ability of oocytes grown in vitro to undergo meiotic resumption The percentages of oocytes acceptable for IVM (fully grown oocytes 110 µm) after 18 days of follicle culture were similar among all treatments (P>0.05), as shown in Table 5. Similarly, oocyte viability evaluated using the fluorescent markers calcein-am and ethidium homodimer-1 (Fig. 5A and B) indicated no differences among the treatments (P>0.05), with 100% viable oocytes stained in green fluorescence for all conditions. The assessment of chromatin configuration showed similar percentages of intact germinal vesicles (Fig. 5C) and meiotic resumption in grown oocytes from follicles cultured under all three treatments (P>0.05). The percentages of meiotic resumption obtained in control FSH, KL 50 (FSH) and KL 100 (FSH) were 39.14%, 47.06% and 31.82%, respectively.
150 150 Table 5. Meiotic stages of caprine oocytes from preantral follicles cultured for 18 days in the absence (control FSH) or presence of different kit ligand concentrations (50 ng/ml or 100 ng/ml): Experiment 3 - culture medium containing FSH. Number of oocytes (%) Treatments Number of cultured follicles Fully grown * (%) Viable oocytes (%) GV (%) Meiotic resumption (%) MII (%) Control FSH 41 23/41 (56.10) 23/23 (100) 14/23 (60.86) 9/23 (39.14) 0/23 (0.0) KL 50 (FSH) 40 17/40 (42.50) 17/17 (100) 9/17 (52.94) 8/17 (47.06) 0/17 (0.0) KL 100 (FSH) 40 22/40 (55.00) 22/22 (100) 15/22 (68.18) 7/22 (31.82) 0/22 (0.0) GV: germinal vesicle; Meiotic resumption: includes germinal vesicle breakdown (GVBD), metaphase I (MI), anaphase I (AI) and telophase I (TI); MII: metaphase II. *Only oocytes 110 µm were selected for the in vitro maturation procedure. There was no significant difference among treatments (P>0.05). Fig. 5. Fluorescence of oocytes from caprine preantral follicles cultured in vitro for 18 days. (A) Viable oocyte labeled by calcein AM (green fluorescence) after culture with 100 ng/ml
151 151 KL and (B) non-viable oocyte marked with ethidium homodimer-1 (red fluorescence) after culture in control FSH; fully grown oocyte from preantral follicle cultured with 50 ng/ml KL showing (C) the chromatin in intact germinal vesicle and (D) metaphase II after staining with Hoechst (400x magnification). (For interpretation of the references to colour in this figure legend, the reader is referred to the web version of this article.) 4. Discussion During the last decade, several gene expression studies have revealed the presence of a functional KL/c-kit system in mammalian ovaries regulating the oogenesis and folliculogenesis processes (Celestino et al., 2009; Hutt et al., 2006a). To better understand the action of the KL/c-kit system in goats, the present study performed for the first time the quantification of c-kit mrna in caprine ovarian follicles, as well as the in vitro culture of isolated goat preantral follicles with KL in the absence and presence of FSH. Quantification of c-kit mrna demonstrated a decrease in the levels of c-kit mrna during the transition from the primary to secondary follicle stage. Our results are consistent with those previously reported in caprine ovaries by Silva et al. (2006), who verified in oocytes of primordial and primary follicles an immunoreactivity for c-kit stronger than in secondary and antral stages. Emphasizing these results, researchers observed in another study utilizing immature mouse ovaries a gradual decrease of c-kit expression in oocytes as follicles developed into the secondary stage (Kang et al., 2003). In contrast, previous investigations demonstrated a high and uniform expression of c-kit protein and mrna in primordial and later preantral follicles, which decreased only from the antral stage (mouse: Horie et al., 1991; sheep: Tisdall et al., 1999). These contradictory results suggest the existence of differences among the species or ages of the animal models. In addition, we hypothesize from both previous (Celestino et al., 2010) and present results the greatest need for KL action in goats occurs in early preantral follicles, especially during follicular activation. This hypothesis is supported by the reduction in the expression of c-kit mrna at the secondary follicle stage that we observed in this study, which is possibly associated with high expression of other growth factors and receptors essential for this follicular phase. In this study on goat follicles, we also observed a higher level of c-kit mrna in COCs compared to granulosa/theca cells, both from small and large antral follicles. Indeed, oocytes at all stages of development have been reported to express c-kit mrna and protein (Doneda et al., 2002; Manova et al., 1990),
152 152 which does not occur in somatic cells (mural granulosa and theca). Similarly, Kang et al. (2003) observed that the c-kit protein was expressed strongly in mouse oocytes of preantral follicles and expressed weakly in granulosa and theca cells. In our work, the identification of c-kit mrna in both COCs (high expression) and somatic cells (low expression) of antral follicles, as well as in all categories of preantral follicles, demonstrates an important role of KL synthesized by granulosa cells in goat follicular development. This information is consistent with many previous findings demonstrating the KL action in follicles from other species (for review see Celestino et al., 2009). In the present study, follicular survival was significantly higher in the presence of 50 ng/ml KL (without FSH) compared to the control after 18 days of culture. Similar to our results, previous works showed a positive effect of 50 ng/ml KL on the viability of early caprine preantral follicles enclosed in ovarian tissue after in vitro culture in a simple medium (Celestino et al., 2010) and in a dynamic medium (Lima et al., in press). Moreover, KL has been shown to promote primordial follicle survival in cultured mouse ovaries, as well as oocyte viability by inhibiting apoptosis (Jin et al., 2005; Reynaud et al., 2000). According to Jin et al. (2005), KL inhibits apoptosis in mouse oocytes by increasing the mrna levels of antiapoptotic proteins, Bcl-2 and Bcl-xL, and reducing the mrna levels of the proapoptotic factor Bax. Regarding the results of antrum formation, we observed a significantly higher development rate in both KL concentrations (50 and 100 ng/ml) than in the control from day 12 onwards. Our results demonstrating the role of the KL/c-kit system in antrum formation confirms an earlier observation reported by Yoshida et al. (1997), who injected in vivo an antibody blocking the KL/c-kit interaction and observed the inhibition of both antrum formation and follicular fluid accumulation. In addition, another study verified that the blockade of the KL/c-kit system severely inhibited the antrum formation after 12 days of in vitro culture (Reynaud et al., 2000). In relation to oocyte growth, the present study found a higher oocyte diameter after utilizing KL at 100 ng/ml than when compared to the control. Similar results were observed by Klinger and De Felici (2002) working with mouse oocytes, who reported a two-fold increase in oocyte diameter compared to controls after 4 days of culture in the presence of 100 ng/ml KL. Other studies have also demonstrated the role of KL in the promotion of oocyte growth (goat: Celestino et al., 2010, Lima et al., in press; rabbit: Hutt et al., 2006b; mouse: Packer et al., 1994). Although the mechanism by which KL promotes oocyte growth is not fully understood, it has been suggested that the activation of the phosphoinositide-3 kinase
153 153 (PI3K) pathway in the oocytes is involved in this process (Reddy et al., 2005; John et al., 2008). In the current work, both KL concentrations (50 and 100 ng/ml) increased the number of oocytes destined for IVM. These concentrations also increased the percentage of meiotic resumption (KL 50: 62.50%; KL 100: 69.23%) compared to the control group (33.33%), with the KL 50 treatment reaching 8.33% of oocytes in metaphase II. For goats, these results are interesting, since few studies in this species have achieved meiotically competent oocytes from the in vitro culture of preantral follicles (Magalhães et al., 2011a,b; Silva et al., 2010), especially with the occurrence of nuclear maturation. Meiotic resumption in goat oocytes grown in vitro with KL probably occurred due to the increased levels of c-kit mrna in COCs from antral follicles, as verified in our study of expression (Experiment 1). In line with our results, Ye et al. (2009) recently verified that the treatment of mouse COCs with KL enhanced the first polar body extrusion with an increase in cyclin B1 synthesis, which is important for the progression of meiotic maturation after GVBD. In addition, studies in rats reported that the interaction between KL and c-kit may play a role in controlling the nuclear maturation of oocytes (Ismail et al., 1996, 1997). Based on the study from De Smedt et al. (1994), the low rate of oocytes in metaphase II found in our work may have occurred due to the short culture period used. We believe that, even after 18 days of culture, follicles were still too small to produce fully competent oocytes capable of reaching a high rate of metaphase II. Thus, further investigations using a longer culture time will be necessary. Unlike the culture medium without FSH, the addition of KL to the in vitro culture of caprine preantral follicles in the presence of this gonadotropin (Experiment 3) did not demonstrate any effect on all parameters evaluated (follicular survival and growth, antrum formation, oocyte survival and growth, and meiotic resumption). In this study, FSH was added to the basic culture medium sequentially, i.e., in increasing concentrations, because as the follicles develop, the gonadotropin levels increase to meet the requirements of different follicular stages (Saraiva et al., in press). We formulated two different hypotheses to explain our results after using this basic medium. The first hypothesis is that the high levels of FSH used in the culture medium masked the possible effects of KL added in vitro throughout the 18 days of culture. Indeed, some studies have suggested that lower concentrations of FSH are more important for the appropriate regulation of paracrine factors, such as KL, that trigger cell development (Celestino et al., 2009; Thomas et al., 2005). The second hypothesis is based on the previously demonstrated role of FSH in the regulation of KL expression in vitro
154 154 (Thomas et al., 2005). Considering this function of FSH, it is possible that its presence in the basic medium has been able to stimulate the synthesis of KL by follicular granulosa cells, allowing KL to reach satisfactory levels in vitro. Consequently, additional effects of the two KL concentrations were not observed in the culture containing FSH. Although FSH and KL showed no additive effect on in vitro follicle growth, i.e., a significant increase in follicle diameter, the results highlight the growth promoting role of FSH on preantral follicles as reported in previous studies (Andrade et al., 2005; Magalhães et al., 2009; Roy and Greenwald, 1988, 1989). In conclusion, this study demonstrated that c-kit mrna is present in all investigated follicular categories and cellular types. Moreover, KL at 50 and/or 100 ng/ml promotes the survival and the antral cavity formation of isolated caprine preantral follicles after in vitro culture, as well as the growth and meiotic resumption of their oocytes in the absence of FSH. Results on the levels of c-kit mrna and the culture system established in this work may contribute to future research investigating the mechanisms and substances involved in the regulation of follicular development. Acknowledgments This work was supported by the National Council for Scientific and Technological Development (CNPq, Brazil, grant number: / RENORBIO), the Coordination for the Improvement of Higher Education Personnel (CAPES) and the Brazilian Innovation Agency (FINEP). Isadora Machado Teixeira Lima is a recipient of a grant from CAPES. References Arunakumari, G., Shanmugasundaram, N., Rao, V.H., Development of morulae from the oocytes of cultured sheep preantral follicles. Theriogenology 74, Andrade, E.R, Seneda, M.M., Alfieri, A.A., Oliveira, J.A., Federico Rodrigues Loureiro Bracarense, A.P., Figueiredo, J.R., Toniolli, R., Interactions of indole acetic acid with EGF and FSH in the culture of ovine preantral follicles. Theriogenology 64, Carlsson, I.B., Laitinen, M.P.E, Scott, J.E., Louhio H., Velentzis L., Tuuri T., Aaltonen J., Ritvos, O., Winston, R.M.L., Hovatta, O., Kit ligand and c-kit are expressed
155 155 during early human ovarian follicular development and their interaction is required for the survival of follicles in long-term culture. Reproduction 131, Celestino, J.J.H., Bruno, J.B., Lima-Verde, I.B., Matos, M.H.T., Saraiva, M.V.A., Chaves, R.N., Martins, F.S., Almeida, A.P., Cunha, R.M.S., Lima, L.F., Name, K.O., Campello, C.C., Silva, J.R.V., Báo, S.N., Figueiredo, J.R., Steady-state level of kit ligand mrna in goat ovaries and the role of kit ligand in preantral follicle survival and growth in vitro. Mol. Reprod. Dev. 77, Celestino, J.J.H., Matos, M.H.T., Saraiva, M.V.A., Figueiredo, J.R., Regulation of ovarian folliculogenesis by Kit Ligand and the c-kit system in mammals. Anim. Reprod. 6, Chaves, R.N., Martins, F.S., Saraiva, M.V., Celestino, J.J., Lopes, C.A., Correia, J.C., Verde, I.B., Matos, M.H., Báo, S.N., Name, K.P., Campello, C.C., Silva, J.R.V., Figueiredo, J.R., Chilling ovarian fragments during transportation improves viability and growth of goat preantral follicles cultured in vitro. Reprod. Fertil. Dev. 20, Clark, D.E., Tisdall, D.J., Fidler, A.E., McNatty, K.P., Localization of mrna encoding c-kit during the initiation of folliculogenesis in ovine fetal ovaries. J. Reprod. Fertil. 106, Crozet, N., Dahirel, M., Gall, L., Meiotic competence of in vitro grown goat oocytes. J. Reprod. Fertil. 118, De Smedt, V., Crozet, N., Gall, L., Morphological and functional changes accompanying the acquisition of meiotic competence in ovarian goat oocyte. J. Exp. Zool. 269, Doneda, L., Klinger, F.G., Larizza, L., De Felici, M., KL/KIT coexpression in mouse fetal oocytes. Int. J. Dev. Biol. 46, Eppig, J.J., Schroeder, A.C., Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation and fertilization in vitro. Biol. Reprod. 41, Gupta, P.S.P., Ramesh, H.S., Manjunatha, B.M., Nand, S., Ravindra, J.P, Production of buffalo embryos using oocytes from in vitro grown preantral follicles. Zygote 16, Gutierrez, C.G., Ralph, J.H., Telfer, E.E., Wilmut, I., Webb, R., Growth and antrum formation of bovine preantral follicles in long-term culture in vitro. Biol. Reprod. 62,
156 156 Horie, K., Takakura, K., Taii, S., Narimoto, K., Noda, Y., Nishikawa, S., Nakayama, H., Fujita, J., Mori, T., The expression of c-kit protein during oogenesis and early development. Biol. Reprod. 45, Huang, E.J., Nocka, K.H., Buck, J., Besmer, P., Differential expression and processing of two cell associated forms of the Kit-Ligand: KL-1 and KL-2. Mol. Biol. Cell. 3, Hutt, K., McLaughlin, E.A., Holland, M.K., 2006a. KL and KIT have diverse roles during mammalian oogenesis. Mol. Hum. Reprod. 12, p Hutt, K.J., Mclaughlin, E.A., Holland, M.K., 2006b. KIT/KIT Ligand in mammalian oogenesis and folliculogenesis: Roles in rabbit and murine ovarian follicle activation and oocyte growth. Biol. Reprod. 75, Ismail, R.S., Dube, M., Vanderhyden, B.C., Hormonally regulated expression and alternative splicing of kit ligand may regulate kit induced inhibition of meiosis in rat oocytes. Dev. Biol. 184, Ismail, R.S., Okawara, Y., Fryer, J.N., Vanderhyden, B.C., Hormonal regulation of the ligand for c-kit in the rat ovary and its effects on spontaneous oocyte meiotic maturation. Mol. Reprod. Dev. 43, Jin, X., Han, C.S., Yu, F.Q., Wei, P., Hu, Z.Y., Liu, Y.X., Anti-apoptotic action of stem cell factor on oocytes in primordial follicles and its signal transduction. Mol. Reprod. Dev. 70, John, G.B., Gallardo, T.D., Shirley, L.J., Castrillon, D.H., Foxo3 is a PI3K-dependent molecular switch controlling the initiation of oocyte growth. Dev. Biol. 321, Kang, J.S., Lee, C.J., Lee, J.M., Rha, J.Y., Song, K.W., Park, M.H., Follicular Expression of c-kit/scf and Inhibin-α in mouse ovary during development. J. Histochem. Cytochem. 51, Klinger, F.G., De Felici, M., In vitro development of growing oocytes from fetal mouse oocytes: Stage-specific regulation by stem cell factor and granulose cells. Dev. Biol. 244, Lima, I.M.T., Celestino, J.J., Faustino, L.R., Magalhães-Padilha, D.M., Rossetto, R., Brito, I.R., Donato, M.A., Lopes, C.A., Campello, C.C., Peixoto, C.A., Figueiredo, J.R., Rodrigues, A.P.R. Dynamic Medium Containing Kit Ligand and Follicle-Stimulating Hormone Promotes Follicular Survival, Activation, and Growth during Long-Term in
157 157 vitro Culture of Caprine Preantral Follicles. Cells Tissues Organs, doi: / Lucci, C.M., Amorim, C.A., Bao, S.N., Figueiredo, J.R., Rodrigues, A.P.R., Silva, J.R.V., Gonçalves, P.B.D., Effect of the interval of serial sections of ovarian in the tissue chopper on the number of isolated caprine preantral follicles. Anim. Reprod. Sci. 56, Magalhães, D.M., Araújo, V.R., Lima-Verde, I.B., Matos, M.H.T., Silva, R.C., Lucci, C.M., Báo, S.N., Campello, C.C., Figueiredo, J.R., Different follicle-stimulating hormone (FSH) sources influence caprine preantral follicle viability and development in vitro. Braz. J. Vet. Res. Anim. Sci. 46, Magalhães, D.M., Duarte, A.B.G., Araújo, V.R., Brito, I.R., Soares, T.G., Lima, I.M.T., Lopes, C.A.P., Campello, C.C., Rodrigues, A.P.R., Figueiredo, J.R., 2011a. In vitro production of a caprine embryo from a preantral follicle cultured in media supplemented with growth hormone. Theriogenology 75, Magalhães, D.M., Fernandes, D.D., Mororó, M.B.S., Silva, C.M.G., Rodrigues, G.Q., Bruno, J.B., Matos, M.H.T., Campello, C.C., Figueiredo, J.R., 2011b. Effect of the Medium Replacement Interval on the Viability, Growth and In Vitro Maturation of Isolated Caprine and Ovine Pre-Antral Follicles. Reprod. Dom. Anim. 46, Manova, K., Nocka, K., Besmer, P., Bachvarova, R.F., Gonadal expression of c-kit encoded at the W locus of the mouse. Development 110, Motro, B., Bernstein, A., Dynamic changes in ovarian c-kit and syeel expression during the estrous reproductive cycle. Dev. Dyn. 197, Muruvi, W., Picton, H.M., Rodway, R.G., Joyce, I.M., In vitro growth of oocytes from primordial follicles isolated from frozen thawed lamb ovaries. Theriogenology 64, O Brien, M.J., Pendola, J.K., Eppig, J.J., A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol. Reprod. 68, Otsuka, F., Shimasaki, S., A negative feedback system between oocyte bone morphogenetic protein 15 and granulosa cell kit ligand: Its role in regulating granulosa cell mitosis. Proc. Natl. Acad. Sci. USA 99, Packer, A.I., Hsu, Y.C., Besmer, P., Bachvarova, R.F., The ligand of the c-kit receptor promotes oocyte growth. Dev. Biol. 161,
158 158 Reddy, P., Shen, L., Ren, C., Boman, K., Lundin, E., Ottander, U., Lindgren, P., Liu, Y-x., Sun, Q-y., Liu, K., Activation of Akt (PKB) and suppression of FKHRL1 in mouse and rat oocytes by stem cell factor during follicular activation and development. Dev. Biol. 281, Reynaud, K., Cortvrindt, R., Smitz, J., Driancourt, M.A., Effects of Kit Ligand and anti-kit antibody on growth of cultured mouse preantral follicles. Mol. Reprod. Dev. 56, Roy, S.K., Greenwald, G.S., Hormonal requirements for the growth and differentiation of hamster preantral follicles in long-term culture. J. Reprod. Fert. 87, Roy, S.K., Greenwald, G.S., In vitro effects of follicle-stimulating hormone, luteinizing hormone and prolactin on follicular deoxyribonucleic acid synthesis in the hamster. Endocrinology 122, Roy, S.K., Treacy, B.J., Isolation and long term culture of human preantral follicles. Fertil. Steril. 59, Saraiva, M.V.A., Celestino, J.J.H., Araújo, V.R., Chaves, R.N., Almeida, A.P., Lima-Verde, I.B., Duarte, A.B.G., Silva, G.M., Martins, F.S., Bruno, J.B., Matos, M.H.T., Campello, C.C., Silva, J.R.V., Figueiredo, J.R. Expression of follicle-stimulating hormone receptor (FSHR) in goat ovarian follicles and the impact of sequential culture medium on in vitro development of caprine preantral follicles. Zygote, Available on CJO doi: /s SAS Ver SAS Institute Inc., Cary, NC, USA, Serafim, M.K.B., Araújo, V.R., Silva, G.M., Duarte, A.B.G., Almeida, A.P., Chaves, R.N., Campello, C.C., Lopes, C.A.P., Figueiredo, J.R., Silva, L.D.M., Canine preantral follicles cultured with various concentrations of follicle-stimulating hormone (FSH). Theriogenology 74, Silva, C.M.G., Matos, M.H.T., Rodrigues, G.Q., Faustino, L.R., Pinto, L.C., Chaves, R.N., Araújo, V.R., Campello, C.C., Figueiredo, J.R., In vitro survival and development of goat preantral follicles in two different oxygen tensions. Anim. Reprod. Sci. 117, Silva, J.R.V., van den Hurk, R., Van Tol, H.T.A., Roelen, B.A.J., Figueiredo, J.R., The Kit ligand/c-kit receptor system in goat ovaries: gene expression and protein localization. Zygote 14,
159 159 Telfer, E.E., McLaughlin, M., Ding, C., Thong, K.J., A two step serum free culture system supports development of human oocytes from primordial follicles in the presence of activin. Hum. Reprod. 23, Thomas, F.H., Ethier, J.F., Shimasaki, S., Vanderhyden, B.C., Follicle stimulating hormone regulates oocyte growth by modulation of expression of oocyte and granulosa cell factors. Endocrinology 146, Thomas, F.H., Ismail, R.S., Jiang, J., Vanderhyden, B.C., Kit ligand 2 promotes murine oocyte growth in vitro. Biol. Reprod. 78, Tisdall, D.J., Fidler, A.E., Smith, P., Quirke, L.D., Stent, V.C., Heath, D.A., Mcnatty, K.P., Stem cell factor and c-kit gene expression and protein localization in the sheep ovary during fetal development. J. Reprod. Fertil. 116, van Tol, H.T., Bevers, M.M., Theca cells and theca-cell conditioned medium inhibit the progression of FSH-induced meiosis of bovine oocytes surrounded by cumulus cells connected to membrane granulosa. Mol. Reprod. Dev. 51, Vandesompele, J., De Paepe, A., Speleman, F., Elimination of primer-dimer artifacts and genomic coamplification using a two-step SYBR Green I real-time RT-PCR. Anal. Biochem., v. 303, Wu, J., Emery, B.R., Carrel, D.T., In vitro growth, maturation, fertilization and embryonic development of oocytes from porcine preantral follicles. Biol. Reprod. v. 64, Ye, Y., Kawamura, K., Sasaki, M., Kawamura, N., Groenen, P., Gelpke, M.D.S., Rauch, R., Hsueh, A.J.W., Tanaka, T., Kit ligand promotes first polar body extrusion of mouse preovulatory oocytes. Reprod. Biol. Endocrinol. 7, Yoshida, H., Takakura, N., Nataoka, H., Kunisada, T., Okamura, H., Nishikawa, S.I., Stepwise requirement of c-kit tyrosine kinase in mouse ovarian follicle development. Dev. Biol. 184,
160 160 9 CAPÍTULO 4 Níveis de expressão de RNAm para BMPRIB e BMPRII em folículos ovarianos caprinos e os efeitos in vitro da BMP-15 sobre o desenvolvimento de folículos pré-antrais (BMPRIB and BMPRII mrna expression levels in goat ovarian follicles and the in vitro effects of BMP-15 on preantral follicle development) Periódico: Cell and Tissue Research, 2012 (in press)
161 161 BMPRIB and BMPRII mrna expression levels in goat ovarian follicles and the in vitro effects of BMP-15 on preantral follicle development Isadora Machado T. Lima a *, Ivina R. Brito a, Rafael Rossetto a, Ana Beatriz G. Duarte a, Giovanna Q. Rodrigues a, Márcia Viviane A. Saraiva a, José Jackson N. Costa b, Mariana Aragão M. Donato c, Christina A. Peixoto c, José Roberto V. Silva b, José Ricardo de Figueiredo a, Ana Paula R. Rodrigues a a Faculty of Veterinary, Laboratory of Manipulation of Oocyte and Preantral Follicles (LAMOFOPA), State University of Ceará, Fortaleza, CE, Brazil b Biotechnology Nucleus of Sobral (NUBIS), Federal University of Ceará, Sobral, CE, Brazil c Ultrastructure Laboratory, Aggeu Magalhães Research Center (FIOCRUZ) and Center for Strategic Technologies of the Northeast (CETENE), Recife, PE, Brazil *Corresponding address: Programa de Pós-Graduação em Ciências Veterinárias (PPGCV) Laboratório de Manipulação de Oócitos e Folículos Pré-Antrais (LAMOFOPA) Universidade Estadual do Ceará (UECE) Av. Paranjana, 1700, Campus do Itaperi. Fortaleza CE Brasil. CEP: Tel.: ; Fax: address: dora.uece@gmail.com (Isadora Machado Teixeira Lima)
162 162 Resumo Esse estudo avaliou os níveis de RNAm para BMPRIB e BMPRII em folículos caprinos e os efeitos da proteína morfogenética óssea 15 (BMP-15) sobre o desenvolvimento in vitro de folículos pré-antrais cutivados. A PCR em tempo real foi utilizada para analisar os níveis de RNAm para BMPRIB e BMPRII em folículos pré-antrais caprinos e também em pequenos e grandes folículos antrais desta espécie. Aliado a isto, folículos pré-antrais ( 150 µm) foram isolados de ovários caprinos e cultivados por 18 dias em meio α-mem + suplementado ou não com BMP-15 (10, 50 ou 100 ng/ml). Ao final do cultivo, alguns folículos foram fixados para avaliação ultraestrutural. A PCR em tempo real mostrou uma redução nos níveis de RNAm para BMPRII com a progressão de folículos primários para secundários. Maiores níveis de RNAm para BMPRIB foram observados em células da granulosa/teca de grandes folículos antrais em comparação àquelas de pequenos folículos antrais. Além disso, os RNAm para BMPRII foram mais expressos em COCs de grandes folículos antrais em relação às suas respectivas células da granulosa/teca. No cultivo in vitro, 50 ng/ml de BMP-15 influenciou positivamente a formação de cavidade antral e o crescimento folicular após 18 dias, e ainda manteve a integridade folicular. Em conclusão, os RNAm para BMPRIB e BMPRII estão presentes em todas as categorias foliculares. A BMP-15 (50 ng/ml) estimula o crescimento, formação de antro, bem como a integridade ultraestrutural de folículos pré-antrais caprinos isolados após 18 dias de cultivo. Palavras-chave: Receptores de BMP-15. BMP-15. Cultivo. Crescimento folicular. Caprinos.
163 163 Abstract This study evaluated the levels of BMPRIB and BMPRII mrna in goat follicles and the effects of bone morphogenetic protein-15 (BMP-15) on the in vitro development of cultured preantral follicles. Real-time PCR was used to analyze the levels of BMPRIB and BMPRII mrna in caprine preantral follicles, and in small and large antral follicles. Furthermore, preantral follicles ( 150 µm) were isolated from goat ovaries and cultured for 18 days in α- MEM + supplemented or not with BMP-15 (10, 50 or 100 ng/ml). At the end of culture, some follicles were fixed for ultrastructural evaluation. Real-time PCR showed a reduction in BMPRII mrna levels from the primary to secondary follicles. Higher levels of BMPRIB mrna were observed in granulosa/theca cells from large antral follicles compared to small antral follicles. Moreover, BMPRII mrna was expressed more in COCs from large antral follicles than in their respective granulosa/theca cells. In the in vitro culture, 50 ng/ml BMP- 15 positively influenced antral cavity formation and follicle growth after 18 days, and it also maintained follicular integrity. In conclusion, BMPRIB and BMPRII mrnas are present in all follicular categories. BMP-15 (50 ng/ml) stimulates growth, antrum formation, as well as ultrastructural integrity of isolated caprine preantral follicles after 18 days of culture. Keywords: BMP-15 receptors, BMP-15, culture, follicle growth, caprine.
164 Introduction Ovarian follicular development in large domestic animals is a long and intricate process ultimately resulting in the ovulation of a subset of one or more oocytes that are potentially competent to support fertilization and embryonic development. Since ovulation rate and oocyte quality can be important determinants of reproductive efficiency, we need to understand the regulation of follicular growth leading to ovulation (Paradis et al., 2009). Several members of the transforming growth factor- (TGF- ) superfamily are involved in the signaling pathways that regulate ovarian follicular growth until the ovulatory stage. Among these members, bone morphogenetic protein-15 (BMP-15), also known as growth differentiation factor-9b (GDF-9B), has demonstrated a key role in the control of ovarian function and female fertility (Otsuka, 2010; Paulini and Melo, 2011). In all species studied to date, the ovary is the major site of BMP-15 production (Peng et al., 2009). BMP-15 mrna and/or protein have been detected in oocytes from primordial follicles onward in marsupials (Eckery et al., 2002), sheep (Mery et al., 2007), goats (Silva et al., 2004; Celestino et al., 2011), pigs (Sun et al., 2010) and humans (Margulis et al., 2009; Sun et al., 2010). In rodents, however, the expression of BMP-15 has been observed in the oocyte only from the primary follicles onward (Laitinen et al., 1998; Jaatinen et al., 1999). After being synthesized, BMP-15 binds to a type I receptor [BMP type-ib receptor (BMPRIB) or activin receptor-like kinase 6 (ALK-6)], and to a type II receptor [BMP type-ii receptor (BMPRII)] on the surface of the cell (Moore et al., 2003). Both type I and type II receptors are structurally similar, each comprising an extracellular domain (ECD), a single transmembrane domain, and a large intracellular serine/threonine kinase domain (Allendorph et al., 2006; Otsuka, 2010). BMP-15 binds with high affinity to BMPRIB and with low affinity to BMPRII. However, if BMPRII is overexpressed together with BMPRIB, the affinity of BMP-15 for BMPRII is dramatically increased (Gilboa et al., 2000). These data suggest that BMPRII and BMPRIB act together to form a high-affinity complex for BMP-15 (Nohe et al., 2002; Souza et al., 2007). Alternatively, BMP-15 has been proposed to bind first to BMPRIB, followed by the recruitment of BMPRII (Nohe et al., 2002; Shimasaki et al., 2004). The activated BMPRIB, in turn, phosphorylates one or more cytoplasmic signaling intermediates, known as Smads 1/5/8, responsible for promoting BMP-15 signaling (Moore et al., 2003; Shimasaki et al., 2004).
165 165 In the ovary, the expression of BMPRIB and BMPRII mrna has been reported in various follicle stages of rats (Shimasaki et al., 1999), cattle (Jayawardana et al., 2006), goats (Silva et al., 2004) and sheep (Chen et al., 2009), mainly in the granulosa cell compartment. Nevertheless, in goats, the quantification of the levels of BMPRIB and BMPRII mrna during the different stages of follicle development has not yet been performed. The principal activities of BMP-15 during folliculogenesis include the potent stimulation of granulosa cell mitosis and the inhibition of follicle-stimulating hormone (FSH) receptor expression (Otsuka et al., 2001; Moore et al., 2003). BMP-15 also stimulates cumulus expansion (Yoshino et al., 2006) and the expression of kit ligand (KL) in the granulosa cells, a factor known to be essential for early folliculogenesis (Otsuka and Shimasaki, 2002). Both in vivo and in vitro studies have revealed an important role for BMP- 15 in regulating ovulation rate and oocyte quality (Galloway et al., 2000; Hanrahan et al., 2004; Wu et al., 2007). In addition, researchers have observed that the deletion of the BMP-15 gene causes infertility in sheep, with a blockage of folliculogenesis at the primary follicle stage (Galloway et al., 2000; Galloway et al., 2002), suggesting the pivotal role of this factor in sheep follicle development. However, in caprine species, the influence of BMP-15 during folliculogenesis is not well known. Furthermore, in this species, only information concerning the role of BMP-15 during the in vitro development of primordial follicles is available (Celestino et al., 2011). Therefore, studies of its effects on the large preantral follicles and their oocytes are lacking. The aims of the present study have thus been (1) to investigate the levels of BMPRIB and BMPRII mrna during the different follicular stages in goat ovaries, and (2) to evaluate the effects of various BMP-15 concentrations on the survival and development of isolated caprine preantral follicles after in vitro culture and on the ability of oocytes to undergo meiotic resumption. 2. Materials and methods This work was divided into two experiments: the quantification of BMPRIB and BMPRII mrna in goat ovaries (Experiment 1), and the in vitro culture of caprine preantral follicles in medium supplemented with BMP-15 at various concentrations (10, 50 or 100
166 166 ng/ml) (Experiment 2). The BMP-15 concentrations were chosen based on previous studies conducted in our laboratory (Celestino et al., 2011) Chemicals Recombinant human BMP-15 was purchased from R&D Systems (Minneapolis, MN, USA). The culture media and other chemicals used in the present study were purchased from Sigma Chemical Co. (St. Louis, MO, USA), unless mentioned otherwise Source of ovaries Ovaries (n = 74) were collected from adult mixed-breed goats (Capra hircus) from a local slaughterhouse. Collections occurred on 8 different days during the non-rainy breading season (4 days per experiment). Some of the ovaries (n=26) were used in Experiment 1, whereas the remainder (n=48) were used in Experiment 2. Notably, follicles isolated from each ovarian pair were randomly distributed into the groups/treatments, avoiding possible individual effects (such as an influence of endogenous hormones). Immediately after slaughter, ovaries were washed in 70% alcohol for 10 seconds, followed by two washes in Minimum Essential Medium (MEM) buffered with HEPES (MEM-HEPES) and supplemented with penicillin (100 µg/ml) and streptomycin (100 µg/ml). The ovaries were transported at 4 C to the laboratory within one hour (Chaves et al., 2008) Experiment 1: Levels of BMPRIB and BMPRII mrna in goat ovarian follicles Ten ovaries were used for the mechanical isolation of primordial, primary and secondary follicles. From the other ovarian samples (n=16), the COCs and mural cells (granulosa and theca cells) were collected from small (1 3 mm) and large (3 6 mm) antral follicles. Primordial and primary follicles were isolated by using a previously described mechanical procedure (Lucci et al., 1999), whereas secondary follicles ( 150 µm) were microdissected from the ovarian cortex. After isolation, these follicles were washed in MEM- HEPES, placed by category into separate Eppendorf tubes in groups of 10 and stored at -80 C until the RNA was extracted. From the second group of ovaries, the COCs were aspirated from the small and large antral follicles, and selected from the follicle content as described by
167 167 van Tol and Bevers (1998). Thereafter, groups of 10 COCs were stored at -80 C until RNA extraction. To collect the mural granulosa and theca cell complexes, the small (n=10) and large antral follicles (n=10) were isolated from the ovaries. The follicles were then bisected, and mural granulosa/theca cells were collected and stored at -80 C. Isolation of total RNA was performed by using the Trizol Plus purification kit (Invitrogen, São Paulo, Brazil), according to the manufacturer s instructions. After isolation, eluted RNA samples were incubated for 5 minutes at 70 C and then chilled on ice. Reverse transcription was performed in a total volume of 20 µl, which comprised of 10 µl of sample RNA, 4 µl 5X reverse transcriptase buffer (Invitrogen), 8 U RNAse-out, 150 U Superscript III reverse transcriptase, U random primers (Invitrogen), 10 mm dithiothreitole and 0.5 mm each dntp. The mixture was incubated for one hour at 42 C, for 5 minutes at 80 C, and then stored at -20 C. Negative controls were prepared by using the same conditions but without the inclusion of the reverse transcriptase enzyme. Quantification of BMPRIB and BMPRII mrna was performed with SYBR Green. Real-time polymerase chain reactions (PCRs) contained 1 µl cdna as a template in 7.5 µl of SYBR Green Master Mix (PE Applied Biosystems, Foster City, CA), 5.5 µl of ultra-pure water and 0.5 µm of each primer. Primers were designed to amplify BMPRIB and BMPRII mrna. Beta-actin and β-tubulin (Table 1) were used as endogenous controls for the normalization of the mrna levels. The thermal cycling profile for the first round of real-time PCR was as follows: initial denaturation and activation of the polymerase for 15 minutes at 94 C, followed by 40 cycles of 15 seconds at 94 C, 30 seconds at 60 C, and 45 seconds at 72 C. The final extension was for 10 minutes at 72 C. All reactions were performed in a realtime PCR Mastercycler (Eppendorf, Germany). The delta-delta-ct method and the genorm software program were used to transform CT values into the normalized relative mrna levels.
168 168 Table 1 Oligonucleotide primers used for real-time PCR analysis of goat cells. Target gene Primer sequence (5 3 ) Sense Position GenBank accession nº β-actin ACCACTGGCATTGTCATGGACTCT s GI: (2003) TCCTTGATGTCACGGACGATTTCC as Capra hircus β-tubulin TTCATTGGCAACAGCACAGCCA s GI: (2007) TCGTTCATGTTGCTCTCAGCCT as Bos taurus BMPRIB TTTGGATGGGAAAGTGGCGT s GI: (2009) TGCAGCAATGAAGCCCAAGA as Capra hircus BMPRII TGTGCCAAAGATTGGCCCTT s TGCTTGCTGCCGTTCATAGT as GI: (2009) Bos taurus s, sense; as, antisense Experiment 2: Culture of caprine preantral follicles with BMP Preantral follicle isolation and selection In the laboratory, goat ovaries (n=48) were sliced (1 2 mm in thickness) by using a surgical blade. Next, the ovarian cortex slices were manually dissected in HEPES-buffered MEM by using 26-G needles for isolation of caprine preantral follicles 150 µm in diameter under a stereomicroscope (SMZ 645 Nikon, Tokyo, Japan). After isolation, follicles with a visible oocyte (approximately 60 µm in diameter) surrounded by granulosa cells, an intact basement membrane and no antral cavity were selected for culture In vitro culture After selection, the follicles were individually cultured in 100 µl drops of culture medium in Petri dishes (60 x 15 mm, Corning, USA) under mineral oil for 18 days at 39 C and 5% CO 2 in air. The basic culture medium consisted of α-mem (ph ; 301
169 169 mosm/kg) supplemented with 3 mg/ml bovine serum albumin (BSA), ITS (10 µg/ml insulin, 5.5 µg/ml transferrin and 5 ng/ml selenium), 2 mm glutamine, 2 mm hypoxanthine and 50 μg/ml ascorbic acid in the absence (control) or presence of BMP-15 at 10 ng/ml (BMP-15 [10]), 50 ng/ml (BMP-15 [50]) or 100 ng/ml (BMP-15 [100]). Every other day, 60 µl of the culture media was replaced with fresh medium in each drop. The culture was replicated four times, with 42 follicles being used for each treatment (approximately 10 follicles/replicate) Morphological evaluation of follicular development Follicles were classified according to their morphological aspect, and only those showing an intact basement membrane, bright and homogeneous granulosa cells and an absence of morphological signs of degeneration (e.g., darkness of the oocytes and surrounding cumulus cells or misshapen oocytes) were classified as surviving follicles. Follicular diameter was measured only in surviving follicles every six days of culture (days 0, 6, 12 and 18) by mean of two perpendicular measurements of each follicle by using an ocular micrometer (100 x magnification) inserted into a stereomicroscope (SMZ 645 Nikon, Tokyo, Japan). Antral cavity formation was defined as the occurrence of a visible translucent cavity within the granulosa cell layers. With regard to follicular growth, the daily increase in follicular diameter was calculated as follows: the final diameter of the surviving follicles minus the initial diameter of the surviving follicles (at day 0) divided by the number of days in culture In vitro maturation (IVM) of caprine oocytes from in vitro cultured preantral follicles At the end of the culture period, the oocytes were recovered from follicles by using 26-G needles, washed with TCM199 medium buffered with HEPES (TCM199-HEPES) and measured including the zona pellucida, as described for the follicles. Notably, only oocytes 110 µm (Crozet et al., 2000), with a homogeneous cytoplasm and surrounded by at least one compact layer of cumulus cells, were selected for the maturation procedures. The recovery rate was calculated by dividing the number of recovered oocytes 110 µm by the number of follicles cultured in each treatment and multiplying this number by 100. The selected cumulus-oocyte complexes were washed in maturation medium composed of TCM199 supplemented with 0.5 µg/ml recombinant FSH (rfsh), 5 µg/ml luteinizing hormone, 1
170 170 µg/ml 17β-estradiol, 10 ng/ml recombinant epidermal growth factor (regf), mmol/l pyruvate, 100 µmol/l cysteamine, 50 ng/ml recombinant insulin-like growth factor I (rigf- I) and 1% BSA. The oocytes were grouped into various treatments and were cultured in 100 µl drops of medium on culture dishes (30 x 15 mm) under mineral oil for 40 hours in an incubator at 39 C with 5% CO 2 in air Assessment of oocyte viability and chromatin configuration Fluorescence microscopy was used to analyze the viability of oocytes isolated from the caprine preantral follicles after 18 days of culture. Briefly, the oocytes were incubated in 100 µl drops of phosphate buffered saline (PBS) supplemented with 4 µm calcein-am, 2 µm ethidium homodimer-1 (Molecular Probes, Invitrogen, Karlsruhe, Germany) and 10 µm Hoechst (Sigma, Deisenhofen, Germany) at 37 C for 15 minutes. After incubation, the oocytes were washed with TCM199-HEPES and evaluated under a fluorescence microscope (Nikon, Eclipse 80i, Tokyo, Japan). Oocytes were considered to be alive if the cytoplasm was stained positively with calcein-am (green) and if the chromatin was not labeled with ethidium homodimer-1 (red). Hoechst was used to analyze the oocyte chromatin configuration by observing the intact germinal vesicle (GV) and meiotic resumption (including germinal vesicle breakdown [GVBD], metaphase I [MI], anaphase I [AI], telophase I [TI], and metaphase II [MII]) Ultrastructural analysis of caprine follicles To improve the examination of follicular morphology, transmission electron microscopy (TEM) was performed to analyze the ultrastructure of preantral follicles grown in vivo (fresh control), follicles cultured in control medium, and follicles cultured in the treatments that provided the best results regarding the in vitro culture parameters. Isolated follicles were fixed in Karnovsky solution (4% paraformaldehyde and 2.5% glutaraldehyde in 0.1 M sodium cacodylate buffer, ph 7.2) for at least three hours at room temperature (approximately 25 C). After fixation, cultured follicles were embedded in drops of 4% low melting agarose, and kept in a sodium cacodylate buffer. Specimens were post-fixed in 1% osmium tetroxide, 0.8% potassium ferricyanide and 5 mm calcium chloride in 0.1 M sodium cacodylate buffer for one hour at room temperature, washed in sodium cacodylate buffer and
171 171 counterstained with 5% uranyl acetate. The samples were then dehydrated through a gradient of acetone solutions and embedded in epoxy resin (Epoxy-Embedding Kit, Fluka Chemika- BioChemika). Thereafter, semi-thin sections (1 µm) were cut, stained with toluidine blue and analyzed by light microscopy at a 400 magnification. Ultra-thin sections (60 70 nm) were obtained from preantral follicles classified as morphologically normal in semi-thin sections. Subsequently, the ultra-thin sections were contrasted with uranyl acetate and lead citrate, and examined under a Morgani-FEI transmission electron microscope operating at 80 kv Statistical Analysis Data referring to BMPRIB and BMPRII mrna expression in primordial, primary and secondary follicles were analyzed by using the Kruskal-Wallis test (SAS, 2002), whereas the t-test was used for paired comparisons of mrna expression in the small and large antral follicles (P<0.05). The data on follicular survival, fully grown oocytes, antrum formation and meiotic resumption after in vitro culture were analyzed as dispersion of frequency, expressed in percentages and compared by using the Chi-square test. Continuous variables, such as follicle diameters and daily growth rate, were initially tested to confirm a normal distribution and homoscedasticity. Since daily growth rate had shown both requirements underlying the analysis of variance, this analysis was performed and treatments were compared by using the Student Newman Keuls (SNK) test. Follicle diameters after culture did not show homogeneity of variance amongst treatments, even after transformation, and were therefore compared by using the non-parametric Kruskal-Wallis test (SAS, 2002). The results were expressed as the mean values ± standard deviation (SD), and differences were considered to be significant when P< Results 3.1. Experiment 1: Levels of BMPRIB and BMPRII mrna in goat ovarian follicles The mrna expression levels of the BMP-15 receptors (BMPRIB and BMPRII) were quantified in goat follicles at the different developmental stages by real-time PCR. During the
172 172 transition from the primordial to the secondary follicle stage, no significant differences were observed in the levels of BMPRIB mrna (P>0.05; Fig. 1a). On the other hand, the expression levels of the BMPRII mrna significantly decreased from primary to secondary follicles (P<0.05), although no significant differences were identified between these two follicle stages and primordial follicles (P>0.05; Fig. 2a). When the levels of BMPRIB and BMPRII mrna were compared between the cumulus oocyte complexes (COCs) collected from the small and large antral follicles, no significant differences were verified (P>0.05; Figs. 1b and 2b). A higher level of BMPRIB mrna was observed in the granulosa/theca cells from the large antral follicles compared with the small antral follicles (P<0.05; Fig. 1c). On the other hand, no differences were identified between the granulosa/theca cells from the small and large antral follicles for BMPRII mrna (P>0.05; Fig. 2c). Similarly, no significant differences were noted for both BMPRIB and BMPRII mrna levels between the COCs and the granulosa/theca cells from the small antral follicles (P>0.05; Figs. 1d and 2d). In the large antral follicles, BMPRIB mrna levels from the COCs were similar to those from the granulosa/theca cells (P>0.05; Fig. 1e). Nevertheless, the COCs collected from the large antral follicles showed higher expression levels of BMPRII mrna compared with their respective granulosa/theca cells (P<0.05; Fig. 2e).
173 173 Fig. 1 Levels of BMPRIB mrna in goat ovarian follicles (mean ± SD). (a) Primordial, primary, and secondary follicles; (b) COCs from small and large antral follicles; (c) Granulosa/theca cells from small and large antral follicles; (d) COCs and granulosa/theca cells from small antral follicles; and (e) COCs and granulosa/theca cells from large antral follicles. a,b (P<0.05).
174 174 Fig. 2 Levels of BMPRII mrna in goat ovarian follicles (mean ± SD). (a) Primordial, primary, and secondary follicles; (b) COCs from small and large antral follicles; (c) Granulosa/theca cells from small and large antral follicles; (d) COCs and granulosa/theca cells from small antral follicles; and (e) COCs and granulosa/theca cells from large antral follicles. a,b (P<0.05).
175 Experiment 2: Culture of caprine preantral follicles with BMP Effects of BMP-15 on follicular survival and antrum formation Preantral follicles selected for culture had a centrally located oocyte and normal granulosa cells enclosed by an intact basal membrane (Fig. 3a). The effects of various BMP- 15 concentrations (10, 50 and 100 ng/ml) on follicular survival and antral cavity formation were evaluated throughout the in vitro culture period (shown in Fig. 4a, b, respectively). In all treatments, except in the control, follicular survival was maintained up to 6 days of culture when compared with day 0 (P>0.05). After 12 days, only the BMP-15 [50] treatment was able to maintain a rate of follicular survival similar to that on day 0 (P>0.05), with a significant decrease in the percentage of surviving follicles being observed only at day 18 of culture (P<0.05). When the treatments were compared with each other, BMP-15 [50] and BMP-15 [100] showed higher percentages of follicular survival than the control at day 6 of culture (P<0.05). However, no significant differences were observed among treatments from day 12 onward (P>0.05; Fig. 4a). Fig. 3 Stereomicrography of caprine preantral follicles cultured in vitro. (a) Caprine preantral follicles at day 0; (b) Healthy follicle after 6 days of culture, showing an initial antral cavity;
176 176 (c, d) Healthy follicles with well-defined antral cavities after 12 and 18 days of in vitro culture, respectively. Antral follicles were observed as early as day 6 of culture in all treatments (Fig. 3b), with large antral cavities being visualized at days 12 and 18 (Fig. 3c, d). According to Fig. 4b, the rate of antrum formation was significantly increased in the control and BMP-15 [10] from day 6 to day 18 of culture (P<0.05). Compared with the control, BMP-15 [50] was the only treatment that showed higher percentages of antrum formation on all days of culture evaluated (i.e., days 6, 12 and 18) (P<0.05), thus indicating its significant role at this concentration in early antrum formation. Fig. 4 Caprine preantral follicles cultured in vitro for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml). (a) Percentage of follicle survival; (b) Percentage of antrum formation. A,B indicates significant differences among
177 177 treatments within the same day of culture (P<0.05). a,b,c among days of culture within the same treatment (P<0.05). indicates significant differences Follicle growth after in vitro culture with BMP-15 Values related to the follicular diameter during the in vitro culture of isolated caprine preantral follicles are presented in Table 2. A progressive and significant increase in follicular diameter was observed up to day 18 of culture for all BMP-15 concentrations (P<0.05). On the other hand, in the control, a significant increase in follicular growth only occurred until day 12 (P<0.05). When the treatments were compared with each other, only the BMP-15 [50] treatment resulted in larger follicular diameters than those obtained in the control group from day 12 onwards (P<0.05). Nevertheless, at the end of culture, BMP-15 [10] and BMP-15 [50] showed similar values of follicular growth (P>0.05), and both were higher than the control (P>0.05). After 18 days of culture, BMP-15 [50] promoted a greater rate of daily follicular growth compared with the control and the other BMP-15 concentrations (P<0.05; Table 3). Table 2 Follicular diameter (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml). Follicular diameter (µm) Treatments Days of culture Control (n=42) BMP-15 [10] (n=42) BMP-15 [50] (n=42) BMP-15 [100] (n=42) Day ± Ac ± Ad ± Ad ± Ad Day ± Ab ± Ac ± Ac ± Ac Day ± Ba ± ABb ± Ab ± ABb Day ± Ba ± Aa ± Aa ± ABa A,B: indicates significant differences among treatments within the same day of culture (P<0.05); a,b,c,d: indicates significant differences among days of culture within the same treatment (P<0.05)
178 178 Table 3 Daily follicular growth (mean ± SD) of caprine preantral follicles after in vitro culture for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml). Treatments Cultured follicles (n) Daily follicular growth (µm) Control ± 4.48 B BMP-15 [10] ± 6.48 B BMP-15 [50] ± 5.26 A BMP-15 [100] ± 7.08 B A,B: indicates significant differences among treatments within the same culture period (P<0.05) Ability of oocytes grown in vitro to undergo meiotic resumption The percentages of oocytes acceptable for IVM (fully grown oocytes 110 µm; Fig. 5a, b) after 18 days of follicle culture were similar among all treatments (P>0.05), as shown in Table 4. Similarly, oocyte viability evaluated by using the fluorescent markers calcein-am and ethidium homodimer-1 (Fig. 5c, d) indicated no differences among the treatments (P>0.05), which showed high percentages of viable oocytes stained with green fluorescence. The assessment of chromatin configuration showed similar percentages of intact germinal vesicles (Fig. 5e) and meiotic resumption (Fig. 5f-h) in oocytes grown from follicles cultured under all treatments (P>0.05).
179 179 Fig. 5 Fluorescence of oocytes from caprine preantral follicles cultured in vitro for 18 days. (a) Cumulus oocyte complexes (COCs) obtained from grown follicles; (b) Non-stained oocyte (diameter 110 µm) mechanically denuded after maturation; (c) Viable oocyte marked with calcein-am (green fluorescence); (d) Non-viable oocyte marked with ethidium homodimer-1 (red fluorescence); (e) Fully grown oocyte labeled with Hoechst showing an intact nuclear membrane (germinal vesicle stage), (f) Germinal vesicle breakdown, (g) Metaphase I, and (h) Metaphase II.
180 180 Table 4 Meiotic stages of caprine oocytes from preantral follicles cultured for 18 days in the absence (control) or presence of various BMP-15 concentrations (10, 50 or 100 ng/ml). Treatments Cultured follicles (n) Fully grown * (%) Viable oocytes (%) Number of oocytes (%) GV (%) GVBD (%) MI (%) AI (%) TI (%) MII (%) Control 42 31/42 (73.81) 30/31 (96.77) 21/31 (67.74) 7/31 (22.58) 3/31 (9.68) 0/31 (0.00) 0/31 (0.00) 0/31 (0.00) BMP-15 [10] 42 32/42 (76.19) 31/32 (96.87) 22/32 (68.75) 6/32 (18.75) 3/32 (9.38) 0/32 (0.00) 0/32 (0.00) 1/32 (3.12) BMP-15 [50] 42 30/42 (71.43) 28/30 (93.33) 14/30 (46.67) 11/30 (36.67) 5/30 (16.66) 0/30 (0.00) 0/30 (0.00) 0/30 (0.00) BMP-15 [100] 42 29/42 (69.05) 27/29 (93.10) 14/29 (48.28) 10/29 (34.48) 3/29 (10.34) 0/29 (0.00) 0/29 (0.00) 2/29 (6.90) GV: germinal vesicle, GVBD: germinal vesicle breakdown, MI: metaphase I, AI: anaphase I, TI: telophase I, MII: metaphase II. There was no significant difference among treatments (P>0.05). *Only oocytes 110 µm were selected for the in vitro maturation procedure.
181 Ultrastructural features of caprine follicles Follicles from the fresh control (Fig. 6a, b) showed a normal profile, with granulosa cells, antrum, zona pellucida and typical oocyte. Cytoplasm of the oocyte contained mitochondria with visible cristae; a few mitochondria presented a swollen profile. A paucity of lipid droplets and vacuoles were observed, and cortical granules were also detectable. Some ribosomes were present, scattered through the cytoplasm or at the endoplasmic reticulum, which displayed normal cisternae. After treatment with BMP-15 [50], the follicles maintained their morphology (Fig. 6c, d). The basement membrane was intact (not shown) and granulosa cells were present with normal organelles and regular chromatin. The zona pellucida was preserved, and microvilli were evident. The oocyte was of the regular size, and the nucleus was visible with no alterations. At a higher magnification, the mitochondria showed no swelling, and the cortical granules were large (Fig. 6d). The morphological characteristics of these organelles were related to better oocyte quality, a swollen mitochondria suggesting cellular stress and cortical granules being important during fertilization (van den Hurk et al., 1998; Velilla et al., 2004). In general, structures in the follicles following BMP-15 [50] treatment presented morphological characteristics similar to those of the fresh control. In contrast, follicles cultured in control medium (ie, α-mem + without BMP-15) exhibited typical features of cellular stress: swollen mitochondria and endoplasmic reticulum, and mitochondria with no visible cristae (Fig. 6e, f). Other organelles, such as the nucleolus, cortical granules and Golgi apparatus (data not shown) presented unchanged morphology.
182 182 Fig. 6 TEM micrographs of follicles. (a, b) Follicles from the fresh control showing normal ultrastructure, with a regular zona pellucida, cytoplasm and nucleus. (c, d) Follicles cultured in the BMP-15 [50] treatment for 18 days showing ultrastructure similar to the fresh control. (e, f) Follicles cultured in the control medium (α-mem + without BMP-15) for 18 days, exhibiting some features of cellular stress. n: nucleus; nu: nucleolus; m: mitochondria; ri: ribosome; r: endoplasmic reticulum; cg: cortical granule; zp: zona pellucida; v: vacuoles; l: lipid droplets. Magnifications: 4.400x (a, c, e) and x (b, d, f); bars: 5 µm (a, c, e) and 1 µm (b, d, f).
EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS
 1 EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS EFFECT OF TYPE OF CULTURE SYSTEM ON THE IN VITRO DEVELOPMENT OF ISOLATED CAPRINE PREANTRAL
1 EFEITO DO TIPO DE SISTEMAS DE CULTIVO NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS ISOLADOS EFFECT OF TYPE OF CULTURE SYSTEM ON THE IN VITRO DEVELOPMENT OF ISOLATED CAPRINE PREANTRAL
GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS. Profª Msc. Tatiane da Silva Poló
 GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS Profª Msc. Tatiane da Silva Poló ou OOGÊNESE ou OVULOGÊNESE e FOLICULOGÊNESE DEFINIÇÃO OVOGÊNESE: É uma sequência de eventos através dos quais as células germinativas
GAMETOGÊNESE DIFERENCIAÇÃO DOS GAMETAS Profª Msc. Tatiane da Silva Poló ou OOGÊNESE ou OVULOGÊNESE e FOLICULOGÊNESE DEFINIÇÃO OVOGÊNESE: É uma sequência de eventos através dos quais as células germinativas
Competência Oocitária
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Laboratório de Reprodução Animal -EMBRAPA Competência Oocitária Lucas Hax Médico Veterinário Doutorando em Biotecnologia
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Laboratório de Reprodução Animal -EMBRAPA Competência Oocitária Lucas Hax Médico Veterinário Doutorando em Biotecnologia
Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes Lucas Hax e Patrícia Mattei Pelotas, 18 de
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Regulação da foliculogênese e determinação da taxa de ovulação em ruminantes Lucas Hax e Patrícia Mattei Pelotas, 18 de
Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca
 Topicos Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca Fertilizacao e desenvolvimento embrionario Cerebro
Topicos Eixo hipotalamico-hipofisario-gonadal na femea Funcoes dos hormonios Organizacao das gonadas e desenvolvimento folicular Ciclo estral da vaca Fertilizacao e desenvolvimento embrionario Cerebro
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 0 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS JAMILY BEZERRA BRUNO CULTIVO IN VITRO DE FOLÍCULOS
0 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS JAMILY BEZERRA BRUNO CULTIVO IN VITRO DE FOLÍCULOS
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS JULIANA JALES DE HOLLANDA CELESTINO EXPRESSÃO DO RNAm
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS JULIANA JALES DE HOLLANDA CELESTINO EXPRESSÃO DO RNAm
SISTEMA REPRODUTOR FEMININO
 Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR FEMININO Histologia e Embriologia Geral Veterinária Profa. Janaina Serra Azul Monteiro Evangelista SISTEMA REPRODUTOR FEMININO
Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR FEMININO Histologia e Embriologia Geral Veterinária Profa. Janaina Serra Azul Monteiro Evangelista SISTEMA REPRODUTOR FEMININO
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS CLEIDSON MANOEL GOMES DA SILVA UTILIZAÇÃO DO HORMÔNIO
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS CLEIDSON MANOEL GOMES DA SILVA UTILIZAÇÃO DO HORMÔNIO
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS DOUTORADO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS DOUTORADO EM CIÊNCIAS VETERINÁRIAS HUDSON HENRIQUE VIEIRA CORREIA CULTIVO IN VITRO DE OÓCITOS
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS DOUTORADO EM CIÊNCIAS VETERINÁRIAS HUDSON HENRIQUE VIEIRA CORREIA CULTIVO IN VITRO DE OÓCITOS
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Efeito do ácido lisofosfatídico durante a maturação in vitro do complexo cumulus-oócito: expansão do cumulus, metabolismo
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Efeito do ácido lisofosfatídico durante a maturação in vitro do complexo cumulus-oócito: expansão do cumulus, metabolismo
UNIVERSIDADE ESTADUAL DO CEARÁ-UECE FACULDADE DE VETERINÁRIA-FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS- PPGCV
 1 UNIVERSIDADE ESTADUAL DO CEARÁ-UECE FACULDADE DE VETERINÁRIA-FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS- PPGCV PATRÍCIA MAGALHÃES DE ANDRADE EFEITO DOS MEIOS DE CULTIVO DE BASE α-mem E
1 UNIVERSIDADE ESTADUAL DO CEARÁ-UECE FACULDADE DE VETERINÁRIA-FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS- PPGCV PATRÍCIA MAGALHÃES DE ANDRADE EFEITO DOS MEIOS DE CULTIVO DE BASE α-mem E
Bloco X- Testes- Células germinativas
 Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Produção in vitro de embriões
 Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões Vicente
Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões Vicente
Gametogênese ESPERMATOGÊNESE. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas em desenvolvimento.
Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas em desenvolvimento.
Importância dos processos de sinalização. Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases)
 Sinalização celular Importância dos processos de sinalização Seres unicelulares Seres multicelulares Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases) Receptores Proteínas -
Sinalização celular Importância dos processos de sinalização Seres unicelulares Seres multicelulares Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases) Receptores Proteínas -
Aspectos gerais da estrutura celular
 Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Biologia Celular. A Célula. Células 02/23/2008. Membrana Celular. Citoplasma. Eucariotes. Procariotes
 Biologia Celular Células Procariotes Procariotes são organismos unicelulares, presentes em todos os meios ambientes. Constituem o maior grupo de organismos da natureza, principalmente porque as bactérias
Biologia Celular Células Procariotes Procariotes são organismos unicelulares, presentes em todos os meios ambientes. Constituem o maior grupo de organismos da natureza, principalmente porque as bactérias
ALLANA FERREIRA DA COSTA PESSOA
 1 UNIVERSIDADE ESTADUAL DO CEARÁ- UECE PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA- FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS-PPGCV ALLANA FERREIRA DA COSTA PESSOA
1 UNIVERSIDADE ESTADUAL DO CEARÁ- UECE PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA- FAVET PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS-PPGCV ALLANA FERREIRA DA COSTA PESSOA
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS ROBERTA NOGUEIRA CHAVES EFEITO DA TEMPERATURA E DO
1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS ROBERTA NOGUEIRA CHAVES EFEITO DA TEMPERATURA E DO
Produção in vitro de embriões ovinos
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Produção in vitro de embriões ovinos Apresentadores: Mauri Mazurek Rodrigo C. de C. de Azambuja Orientação: Liziane Lemos Viana Small Ruminant Resarch
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Produção in vitro de embriões ovinos Apresentadores: Mauri Mazurek Rodrigo C. de C. de Azambuja Orientação: Liziane Lemos Viana Small Ruminant Resarch
Gametogênese Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado
 Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado A gametogênese é o processo de produção dos gametas, as células reprodutoras. Esta produção ocorre nas gônadas e seu principal evento é a meiose, responsável
Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado A gametogênese é o processo de produção dos gametas, as células reprodutoras. Esta produção ocorre nas gônadas e seu principal evento é a meiose, responsável
CAMILA BIZARRO DA SILVA
 CENTRO DE PESQUISA EM CIÊNCIAS AGRÁRIAS MESTRADO EM SAÚDE E PRODUÇÃO DE RUMINANTES CAMILA BIZARRO DA SILVA EFEITO DE DIFERENTES CONCENTRAÇÕES DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NO SISTEMA DE CULTIVO
CENTRO DE PESQUISA EM CIÊNCIAS AGRÁRIAS MESTRADO EM SAÚDE E PRODUÇÃO DE RUMINANTES CAMILA BIZARRO DA SILVA EFEITO DE DIFERENTES CONCENTRAÇÕES DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NO SISTEMA DE CULTIVO
O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50
 O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50 Sistema reprodutor feminino Ovários = produz óvulos Tubas uterinas = transportam e protegem os óvulos Útero = prove meio adequado
O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50 Sistema reprodutor feminino Ovários = produz óvulos Tubas uterinas = transportam e protegem os óvulos Útero = prove meio adequado
SANELY LOURENÇO DA COSTA CALIMAN
 SANELY LOURENÇO DA COSTA CALIMAN hfsh, T4 E IGF-I NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS Tese apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa
SANELY LOURENÇO DA COSTA CALIMAN hfsh, T4 E IGF-I NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS Tese apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa
Expressão Gênica em Oócitos e Embriões
 Universidade Federal de Pelotas Graduação em Biotecnologias Manipulação de Gametas e Embriões Expressão Gênica em Oócitos e Embriões Prof. Tiago Collares Prof a. Priscila M. M. de Leon Janeiro, 2013 Análise
Universidade Federal de Pelotas Graduação em Biotecnologias Manipulação de Gametas e Embriões Expressão Gênica em Oócitos e Embriões Prof. Tiago Collares Prof a. Priscila M. M. de Leon Janeiro, 2013 Análise
VALDEVANE ROCHA ARAÚJO INFLUÊNCIA DA PROTEÍNA MORFOGENÉTICA ÓSSEA-7 (BMP-7) SOBRE O DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ- ANTRAIS CAPRINOS
 VALDEVANE ROCHA ARAÚJO INFLUÊNCIA DA PROTEÍNA MORFOGENÉTICA ÓSSEA-7 (BMP-7) SOBRE O DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ- ANTRAIS CAPRINOS FORTALEZA-CE 2008 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA
VALDEVANE ROCHA ARAÚJO INFLUÊNCIA DA PROTEÍNA MORFOGENÉTICA ÓSSEA-7 (BMP-7) SOBRE O DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ- ANTRAIS CAPRINOS FORTALEZA-CE 2008 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA
Fases do ciclo celular O ciclo celular dos eucariotos está dividido em quatro fases separadas: M, G 1
 CICLO CELULAR A vida das células é formada por dois períodos: INTÉRFASE: inicia no fim da mitose e estende até iniciar a próxima mitose. MITOSE: Reprodução celular, com as seguintes finalidades: Nos unicelulares:
CICLO CELULAR A vida das células é formada por dois períodos: INTÉRFASE: inicia no fim da mitose e estende até iniciar a próxima mitose. MITOSE: Reprodução celular, com as seguintes finalidades: Nos unicelulares:
benefícios oriundos de uma melhor compreensão do desenvolvimento folicular para a melhoria da eficiência reprodutiva dos caprinos também são
 1. INTRODUÇÃO Os caprinos são considerados animais economicamente atrativos por serem importantes fontes de carne, leite e pele. Além de estarem presentes em todos os continentes, no Brasil, eles desempenham
1. INTRODUÇÃO Os caprinos são considerados animais economicamente atrativos por serem importantes fontes de carne, leite e pele. Além de estarem presentes em todos os continentes, no Brasil, eles desempenham
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL CURSO DE MEDICINA PROGRAMA DE PÓS GRADUAÇÃO EM BIOTECNOLOGIA PPGB REGISLANE PINTO RIBEIRO
 UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL CURSO DE MEDICINA PROGRAMA DE PÓS GRADUAÇÃO EM BIOTECNOLOGIA PPGB REGISLANE PINTO RIBEIRO EFEITO DA LECTINA JACALINA (Artocarpus integrifolia) SOBRE A SOBREVIVÊNCIA
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL CURSO DE MEDICINA PROGRAMA DE PÓS GRADUAÇÃO EM BIOTECNOLOGIA PPGB REGISLANE PINTO RIBEIRO EFEITO DA LECTINA JACALINA (Artocarpus integrifolia) SOBRE A SOBREVIVÊNCIA
REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACAS: UM ESTUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULAS DA GRANULOSA
 REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACA: UM ETUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULA DA GRANULOA Douglas Peraoli & Francielle Bado Augusto chneider FI: 3.300
REGULAÇÃO DA PRODUÇÃO DO HORMÔNIO ANTI- MÜLLERIANO EM VACA: UM ETUDO COMPARATIVO EM NÍVEL ENDÓCRINO, OVARIANO, FOLÍCULAR E DE CÉLULA DA GRANULOA Douglas Peraoli & Francielle Bado Augusto chneider FI: 3.300
hormônios do sistema genital masculino gônadas masculinas
 Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS - GRADUAÇÃO EM BIOTECNOLOGIA - PPGB GISVANI LOPES DE VASCONCELOS
 UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS - GRADUAÇÃO EM BIOTECNOLOGIA - PPGB GISVANI LOPES DE VASCONCELOS EFEITOS DO FATOR DE CRESCIMENTO E DIFERENCIAÇÃO-9 E DO
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS - GRADUAÇÃO EM BIOTECNOLOGIA - PPGB GISVANI LOPES DE VASCONCELOS EFEITOS DO FATOR DE CRESCIMENTO E DIFERENCIAÇÃO-9 E DO
BIOLOGIA. Moléculas, Células e Tecidos Gametogênese. Prof. Daniele Duó
 BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
Reparação. Regeneração Tecidual 30/06/2010. Controlada por fatores bioquímicos Liberada em resposta a lesão celular, necrose ou trauma mecânico
 UNIVERSIDADE FEDERAL DO PARANÁ COORDENAÇÃO DO CURSO DE MEDICINA VETERINÁRIA DISCIPLINA DE PATOLOGIA VETERINÁRIA Reparação Prof. Raimundo Tostes Reparação Regeneração: reposição de um grupo de células destruídas
UNIVERSIDADE FEDERAL DO PARANÁ COORDENAÇÃO DO CURSO DE MEDICINA VETERINÁRIA DISCIPLINA DE PATOLOGIA VETERINÁRIA Reparação Prof. Raimundo Tostes Reparação Regeneração: reposição de um grupo de células destruídas
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS GRADUAÇÃO EM BIOTECNOLOGIA ISANA MARA ARAGÃO FROTA
 UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS GRADUAÇÃO EM BIOTECNOLOGIA ISANA MARA ARAGÃO FROTA ESTABILIDADE DE GENES DE REFERÊNCIA E INFLUÊNCIA DAS PROTEÍNAS MORFOGENÉTICAS
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS GRADUAÇÃO EM BIOTECNOLOGIA ISANA MARA ARAGÃO FROTA ESTABILIDADE DE GENES DE REFERÊNCIA E INFLUÊNCIA DAS PROTEÍNAS MORFOGENÉTICAS
UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL. Luciana da Paz dos Santos
 1 UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL Luciana da Paz dos Santos IMUNOLOCALIZAÇÃO DO FATOR DE CRESCIMENTO EPIDERMAL (EGF) EM OVÁRIOS OVINOS E SEU EFEITO
1 UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL Luciana da Paz dos Santos IMUNOLOCALIZAÇÃO DO FATOR DE CRESCIMENTO EPIDERMAL (EGF) EM OVÁRIOS OVINOS E SEU EFEITO
Olfato e visão. Dependem de GPCRs!!
 Sinalização celular Olfato e visão Dependem de GPCRs!! Olfato e Visão Dependem de GPCRs que regulam canais iônicos controlados por AMPc/GMPc Humanos: distinguem ~350 grupos odorantes (sinais) Detecção
Sinalização celular Olfato e visão Dependem de GPCRs!! Olfato e Visão Dependem de GPCRs que regulam canais iônicos controlados por AMPc/GMPc Humanos: distinguem ~350 grupos odorantes (sinais) Detecção
Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras
 Sinalização celular Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras Etapas da Sinalização 1) Síntese e liberação da molécula sinalizadora pela célula sinalizadora
Sinalização celular Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras Etapas da Sinalização 1) Síntese e liberação da molécula sinalizadora pela célula sinalizadora
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR. Sinalização Celular SALVADOR - BA 2016
 UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
Gametogênese ESPERMATOGÊNESE. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese Embrião final 3ªsemana CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas
Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese Embrião final 3ªsemana CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS REBECA MAGALHÃES PEDROSA ROCHA EFEITO DA MELATONINA E
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS REBECA MAGALHÃES PEDROSA ROCHA EFEITO DA MELATONINA E
INFLUÊNCIA DA ORIGEM E PUREZA DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NA SOBREVIVÊNCIA E NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS
 INFLUÊNCIA DA ORIGEM E PUREZA DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NA SOBREVIVÊNCIA E NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS 1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO
INFLUÊNCIA DA ORIGEM E PUREZA DO HORMÔNIO FOLÍCULO ESTIMULANTE (FSH) NA SOBREVIVÊNCIA E NO DESENVOLVIMENTO IN VITRO DE FOLÍCULOS PRÉ-ANTRAIS CAPRINOS 1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO
ENGENHARIA TECIDUAL. Prof. Flávio F. Demarco
 ENGENHARIA TECIDUAL Prof. Flávio F. Demarco Nor, 2006 ENGENHARIA TECIDUAL Fatores morfogênicos (fatores de crescimento) Definição Fatores de crescimento são proteínas solúveis que atuam como agentes de
ENGENHARIA TECIDUAL Prof. Flávio F. Demarco Nor, 2006 ENGENHARIA TECIDUAL Fatores morfogênicos (fatores de crescimento) Definição Fatores de crescimento são proteínas solúveis que atuam como agentes de
Painel temático. Pelotas, 28 de setembro de 2017
 Painel temático Pelotas, 28 de setembro de 2017 Universidade Federal de Pelotas Faculdade De Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária www.ufpel.edu.br/nupeec Painel temático Efeitos
Painel temático Pelotas, 28 de setembro de 2017 Universidade Federal de Pelotas Faculdade De Veterinária Núcleo de Pesquisa, Ensino e Extensão em Pecuária www.ufpel.edu.br/nupeec Painel temático Efeitos
NUPEEC. Núcleo de Pesquisa, Ensino e Extensão em Pecuária
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Fatores Parácrinos, Autócrinos e Endócrinos que Mediam a Influência da Nutrição na Reprodução em Bovinos e Suínos Journal of Animal Science 1996
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária Fatores Parácrinos, Autócrinos e Endócrinos que Mediam a Influência da Nutrição na Reprodução em Bovinos e Suínos Journal of Animal Science 1996
Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente desenvolvimento folicular em fetos de ovelhas
 Universidade Federal de Pelotas Faculdade de Veterinária Núcleo de Pesquisa Ensino e Extensão em Pecuária Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente
Universidade Federal de Pelotas Faculdade de Veterinária Núcleo de Pesquisa Ensino e Extensão em Pecuária Efeito da desnutrição materna durante a gestação no desenvolvimento ovariano inicial e subsequente
Aparelho Reprodutor Feminino
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho Reprodutor Feminino Prof. Msc. Macks Wendhell Gonçalves mackswenedhell@gmail.com É formado por: Parte interna: - Dois ovários
Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho Reprodutor Feminino Prof. Msc. Macks Wendhell Gonçalves mackswenedhell@gmail.com É formado por: Parte interna: - Dois ovários
Fisiologia da Reprodução
 Texto de Referência Fisiologia da Reprodução Conhecimentos de anatomia e fisiologia são imprescindíveis para o Médico Veterinário que pretende trabalhar de forma correta e tirar o máximo proveito da técnica
Texto de Referência Fisiologia da Reprodução Conhecimentos de anatomia e fisiologia são imprescindíveis para o Médico Veterinário que pretende trabalhar de forma correta e tirar o máximo proveito da técnica
Avanços, aplicações, limitações e perspectivas da tecnologia do ovário artificial de ruminantes
 Anais do IX Congresso Norte e Nordeste de Reprodução Animal (CONERA 2018); Belém, PA, 10 a 12 de setembro de 2018. Avanços, aplicações, limitações e perspectivas da tecnologia do ovário artificial de ruminantes
Anais do IX Congresso Norte e Nordeste de Reprodução Animal (CONERA 2018); Belém, PA, 10 a 12 de setembro de 2018. Avanços, aplicações, limitações e perspectivas da tecnologia do ovário artificial de ruminantes
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS LARITZA FERREIRA DE LIMA UTILIZAÇÃO DO HORMÔNIO FOLÍCULO
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS LARITZA FERREIRA DE LIMA UTILIZAÇÃO DO HORMÔNIO FOLÍCULO
Coleta, Classificação e Maturação in vitrode Oócitos
 Universidade Federal de Pelotas Graduação em Biotecnologias Disciplina de Manipulação de Gametas e Embriões 2ª Aula: Coleta, Classificação e Maturação in vitrode Oócitos Priscila M. M. de Leon Doutoranda
Universidade Federal de Pelotas Graduação em Biotecnologias Disciplina de Manipulação de Gametas e Embriões 2ª Aula: Coleta, Classificação e Maturação in vitrode Oócitos Priscila M. M. de Leon Doutoranda
Gametogênese Ovogênese. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese Ovogênese Prof a. Marta G. Amaral, Dra. Embriologia molecular Cél germinativa primordial (CGP) CGP Oogônias Inicia antes do nascimento Depois entra em repouso Na puberdade termina a diferenciação
Gametogênese Ovogênese Prof a. Marta G. Amaral, Dra. Embriologia molecular Cél germinativa primordial (CGP) CGP Oogônias Inicia antes do nascimento Depois entra em repouso Na puberdade termina a diferenciação
HORMÔNIOS VEGETAIS. Katia Christina Zuffellato-Ribas
 HORMÔNIOS VEGETAIS Katia Christina Zuffellato-Ribas HORMÔNIO VEGETAL COMPOSTO ORGÂNICO, NÃO NUTRIENTE, DE OCORRÊNCIA NATURAL, PRODUZIDO NA PLANTA, O QUAL, EM BAIXAS CONCENTRAÇÕES (10-4 A 10-6 M), PROMOVE,
HORMÔNIOS VEGETAIS Katia Christina Zuffellato-Ribas HORMÔNIO VEGETAL COMPOSTO ORGÂNICO, NÃO NUTRIENTE, DE OCORRÊNCIA NATURAL, PRODUZIDO NA PLANTA, O QUAL, EM BAIXAS CONCENTRAÇÕES (10-4 A 10-6 M), PROMOVE,
Mutações no gene STAT5A estão associadas com a sobrevivência embrionária e produção de leite
 UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE VETERINÁRIA Núcleo de Pesquisa, Ensino e Extensão em Pecuária Mutações no gene STAT5A estão associadas com a sobrevivência embrionária e produção de leite Apresentação:
UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE VETERINÁRIA Núcleo de Pesquisa, Ensino e Extensão em Pecuária Mutações no gene STAT5A estão associadas com a sobrevivência embrionária e produção de leite Apresentação:
ENDOCRINOLOGIA DA REPRODUÇÃO. Elisângela Mirapalheta Madeira Medica Veterinária, MC
 ENDOCRINOLOGIA DA REPRODUÇÃO Elisângela Mirapalheta Madeira Medica Veterinária, MC Introdução Glândulas Endócrinas Hipotálamo Hipófise Gônadas Glândula pineal Glândulas Endócrinas Hipotálamo Glândulas
ENDOCRINOLOGIA DA REPRODUÇÃO Elisângela Mirapalheta Madeira Medica Veterinária, MC Introdução Glândulas Endócrinas Hipotálamo Hipófise Gônadas Glândula pineal Glândulas Endócrinas Hipotálamo Glândulas
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 i UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS FRANCIELE OSMARINI LUNARDI VITRIFICAÇÃO E CULTIVO IN
i UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS FRANCIELE OSMARINI LUNARDI VITRIFICAÇÃO E CULTIVO IN
ENDOCRINOLOGIA REPRODUTIVA. M. V. Doutorando Lucas Balinhas Farias
 ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
Núcleo celular: O centro de comando. Unidade 4 Pág 34
 Núcleo celular: O centro de comando. Unidade 4 Pág 34 NÚCLEO O núcleo é o centro de coordenação das atividades da célula. Em geral há um núcleo por célula; células sem núcleo são apenas uma fase da vida;
Núcleo celular: O centro de comando. Unidade 4 Pág 34 NÚCLEO O núcleo é o centro de coordenação das atividades da célula. Em geral há um núcleo por célula; células sem núcleo são apenas uma fase da vida;
Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal
 Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal Disciplina de Reprodução Humana Departamento de Ginecologia e Obstetrícia FMRP - USP Profa Dra
Ciclo Reprodutivo Feminino Parte I. Embriogênese do aparelho reprodutor feminino e desenvolvimento puberal Disciplina de Reprodução Humana Departamento de Ginecologia e Obstetrícia FMRP - USP Profa Dra
Reprodução. Biologia Ambiental Professora: Keffn Arantes
 Reprodução Biologia Ambiental Professora: Keffn Arantes GAMETAS E FECUNDAÇÃO NOS ANIMAIS *MEIOSE-significa diminuição. *Seres humanos têm 46 cromossomos nas células corporais. *Gametas apresentam
Reprodução Biologia Ambiental Professora: Keffn Arantes GAMETAS E FECUNDAÇÃO NOS ANIMAIS *MEIOSE-significa diminuição. *Seres humanos têm 46 cromossomos nas células corporais. *Gametas apresentam
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS MESTRADO ACADÊMICO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS MESTRADO ACADÊMICO EM CIÊNCIAS VETERINÁRIAS LIVIA BRUNETTI APOLLONI EFEITO DO HORMÔNIO ANDROSTENEDIONA
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS MESTRADO ACADÊMICO EM CIÊNCIAS VETERINÁRIAS LIVIA BRUNETTI APOLLONI EFEITO DO HORMÔNIO ANDROSTENEDIONA
EXPRESSÃO DAS MAPKs EM FOLÍCULOS OVARIANOS E CORPOS LUTEOS EM DIFERENTES FASES DO CICLO ESTRAL DE BOVINOS
 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DAS MAPKs EM FOLÍCULOS OVARIANOS E CORPOS LUTEOS EM DIFERENTES FASES DO CICLO ESTRAL DE BOVINOS
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL EXPRESSÃO DAS MAPKs EM FOLÍCULOS OVARIANOS E CORPOS LUTEOS EM DIFERENTES FASES DO CICLO ESTRAL DE BOVINOS
Determinação do sexo
 Determinação do sexo No reino animal sexo é um dos fenótipos mais visíveis John Wiley & Sons, Inc. Esse dimorfismo, as vezes é determinado por fatores ambientais John Wiley & Sons, Inc. Exemplo Em uma
Determinação do sexo No reino animal sexo é um dos fenótipos mais visíveis John Wiley & Sons, Inc. Esse dimorfismo, as vezes é determinado por fatores ambientais John Wiley & Sons, Inc. Exemplo Em uma
ÍNDICE GERAL ÍNDICE DE FIGURAS ÍNDICE DE TABELAS LISTA DE ABREVIATURAS LISTA DE UNIDADES DE MEDIDAS
 i Pág. ÍNDICE GERAL ÍNDICE DE FIGURAS ÍNDICE DE TABELAS LISTA DE ABREVIATURAS LISTA DE UNIDADES DE MEDIDAS RESUMO ABSTRACT i iii iv vi viii ix xii INTRODUÇÃO 1 1. ENDOMETRIOSE 1.1- Conceito, clínica, epidemiologia,
i Pág. ÍNDICE GERAL ÍNDICE DE FIGURAS ÍNDICE DE TABELAS LISTA DE ABREVIATURAS LISTA DE UNIDADES DE MEDIDAS RESUMO ABSTRACT i iii iv vi viii ix xii INTRODUÇÃO 1 1. ENDOMETRIOSE 1.1- Conceito, clínica, epidemiologia,
O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas
 NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas Apresentadores: Andressa Stein Maffi Mauri Mazurek
NUPEEC Núcleo de Pesquisa, Ensino e Extensão em Pecuária O efeito das taxas de morte embrionária na eficiência de programas de sincronização de cio em vacas Apresentadores: Andressa Stein Maffi Mauri Mazurek
ESTUDO DO DESENVOLVIMENTO FOLICULAR INICIAL E ATRESIA EM OVÁRIOS CAPRINOS
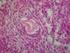 1 Universidade Estadual do Ceará José Roberto Viana Silva ESTUDO DO DESENVOLVIMENTO FOLICULAR INICIAL E ATRESIA EM OVÁRIOS CAPRINOS Fortaleza Ceará Agosto, 2004 2 Universidade Estadual do Ceará José Roberto
1 Universidade Estadual do Ceará José Roberto Viana Silva ESTUDO DO DESENVOLVIMENTO FOLICULAR INICIAL E ATRESIA EM OVÁRIOS CAPRINOS Fortaleza Ceará Agosto, 2004 2 Universidade Estadual do Ceará José Roberto
Sistema reprodutor masculino e feminino: origem, organização geral e histologia
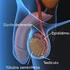 Sistema reprodutor masculino e feminino: origem, organização geral e histologia CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR Profa. Msc. Ângela Cristina Ito Sistema reprodutor
Sistema reprodutor masculino e feminino: origem, organização geral e histologia CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR Profa. Msc. Ângela Cristina Ito Sistema reprodutor
Ciclo celular. Patricia Coltri
 Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que interferem no ciclo Métodos de estudo Ciclo celular e proliferação Eventos sequenciais coordenados: geração
Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que interferem no ciclo Métodos de estudo Ciclo celular e proliferação Eventos sequenciais coordenados: geração
Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução
 Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução Apresentadores: Med. Vet. Andressa Stein Maffi Kauana Soares FI: 1,79 Qual
Diferenças metabólicas e endócrinas entre femêas Bos taurus e Bos indicus e o impacto da interação da nutrição com a reprodução Apresentadores: Med. Vet. Andressa Stein Maffi Kauana Soares FI: 1,79 Qual
Mecanismos de comunicação celular 26/05/2015
 Mecanismos de comunicação celular 26/05/2015 Alvos terapêuticos Hopkins & Groom (2002) Nature Reviews Drug Discovery 1:727 Elementos da comunicação celular LIGANTE RECEPTOR Há dois tipos de receptores
Mecanismos de comunicação celular 26/05/2015 Alvos terapêuticos Hopkins & Groom (2002) Nature Reviews Drug Discovery 1:727 Elementos da comunicação celular LIGANTE RECEPTOR Há dois tipos de receptores
Ciclo celular. Patricia Coltri
 Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que estimulam/inibem o ciclo celular Métodos para estudo do ciclo Ciclo celular Células se reproduzem com a duplicação
Ciclo celular Patricia Coltri coltri@usp.br Nesta aula: Controle do ciclo celular Fatores que estimulam/inibem o ciclo celular Métodos para estudo do ciclo Ciclo celular Células se reproduzem com a duplicação
Interação dos mecanismos fisiológicos que influenciam a fertilidade em vacas leiteiras
 Ministério da Educação Universidade Federal de Pelotas Faculdade de Medicina Veterinária Núcleo de Ensino, Pesquisa e Extensão em Pecuária-NUPEEC Interação dos mecanismos fisiológicos que influenciam a
Ministério da Educação Universidade Federal de Pelotas Faculdade de Medicina Veterinária Núcleo de Ensino, Pesquisa e Extensão em Pecuária-NUPEEC Interação dos mecanismos fisiológicos que influenciam a
Divisão celular. A única situação em que dividir e multiplicar significam a mesma coisa
 Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
Divisão celular A única situação em que dividir e multiplicar significam a mesma coisa Todos as células se dividem: 1. Em organismos unicelulares, divisão celular é o modo principal de reprodução 2. Em
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS RAFAEL ROSSETTO DE SOUSA EFEITO DO FATOR DE CRESCIMENTO
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS RAFAEL ROSSETTO DE SOUSA EFEITO DO FATOR DE CRESCIMENTO
Sinalização Celular. Rafael Silva Rocha FMRP-USP, SP, Brazil
 Sinalização Celular Rafael Silva Rocha FMRP-USP, SP, Brazil silvarochar@gmail.com http://silvarochar.wixsite.com/ssbl 1 A célula e seu ambiente Temperatura Nutrientes Estresses Integridade própria Injurias
Sinalização Celular Rafael Silva Rocha FMRP-USP, SP, Brazil silvarochar@gmail.com http://silvarochar.wixsite.com/ssbl 1 A célula e seu ambiente Temperatura Nutrientes Estresses Integridade própria Injurias
GILDAS MBEMYA TETAPING
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS GILDAS MBEMYA TETAPING EXTRATO AQUOSO DE JUSTICIA INSULARIS:
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS GILDAS MBEMYA TETAPING EXTRATO AQUOSO DE JUSTICIA INSULARIS:
TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO
 TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO Raphael Bessa Parmigiani, PhD Centro de Oncologia Molecular Instituto Sírio-Libanes de Ensino e Pesquisa Curso de Introdução à Biologia Molecular Goiânia, Maio
TRANSDUÇÃO DE SINAL E VIAS DE SINALIZAÇÃO Raphael Bessa Parmigiani, PhD Centro de Oncologia Molecular Instituto Sírio-Libanes de Ensino e Pesquisa Curso de Introdução à Biologia Molecular Goiânia, Maio
Ontogenia de Linfócito T. Alessandra Barone
 Ontogenia de Linfócito T Alessandra Barone Ontogenia de Linfócitos Desenvolvimento dos linfócitos Necessidade de desenvolvimento e maturação de linfócitos para produção de receptores de antígenos Estímulos
Ontogenia de Linfócito T Alessandra Barone Ontogenia de Linfócitos Desenvolvimento dos linfócitos Necessidade de desenvolvimento e maturação de linfócitos para produção de receptores de antígenos Estímulos
Fisiologia celular I. Fisiologia Prof. Msc Brunno Macedo
 celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
Rede de Pesquisa do Ovário Artificial
 Rede de Pesquisa do Ovário Artificial Coordenador Instituição Executora Vigência Número de pesquisadores envolvidos Projetos associados a Rede/Coordenadores Importância da tecnologia do ovário artificial
Rede de Pesquisa do Ovário Artificial Coordenador Instituição Executora Vigência Número de pesquisadores envolvidos Projetos associados a Rede/Coordenadores Importância da tecnologia do ovário artificial
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS - GRADUAÇÃO EM BIOTECNOLOGIA - PPGB
 UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS - GRADUAÇÃO EM BIOTECNOLOGIA - PPGB JOSÉ JACKSON DO NASCIMENTO COSTA ESTABILIDADE DE GENES DE REFERÊNCIA E EXPRESSÃO DAS
UNIVERSIDADE FEDERAL DO CEARÁ CAMPUS DE SOBRAL - CURSO DE MEDICINA PROGRAMA DE PÓS - GRADUAÇÃO EM BIOTECNOLOGIA - PPGB JOSÉ JACKSON DO NASCIMENTO COSTA ESTABILIDADE DE GENES DE REFERÊNCIA E EXPRESSÃO DAS
Ciclo Celular. Dividido em: - Intérfase - Divisão celular: Dois tipos fundamentais. Mitose Meiose
 Meiose Ciclo Celular Dividido em: - Intérfase - Divisão celular: Dois tipos fundamentais Mitose Meiose Antes de qualquer divisão celular há duplicação do DNA durante a intérfase. Divisão Celular O Ciclo
Meiose Ciclo Celular Dividido em: - Intérfase - Divisão celular: Dois tipos fundamentais Mitose Meiose Antes de qualquer divisão celular há duplicação do DNA durante a intérfase. Divisão Celular O Ciclo
ANÁLISE MORFOLÓGICA E ULTRAESTRUTURAL DE FOLÍCULOS PRIMORDIAIS OVINOS CONSERVADOS EM SOLUÇÃO SALINA 0,9% E TCM
 Universidade Estadual do Ceará Pró-Reitoria de Pós-Graduação e Pesquisa Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Maria Helena Tavares de Matos ANÁLISE MORFOLÓGICA E ULTRAESTRUTURAL
Universidade Estadual do Ceará Pró-Reitoria de Pós-Graduação e Pesquisa Faculdade de Veterinária Programa de Pós-Graduação em Ciências Veterinárias Maria Helena Tavares de Matos ANÁLISE MORFOLÓGICA E ULTRAESTRUTURAL
Conceitos fundamentais de Biologia Celular
 Conceitos fundamentais de Biologia Celular Principais estruturas da célula eucariótica O NÚCLEO Contém nos cromossomos todo o genoma (DNA) das células; Responsável pela síntese e processamento dos RNAs
Conceitos fundamentais de Biologia Celular Principais estruturas da célula eucariótica O NÚCLEO Contém nos cromossomos todo o genoma (DNA) das células; Responsável pela síntese e processamento dos RNAs
Núcleo celular. Responsável pela transmissão da hereditariedade e centro de comando das atividades celulares. Carioteca
 Núcleo celular Responsável pela transmissão da hereditariedade e centro de comando das atividades celulares Carioteca Dupla camada de lipídios, contendo poros (passagem de grandes moléculas) Cariolinfa
Núcleo celular Responsável pela transmissão da hereditariedade e centro de comando das atividades celulares Carioteca Dupla camada de lipídios, contendo poros (passagem de grandes moléculas) Cariolinfa
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular
 Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS VALDEVANE ROCHA ARAÚJO ESTUDO DOS FATORES QUE AFETAM
1 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS VALDEVANE ROCHA ARAÚJO ESTUDO DOS FATORES QUE AFETAM
Produção in vitro de embriões
 Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós- Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões
Universidade Estadual do Ceará Faculdade de Veterinária Programa de Pós- Graduação em Ciências Veterinárias Biotécnicas Aplicadas à Reprodução de Fêmeas Caprinas e Ovinas Produção in vitro de embriões
CROMOSSOMOS. Profa. Dra. Viviane Nogaroto
 CROMOSSOMOS Cromossomos EUCARIOTOS Cada cromossomo carrega um subconjunto de genes que são arranjados linearmente ao longo do DNA Tamanho: -DNA de cromossomo de E. coli: 1.200 µm -DNA de cromossomo humano:
CROMOSSOMOS Cromossomos EUCARIOTOS Cada cromossomo carrega um subconjunto de genes que são arranjados linearmente ao longo do DNA Tamanho: -DNA de cromossomo de E. coli: 1.200 µm -DNA de cromossomo humano:
GAMETOGÊNESE. Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS.
 GAMETOGÊNESE 1 GAMETOGÊNESE Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS. Gameta masculino Espermatozóide. Gameta feminino Ovócito. Os gametas possuem metade
GAMETOGÊNESE 1 GAMETOGÊNESE Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS. Gameta masculino Espermatozóide. Gameta feminino Ovócito. Os gametas possuem metade
DIVISÃO CELULAR. Multiplicação celular:
 DIVISÃO CELULAR Multiplicação celular: Para que uma célula se multiplique o genoma também precisa se multiplicar REPLICAÇÃO do DNA precede multiplicação celular DIVISÃO CELULAR MITOSE: divisão das células
DIVISÃO CELULAR Multiplicação celular: Para que uma célula se multiplique o genoma também precisa se multiplicar REPLICAÇÃO do DNA precede multiplicação celular DIVISÃO CELULAR MITOSE: divisão das células
Regulação gênica em Eucariotos. Prof. Dr. Marcelo Ricardo Vicari
 Regulação gênica em Eucariotos REGULAÇÃO GÊNICA Neurônio e célula de fígado: células de um mesmo indivíduo e que contêm a mesmo genoma REGULAÇÃO GÊNICA Diferenciação celular 1973 REGULAÇÃO GÊNICA Dolly:
Regulação gênica em Eucariotos REGULAÇÃO GÊNICA Neurônio e célula de fígado: células de um mesmo indivíduo e que contêm a mesmo genoma REGULAÇÃO GÊNICA Diferenciação celular 1973 REGULAÇÃO GÊNICA Dolly:
Leia atentamente os textos e as questões que se seguem e indique a letra da opção correta no local indicado na folha de respostas no final.
 Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia e Geologia - 11º ano - Teste de Avaliação Outubro 2017 Tema 6 Biologia: DNA, Síntese de Proteínas, Ciclo celular, Mitose, Diferenciação Leia
Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia e Geologia - 11º ano - Teste de Avaliação Outubro 2017 Tema 6 Biologia: DNA, Síntese de Proteínas, Ciclo celular, Mitose, Diferenciação Leia
Estado nutricional. Desordens metabólicas - jejum, desnutrição, baixa ingestão calórica proteica
 Estado nutricional Desordens metabólicas - jejum, desnutrição, baixa ingestão calórica proteica Balanço catabolismo / anabolismo aumentado Alto GH, baixo IGF e insulina lipólise ativada (mecanismo adaptativo
Estado nutricional Desordens metabólicas - jejum, desnutrição, baixa ingestão calórica proteica Balanço catabolismo / anabolismo aumentado Alto GH, baixo IGF e insulina lipólise ativada (mecanismo adaptativo
UNIVERSIDADE FEDERAL DO CEARÁ UFC PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA DOUTORADO EM BIOTECNOLOGIA REDE NORDESTE DE BIOTECNOLOGIA RENORBIO
 UNIVERSIDADE FEDERAL DO CEARÁ UFC PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA DOUTORADO EM BIOTECNOLOGIA REDE NORDESTE DE BIOTECNOLOGIA RENORBIO ANDERSON WEINY BARBALHO SILVA Localização de proteínas, quantificação
UNIVERSIDADE FEDERAL DO CEARÁ UFC PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA DOUTORADO EM BIOTECNOLOGIA REDE NORDESTE DE BIOTECNOLOGIA RENORBIO ANDERSON WEINY BARBALHO SILVA Localização de proteínas, quantificação
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS
 UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS GIOVANNA QUINTINO RODRIGUES EFEITO DE DIFERENTES CONCENTRAÇÕES
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS GIOVANNA QUINTINO RODRIGUES EFEITO DE DIFERENTES CONCENTRAÇÕES
Princípios. Gerais da Fisiologia Endócrina. Diego Veras Wilke
 Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL. Vanessa Raquel Pinto de Barros
 UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL Vanessa Raquel Pinto de Barros ESTUDO DA EXPRESSÃO DE RECEPTORES DE
UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO UNIVERSIDADE FEDERAL DO VALE DO SÃO FRANCISCO CURSO DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL Vanessa Raquel Pinto de Barros ESTUDO DA EXPRESSÃO DE RECEPTORES DE
