FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
|
|
|
- Danilo Corte-Real Costa
- 7 Há anos
- Visualizações:
Transcrição
1 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Outubro de 2016 Volume 3, Número 3 3º Trimestre de 2016 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca das novas medidas de segurança referentes à utilização dos medicamentos posaconazol (Noxafil ), varfarina, riociguat (Adempas ), Idelalisib (Zydelig ) e medicamentos derivados do plasma e urina. São ainda apresentadas, as atividades científicas e os resultados das atividades da Unidade de Farmacovigilância do Centro (UFC), referentes ao terceiro trimestre de II Encontro Regional de Farmacovigilância A Unidade de Farmacovigilância do Centro vai organizar o II Encontro Regional de Farmacovigilância. Todos os profissionais de saúde estão convidados a participar no encontro a realizar no dia 4 de novembro de 2016, pelas 14 horas no Auditório do IBILI (FMUC, Polo III, Universidade de Coimbra, Celas, Coimbra). Nesta edição: Notas de segurança 2 Alertas de segurança 5 Atividade científica da UFC Resultados da atividade da UFC 6 7 Q&A 9 Pontos de especial interesse: Posaconazol (Noxafil ): as forma farmacêuticas comprimidos e suspensão oral não são intercambiáveis; Varfarina: notificações de calcifilaxia; Riociguat (Adempas ): utilização não recomendável em doentes com hipertensão pulmonar associada a pneumonia intersticial idiopática; Idelalisib (Zydelig ): recomendações finais; Vírus Zika: segurança dos medicamentos derivados do plasma e urina.
2 II Encontro Regional de Farmacovigilância 4 de Novembro de Auditório do IBILI (Faculdade de Medicina da Universidade de Coimbra, Polo das Ciências da Saúde (III), Celas, Coimbra) Organização: Unidade de Farmacovigilância do Centro, CHAD Centro de Avaliação de Tecnologias em Saúde e Investigação do Medicamento, AIBILI Associação para Investigação Biomédica e Inovação em Luz e Imagem. A Unidade de Farmacovigilância do Centro (UFC) vem, por este meio, agradecer o contributo que os notificadores têm prestado ao Sistema Nacional de Farmacovigilância (SNF) ao colaborar ativamente na identificação e notificação espontânea de suspeitas de reações adversas a medicamentos (RAM) ao longo dos últimos anos. À semelhança do I Encontro, esta reunião visa promover um encontro entre a UFC e os profissionais de saúde da região Centro que têm notificado suspeitas de reações adversas a medicamentos (RAM) ao longo dos anos. Serão apresentados e discutidos os resultados da atividade da UFC, a gestão do risco clínico e o processo de identificação e documentação da iatrogenia medicamentosa na prática clínica. Assim, convidamo-lo(a) a participar no encontro a realizar no dia 4 de novembro de 2016 (sexta-feira), pelas 14 horas no Auditório do IBILI (FMUC, Polo III da Universidade de Coimbra, Celas, Coimbra), cujo programa se apresenta. Página 2 Agradecemos que confirme a sua presença por correio eletrónico (ufc@aibili.pt) ou por correio postal (AIBILI Unidade de Farmacovigilância do Centro Azinhaga de Santa Comba, Celas Coimbra) até dia 31 de outubro de 2016.
3 Notificação de RAM preferencialmente via Portal UFC ( O Portal RAM do INFARMED, I.P. encontra-se com problemas de compatibilidade desde a entrada em vigor das versões mais recentes do Internet Explorer e do Mozilla Firefox. Este facto tem impedido a notificação de suspeitas de reações adversas a medicamentos (RAM) por parte dos profissionais de saúde e utentes. Como tal, recomendamos que utilize preferencialmente o Portal da Unidade de Farmacovigilância do Centro (UFC) (disponível em para notificar suspeitas de RAM. O Portal da UFC é compatível com as versões mais recentes dos browsers referidos e também com o Google Chrome. Notas de Segurança Posaconazol (Noxafil ): as forma farmacêuticas comprimidos e suspensão oral não são intercambiáveis A substituição das formas farmacêuticas comprimidos para suspensão oral de posaconazol tem originado em casos de toxicidade relacionada com a dose, visto que esta substituição resulta numa dosagem inferior à dose ótima da terapia, resultando em falta de eficácia. O posaconazol (Noxafil ) é um anti-fúngico derivados dos triazóis indicado no tratamento e prevenção de infeções fúngicas. O posaconazol está disponível na forma farmacêutica de suspensão oral (40 mg/ml), comprimidos (100 mg) e concentrado para solução para perfusão (18 mg/ml). Erros de Medicação As formas farmacêuticas comprimidos e a suspensão oral de posaconazol não são intercambiáveis devido a diferenças entre estas duas formulações na frequência posológica, administração com alimentos e concentração plasmática atingida. Assim, devem ser seguidas as recomendações posológicas específicas de cada formulação, que variam também de acordo com a indicação terapêutica. O resumo das características do medicamento posaconazol foi atualizado para clarificar que os comprimidos e a solução oral não são intercambiáveis, na mesma dose. Recomendações para o profissional de saúde: As formas farmacêuticas comprimidos e suspensão oral não são diretamente intersubstituíveis. A substituição de suspensão oral para comprimidos pode originar sobredosagem e, consequentemente, ao desenvolvimento de reações adversas graves; enquanto a substituição de comprimidos pela suspensão oral pode originar uma dosagem inferior à desejada e, consequentemente, à falta de eficácia. Os prescritores devem especificar a dosagem para cada forma farmacêutica de posaconazol em cada prescrição. Os farmacêuticos devem assegurar que a forma farmacêutica correta é dispensada aos doentes. Adaptado de Drug Safety Update Volume 10 Issue 2, September 2016: 2. Página 3
4 Varfarina: notificações de calcifilaxia A calcifilaxia é uma condição muito rara, mas grave, que causa calcificação vascular e necrose cutânea. A varfarina é um anticoagulante oral, antagonista da vitamina K, que impede a síntese hepática de vários factores de coagulação (II, VII, IX e X). Risco de calcifilaxia A calcifilaxia é uma condição muito rara, mas grave, que causa calcificação e necrose cutânea. A taxa de mortalidade é elevada. A condição é mais frequente em doentes com doença renal em último estadio ou em diálise, ou naqueles com fatores de risco conhecidos, tais como défice de proteína C ou S, hiperfosfatémia, hipercalcémia ou hipoalbuminemia. Têm sido reportados casos de calcifilaxia em doentes tratados com varfarina. A doença renal pré-existente foi uma condição verificada na maioria dos casos reportados; contudo, em alguns casos foi verificada uma função renal normal. Uma revisão europeia recente concluiu que existe uma possibilidade de, em raras ocasiões, o tratamento com varfarina estar associado ao desenvolvimento de calcifilaxia. O resumo das características da varfarina será atualizado com esta nova informação de segurança. O folheto informativo será também atualizado alertando os doentes para o risco de calcifilaxia, aconselhando os doentes a consultar o seu médico caso eles desenvolvam erupção cutânea dolorosa. Potenciais mecanismos A fisiopatologia da calcifilaxia é ainda desconhecida. A calcifilaxia e a necrose cutânea induzida pela varfarina podem apresentar achados clínicos semelhantes, mas podem ser diferenciados por achados histopatológicos. O mecanismo pode ser mediado através da proteína da matriz Gla, que é dependente da vitamina K, envolvendo a inibição da calcificação. A varfarina inibe a protérina Gla e pode, consequentemente, promover a calcificação vascular em indivíduos suscetíveis. Recomendações para o profissional de saúde: A calcifilaxia é uma condição muito rara, mas grave, que é mais frequente em doentes com fatores de risco conhecidos, tais como doença renal em último estadio. Têm sido reportados casos de calcifilaxia em doentes que tomaram varfarina, incluindo doentes com a função renal normal. Se for diagnosticado calcifilaxia, deve ser iniciado tratamento apropriado e deve ser ponderada a suspensão do tratamento com varfarina. Página 4 Adaptado de Drug Safety Update Volume 9 Issue 12 July 2016: 1.
5 Riociguat (Adempas ): utilização não recomendável em doentes com hipertensão pulmonar associada a pneumonia intersticial idiopática Os doentes com hipertensão pulmonar associada a pneumonia intersticial idiopática não devem ser tratados com riocioguat, como demonstrado nos resultados interinos de um estudo recentemente interrompido por questões de segurança. Indicações Terapêuticas O riociguat (Adempas ) está indicado para o tratamento de doentes adultos com Classes Funcionais II e III (da Organização Mundial de Saúde) com hipertensão pulmonar tromboembólica crónica inoperável ou persistente ou recorrente após tratamento cirúrgico e em doentes com hipertensão arterial pulmonar com Classes Funcionais II e III (da Organização Mundial de Saúde). Ensaio Clínico RISE-IIP O ensaio clínico RISE-IIP foi um ensaio clínico aleatorizado, duplamente oculto, controlado com placebo, multicêntrico, de fase II, com o objetivo de investigar a eficácia e segurança de riociguat em 145 doentes com hipertensão pulmonar associada a pneumonia intersticial idiopática (nova indicação terapêutica). O endpoint primário foi a alteração no teste de caminhada de distância de 6 minutos após 26 semanas de tratamento. Término precoce do ensaio clínico O ensaio clínico terminou mais cedo devido uma vez que os resultados interinos revelaram mortalidade acrescida e um risco acrescido de eventos adversos graves no grupo de doentes tratados com riociguat comparativamente ao grupo de doentes que recebiam placebo. Adicionalmente, dados preliminares indicavam que o tratamento com riociguat não se traduzia em benefícios significativos nestes doentes. Até à avaliação interina, tinham sido registadas 21 mortes: em 17 doentes tratados com riociguat e em 4 doentes a receber placebo. A frequência de eventos adversos graves, que na sua maioria foram doenças respiratórias e infeções pulmonares, foi também superior no grupo de doentes tratados com riociguat comparativamente ao grupo de doentes que receberam placebo. Face a estes resultados, o resumo das características de riociguat será atualizado, passando a ser contraindicado em doentes com hipertensão pulmonar associada a pneumonia intersticial idiopática. Os benefícios de riociguat continuam a ser superiores aos riscos, nas indicações terapêuticas anteriormente aprovadas. Recomendações para o profissional de saúde: Os doentes com hipertensão pulmonar associada a pneumonia intersticial idiopática não devem ser tratados com riociguat. O tratamento com riociguat deve ser descontinuado em qualquer doente com hipertensão pulmonar associada a pneumonia intersticial idiopática. O estado clínico do doente deve ser monitorizado atentamente após a suspensão de riociguat. Os benefício de riociguat nas indicações terapêuticas atualmente aprovadas continuam a ser superiores aos riscos. Adaptado de Drug Safety Update volume 10 issue 1, August 2016: 1. Página 5
6 Alertas de Segurança Idelalisib (Zydelig ): recomendações finais Na sequência da revisão de segurança efetuada ao medicamento Zydelig (idelalisib), foi concluído que os seus benefícios no tratamento de leucemia linfocítica crónica (LLC) e linfoma folicular são superiores aos riscos. No entanto, após esta revisão foram atualizadas as recomendações de modo a minimizar o risco de infeções graves em doentes tratados com este medicamento. Recomendações para o profissional de saúde: A terapêutica com Zydelig não deve ser iniciada em doentes com evidências de infeção sistémica. Todos os doentes que estejam a ser tratados com Zydelig: devem iniciar também tratamento profilático da pneumonia por Pneumocystis. jirovecii, que se deve manter até 2 a 6 meses após conclusão da terapêutica e ser monitorizados para os sintomas e sinais respiratórios; deve ser monitorizada regularmente a infeção por citomegalovírus, por meios clínicos e laboratoriais, de acordo com o que está descrito no resumo das características do medicamento (RCM) atualizado; devem ser regularmente monitorizados para detetar neutropenia. No caso de o doente apresentar uma neutropenia grave, o tratamento com Zydelig deve ser interrompido, de acordo com o RCM atualizado. O Zydelig pode continuar a ser utilizado em: combinação com o rituximab em doentes com LLC que receberam, pelo menos, uma terapêutica prévia; combinação com o rituximab, como tratamento de primeira linha em doentes com LLC cujas células cancerígenas tenham deleção em 17p ou mutação da TP53, desde que não existam alternativas terapêuticas e que sejam seguidas as medidas de minimização do risco de infeções; monoterapia em doentes com linfoma folicular que sejam refratários a duas linhas de tratamento, desde que sejam seguidas as medidas de minimização do risco de infeções. Os doentes devem ser informados do risco de infeções graves com Zydelig. Adaptado de Circular Informativa N.º 109/CD/ Vírus Zika: segurança dos medicamentos derivados do plasma e urina A Agência Europeia do Medicamento (EMA) confirmou que não há um risco aumentado de contaminação pelo vírus Zika em doentes em tratamento com medicamentos derivados do plasma e urina. Os medicamentos derivados do plasma e urina são produzidos a partir de fluidos corporais que podem ter origem em países com prevalência do vírus Zika. Após avaliação, concluiu-se que o processo de fabrico inativa ou remove o vírus Zika do medicamento final, pelo que estes medicamentos não acarretam risco de contaminação, nem há necessidade de medidas de segurança adicionais, como testes ou exclusão de dadores. Página 6 Adaptado de Circular Informativa N.º 134/CD/
7 Atividade científica da Unidade de Farmacovigilância do Centro (UFC) Congressos Científicos Os colaboradores da Unidade de Farmacovigilância do Centro (UFC) apresentaram, no último trimestre, dois estudos de investigação em farmacovigilância e segurança de medicamentos na International Conference on Pharmacoepidemiology and Therapeutic Risk Management. Os títulos dos estudos e as ligações ao texto integral são apresentadas em baixo. 32nd International Conference on Pharmacoepidemiology and Therapeutic Risk Management, August 25-28, 2016, Dublin, Ireland Poster. Alves C, Ribeiro I, Penedones A, Mendes D, Batel Marques F. Ophthalmic Adverse Effects In Cancer Patients Treated With MEK Inhibitors: A Meta-Analysis. 32nd ICPE Annual Meeting. August Dublin, Ireland. Poster. Mendes, D. Alves, C. Batel Marques, F. Applying the number needed to harm (NNH) to benefit-risk (BR) assessments of drugs withdrawn from the market due to safety reasons. 32nd ICPE Annual Meeting. August Dublin, Ireland. Publicações O jornal ClinicoEconomics and Outcomes Research publicou um estudo realizado por colaboradores da UFC, sobre os custos das reações adversas a medicamentos, utilizando a técnica da revisão sistemática de estudos observacionais. O resumo do estudo encontra-se descrito abaixo. Para aceder ao estudo completo, pode aceder aqui. Introduction: The growing evidence of the increased frequency and severity of adverse drug events (ADEs), besides the negative impact on patient s health status, indicates that costs due to ADEs may be steadily rising. Observational studies are an important tool in pharmacovigilance. Despite these studies being more susceptible to bias than experimental designs, they are more competent in assessing ADEs and their associated costs. Página 7
8 Objective: To identify and characterize the best available evidence on ADEassociated costs. Methods: MEDLINE, Cochrane Library, and Embase were searched from 1995 to Observational studies were included. The methodological quality of selected studies was assessed by Cochrane Collaboration tool for experimental and observational studies. Studies were classified according to the setting analyzed in ambulatory, hospital, or both. Costs were classified as direct and indirect. Data were analyzed using descriptive statistics. The total incremental cost per patient with ADE was estimated. Results: Twenty-nine (94%) longitudinal observational studies and two (7%) cross-sectional studies were included. Twenty-three (74%) studies were assessed with the highest methodological quality score. The studies were mainly conducted in the US (61%). Twenty (65%) studies evaluated any therapeutic group. Twenty (65%) studies estimated costs of ADEs leading to or prolonging hospitalization. The direct costs were evaluated in all studies, whereas only two (7%) also estimated the indirect costs. The direct costs in ambulatory ranged from to 40,273.08, and the in hospital from to 7, Discussion: Methodological heterogeneities were identified among the included studies, such as design, type of ADEs, suspected drugs, and type and structure of costs. Despite such discrepancies, the financial burden associated with ADE costs was found to be high. In the light of the present findings, validated methods to measure ADE-associated costs need future research efforts. Keywords: drug costs, health care costs, drug-related side effects and adverse reactions, review Clinicoecon Outcomes Res Aug 24;8: doi: /CEOR.S Resultados da atividade da Unidade de Farmacovigilância do Centro (UFC) A Unidade de Farmacovigilância do Centro (UFC) recebeu um total de 66 notificações espontâneas de reações adversas a medicamentos entre 1 de Julho e 30 de Setembro de As Figuras dispostas na página seguinte apresentam a distribuição das notificações espontâneas de acordo com o local de origem, o tipo de notificador, a gravidade, o conhecimento prévio, a imputação de causalidade atribuída à relação entre a ocorrência da reação adversa e a exposição ao medicamento suspeito e o grupo terapêutico do medicamento suspeito. Página 8
9 Grave uma reação adversa que resultou em morte, colocou a vida em risco, motivou ou prolongou o internamento, resultou em incapacidade significativa, causou anomalias congénitas ou outra clinicamente importante. Não descrito uma notificação espontânea contendo, pelo menos, uma reação adversa cuja descrição não está incluída no resumo das características do medicamento suspeito. I: Medicamentos anti-infeciosos; II: Sistema Nervoso Central; III: Aparelho Cardiovascular; IV: Sangue; VI: Aparelho digestivo; VII: Aparelho geniturinário; VIII: Hormonas e medicamentos usados no tratamento das doenças endócrinas; IX: Aparelho locomotor; X: Medicação antialérgica; XI: Nutrição; XVI: Medicamentos antineoplásicos e imunomoduladores; XVIII: Vacinas e imunoglobulinas; XIX: Meios de diagnóstico. Página 9
10 FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos, Volume 1, 3, Número 43 Q&A Todos os profissionais de saúde e utentes/consumidores podem utilizar o ufc@aibili.pt para colocarem questões relacionadas com a segurança de medicamentos. As questões serão respondidas por e/ou através de publicação nas próximas edições deste boletim. Como notificar suspeitas de reações adversas a medicamentos à UFC? Portal RAM (online) UFC, AIBILI Notificação de reações adversas (online) Boletins de notificação para imprimir MEDICAMENTOS_USO_HUMANO/FARMACOVIGILANCIA/NOTIFICACAO_DE_RAM Unidade de Farmacovigilância do Centro (UFC) Tel: Fax: ufc@aibili.pt Ficha técnica Unidade de Farmacovigilância do Centro (UFC) AIBILI Azinhaga de Santa Comba - Celas Coimbra Portugal Tel: Fax: ufc@aibili.pt Título: FARMACOVIGILÂNCIA - Atualizações de segurança de medicamentos Editor: Unidade de Farmacovigilância do Centro (UFC), AIBILI - Associação para Investigação Biomédica e Inovação em Luz e Imagem. Diretor: Tice Macedo Produção: Ana Penedones, Diogo Mendes, Carlos Alves. Coordenação da UFC: Francisco Batel Marques, Carlos Fontes Ribeiro. Conselho Científico da UFC: Carlos Fontes Ribeiro, Francisco Batel Marques, Luiz Miguel Santiago, Margarida Caramona, Maria Angelina Martins, Patrícia Dinis Dias, Ricardo Correia de Matos, Tice Macedo. Apoio técnico: Daniel Sanches Fernandes. ISSN:
Guia do Prescritor. Versão 1 (novembro 2017)
 Versão (novembro 7) CONTEÚDO Introdução sobre MAVENCLAD Regimes de tratamento Monitorização durante o tratamento Contagens de linfócitos Infeções graves Leucoencefalopatia multifocal progressiva Neoplasias
Versão (novembro 7) CONTEÚDO Introdução sobre MAVENCLAD Regimes de tratamento Monitorização durante o tratamento Contagens de linfócitos Infeções graves Leucoencefalopatia multifocal progressiva Neoplasias
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 22 de Abril de 2016 Volume 3, Número 1 1º Trimestre de 2016 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 22 de Abril de 2016 Volume 3, Número 1 1º Trimestre de 2016 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Anexo III. Alterações à informação do medicamento
 Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
esclarecimento sobre reacções adversas INFARMED, I.P.
 Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
Leitura Rápida AIM AIM
 3 Leitura Rápida 4 Leitura Rápida 5 Leitura Rápida PRAC PRAC PRAC 6 PRAC 7 Leitura Rápida PRAC PRAC RAM RCM FI Leitura Rápida 8 9 Leitura Rápida PRAC RCM FI início do tratamento aumento da dose 10 Leitura
3 Leitura Rápida 4 Leitura Rápida 5 Leitura Rápida PRAC PRAC PRAC 6 PRAC 7 Leitura Rápida PRAC PRAC RAM RCM FI Leitura Rápida 8 9 Leitura Rápida PRAC RCM FI início do tratamento aumento da dose 10 Leitura
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 15 de abril de 2014 Volume 1, Número 1 1º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 15 de abril de 2014 Volume 1, Número 1 1º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Deliberação n.º 62/CD/2017
 Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Segurança do Doente Integração da Farmacovigilância num Sistema de Registo de Incidentes de Segurança do Doente
 Segurança do Doente Integração da Farmacovigilância num Sistema de Registo de Incidentes de Segurança do Doente 9as Jornadas da Farmácia Hospitalar OF Fevereiro 2017 SUMÁRIO Contextualização; Fluxograma
Segurança do Doente Integração da Farmacovigilância num Sistema de Registo de Incidentes de Segurança do Doente 9as Jornadas da Farmácia Hospitalar OF Fevereiro 2017 SUMÁRIO Contextualização; Fluxograma
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 28 de Abril de 2017 Volume 4, Número 1 1º Trimestre de 2017 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 28 de Abril de 2017 Volume 4, Número 1 1º Trimestre de 2017 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
FARMACOVIGILÂNCIA. Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM. Unidade de Farmacovigilância do Norte
 Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM Unidade de Farmacovigilância do Norte Elixir de Sulfanilamida (1937) Defeito de formulação Envenenamento Melhoria da regulação farmacêutica
Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM Unidade de Farmacovigilância do Norte Elixir de Sulfanilamida (1937) Defeito de formulação Envenenamento Melhoria da regulação farmacêutica
Índice. Índice... ii Sumário... iii Abstract... v
 2ª ed Caracterização de reacções adversas a medicamentos notificadas à Unidade de Farmacovigilância do Norte pelo Serviço de Imunoalergologia do Centro Hospitalar de São João do Porto Maria João Baldaia
2ª ed Caracterização de reacções adversas a medicamentos notificadas à Unidade de Farmacovigilância do Norte pelo Serviço de Imunoalergologia do Centro Hospitalar de São João do Porto Maria João Baldaia
Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram
 ( ) Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação
( ) Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Editorial. Pontos de especial interesse:
 30 de Abril de 2018 Volume 5, Número 1 1º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
30 de Abril de 2018 Volume 5, Número 1 1º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE
 GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE FLIXABI é um medicamento biológico. Para fins de rastreabilidade, é importante registar, sempre que possível, o nome de marca e o número de
GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE FLIXABI é um medicamento biológico. Para fins de rastreabilidade, é importante registar, sempre que possível, o nome de marca e o número de
Brochura Educacional para os Médicos Prescritores sobre a PrEP
 Brochura Educacional para os Médicos Prescritores sobre a PrEP Informação de segurança importante para os médicos prescritores sobre a profilaxia pré-exposição (PrEP) com Emtricitabina/Tenofovir disoproxil
Brochura Educacional para os Médicos Prescritores sobre a PrEP Informação de segurança importante para os médicos prescritores sobre a profilaxia pré-exposição (PrEP) com Emtricitabina/Tenofovir disoproxil
28/05/2015 Unidade de Farmacovigilância do Norte
 Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM 28/05/2015 Unidade de Farmacovigilância do Norte SISTEMA NACIONAL DE FARMACOVIGILÂNCIA Elixir de Sulfanilamida (1937) Defeito de formulação
Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM 28/05/2015 Unidade de Farmacovigilância do Norte SISTEMA NACIONAL DE FARMACOVIGILÂNCIA Elixir de Sulfanilamida (1937) Defeito de formulação
Conclusões científicas
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
Notificar efeitos indesejáveis: porquê, o quê e para quê?
 Notificar efeitos indesejáveis: porquê, o quê e para quê? Rui Pombal Comissão de Avaliação de Medicamentos Direção de Gestão do Risco de Medicamentos Manhã Informativa INFARMED 04 dezembro 2017 Notificar
Notificar efeitos indesejáveis: porquê, o quê e para quê? Rui Pombal Comissão de Avaliação de Medicamentos Direção de Gestão do Risco de Medicamentos Manhã Informativa INFARMED 04 dezembro 2017 Notificar
Notificação Espontânea de Reacções Adversas a Medicamentos
 Notificação Espontânea de Reacções Adversas a Medicamentos Manuela Pinto Milne Unidade de Farmacovigilância do Norte Faculdade de Medicina da Universidade do Porto eacçõesdversas aedicamentos (OMS) resposta
Notificação Espontânea de Reacções Adversas a Medicamentos Manuela Pinto Milne Unidade de Farmacovigilância do Norte Faculdade de Medicina da Universidade do Porto eacçõesdversas aedicamentos (OMS) resposta
Dimensão Segurança do Doente Check-list Procedimentos de Segurança
 Check-list Procedimentos de Segurança 1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar
Check-list Procedimentos de Segurança 1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona
 Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
Colírio, solução. Solução oleosa, amarelo claro com aspeto límpido e cheiro característico.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Diomicete 10 mg/ml colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml de solução contém 10 mg de clotrimazol. Excipientes com
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Diomicete 10 mg/ml colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml de solução contém 10 mg de clotrimazol. Excipientes com
Anexo III. Alterações às secções relevantes do resumo das características do medicamento e folheto informativo
 Anexo III Alterações às secções relevantes do resumo das características do medicamento e folheto informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo é o resultado
Anexo III Alterações às secções relevantes do resumo das características do medicamento e folheto informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo é o resultado
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
O RNEC na perspetiva dos Estudos Observacionais. Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo
 O RNEC na perspetiva dos Estudos Observacionais Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo PAS Post Authorisation Study Estudos pós autorização podem ser pedidos pelas
O RNEC na perspetiva dos Estudos Observacionais Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo PAS Post Authorisation Study Estudos pós autorização podem ser pedidos pelas
Conceito de evidência e Busca bibliográfica. 1º semestre de
 Conceito de evidência e Busca bibliográfica 1º semestre de 2017 www.epi.uff.br O método Epidemiológico Observação da frequência e distribuição de um evento relacionado à saúde-doença Formulação de hipóteses
Conceito de evidência e Busca bibliográfica 1º semestre de 2017 www.epi.uff.br O método Epidemiológico Observação da frequência e distribuição de um evento relacionado à saúde-doença Formulação de hipóteses
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Abril de 2015 Volume 2, Número 1 1º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Abril de 2015 Volume 2, Número 1 1º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Dimensão Segurança do Doente Check-list Procedimentos de Segurança
 1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar na implementação de processos relativos
1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar na implementação de processos relativos
Anexo IV. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI LAPATINIB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Embalagem
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI LAPATINIB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Embalagem
Resumo da avaliação científica de medicamentos contendo nimesulida para uso sistémico (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
A Fresenius Medical Care dá mais um passo à frente.
 Farmacovigilância A Fresenius Medical Care dá mais um passo à frente. Um novo tempo no monitoramento da segurança dos medicamentos. O que é Farmacovigilância? De acordo com a OMS (Organização Mundial
Farmacovigilância A Fresenius Medical Care dá mais um passo à frente. Um novo tempo no monitoramento da segurança dos medicamentos. O que é Farmacovigilância? De acordo com a OMS (Organização Mundial
UMA ESTRATÉGIA DE VIGILÂNCIA ATIVA PARA O USO RACIONAL DE MEDICAMENTOS
 UMA ESTRATÉGIA DE VIGILÂNCIA ATIVA PARA O USO RACIONAL DE MEDICAMENTOS Patricia Fernanda Toledo Barbosa Coordenação de Vigilância em Serviços Sentinela CVISS/NUVIG/ANVISA Contexto; Fases da regulação do
UMA ESTRATÉGIA DE VIGILÂNCIA ATIVA PARA O USO RACIONAL DE MEDICAMENTOS Patricia Fernanda Toledo Barbosa Coordenação de Vigilância em Serviços Sentinela CVISS/NUVIG/ANVISA Contexto; Fases da regulação do
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Janeiro de 2016 Volume 2, Número 4 4º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Janeiro de 2016 Volume 2, Número 4 4º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 23 de janeiro de 2018 Volume 4, Número 4 4º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 23 de janeiro de 2018 Volume 4, Número 4 4º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
A IMPORTÂNCIA DA COMUNICAÇÃO. Novo Portal RAM. Célia Alves. Diretora Direção de Gestão de Informação e Comunicação
 A IMPORTÂNCIA DA COMUNICAÇÃO Novo Portal RAM Célia Alves Diretora Direção de Gestão de Informação e Comunicação 04/12/2017 Agenda Os desafios da comunicação Interação com notificadores Iniciativas de comunicação
A IMPORTÂNCIA DA COMUNICAÇÃO Novo Portal RAM Célia Alves Diretora Direção de Gestão de Informação e Comunicação 04/12/2017 Agenda Os desafios da comunicação Interação com notificadores Iniciativas de comunicação
Guia para médicos sobre a prescrição de TOCTINO
 Guia para médicos sobre a prescrição de TOCTINO Queira ler atentamente este guia antes de discutir com a sua doente a possibilidade de tratamento com TOCTINO. Aqui encontrará informação acerca da contraceção,
Guia para médicos sobre a prescrição de TOCTINO Queira ler atentamente este guia antes de discutir com a sua doente a possibilidade de tratamento com TOCTINO. Aqui encontrará informação acerca da contraceção,
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 30 de outubro de 2017 Volume 4, Número 3 3º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 30 de outubro de 2017 Volume 4, Número 3 3º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
ANEXO I. Perguntas e Respostas sobre a revisão benefício-risco do piroxicam
 ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
Estudo de segurança do Trissulfin SID (400 mg) administrado em gatos jovens e adultos pela via oral durante 21 dias consecutivos.
 Estudo de segurança do Trissulfin SID (400 mg) administrado em gatos jovens e adultos pela via oral durante 21 dias consecutivos. (Resumo de dados) O estudo foi conduzido no gatil da Fazenda Experimental
Estudo de segurança do Trissulfin SID (400 mg) administrado em gatos jovens e adultos pela via oral durante 21 dias consecutivos. (Resumo de dados) O estudo foi conduzido no gatil da Fazenda Experimental
Epidemiologia Analítica. AULA 1 1º semestre de 2016
 Epidemiologia Analítica AULA 1 1º semestre de 2016 www.epi.uff.br Como o conhecimento médico é construído? O método Epidemiológico Epidemiologia descritiva: Observação da frequência e distribuição de um
Epidemiologia Analítica AULA 1 1º semestre de 2016 www.epi.uff.br Como o conhecimento médico é construído? O método Epidemiológico Epidemiologia descritiva: Observação da frequência e distribuição de um
Resumo da avaliação científica de supositórios contendo derivados terpénicos (ver Anexo I)
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A REVOGAÇÃO OU A ALTERAÇÃO DAS SECÇÕES RELEVANTES DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DOS FOLHETOS INFORMATIVOS APRESENTADOS
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A REVOGAÇÃO OU A ALTERAÇÃO DAS SECÇÕES RELEVANTES DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DOS FOLHETOS INFORMATIVOS APRESENTADOS
Editorial. Pontos de especial interesse:
 30 de Julho de 2018 Volume 5, Número 2 2º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
30 de Julho de 2018 Volume 5, Número 2 2º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV) INFORMAÇÃO DE SEGURANÇA
Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV) INFORMAÇÃO DE SEGURANÇA
INFARMED. Circular Informativa. N.º 011/CA Data: Assunto: Ceftriaxona - Informação de segurança
 INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
MAIOR CONTRO. Informação De Segurança Importante Sobre PRILIGY. 1 Informação para o médico
 MAIOR CONTRO Informação De Segurança Importante Sobre PRILIGY 1 Informação para o médico 2 A Ejaculação Precoce e PRILIGY PRILIGY é um medicamento oral aprovado para o tratamento da Ejaculação Precoce
MAIOR CONTRO Informação De Segurança Importante Sobre PRILIGY 1 Informação para o médico 2 A Ejaculação Precoce e PRILIGY PRILIGY é um medicamento oral aprovado para o tratamento da Ejaculação Precoce
A importância de Notificar Efeitos Indesejáveis
 Manhãs Informativas do INFARMED, I.P. A importância de Notificar Efeitos Indesejáveis Direção de Gestão do Risco de Medicamentos 4 de dezembro 2017 Programa da sessão Abertura da sessão - Conselho Diretivo
Manhãs Informativas do INFARMED, I.P. A importância de Notificar Efeitos Indesejáveis Direção de Gestão do Risco de Medicamentos 4 de dezembro 2017 Programa da sessão Abertura da sessão - Conselho Diretivo
Stelara (ustecinumab)
 Stelara (ustecinumab) Folheto para os doentes Por favor, leia este folheto com atenção, assim como o Folheto Informativo. Este folheto contém informação importante sobre Stelara, Este folheto destina-se
Stelara (ustecinumab) Folheto para os doentes Por favor, leia este folheto com atenção, assim como o Folheto Informativo. Este folheto contém informação importante sobre Stelara, Este folheto destina-se
Terapia medicamentosa
 www.printo.it/pediatric-rheumatology/br/intro Terapia medicamentosa Versão de 2016 13. Medicamentos biológicos Nos últimos anos, foram introduzidas novas perspectivas com substâncias conhecidas como agentes
www.printo.it/pediatric-rheumatology/br/intro Terapia medicamentosa Versão de 2016 13. Medicamentos biológicos Nos últimos anos, foram introduzidas novas perspectivas com substâncias conhecidas como agentes
No mieloma múltiplo, um cancro de um tipo de glóbulos brancos denominados células plasmáticas, o Revlimid é utilizado:
 EMA/113870/2017 EMEA/H/C/000717 Resumo do EPAR destinado ao público lenalidomida Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a Agência
EMA/113870/2017 EMEA/H/C/000717 Resumo do EPAR destinado ao público lenalidomida Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo como a Agência
Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA
 CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
APROVADO EM INFARMED
 FOLHETO INFORMATIVO DENOMINAÇÃO DO MEDICAMENTO Q10 Forte, 30 mg de Ubidecarenona (Coenzima Q10), cápsula. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Uma cápsula de Q10 Forte contém 30mg de ubidecarenona (coenzima
FOLHETO INFORMATIVO DENOMINAÇÃO DO MEDICAMENTO Q10 Forte, 30 mg de Ubidecarenona (Coenzima Q10), cápsula. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Uma cápsula de Q10 Forte contém 30mg de ubidecarenona (coenzima
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 18 de julho de 2014 Volume 1, Número 2 2º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 18 de julho de 2014 Volume 1, Número 2 2º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco
 Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
Anexo III Resumo das características do medicamento, rotulagem e folheto informativo
 Anexo III Resumo das características do medicamento, rotulagem e folheto informativo Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas no momento
Anexo III Resumo das características do medicamento, rotulagem e folheto informativo Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas no momento
Atenção farmacêutica especializada. Atenção Farmacêutica e Farmácia Clínica. Para poder... Objetivos dos tratamentos
 Atenção Farmacêutica e Farmácia Clínica William Rotea Junior Atenção farmacêutica especializada Objetiva atender a todas as necessidades relativas aos dos pacientes, com foco nas especificidades da doença
Atenção Farmacêutica e Farmácia Clínica William Rotea Junior Atenção farmacêutica especializada Objetiva atender a todas as necessidades relativas aos dos pacientes, com foco nas especificidades da doença
Grupo I-3-Medicamentos anti-infecciosos, antivíricos
 FOLHETO INFORMATIVO Nome do Medicamento Aciclovir Actavis mg comprimidos Aciclovir Actavis 400 mg comprimidos Composição Qualitativa e Quantitativa Cada comprimido contém: Aciclovir... ou 400 mg Forma
FOLHETO INFORMATIVO Nome do Medicamento Aciclovir Actavis mg comprimidos Aciclovir Actavis 400 mg comprimidos Composição Qualitativa e Quantitativa Cada comprimido contém: Aciclovir... ou 400 mg Forma
Anexo I. Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado
 Anexo I Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado 1 Conclusões científicas Tendo em conta o Relatório de Avaliação PRAC no PSUR para o cloridrato
Anexo I Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado 1 Conclusões científicas Tendo em conta o Relatório de Avaliação PRAC no PSUR para o cloridrato
Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento
 23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
XVIII CONGRESSO MUNDIAL DE EPIDEMILOGIA VII CONGRESSO BRASILEIRO DE EPIDEMIOLOGIA
 XVIII CONGRESSO MUNDIAL DE EPIDEMILOGIA VII CONGRESSO BRASILEIRO DE EPIDEMIOLOGIA PORTO ALEGRE SETEMBRO 2008 Dr Paulo Rogério Affonso Antonio Dra Diva Leonor Correa Longa Permanência Causada por Reações
XVIII CONGRESSO MUNDIAL DE EPIDEMILOGIA VII CONGRESSO BRASILEIRO DE EPIDEMIOLOGIA PORTO ALEGRE SETEMBRO 2008 Dr Paulo Rogério Affonso Antonio Dra Diva Leonor Correa Longa Permanência Causada por Reações
Qualidade e Segurança ao Serviço de Todos COMUNICADO
 COMUNICADO A ARFA pretende promover a notificação dos problemas com medicamentos (PRM) e reações adversas a medicamentos (RAM) em particular junto da classe médica, visando dar continuidade à campanha
COMUNICADO A ARFA pretende promover a notificação dos problemas com medicamentos (PRM) e reações adversas a medicamentos (RAM) em particular junto da classe médica, visando dar continuidade à campanha
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS ENTENDA MANUAL COMO E POR QUE. RELATAR EventoS AdversoS
 FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
Farmacovigilância LEGISLAÇÃO SANITÁRIA O QUE É FARMACOVIGILÂNCIA? INÍCIO INTRODUÇÃO INTRODUÇÃO FARMACOVIGILÂNCIA 21/11/2010
 LEGISLAÇÃO INÍCIO Deborah Masano Cavaloti Manira Georges Soufia SANITÁRIA - PROF. PALUDETTI - Farmacovigilância O risco do uso de remédios é conhecido desde a Antiguidade. Entretanto, pode-se dizer que
LEGISLAÇÃO INÍCIO Deborah Masano Cavaloti Manira Georges Soufia SANITÁRIA - PROF. PALUDETTI - Farmacovigilância O risco do uso de remédios é conhecido desde a Antiguidade. Entretanto, pode-se dizer que
Contrato Público de Aprovisionamento. Data de Entrada em Vigor Entrada em Vigor Vigência
 CP 2015/7 - Hormonas e outros Medicamentos usados no Tratamento de Doenças Endócrinas 18-08-2015 No dia 18/08/2015 entrarão em vigor CP 2014/10 - Material de Penso de Efeito Terapêutico 03-08-2015 No dia
CP 2015/7 - Hormonas e outros Medicamentos usados no Tratamento de Doenças Endócrinas 18-08-2015 No dia 18/08/2015 entrarão em vigor CP 2014/10 - Material de Penso de Efeito Terapêutico 03-08-2015 No dia
Lipophoral Tablets 150mg. Mediator 150 mg Comprimido Via oral. Benfluorex Mylan 150 mg Comprimido Via oral. Benfluorex Qualimed
 ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
Editorial. Pontos de especial interesse:
 Editorial 18 de Outubro de 2018 Volume 5, Número 3 3º Trimestre de 2018 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Editorial 18 de Outubro de 2018 Volume 5, Número 3 3º Trimestre de 2018 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 7 Conclusões científicas O pó e solvente Solu-Medrol 40 mg para solução para injeção (a seguir designado «Solu-Medrol») contém metilprednisolona e, tratando-se de um excipiente,
Anexo II Conclusões científicas 7 Conclusões científicas O pó e solvente Solu-Medrol 40 mg para solução para injeção (a seguir designado «Solu-Medrol») contém metilprednisolona e, tratando-se de um excipiente,
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Meloxidyl 1,5 mg/ml suspensão oral para cães. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Composição para 1 ml Substância(s)
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Meloxidyl 1,5 mg/ml suspensão oral para cães. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Composição para 1 ml Substância(s)
Cuidados Paliativos no AVC em fase aguda
 Universidade de Lisboa Faculdade de Medicina de Lisboa Cuidados Paliativos no AVC em fase aguda Maria João da Silva Duarte Mestrado de Cuidados Paliativos (6ª Edição) Lisboa 2011 A impressão desta dissertação
Universidade de Lisboa Faculdade de Medicina de Lisboa Cuidados Paliativos no AVC em fase aguda Maria João da Silva Duarte Mestrado de Cuidados Paliativos (6ª Edição) Lisboa 2011 A impressão desta dissertação
RESUMO DA AVALIAÇÃO CIENTÍFICA DE MEDICAMENTOS CONTENDO ÁCIDO VALPRÓICO/VALPROATO (ver Anexo I)
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 108 CONCLUSÕES
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 108 CONCLUSÕES
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016
 RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA
 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
Fabricado por: Sofarimex Industria Química e Farmacêutica L.da,
 FOLHETO INFORMATIVO Leia atentamente este folheto informativo antes de tomar o medicamento - Conserve este folheto. Pode ter necessidade de o ler novamente. - Caso tenha dúvidas, consulte o seu médico
FOLHETO INFORMATIVO Leia atentamente este folheto informativo antes de tomar o medicamento - Conserve este folheto. Pode ter necessidade de o ler novamente. - Caso tenha dúvidas, consulte o seu médico
O Pradaxa é um medicamento que contém a substância ativa etexilato de dabigatran. Está disponível em cápsulas (75, 110 e 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Resumo do EPAR destinado ao público etexilato de dabigatran Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo
EMA/47517/2015 EMEA/H/C/000829 Resumo do EPAR destinado ao público etexilato de dabigatran Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao. O seu objetivo é explicar o modo
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO. Tratamento sintomático da obstipação em crianças com idade entre 6 meses e 8 anos.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Casenlax 500 mg/ml solução oral 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml de produto contém 500 mg de Macrogol 4000. Lista completa
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Casenlax 500 mg/ml solução oral 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml de produto contém 500 mg de Macrogol 4000. Lista completa
Índice. Índice de Figuras. Índice de Tabelas. Lista de Abreviaturas. Resumo e Palavras-chave. 1. Introdução Objetivos 6
 Índice Índice de Figuras iii Índice de Tabelas iv Lista de Abreviaturas v Resumo e Palavras-chave vii 1. Introdução 1 2. Objetivos 6 3. Materiais e Métodos 8 4. Resultados e Discussão 10 5. Conclusão 17
Índice Índice de Figuras iii Índice de Tabelas iv Lista de Abreviaturas v Resumo e Palavras-chave vii 1. Introdução 1 2. Objetivos 6 3. Materiais e Métodos 8 4. Resultados e Discussão 10 5. Conclusão 17
Nome de fantasia Dosagem Forma farmacêutica. VASOBRAL, comprimido sulcado. VASOBRAL, A solução oral num frasco. 0.
 Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s) do(s) titular(es) da(s) Autorização(ões) de Introdução no mercado nos Estados-Membros 1
Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s) do(s) titular(es) da(s) Autorização(ões) de Introdução no mercado nos Estados-Membros 1
Tipos de Estudos Científicos e Níveis de Evidência
 Tipos de Estudos Científicos e Níveis de Evidência Francisco Batel Marques, PhD Professor, School of Pharmacy, University of Coimbra Director, CHAD Centro de Avaliação de Tecnologias em Saúde e Investigação
Tipos de Estudos Científicos e Níveis de Evidência Francisco Batel Marques, PhD Professor, School of Pharmacy, University of Coimbra Director, CHAD Centro de Avaliação de Tecnologias em Saúde e Investigação
Editorial. Pontos de especial interesse:
 Editorial 26 de Julho de 2019 Volume 6, Número 2 2º Trimestre de 2019 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de várias questões relacionadas
Editorial 26 de Julho de 2019 Volume 6, Número 2 2º Trimestre de 2019 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de várias questões relacionadas
Electroconvulsivoterapia de Continuação e Manutenção
 Electroconvulsivoterapia de Continuação e Manutenção Ricardo Coentre Assistente Hospitalar de Psiquiatria Curso Teórico-Prático de Electroconvulsivoterapia Hospital Beatriz Ângelo, Loures, Portugal 10
Electroconvulsivoterapia de Continuação e Manutenção Ricardo Coentre Assistente Hospitalar de Psiquiatria Curso Teórico-Prático de Electroconvulsivoterapia Hospital Beatriz Ângelo, Loures, Portugal 10
Divulgação geral, Hospitais do SNS e Profissionais de Saúde
 Circular Normativa N.º 01/CD/2012 Data: 30/11/2012 Assunto: Para: Procedimentos de cedência de medicamentos no ambulatório hospitalar Divulgação geral, Hospitais do SNS e Profissionais de Saúde Contacto:
Circular Normativa N.º 01/CD/2012 Data: 30/11/2012 Assunto: Para: Procedimentos de cedência de medicamentos no ambulatório hospitalar Divulgação geral, Hospitais do SNS e Profissionais de Saúde Contacto:
Quetiapina SR Zentiva
 Quetiapina SR Zentiva Minimização e gestão de riscos importantes Material educacional para profissionais de saúde Conteúdo O que é Quetiapina SR Zentiva?... 2 Quais os riscos importantes associados a Quetiapina
Quetiapina SR Zentiva Minimização e gestão de riscos importantes Material educacional para profissionais de saúde Conteúdo O que é Quetiapina SR Zentiva?... 2 Quais os riscos importantes associados a Quetiapina
Nos termos da alínea a) do nº 2 do artigo 2º do Decreto Regulamentar nº 14/2012, de 26 de janeiro, emite-se a Norma seguinte:
 NORMA NÚMERO: 007/2017 DATA: ATUALIZAÇÃO: ASSUNTO: PALAVRAS-CHAVE: 12/06/2017 24/04/2019 Procedimento para disponibilização da reserva estratégica nacional de imunoglobulina contra a raiva (REN IgR) Raiva;
NORMA NÚMERO: 007/2017 DATA: ATUALIZAÇÃO: ASSUNTO: PALAVRAS-CHAVE: 12/06/2017 24/04/2019 Procedimento para disponibilização da reserva estratégica nacional de imunoglobulina contra a raiva (REN IgR) Raiva;
Contrato Público de Aprovisionamento. Data de Entrada em Vigor Entrada em Vigor Vigência
 Mapa da Entrada em Vigor d disponíveis no Catálogo 24/05/2016 CP 2016/112 - Prestação de Serviços de Consultadoria na Área da Saúde e Segurança 25-05-2016 No dia 25/05/2016 entrarão em vigor. CP 2015/6
Mapa da Entrada em Vigor d disponíveis no Catálogo 24/05/2016 CP 2016/112 - Prestação de Serviços de Consultadoria na Área da Saúde e Segurança 25-05-2016 No dia 25/05/2016 entrarão em vigor. CP 2015/6
Trombocitopenia induzida pela heparina
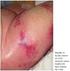 Trombocitopenia induzida pela heparina Novembro 2012 ULSM Hospital Pedro Hispano, Matosinhos Distinguir Terapêutica curta duração: Profilática Emergência Heparina via parentérica Heparinas baixo peso molecular
Trombocitopenia induzida pela heparina Novembro 2012 ULSM Hospital Pedro Hispano, Matosinhos Distinguir Terapêutica curta duração: Profilática Emergência Heparina via parentérica Heparinas baixo peso molecular
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI brodalumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5721956 Kyntheum 2 unidades de 1,5ml/
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI brodalumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5721956 Kyntheum 2 unidades de 1,5ml/
Adoção de CDS no Hospital Digital. Dr. Claudio Giulliano Alves da Costa MD, MSc, CPHIMS Diretor da FOLKS Consultoria
 Adoção de CDS no Hospital Digital Dr. Claudio Giulliano Alves da Costa MD, MSc, CPHIMS Diretor da FOLKS Consultoria Contato Claudio Giulliano Alves da Costa claudio@folkstic.com HIMSS Analytics Certified
Adoção de CDS no Hospital Digital Dr. Claudio Giulliano Alves da Costa MD, MSc, CPHIMS Diretor da FOLKS Consultoria Contato Claudio Giulliano Alves da Costa claudio@folkstic.com HIMSS Analytics Certified
Transfusão de sangue. Informação para os pacientes sobre os benefícios, riscos e alternativas
 Transfusão de sangue Blood Transfusion Portuguese Informação para os pacientes sobre os benefícios, riscos e alternativas Quais são os benefícios da transfusão de sangue? A transfusão de sangue pode ajudar
Transfusão de sangue Blood Transfusion Portuguese Informação para os pacientes sobre os benefícios, riscos e alternativas Quais são os benefícios da transfusão de sangue? A transfusão de sangue pode ajudar
Farmacovigilância: notificar é preciso
 Farmacovigilância: notificar é preciso Dra. Ana Maria Sortino-Rachou Comissão de Farmacovigilância Conhecimento dos médicos prescritores Sinais de alerta na prescrição eletrônica Conhecimento dos farmacêuticos
Farmacovigilância: notificar é preciso Dra. Ana Maria Sortino-Rachou Comissão de Farmacovigilância Conhecimento dos médicos prescritores Sinais de alerta na prescrição eletrônica Conhecimento dos farmacêuticos
Cartão de Alerta do Paciente
 Cartão de Alerta do Paciente Hemcibra MD (emicizumabe) Injeção subcutânea Cartão de Alerta do Paciente para garantir o uso seguro de Hemcibra MD (emicizumabe) no tratamento da hemofilia A. Este material
Cartão de Alerta do Paciente Hemcibra MD (emicizumabe) Injeção subcutânea Cartão de Alerta do Paciente para garantir o uso seguro de Hemcibra MD (emicizumabe) no tratamento da hemofilia A. Este material
Sistemas de Imputação e. Curso de Formação em Farmacovigilância Unidade de Farmacovigilância do Norte
 Sistemas de Imputação e Avaliação da Causalidade Curso de Formação em Farmacovigilância Unidade de Farmacovigilância do Norte Dados da notificação; Fontes de Informação Informações adicionais fornecidas
Sistemas de Imputação e Avaliação da Causalidade Curso de Formação em Farmacovigilância Unidade de Farmacovigilância do Norte Dados da notificação; Fontes de Informação Informações adicionais fornecidas
Preditores de lesão renal aguda em doentes submetidos a implantação de prótese aórtica por via percutânea
 Preditores de lesão renal aguda em doentes submetidos a implantação de prótese aórtica por via percutânea Sérgio Madeira, João Brito, Maria Salomé Carvalho, Mariana Castro, António Tralhão, Francisco Costa,
Preditores de lesão renal aguda em doentes submetidos a implantação de prótese aórtica por via percutânea Sérgio Madeira, João Brito, Maria Salomé Carvalho, Mariana Castro, António Tralhão, Francisco Costa,
