FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
|
|
|
- André Escobar Aquino
- 7 Há anos
- Visualizações:
Transcrição
1 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 22 de Abril de 2016 Volume 3, Número 1 1º Trimestre de 2016 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca das novas medidas de segurança referentes à utilização dos medicamentos trametinib (Mekinist ), idelalisib (Zydelig ), corticosteroides para inalação, espironolactona e modificadores do eixo renina angiotensina, antivirais de ação direta, meios de contraste contendo gadolíneo e fusafungina para pulverização bucal ou nasal. São ainda apresentadas, as atividades científicas e os resultados das atividades da Unidade de Farmacovigilância do Centro (UFC), referentes ao primeiro trimestre de Nesta edição: Notas de segurança 2 Pontos de especial interesse: Trametinib (Mekinist ): risco de perfuração gastrointestinal e de colite Idelalisib (Zydelig ): recomendações provisórias de segurança Atividade científica da UFC 8 Corticosteroides para inalação: risco de desenvolvimento de pneumonia Espironolactona e modificadores do eixo renina angiotensina na insuficiência cardíaca: risco de hipercaliémia potencialmente fatal Resultados da atividade da UFC Q&A 10 8 Antivirais de ação direta (hepatite C): Reativação da hepatite B Meios de contraste contendo gadolínio: deposição de gadolínio nos tecidos cerebrais Fusafungina para pulverização bucal ou nasal: recomendação de retirada do mercado
2 Notas de Segurança Trametinib (Mekinist ): risco de perfuração gastrointestinal e de colite Trametinib (Mekinist ) está autorizado, quer em monoterapia, quer em associação com dabrafenib, para o tratamento de adultos com melanoma irresetável ou metastático, com uma mutação BRAF V600. Aquando a sua utilização, devem ser tidos em conta, os fatores de risco para perfuração gastrointestinal. Referência: 1. Kass SL, Linden AF, Jackson, PG. Bowel perforation associated with robust response to BRAF/ MEK inhibitor therapy for BRAF-mutant melanoma: a case report. Melanoma Manag 2015; 2: Risco de perfuração gastrointestinal ou colite Uma revisão de estudos clínicos e de casos de suspeitas de reação adversa a medicamento, reportados por profissionais de saúde ou descritos na literatura, concluiu que trametinib pode causar perfuração gastrointestinal ou colite. Esta revisão avaliou todos os casos descritos até 19 de Novembro de 2015 e identificou 4 doentes que morreram, devido a perfuração gastrointestinal aquando do tratamento com trametinib. Casos descritos na literatura Dos casos de suspeita de reação adversa a medicamento em que foi estabelecida relação causal com trametinib, pelo menos provável, a maioria foi relativa a perfuração gastrointestinal (13 de 19); foram ainda reportados casos de perfuração gastrointestinal e colite (3) ou de apenas colite (3). A maioria dos casos de perfuração gastrointestinal documentava a existência de fatores de risco, tais como, metástases gastrointestinais, diverticulite ou o uso concomitante de fármacos que podem causar perfuração gastrointestinal (corticosteróides ou anti-inflamatórios não esteróides). A maioria dos casos ocorreu em doentes que receberam trametinib em associação com dabrafenib. O risco parece ser mais elevado durante os primeiros dois meses de terapia com trametinib, quer em monoterapia quer em associação com dabrafenib. De acordo com os ensaios clínicos de trametinib (em monoterapia) a incidência de colite ou perfuração gastrointestinal é de, aproximadamente, 1 em 200. Potenciais mecanismos Os efeitos inibitórios de trametinib na angiogénese e na proliferação de células epiteliais gastrointestinais podem contribuir para o desenvolvimento de perfuração gastrointestinal. Em doentes com metástases gastrointestinais pode ocorrer, simultaneamente, uma redução acelerada do tumor devido à associação de trametinib e dabrafenib, o que pode resultar em perfuração gastrointestinal no local das metástases. 1 Recomendações para o profissional de saúde: Aquando o tratamento com trametinib, quer em monoterapia, quer em associação com dabrafenib, devem ser ponderados os fatores de risco para perfuração gastrointestinal, tais como metástases gastrointestinais, diverticulite ou uso concomitante de fármacos que possam causar perfuração gastrointestinal. O profissional de saúde deve estar atento a sinais e sintomas de perfuração gastrointestinal. Os doentes devem ser aconselhados a procurar cuidados médicos, urgentemente, se desenvolverem dores abdominais severas. Página 2 Adaptado de Drug Safety Update Vol 9 issue 8 March 2016: 1
3 Idelalisib (Zydelig ): recomendações provisórias de segurança Notas de Segurança O Comité de Avaliação do Risco em Farmacovigilância (PRAC) da Agência Europeia de Medicamentos (EMA) emitiu recomendações provisórias para garantir que o medicamento idelalisib (Zydelig ) continua a ser utilizado em segurança. O idelalisib está autorizado para o tratamento de leucemia linfocítica crónica (LLC) e linfoma folicular. Este medicamento encontra-se sob revisão de segurança, devido ao aumento da ocorrência de eventos adversos graves que incluíram mortes em três ensaios clínicos. A maioria das mortes deveram-se essencialmente a pneumonias por Pneumocystis jirovecii, infeções por citomegalovirus e outros eventos respiratórios. Recomendações para o profissional de saúde: O idelalisib não deve ser administrado como primeira linha em doentes com LLC, cujas células cancerígenas tenham deleção em 17p ou mutação da TP53, ou em doentes com infeção sistémica; O idelalisib pode continuar a ser utilizado em combinação apenas com o rituximab, em doentes com LLC que receberam, pelo menos, uma terapêutica prévia, e em monoterapia em doentes com linfoma folicular que sejam refratários a duas linhas de tratamento; Os doentes que estejam a fazer terapêutica com idelalisib para LLC devem ser reavaliados e o tratamento só deve ser continuado se os benefícios superarem os riscos. Devem fazer tratamento profilático da pneumonia por P. jirovecii e ser monitorizados para os sintomas e sinais respiratórios. Devem, ainda, ser monitorizadas a sua função respiratória, infeção por citomegalovírus e deteção de neutropenia. No caso de o doente apresentar uma neutropenia moderada ou grave, o tratamento com idelalisib deve ser reavaliado, podendo ser interrompido. Adaptado de Circular Informativa N.º 44/CD/ Infarmed Corticosteroides para inalação: risco de desenvolvimento de pneumonia O Comité de Avaliação do Risco em Farmacovigilância (PRAC) da Agência Europeia de Medicamentos (EMA) concluiu a avaliação do risco de desenvolvimento de pneumonia em doentes com doença pulmonar obstrutiva crónica (DPOC), tratados com medicamentos contendo corticosteroides para inalação. O PRAC considera que, apesar de os doentes com DPOC tratados com corticosteroides para inalação apresentarem maior risco de desenvolver pneumonia, os benefícios destes medicamentos continuam a ser superiores aos riscos. Adicionalmente, não foram identificadas diferenças no risco de pneumonia entre os vários corticosteroides avaliados. Com base na avaliação realizada, o PRAC considerou que a informação destes medicamentos deve ser atualizada para incluir a referência à necessidade de os médicos e doentes com DPOC estarem atentos aos sinais e sintomas de pneumonia, uma vez que estes se podem confundir com os da exacerbação da doença subjacente. Adaptado de Circular Informativa N.º 43/CD/ Infarmed Os corticosteroides são uma classe de medicamentos que, quando usados por via inalatória, reduzem a inflamação nos pulmões facilitando a respiração. Estes medicamentos são utilizados no tratamento da DPOC com recurso a dispositivos para inalação. Página 3
4 Espironolactona e modificadores do eixo renina angiotensina na insuficiência cardíaca: risco de hipercaliémia potencialmente fatal No tratamento da insuficiência cardíaca em doentes tratados com uma associação entre um bloqueador da entrada do cálcio e um inibidor da enzima de conversão da angiotensina (IECA) ou um antagonista dos recetores da angiotensina (ARA), é essencial a monitorização de eletrólitos no sangue. Risco de hipercaliémia com espironolactona Recomendações para o profissional de saúde: A espironolactona está recomendada para doentes com insuficiência cardíaca congestiva. A espironolactona é um antagonista competitivo da aldosterona que leva ao aumento da excreção de sódio, enquanto reduz a perda de potássio ao nível do túbulo renal distal. Este mecanismo de ação facilita a ocorrência de hipercaliémia, especialmente em doentes que tenham insuficiência renal. Como tal, a espironolactona não deve ser prescrita a doentes com esta condição ou que já apresentem hipercaliémia. Risco de hipercaliémia com modificadores do eixo renina angiotensina Os IECAs são, principalmente, prescritos a doentes com hipertensão ou insuficiência cardíaca. Os ARAs estão também indicados no tratamento da hipertensão e alguns estão ainda indicados no tratamento da insuficiência cardíaca. A disfunção renal e o aumento do potássio sérico são efeitos adversos conhecidos de ambos os grupos de fármacos. Factores de risco, tais como a insuficiência cardíaca ou a diabetes mellitus, são mais comuns em doentes que requeiram terapêutica com estes fármacos. A desidratação pode também aumentar o risco de insuficiência renal, levando a hipercaliémia. Estima-se que a ocorrência de hipercaliémia em doentes tratados com IECAs ou ARAs seja de 1 em 100 e de 1 em 1000, respetivamente. O uso concomitante de espironolactona com IECAs ou ARAs não é comummente recomendado, devido aos riscos de hipercaliémia severa, particularmente em doentes com insuficiência renal acentuada. Caso a co-administração seja essencial devem ser prescritas as doses mais baixas, quer da espironolactona, quer do IECA ou do ARA. Devem ser monitorizados regularmente os níveis séricos de potássio e a função renal. Caso ocorra hipercaliémia, a terapia deve ser imediatamente descontinuada ou interrompida. Adaptado de Drug Safety Update volume 9 issue 6 February 2016: 2. Antivirais de ação direta (hepatite C): Reativação da hepatite B A Agência Europeia de Medicamentos (EMA) iniciou uma revisão de segurança dos antivirais de ação direta, utilizados no tratamento da hepatite C crónica, para investigar uma possível reativação da hepatite B. Esta revisão surge na sequência da notificação de casos de reativação da hepatite B em doentes infetados com vírus da hepatite B e C e que tinham sido tratados com antivirais de ação direta para a hepatite C. Página 4 A EMA irá agora avaliar a extensão da reativação da hepatite B em doentes tratados com antivirais de ação direta para o tratamento da hepatite C e analisar a necessidade de tomar medidas adicionais para otimizar o tratamento. Adaptado de Circular Informativa N.º 42/CD/
5 Meios de contraste contendo gadolínio: deposição de gadolínio nos tecidos cerebrais A Agência Europeia de Medicamentos (EMA) iniciou uma revisão de segurança para avaliar o risco de deposição de gadolínio nos tecidos cerebrais, após utilização de meios de contraste contendo gadolínio, em doentes para imagiologia por ressonância magnética. Os meios de contraste, contendo gadolínio, incluem as seguintes substâncias ativas: ácido gadobénico, gadobutrol, gadodiamida, ácido gadopentético, ácido gadotérico, gadoteridol, gadoversetamida e ácido gadoxético. Em Portugal, estão comercializados os meios de contraste MultiHance, Gadovist, Omniscan, Magnevist, Dotarem, Optimark e Primovist. Estes medicamentos podem ser administrados antes ou durante a ressonância magnética para intensificação do contraste, ajudando a obter melhores imagens dos órgão e tecidos. Após administração, os meios de contaste contendo gadolínio são maioritariamente eliminados pelos rins, mas alguns estudos indicam que este elemento pode acumular-se em certos tecidos e órgãos, incluindo fígado, rins, músculos, pele e ossos. Publicações recentes 1-7 relatam que estes meios de contraste também se podem acumular no tecido cerebral. Em Janeiro de 2016, o Comité de Avaliação do Risco em Farmacovigilância (PRAC) da EMA reviu estas publicações. Apesar de não terem sido notificados efeitos adversos relacionados com a deposição de gadolínio no cérebro, o PRAC irá realizar uma revisão de segurança para avaliar este risco. 1 Errante Y, et al. Investigative radiology 2014;49 (10): Kanda T, et al. Radiology 2015;276 (1): Kanda T, et al. Radiology 2014;270(3): Kanda T, et al. Radiology 2015;275(3): McDonald RJ, et al. Radiology 2015;275(3): Quattrocchi CC, et al. Investigative radiology 2015;50(7): Radbruch A, et al. Radiology 2015;275(3): Adaptado de Drug Safety Update vol 9 issue 3, November 2015: 1. Fusafungina para pulverização bucal ou nasal: recomendação de retirada do mercado O Comité de Avaliação do Risco em Farmacovigilância (PRAC) da Agência Europeia do Medicamento (EMA) recomenda a revogação das autorizações de introdução no mercado dos medicamentos contendo fusafungina. A fusafungina é um antibiótico usado no tratamento local de infeções das vias aéreas superiores como rinofaringite, sinusite e amigdalite. Esta recomendação do PRAC surge na sequência da revisão de segurança que avaliou os riscos de reações alérgicas graves em doentes a usar fusafungina, tendo -se concluído que os benefícios do medicamento não são superiores aos riscos. A maioria das reações alérgicas graves ocorreu logo após o uso do medicamento e incluíram broncospasmo. Apesar destas reações serem raras, podem ser fatais e não foram identificadas medidas que pudessem minimizar significativamente este risco. O PRAC avaliou também o aumento de resistências bacterianas causado pela fusafungina, tendo concluído que, apesar das evidências serem insuficientes, este risco não pode ser excluído. Em relação aos efeitos benéficos da fusafungina, o PRAC considerou que são reduzidos, tendo em conta a natureza ligeira e auto-limitada das infeções das vias aéreas superiores. Até decisão final do Grupo de Coordenação (CMDh), os medicamentos que contêm fusafungina continuarão disponíveis no mercado. Adaptado de Circular Informativa N.º 018/CD/ Página 5
6 Atividade científica da Unidade de Farmacovigilância do Centro (UFC) Congressos Científicos Os colaboradores da Unidade de Farmacovigilância do Centro (UFC) apresentaram, no último trimestre, quatro estudos de investigação em farmacovigilância e segurança de medicamentos na Reunião Anual da Sociedade Portuguesa de Farmacologia. Os títulos dos estudos e as ligações ao texto integral são apresentadas em baixo. XLVI Reunião Anual da Sociedade Portuguesa de Farmacologia, Porto, Portugal, 4-6 de Fevereiro de 2016 Comunicação Oral. Penedones, A. Alves, C. Mendes, D. Batel Marques, F. A systematic review and meta-analysis of the association between systemic fluoroquinolones and retinal detachment. Comunicação Oral. Mendes, D. Alves, C. Batel Marques, F. Testing the use of the number needed to harm (NNH) in benefit-risk evaluations of drugs withdrawn from the European market due to safety reasons. Comunicação Oral. Batel Marques, F. Mendes, D. Penedones, A. Alves, C. Pharmacovigilance outcomes over a six years period of time: an update. Comunicação Oral. Alves, C. Ribeiro, I. Penedones, A. Mendes, D. Batel Marques, F. Risk of ophthalmic adverse effects in cancer patients treated with MEK inhibitors: a systematic review and meta-analysis. Publicações A Acta Ophthalmologica publicou um estudo realizado por colaboradores da UFC, sobre o desenvolvimento de descolamento da retina associado à utilização de fluoroquinolonas, utilizando a técnica da revisão sistemática e meta-análise. O resumo do estudo encontra-se descrito abaixo. Acta Ophthalmologica Página 6
7 FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos, Volume 1, Número 4 FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos, Volume 3, Número 1 Purpose: Several pharmacoepidemiologic studies have been carried out evaluating the risk of retinal detachment associated with systemic fluoroquinolones. This meta-analysis aims to investigate such association, in the light of the best scientific evidence available. Methods: A literature search was conducted to identify relevant studies evaluating the risk for retinal detachment associated with systemic fluoroquinolones. A meta-analysis was performed to pool rate ratios (RRs). Meta -regressions were conducted aiming to evaluate the influence of time interval between fluoroquinolones use and retinal detachment diagnosis or treatment risk estimates. Results: Ten observational studies from seven publications were included. Overall, fluoroquinolones were not associated with an increased risk for retinal detachment [RR 1.47 (95% CI ): p = 0.09; I2 = 92.8%]. When the analysis was stratified according to different study designs, the result was statistically significant for retrospective cohort studies [RR 1.87 (95% CI ); p < 0.001; I2 = 0.0%] and for past users of fluoroquinolones, based on data from case-control studies [RR 1.07 (95% CI ); p = 0.01; I2 = 0.0%]. According to meta-regressions, the risk for retinal detachment did not vary due to different time intervals between fluoroquinolones prescription and retinal detachment occurrence. No statistically significant results were identified among studies evaluating only rhegmatogenous retinal detachments, as well as among studies that evaluated patients not requiring a prior ophthalmologist visit to be included. Conclusions: In light of the current available evidence, systemic fluoroquinolones do not seem to be associated with retinal detachment. Acta Ophthalmol Feb 5. doi: /aos [Epub ahead of print] Resultados da atividade da Unidade de Farmacovigilância do Centro (UFC) A Unidade de Farmacovigilância do Centro (UFC) recebeu um total de 68 notificações espontâneas de reações adversas a medicamentos entre 1 de Janeiro e 31 de Março de As Figuras dispostas na página seguinte apresentam a distribuição das notificações espontâneas de acordo com o local de origem, o tipo de notificador, a gravidade, o conhecimento prévio, a imputação de causalidade atribuída à relação entre a ocorrência da reação adversa e a exposição ao medicamento suspeito e o grupo terapêutico do medicamento suspeito. Página 7
8 Grave uma reação adversa que resultou em morte, colocou a vida em risco, motivou ou prolongou o internamento, resultou em incapacidade significativa, causou anomalias congénitas ou outra clinicamente importante. Não descrito uma notificação espontânea contendo, pelo menos, uma reação adversa cuja descrição não está incluída no resumo das características do medicamento suspeito. I: Medicamentos anti-infeciosos; II: Sistema Nervoso Central; IV: Sangue; V: Aparelho respiratório; VI: Aparelho digestivo; VII: Aparelho geniturinário; VIII: Hormonas e medicamentos usados no tratamento das doenças endócrinas; IX: Aparelho locomotor; XIII: Medicamentos usados em afeções cutâneas; XVI: Medicamentos antineoplásicos e imunomoduladores; XVIII: Vacinas e imunoglobulinas; IXX: Meios de diagnóstico. Página 8
9 FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos, Volume 1, 3, Número 41 Q&A Todos os profissionais de saúde e utentes/consumidores podem utilizar o ufc@aibili.pt para colocarem questões relacionadas com a segurança de medicamentos. As questões serão respondidas por e/ou através de publicação nas próximas edições deste boletim. Como notificar suspeitas de reações adversas a medicamentos à UFC? Portal RAM (online) UFC, AIBILI Notificação de reações adversas (online) Boletins de notificação para imprimir MEDICAMENTOS_USO_HUMANO/FARMACOVIGILANCIA/NOTIFICACAO_DE_RAM Unidade de Farmacovigilância do Centro (UFC) Tel: Fax: ufc@aibili.pt Ficha técnica Unidade de Farmacovigilância do Centro (UFC) AIBILI Azinhaga de Santa Comba - Celas Coimbra Portugal Tel: Fax: ufc@aibili.pt Título: FARMACOVIGILÂNCIA - Atualizações de segurança de medicamentos Editor: Unidade de Farmacovigilância do Centro (UFC), AIBILI - Associação para Investigação Biomédica e Inovação em Luz e Imagem. Diretor: Tice Macedo Produção: Ana Penedones, Diogo Mendes, Carlos Alves. Coordenação da UFC: Francisco Batel Marques, Carlos Fontes Ribeiro. Conselho Científico da UFC: Carlos Fontes Ribeiro, Francisco Batel Marques, Luiz Miguel Santiago, Margarida Caramona, Maria Angelina Martins, Patrícia Dinis Dias, Ricardo Correia de Matos, Tice Macedo. Apoio técnico: Daniel Sanches Fernandes. ISSN:
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 28 de Abril de 2017 Volume 4, Número 1 1º Trimestre de 2017 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 28 de Abril de 2017 Volume 4, Número 1 1º Trimestre de 2017 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Outubro de 2016 Volume 3, Número 3 3º Trimestre de 2016 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Outubro de 2016 Volume 3, Número 3 3º Trimestre de 2016 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Anexo III Alterações às secções relevantes do resumo das características do medicamento e do folheto informativo
 Anexo III Alterações às secções relevantes do resumo das características do medicamento e do folheto informativo Nota: Estas alterações às secções relevantes do resumo das características do medicamento
Anexo III Alterações às secções relevantes do resumo das características do medicamento e do folheto informativo Nota: Estas alterações às secções relevantes do resumo das características do medicamento
esclarecimento sobre reacções adversas INFARMED, I.P.
 Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 30 de outubro de 2017 Volume 4, Número 3 3º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 30 de outubro de 2017 Volume 4, Número 3 3º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE
 GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE FLIXABI é um medicamento biológico. Para fins de rastreabilidade, é importante registar, sempre que possível, o nome de marca e o número de
GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE FLIXABI é um medicamento biológico. Para fins de rastreabilidade, é importante registar, sempre que possível, o nome de marca e o número de
Anexo I. Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado
 Anexo I Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado 1 Conclusões científicas Tendo em conta o Relatório de Avaliação PRAC no PSUR para o cloridrato
Anexo I Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado 1 Conclusões científicas Tendo em conta o Relatório de Avaliação PRAC no PSUR para o cloridrato
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 18 de julho de 2014 Volume 1, Número 2 2º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 18 de julho de 2014 Volume 1, Número 2 2º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Janeiro de 2016 Volume 2, Número 4 4º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Janeiro de 2016 Volume 2, Número 4 4º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 57 Conclusões científicas Em 7 de junho de 2017, a Comissão Europeia (CE) foi informada da ocorrência de um caso fatal de falência hepática fulminante, registado num doente
Anexo IV Conclusões científicas 57 Conclusões científicas Em 7 de junho de 2017, a Comissão Europeia (CE) foi informada da ocorrência de um caso fatal de falência hepática fulminante, registado num doente
Turma(s): C11, C12, C13, C14, C21, C22, C23, C24, D11, D12, D13, D14, D21, D22, D23, D24
 AULA n.º: 1 Dia 28-02-2018 das 14:00 às 17:00 Apresentação: disciplina, docente, avaliação, programa, bibliografia. I - FARMACOLOGIA GERAL: 1. PRINCÍPIOS FUNDAMENTAIS DA FARMACOLOGIA A importância e âmbito
AULA n.º: 1 Dia 28-02-2018 das 14:00 às 17:00 Apresentação: disciplina, docente, avaliação, programa, bibliografia. I - FARMACOLOGIA GERAL: 1. PRINCÍPIOS FUNDAMENTAIS DA FARMACOLOGIA A importância e âmbito
ANEXO III ALTERAÇÃO AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO
 ANEXO III ALTERAÇÃO AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 1 ALTERAÇÕES QUE DEVEM SER INCLUÍDAS NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO PARA OS MEDICAMENTOS
ANEXO III ALTERAÇÃO AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 1 ALTERAÇÕES QUE DEVEM SER INCLUÍDAS NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO PARA OS MEDICAMENTOS
Turma(s): A11, A12, A13, A14, A21, A22, A23, A24, B11, B12, B13, B14, B21, B22, B23, B24
 AULA n.º: 1 Dia 27-09-2016 das 14:00 às 17:00 Ana Leonor Alves Ribeiro Apresentação: disciplina, docente, avaliação, programa, bibliografia. I - FARMACOLOGIA GERAL: 1. PRINCÍPIOS FUNDAMENTAIS DA FARMACOLOGIA
AULA n.º: 1 Dia 27-09-2016 das 14:00 às 17:00 Ana Leonor Alves Ribeiro Apresentação: disciplina, docente, avaliação, programa, bibliografia. I - FARMACOLOGIA GERAL: 1. PRINCÍPIOS FUNDAMENTAIS DA FARMACOLOGIA
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Julho de 2016 Volume 3, Número 2 2º Trimestre de 2016 Editorial Nesta edição: Nesta edição do boletim
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Julho de 2016 Volume 3, Número 2 2º Trimestre de 2016 Editorial Nesta edição: Nesta edição do boletim
Brochura Educacional para os Médicos Prescritores sobre a PrEP
 Brochura Educacional para os Médicos Prescritores sobre a PrEP Informação de segurança importante para os médicos prescritores sobre a profilaxia pré-exposição (PrEP) com Emtricitabina/Tenofovir disoproxil
Brochura Educacional para os Médicos Prescritores sobre a PrEP Informação de segurança importante para os médicos prescritores sobre a profilaxia pré-exposição (PrEP) com Emtricitabina/Tenofovir disoproxil
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
 25 February 2016 EMA/PRAC/137770/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
25 February 2016 EMA/PRAC/137770/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais de segurança
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 15 de abril de 2014 Volume 1, Número 1 1º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 15 de abril de 2014 Volume 1, Número 1 1º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
PIROXICAM. Anti-Inflamatório, Analgésico e Antipirético. Descrição
 PIROXICAM Anti-Inflamatório, Analgésico e Antipirético Descrição Piroxicam é um anti-inflamatório não esteroide (AINE), indicado para uma variedade de condições que requeiram atividade anti-inflamatória
PIROXICAM Anti-Inflamatório, Analgésico e Antipirético Descrição Piroxicam é um anti-inflamatório não esteroide (AINE), indicado para uma variedade de condições que requeiram atividade anti-inflamatória
Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento
 23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a revogação ou alteração dos termos das Autorizações de Introdução no Mercado e explicação detalhada para as diferenças relativamente à recomendação do
Anexo II Conclusões científicas e fundamentos para a revogação ou alteração dos termos das Autorizações de Introdução no Mercado e explicação detalhada para as diferenças relativamente à recomendação do
ANEXO I. Perguntas e Respostas sobre a revisão benefício-risco do piroxicam
 ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA
 CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças em relação à recomendação do PRAC
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado e explicação detalhada dos fundamentos científicos para as diferenças relativamente à
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado e explicação detalhada dos fundamentos científicos para as diferenças relativamente à
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 13 de Outubro de 2015 Volume 2, Número 3 3º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 13 de Outubro de 2015 Volume 2, Número 3 3º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
Anexo III. Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo
 Anexo III Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo Nota: As alterações ao Resumo das Características do Medicamento e ao Folheto Informativo
Anexo III Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo Nota: As alterações ao Resumo das Características do Medicamento e ao Folheto Informativo
Conselhos atualizados relativos à utilização de ibuprofeno de dose alta
 22 de maio de 2015 EMA/325007/2015 Conselhos atualizados relativos à utilização de ibuprofeno de dose alta Revisão confirma risco cardiovascular pequeno com doses diárias iguais ou superiores a 2400 mg
22 de maio de 2015 EMA/325007/2015 Conselhos atualizados relativos à utilização de ibuprofeno de dose alta Revisão confirma risco cardiovascular pequeno com doses diárias iguais ou superiores a 2400 mg
Conclusões científicas
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
Segurança do Doente Integração da Farmacovigilância num Sistema de Registo de Incidentes de Segurança do Doente
 Segurança do Doente Integração da Farmacovigilância num Sistema de Registo de Incidentes de Segurança do Doente 9as Jornadas da Farmácia Hospitalar OF Fevereiro 2017 SUMÁRIO Contextualização; Fluxograma
Segurança do Doente Integração da Farmacovigilância num Sistema de Registo de Incidentes de Segurança do Doente 9as Jornadas da Farmácia Hospitalar OF Fevereiro 2017 SUMÁRIO Contextualização; Fluxograma
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Informação de Segurança Importante destinada aos Médicos Prescritores
 INFLECTRA (INFLIXIMAB): Este medicamento está sujeito a monitorização adicional Informação de Segurança Importante destinada aos Médicos Prescritores Infliximab pode estar associado a reações adversas
INFLECTRA (INFLIXIMAB): Este medicamento está sujeito a monitorização adicional Informação de Segurança Importante destinada aos Médicos Prescritores Infliximab pode estar associado a reações adversas
INFARMED. Circular Informativa. N.º 011/CA Data: Assunto: Ceftriaxona - Informação de segurança
 INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
Brochura de perguntas frequentes para os. Esta brochura contém informação de segurança importante sobre a utilização do medicamento.
 KEYTRUDA (pembrolizumab) Brochura de perguntas frequentes para os Profissionais de Saúde Esta brochura contém informação de segurança importante sobre a utilização do medicamento. Este medicamento está
KEYTRUDA (pembrolizumab) Brochura de perguntas frequentes para os Profissionais de Saúde Esta brochura contém informação de segurança importante sobre a utilização do medicamento. Este medicamento está
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Editorial. Pontos de especial interesse:
 29 de Abril de 2019 Volume 6, Número 1 1º Trimestre de 2019 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
29 de Abril de 2019 Volume 6, Número 1 1º Trimestre de 2019 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Anexo III. Alterações à informação do medicamento
 Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 25 January 2018 EMA/PRAC/35596/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião do
25 January 2018 EMA/PRAC/35596/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião do
Brochura de informação para o doente sobre KEYTRUDA. (pembrolizumab)
 Brochura de informação para o doente sobre KEYTRUDA (pembrolizumab) Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Poderá
Brochura de informação para o doente sobre KEYTRUDA (pembrolizumab) Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Poderá
Deliberação n.º 62/CD/2017
 Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Efeitos retinotóxicos, incluindo cegueira, podem ocorrer em gatos quando a dose recomendada é excedida.
 1. NOME DO MEDICAMENTO VETERINÁRIO BAYTRIL palatável 15 mg comprimidos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido contém: Substância ativa: Enrofloxacina 15,0 mg Para a lista completa de
1. NOME DO MEDICAMENTO VETERINÁRIO BAYTRIL palatável 15 mg comprimidos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido contém: Substância ativa: Enrofloxacina 15,0 mg Para a lista completa de
Anexo IV. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 23 de janeiro de 2018 Volume 4, Número 4 4º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DE COIMBRA FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos Editorial 23 de janeiro de 2018 Volume 4, Número 4 4º Trimestre de 2017 Nesta edição do boletim FARMACOVIGILÂNCIA:
FARMACOVIGILÂNCIA. Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM. Unidade de Farmacovigilância do Norte
 Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM Unidade de Farmacovigilância do Norte Elixir de Sulfanilamida (1937) Defeito de formulação Envenenamento Melhoria da regulação farmacêutica
Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM Unidade de Farmacovigilância do Norte Elixir de Sulfanilamida (1937) Defeito de formulação Envenenamento Melhoria da regulação farmacêutica
Leitura Rápida AIM AIM
 3 Leitura Rápida 4 Leitura Rápida 5 Leitura Rápida PRAC PRAC PRAC 6 PRAC 7 Leitura Rápida PRAC PRAC RAM RCM FI Leitura Rápida 8 9 Leitura Rápida PRAC RCM FI início do tratamento aumento da dose 10 Leitura
3 Leitura Rápida 4 Leitura Rápida 5 Leitura Rápida PRAC PRAC PRAC 6 PRAC 7 Leitura Rápida PRAC PRAC RAM RCM FI Leitura Rápida 8 9 Leitura Rápida PRAC RCM FI início do tratamento aumento da dose 10 Leitura
Guia do Prescritor. Versão 1 (novembro 2017)
 Versão (novembro 7) CONTEÚDO Introdução sobre MAVENCLAD Regimes de tratamento Monitorização durante o tratamento Contagens de linfócitos Infeções graves Leucoencefalopatia multifocal progressiva Neoplasias
Versão (novembro 7) CONTEÚDO Introdução sobre MAVENCLAD Regimes de tratamento Monitorização durante o tratamento Contagens de linfócitos Infeções graves Leucoencefalopatia multifocal progressiva Neoplasias
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 199 Conclusões científicas Na sequência da avaliação de um procedimento de partilha do trabalho do RPS sobre os medicamentos contendo ambroxol iniciada em janeiro de 2012
Anexo II Conclusões científicas 199 Conclusões científicas Na sequência da avaliação de um procedimento de partilha do trabalho do RPS sobre os medicamentos contendo ambroxol iniciada em janeiro de 2012
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco
 Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
GuerbetProdutosRadiológicosLtda. SoluçãoInjetável 0,5mmol/mL
 Wikibula: Wikibula GuerbetProdutosRadiológicosLtda. SoluçãoInjetável 0,5mmol/mL Dotaremvials_SPC_03&2013_FR_vES ácidogadotérico0,5mmol/ml Meiodecontrasteinjetávelporviaintravenosa paraimagemporressonânciamagnética
Wikibula: Wikibula GuerbetProdutosRadiológicosLtda. SoluçãoInjetável 0,5mmol/mL Dotaremvials_SPC_03&2013_FR_vES ácidogadotérico0,5mmol/ml Meiodecontrasteinjetávelporviaintravenosa paraimagemporressonânciamagnética
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 10 November 2016 EMA/PRAC/730053/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC Adotado na reunião do PRAC de 24-27 de
10 November 2016 EMA/PRAC/730053/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC Adotado na reunião do PRAC de 24-27 de
Editorial. Pontos de especial interesse:
 30 de Julho de 2018 Volume 5, Número 2 2º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
30 de Julho de 2018 Volume 5, Número 2 2º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
28/05/2015 Unidade de Farmacovigilância do Norte
 Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM 28/05/2015 Unidade de Farmacovigilância do Norte SISTEMA NACIONAL DE FARMACOVIGILÂNCIA Elixir de Sulfanilamida (1937) Defeito de formulação
Sistema Nacional de Farmacovigilância Notificação Espontânea de RAM 28/05/2015 Unidade de Farmacovigilância do Norte SISTEMA NACIONAL DE FARMACOVIGILÂNCIA Elixir de Sulfanilamida (1937) Defeito de formulação
Anexo III. Alterações às secções relevantes da informação do medicamento
 Anexo III Alterações às secções relevantes da informação do medicamento Nota: Estas alterações às secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo são o resultado
Anexo III Alterações às secções relevantes da informação do medicamento Nota: Estas alterações às secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo são o resultado
O RNEC na perspetiva dos Estudos Observacionais. Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo
 O RNEC na perspetiva dos Estudos Observacionais Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo PAS Post Authorisation Study Estudos pós autorização podem ser pedidos pelas
O RNEC na perspetiva dos Estudos Observacionais Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo PAS Post Authorisation Study Estudos pós autorização podem ser pedidos pelas
Notificar efeitos indesejáveis: porquê, o quê e para quê?
 Notificar efeitos indesejáveis: porquê, o quê e para quê? Rui Pombal Comissão de Avaliação de Medicamentos Direção de Gestão do Risco de Medicamentos Manhã Informativa INFARMED 04 dezembro 2017 Notificar
Notificar efeitos indesejáveis: porquê, o quê e para quê? Rui Pombal Comissão de Avaliação de Medicamentos Direção de Gestão do Risco de Medicamentos Manhã Informativa INFARMED 04 dezembro 2017 Notificar
Índice. Índice... ii Sumário... iii Abstract... v
 2ª ed Caracterização de reacções adversas a medicamentos notificadas à Unidade de Farmacovigilância do Norte pelo Serviço de Imunoalergologia do Centro Hospitalar de São João do Porto Maria João Baldaia
2ª ed Caracterização de reacções adversas a medicamentos notificadas à Unidade de Farmacovigilância do Norte pelo Serviço de Imunoalergologia do Centro Hospitalar de São João do Porto Maria João Baldaia
Editorial. Pontos de especial interesse:
 Editorial 28 de Janeiro de 2019 Volume 5, Número 4 4º Trimestre de 2018 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Editorial 28 de Janeiro de 2019 Volume 5, Número 4 4º Trimestre de 2018 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Os inibidores do cotransportador de sódio-glucose 2 (SGLT2) são utilizados, juntamente com dieta e exercício físico, em doentes com diabetes de
Anexo IV Conclusões científicas 1 Conclusões científicas Os inibidores do cotransportador de sódio-glucose 2 (SGLT2) são utilizados, juntamente com dieta e exercício físico, em doentes com diabetes de
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Abril de 2015 Volume 2, Número 1 1º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 27 de Abril de 2015 Volume 2, Número 1 1º Trimestre de 2015 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
APROVADO EM INFARMED
 Leia atentamente este folheto antes de começar a tomar o medicamento. APROVADO EM Conserve este folheto. Pode ter necessidade de o ler novamente. Caso tenha dúvidas consulte o seu médico ou farmacêutico.
Leia atentamente este folheto antes de começar a tomar o medicamento. APROVADO EM Conserve este folheto. Pode ter necessidade de o ler novamente. Caso tenha dúvidas consulte o seu médico ou farmacêutico.
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 1 October 2018 1 EMA/PRAC/621110/2018 Corr 2 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
1 October 2018 1 EMA/PRAC/621110/2018 Corr 2 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
A EMA confirma as recomendações para minimizar o risco da infeção cerebral LMP com Tysabri
 25/04/2016 EMA/266665/2016 A EMA confirma as recomendações para minimizar o risco da infeção cerebral LMP com Deve considerar-se a realização mais frequente de exames de IRM para os doentes de maior risco
25/04/2016 EMA/266665/2016 A EMA confirma as recomendações para minimizar o risco da infeção cerebral LMP com Deve considerar-se a realização mais frequente de exames de IRM para os doentes de maior risco
Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos sinais
 15 September 2016 EMA/PRAC/603540/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
15 September 2016 EMA/PRAC/603540/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Novo texto da informação do medicamento Extratos das recomendações do PRAC relativamente aos Adotado na reunião
Notificação Espontânea de Reacções Adversas a Medicamentos
 Notificação Espontânea de Reacções Adversas a Medicamentos Manuela Pinto Milne Unidade de Farmacovigilância do Norte Faculdade de Medicina da Universidade do Porto eacçõesdversas aedicamentos (OMS) resposta
Notificação Espontânea de Reacções Adversas a Medicamentos Manuela Pinto Milne Unidade de Farmacovigilância do Norte Faculdade de Medicina da Universidade do Porto eacçõesdversas aedicamentos (OMS) resposta
ANEXO IV CONCLUSÕES CIENTÍFICAS
 ANEXO IV CONCLUSÕES CIENTÍFICAS Conclusões científicas A coinfeção pelo vírus da hepatite В (VHB) e pelo vírus da hepatite C (VHC) não é incomum devido à sobreposição dos modos de transmissão. Sabe-se
ANEXO IV CONCLUSÕES CIENTÍFICAS Conclusões científicas A coinfeção pelo vírus da hepatite В (VHB) e pelo vírus da hepatite C (VHC) não é incomum devido à sobreposição dos modos de transmissão. Sabe-se
Turma(s): A11, A12, A13, A14, A21, A22, A23, A24, B11, B12, B13, B14, B21, B22, B23, B24
 AULA n.º: 1 Dia 15-09-2014 das 17:00 às 20:00 Ana Leonor Alves Ribeiro Apresentação: disciplina, docente, avaliação, programa, bibliografia. FARMACOLOGIA GERAL: 1.PRINCÍPIOS FUNDAMENTAIS DA FARMACOLOGIA
AULA n.º: 1 Dia 15-09-2014 das 17:00 às 20:00 Ana Leonor Alves Ribeiro Apresentação: disciplina, docente, avaliação, programa, bibliografia. FARMACOLOGIA GERAL: 1.PRINCÍPIOS FUNDAMENTAIS DA FARMACOLOGIA
APROVADO EM INFARMED
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR APROVADO EM Por favor leia este folheto antes de começar a tomar LARUTAN 600 mg. Guarde este folheto até ter acabado o medicamento. Pode necessitar de
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR APROVADO EM Por favor leia este folheto antes de começar a tomar LARUTAN 600 mg. Guarde este folheto até ter acabado o medicamento. Pode necessitar de
Editorial. Pontos de especial interesse:
 30 de Abril de 2018 Volume 5, Número 1 1º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
30 de Abril de 2018 Volume 5, Número 1 1º Trimestre de 2018 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
ANEXO III SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO
 ANEXO III SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas
ANEXO III SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Campanha de Vacinação Influenza 2018
 Campanha de Vacinação Influenza 2018 COORD DE IMUNIZAÇÕES/SVS/SUBPAV/S PREFEITURA DO RIO DE JANEIRO SECRETARIA MUNICIPAL DE SAÚDE RESULTADOS DA CAMPANHA 2017 AP CRIANÇAS GESTANTES PUERPERAS IDOSOS TRAB
Campanha de Vacinação Influenza 2018 COORD DE IMUNIZAÇÕES/SVS/SUBPAV/S PREFEITURA DO RIO DE JANEIRO SECRETARIA MUNICIPAL DE SAÚDE RESULTADOS DA CAMPANHA 2017 AP CRIANÇAS GESTANTES PUERPERAS IDOSOS TRAB
Doença de Addison DOENÇA DE ADDISON
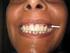 Enfermagem em Clínica Médica Doença de Addison Enfermeiro: Elton Chaves email: eltonchaves76@hotmail.com DOENÇA DE ADDISON A insuficiência adrenal (IA) primária, também denominada doença de Addison, geralmente
Enfermagem em Clínica Médica Doença de Addison Enfermeiro: Elton Chaves email: eltonchaves76@hotmail.com DOENÇA DE ADDISON A insuficiência adrenal (IA) primária, também denominada doença de Addison, geralmente
Lipophoral Tablets 150mg. Mediator 150 mg Comprimido Via oral. Benfluorex Mylan 150 mg Comprimido Via oral. Benfluorex Qualimed
 ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
Anexo II. Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças relativamente à recomendação do PRAC
 Anexo II Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças relativamente à recomendação do PRAC 35 Conclusões científicas e explicação detalhada dos fundamentos
Anexo II Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças relativamente à recomendação do PRAC 35 Conclusões científicas e explicação detalhada dos fundamentos
Editorial. Pontos de especial interesse:
 Editorial 26 de Julho de 2019 Volume 6, Número 2 2º Trimestre de 2019 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de várias questões relacionadas
Editorial 26 de Julho de 2019 Volume 6, Número 2 2º Trimestre de 2019 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de várias questões relacionadas
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO. Tratamento sintomático da obstipação em crianças com idade entre 6 meses e 8 anos.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Casenlax 500 mg/ml solução oral 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml de produto contém 500 mg de Macrogol 4000. Lista completa
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Casenlax 500 mg/ml solução oral 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml de produto contém 500 mg de Macrogol 4000. Lista completa
MANEJO DOS CASOS SUSPEITOS E CONFIRMADOS DE INFLUENZA NO HIAE E UNIDADES
 MANEJO DOS CASOS SUSPEITOS E CONFIRMADOS DE INFLUENZA NO HIAE E UNIDADES AVANÇADAS Maio de 2013 Serviço de Controle de Infecção Hospitalar Conteúdo Definições atualmente utilizadas Diagnóstico Tratamento
MANEJO DOS CASOS SUSPEITOS E CONFIRMADOS DE INFLUENZA NO HIAE E UNIDADES AVANÇADAS Maio de 2013 Serviço de Controle de Infecção Hospitalar Conteúdo Definições atualmente utilizadas Diagnóstico Tratamento
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona
 Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
1. NOME DO MEDICAMENTO VETERINÁRIO. Baytril Palatável 250 mg comprimidos para cães. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA. Cada comprimido contém:
 1. NOME DO MEDICAMENTO VETERINÁRIO Baytril Palatável 250 mg comprimidos para cães. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido contém: Substância activa: Enrofloxacina 250,0 mg Para a lista
1. NOME DO MEDICAMENTO VETERINÁRIO Baytril Palatável 250 mg comprimidos para cães. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido contém: Substância activa: Enrofloxacina 250,0 mg Para a lista
Brochura de informação para o doente sobre KEYTRUDA. (pembrolizumab)
 Brochura de informação para o doente sobre KEYTRUDA (pembrolizumab) Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Poderá
Brochura de informação para o doente sobre KEYTRUDA (pembrolizumab) Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação de nova informação de segurança. Poderá
Terapia Alvo versus Imunoterapia: Qual a melhor opção? Helena de Andrade Oncologista Clínica
 Terapia Alvo versus Imunoterapia: Qual a melhor opção? Helena de Andrade Oncologista Clínica Conflitos de Interesse De acordo com a norma 1595/00 do Conselho Federal de Medicina e a Resolução da Diretoria
Terapia Alvo versus Imunoterapia: Qual a melhor opção? Helena de Andrade Oncologista Clínica Conflitos de Interesse De acordo com a norma 1595/00 do Conselho Federal de Medicina e a Resolução da Diretoria
Stelara (ustecinumab)
 Stelara (ustecinumab) Folheto para os doentes Por favor, leia este folheto com atenção, assim como o Folheto Informativo. Este folheto contém informação importante sobre Stelara, Este folheto destina-se
Stelara (ustecinumab) Folheto para os doentes Por favor, leia este folheto com atenção, assim como o Folheto Informativo. Este folheto contém informação importante sobre Stelara, Este folheto destina-se
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR. Ezetimiba Teva, 10 mg, Comprimidos Ezetimiba
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Ezetimiba Teva, 10 mg, Comprimidos Ezetimiba Leia atentamente este folheto antes de tomar este medicamento. - Conserve este folheto. Pode ter necessidade
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Ezetimiba Teva, 10 mg, Comprimidos Ezetimiba Leia atentamente este folheto antes de tomar este medicamento. - Conserve este folheto. Pode ter necessidade
Sistema Nacional de Farmacovigilancia (SNF) Notificações e Casos de RAM Ano 2017
 Sistema Nacional de Farmacovigilancia (SNF) Notificações e Casos de RAM Ano 2017 Notas essenciais N.º total de notificações de RAM recebidas: 6105 N.º de notificações diretamente de Profissionais de Saúde
Sistema Nacional de Farmacovigilancia (SNF) Notificações e Casos de RAM Ano 2017 Notas essenciais N.º total de notificações de RAM recebidas: 6105 N.º de notificações diretamente de Profissionais de Saúde
Diprosalic pomada está indicado no tratamento inicial de psoríase em placas moderada a grave.
 Folheto informativo: Informação para o utilizador Diprosalic 0,5 mg/g + 30 mg/g Pomada Dipropionato de betametasona / Ácido Salicílico Leia com atenção todo este folheto antes de começar a utilizar este
Folheto informativo: Informação para o utilizador Diprosalic 0,5 mg/g + 30 mg/g Pomada Dipropionato de betametasona / Ácido Salicílico Leia com atenção todo este folheto antes de começar a utilizar este
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 12 1. NOME DO MEDICAMENTO VETERINÁRIO ENACARD 5 mg comprimidos para cães 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido contém: Substância(s)
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 12 1. NOME DO MEDICAMENTO VETERINÁRIO ENACARD 5 mg comprimidos para cães 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido contém: Substância(s)
Resumo da avaliação científica de medicamentos contendo nimesulida para uso sistémico (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Brochura de perguntas frequentes para os. Esta brochura contém informação de segurança importante sobre a utilização do medicamento.
 KEYTRUDA (pembrolizumab) Brochura de perguntas frequentes para os Profissionais de Saúde Esta brochura contém informação de segurança importante sobre a utilização do medicamento. Este medicamento está
KEYTRUDA (pembrolizumab) Brochura de perguntas frequentes para os Profissionais de Saúde Esta brochura contém informação de segurança importante sobre a utilização do medicamento. Este medicamento está
Editorial. Pontos de especial interesse:
 Editorial 18 de Outubro de 2018 Volume 5, Número 3 3º Trimestre de 2018 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Editorial 18 de Outubro de 2018 Volume 5, Número 3 3º Trimestre de 2018 Nesta edição do boletim FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos informa-se acerca de vários alertas de segurança
Hidroclorotiazida. Diurético - tiazídico.
 Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
Monitorização de justificações técnicas e direito de opção - registo de casos
 Monitorização de justificações técnicas e direito de opção - registo de casos Comissão de Farmácia e Terapêutica - ARS Norte Porto,10 novembro de 2014 Índice 1. Introdução.... 4 2. Metodologia.... 5 2.1
Monitorização de justificações técnicas e direito de opção - registo de casos Comissão de Farmácia e Terapêutica - ARS Norte Porto,10 novembro de 2014 Índice 1. Introdução.... 4 2. Metodologia.... 5 2.1
BULA PARA O PACIENTE MEGESTAT (acetato de megestrol) comprimidos
 BULA PARA O PACIENTE MEGESTAT (acetato de megestrol) comprimidos MEGESTAT acetato de megestrol Uso oral APRESENTAÇÃO MEGESTAT 160mg comprimidos é apresentado em frasco com 30 comprimidos sulcados. USO
BULA PARA O PACIENTE MEGESTAT (acetato de megestrol) comprimidos MEGESTAT acetato de megestrol Uso oral APRESENTAÇÃO MEGESTAT 160mg comprimidos é apresentado em frasco com 30 comprimidos sulcados. USO
GILENYA (fingolimod) Lista de Verificação do Médico Prescritor. Este medicamento está sujeito a monitorização adicional
 GILENYA (fingolimod) Lista de Verificação do Médico Prescritor Este medicamento está sujeito a monitorização adicional Lista de verificação dirigida ao médico com informação de segurança importante acerca
GILENYA (fingolimod) Lista de Verificação do Médico Prescritor Este medicamento está sujeito a monitorização adicional Lista de verificação dirigida ao médico com informação de segurança importante acerca
Cloreto de sódio 20% Braun 200 mg/ml Concentrado para solução para perfusão
 Folheto Informativo: Informação para o utilizador Cloreto de sódio 20% Braun 200 mg/ml Concentrado para solução para perfusão Cloreto de sódio Leia com atenção todo este folheto antes de começar a utilizar
Folheto Informativo: Informação para o utilizador Cloreto de sódio 20% Braun 200 mg/ml Concentrado para solução para perfusão Cloreto de sódio Leia com atenção todo este folheto antes de começar a utilizar
Anexo III. Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo
 Anexo III Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo Nota: Esta adenda às secções relevantes do Resumo das Características do Medicamento e Folheto
Anexo III Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo Nota: Esta adenda às secções relevantes do Resumo das Características do Medicamento e Folheto
FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos
 UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 05 de novembro de 2014 Volume 1, Número 3 3º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
UNIDADE DE FARMACOVIGILÂNCIA DO CENTRO FARMACOVIGILÂNCIA: Atualizações de segurança de medicamentos 05 de novembro de 2014 Volume 1, Número 3 3º Trimestre de 2014 Editorial Nesta edição do boletim FARMACOVIGILÂNCIA:
