Manual do kit EZ1 DSP Virus 48
|
|
|
- Marcela Canto de Abreu
- 9 Há anos
- Visualizações:
Transcrição
1 Março de 2015 Manual do kit EZ1 DSP Virus 48 Versão 4 Para utilização em diagnóstico in vitro PT QIAGEN GmbH, QIAGEN Strasse 1, Hilden, ALEMANHA R PT Sample & Assay Technologies
2 Tecnologias de amostragem e ensaio da QIAGEN A QIAGEN é o principal fornecedor de tecnologias inovadoras de amostragem e ensaio, permitindo o isolamento e a detecção do conteúdo de qualquer amostra biológica. Os avançados produtos e serviços de elevada qualidade da nossa empresa garantem o sucesso desde a amostra ao resultado. A QIAGEN é uma empresa de referência em matéria de: Purificação de ADN, ARN e proteínas Ensaios de ácidos nucleicos e proteínas Investigação em microarn e ARNi Automatização de tecnologias de amostragem e ensaio A nossa missão permitir-lhe-á alcançar o sucesso, bem como resultados notáveis. Para obter mais informações, visite
3 Índice Utilização prevista 5 Resumo e explicação 5 Princípios do procedimento 6 Materiais fornecidos 8 Conteúdo do kit 8 Materiais necessários, mas não fornecidos 9 Avisos e precauções 11 Armazenamento e manuseamento de reagentes 12 Manuseamento e armazenamento de amostras 13 Procedimento 14 Trabalhar com instrumentos EZ1 14 Preparar o ARN transportador (CARRIER) 20 Utilização de um controlo interno (CI) 21 Volumes de eluição e manuseamento de eluatos 21 Armazenamento de ácidos nucleicos virais/adn bacteriano 22 Características de desempenho 22 Protocolos Pré-tratamento de urina 23 Pré-tratamento de sangue total 24 Pré-tratamento de fezes 25 Pré-tratamento de secreções secas 27 Pré-tratamento de amostras respiratórias viscosas 28 Pré-tratamento para isolamento de ADN genómico de bactérias Gram-positivas 29 Purificação de ácidos nucleicos virais e ADN bacteriano 30 Controlo de qualidade 34 Limitações 34 Símbolos 35 Referências 36 Informação de contacto 36 Guia de resolução de problemas 37 Manual do kit EZ1 DSP Virus 03/2015 3
4 Apêndice A: Mensagens apresentadas 41 Apêndice B: Calcular a quantidade de controlo interno (CI) 65 Apêndice C: Folha de amostra para utilizar com o sistema EZ1 DSP Virus68 Apêndice D: Exemplo de um ficheiro de relatório do EZ1 Advanced 69 Informações para encomenda 71 4 Manual do kit EZ1 DSP Virus 03/2015
5 Utilização prevista O kit EZ1 DSP Virus utiliza tecnologia de partículas magnéticas para o isolamento e purificação automatizada de ácidos nucleicos virais e ADN bacteriano de amostras biológicas. O produto destina-se a utilizadores profissionais, tais como técnicos e médicos com formação em técnicas de biologia molecular. O EZ1 DSP Virus system foi concebido para aplicações de diagnóstico in vitro. Resumo e explicação O kit EZ1 DSP Virus oferece um procedimento totalmente automatizado para a purificação simultânea de ácidos nucleicos virais e ADN bacteriano dos seguintes materiais de amostra, usando instrumentos EZ1: Soro e plasma Líquido cefalorraquidiano (LCR) Urina Sangue total Fezes Fluidos de transporte Amostras respiratórias Secreções secas O kit pode ser utilizado para purificar ácidos nucleicos de um vasto intervalo de ADN e ARN de vírus, bem como ADN de bactérias. Contudo, o desempenho do kit não está garantido para cada espécie de patógeno extraído de quaisquer dos materiais de amostra e deve ser validado pelo utilizador. A tecnologia de partículas magnéticas permite a purificação de ácidos nucleicos de elevada qualidade que não contenham proteínas, nucleases e outras impurezas. Os ácidos nucleicos purificados estão prontos a ser utilizados para a detecção altamente sensível em ensaios a jusante, tais como a amplificação ou outras reacções enzimáticas. O instrumento EZ1 efectua todos os passos do procedimento de preparação de, no máximo, 6 amostras (utilizando o EZ1 Advanced ou o BioRobot EZ1 DSP ) ou no máximo 14 amostras (utilizando o EZ1 Advanced XL) numa única corrida. Indisponível nos EUA ou no Canadá. Manual do kit EZ1 DSP Virus 03/2015 5
6 Princípios do procedimento A tecnologia de partículas magnéticas combina a velocidade e a eficiência da purificação de ácidos nucleicos baseada em sílica com o prático manuseamento das partículas magnéticas. O procedimento de purificação está concebido para garantir a manipulação segura e reproduzível de amostras potencialmente infecciosas. O procedimento de purificação tem 4 passos: lise, ligação, lavagem e eluição (consulte abaixo e o fluxograma). O pré-tratamento da amostra é importante no caso de urina, sangue total, fezes, amostras respiratórias e secreções secas. Consulte o protocolo de pré-tratamento para o respectivo material da amostra. Lise com proteinase K A proteólise de amostras é realizada em condições altamente desnaturantes a temperaturas elevadas. A lise é efectuada na presença de proteinase K e tampão de lise, os quais juntamente, asseguram a digestão das proteínas da cápsula viral e a inactivação de nucleases. Ligação às partículas magnéticas É adicionado tampão de ligação às amostras lisadas para ajustar as condições de ligação. Os lisados são misturados cuidadosamente com partículas magnéticas de modo a permitir a adsorção óptima dos ácidos nucleicos virais e do ADN bacteriano à superfície de sílica. As condições de sal e de ph garantem que as proteínas e outros contaminantes que possam inibir o PCR e outras reacções enzimáticas a jusante, não se liguem às partículas magnéticas. Lavagem dos ácidos nucleicos ligados Embora os ácidos nucleicos virais e o ADN bacteriano permaneçam ligados às partículas magnéticas, os contaminantes são eficazmente lavados e removidos durante a sequência dos passos de lavagem, utilizando primeiro o tampão de lavagem 1, em seguida o tampão de lavagem 2 e no final etanol. Eluição de ácidos nucleicos puros Num passo único, ácidos nucleicos virais e o ADN bacteriano de elevada pureza são eluídos em tampão de eluição (AVE). Os ácidos nucleicos purificados estão podem ser utilizados imediatamente em aplicações a jusante ou armazenados para utilização futura. 6 Manual do kit EZ1 DSP Virus 03/2015
7 Procedimento EZ1 DSP Virus Soro, plasma, LCR, fluidos de transporte ou amostras pré-tratadas de urina, sangue total, fezes, amostras respiratórias ou secreções secas Lise com proteinase K e tampão de lise Partículas magnéticas e tampão de ligação adicionado aos lisados Os ácidos nucleicos ligam-se às partículas magnéticas Separação magnética Lavagem com tampão de lavagem 1, em seguida com tampão de lavagem 2 e, por fim, com etanol Separação magnética Eluir com tampão de eluição (AVE) Ácidos nucleicos virais e/ou o ADN bacteriano purificado(s)/de elevada qualidade Manual do kit EZ1 DSP Virus 03/2015 7
8 Materiais fornecidos Conteúdo do kit Kit EZ1 DSP Virus (48) N.º de catálogo Número de preparações 48 RCV Cartuchos de reagentes, Virus* 48 DTH Porta-pontas descartáveis 50 DFT Pontas com filtro descartáveis 50 ST Tubos de amostras (2 ml) 100 ET Tubos de eluição (1,5 ml) 100 CARRIER Transportador ARN 310 µg AVE Tampão de eluição 3 x 2 ml Cartão Q 1 Manual 1 * Contém um sal de guanidina. Não compatível com desinfectantes contendo lixívia. Consulte a página 11 para informações de segurança. Contém azida de sódio como conservante. As informações codificadas no código de barras do cartão Q são necessárias para a detecção de dados dos reagentes através da utilização dos instrumentos EZ1 Advanced e EZ1 Advanced XL. 8 Manual do kit EZ1 DSP Virus 03/2015
9 Materiais necessários, mas não fornecidos Quando trabalhar com substâncias químicas, use sempre um avental de laboratório adequado, luvas descartáveis e óculos de protecção. Para mais informações, consultar as fichas de dados de segurança (SDS) adequadas, disponíveis junto do fornecedor do produto. Todos os protocolos Pipetas* e pontas de pipeta estéreis isentas de RNase Lenço de papel suave Água Etanol a 70% Opcional: Vortexer* (se for necessário misturar amostras congeladas) Para tratamento prévio de urina e sangue total ATL (ref.ª ) Para tratamento prévio de urina Tampão ASL (ref.ª 19082) Vortexer Termoagitadora* ou em banho-maria* a 70 C Para tratamento prévio de secreções secas ATL (ref.ª ) Termoagitadora (56 C)* Para tratamento prévio de amostras respiratórias viscosas Sputasol (Oxoid Limited; Termoagitadora* ou em banho-maria* a 37 C Para isolamento de ADN genómico de bactérias Gram-positivas Lisozima, Tris-HCl, EDTA, Triton X-100 Termoagitadora* ou em banho-maria* a 37 C * Assegure-se de que os instrumentos foram verificados, mantidos e calibrados regularmente de acordo com as recomendações do fabricante. Manual do kit EZ1 DSP Virus 03/2015 9
10 Para utilizadores do BioRobot EZ1 Instrumento BioRobot EZ1 DSP* (ref.ª ) Cartão EZ1 DSP Virus (ref.ª ) Para utilizadores do EZ1 Advanced Instrumento EZ1 Advanced* (ref.ª ) Cartão EZ1 Advanced DSP Virus (ref.ª ) Para utilizadores do EZ1 Advanced XL Instrumento EZ1 Advanced XL* (ref.ª ) Cartão EZ1 Advanced XL DSP Virus (ref.ª ) Para utilizadores do EZ1 Advanced e EZ1 Advanced XL Para o controlo das amostras, é necessário utilizar um dos seguintes componentes: PC e monitor TFT de 17 (QIAGEN, ref.ª ), (ou o seu próprio PC e monitor) com EZ1 Advanced Communicator Software (software fornecido juntamente com os instrumentos EZ1 Advanced e EZ1 Advanced XL) Impressora (ref.ª ) e pacote de acessórios para impressora (ref.ª ) * Assegure-se de que os instrumentos foram verificados, mantidos e calibrados regularmente de acordo com as recomendações do fabricante. Indisponível nos EUA ou no Canadá. 10 Manual do kit EZ1 DSP Virus 03/2015
11 Avisos e precauções Para utilização em diagnóstico in vitro Quando trabalhar com substâncias químicas, use sempre um avental de laboratório adequado, luvas descartáveis e óculos de protecção. Para obter mais informações, consultar as fichas de dados de segurança (SDS) adequadas. Estas estão disponíveis online no formato PDF, prático e compacto, no endereço onde poderá encontrar, visualizar e imprimir as MSDSs para cada kit da QIAGEN e respectivos componentes. PRECAUÇÃO: NÃO adicione lixívia nem soluções ácidas directamente aos resíduos provenientes da preparação de amostras. Alguns tampões nos cartuchos de reagentes (RCV) contêm cloridrato de guanidina ou isotiocianato de guanidina, que podem formar compostos altamente reactivos quando combinados com lixívia. Se for derramado líquido destes tampões, limpe com detergente laboratorial adequado e água. Se no instrumento EZ1 for derramado líquido que contenha agentes potencialmente infecciosos, desinfecte o instrumento, utilizando os reagentes descritos no manual do utilizador fornecido com o instrumento EZ1 em questão. Os cartuchos de reagentes (RCV) danificados ou com fugas têm de ser manuseados e eliminados de acordo com os regulamentos de segurança locais. Não utilize cartuchos de reagentes (RCV) ou outros componentes do kit danificados, uma vez que a sua utilização poderá resultar num fraco desempenho do kit. A QIAGEN não testou os resíduos líquidos gerados pelo procedimento do EZ1 DSP Virus para materiais infecciosos residuais. A contaminação dos resíduos líquidos com materiais infecciosos residuais é altamente improvável, mas não pode ser completamente excluída. Por conseguinte, os resíduos líquidos têm de ser considerados infecciosos e têm de ser manuseados e eliminados de acordo com os regulamentos de segurança locais. Manual do kit EZ1 DSP Virus 03/
12 As seguintes advertências de precaução e de perigo aplicam-se aos componentes do kit EZ1 DSP Virus: Reagent Cartridge, Virus Mini, v2.0 CE Contém: ethanol; guanidine thiocyanate; Isopropanol. Perigo! Provoca queimaduras na pele e lesões oculares graves. Líquido e vapor facilmente inflamáveis. Eliminar o conteúdo/ recipiente em instalação aprovada de destruição de resíduos. SE ENTRAR EM CONTACTO COM OS OLHOS: enxaguar cuidadosamente com água durante vários minutos. Se usar lentes de contacto, retire-as, se tal lhe for possível. Continuar a enxaguar. SE ENTRAR EM CONTACTO COM A PELE (ou o cabelo): despir/ retirar imediatamente toda a roupa contaminada. Enxaguar a pele com água/ tomar um duche. Contacte imediatamente um CENTRO DE INFORMAÇÃO ANTIVENENOS ou um médico. Manter afastado do calor/faísca/chama aberta/superfícies quentes. - Não fumar. Armazenar em local bem ventilado. Conservar em ambiente fresco. Usar luvas de protecção/ vestuário de protecção/ protecção ocular/ protecção facial. Armazenamento e manuseamento de reagentes Armazene os cartuchos de reagentes (RCV) na vertical à temperatura ambiente (15 25 C). As partículas magnéticas nos cartuchos de reagentes (RCV) mantêm-se activas quando armazenadas a esta temperatura. Não congele os cartuchos de reagentes (RCV). Quando armazenados adequadamente, os cartuchos de reagentes (RCV) mantêm-se estáveis até ao prazo de validade impresso no cartão Q e na caixa do kit. O Transportador ARN liofilizado (CARRIER) mantém-se estável até ao prazo de validade impresso na caixa do kit quando armazenado à temperatura ambiente. Podem formar-se precipitados nos tampões pré-tratados ATL ou ASL durante o armazenamento à temperatura ambiente ou a 2 8 C. Incube os frascos a C durante minutos, agitando os frascos manualmente duas vezes neste período de incubação. 12 Manual do kit EZ1 DSP Virus 03/2015
13 Manuseamento e armazenamento de amostras Durante o procedimento de pré-tratamento, as amostras têm de ser manuseadas adequadamente, a fim de excluir o risco de mistura de amostras. O procedimento de purificação está optimizado para utilização com 100 µl, 200 µl ou 400 µl de volumes de amostra. É recomendado um volume de amostra de 200 µl para extracção de ácidos nucleicos virais ou bacterianos das fezes. As amostras de sangue tratadas com EDTA ou citrato como anticoagulante podem ser utilizadas para preparação do plasma. As amostras podem ser frescas ou congeladas, desde que não tenham sido novamente congeladas depois da descongelação. O sangue total deverá ser processado como as amostras frescas. Caso seja necessário armazenar, recomendamos que o armazenamento das amostras de sangue total seja feito a uma temperatura de 2 8 C, durante até 2 dias. Depois da colheita (e centrifugação, no caso de plasma e soro), as amostras podem ser armazenadas a uma temperatura de 2 8 C, durante até 6 horas. Para um armazenamento mais prolongado recomendamos a congelação de alíquotas de amostras (excepto de sangue total) a uma temperatura entre 80 C e 20 C. Descongele as amostras congeladas à temperatura ambiente (15 25 C) e processe as amostras imediatamente assim que tiverem estabilizado à temperatura ambiente. Não volte a congelar as alíquotas depois de terem sido descongeladas. Uma congelação-descongelação repetida leva à desnaturação e precipitação de proteínas, resultando em títulos virais e bacterianos mais baixos e, como tal, rendimentos mais baixos de ácidos nucleicos virais e ADN bacteriano. Se forem visíveis crioprecipitados nas amostras, centrifugue-as a 6800 x g, durante 3 minutos ± 30 segundos, transfira os sobrenadantes para tubos novos, sem interferir com os pellets, e comece imediatamente o procedimento de purificação. Este passo não reduz os títulos virais, mas os títulos bacterianos poderão ser afectados. Para proceder à extracção de bactérias Gram-positivas de lise difícil, poderá integrar-se um passo adicional de pré-lise, compreendendo a digestão de lisozima, antes de extrair no instrumento EZ1 (consulte a página 29 para conhecer o Protocolo: pré-tratamento para isolamento de ADN genómico de bactérias Gram-positivas ). Manual do kit EZ1 DSP Virus 03/
14 Procedimento Trabalhar com instrumentos EZ1 As principais características dos instrumentos EZ1 incluem: Purificação de ácidos nucleicos de elevada qualidade de 1 6 ou 1 14 amostras por corrida Equipamento de pequena dimensão para poupar espaço no laboratório Cartões EZ1 DSP pré-programados com protocolos prontos a utilizar Cartuchos de reagentes selados e enchidos previamente para a configuração fácil, rápida e segura Automatização completa da purificação de ácidos nucleicos As características adicionais do EZ1 Advanced e EZ1 Advanced XL incluem: Leitura do código de barras e controlo de amostras Detecção de dados do kit com o cartão Q fornecido no kit Lâmpada UV para ajudar a eliminar o carry-over" de amostras de execução para execução e para permitir a descontaminação das superfícies da mesa de trabalho Nota: a descontaminação por UV ajuda a reduzir a possível contaminação por agentes patogénicos nas superfícies da mesa de trabalho do EZ1 Advanced e EZ1 Advanced XL. A eficiência da inactivação deverá ser determinada para cada organismo específico e depende, por exemplo, da espessura da camada e do tipo de amostra. A QIAGEN não pode garantir a erradicação completa de agentes patogénicos específicos. Cartões EZ1 DSP, cartões EZ1 Advanced DSP e cartões EZ1 Advanced XL DSP Os protocolos para purificação de ácidos nucleicos virais e ADN bacteriano encontram-se memorizados nos cartões EZ1 pré-programados. O utilizador só tem de inserir um cartão EZ1 Advanced XL DSP no EZ1 Advanced XL, um cartão EZ1 Advanced DSP no EZ1 Advanced, ou um cartão EZ1 DSP no instrumento BioRobot EZ1 DSP, ficando depois o instrumento pronto para executar um protocolo (figuras 1 e 2). * Indisponível nos EUA ou no Canadá. 14 Manual do kit EZ1 DSP Virus 03/2015
15 Figura 1. Facilidade de configuração do protocolo utilizando os cartões EZ1 DSP. Inserção de um cartão EZ1, programado com o protocolo, no instrumento EZ1. Nota: o instrumento só deve ser ligado depois de inserido o cartão EZ1 DSP correspondente. Certifique-se de que o cartão EZ1 DSP correspondente se encontra totalmente inserido! Caso contrário, os dados essenciais do instrumento podem perder-se, dando origem a um erro na memória. Os cartões EZ1 DSP não devem ser trocados enquanto o instrumento estiver ligado. Figura 2. Cartão totalmente inserido na ranhura do cartão EZ1. O kit EZ1 DSP Virus requer a utilização do cartão EZ1 DSP Virus, cartão EZ1 Advanced DSP Virus ou do cartão EZ1 Advanced XL DSP Virus. Os cartões contêm os protocolos de purificação dos ácidos nucleicos virais e do ADN bacteriano a partir de soro, plasma, LCR, urina, sangue total, fezes, fluidos de transporte, secreções secas e amostras respiratórias. Indisponível nos EUA ou no Canadá. Manual do kit EZ1 DSP Virus 03/
16 Cartuchos de reagentes (RCV) Os reagentes para a purificação de ácidos nucleicos de uma única amostra estão contidos num único cartucho de reagentes (RCV) (Figura 3). Cada poço do cartucho (RCV) contém um reagente específico, como por exemplo partículas magnéticas, tampão de lise, tampão de lavagem ou tampão de eluição isento de RNases (AVE). Dado que cada poço contém apenas a quantidade de reagente necessária, evita-se a geração de resíduos adicionais provenientes dos restos de reagentes no fim do procedimento de purificação. Os cartuchos de reagentes (RCV) fornecidos com o kit EZ1 DSP Virus estão previamente enchidos com todos os reagentes necessários para a purificação de ácidos nucleicos virais e ADN bacteriano, excepto ARN transportador (CARRIER). O ARN transportador (CARRIER) e os controlos internos (CI) (opcional) são adicionados num tubo fora do cartucho de reagentes (RCV). A B Figura 3. Facilidade na configuração do instrumento, utilizando cartuchos de reagentes (RCV). A Um cartucho de reagentes selado e enchido previamente (RCV). Os níveis de enchimento variam, consoante o tipo de cartucho de reagentes (RCV). B Carregamento dos cartuchos de reagentes (RCV) no suporte de cartuchos. O próprio suporte de cartuchos está identificado com uma seta para indicar a direcção na qual se devem carregar os cartuchos de reagentes (RCV). 16 Manual do kit EZ1 DSP Virus 03/2015
17 Mesa de trabalho A mesa de trabalho dos instrumentos EZ1 é o local onde o utilizador carrega as amostras e os componentes do kit EZ1 DSP Virus. Os detalhes sobre a configuração da mesa de trabalho são apresentados no visor de vácuo fluorescente (VFD) do EZ1 Advanced e do EZ1 Advanced XL ou no visor de cristais líquidos (LCD) do painel de controlo do BioRobot EZ1 DSP quando o utilizador inicia a configuração da mesa de trabalho. O visor do instrumento apresenta também o estado do protocolo durante o procedimento de purificação automatizado Figura 4. Mesa de trabalho de um instrumento EZ1. 1. Tubos de eluição (ET) (1,5 ml) carregados na primeira fila. 2. Porta-pontas descartáveis (DTH), contendo pontas com filtro descartáveis (DFT), carregados na segunda fila. 3. Tubo (ET) (1,5 ml), contendo ARN transportador (CARRIER) e controlo interno (CI) (se utilizado) em tampão de eluição (AVE), carregado na terceira fila. Indisponível nos EUA ou no Canadá. Manual do kit EZ1 DSP Virus 03/
18 4. Tubos de amostras (ST) (2 ml) carregados na quarta fila. 5. Cartuchos de reagentes (RCV) carregados no suporte de cartuchos. 6. Bloco de aquecimento com tubos de 2 ml (ST) nos cartuchos de reagentes para lise. Detecção de dados com o EZ1 Advanced e EZ1 Advanced XL O EZ1 Advanced e o EZ1 Advanced XL permitem a detecção abrangente de uma diversidade de dados para um maior controlo e fiabilidade dos processos. O número de lote e o prazo de validade do kit EZ1 DSP são introduzidos no início do protocolo, utilizando o código de barras do cartão Q. A ID do utilizador e o código de barras do cartão Q podem ser introduzidos manualmente, utilizando o teclado, ou através da leitura dos códigos de barras, utilizando o leitor de código de barras portátil. Opcionalmente, as informações de amostras e teste também podem ser introduzidas no início do protocolo. No fim da execução do protocolo, é gerado automaticamente um ficheiro de relatório. O EZ1 Advanced e o EZ1 Advanced XL podem armazenar até 10 ficheiros de relatório e os dados podem ser transferidos para um PC ou impressos directamente numa impressora (consulte Fluxo de trabalho do funcionamento do EZ1 DSP Virus, página 19). Para receber ficheiros de relatório num PC, é necessário instalar o software EZ1 Advanced Communicator. O software recebe um ficheiro de relatório e armazena-o numa pasta definida pelo utilizador. Quando o PC recebe o ficheiro de relatório, é possível utilizá-lo e processá-lo com um sistema de gestão de informação laboratorial (LIMS) ou outros programas. Em ficheiros de relatório, os 6 canais de pipetação do EZ1 Advanced são designados da esquerda para a direita, canais A a F, ou os 14 canais de pipetação do EZ1 Advanced XL são designados, da esquerda para a direita, canais Ao pesquisar uma ID de utilizador ou código de barras do cartão Q com o leitor de código de barras, um sinal sonoro confirma a entrada de dados. Depois de as informações serem apresentadas durante 2 segundos, são automaticamente armazenadas, e é apresentada a seguinte no visor. Ao pesquisar a ID de uma amostra, ID de um kit de teste ou notas, um sinal sonoro confirma a entrada de dados, as informações são apresentadas e aparece uma a solicitar-lhe que introduza o item ou a informação seguinte. Depois de pesquisar a ID da amostra, ID do kit de teste e notas, prima ENT uma vez para confirmar que as informações introduzidas estão correctas. Se, por exemplo, tiver sido pesquisado um código de barras incorrecto para uma das amostras, prima ESC e, em seguida, volte a pesquisar todos os códigos de barras das amostras, de acordo com as instruções no ecrã. Para as ID de utilizador e notas, pode introduzir os números, utilizando o teclado, ou pode facilmente gerar os seus próprios códigos de barras para codificar estes números. 18 Manual do kit EZ1 DSP Virus 03/2015
19 Nota: para a detecção de dados, comece sempre por carregar as amostras na posição A no EZ1 Advanced e na posição 1 no EZ1 Advanced XL. Coloque as amostras restantes consecutivamente nas posições abertas seguintes da mesa de trabalho. Para obter mais informações sobre detecção utilizando o EZ1 Advanced Communicator software, consulte o Manual do Utilizador do EZ1 Advanced ou o Manual do Utilizador do EZ1 Advanced XL. Fluxo de trabalho do funcionamento do EZ1 DSP Virus Inserir o cartão EZ1 DSP Virus na ranhura do cartão EZ1 Ligar o instrumento EZ1 Seguir as mensagens no ecrã relativas à detecção de dados* Seguir as mensagens no ecrã relativas à configuração da mesa de trabalho Iniciar o protocolo Recolher ácidos nucleicos purificados Descontaminação por UV* * Apenas para EZ1 Advanced e EZ1 Advanced XL. Manual do kit EZ1 DSP Virus 03/
20 Preparar o ARN transportador (CARRIER) O ARN transportador (CARRIER) tem dois objectivos durante o procedimento de purificação. Em primeiro lugar, melhora a ligação dos ácidos nucleicos virais e do ADN bacteriano à superfície de sílica das partículas magnéticas, especialmente se a amostra contiver muito poucas moléculas alvo. Em segundo lugar, a adição de grandes quantidades de ARN transportador (CARRIER) reduz as hipóteses de degradação de ARN viral no caso raro de as RNases não estarem desnaturadas pelos sais caotrópicos e detergentes do tampão de lise. Se não for adicionado ARN transportador (CARRIER) à reacção, a recuperação de ADN ou ARN viral ou de ADN bacteriano pode ser baixa. O ARN transportador (CARRIER) liofilizado fornecido com o kit é suficiente para a preparação de 48 amostras. A concentração do ARN transportador (CARRIER) utilizado no processo de purificação permite que o kit EZ1 DSP Virus possa ser utilizado como um sistema de purificação genérico, que é compatível com muitos sistemas de amplificação diferentes e é adequado para a purificação de ácidos nucleicos de uma vasta gama de bactérias e ADN e ARN de vírus. Contudo, a eficiência dos sistemas de amplificação varia consoante a quantidade total de ácidos nucleicos presentes na reacção. Os eluatos obtidos utilizando o kit EZ1 DSP Virus contêm ácidos nucleicos virais e bacterianos e ARN transportador (CARRIER), e a quantidade de ARN transportador (CARRIER) em cada eluato excede grandemente a quantidade de ácidos nucleicos virais e bacterianos. Para obter os níveis mais elevados de sensibilidade em reacções de amplificação, pode ser necessário ajustar a quantidade da solução de ARN transportador (CARRIER) adicionada. Dissolva o ARN transportador (CARRIER) liofilizado cuidadosamente em 310 µl de tampão de eluição (AVE), divida-o em alíquotas convenientemente dimensionadas e armazene a 20 ± 5 C. Não congele/descongele as alíquotas mais do que 2 vezes. Para cada amostra processada, dilua 3,6 µl da solução-mãe de ARN transportador (CARRIER) num volume total de 60 µl utilizando o tampão de eluição (AVE) (e/ou uma solução de controlo interno). É transferido para a mistura de lise, um volume de 50 µl desta solução de ARN transportadortampão de eluição (CARRIER AVE), correspondente a 3 µg de ARN transportador (CARRIER). Se quiser utilizar um controlo interno (CI), consulte Utilização de um controlo interno (CI) abaixo. Nota: o procedimento de purificação é optimizado de modo a que sejam adicionados 3 µg de ARN transportador (CARRIER) por amostra. Se uma quantidade diferente de ARN transportador (CARRIER) tiver demonstrado ser melhor para um sistema de amplificação específico, altere o volume da solução-mãe de ARN transportador (CARRIER) misturada com o tampão de 20 Manual do kit EZ1 DSP Virus 03/2015
21 eluição (AVE) ou utilize uma concentração diferente da solução-mãe. O volume total da solução ARN transportador tampão de eluição (CARRIER AVE) deve ser de 60 µl, dos quais 50 µl são transferidos para a mistura de lise. A utilização de quantidades diferentes de ARN transportador (CARRIER) deve ser validada para cada tipo de amostra em particular e ensaio a jusante. Utilização de um controlo interno (CI) A utilização do kit EZ1 DSP Virus em combinação com sistemas de amplificação disponíveis comercialmente pode necessitar da introdução de um controlo interno (CI) no procedimento de purificação para monitorizar a eficiência da preparação da amostra. O controlo interno do ADN e do ARN deve ser combinado com a solução-mãe do ARN transportador (CARRIER) (3,6 µl) numa mistura. Para cada amostra, a mistura ARN transportador controlo interno (CARRIER controlo interno) deve ter um volume de 60 µl, dos quais 50 µl serão transferidos para a mistura de lise. Esta quantidade corresponde a 3 µl da solução-mãe do ARN transportador (CARRIER) mais 47 µl de tampão de eluição (AVE) e/ou solução de controlo interno. Nota: se o controlo interno (CI) estiver estável no plasma, soro, líquido cefalorraquidiano (LCR), urina, amostras respiratórias, sangue total, fezes, fluidos de transporte ou secreções secas (por exemplo, ARN blindado), pode ser adicionado alternadamente à amostra, pouco tempo antes de iniciar a preparação da amostra. Consulte as instruções do fabricante para determinar a quantidade óptima de controlo interno (CI) para aplicações específicas a jusante. Utilizar uma quantidade diferente da recomendada pode diminuir a eficiência da amplificação. Para determinar a quantidade de controlo interno (CI) necessário para o protocolo EZ1 DSP Virus, o volume do eluato necessita de ser tido em consideração. Consulte Apêndice B: Calcular a quantidade de controlo interno (CI), na página 65, para instruções detalhadas sobre como calcular o volume correcto de controlo interno (CI). Não são fornecidos controlos internos (CI) no kit EZ1 DSP Virus. Volumes de eluição e manuseamento de eluatos O passo final do procedimento de purificação consiste na eluição dos ácidos nucleicos virais e do ADN bacteriano num volume final de 60 µl, 90 µl, 120 µl ou 150 µl. Se o material da amostra forem fezes, recomendamos um volume de eluição de µl. Caso os eluatos obtidos a partir das fezes estejam turvos, centrifugue à velocidade máxima ( x g), durante 3 minutos ± 30 segundos, para Manual do kit EZ1 DSP Virus 03/
22 clarificar os eluatos. Este tratamento irá permitir melhorar o desempenho dos eluatos turvos em aplicações a jusante. Armazenamento de ácidos nucleicos virais/adn bacteriano Para o armazenamento a curto prazo até 24 horas, recomendamos o armazenamento dos ácidos nucleicos virais ou do ADN bacteriano a 2 8 C. Para o armazenamento a longo prazo superior a 24 horas, recomendamos o armazenamento entre 80 C e 20 C. Características de desempenho Para qualquer informação adicional eventualmente disponível no seu país, pedimos o favor de visitar o website da QIAGEN: 22 Manual do kit EZ1 DSP Virus 03/2015
23 Protocolo: pré-tratamento de urina Este protocolo destina-se ao pré-tratamento da urina antes da purificação de ácidos nucleicos (página 30). Procedimento 1. Adicione urina ao tampão ATL para obter um volume final de 100 µl, 200 µl ou 400 µl, de acordo com a tabela. Tabela 9. Volumes de urina e ATL Urina (µl) ATL (µl) Volume final da amostra (µl) O ATL deve ser encomendado em separado, consultar informações para encomenda, página Misture a solução, pipetando cuidadosamente para cima e para baixo, ou invertendo 3 vezes o tubo fechado. 3. Continue para o protocolo de purificação (página 30). Manual do kit EZ1 DSP Virus 03/
24 Protocolo: Pré-tratamento de sangue total Este protocolo destina-se ao pré-tratamento de amostras de sangue total antes da purificação de ácidos nucleicos (página 30). Procedimento 1. Adicione sangue total ao tampão ATL para obter um volume final de 100 µl, 200 µl ou 400 µl, de acordo com a tabela. Tabela 10. Volumes de sangue total e ATL Sangue total (µl) ATL (µl) Volume final da amostra (µl) O ATL deve ser encomendado em separado, consultar informações para encomenda, página Misture a solução, pipetando cuidadosamente para cima e para baixo, ou invertendo 3 vezes o tubo fechado. 3. Continue para o protocolo de purificação (página 30). 24 Manual do kit EZ1 DSP Virus 03/2015
25 Protocolo: pré-tratamento de fezes Este protocolo destina-se ao pré-tratamento de amostras de fezes sólidas e líquidas antes da purificação de ácidos nucleicos (página 30). Procedimento 1. Ressuspenda 100 mg de fezes sólidas ou líquidas em 900 µl de tampão ASL. Nota: se forem usadas mais ou menos fezes, é necessário ajustar a quantidade de tampão ASL, a fim de manter uma relação de diluição de 1:10 (p/v). 30 mg de fezes é o requisito mínimo para obter, pelo menos, 200 µl de volume de amostra após o pré-tratamento, para extracção com o instrumento EZ1. 2. Agite vigorosamente a amostra no vortexer, durante 1 2 minutos ou até a suspensão adquirir um aspecto homogéneo. Nota: se estiver a lidar com fezes bastante duras, poderá ter de prolongar o procedimento de ressuspensão o então tentar desagregar a amostra, pipetando para cima e para baixo. Para facilitar a operação de pipetação, poderá ser necessário cortar a extremidade da pipeta. Algumas partículas permanecerão insolúveis, sendo removidas durante o passo seguinte. 3. Incube a amostra durante 10 minutos ± 1 minuto, à temperatura ambiente, na bancada, a fim de permitir a sedimentação de partículas grandes de fezes. 4. Transfira, pelo menos, 400 µl de sobrenadante do topo da suspensão para um tubo de tampa roscada limpo de 1,5 ml, sem deixar passar partículas grandes das fezes. Nota: assegure-se de que não são transferidas para o instrumento EZ1 quaisquer partículas de fezes sólidas juntamente com o sobrenadante. Amostras com partículas grandes de fezes poderão entupir a ponta do filtro do instrumento EZ1. 5. Incube a amostra durante 10 minutos ± 1 minute a 70 C ± 3 C em banho-maria ou na termoagitadora. 6. Continue para o protocolo de purificação (página 30). Nota: no caso das amostras de fezes, é recomendável a utilização de um volume de amostra de 200 µl para extracção e µl de volume para eluição. Volumes de amostra maiores e volumes de eluição menores poderão fazer diminuir a sensibilidade das aplicações a jusante. Nota: caso os eluatos obtidos a partir das fezes estejam turvos, centrifugue à velocidade máxima ( x g) durante 3 minutos ± 30 segundos, para Assegure-se de que os instrumentos foram verificados, mantidos e calibrados regularmente de acordo com as recomendações do fabricante. Manual do kit EZ1 DSP Virus 03/
26 clarificar os eluatos. Isto não se irá reflectir negativamente em eluatos transparentes, mas irá melhorar o desempenho de eluatos turvos nas aplicações a jusante. 26 Manual do kit EZ1 DSP Virus 03/2015
27 Protocolo: Pré-tratamento de secreções secas Este protocolo destina-se ao pré-tratamento de secreções secas, com o intuito de libertar o material de amostra seco das secreções, antes de proceder à purificação de ácidos nucleicos (página 30). Procedimento 1. Acrescente 600 µl de ATL à secreção seca. Nota: o volume é ajustado em função do tipo de secreção. É preciso dispor de um volume de 400 µl para proceder à extracção. 2. Incube a secreção durante 15 minutos ± 1 minuto, a 56 C ± 3 C, agitando vigorosamente. 3. Transfira 100 µl, 200 µl ou 400 µl de líquido para um tubo de tampa roscada novo, consoante o volume de amostra escolhido. 4. Continue para o protocolo de purificação (página 30). Manual do kit EZ1 DSP Virus 03/
28 Protocolo: pré-tratamento de amostras respiratórias viscosas Este protocolo destina-se ao pré-tratamento de amostras respiratórias viscosas antes da purificação de ácidos nucleicos. As amostras respiratórias não viscosas não exigem qualquer pré-tratamento, podendo ser usadas imediatamente como material de partida para o protocolo de purificação (página 30). Procedimento 1. Adicione 1 volume de solução de Sputasol a 1 volume de amostra e agite bem. 2. Coloque em banho-maria ou na termoagitadora e incube a 37 C ± 3 C, agitando de tempos a tempos, até a amostra estar completamente liquefeita. 3. Continue para o protocolo de purificação (página 30). Assegure-se de que os instrumentos foram verificados, mantidos e calibrados regularmente de acordo com as recomendações do fabricante. 28 Manual do kit EZ1 DSP Virus 03/2015
29 Protocolo: pré-tratamento para isolamento de ADN genómico de bactérias Gram-positivas A extracção de ADN pode ser melhorada para algumas bactérias Grampositivas, através de pré-tratamento enzimático antes da transferência da amostra para o instrumento EZ1. Caso as amostras apresentem uma elevada viscosidade, como a expectoração, é recomendável efectuar a sua liquefacção de acordo com o protocolo relativo a amostras respiratórias, antes de começar este protocolo. Este protocolo não se destina a ser usado no caso de amostras de fezes ou de sangue total. Procedimento: 1. Forme um pellet de bactérias por centrifugação a 5000 x g durante 10 minutos ± 1 minuto (7500 rpm numa microcentrífuga). 2. Suspenda o pellet bacteriano em 180 µl de solução enzimática (20 mg/ml lisozima; 20 mm Tris-HCl, ph 8.0; 2 mm EDTA; Triton X- 100 a 1,2 %) num tubo de tampa roscada de 2 ml. 3. Incube durante, pelo menos, 30 minutos a 37 C ± 3 C. 4. Centrifugue o tubo, durante breves instantes, para remover gotas do interior da tampa. 5. Continue para o protocolo de purificação (página 30). Manual do kit EZ1 DSP Virus 03/
30 Protocolo: Purificação de ácidos nucleicos virais e ADN bacteriano Aspectos importantes antes do início do procedimento Se estiver a utilizar o kit EZ1 DSP Virus pela primeira vez, leia o Procedimento (página 14). Os cartuchos de reagentes (RCV) contêm sais de guanidina e, por conseguinte, não são compatíveis com reagentes desinfectantes que contenham lixívia. Tome medidas de segurança adequadas e use luvas durante o manuseamento. Consulte a página 11 para obter informações de segurança. Efectue todos os passos do protocolo à temperatura ambiente (15 25 C). Durante o procedimento de configuração, trabalhe rapidamente. Depois de receber o kit, verifique se os componentes do mesmo apresentam danos. Se os cartuchos de reagentes (RCV) ou outros componentes do kit estiverem danificados, contacte a Assistência Técnica ou o distribuidor local da QIAGEN. Em caso de derrame de líquido, consulte Avisos e precauções (página 11). Não utilize cartuchos de reagentes (RCV) ou outros componentes do kit danificados, uma vez que a sua utilização poderá resultar num fraco desempenho do kit. Em alguns passos do procedimento, pode fazer uma de 2 escolhas. Escolha se estiver a usar o EZ1 Advanced ou o EZ1 Advanced XL; escolha se estiver a usar o BioRobot EZ1 DSP. Outros aspectos importantes antes de iniciar o procedimento O tampão de lise no cartucho de reagentes (RCV) pode formar precipitados após o armazenamento. Se necessário, volte a dissolver, aquecendo a C e depois colocando à temperatura ambiente. Prepare as amostras de soro, plasma, LCR ou fluidos de transporte, tal como descrito em Manuseamento e armazenamento de amostras, página 13. Se forem visíveis crioprecipitados nas amostras descongeladas, centrifugue-as a 6800 x g, durante 3 minutos ± 30 segundos, transfira os sobrenadantes para tubos novos, sem interferir com os pellets, e comece imediatamente o procedimento de purificação. Prepare as amostras de urina tal como descrito em Protocolo: prétratamento de urina, página 23. Indisponível nos EUA ou no Canadá. 30 Manual do kit EZ1 DSP Virus 03/2015
31 Prepare as amostras de sangue total tal como descrito em Protocolo: Prétratamento de sangue total, página 24. Prepare as amostras de fezes tal como descrito em Protocolo: prétratamento de fezes, página 25. Prepare as amostras de secreções secas tal como descrito em Protocolo: Pré-tratamento de secreções secas, página 27. Prepare as amostras respiratórias tal como descrito em Protocolo: prétratamento de amostras respiratórias viscosas, página 28. As amostras respiratórias não viscosas não exigem qualquer pré-tratamento. Prepare uma solução-mãe de ARN transportador (CARRIER) (com controlo interno [IC] opcional) antes de usar pela primeira vez. Dissolva o ARN transportador (CARRIER) liofilizado em 310 µl de tampão de eluição (AVE) (fornecido no kit) e misture-o com o controlo interno (CI) (opcional), tal como descrito em Preparar o ARN transportador (CARRIER) e Utilização de um controlo interno (CI), páginas Procedimento 1. Para cada amostra, prepare uma solução de 60 µl contendo 3,6 µl de ARN transportador (CARRIER) dissolvido (com controlo interno [CI] opcional) num tubo de 1,5 ml (ET) (fornecido). Misture suavemente, pipetando a solução 10 vezes. Não leve ao vórtex. O tubo de 1,5 ml (ET) é carregado na terceira fila, tal como especificado nas instruções no ecrã. Nota: certifique-se de que a solução do ARN transportador (CARRIER) se encontra na parte inferior do tubo de 1,5 ml (ET), de modo a que a quantidade apropriada possa ser transferida pelo instrumento EZ1. 2. Transfira 100 µl, 200 µl, ou 400 µl de amostra para tubos de amostra de 2 ml (ST) e estabilize à temperatura ambiente (15 25 C) antes de carregar na mesa de trabalho. Se forem utilizadas amostras congeladas, descongele-as e estabilize-as à temperatura ambiente e misture-as bem no vórtex. Nota: para o desempenho ideal é essencial utilizar os tubos de 2 ml (ST) fornecidos com o kit. Nota: Não congele amostras descongeladas nem armazene amostras durante mais de 6 horas a 2 8 C, uma vez que isso leva à uma redução significativa dos rendimentos dos ácidos nucleicos virais ou do ADN bacteriano. Recomendamos a utilização de um volume de amostra de 100 µl, 200 µl ou 400 µl. É recomendado um volume de amostra de 200 µl para extracção de ácidos nucleicos virais ou bacterianos das fezes. Para efectuar Manual do kit EZ1 DSP Virus 03/
32 o pré-tratamento de amostras, consulte o protocolo de pré-tratamento correspondente. Se pretender utilizar menos amostra, perfaça o volume de 100 µl, 200 µl ou 400 µl com a quantidade apropriada de tampão de eluição (AVE) (tampão de eluição extra [AVE] não fornecido; disponível em separado). Nota: Não use volumes de amostra superiores a 100 µl, 200 µl ou 400 µl. Após a lise e a ligação dos ácidos nucleicos virais e do ADN bacteriano às partículas magnéticas, uma porção do lisado é transferida para o tubo de amostra (ST), a fim de inactivar os vírus residuais. Qualquer amostra deixada no tubo de amostra (ST) após a transferência da amostra perderse-á. 3. Insira o cartão EZ1 Advanced DSP Virus totalmente na ranhura do cartão EZ1 Advanced do EZ1 Advanced ou o cartão EZ1 Advanced XL DSP Virus na ranhura do cartão EZ1 Advanced XL do EZ1 Advanced XL, ou o cartão EZ1 DSP Virus totalmente na ranhura do cartão EZ1 do BioRobot EZ1 DSP. 4. Ligue o instrumento EZ1. O interruptor de alimentação está localizado na parte posterior esquerda do instrumento. 5. Prima START para iniciar a configuração da mesa de trabalho do protocolo EZ1 DSP Virus. 6. Abra a porta do instrumento. 7. Inverta cartuchos de reagentes (RCV) 3 vezes para misturar as partículas magnéticas. Em seguida, bata ligeiramente nos cartuchos (RCV) para depositar os reagentes no fundo dos respectivos poços. 8. Siga as instruções no ecrã relativas à configuração da mesa de trabalho, selecção da variável do protocolo e detecção de dados. Nota: Depois de fazer deslizar um cartucho de reagentes (RCV) para dentro do suporte de cartuchos, pressione o cartucho para baixo até ficar devidamente encaixado. Nota: Se existirem menos de 6 (BioRobot EZ1 DSP, EZ1 Advanced) ou 14 (EZ1 Advanced XL) cartuchos de reagentes (RCV), podem ser carregados por qualquer ordem no suporte. Contudo, quando carregar os outros materiais de laboratório, certifique-se de que também seguem a mesma ordem. Nota: Certifique-se de que os volumes de amostra correspondem ao volume de amostra do protocolo escolhido. Nota: Certifique-se de que os volumes de eluição correspondem ao volume de eluição do protocolo escolhido. Indisponível nos EUA ou no Canadá. 32 Manual do kit EZ1 DSP Virus 03/2015
33 Nota: Para a detecção de dados, comece sempre por carregar as amostras na posição A no EZ1 Advanced e na posição 1 no EZ1 Advanced XL. Coloque as amostras restantes consecutivamente nas posições abertas seguintes da mesa de trabalho. Nota: Quando utilizar a opção de detecção de dados, certifique-se de que a ID da amostra segue a mesma ordem das amostras na mesa de trabalho, para evitar a mistura de dados. 9. Feche a porta do instrumento. 10. Prima START para iniciar o protocolo. 11. Quando o protocolo terminar, o ecrã apresenta a indicação Protocol finished. Prima ENT para gerar o ficheiro de relatório. O EZ1 Advanced e o EZ1 Advanced XL podem armazenar até 10 ficheiros de relatório. Pode imprimir os ficheiros de relatório directamente numa impressora ligada ou transferi-los para um computador. 12. Abra a porta do instrumento. 13. Retire os tubos de eluição (ET) com os ácidos nucleicos virais/adn bacteriano purificado(s) da primeira fila. Elimine os resíduos da preparação das amostras *. 14. Recomendação: Siga as instruções no ecrã para executar a descontaminação por UV das superfícies da mesa de trabalho. 15. Efectue o procedimento de manutenção regular, tal como descrito no manual do utilizador fornecido com o instrumento EZ1. A manutenção regular tem de ser efectuada no fim de cada execução de protocolo. A mesma consiste na limpeza da unidade de perfuração e das superfícies da mesa de trabalho. Nota: A unidade de perfuração é afiada! É recomendada a utilização de luvas duplas. 16. Para executar outro protocolo, prima START, efectue os passos 1 e 2 do protocolo e, em seguida, siga o protocolo a partir do passo 5. Caso contrário, prima STOP duas vezes para regressar ao primeiro ecrã, feche a porta do instrumento e desligue o instrumento EZ1. Não é necessário efectuar os passos 3 4 quando executar outro protocolo. Ignore estes passos. Os resíduos das amostras contêm sais de guanidina e, por conseguinte, não são compatíveis com lixivia. Consultar a página 22 para informações de segurança. Manual do kit EZ1 DSP Virus 03/
34 Controlo de qualidade De acordo com o Sistema de Gestão da Qualidade Total certificado por norma ISO da QIAGEN, todos os lotes do EZ1 DSP Virus kit são testados face a especificações predeterminadas para garantir uma qualidade constante do produto. Limitações É da responsabilidade do utilizador validar o desempenho do sistema para quaisquer procedimentos utilizados no seu laboratório que não estejam abrangidos pelos estudos de avaliação de desempenho da QIAGEN. O desempenho do sistema foi estabelecido em estudos de avaliação de desempenho utilizando plasma, soro, LCR, urina, sangue total, fezes, fluidos de transporte, secreções secas e amostras respiratórias para o isolamento de ácidos nucleicos virais e ADN bacteriano. A avaliação de desempenho foi levada a cabo unicamente com as combinações de patógenos e de material de amostra listado nos dados de desempenho do manual. Para minimizar o risco de um impacto negativo nos resultados do diagnóstico, devem ser utilizados os controlos adequados para aplicações a jusante. Para uma validação mais aprofundada, são recomendadas as directrizes da International Conference on Harmonisation of Technical Requirements (ICH) descritas em ICH Q2(R1) Validation Of Analytical Procedures: Text and Methodology (Validação de Procedimentos Analíticos: Texto e Metodologia). Quaisquer resultados de diagnóstico gerados têm de ser interpretados juntamente com outros resultados clínicos ou laboratoriais. 34 Manual do kit EZ1 DSP Virus 03/2015
35 Símbolos O kit contém reagentes para 48 preparações de amostras Prazo de validade Dispositivo médico para diagnóstico in vitro Número de catálogo Número de lote Número do material Componentes Número Volume Número do item de comércio mundial Limitação de temperatura Fabricante legal Utilizar apenas com Contém Isotiocianato de guanidina Cloridrato de guanidina Etanol Isopropanol Proteinase K Este lado para baixo ao abrir Manual do kit EZ1 DSP Virus 03/
36 Referências A QIAGEN mantém uma abrangente base de dados online actualizada de publicações científicas que utilizam produtos QIAGEN. As opções de pesquisa avançada permitem localizar os artigos de que necessita, quer através da pesquisa por uma única palavra-chave, quer especificando a aplicação, área de investigação, título, etc. Para obter uma lista completa de referências, visite a base de dados de referências da QIAGEN online em ou contacte a Assistência Técnica ou o distribuidor local da QIAGEN. Informação de contacto Na QIAGEN, orgulhamo-nos da qualidade e da disponibilidade do nosso suporte técnico. Os nossos departamentos de assistência técnica são compostos por cientistas experientes com conhecimentos práticos e teóricos abrangentes em tecnologias de amostragem e ensaio e utilização dos produtos QIAGEN. Se tiver alguma dúvida ou tenha dificuldades em relação ao EZ1 DSP Virus kit ou aos produtos QIAGEN de um modo geral, não hesite em contactar-nos. Os clientes da QIAGEN são a principal fonte de informação no que diz respeito às utilizações avançadas ou especializadas dos nossos produtos. Estas informações são úteis a outros cientistas, bem como aos investigadores da QIAGEN. Por conseguinte, incentivamo-lo a contactar-nos caso tenha alguma sugestão acerca do desempenho dos produtos ou de novas aplicações e técnicas. Para obter assistência técnica e mais informações, consulte o nosso Centro de Suporte Técnico em ou contacte um dos Departamentos da Assistência Técnica ou distribuidores locais da QIAGEN (consulte o verso do manual ou visite 36 Manual do kit EZ1 DSP Virus 03/2015
37 Guia de resolução de problemas Este guia de resolução de problemas pode ser útil para resolver qualquer problema que possa surgir. Para obter mais informações, consulte também a página de perguntas frequentes no nosso Centro de Suporte Técnico: Os cientistas da Assistência Técnica da QIAGEN estão sempre prontos a responder a qualquer questão que possa ter sobre as informações e protocolos constantes neste manual ou sobre as tecnologias de amostragem e ensaio (para informações de contacto, consulte o verso do manual ou visite Comentários e sugestões Manuseamento geral a) Mensagem de erro no ecrã do instrumento b) O ficheiro de relatório não é imprimido c) O ficheiro de relatório não é enviado para o PC d) Introdução da ID do cartão Q incorrecta Consulte o manual do utilizador fornecido com o instrumento EZ1. Verifique se a impressora está conectada ao EZ1 Advanced ou EZ1 Advanced XL através da porta série PC/Printer. Verifique se a porta série está configurada para utilizar com uma impressora. Verifique se o PC está conectado ao EZ1 Advanced ou EZ1 Advanced XL através da porta série PC/Printer. Verifique se a porta série está configurada para utilizar com um PC. Se tiver sido introduzida uma ID incorrecta em vez da ID do cartão Q, o EZ1 Advanced ou o EZ1 Advanced XL não irá aceitar a ID e irá pedir-lhe a ID do cartão Q até que seja introduzida a ID correcta. Prima STOP duas vezes para regressar ao menu principal. Baixo rendimento de ácidos nucleicos virais ou de ADN bacteriano a) Ressuspensão incompleta das partículas magnéticas Certifique-se de que ressuspende as partículas magnéticas cuidadosamente antes de carregar os cartuchos de reagentes (RCV) no suporte. b) Foi aspirado pouco reagente Depois de inverter os cartuchos de reagentes (RCV), para ressuspender as partículas magnéticas, certifique-se de que bate ligeiramente nos cartuchos (RCV) para depositar os reagentes no fundo dos poços. Manual do kit EZ1 DSP Virus 03/
38 Comentários e sugestões c) Reagentes carregados na mesa de trabalho pela ordem errada d) Não foi adicionado ARN transportador (CARRIER) e) O ARN transportador (CARRIER) e tampão de eluição (AVE) não foram suficientemente misturados Certifique-se de que todos os tubos (ET, ST) e os porta-pontas (DTH) com as pontas (DFT) estão carregados na mesa de trabalho pela ordem correcta. Repita o procedimento de purificação com novas amostras. Reconstitua o ARN transportador (CARRIER) liofilizado em 310 µl de tampão de eluição (AVE). Para cada amostra, utilize 3,6 µl desta solução-mãe de ARN transportador (CARRIER), misturado com controlo interno (CI) (opcional) e tampão de eluição (AVE) adicional a um volume final de 60 µl, tal como descrito em Preparar o ARN transportador (CARRIER) e Utilização de um controlo interno (CI), páginas Repita o procedimento de purificação com novas amostras. Misture o ARN transportador (CARRIER), o controlo interno (CI) (opcional) e o tampão de eluição (AVE), pipetando, pelo menos, 10 vezes. f) ARN degradado O ARN poderá ter sido degradado pelas RNases nas amostras originais. Certifique-se de que todas as amostras são processadas imediatamente após a colheita ou remoção do armazenamento. g) Precipitados visíveis no fundo dos poços dos cartuchos de reagentes Coloque os cartuchos de reagentes (RCV) num agitador-incubador e incube a C com agitação suave durante, no máximo, 2 horas. Não utilize os cartuchos de reagentes (RCV) se os precipitados não voltarem a dissolver-se. O ARN e o ADN não têm um bom desempenho em aplicações a jusante a) Poucos ou nenhuns ácidos nucleicos no eluato Consulte Baixo rendimento de ácidos nucleicos virais ou de ADN bacteriano, página 37, para possíveis motivos. Aumente a quantidade de eluato adicionado às reacções enzimáticas a jusante, se possível. 38 Manual do kit EZ1 DSP Virus 03/2015
39 Comentários e sugestões b) As amostras congeladas não foram devidamente misturadas após descongelamento c) Ácidos nucleicos em amostras já degradadas antes da purificação d) Lise insuficiente das amostras e) Carry-over do sal durante a eluição f) ARN transportador (CARRIER) no eluato g) Muito eluato na reacção de amplificação Descongele as amostras congeladas à temperatura ambiente (15 25 C) e misture no vortexer durante 15 segundos. Isto pode ocorrer se as amostras tiverem sido novamente congeladas após uma descongelação ou armazenadas à temperatura ambiente durante muito tempo. Utilize sempre amostras frescas ou amostras descongeladas apenas uma vez. Repita o procedimento de purificação com novas amostras. Isto pode ocorrer se os cartuchos de reagentes (RCV) tiverem sido armazenados a temperaturas elevadas durante demasiado tempo, levando à inactivação da proteinase K. Repita o procedimento de purificação utilizando amostras e cartuchos de reagentes (RCV) novos. Para obter os melhores resultados, certifique-se de que os cartuchos de reagentes (RCV) estão a C. Determine a quantidade máxima de ARN transportador (CARRIER) adequada para a sua reacção de amplificação. Ajuste a concentração da solução de ARN transportador (CARRIER). Determine o volume máximo de eluato adequada para a sua reacção de amplificação. Reduza o volume de eluato adicionado à reacção de amplificação ou aumente o volume de eluição em conformidade. Um controlo positivo pode ser fortificado no eluato, se assim se pretender, para determinar o efeito do eluato na reacção de amplificação. Manual do kit EZ1 DSP Virus 03/
40 Comentários e sugestões h) Variação do desempenho de ácidos nucleicos purificados em ensaios a jusante i) Falta de sensibilidade devido a substâncias inibitórias j) Nova combinação de transcriptase reversa e Taq ADN polimerase k) Carry-over de partículas magnéticas Os componentes do sal e etanol do tampão de lavagem 1 ou do tampão de lavagem 2 no cartucho (RCV) podem ter-se separado devido a um armazenamento demasiado longo. Agite sempre os cartuchos (RCV) cuidadosamente e bata-os ligeiramente antes de iniciar um procedimento de purificação. Aumente o volume de eluição. Um controlo positivo pode ser fortificado no eluato, se assim se pretender, para determinar o efeito do volume de eluição na reacção de amplificação. Caso os eluatos obtidos a partir das fezes estejam turvos, centrifugue à velocidade máxima ( x g) durante 3 minutos ± 30 segundos, para clarificar os eluatos. Isto não se irá reflectir negativamente em eluatos transparentes, mas irá melhorar o desempenho de eluatos turvos nas aplicações a jusante. Se as enzimas tiverem mudado, poderá ser necessário reajustar a quantidade de ARN transportador (CARRIER) adicionado ao tampão de eluição (AVE) e a quantidade de eluato utilizado. O carry-over de partículas magnéticas nos eluatos não irá afectar a maioria das aplicações a jusante, incluindo RT-PCR. Se o risco de carryover de partículas magnéticas necessitar de ser minimizado (por exemplo, para aplicações tais como PCR em tempo real), coloque primeiro os tubos que contêm eluato num íman adequado (por exemplo, 12-Tube Magnet [ref.ª 36912]), durante 1 minuto, e em seguida transfira os eluatos para tubos limpos. Se não estiver disponível um íman adequado, centrifugue os tubos que contém os eluatos durante 1 minuto, à velocidade máxima, numa microcentrífuga, para formar um pellet de todas as partículas magnéticas restantes e transfira os sobrenadantes para tubos limpos. 40 Manual do kit EZ1 DSP Virus 03/2015
41 Apêndice A: Mensagens apresentadas As mensagens apresentadas pelo protocolo do software durante a configuração da mesa de trabalho, durante a execução do protocolo e após a execução do protocolo são apresentadas nas Tabelas Os números das mensagens apresentadas nas tabelas correspondem aos números das mensagens apresentadas pelo software. Para obter informações sobre as mensagens de erro gerais apresentadas no visor do instrumento EZ1 consulte o manual do utilizador fornecido com o instrumento EZ1 em questão. Tabela 11. Mensagens apresentadas no procedimento do EZ1 Advanced XL DSP Virus Número da Tipo de Texto da do EZ1 Advanced XL Nenhum Orientação Date/time START: Run 1: UV 2: Man 3: Test 4: Setup 1 Orientação EZ1 Advanced XL DSP Virus Version 1.0 Tradução Data/hora INICIAR: Execução 1: UV 2: Man 2: Man 3: Teste 4: Configuração EZ1 Advanced XL DSP Virus Versão Detecção de dados 3 Detecção de dados Enter user ID ENT: Next Enter Q-Card bar code ENT: Next Introduzir ID do utilizador ENT: Seguinte Introduzir código de barras do cartão Q ENT: Seguinte 4 Orientação Wrong kit! Please load EZ1 DSP Virus Kit ENT: Back Kit incorrecto! Carregue-o EZ1 DSP Virus Kit ENT: Recuar A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
42 Tabela 11. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 5 Orientação Kit expired MMYY ENT: Use new kit ESC: Stop protocol Tradução Prazo de validade do kit expirado MMAA ENT: Utilize um kit novo ESC: Parar protocolo 6 Detecção de dados Use Q-Card data with sample 1 to xx Enter 1 to 14 ENT: Next Utilize os dados do cartão Q com a amostra 1 a xx Introduza 1 a 14 ENT: Seguinte 7 Orientação Do you want to process more samples with another kit lot ENT:Yes, ESC: No Pretende processar mais amostras com um kit de outro lote ENT: Sim, ESC: Não 8 Detecção de dados 9 Detecção de dados 10 Detecção de dados Do you want to add sample ID? ENT: Yes ESC: No Enter sample ID for sample no. [x] ENT: Next Do you want to check sample IDs ENT: Yes ESC: No Pretende adicionar a ID da amostra? ENT: Sim ESC: Não Introduza a ID da amostra para a amostra n.º [x] ENT: Seguinte Pretende verificar as IDs das amostras? ENT: Sim ESC: Não A tabela continua na página seguinte. 42 Manual do kit EZ1 DSP Virus 03/2015
43 Tabela 11. Continuação Número da Tipo de 11 Detecção de dados Texto da do EZ1 Advanced XL ID 1: ID 2: ID 3: DOWN: Next Tradução ID 1: ID 2: ID 3: PARA BAIXO: Seguinte 12 Detecção de dados 13 Detecção de dados 14 Detecção de dados 15 Detecção de dados ID 4: ID 5: ID 6: DOWN: Next, UP: Back ID 7: ID 8: ID 9: DOWN: Next, UP: Back ID 10: ID 11: ID 12: DOWN: Next, UP: Back ID 13: ID 14: ESC: Rescan DOWN: Next, UP: Back ID 4: ID 5: ID 6: PARA BAIXO: Seguinte, PARA CIMA: Recuar ID 7: ID 8: ID 9: PARA BAIXO: Seguinte, PARA CIMA: Recuar ID 10: ID 11: ID 12: PARA BAIXO: Seguinte, PARA CIMA: Recuar ID 13: ID 14: ESC: Voltar a pesquisar PARA BAIXO: Seguinte, PARA CIMA: Recuar A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
44 Tabela 11. Continuação Número da Tipo de 16 Detecção de dados 17 Detecção de dados 18 Detecção de dados 19 Detecção de dados 20 Detecção de dados 21 Detecção de dados Texto da do EZ1 Advanced XL Do you want to add assay information? ENT: Yes, ESC: No Enter assay ID for sample no. [x] ENT: Next Do you want to check assay IDs? ENT: Yes ESC: No Do you want to add notes? ENT: Yes ESC: No Enter notes for sample no. [x] ENT: Next Do you want to check notes? ENT: Yes ESC: No Tradução Pretende adicionar informações do ensaio? ENT: Sim, ESC: Não Introduza a ID do ensaio para a amostra n.º [x] ENT: Seguinte Pretende verificar as IDs dos ensaios? ENT: Sim ESC: Não Pretende adicionar notas? ENT: Sim ESC: Não Introduza as notas para a amostra n.º [x] ENT: Seguinte Pretende verificar as notas? ENT: Sim ESC: Não 22 Selecção Select sample volume: 1: 100 ul 2: 200 ul 3: 400 ul Seleccionar volume da amostra: 1: 100 ul 2: 200 ul 3: 400 ul A tabela continua na página seguinte. 44 Manual do kit EZ1 DSP Virus 03/2015
45 Tabela 11. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 23 Selecção Select elution volume: 1: 60 ul 2: 90 ul 3: 120 ul 4: 150 ul 24 Orientação You have chosen Sample volume: xxxul Elution volume :yyyul ENT: Next, ESC: Back 25 Orientação Load cartridges at same positions as samples ENT: Next, ESC: Back 26 Orientação Load empty 2 ml tubes into heating block ENT: Next, ESC: Back 27 Orientação Load elution tubes (1.5 ml) into first row ENT: Next, ESC: Back 28 Orientação Load tip holders and tips into second row ENT: Next, ESC: Back Tradução Seleccionar volume de eluição: 1: 60 ul 2: 90 ul 3: 120 ul 4: 150 ul Seleccionou: Volume da amostra: xxxul Volume de eluição: yyyul ENT: Seguinte, ESC: Recuar Carregar os cartuchos nas mesmas posições que as amostras ENT: Seguinte, ESC: Recuar Carregar tubos de 2 ml vazios no bloco de aquecimento ENT: Seguinte, ESC: Recuar Carregar os tubos de eluição de 1,5 ml na primeira fila ENT: Seguinte, ESC: Recuar Carregar os portapontas e as pontas na segunda fila ENT: Seguinte, ESC: Recuar A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
46 Tabela 11. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 29 Orientação Load 1.5ml tubes containing crna and IC into third row ENT: Next, ESC: Back 30 Orientação Load 2 ml tubes with sample into fourth row ENT: Next, ESC: Back 31 Orientação Loading finished Close door and press START ESC: Back 32 Orientação Please close door! ENT: Next 33 Orientação Checking Temperature Set: Cur: Tradução Carregar tubos de 1,5 ml contendo carn e CI na terceira fila ENT: Seguinte, ESC: Recuar Carregar os tubos de eluição de 2 ml na primeira fila ENT: Seguinte, ESC: Recuar Carregamento terminado Fechar a porta e primir ESC: Recuar Feche a porta! ENT: Seguinte Verificar a configuração da temperatura Set: Cur: 34 Estado Protocol started Protocolo iniciado 35 Estado Piercing Foil [x] of 43 min left 36 Estado Collecting elution buffer AVE [x] of 43 min left Perfuração da película Faltam [x] de 43 min Colheita do tampão de eluição AVE Faltam [x] de 43 min A tabela continua na página seguinte. 46 Manual do kit EZ1 DSP Virus 03/2015
47 Tabela 11. Continuação Número da Tipo de 37 Estado Collecting crna + IC Texto da do EZ1 Advanced XL Tradução [x] of 43 min left Colheita de crna + CI Faltam [x] de 43 min 38 Estado Collecting Lysis Buffer [x] of 43 min left 39 Estado Collecting Sample [x] of 43 min left 40 Estado Collecting Proteinase K Faltam [x] de 43 min 41 Estado Mixing Lysate Faltam [x] de 43 min 42 Estado 15 min incubation [x] of 43 min left 43 Estado Tip touch. [x] of 43 min left 44 Estado Collecting Binding Buffer [x] of 43 min left Colheita de tampão de lise Faltam [x] de 43 min Recolha de amostra Faltam [x] de 43 min Colheita de Proteinase K Faltam [x] de 43 min Misturar o lisado Faltam [x] de 43 min Incubação de 15 minutos Faltam [x] de 43 min Suporte de pontas Faltam [x] de 43 min Colheita de tampão de ligação Faltam [x] de 43 min A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
48 Tabela 11. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 45 Estado Collecting Lysis Buffer [x] of 43 min left 46 Estado Collecting Beads [x] of 43 min left 47 Estado Resuspending Beads in Binding Buffer [x] of 43 min left 48 Estado Transfering Lysate [x] of 43 min left 49 Estado Binding Magnetic Separation [x] of 43 min left 50 Estado Wash 1 Magnetic Separation [x] of 43 min left 51 Estado Wash 2 Magnetic Separation [x] of 43 min left Tradução Colheita de tampão de lise Faltam [x] de 43 min Colheita de esferas Faltam [x] de 43 min Ressuspender as esferas em tampão de ligação Faltam [x] de 43 min Transferir o lisado Faltam [x] de 43 min Ligação da separação magnética Faltam [x] de 43 min Lavagem 1 Separação magnética Faltam [x] de 43 Lavagem 2 Separação magnética Faltam [x] de 43 min A tabela continua na página seguinte. 48 Manual do kit EZ1 DSP Virus 03/2015
49 Tabela 11. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 52 Estado Wash 3 Magnetic Separation [x] of 43 min left 53 Estado Drying Beads 54 Estado Rinse 55 Estado Elution [x] of 43 min left [x] of 43 min left [x] of 43 min left 56 Orientação Check transfer of crna + IC (row 3) ENT: Next 57 Orientação Check transfer of sample (row 4) ENT: Next 58 Orientação Protocol finished ENT: Next Tradução Lavagem 3 Separação magnética Faltam [x] de 43 min Secar as esferas Faltam [x] de 43 min Enxaguamento Faltam [x] de 43 min Eluição Faltam [x] de 43 min Verificar a transferência de crna + CI (linha 3) ENT: Seguinte Verificar a transferência da amostra (linha 4) ENT: Seguinte Protocolo concluído ENT: Seguinte A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
50 Tabela 11. Continuação Número da Tipo de 59 Detecção de dados 60 Nenhum Texto da do EZ1 Advanced XL Transferring report file Attempt no. Tradução Transferência do ficheiro de relatório Tentativa n.º Nenhum Orientação Report file sent Print out o.k.? 1: o.k. 2: não o.k. 61 Orientação Report file sent ENT: Next 62 Orientação Report file could not be sent ENT: Resend 63 Orientação Perform UV run? ENT: Yes ESC: No 64 Orientação Remove eluates and consumables from the worktable ENT: Next 65 Orientação UV decontamination: Enter min ENT: Next Ficheiro de relatório enviado Ficou bem impresso? 1: o.k. 2: não o.k. Ficheiro de relatório enviado ENT: Seguinte O ficheiro de relatório não pode ser enviado ENT: Enviar novamente Realizar execução UV? ENT: Sim ESC: Não Remover eluatos e consumíveis da mesa de trabalho ENT: (Seguinte) Descontaminação UV): Inserir min ENT: Seguinte A tabela continua na página seguinte. 50 Manual do kit EZ1 DSP Virus 03/2015
51 Tabela 11. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 66 Orientação UV descontamination time must be between min ESC: Back 67 Orientação UV decontamination Total time: min Time left: min 68 Orientação Perform regular maintenance after each run ESC: Main menu 69 Orientação UV lamps expire soon UV runs left: ENT: Next 70 Orientação UV lamps are expired ENT: Next ESC: Abort 71 Orientação Decontamination UV lamps cooling Please stand by 72 Orientação Perform regular maintenance after each run ESC: Main menu Tradução O tempo de descontaminação UV deve ser configurado entre min ESC: Recuar Descontaminação UV Tempo total: min Tempo restante: min Executar manutenção regular após cada execução ESC: Menu principal A lâmpada de UV expirará brevemente Execuções UV restantes: ENT: Seguinte As lâmpadas UV expiraram ENT: Seguinte ESC: Cancelar Arrefecimento das lâmpadas de descontaminação UV Aguarde Executar manutenção regular após cada execução ESC: Menu principal Manual do kit EZ1 DSP Virus 03/
52 Tabela 12. Mensagens apresentadas no procedimento do EZ1 Advanced DSP Virus Número da Tipo de Texto da do EZ1 Advanced XL Nenhum Orientação Date/time START: Run 1: UV 2: Man 3: Test 4: Setup Key: START, 1, 2, 3, 4 1 Orientação EZ1 Advanced DSP Virus Version 1.0 Tradução Data/hora INICIAR: Executar 1: UV 2: Man 3: Teste 4: Configuração Tecla: INICIAR, 1, 2, 3, 4 EZ1 Advanced DSP Virus Versão Detecção de dados 3 Detecção de dados Scan/enter user ID Scan/enter Q-Card bar code Pesquisar/introduzir ID do utilizador Pesquisar/introduzir código do cartão Q 4 Orientação Wrong kit! Please load EZ1 DSP Virus Kit ENT=back 5 Orientação Kit expired ENT: Use new kit ESC: Stop protocol Kit incorrecto! Carregue o EZ1 DSP Virus Kit ENT=Recuar O kit expirou ENT: Utilize um kit novo ESC: Parar protocolo 6 Detecção de dados Use Q-Card data with sample no. 1 to Enter 1 to 6 Utilize os dados do cartão Q com a amostra n.º 1 para Introduzir 1 a 6 A tabela continua na página seguinte. 52 Manual do kit EZ1 DSP Virus 03/2015
53 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 7 Orientação Do you want to process more samples with another kit lot ENT: Yes, ESC: No Tradução Pretende processar mais amostras com um kit de outro lote ENT: Sim, ESC: Não 8 Detecção de dados 9 Detecção de dados 10 Detecção de dados 11 Detecção de dados 12 Detecção de dados 13 Detecção de dados Do you want to add sample ID? ENT: Yes ESC: No Scan/enter sample ID sample no. [x] ID1: ID2: ID3: Next=ENT ID4: ID5: ID6: Next=ENT, ID1-3=Up Do you want to add assay information? ENT: Yes, ESC: No Scan/enter assay ID ID sample no. [x] Pretende adicionar a ID da amostra? ENT: Sim ESC: Não Pesquisar/introduzir ID da amostra amostra n.º [x] ID1: ID2: ID3: Seguinte=ENT ID4: ID5: ID6: Seguinte=ENT, ID1-3=Para cima Pretende adicionar informações do ensaio? ENT: Sim, ESC: Não Pesquisar/introduzir ID do ensaio D da amostra n.º [x] A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
54 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL Tradução 14 Detecção de dados 15 Detecção de dados Do you want to add notes? ENT: Yes ESC: No Scan/enter notes sample no. [x] Pretende adicionar notas? ENT: Sim ESC: Não Pesquisar/introduzir notas amostra n.º [x] 16 Orientação Select sample volume: 1: 100 ul 2: 200 ul 3: 400 ul 17 Orientação Select elution volume: 1: 60 ul 2: 90 ul 3: 120 ul 4: 150 ul 18 Orientação You have chosen: Sample volume: [xxx] ul Elution volume: [yyy] ul Next=Any, Prev=Esc 19 Orientação Load cartridges at same positions as samples Next=Any, Prev=Esc Seleccionar volume da amostra: 1: 100 ul 2: 200 ul 3: 400 ul Seleccionar volume de eluição: 1: 60 ul 2: 90 ul 3: 120 ul 4: 150 ul Seleccionou: Volume da amostra: [xxx] ul Volume de eluição: [yyy] ul Seguinte=Qualquer, Anterior=Esc Carregar os cartuchos nas mesmas posições que as amostras Seguinte=Qualquer, Anterior=Esc A tabela continua na página seguinte. 54 Manual do kit EZ1 DSP Virus 03/2015
55 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 20 Orientação Load empty 2.0 ml tubes at heating block Next=Any, Prev=Esc 21 Orientação Load elution tubes (1.5 ml) into first row Next=Any, Prev=Esc 22 Orientação Load tip holders and tips into second row Next=Any, Prev=Esc 23 Orientação Load 1.5 ml tubes containing crna and IC in third row Next=Any, Prev=Esc 24 Orientação Load 2.0 ml tubes with sample in fourth row Next=Any, Prev =Esc 25 Orientação Loading finished. Close door and press START Prev=Esc Tradução Carregar tubos de 2 ml vazios no bloco de aquecimento Seguinte=Qualquer, Anterior=Esc Carregar os tubos de eluição de 1,5 ml na primeira fila Seguinte=Qualquer, Anterior=Esc Carregar os portapontas e as pontas na segunda fila Seguinte=Qualquer, Anterior=Esc Carregar tubos de 1,5 ml contendo carn e CI na terceira fila Seguinte=Qualquer, Anterior=Esc Carregar os tubos de 2 ml com amostra na quarta fila Seguinte=Qualquer, Anterior=Esc Carregamento terminado. Feche a porta e prima INICIAR Anterior=Esc A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
56 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL Tradução 26 Orientação Please close door! Feche a porta! 27 Orientação Checking Temperature Set: Cur: Verificar a configuração da temperatura Set: Cur: 28 Estado Protocol started Protocolo iniciado 29 Estado Piercing foil Perfuração da película 30 Estado Collecting Elution Buffer AVE 31 Estado Collecting crna + IC 32 Estado Collecting Lysis Buffer Colheita do tampão de eluição AVE Colheita de carn + CI Colheita de tampão de lise 33 Estado Collecting Sample Recolha de amostra 34 Estado Collecting Proteinase K Colheita de Proteinase K 35 Estado Mixing Lysate Misturar o lisado 36 Estado 15 min Incubation [x] of 43 min left 37 Estado Kick [x] of 43 min left 38 Estado Collecting Binding Buffer [x] of 43 min left Incubação de 15 minutos Faltam [x] de 43 min Kick Faltam [x] de 43 min Colheita de tampão de ligação Faltam [x] de 43 min A tabela continua na página seguinte. 56 Manual do kit EZ1 DSP Virus 03/2015
57 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 39 Estado Collecting Lysis Buffer [x] of 43 min left 40 Estado Collecting Beads [x] of 43 min left 41 Estado Resuspension of Beads in Binding Buffer [x] of 43 min left 42 Estado Transferring Lysate [x] of 43 min left 43 Estado Binding Magnetic Separation [x] of 43 min left 44 Estado Wash 1 Magnetic Separation [x] of 43 min left 45 Estado Wash 2 Magnetic Separation [x] of 43 min left 46 Estado Wash 3 Magnetic Separation [x] of 43 min left Tradução Colheita de tampão de lise Faltam [x] de 43 min Colheita de esferas Faltam [x] de 43 min Ressuspensão das esferas em tampão de ligação Faltam [x] de 43 min Transferência de lisado Faltam [x] de 43 min Ligação da separação magnética Faltam [x] de 43 min Lavagem 1 Separação magnética Faltam [x] de 43 min Lavagem 2 Separação magnética Faltam [x] de 43 min Lavagem 3 Separação magnética Faltam [x] de 43 min A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
58 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 47 Estado Dry Beads [x] of 43 min left 48 Estado Rinse [x] of 43 min left 49 Estado Elution [x] of 43 min left 50 Orientação Check transfer of crna + IC (row 3) Next=Any Tradução Secar as esferas Faltam [x] de 43 min Enxaguamento Faltam [x] de 43 min Eluição Faltam [x] de 43 min Verificar a transferência de carn + CI (linha 3) Seguinte=Qualquer 51 Orientação Check transfer of sample (row 4) Next=Any Verificar a transferência da amostra (linha 4) Seguinte=Qualquer 52 Orientação Protocol finished Protocolo concluído 53 Detecção de dados Transfer Report file, attempt no. Transferência do ficheiro de relatório, tentativa n.º 54 Orientação Report file sent Next=ENT Ficheiro de relatório enviado Seguinte=ENT 55 Orientação Report file could not be sent Resend=ENT O ficheiro de relatório não pode ser enviado Reenviar=ENT 56 Orientação Perform UV run? ENT: Yes ESC: No Realizar execução UV? ENT: Sim ESC: Não A tabela continua na página seguinte. 58 Manual do kit EZ1 DSP Virus 03/2015
59 Tabela 12. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 57 Orientação UV decontamination Set time min Key:0-9, ENT 58 Orientação UV decontamination. Time must be between min Key:ESC 59 Orientação UV decontamination Time left: min 60 Orientação Perform regular maintenance after each run ESC=Main menu 61 Orientação UV lamps expires soon UV runs left: ENT=continuar 62 Orientação UV lamp is expired ENT=continue ESC=abort 63 Orientação Decontamination UV lamp cooling Please stand by Tradução Descontaminação UV Configurar tempo min Tecla:0-9, ENT Descontaminação UV. O tempo deve ser entre min Tecla:ESC Descontaminação UV Tempo restante: min Efectuar manutenção regular após cada execução ESC=Menu principal A lâmpada de UV expirará brevemente Execuções UV restantes: ENT= continuar Fim do prazo de validade da lâmpada UV ENT=continuar ESC=cancelar Arrefecimento da lâmpada de descontaminação UV, aguarde A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
60 Tabela 13. Mensagens apresentadas no procedimento do BioRobot EZ1DSP Virus* Número da Tipo de Texto da do EZ1 Advanced XL Nenhum Orientação Choose button: START: Protocols 1: Tools 2: Tests 1 Orientação BioRobot EZ1 DSP Virus Version 2 Orientação Select sample volume: 1: 100ul 2: 200ul 3: 400ul 3 Orientação Select elution volume: 1: 60ul 2: 90ul 3: 120ul 4: 150ul 4 Orientação You have chosen: Sample Volume:[sample volume]ul Elution Volume:[elution volume]ul Next=Any, Prev=ESC Tradução Seleccione o botão: INICIAR:Protocolos 1: Ferramentas 2: Testes Versão BioRobot EZ1 DSP Virus Seleccionar volume da amostra: 1: 100ul 2: 200ul 3: 400ul Seleccionar volume de eluição: 1: 60ul 2: 90ul 3: 120ul 4: 150ul Seleccionou: Volume da amostra:[volume da amostra]ul Volume de eluição):[volume de eluição]ul Seguinte=Qualquer, Anterior=ESC A tabela continua na página seguinte. Indisponível nos EUA ou no Canadá. 60 Manual do kit EZ1 DSP Virus 03/2015
61 Tabella 13. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 5 Orientação Load cartridges (RCV) at same positions as samples Next=Any, Prev=Esc 6 Orientação Load empty 2.0ml tubes (ST)at heating block Next=Any, Prev=Esc 7 Orientação Load elution tubes (ET) (1.5ml) into first row Next=Any, Prev=ESC 8 Orientação Load tip holders (DTH) and tips (DFT) into second row Next=Any, Prev=ESC 9 Orientação Load 1.5ml tubes (ET) with (CARRIER) + IC in third row Next =Any, Prev=ESC Tradução Carregar os cartuchos (RCV) nas mesmas posições que as amostras Seguinte=Qualquer, Anterior=Esc Carregar tubos de 2 ml vazios (ST) no bloco de aquecimento Seguinte=Qualquer, Anterior=Esc Carregar os tubos de eluição de 1,5 ml (ET) na primeira fila Seguinte=Qualquer, Anterior=ESC Carregar os portapontas (DTH) e as pontas (DFT) na segunda fila Seguinte=Qualquer, Anterior=ESC Carregar tubos de 1,5 ml (ET) contendo (CARRIER) + CI na terceira fila Seguinte=Qualquer, Anterior=ESC A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
62 Tabella 13. Continuação Número da Tipo de Texto da do EZ1 Advanced XL 10 Orientação Load 2.0ml tubes (ST) with sample in fourth row Next=Any, Prev=ESC 11 Orientação Start protocol Press START Prev=ESC 12 Estado Checking Temperature Set: 63.0 [deg] Cur: [deg] Tradução Carregar os tubos de 2 ml (ST) com amostra na quarta fila Seguinte=Qualquer, Anterior=ESC Iniciar protocolo Premir INICIAR Anterior=ESC Verificar a configuração da temperatura Set: 63,0 [deg] Cur: [deg] 13 Estado Protocol started Protocolo iniciado 14 Estado Piercing Foil Perfuração da película 15 Estado Collecting Elution Buffer AVE 16 Estado Collecting crna (CARRIER) + IC 17 Estado Collecting Lysis Buffer Colheita do tampão de eluição AVE Colheita de carn (CARRIER) + CI Colheita de tampão de lise 18 Estado Collecting Sample Recolha de amostra 19 Estado Collecting Colheita 20 Estado Mixing Lysate Misturar o lisado 21 Estado Checking Temperature Set: 56.0 [deg] Cur: [deg] Verificar a configuração da temperatura Set: 56,0 [deg] Cur: [deg] A tabela continua na página seguinte. 62 Manual do kit EZ1 DSP Virus 03/2015
63 Tabella 13. Continuação Número da Tipo de Texto da do EZ1 Advanced XL Tradução 22 Estado 15 min Incubation Incubação de 15 minutos 23 Estado Kick Kick 24 Estado Collecting Binding Buffer 25 Estado Collecting Lysis Buffer Colheita de tampão de ligação Colheita de tampão de lise 26 Estado Collecting Beads Colheita de esferas 27 Estado Resuspension of Beads in Binding Buffer Resuspensão das esferas em tampão de ligação 28 Estado Transferring Lysate Transferência de lisado 29 Estado Binding Magnetic Separation 30 Estado Wash 1 Magnetic Separation 31 Estado Wash 2 Magnetic Separation 32 Estado Wash 3 Magnetic Separation Ligação da separação magnética Lavagem 1 Separação magnética Lavagem 2 Separação magnética Lavagem 3 Separação magnética 33 Estado Dry Beads Secar as esferas 34 Estado Kick Kick 35 Estado Dry Beads Secar as esferas 36 Estado Kick Kick A tabela continua na página seguinte. Manual do kit EZ1 DSP Virus 03/
64 Tabella 13. Continuação Número da Tipo de Texto da do EZ1 Advanced XL Tradução 37 Estado Rinse Enxaguamento 38 Estado Checking Temperature Set: 65.0 [deg] Cur: [deg] Verificar a configuração da temperatura Set: 65,0 [deg] Cur: [deg] 39 Estado Elution Eluição 40 Orientação Check transfer of crna (CARRIER) + IC (tube [ET], row 3) Next=Any 41 Orientação Check transfer of sample (tube [ST], row 4) Next=Any 42 Orientação Protocol finished! Press ESC to return to Menu Verificar a transferência de crna (CARRIER) + CI) (Tubo [ET] linha 3) Seguinte=Qualquer Verificar a transferência da amostra)(tubo [ST], linha 4 Seguinte=Qualquer Protocolo concluído! Prima ESC para regressar ao menu 64 Manual do kit EZ1 DSP Virus 03/2015
65 Apêndice B: Calcular a quantidade de controlo interno (CI) Para monitorizar a eficiência da preparação da amostra e do teste a jusante, poderá ser necessário adicionar um controlo interno (CI)ao processo de preparação da amostra. Para calcular a quantidade de controlo interno (CI) necessário para o protocolo EZ1 DSP Vir us, o volume do tampão que contém CI adicionado por amostra e o volume de eluição para um determinado ensaio necessita de ser tido em consideração. Determinar a quantidade de controlo interno (CI) que estará em reacções a jusante Para determinar o volume de controlo interno (CI) que estará presente num determinado teste a jusante, utilize a fórmula: IC RXN = IC LB x LB SAM x EL RXN (LB TOT + IC LB ) x EL SAM Onde: IC RXN = Volume de controlo interno (CI) por reacção a jusante IC LB = Volume de controlo interno (CI) adicionado ao tampão de lise (LB) LB SAM = Volume de tampão de lise (LB) por amostra EL RXN = Volume de eluato por reacção a jusante LB TOT = Volume total de tampão de lise (LB) mais portador de RNA (CARRIER) utilizado no protocolo EL SAM = Volume de eluato por amostra Como exemplo, utilizando um sistema de teste previamente estabelecido, o Utilizador adiciona 39 µl de solução de controlo interno (ICLB) a 8,4 ml de tampão de lise (LB) e 140 µl de portador de RNA (CARRIER). Utilizando o procedimento manual de referência para o sistema de teste, são adicionados 625 µl do tampão de lise (LB) por amostra (LB SAM ), e é utilizado um volume de eluição de 75 µl (EL SAM ). O utilizador 1 utiliza 50 µl de eluato por reacção a jusante (EL RXN ). O volume de solução de controlo interno por reacção a jusante (IC RXN ) é: IC RXN = 39 µl x 625 µl x 50 µl = 1,89 µl Manual do kit EZ1 DSP Virus 03/
66 (8540 µl + 39 µl) x 75 µl As reacções a jusante finais para o sistema de teste em questão contêm 1,89 µl de solução de controlo interno por reacção. Determinar a quantidade de solução de controlo interno a adicionar antes de iniciar o procedimento Se souber a quantidade de controlo interno (CI) que pretende ter presente no teste a jusante (IC RXN ), então necessita de determinar a quantidade de controlo interno (CI) a diluir com o tampão de eluição (AVE) e portador de RNA (CARRIER) (IC AVE ) antes de iniciar a purificação. Para calcular este valor, utilize a fórmula: IC AVE = IC RXN x IC TOT x EL SAM IC SAM x EL RXN Onde: IC AVE IC RXN IC TOT IC SAM EL SAM EL RXN = Volume de controlo interno (CI) diluído em tampão de eluição portador de RNA (AVE CARRIER) = Volume de controlo interno (CI) por reacção a jusante = Volume total de controlo interno (CI) diluído em tampão de eluição portador de RNA (AVE CARRIER) por execução = Volume de controlo interno (CI) diluído adicionado por amostra (50 µl) = Volume de eluato por amostra = Volume de eluato por reacção a jusante Como exemplo, o Utilizador 2 está a trabalhar com um teste optimizado para ser utilizado com 1,0 µl de solução de controlo interno por reacção (IC RXN ) e 20 µl de eluato por reacção (EL RXN ). O Utilizador 2 segue o protocolo EZ1 DSP Virus, e foi seleccionado um volume de eluição de 60 µl (EL SAM ). Para cada amostra processada, tem que ser pipetado manualmente um volume de 60 µl de controlo interno (CI) diluído para o tubo de 1,5 ml (ET) na posição 3 da mesa de trabalho do EZ1, mas durante o processo de preparação da amostra do protocolo EZ1 DSP Virus o instrumento EZ1 irá transferir apenas 50 µl de controlo interno diluído (IC SAM ) do poço 3 para a reacção de ligação. Para 6 amostras a ser processadas numa execução, o volume total de controlo interno diluído (IC TOT ) a ser preparado é: 66 Manual do kit EZ1 DSP Virus 03/2015
67 IC TOT = Número de amostras por execução x 60 µl = 6 x 60 µl = 360 µl O volume de solução de controlo interno (IC AVE ) que o Utilizador 2 necessita para 6 amostras é: IC AVE = 1 µl x 360 µl x 60 µl (50 µl x 20 µl) = 21,6 µl Para cada amostra, tem de ser adicionado 3,6 µl de solução-mãe de portador de RNA (CARRIER) com 1 µg/µl à diluição de CI. Para 6 amostras o volume total tem de ser calculado: O volume total de stock de portador de RNA = 6 x 3,6 µl de stock de portador de RNA = 21,6 µl Para um volume total final de 360 µl de controlo interno diluído (CI), o utilizador tem de adicionar tampão de eluição (AVE): Volume do tampão de eluição (AVE) = IC TOT IC AVE Volume de portador de RNA (CARRIER) = 360 µl 21,6 µl 21,6 µl = 316,8 µl O utilizador 2 necessita de adicionar 21,6 µl de solução de controlo interno a 316,8 µl de tampão de eluição (AVE) e 21,6 µl de stock de portador de RNA (CARRIER) de modo a obter 360 µl de controlo interno diluído (CI). A partir deste controlo interno diluído (CI),têm que ser transferidos manualmente 60 µl para tubos de 1,5 ml (ET) na posição 3 mesa de trabalho dos instrumentos EZ1 antes de iniciar o protocolo EZ1 DSP Virus. Manual do kit EZ1 DSP Virus 03/
68 Apêndice C: Folha de amostra para utilizar com o sistema EZ1 DSP Virus Este modelo de folha de amostra pode ser útil para guardar os registos quando utilizar o procedimento do EZ1 DSP. Esta folha pode ser fotocopiada e identificada com descrições das amostras e detalhes da execução. EZ1 DSP Virus system Data/hora: Operador: Número de série do instrumento: Número do lote do kit: ID da execução: Posição na mesa de trabalho ID da amostra: Material da amostra RCV disponível? ST disponível? RT disponível? DTH com DFT disponível? ET com CARRIER e CI disponível? 1(esquerda) (direita) 68 Manual do kit EZ1 DSP Virus 03/2015
69 Apêndice D: Exemplo de um ficheiro de relatório do EZ1 Advanced Neste apêndice é apresentado um ficheiro de relatório normal gerado no EZ1 Advanced. Os valores para cada parâmetro irão diferir dos do ficheiro de relatório gerado no seu EZ1 Advanced. Tenha em atenção que User ID (ID do utilizador) pode ter um um máximo de 9 caractéres e que Assay kit ID (ID do kit de teste) e Note (Nota) pode ter um um máximo de 14 caractéres. O EZ1 Advanced XL gera um ficheiro de relatório semelhante contendo informações relevantes do instrumento e do protocolo para o EZ1 Advanced XL e informações para os canais Report File EZ1 Advanced: Serial No. EZ1 Advanced:... " " User ID:... "964" Firmware version:... "V 1.0.0" Installation date of instrument:... ", " Weekly maintenance done on:... "Feb 26, 2008" Yearly maintenance done on:... "Nov 06, 2007" Date of last UV-run:... "Mar 03, 2008" Start of last UV-run:... "14:48" End of last UV-run:... "14:52" Status of last UV-run:... "UV run aborted" Protocol name:... "Virus DSP"... "Version 1.0" Date of run:... "Mar 03, 2008" Start of run:... "14:54" End of run:... "15:40" Status run:... "o.k" Error Code:... "---" Sample input Volume [ul]:... " 400" Elution volume [ul]:... " 60" Channel A: Sample ID:... "717" Reagent Kit number:... " " Reagent Lot number:... " " Reagent Expiry date:... "1210" Assay Kit ID:... "717" Note:... "717" Channel B: Sample ID:... "393" Reagent Kit number:... " " Reagent Lot number:... " " Reagent Expiry date:... "1210" Assay Kit ID:... "393" Note:... "393" Manual do kit EZ1 DSP Virus 03/
70 Channel C: Sample ID:... "163" Reagent Kit number:... " " Reagent Lot number:... " " Reagent Expiry date:... "1210" Assay Kit ID:... "163" Note:... "163" Channel D: Sample ID:... "149" Reagent Kit number:... " " Reagent Lot number:... " " Reagent Expiry date:... "1210" Assay Kit ID:... "149" Note:... "149" Channel E: Sample ID:... "719" Reagent Kit number:... " " Reagent Lot number:... " " Reagent Expiry date:... "1210" Assay Kit ID:... "719" Note:... "719" Channel F: Sample ID:... "407" Reagent Kit number:... " " Reagent Lot number:... " " Reagent Expiry date:... "1210" Assay Kit ID:... "407" Note:... "407" [Checksum E95974AC] 70 Manual do kit EZ1 DSP Virus 03/2015
71 Informações para encomenda Produto Índice N.º cat. EZ1 DSP Virus Kit (48) EZ1 Advanced DSP Virus Card EZ1 Advanced XL DSP Virus Card EZ1 DSP Virus Card* EZ1 Advanced XL EZ1 Advanced Para 48 preparações de ácidos nucleicos virais: Cartuchos de reagentes enchidos previamente, porta-pontas descartáveis, pontas com filtros descartáveis, tubos de amostra, tubos de eluição, tampões, portador de RNA Cartão pré-programado para o protocolo EZ1 DSP Virus; para utilizar com o instrumento EZ1 Advanced Cartão pré-programado para o protocolo EZ1 DSP Virus; para utilizar com o instrumento EZ1 Advanced XL Cartão pré-programado para o protocolo EZ1 DSP Virus; para utilizar com o instrumento BioRobot EZ1 DSP* Instrumento robótico para a purificação automatizada de ácidos nucleicos de até 14 amostras utilizando os kits EZ1, garantia de 1 ano em peças e mão-deobra* Instrumento robótico para a purificação automatizada de ácidos nucleicos utilizando os kits EZ1, garantia de 1 ano em peças e mão-de-obra ATL (4x 50 ml) ATL (4x 50 ml) Buffer ASL (4x 140 ml) Tampão ASL (4x 140 ml) * Indisponível nos EUA ou no Canadá. Warranty PLUS 2 (n.º cat ) recomendada: Garantia de 3 anos, 1 visita de assistência preventiva por ano, resposta prioritária em 48 horas (2 dias úteis), toda a mão de obra, deslocamento e peças de reparação. Manual do kit EZ1 DSP Virus 03/
72 Visite para obter mais informações sobre as tecnologias de ensaio da QIAGEN! Para informações de licenciamento actualizadas e declarações específicas de produtos consulte o manual do kit QIAGEN respective ou o manual do utilizador Os manuais dos kits e os manuais do utilizador da QIAGEN estão disponíveis em ou podem ser pedidos aos serviços de Assistência Técnica ou ao distribuidor local da QIAGEN. 72 Manual do kit EZ1 DSP Virus 03/2015
73 Esta página foi intencionalmente deixada em branco Manual do kit EZ1 DSP Virus 03/
74 Esta página foi intencionalmente deixada em branco 74 Manual do kit EZ1 DSP Virus 03/2015
75 Marcas registadas: QIAGEN, EZ1 (QIAGEN Group). Acordo de Licença Limitada A utilização deste produto significa o acordo de qualquer comprador ou utilizador do EZ1 DSP Virus Kit para os seguintes termos: 1. O kit EZ1 DSP Virus pode ser usado somente de acordo com o Manual do kit EZ1 DSP Virus e apenas para utilização com os componentes contidos no kit. A QIAGEN não concede nenhuma licença ao abrigo de qualquer da sua propriedade intelectual para usar ou incorporar os componentes englobados neste Kit com qualquer componente não incluído neste Kit, excepto conforme descrito no Manual do kit EZ1 DSP Virus e quaisquer protocolos adicionais disponíveis em 2. À excepção de licenças expressamente declaradas, a QIAGEN não emite qualquer garantia de que este Kit e/ou a sua utilização ou utilizações não infrinjam os direitos de terceiros. 3. Este Kit e os seus componentes estão licenciados para uma única utilização e não podem ser reutilizados, renovados ou objecto de revenda. 4. A QIAGEN recusa especificamente qualquer outra licença, expressa ou implícita, à excepção das expressamente declaradas. 5. O comprador e utilizador do Kit concorda em não tomar nem permitir que qualquer outro tome medidas que possam conduzir ou facilitar qualquer dos actos acima proibidos. A QIAGEN pode fazer cumprir as proibições deste Acordo de Licença Limitada em qualquer Tribunal e irá recuperar todos os seus custos legais e de investigação, incluindo honorários de advogados, em qualquer processo destinado a fazer cumprir este Acordo de Licença Limitada ou qualquer dos seus direitos de propriedade intelectual relativos ao Kit e/ou seus componentes. Para obter os termos de licença actualizados, consulte QIAGEN, todos os direitos reservados.
76 Australia Orders Fax Technical Austria Orders 0800/ Fax 0800/ Technical 0800/ Belgium Orders Fax Technical Brazil Orders Fax Technical Canada Orders Fax Technical 800-DNA-PREP ( ) China Orders Fax Technical Denmark Orders Fax Technical Finland Orders Fax Technical France Orders Fax Technical Offers Germany Orders Fax Technical Hong Kong Orders Fax Technical Ireland Orders Fax Technical Italy Orders Fax Technical Japan Telephone Fax Technical Korea (South) Orders Fax Technical Luxembourg Orders Fax Technical Mexico Orders Fax Technical The Netherlands Orders Fax Technical Norway Orders Fax Technical Singapore Orders Fax Technical Spain Orders Fax Technical Sweden Orders Fax Technical Switzerland Orders Fax Technical UK Orders Fax Technical USA Orders Fax Technical 800-DNA-PREP ( ) PT /2015 Sample & Assay Technologies
Instruções de uso IVD Matrix HCCA-portioned
 Instruções de uso IVD Matrix HCCA-portioned Substância matriz purificada para espectrometria de massa por tempo de vôo e de ionização e dessorção a laser assistida por matriz (MALDI-TOF-MS). Os produtos
Instruções de uso IVD Matrix HCCA-portioned Substância matriz purificada para espectrometria de massa por tempo de vôo e de ionização e dessorção a laser assistida por matriz (MALDI-TOF-MS). Os produtos
INSTRUÇÕES DE UTILIZAÇÃO
 INSTRUÇÕES DE UTILIZAÇÃO ANTES DE UTILIZAR A PLACA DE FOGÃO SUGESTÕES PARA A PROTECÇÃO DO AMBIENTE PRECAUÇÕES E RECOMENDAÇÕES GERAIS SUGESTÕES PARA POUPANÇA DE ENERGIA CUIDADOS E MANUTENÇÃO GUIA PARA RESOLUÇÃO
INSTRUÇÕES DE UTILIZAÇÃO ANTES DE UTILIZAR A PLACA DE FOGÃO SUGESTÕES PARA A PROTECÇÃO DO AMBIENTE PRECAUÇÕES E RECOMENDAÇÕES GERAIS SUGESTÕES PARA POUPANÇA DE ENERGIA CUIDADOS E MANUTENÇÃO GUIA PARA RESOLUÇÃO
* Verificar item 9 Preparo dos Reagentes e item 8 - Reagentes e Equipamentos necessários, mas não fornecidos.
 KIT DE EXTRAÇÃO MINI VAC AUTOMAÇÃO DE 96 AMOSTRAS Instruções de Uso 1. USO PRETENDIDO O BIOPUR Kit de Extração Mini VAC Automação 96 Amostras é a ferramenta ideal para extração automática rápida e confiável
KIT DE EXTRAÇÃO MINI VAC AUTOMAÇÃO DE 96 AMOSTRAS Instruções de Uso 1. USO PRETENDIDO O BIOPUR Kit de Extração Mini VAC Automação 96 Amostras é a ferramenta ideal para extração automática rápida e confiável
Manual de inserção do acessório de rotação de endoscópio Arthrex Starfish
 950-0036-00, Rev. D Português Manual de inserção do acessório de rotação de endoscópio Arthrex Starfish Acessórios para endoscópio Arthrex, Inc. 1370 Creekside Blvd. Naples, FL 34108, EUA (800)-934-4404
950-0036-00, Rev. D Português Manual de inserção do acessório de rotação de endoscópio Arthrex Starfish Acessórios para endoscópio Arthrex, Inc. 1370 Creekside Blvd. Naples, FL 34108, EUA (800)-934-4404
Código: CHCB.PI..EST.01 Edição: 1 Revisão: 0 Páginas:1 de 12. 1. Objectivo. 2. Aplicação
 Código: CHCB.PI..EST.01 Edição: 1 Revisão: 0 Páginas:1 de 12 1. Objectivo o Estabelecer normas para o processamento dos dispositivos médicos, baseadas em padrões de qualidade. o Estabelecer condições de
Código: CHCB.PI..EST.01 Edição: 1 Revisão: 0 Páginas:1 de 12 1. Objectivo o Estabelecer normas para o processamento dos dispositivos médicos, baseadas em padrões de qualidade. o Estabelecer condições de
INSTRUÇÕES DE REFERÊNCIA RÁPIDA Para utilização apenas com o analisador Sofia.
 Analisador e imunoensaio de fluorescência para VSR INSTRUÇÕES DE REFERÊNCIA RÁPIDA Para utilização apenas com o analisador Sofia. Procedimento de teste Estude atentamente o Folheto informativo e o Manual
Analisador e imunoensaio de fluorescência para VSR INSTRUÇÕES DE REFERÊNCIA RÁPIDA Para utilização apenas com o analisador Sofia. Procedimento de teste Estude atentamente o Folheto informativo e o Manual
rainbowsystem.com Rexair LLC Troy, Michigan 2011 Rexair LLC R14388u-1 Printed in U.S.A.
 rainbowsystem.com Rexair LLC Troy, Michigan 2011 Rexair LLC R14388u-1 Printed in U.S.A. Número de série Como parte do programa de assistência ao Cliente Rexair, é dado a cada Rainbow e a cada Aquamate
rainbowsystem.com Rexair LLC Troy, Michigan 2011 Rexair LLC R14388u-1 Printed in U.S.A. Número de série Como parte do programa de assistência ao Cliente Rexair, é dado a cada Rainbow e a cada Aquamate
Série 1000 Manual de Instruções da Unidade de Sucção. pulmocare DISPOSITIVO DE SUCÇÃO MÉDICA. Modelos No. SU-DC02
 medcare a saúde em 1º lugar Série 1000 Manual de Instruções da Unidade de Sucção pulmocare DISPOSITIVO DE SUCÇÃO MÉDICA Modelos No. SU-02 Modelos No. SU-DC02 Esta unidade é compatível com a EU EMC norma
medcare a saúde em 1º lugar Série 1000 Manual de Instruções da Unidade de Sucção pulmocare DISPOSITIVO DE SUCÇÃO MÉDICA Modelos No. SU-02 Modelos No. SU-DC02 Esta unidade é compatível com a EU EMC norma
Manual de Instruções
 EL-USB-2-LCD Registador de Humidade, Temperatura e Ponto de Condensação com visor LCD Manual de Instruções Este registador mede e armazena até 16,379 leituras relativas a humidade e 16,379 leituras relativas
EL-USB-2-LCD Registador de Humidade, Temperatura e Ponto de Condensação com visor LCD Manual de Instruções Este registador mede e armazena até 16,379 leituras relativas a humidade e 16,379 leituras relativas
MaxHome. Mini Ferro de Viagem. MaxHome. Sm-110 Bivolt
 Mini Ferro de Viagem Sm-110 Bivolt ÍNDICE NOTAS: Parabéns por ter adquirido o seu Mini Ferro de Viagem. Características do produto Dicas de Segurança Informações do aparelho Usando o aparelho Cuidados
Mini Ferro de Viagem Sm-110 Bivolt ÍNDICE NOTAS: Parabéns por ter adquirido o seu Mini Ferro de Viagem. Características do produto Dicas de Segurança Informações do aparelho Usando o aparelho Cuidados
Procedimentos de montagem e instalação
 Procedimentos de montagem e instalação de elementos filtrantes Pall grau P (farmacêutico) 1. Introdução Os procedimentos abaixo devem ser seguidos para a instalação dos elementos filtrantes Pall grau P
Procedimentos de montagem e instalação de elementos filtrantes Pall grau P (farmacêutico) 1. Introdução Os procedimentos abaixo devem ser seguidos para a instalação dos elementos filtrantes Pall grau P
1 Designação comercial da substância e identificação da empresa
 1 Designação comercial da substância e identificação da empresa Identificação do nome do rótulo/designação comercial Utilização da substância/preparação Cosméticos/Cuidado pessoal Para emergência química
1 Designação comercial da substância e identificação da empresa Identificação do nome do rótulo/designação comercial Utilização da substância/preparação Cosméticos/Cuidado pessoal Para emergência química
 NOTA IMPORTANTE Claro cliente, muito obrigado por ter escolhido a balança eletrônica UMA, da Casa Bugatti. Como a maioria dos eletrodomésticos, esta balança deve ser usada com cuidado e atenção para prevenir
NOTA IMPORTANTE Claro cliente, muito obrigado por ter escolhido a balança eletrônica UMA, da Casa Bugatti. Como a maioria dos eletrodomésticos, esta balança deve ser usada com cuidado e atenção para prevenir
NEBULIZADOR COMPRESSOR
 MANUAL DE INSTRUÇÕES medcarer NEBULIZADOR COMPRESSOR Modelo: NEB-C130 CNP 6146514 0434! ANTES DE USAR, LER COM ATENÇÃO O MANUAL DE INSTRUÇÕES medcare NEBULIZADOR COMPRESSOR MODELO: NEB-C130 I N S T R U
MANUAL DE INSTRUÇÕES medcarer NEBULIZADOR COMPRESSOR Modelo: NEB-C130 CNP 6146514 0434! ANTES DE USAR, LER COM ATENÇÃO O MANUAL DE INSTRUÇÕES medcare NEBULIZADOR COMPRESSOR MODELO: NEB-C130 I N S T R U
Espresso 3000 - Cod. M0S04159 - Edizione 1H10
 10 2 3 6 4 5 15 8 7 9 14 16 11 12 1 13 18 17 19 20 Espresso 3000 - Cod. M0S04159 - Edizione 1H10 PORTOGUÊS Espresso 3000 1) Interruptor geral 2) Luz de aviso de funcionamento ON: máquina ligada 3) Luz
10 2 3 6 4 5 15 8 7 9 14 16 11 12 1 13 18 17 19 20 Espresso 3000 - Cod. M0S04159 - Edizione 1H10 PORTOGUÊS Espresso 3000 1) Interruptor geral 2) Luz de aviso de funcionamento ON: máquina ligada 3) Luz
Manual do Utilizador Rocker! O seu parceiro para uma vida elegante
 Manual do Utilizador Rocker! O seu parceiro para uma vida elegante Conteúdo Prefácio Características Preparação Funcionamento LIGAR e DESLIGAR Como utilizar o seu aparelho auditivo Controlo de volume
Manual do Utilizador Rocker! O seu parceiro para uma vida elegante Conteúdo Prefácio Características Preparação Funcionamento LIGAR e DESLIGAR Como utilizar o seu aparelho auditivo Controlo de volume
HD 100. P Cobertor elétrico Instruções de utilização. BEURER GmbH Söflinger Str. 218 89077 Ulm (Germany) www.beurer.com. 06.0.
 HD 100 P 06.0.43510 Hohenstein P Cobertor elétrico Instruções de utilização BEURER GmbH Söflinger Str. 218 89077 Ulm (Germany) www.beurer.com Conteúdo 1. Volume de fornecimento... 3 1.1 Descrição do aparelho...
HD 100 P 06.0.43510 Hohenstein P Cobertor elétrico Instruções de utilização BEURER GmbH Söflinger Str. 218 89077 Ulm (Germany) www.beurer.com Conteúdo 1. Volume de fornecimento... 3 1.1 Descrição do aparelho...
PRIMEIRO A SEGURANÇA. Armazenamento e Manuseamento Seguro de Produtos de Limpeza e de Desinfecção. Seguir as Regras de Segurança:
 Seguir as Regras de Segurança: 1. Seguir sempre as recomendações e instruções de aplicação dos produtos de limpeza e de desinfecção. 2. Observar os pictogramas de perigo, as advertências de perigo e as
Seguir as Regras de Segurança: 1. Seguir sempre as recomendações e instruções de aplicação dos produtos de limpeza e de desinfecção. 2. Observar os pictogramas de perigo, as advertências de perigo e as
Resolução de avarias de MPEG
 Resolução de avarias de MPEG Esta secção é para utilizadores de cardiologia que visualizam MPEGs. Consulte os seguintes tópicos para o ajudarem a resolver problemas detectados ao visualizar MPEGs. Componentes
Resolução de avarias de MPEG Esta secção é para utilizadores de cardiologia que visualizam MPEGs. Consulte os seguintes tópicos para o ajudarem a resolver problemas detectados ao visualizar MPEGs. Componentes
DIGISKY. Preparação. Revisão: 01.08.2011
 DIGISKY Guia Rápido 15448 V1.01 Preparação Por favor leia antes as instruções para utilização (no CD). Nestas instruções são descritos os preparativos necessários para o uso do medidor de exposição e suas
DIGISKY Guia Rápido 15448 V1.01 Preparação Por favor leia antes as instruções para utilização (no CD). Nestas instruções são descritos os preparativos necessários para o uso do medidor de exposição e suas
SOLID CERAMIC HAIR STYLER
 SOLID CERAMIC HAIR STYLER Straigth & Curls HS 3830 PORTUGUÊS A C E A B D F 2 SEGURANÇA Durante a colocação em funcionamento do aparelho, por favor, respeite as seguintes indicações: 7 Este aparelho destina-se
SOLID CERAMIC HAIR STYLER Straigth & Curls HS 3830 PORTUGUÊS A C E A B D F 2 SEGURANÇA Durante a colocação em funcionamento do aparelho, por favor, respeite as seguintes indicações: 7 Este aparelho destina-se
Cópia de Segurança e Recuperação Manual do utilizador
 Cópia de Segurança e Recuperação Manual do utilizador Copyright 2009 Hewlett-Packard Development Company, L.P. Windows é uma marca comercial registada nos EUA da Microsoft Corporation. As informações aqui
Cópia de Segurança e Recuperação Manual do utilizador Copyright 2009 Hewlett-Packard Development Company, L.P. Windows é uma marca comercial registada nos EUA da Microsoft Corporation. As informações aqui
Z6 Resumo das informações mais importantes
 Z6 Resumo das informações mais importantes Z6 Resumo das informações mais importantes J Este manual breve não substitui o Manual de instruções Z6. Primeiro, leia e respeite as instruções de segurança e
Z6 Resumo das informações mais importantes Z6 Resumo das informações mais importantes J Este manual breve não substitui o Manual de instruções Z6. Primeiro, leia e respeite as instruções de segurança e
KF2.4 MANUAL DE UTILIZADOR
 MANUAL DE UTILIZADOR Conteúdo Marcas comerciais IKIMOBILE é uma marca registada da Univercosmos, Lda., uma empresa do Grupo FF, com uma participação na Technology Solutions IT INT. Android e Google Search
MANUAL DE UTILIZADOR Conteúdo Marcas comerciais IKIMOBILE é uma marca registada da Univercosmos, Lda., uma empresa do Grupo FF, com uma participação na Technology Solutions IT INT. Android e Google Search
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Instruções para o médico Para uso em diagnóstico in vitro. Exclusivamente para exportação dos EUA. Instruções 1. Pode ser útil pedir ao paciente que beba uma
PROGENSA PCA3 Urine Specimen Transport Kit Instruções para o médico Para uso em diagnóstico in vitro. Exclusivamente para exportação dos EUA. Instruções 1. Pode ser útil pedir ao paciente que beba uma
BOMBA-FILTRO MANUAL DO UTILIZADOR
 ESPECIALISTA EM INSUFLÁVEIS BOMBA-FILTRO MANUAL DO UTILIZADOR Para os modelos: 110 220v Leia atentamente e guarde para referência futura! 1 INSTRUÇÕES Agradecemos-lhe a compra da nossa bomba-filtro. Pensamos
ESPECIALISTA EM INSUFLÁVEIS BOMBA-FILTRO MANUAL DO UTILIZADOR Para os modelos: 110 220v Leia atentamente e guarde para referência futura! 1 INSTRUÇÕES Agradecemos-lhe a compra da nossa bomba-filtro. Pensamos
Boot Camp Manual de Instalação e Configuração
 Boot Camp Manual de Instalação e Configuração Índice 3 Introdução 4 Descrição geral da instalação 4 Passo 1: Verificar se existem actualizações 4 Passo 2: Preparar o computador Mac para o Windows 4 Passo
Boot Camp Manual de Instalação e Configuração Índice 3 Introdução 4 Descrição geral da instalação 4 Passo 1: Verificar se existem actualizações 4 Passo 2: Preparar o computador Mac para o Windows 4 Passo
Cópia de Segurança e Recuperação Manual do utilizador
 Cópia de Segurança e Recuperação Manual do utilizador Copyright 2008 Hewlett-Packard Development Company, L.P. O Windows e o Windows Vista são marcas comerciais ou marcas registadas da Microsoft Corporation,
Cópia de Segurança e Recuperação Manual do utilizador Copyright 2008 Hewlett-Packard Development Company, L.P. O Windows e o Windows Vista são marcas comerciais ou marcas registadas da Microsoft Corporation,
SECÇÂO 1. Identificação da substancia/preparação e da sociedade
 Pagina: 1 de 7 SECÇÂO 1. Identificação da substancia/preparação e da sociedade 1.1 Identificação da substância/mistura e da sociedade/empresa Tipo de produto quimico Nome Comercial Mistura 1.2 Utilizações
Pagina: 1 de 7 SECÇÂO 1. Identificação da substancia/preparação e da sociedade 1.1 Identificação da substância/mistura e da sociedade/empresa Tipo de produto quimico Nome Comercial Mistura 1.2 Utilizações
Laboratório de Química Orgânica. Orgânica e Farmacêutica. Com colaboração da Dr.ª Sara Cravo QOI - 02/03 1
 Laboratório de Química Orgânica e Farmacêutica NORMAS GERAIS E PROCEDIMENTOS DE SEGURANÇA Com colaboração da Dr.ª Sara Cravo 1 Laboratório de Química Orgânica 2 QOI - 02/03 1 1) Não entre no laboratório
Laboratório de Química Orgânica e Farmacêutica NORMAS GERAIS E PROCEDIMENTOS DE SEGURANÇA Com colaboração da Dr.ª Sara Cravo 1 Laboratório de Química Orgânica 2 QOI - 02/03 1 1) Não entre no laboratório
QL-500 QL-560 QL-570 QL-650TD QL-1050
 QL-500 QL-560 QL-570 QL-650TD QL-1050 Manual de instalação do software Português LB9155001 Funcionalidades P-touch Editor Controlador da impressora P-touch Address Book (apenas Windows ) Introdução Torna
QL-500 QL-560 QL-570 QL-650TD QL-1050 Manual de instalação do software Português LB9155001 Funcionalidades P-touch Editor Controlador da impressora P-touch Address Book (apenas Windows ) Introdução Torna
Boot Camp Manual de Instalação e Configuração
 Boot Camp Manual de Instalação e Configuração Conteúdo 3 Introdução 3 Do que necessita 4 Descrição geral da instalação 4 Passo 1: Procurar actualizações 4 Passo 2: Preparar o computador Mac para o Windows
Boot Camp Manual de Instalação e Configuração Conteúdo 3 Introdução 3 Do que necessita 4 Descrição geral da instalação 4 Passo 1: Procurar actualizações 4 Passo 2: Preparar o computador Mac para o Windows
Manual de Configuração do Hardware
 Desembalar Remova todos os materiais de protecção. As ilustrações neste manual são de um modelo semelhante. Apesar de poderem ser diferentes do seu modelo, o método de funcionamento é igual. Ligar o produto
Desembalar Remova todos os materiais de protecção. As ilustrações neste manual são de um modelo semelhante. Apesar de poderem ser diferentes do seu modelo, o método de funcionamento é igual. Ligar o produto
MANUAL DE INSTRUÇÕES. Obrigado por adquirir a escova elétrica corporal e facial D-Clean Plus. Este manual deve ser guardado para consultas futuras.
 MANUAL DE INSTRUÇÕES Obrigado por adquirir a escova elétrica corporal e facial D-Clean Plus. Este manual deve ser guardado para consultas futuras. 2 Esse produto contém: Aparelho 3 escovas (facial normal,
MANUAL DE INSTRUÇÕES Obrigado por adquirir a escova elétrica corporal e facial D-Clean Plus. Este manual deve ser guardado para consultas futuras. 2 Esse produto contém: Aparelho 3 escovas (facial normal,
Instalar o computador
 ThinkPad R40 Series Lista de verificação de componentes Part Number: 9P54 Manual de Instalação A IBM agradece a sua preferência por um computador IBM ThinkPad R Series. Confronte os itens indicados nesta
ThinkPad R40 Series Lista de verificação de componentes Part Number: 9P54 Manual de Instalação A IBM agradece a sua preferência por um computador IBM ThinkPad R Series. Confronte os itens indicados nesta
IRISPen Air 7. Guia rápido. (Windows & Mac OS X)
 IRISPen Air 7 Guia rápido (Windows & Mac OS X) Este Guia rápido do utilizador ajuda-o a dar os primeiros passos com o IRISPen Air TM 7. Leia este guia antes de utilizar o scanner e o respetivo software.
IRISPen Air 7 Guia rápido (Windows & Mac OS X) Este Guia rápido do utilizador ajuda-o a dar os primeiros passos com o IRISPen Air TM 7. Leia este guia antes de utilizar o scanner e o respetivo software.
Gestor de Janelas Gnome
 6 3 5 Gestor de Janelas Gnome Nesta secção será explicado o funcionamento de um dos ambientes gráficos disponíveis no seu Linux Caixa Mágica, o Gnome. Na figura 5.1 apresentamos o GDM, o sistema gráfico
6 3 5 Gestor de Janelas Gnome Nesta secção será explicado o funcionamento de um dos ambientes gráficos disponíveis no seu Linux Caixa Mágica, o Gnome. Na figura 5.1 apresentamos o GDM, o sistema gráfico
Guia Passo a Passo de Actualização do Windows 8.1
 Guia Passo a Passo de Actualização do Windows 8.1 Instalação e Actualização do Windows 8.1 Actualizar o BIOS, aplicações, controladores e executar o Windows Update Seleccionar o tipo de instalação Instalar
Guia Passo a Passo de Actualização do Windows 8.1 Instalação e Actualização do Windows 8.1 Actualizar o BIOS, aplicações, controladores e executar o Windows Update Seleccionar o tipo de instalação Instalar
GUIA DO USUÁRIO. Teste de Cloro Total e Livre Pendência Patente. Modelo CL500
 GUIA DO USUÁRIO Teste de Cloro Total e Livre Pendência Patente Modelo CL500 Introdução Parabéns pela sua compra do teste de cloro CL500. O CL500 é um dos primeiros dispositivos revolucionários deste tipo
GUIA DO USUÁRIO Teste de Cloro Total e Livre Pendência Patente Modelo CL500 Introdução Parabéns pela sua compra do teste de cloro CL500. O CL500 é um dos primeiros dispositivos revolucionários deste tipo
GA-1 Dispositivo de Alarme de Separador de Massa Lubrificante Instruções de instalação e funcionamento
 Labkotec Oy Myllyhaantie 6 FI-33960 PIRKKALA FINLAND Tel: +358 29 006 260 Fax: +358 29 006 1260 19.1.2015 Internet: www.labkotec.com 1/11 GA-1 Dispositivo de Alarme de Separador de Massa Lubrificante Copyright
Labkotec Oy Myllyhaantie 6 FI-33960 PIRKKALA FINLAND Tel: +358 29 006 260 Fax: +358 29 006 1260 19.1.2015 Internet: www.labkotec.com 1/11 GA-1 Dispositivo de Alarme de Separador de Massa Lubrificante Copyright
Impressora HP DeskJet 720C Series. Sete passos simples para configurar a sua impressora
 Impressora HP DeskJet 720C Series Sete passos simples para configurar a sua impressora Parabéns pela aquisição de sua impressora HP DeskJet 720C Series! Aqui está uma lista dos componentes da caixa. Se
Impressora HP DeskJet 720C Series Sete passos simples para configurar a sua impressora Parabéns pela aquisição de sua impressora HP DeskJet 720C Series! Aqui está uma lista dos componentes da caixa. Se
MANUAL DE INSTRUÇÕES BANHO SECO DIGITAL MODELOS D1100 E D1200. Representante: Ciencor Scientific Ltda www.ciencor.com.br Fone: (11) 3673-7809
 MANUAL DE INSTRUÇÕES BANHO SECO DIGITAL MODELOS D1100 E D1200 Representante: Ciencor Scientific Ltda www.ciencor.com.br Fone: (11) 3673-7809 1 MANUAL DE INSTRUÇÕES 1 ESPECIFICAÇÕES GERAIS : Faixa de temperatura
MANUAL DE INSTRUÇÕES BANHO SECO DIGITAL MODELOS D1100 E D1200 Representante: Ciencor Scientific Ltda www.ciencor.com.br Fone: (11) 3673-7809 1 MANUAL DE INSTRUÇÕES 1 ESPECIFICAÇÕES GERAIS : Faixa de temperatura
FICHA DE SEGURANÇA Edição revista no : 1
 Página : 1 Etiqueta 2.2 : Gás não inflamável e não tóxico. 1 IDENTIFICAÇÃO DA SUBSTÂNCIA/PREPARAÇÃO E DA SOCIEDADE / EMPRESA Designação Comercial : N Ficha de Segurança : Uso : Gas Refrigerante. Identificação
Página : 1 Etiqueta 2.2 : Gás não inflamável e não tóxico. 1 IDENTIFICAÇÃO DA SUBSTÂNCIA/PREPARAÇÃO E DA SOCIEDADE / EMPRESA Designação Comercial : N Ficha de Segurança : Uso : Gas Refrigerante. Identificação
MANUAL DE INSTRUÇÕES DO TERMÔMETRO DIGITAL MODELO TD-870
 MANUAL DE INSTRUÇÕES DO TERMÔMETRO DIGITAL MODELO TD-870 Leia atentamente as instruções contidas neste manual antes de iniciar o uso do instrumento ÍNDICE 1. INTRODUÇÃO... - 1-2. REGRAS DE SEGURANÇA...
MANUAL DE INSTRUÇÕES DO TERMÔMETRO DIGITAL MODELO TD-870 Leia atentamente as instruções contidas neste manual antes de iniciar o uso do instrumento ÍNDICE 1. INTRODUÇÃO... - 1-2. REGRAS DE SEGURANÇA...
1 Alteração das imagens do aparelho Kaue 11-08-2011 2 Alteração na capacidade do reservat rio, de 1600ml para 1400ml Kaue 20-09-2011
 1 Alteração das imagens do aparelho Kaue 11-08-2011 2 Alteração na capacidade do reservat rio, de 1600ml para 1400ml Kaue 20-09-2011 07/11 719-09-05 775788 REV.2 Vapor Tapete Clean 719-09-05 2 Parabéns
1 Alteração das imagens do aparelho Kaue 11-08-2011 2 Alteração na capacidade do reservat rio, de 1600ml para 1400ml Kaue 20-09-2011 07/11 719-09-05 775788 REV.2 Vapor Tapete Clean 719-09-05 2 Parabéns
Climatizador de Ar Fresh Plus PCL703
 Climatizador de Ar Fresh Plus PCL703 Agradecemos sua preferencia por um produto da linha Lenoxx, um produto de alta tecnologia, seguro e eficiente. É muito importante ler atentamente este manual de instruções,
Climatizador de Ar Fresh Plus PCL703 Agradecemos sua preferencia por um produto da linha Lenoxx, um produto de alta tecnologia, seguro e eficiente. É muito importante ler atentamente este manual de instruções,
FICHA DE DADOS DE SEGURANÇA
 FICHA DE DADOS DE SEGURANÇA (REGULAMENTO (CE) n 1907/2006 - REACH) Versão 2.1 (30/01/2014) - Página 1/5 FICHA DE DADOS DE SEGURANÇA (Regulamento REACH (CE) nº 1907/2006 - nº 453/2010) SECÇÃO 1: IDENTIFICAÇÃO
FICHA DE DADOS DE SEGURANÇA (REGULAMENTO (CE) n 1907/2006 - REACH) Versão 2.1 (30/01/2014) - Página 1/5 FICHA DE DADOS DE SEGURANÇA (Regulamento REACH (CE) nº 1907/2006 - nº 453/2010) SECÇÃO 1: IDENTIFICAÇÃO
Virologia em Laboratório Fase Pré- Analítica
 Virologia em Laboratório Fase Pré- Analítica Leonor Rebelo Lab Virologia i do IPOFGL EPE Novembro 2012 1º Curso de Virologia Molecular em Oncologia 1 ,, TÑÜxÇwxÜ t ØÇ vt vé át wx Öâx t ÅxÇàx ÇâÇvt áx vtçát?
Virologia em Laboratório Fase Pré- Analítica Leonor Rebelo Lab Virologia i do IPOFGL EPE Novembro 2012 1º Curso de Virologia Molecular em Oncologia 1 ,, TÑÜxÇwxÜ t ØÇ vt vé át wx Öâx t ÅxÇàx ÇâÇvt áx vtçát?
Solius 61 Manual de Instruções
 Zona Industrial de Avintes, nº 103 4430 930 Avintes, V. N. de Gaia web: www.cirelius.pt e-mail: [email protected] tel: 227 843 817 fax: 227 843 819 Controlador Solar Solius 61 O controlador Solius 61 dispõe
Zona Industrial de Avintes, nº 103 4430 930 Avintes, V. N. de Gaia web: www.cirelius.pt e-mail: [email protected] tel: 227 843 817 fax: 227 843 819 Controlador Solar Solius 61 O controlador Solius 61 dispõe
Descrição do Serviço Diagnóstico no Local
 Apresentação do serviço A Dell tem o prazer de fornecer o Serviço de (o Serviço ) de acordo com este documento (a Descrição do Serviço ). Este fornece actividades opcionais de diagnóstico no local na empresa
Apresentação do serviço A Dell tem o prazer de fornecer o Serviço de (o Serviço ) de acordo com este documento (a Descrição do Serviço ). Este fornece actividades opcionais de diagnóstico no local na empresa
Nokia Bluetooth Headset BH-211 9204665/2
 Nokia Bluetooth Headset BH-211 1 2 5 4 7 8 3 6 11 9 10 9204665/2 DECLARAÇÃO DE CONFORMIDADE NOKIA CORPORATION declara que este produto HS-99W está conforme com os requisitos essenciais e outras disposições
Nokia Bluetooth Headset BH-211 1 2 5 4 7 8 3 6 11 9 10 9204665/2 DECLARAÇÃO DE CONFORMIDADE NOKIA CORPORATION declara que este produto HS-99W está conforme com os requisitos essenciais e outras disposições
Breve resumo Gigaset DA310
 1 Breve resumo Gigaset DA310 1 2 3 4 5 6 7 8 1 Teclas de marcação directa 2 Etiqueta para anotar a programação das teclas de marcação directa e marcação abreviada 3 Tecla de marcação abreviada 4 Tecla
1 Breve resumo Gigaset DA310 1 2 3 4 5 6 7 8 1 Teclas de marcação directa 2 Etiqueta para anotar a programação das teclas de marcação directa e marcação abreviada 3 Tecla de marcação abreviada 4 Tecla
Máquinas de Gelo em Escama QF800-QC700. Instalação. Sistema Elétrico. Localização da Máquina de Gelo
 Máquinas de Gelo em Escama QF800-QC700 Instalação Localização da Máquina de Gelo Sistema Elétrico O local selecionado para a máquina de gelo deve atender os critérios seguintes. Se algum desses critérios
Máquinas de Gelo em Escama QF800-QC700 Instalação Localização da Máquina de Gelo Sistema Elétrico O local selecionado para a máquina de gelo deve atender os critérios seguintes. Se algum desses critérios
ScanGel ABO Complete/RH/K Duo 86719 2 x 24 cards 86709 2 x 144 cards Cards ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo
 ScanGel ABO Complete/RH/K Duo 86719 2 x 24 cards 86709 2 x 144 cards Cards ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo GEL FORMULADO COM REAGENTES MONOCLONAIS DE ORIGEM MURINA
ScanGel ABO Complete/RH/K Duo 86719 2 x 24 cards 86709 2 x 144 cards Cards ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo GEL FORMULADO COM REAGENTES MONOCLONAIS DE ORIGEM MURINA
Gestor de ligações Manual do Utilizador
 Gestor de ligações Manual do Utilizador 1.0ª Edição PT 2010 Nokia. Todos os direitos reservados. Nokia, Nokia Connecting People e o logótipo Nokia Original Accessories são marcas comerciais ou marcas registadas
Gestor de ligações Manual do Utilizador 1.0ª Edição PT 2010 Nokia. Todos os direitos reservados. Nokia, Nokia Connecting People e o logótipo Nokia Original Accessories são marcas comerciais ou marcas registadas
NORMAS DE SEGURANÇA EM LABORATÓRIO
 NORMAS DE SEGURANÇA EM LABORATÓRIO 1. INTRODUÇÃO Toda e qualquer atividade prática a ser desenvolvida dentro de um laboratório apresentam riscos e estão propensas a acidentes. Devemos então utilizar normas
NORMAS DE SEGURANÇA EM LABORATÓRIO 1. INTRODUÇÃO Toda e qualquer atividade prática a ser desenvolvida dentro de um laboratório apresentam riscos e estão propensas a acidentes. Devemos então utilizar normas
A unidade Energise inclui a tecnologia sem fios SimplyWorks, permitindo a ativação de aparelhos até 10 metros de distância.
 Instruções Descrição do Produto Um regulador de funcionalidades de alimentação elétrica que permite que os utilizadores possam controlar até dois aparelhos elétricos com manípulos com ou sem fio. A unidade
Instruções Descrição do Produto Um regulador de funcionalidades de alimentação elétrica que permite que os utilizadores possam controlar até dois aparelhos elétricos com manípulos com ou sem fio. A unidade
Atualizações de Software Guia do Usuário
 Atualizações de Software Guia do Usuário Copyright 2009 Hewlett-Packard Development Company, L.P. Windows e Windows Vista são marcas registradas da Microsoft Corporation nos EUA. Aviso sobre o produto
Atualizações de Software Guia do Usuário Copyright 2009 Hewlett-Packard Development Company, L.P. Windows e Windows Vista são marcas registradas da Microsoft Corporation nos EUA. Aviso sobre o produto
Manual do usuário da impressora Xerox Phaser 6180MFP
 Manual do usuário da impressora Xerox Phaser 6180MFP IMPORTANTE - Evite abrir a impressora.. Há várias peças sensíveis neste equipamento e qualquer dano à integridade física do mesmo não será coberto pela
Manual do usuário da impressora Xerox Phaser 6180MFP IMPORTANTE - Evite abrir a impressora.. Há várias peças sensíveis neste equipamento e qualquer dano à integridade física do mesmo não será coberto pela
Etapa complementar para o diagnóstico da infecção pelo HIV princípios metodológicos
 Aula 11 Etapa complementar para o diagnóstico da infecção pelo HIV princípios metodológicos As amostras com resultados reagentes, na etapa de triagem, devem ser submetidas à etapa complementar. Nessa etapa,
Aula 11 Etapa complementar para o diagnóstico da infecção pelo HIV princípios metodológicos As amostras com resultados reagentes, na etapa de triagem, devem ser submetidas à etapa complementar. Nessa etapa,
Ficha de Dados de Segurança. Cloreto de Sódio
 Ficha de Dados de Segurança Cloreto de Sódio 1. Identificação da substância e da empresa 1.1 Identificação da substância ou do preparado Denominação: Sódio Cloreto Segundo Regulamento (CE) 1907/2006 1.2
Ficha de Dados de Segurança Cloreto de Sódio 1. Identificação da substância e da empresa 1.1 Identificação da substância ou do preparado Denominação: Sódio Cloreto Segundo Regulamento (CE) 1907/2006 1.2
ANTES DE UTILIZAR A PLACA EM VIDRO CERÂMICO
 MANUAL DE UTILIZAÇÃO ANTES DE UTILIZAR A PLACA EM VIDRO CERÂMICO INSTALAÇÃO LIGAÇÃO ELÉCTRICA SUGESTÕES PARA POUPANÇA DE ENERGIA SUGESTÕES PARA A PROTECÇÃO DO AMBIENTE PRECAUÇÕES E RECOMENDAÇÕES GERAIS
MANUAL DE UTILIZAÇÃO ANTES DE UTILIZAR A PLACA EM VIDRO CERÂMICO INSTALAÇÃO LIGAÇÃO ELÉCTRICA SUGESTÕES PARA POUPANÇA DE ENERGIA SUGESTÕES PARA A PROTECÇÃO DO AMBIENTE PRECAUÇÕES E RECOMENDAÇÕES GERAIS
FineNess Cachos PRO. Manual de Uso
 Manual de Uso IMPORTANTE, POR FAVOR, LEIA ESTAS INFORMAÇÕES E INSTRUÇÕES ANTES DE USAR O DUTO Antes de começar a utilizar o novo Fineness Cachos, por favor, leia atentamente as instruções. 1. Certifique-se
Manual de Uso IMPORTANTE, POR FAVOR, LEIA ESTAS INFORMAÇÕES E INSTRUÇÕES ANTES DE USAR O DUTO Antes de começar a utilizar o novo Fineness Cachos, por favor, leia atentamente as instruções. 1. Certifique-se
Ficha de Dados de Segurança Conforme o Regulamento (CE) Nº 1907/2006 (REACH)
 Ficha de Dados de Segurança Conforme o Regulamento (CE) Nº 1907/2006 (REACH) 1.- Identificação da substância ou do preparado e da sociedade ou empresa Identificação da substância ou do preparado Denominação:
Ficha de Dados de Segurança Conforme o Regulamento (CE) Nº 1907/2006 (REACH) 1.- Identificação da substância ou do preparado e da sociedade ou empresa Identificação da substância ou do preparado Denominação:
Para utilizar na preparação e isolamento de linfócitos purificados directamente a partir de sangue total FOLHETO INFORMATIVO
 Para utilizar na preparação e isolamento de linfócitos purificados directamente a partir de sangue total FOLHETO INFORMATIVO Para Utilizar no Diagnóstico In Vitro PI-TT.610-PT-V5 Informação sobre o produto
Para utilizar na preparação e isolamento de linfócitos purificados directamente a partir de sangue total FOLHETO INFORMATIVO Para Utilizar no Diagnóstico In Vitro PI-TT.610-PT-V5 Informação sobre o produto
PAINEL DE ADMINISTRADOR
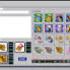 PAINEL DE ADMINISTRADOR IMPORTANTE: O Painel de administrador APENAS deverá ser utilizado pelo responsável do sistema. são: Nesta aplicação, poderá configurar todo o sistema de facturação. As opções do
PAINEL DE ADMINISTRADOR IMPORTANTE: O Painel de administrador APENAS deverá ser utilizado pelo responsável do sistema. são: Nesta aplicação, poderá configurar todo o sistema de facturação. As opções do
Superintendência Regional de Ensino de Ubá - MG Núcleo de Tecnologia Educacional NTE/Ubá. LibreOffice Impress Editor de Apresentação
 Superintendência Regional de Ensino de Ubá - MG Núcleo de Tecnologia Educacional NTE/Ubá LibreOffice Impress Editor de Apresentação Iniciando o Impress no Linux Educacional 4 1. Clique no botão 'LE' no
Superintendência Regional de Ensino de Ubá - MG Núcleo de Tecnologia Educacional NTE/Ubá LibreOffice Impress Editor de Apresentação Iniciando o Impress no Linux Educacional 4 1. Clique no botão 'LE' no
com a qualidade e características deste produto, mas recomendados que leia cuidadosamente estas instruções para tirar o melhor partido da sua compra.
 ÍNDICE 1. Introdução 3. Instruções de segurança 4. Características do produto 5. Instruções de utilização 6. Manutenção 8. Informação de eliminação de pilhas e produto 9. Declaração de conformidade 1.
ÍNDICE 1. Introdução 3. Instruções de segurança 4. Características do produto 5. Instruções de utilização 6. Manutenção 8. Informação de eliminação de pilhas e produto 9. Declaração de conformidade 1.
Versão 1.0 Numero da FISPQ: 100000010394 Data da revisão: 19.10.2015. Sika Silicone W : PROQUÍMICA: 0800118270 SIKA (DDG): 08007037340.
 SEÇÃO 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do produto : Código do produto : 100000010394 Tipo de produto : líquido Detalhes do fabricante ou do fornecedor Empresa : Sika S.A. Avenida Dr. Alberto
SEÇÃO 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do produto : Código do produto : 100000010394 Tipo de produto : líquido Detalhes do fabricante ou do fornecedor Empresa : Sika S.A. Avenida Dr. Alberto
Sistema de altifalantes Bluetooth 2.1 SP 120. Bedienungsanleitung Manual de instruções
 Sistema de altifalantes Bluetooth 2.1 SP 120 Bedienungsanleitung Manual de instruções Antes de conectar Agradecemos-lhe por haver adquirido este sistema de reprodução de multimédia. Para utilizar este
Sistema de altifalantes Bluetooth 2.1 SP 120 Bedienungsanleitung Manual de instruções Antes de conectar Agradecemos-lhe por haver adquirido este sistema de reprodução de multimédia. Para utilizar este
04/2014. Mod: MICRON-48/B. Production code: UPD80 Black
 04/2014 Mod: MICRON-48/B Production code: UPD80 Black Model: UPD60-UPD80 Manual de instrucción PT 280-120424 1 PT Instruções importantes de segurança 1. Para se obter uma utilização plena desta arca vertical,
04/2014 Mod: MICRON-48/B Production code: UPD80 Black Model: UPD60-UPD80 Manual de instrucción PT 280-120424 1 PT Instruções importantes de segurança 1. Para se obter uma utilização plena desta arca vertical,
Relatório SHST - 2003
 Relatório da Actividade dos Serviços de Segurança, Higiene e Saúde no Trabalho Relatório SHST - 2003 Programa de Recolha da Informação Manual de Operação Versão 1.0 DEEP Departamento de Estudos, Estatística
Relatório da Actividade dos Serviços de Segurança, Higiene e Saúde no Trabalho Relatório SHST - 2003 Programa de Recolha da Informação Manual de Operação Versão 1.0 DEEP Departamento de Estudos, Estatística
ENERGIA DA BATERIA & GERENCIAMENTO DA ENERGIA
 CAPÍTULO VINTE TRÊS ENERGIA DA BATERIA & GERENCIAMENTO DA ENERGIA Neste capítulo, você aprenderá os fundamentos do gerenciamento de energia e como usá-los para adquirir uma vida média da bateria mais longa.
CAPÍTULO VINTE TRÊS ENERGIA DA BATERIA & GERENCIAMENTO DA ENERGIA Neste capítulo, você aprenderá os fundamentos do gerenciamento de energia e como usá-los para adquirir uma vida média da bateria mais longa.
Guia de instalação e do usuário do carregador Série MZ
 Guia de instalação e do usuário do carregador Série MZ Informações de segurança importantes sobre a bateria e o carregador Mantenha este guia sempre à mão. Ele contém importantes informações de segurança
Guia de instalação e do usuário do carregador Série MZ Informações de segurança importantes sobre a bateria e o carregador Mantenha este guia sempre à mão. Ele contém importantes informações de segurança
ANTI-A ANTI-B ANTI-AB
 ANTI-A ANTI-B ANTI-AB Monoclonal Murino IgM PROTHEMO Produtos Hemoterápicos Ltda. Reagentes para classificação do sistema sangüíneo ABO PARA TESTES EM LÂMINA OU TUBO Somente para Uso Diagnóstico IN VITRO
ANTI-A ANTI-B ANTI-AB Monoclonal Murino IgM PROTHEMO Produtos Hemoterápicos Ltda. Reagentes para classificação do sistema sangüíneo ABO PARA TESTES EM LÂMINA OU TUBO Somente para Uso Diagnóstico IN VITRO
FICHA TÉCNICA DE SEGURANÇA INSTRUNET GAM
 Pág. 1 de 5 1.- IDENTIFICAÇÃO DA PREPARAÇÃO E DA SOCIEDADE OU EMPRESA Identificação da substância ou da preparação: Utilização da substância ou da preparação: Gel de acção rápida para a desinfecção higiénica
Pág. 1 de 5 1.- IDENTIFICAÇÃO DA PREPARAÇÃO E DA SOCIEDADE OU EMPRESA Identificação da substância ou da preparação: Utilização da substância ou da preparação: Gel de acção rápida para a desinfecção higiénica
InTrac 787 Manual de Instruções
 1 Manual de Instruções 2 Índice: 1. Introdução... 5 2. Observações importantes... 6 2.1 Verificando a entrega... 6 2.2 Instruções operacionais... 6 2.3 Uso normal... 7 2.4 Instruções de segurança... 7
1 Manual de Instruções 2 Índice: 1. Introdução... 5 2. Observações importantes... 6 2.1 Verificando a entrega... 6 2.2 Instruções operacionais... 6 2.3 Uso normal... 7 2.4 Instruções de segurança... 7
Manual do QIAamp DSP DNA Blood Mini Kit 50
 Junho de 2012 Manual do QIAamp DSP DNA Blood Mini Kit 50 Versão 2 Para utilização em diagnóstico in vitro 61104 1071108PT QIAGEN GmbH, QIAGEN Strasse 1, D-40724 Hilden Tel: +49-2103-29-0 R2 1071108PT Sample
Junho de 2012 Manual do QIAamp DSP DNA Blood Mini Kit 50 Versão 2 Para utilização em diagnóstico in vitro 61104 1071108PT QIAGEN GmbH, QIAGEN Strasse 1, D-40724 Hilden Tel: +49-2103-29-0 R2 1071108PT Sample
Segurança e recuperação Manual do utilizador
 Segurança e recuperação Manual do utilizador Copyright 2007-2009 Hewlett-Packard Development Company, L.P. Microsoft é uma marca comercial registada da Microsoft Corporation nos E.U.A. As informações contidas
Segurança e recuperação Manual do utilizador Copyright 2007-2009 Hewlett-Packard Development Company, L.P. Microsoft é uma marca comercial registada da Microsoft Corporation nos E.U.A. As informações contidas
Instalação. Conteúdos da embalagem
 Este Guia de Início Rápido fornece linhas de orientação para instalar e utilizar a IRISPen. Para mais informações acerca de todas as funcionalidades da IRISPen, consulte o Manual do Utilizador completo
Este Guia de Início Rápido fornece linhas de orientação para instalar e utilizar a IRISPen. Para mais informações acerca de todas as funcionalidades da IRISPen, consulte o Manual do Utilizador completo
Introdução. Conteúdo da embalagem. Especificações. Requisitos de sistema. Versão Portuguesa SWEEX.COM. IP002 Sweex USB Internet Phone
 Introdução IP002 Sweex USB Internet Phone Gostaríamos de agradecer o facto de ter adquirido o Sweex USB Internet Phone. Com este telefone, fácil de ligar, pode fazer telefonemas através da internet. Para
Introdução IP002 Sweex USB Internet Phone Gostaríamos de agradecer o facto de ter adquirido o Sweex USB Internet Phone. Com este telefone, fácil de ligar, pode fazer telefonemas através da internet. Para
2.O que precisa de saber antes de utilizar Frisolona Forte
 Folheto informativo: Informação para o utilizador Frisolona Forte 10 mg/ml colírio, suspensão Prednisolona, acetato Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois
Folheto informativo: Informação para o utilizador Frisolona Forte 10 mg/ml colírio, suspensão Prednisolona, acetato Leia com atenção todo este folheto antes de começar a utilizar este medicamento pois
FICHA DE DADOS DE SEGURANÇA (Regulamento REACH (CE) nº 1907/2006 - nº 453/2010)
 FICHA DE DADOS DE SEGURANÇA (REGULAMENTO CE N.o 1907/2006 - REACH) Data: 30/01/2012 Página 1/5 FICHA DE DADOS DE SEGURANÇA (Regulamento REACH (CE) nº 1907/2006 - nº 453/2010) SECÇÃO 1: IDENTIFICAÇÃO DA
FICHA DE DADOS DE SEGURANÇA (REGULAMENTO CE N.o 1907/2006 - REACH) Data: 30/01/2012 Página 1/5 FICHA DE DADOS DE SEGURANÇA (Regulamento REACH (CE) nº 1907/2006 - nº 453/2010) SECÇÃO 1: IDENTIFICAÇÃO DA
XPontos. Manual de Instruções
 XPontos Manual de Instruções 2 XPontos LIGAR O EQUIPAMENTO Na parte inferior do equipamento, ligar o cabo de alimentação de acordo com a ilustração. COLOCAR O ROLO PARA IMPRESSÃO Pressionar o botão OPEN
XPontos Manual de Instruções 2 XPontos LIGAR O EQUIPAMENTO Na parte inferior do equipamento, ligar o cabo de alimentação de acordo com a ilustração. COLOCAR O ROLO PARA IMPRESSÃO Pressionar o botão OPEN
características do seu novo ionizador de plasma
 características do seu novo ionizador de plasma O seu ionizador de plasma é uma excelente escolha para uma limpeza eficiente do ar. O ionizador de plasma protegerá a sua família das alergias causadas pelo
características do seu novo ionizador de plasma O seu ionizador de plasma é uma excelente escolha para uma limpeza eficiente do ar. O ionizador de plasma protegerá a sua família das alergias causadas pelo
Localização do termostato 14 Posicionamento e instalação do sensor 14. Instalação eléctrica normal 15 Montagem do termostato na caixa de parede 16
 ÍNDICE INTRODUÇÃo 13 Especificações técnicas 14 POSICIONAMENTO DO TERMOSTATO E DO SENSOR 14 Localização do termostato 14 Posicionamento e instalação do sensor 14 INSTALAÇÃO 15 Instalação eléctrica normal
ÍNDICE INTRODUÇÃo 13 Especificações técnicas 14 POSICIONAMENTO DO TERMOSTATO E DO SENSOR 14 Localização do termostato 14 Posicionamento e instalação do sensor 14 INSTALAÇÃO 15 Instalação eléctrica normal
SOPRADOR ASPIRADOR GASOLINA 2T. Manual do Operador
 SOPRADOR ASPIRADOR GASOLINA 2T Manual do Operador 360422 Agradecemos por optar por um produto de jardinagem Matsuyama. O Soprador Aspirador Matsuyama é desenhado e construído para proporcionar performance
SOPRADOR ASPIRADOR GASOLINA 2T Manual do Operador 360422 Agradecemos por optar por um produto de jardinagem Matsuyama. O Soprador Aspirador Matsuyama é desenhado e construído para proporcionar performance
Versão 1.0 Numero da FISPQ: 000000122941 Data da revisão: 16.09.2015. Sikaflex -265. : Selante/ Adesivo
 SEÇÃO 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do produto : Código do produto : 000000122941 Tipo de produto : líquido Uso recomendado do produto químico e restrições de uso Uso da substância / preparação
SEÇÃO 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do produto : Código do produto : 000000122941 Tipo de produto : líquido Uso recomendado do produto químico e restrições de uso Uso da substância / preparação
No sentido da marcha. Manual de instruções. Grupo Peso Idade 2-3 15-36 kg 4-12 anos
 No sentido da marcha Manual de instruções ECE R44 04 Grupo Peso Idade 2-3 15-36 kg 4-12 anos 1 ! Obrigado por optar pela BeSafe izi Up FIX A BeSafe desenvolveu esta cadeira com todo o cuidado, para proteger
No sentido da marcha Manual de instruções ECE R44 04 Grupo Peso Idade 2-3 15-36 kg 4-12 anos 1 ! Obrigado por optar pela BeSafe izi Up FIX A BeSafe desenvolveu esta cadeira com todo o cuidado, para proteger
ANTI D IgM +IgG Monoclonal (Humano)
 ANTI D IgM +IgG Monoclonal (Humano) PROTHEMO Produtos Hemoterápicos Ltda. Reagente para classificação do fator Rh PARA TESTES EM LÂMINA OU TUBO Somente para Uso Diagnóstico IN VITRO Conservar entre: 2-8
ANTI D IgM +IgG Monoclonal (Humano) PROTHEMO Produtos Hemoterápicos Ltda. Reagente para classificação do fator Rh PARA TESTES EM LÂMINA OU TUBO Somente para Uso Diagnóstico IN VITRO Conservar entre: 2-8
CLIPPER DE LA COURONNE
 Gebruiksaanwijzing Instructions for use Mode d emploi Anleitung Instrucciones de Uso Istruzioni d uso Bruksanvisning Brugsanvisning Bruksanvisning Käyttöohje Instruções de utilização TYPE 535409 V1 CLIPPER
Gebruiksaanwijzing Instructions for use Mode d emploi Anleitung Instrucciones de Uso Istruzioni d uso Bruksanvisning Brugsanvisning Bruksanvisning Käyttöohje Instruções de utilização TYPE 535409 V1 CLIPPER
Início Rápido. Nero BackItUp. Ahead Software AG
 Início Rápido Nero BackItUp Ahead Software AG Informações sobre copyright e marcas comerciais O manual do utilizador Nero BackItUp e a totalidade do respectivo conteúdo estão protegidos por copyright e
Início Rápido Nero BackItUp Ahead Software AG Informações sobre copyright e marcas comerciais O manual do utilizador Nero BackItUp e a totalidade do respectivo conteúdo estão protegidos por copyright e
Hidróxido de Sódio, pérolas Segundo Regulamento (CE) 1907/2006
 Ficha de Dados de Segurança 1. Identificação da substância e da empresa 1.1 Identificação da substância ou do preparado Denominação: Sódio Hidróxido *pérola Hidróxido de Sódio, pérolas Segundo Regulamento
Ficha de Dados de Segurança 1. Identificação da substância e da empresa 1.1 Identificação da substância ou do preparado Denominação: Sódio Hidróxido *pérola Hidróxido de Sódio, pérolas Segundo Regulamento
Guia de iniciação Bomgar B400
 Guia de iniciação Bomgar B400 Documento: 043010.15 Publicado: maio de 2010 Guia de iniciação Bomgar B400 Documento: 043010.15 Publicado: maio 2010 Obrigado por utilizar a Bomgar. Na Bomgar, o atendimento
Guia de iniciação Bomgar B400 Documento: 043010.15 Publicado: maio de 2010 Guia de iniciação Bomgar B400 Documento: 043010.15 Publicado: maio 2010 Obrigado por utilizar a Bomgar. Na Bomgar, o atendimento
FICHA DE SEGURANÇA: ZOTAL LABORATÓRIOS ZOTAL, S. L. UNIVETE, S. A. 41900 Camas (Sevilla) Tel: 21 3041230 Espanha Fax: 21 3041233
 FICHA DE SEGURANÇA: ZOTAL Identificação do fabricante: Identificação do distribuidor: LABORATÓRIOS ZOTAL, S. L. UNIVETE, S. A. Ctra. N. 630, KM 809 Rua D. Jerónimo Osório, 5 - B Apdo. De Correos, 4 1400-350
FICHA DE SEGURANÇA: ZOTAL Identificação do fabricante: Identificação do distribuidor: LABORATÓRIOS ZOTAL, S. L. UNIVETE, S. A. Ctra. N. 630, KM 809 Rua D. Jerónimo Osório, 5 - B Apdo. De Correos, 4 1400-350
Características da Câmara de Look 312P. Instalar a Câmara de Look 312P
 Características da Câmara de Look 312P 1 2 3 Objectiva Focagem manual através do ajuste da objectiva Bolsa Pode colocar o cabo na bolsa. Corpo dobrável Pode ajustar a Look 312P em diferentes posições.
Características da Câmara de Look 312P 1 2 3 Objectiva Focagem manual através do ajuste da objectiva Bolsa Pode colocar o cabo na bolsa. Corpo dobrável Pode ajustar a Look 312P em diferentes posições.
1 ACESSO PARA SECRETÁRIA... 4 2 - CONFIGURAR HORÁRIOS DE ATENDIMENTO... 4 2.1 BLOQUEANDO E HABILITANDO HORÁRIOS... 5 3 PRÉ-DEFININDO PARÂMETROS DE
 2 1 ACESSO PARA SECRETÁRIA... 4 2 - CONFIGURAR HORÁRIOS DE ATENDIMENTO... 4 2.1 BLOQUEANDO E HABILITANDO HORÁRIOS... 5 3 PRÉ-DEFININDO PARÂMETROS DE ATENDIMENTO... 6 4 - A TELA AGENDA... 7 4.1 - TIPOS
2 1 ACESSO PARA SECRETÁRIA... 4 2 - CONFIGURAR HORÁRIOS DE ATENDIMENTO... 4 2.1 BLOQUEANDO E HABILITANDO HORÁRIOS... 5 3 PRÉ-DEFININDO PARÂMETROS DE ATENDIMENTO... 6 4 - A TELA AGENDA... 7 4.1 - TIPOS
