Conclusões científicas
|
|
|
- Benedita Paixão Andrade
- 6 Há anos
- Visualizações:
Transcrição
1 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo em conta as indicações aprovadas para cada medicamento 9
2 Conclusões científicas Resumo da avaliação científica de medicamentos contendo di-hidroergotamina (ver Anexo I) Em 18 de janeiro de 2012, a França desencadeou um procedimento de consulta nos termos do artigo 31.º da Diretiva 2001/83/CE para os seguintes medicamentos contendo derivados da ergotamina: di-hidroergocriptina/cafeína, di-hidroergocristina, di-hidroergotamina, di-hidroergotoxina e nicergolina. Na sequência de uma revisão nacional da farmacovigilância realizada em 2011, novas notificações espontâneas comunicadas com alguns desses medicamentos identificaram casos graves de fibrose e ergotismo e a França considerou que esta preocupação de segurança não era superada pelas limitadas evidências de eficácia. Por conseguinte, foi solicitado ao CHMP que desse o seu parecer sobre se as Autorizações de Introdução no Mercado para os medicamentos contendo derivados da ergotamina deviam ser mantidas, alteradas, suspensas ou retiradas em relação às seguintes indicações: Tratamento sintomático de patologias crónicas da função cognitiva ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências), Tratamento auxiliar da claudicação intermitente na doença oclusiva arterial periférica sintomática (DAOP estadio II), Tratamento auxiliar da doença de Raynaud, Tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem presumivelmente vascular, Retinopatias agudas de origem vascular, Profilaxia da enxaqueca, Hipotensão ortostática, Tratamento sintomático da insuficiência veno-linfática. O mesilato de di-hidroergotamina (di-hidroergotamina - DHE) é um derivado semissintético da ergotamina. Há muito que é utilizado no tratamento da enxaqueca em virtude da sua atividade vasoconstritora, que é mais ligeira do que a da ergotamina. No tratamento preventivo de enxaqueca, a di-hidroergotamina é administrada oralmente por um longo período de tempo. No tratamento agudo de enxaqueca, é administrada parentericamente ou na forma de pulverização nasal devido à baixa biodisponibilidade do fármaco inalterado pela via oral. A eficácia da di-hidroergotamina no tratamento agudo de crises de enxaqueca não se enquadra no âmbito deste procedimento de consulta, pelo que não será discutida. Da mesma forma, a eficácia da di-hidroergotamina administrada por injeção subcutânea, intramuscular ou intravenosa ou por pulverização intranasal não se enquadra no âmbito deste procedimento de consulta, pelo que não será discutida. Das indicações aprovadas para os medicamentos contendo di-hidroergotamina, as que se enquadram no âmbito deste procedimento de consulta e que estão aprovadas em pelo menos um Estado-Membro são as seguintes (a redação específica da indicação poderá variar consoante o medicamento): profilaxia da enxaqueca, hipotensão ortostática, tratamento sintomático da insuficiência veno-linfática. Os titulares das Autorizações de Introdução no Mercado (titulares das AIM) apresentaram todos os dados de eficácia disponíveis de ensaios clínicos e estudos observacionais, incluindo dados que se tornaram disponíveis desde que a Autorização de Introdução no Mercado foi inicialmente concedida. Os titulares das AIM apresentaram igualmente as suas próprias descrições gerais e resumos de todos os relatos espontâneos de reações fibróticas (cardíacas com ou sem hipertensão arterial pulmonar, pulmonares, pleurais, peritoneais, retroperitoneais, etc.) e ergotismo com os seus medicamentos contendo derivados da ergotamina. Sempre que possível, foi disponibilizada uma revisão de todos os outros dados disponíveis (ou seja, dados da literatura, dados pré-clínicos e outros dados clínicos, incluindo estudos epidemiológicos) que foram relevantes para avaliar o risco de fibrose. O CHMP teve em conta a totalidade dos dados disponíveis relacionados com a segurança e eficácia da di-hidroergotamina. 10
3 Eficácia clínica No que toca à eficácia para a indicação profilaxia da enxaqueca, os dados derivam de alguns estudos aleatorizados, em dupla ocultação e controlados por placebo ou de estudos em dupla ocultação, não controlados por placebo e sem ocultação, sendo que a maioria foi realizada após a concessão da autorização de introdução no mercado inicial. Os estudos aleatorizados, em dupla ocultação e controlados por placebo eram antigos e, regra geral, não foram realizados com a metodologia atual. O número de doentes incluídos era pequeno e a duração do tratamento demasiado curta, além de que os parâmetros de eficácia clínica utilizados não estão em linha com as normas orientadoras europeias para a investigação clínica de medicamentos para o tratamento de enxaquecas. No único estudo recente de grandes dimensões com um desenho apropriado (estudo em dupla ocultação, controlado por placebo, com tratamento de 5 meses) (estudo PROMISE) que foi disponibilizado após a concessão da autorização de introdução no mercado inicial, as evidências da eficácia da di-hidroergotamina na prevenção de enxaquecas não foram demonstradas, visto não existir uma diferença estatisticamente significativa entre a di-hidroergotamina e o placebo. Um total de 363 participantes foi tratado com di-hidroergotamina ou placebo durante 4 meses após 1 mês de período introdutório com placebo. A frequência das crises de enxaqueca (o critério de eficácia primária) não foi estatisticamente significativa (grupo da di-hidroergotamina (-1,84 ± 1,55) versus grupo do placebo (-1,67 ± 1,49) (p=0,220)). Quanto à percentagem de doentes que reagiram (61,1% no grupo da di-hidroergotamina versus 55,9% no grupo do placebo), a diferença não foi estatisticamente significativa. Realizou-se uma análise post-hoc com o subgrupo de doentes (n=288) com deficiência funcional e qualidade de vida (QdV) diminuída (definida pelo questionário Migraine Specific Quality of Life como MSQ<80). Após 4 meses de tratamento, a frequência dos crises diminuiu 2,0 ± 1,6 ( 60,0%) com a di-hidroergotamina versus 1,7 ± 1,5 ( 48,8%) com o placebo (p=0,014 para as alterações relativas). Não se observou uma melhoria significativa em relação ao placebo no subconjunto de doentes com QdV não afetada. Neste estudo, a eficácia da di-hidroergotamina na prevenção de enxaquecas não ficou demonstrada tendo em consideração que não houve uma diferença estatisticamente significativa entre a di-hidroergotamina e o placebo a respeito da redução da frequência das crises de enxaqueca (o critério de eficácia primária) na população em geral. Os dados da literatura indicam uma eventual eficácia da di-hidroergotamina oral na profilaxia da enxaqueca, mas as provas científicas concretas continuam a ser fracas. Há poucas evidências extraídas dos ensaios clínicos em dupla ocultação e controlados por placebo e, destes estudos, não emerge uma imagem uniforme da eficácia da ergotamina oral comparada com o placebo ou outras substâncias na prevenção de enxaquecas, visto que os estudos apresentaram tanto resultados positivos como resultados negativos. Em conclusão, os estudos disponibilizados pelos titulares das AIM não foram realizados com a metodologia atual. O número de doentes incluídos era pequeno e a duração do tratamento demasiado curta. No único estudo recente de grandes dimensões com um desenho apropriado (estudo PROMISE), não houve uma diferença estatisticamente significativa entre a di-hidroergotamina e o placebo a respeito da redução da frequência das crises de enxaqueca (o critério de eficácia primária) na população em geral. Além disso, em dezembro de 2012, um grupo de aconselhamento científico (SAG) reuniu-se a pedido do CHMP, sendo que os especialistas debateram, com base na sua experiência clínica, se esta substância desempenha um papel na profilaxia da enxaqueca. Com base na experiência clínica, o grupo considerou que não existe uma população especial que possa beneficiar do tratamento com esta substância ativa na profilaxia da enxaqueca. Por conseguinte, o grupo considerou que não existe uma população claramente definida que reaja de forma insatisfatória ao tratamento padrão de profilaxia da enxaqueca e em que haja uma necessidade terapêutica desta substância como alternativa/tratamento de último recurso. Relativamente à indicação hipotensão ortostática, os estudos apresentados foram considerados de má qualidade metodológica pelo CHMP: eram maioritariamente ensaios não controlados com apenas 1 estudo em dupla ocultação, mas com poucos doentes. Alguns avaliavam a via injetável ou doses mais altas do que o recomendado (até 42 mg por dia, em vez de 10 mg por dia). A população de doentes era heterogénea ou composta por doentes com hipotensão induzida pelo tratamento com fármacos psicotrópicos. Nestes estudos, a di-hidroergotamina parece ter alguma eficácia apenas por via injetável 11
4 ou com doses mais altas do que a dose autorizada. As doses orais autorizadas parecem ter uma eficácia fraca ou nula devido à baixa biodisponibilidade do fármaco. Apenas um estudo, o da autoria de Thulesius (1986), demonstrou uma redução significativa da queda imediata da tensão arterial no doente ao levantar-se, com 10 mg por dia de di-hidroergotamina comparado com o placebo, em doentes com hipotensão induzida pelo tratamento com fármacos psicotrópicos, sendo que o estudo foi disponibilizado após a concessão da autorização de introdução no mercado inicial. O desenho deste estudo foi considerado aceitável pelo CHMP (ou seja, controlado, aleatorizado, em dupla ocultação), mas a dimensão do estudo foi considerada pequena (n=58). Além disso, os doentes eram incluídos se apresentassem uma redução da tensão arterial sistólica superior a 10 mmhg, o que não está em conformidade com a definição estabelecida de hipotensão ortostática (pelo menos 20 mmhg abaixo do valor basal). A tensão arterial sistólica dos grupos do placebo e da dihidroergotamina já diferia à partida. A eficácia foi avaliada pela comparação de medições da tensão arterial absoluta após o tratamento, em vez da comparação das diferenças entre as posições supina e em pé, que não se considerou aceitável. O CHMP afirmou igualmente que a população do estudo, composta apenas por doentes com hipotensão ortostática induzida por fármacos, não é representativa para se poder concluir sobre a eficácia da di-hidroergotamina na população total de doentes com hipotensão ortostática. O CHMP também tomou nota da posição de vários titulares de AIM de que não existem evidências suficientes para apoiar uma indicação de di-hidroergotamina oral na hipotensão ortostática. Além disso, em dezembro de 2012, um grupo de aconselhamento científico (SAG) reuniu-se a pedido do CHMP, sendo que os especialistas debateram, com base na sua experiência clínica, se esta substância desempenha um papel no tratamento da hipotensão ortostática. Com base na experiência clínica, o grupo considerou que a di-hidroergotamina só tem sido utilizada raramente para o tratamento da hipotensão ortostática, sem um claro benefício para os doentes. Além disso, foi utilizada a formulação IV do medicamento e não a formulação oral que está no âmbito deste procedimento de consulta. Por conseguinte, o grupo considerou que, com base nas evidências disponíveis, não há necessidade desta substância, uma vez que não existe um claro subconjunto de doentes que beneficiariam da mesma. Relativamente à indicação tratamento sintomático da insuficiência veno-linfática, os estudos realizados foram muito poucos. O estudo sem ocultação (Wenzel-E et al., 1989) que foi disponibilizado após a concessão da autorização de introdução no mercado inicial discute a utilização da di-hidroergotamina na insuficiência venosa. Doze doentes com insuficiência venosa periférica começaram por ser tratados com di-hidroergotamina intravenosa, seguindo-se a administração oral de di-hidroergotamina durante uma semana. Apesar de se ter demonstrado uma redução significativa da capacidade venosa, fluxo capilar dos eritrócitos e fluxo máximo da hiperemia reativa, o CHMP não foi capaz de chegar a qualquer conclusão quanto à eficácia da di-hidroergotamina devido a um grupo de estudo muito pequeno, ao desenho não controlado e a outras limitações metodológicas. Os estudos apresentados são antigos e de má qualidade metodológica: não controlados, de desenho aberto e com um baixo número de doentes (n=12 no estudo de Wenzel, 1989, o estudo mais recente). Alguns foram realizados com a administração intravenosa, que não está no âmbito deste procedimento de consulta para a di-hidroergotamina. A doença dos doentes não está bem definida nem os endpoints de eficácia. A relevância dos endpoints clínicos é questionável. O CHMP tomou nota da posição de vários titulares de AIM de que não existem evidências suficientes para apoiar uma indicação de di-hidroergotamina oral no tratamento sintomático da insuficiência veno-linfática e considerou que não é possível chegar a qualquer conclusão científica relativamente à eficácia da di-hidroergotamina com base nos resultados destes estudos. Segurança clínica Os derivados da ergotamina são reconhecidos como capazes de induzir fibrose, em particular, fibrose da válvula cardíaca. A relação entre a fibrose e a ativação dos recetores serotoninérgicos, sobretudo os recetores 5-HT 2B, por derivados da ergotamina está amplamente descrita na literatura. O agonismo aos recetores 5-HT 2B induz uma resposta proliferativa e a mitogenicidade das células que expressam este recetor, originando a fibrogénese. Globalmente, a afinidade variável pelos recetores serotoninérgicos com os diferentes derivados da ergotamina e as doses terapêuticas utilizadas poderão explicar as diferenças observadas nas taxas de notificação de reações fibróticas. Por conseguinte, mesmo que seja altamente plausível em termos farmacológicos que os derivados da ergotamina que atuam como agonistas dos recetores 5-HT 2B possam induzir a doença "serotonérgica" da válvula, semelhante à induzida por tumores carcinoides ou lesões fibróticas de outros tecidos, é preciso recordar que alguns 12
5 derivados da ergotamina não são agonistas dos recetores 5-HT 2B. por conseguinte, não se pode excluir outros mecanismos que induzam fibrose, o que sugere um elo causal entre a fibrose e o agonismo dos recetores 5-HT 2A e 5-HT 1B, além de um efeito plausível no transportador da serotonina. Em relação aos casos relatados, o CHMP constatou o problema da subnotificação em relação a este medicamento, tendo em conta o tempo que ele já está no mercado. Pode suspeitar-se de subnotificação visto que: reações adversas medicamentosas com uma substância comercializada há muito tempo são geralmente menos comunicadas, a fibrose é mencionada em vários Resumos das Características do Medicamento (RCM) europeus atuais e as reações esperadas são muitas vezes subnotificadas, a fibrose é também uma reação insidiosa que ocorre após um longo período de tratamento e, portanto, com diagnóstico muitas vezes tardio. Além disso, os dados de segurança fornecidos por alguns titulares de AIM estão incompletos (lacuna entre o período de revisão e o período de comercialização do medicamento), não se podendo excluir o facto de faltarem casos relatados com os seus próprios medicamentos. Ao todo, 8 casos de reações adversas fibróticas relatadas num inquérito francês realizado em 2011 e 50 casos entre os 75 casos comunicados pelos titulares das AIM foram considerados como estando potencialmente relacionados com a di-hidroergotamina, incluindo 24 que não apresentavam fator de confusão. Um caso foi perturbado pelo historial médico e foram comunicados fármacos suspeitos administrados de forma concomitante em 25 casos: benfluorex (4 casos), dexfenfluramina (4 casos), pergolida (1 caso), bloqueadores beta (9 casos), fenofibrato (2 casos) e fármaco derivado da ergotamina (8 casos). Estes fármacos suspeitos administrados de forma concomitante são conhecidos por induzir fibrose. Contudo, o CHMP registou que os bloqueadores beta não são amplamente reconhecidos como causa de fibrose. Nalguma literatura publicada, são considerados a etiologia da fibrose retroperitoneal (P. Meier et al., La fibrose rétropéritonéale, une maladie inflammatoire méconnue. Observations cliniques et revue de la littérature. Néphrologie Vol. 24 n , pp ). Nos casos relatados, a di-hidroergotamina é maioritariamente indicada para enxaquecas ou cefaleias (30 doentes) e é utilizada com a dosagem diária recomendada. Conforme esperado, a fibrose ocorreu principalmente nos doentes femininos (68%) após um longo período de tratamento com a di-hidroergotamina (9,1 anos em média) e o tipo de reação fibrótica mais frequentemente relatado foi a fibrose retroperitoneal (36%), seguida da fibrose cardíaca (30%) e da fibrose pleural (18%). Quase todos os casos eram graves (93% dos casos relatavam gravidade) e o tratamento com a di-hidroergotamina foi descontinuado em 91% dos casos (cuja informação está disponível) e, em 57% destes casos, o resultado notificado tem sido uma melhoria ou recuperação. Porém, o CHMP registou que, para a maioria destes doentes, uma melhoria ou recuperação tinha sido observada após tratamento com corticosteroides ou cirurgia (substituição da válvula) e que, na maioria dos casos, a melhoria é declarada com base nos sintomas clínicos (sem exame). Para concluir, considerando os casos relatados de uma reação difícil de diagnosticar precocemente (sintomas tardios) e provavelmente subnotificada, a utilização do fármaco com uma dosagem aprovada, aliada a um perfil farmacológico plausível, considera-se que a di-hidroergotamina está fortemente associada ao risco de reações fibróticas. Além disso, considerando que a fibrose é uma reação grave que pode ser fatal, observada após um tratamento de longa duração com di-hidroergotamina (um fármaco utilizado para indicações que exigem um tratamento de longa duração), isto tem impacto na relação risco-benefício dos medicamentos. Adicionalmente, as 8 novas notificações espontâneas relatadas durante o inquérito francês realizado em 2011 mostram que as medidas de minimização dos riscos atualmente em vigor não são suficientes para prevenir o risco de desenvolvimento de reações fibróticas. Em relação ao risco de ergotismo, a revisão dos casos fornecidos pelos titulares das AIM não foi exaustiva e a metodologia utilizada para obter casos de ergotismo não foi clara para a maioria dos titulares das AIM. Alguns sintomas relacionados com o ergotismo podem ser confundidos com sintomas de enxaqueca, pelo que não são comunicados como uma reação adversa medicamentosa. Contudo, no total, os titulares das AIM comunicaram 134 casos de ergotismo ou sintomas potencialmente relacionados com ergotismo. O ergotismo é uma reação grave, que, em casos raros relatados, dá origem a sequelas importantes, às quais se seguem amputação ou ressecção do cólon, por exemplo. Esta reação ocorreu em doentes 13
6 jovens (média de idade dos casos relatados: 41 anos), aparecendo pouco tempo depois do início do tratamento com di-hidroergotamina (menos de 2 meses, média: 2 dias). Fica realçada a gravidade desses efeitos adversos e das suas eventuais consequências fatais. Os sintomas do ergotismo estão enunciados nas secções 4.8 e 4.9 de todos os RCM e o ergotismo é identificado na secção 4.4 como consequência de uma utilização prolongada da di-hidroergotamina ou de uma dosagem elevada. Para todos os medicamentos, a utilização concomitante de inibidores da CYP3A está contraindicada com di-hidroergotamina (secção 4.5) e, para outros medicamentos, a utilização concomitante do agente vasoconstritor também está contraindicada. Contudo, mais de metade dos casos de ergotismo relatados foi descrita no contexto de sobredosagem, sem utilização de um fármaco contraindicado. Além disso, o número de casos relatados com um fármaco concomitante contraindicado revela que a informação no RCM não é suficiente para evitar a exposição do doente ao grave risco de ergotismo. Para concluir, o ergotismo é uma reação adversa aos fármacos derivados da ergotamina que ocorre no contexto de sobredosagem ou interação. Porém, considerando o número de casos relatados com a di-hidroergotamina, com sintomas relacionados com o ergotismo (apesar da provável escassez de casos) mesmo quando a di-hidroergotamina é utilizada conforme recomendado (sem sobredosagem, sem fármaco contraindicado e tratamento de curta duração), a elevada plausibilidade farmacológica e uma cronologia sugestiva na maioria dos casos, considera-se que os doentes são expostos a um elevado risco de ergotismo quando tratados com di-hidroergotamina. Além disso, dada a gravidade do ergotismo e das suas consequências (sequelas, necessidade de cirurgia e amputação), a idade jovem dos doentes com sintomas de ergotismo e o curto período de tempo até ao início da reação, o perfil de segurança da di-hidroergotamina é altamente questionável. O CHMP considerou as propostas de medidas de minimização dos riscos apresentadas pelos titulares das AIM. Essas propostas incluíam a restrição das indicações terapêuticas, a recomendação de uma monitorização atenta dos doentes e a emissão de uma comunicação dirigida aos profissionais de saúde (DHPC). Apesar de algumas medidas propostas poderem contribuir para a identificação precoce dos doentes com fibrose, poderá ser demasiado tarde, visto que estas reações são, por vezes, irreversíveis. Assim sendo, o Comité salientou que as medidas propostas são insuficientes para evitar que alguns doentes desenvolvam fibrose e ergotismo durante o tratamento. Globalmente, o CHMP considerou que nenhuma situação podia justificar a exposição de um doente ao risco de fibrose e ergotismo, tendo em consideração os dados muito limitados sobre a eficácia. Relação risco-benefício O Comité concluiu que, nos termos do artigo 116.º da Diretiva 2001/83/CE, a relação risco-benefício dos medicamentos contendo di-hidroergotamina para utilização por via oral não é favorável para a profilaxia da enxaqueca, tratamento de hipotensão ortostática e tratamento sintomático da insuficiência veno-linfática. Fundamentos para a suspensão/alteração dos termos das Autorizações de Introdução no Mercado Considerando que: o Comité teve em conta o procedimento realizado nos termos do artigo 31.º da Diretiva 2001/83/CE, relativamente aos medicamentos contendo derivados da ergotamina nas indicações em questão; o Comité teve em conta todos os dados apresentados pelos titulares das AIM e as conclusões do grupo de aconselhamento científico; o Comité teve em conta que não se pode excluir uma potencial associação causal entre as reações fibróticas ou o ergotismo e a di-hidroergotamina oral. Os dados disponíveis são, de facto, indicativos dessa relação causal. Fica realçada a gravidade desses efeitos adversos e das suas eventuais consequências fatais; 14
7 o Comité considerou que as evidências de eficácia clinicamente significativa da di-hidroergotamina oral nas indicações atualmente avaliadas são muito limitadas e, por conseguinte, o potencial benefício para os doentes nestas indicações é superado pelo risco acima identificado; o Comité considerou que a relação risco-benefício dos medicamentos contendo di-hidroergotamina oral: não é favorável para a profilaxia da enxaqueca, não é favorável para a hipotensão ortostática, não é favorável para o tratamento sintomático da insuficiência veno-linfática. Por conseguinte, o CHMP recomenda, em conformidade com o artigo 116.º da Diretiva 2001/83/CE: a alteração dos termos da Autorização de Introdução no Mercado para os medicamentos contendo di-hidroergotamina referidos no Anexo I, a eliminação das indicações referidas abaixo da Informação do Medicamento (a redação específica da indicação poderá variar consoante o medicamento e consoante o país), bem como qualquer referência relevante a essas indicações na Informação do Medicamento, quando haja outras indicações terapêuticas aprovadas como parte integrante da respetiva Autorização de Introdução no Mercado: profilaxia da enxaqueca, hipotensão ortostática, tratamento sintomático da insuficiência veno-linfática; a suspensão da Autorização de Introdução no Mercado para os medicamentos contendo di-hidroergotamina referidos no Anexo I, caso não haja outras indicações aprovadas como parte integrante da respetiva Autorização de Introdução no Mercado. Com vista a levantar a suspensão, os titulares das AIM têm de identificar uma população específica de doentes na qual os benefícios do medicamento são superiores aos riscos. 15
Nome de fantasia Dosagem Forma farmacêutica. VASOBRAL, comprimido sulcado. VASOBRAL, A solução oral num frasco. 0.
 Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s) do(s) titular(es) da(s) Autorização(ões) de Introdução no mercado nos Estados-Membros 1
Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s) do(s) titular(es) da(s) Autorização(ões) de Introdução no mercado nos Estados-Membros 1
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo
Nome de fantasia Dosagem Forma Farmacêutica. Hydergin Fas 4,5 mg Filmcomprimidoten. Hydergin SRO 6 mg Kapseln
 Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de admnistração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado no(s) estados-membros
Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de admnistração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado no(s) estados-membros
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 15 Conclusões científicas Haldol, que contém a substância ativa haloperidol, é um antipsicótico do grupo das butirofenonas. É um potente antagonista dos recetores de dopamina
Anexo II Conclusões científicas 15 Conclusões científicas Haldol, que contém a substância ativa haloperidol, é um antipsicótico do grupo das butirofenonas. É um potente antagonista dos recetores de dopamina
Lipophoral Tablets 150mg. Mediator 150 mg Comprimido Via oral. Benfluorex Mylan 150 mg Comprimido Via oral. Benfluorex Qualimed
 ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
Resumo da avaliação científica de medicamentos contendo nimesulida para uso sistémico (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
RESUMO DA AVALIAÇÃO CIENTÍFICA DE MEDICAMENTOS CONTENDO ÁCIDO VALPRÓICO/VALPROATO (ver Anexo I)
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 108 CONCLUSÕES
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 108 CONCLUSÕES
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 7 Conclusões científicas Resumo da avaliação científica do Kantos Master e nomes associados
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 7 Conclusões científicas Resumo da avaliação científica do Kantos Master e nomes associados
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 7 Conclusões científicas O pó e solvente Solu-Medrol 40 mg para solução para injeção (a seguir designado «Solu-Medrol») contém metilprednisolona e, tratando-se de um excipiente,
Anexo II Conclusões científicas 7 Conclusões científicas O pó e solvente Solu-Medrol 40 mg para solução para injeção (a seguir designado «Solu-Medrol») contém metilprednisolona e, tratando-se de um excipiente,
Resumo das conclusões científicas relativas aos fármacos que contêm buflomedil (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para a suspensão da autorização de introdução no mercado e utilização dos produtos apresentados pela EMA 14 Conclusões científicas Resumo das conclusões científicas
Anexo II Conclusões científicas e fundamentos para a suspensão da autorização de introdução no mercado e utilização dos produtos apresentados pela EMA 14 Conclusões científicas Resumo das conclusões científicas
Ergomed - Tropfen (1:1:1) ERSILAN 1mg/ml solução oral em gotas oral mg/19.20 mg. ISKEDYL, comprimé 0.60 mg / 4.80 mg
 Anexo I Lista de nomes, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Estado
Anexo I Lista de nomes, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Estado
Resumo da avaliação científica de supositórios contendo derivados terpénicos (ver Anexo I)
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A REVOGAÇÃO OU A ALTERAÇÃO DAS SECÇÕES RELEVANTES DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DOS FOLHETOS INFORMATIVOS APRESENTADOS
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A REVOGAÇÃO OU A ALTERAÇÃO DAS SECÇÕES RELEVANTES DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DOS FOLHETOS INFORMATIVOS APRESENTADOS
Anexo II. Conclusões científicas e fundamentos para a recusa apresentados pela EMA
 Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela EMA 30 Conclusões científicas Resumo da avaliação científica do Norditropin SimpleXx, Norditropin NordiFlex, Norditropin FlexPro
Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela EMA 30 Conclusões científicas Resumo da avaliação científica do Norditropin SimpleXx, Norditropin NordiFlex, Norditropin FlexPro
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 199 Conclusões científicas Na sequência da avaliação de um procedimento de partilha do trabalho do RPS sobre os medicamentos contendo ambroxol iniciada em janeiro de 2012
Anexo II Conclusões científicas 199 Conclusões científicas Na sequência da avaliação de um procedimento de partilha do trabalho do RPS sobre os medicamentos contendo ambroxol iniciada em janeiro de 2012
MAIOR CONTRO. Informação De Segurança Importante Sobre PRILIGY. 1 Informação para o médico
 MAIOR CONTRO Informação De Segurança Importante Sobre PRILIGY 1 Informação para o médico 2 A Ejaculação Precoce e PRILIGY PRILIGY é um medicamento oral aprovado para o tratamento da Ejaculação Precoce
MAIOR CONTRO Informação De Segurança Importante Sobre PRILIGY 1 Informação para o médico 2 A Ejaculação Precoce e PRILIGY PRILIGY é um medicamento oral aprovado para o tratamento da Ejaculação Precoce
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 7 Conclusões científicas A amitriptilina é um antidepressivo tricíclico bem conhecido com um mecanismo de ação e um uso bem estabelecidos (Brunton 2011). A amitriptilina
Anexo II Conclusões científicas 7 Conclusões científicas A amitriptilina é um antidepressivo tricíclico bem conhecido com um mecanismo de ação e um uso bem estabelecidos (Brunton 2011). A amitriptilina
Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento
 23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 14 Conclusões científicas Resumo da avaliação científica do Zinacef e nomes associados
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 14 Conclusões científicas Resumo da avaliação científica do Zinacef e nomes associados
Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças em relação à recomendação do PRAC
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado e explicação detalhada dos fundamentos científicos para as diferenças relativamente à
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado e explicação detalhada dos fundamentos científicos para as diferenças relativamente à
Nome de fantasia Dosagem Forma farmacêutica. Ergotop 10 mg - Tabletten. Ergotop 20 mg - Filmtabletten. Ergotop 30 mg - Filmtabletten
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros
Anexo III. Alterações à informação do medicamento
 Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
ANEXO III ALTERAÇÕES AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO
 ANEXO III ALTERAÇÕES AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 43 ALTERAÇÕES A SEREM INCLUÍDAS NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO PARA MEDICAMENTOS
ANEXO III ALTERAÇÕES AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 43 ALTERAÇÕES A SEREM INCLUÍDAS NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO PARA MEDICAMENTOS
Agência Europeia de Medicamentos recomenda alterações à utilização da metoclopramida
 20 de dezembro de 2013 EMA/13239/2014 Corr. 1 Agência Europeia de Medicamentos recomenda alterações à utilização da As alterações destinam-se principalmente a reduzir o risco de efeitos secundários neurológicos
20 de dezembro de 2013 EMA/13239/2014 Corr. 1 Agência Europeia de Medicamentos recomenda alterações à utilização da As alterações destinam-se principalmente a reduzir o risco de efeitos secundários neurológicos
Posologia: A posologia habitual corresponde à ingestão de uma cápsula, três vezes por dia, no momento das principais refeições.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Venosmil 200 mg cápsula 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Composição por cápsula: Substância ativa: Cada cápsula contém 200 mg de
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Venosmil 200 mg cápsula 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Composição por cápsula: Substância ativa: Cada cápsula contém 200 mg de
PROCEDIMENTO DE VERIFICAÇÃO DA INSTRUÇÃO DE UM PEDIDO DE RENOVAÇÃO DA AIM SUBMETIDO POR PROCEDIMENTO NACIONAL MÓDULO 1 INFORMAÇÕES ADMINISTRATIVAS
 PROCEDIMENTO DE VERIFICAÇÃO DA INSTRUÇÃO DE UM PEDIDO DE RENOVAÇÃO DA AIM SUBMETIDO POR PROCEDIMENTO NACIONAL Nome do medicamento Nº de processo Data de Entrada Substância ativa Forma farmacêutica Dosagem
PROCEDIMENTO DE VERIFICAÇÃO DA INSTRUÇÃO DE UM PEDIDO DE RENOVAÇÃO DA AIM SUBMETIDO POR PROCEDIMENTO NACIONAL Nome do medicamento Nº de processo Data de Entrada Substância ativa Forma farmacêutica Dosagem
Anexo III. Alterações às secções relevantes do resumo das características do medicamento e folheto informativo
 Anexo III Alterações às secções relevantes do resumo das características do medicamento e folheto informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo é o resultado
Anexo III Alterações às secções relevantes do resumo das características do medicamento e folheto informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo é o resultado
Requerente Nome (de fantasia) Dosagem Forma Farmacêutica. Simvastatin Vale 20 mg/5 ml Suspension zum Einnehmen
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de do(s) medicamento(s), titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Áustria 20 mg/5
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de do(s) medicamento(s), titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Áustria 20 mg/5
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
Anexo III. Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo
 Anexo III Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo Nota: Esta adenda às secções relevantes do Resumo das Características do Medicamento e Folheto
Anexo III Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo Nota: Esta adenda às secções relevantes do Resumo das Características do Medicamento e Folheto
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tomando
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tomando
Titular da Autorização de Introdução no Mercado Nome de fantasia Dosagem Forma farmacêutica Via de administração
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 Estado-Membro
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 Estado-Membro
Anexo II. Conclusões científicas e fundamentos da recusa
 Anexo II Conclusões científicas e fundamentos da recusa 4 Conclusões científicas Resumo da avaliação científica do Levothyroxine Alapis e nomes associados (ver Anexo I) As indicações propostas para o Levothyroxine
Anexo II Conclusões científicas e fundamentos da recusa 4 Conclusões científicas Resumo da avaliação científica do Levothyroxine Alapis e nomes associados (ver Anexo I) As indicações propostas para o Levothyroxine
(Inventado) Loratadine Vitabalans 10 mg tablety. Loraxin 10 mg tablet uso oral. Loratadine Vitabalans. Loratadine Vitabalans 10 mg tabletes
 Anexo I Lista de nomes, forma farmacêutica, potência do medicamento, via de administração, requerente, titular da autorização de introdução no mercado nos Estados-Membros 1 Estado- Membro da UE/AEE República
Anexo I Lista de nomes, forma farmacêutica, potência do medicamento, via de administração, requerente, titular da autorização de introdução no mercado nos Estados-Membros 1 Estado- Membro da UE/AEE República
Anexo I. Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estadosmembros
 Anexo I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estadosmembros 1 Estadomembro UE/EEE República Checa França República Eslovaca Requerente
Anexo I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estadosmembros 1 Estadomembro UE/EEE República Checa França República Eslovaca Requerente
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5586623 5586631 Relvar Ellipta 30
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5586623 5586631 Relvar Ellipta 30
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo II. Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
 Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos 4 Conclusões científicas Resumo da avaliação científica do Furosemide Vitabalans e nomes associados
Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos 4 Conclusões científicas Resumo da avaliação científica do Furosemide Vitabalans e nomes associados
esclarecimento sobre reacções adversas INFARMED, I.P.
 Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
Anexo I. Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros
 Anexo I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros 1 Estado-membro UE/EEE Requerente nome da empresa, endereço Nome
Anexo I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros 1 Estado-membro UE/EEE Requerente nome da empresa, endereço Nome
Anexo III Resumo das características do medicamento, rotulagem e folheto informativo
 Anexo III Resumo das características do medicamento, rotulagem e folheto informativo Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas no momento
Anexo III Resumo das características do medicamento, rotulagem e folheto informativo Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas no momento
Anexo II. Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 12 Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 12 Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA
 CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
DELIBERAÇÃON.o3lto /CA/2006
 '" ""!EF Mini,tério da Saúde DELIBERAÇÃON.o3lto /CA/2006 o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que: A Comissão Europeia proferiu a Decisão
'" ""!EF Mini,tério da Saúde DELIBERAÇÃON.o3lto /CA/2006 o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que: A Comissão Europeia proferiu a Decisão
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Laurabolin 25 mg/ml, solução injetável para cães e gatos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml contém:
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Laurabolin 25 mg/ml, solução injetável para cães e gatos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml contém:
ANEXO I. Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros
 ANEXO I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros 1 Estado- Membro UE/EEE Requerente Nome (de fantasia) Dosagem Forma
ANEXO I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros 1 Estado- Membro UE/EEE Requerente Nome (de fantasia) Dosagem Forma
Segurança. Salbutamol
 Anexo II Conclusões científicas e fundamentos para a revogação ou alteração, conforme aplicável, dos termos das autorizações de introdução no mercado e explicação detalhada das diferenças relativamente
Anexo II Conclusões científicas e fundamentos para a revogação ou alteração, conforme aplicável, dos termos das autorizações de introdução no mercado e explicação detalhada das diferenças relativamente
40 mg tablet uso oral. Furosemide Vitabalans 40 mg tablet uso oral. Furosemide Vitabalans 40 mg tablet uso oral
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) requerente(s) titular(es) da(s) autorização(ões) de introdução no mercado nos
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) requerente(s) titular(es) da(s) autorização(ões) de introdução no mercado nos
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona
 Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
Aplicação de metodologias quantitativas para avaliação da relação benefício/risco: caso de estudo com rosiglitazona e pioglitazona Diogo Mendes 1,2, Carlos Alves 1,2, Francisco Batel Marques 1,2 1. Unidade
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 11 Conclusões científicas O CMDh, depois de considerar a recomendação final revista do Comité de Avaliação do Risco em Farmacovigilância (PRAC) datada de 10 de julho de
Anexo II Conclusões científicas 11 Conclusões científicas O CMDh, depois de considerar a recomendação final revista do Comité de Avaliação do Risco em Farmacovigilância (PRAC) datada de 10 de julho de
Anexo C. (alteração a medicamentos autorizados nacionalmente)
 Anexo C (alteração a medicamentos autorizados nacionalmente) ANEXO I CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS RECOMENDANDO A ALTERAÇÃO AOS TERMOS DA(S) AUTORIZAÇÃO(ÇÕES) DE INTRODUÇÃO NO MERCADO Conclusões
Anexo C (alteração a medicamentos autorizados nacionalmente) ANEXO I CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS RECOMENDANDO A ALTERAÇÃO AOS TERMOS DA(S) AUTORIZAÇÃO(ÇÕES) DE INTRODUÇÃO NO MERCADO Conclusões
Deliberação n.º 62/CD/2017
 Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
Deliberação n.º 62/CD/2017 Assunto: Alteração aos termos da AIM dos medicamentos contendo Levetiracetam, na forma farmacêutica solução oral Considerando que: a) A Agência Europeia do Medicamento (EMA)
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Nobivac Pi 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Substâncias ativas: Vírus vivo atenuado da parainfluenza
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Nobivac Pi 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Substâncias ativas: Vírus vivo atenuado da parainfluenza
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO TONSILOTREN 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 comprimido (250 mg) contém: Substâncias activas: Atropinum sulfuricum trit. D5 Hepar
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO TONSILOTREN 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 comprimido (250 mg) contém: Substâncias activas: Atropinum sulfuricum trit. D5 Hepar
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS ENTENDA MANUAL COMO E POR QUE. RELATAR EventoS AdversoS
 FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
fantasia Actocalcio D3 35 mg mg/880 IU Acrelcombi 35 mg mg/880 IU Fortipan Combi D
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), DO(S) REQUERENTE(S) TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), DO(S) REQUERENTE(S) TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS
540 UI/3ml Via intramuscular 180 UI/ml. 540 UI/3ml Via intramuscular 180 UI/ml. injectável. injectável. 180 UI/ml Solução. UMAN BIG 180 UI/ml Solução
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), DO(S) REQUERENTE(S) TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), DO(S) REQUERENTE(S) TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS
ANEXO I. Perguntas e Respostas sobre a revisão benefício-risco do piroxicam
 ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE
 GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE FLIXABI é um medicamento biológico. Para fins de rastreabilidade, é importante registar, sempre que possível, o nome de marca e o número de
GUIA DE INFORMAÇÃO DE SEGURANÇA PARA OS PROFISSIONAIS DE SAÚDE FLIXABI é um medicamento biológico. Para fins de rastreabilidade, é importante registar, sempre que possível, o nome de marca e o número de
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ustecinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5279062
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ustecinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5279062
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 16 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Paramyxo P201 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose de 0,25 ml: Substância ativa: Antigénio
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 16 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Paramyxo P201 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose de 0,25 ml: Substância ativa: Antigénio
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Nobivac Myxo-RHD liofilizado e solvente para suspensão injetável para coelhos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Nobivac Myxo-RHD liofilizado e solvente para suspensão injetável para coelhos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Anexo III. Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo
 Anexo III Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo Nota: As alterações ao Resumo das Características do Medicamento e ao Folheto Informativo
Anexo III Alterações nas secções relevantes do resumo das caraterísticas do medicamento e do folheto informativo Nota: As alterações ao Resumo das Características do Medicamento e ao Folheto Informativo
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO PG 600, pó e solvente para solução injetável para porcas e primíparas. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO PG 600, pó e solvente para solução injetável para porcas e primíparas. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
ANEXO III SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO
 ANEXO III SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas
ANEXO III SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Ma5 + Clone 30 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose: Substâncias ativas: Vírus vivo da Bronquite
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Ma5 + Clone 30 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose: Substâncias ativas: Vírus vivo da Bronquite
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV) INFORMAÇÃO DE SEGURANÇA
Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV) INFORMAÇÃO DE SEGURANÇA
Conflito de interesses
 Disclaimer Este conjunto de slides inclui informações sobre um produto Astellas ou composto que está aprovado pelos órgãos reguladores para indicações específicas. Informações de outras indicações potenciais
Disclaimer Este conjunto de slides inclui informações sobre um produto Astellas ou composto que está aprovado pelos órgãos reguladores para indicações específicas. Informações de outras indicações potenciais
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO Nobivac Rabies, suspensão injetável destinada a cães, gatos, bovinos e equinos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO Nobivac Rabies, suspensão injetável destinada a cães, gatos, bovinos e equinos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
O CMDh teve em conta a recomendação abaixo do PRAC datada de 13 de junho de 2013 relativamente aos medicamentos contendo flupirtina.
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado sujeitas a condições e explicação detalhada para as diferenças relativamente à recomendação
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado sujeitas a condições e explicação detalhada para as diferenças relativamente à recomendação
CETIRIZINE DIHYDROCHLORIDE DERMAPHARM 10 mg E DESIGNACÕES ASSOCIADAS. Cetirizine dihydrochloride Dermapharm 10 mg filmomhulde tabletten
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA FARMACÊUTICA, DOSAGEM, VIA DE ADMINISTRAÇÃO DOS MEDICAMENTOS, DO REQUERENTE TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 CETIRIZINE DIHYDROCHLORIDE
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA FARMACÊUTICA, DOSAGEM, VIA DE ADMINISTRAÇÃO DOS MEDICAMENTOS, DO REQUERENTE TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 CETIRIZINE DIHYDROCHLORIDE
Química Nuclear e Radiofarmácia
 Licenciatura em Engenharia Biomédica Química Nuclear e Radiofarmácia AC Santos - 2008/2009 Os produtos para Medicina Nuclear obedecem a regulamentos organizados em 7 vol: Vol 1 directivas que regulam os
Licenciatura em Engenharia Biomédica Química Nuclear e Radiofarmácia AC Santos - 2008/2009 Os produtos para Medicina Nuclear obedecem a regulamentos organizados em 7 vol: Vol 1 directivas que regulam os
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Porcilis Glässer, suspensão injetável para suínos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose de 2 ml:
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Porcilis Glässer, suspensão injetável para suínos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose de 2 ml:
Classificando as crises epilépticas para a programação terapêutica Farmacocinética dos fármacos antiepilépticos... 35
 Índice Parte 1 - Bases para a terapêutica com fármacos antiepilépticos Classificando as crises epilépticas para a programação terapêutica... 19 Classificação das Crises Epilépticas (1981)... 20 Classificação
Índice Parte 1 - Bases para a terapêutica com fármacos antiepilépticos Classificando as crises epilépticas para a programação terapêutica... 19 Classificação das Crises Epilépticas (1981)... 20 Classificação
Farmacovigilância LEGISLAÇÃO SANITÁRIA O QUE É FARMACOVIGILÂNCIA? INÍCIO INTRODUÇÃO INTRODUÇÃO FARMACOVIGILÂNCIA 21/11/2010
 LEGISLAÇÃO INÍCIO Deborah Masano Cavaloti Manira Georges Soufia SANITÁRIA - PROF. PALUDETTI - Farmacovigilância O risco do uso de remédios é conhecido desde a Antiguidade. Entretanto, pode-se dizer que
LEGISLAÇÃO INÍCIO Deborah Masano Cavaloti Manira Georges Soufia SANITÁRIA - PROF. PALUDETTI - Farmacovigilância O risco do uso de remédios é conhecido desde a Antiguidade. Entretanto, pode-se dizer que
Nome Dosagem Forma farmacêutica. Levothyroxine Alapis 100 microgram/ml Gotas orais, solução Via oral
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), requerente(s) nos estados-membros 1 Estado-Membro UE/EEE Bélgica Chipre Grécia Malta
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), requerente(s) nos estados-membros 1 Estado-Membro UE/EEE Bélgica Chipre Grécia Malta
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 18 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Bovilis BVD Suspensão injetável para bovinos 2. COMPOSIÇÃO
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 18 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Bovilis BVD Suspensão injetável para bovinos 2. COMPOSIÇÃO
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO VETERINÁRIO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO VETERINÁRIO Página 1 de 9 1. NOME DO MEDICAMENTO VETERINÁRIO Zuritol 50 mg/ml suspensão oral para suínos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 ml contém:
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO VETERINÁRIO Página 1 de 9 1. NOME DO MEDICAMENTO VETERINÁRIO Zuritol 50 mg/ml suspensão oral para suínos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 1 ml contém:
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco
 Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
Benepali (etanercept): Breve formação sobre medidas adicionais de minimização do risco Conjunto de diapositivos para formação de Profissionais de Saúde (PdS) Versão 2.0; Data de aprovação do Infarmed:
Cada ml de Piridoxina Labesfal, 150 mg/ml, Solução injectável, contém 150 mg de cloridrato de piridoxina como substância activa.
 FOLHETO INFORMATIVO Leia atentamente este folheto antes de tomar o medicamento. Conserve este folheto. Pode ter necessidade de o reler. Caso tenha dúvidas, consulte o seu médico ou farmacêutico. Este medicamento
FOLHETO INFORMATIVO Leia atentamente este folheto antes de tomar o medicamento. Conserve este folheto. Pode ter necessidade de o reler. Caso tenha dúvidas, consulte o seu médico ou farmacêutico. Este medicamento
ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS
 ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS Nota: As alterações ao Resumo das Características do Medicamento e aos folhetos informativos
ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS Nota: As alterações ao Resumo das Características do Medicamento e aos folhetos informativos
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 13 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Rismavac, suspensão celular congelada para galinhas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose:
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 13 1. NOME DO MEDICAMENTO VETERINÁRIO Nobilis Rismavac, suspensão celular congelada para galinhas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Por dose:
RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO
 PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
PHPT/VEL/0317/0002 Informação importante relacionada com a RECONSTITUIÇÃO, DOSAGEM E ADMINISTRAÇÃO de VELCADE (bortezomib) 3,5 mg frasco para injetáveis para utilização subcutânea (SC) e intravenosa (IV)
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ranibizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5588744
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Vetalgin 500 mg/ml solução injetável para bovinos, suínos, equinos e cães 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 14 1. NOME DO MEDICAMENTO VETERINÁRIO Vetalgin 500 mg/ml solução injetável para bovinos, suínos, equinos e cães 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI LAPATINIB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Embalagem
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MAIO HOSPITALAR DCI LAPATINIB N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM Embalagem
Notificação Espontânea de Reacções Adversas a Medicamentos
 Notificação Espontânea de Reacções Adversas a Medicamentos Manuela Pinto Milne Unidade de Farmacovigilância do Norte Faculdade de Medicina da Universidade do Porto eacçõesdversas aedicamentos (OMS) resposta
Notificação Espontânea de Reacções Adversas a Medicamentos Manuela Pinto Milne Unidade de Farmacovigilância do Norte Faculdade de Medicina da Universidade do Porto eacçõesdversas aedicamentos (OMS) resposta
Úlceras de Perna. Definição Epidemiologia Etiologia Manifestações Clínicas Diagnóstico Diferencial Tratamento 2015 ENF.
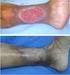 ÚLCERAS DE PERNA Úlceras de Perna Definição Epidemiologia Etiologia Manifestações Clínicas Diagnóstico Diferencial Tratamento 2015 ENF.ª MARTA MIRANDA 2 2015 ENF.ª MARTA MIRANDA 3 2015 ENF.ª MARTA MIRANDA
ÚLCERAS DE PERNA Úlceras de Perna Definição Epidemiologia Etiologia Manifestações Clínicas Diagnóstico Diferencial Tratamento 2015 ENF.ª MARTA MIRANDA 2 2015 ENF.ª MARTA MIRANDA 3 2015 ENF.ª MARTA MIRANDA
DCI Nome de fantasia Dosagem Forma farmacêutica CAUSTINERF ARSENICAL. CAUSTINERF ARSENICAL, pâte pour usage dentaire
 Anexo I Lista dos nomes, formas farmacêuticas, dosagens dos medicamentos, vias de administração, titulares das Autorizações de Introdução no Mercado nos Estados-Membros 1 Estado-Membro (no EEE) Titular
Anexo I Lista dos nomes, formas farmacêuticas, dosagens dos medicamentos, vias de administração, titulares das Autorizações de Introdução no Mercado nos Estados-Membros 1 Estado-Membro (no EEE) Titular
GLICONATO DE CÁLCIO. Blau Farmacêutica S.A. Solução Injetável 100 mg/ml. Blau Farmacêutica S/A.
 GLICONATO DE CÁLCIO Solução Injetável 100 mg/ml MODELO DE BULA PACIENTE RDC 47/09 gliconato de cálcio APRESENTAÇÃO Solução injetável contendo 100 mg de gliconato de cálcio + 5,023 mg de sacarato de cálcio
GLICONATO DE CÁLCIO Solução Injetável 100 mg/ml MODELO DE BULA PACIENTE RDC 47/09 gliconato de cálcio APRESENTAÇÃO Solução injetável contendo 100 mg de gliconato de cálcio + 5,023 mg de sacarato de cálcio
Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram
 ( ) Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação
( ) Informação de segurança muito importante para os profissionais de saúde que prescrevem, dispensam e administram Este medicamento está sujeito a monitorização adicional. Isto irá permitir a rápida identificação
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO. Excipientes: cada comprimido contém 268,36 mg de sacarose e 102,99 mg de glucose.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Xonkor 450 mg Comprimidos revestidos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido revestido contém 450 mg de extracto (sob a
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Xonkor 450 mg Comprimidos revestidos 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada comprimido revestido contém 450 mg de extracto (sob a
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Secucinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5635107
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Secucinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5635107
NANOTOP 0,5 mg Kit für ein radioaktives Arzneimittel. ROTOP-NanoHSA 0,5 mg Trousse pour préparation radiopharmaceutique
 Anexo I Lista dos nomes, forma farmacêutica, dosagem dos medicamentos, via de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro da UE/EEE
Anexo I Lista dos nomes, forma farmacêutica, dosagem dos medicamentos, via de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro da UE/EEE
Forma farmacêutica. Dosagens. Clavulanic acid 10 mg. de 10 mg de amoxicilina / 2,5 mg de ácido clavulânico/kg de peso corporal República Checa
 Anexo I Lista dos nomes, forma farmacêutica, dosagem do medicamento veterinário, espécies-alvo, via de administração, requerente/titular da Autorização de Introdução no Mercado nos Estados-Membros 1/11
Anexo I Lista dos nomes, forma farmacêutica, dosagem do medicamento veterinário, espécies-alvo, via de administração, requerente/titular da Autorização de Introdução no Mercado nos Estados-Membros 1/11
