4 Determinação do ciclofenil utilizando o fotoproduto eletroativo no eletrodo de mercúrio.
|
|
|
- Jessica Olivares Vilaverde
- 6 Há anos
- Visualizações:
Transcrição
1 4 Determinação do ciclofenil utilizando o fotoproduto eletroativo no eletrodo de mercúrio. 4.1 Estudos preliminares Estudos preliminares foram realizados para encontrar condições experimentais ótimas que permitam a determinação sensível do ciclofenil utilizando as técnicas voltamétricas específicas, seja diretamente ou a partir de um produto do ciclofenil obtido por derivatização. Desde que o eletrodo de gota pendente de mercúrio (EGPM), usado como eletrodo de trabalho, permite a utilização de três tamanhos de gota, é necessário a escolha prévia desse parâmetro. Muito embora maior sinal analítico seja obtido com maiores áreas de superfície, a gota de tamanho médio (área de superfície de 1,56 x 10-2 cm 2 ) foi utilizada por permitir a obtenção um menor desvio padrão dos resultados. Esse fato já havia concluído em um estudo anterior, realizado com o mesmo equipamento usado no presente trabalho Estudo do eletrólito suporte. O eletrólito suporte é uma solução de substância iônica cuja concentração costuma ser tipicamente entre 10 a 100 vezes maior que as demais espécies na cela eletroquímica. O eletrólito suporte deve ser eletroinativo na janela de potencial do eletrodo na qual os estudos com o analito de interesse são realizados. Além disto, o eletrólito suporte deve ser neutro, não reagindo com o analito eletroativo ou nenhum de seus subprodutos. As funções principais do eletrólito suporte são, primeiramente ser responsável por quase a totalidade da corrente iônica da cela, uma vez que ele está em grande excesso em relação às demais substâncias em solução. A alta concentração do eletrólito suporte mantém baixa a resistência da cela. Em
2 60 segundo lugar, o eletrólito suporte mantém a força iônica da solução constante, impedindo que a composição da interface entre a solução e o eletrodo mude significativamente com a corrente proveniente da reação. Como a composição desta região influi nas medidas elétricas é necessário que ela se mantenha constante durante todo o tempo da análise, fornecendo assim resultados reprodutíveis. Finalmente, o eletrólito suporte suprime a contribuição da corrente de migração (formação de um gradiente de carga elétrica) no transporte do analito para a superfície do eletrodo. A primeira etapa dessa otimização foi encontrar o melhor eletrólito suporte visando obter um sinal eletroanalítico relevante de soluções padrões de ciclofenil. Estabeleceram-se como características para escolha do melhor eletrólito correntes faradaicas estáveis, reprodutíveis e de maior intensidade para o ciclofenil. Além disso, o aparecimento no voltamograma de picos bem definidos e afastados das barreiras de oxiredução do solvente, foi fator relevante na comparação dos resultados. Na Tabela 1 é apresentado uma relação dos eletrólitos testados e os respectivos valores de correntes (três medidas sequenciais) e potencial do pico de corrente obtida por varredura de pulso diferencial (DPV). É importante salientar que tipos diferentes de eletrólito podem afetar diferentemente as condições da reação eletródica, afetando o mecanismo da interação entre a superfície do eletrodo e por conseqüência a resposta voltamétrica. Evitou-se manter as concentrações dos eletrólitos utilizados em grande excesso, pois segundo Wang e Farias 74, soluções eletródicas relativamente diluídas são mais apropriadas para se efetuar medições eletroquímicas usando técnicas de redissolução.
3 61 Tabela 1 Estudo do eletrólito de suporte para o ciclofenil no EGPM. Condições experimentais: modo DPV; tempo de deposição 0 s; velocidade de varredura 10 mv/s; potencial inicial 0,1 V; potencial final - 1,7 V; amplitude 100 mv. Eletrólito Corrente (na) E máx 1 o medida 2 o medida 3 o medida Britton Robbinson, ph ,300 V -1,306 V Britton Robbinson, ph Britton Robbinson, ph ,294 V -1,282 V NaOH 0,2 mol L HCl 0,01 mol L H2SO4 0,001 mol L KCl 0,1 mol L -1 ; ph 5, KCl 0,1 mol L -1 ; ph 11,8 (NaOH) KNO 3 0,1 mol L -1 ; ph 5,1 KNO 3 0,1 mol L -1 ; ph 11,8 (NaOH) Eletrólitos de suporte em meios ácidos, neutro e alcalino foram testados para se avaliar a influência do ph no sinal. Ficou claro que as melhores respostas de corrente (levando em consideração a 1 0 medida de corrente) foram obtidos em tampão Britton-Robbinson em ph s neutro e alcalino. Outros eletrólitos em meio básico foram testados para verificar se o fator determinante do aparecimento do sinal era o ph da solução. Porém, resposta melhor que a observada no Britton- Robbinson, que possibilitou um sinal analítico intenso na 1 a medida de corrente, não foi obtida. No entanto, ao se tentar reproduzir o sinal analítico no tampão Britton-Robbinson (ph=9 ou ph=7), em uma 2 a e 3 a medida de corrente subsequente na mesma solução, a magnitude do sinal caiu significantemente, indicando a degradação do analito nesses dois meios. A queda de corrente nas três medidas subsequentes pode ser verificado na Figura 13. Outro estudo, utilizando
4 62 a medição de corrente de soluções de ciclofenil após diferentes tempos de preparação indicou que a queda de sinal era realmente devido à degradação do analito no meio aquoso. Tentou-se então aumentar a porcentagem de solvente orgânico (metanol, etanol, acetona e acetonitrila) na composição da solução na cela, no entanto, o sinal analítico piorava, devido principalmente ao aumento do ruído. Corrente ( A) 1 a leitura 2 a leitura Potencial (V) Figura 13 Voltamogramas do ciclofenil em Britton-Robbinson ph 9, demonstrando a diminuição da corrente faradaica como o tempo. Ciclofenil (pico 2U), oxigênio dissolvido (pico 1U). Em um trabalho publicado por Dwivedi 35, esse problema da degradação é contornado por meio de um produto derivado da degradação ácida do ciclofenil para fazer a sua determinação espectrofométrica. No entanto, este produto de derivatização ácida não se mostrou eletroativo no EGPM.
5 Estudo do efeito da irradiação e do ph. A incidência de radiação eletromagnética na região do ultravioleta sobre uma substância pode mudar as suas características químicas por meio da indução de reações fotoquímicas. Esta mudança na identidade das substâncias, e consequentemente nas suas propriedades, é usada não somente para a determinação direta desses analitos de interesse, mas também utilizados para aumentar a seletividade da determinação de um analito específico por meio da eliminação do sinal de substâncias interferentes. Cavicchioli e colaboradores 75 revisaram a aplicação de radiação UV como pré-tratamento em métodos analíticos para compostos inorgânicos em diversas amostras, por diversas técnicas analíticas. No caso das técnicas voltamétricas, existe grande sensibilidade à presença de matéria orgânica dissolvida que causam interferência tanto pela geração de sinais espúrios quanto pela possibilidade de interação com o analito formando adutos eletroquimicamente inertes. Nesse caso, o tratamento UV tem sido usado com sucesso para minimização de interferências por meio da degradação da matéria orgânica. No entanto, esta não é a única aplicação da radiação UV como artifício em química analítica. A sua utilização na derivatização da amostra, conversão química do composto em uma forma mais apropriada para uma detecção específica, também vem sendo muito utilizada. Diversos trabalhos a respeito tendo sido publicados que tiram vantagem das propriedades espectroscópicas (eficiência quântica luminescente e absorptividade molar) e eletroquímicas (propriedades oxiredutoras) desses derivados mais atrativas do ponto de vista analítico. Na busca de um derivado do ciclofenil, que fosse estável durante o tempo necessário para se realizar a determinação voltamétrica indireta do analito, o tratamento fotoquímico com radiação UV de soluções padrões do analito foi feito no reator disponível em nosso laboratório (descrito no capítulo 3). A irradiação do ciclofenil gerou um composto estável nas condições de trabalho na cela eletroquímica, permitindo a obtenção sucessiva de sinal sem a degradação observada anteriormente. A influência do tempo de irradiação sobre a estabilidade do derivado fotoquímico bem como sobre a intensidade da corrente de pico estão apresentadas na Tabela 2 Este fotoproduto possui potencial de pico
6 64 idêntico ao ciclofenil. Leituras espectrométricas na região do UV-visível da solução antes e depois de ser irradiada indicam a derivatização do ciclofenil. Esta alteração (Figura 14) é indicada pelo alargamento da região de absorção, pelo deslocamento do máximo de absorção (de 216 para 242 nm) e pelo aumento do máximo de absorção (de 1563 para u.a.). Absorvância (ua) A B λ (nm) Figura 14 - Espectros de absorção molecular na região do uv-visível para A) ciclofenil semirradiação e B) ciclofenil irradiado. Condições: meio metanol/água 1:1, ciclofenil 5,0 x 10-5 mol L -1. Tabela 2 Efeito do tempo de irradiação UV no sinal de uma solução de ciclofenil (quatro medidas subsequentes do fotoproduto do ciclofenil). Condições experimentais: concentração de ciclofenil 1,0 x 10-6 mol L -1 ; tempo de deposição 30 s; incremento = 10 mv; frequência 100 Hz; amplitude 250 mv. Tempo (min) Sinal (na) 1 0 medida 2 0 medida 3 0 medida 4 0 medida Sinal médio (na) Desvio padrão (na) Desvio padrão relativo (%) ,0 50,7 2, , , ,0 42 1, , , , ,1
7 65 Baseado nos resultados da Tabela 2, escolheu-se o tempo de 45 minutos como ideal para se irradiar a solução e dar prosseguimento aos demais experimentos. Um estudo da estabilidade do fotoproduto e da magnitude do sinal como função do ph do eletrolítico foi feito nos intervalos de ph entre 6 e 11. A variação do ph foi feito pela adição de solução de NaOH 10% ao eletrólito suporte (Britton-Robbinson) A influência do ph sobre a corrente de pico está representado na Figura corrente do pico (na) ph Figura 15 - Influência do ph sobre o sinal de uma solução de ciclofenil. Condições experimentais: ciclofenil 1,0 x 10-6 mol L -1 ; tempo de deposição 30 s; incremento 10 mv; frequência 100 Hz, amplitude 250 mv, modo de varredura de potencial SWV. Baseado nos resultados, e buscando a maior sensibilidade para a determinação do ciclofenil, escolheu-se trabalhar utilizando como eletrólito suporte a solução de Britton-Robbinson ph 9,0. Por coincidência esse ph é o mesmo ph no qual se fez o teste do tempo de irradiação.
8 Voltametria de pulso diferencial (DPV) Estudo do potencial de deposição Estudos mostraram que o fotoproduto do ciclofenil pode ser acumulado no eletrodo de mercúrio, possibilitando que o mesmo seja pré-concentrado, permitindo que uma maior sensibilidade nas determinações analíticas seja alcançada. O potencial de deposição do analito (também chamado de potencial de acumulação) é o potencial que se aplica ao eletrodo de trabalho antes de se iniciar as medidas voltamétricas. Como a aplicação deste potencial altera o valor da capacitância da dupla camada, altera também a capacidade que o analito tem de adsorver no eletrodo de trabalho, seja esta uma adsorção específica ou não. A etapa de pré-concentração é realizada com a solução sob agitação para que aumentar o transporte de massa do analito (no caso o fotoproduto do ciclofenil) da solução para o eletrodo, de forma a maximizar a quantidade de material depositado. Para voltametria de redissolução catódica (varredura em direção a potenciais mais negativos), o potencial de deposição é mais positivo que o potencial de pico, e normalmente escolhe-se um potencial de apenas 0,2 ou 0,3 V mais positivo que o potencial de pico para se minimizar a possibilidade de que interferentes sejam adsorvidos concomitantemente no eletrodo de trabalho. Essa pequena diferença de potencial é mantida também para se obter um ganho na velocidade da análise. Visando encontrar o potencial ótimo para a cumulação do fotoproduto do ciclofenil, utilizou-se o modo DPV de varredura com a variação de potencial de acumulação de 1,0 a 0,2 V, fixando as demais condições experimentais (concentração de analito, velocidade de varredura e amplitude do pulso). O resultado deste estudo está representado na Figura 16. Baseado nesses resultados, escolheu-se o potencial de acumulação de 0,600 V para o modo de varredura por pulso diferencial.
9 corrente do pico (na) ,0-0,8-0,6-0,4-0,2 potencial de dposição (V) Figura 16 Influência do potencial de deposição sobre o sinal eletroanalítico de uma solução de ciclofenil tratado com radiação UV. Condições experimentais: Ciclofenil 2,2 x 10-5 mol L -1 irradiado por 45 min; tempo de deposição 30 s; velocidade de varredura 10 mv/s; amplitude 100 mv.
10 Estudo do tempo de deposição O tempo de deposição do analito no eletrodo de trabalho (EGPM) é um parâmetro a ser determinado experimentalmente. Caso a substância em estudo possua uma enorme tendência de sofrer adsorção no mercúrio, sem saturação da superfície do mesmo, o tempo de deposição será relativamente alto (podendo atingir valores de até 20 ou 30 minutos), possibilitando um incrível aumento da quantidade do analito na gota de mercúrio. Porém, em geral, esse tempo de deposição não passa de alguns poucos minutos. Esse processo acarreta uma préconcentração da espécie em estudo com consequente aumento da corrente de pico quando da redissolução da espécie para a solução. 600 corrente de pico (na) ,0 0,5 1,0 1,5 2,0 tempo (min) Figura 17 - Influência do tempo de deposição sobre o sinal de uma solução de ciclofenil irradiado. Condições experimentais: velocidade de varredura 10 mv/s; amplitude = 100 mv; potencial de deposição -0,600 V; concentração de ciclofenil 6.6 x O estudo do tempo de deposição foi feito fixando os demais parâmetros instrumentais (amplitude de pulso, concentração do analito, velocidade de varredura e potencial de deposição) e variando o tempo de deposição. A Figura 17 representa o resultado deste estudo.
11 69 A Figura 17 sugere que o fotoproduto do ciclofenil não possui uma tendência muito grande de adsorver na gota de mercúrio, pois com apenas 30 s de deposição o valor da corrente de pico atingiu um patamar máximo. Isso sugere que a gota de mercúrio já estava saturada com ciclofenil, não adiantando usar um tempo de deposição maior. Por este motivo utilizou-se o tempo de 30 s como tempo de deposição.
12 Estudo da influência da amplitude A voltametria por pulso diferencial é caracterizada pela aplicação de potenciais de mesma intensidade (mesma amplitude) sobrepostos a uma rampa de potencial crescente. Estes pulsos costumam ter intensidade de 25 ou 50 mv, ocorrendo em intervalos que variam de 0,5 a 5 segundos 51. A amplitude de 100 mv também é usada, porém costuma acarretar perda na resolução do sinal. A influência do valor da amplitude pode ser entendida pela equação derivada por Lund e Onshus 83 para o valor da corrente de pico (i pc ) medida por voltametria de pulso diferencial no eletrodo de gota pendente de mercúrio. i pc = kn 2 r EU 1/2 t d C b (26) Sendo E a amplitude do potencial aplicado, (k uma constante, n é o número de elétrons envolvido no processo, U é a velocidade de agitação, t d é o tempo de deposição e C b é a concentração do composto). Para valores altos de amplitude esta equação não é mais válida, pois ocorre perda da linearidade da corrente de pico em função da amplitude. Deve haver um compromisso quando se escolhe a melhor amplitude do potencial, pois enquanto valores altos de amplitude implicam em um ganho de sensibilidade, valores baixos de amplitude implicam em um ganho em definição do pico 51. Foram testadas as amplitudes de 25, 50 e 100 mv para o modo de pulso diferencial, Figura 18 apresenta o resultado deste estudo.
13 corrente de pico (na) amplitude (mv) Figura 18 Influência da amplitude sobre o sinal lido de uma solução de ciclofenil irradiado. Condições experimentais: concentração de ciclofenil 6.6 x 10-6 mol L -1 ; velocidade de varredura 10 mv.s -1, tempo de deposição 30 s; potencial de deposição 0,600 V. Como as larguras dos pulsos se mantiveram praticamente constante (largura de pico na meia altura), Figura 19, a resolução do pico não foi afetada. Assim, escolheu-se o valor de 100 mv para a amplitude do potencial. 100 largura a meia altura do pico (V) amplitude (mv) Figura 19 Largura do pico a meia altura em função da amplitude utilizada.
14 Estudo da influência da velocidade de varredura A velocidade de varredura típica para DPV compreende o intervalo de 2 a 10 mv s -1. Esta velocidade relativamente lenta (se comparada com a técnica de voltametria de onda quadrada, cujas velocidades de varredura típicas estão entre 100 a 1000 mv s -1 ) é necessária para impedir que a rampa de potencial não sofra variações drásticas durante o tempo de vida do pulso 51. A Figura 20 apresenta o resultado das leituras de corrente de pico em função da velocidade de varredura. O maior valor de corrente (n = 3, 95%) foi obtido para a velocidade de varredura de 10 mvs -1. Com o objetivo de conseguir a maior sensibilidade para esta técnica, utilizou-se esta velocidade para os demais experimentos corrente ded pico (na) velocidade de varredura (mv s -1 ) Figura 20 - Efeito da velocidade de varredura sobre a leitura de uma solução de ciclofenil irradiado. Condições: concentração de ciclofenil 1,35 x 10-5 mol L -1, tempo de deposição de 30 s amplitude de 100 mv. Informações sobre o mecanismo de controle do processo de oxiredução podem ser obtidas com base no estudo da velocidade de varredura para o modo de pulso diferencial 84. Para processos controlados por adsorção existe uma relação linear entre a corrente e a velocidade de varredura. A Figura 21 apresenta esta relação obtida experimentalmente.
15 r 2 = 1 corrente de pico (na) velocidade de varredura (mv s -1 ) Figura 21 Relação entre a corrente de pico e a velocidade de varredura. Condições: concentração de ciclofenil irradiado 1,35 x 10-5 mol L -1, tempo de deposição de 30 s amplitude de 100 mv. Pela análise deste comportamentos (Figura 21), pode-se observar que uma relação linear ( r 2 = 1) existe entre a corrente e a velocidade de varredura, o que sugere que exista um processo adsortivo controlando o processo de oxiredução. Além das informações sobre este mecanismo de controle do processo de oxiredução, o estudo da velocidade de varredura também fornece informações sobre a reversibilidade do processo oxiredução. Quando o processo é reversível o potencial de redução independe da velocidade de varredura, uma vez que não há contribuição cinética, o potencial da reação pode ser determinado apenas por fatores termodinâmicos, no caso, a equação de Nernst. Para um comportamento Nernstisiano, a relação entre o logarítimo da velocidade de varredura e o potencial de pico deve ser uma linha reta sem inclinação, pois como as velocidades de redução e reoxidação são iguais, não há nenhuma contribuição cinética e o potencial é dado apenas pela equação de Nernst. No entanto, este comportamento não foi verificado (Figura 22), não houve na verdade nenhuma relação entre o logarítimo da velocidade e potencial de pico, o que sugere, a princípio, que houve algum desvio do comportamento ideal. A questão da reversibilidade então poderá ser desvendada utilizando informações obtidas a partir de experimentos com a voltametria cíclica e com a voltametria de onda quadrada.
16 74 potencial do pico (V) -1,256-1,258-1,260-1,262-1,264-1,266-1,268-1,270-1,272-1,274-1,276 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 log v Figura 22 Influência da velocidade de varredura sobre o potencial do pico. Outra informação interessante sobre o mecanismo do processo redox que pode ser obtida pela voltametria de pulso diferencial é sobre a quantidade de elétrons envolvida no processo, esta informação é obtida com base na largura do pico a meia altura (W 1/2 ), de acordo com a seguinte equação: 3,52RT W1 / 2 = (27) nf A Figura 23 representa o voltamograma no modo pulso diferencial para uma solução de ciclofenil irradiada, com base neste voltamograma, o número de elétrons envolvidos no processo redox é 1.
17 75 Figura 23 voltamograma no modo de pulso diferencial de solução irradiada de ciclofenil. Condições: concentração de ciclofenil = 1,35 x 10-5 mol L -1, tempo de deposição 30 s, velocidade de varredura 10 mv/s.
18 Parâmetros analíticos de mérito para DPV Tendo sido estabelecidas as melhores condições experimentais para a determinação ciclofenil, por meio de seu fotoproduto estável, utilizando voltametria adsortiva de redissolução catódica no modo de varredura de pulso diferencial, foi construída uma curva analítica para se estabelecer os parâmetros analíticos de mérito. Esta curva analítica é apresentada na Figura y = 220,95434x - 68,02964 r 2 = 0, corrente de pico (na) [ciclofenil] (10-6 mol L -1 ) Figura 24 curva analítica para o modo de pulso diferencial nas condições otimizadas. Os dados utilizados para construir esta curva provêm dos valores médios de três leituras para cada valor de concentração. A melhor reta entre os pontos experimentais foi traçada através do método dos mínimos quadrados 85. O limite de detecção (L.D.) foi de 8,3 x 10-8 mol L -1, o L.D. foi estimado usando o critério de 3Sb/m, sendo Sb o desvio padrão de 10 leituras do branco e m é a inclinação da curva analítica. O limite de quantificação foi de 2,7 x 10-7 mol L -1. Para 20 µl de amostra, o limite de detecção absoluto foi de 0,6 pg, a faixa linear dinâmica se estendeu por 2 ordens de grandeza, e o coeficiente de correlação (r 2 ) foi de 0,99841.
19 Voltametria de onda quadrada (SWV) Estudo do potencial de deposição O estudo do melhor potencial de deposição para o modo de varredura de onda quadrada (SWV) foi feito da mesma forma que para o modo DPV, fixandose as demais condições. Neste caso, além da concentração e amplitude, fixou-se também o incremento de potencial e a frequência de aplicação dos pulsos, parâmetros exclusivos da varredura SWV. A Figura 25 representa o estudo do potencial de acumulação para o modo de varredura SWV. Para SWV, verificou-se que o potencial de 0,900 V mostrou-se melhor para a pré-concentração do fotoproduto do ciclofenil no eletrodo de mercúrio corrente de pico (na) ,1-1,0-0,9-0,8-0,7-0,6 potencial de deposição (V) Figura 25 - Efeito do potencial de deposição sobre a corrente lida de uma solução irradiada de ciclofenil. Condições experimentais: concentração de ciclofenil 1,0 x 10-6 mol L -1, tempo de deposição 30 s; frequência 100 Hz; incremento = 10 mv.
20 Estudo da influência do incremento da varredura. A voltametria de onda quadrada é uma técnica onde se aplica altos valores de amplitude e de velocidade. A velocidade desta técnica é dada pelo produto f E s, sendo f a frequência de aplicação dos pulsos de potenciais e E s o incremento da varredura. Este incremento indica o quanto o potencial irá variar (em volts) por unidade de tempo (segundo). Os valores típicos de incremento de varredura são de 2, 4, 6, 8 e 10 mv. Com o aumento do incremento de varredura costuma haver um aumento da sensibilidade da técnica, porém, em geral existe a contrapartida da perda na resolução do pico 86. A Figura 26 representa o estudo da influência do incremento da varredura. Apesar do aumento da sensibilidade com o aumento da varredura, escolheu-se o valor de 2 mv como incremento, pois houve um significativo alargamento do pico, o que acarreta uma perda de resolução muito grande, como pode ser visualizado na Figura corrente de pico (na) incremento de potencial (mv) Figura 26 - Efeito do incremento da varredura para a leitura de uma solução de ciclofenil. Condições experimentais: concentração de ciclofenil 6,9 X 10-6 mol L -1 tempo de deposição de 30 s, amplitude de potencial de 250 mv, frequência de 100 Hz.
21 79 A B Figura 27 Voltamogramas da mesma solução de ciclofenil, com incremento de (A)2 e (B) 10 mv. A reação da redução que ocorre na superfície do eletrodo de mercúrio (Equação 1) implica na formação de um novo composto, este novo composto, que é o produto da reação de redução, pode competir com o reagente (a forma inicialmente oxidada do fotoproduto do ciclofenil) pela superfície do eletrodo de mercúrio, se adsorvendo a ele, ou pode não sofrer nenhuma interação com o mesmo nas condições de trabalho. Esta informação sobre o mecanismo do processo redox pode ser obtida do estudo do incremento da varredura 87, ao se relacionar com a corrente de pico normalizada (φ). Quando reagente e produto adsorvem na superfície do eletrodo de trabalho, o valor de φ não depende da variação do incremento da varredura, porém, quando apenas o reagente sofre adsorção, a relação entre a corrente de
22 80 pico normalizada e o incremento da varredura é linear, independente da reversibilidade da reação redox. (φ=k E).Sendo E o incremento de potencial. A corrente de pico normalizada é definida como: i π φ = (28) o nfqa 2 fd A Sendo φ a corrente de pico normalizada, q a área do eletrodo, A o a concentração do reagente no seio da solução e D A o coeficiente de difusão. Como no estudo do incremento da varredura os valores de q, A o, D A e f se mantiveram constante (além dos valores de n, π e F que são constantes) pode-se dizer que a corrente de pico normalizada é diretamente proporcional a corrente do pico. A Figura 26 indica uma relação linear entre o incremento da varredura e o sinal, o que indica que o produto da reação de redução do fotoproduto do ciclofenil não adsorve no eletrodo de trabalho.
23 Estudo da influência da freqüência A freqüência indica a quantidade de pulsos de potencial que serão aplicados por segundos ao eletrodo de trabalho. Segundo revisão de Sousa 49 algumas informações sobre o mecanismo do processo redox podem ser obtidas pelo estudo da influência da freqüência. Além disso, como os demais parâmetros experimentais que estão sendo otimizados, a sensibilidade da técnica também depende deste fator. Para um processo de oxiredução reversível, a corrente de pico varia linearmente com a raiz quadrada da freqüência. Já, para um processo irreversível, a corrente varia linearmente com a freqüência, e para um processo quasereversível, a corrente de pico aumenta, porém não possui nenhuma relação linear com a freqüência. As relações experimentalmente obtidas entre a corrente do pico e a frequência de aplicação dos potenciais estão representados na Figura r 2 = 0, corrente de pico (na) ,0 6,5 7,0 7,5 8,0 8,5 9,0 9,5 10,0 10,5 raíz f Figura 28 Relações experimentais obtidas entre a corrente do pico e a raíz quadrada da frequência de aplicação do pulso de potencial para uma solução de ciclofenil. Condições experimentais: concentração de ciclofenil 6,88 x 10-6 mol L -1, tempo de deposição de 30 s, incremento de varredura de 2 mv.
24 82 Pela Figura 28 observa-se uma relação linear entre a corrente de pico e a raiz quadrada da frequência de aplicação do pulso de potencial, o que sugere uma reação reversível. Buscando a maior sensibilidade analítica em função da maior corrente escolheu-se a freqüência de 100 Hz para se dar procedimento aos demais experimentos.
25 Estudo da influência da amplitude Na técnica SWV, amplitudes de pulso muito mais altas do que as aplicadas em DPV podem ser usadas sem que haja perda de linearidade da técnica, e sem substancial perda de resolução no pico. A Figura 29 representa o estudo da influência da amplitude. Por esta figura pode-se observar que houve um comportamento linear no aumento da corrente de pico em função do aumento da amplitude. Tal comportamento é típico de sistemas de oxirredução reversíveis 49. Buscando a maior sensibilidade da técnica, a amplitude utilizada no decorrer dos experimentos foi a de 250 mv corrente de pico (na) r 2 =0, amplitude (mv) Figura 29 Efeito da amplitude para uma solução irradiada de ciclofenil. Condições experimentais: tempo de deposição 30 s; frequência 100 Hz; incremento 10 mv; concentração de ciclofenil 3,0 x 10-6 mol L -1.
26 Parâmetros analíticos de mérito para SWV Tendo sido estabelecido as melhores condições experimentais para a determinação do ciclofenil por voltametria adsortiva de redissolução catódica no modo SWV, foi construída uma curva analítica para se estabelecer os parâmetros analíticos de mérito. A curva de calibração mostrada na Figura 30 foi usada para se estimar alguns desses parâmetros y = 5249,725x + 325,86934 r 2 = 0,99883 corrente de pico (na) [Ciclofenil] 10-6 mol L -1 Figura 30 curva analítica para determinação de ciclofenil nas condições otimizadas para onda quadrada. Os dados utilizados para a construir esta curva provêm dos valores médios de três leituras para cada valor de concentração. A melhor reta entre os pontos experimentais foi traçada através do método dos mínimos quadrados 85. O limite de detecção (LD) foi estimado usando o critério de 3Sb/m. O limite de detecção foi de 4,3 x 10 8 mol L -1, o limite de detecção absoluto para 20 µl de amostra foi 0,3 pg. O limite de quantificação foi de 1,4 x 10-7 mol L -1, a faixa linear dinâmica se estendeu por 2 ordens de grandeza.
27 Voltametria cíclica Algumas informações sobre a reversibilidade do sistema podem ser obtidas dos estudos com voltametria cíclica. Os resultados aqui apresentados foram obtidos por voltametria cíclica stair case, sem tempo de deposição, com um intervalo de equilíbrio de 30 segundos, e o potencial foi varrido de 0,800 a 1,600 V. O objetivo deste estudo com voltametria cíclica foi o de obter algumas informações sobre a reversibilidade do sistema. A Figura 31 representa um voltamograma cíclico para uma solução irradiada de ciclofenil. Figura 31 voltamograma cíclico para uma solução irradiada de ciclofenil Foi constatada a presença de um pico catódico, e quando o potencial é revertido, observa-se a presença de um pico anódico quase simétrico, indicando a reversibilidade do processo. Dos resultados provenientes das otimizações para voltametria DPV e SWV já se determinou que o composto possui um comportamento reversível, com adsorção apenas do reagente, e não do produto da reação de oxiredução, e que o processo de redução do composto apresenta a transferência de apenas 1 elétron. Alguns experimentos foram realizados para se comprovar este comportamento, agora pela voltametria cíclica.
28 86 Para um processo reversível, a corrente de pico varia linearmente com a raiz quadrada da velocidade de varredura (observado, Figura 32), possui uma diferença de potencial entre o pico catódico e anódico de aproximadamente 59 mv para um processo que envolve a transferência de 1 elétron (observado, Figura 31), os potenciais de pico não apresentam nenhuma dependência com a velocidade de varredura (não observado), e possui uma relação de intensidade de pico catódico / intensidade de pico anódico igual a 1, independente da velocidade de varredura, fato este também não observado. Pelo resultado da voltametria cíclica, não se pode confirmar o comportamento reversível do composto, no entanto, vale ressaltar, que efeitos distorcivos sobre o voltamograma podem ocorrer, fazendo com que o composto não se comporte idealmente. Entre estes efeitos existe o causado pelas reações químicas acopladas, o sobrepotencial causado pela resistência não compensada (R u ) da solução e a capacitância da dupla camada (C d ). O sistema do potenciostado com três eletrodo foi projetado para minimizar a queda ôhmica do potencial causada a esta resistência, no entanto existe sempre uma parcela desta resistência que não é compensada 84. Na prática, os efeitos de R u são de achatar a onda e deslocar o potencial de redução na direção catódica, desta forma os valores do potencial do pico, e a razão entre o pico catódico e anódico passem a variar com a velocidade de varredura, mesmo quando o composto apresenta um comportamento nernstisiano. Isto poderia explicar o comportamento do fotoproduto do ciclofenil nas condições de trabalho.
29 r 2 = 0,99892 corrente do pico (na) raiz v Figura 32 Relação entre a raíz quadrada da velocidade de varredura e a corrente do pico.
30 Determinação do ciclofenil utilizando o seu fotoproduto estável Determinação em formulações farmacêuticas Para se testar a aplicabilidade do método voltamétrico para a determinação do ciclofenil a partir do sinal de seu fotoproduto estável em formulações farmacêuticas, utilizou-se o medicamento Menopax para se realizar o teste de recuperação. Para a determinação, a amostra foi pulverizada (pelo menos 5 comprimidos). Uma alíquota desse material foi dissolvida em metanol, filtrada e avolumada também com metanol. Alíquotas destas soluções foram tratadas com radiação UV e usadas na determinação do princípio ativo por voltametria adsortiva com redissolução catódica, com varredura de potencial no modo de onda quadrada nas condições otimizadas. O modo SWV foi pois segundo os testes preliminares este modo se mostrou mais sensível para a determinação do ciclofenil, como pode ser visualizado pela Figura SWV DPV corrente de pico (na) [ciclofenil] x 10-6 mol/l Figura 33 Comparação ente as curvas analíticas obtidas no modo DPV e SWV. As amostras foram irradiadas pelo mesmo período de tempo que as soluções padrões usadas na curva de calibração. As determinações foram feitas
31 89 para três soluções preparadas com alíquotas diferentes de massa de comprimidos pulverizados e lida em triplicata em três dias diferentes. As leituras foram realizadas utilizando-se curvas analíticas preparadas em uma cela separada, e os resultados destas determinações estão expostos na Tabela 3, na forma de percentual recuperado com base na concentração de analito na solução da amostra, que por sua vez, foi calculada levando em consideração na massa de referência descrita na bula do medicamento. Tabela 3 Resultado da recuperação do ciclofenil em medicamentos. Amostra Recuperação (%) media Desvio padrão 1 105,5 99,2 106,5 103,7 3, ,5 102,7 95,5 97,6 4, ,8 100,7 101,5 3,37 Tendo em vista a excelente resultado em termos de recuperação do analito, mostrado na Tabela 3, pode-se concluir que o método pode ser aplicado para a determinação do ciclofenil em formulações farmacêuticas. A repetibilidade dos resultados também foi bastante satisfatória, levando em consideração os desvios padrões para a mesma amostra analisadas em dias diferentes. Pela comparação do valor recuperado com o valor de referência também pode-se concluir que o método é livre de interferência dos componentes da matriz da formulação. Segundo a bula deste medicamento, cada comprimido (massa em torno de 300 mg) contém 200 mg do principio ativo e o restante da formulação é formada por excipientes (amido de milho, celulose microcristalina, estearato de magnésio, glicolato de amido sódico, polvidona e manitol). Destes, apenas o manitol é solúvel em metanol. Para se avaliar o potencial efeito interferente do manitol, em uma cela contendo 4,0 x 10-6 mol L -1 de ciclofenil foi adicionado quantidades de manitol (irradiado nas mesmas condições que o padrão) até a razão molar de 1:1 e constatou-se que pelo menos até este valor o manitol não interfere no sinal de redução do ciclofenil.
32 Determinação em urina. Amostras de urina, obtidas por voluntários do próprio laboratório, foram fortificadas com ciclofenil e submetidas à irradiação UV para a posterior análise. Testou-se primeiro a determinação direta da amostra, sem nenhum pré-tratamento, exceto a irradiação UV, que também foi utilizado nas soluções padrões de ciclofenil preparadas em metanol. Com esse procedimento, observou-se uma queda do sinal do fotoproduto do ciclofenil em urina em torno de 40% quando comparado com o sinal de solução padrão de mesma. Este comportamento indica a existência de interferência de matriz. Com o intuito de se eliminar esta interferência, utilizou-se o procedimento de clarificação da amostra ou clean-up com sulfato de amônio que serve para precipitar parte das proteínas presentes na urina. A análise do sobrenadante resultante do processo de clarificação, descrito no capítulo 3, indicou que este procedimento não reduz a interferência de matriz. Assim, decidiu-se realizar as determinações do ciclofenil com alíquotas de urina enriquecida sem nenhum tratamento prévio. Para corrigir a interferência da matriz de urina, utilizou-se o procedimento de adição de analito. As análises foram então realizadas fazendo adição de 200 µl da amostra de urina, seguido de adição de porções de 20 µl de solução padrão de ciclofenil (5,2 x 10-4 mol L -1 ). Assim como na determinação em formulações farmacêuticas, analisou-se três soluções de amostra, cada uma sendo analisada em triplicata em dias diferentes. Os resultados destas análises estão expressas na Tabela 4 na forma de percentual recuperado. Tabela 4 - Resultado da recuperação do ciclofenil em urina enriquecida Amostras Recuperação (%) media Desvio padrão ,5 2, ,1 3, ,1 2,03
5 Determinação da primaquina em ECV.
 5 Determinação da primaquina em ECV. 5.1 Estudos preliminares Tentou-se inicialmente realizar a determinação direta da primaquina no EGPM. Apesar de já existirem vários trabalhos publicados na literatura
5 Determinação da primaquina em ECV. 5.1 Estudos preliminares Tentou-se inicialmente realizar a determinação direta da primaquina no EGPM. Apesar de já existirem vários trabalhos publicados na literatura
5.1. Estudos preliminares e otimização.
 106 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
106 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
5.1. Estudos preliminares e otimização.
 105 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
105 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto
 122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Nas determinações voltamétricas de espécies químicas tais como Cd (II) e Pb (II), o ajuste das
122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Nas determinações voltamétricas de espécies químicas tais como Cd (II) e Pb (II), o ajuste das
6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto
 122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Ao se ajustar a concentração de Bi (III) para a formação in situ do eletrodo de bismuto (BiFE)
122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Ao se ajustar a concentração de Bi (III) para a formação in situ do eletrodo de bismuto (BiFE)
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
Sendo O a forma oxidada do analito e R a forma reduzida.
 2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
3 Resultado e discussão
 3 Resultado e discussão 3.1 Otimização das condições experimentais A seletividade e a sensibilidade da resposta analítica em um método voltamétrico dependem das condições experimentais e instrumentais
3 Resultado e discussão 3.1 Otimização das condições experimentais A seletividade e a sensibilidade da resposta analítica em um método voltamétrico dependem das condições experimentais e instrumentais
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
ESTUDOS POLAROGRÁFICOS DO HERBICIDA IMAZAQUIN
 ISSN 1413-6244 Empresa Brasileira de Pesquisa Agropecuária Centro Nacional de Pesquisa e Desenvolvimento de Instrumentação Agropecuária Ministério da Agricultura e do Abastecimento Rua XV de Novembro,
ISSN 1413-6244 Empresa Brasileira de Pesquisa Agropecuária Centro Nacional de Pesquisa e Desenvolvimento de Instrumentação Agropecuária Ministério da Agricultura e do Abastecimento Rua XV de Novembro,
Variável (número da variável) Símbolo para variável (-) (+) Emulsão com Triton X-100 Oxigênio (1) a X 1 sem com Quantidade de amostra (2)
 95 5 Resultados e discussão: Comparação entre dois procedimentos de emulsificação para a determinação de Cr, Mo, V e Ti em óleo diesel e óleo combustível por ICP OES utilizando planejamento fatorial Neste
95 5 Resultados e discussão: Comparação entre dois procedimentos de emulsificação para a determinação de Cr, Mo, V e Ti em óleo diesel e óleo combustível por ICP OES utilizando planejamento fatorial Neste
6 Método para a determinação seletiva de CIP na presença de GAT ou MOX 6.1 Comentário preliminar
 129 6 Método para a determinação seletiva de na presença de GAT ou MOX 6.1 Comentário preliminar Nesse segundo estudo de caso, decidiu-se desenvolver um método fosforimétrico seletivo para a determinação
129 6 Método para a determinação seletiva de na presença de GAT ou MOX 6.1 Comentário preliminar Nesse segundo estudo de caso, decidiu-se desenvolver um método fosforimétrico seletivo para a determinação
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
Desenvolvimento e comparação de métodos voltamétricos para a determinação de ciclofenil e primaquina em medicamentos e em urina
 Wagner Felippe Pacheco Desenvolvimento e comparação de métodos voltamétricos para a determinação de ciclofenil e primaquina em medicamentos e em urina Dissertação de Mestrado Dissertação apresentada como
Wagner Felippe Pacheco Desenvolvimento e comparação de métodos voltamétricos para a determinação de ciclofenil e primaquina em medicamentos e em urina Dissertação de Mestrado Dissertação apresentada como
ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA. Resumo 800
 ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA Resumo 800 Este trabalho objetivou a caracterização eletroquímica do carrapaticida fipronil, por meio da técnica de
ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA Resumo 800 Este trabalho objetivou a caracterização eletroquímica do carrapaticida fipronil, por meio da técnica de
4 Resultados: Desenvolvimento de método espectrofluorimétrico para determinação de tetrabenazina
 4 Resultados: Desenvolvimento de método espectrofluorimétrico para determinação de tetrabenazina 4.1. Estudos preliminares A TBZ é uma substância levemente solúvel em água, porém, solúvel em metanol, razão
4 Resultados: Desenvolvimento de método espectrofluorimétrico para determinação de tetrabenazina 4.1. Estudos preliminares A TBZ é uma substância levemente solúvel em água, porém, solúvel em metanol, razão
3º - CAPÍTULO: RESULTADOS e DISCUSSÃO
 3º - CAPÍTUL: RESULTADS e DISCUSSÃ 39 40 3 3.1 - Estudo de Dependência do ph na Formação do Filme 3.1.1 - Comportamento Eletroquímico de Ácido 4-HFA Voltametria cíclica em solução aquosa contendo o par
3º - CAPÍTUL: RESULTADS e DISCUSSÃ 39 40 3 3.1 - Estudo de Dependência do ph na Formação do Filme 3.1.1 - Comportamento Eletroquímico de Ácido 4-HFA Voltametria cíclica em solução aquosa contendo o par
Espectrofotometria UV-Vis. Química Analítica V Mestranda: Joseane Maria de Almeida Prof. Dr. Júlio César José da Silva
 Espectrofotometria UV-Vis Química Analítica V Mestranda: Joseane Maria de Almeida Prof. Dr. Júlio César José da Silva Relembrando... Conceitos Comprimento de onda (λ): distância entre dois pontos na mesma
Espectrofotometria UV-Vis Química Analítica V Mestranda: Joseane Maria de Almeida Prof. Dr. Júlio César José da Silva Relembrando... Conceitos Comprimento de onda (λ): distância entre dois pontos na mesma
AMOSTRA METODOLOGIA ANALITOS TÉCNICA Óleo diesel Emulsificação em Cr, Mo, Ti e V PN-ICP OES. Ni, Ti, V e Zn
 163 9 Conclusões Neste trabalho, duas abordagens diferentes para análise de amostras de óleos e gorduras foram estudadas visando o desenvolvimento de métodos analíticos baseados em técnicas que utilizam
163 9 Conclusões Neste trabalho, duas abordagens diferentes para análise de amostras de óleos e gorduras foram estudadas visando o desenvolvimento de métodos analíticos baseados em técnicas que utilizam
5 Parte experimental Validação analítica
 58 5 Parte experimental Validação analítica A validação analítica busca, por meio de evidências objetivas, demonstrar que um método produz resultados confiáveis e adequados ao uso pretendido 40. Para isso,
58 5 Parte experimental Validação analítica A validação analítica busca, por meio de evidências objetivas, demonstrar que um método produz resultados confiáveis e adequados ao uso pretendido 40. Para isso,
7 Determinação de Fe, Ni e V em asfaltenos por extração ácida assistida por ultra-som usando ICP OES
 136 7 Determinação de Fe, Ni e V em asfaltenos por extração ácida assistida por ultra-som usando ICP OES Baseando-se nos bons resultados obtidos descritos no Capítulo 6, com a extração de metais-traço
136 7 Determinação de Fe, Ni e V em asfaltenos por extração ácida assistida por ultra-som usando ICP OES Baseando-se nos bons resultados obtidos descritos no Capítulo 6, com a extração de metais-traço
3 Materiais e métodos 3.1. Reagentes
 3 Materiais e métodos 3.1. Reagentes Todos os compostos e reagentes utilizados neste trabalho são de grau analítico e não sofreram etapas prévias de purificação. A água utilizada foi deionizada (resistividade
3 Materiais e métodos 3.1. Reagentes Todos os compostos e reagentes utilizados neste trabalho são de grau analítico e não sofreram etapas prévias de purificação. A água utilizada foi deionizada (resistividade
UNIVERSIDADE FEDERAL DO PARANÁ SETOR DE CIÊNCIAS EXATAS DEPARTAMENTO DE QUÍMICA CURSO DE QUÍMICA
 UNIVERSIDADE FEDERAL DO PARANÁ SETOR DE CIÊNCIAS EXATAS DEPARTAMENTO DE QUÍMICA CURSO DE QUÍMICA LABORATÓRIO DE QUÍMICA ANALÍTICA INSTRUMENTAL II CQ122 Prática 1 Profa. Iara Messerschmidt Prof. Claudio
UNIVERSIDADE FEDERAL DO PARANÁ SETOR DE CIÊNCIAS EXATAS DEPARTAMENTO DE QUÍMICA CURSO DE QUÍMICA LABORATÓRIO DE QUÍMICA ANALÍTICA INSTRUMENTAL II CQ122 Prática 1 Profa. Iara Messerschmidt Prof. Claudio
Tabela 14: Fluorescência (240/350 nm) da hidrocortisona e prednisolona após procedimento de derivação fotoquímica.
 6 Resultados e discussão: Avaliação da viabilidade do uso do procedimento de derivação fotoquímica de glicocorticóides em cromatografia líquida, para fluidos biológicos. 6.1. Interferência da hidrocortisona
6 Resultados e discussão: Avaliação da viabilidade do uso do procedimento de derivação fotoquímica de glicocorticóides em cromatografia líquida, para fluidos biológicos. 6.1. Interferência da hidrocortisona
7 Conclusões 7.1 Determinações fluorimétricas e eletroforéticas para a camptotecina e derivados
 215 7 Conclusões 7.1 Determinações fluorimétricas e eletroforéticas para a camptotecina e derivados Com o objetivo de permitir uma detecção simples, rápida e barata de contaminações de camptotecina (CPT)
215 7 Conclusões 7.1 Determinações fluorimétricas e eletroforéticas para a camptotecina e derivados Com o objetivo de permitir uma detecção simples, rápida e barata de contaminações de camptotecina (CPT)
Análise Instrumental. Prof. Elias da Costa
 Análise Instrumental Prof. Elias da Costa 1-Introdução a Análise Instrumental CLASSIFICAÇÃO DOS MÉTODOS ANALÍTICOS CLASSIFICAÇÃO DOS MÉTODOS INSTRUMENTAIS INSTRUMENTOS PARA ANÁLISE SELEÇÃO DE UM MÉTODO
Análise Instrumental Prof. Elias da Costa 1-Introdução a Análise Instrumental CLASSIFICAÇÃO DOS MÉTODOS ANALÍTICOS CLASSIFICAÇÃO DOS MÉTODOS INSTRUMENTAIS INSTRUMENTOS PARA ANÁLISE SELEÇÃO DE UM MÉTODO
MÉTODOS DE CALIBRAÇÃO
 MÉTODOS DE CALIBRAÇÃO Sinais obtidos por equipamentos e instrumentos devem ser calibrados para evitar erros nas medidas. Calibração, de acordo com o INMETRO, é o conjunto de operações que estabelece, sob
MÉTODOS DE CALIBRAÇÃO Sinais obtidos por equipamentos e instrumentos devem ser calibrados para evitar erros nas medidas. Calibração, de acordo com o INMETRO, é o conjunto de operações que estabelece, sob
QUI346 ESPECTROFOTOMETRIA
 QUI346 ESPECTROFOTOMETRIA ABSORÇÃO FOTOQUÍMICA 3ª Parte (cont.) A QUANTIFICAÇÃO Mauricio X. Coutrim QUANTIFICAÇÃO: BRANCO O BRANCO NA DETERMINAÇÃO A radiação absorvida não é a simples diferença entre as
QUI346 ESPECTROFOTOMETRIA ABSORÇÃO FOTOQUÍMICA 3ª Parte (cont.) A QUANTIFICAÇÃO Mauricio X. Coutrim QUANTIFICAÇÃO: BRANCO O BRANCO NA DETERMINAÇÃO A radiação absorvida não é a simples diferença entre as
Prova de Química Analítica
 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2018/01 EDITAL PPGQ Nº 001/2018 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número de seu CPF (brasileiros/estrangeiros)
PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2018/01 EDITAL PPGQ Nº 001/2018 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número de seu CPF (brasileiros/estrangeiros)
muda de marrom para azula (medida pela absorvância da luz em um comprimento de onda de 595 nm) é proporcional à concentração de proteína presente.
 ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS E APOSTILAS CITADOS ABAIXO. 1 Na determinação de uma proteína pelo método de Bradford, a cor de um corante muda de marrom para
ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS E APOSTILAS CITADOS ABAIXO. 1 Na determinação de uma proteína pelo método de Bradford, a cor de um corante muda de marrom para
Métodos Eletroanalíticos. Condutometria
 Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
VALIDAÇÃO DE MÉTODOS ANALÍTICOS
 VALIDAÇÃO DE MÉTODOS ANALÍTICOS RE nº 899, de 2003 da ANVISA - Guia para validação de métodos analíticos e bioanalíticos; Validation of analytical procedures - UNITED STATES PHARMACOPOEIA - última edição;
VALIDAÇÃO DE MÉTODOS ANALÍTICOS RE nº 899, de 2003 da ANVISA - Guia para validação de métodos analíticos e bioanalíticos; Validation of analytical procedures - UNITED STATES PHARMACOPOEIA - última edição;
ANÁLISE QUÍMICA INSTRUMENTAL. Calibração de equipamentos/curva analítica
 ANÁLISE QUÍMICA INSTRUMENTAL Calibração de equipamentos/curva analítica 6 Ed. Cap. 1 Pg.25-38 6 Ed. Cap. 0 Pg.1-9 7 Ed. Cap. 0 Pg.1-9 8 Ed. Cap. 5-8 Pg. 82-210 Site: Cálculo de cafeína diária. http://www.pregnancytod
ANÁLISE QUÍMICA INSTRUMENTAL Calibração de equipamentos/curva analítica 6 Ed. Cap. 1 Pg.25-38 6 Ed. Cap. 0 Pg.1-9 7 Ed. Cap. 0 Pg.1-9 8 Ed. Cap. 5-8 Pg. 82-210 Site: Cálculo de cafeína diária. http://www.pregnancytod
FILMES ELETROPOLIMERIZADOS DE 3,4 -DHB OH OH. Estrutura do acido 3,4-dihIdroxIbenzóico OBJETIVOS
 FILMES ELETRPLIMERIZADS DE 3,4 -DB Estrutura do acido 3,4-dihIdroxIbenzóico BJETIVS PREPARAR ELETRDS QUIMIAMENTE MDIFIADS USAND A ELETRPLIMERIZAÇÃ D 3,4 DI-IDRXIBENZALDEÍD PARA DETERMINAÇÃ DE NAD E NADP
FILMES ELETRPLIMERIZADS DE 3,4 -DB Estrutura do acido 3,4-dihIdroxIbenzóico BJETIVS PREPARAR ELETRDS QUIMIAMENTE MDIFIADS USAND A ELETRPLIMERIZAÇÃ D 3,4 DI-IDRXIBENZALDEÍD PARA DETERMINAÇÃ DE NAD E NADP
5. Resultados e Discussão
 47 5. Resultados e Discussão 5.1.1. Faixa de trabalho e Faixa linear de trabalho As curvas analíticas obtidas são apresentadas na Figura 14 e Figura 16. Baseado no coeficiente de determinação (R 2 ) encontrado,
47 5. Resultados e Discussão 5.1.1. Faixa de trabalho e Faixa linear de trabalho As curvas analíticas obtidas são apresentadas na Figura 14 e Figura 16. Baseado no coeficiente de determinação (R 2 ) encontrado,
Laboratório de Análise Instrumental
 Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis Caderno de Laboratório 1. Título 2. Introdução 3. Objetivo 4. Parte Experimental 4.1. Reagentes
Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis Caderno de Laboratório 1. Título 2. Introdução 3. Objetivo 4. Parte Experimental 4.1. Reagentes
4 Resultados: Determinação espectrofluorimétrica do ciclofenil Considerações iniciais
 65 4 Resultados: Determinação espectrofluorimétrica do ciclofenil. 4.1. Considerações iniciais A posição espectral, a intensidade e a forma de um espectro eletrônico molecular, em especial os fotoluminescentes,
65 4 Resultados: Determinação espectrofluorimétrica do ciclofenil. 4.1. Considerações iniciais A posição espectral, a intensidade e a forma de um espectro eletrônico molecular, em especial os fotoluminescentes,
4. Resultados e Discussão
 Absorbância 4. Resultados e Discussão 4.1. Obtenção da curva de calibração A obtenção da curva de calibração, absorbância vs. concentração de Paraquat, é necessária para a análise química do pesticida.
Absorbância 4. Resultados e Discussão 4.1. Obtenção da curva de calibração A obtenção da curva de calibração, absorbância vs. concentração de Paraquat, é necessária para a análise química do pesticida.
Centro Universitário Anchieta Análise Química Instrumental 2016/1 Semestre - Prof.Ms. Vanderlei I. Paula Lista 3A Nome: RA
 Centro Universitário Anchieta Análise Química Instrumental 2016/1 Semestre - Prof.Ms. Vanderlei I. Paula Lista 3A Nome: RA 1) Qual é a relação entre *(a) absorbância e transmitância? (b) absortividade
Centro Universitário Anchieta Análise Química Instrumental 2016/1 Semestre - Prof.Ms. Vanderlei I. Paula Lista 3A Nome: RA 1) Qual é a relação entre *(a) absorbância e transmitância? (b) absortividade
Seleção de um Método Analítico. Validação e protocolos em análises químicas. Validação de Métodos Analíticos
 Seleção de um Método Analítico Capítulo 1 SKOOG, D.A.; HOLLER, F.J.; NIEMAN, T.A. Princípios de Análise Instrumental. 5 a edição, Ed. Bookman, Porto Alegre, 2002. Validação e protocolos em análises químicas
Seleção de um Método Analítico Capítulo 1 SKOOG, D.A.; HOLLER, F.J.; NIEMAN, T.A. Princípios de Análise Instrumental. 5 a edição, Ed. Bookman, Porto Alegre, 2002. Validação e protocolos em análises químicas
UTILIZAÇÃO DO ELETRODO SÓLIDO DE AMÁLGAMA NA OTIMIZAÇÃO EXPERIMENTAL E VOLTAMETRIA PARA O DESENVOLVIMENTO DE MÉTODO DE ANALÍSE DO PESTICIDA TIRAM
 UTILIZAÇÃO DO ELETRODO SÓLIDO DE AMÁLGAMA NA OTIMIZAÇÃO EXPERIMENTAL E VOLTAMETRIA PARA O DESENVOLVIMENTO DE MÉTODO DE ANALÍSE DO PESTICIDA TIRAM 1 Vanessa Cristina Pereira Maia, 2 Lucas Moreira Silva,
UTILIZAÇÃO DO ELETRODO SÓLIDO DE AMÁLGAMA NA OTIMIZAÇÃO EXPERIMENTAL E VOLTAMETRIA PARA O DESENVOLVIMENTO DE MÉTODO DE ANALÍSE DO PESTICIDA TIRAM 1 Vanessa Cristina Pereira Maia, 2 Lucas Moreira Silva,
Prática 10 Determinação da constante de equilíbrio entre íons Fe 3+ e SCN -
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 10 Determinação da constante de equilíbrio
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 10 Determinação da constante de equilíbrio
Laboratório de Análise Instrumental
 Laboratório de Análise Instrumental Prof. Renato Camargo Matos Profa. Maria Auxiliadora Costa Matos http://www.ufjf.br/nupis DIA/MÊS ASSUNTO 06/03 Apresentação do curso 13/03 PRÁTICA 1: Determinação de
Laboratório de Análise Instrumental Prof. Renato Camargo Matos Profa. Maria Auxiliadora Costa Matos http://www.ufjf.br/nupis DIA/MÊS ASSUNTO 06/03 Apresentação do curso 13/03 PRÁTICA 1: Determinação de
UNIVERSIDADE ESTADUAL DE CAMPINAS
 UNIVERSIDADE ESTADUAL DE CAMPINAS Faculdade de Engenharia Civil Arquitetura e Urbanismo Instituto de Química Especiação e remoção de arsênio inorgânico de águas de superfície e subterrânea empregando fotocatálise
UNIVERSIDADE ESTADUAL DE CAMPINAS Faculdade de Engenharia Civil Arquitetura e Urbanismo Instituto de Química Especiação e remoção de arsênio inorgânico de águas de superfície e subterrânea empregando fotocatálise
Prática de Ensino de Química e Bioquímica
 INSTITUTO DE QUÍMICA UNIVERSIDADE DE SÃO PAULO Prática de Ensino de Química e Bioquímica Alex da Silva Lima Relatório final sobre as atividades desenvolvidas junto à disciplina QFL 1201 São Paulo -2009-
INSTITUTO DE QUÍMICA UNIVERSIDADE DE SÃO PAULO Prática de Ensino de Química e Bioquímica Alex da Silva Lima Relatório final sobre as atividades desenvolvidas junto à disciplina QFL 1201 São Paulo -2009-
Minicurso: Medição de ph e Íons por Potenciometria
 Minicurso: por Potenciometria Instrutor: Nilton Pereira Alves São José dos Campos 29/05/2010 1/37 Instrutor: Nilton Pereira Alves Técnico químico ECOMPO SJC - SP Bacharel em Química Oswaldo Cruz SP Mestre
Minicurso: por Potenciometria Instrutor: Nilton Pereira Alves São José dos Campos 29/05/2010 1/37 Instrutor: Nilton Pereira Alves Técnico químico ECOMPO SJC - SP Bacharel em Química Oswaldo Cruz SP Mestre
QUI 154/150 Química Analítica V Análise Instrumental. Aula 1 Introdução a Química Analítica Instrumental Parte 2
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154/150 Química Analítica V Análise Instrumental Aula 1 Introdução a Química Analítica Instrumental Parte
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154/150 Química Analítica V Análise Instrumental Aula 1 Introdução a Química Analítica Instrumental Parte
Desenvolvimento de um método
 Desenvolvimento de um método -Espectro: registro de um espectro na região de interesse seleção do comprimento de onda -Fixação de comprimento de onda: monitoramento da absorbância no comprimento de onda
Desenvolvimento de um método -Espectro: registro de um espectro na região de interesse seleção do comprimento de onda -Fixação de comprimento de onda: monitoramento da absorbância no comprimento de onda
Graduação em Biotecnologia Disciplina de Proteômica. Caroline Rizzi Doutoranda em Biotecnologia -UFPel
 Graduação em Biotecnologia Disciplina de Proteômica Caroline Rizzi Doutoranda em Biotecnologia -UFPel Metodologias para quantificar proteínas Qualquer trabalho com proteína deve envolver a quantificação
Graduação em Biotecnologia Disciplina de Proteômica Caroline Rizzi Doutoranda em Biotecnologia -UFPel Metodologias para quantificar proteínas Qualquer trabalho com proteína deve envolver a quantificação
ESTUDO DO COMPORTAMENTO ELETROQUÍMICO DE FITOESTROGÊNIOS E A DETERMINAÇÃO DESTES EM MATRIZES ALIMENTARES UTILIZANDO MÉTODOS ELETROANALÍTICOS
 Serviço Público Federal Ministério da Educação Fundação Universidade Federal de Mato Grosso do Sul Centro de Ciências Exatas e Tecnologia Programa de Pós Graduação em Química - Doutorado ESTUDO DO COMPORTAMENTO
Serviço Público Federal Ministério da Educação Fundação Universidade Federal de Mato Grosso do Sul Centro de Ciências Exatas e Tecnologia Programa de Pós Graduação em Química - Doutorado ESTUDO DO COMPORTAMENTO
APLICAÇÕES DOS POTENCIAIS PADRÃO DE ELETRODO
 APLICAÇÕES DOS POTENCIAIS PADRÃO DE ELETRODO POTENCIAL TERMODINÂMICO! definido como o potencial do catodo menos o potencial do anodo (semi-reações escritas como redução; despreza queda ôhmica e potencial
APLICAÇÕES DOS POTENCIAIS PADRÃO DE ELETRODO POTENCIAL TERMODINÂMICO! definido como o potencial do catodo menos o potencial do anodo (semi-reações escritas como redução; despreza queda ôhmica e potencial
Polarização e cinética de eletrodo
 Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÃO TAMPÃO Tampão Ácido Qual o ph de uma solução de ácido fórmico 1,00.10-1 mol.l -1 e formiato de sódio 1,00 mol.l
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÃO TAMPÃO Tampão Ácido Qual o ph de uma solução de ácido fórmico 1,00.10-1 mol.l -1 e formiato de sódio 1,00 mol.l
Aula 13 PRÁTICA 03 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: LEI DE BEER. Elisangela de Andrade Passos
 Aula 13 PRÁTICA 03 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: LEI DE BEER META Habilitar o aluno na utilização da espectrofotômetria em determinações quantitativas; redigir o relatório prático.
Aula 13 PRÁTICA 03 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: LEI DE BEER META Habilitar o aluno na utilização da espectrofotômetria em determinações quantitativas; redigir o relatório prático.
CÉLULAS ELETROLÍTICAS
 QUÍMICAELETROANALÍTICA CÉLULAS ELETROLÍTICAS REPRESENTAÇÃOESQUEMÁTICA dois limites, um em cada extremidade da ponte salina Cu Cu 2+ (0,0200 mol L -1 ) Ag + (0,0200 mol L -1 ) Ag limite entres fases, ou
QUÍMICAELETROANALÍTICA CÉLULAS ELETROLÍTICAS REPRESENTAÇÃOESQUEMÁTICA dois limites, um em cada extremidade da ponte salina Cu Cu 2+ (0,0200 mol L -1 ) Ag + (0,0200 mol L -1 ) Ag limite entres fases, ou
26/03/2015 VALIDAÇÃO CONTROLE FÍSICO-QUÍMICO DA QUALIDADE RDC 899/2003. Por que validar? OBJETIVO DA VALIDAÇÃO:
 VALIDAÇÃO CONTROLE FÍSICO-QUÍMICO DA QUALIDADE RDC 899/2003 VALIDAÇÃO: ato documentado que atesta que qualquer procedimento, processo, equipamento, material, operação ou sistema realmente conduza aos resultados
VALIDAÇÃO CONTROLE FÍSICO-QUÍMICO DA QUALIDADE RDC 899/2003 VALIDAÇÃO: ato documentado que atesta que qualquer procedimento, processo, equipamento, material, operação ou sistema realmente conduza aos resultados
DETERMINAÇÃO DO ESPECTRO DE ABSORÇÃO DE SOLUÇÕES AQUOSAS DE PERMANGANATO DE POTÁSSIO, CROMATO DE POTÁSSIO, DICROMATO DE POTÁSSIO E SULFATO DE COBRE
 ATIVIDADE EXPERIMENTAL N o 1 DETERMINAÇÃO DO ESPECTRO DE ABSORÇÃO DE SOLUÇÕES AQUOSAS DE PERMANGANATO DE POTÁSSIO, CROMATO DE POTÁSSIO, DICROMATO DE POTÁSSIO E SULFATO DE COBRE Materiais: 01 balão volumétrico
ATIVIDADE EXPERIMENTAL N o 1 DETERMINAÇÃO DO ESPECTRO DE ABSORÇÃO DE SOLUÇÕES AQUOSAS DE PERMANGANATO DE POTÁSSIO, CROMATO DE POTÁSSIO, DICROMATO DE POTÁSSIO E SULFATO DE COBRE Materiais: 01 balão volumétrico
CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP)
 CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP) Medição de ph e íons por potenciometria Ministrante: Nilton Pereira Alves Quimlab Química Contatos: nilton@quimlab.com.br Apoio São José dos Campos, 29 de
CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP) Medição de ph e íons por potenciometria Ministrante: Nilton Pereira Alves Quimlab Química Contatos: nilton@quimlab.com.br Apoio São José dos Campos, 29 de
5 Método para a determinação seletiva de NOR na presença de LEV ou de CIP 5.1 Comentário preliminar
 82 5 Método para a determinação seletiva de na presença de LEV ou de CIP 5.1 Comentário preliminar Nesse primeiro estudo de caso, decidiu-se por desenvolver um método fosforimétrico para a determinação
82 5 Método para a determinação seletiva de na presença de LEV ou de CIP 5.1 Comentário preliminar Nesse primeiro estudo de caso, decidiu-se por desenvolver um método fosforimétrico para a determinação
5 Resultados: desenvolvimento de métodos para determinação indireta da amitriptilina
 5 Resultados: desenvolvimento de métodos para determinação indireta da amitriptilina No presente capítulo serão apresentados e discutidos os procedimentos realizados para a derivatização fotoquímica da
5 Resultados: desenvolvimento de métodos para determinação indireta da amitriptilina No presente capítulo serão apresentados e discutidos os procedimentos realizados para a derivatização fotoquímica da
5 Otimizações experimentais e instrumentais para maximização do sinal fosforescente
 5 Otimizações experimentais e instrumentais para maximização do sinal fosforescente A partir dos estudos das características fosforescentes dos 7 compostos selecionados (DBT, BNT, BTF, CB, 78BQ, 79DMBA
5 Otimizações experimentais e instrumentais para maximização do sinal fosforescente A partir dos estudos das características fosforescentes dos 7 compostos selecionados (DBT, BNT, BTF, CB, 78BQ, 79DMBA
Calcule o ph de uma solução de HCl 1x10-7 mol L-1
 Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Metodologia Analítica
 Metodologia Analítica Espectrofotometria UV-vis Prof. Renato Camargo Matos http://www.ufjf.br/nupis Prática Otimização de um Método Espectrofotométrico para Quantificação de Ferro Objetivo Estudar as propriedades
Metodologia Analítica Espectrofotometria UV-vis Prof. Renato Camargo Matos http://www.ufjf.br/nupis Prática Otimização de um Método Espectrofotométrico para Quantificação de Ferro Objetivo Estudar as propriedades
Lista de Exercício 1ª TVC Química Analítica V Teoria (1º Sem 2016)
 Lista de Exercício 1ª TVC Química Analítica V Teoria (1º Sem 2016) Skoog Capítulo 5: Erros em análises químicas 5-1. Explique a diferença entre: a) erro constante e erro proporcional b) Erro aleatório
Lista de Exercício 1ª TVC Química Analítica V Teoria (1º Sem 2016) Skoog Capítulo 5: Erros em análises químicas 5-1. Explique a diferença entre: a) erro constante e erro proporcional b) Erro aleatório
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
DEPARTAMENTO DE QUÍMICA UFJF QUI102 Metodologia Analítica
 DEPARTAMENTO DE QUÍMICA UFJF QUI102 Metodologia Analítica OTIMIZAÇÃO DE UM MÉTODO ESPECTROFOTOMÉTRICO PARA QUANTIFICAÇÃO DE FERRO Data do experimento: Grupo: Objetivo: Estudar as propriedades colorimétricas
DEPARTAMENTO DE QUÍMICA UFJF QUI102 Metodologia Analítica OTIMIZAÇÃO DE UM MÉTODO ESPECTROFOTOMÉTRICO PARA QUANTIFICAÇÃO DE FERRO Data do experimento: Grupo: Objetivo: Estudar as propriedades colorimétricas
QUÍMICA ELETROANALÍTICA
 QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O
 E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O OBJETIVO Pretende-se com este trabalho experimental que os alunos avaliem as características de um eléctrodo sensível a ião
E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O OBJETIVO Pretende-se com este trabalho experimental que os alunos avaliem as características de um eléctrodo sensível a ião
Condutividade Elétrica
 FQE1 Exp. 1 Condutividade Elétrica 1. Introdução A condução elétrica é um fenômeno de transporte em que a carga elétrica (elétrons ou íons) se move através do sistema. A condutividade elétrica, também
FQE1 Exp. 1 Condutividade Elétrica 1. Introdução A condução elétrica é um fenômeno de transporte em que a carga elétrica (elétrons ou íons) se move através do sistema. A condutividade elétrica, também
5 Otimização da fosforescência
 55 5 Otimização da fosforescência 5.1. Metil Indol (2MI) Com o objetivo de maximizar o sinal fosforescente do 2MI, primeiramente foi usado um procedimento de otimização univariado dos fatores mais relevantes
55 5 Otimização da fosforescência 5.1. Metil Indol (2MI) Com o objetivo de maximizar o sinal fosforescente do 2MI, primeiramente foi usado um procedimento de otimização univariado dos fatores mais relevantes
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR
 INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
ESPECTROFLUORIMETRIA MOLECULAR (FL) Ficha técnica do equipamento Espectrofluorímetro Shimadzu RF-5301PC
 ESPECTROFLUORIMETRIA MOLECULAR (FL) Ficha técnica do equipamento Espectrofluorímetro Shimadzu RF-5301PC Fonte de excitação: Lâmpada de arco de Xe, 150 W; Seletores de comprimento de onda: Monocromadores
ESPECTROFLUORIMETRIA MOLECULAR (FL) Ficha técnica do equipamento Espectrofluorímetro Shimadzu RF-5301PC Fonte de excitação: Lâmpada de arco de Xe, 150 W; Seletores de comprimento de onda: Monocromadores
Determinação de permanganato em água
 ESPECTROFOTOMETRIA NO UV-VIS Ficha técnica do equipamento Espectrofotômetro Shimadzu UV-1650PC Fontes de excitação: Lâmpada de deutério e Lâmpada de tungstênio-halogênio Seletores de comprimento de onda:
ESPECTROFOTOMETRIA NO UV-VIS Ficha técnica do equipamento Espectrofotômetro Shimadzu UV-1650PC Fontes de excitação: Lâmpada de deutério e Lâmpada de tungstênio-halogênio Seletores de comprimento de onda:
P4 - PROVA DE QUÍMICA GERAL - 28/11/09
 P4 - PROVA DE QUÍMICA GERAL - 8/11/09 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão Dados gerais: 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 G o = H o - T S o G = - n F E o RT E =
P4 - PROVA DE QUÍMICA GERAL - 8/11/09 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão Dados gerais: 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 G o = H o - T S o G = - n F E o RT E =
6 RESULTADOS E DISCUSSÕES
 - 102-6 RESULTADOS E DISCUSSÕES A seguir, são apresentados os resultados e discussões obtidos nos ensaios de eletrocoagulação da emulsão óleo-água sintética. Os parâmetros iniciais de cada experimento
- 102-6 RESULTADOS E DISCUSSÕES A seguir, são apresentados os resultados e discussões obtidos nos ensaios de eletrocoagulação da emulsão óleo-água sintética. Os parâmetros iniciais de cada experimento
4 Resultados e Discussão:
 4 Resultados e Discussão: Os resultados obtidos são apresentados e discutidos separadamente a seguir, de acordo com o tipo de amostra objeto de análise: 4.1 Análise de amostras para estudos toxicológicos.
4 Resultados e Discussão: Os resultados obtidos são apresentados e discutidos separadamente a seguir, de acordo com o tipo de amostra objeto de análise: 4.1 Análise de amostras para estudos toxicológicos.
Nanopartículas de Prata e. Curva de Calibração da Curcumina
 RELATÓRIODEAULAPRÁTICA Disciplina:NanotecnologiaFarmacêutica NanopartículasdePratae CurvadeCalibraçãodaCurcumina Grupo 4 Erick Nunes Garcia Fernanda Buzatto Gabriela do Amaral Gleicy Romão Manuela Pereira
RELATÓRIODEAULAPRÁTICA Disciplina:NanotecnologiaFarmacêutica NanopartículasdePratae CurvadeCalibraçãodaCurcumina Grupo 4 Erick Nunes Garcia Fernanda Buzatto Gabriela do Amaral Gleicy Romão Manuela Pereira
7. Resultados e discussão
 7 Resultados e discussão 32 7. Resultados e discussão 7.1 orção ótica Inicialmente foi realizada a análise dos espectros dos BCD em solução de tampão fosfato (PBS) e em etanol, com as soluções estoques
7 Resultados e discussão 32 7. Resultados e discussão 7.1 orção ótica Inicialmente foi realizada a análise dos espectros dos BCD em solução de tampão fosfato (PBS) e em etanol, com as soluções estoques
Métodos voltamétricos
 VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
CATÁLISE ENZIMÁTICA. CINÉTICA Controle da velocidade de reações. CINÉTICA Equilíbrio e Estado Estacionário
 CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Termodinâmica das Misturas Propriedades das Soluções Atividade
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Tipos de métodos eletroanalíticos
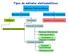 Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
Espectroscopia Óptica Instrumentação e aplicações UV/VIS. CQ122 Química Analítica Instrumental II 1º sem Prof. Claudio Antonio Tonegutti
 Espectroscopia Óptica Instrumentação e aplicações UV/VIS CQ122 Química Analítica Instrumental II 1º sem. 2017 Prof. Claudio Antonio Tonegutti Lei de Beer A = b c A = absorbância = absortividade molar (L
Espectroscopia Óptica Instrumentação e aplicações UV/VIS CQ122 Química Analítica Instrumental II 1º sem. 2017 Prof. Claudio Antonio Tonegutti Lei de Beer A = b c A = absorbância = absortividade molar (L
ROTEIRO PRÁTICO DE QUÍMICA GERAL
 ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
Voltametria Ciclica: Fundamentos Básicos e Aplicações
 Voltametria Ciclica: Fundamentos Básicos e Aplicações rof. Alzir Azevedo Batista Universidade Federal de São Carlos - Brasil Introdução A técnica de voltametria c cclica é mais própria para fins qualitativos
Voltametria Ciclica: Fundamentos Básicos e Aplicações rof. Alzir Azevedo Batista Universidade Federal de São Carlos - Brasil Introdução A técnica de voltametria c cclica é mais própria para fins qualitativos
4 Características fosforescentes dos indóis
 44 4 Características fosforescentes dos indóis A capacidade fotoluminescente de um composto é função de sua estrutura molecular e das condições do meio que o cerca, assim sendo, o desenvolvimento de uma
44 4 Características fosforescentes dos indóis A capacidade fotoluminescente de um composto é função de sua estrutura molecular e das condições do meio que o cerca, assim sendo, o desenvolvimento de uma
4 Parte experimental Desenvolvimento do Método
 35 4 Parte experimental Desenvolvimento do Método O vanádio por suas características e baixos níveis no soro levou os experimentos a condições extremas. Conseqüentemente, foram obtidos resultados com maiores
35 4 Parte experimental Desenvolvimento do Método O vanádio por suas características e baixos níveis no soro levou os experimentos a condições extremas. Conseqüentemente, foram obtidos resultados com maiores
Métodos Eletroanalíticos. Voltametria
 Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
~..l:. ..","".. ~ Yq STORAENSO ~ Votoranlim ICelulose e Papel 4QANOA. === Fc.z HM! BONGE ,.,...,.
 ';'"'1 XXXI. CONGRESSOCONQUISTAS BRASILEIRO & DESAFIOS u DECIÊNCIAda Ciência do DOSOLO Solo brasileira ~~ ~..l:. Promoção, i UFRGS II> l "".,.. ", '" ~:.. Apoio,..","".. ~FAPERGS _...at Al Gramado ===
';'"'1 XXXI. CONGRESSOCONQUISTAS BRASILEIRO & DESAFIOS u DECIÊNCIAda Ciência do DOSOLO Solo brasileira ~~ ~..l:. Promoção, i UFRGS II> l "".,.. ", '" ~:.. Apoio,..","".. ~FAPERGS _...at Al Gramado ===
Introdução aos métodos titulométricos volumétricos. Prof a Alessandra Smaniotto QMC Química Analítica - Farmácia Turmas 02102A e 02102B
 Introdução aos métodos titulométricos volumétricos Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Definições ² Métodos titulométricos: procedimentos quantitativos
Introdução aos métodos titulométricos volumétricos Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Definições ² Métodos titulométricos: procedimentos quantitativos
Noções de Exatidão, Precisão e Resolução
 Noções de Exatidão, Precisão e Resolução Exatidão: está relacionada com o desvio do valor medido em relação ao valor padrão ou valor exato. Ex : padrão = 1,000 Ω ; medida (a) = 1,010 Ω ; medida (b)= 1,100
Noções de Exatidão, Precisão e Resolução Exatidão: está relacionada com o desvio do valor medido em relação ao valor padrão ou valor exato. Ex : padrão = 1,000 Ω ; medida (a) = 1,010 Ω ; medida (b)= 1,100
CAPÍTULO 4 APRESENTAÇÃO E ANÁLISE DOS RESULTADOS
 8 CAPÍTULO 4 APRESENTAÇÃO E ANÁLISE DOS RESULTADOS Neste capítulo serão apresentados e discutidos os resultados do estudo dos sistemas metal/solução através de análises voltamétricas. Em seguida, os resultados
8 CAPÍTULO 4 APRESENTAÇÃO E ANÁLISE DOS RESULTADOS Neste capítulo serão apresentados e discutidos os resultados do estudo dos sistemas metal/solução através de análises voltamétricas. Em seguida, os resultados
P4 - PROVA DE QUÍMICA GERAL - 05/12/07
 P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
Determinação voltamétrica do nedocromil de sódio utilizando eletrodo de carbono vítreo
 Volume 28 (2003) número 2 www.scielo.br/eq Determinação voltamétrica do nedocromil de sódio utilizando eletrodo de carbono vítreo T. F. Rosa 1, A. A. Saczk 1, M. V. B. Zanoni 1, N. R. Stradiotto 1 1 Departamento
Volume 28 (2003) número 2 www.scielo.br/eq Determinação voltamétrica do nedocromil de sódio utilizando eletrodo de carbono vítreo T. F. Rosa 1, A. A. Saczk 1, M. V. B. Zanoni 1, N. R. Stradiotto 1 1 Departamento
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
