Voltametria Ciclica: Fundamentos Básicos e Aplicações
|
|
|
- Emanuel Thiago Marinho Franca
- 9 Há anos
- Visualizações:
Transcrição
1 Voltametria Ciclica: Fundamentos Básicos e Aplicações rof. Alzir Azevedo Batista Universidade Federal de São Carlos - Brasil Introdução A técnica de voltametria c cclica é mais própria para fins qualitativos (para fins quantitativos outras técnicas, p.e. Voltametria de ulso Diferencial, são mais eficazes) Exemplo de aplicações: Avaliação de potenciais redox de espécies em solução Detecção de intermediários Detecção da existência de reações acopladas a processos eletroquímicos A voltametria cíclica compreende um grupo de métodos eletroanalíticos nos quais as informações sobre a concentração do analito são derivadas a partir das medidas de corrente em função do potencial aplicado sob condições de completa polarização do eletrodo de trabalho, através do uso de microeletrodos. Instrumentação necessária: a)potenciostato com gerador de programa de potencial; b)computador para registrar os gráficos de corrente em função do potencial c)célula convencional de três eletrodos e uma solução contendo o analito e eletrólito suporte. A voltametria cíclica é uma modificação da técnica de varredura rápida em que se inverte a direção de varredura, segundo a redução de interesse. ara conseguir isso se aplica uma voltagem chamada onda triangular a célula eletrolítica. EQUIAMENTO: OTENCIOSTATO; ROGRAMADOR DE ONDAS Célula Eletroquímica Uma célula eletroquímica é tipicamente composta por um eletrodo de trabalho, por um de referência e por um auxiliar Célula Eletroquímica 1
2 As reações eletroquímicas ocorrem nos orbitais HOMO e HUMO O orbital de maior energia ocupado (HOMO) é particularmente importante quando uma oxidação está envolvida O orbital de maior energia desocupado (LUMO) é particularmente importante quando uma redução está envolvida ELETRODO DE TRABALHO O eletrodo de trabalho é o eletrodo em cuja superfície ocorre as reações envolvendo o analito Esses eletrodos são tipicamente compostos por um material inerte a reação redox *carbono, platina, ouro, mercúrio Interface polarizável Elevada condução elétrica Elevado grau de pureza Reprodutibilidade da superfice Eletrodo de referência Eletrodos de referências mais comuns, suas reações redox correspondentes e seus potenciais de reação relativo ao eletrodo normal de hidrogênio Um eletrodo de referência é utilizado para sustentar um potencial constante na célula eletroquímica Os principais tipos de materiais utilizados como eletrodo de referência são - Hidrogênio (t)/h 2, H + - Calomelano Hg/Hg 2 2, K (1M) - rata/oreto de prata Ag/Ag, K (0,1M) Eletrodo auxiliar O eletrodo auxiliar é utilizado para completar o circuito eletroquímico, que permite o fluxo de corrente entre o eletro de trabalho e o de referência, dessa forma é possível um medida mais exata do potencial entre esses eletrodos Enquanto a reação redox do analito ocorre no eletrodo de trabalho, a contra reação, tipicamente a reação redox do solvente, ocorre no eletrodo auxiliar VOLTAMETRIA LINEAR As características de um voltamograma linear depende de vários fatores: Velocidade da reação de transferência eletrónica. Reatividade química das espécies em solução. Velocidade de varredura de potencial 2
3 A figura mostra o padrão típico da excitação do sinal para a técnica de voltametria cíclica. A faixa de variação do potencial aplicado deve ser aquela onde a espécie em análise é eletroativa e o solvente é estável. Dependendo do analito pode-se fazer apenas um ciclo ou múltiplos ciclos. Um voltamograma cíclico é obtido pela medida de corrente sobre o eletrodo de trabalho (E.T.)durante a variação de potencial (gráfico de corrente em função do potencial). A corrente pode ser considerada responsável pelo sinal de excitação do potencial FORMAS DE VARIAÇÃO DE OTENCIAIS Variação linear do potencial no tempo, com inversões periódicas Um ou mais ciclos possíveis de serem efetuados Velocidades de varredura variáveis arâmetros importantes extraídos do voltamograma cíclico: potencial de pico catódico (E pc ); potencial de pico anódico (E pa ); corrente de pico catódico (i pc ); corrente de pico anódico (i pa ). A corrente de pico para sistemas reversíveis é descrita pela equação de Randles-Sevcik: I p =2,69X 10 5 n 3/2 AD 1/2 Cv 1/2 Voltamograma cíclico para o ferroceno [Fe(Cp) 2 ] medido em CH 3 CN com 0,1 M Bu 4 NF 6 versus SCE Corrente do pico anódico (i pa ) Corrente do pico catódico (i pc ) Equação de Randles-Svecik i p = 2,69 X 10 5 n 3/2 A D 1/2 Cv 1/2 i p = corrente de pico; A = área do eletrodo, cm 2 ; D = coeficiente de difusão, cm 2 /s; C = concentração, mol.cm -3 ; v = velocidade de variação, V/s; n = número de elétrons adicionados ou removidos por íon ou por molécula. Reações reversíveis i p ν 1/2 Epa e Epc não dependem da velocidade de varredura i pa /i pc = 1 3
4 Equação de Randles-Svecik i p = (2,69 x10 5 )n 3/2 A D 1/2 C v 1/ 2 25 o C i p - corrente pico (A) n - nº de eletrons trocados no processo A - área do eletrodo (cm 2 ) D - coeficiente de difusão (cm 2 /s) C - concentração (mol/cm 3 ) v - velocidade de varredura (V/s) rocessos reversíveis Se E aumentar com o aumento da velocidade de varredura a reação é quasireversível Quando E é muito elevado (constante de transferência eletrónica padrão igual ou inferior a 2x10-5 v 1/2 ) as reações dizem-se irreversíveis Coeficiente de difusão - i vs v - i vs c ROCESSOS REVERSÍVEIS E QUASE-REVERSIVEIS *Linha cheia: voltamograma reversível *Linha pontilhada: voltamograma quasi-reversível Voltamograma cíclico irreversível 4
5 Cálculo de E 1/2 e n O potencial de meia-onda está aproximadamente relacionado com o potencial padrão para a semi-reação E = (E pa + E pc )/2 ara uma reação reversível: E 1/2 = (E pc + E pa )/2 (ou 85,17% da corrente de pico) E p = (E pa - E pc ) (0,059)/n V Corrente (A) VC: [Ru 2 (dppb)(mebipy)] e [Ru 2 (dppf)(mebipy)] em CH 2 2, TBA 0,1 mol L -1 e velocidade de varredura de 500 mv s -1. 0, , , , ,00005 onde n é o número de elétrons envolvido na semi reação ara uma reação quasi-reversível E p > E pa E pc > 0,059/n -0, otencial (mv) rocesso Sucessivo, Reversível e Quasireversível no [Ru(NO)(dppe) 2 ](F 6 ) 2 Eletroquímica como sonda na atividade biológica de complexos inorgânicos Current (ma) 0,06 0,04 0,02 0,00-0,02-0,04-0,06-0,08-0,10-0,12-0,14-0,16-0,18-0,20-0, VC do trans-[ru(no)(dppe) 2](F 6) 2, 1.0 x 10-3 M em CH3CN (0,1 M TBA, eletrodo de trabalho t vs Ag/Ag. Ru(NO + )(dppe) 2 ] 2+ + e- Ru(NO o )(dppe) 2 ] + [Ru(NO o )(dppe) 2 ] + + e- [Ru(NO - )(dppe) 2 O VC do trans- [Ru(NO)(dppe) 2 ](F 6 ) 2 apresenta um processo catódico em 94 mv e um processo anódico em 160 mv. E 1/2 = (E pa + E pc )/2 = 127 mv vs Ag/Ag). E 66 mv ( E = Epc Epa = mv In the present work the quasireversible process between and V has been attributed to the formation of the Ar-NO2 radical. Interestingly, complexes (1-6) have otential (mv) adequate NO2-reduction potential to mv para processos act against T. cruzi via a redox cycling reversíveis em solventes process. European Journal of Medicinal orgânicos) Chemistry 45 (2010) 2847e2853 VOLTAMETRIA DE ULSOS Esta técnica foi desenvolvida com o objetivo de aumentar a sensibilidade tendo em vista aplicações analíticas. A corrente é medida no fim do pulso porque a corrente capacitiva extinguese mais rapidamente do que a corrente faradaica. Voltamograma Cíclico e Voltamograma de ulso Diferencial do complexo [Ru 2 (Mebipy)(dppf)] em CH 2 2, TBA 0,1 mol L -1 5
6 Voltametria de pulso diferencial para a reação de substituição do cloro no complexo cis-[ru 2 (dppb)(bipy)] pelo ligante 4-picolina, em CH 2 2, a 20ºC. Concentração 1/10 complexo/ligante. O N Ru + L CH 3OH/NH 4F 6 CH22 0,00007 O N Ru L F 6 NH 4 Eletrodos Modificados 0, ,00005 Corrente, (A) 0, , , , , otencial, (mv) Eletrodo modificado, para detecção de hidroquinona OH O O O etc Voltamograma Cíclico do {CoTy[Ru 3 (dppb)] 4 } em eletrodo de pasta de carbono, usando a dopamina como substrato (NaTFA 0.1 mol.l -1 ph = 4,5. Scan: 50 mv/s OH OH OH OH 20 Modified (glassy carbon) electrode with porphyrin Glassy carbon electrode glass carbon modified electrode glass carbon electrode 10 Current (ua) O - O - - O O Current (ua) otential (mv) vs Ag/Ag otential (mv) Formação do Filme na Superfície do Eletrodo Ru N e - - II Ru N n {Ty[Ru 3 (dppb)py] 4 } + n 4 e- n {Ty[Ru 2 (dppb)] 4 } + n - n{ty[ru 3 (dppb)]}+n {Ty[Ru 2 (dppb)] 4 } {[Ru 2 3 (dppb) 2 (Ty) 2 ] 2+ } n II Ru N + III Ru N 0,04 N II III Ru Ru N 2+ Absorbance/layer 0,32 0,30 0,28 0,26 0,24 0,22 0,20 0,18 0,16 current [ma] 0,03 0,02 0,01 0,00-0,01-0,02-0,03-0, Number of cycles potential [mv] 6
7 Voltamogramas para o complexo [Ru(L-Try)(dppb)(bipy)]F 6 ; E) cíclico ; D) de pulso diferencial Corrente, µa Corrente, µa otencial, mv otencial, mv Considerações práticas ureza dos solventes Água é um impureza comum em muitos solventes, pois ela pode sofrer redução ou oxidação dentro da janela de potencial desejada O 2(g) + 4H + (aq) + 4e - 2H 2 O E = 1,23V SOLVENTES Acetonitrila e diclorometano são bons solvente para aumentar a janela de potencial para a região anódica N,N-dimetilformamida (DMF) e dimetil sulfoxo (DMSO) são bons para aumentar a janela de potencial para a região catódica Tabela 2: Janela de potencial e eletrólito suporte para alguns dos solventes mais utilizados 2H 2 O + 2e - H 2(g) + OH - (aq) E = -0,83V Uma possível alternativa para esse problema é a remoção do oxigênio da solução 7
8 REFERÊNCIA BIBLIOGRÁFICA Brett, Christopher M. A.; Brett, Ana Maria O., Electrochemistry: rinciples, Methods, and Applications, Oxford,
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
Métodos Eletroanalíticos. Voltametria
 Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
Estudo preliminar da deposição voltamétrica de estanho sobre aço em meio ácido
 Estudo preliminar da deposição voltamétrica de estanho sobre aço em meio ácido Marcos Aurélio Nunes da Silva Filho, Ana Lídia Tomaz de Melo, Denis Valony Martins Paiva, Laudelyna Rayanne Freitas de Oliveira,
Estudo preliminar da deposição voltamétrica de estanho sobre aço em meio ácido Marcos Aurélio Nunes da Silva Filho, Ana Lídia Tomaz de Melo, Denis Valony Martins Paiva, Laudelyna Rayanne Freitas de Oliveira,
CQ049 FQ Eletroquímica.
 CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros [email protected] www.quimica.ufpr.br/mvidotti A Eletroquímica pode ser dividida em duas áreas: Iônica: Está
CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros [email protected] www.quimica.ufpr.br/mvidotti A Eletroquímica pode ser dividida em duas áreas: Iônica: Está
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
Tipos de métodos eletroanalíticos
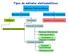 Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Polarização e cinética de eletrodo
 Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Sendo O a forma oxidada do analito e R a forma reduzida.
 2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA. Resumo 800
 ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA Resumo 800 Este trabalho objetivou a caracterização eletroquímica do carrapaticida fipronil, por meio da técnica de
ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA Resumo 800 Este trabalho objetivou a caracterização eletroquímica do carrapaticida fipronil, por meio da técnica de
QUI 070 Química Analítica V Análise Instrumental. Aula 7 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Eletrodo redox. Eletrodos construídos com metais inertes: platina, ouro, paládio. do sistema de óxido-redução presente na solução.
 Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Métodos voltamétricos
 VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
Eletroanalítica: Condutometria (ou Condutimetria)
 Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
Química Geral e Inorgânica. QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin. Eletroquímica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
TRANSPORTE DE MASSA Eletroquímica Aula 6 Prof a. Dr a. Carla Dalmolin
 TRANSPORTE DE MASSA Eletroquímica Aula 6 Prof a. Dr a. Carla Dalmolin Velocidade de Reação de Eletrodo v = k a [R] k c [O] Dependem do transporte de espécies Difusão: movimento térmico de espécies neutras
TRANSPORTE DE MASSA Eletroquímica Aula 6 Prof a. Dr a. Carla Dalmolin Velocidade de Reação de Eletrodo v = k a [R] k c [O] Dependem do transporte de espécies Difusão: movimento térmico de espécies neutras
Eletroquímica. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Eletroquímica Professora: Melissa Soares Caetano Disciplina QUI 217 Eletroquímica estuda as relações
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Eletroquímica Professora: Melissa Soares Caetano Disciplina QUI 217 Eletroquímica estuda as relações
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
QUÍMICA ELETROANALÍTICA
 QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
REAÇÕES DE ÓXIDO-REDUÇÃO
 REAÇÕES DE ÓXIDO-REDUÇÃO A Química Analítica moderna tem por base a medida dos Sinais Analíticos, relacionados às transformações de propriedades dos materiais ao longo de uma Análise Química. Entre estes
REAÇÕES DE ÓXIDO-REDUÇÃO A Química Analítica moderna tem por base a medida dos Sinais Analíticos, relacionados às transformações de propriedades dos materiais ao longo de uma Análise Química. Entre estes
EXERCÍCIOS DE ELETROQUÍMICA
 Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
02/10/2017 ELETRÓLISE AQUOSA
 ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
LISTA DE EXERCÍCIOS Eletroquímica
 DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
MÉTODOS ELETROANALÍTICOS PARTE II
 Aula 7 MÉTODOS ELETROANALÍTICOS PARTE II META Apresentar os fundamentos da titulação potenciométrica; apresentar a localização do ponto fi nal da titulação potenciométrica; apresentar os fundamentos da
Aula 7 MÉTODOS ELETROANALÍTICOS PARTE II META Apresentar os fundamentos da titulação potenciométrica; apresentar a localização do ponto fi nal da titulação potenciométrica; apresentar os fundamentos da
Aula 9 FÍSICO-QUÍMICA DE SUPERFÍCIES PARTE 2: PROCESSOS EM ELETRODOS. Kleber Bergamaski
 Aula 9 FÍSICO-QUÍMICA DE SUPERFÍCIES PARTE 2: PROCESSOS EM ELETRODOS META Apresentar os principais conceitos à físico-química de superfícies envolvidos nos processos de eletrodos. Entendimento da interface
Aula 9 FÍSICO-QUÍMICA DE SUPERFÍCIES PARTE 2: PROCESSOS EM ELETRODOS META Apresentar os principais conceitos à físico-química de superfícies envolvidos nos processos de eletrodos. Entendimento da interface
QUI 070 Química Analítica V Análise Instrumental. Aula 7 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
MÉTODOS COULOMÉTRICOS
 MÉTODOS COULOMÉTRICOS São realizados por meio da medida de quantidade de carga elétrica requerida para converter uma amostra de um analito quantitativamente a um diferente estado de oxidação. A coulometria
MÉTODOS COULOMÉTRICOS São realizados por meio da medida de quantidade de carga elétrica requerida para converter uma amostra de um analito quantitativamente a um diferente estado de oxidação. A coulometria
Eletroquímica. Profa. Marcia Margarete Meier. Disciplina de Química Geral Profa. Marcia Margarete Meier
 Eletroquímica 1 Células voltaicas ou galvânica A energia liberada em uma reação de oxi-redução espontânea é usada para executar trabalho elétrico. Células voltaicas ou galvânicas são aparelhos nos quais
Eletroquímica 1 Células voltaicas ou galvânica A energia liberada em uma reação de oxi-redução espontânea é usada para executar trabalho elétrico. Células voltaicas ou galvânicas são aparelhos nos quais
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR
 INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
Síntese e caracterização de um complexo de níquel suportado em Vulcan X 72R para utilização em pilhas a combustível
 Química Inorgânica Síntese e caracterização de um complexo de níquel suportado em Vulcan X 72R para utilização em pilhas a combustível ISBN 978-85-85905-10-1 Área Química Inorgânica Autores Santos, R.D.
Química Inorgânica Síntese e caracterização de um complexo de níquel suportado em Vulcan X 72R para utilização em pilhas a combustível ISBN 978-85-85905-10-1 Área Química Inorgânica Autores Santos, R.D.
CQ049 FQ Eletroquímica. prof. Dr. Marcio Vidotti Terça / Quarta: 15:30 17:30
 CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti [email protected] www.quimica.ufpr.br/mvidotti Terça / Quarta: 15:30 17:30 Espontaneidade de reações eletroquímicas redução A + e - A - oxidação A A + + e
CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti [email protected] www.quimica.ufpr.br/mvidotti Terça / Quarta: 15:30 17:30 Espontaneidade de reações eletroquímicas redução A + e - A - oxidação A A + + e
= 1.86 (100,75 100) C = 2,68 C Logo, o ponto de congelamento é (0 2,68) o C = 2,68 o C.
 1ª Questão: Justifique, em termos de interações intermoleculares, porque o movimento de migração intra e extracelular de sais minerais não ocorreria caso a molécula de água fosse linear. Caso a água fosse
1ª Questão: Justifique, em termos de interações intermoleculares, porque o movimento de migração intra e extracelular de sais minerais não ocorreria caso a molécula de água fosse linear. Caso a água fosse
QUI 070 Química Analítica V Análise Instrumental. Aula 4 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 4 Química Eletroanalítica Julio C. J. Silva 2o semestre
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 4 Química Eletroanalítica Julio C. J. Silva 2o semestre
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin MÉTODOS DE IMPEDÂNCIA Espectroscopia de Impedância Eletroquímica Aplicada à caracterização de processos de eletrodo e de interfaces complexas Deve ser utilizada
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin MÉTODOS DE IMPEDÂNCIA Espectroscopia de Impedância Eletroquímica Aplicada à caracterização de processos de eletrodo e de interfaces complexas Deve ser utilizada
QUI 154 Química Analítica V Análise Instrumental. Aula 4 Potenciometria
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Análise Instrumental Aula 4 Potenciometria Julio C. J. Silva Juiz de Fora, 1 o sem
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Análise Instrumental Aula 4 Potenciometria Julio C. J. Silva Juiz de Fora, 1 o sem
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Métodos Eletroanalíticos. Condutometria
 Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Aula 20 Eletrodeposição
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
1- Números de oxidação (Nox) Indicam a espécie que perde elétrons e a que ganha elétrons, ou seja, é a carga elétrica da espécie química.
 Eletroquímica É um ramo da Química que estuda as reações químicas que ocorrem, em um meio envolvendo um condutor (um metal ou um semicondutor) e um condutor iônico (o eletrólito), envolvendo trocas de
Eletroquímica É um ramo da Química que estuda as reações químicas que ocorrem, em um meio envolvendo um condutor (um metal ou um semicondutor) e um condutor iônico (o eletrólito), envolvendo trocas de
Trataremos da lei limite de Debye-Hückel e definiremos as células
 Aula: 4 Temática: Células Eletroquímicas eletroquímicas. Trataremos da lei limite de Debye-Hückel e definiremos as células. Lei limite de Debye-Hückel O modelo proposto do fim da aula passada acerca da
Aula: 4 Temática: Células Eletroquímicas eletroquímicas. Trataremos da lei limite de Debye-Hückel e definiremos as células. Lei limite de Debye-Hückel O modelo proposto do fim da aula passada acerca da
E cel = E catodo - E anodo E cel = 0,337 ( 0,763) E cel = 1,100 V. ZnSO 4(aq) 1,0 mol L -1 CuSO 4(aq) 1,0 mol L -1
 QMC5351 Química Analítica Instrumental POTENCIOMETRIA Análise Potenciométrica Conceitos Iniciais CÉLULA ELETROQUÍMICA sistema onde dois eletrodos, cada um deles imerso em uma solução eletrolítica (interligadas
QMC5351 Química Analítica Instrumental POTENCIOMETRIA Análise Potenciométrica Conceitos Iniciais CÉLULA ELETROQUÍMICA sistema onde dois eletrodos, cada um deles imerso em uma solução eletrolítica (interligadas
APOSTILA QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes
 1 APOSTILA 1-2009 QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes I. Polarografia Objetivos: Obter e interpretar as curvas corrente versus
1 APOSTILA 1-2009 QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes I. Polarografia Objetivos: Obter e interpretar as curvas corrente versus
Reações de oxirredução
 LCE-108 Química Inorgânica e Analítica Reações de oxirredução Wanessa Melchert Mattos 2 Ag + + Cu (s) 2 Ag (s) + Cu 2+ Baseada na transferência de elétrons de uma substância para outra Perde oxigênio e
LCE-108 Química Inorgânica e Analítica Reações de oxirredução Wanessa Melchert Mattos 2 Ag + + Cu (s) 2 Ag (s) + Cu 2+ Baseada na transferência de elétrons de uma substância para outra Perde oxigênio e
HELOISA NUNES DA MOTTA ESTUDO DA CINÉTICA DE CRESCIMENTO DE ÓXIDOS SOBRE METAIS. O CASO DO CÁDMIO EM MEIO ALCALINO
 HELOISA NUNES DA MOTTA ESTUDO DA CINÉTICA DE CRESCIMENTO DE ÓXIDOS SOBRE METAIS. O CASO DO CÁDMIO EM MEIO ALCALINO Tese apresentada como requisito parcial à obtenção do grau de doutor em Engenharia. Curso
HELOISA NUNES DA MOTTA ESTUDO DA CINÉTICA DE CRESCIMENTO DE ÓXIDOS SOBRE METAIS. O CASO DO CÁDMIO EM MEIO ALCALINO Tese apresentada como requisito parcial à obtenção do grau de doutor em Engenharia. Curso
EXAME SELETIVO PARA INGRESSO NO CURSO DE MESTRADO EM QUÍMICA 2014/2016. Tabela Periódica dos Elementos
 MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DO PIAUÍ CENTRO DE CIÊNCIAS DA NATUREZA Pró-reitoria de Pesquisa e Pós-Graduação Coordenação do Programa de Pós-Graduação em Química EXAME SELETIVO PARA INGRESSO
MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DO PIAUÍ CENTRO DE CIÊNCIAS DA NATUREZA Pró-reitoria de Pesquisa e Pós-Graduação Coordenação do Programa de Pós-Graduação em Química EXAME SELETIVO PARA INGRESSO
Minicurso: Medição de ph e Íons por Potenciometria
 Minicurso: por Potenciometria Instrutor: Nilton Pereira Alves São José dos Campos 29/05/2010 1/37 Instrutor: Nilton Pereira Alves Técnico químico ECOMPO SJC - SP Bacharel em Química Oswaldo Cruz SP Mestre
Minicurso: por Potenciometria Instrutor: Nilton Pereira Alves São José dos Campos 29/05/2010 1/37 Instrutor: Nilton Pereira Alves Técnico químico ECOMPO SJC - SP Bacharel em Química Oswaldo Cruz SP Mestre
DESENVOLVIMENTO DE METODOLOGIA ELETROANALÍTICA PARA DETERMINAÇÃO DE PENICILINAS UTILIZANDO ELETRODO DE COBRE
 UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS FÍSICAS E MATEMÁTICAS DEPARTAMENTO DE QUÍMICA DESENVOLVIMENTO DE METODOLOGIA ELETROANALÍTICA PARA DETERMINAÇÃO DE PENICILINAS UTILIZANDO ELETRODO
UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS FÍSICAS E MATEMÁTICAS DEPARTAMENTO DE QUÍMICA DESENVOLVIMENTO DE METODOLOGIA ELETROANALÍTICA PARA DETERMINAÇÃO DE PENICILINAS UTILIZANDO ELETRODO
Coulometria 03/10/2011. Eletroquímica. Tipos de métodos eletroanalíticos
 Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Eletroquímica Coulometria Estáticos Potenciometria Métodos Interfaciais Titulações Potenciométricas Dinâmicos Potencial Controlado Corrente Constante
Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Eletroquímica Coulometria Estáticos Potenciometria Métodos Interfaciais Titulações Potenciométricas Dinâmicos Potencial Controlado Corrente Constante
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
para as soluções e pressão para gases. Identificar o par
 Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
Escola Secundária de Lagoa Química 12º Ano Paula Melo Silva Ficha de Trabalho 2 Metais e Ligas Metálicas: Pilhas e Baterias: uma oxidação útil Proteção dos metais Metais, complexos e cor Conteúdos e Metas
DESENVOLVIMENTO DE GENOSSENSOR ELETROQUÍMICO BASEADO EM ELETRODOS IMPRESSOS DE CAROBONO E POLIPIRROL PARA APLICAÇÃO EM DIAGNÓSTICO DO HPV-18
 DESENVOLVIMENTO DE GENOSSENSOR ELETROQUÍMICO BASEADO EM ELETRODOS IMPRESSOS DE CAROBONO E POLIPIRROL PARA APLICAÇÃO EM DIAGNÓSTICO DO HPV-18 Eloisa Neves Almeida Pimentel 1 ; Rosa Amalia Fireman Dutra
DESENVOLVIMENTO DE GENOSSENSOR ELETROQUÍMICO BASEADO EM ELETRODOS IMPRESSOS DE CAROBONO E POLIPIRROL PARA APLICAÇÃO EM DIAGNÓSTICO DO HPV-18 Eloisa Neves Almeida Pimentel 1 ; Rosa Amalia Fireman Dutra
MONTAGEM E CARACTERIZAÇÃO DE UMA PILHA DE COMBUSTÍVEL DE BOROHIDRETO/PERÓXIDO DE HIDROGÉNIO
 Mestrado em Energia e Bioenergia Departamento de Ciências e Tecnologia da Biomassa MONTAGEM E CARACTERIZAÇÃO DE UMA PILHA DE COMBUSTÍVEL DE BOROHIDRETO/PERÓXIDO DE HIDROGÉNIO PAULO Guilherme SATURNINO
Mestrado em Energia e Bioenergia Departamento de Ciências e Tecnologia da Biomassa MONTAGEM E CARACTERIZAÇÃO DE UMA PILHA DE COMBUSTÍVEL DE BOROHIDRETO/PERÓXIDO DE HIDROGÉNIO PAULO Guilherme SATURNINO
PAGQuímica Eletroquímica
 Atenção: detectamos que em diversos exercícios a resolução escaneada e colada após o enunciado não corresponde à resolução correta. Agradecemos que tais exercícios nos sejam comunicados via fórum e, se
Atenção: detectamos que em diversos exercícios a resolução escaneada e colada após o enunciado não corresponde à resolução correta. Agradecemos que tais exercícios nos sejam comunicados via fórum e, se
. (Um agente oxidante comumente formado nas células aeróbias)
 Pense: Qual seria a distribuição de elétrons no íon superóxi-ânion? O 2. (Um agente oxidante comumente formado nas células aeróbias) Onde estudar?? Atkins e Jones, Princípios de Química, Cap. 3>> p. 93-131
Pense: Qual seria a distribuição de elétrons no íon superóxi-ânion? O 2. (Um agente oxidante comumente formado nas células aeróbias) Onde estudar?? Atkins e Jones, Princípios de Química, Cap. 3>> p. 93-131
PMT2423 FÍSICO-QUÍMICA PARA METALURGIA E MATERIAIS III. PMT Físico-Química para Metalurgia e Materiais III - Neusa Alonso-Falleiros
 PMT2423 FÍSICO-QUÍMICA PARA METALURGIA E MATERIAIS III 1 Reações Eletroquímicas e suas Aplicações Corrosão Eletrodeposição Hidrometalurgia (ex.: cobre; níquel; zinco) Reações Metal / Escória Eletroconformação
PMT2423 FÍSICO-QUÍMICA PARA METALURGIA E MATERIAIS III 1 Reações Eletroquímicas e suas Aplicações Corrosão Eletrodeposição Hidrometalurgia (ex.: cobre; níquel; zinco) Reações Metal / Escória Eletroconformação
MURILO SÉRGIO DA SILVA JULIÃO
 UNIVERSIDADE DE SÃO PAULO INSTITUTO DE QUÍMICA Programa de Pós-Graduação em Química MURILO SÉRGIO DA SILVA JULIÃO Comportamento Eletroquímico de Nitrofuranos em Eletrodos de Diamante Dopado com Boro Modelo
UNIVERSIDADE DE SÃO PAULO INSTITUTO DE QUÍMICA Programa de Pós-Graduação em Química MURILO SÉRGIO DA SILVA JULIÃO Comportamento Eletroquímico de Nitrofuranos em Eletrodos de Diamante Dopado com Boro Modelo
Questão 1. (X pontos) Expectativa de resposta
 Questão 1. (X pontos) A acidez e a basicidade de compostos orgânicos podem ser influenciadas por diversos fatores, dentre os quais a ressonância, citada como um exemplo de fator intrínseco. No esquema
Questão 1. (X pontos) A acidez e a basicidade de compostos orgânicos podem ser influenciadas por diversos fatores, dentre os quais a ressonância, citada como um exemplo de fator intrínseco. No esquema
Detalhes: Potenciostato Célula Eletroquímica Tipos de célula eletroquímica
 2.4 Métodos experimentais em corrosão. 2.5 Tipos de corrosão: generalizada,... Detalhes: Potenciostato Célula Eletroquímica Tipos de célula eletroquímica PMT 2507- CORROSÃO E PROTEÇÃO DOS MATERIAIS - Neusa
2.4 Métodos experimentais em corrosão. 2.5 Tipos de corrosão: generalizada,... Detalhes: Potenciostato Célula Eletroquímica Tipos de célula eletroquímica PMT 2507- CORROSÃO E PROTEÇÃO DOS MATERIAIS - Neusa
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PC1. [D] SOLUÇÃO PRATIQUE EM CASA Teremos: 2 3 Cr 2O 7 (aq) 14H (aq) 6e 2Cr (aq) 7H2O( ); 0 E 1,33 V C O 4 (aq) 2H (aq) 2e C O 3 (aq) H2O( ); 0 E 1,23 V + 1,33 V > +1,23 V Então: 2 3 Cr 2O 7 (aq)
SOLUÇÃO PC1. [D] SOLUÇÃO PRATIQUE EM CASA Teremos: 2 3 Cr 2O 7 (aq) 14H (aq) 6e 2Cr (aq) 7H2O( ); 0 E 1,33 V C O 4 (aq) 2H (aq) 2e C O 3 (aq) H2O( ); 0 E 1,23 V + 1,33 V > +1,23 V Então: 2 3 Cr 2O 7 (aq)
ELETROQUÍMICA Profº Jaison Mattei
 ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
2. POLAROGRAFIA 2.1 CONCEITOS GERAIS
 2. POLAROGRAFIA 2.1 CONCEITOS GERAIS A eletroanalítica é um ramo do conhecimento da química em que são estabelecidas relações diretas entre as concentrações do analito e alguma propriedade elétrica como
2. POLAROGRAFIA 2.1 CONCEITOS GERAIS A eletroanalítica é um ramo do conhecimento da química em que são estabelecidas relações diretas entre as concentrações do analito e alguma propriedade elétrica como
Respondem à atividade do analito, de forma rápida e reprodutível. Assim... ΔE = função da atividade do analito
 Respondem à atividade do analito, de forma rápida e reprodutível. Assim... ΔE = função da atividade do analito Idealmente, estes eletrodos deveriam ser específicos. Entretanto, a maioria deles são seletivos
Respondem à atividade do analito, de forma rápida e reprodutível. Assim... ΔE = função da atividade do analito Idealmente, estes eletrodos deveriam ser específicos. Entretanto, a maioria deles são seletivos
Prova de Química Analítica
 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2018/01 EDITAL PPGQ Nº 001/2018 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número de seu CPF (brasileiros/estrangeiros)
PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2018/01 EDITAL PPGQ Nº 001/2018 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número de seu CPF (brasileiros/estrangeiros)
A teoria dos orbitais moleculares
 A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Equilíbrio Químico. Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação
 Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP)
 CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP) Medição de ph e íons por potenciometria Ministrante: Nilton Pereira Alves Quimlab Química Contatos: [email protected] Apoio São José dos Campos, 29 de
CONSELHO REGIONAL DE QUÍMICA - IV REGIÃO (SP) Medição de ph e íons por potenciometria Ministrante: Nilton Pereira Alves Quimlab Química Contatos: [email protected] Apoio São José dos Campos, 29 de
Desenvolvimento e comparação de métodos voltamétricos para a determinação de ciclofenil e primaquina em medicamentos e em urina
 Wagner Felippe Pacheco Desenvolvimento e comparação de métodos voltamétricos para a determinação de ciclofenil e primaquina em medicamentos e em urina Dissertação de Mestrado Dissertação apresentada como
Wagner Felippe Pacheco Desenvolvimento e comparação de métodos voltamétricos para a determinação de ciclofenil e primaquina em medicamentos e em urina Dissertação de Mestrado Dissertação apresentada como
Cursos Técnicos Integrados ao Ensino Médio
 Cursos Técnicos Integrados ao Ensino Médio Referência: BROWN, THEODORE L.; LEMAY JR., H. EUGENE; BURSTEN, BRUCE E.; BURDGE, JULIA R.. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005.
Cursos Técnicos Integrados ao Ensino Médio Referência: BROWN, THEODORE L.; LEMAY JR., H. EUGENE; BURSTEN, BRUCE E.; BURDGE, JULIA R.. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005.
Tabela Periódica dos Elementos
 MINISTÉRI DA EDUCAÇÃ UNIVERSIDADE FEDERAL D PIAUÍ CENTR DE CIÊNCIAS DA NATUREZA Pró-reitoria de Pesquisa e Pós-Graduação Coordenação do Programa de Pós-Graduação em Química EXAME SELETIV PARA INGRESS N
MINISTÉRI DA EDUCAÇÃ UNIVERSIDADE FEDERAL D PIAUÍ CENTR DE CIÊNCIAS DA NATUREZA Pró-reitoria de Pesquisa e Pós-Graduação Coordenação do Programa de Pós-Graduação em Química EXAME SELETIV PARA INGRESS N
ELETROQUÍMICA OU. Profa. Marcia M. Meier QUÍMICA GERAL II
 ELETROQUÍMICA OU REAÇÕES DE TRANSFERÊNCIA DE ELÉTRONS Profa. Marcia M. Meier QUÍMICA GERAL II 1 Objetivo Compreender: Balanceamento de equações redox em solução ácida e básica. Células galvânicas e potencial
ELETROQUÍMICA OU REAÇÕES DE TRANSFERÊNCIA DE ELÉTRONS Profa. Marcia M. Meier QUÍMICA GERAL II 1 Objetivo Compreender: Balanceamento de equações redox em solução ácida e básica. Células galvânicas e potencial
