PROPRIEDADES DAS SOLUÇÕES
|
|
|
- Aníbal Araújo Angelim
- 9 Há anos
- Visualizações:
Transcrição
1 PROPRIEDADES DAS SOLUÇÕES M Filomena Botelho Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica Identificar e descrever os métodos de medir a pressão osmótica Escolher o método de medir π de acordo com o tipo de solução Ser capaz de interpretar a imporância da pressão osmótica: Soro sanguíneo Plasma sanguíneo Ultrafiltração renal Equilíbrio de Starling 1
2 Propriedades das soluções As propriedades das soluções são muito importantes em Biologia -Aditivas - Constitutivas - Coligativas Propriedades Aditivas Estão relacionadas com a massa das soluções Propriedades Constitutivas Dependem da natureza do soluto Propriedades Coligativas Dependem da unicamente do número de partículas por unidade de volume, em solução, sendo pois independentes da natureza do soluto Propriedades Coligativas Dependem da unicamente do número de partículas por unidade de volume, em solução, sendo pois independentes da natureza do soluto 1 abaixamento relativo da tensão de vapor 2 abaixamento da temperatura de congelação (ponto crioscópico) 3 elevação da temperatura de ebulição (ponto ebulioscópico) 4 osmose 2
3 1 - Abaixamento relativo da tensão de vapor Para qualquer temperatura, a pressão do vapor do solvente em solução é menor do que a pressão do solvente puro (à mesma temperatura) Numa solução diluída o abaixamento relativo da pressão de vapor do solvente, em relação ao solvente puro, é igual à relação entre os números de moles do -do soluto -do solvente, ou proporcional à concentração molar da solução. 1ª Lei de Raoult - Tomonetria 1º Lei de Raoult Lei da Tomonetria P 0 -P P 0 = n n = K C s n número de moles da solução n numero de moles do solvente T constante P 0 pressão de vapor do solvente puro P pressão de vapor do solvente em solução C s concentração molar O abaixamento relativo da pressão de vapor da solução, em relação ao solvente puro, é proporcional à concentração molar da solução (solução diluída) Solvente = água 3
4 Solvente = água P = P(t) - para os diferentes estados P 2 líquido 1 Curva 1 - É a curva P(t) correspondente à passagem da água líquida a vapor de água líquida (vaporização) - Separa os valores de pressão e temperatura para os quais a água é líquida ou gasosa 0 sólido 3 M vapor t Curva 2 - É a curva P(t) correspondente à passagem da água sólida a água líquida (fusão do gelo) - Separa os valores de pressão e temperatura para os quais a água é solida ou líquida As curvas 1, 2 e 3 convergem no ponto M (ponto triplo) Curva 3 - É a curva P(t) correspondente à passagem da água sólida a vapor de água (sublimação do gelo) - Separa os valores de pressão e temperatura para os quais a água é solida ou vapor de água Solvente = água P = P(t) - para os diferentes estados P 0,006 atm sólido 3 2 M líquido vapor 1 ponto triplo Corresponde aos valores de pressão e temperatura para os quais existem em equilíbrio: - água sólida gelo - água líquida - vapor de água 0 0,01ºC t Corresponde ao par de valores de pressão e temperatura de 0,006 atm e de 0,01ºC 4
5 P P E P M P N 0 sólido N 3 M Se no solvente puro dissolvermos um soluto, obteremos uma solução. Observa-se então um: - abaixamento da pressão de vapor da água (em relação à pressão de vapor da água pura) líquido vapor θ t M 100 t 1 1 t Curva 1 - Traduz a variação da pressão de vapor da água com a temperatura, quando consideramos uma solução diluída, em que a água é o solvente Curva 2 e 3 - o mesmo que as 2 e 3 mas com uma solução em vez de solvente puro Ponto N (novo ponto triplo) corresponde aos valores de pressão e temperatura, para os quais, quando estamos em presença de uma solução diluída, coexistem simultaneamente e em equilíbrio os três estados da água: sólido, líquido e gasoso Esta temperatura é θº inferior a 0ºC 2 - Abaixamento da temperatura de congelação O valor de θ P É o abaixamento da temperatura de congelação, isto é, o abaixamento crioscópico da solução em relação ao solvente puro sólido 2 2 N 3 3 M líquido vapor 1 1 Se a solução for muito diluída, o ponto N é suficientemente próximo do ponto M, para se poder considerar o segmento MN como uma recta 0 θ t 5
6 P 2 líquido 1 1 P M P N sólido 2 N 3 3 M vapor Se o segmento MN for uma recta significa que P θ = constante 0 θ t Pela 1ª Lei de Raoult estabelece-se uma relação entre a: - variação relativa da pressão de vapor, e a - concentração molar para uma determinada temperatura 1ª Lei de Raoult P 0 -P P 0 = K C s Se a variação da pressão de vapor for considerada em relação à pressão do ponto M, vem: P = K C P s M Combinando estas equações, e como P = P M P N, vem: P = P M K C s e θ = Const P θ = K C s O abaixamento do ponto de congelação de uma solução, em relação ao ponto de congelação do solvente, é proporcional à concentração molar da solução 2ª Lei de Raoult - Crioscopia θ -depende da concentração molar natureza do solvente - não depende da natureza do soluto 6
7 3 Elevação da temperatura de ebulição Quando a pressão do vapor do solvente iguala a pressão atmosférica, é quando se atinge o: - ponto de ebulição P P E P M P N sólido 2 2 N 3 3 M líquido vapor 1 1 Para o caso do solvente puro (curva 1), a temperatura correspondente à pressão de vapor do solvente de 760 mmhg, isto é, a pressão atmosférica, é de: ºC 0 θ t M 100 t t Para o caso de uma solução diluída (curva 1 ), a temperatura para a qual a pressão de vapor do solvente é de 760 mmhg, é maior do que 100 ºC, isto é: -(100 + t) ºC P P E P M P N sólido 2 2 N 3 3 M líquido vapor 1 E R1 F Do mesmo modo que em relação ao ponto crioscópico, se o segmento FR for rectilíneo, vem P t = constante 0 θ t M 100 t t Usando outra vez a 1ª Lei de Raoult: P = K C, podemos obter a seguinte ralação: P s E t = K C s 3ª Lei de Raoult - Lei da ebulioscopia O aumento da temperatura de ebulição de uma solução é proporcional à concentração molar do solução 7
8 t = K C s 3ª Lei de Raoult - Lei da ebulioscopia A variação da temperatura ( t): - não depende da natureza do soluto -depende da concentração molar do soluto natureza do solvente 4 Osmose - propriedade coligativa Difusão de solvente através de membranas pela presença de moléculas em solução incapazes de atravessar a membrana - Supondo dois recipientes separados por uma membrana - Num dos recipientes existe uma solução diluída - No outro recipiente só há solvente puro - A membrana é semi-permeável: M - permeável ao solvente - impermeável ao soluto I II solução só solvente puro 8
9 Passado algum tempo, a água desceu no recipiente II (só solvente puro) e subiu no recipiente I (solução) M I II O nível atingido no recipiente I, é tanto maior quanto mais concentrada for a solução inicial h Para definirmos pressão osmótica, vamos pensar no caso anterior: é a pressão que se tem que exercer sobre uma solução em contacto com solvente puro, através de uma membrana semi-permeável, de modo a impedir a osmose É a força de pressão que é necessária para equilibrar a resultante das forças de difusão do solvente através da membrana Dimensões dine/cm 2 Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica 9
10 PRESSÃO OSMÓTICA M Filomena Botelho Medição da pressão osmótica Três métodos para medir a pressão osmótica 1. Osmometria 2. Crioscopia 3. Tonometria 10
11 1 - Osmometria Método que usa um osmómetro, onde uma membrana semipermeável: - mede-se a altura que a solução atinge no tubo capilar Este método só mede a: - pressão osmótica produzida pelas partículas para as quais a membrana é impermeável. Esta característica, torna a pressão osmótica sem valor absoluto, uma vez que o seu valor fica a depender fundamentalmente - propriedades da membrana - características do soluto Como geralmente não se conseguem arranjar membranas semipermeáveis a: - pequenos iões - moléculas de pequenas dimensões Este método é inadequado para avaliar a pressão osmótica de soluções micromoleculares. A osmometria é um método importante para a medição da pressão osmótica de soluções de macromoléculas, para as quais é relativamente fácil arranjar membranas impermeáveis. 11
12 2 - Crioscopia A aplicação da 2ª lei de Raoult, está na base deste método: a temperatura de congelação de uma solução é mais baixa do que a do solvente puro (abaixamento do ponto crioscópico) Abaixamento crioscópico θ = K Cs Pressão osmótica π = RT Cs Relacionando as duas equações com eliminação de Cs, vem: π = RT θ K π = RT K θ R = 8,314 x 10 7 erg ºK -1 mol -1 K (solvente água) = 1,87 x 10 3 ºK mol -1 cm 3 π = 8,314 x ,87 x 10 3 T θ π = 4,44 x 10 4 T θ dines/cm 2 1 atm = 1,012 x 10 6 dines/cm 2 π = 0,044 T θ atm Baseando-se no facto de que a temperatura de congelação de uma solução é mais baixa do que a temperatura de congelação do solvente puro 12
13 O equilíbrio água-gelo à temperatura de 0ºC, é um: equilíbrio dinâmico compensando os caudais moleculares que se estabelecem nos dois sentidos: água em direcção ao gelo gelo em direcção à água líquida Quando a água líquida contém um soluto, o: - caudal água-gelo - diminui, rompendo-se o equilíbrio e aumentando o caudal de solvente através da interface gelo-água líquida. O gelo funde O equilíbrio só é recuperado se diminuirmos a temperatura A temperatura de fusão é mais baixa para uma solução do que para o solvente puro Os valores da pressão que se obtêm com a crioscopia referem-se à: totalidade das partículas em solução. Geralmente este método não é aplicável a macromoléculas, pois para se obter um abaixamneto crioscópico mensurável, é necessário que a concentração seja elevada: θ = K C M C = concentração ponderal Como para as macromoléculas M é também elevada, fica que só para grandes concentrações é que θ émensurável. 13
14 Exemplo Para se ter um abaixamento de 0,1ºK no ponto de congelação, a concentração molar será de: θ = K Cs K (água) = 1,87 x 10 3 ºK mol -1 cm 3 0,1 Cs = = 5,3 x 10-5 mol/cm 1,87 x Para uma proteína, com um peso molecular de Dalton, a concentração molar será de: Cs = 5,3 g/cm 3 Muito longe de uma solução diluída Os valores da pressão que se obtêm com a crioscopia referem-se à: totalidade das partículas em solução. Geralmente este método não é aplicável a macromoléculas, pois para se obter um abaixamneto crioscópico mensurável, é necessário que a concentração seja elevada: θ = K C M C = concentração ponderal Como para as macromoléculas M é também elevada, fica que só para grandes concentrações é que θ émensurável. Porém para as micromoléculas, a crioscopia é um método muito útil A osmometria e a crioscopia são métodos complementares de medição da pressão osmótica 14
15 3 - Tonometria Usa a determinação do: abaixamento da tensão de vapor de um solvente em solução relativamente à tensão de vapor do solvente puro Permite medir a pressão osmótica, qualquer que seja a temperatura Apresenta dificuldades, mas permite por vezes medições em fases biológicas (37ºC) Aplicações Pressão oncótica - pressão osmótica devida exclusivamente às proteínas plasmáticas O abaixamento crioscópico do soro humano é: θ = 0,56 ºK Pela 2ª Lei de Raoult: θ = K Cs Como π = RT Cs, vem: π = RT K θ π = 8,314 x ,87 x 10 3 T θ K (água) = 1,87 x 10 3 ºK mol -1 cm 3 R = 8,314 J ºK mol -1 ºK -1 π = 4,44 x 10 4 T θ dine/cm 2 15
16 O abaixamento crioscópico do soro humano é: θ = 0,56 ºK Pela 2ª Lei de Raoult: θ = K Cs Como π = RT Cs, vem: π = RT K θ π = 8,314 x ,87 x 10 3 T θ K (água) = 1,87 x 10 3 ºK mol -1 cm 3 R = 8,314 J ºK mol -1 ºK -1 π = 4,44 x 10 4 T θ dine/cm 2 A pressão osmótica do soro, para a temperatura de 37ºC, é: T = = 310 ºK π = 4,44 x 10 4 x 310 x 0,56 1,012 x 10 6 = 7,6 atm A concentração de proteínas no plasma é = 70 g/l A massa molecular média das proteínas do plasma ± A pressão osmótica do plasma é então: n C π onc = RT = RT V M 70 g/l = 70 x 10-3 g/ml R = 8,314 J ºK mol -1 ºK x 10 π onc = -3 x 8,314 x 10 7 x 310 = 2,6 x 10 4 dine/cm π onc = 0,026 atm pressão oncótica do plasma = 0,026 atm Como a pressão osmótica do soro = 7,6 atm π onc 0,026 = = 0,0033 7,6 π soro 0,33 % A pressão oncótica é 0,33% da pressão osmótica total do soro 16
17 Aplicações Osmolaridade Vamos supor uma solução onde existem: - n moles de soluto Resultando: - n A - partículas em solução ( A número de Avogadro) Se: 1 osmole - corresponde ao número de Avogadro de partículas em solução, independentemente da sua espécie Podemos então dizer, que para a solução acima, a sua osmolaridade é N (a pressão osmótica só depende do número de partículas em solução e não da sua natureza) No caso de iões: N = n (1 α) + n δα α grau de ionização δ nº de iões/moléculas dissociadas A partir do abaixamento crioscópico é pois possível calcular a osmolaridade do soro: θ 0,56 Cs = = = 0,298 osmol/litro K 1,87 17
18 Aplicações Qual a concentração de uma solução de NaCl com a mesma osmolaridade? NaCl - massa molecular = 58,5 α 1 δ 2 Número de iões = 2 = N 58,5 g contêm em solução 2 x 6,023 x partículas (correspondem a 2 osmoles) A concentração ponderal é: θ 0,56 Cs = = = 0,298 osmol/l K 1,87 58,5 2 X 0,298 = 9,75 g/l Concentração do soro fisiológico Teoricamente Duas soluções com a mesma osmolaridade, produzem a mesma pressão osmótica: são duas soluções isotónicas Na prática Quando duas soluções estão separadas por uma membrana, elas só apresentam a mesma pressão osmótica aparente se a membrana for perfeitamente semi-permeável para os dois solutos Se a membrana tiver permeabilidade selectiva para alguns iões, duas soluções com igual osmolaridade, podem apresentar pressões osmóticas diferentes 18
19 As características das membranas semi-permeáveis usadas, podem originar diferentes medições da pressão osmótica, para a mesma solução Assim: usando membranas semi-permeáveis reais (não absolutamente impermeáveis às moléculas de quaisquer solutos em solução) as pressões osmóticas aparentes obtidas pela: osmometria - mais baixa são diferentes das obtidas pela crioscopia Nestas circunstâncias, o solvente é considerado como sendo constituído pela: água partículas para as quais a membrana é permeável Usando uma membrana que deixe passar algumas moléculas do soluto (as mais pequenas) é como se a: - osmolaridade da solução diminuísse A pressão osmótica efectiva é a pressão osmótica obtida pelo método da osmometria A pressão oncótica dos líquidos biológicos equivale quase sempre à pressão osmótica efectiva 19
20 Soluções hipotónicas Uma solução é hipotónica em relação a outra, separada dela por uma membrana semi-permeável, quando: perde solvente Esta perda de solvente ocorre, porque a solução que perde solvente, tem menor pressão osmótica efectiva Soluções hipertónicas Uma solução é hipertónica em relação a outra, separada dela por uma membrana semi-permeável, quando: ganha solvente No caso anterior, a solução que ganha o solvente, é hipertónica. Soluções isotónicas Quando não existe transporte de solvente entre duas soluções separadas por uma membrana semi-permeável, elas são: isotónicas Glóbulos vermelhos colocados numa solução hipertónica diminuem o seu volume - ocorre plasmólise Glóbulos vermelhos colocados numa solução hipotónica aumentam o seu volume - ocorre hemólise 20
21 Resistência globular A maior parte das membranas biológicas, são permeáveis aos pequenos iões: ex. Membranas capilares sanguíneos Uma excepção importante, é a: Membranas plasmática dos glóbulos vermelhos a qual não é permeável as iões de NaCl a 0,15 M, o que corresponde solução de cloreto de sódio a 9 g/l (0,9 g%) isotónica com a plasma soro fisiológico Deste modo: os glóbulos vermelhos colocados numa solução destas, não variam o seu volume. Alterações da resistência globular Estes conhecimentos são importantes para o estudo da resistência da membrana dos glóbulos vermelhos, pois há situações patológicas onde ela se encontra reduzida Os glóbulos vermelhos normais, só: - começam a sofrer hemólise, para soluções de cloreto de sódio com concentrações entre 0,4 e 0,48 g% (0,07 a 0,08 M) - sofrem hemólise total, para soluções de cloreto de sódio com concentrações 0,3 g% Em situações patológicas: - a hemólise inicia-se para soluções de cloreto de sódio com concentrações da ordem dos 0,6-0,7 g% 21
22 Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica Identificar e descrever os métodos de medir a pressão osmótica Escolher o método de medir π de acordo com o tipo de solução ULTRAFILTRAÇÃO M Filomena Botelho 22
23 Ultrafiltração renal A ultrafiltração renal, é uma situação muito importante, dependente dos movimentos do solvente Processo de filtração glomerular no rim, com formação da urina primitiva Vamos ver esquematicamente o que sucede: Membrana semipermeável real P 2 Solvente puro Solução P > π P 1 Jw = Lp ( P σ π) P = P 1 P 2 Membrana semipermeável real P 2 Solvente puro Solução P > π P 1 Jw = Lp ( P - σ π) P = P 1 P 2 A pressão hidrostática P ( P) ésuperior àpressão osmótica efectiva (π), donde resulta uma: corrente de solvente da solução para o solvente puro ultrafiltração ultrafiltração Nesta situação, a pressão hidrostática: anula a osmose Forças de difusão a actuar sobre as moléculas do solvente fornece uma força de pressão adicional que faz deslocar o solvente para o lado do solvente puro, através da membrana 23
24 Filtração glomerular renal No caso da filtração glomerular renal: a nível da componente sanguínea a pressão hidrostática do sangue nos capilares glomerulares (resultante da acção mecânica do coração) é superior à pressão oncótica do sangue a nível da parede dos capilares glomerulares há uma corrente de solvente (solvente mais pequenas moléculas e iões) que vai dos capilares para o espaço glomerular (solução - solvente ) Esta corrente de solvente, corresponde à formação de: - urina primitiva O trabalho dispendido na ultrafiltração glomerular é fornecido pelo coração: Forças de pressão (P) Se o coração não conseguir gerar esta pressão (caso de algumas situações de insuficiência cardíaca) no glomérulo, P pode não conseguir ultrapassar π deixando de se poder realizar a ultrafiltração glomerular anúria 24
25 Trabalho osmótico Solução I Solvente puro II Êmbolo x a x 0 x 0 + x x m Membrana semi-permeável tem área A Funciona como êmbolo Lado I contém solução de macromoléculas com concentração C -(moles/cm 3 ) Lado II contém solvente puro Êmbolo E fixo Solução I Solvente puro II Êmbolo x a x 0 x 0 + x x m Membrana semi-permeável área A Funciona como êmbolo Lado I solução de macromoléculas Lado II solvente puro Êmbolo E fixo A temperatura constante, e em condições reversíveis: o trabalho das forças de difusão para deslocar a membrana de x 0 para x 0 + x, é: W = π. A. x (trabalho elementar) (Após este trabalho π diminui, pois a concentração da solução diminui, isto é, a pressão osmótica π éfunção de x) 25
26 Solução I Solvente puro II Êmbolo x a x 0 x 0 + x x m Membrana semi-permeável área A Funciona como êmbolo Lado I solução de macromoléculas Lado II solvente puro Êmbolo E fixo o trabalho das forças de difusão para deslocar o êmbolo de x 0 para x m, é: W = W = π. A. x x 0, x m Como: A. x = V (volume do cilindro de área A e comprimento de x a x 0 + x) vem: W = π. V Mas tendo em atenção que o número de moles de soluto que existe no compartimento I, para as diversas posições do êmbolo (membrana), pode ser escrito: n = C 0. A. x 0 Para a posição x 0 n = C 1. A. x 1 Para a posição x 1 n = C 2. A. x 2 Para a posição x 2 Se n = 1, vem: C 0. A = x0 1 C 1. A = x1 1 C 2. A = x2 1 Generalizando: C. A = x 1 26
27 Voltando à equação do trabalho das forças de difusão para o deslocamento do êmbolo de x 0 a x m : W = π. A. x No limite, quando dx 0, o somatório transforma-se no integral definido: x m W = π. A. dx x 0 Como: π = C R T C = concentração molar Vem: x m W = C. R. T. A. dx x 0 x m W = R T C. A. dx x 0 x m W = R T C. A. dx x 0 Mas já vimos que: C. A = x 1 Então: x m W = R T 1 x x 0 dx W = R T ln x m x0 27
28 Mas: W = R T ln x m x0 W = π. A. x π 1 = C 1 RT π 2 = C 2 RT π 1 C 1 π = 2 C 2 Contudo, sabemos também que: π 1 C 1 π = 2 C 2 1 Uma vez que C A = x Sendo assim: C 0 W = R T ln Cm C 0 W = R T ln Cm W = R T ln π 0 πm Trabalho realizado pelas forças de pressão osmótica para diluir a solução desde a concentração C 0 a C m π 0 pressão osmótica da solução para a posição x 0 π m pressão osmótica da solução para a posição x m C 0 concentração do soluto para a posição x 0 C m concentração do soluto para a posição x m 28
29 Voltando ao esquema anterior: Solução I C Solvente puro II Êmbolo E x A x 0 x m Se no êmbolo E actuar uma força de pressão hidrostática P, de tal maneira que se ultrapasse a pressão osmótica da solução π: - a membrana (que se comporta como um êmbolo) desloca-se para uma posição à esquerda do x 0. Quando este deslocamento ocorre, a pressão hidrostática da solução fica maior do que a pressão osmótica. Nesta situação vai haver um: - deslocamento de solvente do lado da solução para o lado do solvente (a solução tende a concentrar). ULTRAFILTRAÇÃO Voltando ao esquema anterior: Solução I C Solvente puro II Êmbolo E x A x 0 x m Se a membrana se deslocar para x, podemos A dizer que a concentração da solução é C A. Neste caso, o trabalho efectivo pela força de pressão hidrostática P, em condições de reversibilidade, é de: W = R T ln W = R T ln π A π0 C A C0 Trabalho realizado contra as forças de pressão osmótica 29
30 Trabalho do Rim Poderia por-se então uma pergunta: qual o trabalho renal na excreção de 1 osmole? Abaixamento crioscópico do soro: - θ = 0,56 ºC 0,298 osmoles/l Abaixamento crioscópico da urina: - θ = 3,5 ºC 1,8 osmoles/l Isto significa que o rim produz trabalho para aumentar o osmolaridade. Então: W = R T ln C u C s = R T ln π u π s W = R T ln C u C s = R T ln π u π s Como: θ = K Cs Vem que: θ W = R T ln u θs W = 8,314 x 310 x ln 6 W = 2600 x ln J/osmole Este trabalho, contudo, não é realizado reversivelmente, pois, o rim dispende energia noutro tipo de processos 30
31 Por dia: O rim elimina cerca de 1,5 l de urina, o que corresponde a 2,7 osmoles. Sendo assim: o trabalho total renal é: W = J/dia (Se for realizado reversivelmente) Na realidade é maior Fenómeno de Starling M Filomena Botelho 31
32 Fenómeno de Starling Capilares arteriais Espaço extravascular Capilares venosos J wa J wv P A = 48 cmh 2 O π A = 42 cm H 2 O J wa P = 4 cmh 2 O π = 6 cm H 2 O J wv P V = 21 cmh 2 O π V = 42 cm H 2 O P A π A P π P V π V - Pressão hidrostática nos capilares arteriais - Pressão osmótica nos capilares arteriais - Pressão hidrostática no espaço extravascular - Pressão osmótica no espaço extravascular - Pressão hidrostática nos capilares venosos - Pressão osmótica nos capilares venosos Aplicando a expressão da densidade de corrente de água a cada tipo capilar, e considerando as diferenças de pressões entre o interior e o exterior dos vasos, vem: Parte arterial J wa = Lp ( P π) = Lp [(P A P) (π A π)] = Lp ( ) = Lp 8 J wa > 0 Na porção arterial dos capilares: J wa tem sinal positivo, o que significa que o solvente sai do interior para o exterior do vaso capilar (para o espaço extracelular) 32
33 Parte venosa J wv = Lp ( P π) = Lp [(P V P) (π V π)] = Lp ( ) = - Lp 19 J wv < 0 Na porção venosa dos capilares: J wv tem sinal negativo, pelo o que o solvente passa do espaço extracelular para o interior do capilar venoso É a esta entrada de solvente para os capilares venosos que constitui o: Fenómeno de Starling Qualquer alteração deste mecanismo, pode provocar a acumulação de fluidos no espaço extravascular, provocando os: edemas Causas para o aparecimento de edemas: 1. Diminuição da concentração de proteínas na plasma π A JwA - aumenta - diminui J wv Situações de nefroses 2. Aumento da pressão hidrostática venosa P V Insuficiência cardíaca 33
34 Membranas Biológicas As membranas biológicas são: - modelos de permeabilidade - outras funções Constituição da membrana biológica: Porção lipídica barreira à permeabilidade de moléculas e iões hidrossolúveis Porção proteica (proteínas intercaladas) formas de: transporte diferentes (transporte facilitado, transporte activo) transferência de energia transferência de carga eléctrica Outras funções: Dependentes de componentes funcionais próprios - bombas iónicas - canais de transporte - receptores membranares Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica Identificar e descrever os métodos de medir a pressão osmótica Escolher o método de medir π de acordo com o tipo de solução Ser capaz de interpretar a imporância da pressão osmótica: Soro sanguíneo Plasma sanguíneo Ultrafiltração renal Equilíbrio de Starling 34
35 Leitura adicional Biofísica Médica. JJ Pedroso de Lima Capítulo I Pag. 45 a 51 Pag. 53 a 63 35
ULTRAFILTRAÇÃO. M Filomena Botelho
 ULTRAFILTRAÇÃO M Filomena Botelho Ultrafiltração renal A ultrafiltração renal, é uma situação muito importante, dependente dos movimentos do solvente Processo de filtração glomerular no rim, com formação
ULTRAFILTRAÇÃO M Filomena Botelho Ultrafiltração renal A ultrafiltração renal, é uma situação muito importante, dependente dos movimentos do solvente Processo de filtração glomerular no rim, com formação
Profa. Maria Fernanda - Química [email protected]
 Profa. Maria Fernanda - Química [email protected] Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química [email protected] Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
3 Propriedades Coligativas
 3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
Propriedades Coligativas Aula 3
 Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
03/04/2016 AULAS 11 E 12 SETOR A
 AULAS 11 E 12 SETOR A 1 Propriedade coligativa das soluções: são aquelas que depende unicamente do número de partículas dissolvidas. Ou seja: a adição de um soluto não-volátil a uma solução provoca mudanças
AULAS 11 E 12 SETOR A 1 Propriedade coligativa das soluções: são aquelas que depende unicamente do número de partículas dissolvidas. Ou seja: a adição de um soluto não-volátil a uma solução provoca mudanças
Mudanças de fase. Temperatura e pressão críticas Os gases são liquefeitos sob o aumento da pressão a uma temperatura.
 Mudanças de fase Sublimação: sólido gás. Vaporização: líquido gás. Derretimento ou fusão: sólido líquido. Deposição: gás sólido. Condensação: gás líquido. Congelamento: líquido sólido. Mudanças de fase
Mudanças de fase Sublimação: sólido gás. Vaporização: líquido gás. Derretimento ou fusão: sólido líquido. Deposição: gás sólido. Condensação: gás líquido. Congelamento: líquido sólido. Mudanças de fase
Aula 4 PROPRIEDADES COLIGATIVAS. Glauber Silva Godoi
 Aula 4 PROPRIEDADES COLIGATIVAS META Transmitir para o aluno o conceito de propriedades coligativas e suas aplicações. OBJETIVOS Ao fi nal desta aula, o aluno deverá: entender o significado do termo propriedades
Aula 4 PROPRIEDADES COLIGATIVAS META Transmitir para o aluno o conceito de propriedades coligativas e suas aplicações. OBJETIVOS Ao fi nal desta aula, o aluno deverá: entender o significado do termo propriedades
SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO
 SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO A SOLUÇÃO IDEAL Solução: mistura homogenia de espécies químicas (única fase) Solvente: constituinte em maior quantidade Soluto:
SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO A SOLUÇÃO IDEAL Solução: mistura homogenia de espécies químicas (única fase) Solvente: constituinte em maior quantidade Soluto:
Transporte através da Membrana Plasmática. Biofísica
 Transporte através da Membrana Plasmática Biofísica Estruturas das células Basicamente uma célula é formada por três partes básicas: Membrana: capa que envolve a célula; Citoplasma: região que fica entre
Transporte através da Membrana Plasmática Biofísica Estruturas das células Basicamente uma célula é formada por três partes básicas: Membrana: capa que envolve a célula; Citoplasma: região que fica entre
As propriedades coligativas não dependem da natureza química do soluto, mas apenas do número de partículas do soluto presente em relação ao total.
 ula: 17 Temática: Propriedades Coligativas das Soluções s propriedades coligativas não dependem da natureza química do soluto, mas apenas do número de partículas do soluto presente em relação ao total.
ula: 17 Temática: Propriedades Coligativas das Soluções s propriedades coligativas não dependem da natureza química do soluto, mas apenas do número de partículas do soluto presente em relação ao total.
PROPRIEDADES COLIGATIVAS
 RORIEDADES COLIGAIVAS O artigo abaixo trata de um tema extremamente cobrado nas provas do IME e do IA dos últimos anos. Em nosso site já existem dois outros artigos com exercícios sobre esse assunto e
RORIEDADES COLIGAIVAS O artigo abaixo trata de um tema extremamente cobrado nas provas do IME e do IA dos últimos anos. Em nosso site já existem dois outros artigos com exercícios sobre esse assunto e
As Propriedades das Misturas (Aulas 18 a 21)
 As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
Determinação de Massas Moleculares de Polímeros
 Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Propriedades coligativas
 As propriedades coligativas dependem da quantidade de moléculas de soluto. Já sabemos que a presença de soluto afeta as propriedades físicas do solvente, as propriedades coligativas de maior importância
As propriedades coligativas dependem da quantidade de moléculas de soluto. Já sabemos que a presença de soluto afeta as propriedades físicas do solvente, as propriedades coligativas de maior importância
Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.
 Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: [email protected] Misturas - soluções A grande maioria dos sistemas encontrados
Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: [email protected] Misturas - soluções A grande maioria dos sistemas encontrados
 PROPRIEDADES COLIGATIVAS Prof. Robinho Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução desse líquido
PROPRIEDADES COLIGATIVAS Prof. Robinho Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução desse líquido
 Soluções Químicas são misturas homogêneas de duas ou mais substâncias, onde o solvente aparece em maior quantidade e o soluto em menor quantidade. O estado de agregação do solvente é que determina o estado
Soluções Químicas são misturas homogêneas de duas ou mais substâncias, onde o solvente aparece em maior quantidade e o soluto em menor quantidade. O estado de agregação do solvente é que determina o estado
Propriedade Coligativas das Soluções
 Capítulo 9 Propriedade Coligativas das Soluções 1. (IME) Um instrumento desenvolvido para medida de concentração de soluções aquosas não eletrolíticas, consta de: a) um recipiente contendo água destilada;
Capítulo 9 Propriedade Coligativas das Soluções 1. (IME) Um instrumento desenvolvido para medida de concentração de soluções aquosas não eletrolíticas, consta de: a) um recipiente contendo água destilada;
a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica).
 01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS
 QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS 800 pressão de vapor de água (mmhg) 760 700 600 500 400 300 200 100 líquido benzeno puro benzeno + soluto p vapor p.e. do benzeno puro t p.e. do
QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS 800 pressão de vapor de água (mmhg) 760 700 600 500 400 300 200 100 líquido benzeno puro benzeno + soluto p vapor p.e. do benzeno puro t p.e. do
41 Por que não bebemos água do mar?
 A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
a) Uma gota de orvalho sobre uma superfície encerada (pode ser a de um automóvel). As moléculas da água aderem fracamente à cera e fortemente entre
 Tensão superficial a) Uma gota de orvalho sobre uma superfície encerada (pode ser a de um automóvel). As moléculas da água aderem fracamente à cera e fortemente entre si, então a água se junta. A tensão
Tensão superficial a) Uma gota de orvalho sobre uma superfície encerada (pode ser a de um automóvel). As moléculas da água aderem fracamente à cera e fortemente entre si, então a água se junta. A tensão
Química Prof. Marcelo
 Química Prof. Marcelo PROPRIEDADES COLIGATIVAS 1 Pressão de vapor 2 Pressão de vapor e mudança de estado 3- Tonoscopia 4- Crioscopia 5- Ebulioscopia 6 - Osmose e pressão osmótica PROPRIEDADES COLIGATIVAS
Química Prof. Marcelo PROPRIEDADES COLIGATIVAS 1 Pressão de vapor 2 Pressão de vapor e mudança de estado 3- Tonoscopia 4- Crioscopia 5- Ebulioscopia 6 - Osmose e pressão osmótica PROPRIEDADES COLIGATIVAS
Propriedades Coligativas
 1. Introdução Propriedades Coligativas Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
1. Introdução Propriedades Coligativas Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
Revisão para o Teste
 Revisão para o Teste PROPRIEDADES COLIGATIVAS # Mudanças de estado: *fusão e solidificação sólido < > líquido (solidificação ou congelamento) *ebulição e liquefação líquido < > gasoso *sublimação e resublimação
Revisão para o Teste PROPRIEDADES COLIGATIVAS # Mudanças de estado: *fusão e solidificação sólido < > líquido (solidificação ou congelamento) *ebulição e liquefação líquido < > gasoso *sublimação e resublimação
Membranas Biológicas e Transporte
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Introdução a Bioquímica Membranas Biológicas e Transporte 1. Introdução 2. Os Constituintes
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Introdução a Bioquímica Membranas Biológicas e Transporte 1. Introdução 2. Os Constituintes
pressão (atm) temperatura( C)
 pressão (atm) T temperatura( C) 01) No diagrama de fases da água: 760 Pressão (mmhg) ta tb ta ( C) As temperaturas ta e tb são, respectivamente: a) pontos normais de fusão e ebulição. b) pontos normais
pressão (atm) T temperatura( C) 01) No diagrama de fases da água: 760 Pressão (mmhg) ta tb ta ( C) As temperaturas ta e tb são, respectivamente: a) pontos normais de fusão e ebulição. b) pontos normais
CAPÍTULO III TERMOQUÍMICA
 CAPÍTULO III - Termoquímica 40 CAPÍTULO III TERMOQUÍMICA Podemos designar a termoquímica como o estudo do calor envolvido nas transformações físicas e químicas. Vamos considerar um sistema constituído
CAPÍTULO III - Termoquímica 40 CAPÍTULO III TERMOQUÍMICA Podemos designar a termoquímica como o estudo do calor envolvido nas transformações físicas e químicas. Vamos considerar um sistema constituído
Métodos de determinação da Massa Molecular
 Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Osmose, osmolaridade e tonicidade: transporte de água e regulação do volume celular
 Osmose, osmolaridade e tonicidade: transporte de água e regulação do volume celular Fisiologia I RCG0214 Medicina RP Prof. Ricardo Leão Departamento de Fisiologia FMRP-USP Era uma vez uma hemácia feliz
Osmose, osmolaridade e tonicidade: transporte de água e regulação do volume celular Fisiologia I RCG0214 Medicina RP Prof. Ricardo Leão Departamento de Fisiologia FMRP-USP Era uma vez uma hemácia feliz
Características e os efeitos das propriedades coligativas
 Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
DISPERSÕES. Profa. Kátia Aquino
 DISPERSÕES Profa. Kátia Aquino O que é uma dispersão do ponto de vista químico? Mistura de duas ou mais substâncias, em que as partículas de uma fase a fase dispersa se encontram distribuidas em outra
DISPERSÕES Profa. Kátia Aquino O que é uma dispersão do ponto de vista químico? Mistura de duas ou mais substâncias, em que as partículas de uma fase a fase dispersa se encontram distribuidas em outra
Resoluções das Atividades
 Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
NÚCLEO DE ENGENHARIA DE ÁGUA E SOLO
 UNIVERSIDADE FEDERAL DO RECÔNCAVO DA BAHIA Centro de Ciências Agrárias, Biológicas e Ambientais NÚCLEO DE ENGENHARIA DE ÁGUA E SOLO Vital Pedro da Silva Paz [email protected] Francisco A. C. Pereira [email protected]
UNIVERSIDADE FEDERAL DO RECÔNCAVO DA BAHIA Centro de Ciências Agrárias, Biológicas e Ambientais NÚCLEO DE ENGENHARIA DE ÁGUA E SOLO Vital Pedro da Silva Paz [email protected] Francisco A. C. Pereira [email protected]
QUÍMICA POR QUE ESTUDAR QUÍMICA?
 QUÍMICA POR QUE ESTUDAR QUÍMICA? A Química contribui para a melhora da qualidade de vida das pessoas, se souber usá-la corretamente. Nosso futuro depende de como vamos usar o conhecimento Químico. A química
QUÍMICA POR QUE ESTUDAR QUÍMICA? A Química contribui para a melhora da qualidade de vida das pessoas, se souber usá-la corretamente. Nosso futuro depende de como vamos usar o conhecimento Químico. A química
2) Uma solução de 5,00 g de ácido acético, CH 3 COOH, em 100 g de benzeno congela a 3,37
 Química Geral e Experimental II Soluções e propriedades coligativas Resolução comentada de exercícios selecionados versão colig_v3_2005 Prof. Fabricio R. Sensato 1) Qual o ponto de ebulição de uma solução
Química Geral e Experimental II Soluções e propriedades coligativas Resolução comentada de exercícios selecionados versão colig_v3_2005 Prof. Fabricio R. Sensato 1) Qual o ponto de ebulição de uma solução
CAPÍTULO 6 Termologia
 CAPÍTULO 6 Termologia Introdução Calor e Temperatura, duas grandezas Físicas bastante difundidas no nosso dia-a-dia, e que estamos quase sempre relacionando uma com a outra. Durante a explanação do nosso
CAPÍTULO 6 Termologia Introdução Calor e Temperatura, duas grandezas Físicas bastante difundidas no nosso dia-a-dia, e que estamos quase sempre relacionando uma com a outra. Durante a explanação do nosso
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL
 RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
SOLUÇÕES. Curvas de Solubilidade
 QUÍMICA SOLUÇÕES 1. INTRODUÇÃO Soluções são misturas homogêneas, ou seja, misturas entre dois ou mais componentes apresentando uma única fase. Exemplos: Água + Álcool Água + Sal + Açucar Curvas de Solubilidade
QUÍMICA SOLUÇÕES 1. INTRODUÇÃO Soluções são misturas homogêneas, ou seja, misturas entre dois ou mais componentes apresentando uma única fase. Exemplos: Água + Álcool Água + Sal + Açucar Curvas de Solubilidade
Um sistema bem dimensionado permite poupar, em média, 70% a 80% da energia necessária para o aquecimento de água que usamos em casa.
 Mais Questões Isildo M. C. Benta, Assistência Técnica Certificada de Sistemas Solares Quanto poupo se instalar um painel solar térmico? Um sistema bem dimensionado permite poupar, em média, 70% a 80% da
Mais Questões Isildo M. C. Benta, Assistência Técnica Certificada de Sistemas Solares Quanto poupo se instalar um painel solar térmico? Um sistema bem dimensionado permite poupar, em média, 70% a 80% da
CALORIMETRIA. H T = c m T.
 CALORIMETRIA 1. Resumo Coloca-se em contacto diferentes quantidades de água quente e fria num recipiente termicamente isolado, verificando-se a conservação da energia térmica. Com base nessa conservação,
CALORIMETRIA 1. Resumo Coloca-se em contacto diferentes quantidades de água quente e fria num recipiente termicamente isolado, verificando-se a conservação da energia térmica. Com base nessa conservação,
Química 12º Ano. Unidade 2 Combustíveis, Energia e Ambiente. Actividades de Projecto Laboratorial. Janeiro 2005. Jorge R. Frade, Ana Teresa Paiva
 Efeitos da composição em temperaturas de fusão e de ebulição Química 12º Ano Unidade 2 Combustíveis, Energia e Ambiente Actividades de Projecto Laboratorial Janeiro 2005 Jorge R. Frade, Ana Teresa Paiva
Efeitos da composição em temperaturas de fusão e de ebulição Química 12º Ano Unidade 2 Combustíveis, Energia e Ambiente Actividades de Projecto Laboratorial Janeiro 2005 Jorge R. Frade, Ana Teresa Paiva
Projeto rumo ao ita. Química. Exercícios de Fixação. Exercícios Propostos. Termodinâmica. ITA/IME Pré-Universitário 1. 06. Um gás ideal, com C p
 Química Termodinâmica Exercícios de Fixação 06. Um gás ideal, com C p = (5/2)R e C v = (3/2)R, é levado de P 1 = 1 bar e V 1 t = 12 m³ para P 2 = 12 bar e V 2 t = 1m³ através dos seguintes processos mecanicamente
Química Termodinâmica Exercícios de Fixação 06. Um gás ideal, com C p = (5/2)R e C v = (3/2)R, é levado de P 1 = 1 bar e V 1 t = 12 m³ para P 2 = 12 bar e V 2 t = 1m³ através dos seguintes processos mecanicamente
Densímetro de posto de gasolina
 Densímetro de posto de gasolina Eixo(s) temático(s) Ciência e tecnologia Tema Materiais: propriedades Conteúdos Densidade, misturas homogêneas e empuxo Usos / objetivos Introdução ou aprofundamento do
Densímetro de posto de gasolina Eixo(s) temático(s) Ciência e tecnologia Tema Materiais: propriedades Conteúdos Densidade, misturas homogêneas e empuxo Usos / objetivos Introdução ou aprofundamento do
Aula sobre Soluções Aula 01 (ENEM) Profº.: Wesley de Paula
 Aula sobre Soluções Aula 01 (ENEM) Profº.: Wesley de Paula Propriedades das Soluções Classificação das Misturas: Soluções e Dispersões Classificação das soluções O Processo de Dissolução em soluções Relações
Aula sobre Soluções Aula 01 (ENEM) Profº.: Wesley de Paula Propriedades das Soluções Classificação das Misturas: Soluções e Dispersões Classificação das soluções O Processo de Dissolução em soluções Relações
Monopólio. Microeconomia II LGE108. Características do Monopólio:
 Monopólio Introdução Características do Monopólio: Existe uma única empresa do lado da oferta; Existem muitos compradores de pequena dimensão; Não existem substitutos próximos; Existe informação perfeita
Monopólio Introdução Características do Monopólio: Existe uma única empresa do lado da oferta; Existem muitos compradores de pequena dimensão; Não existem substitutos próximos; Existe informação perfeita
Água e Soluções Biológicas
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Potenciação no Conjunto dos Números Inteiros - Z
 Rua Oto de Alencar nº 5-9, Maracanã/RJ - tel. 04-98/4-98 Potenciação no Conjunto dos Números Inteiros - Z Podemos epressar o produto de quatro fatores iguais a.... por meio de uma potência de base e epoente
Rua Oto de Alencar nº 5-9, Maracanã/RJ - tel. 04-98/4-98 Potenciação no Conjunto dos Números Inteiros - Z Podemos epressar o produto de quatro fatores iguais a.... por meio de uma potência de base e epoente
Biologia. Sistema circulatório
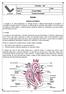 Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Balanço de Massa e Energia Aula 4
 Gases e Vapores Na maioria das pressões e temperaturas, uma substância pura no equilíbrio existe inteiramente como um sólido, um líquido ou um gás. Contudo, em certas temperaturas e pressões, duas ou mesmo
Gases e Vapores Na maioria das pressões e temperaturas, uma substância pura no equilíbrio existe inteiramente como um sólido, um líquido ou um gás. Contudo, em certas temperaturas e pressões, duas ou mesmo
SOLUBILIDADE DOS GASES E TROCAS NA INTERFACE AR-MAR. Tópicos. Introdução. Vanessa Hatje. GASES: Importante nos ciclos biogeoquímicos
 SOLUBILIDADE DOS GASES E TROCAS NA INTERFACE AR-MAR Vanessa Hatje Tópicos Introdução Leis determinantes Solubilidade dos gases Lei de Henry Coeficiente de solubilidade de Bunsen Tendências da solubilidade
SOLUBILIDADE DOS GASES E TROCAS NA INTERFACE AR-MAR Vanessa Hatje Tópicos Introdução Leis determinantes Solubilidade dos gases Lei de Henry Coeficiente de solubilidade de Bunsen Tendências da solubilidade
Introdução ao Estudo da Corrente Eléctrica
 Introdução ao Estudo da Corrente Eléctrica Num metal os electrões de condução estão dissociados dos seus átomos de origem passando a ser partilhados por todos os iões positivos do sólido, e constituem
Introdução ao Estudo da Corrente Eléctrica Num metal os electrões de condução estão dissociados dos seus átomos de origem passando a ser partilhados por todos os iões positivos do sólido, e constituem
Propriedades Coligativas. Profa. Kátia Aquino
 Propriedades Coligativas Profa. Kátia Aquino O que são? São as propriedades de uma solução que são influenciadas pela quantidade de soluto. Tal influência não depende da natureza do soluto. Vamos recapitular...
Propriedades Coligativas Profa. Kátia Aquino O que são? São as propriedades de uma solução que são influenciadas pela quantidade de soluto. Tal influência não depende da natureza do soluto. Vamos recapitular...
O estado no qual um ou mais corpos possuem a mesma temperatura e, dessa forma, não há troca de calor entre si, denomina-se equilíbrio térmico.
 4. CALORIMETRIA 4.1 CALOR E EQUILÍBRIO TÉRMICO O objetivo deste capítulo é estudar a troca de calor entre corpos. Empiricamente, percebemos que dois corpos A e B, a temperaturas iniciais diferentes, ao
4. CALORIMETRIA 4.1 CALOR E EQUILÍBRIO TÉRMICO O objetivo deste capítulo é estudar a troca de calor entre corpos. Empiricamente, percebemos que dois corpos A e B, a temperaturas iniciais diferentes, ao
QUÍMICA FÍSICA Mestrado Integrado em Engª Biológica (2014 2015)
 QUÍMICA FÍSICA Mestrado Integrado em Engª Biológica (2014 2015) Docentes: Laura Maria Ilharco e mail: [email protected] Extensão: 3220 (Complexo Interdisciplinar) Pedro Paulo (laboratório) e
QUÍMICA FÍSICA Mestrado Integrado em Engª Biológica (2014 2015) Docentes: Laura Maria Ilharco e mail: [email protected] Extensão: 3220 (Complexo Interdisciplinar) Pedro Paulo (laboratório) e
Sistema Respiratório Introdução
 Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
1.1.2 PROPRIEDADES FUNDAMENTAIS DOS FLUIDOS
 UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE AGRONOMIA E ENGENHARIA DE ALIMENTOS SETOR DE ENGENHARIA RURAL Prof. Adão Wagner Pêgo Evangelista 1.1.2 PROPRIEDADES FUNDAMENTAIS DOS FLUIDOS A) MASSA ESPECÍFICA
UNIVERSIDADE FEDERAL DE GOIÁS ESCOLA DE AGRONOMIA E ENGENHARIA DE ALIMENTOS SETOR DE ENGENHARIA RURAL Prof. Adão Wagner Pêgo Evangelista 1.1.2 PROPRIEDADES FUNDAMENTAIS DOS FLUIDOS A) MASSA ESPECÍFICA
LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos TERMOQUÍMICA Atkins & de Paula (sétima edição)
 LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos TERMOQUÍMICA Atkins & de Paula (sétima edição) Profa. Dra. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia LOT E-mail: [email protected]
LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos TERMOQUÍMICA Atkins & de Paula (sétima edição) Profa. Dra. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia LOT E-mail: [email protected]
Capítulo 3 Modelos Estatísticos
 Capítulo 3 Modelos Estatísticos Slide 1 Resenha Variáveis Aleatórias Distribuição Binomial Distribuição de Poisson Distribuição Normal Distribuição t de Student Distribuição Qui-quadrado Resenha Slide
Capítulo 3 Modelos Estatísticos Slide 1 Resenha Variáveis Aleatórias Distribuição Binomial Distribuição de Poisson Distribuição Normal Distribuição t de Student Distribuição Qui-quadrado Resenha Slide
Cotagem de dimensões básicas
 Cotagem de dimensões básicas Introdução Observe as vistas ortográficas a seguir. Com toda certeza, você já sabe interpretar as formas da peça representada neste desenho. E, você já deve ser capaz de imaginar
Cotagem de dimensões básicas Introdução Observe as vistas ortográficas a seguir. Com toda certeza, você já sabe interpretar as formas da peça representada neste desenho. E, você já deve ser capaz de imaginar
PROPRIEDADES COLIGATIVAS. Prof.: Rodrigo Rocha Monteiro
 PROPRIEDADES COLIGATIVAS Prof.: Rodrigo Rocha Monteiro Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução
PROPRIEDADES COLIGATIVAS Prof.: Rodrigo Rocha Monteiro Propriedades Coligativas São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química, um líquido puro e uma solução
SOLUÇÕES SOLUÇÕES MISTURAS
 MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
Equações Diferenciais
 Equações Diferenciais EQUAÇÕES DIFERENCIAS Em qualquer processo natural, as variáveis envolvidas e suas taxas de variação estão interligadas com uma ou outras por meio de princípios básicos científicos
Equações Diferenciais EQUAÇÕES DIFERENCIAS Em qualquer processo natural, as variáveis envolvidas e suas taxas de variação estão interligadas com uma ou outras por meio de princípios básicos científicos
V = 0,30. 0,20. 0,50 (m 3 ) = 0,030m 3. b) A pressão exercida pelo bloco sobre a superfície da mesa é dada por: P 75. 10 p = = (N/m 2 ) A 0,20.
 11 FÍSICA Um bloco de granito com formato de um paralelepípedo retângulo, com altura de 30 cm e base de 20 cm de largura por 50 cm de comprimento, encontra-se em repouso sobre uma superfície plana horizontal.
11 FÍSICA Um bloco de granito com formato de um paralelepípedo retângulo, com altura de 30 cm e base de 20 cm de largura por 50 cm de comprimento, encontra-se em repouso sobre uma superfície plana horizontal.
Osmose Reversa Conheça este processo de purificação de água
 Osmose Reversa Conheça este processo de purificação de água Antes de falarmos sobre Osmose Reversa, precisamos entender o que é Osmose. Osmose é o nome dado ao movimento da água entre meios com concentrações
Osmose Reversa Conheça este processo de purificação de água Antes de falarmos sobre Osmose Reversa, precisamos entender o que é Osmose. Osmose é o nome dado ao movimento da água entre meios com concentrações
Universidade de São Paulo Departamento de Geografia FLG 0253 - Climatologia I. Pressão Atmosférica
 Universidade de São Paulo Departamento de Geografia FLG 0253 - Climatologia I Pressão Atmosférica Prof. Dr. Emerson Galvani Laboratório de Climatologia e Biogeografia LCB Questão motivadora: Observamos
Universidade de São Paulo Departamento de Geografia FLG 0253 - Climatologia I Pressão Atmosférica Prof. Dr. Emerson Galvani Laboratório de Climatologia e Biogeografia LCB Questão motivadora: Observamos
Simulado ENEM: Matemática
 Simulado ENEM: Matemática Questão 1 Cinco diretores de uma grande companhia, doutores Arnaldo, Bernardo, Cristiano, Denis e Eduardo, estão sentados em uma mesa redonda, em sentido horário, para uma reunião
Simulado ENEM: Matemática Questão 1 Cinco diretores de uma grande companhia, doutores Arnaldo, Bernardo, Cristiano, Denis e Eduardo, estão sentados em uma mesa redonda, em sentido horário, para uma reunião
MEDIÇÃO DE TEMPERATURA
 MEDIÇÃO DE TEMPERATURA 1 INTRODUÇÃO Temperatura é sem dúvida a variável mais importante nos processos industriais, e sua medição e controle, embora difíceis, são vitais para a qualidade do produto e a
MEDIÇÃO DE TEMPERATURA 1 INTRODUÇÃO Temperatura é sem dúvida a variável mais importante nos processos industriais, e sua medição e controle, embora difíceis, são vitais para a qualidade do produto e a
Fluxo sanguíneo - 21% do débito cardíaco.
 Função renal: excreção, controle do volume e composição dos líquidos corporais. Composto por um par de rins, um par de ureteres, pela bexiga urinária e pela uretra. Os rins situam-se na parte dorsal do
Função renal: excreção, controle do volume e composição dos líquidos corporais. Composto por um par de rins, um par de ureteres, pela bexiga urinária e pela uretra. Os rins situam-se na parte dorsal do
Dados: Equilíbrio líquido-líquido do sistema acetona/água/tca a 1 atm e 25ºC.
 9. 5 E F E I T O D O C A U D A L D E S O L V E N T E 503 Exemplo 9.2 1000 kg/h de uma solução aquosa binária com 40% (% mássicas) de acetona vai ser extraída em contínuo (a 25ºC e 1 atm) e em contracorrente
9. 5 E F E I T O D O C A U D A L D E S O L V E N T E 503 Exemplo 9.2 1000 kg/h de uma solução aquosa binária com 40% (% mássicas) de acetona vai ser extraída em contínuo (a 25ºC e 1 atm) e em contracorrente
Automatismos Industriais
 Automatismos Industriais Introdução à Pneumática Nos actuais sistemas de automação a pneumática é um elemento muito importante pois está presente num vasto numero de aplicações, seja como sistema totalmente
Automatismos Industriais Introdução à Pneumática Nos actuais sistemas de automação a pneumática é um elemento muito importante pois está presente num vasto numero de aplicações, seja como sistema totalmente
Resolução de Curso Básico de Física de H. Moysés Nussenzveig Capítulo 08 - Vol. 2
 HTTP://COMSIZO.BLOGSPOT.COM/ Resolução de Curso Básico de Física de H. Moysés Nussenzveig Capítulo 08 - Vol. 2 Engenharia Física 09 Universidade Federal de São Carlos 10/31/2009 *Conseguimos algumas resoluções
HTTP://COMSIZO.BLOGSPOT.COM/ Resolução de Curso Básico de Física de H. Moysés Nussenzveig Capítulo 08 - Vol. 2 Engenharia Física 09 Universidade Federal de São Carlos 10/31/2009 *Conseguimos algumas resoluções
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
Lipídios Proteínas Carboidratos (glicocálix)
 Delimita a Célula Realiza reações celulares Possui Permeabilidade Seletiva Composição: Lipídios Proteínas Carboidratos (glicocálix) Membrana Plasmática xx/xx 2 MOSAICO FLUÍDO Hidrofílica = afinidade com
Delimita a Célula Realiza reações celulares Possui Permeabilidade Seletiva Composição: Lipídios Proteínas Carboidratos (glicocálix) Membrana Plasmática xx/xx 2 MOSAICO FLUÍDO Hidrofílica = afinidade com
Propriedades coligativas I
 Propriedades coligativas I 01. (Ufrn) Um béquer de vidro, com meio litro de capacidade, em condições normais de temperatura e pressão, contém 300 ml de água líquida e 100 g de gelo em cubos. Adicionando-se,
Propriedades coligativas I 01. (Ufrn) Um béquer de vidro, com meio litro de capacidade, em condições normais de temperatura e pressão, contém 300 ml de água líquida e 100 g de gelo em cubos. Adicionando-se,
Transporte nos animais
 Transporte nos animais Tal como nas plantas, nem todos os animais possuem sistema de transporte, apesar de todos necessitarem de estabelecer trocas com o meio externo. As hidras têm somente duas camadas
Transporte nos animais Tal como nas plantas, nem todos os animais possuem sistema de transporte, apesar de todos necessitarem de estabelecer trocas com o meio externo. As hidras têm somente duas camadas
CONVERSÃO DE TEMPERATURA
 CONVERSÃO DE TEMPERATURA Caro(a) e estimado(a) aluno(a), entre neste link e observe um interessante programa de conversão de temperaturas. Mas não o utilize para resolver esta lista. Não tente enganar
CONVERSÃO DE TEMPERATURA Caro(a) e estimado(a) aluno(a), entre neste link e observe um interessante programa de conversão de temperaturas. Mas não o utilize para resolver esta lista. Não tente enganar
FISIOLOGIA RENAL DAS AVES
 Disciplina de Fisiologia Veterinária FISIOLOGIA RENAL DAS AVES Prof. Fabio Otero Ascoli OBJETIVOS DA AULA Identificar principais semelhanças e diferenças com a fisiologia dos mamíferos Aprender sobre os
Disciplina de Fisiologia Veterinária FISIOLOGIA RENAL DAS AVES Prof. Fabio Otero Ascoli OBJETIVOS DA AULA Identificar principais semelhanças e diferenças com a fisiologia dos mamíferos Aprender sobre os
Características de um fluido
 FLUIDOS - Propriedades Características de um fluido Gases e liquídos podem ambos ser considerados fluidos. Há certas características partilhadas por todos os fluidos que podem usar-se para distinguir liquidos
FLUIDOS - Propriedades Características de um fluido Gases e liquídos podem ambos ser considerados fluidos. Há certas características partilhadas por todos os fluidos que podem usar-se para distinguir liquidos
As forças atrativas entre duas moléculas são significativas até uma distância de separação d, que chamamos de alcance molecular.
 Tensão Superficial Nos líquidos, as forças intermoleculares atrativas são responsáveis pelos fenômenos de capilaridade. Por exemplo, a subida de água em tubos capilares e a completa umidificação de uma
Tensão Superficial Nos líquidos, as forças intermoleculares atrativas são responsáveis pelos fenômenos de capilaridade. Por exemplo, a subida de água em tubos capilares e a completa umidificação de uma
Capítulo 20. Processos reversíveis Entropia O Motor de Carnot Frigoríficos Motores de reais (20-1)
 Capítulo 20 Entropia e a Segunda ei da ermodinâmica Neste capítulo, vamos introduzir a segunda lei da termodinâmica. Os seguintes tópicos serão abordados: Processos reversíveis Entropia O Motor de Carnot
Capítulo 20 Entropia e a Segunda ei da ermodinâmica Neste capítulo, vamos introduzir a segunda lei da termodinâmica. Os seguintes tópicos serão abordados: Processos reversíveis Entropia O Motor de Carnot
Balanço de Massa e Energia Aula 5
 Balanço de Massa e Energia Aula 5 Solubilidade, Saturação e Cristalização. Solubilidade: A solubilidade de um sólido (soluto) em uma solução é a quantidade máxima desta substância que pode ser dissolvida
Balanço de Massa e Energia Aula 5 Solubilidade, Saturação e Cristalização. Solubilidade: A solubilidade de um sólido (soluto) em uma solução é a quantidade máxima desta substância que pode ser dissolvida
De acordo a Termodinâmica considere as seguintes afirmações.
 Questão 01 - (UFPel RS/2009) De acordo a Termodinâmica considere as seguintes afirmações. I. A equação de estado de um gás ideal, pv = nrt, determina que a pressão, o volume, a massa e a temperatura podem
Questão 01 - (UFPel RS/2009) De acordo a Termodinâmica considere as seguintes afirmações. I. A equação de estado de um gás ideal, pv = nrt, determina que a pressão, o volume, a massa e a temperatura podem
INSTITUTO TECNOLÓGICO
 PAC - PROGRAMA DE APRIMORAMENTO DE CONTEÚDOS. ATIVIDADES DE NIVELAMENTO BÁSICO. DISCIPLINAS: MATEMÁTICA & ESTATÍSTICA. PROFº.: PROF. DR. AUSTER RUZANTE 1ª SEMANA DE ATIVIDADES DOS CURSOS DE TECNOLOGIA
PAC - PROGRAMA DE APRIMORAMENTO DE CONTEÚDOS. ATIVIDADES DE NIVELAMENTO BÁSICO. DISCIPLINAS: MATEMÁTICA & ESTATÍSTICA. PROFº.: PROF. DR. AUSTER RUZANTE 1ª SEMANA DE ATIVIDADES DOS CURSOS DE TECNOLOGIA
Nome:...N o...turma:... Data: / / ESTUDO DOS GASES E TERMODINÂMICA
 Ensino Médio Nome:...N o...turma:... Data: / / Disciplina: Física Dependência Prof. Marcelo Vettori ESTUDO DOS GASES E TERMODINÂMICA I- ESTUDO DOS GASES 1- Teoria Cinética dos Gases: as moléculas constituintes
Ensino Médio Nome:...N o...turma:... Data: / / Disciplina: Física Dependência Prof. Marcelo Vettori ESTUDO DOS GASES E TERMODINÂMICA I- ESTUDO DOS GASES 1- Teoria Cinética dos Gases: as moléculas constituintes
Capítulo 8: Transferência de calor por condução
 Capítulo 8: ransferência de calor por condução Equação da condução de calor Condução de calor unidimensional e em regime permanente Condução Um corpo sólido isolado está em equilíbrio térmico se a sua
Capítulo 8: ransferência de calor por condução Equação da condução de calor Condução de calor unidimensional e em regime permanente Condução Um corpo sólido isolado está em equilíbrio térmico se a sua
Válvulas controladoras de vazão
 Generalidades Válvula controladora de vazão variável Válvula de controle de vazão variável com retenção integrada Métodos de controle de vazão Válvula de controle de vazão com pressão compensada temperatura
Generalidades Válvula controladora de vazão variável Válvula de controle de vazão variável com retenção integrada Métodos de controle de vazão Válvula de controle de vazão com pressão compensada temperatura
Sensor de Nível por Medida de Pressão Diferencial com Sensor SMART
 INSTRUMENTAÇÃO II Engenharia de Automação, Controlo e Instrumentação 2006/07 Trabalho de Laboratório nº 4 Sensor de Nível por Medida de Pressão Diferencial com Sensor SMART Realizado por Paulo Alvito 26
INSTRUMENTAÇÃO II Engenharia de Automação, Controlo e Instrumentação 2006/07 Trabalho de Laboratório nº 4 Sensor de Nível por Medida de Pressão Diferencial com Sensor SMART Realizado por Paulo Alvito 26
Soluções I e II. Soluções I e II Monitor: Gabriel dos Passos 28 e 29/05/2014. Material de apoio para Monitoria. 1. O que é uma solução?
 1. O que é uma solução? 2. Como podemos classificar as soluções? 3. O que você entende por concentração comum? 4. O que você entende por molaridade? 5. O que você entende por título percentual? 6. O que
1. O que é uma solução? 2. Como podemos classificar as soluções? 3. O que você entende por concentração comum? 4. O que você entende por molaridade? 5. O que você entende por título percentual? 6. O que
Fichas de sistemas de partículas
 Capítulo 3 Fichas de sistemas de partículas 1. (Alonso, pg 247) Um tubo de secção transversal a lança um fluxo de gás contra uma parede com uma velocidade v muito maior que a agitação térmica das moléculas.
Capítulo 3 Fichas de sistemas de partículas 1. (Alonso, pg 247) Um tubo de secção transversal a lança um fluxo de gás contra uma parede com uma velocidade v muito maior que a agitação térmica das moléculas.
Aulas 13 e 14. Soluções
 Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Como erguer um piano sem fazer força
 A U A UL LA Como erguer um piano sem fazer força Como vimos na aula sobre as leis de Newton, podemos olhar o movimento das coisas sob o ponto de vista da Dinâmica, ou melhor, olhando os motivos que levam
A U A UL LA Como erguer um piano sem fazer força Como vimos na aula sobre as leis de Newton, podemos olhar o movimento das coisas sob o ponto de vista da Dinâmica, ou melhor, olhando os motivos que levam
1 Introdução simulação numérica termoacumulação
 22 1 Introdução Atualmente o custo da energia é um dos fatores mais importantes no projeto, administração e manutenção de sistemas energéticos. Sendo assim, a economia de energia está recebendo maior atenção
22 1 Introdução Atualmente o custo da energia é um dos fatores mais importantes no projeto, administração e manutenção de sistemas energéticos. Sendo assim, a economia de energia está recebendo maior atenção
SEPARAÇÃO DE MISTURAS. Pr ofª Tatiana Lima
 SEPARAÇÃO DE MISTURAS Pr ofª Tatiana Lima As separações de misturas estão baseadas nas diferenças de propriedades entre os componentes de uma mistura. Soluções são misturas homogêneas, onde o solvente
SEPARAÇÃO DE MISTURAS Pr ofª Tatiana Lima As separações de misturas estão baseadas nas diferenças de propriedades entre os componentes de uma mistura. Soluções são misturas homogêneas, onde o solvente
V.7. Noções Básicas sobre o uso da Potência e do Torque do Motor.
 V.7. Noções Básicas sobre o uso da Potência e do Torque do Motor. V.7.1. Torque Quando você faz força para desrosquear uma tampa de um vidro de conservas com a mão, se está aplicando torque. O torque é
V.7. Noções Básicas sobre o uso da Potência e do Torque do Motor. V.7.1. Torque Quando você faz força para desrosquear uma tampa de um vidro de conservas com a mão, se está aplicando torque. O torque é
MEMBRANA PLASMÁTICA. Modelo do mosaico fluido caráter dinâmico à estrutura da membrana (as proteínas estão em constante deslocamento lateral)
 MEMBRANA PLASMÁTICA Modelo do mosaico fluido caráter dinâmico à estrutura da membrana (as proteínas estão em constante deslocamento lateral) ESTRUTURA DA MEMBRANA Formada por fosfolipídios e (nas animais
MEMBRANA PLASMÁTICA Modelo do mosaico fluido caráter dinâmico à estrutura da membrana (as proteínas estão em constante deslocamento lateral) ESTRUTURA DA MEMBRANA Formada por fosfolipídios e (nas animais
CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS
 CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS A DEPENDÊNCIA DA VELOCIDADE DE REAÇÃO COM A TEMPERATURA A velocidade da maioria das reações químicas aumenta à medida que a temperatura também aumenta.
CINÉTICA QUÍMICA CINÉTICA QUÍMICA EQUAÇÃO DE ARRHENIUS A DEPENDÊNCIA DA VELOCIDADE DE REAÇÃO COM A TEMPERATURA A velocidade da maioria das reações químicas aumenta à medida que a temperatura também aumenta.
LISTA 3 - Prof. Jason Gallas, DF UFPB 10 de Junho de 2013, às 14:26. Jason Alfredo Carlson Gallas, professor titular de física teórica,
 Exercícios Resolvidos de Física Básica Jason Alfredo Carlson Gallas, professor titular de física teórica, Doutor em Física pela Universidade udwig Maximilian de Munique, Alemanha Universidade Federal da
Exercícios Resolvidos de Física Básica Jason Alfredo Carlson Gallas, professor titular de física teórica, Doutor em Física pela Universidade udwig Maximilian de Munique, Alemanha Universidade Federal da
Capítulo 5: Aplicações da Derivada
 Instituto de Ciências Exatas - Departamento de Matemática Cálculo I Profª Maria Julieta Ventura Carvalho de Araujo Capítulo 5: Aplicações da Derivada 5- Acréscimos e Diferenciais - Acréscimos Seja y f
Instituto de Ciências Exatas - Departamento de Matemática Cálculo I Profª Maria Julieta Ventura Carvalho de Araujo Capítulo 5: Aplicações da Derivada 5- Acréscimos e Diferenciais - Acréscimos Seja y f
Física Unidade VI Termofísica Série 4 - Calor provocando mudanças de estado físico
 01 De acordo com o enunciado: na etapa I do processo de liofilização, a água contida no alimento é solidificada. Sendo assim, ela passa do estado líquido ao estado sólido, representado no diagrama de fases
01 De acordo com o enunciado: na etapa I do processo de liofilização, a água contida no alimento é solidificada. Sendo assim, ela passa do estado líquido ao estado sólido, representado no diagrama de fases
