UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
|
|
|
- Marina Caires
- 5 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA JAMYLA LIMA SABOYA DE CASTRO A TOXIDADE DO ÁCIDO ASCÓRBICO EM PLANTAS DE ARROZ SILENCIADAS NAS APXs CLOROPLÁSTICAS INDUZ ESTRESSE OXIDATIVO NÃO DEPENDENTE DA FOTOSSÍNTESE FORTALEZA 2014
2 JAMYLA LIMA SABOYA DE CASTRO A TOXIDADE DO ÁCIDO ASCÓRBICO EM PLANTAS DE ARROZ SILENCIADAS NAS APXs CLOROPLÁSTICAS INDUZ ESTRESSE OXIDATIVO NÃO DEPENDENTE DA FOTOSSÍNTESE Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do Título de Mestre em Bioquímica. Orientador: Prof. Dr. Joaquim Albenísio Gomes da Silveira FORTALEZA 2014
3
4 JAMYLA LIMA SABOYA DE CASTRO A TOXIDADE DO ÁCIDO ASCÓRBICO EM PLANTAS DE ARROZ SILENCIADAS NAS APXs CLOROPLÁSTICAS INDUZ ESTRESSE OXIDATIVO NÃO DEPENDENTE DA FOTOSSÍNTESE Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do Título de Mestre em Bioquímica. Orientador: Prof. Dr. Joaquim Albenísio Gomes da Silveira Aprovada em: 14/07/2014.
5 À Deus, OFEREÇO À minha família, DEDICO AGRADECIMENTOS
6 Em primeiro lugar, agradeço a Deus por ter me concedido graças, paciência, sabedoria, persistência, força, coragem e determinação em minha caminhada acadêmica. A meus Pais, pelo incentivo, que torceram e se alegraram com minhas conquistas e me apoiaram em todos os momentos, pelo esforço que fizeram para oferecer a mim e meu irmão uma boa educação. A minha família por todo apoio, incentivo e ajuda na minha caminhada. Ao Prof. Dr. Joaquim Albenísio Gomes da Silveira, pela oportunidade e por ter acreditado no meu potencial, aceitando me orientar durante o mestrado, oferecendo todo o suporte técnico, conselhos e todo tipo de contribuição para esta importante etapa da minha formação profissional. À Profa. Dra. Márcia Margis-Pinheiro, da UFRGS, pelo fornecimento das plantas silenciadas e pelas demais colaborações neste trabalho. Ao Prof. Dr. Evandro Nascimento da Silva e Dr. Milton Costa Lima Neto, pela aceitação do convite para participar da banca examinadora e devidas contribuições. Aos integrantes e ex-integrantes do LABPLANT, Adilton, Amnon, Ana Karla, Cinthya, Cristina, Carol, Fabrício, Girlaine, Glaydson, João Victor, Jones, Jordânia, Juliana, Lara, Marcio, Petterson, Rachel, Rafael, Sérgio e Tathiana, presentes durante o período do meu mestrado. Ao programa de Pós-graduação em Bioquímica da Universidade Federal do Ceará e aos funcionários do Departamento de Bioquímica e Biologia Molecular e da coordenação da Pós-Graduação em Bioquímica da UFC. Ao coordenador da Pós-Graduação, Prof. Dr. Márcio Viana Ramos. A Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa concedida. A todos, muito obrigada!
7 RESUMO O ácido ascórbico (AA) é um dos antioxidantes mais importante na proteção das plantas contra o estresse oxidativo gerado por estresses abióticos. Em células animais, diversos trabalhos têm demonstrado que concentrações elevadas desse ácido podem causar toxicidade e morte celular. O mecanismo proposto é de uma ação pro-oxidante, por meio da redução de Fe +3 para Fe +2 e ação desse último na reação de Fenton, com geração de espécies reativas de oxigênio (EROs). Até o nosso conhecimento, esse mecanismo ainda não foi relatado em plantas. O objetivo deste trabalho foi elucidar mecanismos de toxicidade de concentrações elevadas de AA em plantas, utilizando como modelo mutantes de arroz com deficiência (silenciamento gênico) nas duas APX de cloroplasto (estromal e tilacoidal). Plantas silenciadas e não transformadas (NT) com 45 dias de idade foram expostas a 10 mm (concentração moderada) e 50 mm (concentração elevada) de AA exógeno (pulverizado nas folhas). Essas concentrações foram definidas a partir de experimentos dose-dependente de 0 a 50 mm utilizando segmentos foliares em placa. No sentido de avaliar o efeito protetor (antioxidante) do AA, plantas e segmentos foliares foram expostos a intensidade de luz elevada (1000 µmol m -2 s -1 ) para induzir estresse fotoxidativo. Concentrações de AA acima de 30 mm induziram estresse oxidativo (aumento no nível de TBARS) em segmentos de folhas e esse efeito foi potencializado por luz elevada. Além de dano oxidativo, esses níveis de AA induziram aumento no dano de membrana (vazamento de eletrólitos) e redução na integridade do fotossistema II (Fv/Fm). É interessante notar que as concentrações de 10 e 20 mm de AA não mitigaram os efeitos negativos causados pelo o excesso de luz. A concentração elevada de AA (50 mm) induziu senescência foliar na presença de luz elevada, indicada por redução nos conteúdos de clorofilas e carotenoides. As plantas deficientes nas duas APXs de cloroplasto (APX7/8) apresentaram maior sensibilidade a toxicidade do AA, especialmente na combinação com luz elevada. Esses efeitos foram indicados por exibirem maiores níveis de TBARS (peroxidação lipídica), vazamento de eletrólitos, H 2 O 2 e radical superóxido. Curiosamente, as plantas mutantes na presença de AA elevado não apresentaram diferenças em diversos parâmetros da fotossíntese: taxa de assimilação de CO 2 e indicadores de eficiência do FSII (ΦPSII, ETR, NPQ e Fv/Fm) e FSI (ΦPSI, ETR e P700), além da estimativa do fluxo cíclico (CEF), quando compradas com as NT. A despeito da
8 toxicidade de AA não ter alterado os parâmetros da fotossíntese nas plantas deficientes em APX, a presença de luz elevada, isoladamente, causou mudanças em alguns parâmetros da atividade fotoquímica nessas plantas. O conjunto dos dados deste trabalho mostra que o excesso de AA pode causar toxicidade em plantas. A intensidade desses efeitos é fortemente potencializada pelo excesso de luz, mas eles não são dependentes da fotossíntese. O papel das duas APXs de cloroplasto e da luz elevada na toxicidade de AA não ficou claro neste trabalho, apesar das plantas deficientes terem mostrado maior sensibilidade. Aparentemente, o mecanismo de toxicidade de AA em plantas é semelhante ao proposto para células animais. Esse antioxidante quando em excesso pode atuar como pro-oxidante estimulando as reações de Fenton, induzindo a acumulação de EROs e gerando estresse oxidativo. Novos estudos são necessários para elucidar o papel das APXs de cloroplasto e da luz elevada na toxicidade de ácido ascórbico em plantas. Palavras-chave: Ácido ascórbico. Peroxidases do ascorbato. Estresse oxidativo. Oryza sativa.
9 ABSTRACT Ascorbic acid (AA) is one of the most important antioxidants in plant protection against the oxidative stress generated by abiotic stresses. In animal cells, several works have shown that high concentrations of this acid can cause toxicity and cell death. The proposed mechanism is related to a pro-oxidant action by the reduction of Fe +3 to Fe +2 and by the action of this Fe +2 in the Fenton reaction with generation of reactive oxygen species (ROS). To the best of our knowledge, this mechanism has not been reported yet. The objective of this work was to elucidate toxicity mechanisms of high concentrations of AA in plants using rice mutants with deficiency (gene silencing) in two chloroplastic APX (stromal and thylakoidal) as model. Fortyfive days old silenced plants and non-transformed (NT) were exposed to 10 mm (moderate concentration) and 50 mm (high concentration) of exogenous AA (sprayed on leaves). These concentrations were defined based on dose-dependent experiments from 0 to 50 mm using leaf segments in plates. In order to assess the protective effect (antioxidant) of the AA, plants and leaf segments were exposed to high light intensity (1000 µmol m -2 s -1 ) to induce photooxidative stress. AA concentrations higher than 30 mm induced oxidative stress (increase in the TBARS level) in leaf segments and this effect was enhanced by high light. In addition to the oxidative damage, these AA concentrations induced an increase in membrane damage (electrolytes leakage) and reduction in photosystem II integrity (Fv/Fm). Interestingly, the 10 and 20 mm concentrations did not mitigate the negative effects caused by the light excess. The high AA concentration (50 mm) induced leaf senescence under high light, indicated by the decrease in chlorophyll and carotenoids contents. Plants deficient in two chloroplast APX (APX7/8) displayed higher sensibility to AA toxicity, especially in combination with high light. These effects were indicated by exhibition of higher levels of TBARS (lipid peroxidation), electrolyte leakage, H 2 O 2 and superoxide radical. Curiously, the transgenic plants under high AA concentrations did not exhibited differences for several photosynthetic parameters: CO 2 assimilation rate and PSII (ΦPSII, ETR, NPQ e Fv/Fm) and PSI efficiency indicators (ΦPSI, ETR e P700), apart from the estimation of cyclic flux (CEF), compared with NT. Despite the AA toxicity have not changed the parameters of photosynthesis in APX-deficient plants, the sole presence of high light caused changes in some parameters of photochemical activity in these plants. The data set
10 of this work shows that the excess of AA may cause toxicity in plants. The intensity of these effects is strongly enhanced by the excess of light but they are not dependent on photosynthesis. In this work, the roles of the two chloroplastic APX and/or high light on the AA toxicity still unclear, despite the deficient plants had showed increased sensibility. Apparently, the mechanism of AA toxicity in plants is similar to the proposed for animal cells. This antioxidant, when in excess, can act as a pro-oxidant stimulating Fenton reactions, inducing the accumulation of ROS and resulting oxidative stress. Further studies are needed to elucidate the role of the chloroplast APXs and high light on the toxicity of ascorbic acid in plants. Key words: Ascorbic acid. Ascorbate peroxidase. Oxidative stress. Oryza sativa.
11 LISTA DE ILUSTRAÇÕES CAPÍTULO 1 Figura 1 Resumo simples das principais espécies químicas de oxigênio (A) e os dois caminhos principais de redução de oxigênio (B) Figura 2 Duas das principais vias para o metabolismo de H 2 O 2 em plantas Figura 3 A rede ascorbato - fotossíntese - respiração - ciclo TCA Figura 4 Papel de do reciclagem ascorbato em processos relacionados com a fotossíntese CAPÍTULO 2 Figure 1. Changes in (A) membrane damage, (B) Fv/Fm and (C) φpsii in leaf segments of non-transformed (NT) rice plants treated with different ascorbic acid (AA) concentrations after 24h in low light (200 µmol m -2 s - 1 ) and high light (1000 µmol m -2 s -1 ). Asterisks indicate significant difference between treatments, within a same AA concentration, at a confidence level of Points are averages of 4 replicates ± SD Figure 2. Changes in (A) membrane damage, (B) APX activity, (C) reduced ascorbate content (ASC) and (D) total ascorbate content (ASC + DHA) in leaf segments of non-transformed (NT) and APX7/8-silenced rice plants exposed to different ascorbic acid (AA) concentrations after 24h in the dark. Asterisks indicate significant difference between treatments, within a same AA concentration, at a confidence level of Points are averages of 4 replicates ± SD Figure 3. Changes in (A) membrane damage, (B) lipid peroxidation, (C) Fv/Fm and (D) hydrogen peroxide in leaf segments of non-transformed (NT) and APX7/8-silenced rice plants treated with 0 and 50 mm ascorbic acid (AA) after 24h of dark and high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between the treatments within of the light treatments (dark and HL), and different capital letters represent significant difference between light treatments within the treatments at a confidence level of Bars represent the average of 4 replicates ± SD Figure 4. Changes in (A) chlorophylls and (B) carotenoids in leaf segments of nontransformed (NT) and APX7/8-silenced rice plants treated with 0 and 50
12 mm ascorbic acid (AA) after 24h of dark and high light (1000 µmol m -2 s - 1 ). Lowercase letters represent significant difference between the treatments within of the light treatments (dark and HL), and different capital letters represent significant difference between light treatments within the treatments at a confidence level of Bars represent the average of 4 replicates ± SD Figure 5. Appearance of NT and APX7/8-silenced leaf segments of rice plants exposed to control or 50 mm ascorbic acid (AA) after 24h of dark and high light (1000 µmol m -2 s -1 ). The pictures were selected as the most representative from four independent replicates Figure 6. In situ localization of superoxide using NBT dye in NT and APX7/8 leaf segments of rice plants exposed to control or 50 mm ascorbic acid (AA) after 24 h of dark. The pictures were selected as the most representative from four independent replicates Figure S1. Habitus of representative plants from four replicates (each replicate represented by a pot containing two plants). Non-transformed (NT) and OsApx7/8-silenced plants after 45 days of growth in a complete nutrient solution under normal growth conditions 76 Figure S2. Characterization of chloroplastic OsAPX7 and OsAPX8 genes in Apx7/8s silenced plants. (A) Expression of all OsAPX genes in Apx7/8s plants at generation T2 compared to the expression observed in NT plants. (B) APX activity in NT and APX7/8-silenced leaf segments of rice plants under control conditions. Bars represent the average of 3 replicates ± SD. Different letters represent significant differences among the Apx7/8s silenced and NT plants 77 Figure S3. Appearance of leaf segments in NT rice plants exposed different acid ascorbic (AA) concentration after 24h of low light (200 µmol m -2 s -1 ) and high light (1000 µmol m -2 s -1 ). The pictures were selected as the most representative from four independent replicates... 78
13 LISTA DE TABELAS CAPÍTULO 2 Table 1. Changes in membrane damage, lipid peroxidation, contents of ASC, ASC + DHA, GSH and total GSH, and redox state of ASC and GSH in nontransformed (NT) and APX7/8-silenced rice leaves, control and sprayed in absence or 10 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and capital letters represent significant difference between genotypes within treatments at confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test Table 2. Changes in membrane damage, lipid peroxidation, contents of ASC, ASC + DHA, GSH and total GSH, and redox state of ASC and GSH in nontransformed (NT) and APX7/8-silenced rice leaves, control and sprayed with 50 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ) or moderate light (500 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and capital letters represent significant difference between genotypes within treatments at confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test Table 3. Gas exchange and photochemical parameters of PSII and PSI in nontransformed (NT) and APX7/8-silenced rice intact leaves, control and sprayed in absence or 10 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and different capital letters represent significant difference between genotypes within treatments at a confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test Table 4. Gas exchange and photochemical parameters of PSII and PSI in nontransformed (NT) and APX7/8-silenced rice intact leaves, control and sprayed with 50 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ) or moderate light (500 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and
14 different capital letters represent significant difference between genotypes within treatments at a confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test
15 LISTA DE ABREVIATURAS E SIGLAS APX AA ASC capx CAT chlapx CTE DHA DHAR EROs; ROS FSI; PSI FSII; PSII GSH GSSG mcte MDHA MDHAR MV sapx SOD tapx TCA Peroxidase do Ascorbato Ácido ascórbico Ascorbato; ascorbato reduzido Peroxidase do Ascorbato citosólica Catalase Peroxidase do Ascorbato cloroplástica Cadeia de Transporte de Elétrons Dehidroascorbato Dehidroascorbato redutase Espécies Reativas de Oxigênio Fotossistema I Fotossistema II Glutationa; Glutationa reduzida Glutationa oxidada Cadeia de Transporte de Elétrons mitocondrial Monodehidroascorbato Monodehidroascorbato redutase Metilviologênio Peroxidase do Ascorbato do estroma Superóxido Dismutase Peroxidase do Ascorbato tilacoidal Ácido tricarboxílico
16 SUMÁRIO CAPÍTULO INTRODUÇÃO GERAL REFERENCIAL TEÓRICO Modelo vegetal: arroz Estresse oxidativo: Espécies reativas de oxigênio Processos fotossintéticos e produção de EROs Estresse de alta luz Ascorbato e peroxidase do ascorbato HIPÓTESE E OBJETIVOS Hipótese Objetivo geral Objetivos específicos REFERÊNCIAS CAPÍTULO Abstract INTRODUCTION MATERIALS AND METHODS Constructing the plant vector, plant transformation and growth conditions Ascorbic acid and high light supplying in leaf segments Ascorbic acid and high light supplying to entire plants Gas exchange, chlorophyll a fluorescence and P700 absorption measurements Electrolyte leakage and lipid peroxidation H 2 O 2 content determination Determination of ascorbate and glutathione Pigment determination Enzymatic activity assays Statistical analyses and experimental design RESULTS Phenotypic characterization, OsAPX7 and OsAPX8 transcript levels and APX activity... 51
17 3.2 High light enhanced exogenous ascorbic acid toxicity and APX7/8 mutants were more sensitive than NT utilizing leaf segments Exogenous AA toxicity was strongly enhanced by HL and APX7/8 mutants suffered higher oxidative stress compared with NT plants High exogenous AA in presence of HL induced higher oxidative stress in APX7/8 plants but they presented similar oxidation-reduction states of ASC and GSH Exogenous AA induces strong impairment in photochemical activity and CO 2 assimilation under HL but APX7/8 mutant plants were similarly affected DISCUSSION ACKNOWLEDGEMENTS REFERENCES... 60
18 CAPÍTULO 1 REFERENCIAL TEÓRICO
19 17 1 INTRODUÇÃO GERAL As plantas são continuamente expostas aos estresses ambientais, incluindo a luz alta, a irradiação UV, seca, salinidade, calor e frio. Estes estresses perturbam o equilíbrio metabólico das células, o que resulta numa maior produção de espécies reativas de oxigênio (EROs), tais como peróxido de hidrogénio (H 2 O 2 ), o radical superóxido (O - 2 ), o radical hidroxil ( OH) e oxigênio singleto, levando a danos oxidativos (ASADA 1999; MITTLER, 2002; SHIGEOKA et al. 2002; ISHIKAWA; SHIGEOKA 2008). Recentemente tornou-se claro que as EROs também são reguladores-chave de muitos processos biológicos, tais como o crescimento, o ciclo celular, a morte celular programada, a sinalização hormonal, as respostas ao estresse abiótico e biótico, e desenvolvimento (MITTLER et al., 2004; FOYER; NOCTOR, 2005; FUJITA et al., 2006). Portanto, o estado redox celular, que consiste em um delicado equilíbrio entre a produção e remoção de EROs, deve ser estritamente controlado. O desbalanço entre a produção e eliminação destas EROs leva ao estresse oxidativo. (MÜLLER et al., 2001; GUO et al., 2006). A fotorredução de oxigênio molecular através do fotossistema I (FSI) leva à formação de O - 2, que, por sua vez, torna-se rapidamente dismutado a H 2 O 2, quer espontaneamente ou por via enzimática por meio da superóxido dismutase (SOD) (ASADA, 1999). O H 2 O 2 é então convertido em água pela peroxidase do ascorbato (APX). Embora o nível das EROs seja utilizado como indicador do nível de estresse sofrido pela planta, o conteúdo destes precisa ser mantido sob controle a fim de evitar seus efeitos danosos (MITTLER, 2002; MOLLER et al., 2007). Para tal, a célula possui um sistema de defesa compostos por antioxidantes enzimáticos e não enzimáticos que são responsáveis em manter os níveis aceitáveis das EROs levando a proteção contra danos oxidativos (del RIO et al., 2002; VRANOVÁ et al., 2002). Nas células vegetais, a síntese do ascorbato (ASC) é comum em plantas superiores. O ASC é considerado um dos principais compostos antioxidantes solúveis ativamente sintetizadas em tecidos verdes, bem como em órgãos de armazenamento, e é formada em plantas através de várias vias de biossíntese (MASTROPASQUA et al., 2012). O ASC está envolvido em muitos processos fisiológicos do metabolismo da planta (SMIRNOFF, 1996). O ascorbato pode atuar como antioxidante secundário, doando elétrons para a redução do peróxido de
20 18 hidrogênio na reação catalisada pela APX, ou primariamente, pela interação direta com diferentes EROs, como o H 2 O 2, O - 2, OH, 1 O 2 e hidroperóxidos de lipídios (SMIRNOFF, 1996; NOCTOR; FOYER, 1998; SHAO et al., 2008). O ASC é uma das primeiras linhas de defesa oxidativa e o seu sistema redox, constituído pelos diferentes estados de oxidação da molécula, é um importante mecanismo de manutenção do estado redox celular, sob condições fisiológicas normais ou de estresses (NOCTOR; FOYER, 1998). O ácido L-ascórbico é o antioxidante primário solúvel em água, em plantas e animais. Dada a importância desta vitamina para a saúde animal e vegetal, o aumento do teor de ascorbato têm sido o objetivo de muitos estudos para melhorar o valor nutritivo das plantas e suas respostas ao estresse (CHEN et al., 2003; HANCOCK; VIOLA, 2005; NAQVI et al., 2009). Portanto, a amplificação do conhecimento dos mecanismos vegetais de combate aos efeitos danosos de estresses ambientais, incluindo os relacionados ao metabolismo oxidativo em estudos utilizando abordagens experimentais mais amplas, capazes de testar e avaliar os efeitos isolados e combinados de determinados fatores adversos, são indispensáveis para uma compreensão mais precisa e detalhada das interações ambientais que afetam negativamente o desempenho vegetal.
21 19 2 REFERENCIAL TEÓRICO 2.1 Modelo vegetal: arroz O arroz está entre os cereais mais consumidos do mundo (MAPA, 2014), caracterizando-se como principal alimento para mais da metade da população mundial. É a terceira maior cultura cerealífera do mundo, apenas ultrapassado pelo milho e pelo trigo. O arroz cultivado é uma planta herbácea incluída na classe Liliopsida (Monocotiledônea), ordem Poales, família Poaceae, gênero Oryza. O arroz (Oryza sativa L.) é uma gramínea anual, classificada no grupo de plantas C 3, adaptada a ambientes aquáticos. Esta adaptação é devido à presença de aerênquima no colmo e nas raízes das plantas, possibilitando a passagem de oxigênio do ar para a camada da rizosfera (SOSBAI, 2005). Foram identificados no genoma do arroz oito genes que codificam para a enzima APX, APXs de 1 a 8, e variam de acordo com a localização subcelular: APX1 e APX2 são codificadores das APXs citosólicas; APX3 e APX4, das peroxissomais; APX5 e APX6, das mitocondriais; e APX7 e APX8, das cloroplastídicas (TEIXEIRA et al., 2004; 2006). O estudo de como a ausência de um dos genes codificadores de APX pode alterar o metabolismo oxidativo de plantas transformadas de arroz aparenta ser um enfoque importante. 2.2 Estresse oxidativo: Espécies reativas de oxigênio O termo estresse oxidativo ainda carece de uma definição precisa, mas as características principais são: (1) aumento da carga oxidativa (aumento da produção de EROs); (2) o potencial de oxidação descontrolada devido a taxas de produção serem superiores as taxas de metabolismo; (3) o dano oxidativo aos componentes celulares, o que pressupõe que a taxa de oxidação é superior a reparação ou substituição; causando (4) a acumulação de componentes celulares danificados de alguma forma que conduzem à perda de função e eventual morte (FOYER; NOCTOR, 2011). Como resultado do metabolismo oxidativo, os organismos passaram a produzir grande variedade e quantidade de espécies reativas de oxigênio (EROs), as quais podem desempenhar diversas funções no metabolismo celular, sendo
22 20 produzidas em diferentes compartimentos celulares, tais como cloroplastos, mitocôndrias, peroxissomos, membrana plasmática, entre outros. Quando produzidos em excesso, prejudicam a homeostase metabólica através de danos oxidativos a lipídeos (destruindo as membranas lipídicas), proteínas e ácidos nucléicos, por serem altamente reativos a estes tipos de moléculas (McCORD, 2000; APEL; HIRT, 2004; MUNNS, 2005; SHARMA et al., 2012). As EROs controlam várias vias de sinalização em plantas envolvidas nas respostas a estresses e patógenos, fotossíntese, morte celular programada, a ação hormonal, crescimento e desenvolvimento (SCANDALIOS, 2002; APEL; HIRT, 2004). As EROs superóxido (O - 2 ) e oxigênio singleto ( 1 O 2 ) são produzidas nos cloroplastos pela fotorredução de oxigênio e transferência de energia da clorofila no estado excitado tripleto ao oxigênio, respectivamente. O peróxido de hidrogênio (H 2 O 2 ) e radicais hidroxil (. OH) podem se formar como resultado das reações de O 2 Normalmente, os níveis de EROs em plantas são regulados pelos sistemas antioxidantes e mantido a um nível constante (WANG et al., 2013). O dano por EROs é um dos principais mecanismos subjacentes aos estresses bióticos e abióticos, incluindo secas, luz alta, ferimento, sal, ou infecção por patógeno (KARPINSKI et al., 1997; NOCTOR; FOYER, 1998; MITTLER et al., 2004). As células desenvolveram mecanismos altamente regulados para manter um equilíbrio entre a produção e a destruição de EROs (MILLER et al., 2007). Esta rede é composta por mais de 150 genes que codificam para proteínas produtoras de EROs tais como NADPH oxidases e enzimas de limpeza de EROs tais como superóxido dismutase (SODs), catalases (CATs), e as peroxidases do ascorbato (APXs) (MITTLER et al., 2004). Entre as diferentes EROs, o H 2 O 2 é o menos reativo (Figura 1). No entanto, ainda não há consenso sobre os teores foliares prováveis ou concentrações em diferentes compartimentos intracelulares, e a quantificação do mesmo desta relativamente estável EROs é problemática por causa de uma série de potenciais artefatos, por exemplo, ligados a ascorbato (QUEVAL et al., 2008; VELJOVIC JOVANOVIC et al., 2002).
23 Figura 1 Resumo simples das principais espécies químicas de oxigênio (A) e os dois caminhos principais de redução de oxigênio (B). 21 Fonte: Adaptado de FOYER; NOCTOR, O esquema mostra apenas as principais formas pensadas para existir em condições fisiológicas. As formas protonadas de superóxido e formas desprotonadas de H 2 O 2 também existem. As reatividades relativas dos diferentes ROS são indicadas por asteriscos em (A). O termo ROS se refere a qualquer espécie de oxigênio tripleto que é mais reativa que o O 2 ; um radical é definido como uma molécula que transporta um elétron não emparelhado; um íon refere-se a um composto que transporta uma carga (isto é, o número total de elétrons não é igual ao número total de prótons). A ubiquidade de EROs no metabolismo da planta, sem dúvida, explica a complexidade e redundância parcial aparente do sistema antioxidante em plantas, o qual inclui várias classes de metabólitos redutores, assim como enzimas (MITTLER, 2004). Antioxidantes de baixo peso molecular são frequentemente descritos como moléculas que são capazes de reduzir oxidantes sem se ter ação significativa próoxidantes. Numerosas classes de compostos encontrados em plantas têm sido discutidas como antioxidantes (por exemplo, ascorbato, glutationa, tocoferol, carotenóides, flavonóides e derivados relacionados aos fenilpropanóides e poliaminas) e muitas outras moléculas comuns podem ser considerados como tendo esta propriedade (por exemplo, açúcares e açúcar álcoois). No entanto, alguns destes compostos podem também ser potencialmente pró-oxidantes, dependendo do contexto bioquímico e presença de enzimas tais como as oxidases. Por exemplo, o papel sinalizador de oxidase de poliaminas apoplástica e H 2 O 2 derivados de
24 22 poliaminas têm sido descritos na defesa de morte celular programada em respostas ao estresse abiótico (MOSCHOU et al., 2008). Apesar da grande eficiência antioxidante, o ascorbato também age paradoxalmente como pró-oxidante in vitro. Soluções de ascorbato e ferro são usadas há décadas para induzir modificações oxidativas em lipídios, proteínas e DNA (HALLIWELL; GUTTERIDGE, 1999). Assim, o ácido ascórbico pode atuar como catalisador na reação de Fenton, promovendo a redução de íons férricos em íons ferrosos, conforme mostrado na equação 2 e 3 (reação entre um antioxidante e com radicais livres e com íon férrico). Portanto, o ácido ascórbico pode ser tanto um antioxidante, quanto um pró-oxidante dependendo das condições (DENISOV; AFANAS EV, 2005). AH 2 + R. AH. + RH (2) AH 2 + Fe 3+ AH. + Fe 2+ + H + (3) Enquanto o oxigênio singleto e radical hidroxil são pensados para ser essencialmente controlado por sistemas de desintoxicação não enzimáticos, várias enzimas desempenham papéis importantes na remoção de H 2 O 2. As enzimas que participam do metabolismo antioxidante e reações redox relacionadas podem distinguir-se do seguinte modo: (a) as que atuam como uma enzima antioxidante primária (isto é, utiliza superóxido, H 2 O 2 ou peróxido orgânico como substratos); (b) as que estão envolvidas com a manutenção do estado redox (por exemplo, a regeneração de formas reduzidas de redutores); (c) as que funcionam para controlar sinais de metabólitos secundariamente liberados (por exemplo, conjugases). Dentro da primeira categoria, as enzimas antioxidantes primárias mais bem estudadas em plantas são SOD, CAT e APX (Figura 2). Enquanto as duas primeiras catalisam reações de dismutação, a terceira requer um redutor na forma de ascorbato (FOYER; NOCTOR, 2009).
25 23 Figura 2 Duas das principais vias para o metabolismo de H 2 O 2 em plantas. Fonte: FOYER; NOCTOR, APX, peroxidase do ascorbato; DHAR, dehidroascorbato redutase; GR, glutationa redutase; GSH, glutationa; GSSG, glutationa oxidada; MDHAR, monodehidroascorbato redutase. O ciclo ascorbato-glutationa (ASC-GSH) tem uma função importante na eliminação de H 2 O 2, e o metabolismo do ciclo ASC-GSH pode ser estimulado em plantas por moderar as condições de estresse para eliminar EROs (RAO et al., 1995). O ácido ascórbico e a glutationa, dois antioxidantes de baixo peso molecular, são envolvidos em reações do ciclo de ASC-GSH e são de grande importância para a preservação de uma ampla gama de processos metabólicos (DRAZKIEWICZ et al., 2003). Eles são associados com o equilíbrio redox celular, e as proporções de ASC/DHA e GSH/GSSG pode funcionar como sinais para a regulação dos mecanismos antioxidantes (MITTLER, 2002). 2.3 Processos fotossintéticos e produção de EROs A fotossíntese é uma fonte bem estabelecida de EROs em plantas. A cadeia de transporte de elétrons (CTE) opera em um ambiente aeróbio; assim, os sistemas de regulação são necessários para minimizar a produção de EROs. Além disso, uma rede de antioxidante eficaz também é essencial, a fim de processar eficazmente EROs e para manter o pool de EROs intracelulares em níveis baixos. A importância da rede antioxidante na manutenção de altas taxas de fotossíntese foi demonstrada em muitos estudos usando a abordagem de genética molecular tanto para desativar, aumentar as atividades de enzimas antioxidantes ou alterar a abundância de antioxidantes de baixo peso molecular, como ascorbato (ASC) e glutationa reduzida (GSH) (FOYER; SHIGEOKA, 2011). Os conceitos dos papéis de EROs em células vegetais heterotróficas foram parcialmente inspirados por modelos animais e outros sistemas, como leveduras e bactérias não fotossintetizantes. No entanto, o foco esmagador sobre os
26 24 papéis de EROs nas respostas das plantas ao estresse têm sido sobre os tecidos fotossintetizantes. É frequentemente afirmado que o teor de oxigênio dos cloroplastos é significativamente mais elevado do que o resto da célula fotossintética (ASADA, 1999, 2006). É interessante notar, no entanto, que, apesar de cloroplastos gerar oxigênio na face interior da membrana do tilacóide, ainda há tão poucas provas que tanto o tilacóide ou membranas envelope dos cloroplastos apresentam uma barreira significativa para a difusão do oxigênio. De longa data os dados experimentais sugerem que a evolução do O 2 na fotossíntese faz com que haja apenas um aumento modesto nas já elevadas concentrações de O 2 nos cloroplastos [~20% durante a fotossíntese (STEIGER et al., 1977)]. No entanto, as células fotossintéticas têm indiscutivelmente várias vias produtoras de EROs únicas e uma multiplicidade de sistemas de metabolização de EROs. A alta concentração de EROs pode causar alterações no metabolismo vegetal devido a uma restrição dos processos fotossintéticos (CATTIVELLI et al., 2008). O dano oxidativo a qualquer parte dos fotossistemas diminui a eficiência e a taxa máxima de fotossíntese, um processo chamado de fotoxidação ou fotoinibição (KOK, 1956; MATSUBAR; CHOW, 2004). As alterações causadas ao processo fotossintético em plantas sob condições de estresse levam a uma produção excessiva de EROs. Na ausência de mecanismos eficientes de proteção (enzimáticos ou não), o metabolismo pode ser seriamente alterado e resultar em danos oxidativos (PAN et al., 2006). Dentro do contexto da hipótese de "dano induzido pelo estresse oxidativo", a proteção adicional da fotossíntese durante o estresse, que têm sido obtido através do reforço da rede antioxidante do cloroplasto, fornece evidências de que é possível reduzir as reações potencialmente nocivas causadas pela carga oxidativo (LOGAN et al., 2006). Por exemplo, plantas de tabaco transgênico (Nicotiana tabacum) e Arabidopsis com superexpressão da APX ligada à membrana tilacoidal nos cloroplastos exibiram tolerância a luz alta e tratamento com paraquat, uma combinação que é projetado para maximizar o estresse fotoxidativo (ISHIKAWA; SHIGEOKA, 2008).
27 Estresse de alta luz A luz é um dos fatores ambientais essenciais para as plantas (MA et al., 2014). Plantas expostas à luz excessiva podem sofrer fotoinibição, sérios danos ao aparato fotossintético e degradação de proteínas de fotossíntese. Estresse de luz também pode levar à acumulação de EROs e ativação de enzimas antioxidantes (MITTLER, 2002). Condições de luz alta desencadeia o excesso de redução da cadeia de transporte de elétrons com subsequente formação de EROs. O quenching não fotoquímica (NPQ) reduz a pressão de elétrons dirigido pela luz e geração de EROs nos fotossistemas I e II. O oxigênio singleto é gerado no FSII e ânions superóxido no FSI. A desintoxicação de EROs neutraliza os desequilíbrios redox e mantém a aptidão da planta. No cloroplasto, SOD catalisa a síntese de H 2 O 2 e O 2 a partir de duas moléculas de O - 2. O H 2 O 2 é desintoxicado pela via dependente de ascorbato usando APX ou a via independente de ascorbato usando oxidases de tiol, tais como peroxirredoxinas (ALSHARAFA et al., 2014). As respostas das isoenzimas de APX para estresse fotoxidativo foram estudadas em folhas de espinafre durante estresse de alta luz. A atividade e transcrições da APX citosólicas foram aumentadas durante o estresse de alta luz, porém os níveis de proteína não foram alterados. As atividades das isoformas de APX cloroplásticas (chlapxs) mostrou um decréscimo gradual, ao passo que as outras isoenzimas não mostraram nenhuma variação significativa nos níveis de transcrição e de proteínas, assim como a atividade (YOSHIMURA et al., 2000). No trigo, uma linha mutante mostrando diminuição da atividade da APX tilacoidal (tapx) apresentaram redução na atividade fotossintética e acúmulo de biomassa quando cultivado sob alta intensidade de luz, o que sugere que tapx é essencial para a fotossíntese (DANNA et al., 2003). Mutantes individuais de Arabidopsis que faltam tapx ou APX do estroma apresentaram níveis mais elevados de H 2 O 2 e proteínas oxidadas do que as plantas não transformadas quando expostos a estresse de alta luz e metilviologênio (MV). O efeito mais forte de estresse fotoxidativo foi observado em plantas que faltam tapx, estas mostrando aumento do acúmulo de H 2 O 2 e proteínas oxidadas (MARUTA et al., 2010). Quando folhas maduras de duplos mutantes de tapx/sapx foram submetidos ao estresse fotoxidativo de curto prazo induzida pela alta luz ou tratamento com MV, as plantas apresentaram
28 26 susceptibilidade (KANGASJARVI et al., 2008). Estes resultados indicam que as isoformas de APXs são indispensáveis sob estresses ambientais em diferentes espécies, especialmente sob condições de estresse de luz. 2.5 Ascorbato e peroxidase do ascorbato Ascorbato: A molécula, que levanta novas questões e fornece novas descobertas continuamente. O conhecimento sobre o seu papel convencional, mas crucial na defesa antioxidante, bem como na proteção de estresse se aprofundou (CONKLIN et al., 1996; SZARKA et al., 2012). O ascorbato pode ser um elemento importante da CTE fotossintética, CTE mitocondrial (mcte) e rede de regulação do ciclo do ácido tricarboxílico (TCA) uma vez que (a) o nível de ascorbato pode influenciar a intensidade da fotossíntese; (b) o fluxo de elétrons através da CTE fotossintética influencia a biossíntese de ascorbato; (c) o ácido ascórbico é sintetizado firmemente acoplado ao mcte fornecendo elétrons do complexo IV, no caso de inibição do ciclo TCA e; (d) a atividade de AOX também influencia a taxa de biossíntese de ácido ascórbico. Quaisquer mudanças em qualquer um dos elementos desta rede podem influenciar os demais (Figura 3). No entanto, os detalhes desta função de transmissor de ascorbato entre as funções plastídica e mitocondriais até agora continua não elucidado e precisa de mais investigações (SZARKA et al., 2013).
29 27 Figura 3 A rede ascorbato - fotossíntese - respiração - ciclo TCA. Fonte: SZARKA et al., O fluxo de elétrons através da CTE fotossintética aumento das capacidades do citocromo c mitocondrial, das vias de AOX, e da biossíntese de ácido ascórbico. Além disso, a atividade da própria AOX aumenta a taxa de biossíntese do ascorbato. Uma vez que o ascorbato é sintetizado firmemente acoplado à CTE mitocondrial, a oxidação da L-galactono-1,4-lactona para ascorbato proporciona elétrons do complexo IV, no caso de inibição do ciclo do TCA. A sobrecarga redutora da respiração pode ser diminuída em função da inibição do ciclo do TCA e ciclo TCA ligada à respiração durante condições de luz. A inibição do ciclo do TCA (por abordagens genéticas) é acompanha pelo aumento dramático nos níveis de ascorbato. O ascorbato pode elevar a intensidade da fotossíntese por seus múltiplos papéis na fotoproteção. Quaisquer mudanças em qualquer um desses elementos desta rede influenciar os demais. AOX, oxidase alternativa. O ASC está presente na maior parte dos compartimentos da célula, incluindo citosol, cloroplastos, mitocôndrias e vacúolos, além da matriz extracelular; a distribuição de ASC nos diferentes compartimentos foi determinada recentemente em folhas de Arabidopsis, por imunomarcação utilizando um anticorpo criado contra ASC acoplado a albumina sérica bovina (ZECHMANN et al., 2011). As concentrações mais elevadas foram encontradas no citosol (20-60 mm) e peroxissomos (cerca de 20 mm). A exposição à luz elevada aumentou a sua concentração no citosol, cloroplastos (a partir de 10 a 20 mm) e vacúolo (de 2 a 12 mm) (TÓTH et al, 2013). Outros estudos avaliam que as concentrações de ASC variam de 300 mm de uma estimativa do estroma do cloroplasto para menos de 20 mm, em outras organelas (SMIRNOFF, 2000). Isto é conseguido em vários níveis, como por regular a expressão do gene e/ou modular as atividades enzimáticas envolvidas na síntese do ASC e a regeneração da sua forma oxidada, em resposta a sinais ambientais e de desenvolvimento. Além disso, a compartimentação e
30 28 transporte do ASC são necessários para manter a concentração de ASC em várias organelas e tecidos (YOSHIMURA et al., 2014). O ASC é um antioxidante eficaz, porque tem um baixo potencial de redução e, portanto, podem reagir com uma variedade de oxidantes e radicais biologicamente relevantes (CARR; FREI, 1999). Além disso, monodehidroascorbato (MDHA) tem uma reatividade baixa devido à estabilização de ressonância de seu elétron não emparelhado e prontamente catalisa a ascorbato e dehidroascorbato (DHA) (TÓTH et al., 2013). Juntamente com a glutationa, o ASC também participa da remoção enzimática de EROs na chamada "reação de Mehler" ou "ciclo águaágua". A reação de Mehler é uma importante fonte de EROs nos cloroplastos de plantas expostas à luz (ASADA, 1999). Nesta reação, a fotorredução do oxigênio molecular através do FSI leva à formação de O - 2, que, por sua vez, torna-se rapidamente dismutado a H 2 O 2, quer espontaneamente ou por via enzimática por meio da SOD (ASADA, 1999). O H 2 O 2 é então convertido em água pela APX. A reação geral de transferência de elétrons é referida como o ciclo água-água (ASADA, 1999). Uma APX solúvel está presente no estroma do cloroplasto (sapx), enquanto que uma outra APX está ancorada na membrana tilacóide (tapx) através de um domínio transmembranar do terminal C, com seu sítio catalítico voltado para o estroma (SHIGEOKA et al., 2002, ISHIKAWA; SHIGEOKA, 2008). Em plantas, o ascorbato é, de longe, o antioxidante de baixo peso molecular mais abundante. As interações entre o ascorbato, superóxido e peróxido de hidrogênio nos cloroplastos, a nível de FSI (ALLEN; HALL, 1974), as enzimas da assimilação de carbono fotossintético e o ciclo água-água através da APX e da redução de MDHA e DHA (ASADA, 1999, 2006; FOYER; HALLIWELL, 1976) têm sido extensivamente estudada por muitos anos. Assim como um substrato para a APX, o ascorbato tem inúmeras funções nas plantas, e isso se reflete em sua acumulação em muitos tecidos de plantas para concentrações muito superiores aos exigidos para a atividade de APX. O ascorbato é um cofator em várias vias de biossíntese e no ciclo da xantofila, que ajuda a proteger as plantas contra os efeitos nocivos do excesso de energia de excitação (FOYER, 1997; FOYER; HALLIWELL, 1976, NOCTOR; FOYER; 1998). Além disso, o ascorbato também desempenha papel no cloroplasto podendo servir como um doador de elétrons diretos ao FSI e fotossistema II (FSII) sob condições onde o principal sistema doador de elétrons é
31 29 prejudicado, por exemplo, sob luz alta (MANO et al., 1997, 2004), com fotorredução de MDHA por ferrodoxina (Fd) (Figura 4) mantendo o transporte de elétrons quando NAPD + é limitante (FORTI e EHRENHEIM, 1993; GRACE et al, 1995.). O ascorbato têm sido classificado como componente chave do sistema antioxidativo das plantas, estando relacionado aos estresses bióticos a abióticos (SMIRNOFF et al., 2001; DIPIERRO et al., 2005). A peroxidase do ascorbato desempenha um papel importante na regulação dos níveis de EROs celulares e são componentes centrais das redes de eliminação de peróxido de hidrogênio (SUZUKI et al., 2013). As APXs são enzimas de ligação do heme, que reduzem o peróxido de hidrogênio (H 2 O 2 ) a água, usando o ascorbato como um doador de elétrons (ASADA, 1999). O co-substrato é regenerado por monodehidroascorbato e dehidroascorbato redutases (MDHAR e DHAR) (HEIBER et al., 2014).
32 30 Figura 4 Papel de do reciclagem ascorbato em processos relacionados com a fotossíntese. Fonte: GALLIE, O transporte de elétrons através de FSII e FSI na membrana tilacóide é mostrado. A transferência de elétrons da ferredoxina (Fd) no FSI para O 2 gerando superóxido (O 2 - ) constitui a Reação de Mehler. Embora não mostrado, MDAR pode também reduzir O 2 para O 2 - no FSI. A FeSOD e a tapx, ambas associadas a membrana tilacoidal, são parte do sistema de eliminação de EROs do tilacóide e desentoxificam o superóxido gerado no fotossistema I. Apesar de não mostrada, uma SOD cobre zinco (CuZnSOD) direcionada ao cloroplasto e associada ao tilacóide funciona no sistema de defesa antioxidante do mesmo. A peroxidase do ascorbato estromal (sapx), CuZnSOD, MDAR, DHAR e GR constituem o sistema limpeza estromal. Enquanto ASC pode doar elétrons aos fotossistemas e é usado como um cofator para a violaxantina de-epoxidase (VDE), nenhum sistema de reciclagem do ASC está presente no lúmen tilacoidal. MDHA lumenal disprotona-se não-enzimaticamente em ASC e DHA, que é transportado para o estroma. PSII, fotossistema II; OEC, complexo em evolução de oxigênio; P680, dímero de clorofila especializada referente ao fotossistema II; PQ, plastoquinona; cit b6f, complexo citocromo b6f; PC, plastocianina; PSI, fotossistema I; P700, dímero de clorofila especializada referente ao fotossistema I; FNR, Fd-NADP + redutase; ASC, ascorbato. Estudos têm mostrado que APXs desempenham um importante papel na remoção de EROs em plantas (SCANDALIOS, 2002). Em Arabidopsis, APXs citosólicas (capxs) são fundamentais para homeostase celular e desempenham um papel importante na proteção oxidativa de cloroplastos sob estresses abióticos, incluindo alta luz, calor, metilviologênio e estresse hídrico (KOUSSEVITZKY et al., 2008; PNUELI et al., 2003). Em comparação com a catalase (outra enzima metabolizadora de H 2 O 2 ), a APX tem uma afinidade por H 2 O 2 (com um K m para o H 2 O 2 na gama micromolar) pelo menos cem vezes mais elevada. Assim, apesar das
33 31 baixas concentrações de APX devido a sua elevada afinidade para o H 2 O 2, esta enzima é capaz de regular finamente estes EROs (De GARA et al., 2010). A APX foi identificada em muitas plantas superiores, onde a natureza multigênica desta enzima têm sido revelada. Uma variedade de isozimas de APX foi observada no citoplasma, estroma do cloroplasto e tilacóides, onde a expensas de ascorbato, estas isozimas removem H 2 O 2 e protegem as células das plantas contra os potenciais efeitos destrutivos de H 2 O 2 (SHIGEOKA et al., 2002). A reação catalisada por APX é a seguinte: APX C 6 H 8 O 6 (ascorbato) + H 2 O 2 C 6 H 6 O 6 (DHA) + H 2 O (1) As sequências genômicas de cdna da APX foram obtidas a partir de uma grande variedade de espécies de plantas, mostrando que APX estão amplamente distribuídas no reino vegetal. As diferentes isoformas são classificadas de acordo com sua localização subcelular. As isoformas solúveis são encontradas no citossol (capx), mitocôndria (mitapx) e estroma do cloroplasto (sapx), enquanto que as isoformas ligadas à membrana são encontradas em peroxissomos e glioxissomos (mapx) e tilacóides do cloroplastos (tapx) (CAVERZAN et al., 2012). As APXs foram parcialmente caracterizadas em algumas espécies de plantas. Na planta modelo Arabidopsis thaliana L., a presença de nove genes APX foi descrito (CHEW et al., 2003). Em outro importante modelo de planta, o arroz, a família de gene APX é composta por oito membros (TEIXEIRA et al., 2004; 2006). As isoenzimas APX são instáveis na ausência do ascorbato. Assim, elevado nível de ascorbato endógeno é essencial para manter a eficácia do sistema antioxidante que protege as plantas de danos oxidativos (SHIGEOKA et al., 2002). Estudos recentes utilizando mutantes de Arabidopsis nocauteados (KOtAPX e KO-sAPX) sem tapx e sapx tem confundido a compreensão da função fisiológica de chlapxs na fotoproteção. Verificou-se que os mutantes individuais KOtAPX e KO-sAPX e até mesmo os duplos mutantes não apresentaram sintomas visíveis de estresse após longo prazo (1-14 d) da exposição à alta luz (2000 µmol fótons m -2 s -1 ) (GIACOMELLI et al. 2007). Além disso, a falta de chlapxs não afetou os níveis e/ou estado redox de H 2 O 2, ascorbato, glutationa e a atividade de transporte de elétrons nas mesmas condições de alta luz (GIACOMELLI et al. 2007). Por outro lado, Kangasjärvi et al. (2008) relataram que, embora os mutantes simples KO-tAPX e KO-sAPX apresentaram fenótipos semelhantes aos das plantas de tipo selvagem sob forte estresse fotoxidativo (50 um MV sob alta luz), os duplos
34 32 mutantes exibiram fenótipos graves sob as mesmas condições. Além disso, os níveis de vazamento de íons e a atividade de transporte de elétrons fotossintéticos nos mutantes individuais foram semelhantes aos do tipo selvagem (KANGASJÄRVI et al., 2008). Estes resultados sugerem que chlapxs podem não ser uma enzima chave na fotoproteção, pelo menos em plantas de Arabidopsis. Infelizmente, nesses estudos, não ficou claro como os mutantes nocautes causaram danos sob estresse fotoxidativo. Além disso, não está claro qual chlapx é mais importante para a fotoproteção em plantas superiores. Em outras palavras, a contribuição de cada chlapx para a tolerância ao estresse fotoxidativo em plantas superiores ainda está em discussão (MARUTA et al., 2010).
35 33 3 HIPÓTESE E OBJETIVOS 3.1 Hipótese O suprimento externo de ascorbato irá favorecer o ciclo água-água, aumentando a atividade da peroxidase do ascorbato do cloroplasto (APX7/8), minimizando os danos oxidativo e favorecendo a fotossíntese, sendo as plantas silenciadas nas APX7/8 mais beneficiadas. 3.2 Objetivo geral Avaliar a participação do ascorbato na atividade fotoquímica e na fotoproteção de plantas de arroz duplamente silenciadas para os genes OsAPX7 e OsAPX Objetivos específicos Comparar o estado geral de plantas tipo selvagem e mutantes OsAPX7/8. Avaliar o desempenho de plantas de arroz tipo selvagem e silenciadas para o gene OsAPX7/8 quando submetidas a diferentes doses de ascorbato e diferentes comprimentos de onda de luz (alta e baixa luminosidade). Entender o grau de participação das APXs cloroplásticas (estromal e tilacóidal) em resposta a estresses. Diferenciar o desempenho fotossintético entre as plantas silenciadas OsAPX7/8 e plantas não transformadas submetidas aos tratamentos. Avaliar o grau de relação do ascorbato exógeno nas plantas de arroz tipo selvagem e OsAPX7/8 submetidas à alta luz (fotoproteção) e se o ascorbato beneficiaria as OsAPX7/8.
36 34 REFERÊNCIAS ALLEN, J.F.; HALL D.O. The relationship of oxygen uptake to electron transport in photosystem I of isolated chloroplasts: The role of superoxide and ascorbate. Biochemical and Biophysical Research Communications, v. 58, p , ALSHARAFA, K.; VOGEL, M.O.; OELZE, M.L.; MOORE, M.; STINGL, N.; KÖNIG, K.; et al. Kinetics of retrograde signalling initiation in the high light response of Arabidopsis thaliana. Philosophical transactions of the Royal Society B, v. 369, p. 1 9, APEL, K.; HIRT, H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, v. 55, p , ASADA, K. The water water cycle in chloroplasts: scavenging of active oxygen and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology, v. 50, p , ASADA, K. Production and scavenging of reactive oxygen pecies in chloroplasts and their functions. Plant Physiology, v. 141, p , 2006 CARR, A.; FREI, B. Does vitamin C act as a pro-oxidant under physiological conditions? The FASEB Journal, v. 13, p , CATTIVELLI, L.; RIZZA, F.; BADECK, F.W.; MAZZUCOTELLI, E.; MASTRANGELO, A.M.; FRANCIA, E.; MARÉ, C.; TONDELLI, A.; STANCA, A.M. Drought tolerance improvement in crop plants: An integrated view from breeding to genomics. Field Crops Research, v. 105, p. 1 14, CAVERZAN, A.; PASSAIA, G.; ROSA, S.B.; RIBEIRO, C.W.; LAZZAROTTO, F.; MARGIS-PINHEIRO, M. Plant responses to stresses: role of ascorbate peroxidase in the antioxidant protection. Genetics and Molecular Biology, v. 35, p , CHEN, Z.; YOUNG, T.E.; LING, J.; CHANG, S-C; GALLIE, D.R. Increasing vitamin C content of plants through enhanced ascorbate recycling. Proceedings of the National Academy of Sciences, v. 100, p , CHEW, O.; WHELAN, J.; MILLAR, A.H. Molecular definition of the ascorbateglutathione cycle in Arabidopsis mitochondria reveals dual targeting of antioxidant defenses in plants. The Journal of Biological Chemistry, v. 278, p , CONKLIN P.L.; WILLIAMS E.H.; LAST R.L. Environmental stress sensitivity of an ascorbic acid-deficient Arabidopsis mutant. Proceedings of the National Academy of Sciences, v. 93, p , 1996.
37 DANNA, C.H.; BARTOLI, C.G.; SACCO, F.; INGALA, L.R.; SANTA-MARIA, G.E.; GUIAMET, J.J.; UGALDE, R.A. Thylakoid-bound ascorbate peroxidase mutant exhibits impaired electron transport and photosynthetic activity. Plant Physiology, v. 132, p , DENISOV, E.T.; AFANAS EV, I.B. Oxidation and antioxidants in organic chemistry and biology. Boca Raton: CRC Taylor & Francis Group, p. De GARA, L.; LOCATO, V.; DIPIERRO, S.; de PINTO, M.C. Redox homeostasis in plants. The challenge of living with endogenous oxygen production. Respiratory Physiology & Neurobiology, v. 173, p. S13 S19, del RIO, L.A.; CORPAS, F.J.; SANDALIO, L.M.; PALMA, J.M.; GOMEZ, M.; BARROSO, J.B. Reactive oxygen species, antioxidant systems and nitric oxide in peroxisomes. Journal of Experimental Botany, v. 53, p , DIPIERRO, N.; MONDELLI, D.; PACIOLLA, C.; BRUNETTI, G.; DIPIERRO, S. Changes in the ascorbate system in the response of pumpkin (Cucurbita pepo L.) roots to aluminium stress. Journal of Plant Physiology, v. 162, p , DRAZKIEWICZ, M.; POLIT, E.S.; KRUPA, Z. Response of the ascorbate glutathione cycle to excess copper in Arabidopsis thaliana (L.). Plant Science, v. 164, p , FORTI, G.; EHRENHEIM, A.M. The role of ascorbic acid in photosynthetic electron transport. Biochimica et Biophysica Acta, v. 1183, p , FOYER, C.H.; HALLIWELL, B. The presence of glutathione and glutathione reductase in chloroplasts: A proposed role in ascorbic acid metabolism. Planta, v. 133, p , FOYER, C.H. Oxygen metabolism and electron transport in photosynthesis. In: Oxidative Stress and the Molecular Biology of Antioxidant Defenses, edited by Scandalios JG. New York: Cold Spring Harbor, p , FOYER, C.H.; NOCTOR, G. Redox homeostasis and antioxidant signaling: a metabolic interface between stress perception and physiological responses. Plant Cell, v. 17, p , FOYER, C.H.; NOCTOR, G. Redox Regulation in Photosynthetic Organisms: Signaling, Acclimation, and Practical Implications. Antioxidants & Redox Signaling, v. 11, p , FOYER, C.H; NOCTOR, G. Ascorbate and Glutathione: The Heart of the Redox Hub1. Plant Physiology, v. 155, p. 2 18, FOYER, C.H.; SHIGEOKA, S. Understanding Oxidative Stress and Antioxidant Functions to Enhance Photosynthesis. Plant Physiology, v. 155, p ,
38 FUJITA, M.; FUJITA, Y.; NOUTOSHI, Y.; TAKAHASHI, F.; NARUSAKA, Y.; YAMAGUCHI-SHINOZAKI, K. Crosstalk between abiotic and biotic stress responses: a current view from the points of convergence in the stress signaling networks. Current Opinion in Plant Biology, v. 9, p , GALLIE, D.R. The role of l-ascorbic acid recycling in responding to environmental stress and in promoting plant growth. Journal of Experimental Botany, v. 64, p , GIACOMELLI, L.; MASI, A.; RIPOLL, D.R.; LEE, M.J.; VAN WIJK, K.J. Arabidopsis thaliana deficient in two chloroplast ascorbate peroxidases shows accelerated lightinduced necrosis when levels of cellular ascorbate are low. Plant Molecular Biology, v. 65, p , GRACE, S.C.; PACE, R.; WYDRZYNSKI, T. Formation and decay of monodehydroascorbate radicals in illuminated thylakoids as determined by ESR spectroscopy. Biochimica et Biophysica Acta, v. 1229, p , GUO, Y.P.; ZHOU, H.F.; ZHANG, L.C. photosynthetic characteristics and protective mechanisms against photoxidation during high temperature stress in two citrus species. Scientia Horticulturae, v. 108, p , HALLIWELL, B.; GUTTERIDGE, J.M.C. Free Radicals in Biology and Medicine, 4th ed. Claredon Press: Oxford, p. HANCOCK, R.D.; VIOLA, R. Improving the nutritional value of crops through enhancement of l-ascorbic acid (vitamin C) content: rationale and biotechnological opportunities. Journal of Agricultural and Food Chemistry, v. 53, p , HEIBER, I.; CAI, W.; BAIER, M. Linking Chloroplast Antioxidant Defense to Carbohydrate Availability: The Transcript Abundance of Stromal Ascorbate Peroxidase Is Sugar-Controlled via Ascorbate. Molecular Plant, v. 7, p , ISHIKAWA, T.; SHIGEOKA, S. Recent advances in ascorbate biosynthesis and the physiological significance of ascorbate peroxidase in photosynthesizing organisms. Bioscience, Biotechnology, and Biochemistry, v. 72, p , KANGASJARVI, S.; LEPISTO, A.; HANNIKAINEN, K.; PIIPPO, M.; LUOMALA, E.M.; ARO, E.M.; RINTAMAKI, E. Diverse roles for chloroplast stromal and thylakoid-bound ascorbate peroxidases in plant stress responses. Biochemical Journal, v. 412, p , KARPINSKI, S.; ESCOBAR, C.; KARPINSKA, B.; CREISSEN, G.; MULLINEAUX, P.M. Photosynthetic electron transport regulates the expression of cytosolic ascorbate peroxidase genes in Arabidopsis during excess light stress. Plant Cell, v. 9, p ,
39 KOK, B. On the inhibition of photosynthesis by intense light. Biochimica et Biophysica Acta, v. 21, p , KOUSSEVITZKY, S.; SUZUKI, N.; HUNTINGTON, S.; ARMIJO, L.; SHA, W.; et al. Ascorbate peroxidase 1 plays a key role in the response of Arabidopsis thaliana to stress combination. The Journal of Biological Chemistry, v. 283, p , LOGAN, B.A.; KORNYEYEV, D.; HARDISON, J.; HOLADAY, A.S. The role of antioxidant enzymes in photoprotection. Photosynthesis Research, v. 88, p , MA, G.; ZHANG, L.; SETIAWAN, C.H.; YAMAWAKI, K.; ASAI, T.; NISHIKAWA, F.; et al. Effect of red and blue LED light irradiation on ascorbate content and expression of genes related to ascorbate metabolism in postharvest broccoli. Postharvest Biology and Technology, v. 94, p , MANO, J.; USHIMARU, T.; ASADA, K. Ascorbate in thylakoid lumenas an endogenous electron donor to photosystem II: protection of thylakoids from photoinhibition and regeneration of ascorbate in stroma by dehydroascorbate reductase. Photosynthesis Research, v. 53, p , MANO, J.; HIDEG, E.; ASADA, K.. Ascorbate in thylakoid lumen functions as an alternative electron donor to photosystem II and photosystem I. Archives of Biochemistry and Biophysics, v. 429, p , MAPA, Ministério da Agricultura, Pecuária e Abastecimento. Disponível em: < Acessado em: 03 de Junho de MARUTA, T.; TANOUCHI, A.; TAMOI, M.; YABUTA, Y.; YOSHIMURA, K.; ISHIKAWA, T.; SHIGEOKA, S. Arabidopsis chloroplastic ascorbate peroxidase isoenzymes play a dual role in photoprotection and gene regulation under photooxidative stress. Plant & Cell Physiology, v. 51, p , MASTROPASQUA, L.; BORRACCINO, G.; BIANCO, L.; PACIOLLA, C. Light qualities and dose influence ascorbate pool size in detached oat leaves. Plant Science, v. 183, p , MATSUBARA, S.; CHOW, W.S. Populations of photoinactivated photosystem II reaction centers characterized by chlorophyll a fluorescence lifetime in vivo. Proceedings of the National Academy of Sciences, v. 101, p , McCORD, J.M.; The evolution of free radicals and oxidative stress. The American Journal of Medicine, v. 108, p , MILLER, G.; SUZUKI, N.; RIZHSKY, L.; HEGIE, A.; KOUSSEVITZKY, S., et al. Double mutants deficient in cytosolic and thylakoid ascorbate peroxidase reveal a 37
40 complex mode of interaction between reactive oxygen species, plant development, and response to abiotic stresses. Plant Physiology, v. 144, p , MITTLER, R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, v. 9, p , MITTLER, R.; VANDERAUWERA, S.; GOLLERY, M.; VAN BREUSEGEM, F. Reactive oxygen gene network of plants. Trends in Plant Science, v. 9, p , MØLLER, I.M.; JENSEN, P.E.; HANSSON, A. Oxidative modifications to cellular components in plants. Annual Review of Plant Biology, v. 58, p , MOSCHOU, P.M.; PASCHALIDIS, K.A.; DELIS, I.D.; ANDRIOPOULOU, A.H.; LAGIOTIS, G.D.; YAKOUMAKIS, D.I.; ROUBELAKIS ANGELAKIS, K.A. Spermidine exodus and oxidation in the apoplast induced by abiotic stress is responsible for H 2 O 2 signatures that direct tolerance responses in tobacco. Plant Cell, v. 20, p , MÜLLER, P.; LI, X.P.; NIYOGI, K.K. Non-photochemical quenching. A response to excess light energy. Plant Physiology, v. 125, p , MUNNS, R. Genes and salt tolerance: bringing them together. New Phytologist, v. 167, p , NAQVI, S.; ZHU, C.; FARRE, G.; et al. Transgenic multivitamin corn through biofortification of endosperm with three vitamins representing three distinct metabolic pathways. Proceedings of the National Academy of Sciences, v. 106, p , NOCTOR, G.; FOYER, C.H. Ascorbate and glutathione: Keeping Active Oxygen Under Control. Annual Review of Plant Physiology and Plant Molecular Biology, v. 49, p , PAN, Y.; WU, L.J.; YU, Z.L. Effect of salt and drought stress on antioxidant enzymes activities and SOD isoenzymes of liquorice (Glycyrrhiza uralensis Fisch). Plant Growth Regulation, v. 49, p , PNUELI, L.; LIANG, H.; ROZENBERG, M.; MITTLER, R. Growth suppression, altered stomatal responses, and augmented induction of heat shock proteins in cytosolic ascorbate peroxidase (Apx1)-deficient Arabidopsis plants. The Plant Journal, v. 34, p , QUEVAL, G.; HAGER, J.; GAKIÉRE, B.; NOCTOR, G. Why are literature data for H 2 O 2 contents so variable? A discussion of potential difficulties in quantitative assays of leaf extracts. Journal of Experimental Botany, v. 59, p , RAO, M.V.; BEVERLEY, A.H.; DOUGLAS, P.O. Amelioration of ozone induced oxidative damage in wheat plants grown under high carbon dioxide. Plant Physiology, v. 109, p ,
41 39 SCANDALIOS, J.G. The rise of ROS. Trends in Biochemical Sciences, v. 27, p , SHAO, H.B.; CHU, L.Y.; LU, Z.H.; KANG, C.M. Primary antioxidant free radical scavenging and redox signaling pathways in higher plant cells. International Journal of Biological Sciences, v. 4, n. 1, p. 8 14, SHARMA, P.; JHA, A.B.; DUBEY, R.S.; PESSARAKLI, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. Journal of Botany, v. 2012, p. 1 26, SHIGEOKA, S.; ISHIKAWA, T.; TAMOI, M.; MIYAGAWA, Y.; TAKEDA, T.; YABUTA, Y.; YOSHIMURA, K. Regulation and function of ascorbate peroxidase isoenzymes. Journal of Experimental Botany, v. 53, p , SMIRNOFF, N. The function and metabolism of ascorbic acid in plants. Annals of Botany., v. 78, p , SMIRNOFF N. Ascorbic acid: metabolism and functions of a multifaceted molecule. Current Opinion in Plant Biology, v. 3, p , SMIRNOFF, N.; CONKLIN, P.L; LOEWUS, F.A. Biosynthesis of ascorbic acid in plants: a renaissance. Annual Review of Plant Physiology and Plant Molecular Biology, v. 52, p SOSBAI. Sociedade Sul-Brasileira De Arroz Irrigado. Arroz Irrigado: Recomendações técnicas da pesquisa para o Sul do Brasil. Santa Maria, 159 p., STEIGER, H.M.; BECK, E.; BECK, R. Oxygen concentrations in isolated chloroplasts during photosynthesis. Plant Physiology, v. 60, p , SUZUKI, N.; MILLER, G.; SEJIMA, H.; HARPER, J.; MITTLER, R. Enhanced seed production under prolonged heat stress conditions in Arabidopsis thaliana plants deficient in cytosolic ascorbate peroxidase 2. Journal of Experimental Botany, v. 64, p , SZARKA A.; TOMASSKOVICS B.; BÁNHEGYI G. The ascorbate-glutathione-αtocopherol triad in abiotic stress response. International Journal of Molecular Sciences, v. 13, p , SZARKA A.; BÁNHEGYI G.; ASARD H. The Inter-Relationship of Ascorbate Transport, Metabolism and Mitochondrial, Plastidic Respiration. Antioxidants & Redox Signaling, v. 19, p , TEIXEIRA, F.K.; MENEZES-BENAVENTE, L.; MARGIS, R.; MARGIS-PINHEIRO, M. Analysis of the molecular evolutionary history of the ascorbate peroxidase gene family: Inferences from the rice genome. Journal of Molecular Evolution, v. 59, p , 2004.
42 40 TEIXEIRA, F.K.; MENEZES-BENAVENTE, L.; GALVÃO, C.V.; MARGIS, R.; MARGIS-PINHEIRO, M. Rice ascorbate peroxidase gene Family encodes functionally diverse isoforms localized in different subcellular compartments. Planta, v. 224, p , TÓTH, S. Z.; SCHANSKER, G.; GARAB, G. The physiological roles and metabolism of ascorbate in chloroplasts. Physiologia Plantarum, v. 148, p , VELJOVIC JOVANOVIC, S.D.; NOCTOR, G.; FOYER, C.H. Are leaf hydrogen peroxide concentrations commonly overestimated? The potential influence of artifactual interference by tissue phenolics and ascorbate. Plant Physiology Biochemical, v. 40, p , VRANOVÁ, E.; INZE, D.; van BREUSEGEM, F. Signal transduction during oxidative stress. Journal of Experimental Botany, v. 53 n. 372, p , WANG, J.; ZENG, Q.; ZHU, J.; LIU, G.; TANG, H. Dissimilarity of ascorbate glutathione (AsA GSH) cycle mechanism in two rice (Oryza sativa L.) cultivars under experimental free-air ozone exposure. Agriculture, Ecosystems and Environment, v. 165, p , YOSHIMURA, K.; YABUTA, Y.; ISHIKAWA, T.; SHIGEOKA, S. Expression of spinach ascorbate peroxidase isoenzymes in response to oxidative stresses. Plant Physiology, v. 123, p , YOSHIMURA, K.; NAKANE T.; KUME S.; SHIOMI Y.; MARUTA T.; et al. Transient expression analysis revealed the importance of VTC2 expression level in light/dark regulation of ascorbate biosynthesis in Arabidopsis. Bioscience, Biotechnology, and Biochemistry, v. 78, p , ZECHMANN B.; STUMPE M.; MAUCH F. Immunocytochemical determination of the subcellular distribution of ascorbate in plants. Planta, v. 233, p. 1 12, 2011.
43 41 CAPÍTULO 2 MANUSCRITO
44 Sensitivity to ascorbic acid toxicity in chloroplast-apx silenced rice leaves is enhanced by high light but is not photosynthesis dependent 42 (in submission phase) Jamyla L. S. Castro 1, Antonio G. S. Feitosa 2, Jones B. Vidal 2, Yugo Lima-Melo 1, Milton C. Lima Neto 1, Marcia Margis-Pinheiro 3 and Joaquim A. G. Silveira 1 * 1 Departamento de Bioquímica e Biologia Molecular, Universidade Federal do Ceará, Brasil 2 Departamento de Ciências do Solos, Universidade Federal do Ceará, Brasil 3 Departamento de Genética, Universidade Federal do Rio Grande do Sul, Brasil Abstract Ascorbic acid (AA) is one of the most important antioxidants in plant protection against the oxidative stress generated by abiotic stresses. In animal cells, several works have shown that high concentrations of this acid can cause toxicity and cell death. The proposed mechanism is related to a pro-oxidant action by the reduction of Fe +3 to Fe +2 and by the action of this Fe +2 in the Fenton reaction with generation of reactive oxygen species (ROS). To the best of our knowledge, this mechanism has not yet been reported to date. The objective of this work was to elucidate toxicity mechanisms of elevated concentrations of AA in plants using rice mutants with deficiency (gene silencing) in two chloroplastic APX (stromal and thylakoidal) as model. The concentrations were defined based on dose-dependent experiments from 0 to 50 mm using leaf segments in plates. In order to assess the protective effect (antioxidant) of the AA, plants and leaf segments were exposed to high light intensity (1000 µmol m -2 s -1 ) to induce photooxidative stress. AA concentrations higher than 30 mm induced oxidative stress (increase in the TBARS level) in leaf segments and this effect was enhanced by high light. In addition to oxidative damage, these AA concentrations induced an increase in membrane damage (electrolytes leakage) and reduction in photosystem II integrity (Fv/Fm). Interestingly, the 10 and 20 mm concentrations did not mitigate the negative effects caused by the light excess. The high AA concentration (50 mm) induced leaf senescence under high light, indicated
45 43 by the decrease in chlorophyll and carotenoids contents. The plants deficient in two chloroplast APX (APX7/8) displayed higher sensibility to AA toxicity, especially in combination with high light. These effects were indicated by exhibition of higher levels of TBARS, electrolyte leakage, H 2 O 2 and superoxide radical. Curiously, the transgenic plants under high AA concentrations did not exhibited differences for several photosynthetic parameters: CO 2 assimilation rate and PSII (ΦPSII, ETR, NPQ e Fv/Fm) and PSI efficiency indicators (ΦPSI, ETR e P700 + ) when compared to NT. The data set of this work shows that the excess of AA may cause toxicity in plants. The intensity of these effects is strongly enhanced by the excess of light but they are not dependent on photosynthesis. In this work, the roles of the two chloroplastic APX and/or high light on the AA toxicity still unclear, despite the deficient plants had showed increased sensibility. Apparently, the mechanism of AA toxicity in plants is similar to the proposed for animal cells. Keywords: Ascorbic acid, ascorbato peroxidase, oxidative stress, photosynthesis.
46 44 1 INTRODUCTION Plants are frequently challenged by several environmental stresses. These stressful conditions induce imbalance between scavenging and production of reactive oxygen species (ROS), especially H 2 O 2, which might cause cellular damage or act as signaling in several processes (ASADA, 2006; ŚLESAK et al., 2007). To maintain adequate H 2 O 2 homeostasis, especially under adverse conditions, plants have developed several antioxidant mechanisms represented mainly by a set of peroxidases and non-enzymatic antioxidants (MUNNÉ-BOSCH et al., 2013). In cytosol and chloroplasts, the ascorbate peroxidases (APX, EC ) are considered the most important in scavenging excess H 2 O 2 as well in maintaining suitable levels of this ROS for cellular signaling (SHIGEOKA et al., 2002). Non-enzymatic antioxidants are found in all cellular compartments and these antioxidant compounds are defined as substances that are distributed virtually in all compartments of plant cells (HALLIWELL; GUTTERIDGE, 1999). Under this definition are components with intrinsic properties such as α-tocopherol (vitamin E), β-carotene, ascorbate (vitamin C) and glutathione (GSH). In addition, are included in this class flavonoids, alkaloids, and carotenoids (APEL; HIRT, 2004; SCANDALIOS, 2005). These may act directly in the detoxification of reactive oxygen species and radicals derived or then act as reducing substrates for antioxidant enzymes (Mittler, 2002). In plants, ascorbato (ASC) is found in virtually all cellular compartments of most cell types. The ability to donate electrons in enzymatic and non-enzymatic reactions does the ASC an important ROS detoxifying compound in the aqueous phase. ASC can directly eliminate superoxide, hydroxyl radicals and singlet oxygen and also reduce hydrogen peroxide to water via ascorbate peroxidase reaction (BLOKHINA et al., 2003).The ascorbate is also involved in the regulation of cell division, in the progression from G1 to S phase of the cell cycle and cell elongation(blokhina et al., 2003). Low molecular-weight antioxidants are often described as molecules that are able to reduce oxidants without themselves having significant pro-oxidant action. However, some of these compounds can also potentially be pro-oxidants, depending on the biochemical context and presence of enzymes such as oxidases. For example, signaling roles of apoplastic polyamine oxidase and polyamine-derived
47 45 H 2 O 2 have been described in defense and programmed cell death responses to abiotic stress (MOSCHOU et al., 2008). Despite the large antioxidant efficiency, the paradoxically ascorbate also acts as a pro-oxidant in vitro. Solutions of ascorbate and iron are used for decades to induce oxidative modifications of lipids, proteins and DNA. Thus, ascorbic acid can act as a catalyst in the Fenton reaction, promoting the reduction of ferric ions into ferrous ions. Therefore, the ascorbic acid can act both as an antioxidant and as a pro-oxidant, depending on conditions (DENISOV; AFANAS EV, 2005). In rice plants, a small gene family encodes APX isoforms which are targeted to distinct subcellular compartments: mitochondria (miapx), cytosol (capx), peroxisome/glyoxysomes (mapx), thylakoid membranes (tapx) and stroma (sapx) in chloroplasts (TEIXEIRA et al., 2006). APX found in organelles scavenges H 2 O 2 produced within the organelles, whereas cytosolic APX eliminates H 2 O 2 produced in the cytosol, apoplast or that diffused from organelles (MITTLER; ZILINSKAS, 1992). The chloroplastic and cytosolic APX isoforms are specific for ASC as electron donor while the cytosolic isoenzymes are less sensitive to depletion of ASC than the chloroplastic isoenzymes, including stromal and thylakoid bound enzymes (SHARMA; DUBEY, 2004; ISHIKAWA et al., 1998). Decreases in ASC levels and inactivation of APXs in chloroplasts have been considered to be limiting factors in the efficiency of the water water cycle and photo-oxidative protection under stress conditions (ISHIKAWA; SHIGEOKA et al., 2008). In this study, we tested the hypothesis that the ascorbate external supply would favor the water-water cycle, increasing thylakoid and stroma ascorbate peroxidase activity, minimizing oxidative damage and favoring photosynthesis, being the APX7/8 mutants more favored. Our data reveal that mutant plants deficient in chloroplastic APXs are more sensible to the toxicity of ascorbic acid, mainly under high light, than to plants non-transformed. However photosynthetic parameters were not differently affected. The physiological significance of the deficiency of both chlapxs isoforms and high light on the ascorbic acid toxicity is discussed.
48 46 2 MATERIALS AND METHODS 2.1 Constructing the plant vector, plant transformation and growth conditions A chimeric gene producing mrna with a hairpin structure (hprna) was constructed based on the sequence of the OsAPX7 (LOC_Os04g35520) and OsAPX8 (LOC_Os02g34810) genes. The following primer pairs were used to amplify a 238-bp RNAiOsAPX7/8 sequence: 5 -CACCCTCTAAAGCTTGTCCAAC-3 and 5 - TCAAGACCCATCCTGTAA-3. PCR products were cloned into the Gateway vector panda, in which hairpin RNA is driven by the maize ubiquitin promoter and an intron placed upstream of the inverted repeats (MIKI and SHIMAMOTO, 2004). Agrobacterium tumefaciens-mediated transformation was performed as described previously Upadhyaya et al., The rice plants knockdowns for both OsAPX7 and OsAPX8 were obtained by A. tumefaciens-mediated transformation of rice embryogenic calli (Oryza sativa L. ssp. japonica cv. Nipponbare) induced from seeds and cultivated in NB medium (UPADHYAYA et al., 2002) at 28 C in the dark. Rice seeds from the T2 generation of non-transformed (NT) and transgenic lines, in which the chloroplastic OsAPX7 and OsAPX8 genes (Apx7/8s) had been silenced, were germinated in MS medium (Sigma Aldrich) supplemented with hygromycin under controlled conditions (150 µmol m 2 s 1 photosynthetic photon flux density (PPFD), 25 C, 80% relative humidity and a 12 h photoperiod). Two weeks after being sown, the rice seedlings were transferred to 3 L plastic pots filled with half-strength Hoagland-Arnon s nutritive solution. The ph was adjusted to 6.0±0.5 every two days, and the nutrient solution was changed weekly. The seedlings were previously grown for 45 days in a greenhouse under natural conditions and with the following conditions: day/night mean temperature of 29/24 ºC, mean relative humidity of 68%, and a photoperiod of 12 h. The light intensity inside the greenhouse varied as for a typical day from 6:00 a.m. to 6:00 p.m., reaching an average maximum PPFD of 820 µmol m -2 s -1 at noon.
49 Ascorbic acid and high light supplying in leaf segments Forty-five-day-old transformed and non-transformed (NT) plants were grown as described previously. The plants were previously acclimated in a growth chamber at 27±2 C/24±2 C (day/night) and 70±10% humidity, with a PPFD of 500 µmol m -2 s -1 and a 12 h photoperiod. For the assay in plates, leaf segments (10 cm) were immersed in a 10 mm HEPES buffer, ph 6.5, containing CaCl mm, 0.05% Triton X-100 (v/v) in the presence of different ascorbic acid concentrations for 24 h. The plates were exposed to dark and high light (1000 µmol m -2 s -1 ) conditions for 24 h. The leaf segments in the presence of the same buffer containing CaCl mm and 0.01% Triton X-100 (v/v) were used as a control. After treatments, the leaf segments were immersed in CaCl mm solution for a minute in order to eliminate the superficial AA. Afterwards, they were immersed in liquid N 2 and rapidly stored in freezer at -85 C. 2.3 Ascorbic acid and high light supplying to entire plants Forty-five-day-old plants previously grown in greenhouse were transferred to a growth chamber as previously described and then acclimated for 24 h. Plants were exposed to ascorbic acid supplying under two light regimes: 500 µmol m -2 s -1 (control) and 1000 µmol m -2 s -1 (high light). The ascorbic acid (10 mm and 50 mm) was dissolved in 10 mm HEPES buffer, ph 6.5, containing 1.5 mm CaCl 2 and 0.05% Triton X-100. These solutions were sprayed in excess on the shoot until a complete wetting was achieved. This procedure was repeated twice per day (at 6:00 a.m. and 6:00 p.m.) and AA treatment remained for 24 h. Treated plants with 50 mm AA were exposed to high light or 500 µmol m -2 s -1 for 6h and 12h, respectively, whereas the 10 mm AA-treated and single high light-treated plants were exposed to 1000 µmol m -2 s - 1 for 12h. The control was sprayed with the same buffer solution in absence of AA and a PPFD of 500 µmol m -2 s -1. After the in vivo photosynthesis measurements (gas exchange and photochemical activity), the leaf samples were immediately harvested, immersed in liquid N 2 and stored in freezer at -85 C.
50 2.4 Gas exchange, chlorophyll a fluorescence and P700 absorption measurements 48 The net CO 2 assimilation rate (P N ) and stomatal conductance (gs) were measured using a portable infrared gas analyzer (IRGA) system equipped with an LED source and leaf chamber (IRGA LI-6400XT, LI-COR, Lincoln, NE, USA). The IRGA chamber had the following internal parameters: 1000 µmol m -2 s -1 PPFD, 1.0±0.2 kpa VPD, 38 Pa CO 2 and 28 ºC. The actinic light utilized for the measurement of gas exchange was 1000 µmol m -2 s -1 of PPFD. A Dual-PAM-100 (Heinz Walz, Germany) was used for the simultaneous measurement of PSII and PSI photosynthetic parameters, based on chlorophyll a fluorescence and P700 oxidation signal (KLÜGHAMMER and SCHREIBER, 2008). The leaf segments and attached leaves were kept in darkness for 20 min prior to measurements. The estimated electron transport rate of PSI and PSII (ETRI and ETRII, respectively) were calculated as ETR = (ΔF/Fm PPFD ). To evaluate the ETR, 0.5 was used as the fraction of excitation energy distributed to PSII, and 0.84 was used as the fraction of incoming light absorbed by the leaves. The relative cyclic electron flow (CEF) was estimated by the ETRI/ETRII ratios according to Yamori et al. (2011). The ratio ETR/P N was calculated to estimate the use of electrons in other processes not related to the photosynthetic CO 2 assimilation rate (RIBEIRO et al., 2009). 2.5 Electrolyte leakage and lipid peroxidation Membrane damage was measured by electrolyte leakage as described previously by Blum and Ebercon (1981). Twenty leaf discs (1.0 cm diameter) were placed in test tubes containing 20 ml of deionized water. The flasks were incubated in a shaking water bath (25 C) for 12 h, and the electrical conductivity in the medium (L1) was measured. The discs were then boiled (95 C) for 60 min and cooled to 25 C, and the electrical conductivity (L2) was measured again. The relative membrane damage (MD) was estimated by MD=L1/L The lipid peroxidation was measured based on the formation of thiobarbituric acid reactive substances (TBARS) in accordance with Cakmak and Horst (1991). The concentration of TBARS was calculated using its absorption coefficient (155 mm -1 cm -1 ), and the results are expressed as nmol MDA-TBA g FW -1.
51 H 2 O 2 content determination An Amplex Red Hydrogen Peroxide/Peroxidase Assay Kit (Invitrogen, Carlsbad, CA, USA) was used to measure H 2 O 2 production (ZHOU et al. 1997). For H 2 O 2 extraction, 150 mg of fresh leaves were ground in liquid N 2, and 1 ml of phosphate buffer (100 mm, ph 7.5) was added to the frozen tissue. After centrifugation, 100 μl of the supernatant was incubated with 0.2 U ml -1 horseradish peroxidase and 100 μm Amplex Red reagent (10-acetyl-3,7-dihydrophenoxazine) at room temperature for 30 min under dark conditions. The absorbance was quantified spectrophotometrically using a wavelength of 560 nm, and the H 2 O 2 content was expressed as μmol H 2 O 2 g FW -1 calculated from a H 2 O 2 stand curve according the Kit manufacturer s instructions. 2.7 Determination of ascorbate and glutathione Ascorbate content was assayed according to Kampfenkel et al. (1995). The assay is based on the reduction of Fe 3+ to Fe 2+ by reduced ascorbate (ASC) and the spectrophotometric detection of Fe 2+ complexed with 2,2 bipirydyl, giving a pink color. The leaf samples (0.1 g FW) were homogenized in cold 6% trichloroacetic acid (TCA) (w/v), and the homogenate was centrifuged at 12,000g (4 ºC) for 20 min and the supernatant was immediately used for reduced ascorbate (ASC) determination. The total ascorbate (ASC + DHA) was measured after a complete reduction of the oxidized fraction by reaction of the samples with dithiothreitol (DTT) in excess (10 mm). Subsequently, the remaining DTT was removed by 0.5% (m/v) N- ethylmaleimide and the DHA was calculated as the difference between total ascorbate and ASC. The absorbance of the pink complex formed was read at 525 nm and the ascorbate concentrations were calculated from a standard curve obtained with ascorbic acid (Sigma-Aldrich). The glutathione (GSH) was measured by the glutathione redutase (GR)- dependent reduction of 5,5 -dithiobis (2-nitro-benzoic acid), DTNB, according to the Griffith (1980) method and detailed protocol described in Queval and Noctor (2007). The GSH and GSSG content were expressed as nmol g FW -1 and calculated from stand curves of GSH and GSSG, respectively.
52 Pigment determination The total chlorophyll, chlorophyll a and b and carotenoid contents were determined after extraction in ethanol and were measured spectrophotometrically at 665 and 649 nm. The amount of pigment was calculated using the equations proposed by Lichtenthaler and Wellburn (1983). 2.9 Enzymatic activity assays For the preparation of enzymatic extracts, fresh leaf samples were ground to a fine powder in the presence of liquid N 2 using a mortar and pestle and extracted in ice-cold (4 C) 100 mm K-phosphate buffer (ph 7.0) containing 1 mm EDTA and 1 mm ascorbic acid. The homogenate was centrifuged at 15,000 g for 15 min, and the obtained supernatant was used for enzymatic activity ascorbate peroxidase (APX; EC ). APX activity was measured by following ascorbate oxidation by the decrease in absorbance at 290 nm (NAKANO; ASADA 1981) with minor modifications. APX activity was assayed in a reaction mixture containing 0.5 mm ascorbate dissolved in 50 mm K-phosphate buffer (ph 6.0) and enzyme extract. The reaction started by adding 30 mm H 2 O 2. Enzyme activity was measured by following the decrease in absorbance at 290 nm (25 C) over 300 s. APX activity is expressed as μmol ASC g FW -1 min Statistical analyses and experimental design All experiments were conducted in a factorial design. In the segments experiments the first dose experiment was conducted in a factorial design with 1 genotypes, 2 light regimes and 6 AA concentrations; the second dose experiment was conducted in a factorial design with 2 genotypes, 1 light regimes and 6 AA concentrations; the third experiment was conducted in a factorial design with 2 genotypes, 2 light regimes and 2 AA concentrations. In plants were conducted two experiments, the first was in a factorial design with 2 genotypes, 2 light regimes and 2 AA concentrations and the second experiments was in a factorial design with 2 genotypes, 2 light regimes and 1 AA concentrations, the control was the same (positive control). An individual pot containing two plants or an
53 51 individual Petri plate containing 20 leaf segments represents each replicate. All measurements were performed with at least four replicates from independent pots and plates. The data were analyzed using ANOVA, and the means were compared using Tukey s test at a confidence level of RESULTS 3.1 Phenotypic characterization, OsAPX7 and OsAPX8 transcript levels and APX activity In this study we utilized the second generation (T2) of chloroplast APX doubly silenced plants in both APX7 (stroma) and APX8 (thylakoid). A complete molecular characterization of these transgenic plants at T1 generation including characteristics of each APX gene and RNA silencing technique was previously described (CAVERZAN et al., 2014). The mutant APX7/8s-2 was selected for this study after a screening of a population of ten silenced mutants by the criterion of being a representative line. The APX7/8 mutants did not exhibit phenotype during all their developmental period. The Figure S1 shows the comparative habitus of APX7/8 and NT 45-day-old rice plants grown under normal conditions. The silencing reduced the transcript amounts in both APX7 and APX8 by 60% whereas the expression of the other APX genes did not change in control condition compared with NT (Figure S2). The APX activity in silenced plant leaves decreased by 40% (Figure S3). 3.2 High light enhanced exogenous ascorbic acid toxicity and APX7/8 mutants were more sensitive than NT utilizing leaf segments The dose-response experiment with NT leaf segments in plates in response to exogenous 0 50 mm ascorbic acid (AA) concentration was performed to evaluate the protective and toxic effects induced by AA in two different light regimes: low light (LL) and high light (HL) for 24 h. The obtained results clearly showed that alone HL caused adverse effects on membrane damage (electrolyte leakage), potential quantum yield of PSII (Fv/Fm) and actual quantum yield of PSII being the leaf segments less affected in low light conditions, regardless of ascorbic acid concentrations (Figure 1A-C). From 30 mm to 50 mm AA occurred a strong AA
54 52 toxicity, which was intensely potentialized by HL, irrespective of AA concentrations. The visual symptoms of AA toxicity on leaf segments are showed in the Figure S3. When the APX7/8 mutants were compared with NT under darkness, it was observed that the effects of the exogenous concentrations were more toxic on APX7/8 leaf segments (indicated by membrane damage - MD). These differences in toxicity were apparently dependent of ascorbic acid concentrations (Figure 2A). APX activity was lower in the mutant segments (by 40%) in absence of ascorbic acid and this difference was maintained until 30 mm. From this concentration untill 50 mm, the APX activity in the mutants significantly increased, reaching levels similar to those presented in NT leaf segments (Figure 2B). In order to evaluate the capacity of accumulation of AA (at ph 6.5) and some derivatives forms in leaf segments after 24 h in the dark, the reduced (ASC) and total (ASC + DHA) ascorbate contents were measured. Both ascorbic acid forms were accumulated more intensely in the NT than in APX7/8 mutants from 10 mm to 50 mm and ASC + DHA forms accumulated intensely in leaf tissues as the AA concentration increased; from 2.61 to µmol ASC g -1 FW in the NT tissues (an increase of 4.4-fold, in an almost linear accumulation). This accumulation induced high values of ASC redox state (ASC/ASC + DHA), by approximately 81% and 87% in the NT and APX 7/8 supplied with 50 mm AA, respectively (Figure 2C-D). In summary, the rice leaf segments were an adequate model to study effects of exogenous AA as they accumulated both AA forms in a dose-dependent way. In addition, high reduced ascorbate levels were capable to estimulate APX activity in the mutants. Besides, high exogenous AA concentrations induced cellular and photosynthetic (PSII) damages. Finally, that model also was able to show negative effects of HL alone or in combination with AA, in both studied plants. 3.3 Exogenous AA toxicity was strongly enhanced by HL and APX7/8 mutants suffered higher oxidative stress compared with NT plants In order to evaluate and compare the effects of high exogenous AA concentration in presence of dark and HL, an experiment with both APX7/8 and NT leaf segments in absence and presence of 50 mm AA was performed. Alone HL significantly increased the membrane damage in both genotypes, compared with dark condition, but the APX7/8 mutants were slightly more affected than NT. High
55 53 exogenous AA concentrations induced prominent increase in MD under both light regimes but HL + AA induced strong and higher effect on the APX7/8 compared with NT. These results were reasonably well correlated with lipid peroxidation (TBARS levels) - (Figure 3A-B), indicating that high exogenous AA, especially under HL, was capable to induce oxidative stress in rice leaf segments. These effects were more pronounced on APX7/8 plants, showing that this mutant was more sensitivity to AA toxicity. Confirming previous results, the Fv/Fm was similarly decreased in both genotypes under the two studied light regimes, indicating that the target of the oxidative stress was not caused from PSII disturbances. Corroborating the lipid peroxidation results, the H 2 O 2 content was strongly increased by alone HL and especially by combination of high AA + HL, in both genotypes despite the APX7/8 mutants have exhibited values higher than NT (Figure 3C-D). The oxidative stress caused by HL and mainly by HL combined with high AA, occurred in parallel with degradation of chlorophylls and carotenoids. Once again, the APX7/8 mutants were more sensitive to AA toxicity in terms of photosynthetic pigments stability (Figure 4A- B). These quantitative results were corroborated by visual symptoms of senescence observed on the leaf segments caused by exogenous high AA concentration, mainly in presence of HL (Figure 5). The chlorosis in AA-treated leaf segments became visible from 30 mm to 50 mm in the NT leaf segments and the pigments degradation was proportional to AA concentration (Figure S3). Altogether, these results strongly suggest that high concentration of exogenous AA is capable to induce oxidative stress, especially in presence of HL. They also indicate that these effects apparently were not associated with PSII damage, despite the photosynthetic pigments had been strongly affected. Moreover, these results reinforce that APX7/8 mutants were more sensitive to AA toxicity than NT in terms of cellular damage and oxidative stress under HL. 3.4 High exogenous AA in presence of HL induced higher oxidative stress in APX7/8 plants but they presented similar oxidation-reduction states of ASC and GSH The whole plants (45-day-old) were exposed to sole HL and in combination with a moderate (10 mm) exogenous AA concentration to investigate if the leaf segments were suitable to mimic the plants responses and also if that AA
56 54 concentration was capable to mitigate the photo-oxidative effects caused by HL stress. Moreover, this experiment was carried out to elucidate the extent of oxidative stress and changes in reduction-oxidation states of ASC and GSH in attached leaves. The supplying of exogenous AA 10 mm did not alter the isolate effects of HL in both genotypes in all analyzed parameters, compared with control (Table 1). The membrane damage and lipid peroxidation increased similarly in HL and HL + AA 10 mm, indicating that AA did not exhibited protection against HL stress nor toxic effect on both genotypes. In opposition, sole HL clearly induced significant effects on these two parameters associated with oxidative stress. Interestingly, single HL and HL + 10 mm AA induced decrease in ASC content but ASC + DHA did not change inducing significant reduction in the ASC redox state. Clearly, these results were not dependent on AA supplied for leaves, indicating a consumption of ASC to cope oxidative effects generated by HL stress. This effect was not mitigated by the supplying of exogenous AA 10 mm, reinforcing that this AA concentration was not important for both rice genotypes exposed to HL stress. The GSH redox state also decreased by effect of HL as the GSSG content increased and the GSH content remained unchangeable in both genotypes, compared with control. Similarly to that noticed for the ASC redox state, 10 mm AA supplying did not contribute to mitigate nor to potentiate the adverse effects caused by HL stress on the GSH pool. Concerning the supplying of a very high exogenous AA concentration (50 mm) alone and in combination with HL, the obtained results corroborated the previous data noticed for leaf segments. The 50 mm AA caused oxidative stress indicated by increase in lipid peroxidation and membrane damage. When that AA dose was combined with HL, the dangerous effects were strongly increased the membrane damage and lipid peroxidation increased by 2- and 2.5-fold, respectively as an average of the two genotypes (Table 2). As it was noted in the previous results utilizing leaf segments, rice plants sprayed with 50 mm in presence of HL, suffered prominent oxidative stress indicated by strong increase in membrane damage and lipid peroxidation, compared with control. The ASC redox state decreased similarly to control as these plants accumulated immense amount of ASC in their leaves, in both genotypes. Interestingly, despite the large oxidative stress in these plants induced by AA toxicity, the GSH redox state decreased slightly and similarly in both genotypes. Differently of lipid peroxidation and membrane damage, the oxidation-reduction of GSH and ASC changed similarly between APX7/8 mutants and NT plants exposed to
57 55 HL and/or HL + AA. In summary, a moderate concentration of exogenous AA (10 mm) was not capable to induce oxidative stress but alone HL was able to alter the oxidation-reduction of ASC and GSH in both studied genotypes. In addition, that AA concentration also was not suitable to protect the plants against oxidative stress generated by HL. Exogenous AA 50 mm in presence of HL caused strong toxicity by increase of oxidative stress but did not alter the oxidation-reduction states of GSH and ASC. The APX7/8 mutants were more sensitive to oxidative stress induced by high AA concentration, especially combined with HL, compared with NT plants. 3.5 Exogenous AA induces strong impairment in photochemical activity and CO 2 assimilation under HL but APX7/8 mutant plants were similarly affected In order to investigate if the oxidative stress induced by exogenous AA under HL was initiated by an unbalance between the photochemical and CO 2 assimilation phases in chloroplasts, an experiment using intact 45-day-old plants, was performed. This experiment was carried out with a moderate (10 mm) and a high (50 mm) AA concentrations to evaluate if under these conditions the APX7/8 mutant deficient in both chloroplast APXs would be more sensitivity in terms of its photosynthetic activity. First, the results evidenced that alone 10 mm AA did not alter any of the analyzed photosynthetic parameters (data not shown), that is, the negative effects were caused only by HL, in both genotypes. The single HL caused significant impairment in both phases of the photosynthesis and these effects were distinct between NT and APX7/8 mutants in the PSII and PSI activities but not on the CO 2 assimilation (P N ) and stomatal conductance (gs) (Table 3). HL and HL + 10 mm AA decreased similarly these parameters by 50% in both genotypes compared with control. Alone HL decreased all photochemical parameters but the two genotypes exhibited different responses. AA 10 mm induced some effects on these photochemical parameters and these responses were different between the two genotypes. The potential quantum yield of PSII (Fv/Fm) and non-photochemical quenching (NPQ) were similarly decreased by HL and HL + AA in both genotypes and these responses indicate low capacity of heat dissipation and photoinhibition. The actual quantum yield of PSII (ΦPSII) and electron transport rate at PSII level (ETRII) also were strongly decreased by HL and HL + AA but, interestingly, the APX7/8 mutants were lesser affected than NT plants (Table 3). The alternative sinks
58 56 for photosynthetic electrons driven to CO 2 assimilation (ETRII/P N ) also decreased by effect of HL but the mutants exhibited values higher than NT plants. Interestingly, 10 mm AA induced increases in that parameter in both genotypes. Concerning the photosystem activity, the P700 + oxidation state decreased by effect of HL or HL + AA in both genotypes. The ΦPSI and ETRI decreased by effect of HL and also under HL + AA and these effect was genotype-dependent, that is, the mutants exhibited higher ΦPSI and ETRI compared with NT. NT and APX7/8 were exposed to 50 mm AA and 50 mm + HL to evaluate the single and combined effects of AA on the photosynthesis. The gas exchange parameters (P N and gs) were intensely decreased by AA and these effects were strongly potentiated by HL, similarly in both genotypes (Table 4). The photochemical parameters exhibited similar trend compared with gas exchange. The immense decrease in Fv/Fm indicates large photoinhibition in 50 mm + AA but unexpectedly the NPQ decreased prominently in both genotypes. ΦPSII and ETRII decreased significantly in 50 mm AA and more strongly in presence of both AA and HL, similarly in both genotypes. In summary, the obtained results utilizing entire plant as model corroborated the previous data obtained from leaf segments. These results reinforce that a moderate 10 mm AA concentration is non-toxic but is not capable to protect the photosynthesis against the photo-damage caused by HL stress. In opposition, single 50 mm AA is able to cause strong impairment in photosynthesis but these effects are remarkably potentiated by HL similarly in both genotypes. The deficiency of both chloroplast APXs triggered some changes in photochemical activity as in presence of single HL as well as under HL + 10 mm AA. The mutants displayed higher ETRI and ETRII associated with higher ETR/P N ratios, indicating that HL induced higher photosynthetic electron transport in thylakoid and that 10 mm AA was able to stimulate this flux in APX7/8 mutants. The data suggest that these additional electrons were driven to alternative sinks considering the CO 2 assimilation as the major electron photosynthetic sink. 4 DISCUSSION Ascorbate (ASC) is a major defensive component of plants against free radicals, H 2 O 2, and oxidative stress (NOCTOR; FOYER, 1998). In general, ascorbate has a role in cell protection. It chemically reacts with a wide range of reactive oxygen
59 57 species (ROS) and acts as a cofactor of the APX, which detoxify H 2 O 2 in plant cells (HOREMANS et al. 2000). A few studies explore the harmful effects of excess of this molecule in plant cells and, to the best of our knowledge, there are no studies dealing with this subject in whole plants or leaf segments. In this study, the exposure of plants to exogenous ascorbate induced oxidative stress, even in the absence of light, a major factor to ROS production. The results show that rice plants deficient in both chloroplastic APX were more susceptible to damage caused by excess of exogenous ascorbic acid (AA). Remarkable results were obtained in experimental dose-dependent with AA using leaf segments in Petri plates, where the contrasting deleterious effect of high concentrations of exogenous AA was evident in leaf tissue. It has been shown that in leaf segments exposed to high light with a high dose of AA occurred severe depigmentation in the leaf tissue. These results go against what is generally reported in the literature, in which the protective role of exogenous application of AA in plants subjected to various stresses is widely studied. In addition, plants deficient in the chloroplastic APX activity exposed to high concentrations of this molecule proved to be even more susceptible to this damage, when the opposite effect was expected. Confirming this result, segments of rice leaves also showed high damage cellular integrity, degradation of photosynthesis-related pigments (chlorophylls and carotenoids), photoinhibition (decrease in Fv/Fm and ΦPSII values) and evidence of oxidative stress (increase in TBARS, concentration of H 2 O 2 and O - 2 production) in the dark, being these effects enhanced by high light. In this work, it was shown that leaf segments of plants deficient in both isoforms of chloroplastic APX exhibited greater damage than in NT segments. One possible explanation is the greater ASC accumulation cause by lower APX activity in chloroplasts, but this accumulation was higher in NT plants at higher concentrations of exogenous AA (20-50 mm) (Figure 3). Furthermore, the total APX activity was higher only in the NT plants in concentrations between 0 and 30 mm. It is important to note that rice plants have a total of eight APX isoforms distributed in chloroplasts, cytosol, mitochondrion and peroxisomes (TEIXEIRA et al., 2006). Therefore, the similarity in the total APX activities between the mutant and NT plants in the concentrations of 40 and 50 mm could be a compensatory response of the nonchloroplastic isoforms as a result of increased oxidative damage. Regarding the unexpected result of lower ASC accumulation in plants deficient in APX, we believe
60 58 that under higher oxidative stress conditions, which was potentiated by the HL condition (evidenced by the higher values of MD, TBARS, H 2 O 2 and the NBT assay), ASC has been degraded by non-regenerative alternative pathways of this molecule, such as non-oxidative routes (SIMPSON; ORTWERTH, 2000) or by the irreversible degradation of DHA form by hydrolysis or oxidation (DEUTSCH, 2000; PARSONS; FRY, 2012). Ribeiro et al. (2007) reported that the activity of chloroplast H + -ATPase CF 0 F 1 was inhibited by Fe 2+ / H 2 O 2 /ascorbato system using isolated chloroplasts of spinach. In this study, the authors affirm that the production of ascorbyl radicals in chloroplast caused this inhibition and that these radicals were formed by the PSI activity during photosynthesis. Sétif et al. (2004) demonstrated in experiments of paramagnetic electronic resonance that a proton/deuteron of PSI is strongly linked to the ascorbyl radical. Probably in our study, the uptake of ASC and H 2 O 2 inside the chloroplast may have favored the formation of this radical, as well as hydroxyl radicals from Fenton-type reactions, mainly in plants deficient in APX 7 and 8. In normal conditions, the plants can quickly neutralize the O - 2 and H 2 O 2 by the waterwater cycle, avoiding the formation of OH (SHARMA et al., 2012). Here, it was observed that the plants exposed to high concentrations of exogenous AA possibly were not able to cope with the generation of hydroxyl radicals inside the chloroplast, which may have caused strong damage to the photosynthetic apparatus. In presence of catalytic metal ions, the ASC may have pro-oxidant effects (BUETTNER; JURKIEWICZ, 1996; FREI; LAWSON, 1998; HALLIWELL, 1999). Since it is an excellent reducing agent, the ASC is capable of reducing iron in the ferric state (Fe + 3 ) to ferrous state (Fe + 2 ), while it is oxidized to ascorbate radical (AscH - + Fe 3+ Asc - + Fe 2+ ) (DU et al., 2012). This Fe 2+ may react promptly with O 2, reducing to superoxide radical. The chloroplast, since it is the main storage site of cell elementary Fe and also the major site where the Fe is incorporated (SALOMÉ, et al., 2013) may be susceptible to reduction reactions Fe 3+ by ASC forming Fe 2+, which in - turn is able to act in reduction reactions with elementary O 2 and H 2 O 2, forming O 2 and hydroxyl radicals, respectively, causing oxidative damage to cell. OH interacts with all biological molecules and causes subsequent cell damage such as lipid peroxidation, protein damage and destruction of membranes (FOYER et al. 1997). Once the chloroplasts, as well as the whole cell, do not have enzymatic mechanism
61 59 to eliminate OH, its overproduction can lead to destruction of proteins involved with CO 2 assimilation and eventual cell death (PINTO et al., 2003). One of the major ways of ascorbate synthesis is linked to the electron transport chain in mitochondria (metc), involved in cellular respiration. In this metabolic pathway, the last step is performed by a membrane protein, the L- galactono-γ-lactonedehydrogenase (GLDH), utilizing L-galactono-γ-lactone as substrate, producing ASC (OSTERGAARD et al., 1997). In addition to this function, the GLDH also participates in this pathway as an alternative electron donor to cytochrome c (BARTOLI et al., 2000). With an increase in intercellular ASC by application of exogenous AA in leaf segments, it is possible that this compound has negatively regulated this synthesis stage by decreasing the activity of GLDH by feedback. This inhibitory effect has been observed in embryonic axes of bean seedlings supplied with exogenous AA (PALLANCA; SMIRNOFF, 2000). It is well-known that the excess of electrons in the mcte may cause ROS production (VANLERBERGHE, 2013). Thus, it is possible that there has been an inhibition of the GLDH activity in which consequently has impaired transportation in metc, causing ROS production and explaining the results found in our work. Ours results show that the APX7/8 whole plants under optimal growth conditions did not resulted in differences on the plant length, toxicity parameters (membrane damage and lipid peroxidation) and on the pool/redox state of ASC, in comparison to NT whole plants. The similarity between the NT and APX7/8 plants in the results remained unchanged in the HL and HL + 10 mm AA treatments, those being higher in relation to the growth conditions. The sole exposure of the plants to 50 mm AA was able to damage the photosynthesis, this effect being enhanced by HL in both genotypes. These responses are probably due to production of hydroxyl and ascorbyl radicals by the excess of ASC in chloroplasts (RIBEIRO et al., 2007). It is known that the activity of the PSI is capable of produce ascorbyl radicals and that hydroxyl radicals are produced by reactions catalyzed by Fe + 2 (SÉTIF et al., 2004), which would be found in high concentrations due to the reduction reactions carried by the ascorbate excess. Taken together, these results reinforce the argument that exogenous AA did not displayed a protective role in HL, although there was no significant decrease in the values to characterize it as a synergism between exogenous AA and high luminosity treatment. The results also supports that the responses obtained in the experiments with leaf segments are partially reproducible
62 60 in intact plants, consequently showing that this is good model for studies of isolated effects on leafs. This study shows for the first time that the application of exogenous AA is capable of causing damage to rice plants under dark and high light conditions. The supply of ascorbate does not mitigates the deleterious effects of high light stress and, in excess, caused unexpected damage. Rice plants deficient in the chloroplastic APX isoforms are prone to that kind of damage. The mechanisms by which that damage was caused remain to be elucidated. Here, we propose that reduction reactions catalyzed by metallic ions who were reduced by ascorbate, contributed to the generation of free radicals (mainly hydroxyl and ascorbyl) in excess, these being the direct cause of oxidative stress. In conclusion, our results go against what is usually found in the literature, where the ascorbate is usually studied by its antioxidant activity. ACKNOWLEDGEMENTS The authors are grateful to Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) Proc for financial support. To Professor Rogério Margis for the chlapx gene construct J.A.G.S and M.M.P are CNPq honored researchers. REFERENCES AMAKO K.; CHEN G.X.; ASADA K. Separate assays specific for ascorbate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase in plants. Plant Cell Physiology, v. 35, p , APEL, K.; HIRT, H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, v. 55, p , ASADA K. Ascorbate peroxidase a hydrogen peroxidescavenging enzyme in plants. Physiologia Plantarum, v. 85, p , ASADA, K. Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant physiology, v. 141, p , BARTOLI, C.G.; PASTORI, G.M.; FOYER, C.H. Ascorbate biosynthesis in mitochondria is linked to the electron transport chain between complexes III and IV. Plant Physiology, v. 123, p , 2000
63 61 BLOKHINA, O.; VIROLAINEN E.; FAGERSTEDT, K.V. Antioxidants, oxidative damage and oxygen deprivation stress: a review. Annals of Botany, v. 91, p , 2003 BLUM A.; EBERCON A. Cell membrane stability as a measure of drought and heat tolerance in wheat. Crop Science, v. 21, p , BRADFORD M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, v. 722, p , BUETTNER, G.R.; JURKIEWICZ, B.A. Catalytic metals, ascorbate and free radicals: combinations to avoid. Radiation Research, v. 145, p , CAKMAK I.; HORST W.J. Effect of aluminum on lipid-peroxidation, superoxidedismutase, catalase and peroxidase-activities in root-tips of soybean (Glycine max). Physiologia Plantarum, v. 83, p , CAVERZAN, A.; BONIFACIO, A.; CARVALHO, F.E.L.; ANDRADE, C.M.B.; PASSAIA, G.; SCHÜNEMANN, M.; MARASCHIN, F.S.; MARTINS, M.O.; TEIXEIRA, F.K.; RAUBER, R.; MARGIS, R.; SILVEIRA, J.A.G.; MARGIS-PINHEIRO, M. The knockdown of chloroplastic ascorbate peroxidases reveals its regulatory role in the photosynthesis and protection under photo-oxidative stress in rice. Plant Science, v. 214, p , CUELLO J.; QUILES M.J. Fractionation of thylakoid membranes into grana and stroma thylakoids. In Photosynthesis Research Protocols (ed. R. Carpentier). Methods in Molecular Biology. Humana Press, NJ, USA, p 1 9, DENISOV, E.T.; AFANAS EV, I.B. Oxidation and antioxidants in organic chemistry and biology. Boca Raton: CRC Taylor & Francis Group, p. DEUTSCH, J.C. Dehydroascorbic acid. Journal of Chromatography A, v. 881, p , DU, J.; CULLEN, J.J; BUETTNER, G.R. Ascorbic acid: chemistry, biology and the treatment of cancer. Biochimica et Biophysica Acta, v. 1826, p , 2012 FLEXAS J.; RIBAS-CARBÓ M.; DIAZ-ESPEJO A.; GALMÉS J.; MEDRANO H. Mesophyll conductance to CO 2 : current knowledge and future prospects. Plant, Cell & Environment, v. 31, p , FOYER C.H.; LOPEZ-DELGADO H.; DAT J.F.; SCOTT I.M. Hydrogen peroxide and glutathione associated mechanisms of acclamatory stress tolerance and signaling. Physiologia Plantarum, v. 100, p , FREI, B.; LAWSON, S. Vitamin C and cancer revisited, Proceedings of the National Academy of Sciences of United States of America, v. 105, p , 1998.
64 62 GRIFFTH O.W. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine. Analytical Biochemistry, v. 106, p , HALLIWELL, B. Vitamin C: poison, prophylactic or panacea? Trends in Biochemical Sciences, v. 24, p , HALLIWELL, B.; GUTTERIDGE, J.M.C. Free Radicals in Biology and Medicine, 4th ed. Claredon Press: Oxford, p. HOREMANS, N.; FOYER, C.H.; ASARD, H. Transport and action of ascorbate at the plant plasma membrane. Trends in Plant Science, v. 5, p , ISHIKAWA, T.; YOSHIMURA, K.; SAKAI, K.; TAMOI, M.; TAKEDA, T.; SHIGEOKA, S. Molecular characterization and physiological role of a glyoxysome-bound ascorbate peroxidase from spinach. Plant and Cell Physiology, v. 39, p , ISHIKAWA, T.; SHIGEOKA, S. Recent advances in ascorbate biosynthesis and thephysiological significance of ascorbate peroxidase in photosynthesizing organisms. Bioscience, Biotechnology, and Biochemistry, v. 72, p , KAMPFENKEL K.; VANMONTAGU M.; INZE D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue. Analytical Biochemistry, v. 225, p , KLÜGHAMMER, C.; SCHREIBER, U (2008) PAM Application Notes (PAN). 1, at LICHTENTHALER H.K.; WELLBURN A.R. Determination of total carotenoids andchlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, v. 11, p , MIKI D.; SHIMAMOTO K. Simple RNAi vectors for stable and transient suppressionof gene function in rice. Plant Cell Physiology, v. 45, p , MITTLER R.; ZILINSKAS, B.A. Molecular cloning and characterization of a gene encoding pea cytosolic ascorbate peroxidase. Journal of Biological Chemistry, v. 267, p , MITTLER, R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, v. 9, p , MOSCHOU, P.M.; PASCHALIDIS, K.A.; DELIS, I.D.; ANDRIOPOULOU, A.H.; LAGIOTIS, G.D.; YAKOUMAKIS, D.I.; ROUBELAKIS ANGELAKIS, K.A. Spermidine exodus and oxidation in the apoplast induced by abiotic stress is responsible for H 2 O 2 signatures that direct tolerance responses in tobacco. Plant Cell, v. 20, p , 2008.
65 63 MUNNÉ-BOSCH, S.; QUEVAL, G.; FOYER, C.H. The impact of global change factors on redox signaling underpinning stress tolerance. Plant Physiology, v. 161, p. 5 19, NAKANO Y.; ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant Cell Physiology, v. 22, p , NOCTOR, G.; FOYER, C.H. Ascorbate and glutathione: Keeping Active Oxygen Under Control. Annual Review of Plant Physiology and Plant Molecular Biology, v. 49, p , 1998 OSTERGAARD, J.; PERSIAU, G.; DAVEY, M.W.; BAUW, G.; VAN MONTAGU, M. Isolation of a cdna coding for L-galactono-y-lactone dehydrogense, an enzyme involved in the biosynthesis of ascorbic acid in plants. The Journal of Biological Chemistry, v. 272, p , PALLANCA, J.E.; SMIRNOFF, N. The control of ascorbic acid synthesis and turnover in pea seedlings. Journal of Experimental Botany, v. 51, p , PARSON, H.T.; FRY, S.C. Oxidation of dehydroascorbic acid and 2,3 diketogulonate under plant apoplastic conditions. Phytochemistry, v. 75, p , PINTO, E.; SIGAUD-KUTNER, T.C.S.; LEITÃO, M.A.S.; OKAMOTO, O.K.; MORSE, D.; COLEPICOLO, P. Heavy metal induced oxidative stress in algae. Journal of Phycology, v. 39, p , QUEVAL G.; NOCTOR G. A plate reader method for the measurement of NAD, NADP, glutathione, and ascorbate in tissue extracts: Application to redox profiling during Arabidopsis rosette development. Analytical Biochemistry, v. 363, p , RIBEIRO A.S.; SOUZA, M.O.; SCOFANO H.M.; CRECZYNSKI-PASA, T.B.; MIGNACO, J.A. Inhibition of spinach chloroplast F0F1 by an Fe 2+ /ascorbate/h 2 O 2 system. Plant Physiology and Biochemistry, v.45, p , RIBEIRO R.V.; MACHADO E.C.; SANTOS M.G.; OLIVEIRA R.F.; Seasonal and diurnal changes in photosynthetic limitation of young sweet orange trees. Environmental and Experimental Botany, v. 66, p , SALOMÉ, P.A.; OLIVA, M.; WEIGEL, D.; KRÄMER, U. Circadian clock adjustment to plant iron status depends on chloroplast and phytochrome function. The EMBO Journal, v. 32, p , SCANDALIOS J.G.; Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses. Brazilian Journal of Medical and Biological Research, v. 38, p , 2005.
66 SCHREIBER U.; BILGER W.; NEUBAUER C. Chlorophyll Fluorescence as a Nonintrusive Indicator for Rapid Assessment of In Vivo Photosynthesis. In: E D Schulze, M M Caldwell, eds, Ecophysiology of photosynthesis. Springer, Berlin, p 49 70, SÉTIF, P.; MEIMBERG, K.; MUHLENHOFF, U.; BOUSSAC, A. Photoaccumulation of two ascorbyl free radicals per photosystem I at 200 K. Biochimica et Biophysica Acta, v. 1656, p , SHARMA, P.; DUBEY, R.S. Ascorbate peroxidase from rice seedlings: properties of enzyme isoforms, effects of stresses and protective roles of osmolytes. Plant Science, v. 167, p , SHARMA, P.; JHA, A.B.; DUBEY, R.S.; PESSARAKLI, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. Journal of Botany, v. 2012, p. 1 26, SHIGEOKA, S.; ISHIKAWA, T.; TAMOI, M.; MIYAGAWA, Y.; TAKEDA, T.; YABUTA, Y.; YOSHIMURA, K. Regulation and function of ascorbate peroxidase isoenzymes. Journal of Experimental Botany, v. 53, p , SIMPSON, G.L.W.; ORTWERTH, B.J. The non-oxidative degradation of ascorbic acid at physiological conditions. Biochimica et Biophysica Acta, v. 1501, p , ŚLESAK, I.; LIBIK, M.; KARPINSKA, B.; KARPINSKI, S.; MISZALSKI, Z. The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses. Acta Biochimica Polonica, v. 54, p , TEIXEIRA F.K.; MENEZES-BENAVENTE L.; GALVAO V.C.; MARGIS R.; MARGIS- PINHEIRO M. Rice ascorbate peroxidase gene family encodes functionally diverse isoformslocalized in different subcellular compartments. Planta, v. 224, p , UPADHYAYA N.M.; ZHOU X-R.; ZHU Q-H.; EAMENS A.; WANG M-B.; WATER- HOUSE P.M.; DENNIS E.S. Transgenic rice. in: L. O Brien, R.J. Henry (Eds.), Transgenic Cereals, AACC, Minnesota, p 28 87, VANLERBERGHE, G.C. Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants. International Journal of Molecular Sciences, v. 14, p , YAMORI W.; SAKATA N.; SUZUKI Y.; SHIKANAI T.; MAKINO A. Cyclic electron flow around photosystem I via chloroplast NAD(P)H dehydrogenase (NDH) complex performs a significant physiological role during photosynthesis and plant growth at low temperature. Plant Journal, v. 68, p , ZHOU M.; DIWU Z.; PANCHUK-VOLOSHINA N.; HAUGLAND R.P. A stable nonfluorescent derivative of resorufin for the fluorometric determination of trace 64
67 hydrogen peroxide: applications in detecting the activity of phagocyte NADPH oxidase and other oxidases. Analytical Biochemistry, v. 253, p ,
68 66 TABLES Table 1. Changes in membrane damage, lipid peroxidation, contents of ASC, ASC + DHA, GSH and total GSH, and redox state of ASC and GSH in non-transformed (NT) and APX7/8-silenced rice leaves, control and sprayed in absence or 10 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and capital letters represent significant difference between genotypes within treatments at confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test. Parameters control HL HL + 10 mm AA NT APX7/8 NT APX7/8 NT APX7/8 Membrane damage (1) Ab Ab Aa Aa Aa Aa Lipid peroxidation (2) Ab Ab Aa Aa Aa Aa ASC (3) 3.71 Aa 3.82 Aa 2.68 Ab 2.73 Ab 2.60 Ab 2.64 Ab ASC + DHA (3) 4.52 Aa 4.40 Aa 4.84 Aa 4.96 Aa 4.88 Aa 4.90 Aa Redox state (5) 82 Aa 87 Aa 55 Ab 55 Ab 53 Ab 54 Ab GSH (4) Aa Ba Aa Aa Aa Aa GSH + GSSG (4) Ab Bb Aa Aa Aa Aa Redox state (5) 91 Aa 88 Aa 64 Ab 62 Ab 64 Ab 64 Ab (1) %electrolyte leakage; (2) nmol MDA-TBA g -1 FW; (3) µmol ASC g -1 FW; (4) nmol GSH g -1 FW and (5) percentage
69 Table 2. Changes in membrane damage, lipid peroxidation, contents of ASC, ASC + DHA, GSH and total GSH, and redox state of ASC and GSH in non-transformed (NT) and APX7/8-silenced rice leaves, control and sprayed with 50 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ) or moderate light (500 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and capital letters represent significant difference between genotypes within treatments at confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test. Parameters Control 50 Mm AA 50 mm AA + HL NT APX7/8 NT APX7/8 NT APX7/8 Membrane damage (1) Ac Ac Bb Ab Ba Aa Lipid peroxidation (2) Ac Ac Ab Ab Ba Aa ASC (3) 3.71 Ab 3.82 Ab Aa Aa Aa 9.89 Aa ASC + DHA (3) 4.52 Ab 4.40 Ab Aa Aa Aa Aa ASC redox state (5) 82 Aa 87 Aa 80 Aa 79 Ab 78 Aa 78 Ab GSH (4) Aa Ba Aa Aa Ab Aa GSH + GSSG (4) Aa Bb Aa Aa Aa Aa GSH redox state (5) 91 Aa 88 Aa 83 Ab 81 Ab 79 Ab 80 Ab (1) %electrolyte leakage; (2) nmol MDA-TBA g -1 FW ; (3) µmol ASC g -1 FW; (4) nmol GSH g -1 FW and (5) percentage 67
70 Table 3. Gas exchange and photochemical parameters of PSII and PSI in nontransformed (NT) and APX7/8-silenced rice intact leaves, control and sprayed in absence or 10 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and different capital letters represent significant difference between genotypes within treatments at a confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test. Parameters P N (1) control HL HL + 10 mm AA NT APX7/8 NT APX7/8 NT APX7/ Aa 9.58 Aa 5.33 Ab 4.62 Ab 5.04 Ab 4.52 Ab gs (2) 0.15 Aa 0.12 Aa 0.09 Ab 0.08 Ab 0.08 Ab 0.07 Ab ETRII/P N 6.50 Bb 8.34 Aa 2.51 Bc 4.65 Ac 3.45 Bb 6.61 Ab P Aa 1.97 Aa 1.56 Ab 1.72 Ab 1.64 Ab 1.80 Ab ΦPSI 0.32 Aa 0.30 Aa 0.11 Bb 0.15 Ab 0.13 Bb 0.17 Ab ΦPSII 0.17 Aa 0.19 Aa 0.06 Bb 0.09 Ab 0.08 Bb 0.12 Ab ETRI (1) Aa Aa Bb Ab Bb Ab ETRII (1) Aa Aa Bb Ab Bb Ab NPQ 2.22 Aa 2.14 Aa 1.32 Ab 1.20 Ab 1.35 Ab 1.29 Ab Fv/Fm 0.69 Aa 0.67 Aa 0.48 Ab 0.51 Ab 0.54 Ab 0.52 Ab (1) (µmol m -2 s -1 ) and (2) (mol m 2 s 1 ) 68
71 Table 4. Gas exchange and photochemical parameters of PSII and PSI in nontransformed (NT) and APX7/8-silenced rice intact leaves, control and sprayed with 50 mm ascorbic acid (AA) in presence of high light (1000 µmol m -2 s -1 ) or moderate light (500 µmol m -2 s -1 ). Lowercase letters represent significant difference between treatments within genotypes and different capital letters represent significant difference between genotypes within treatments at a confidence level of Data are average of 4 replicates ± SD and averages were compared by Tukey s test. Parameters P N (1) Control 50 mm AA 50 mm AA + HL NT APX7/8 NT APX7/8 NT APX7/ Aa 9.58 Aa 4.38 Ab 3.85 Ab 1.25 Ac 1.23 Ac gs (2) 0.15 Aa 0.12 Aa 0.05 Ab 0.07 Ab 0.05 Ab 0.06 Ab ETRII/P N 6.50 Bb 8.34 Ac 6.98 Bb Ab Ba Aa P Aa 1.97 Aa 1.45 Ab 1.67 Ab 1.09 Ac 1.20 Ac ΦPSI 0.32 Aa 0.30 Aa 0.14 Ab 0.17 Ab 0.09 Ac 0.06 Ac ΦPSII 0.17 Aa 0.19 Aa 0.08 Ab 0.08 Ab 0.03 Ac 0.04 Ac ETRI (1) Aa Aa Ab Ab Ac Ac ETRII (1) Aa Aa Ab Ab Ac Ac NPQ 2.22 Aa 2.14 Aa 1.53 Ab 1.54 Ab 0.62 Ac 0.73 Ac Fv/Fm 0.69 Aa 0.67 Aa 0.59 Ab 0.55 Ab 0.29 Ac 0.35 Ac (1) (µmol m -2 s -1 ) and (2) (mol m 2 s 1 ) 69
72 70 FIGURES Membrane damage (% electrolyte leakage) LL HL * * * * * A 0 B Fv/Fm * * * * * * C PSII * * * * * AA concentration (mm) Figure 1. Changes in (A) membrane damage, (B) Fv/Fm and (C) φpsii in leaf segments of non-transformed (NT) rice plants treated with different ascorbic acid (AA) concentrations after 24h in low light (200 µmol m -2 s -1 ) and high light (1000 µmol m -2 s -1 ). Asterisks indicate significant difference between treatments, within a same AA concentration, at a confidence level of Points are averages of 4 replicates ± SD.
73 71 Membrane damage (% electrolyte leakage) NT APX7/8 * * * * * * * A * * B APX activity (µmol ASC g FW -1 min -1 ) ASC (µmol ASC g -1 FW) * * * * C * * * * D ASC + DHA (µmol ASC g -1 FW) AA concentration (mm) AA concentration (mm) Figure 2. Changes in (A) membrane damage, (B) APX activity, (C) reduced ascorbate content (ASC) and (D) total ascorbate content (ASC + DHA) in leaf segments of non-transformed (NT) and APX7/8-silenced rice plants exposed to different ascorbic acid (AA) concentrations after 24h in the dark. Asterisks indicate significant difference between treatments, within a same AA concentration, at a confidence level of Points are averages of 4 replicates ± SD.
74 72 Membrane damage (% electrolyte leakage) Bc Dark HL Ad Bc Ac Bb Ab Ba Aa A Bc Ac Bb Ab Ba Ab Ba Aa B Lipid peroxidation (nmol MDA-TBA g -1 FW) Fv/Fm Aa Ba Aa Ba Ab Bb Ab Bb C Bb Ad Bb Ac Ba Ab Ba Aa D Hydrogen peroxide (µmol H2O2 g -1 FW) NT APX7/8 NT+AA APX7/8+AA NT APX7/8 NT+AA APX7/8+AA Figure 3. Changes in (A) membrane damage, (B) lipid peroxidation, (C) Fv/Fm and (D) hydrogen peroxide in leaf segments of non-transformed (NT) and APX7/8- silenced rice plants treated with 0 and 50 mm ascorbic acid (AA) after 24h of dark and high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between the treatments within of the light treatments (dark and HL), and different capital letters represent significant difference between light treatments within the treatments at a confidence level of Bars represent the average of 4 replicates ± SD.
75 Dark HL A B 1.80 Chlorophylls (mg g -1 DW) Aa Ba Aa Ba Ab Bb Ab Bc Aa Ba Aa Ba Ab Bb Ab Bc Carotenoids (mg g -1 DW) 0.00 NT APX7/8 NT+AA APX7/8+AA NT APX7/8 NT+AA APX7/8+AA 0.00 Figure 4. Changes in (A) chlorophylls and (B) carotenoids in leaf segments of nontransformed (NT) and APX7/8-silenced rice plants treated with 0 and 50 mm ascorbic acid (AA) after 24h of dark and high light (1000 µmol m -2 s -1 ). Lowercase letters represent significant difference between the treatments within of the light treatments (dark and HL), and different capital letters represent significant difference between light treatments within the treatments at a confidence level of Bars represent the average of 4 replicates ± SD.
76 74 Figure 5. Appearance of NT and APX7/8-silenced leaf segments of rice plants exposed to control or 50 mm ascorbic acid (AA) after 24h of dark and high light (1000 µmol m -2 s -1 ). The pictures were selected as the most representative from four independent replicates.
77 75 Figure 6. In situ localization of superoxide using NBT dye in NT and APX7/8 leaf segments of rice plants exposed to control or 50 mm ascorbic acid (AA) after 24 h of dark. The pictures were selected as the most representative from four independent replicates.
78 76 SUPPLEMENTARY MATERIAL Figure S1. Habitus of representative plants from four replicates (each replicate represented by a pot containing two plants). Non-transformed (NT) and OsApx7/8- silenced plants after 45 days of growth in a complete nutrient solution under normal growth conditions.
79 NT APX7/8 A a B 16 Relative expression a a a a a a a a a a a a a b a b b APX activity (µmol AsA g FW -1 min -1 ) 0.0 OsAPX1 OsAPX2 OsAPX3 OsAPX4 OsAPX5 OsAPX6 OsAPX7 OsAPX8 NT APX7/8 0 Figure S2. Characterization of chloroplastic OsAPX7 and OsAPX8 genes in Apx7/8s silenced plants. (A) Expression of all OsAPX genes in Apx7/8s plants at generation T2 compared to the expression observed in NT plants. (B) APX activity in NT and APX7/8-silenced leaf segments of rice plants under control conditions. Bars represent the average of 3 replicates ± SD. Different letters represent significant differences among the Apx7/8s silenced and NT plants.
80 78 Figure S3. Appearance of leaf segments in NT rice plants exposed different acid ascorbic (AA) concentration after 24h of low light (200 µmol m -2 s -1 ) and high light (1000 µmol m -2 s -1 ). The pictures were selected as the most representative from four independent replicates.
Prof. Francisco Hevilásio F. Pereira Fisiologia Vegetal
 Fotossíntese: reações luminosas Fotossíntese: significa literalmente síntese utilizando a luz FISIOLOGIA VEGETAL Fotossíntese Parte I Pombal PB Transformação de energia luminosa em energia química nos
Fotossíntese: reações luminosas Fotossíntese: significa literalmente síntese utilizando a luz FISIOLOGIA VEGETAL Fotossíntese Parte I Pombal PB Transformação de energia luminosa em energia química nos
A energética celular: o papel das mitocôndrias e cloroplastos
 A energética celular: o papel das mitocôndrias e cloroplastos A energética celular ATP: captura e transfere energia livre nos sistemas biológicos Hidrólise do ATP: libera energia para suprir processos
A energética celular: o papel das mitocôndrias e cloroplastos A energética celular ATP: captura e transfere energia livre nos sistemas biológicos Hidrólise do ATP: libera energia para suprir processos
EXERCÍCIO E ESTRESSE OXIDATIVO. Exercício e Estresse Oxidativo. O que são radicais livres? Reação de Óxido-Redução (Redox) O que são radicais livres?
 Referências bibliográficas EXERCÍCIO E ESTRESSE OXIDATIVO Prof. Dr. Paulo Rizzo Ramires Livro McArdle Fisiologia do Exercício Cap. 2 Vitaminas, minerais e água Parte 1 Vitaminas Atividade física, radicais
Referências bibliográficas EXERCÍCIO E ESTRESSE OXIDATIVO Prof. Dr. Paulo Rizzo Ramires Livro McArdle Fisiologia do Exercício Cap. 2 Vitaminas, minerais e água Parte 1 Vitaminas Atividade física, radicais
Bioinorgânica do Manganês. Prof. Fernando R. Xavier
 Bioinorgânica do Manganês Prof. Fernando R. Xavier UDESC 2018 Características químicas gerais O manganês pode acessar 03 (três) estados de oxidação relevantes do ponto de vista biológico: Mn(2+), Mn(3+)
Bioinorgânica do Manganês Prof. Fernando R. Xavier UDESC 2018 Características químicas gerais O manganês pode acessar 03 (três) estados de oxidação relevantes do ponto de vista biológico: Mn(2+), Mn(3+)
Luz. Reacção geral da fotossíntese. Luz
 Os organismos fotossintéticos utilizam a luz solar como fonte de energia para a biossíntese de ATP e NADPH, que são utilizados para produção de glícidos e outros compostos orgânicos, a partir de CO 2 e
Os organismos fotossintéticos utilizam a luz solar como fonte de energia para a biossíntese de ATP e NADPH, que são utilizados para produção de glícidos e outros compostos orgânicos, a partir de CO 2 e
Universidade Federal de Alagoas Campus Arapiraca Fisiologia Vegetal FOTOSSÍNTESE
 Universidade Federal de Alagoas Campus Arapiraca Fisiologia Vegetal FOTOSSÍNTESE Unidade V Fotossíntese Taiz & Zeiger: Fisiologia Vegetal Capítulo 7: Reações luminosas. pág 139-171 Capítulo 8: Reações
Universidade Federal de Alagoas Campus Arapiraca Fisiologia Vegetal FOTOSSÍNTESE Unidade V Fotossíntese Taiz & Zeiger: Fisiologia Vegetal Capítulo 7: Reações luminosas. pág 139-171 Capítulo 8: Reações
BASES CONCEITUAIS DA ENERGIA Bacharelado de Ciência e Tecnologia Profa. Iseli L. Nantes Universidade Federal do ABC. Fotossíntese: reações luminosas
 Fotossíntese: reações luminosas A luz do sol é a fonte de energia mais importante para quase todos seres vivos. Com a ajuda da fotossíntese, a energia luminosa é usada para produzir substâncias orgânicas
Fotossíntese: reações luminosas A luz do sol é a fonte de energia mais importante para quase todos seres vivos. Com a ajuda da fotossíntese, a energia luminosa é usada para produzir substâncias orgânicas
Mecanismo de ação e resistência aos herbicidas induzidos pela ação da luz
 Mecanismo de ação e resistência aos herbicidas induzidos pela ação da luz Dr. Scott Nissen, Professor Colorado State University, Fort Collins, CO Assistance from: Drs. Franck Dayan, Pat Tranel, Dean Riechers
Mecanismo de ação e resistência aos herbicidas induzidos pela ação da luz Dr. Scott Nissen, Professor Colorado State University, Fort Collins, CO Assistance from: Drs. Franck Dayan, Pat Tranel, Dean Riechers
Fotossíntese 08/06/2017. Fotossíntese: Captura da Energia Luminosa. Origem do Cloroplasto. Organismos Fotossintetizantes
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso Engenharia Química Disciplina Bioquímica Fotossíntese: Captura da Energia Luminosa Energia solar é fonte de
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Curso Engenharia Química Disciplina Bioquímica Fotossíntese: Captura da Energia Luminosa Energia solar é fonte de
A energética celular:
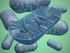 A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
Fotorreações da Fotossíntese
 UNIVERSIDADE DE SÃO PAULO Instituto de Química de São Carlos Fotorreações da Fotossíntese Dr. Paulo Roberto Dores-Silva São Carlos, 2016 A Fosforilação Oxidativa Depende da transferência de elétrons Cadeia
UNIVERSIDADE DE SÃO PAULO Instituto de Química de São Carlos Fotorreações da Fotossíntese Dr. Paulo Roberto Dores-Silva São Carlos, 2016 A Fosforilação Oxidativa Depende da transferência de elétrons Cadeia
FOTOSSÍNTESE. Prof. Fabio Nogueira
 FOTOSSÍNTESE Prof. Fabio Nogueira Definição: Processo que ocorre em plantas, algas e alguns procariotos e que utiliza diretamente a energia luminosa para sintetizar compostos orgânicos Importância:produção
FOTOSSÍNTESE Prof. Fabio Nogueira Definição: Processo que ocorre em plantas, algas e alguns procariotos e que utiliza diretamente a energia luminosa para sintetizar compostos orgânicos Importância:produção
REGULAÇÃO DA FOTOSSÍNTESE PELA ATIVIDADE DO DRENO
 Universidade de São Paulo Relações Metabólicas e Hídricas nos Vegetais REGULAÇÃO DA FOTOSSÍNTESE PELA ATIVIDADE DO DRENO Matthew J. Paul and Christine H. Foyer Journal of Experimental Botany, Vol. 52,
Universidade de São Paulo Relações Metabólicas e Hídricas nos Vegetais REGULAÇÃO DA FOTOSSÍNTESE PELA ATIVIDADE DO DRENO Matthew J. Paul and Christine H. Foyer Journal of Experimental Botany, Vol. 52,
FISIOLOGIA VEGETAL 24/10/2012. Respiração. Respiração. Respiração. Substratos para a respiração. Mas o que é respiração?
 Respiração Mas o que é respiração? FISIOLOGIA VEGETAL Respiração É o processo pelo qual compostos orgânicos reduzidos são mobilizados e subsequentemente oxidados de maneira controlada É um processo de
Respiração Mas o que é respiração? FISIOLOGIA VEGETAL Respiração É o processo pelo qual compostos orgânicos reduzidos são mobilizados e subsequentemente oxidados de maneira controlada É um processo de
A energética celular:
 A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
A energética celular: o papel das mitocôndrias e cloroplastos Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular Como já vimos anteriormente
+ e - + H + H-O-O. H-O-O. + e - + H + H-O-O-H H-O-O-H + e - + H + HO. + H 2. O + Fe 3+
 Catálise baseada em enzimas que contém íons de Ferro Enzimas que atuam sobre H 2 O 2 Peróxido de hidrogênio é comumente formado em reações que envolvem a redução de O 2 em sistemas biológicos. O H 2 O
Catálise baseada em enzimas que contém íons de Ferro Enzimas que atuam sobre H 2 O 2 Peróxido de hidrogênio é comumente formado em reações que envolvem a redução de O 2 em sistemas biológicos. O H 2 O
Cloroplasto e Fotossíntese
 Universidade de São Paulo (USP) Escola de Engenharia de Lorena (EEL) Engenharia Ambiental Cloroplasto e Fotossíntese Fotossíntese: Captura da Energia Luminosa Energia solar é fonte de toda a energia biológia
Universidade de São Paulo (USP) Escola de Engenharia de Lorena (EEL) Engenharia Ambiental Cloroplasto e Fotossíntese Fotossíntese: Captura da Energia Luminosa Energia solar é fonte de toda a energia biológia
Organelas e suas funções. A energética celular:
 Organelas e suas funções Capitulo 15- Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular: Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição
Organelas e suas funções Capitulo 15- Fundamentos da Biologia Celular- Alberts- 2ª edição A energética celular: Capitulo 13 (p 427 a 444) e Capitulo 14 Fundamentos da Biologia Celular- Alberts- 2ª edição
FOTOSSÍNTESE MÓDULO 2 CITOLOGIA
 MÓDULO 2 CITOLOGIA Jovem, se você ainda não viu a aula de Respiração eu sugiro que você pare e vá dar uma olhada. Isso, pode ir agora mesmo, sem problemas. Eu espero. Isso porque a fotossíntese fica muito
MÓDULO 2 CITOLOGIA Jovem, se você ainda não viu a aula de Respiração eu sugiro que você pare e vá dar uma olhada. Isso, pode ir agora mesmo, sem problemas. Eu espero. Isso porque a fotossíntese fica muito
QBQ-0230 Bioquímica do Metabolismo Biologia Noturno
 QBQ-0230 Bioquímica do Metabolismo Biologia Noturno O que é, e para que serve a vias das pentoses fosfato. A via das pentoses fosfato é uma via alternativa de oxidação da glicose. A via das pentoses fosfato
QBQ-0230 Bioquímica do Metabolismo Biologia Noturno O que é, e para que serve a vias das pentoses fosfato. A via das pentoses fosfato é uma via alternativa de oxidação da glicose. A via das pentoses fosfato
Estresse Oxidativo e Fadiga Muscular Esquelética Induzida Pelo Exercício
 Universidade de São Paulo Escola de Educação Física e Esportes (EEFE-USP) Estresse Oxidativo e Fadiga Muscular Esquelética Induzida Pelo Exercício Mestranda: Fátima Lúcia R. Guimarães Orientador: Dr. Paulo
Universidade de São Paulo Escola de Educação Física e Esportes (EEFE-USP) Estresse Oxidativo e Fadiga Muscular Esquelética Induzida Pelo Exercício Mestranda: Fátima Lúcia R. Guimarães Orientador: Dr. Paulo
Modificações fisiológicas no amadurecimento de vegetais
 Modificações fisiológicas no amadurecimento de vegetais Tamara Righetti Tupini Cavalheiro Rio de Janeiro 2018.2 Síntese usando a luz Fotossíntese Fase Fotoquímica ATP NADPH 2 Fase Química GLICOSE CO 2
Modificações fisiológicas no amadurecimento de vegetais Tamara Righetti Tupini Cavalheiro Rio de Janeiro 2018.2 Síntese usando a luz Fotossíntese Fase Fotoquímica ATP NADPH 2 Fase Química GLICOSE CO 2
Prof. Francisco Hevilásio F. Pereira Cultivos em ambiente protegido
 A planta: características morfológicas, anatômicas e fisiológicas POMBAL PB A PLANTA Grande diversidade de tamanhos e formas vegetais Tamanho: 1,0 cm até 100m de altura Formas: herbácea (melancia) até
A planta: características morfológicas, anatômicas e fisiológicas POMBAL PB A PLANTA Grande diversidade de tamanhos e formas vegetais Tamanho: 1,0 cm até 100m de altura Formas: herbácea (melancia) até
Organelas Transdutoras de Energia: Mitocôndria - Respiração
 Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Curso: Engenharia
Universidade de São Paulo Escola de Engenharia de Lorena Departamento de Biotecnologia Organelas: Cloroplasto e Mitocôndria Obtenção de energia para a célula a partir diferentes fontes: Curso: Engenharia
Fosforilação Oxidativa e Fotossíntese são dois processos de captação de energia pelos organismos vivos relacionados pelo ciclo de energia entre os
 Fosforilação Oxidativa e Fotossíntese são dois processos de captação de energia pelos organismos vivos relacionados pelo ciclo de energia entre os organismos vivos e que apresentam semelhanças e diferenças.
Fosforilação Oxidativa e Fotossíntese são dois processos de captação de energia pelos organismos vivos relacionados pelo ciclo de energia entre os organismos vivos e que apresentam semelhanças e diferenças.
Caracterização funcional dos genes de ascorbato peroxidase de arroz (Oryza sativa L.) nas interações entre estresse oxidativo e estresses abióticos
 Caracterização funcional dos genes de ascorbato peroxidase de arroz (Oryza sativa L.) nas interações entre estresse oxidativo e estresses abióticos Andréia Caverzan Porto Alegre, Fevereiro de 2008 Universidade
Caracterização funcional dos genes de ascorbato peroxidase de arroz (Oryza sativa L.) nas interações entre estresse oxidativo e estresses abióticos Andréia Caverzan Porto Alegre, Fevereiro de 2008 Universidade
FOTOSSÍNTESE 1º Semestre de 2011
 FOTOSSÍNTESE 1º Semestre de 2011 FOTOSSÍNTESE - FORNECIMENTO DE ALIMENTO - BIOMASSA - COMBUSTÍVEL FÓSSIL - OXIGÊNIO - ENERGIA QUÍMICA ATP - PODER REDUTOR - NADPH FOTOSSÍNTESE - APENAS 5 % DA ENERGIA SOLAR
FOTOSSÍNTESE 1º Semestre de 2011 FOTOSSÍNTESE - FORNECIMENTO DE ALIMENTO - BIOMASSA - COMBUSTÍVEL FÓSSIL - OXIGÊNIO - ENERGIA QUÍMICA ATP - PODER REDUTOR - NADPH FOTOSSÍNTESE - APENAS 5 % DA ENERGIA SOLAR
Fotossíntese Biologia
 Fotossíntese Licenciatura em Ciências Exatas Biologia 3-2017 Fotossíntese x Respiração Fotossíntese cianobactérias Bactérias vermelhas sulfurosas Plantas verdes Histórico Aristóteles: pensava que as plantas
Fotossíntese Licenciatura em Ciências Exatas Biologia 3-2017 Fotossíntese x Respiração Fotossíntese cianobactérias Bactérias vermelhas sulfurosas Plantas verdes Histórico Aristóteles: pensava que as plantas
Fatores de estresse no milho são diversos e exigem monitoramento constante
 Produtividade Fatores de estresse no milho são diversos e exigem monitoramento constante Gustavo Maia Souza e Alexandrius de Moraes Barbosa* Rodrigo Almeida Fatores bióticos e abióticos podem causar situações
Produtividade Fatores de estresse no milho são diversos e exigem monitoramento constante Gustavo Maia Souza e Alexandrius de Moraes Barbosa* Rodrigo Almeida Fatores bióticos e abióticos podem causar situações
Questão 5. Questão 2. Questão 3. Questão 6. Questão 7. Questão 4. 1 ª série Ensino Médio Tarefão BIOLOGIA 2º bimestre. Aluno(a):
 1 ª série Ensino Médio Tarefão BIOLOGIA 2º bimestre Aluno(a): Questão - 1 Observe a equação geral da fotossíntese para responder as questões de 01 a 04. Questão 5 Sobre o processo de fotossíntese, observe
1 ª série Ensino Médio Tarefão BIOLOGIA 2º bimestre Aluno(a): Questão - 1 Observe a equação geral da fotossíntese para responder as questões de 01 a 04. Questão 5 Sobre o processo de fotossíntese, observe
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
 UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA DEFESA ANTIOXIDATIVA EM PLANTAS DE ARROZ DUPLAMENTE SILENCIADAS
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA DEFESA ANTIOXIDATIVA EM PLANTAS DE ARROZ DUPLAMENTE SILENCIADAS
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA IVANICE BEZERRA DA SILVA
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA IVANICE BEZERRA DA SILVA COORDENAÇÃO ENTRE AS RESPOSTAS DA CATALASE E DA ASCORBATO PEROXIDASE EM FOLHAS DE FEIJÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA IVANICE BEZERRA DA SILVA COORDENAÇÃO ENTRE AS RESPOSTAS DA CATALASE E DA ASCORBATO PEROXIDASE EM FOLHAS DE FEIJÃO
02/10/2016 SENSIBILIDADE AO OXIGÊNIO SUSCEPTIBILIDADE AO OXIGÊNIO. Tolerância ao Oxigênio RADICAIS LIVRES TÓXICOS
 SUSCEPTIBILIDADE AO OXIGÊNIO SENSIBILIDADE AO OXIGÊNIO O OXIGÊNIO EXCESSIVO É TÃO PERIGOSO QUANTO A SUA DEFICIÊNCIA (Lavoisier, 1785) [ ] Prof. Dr. Mario Julio AvilaCampos ORGANISMO http://www.icb.usp.br/bmm/mariojac
SUSCEPTIBILIDADE AO OXIGÊNIO SENSIBILIDADE AO OXIGÊNIO O OXIGÊNIO EXCESSIVO É TÃO PERIGOSO QUANTO A SUA DEFICIÊNCIA (Lavoisier, 1785) [ ] Prof. Dr. Mario Julio AvilaCampos ORGANISMO http://www.icb.usp.br/bmm/mariojac
Fosforilação Oxidativa e Fotossíntese são dois processos de captação de energia pelos organismos vivos relacionados pelo ciclo de energia entre os
 Fosforilação Oxidativa e Fotossíntese são dois processos de captação de energia pelos organismos vivos relacionados pelo ciclo de energia entre os organismos vivos e que apresentam semelhanças e diferenças.
Fosforilação Oxidativa e Fotossíntese são dois processos de captação de energia pelos organismos vivos relacionados pelo ciclo de energia entre os organismos vivos e que apresentam semelhanças e diferenças.
Fisiologia do Exercício
 Fisiologia do Exercício REAÇÕES QUÍMICAS Metabolismo inclui vias metabólicas que resultam na síntese de moléculas Metabolismo inclui vias metabólicas que resultam na degradação de moléculas Reações anabólicas
Fisiologia do Exercício REAÇÕES QUÍMICAS Metabolismo inclui vias metabólicas que resultam na síntese de moléculas Metabolismo inclui vias metabólicas que resultam na degradação de moléculas Reações anabólicas
Professor Antônio Ruas
 Universidade Estadual do Rio Grande do Sul Curso Superior de Tecnologia em Gestão Ambiental Componente curricular: BIOLOGIA GERAL Aula 4 Professor Antônio Ruas 1. Temas: Macromoléculas celulares Produção
Universidade Estadual do Rio Grande do Sul Curso Superior de Tecnologia em Gestão Ambiental Componente curricular: BIOLOGIA GERAL Aula 4 Professor Antônio Ruas 1. Temas: Macromoléculas celulares Produção
Metabolismo Celular: Nutrição. Prof. João Ronaldo Tavares de Vasconcellos Neto
 Metabolismo Celular: Respiração e Fotossíntese Nutrição Prof. João Ronaldo Tavares de Vasconcellos Neto MAR/2011 Aspectos Gerais da Fotossíntese Fotossíntese ntese: do grego, photos, luz, e syntithenai,
Metabolismo Celular: Respiração e Fotossíntese Nutrição Prof. João Ronaldo Tavares de Vasconcellos Neto MAR/2011 Aspectos Gerais da Fotossíntese Fotossíntese ntese: do grego, photos, luz, e syntithenai,
AGRICULTURA GERAL. O ambiente e a planta POMBAL PB
 AGRICULTURA GERAL O ambiente e a planta POMBAL PB O AMBIENTE E A PLANTA A PLANTA Grande diversidade de tamanhos e formas vegetais Tamanho: 1,0 cm até 100m de altura Formas: herbácea (melancia) até arbóreas
AGRICULTURA GERAL O ambiente e a planta POMBAL PB O AMBIENTE E A PLANTA A PLANTA Grande diversidade de tamanhos e formas vegetais Tamanho: 1,0 cm até 100m de altura Formas: herbácea (melancia) até arbóreas
 http://biology-animation.blogspot.com.br/2007/01/photosynthesis.html http://www.johnkyrk.com/photosynthesis.html http://www.blinkx.com/watch-video/photosynthesis-bioflix-animation/zwvq8tsgqeg7fgsd2mwptw
http://biology-animation.blogspot.com.br/2007/01/photosynthesis.html http://www.johnkyrk.com/photosynthesis.html http://www.blinkx.com/watch-video/photosynthesis-bioflix-animation/zwvq8tsgqeg7fgsd2mwptw
Universidade Federal do Rio Grande do Sul UFRGS. Programa de Pós Graduação em Genética e Biologia Molecular
 Universidade Federal do Rio Grande do Sul UFRGS Programa de Pós Graduação em Genética e Biologia Molecular Inter-relações entre estresse oxidativo e estresses abióticos em arroz (Oryza sativa L.): o papel
Universidade Federal do Rio Grande do Sul UFRGS Programa de Pós Graduação em Genética e Biologia Molecular Inter-relações entre estresse oxidativo e estresses abióticos em arroz (Oryza sativa L.): o papel
É a síntese de carboidratos com liberação de oxigênio, a partir de gás carbônico e água, na presença da luz e da clorofila. É um processo endergônico
 É a síntese de carboidratos com liberação de oxigênio, a partir de gás carbônico e água, na presença da luz e da clorofila. É um processo endergônico realizado pela maioria dos seres autotróficos, como
É a síntese de carboidratos com liberação de oxigênio, a partir de gás carbônico e água, na presença da luz e da clorofila. É um processo endergônico realizado pela maioria dos seres autotróficos, como
Embebição. Síntese de RNA e proteínas. enzimática e de organelas. Atividades celulares fundamentais que ocorrem na germinação. Crescimento da plântula
 Embebição Respiração Atividade enzimática e de organelas Síntese de RNA e proteínas Atividades celulares fundamentais que ocorrem na germinação Crescimento da plântula Manifestações metabólicas ou bioquímicas
Embebição Respiração Atividade enzimática e de organelas Síntese de RNA e proteínas Atividades celulares fundamentais que ocorrem na germinação Crescimento da plântula Manifestações metabólicas ou bioquímicas
Processo pelo qual a energia luminosa é captada e convertida em energia química;
 Processo pelo qual a energia luminosa é captada e convertida em energia química; Presente em procariotos e eucariotos; Mais de metade de toda a fotossíntese do planeta ocorre nas algas unicelulares. O
Processo pelo qual a energia luminosa é captada e convertida em energia química; Presente em procariotos e eucariotos; Mais de metade de toda a fotossíntese do planeta ocorre nas algas unicelulares. O
Programa de Pós-Graduação em Genética e Melhoramento de Plantas
 Programa de Pós-Graduação em Genética e Melhoramento de Plantas LGN 5799 - SEMINÁRIOS EM GENÉTICA E MELHORAMENTO DE PLANTAS DEGRADAÇÃO PROTÉICA EM CLOROPLASTOS Camila Motta Borgonove Márcio de Castro Silva
Programa de Pós-Graduação em Genética e Melhoramento de Plantas LGN 5799 - SEMINÁRIOS EM GENÉTICA E MELHORAMENTO DE PLANTAS DEGRADAÇÃO PROTÉICA EM CLOROPLASTOS Camila Motta Borgonove Márcio de Castro Silva
Fisiologia Vegetal. Bibliografia: Lehninger Principles of Biochemistry Taiz Plant Physiology
 Fisiologia Vegetal Objetivos da aula: Fotossíntese: absorção de luz pigmentos fotossintéticos fotossistemas fluxo de elétrons acíclico fotofosforilação fluxo de elétrons cíclico Bibliografia: Lehninger
Fisiologia Vegetal Objetivos da aula: Fotossíntese: absorção de luz pigmentos fotossintéticos fotossistemas fluxo de elétrons acíclico fotofosforilação fluxo de elétrons cíclico Bibliografia: Lehninger
UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA E IMUNOLOGIA BARBARA FONSECA DE OLIVEIRA
 UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA E IMUNOLOGIA BARBARA FONSECA DE OLIVEIRA INFLUÊNCIA DE UM COMPLEXO VITAMÍNICO (ÁCIDO ASCÓRBICO, ALFA-TOCOFEROL
UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA E IMUNOLOGIA BARBARA FONSECA DE OLIVEIRA INFLUÊNCIA DE UM COMPLEXO VITAMÍNICO (ÁCIDO ASCÓRBICO, ALFA-TOCOFEROL
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa
 OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
A ciência dos antioxidantes
 CICLO ALIMENTAÇÃO E SAÚDE A ciência dos antioxidantes Doutoranda: Thaiza Serrano 1 O que são antioxidantes? Substância que retarda o aparecimento de alteração oxidativa no alimento (ANVISA). Substâncias
CICLO ALIMENTAÇÃO E SAÚDE A ciência dos antioxidantes Doutoranda: Thaiza Serrano 1 O que são antioxidantes? Substância que retarda o aparecimento de alteração oxidativa no alimento (ANVISA). Substâncias
AÇÃO DA IRRADIÂNCIA E SALINIDADE NO PROCESSO FOTOSSINTÉTICO EM ECOTIPOS DE FEIJOEIRO
 CAROLINA JARAMILLO GIRALDO AÇÃO DA IRRADIÂNCIA E SALINIDADE NO PROCESSO FOTOSSINTÉTICO EM ECOTIPOS DE FEIJOEIRO Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa
CAROLINA JARAMILLO GIRALDO AÇÃO DA IRRADIÂNCIA E SALINIDADE NO PROCESSO FOTOSSINTÉTICO EM ECOTIPOS DE FEIJOEIRO Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa
METABOLISMO DO NITROGÊNIO Prof. Dr. Roberto Cezar Lobo da Costa
 METABOLISMO DO NITROGÊNIO Prof. Dr. Roberto Cezar Lobo da Costa ROTEIRO DE AULA 1. Introdução, importância e funções do nitrogênio 2. Formas nitrogenadas que podem ser absorvidas 3. Redutase do nitrato
METABOLISMO DO NITROGÊNIO Prof. Dr. Roberto Cezar Lobo da Costa ROTEIRO DE AULA 1. Introdução, importância e funções do nitrogênio 2. Formas nitrogenadas que podem ser absorvidas 3. Redutase do nitrato
Fotossíntese e Quimiossíntese. Natália Paludetto
 Fotossíntese e Quimiossíntese Natália Paludetto nataliaapaludetto@gmail.com Fotossíntese Os seres que a realizam são conhecidos como autotróficos. É processo pelo qual os seres clorofilados sintetizam
Fotossíntese e Quimiossíntese Natália Paludetto nataliaapaludetto@gmail.com Fotossíntese Os seres que a realizam são conhecidos como autotróficos. É processo pelo qual os seres clorofilados sintetizam
FISIOLOGIA E NUTRIÇÃO DA VIDEIRA
 FISIOLOGIA E NUTRIÇÃO DA VIDEIRA aaa a Fotossíntese (Fase Bioquímica) Fase escura Prof. Leonardo Cury Bento Gonçalves, RS 1 Reações Fase bioquímica da Fotossíntese Reações do Carbono (Fase Escura) 2 !
FISIOLOGIA E NUTRIÇÃO DA VIDEIRA aaa a Fotossíntese (Fase Bioquímica) Fase escura Prof. Leonardo Cury Bento Gonçalves, RS 1 Reações Fase bioquímica da Fotossíntese Reações do Carbono (Fase Escura) 2 !
Plastos. Dra. Maria Izabel Gallão
 Plastos - plastídeos organelas de células vegetais que possuem o próprio genoma. - existem vários tipos dentre eles os cloroplastos, diferem entre si em estrutura e função. - os outros plastídeos são rodeados
Plastos - plastídeos organelas de células vegetais que possuem o próprio genoma. - existem vários tipos dentre eles os cloroplastos, diferem entre si em estrutura e função. - os outros plastídeos são rodeados
Função proteica envolve a ligação reversível com outras moléculas O ligante se liga na proteína e um sítio específico, chamado SÍTIO DE LIGAÇÃO.
 Estrutura Função 1. Função proteica envolve a ligação reversível com outras moléculas. A molécula que se liga reversivelmente à proteina LIGANTE 2. O ligante se liga na proteína e um sítio específico,
Estrutura Função 1. Função proteica envolve a ligação reversível com outras moléculas. A molécula que se liga reversivelmente à proteina LIGANTE 2. O ligante se liga na proteína e um sítio específico,
Fisiologia Vegetal. Curso de Zootecnia Prof. Etiane Skrebsky Quadros
 Fisiologia Vegetal Curso de Zootecnia Prof. Etiane Skrebsky Quadros Unidade: Fotossíntese Fase química ou de fixação/redução de carbono da fotossíntese: Todos os organismo que fotossintetizam precisam
Fisiologia Vegetal Curso de Zootecnia Prof. Etiane Skrebsky Quadros Unidade: Fotossíntese Fase química ou de fixação/redução de carbono da fotossíntese: Todos os organismo que fotossintetizam precisam
ESTRESSE OXIDATIVO, EXERCÍCIO FÍSICO E SUPLEMENTAÇÃO COM VITAMINA E. Nayana Vilhena Teive Xavier Esp. Nutrição esportiva
 ESTRESSE OXIDATIVO, EXERCÍCIO FÍSICO E SUPLEMENTAÇÃO COM VITAMINA E Nayana Vilhena Teive Xavier Esp. Nutrição esportiva njteive@novafapi.com.br 1 ESTRESSE OXIDATIVO Desequilíbrio entre a formação e a remoção
ESTRESSE OXIDATIVO, EXERCÍCIO FÍSICO E SUPLEMENTAÇÃO COM VITAMINA E Nayana Vilhena Teive Xavier Esp. Nutrição esportiva njteive@novafapi.com.br 1 ESTRESSE OXIDATIVO Desequilíbrio entre a formação e a remoção
Biologia. Fotossíntese. Professor Enrico Blota.
 Biologia Fotossíntese Professor Enrico Blota www.acasadoconcurseiro.com.br Biologia FOTOSSÍNTESE Processo de formação de matéria orgânica (principalmente a glicose) a partir de gás carbônico e água. Essa
Biologia Fotossíntese Professor Enrico Blota www.acasadoconcurseiro.com.br Biologia FOTOSSÍNTESE Processo de formação de matéria orgânica (principalmente a glicose) a partir de gás carbônico e água. Essa
METABOLISMO ENERGÉTICO. BIOLOGIA 9º ano Profª Renata Coelho Rodrigues
 METABOLISMO ENERGÉTICO BIOLOGIA 9º ano Profª Renata Coelho Rodrigues METABOLISMO ENERGÉTICO PLASTOS: Organelas membranosas (células vegetais e algas eucarióticas). Tilacóides: CLOROPLASTOS Presente em
METABOLISMO ENERGÉTICO BIOLOGIA 9º ano Profª Renata Coelho Rodrigues METABOLISMO ENERGÉTICO PLASTOS: Organelas membranosas (células vegetais e algas eucarióticas). Tilacóides: CLOROPLASTOS Presente em
CARLOS ALBERTO VIEIRA DE SOUZA
 CARLOS ALBERTO VIEIRA DE SOUZA MUDANÇAS FOTO-OXIDATIVAS EM PLANTAS DE ARROZ COM REDUZIDA ATIVIDADE DA OXIDASE DO GLICOLATO SUBMETIDAS AO ESTRESSE HIDRICO COMBINADO AO EXCESSO DE LUZ E CALOR Serra Talhada-PE
CARLOS ALBERTO VIEIRA DE SOUZA MUDANÇAS FOTO-OXIDATIVAS EM PLANTAS DE ARROZ COM REDUZIDA ATIVIDADE DA OXIDASE DO GLICOLATO SUBMETIDAS AO ESTRESSE HIDRICO COMBINADO AO EXCESSO DE LUZ E CALOR Serra Talhada-PE
Organelas Responsáveis pela Geração de Energia: Mitocôndria e Cloroplastos
 LGN0114 Biologia Celular Organelas Responsáveis pela Geração de Energia: Mitocôndria e Cloroplastos Aula 8 Antonio Figueira figueira@cena.usp.br Origem endossimbiótica - Membrana dupla - Genoma próprio
LGN0114 Biologia Celular Organelas Responsáveis pela Geração de Energia: Mitocôndria e Cloroplastos Aula 8 Antonio Figueira figueira@cena.usp.br Origem endossimbiótica - Membrana dupla - Genoma próprio
CARLOS ALBERTO VIEIRA DE SOUZA
 CARLOS ALBERTO VIEIRA DE SOUZA MUDANÇAS FOTO-OXIDATIVAS EM PLANTAS DE ARROZ COM REDUZIDA ATIVIDADE DA OXIDASE DO GLICOLATO SUBMETIDAS AO ESTRESSE HÍDRICO COMBINADO AO EXCESSO DE LUZ E CALOR Serra Talhada-PE
CARLOS ALBERTO VIEIRA DE SOUZA MUDANÇAS FOTO-OXIDATIVAS EM PLANTAS DE ARROZ COM REDUZIDA ATIVIDADE DA OXIDASE DO GLICOLATO SUBMETIDAS AO ESTRESSE HÍDRICO COMBINADO AO EXCESSO DE LUZ E CALOR Serra Talhada-PE
Aulas Biologia 1 Professor João METABOLISMO ENERGÉTICO
 Professor João METABOLISMO ENERGÉTICO RESPIRAÇÃO CELULAR Processo aeróbico de produção de energia (ATP) a partir da quebra de moléculas orgânicas (ex.: glicose); A molécula de ATP (adenosina trifosfato)
Professor João METABOLISMO ENERGÉTICO RESPIRAÇÃO CELULAR Processo aeróbico de produção de energia (ATP) a partir da quebra de moléculas orgânicas (ex.: glicose); A molécula de ATP (adenosina trifosfato)
Professora Leonilda Brandão da Silva
 COLÉGIO ESTADUAL HELENA KOLODY E.M.P. TERRA BOA - PARANÁ Pág. 109 Professora Leonilda Brandão da Silva E-mail: leonildabrandaosilva@gmail.com http://professoraleonilda.wordpress.com/ Em cavernas escuras
COLÉGIO ESTADUAL HELENA KOLODY E.M.P. TERRA BOA - PARANÁ Pág. 109 Professora Leonilda Brandão da Silva E-mail: leonildabrandaosilva@gmail.com http://professoraleonilda.wordpress.com/ Em cavernas escuras
Aula FOTOSSÍNTESE META OBJETIVO. Introduzir os processos da fotossíntese. na formação dos carboidratos.
 FOTOSSÍNTESE META Introduzir os processos da fotossíntese. OBJETIVO na formação dos carboidratos. Conhecer os processos de abertura e fechamento estomático. Fisiologia Vegetal INTRODUÇÃO primariamente
FOTOSSÍNTESE META Introduzir os processos da fotossíntese. OBJETIVO na formação dos carboidratos. Conhecer os processos de abertura e fechamento estomático. Fisiologia Vegetal INTRODUÇÃO primariamente
PREVENÇÃO DE REAÇÕES OXIDATIVAS: ANTIOXIDANTES NOS VEGETAIS DE CONSUMO HUMANO.
 PREVENÇÃO DE REAÇÕES OXIDATIVAS: ANTIOXIDANTES NOS VEGETAIS DE CONSUMO HUMANO. Mancini-Filho, J.*.& Mancini. D.A.P.** *Departamento de Alimentos e Nutrição Experimental Faculdade de Ciências Farmacêuticas
PREVENÇÃO DE REAÇÕES OXIDATIVAS: ANTIOXIDANTES NOS VEGETAIS DE CONSUMO HUMANO. Mancini-Filho, J.*.& Mancini. D.A.P.** *Departamento de Alimentos e Nutrição Experimental Faculdade de Ciências Farmacêuticas
2ª série do Ensino Médio Tarde e Noite Profª Luciana Mollo
 2ª série do Ensino Médio Tarde e Noite Profª Luciana Mollo O que é? FOTOSSÍNTESE A fotossíntese é um processo realizado pelas plantas para produção de seu próprio alimento. Onde ocorre a fotossíntese?
2ª série do Ensino Médio Tarde e Noite Profª Luciana Mollo O que é? FOTOSSÍNTESE A fotossíntese é um processo realizado pelas plantas para produção de seu próprio alimento. Onde ocorre a fotossíntese?
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
 UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA YUGO LIMA MELO PEROXIDASE DE GLUTATIONA MITOCONDRIAL DE ARROZ É
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA YUGO LIMA MELO PEROXIDASE DE GLUTATIONA MITOCONDRIAL DE ARROZ É
Cinética Enzimática. Prof Karine P. Naidek Novembro/2016
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Cinética Enzimática Prof Karine P. Naidek Novembro/2016 Cinética das Reações Bioquímicas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Cinética Enzimática Prof Karine P. Naidek Novembro/2016 Cinética das Reações Bioquímicas
Fase clara. Fase escura
 Fotossíntese Fase clara Fase escura Hipótese Quimiosmótica (Mitchell, 1966) Explica como a fonte de energia e a síntese do ATP são acoplados, Hidrólise do ATP ou a transferência de elétrons geram: Potencial
Fotossíntese Fase clara Fase escura Hipótese Quimiosmótica (Mitchell, 1966) Explica como a fonte de energia e a síntese do ATP são acoplados, Hidrólise do ATP ou a transferência de elétrons geram: Potencial
Como as mudanças climáticas afetam a ecofisiologia vegetal? Anderson Kikuchi Calzavara
 Como as mudanças climáticas afetam a ecofisiologia vegetal? Anderson Kikuchi Calzavara anderson.calzavara@hotmail.com Reações luminosas (Fluorômetro) Reações de carboxilação (IRGA) IRGA (Analisador de
Como as mudanças climáticas afetam a ecofisiologia vegetal? Anderson Kikuchi Calzavara anderson.calzavara@hotmail.com Reações luminosas (Fluorômetro) Reações de carboxilação (IRGA) IRGA (Analisador de
FOTOSSÍNTESE COLÉGIO DELTA PROFESSOR FLÁUDIO
 FOTOSSÍNTESE COLÉGIO DELTA PROFESSOR FLÁUDIO A fotossíntese é o processo pelo qual a planta sintetiza compostos orgânicos a partir da presença de luz, água e gás carbônico. Ela é fundamental para a manutenção
FOTOSSÍNTESE COLÉGIO DELTA PROFESSOR FLÁUDIO A fotossíntese é o processo pelo qual a planta sintetiza compostos orgânicos a partir da presença de luz, água e gás carbônico. Ela é fundamental para a manutenção
Água A queda do teor de água, nas células e no organismo, abaixo de certo limite, gera uma situação de desequilíbrio hidrossalino, com repercussões
 A Química da Vida Água A queda do teor de água, nas células e no organismo, abaixo de certo limite, gera uma situação de desequilíbrio hidrossalino, com repercussões nos mecanismos osmóticos e na estabilidade
A Química da Vida Água A queda do teor de água, nas células e no organismo, abaixo de certo limite, gera uma situação de desequilíbrio hidrossalino, com repercussões nos mecanismos osmóticos e na estabilidade
Processo de obtenção de energia das células respiração celular
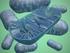 Processo de obtenção de energia das células respiração celular Lipídeos de armazenamento (Gorduras e óleos) Substâncias que originam ácidos graxos e usadas como moléculas que armazenam energia nos seres
Processo de obtenção de energia das células respiração celular Lipídeos de armazenamento (Gorduras e óleos) Substâncias que originam ácidos graxos e usadas como moléculas que armazenam energia nos seres
Metabolismo de glicogênio. Via das pentose-fosfatos. Prof. Dr. Henning Ulrich
 Metabolismo de glicogênio e Via das pentose-fosfatos Prof. Dr. Henning Ulrich Metabolismo de glicogênio Amido Glicogênio Polissacarídeos Plantas Animais Polissacarídeos - Glicogênio São polímeros de α-d-glicose,
Metabolismo de glicogênio e Via das pentose-fosfatos Prof. Dr. Henning Ulrich Metabolismo de glicogênio Amido Glicogênio Polissacarídeos Plantas Animais Polissacarídeos - Glicogênio São polímeros de α-d-glicose,
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
MÓDULO 2 - METABOLISMO. Bianca Zingales IQ-USP
 MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
MÓDULO 2 - METABOLISMO Bianca Zingales IQ-USP INTRODUÇÃO AO METABOLISMO CARACTERÍSTICAS DO SER VIVO 1- AUTO-REPLICAÇÃO Capacidade de perpetuação da espécie 2- TRANSFORMAÇÃO DE ENERGIA O ser vivo extrai
TRABALHO DE BIOLOGIA QUÍMICA DA VIDA
 TRABALHO DE BIOLOGIA QUÍMICA DA VIDA Água Sais minerais Vitaminas Carboidratos Lipídios Proteínas Enzimas Ácidos Núcleos Arthur Renan Doebber, Eduardo Grehs Água A água é uma substância química composta
TRABALHO DE BIOLOGIA QUÍMICA DA VIDA Água Sais minerais Vitaminas Carboidratos Lipídios Proteínas Enzimas Ácidos Núcleos Arthur Renan Doebber, Eduardo Grehs Água A água é uma substância química composta
Obtenção de nutrientes pelos seres vivos
 Professora Priscila F Binatto Agosto/ 2015 ENERGIA Obtenção de nutrientes pelos seres vivos Autótrofos Realização de fotossíntese Heterótrofos Obtenção da glicose pronta a partir de outra fonte RESPIRAÇÃO
Professora Priscila F Binatto Agosto/ 2015 ENERGIA Obtenção de nutrientes pelos seres vivos Autótrofos Realização de fotossíntese Heterótrofos Obtenção da glicose pronta a partir de outra fonte RESPIRAÇÃO
Obtenção de nutrientes pelos seres vivos
 Professora Priscila F Binatto Setembro/ 2016 ENERGIA Obtenção de nutrientes pelos seres vivos Autótrofos Realização de fotossíntese Heterótrofos Obtenção da glicose pronta a partir de outra fonte RESPIRAÇÃO
Professora Priscila F Binatto Setembro/ 2016 ENERGIA Obtenção de nutrientes pelos seres vivos Autótrofos Realização de fotossíntese Heterótrofos Obtenção da glicose pronta a partir de outra fonte RESPIRAÇÃO
Todos tem uma grande importância para o organismo.
 A Química da Vida ÁGUA A água é um composto químico formado por dois átomos de hidrogênio e um de oxigênio. Sua fórmula química é H2O. A água pura não possui cheiro nem cor. Ela pode ser transformada em
A Química da Vida ÁGUA A água é um composto químico formado por dois átomos de hidrogênio e um de oxigênio. Sua fórmula química é H2O. A água pura não possui cheiro nem cor. Ela pode ser transformada em
Glicose / carboidratos Ácidos graxos Aminoácidos. Acetil-CoA. Ciclo de Krebs (NADH e FADH 2 )
 A fosforilação oxidativa (FO) é o estágio final do metabolismo produtor de energia nos organismos aeróbicos Nessa etapa toda a energia produzida (na forma de carreadores de elétrons) durante a oxidação
A fosforilação oxidativa (FO) é o estágio final do metabolismo produtor de energia nos organismos aeróbicos Nessa etapa toda a energia produzida (na forma de carreadores de elétrons) durante a oxidação
Metabolismo Energético. Professora: Luciana Ramalho 2017
 Metabolismo Energético Professora: Luciana Ramalho 2017 Metabolismo Energético Respiração celular Exergônica Catabolismo Produção de energia Ocorre na Mitocôndria Fotossíntese Endergônica Anabolismo Produção
Metabolismo Energético Professora: Luciana Ramalho 2017 Metabolismo Energético Respiração celular Exergônica Catabolismo Produção de energia Ocorre na Mitocôndria Fotossíntese Endergônica Anabolismo Produção
Variam em: localização, abundancia, forma... Axonema flagelar
 Mitocôndrias Variam em: localização, abundancia, forma... Axonema flagelar Matriz Membrana interna (Impermeável a íons) Membrana externa Espaço Intermembranas ou intermembanoso A origem das mitocôndrias:
Mitocôndrias Variam em: localização, abundancia, forma... Axonema flagelar Matriz Membrana interna (Impermeável a íons) Membrana externa Espaço Intermembranas ou intermembanoso A origem das mitocôndrias:
BIJ Bases Conceituais da Energia
 BIJ0207-15 Bases Conceituais da Energia Prof. Dr. José Antonio Souza Aula 3 Origem: Interações fundamentais Gravitacional Eletromagnética Nuclear Energia potencial gravitacional Energ. Potencial Eletrostática
BIJ0207-15 Bases Conceituais da Energia Prof. Dr. José Antonio Souza Aula 3 Origem: Interações fundamentais Gravitacional Eletromagnética Nuclear Energia potencial gravitacional Energ. Potencial Eletrostática
Matéria: Biologia Assunto: Respiração celular Prof. Enrico blota
 Matéria: Biologia Assunto: Respiração celular Prof. Enrico blota Biologia 1. Moléculas, células e tecidos - Fotossíntese e respiração - Respiração celular Fermentação Organismos que só vivem na presença
Matéria: Biologia Assunto: Respiração celular Prof. Enrico blota Biologia 1. Moléculas, células e tecidos - Fotossíntese e respiração - Respiração celular Fermentação Organismos que só vivem na presença
Lipídios. 1. Importância: 2. Lipídios de armazenamento: São as gorduras e óleos 25/11/2012. Aula 2 Estrutura de. Lipídios
 Universidade Federal de Pelotas Disciplina de Bioquímica Lipídios Aula 2 Estrutura de Lipídios Os lipídios apesar de quimicamente diferentes entre si, exibem como característica definidora e comum a insolubilidade
Universidade Federal de Pelotas Disciplina de Bioquímica Lipídios Aula 2 Estrutura de Lipídios Os lipídios apesar de quimicamente diferentes entre si, exibem como característica definidora e comum a insolubilidade
A teoria dos orbitais moleculares
 A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
Introdução ao Metabolismo Microbiano
 Introdução ao Metabolismo Microbiano METABOLISMO DEFINIÇÃO: Grego: metabole = mudança, transformação; Toda atividade química realizada pelos organismos; São de dois tipos: Envolvem a liberação de energia:
Introdução ao Metabolismo Microbiano METABOLISMO DEFINIÇÃO: Grego: metabole = mudança, transformação; Toda atividade química realizada pelos organismos; São de dois tipos: Envolvem a liberação de energia:
CITOLOGIA IV (UECE/ENEM) Profa Eduarda de Souza
 CITOLOGIA IV (UECE/ENEM) Profa Eduarda de Souza Alimentos e Energia Ligações químicas Metabolismo Metabolismo capacidade de transformar substâncias de acordo com o interesse Anabolismo: produção de novas
CITOLOGIA IV (UECE/ENEM) Profa Eduarda de Souza Alimentos e Energia Ligações químicas Metabolismo Metabolismo capacidade de transformar substâncias de acordo com o interesse Anabolismo: produção de novas
NANOMAX NANOTECNOLOGIA NO COMBATE AOS RADICAIS LIVRES
 NANOMAX NANOTECNOLOGIA NO COMBATE AOS RADICAIS LIVRES A pele é o maior órgão do corpo humano, e é responsável por cerca de 16% do peso corporal total. As principais funções da pele são proteger o corpo
NANOMAX NANOTECNOLOGIA NO COMBATE AOS RADICAIS LIVRES A pele é o maior órgão do corpo humano, e é responsável por cerca de 16% do peso corporal total. As principais funções da pele são proteger o corpo
A fotossíntese: É um processo pelo qual a energia luminosa possibilita a redução de carbono e oxidação de água
 Fotossintese A fotossíntese: É um processo pelo qual a energia luminosa possibilita a redução de carbono e oxidação de água Os carboidratos produzidos servem como fonte de energia para o organismo Dois
Fotossintese A fotossíntese: É um processo pelo qual a energia luminosa possibilita a redução de carbono e oxidação de água Os carboidratos produzidos servem como fonte de energia para o organismo Dois
Organelas Produtoras de energia
 Professora Priscila F Binatto Citologia - Maio/2015 CAP. 9 METABOLISMO ENERGÉTICO: RESPIRAÇÃO AERÓBIA E FERMENTAÇÃO Organelas Produtoras de energia Mitocôndrias Organização Morfológica Função Respiração
Professora Priscila F Binatto Citologia - Maio/2015 CAP. 9 METABOLISMO ENERGÉTICO: RESPIRAÇÃO AERÓBIA E FERMENTAÇÃO Organelas Produtoras de energia Mitocôndrias Organização Morfológica Função Respiração
LISTA DE EXERCÍCIOS 3º ANO
 Solvente dos líquidos orgânicos (sangue, linfa, substâncias intracelulares e material intercelular dos tecidos). Veículo de substâncias que passam através da membrana plasmática entre o meio extracelular
Solvente dos líquidos orgânicos (sangue, linfa, substâncias intracelulares e material intercelular dos tecidos). Veículo de substâncias que passam através da membrana plasmática entre o meio extracelular
TATIANE DE OLIVEIRA BARRETO AVALIAÇÃO DO ESTRESSE OXIDATIVO NOS TECIDOS CARDÍACO, HEPÁTICO, ESQUELÉTICO E RENAL NA DEFICIÊNCIA EM TIAMINA
 TATIANE DE OLIVEIRA BARRETO AVALIAÇÃO DO ESTRESSE OXIDATIVO NOS TECIDOS CARDÍACO, HEPÁTICO, ESQUELÉTICO E RENAL NA DEFICIÊNCIA EM TIAMINA Belo Horizonte MG 2012 TATIANE DE OLIVEIRA BARRETO AVALIAÇÃO DO
TATIANE DE OLIVEIRA BARRETO AVALIAÇÃO DO ESTRESSE OXIDATIVO NOS TECIDOS CARDÍACO, HEPÁTICO, ESQUELÉTICO E RENAL NA DEFICIÊNCIA EM TIAMINA Belo Horizonte MG 2012 TATIANE DE OLIVEIRA BARRETO AVALIAÇÃO DO
Biologia. Respiração Celular. Professor Enrico Blota.
 Biologia Respiração Celular Professor Enrico Blota www.acasadoconcurseiro.com.br Biologia RESPIRAÇÃO CELULAR A bioenergética é o estudo dos processos do metabolismo celular de produção e quebra de energia
Biologia Respiração Celular Professor Enrico Blota www.acasadoconcurseiro.com.br Biologia RESPIRAÇÃO CELULAR A bioenergética é o estudo dos processos do metabolismo celular de produção e quebra de energia
Nutrição e Nitrogênio
 Nutrição e Nitrogênio Rhodophyta Ipê Figure 2. Transcriptional profiles of genes differentially expressed in shoots of Arabidopsis plants subjected to N, P or K starvation. The number of genes responding
Nutrição e Nitrogênio Rhodophyta Ipê Figure 2. Transcriptional profiles of genes differentially expressed in shoots of Arabidopsis plants subjected to N, P or K starvation. The number of genes responding
BIOLOGIA. Moléculas, células e tecidos. Respiração celular e fermentação Parte 1. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos Parte 1 Professor: Alex Santos Tópicos em abordagem: Parte 1 Respiração celular I Conceitos fundamentais; II Etapas da respiração celular; Parte 2 Respiração celular
BIOLOGIA Moléculas, células e tecidos Parte 1 Professor: Alex Santos Tópicos em abordagem: Parte 1 Respiração celular I Conceitos fundamentais; II Etapas da respiração celular; Parte 2 Respiração celular
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL CENTRO DE BIOTECNOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL CENTRO DE BIOTECNOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR ANÁLISE FUNCIONAL DAS ISOFORMAS CITOSÓLICAS E PEROXISSOMAIS DE ASCORBATO PEROXIDASE
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL CENTRO DE BIOTECNOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR ANÁLISE FUNCIONAL DAS ISOFORMAS CITOSÓLICAS E PEROXISSOMAIS DE ASCORBATO PEROXIDASE
ATP e NADPH formados na fase luminosa vão ser fonte de energia para a síntese de carboidratos a partir de CO 2
 Reações luminosas e de assimilação de Carbono são duas fases da fotossíntese ATP e NADPH formados na fase luminosa vão ser fonte de energia para a síntese de carboidratos a partir de CO 2 luz induz fluxo
Reações luminosas e de assimilação de Carbono são duas fases da fotossíntese ATP e NADPH formados na fase luminosa vão ser fonte de energia para a síntese de carboidratos a partir de CO 2 luz induz fluxo
