Impacto da qualidade da água subterrânea nas águas superficiais e ecossistemas associados
|
|
|
- Vinícius Salazar Alencar
- 6 Há anos
- Visualizações:
Transcrição
1 Tema da aula: Impacto da qualidade da água subterrânea nas águas superficiais e ecossistemas associados M. Teresa Condesso de Melo (teresa.melo@ist.utl.pt)
2 Factores ambientais dinâmicos que regulam grande parte da estrutura e funcionamento dos ecossistemas de água doce: 1. Fluxo de água (detemina aslinhase velocidades d de fluxo) 2. Sedimentos e a matéria orgânica (produzem e armazenam os nutrientes que abastecem a vida animal e vegetal) 3. Temperatura e penetração de luz (regula as velocidades dos processos metabólicos, e portanto da produtividade metabólica dos organismos aquáticos) 4. Condições químicas e de nutrientes (determinam a produtividade animal e vegetal, regulam o ph e outras condições químicas que condicionam a vida animal/ vegetal) 5. Associações animais e plantas (influencia directamente a velocidade dos principais processos nos ecossistemas)
3 Importância da água subterrânea na influência dos factores ambientais dinâmicos que regulam grande parte da estrutura e funcionamento dos ecossistemas de água doce: 1. Fluxo de água A água subterrânea garante fluxo linhas de água durante períodos secos (verão) 2. Sedimentos e a matéria orgânica As zonas de descarga de água subterrânea podem levar à deposição de sedimentos e à precipitação de novos sedimentos (Fe(OH) 3 ecaco 3 ) 3. Temperatura e penetração de luz Dd Dado queaágua subterrâneatemumatemperaturaaproximadamente constante, contribui para arrefecer as águas superficiais no verão, e arrefece las no inverno. Do ponto de vista da penetração da luz, as águas subterrâneas podem afectar a turbidez de uma água superficial.
4 Importância da água subterrânea na influência dos factores ambientais dinâmicos que regulam grande parte da estrutura e funcionamento dos ecossistemas de água doce: 4. Condições químicas e de nutrientes A água subterrânea como principal fonte nutrientes (C, N,S,P). 5. Associações animais e plantas Movimentação de micro organismos para colonizar as massas de água superficiais.
5
6
7 1. Composição química da água subterrânea A água subterrânea contém grande variedade de constituintes químicos inorgânicos dissolvidos, devido a: Interacções (biogeo)químicas entre a água, o solo e a atmosfera Interacções (biogeo)químicas entre a água e os materiaisgeológicos Influências humanas, sobretudo negativas (contaminação) A maioria dos constituintes encontra se na forma iónica na água; os iões são classificados de acordo com a concentração em que são geralmente encontrados: Iões maiores (> 1 mg/l): catiões: Na +, Ca 2+, Mg 2+ aniões: Cl, SO 2 4, HCO 3 Iões menores (0,01 10,0 mg/l): K +, Fe 2+, Sr 2+, B 3+, NO 3, F, CO Iões vestigiários (< 0,1 mg/l): Fe 3+, Al 3+, Cu 2+, Zn 2+, NH 4+, NO 2, etc.
8 1. Composição química da água subterrânea (cont.) Outros constituintes com importância na água subterrânea são os constituintes orgânicos e os gases dissolvidos (N 2, O 2, CO 2, CH 4, etc.). Asconcentrações dos vários constituintes na água são controladas fundamentalmente por: Disponibilidade nos solos e nas rochas, por onde a água circula; Factores geoquímicos: solubilidade dos minerais, capacidade de adsorção e troca iónica, cinética dos processos; A sequência pela qual a água entrou em contacto com os diversos minerais das rochas por onde a água circula; Influências humanas, que fazem com que certos constituintes menores e vestigiários, passem para concentrações com ordens de grandeza superiores às consideradas normais.
9 2. Parâmetros que caracterizam a água Conteúdo total de sólidos dissolvidos (TSD) Inglês: TDS total dissolved solids: determinado pesando o resíduo sólido que se obtém após secagem de uma amostra de água de volume conhecido e convenientemente filtrada. Unidades: mg/l; >2000 mg/l: água imprópria para consumo. Condutividade eléctrica (CE) Inglês: EC electrical conductivity: capacidade da água de se deixar atravessar pela corrente; indica o conteúdo em sais dissolvidos. A água pode ser vista como uma solução electrolítica: quase todos os constituintes maiores e menores estão presentes sob forma iónica. Unidades: µsiemens/cm, µs/cm (ms/m).
10 2. Parâmetros que caracterizam a água (cont.) Alcalinidade Inglês: Alkalinity: capacidade da água em neutralizar ácidos. Deve se principalmente aos carbonatos e bicarbonatos e, secundariamente, aos iões hidróxidos, silicatos, boratos, fosfatos e amónia. Alk Σ[HCO 3, CO 2 3 ], ph < 8: Alk [HCO 3 ] Unidades: mg/l ou meq/l CaCO 3 Dureza Inglês: hardness: soma das concentrações dos catiões metálicos multivalentes, Σ[Ca[ 2+, Mg 2+, Fe 2+ ] Dureza temporária: compensada pela concentração de HCO 3, removida por fervura Dureza permanente: em excesso relativamente ao HCO 3, compensada pela concentração de Cl, SO 2, NO 4 3 Unidades: mg/l ou meq/l CaCO 3, graus de dureza
11 2. Parâmetros que caracterizam a água (cont.) Potencial redox (Eh) Inglês: redox potential: mede a intensidade e sentido das reacções de oxidaçãoredução de uma água, i.e. a tendência de perder ou adquirir electrões, quando a suacomposição se altera. Unidades: volts (V)
12 3. Unidades de concentração As concentrações dos constituintes na água podem ser dadas em várias unidades. Um exemplo é mg/l ou µg/l, mas outras unidades são utilizadas frequentemente, por darem uma melhor ideia das concentrações relativas dos iões na água. mmol/l: provêm de moles por m 3, unidades do SI x 6,022 x (número de Avogadro) = quantidade de moléculas (iões) por m 3 de solução. A PM iões/litro mol/l g/l A PM Onde: A = Número de Avogadro PM = Peso Molecular (g/mol)
13 3. Unidades de concentração (cont.) meq/l: mili equivalentes por litro, unidades obtidas multiplicando a concentração de um ião em mmol/l pela sua carga eléctrica Útil para representar a distribuição das cargas na solução. Frequentemente utilizadas em representações gráficas de composições químicasdaságuassubterrâneas. subterrâneas.
14 catiões + aniões E.N. (%) = 100 catiões aniões 4. Precisão das análises químicas A conversão das unidades parameq/l serve também paracontrolar a precisão de uma análise, uma vez que a soma dos catiões e aniões em meq/l, ou seja, a soma de todas as cargas positivas e negativas deve ser 0 (água não tem carga). Para analisar a precisão de uma análise, pode se calcular a electroneutralidade (E.N.): Geralmente é suficiente incluir os catiões e aniões maiores no cálculo da E.N.. Valores de E.N. (também denominada erro da análise ) até 2 % (e 2 %) são inevitáveis no laboratório. Frequentemente aceitam se erros até ( )5 %. Para valores superiores a 5 % (ou inferiores a 5 %) há que se rever a análise.
15 4. Precisão das análises químicas (cont.) Outra técnica de controlo da qualidade da análise consiste na comparação do somatório dos aniões ou catiões com a condutividade eléctrica (CE) medida, com base na seguinte relação simplificada: Σcatiões = Σaniões = CE/100 com asconcentrações expressasem em meq/l e CE em µs/cm. Esta relação é válida até valores de CE de cerca de 2000 µs/cm. Grandes desvios à esta relação revelam erros na análise ou na medição da condutividade eléctrica.
16 5. Representação gráfica da composição química A representação gráfica de uma composição química aumenta significativamente a sua visualização e permite estudá la com mais facilidade e rapidez. Existem várias técnicas de representação gráfica de uma ou mais análises químicas. Gráfico em coluna Representam se os iões em duas colunas adjacentes (unidas), a partir de uma base comum. A coluna da esquerda representa os catiões, a coluna da direita os aniões. A altura das colunas é proporcional à soma total dos catiões e aniões em meq/l, representados nas respectivas colunas. Cada ião ocupa uma parte na coluna, conforme a sua concentração em meq/l. O gráfico resultante também é denominado diagrama de Collins. K + Na + Mg 2+ Ca 2+ NO 3 - Cl - SO 4 2- SO 4 HCO 3 -
17 5. Representação gráfica da composição química (cont.) Diagrama circular Neste caso, os iões maiores são representados num círculo com raio proporcional à soma total dos iões (em meq/l) representados no diagrama. Divide se o círculo em duas metades. Na metade superior representam se os catiões e na metade inferior os aniões. A área de cada um dos iões dentro do círculo é proporcional à sua concentração relativa (em % de meq/l). Ca Mg Na + K + NO 3 - HCO - 3 Cl - SO
18 5. Representação gráfica da composição química (cont.) Diagrama Stiff Diagrama muito utilizado. K (10 x) Na+K Cl Consiste num polígono que contorna tê três ouquatro rectas paralelas, ll igualmente espaçadas, cortadas por uma normal, dando assim três ou quatro semirectas à esquerda (catiões) e três ou quatro semirectas à direita (aniões). O comprimento das semirectas é proporcional à concentração em meq/l dos respectivos iões que representam. Existem variantes do diagrama consoante a disposição e ordenação dos iões. Na variante aqui utilizada, a semirecta superior esquerda representa a soma das concentrações de Na + ek +, e o pequeno traço vertical por cima da recta indica até onde chegaaconcentração do K +. As concentrações de NO 3 efe 2+ também são incluídas neste diagrama. A escala do diagrama está indicado, tal como um factor de aumento do diagrama. Mg Ca Fe HCO3 NO3 1 cm = 1,0 meq/l SO4
19 5. Representação gráfica da composição química (cont.) Diagrama Piper O diagrama Piper é um dos diagramas mais aplicados, com vantagem de se poder representar mais que uma amostra. O diagrama consiste em dois diagramas triangulares que representam as concentrações relativas (% da soma total em meq/l) dos catiões e aniões, e num diagramacentral losangular que combina os dois diagramastriangulares. Primeiro, projectam se as concentrações relativas dos catiões (Ca 2+,Mg 2+ e(na + +K + )), no diagrama da esquerda, depoisasconcentrações relativas dos aniões (HCO 3 SO 2, 4 e Cl ) no diagrama da direita. A seguir, os pontos são transferidos para o diagrama central, traçando linhas paralelas aos limites exteriores, até estas se intersectarem. A sua intersecção resulta no ponto final no diagrama central
20 5. Representação gráfica da composição química (cont.) Diagrama Piper Do diagrama Piper existe apenas um único modelo. Fácies hidroquímica: Água cloretada sódicomagnesiana Fácies hidroquímica: Água bicarbonatada cálcica Ca (60%); Na (20%); Mg (20%) Ca (20%); Na (40%); Mg (40%) Cl (40%); HCO 3 (60%); SO 4 (0%) Cl (60%); HCO 3 (20%); SO 4 (20%)
21 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa Infiltração da água da chuva Emzonascosteirasaáguadaprecipitaçãotemasuaorigemmaioritariamentenaágua do mar e a sua composição química resulta da deposição da humidade e dos aerossóis marinhos. Por não existir fraccionamento dos constituintes maiores na água, a composição relativa da precipitação é idêntica à da água marinha (mas fortemente diluída). Durante o seu transporte sobre a terra, as massas de ar e as nuvens apanham poeiras e gases de origem natural e industrial, modificando assim a composição da água da chuva. Depois da precipitação ocorrer, a água da chuva está sujeita a evaporação e transpiração (pelas plantas); a evapotranspiração induz um factor de aumento da mineralização, não alterando porém a concentração relativa dos iões na água. Asrazõesentreosváriosiõesmantêm se constantes. São precisamente algumas destas razões que são bons indicadores dos processos hidrogeoquímicos.
22 Distribuição das isolinhas de 6.0 cloretos água da chuva de Portugal Continental: <2.0 o oceano é a fonte de cerca de 30% da água de precipitação continental junto à linha de costa a água da chuva é água do mar diluída as concentrações dos diversos elementos na água chuva variam durante o seu transporte em terra devido a razões diversas (evaporação, contaminação, combustão, mistura com o pó, gases, etc)
23 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Infiltração da água da chuva OiãoCl é considerado um ião conservativo: a concentração não é alterada por outros processos hidroquímicos. Por esta razão pode ser utilizado para calcular o factor de aumento induzido pela evapotranspiração e consequentemente para estimar a precipitação efectiva, ou seja, a % da água da chuva que chega ao aquífero: P - [Cl ] água da chuva 1 efectiva = 100 % = - [Cl ] Factor de aumento água subterrânea 100 % Multiplicando as concentrações dos outros iões maiores na água da chuva pelo factor de aumento, obtém se a composição conservativa da amostra de água subterrânea. Comparando a comasuacomposiçãoreal,obtém se uma ideia de quais os iões afectados por processos (bio)químicos.
24 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Dissolução de calcite Entre os processos que afectam a água que se infiltrou destaca se a dissolução de minerais presentes no solo e na rocha. A presença de minerais solúveis depende do tipode solo/rocha que a águaatravessa. atravessa Um mineral encontrado em abundância nos solos e nas rochas calcárias, é calcite. A sua dissolução contribui significativamente para a composição de muitas águas subterrâneas. Na ausência de CO 2, a reacção de dissolução de calcite pode ser escrita da seguinte maneira: CaCO 3 (s) Ca 2+ (aq) + CO 2 3 (aq) s = sólido K = [Ca 2+ ][CO 2-3 ] = 10 8,3 aq = em solução (aquosa) [Ca 2+ ] e [CO 2 3 ] são as actividades dos iões, que aqui se consideram iguais às concentrações em mol/l. K = constante de equilíbrio, indica a solubilidade do mineral, que diminui com o aumento da temperatura.
25 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Dissolução de calcite Uma vez que a reacção acima estabelecida representa transferências de massas molares, é possível deduzir que a dissolução de 1 mmol CaCO 3 resulta em 1 mmol Ca 2+ e 1 mmol CO 2 3 na água. ApresençadeCO 2 dissolvido na água aumenta significativamente a solubilidade de calcite. O CO 2 no solo provém da respiração da vegetação e da degradação da matéria orgânica. Por essa razão, a pressão de CO 2 (P CO2 ) no solo é superior à pressão na atmosfera. Dissolvido na água, CO 2 forma ácido carbónico (CO 2 +H 2 O H 2 CO 3 ), que por sua vez fornece protões (H + ) que se podem associar a CO 2 3 (proveniente da dissolução de calcite) para formar HCO 3.Emfórmula: CaCO 3 (s) + CO 2 (g) + H 2 O(l) Ca 2+ (aq) + 2HCO 3 (aq) g = gasoso [Ca ][HCO ] l = líquido 3 5,8 K = = 10 s = sólido P CO 2 Note se que: Ca 2+ /HCO 3 = 0,5 numa água em que houve (unicamente) dissolução de calcite.
26 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Intrusão marinha Em zonas costeiras, a sobre exploração dos aquíferos, para fins de consumo ou de rega agrícola, pode causar grandes rebaixamentos no potencial hidráulico, aumentando o risco de a água do mar entrar nos aquíferos e se misturar com a água doce (de baixa mineralização) residente. Este processo designa se por intrusão marinha. O fenómeno de intrusão marinha aumenta consideravelmente a mineralização da água subterrânea, o que se pode observar sobretudo nas concentrações de Na + ecl, os principais iões na água do mar. A mistura das águas não é conservativa, ou seja, induz várias ái reacções geoquímicas, que podem ser descobertas através dos ganhos ou das perdas em concentração dos iões na água após mistura. Calcula se a fracção de água marinha numa amostra com base na concentração de Cl, o ião conservativo, da seguinte maneira:
27 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Intrusão marinha Calcula se a fracção de água marinha numa amostra com base na concentração de Cl, o ião conservativo, da seguinte maneira: f mar = m Cl,amostra m Cl,mar m m Cl,água Cl,água doce doce m Cl,amostra, mcl,água doce em Cl,mar concentrações de Cl na amostra, em água doce e na água do mar, respectivamente.
28 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Intrusão marinha A concentração de um ião i na mistura conservativa de água doce e água do mar (ou seja, sem haver reacções geoquímicas), seria: m i,mist = f mar m i,mar + (1 f mar ) mi,água doce m i,mist i, m i,mar, m iá i,água doce : concentrações do ião i na mistura, na água do mar e na água doce, respectivamente (mmol/l). A mudança da concentração de um ião i resultante de reacções geoquímicas (não só de mistura), é calculada da seguinte forma: m i,reac = m i,amostra m i,mist m i,reac é a mudança da concentração do ião i m i,amostra a concentração do ião i na amostra.
29 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Troca catiónica Os solos e os aquíferos contêm vários ái materiais ii que conseguem retirar catiões da água por adsorção, incluindo argilas, matéria orgânica e hidróxidos. Estes materiais são chamados os permutadores do aquífero e encontram se em equilíbrio com a água subterrânea. Quando a composição da água subterrânea é alterada (por exemplo por intrusão marinha), o equilíbrio de catiões entre o material do aquífero e a água é perturbado. Os permutadores conseguem restabelecer bl o equilíbrio i através de troca catiónica, i libertando certos catiões à água e retirando outros. Quando na composição de água doce predominam os iões Ca 2+ ehco 3,devidoà dissolução de calcite, os permutadores no aquífero têm em maioria Ca 2+ adsorvido às superfícies. Quando se dá intrusão de água marinha num aquífero de água doce, os permutadores começam a restabelecer o equilíbrio quebrado. A reacção de troca catiónica: Na + +½Ca X 2 Na X+½Ca 2+, X = permutador do solo (argila ou m.o.).
30 6. Evolução hidrogeoquímica da água exemplo de uma zona junto à costa (cont) Troca catiónica Como consequência, a água no aquífero passa a ter menos Na + e mais Ca 2+. A razão Na + /Cl começa a descer para valores inferiores a 0,86, o valor típico na água marinha, mas também nas águas subterrâneas em zonas costeiras que provêm directamente das águas de chuva. O aumento da concentração de Ca 2+ na água aumenta também a razão Ca 2+ /HCO 3. Se antes da troca catiónica e enriquecimento em Ca 2+, a água já se encontrava saturada relativamente a calcite (CaCO 3 ), esse enriquecimento provoca a precipitação do mineral: Ca 2+ (aq) + 2HCO 3 (aq) CaCO 3 (s) + CO 2 (g) + H 2 O(l) O Ca 2+ e o Na + geralmente são os principais catiões que participam no processo de troca catiónica, uma vez que são os catiões dominantes na água doce e água marinha, respectivamente. No entanto, outros catiões, como o Mg 2+, K +, NH + 4+ também podem participar.
31
Classificacao e Caracterizacao de Aguas, Principais Ioes Inorganicos (2)
 26/01/2004 1 Classificacao e Caracterizacao de Aguas, Principais Ioes Inorganicos (2) Alice Newton Universidade do Algarve Mestrado: Qualidade em Analises Quimicas FCT-Gambelas 26/01/2004 2 Programa deste
26/01/2004 1 Classificacao e Caracterizacao de Aguas, Principais Ioes Inorganicos (2) Alice Newton Universidade do Algarve Mestrado: Qualidade em Analises Quimicas FCT-Gambelas 26/01/2004 2 Programa deste
Composição da água do mar
 Composição da água do mar Vanessa Hatje Sumário das propriedades da água Pontes de Hidrogênio são responsáveis pelo alto calor latente de fusão e evaporação e alta capacidade calorífica da água. Transporte
Composição da água do mar Vanessa Hatje Sumário das propriedades da água Pontes de Hidrogênio são responsáveis pelo alto calor latente de fusão e evaporação e alta capacidade calorífica da água. Transporte
2.3.1Mineralização das águas e processos de dissolução
 2.3.1Mineralização das águas e processos de dissolução As águas naturais são na verdade soluções aquosas, não contêm apenas água, mas também substâncias dissolvidas. A facilidade de dissolução das substâncias
2.3.1Mineralização das águas e processos de dissolução As águas naturais são na verdade soluções aquosas, não contêm apenas água, mas também substâncias dissolvidas. A facilidade de dissolução das substâncias
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
Composição da água do mar. Salinidade nos oceanos. Composição da água do mar. Vanessa Hatje. Média Hipersalinos S > 40. Hiposalinos S < 25
 Composição da água do mar Vanessa Hatje Salinidade nos oceanos Média 33 37 Hipersalinos S > 40 Mar Morto, Vermelho Hiposalinos S < 25 Estuários e baías costeiras Composição da água de mar é constante de
Composição da água do mar Vanessa Hatje Salinidade nos oceanos Média 33 37 Hipersalinos S > 40 Mar Morto, Vermelho Hiposalinos S < 25 Estuários e baías costeiras Composição da água de mar é constante de
O SOLO COMO F0RNECEDOR DE NUTRIENTES
 O SOLO COMO F0RNECEDOR DE NUTRIENTES LIQUIDA (SOLUÇÃO DO SOLO) ÍONS INORGÂNICOS E ORGÂNICOS/MICROPOROS SÓLIDA - RESERVATORIO DE NUTRIENTES - SUPERFÍCIE QUE REGULA A CONCENTRAÇÃO DOS ELEMENTOS NA SOLUÇÃO
O SOLO COMO F0RNECEDOR DE NUTRIENTES LIQUIDA (SOLUÇÃO DO SOLO) ÍONS INORGÂNICOS E ORGÂNICOS/MICROPOROS SÓLIDA - RESERVATORIO DE NUTRIENTES - SUPERFÍCIE QUE REGULA A CONCENTRAÇÃO DOS ELEMENTOS NA SOLUÇÃO
ph DAS ÁGUAS NATURAIS.
 TRABALHO Nº 3 ph DAS ÁGUAS NATURAIS. ACIDEZ (PH) POR MEDIDA ELECTROMÉTRICA. OBJECTIVOS 1) Familiarizar os alunos com o ph e o método corrente de determinação. 2) Constituição das águas naturais (CO 2,
TRABALHO Nº 3 ph DAS ÁGUAS NATURAIS. ACIDEZ (PH) POR MEDIDA ELECTROMÉTRICA. OBJECTIVOS 1) Familiarizar os alunos com o ph e o método corrente de determinação. 2) Constituição das águas naturais (CO 2,
Salinização do Solo: Causas e Prevenção
 Salinização do Solo: Causas e Prevenção M. C. Gonçalves, J. C. Martins, T. B. Ramos INIAV UEIS Sistemas Agrários e Florestais e Sanidade Vegetal Laboratório de Solos, Oeiras Av. da República, Quinta do
Salinização do Solo: Causas e Prevenção M. C. Gonçalves, J. C. Martins, T. B. Ramos INIAV UEIS Sistemas Agrários e Florestais e Sanidade Vegetal Laboratório de Solos, Oeiras Av. da República, Quinta do
Estudo da interacção água subterrânea/água superficial nos sistemas associados à Lagoa de Albufeira, em periodo de barra aberta
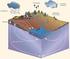 Estudo da interacção água subterrânea/água superficial nos sistemas associados à Lagoa de Albufeira, em periodo de barra aberta Ana Sofia Duarte Paula G. Fernandes M. Rosário Carvalho 1. Introdução e objectivos
Estudo da interacção água subterrânea/água superficial nos sistemas associados à Lagoa de Albufeira, em periodo de barra aberta Ana Sofia Duarte Paula G. Fernandes M. Rosário Carvalho 1. Introdução e objectivos
MINERALIZAÇÃO E DESMINERALIZAÇÃO DA ÁGUA
 MINERALIZAÇÃO E DESMINERALIZAÇÃO DA ÁGUA Dissolução; Solubilidade; Produto de solubilidade; Precipitação; Mineralização e desmineralização das águas. Água do Mar Ó mar salgado, Quanto do teu sal são lágrimas
MINERALIZAÇÃO E DESMINERALIZAÇÃO DA ÁGUA Dissolução; Solubilidade; Produto de solubilidade; Precipitação; Mineralização e desmineralização das águas. Água do Mar Ó mar salgado, Quanto do teu sal são lágrimas
SOLUÇÃO DO SOLO. Atributos físicos e químicos do solo -Aula 10- Prof. Alexandre Paiva da silva. Sólida Gasosa (CO 2.
 SOLUÇÃO DO SOLO Atributos físicos e químicos do solo -Aula 10- Prof. Alexandre Paiva da silva 1. GENERALIDADES Solo: 3 fases Sólida Gasosa (CO 2, O 2, N 2 ) Líquida (H 2 O, íons, moléculas, CO 2, O 2 )
SOLUÇÃO DO SOLO Atributos físicos e químicos do solo -Aula 10- Prof. Alexandre Paiva da silva 1. GENERALIDADES Solo: 3 fases Sólida Gasosa (CO 2, O 2, N 2 ) Líquida (H 2 O, íons, moléculas, CO 2, O 2 )
Relações Mássicas em Reacções Químicas
 Relações Mássicas em Reacções Químicas Química - Aula 2 Massa Atómica N.º de Avogadro e Massa Molar Massa Molecular Reacções Químicas e Equações Químicas Quantidades de Reagentes e Produtos 1 Mundo Micro
Relações Mássicas em Reacções Químicas Química - Aula 2 Massa Atómica N.º de Avogadro e Massa Molar Massa Molecular Reacções Químicas e Equações Químicas Quantidades de Reagentes e Produtos 1 Mundo Micro
QUÍMICA GERAL Ácidos e Bases
 QUÍMICA GERAL Ácidos e Bases Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia 1 Produto iônico da água A água
QUÍMICA GERAL Ácidos e Bases Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia 1 Produto iônico da água A água
3 ÁGUA DO MAR. Cl Na SO4 Mg Ca K outros sais. Figura 3.1- Abundância relativa dos principais sais presentes na água do mar 1% 4% 8% 54% 31%
 3 ÁGUA DO MAR O Oceano consiste de água. Essa aparentemente simples afirmativa, guarda consigo uma importante constatação: para que seja possível estudar o mar é preciso ter em mente que é indispensável
3 ÁGUA DO MAR O Oceano consiste de água. Essa aparentemente simples afirmativa, guarda consigo uma importante constatação: para que seja possível estudar o mar é preciso ter em mente que é indispensável
RESERVAS ESTRATÉGICAS DE ÁGUA SUBTERRÂNEA NA REGIÃO CENTRO (PROJECTO IMAGES)
 Teresa CONDESSO de MELO (1, 4) ; Judite FERNANDES (2) ; Carla MIDÕES (2) ; Carlos COSTA ALMEIDA (2) ; Helena AMARAL (2) ; Ana Rita GOMES (3) ; Maria José MADRUGA (3) ; Manuel MARQUES da SILVA (4) ; João
Teresa CONDESSO de MELO (1, 4) ; Judite FERNANDES (2) ; Carla MIDÕES (2) ; Carlos COSTA ALMEIDA (2) ; Helena AMARAL (2) ; Ana Rita GOMES (3) ; Maria José MADRUGA (3) ; Manuel MARQUES da SILVA (4) ; João
Vestibular Nacional Unicamp 1998
 Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
PARÂMETROS DE CARACTERIZAÇÃO DE UMA MASSA DE ÁGUA. As características organolépticas compreendem a cor, o cheiro e o sabor.
 PARÂMETROS DE CARACTERIZAÇÃO DE UMA MASSA DE ÁGUA Características Organolépticas: As características organolépticas compreendem a cor, o cheiro e o sabor. Origem da Cor: origem natural inorgânica, (p.ex.
PARÂMETROS DE CARACTERIZAÇÃO DE UMA MASSA DE ÁGUA Características Organolépticas: As características organolépticas compreendem a cor, o cheiro e o sabor. Origem da Cor: origem natural inorgânica, (p.ex.
Escola Secundária de Lagoa. Ficha de Trabalho 16. Exercícios. Física e Química A 11º Ano Paula Melo Silva
 Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva Exercícios Ficha de Trabalho 16 Global 1. Um certo ião negativo, X 3-, tem um número total de eletrões de 18 e o seu número de massa
Escola Secundária de Lagoa Física e Química A 11º Ano Paula Melo Silva Exercícios Ficha de Trabalho 16 Global 1. Um certo ião negativo, X 3-, tem um número total de eletrões de 18 e o seu número de massa
Equilíbrio de solubilidade
 Equilíbrio de solubilidade Solubilidade É a quantidade máxima de soluto que se pode dissolver numa certa quantidade de solvente, a uma dada temperatura e pressão. Solubilidade se sais em água: Regra geral
Equilíbrio de solubilidade Solubilidade É a quantidade máxima de soluto que se pode dissolver numa certa quantidade de solvente, a uma dada temperatura e pressão. Solubilidade se sais em água: Regra geral
Física e Química A 715 (versão 1)
 Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
PROCESSOS DE RETENÇÃO E MOVIMENTO DE CONTAMINANTES ORGÂNICOS E INORGÂNICOS EM SOLOS E AQUÍFEROS
 UNIVERSIDADE DE SÃO PAULO Escola Superior de Agricultura Luiz de Queiroz Departamento de Ciência do Solo LSO - 0257 - Fundamentos de Ciência do Solo PROCESSOS DE RETENÇÃO E MOVIMENTO DE CONTAMINANTES ORGÂNICOS
UNIVERSIDADE DE SÃO PAULO Escola Superior de Agricultura Luiz de Queiroz Departamento de Ciência do Solo LSO - 0257 - Fundamentos de Ciência do Solo PROCESSOS DE RETENÇÃO E MOVIMENTO DE CONTAMINANTES ORGÂNICOS
Ciclos Biogeoquímicos
 Ciclos Biogeoquímicos Matéria orgânica: são os restos dos seres vivos. É composta essencialmente de compostos de carbono. Decompositores: são responsáveis pela degradação da matéria orgânica e favorecem
Ciclos Biogeoquímicos Matéria orgânica: são os restos dos seres vivos. É composta essencialmente de compostos de carbono. Decompositores: são responsáveis pela degradação da matéria orgânica e favorecem
Ciclos Biogeoquímicos
 Ciclos Biogeoquímicos Disciplina de Biologia Profa. Daniela Bueno Sudatti Livro 3, Parte III Cap 10.4 O Que é? Circulação de matéria (orgânica e inorgânica) no planeta. BIOSFERA HIDROSFERA ATMOSFERA LITOSFERA
Ciclos Biogeoquímicos Disciplina de Biologia Profa. Daniela Bueno Sudatti Livro 3, Parte III Cap 10.4 O Que é? Circulação de matéria (orgânica e inorgânica) no planeta. BIOSFERA HIDROSFERA ATMOSFERA LITOSFERA
I. Reações químicas. 2.4 Reações de precipitação. Os sais e a sua solubilidade em água
 I. Reações químicas Os sais e a sua solubilidade em água Os sais são substâncias muito comuns e são formados por iões positivos e iões negativos sendo sólidos à temperatura ambiente. Exemplos: 1 Os sais
I. Reações químicas Os sais e a sua solubilidade em água Os sais são substâncias muito comuns e são formados por iões positivos e iões negativos sendo sólidos à temperatura ambiente. Exemplos: 1 Os sais
INTERACÇÃO ÁGUA-ROCHA O caso das rochas ígneas, sedimentares e metamórficas
 INTERACÇÃO ÁGUA-ROCHA O caso das rochas ígneas, sedimentares e metamórficas As rochas apresentam composições mineralógicas variáveis, As condições climáticas, a composição da água de recarga, o tempo de
INTERACÇÃO ÁGUA-ROCHA O caso das rochas ígneas, sedimentares e metamórficas As rochas apresentam composições mineralógicas variáveis, As condições climáticas, a composição da água de recarga, o tempo de
AULA 10 EQUILÍBRIO DE SOLUBILIDADE
 Fundamentos de Química Analítica (009) AULA 10 EQUILÍBRIO DE SOLUBILIDADE OBJETIVOS Definir solubilidade do soluto. Definir solução saturada, não saturada e supersaturada. Conhecer as regras de solubilidade.
Fundamentos de Química Analítica (009) AULA 10 EQUILÍBRIO DE SOLUBILIDADE OBJETIVOS Definir solubilidade do soluto. Definir solução saturada, não saturada e supersaturada. Conhecer as regras de solubilidade.
LISTA DE EXERCÍCIOS 3º ANO
 a) Balão I: 1 elemento e 1 substância simples. Balão II: 4 elementos e 2 substâncias simples. Total de elementos diferentes: 5 Total de substâncias simples: b) Balão I: sistema homogêneo. Balão II: sistema
a) Balão I: 1 elemento e 1 substância simples. Balão II: 4 elementos e 2 substâncias simples. Total de elementos diferentes: 5 Total de substâncias simples: b) Balão I: sistema homogêneo. Balão II: sistema
Exercícios de Equilíbrio Iônico I
 Exercícios de Equilíbrio Iônico I 1. Uma substância química é considerada ácida devido a sua tendência em doar íons H + em solução aquosa. A constante de ionização Ka é a grandeza utilizada para avaliar
Exercícios de Equilíbrio Iônico I 1. Uma substância química é considerada ácida devido a sua tendência em doar íons H + em solução aquosa. A constante de ionização Ka é a grandeza utilizada para avaliar
Laboratório de Química dos Elementos QUI
 ÁGUA DURA A dureza da água pode ter origem natural por contato da água com o solo, onde a presença de dióxido de carbono dissolvido na água provoca a solução de sais pouco solúveis. Em depósitos subterrâneos,
ÁGUA DURA A dureza da água pode ter origem natural por contato da água com o solo, onde a presença de dióxido de carbono dissolvido na água provoca a solução de sais pouco solúveis. Em depósitos subterrâneos,
BC Transformações Químicas
 Transformações Químicas BC0307 Prof. Anderson O. Ribeiro http://www.andersonorzari.com BC 0307 Transformações Químicas ANDERSON ORZARI RIBEIRO Bloco B, 10º andar - Sala 1043 www.andersonorzari.com Transformações
Transformações Químicas BC0307 Prof. Anderson O. Ribeiro http://www.andersonorzari.com BC 0307 Transformações Químicas ANDERSON ORZARI RIBEIRO Bloco B, 10º andar - Sala 1043 www.andersonorzari.com Transformações
Exercícios de Equilíbrio Iônico II
 Exercícios de Equilíbrio Iônico II 1. Com relação às funções inorgânicas, assinale a alternativa incorreta. a) O acetato de sódio é um sal de características básicas, pois é resultante da reação entre
Exercícios de Equilíbrio Iônico II 1. Com relação às funções inorgânicas, assinale a alternativa incorreta. a) O acetato de sódio é um sal de características básicas, pois é resultante da reação entre
ÁGUA SUBTERRÂNEA BAIXO MONDEGO
 ÁGUA SUBTERRÂNEA BAIXO MONDEGO Ana Isabel Andrade Departamento de Ciências da Terra FCTUC ÁGUA SUBTERRÂNEA BAIXO MONDEGO Enquadramento geológico NW SE Quaternário: depósitos aluvionares Mesozóico: formações
ÁGUA SUBTERRÂNEA BAIXO MONDEGO Ana Isabel Andrade Departamento de Ciências da Terra FCTUC ÁGUA SUBTERRÂNEA BAIXO MONDEGO Enquadramento geológico NW SE Quaternário: depósitos aluvionares Mesozóico: formações
mol / kg de água do mar NaCl 0,4186 MgCl 2 0,0596 Na 2 SO 4 0,02856
 QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 5 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
Características hidroquímicas e hidrodinâmicas do aquífero na planície arenosa da Costa da Caparica
 Características hidroquímicas e hidrodinâmicas do aquífero na planície arenosa da Costa da Caparica Frederico FERREIRA1, M. Rosário CARVALHO2, Manuela SIMÕES3, Catarina SILVA2, Paula GALEGO FERNANDES2
Características hidroquímicas e hidrodinâmicas do aquífero na planície arenosa da Costa da Caparica Frederico FERREIRA1, M. Rosário CARVALHO2, Manuela SIMÕES3, Catarina SILVA2, Paula GALEGO FERNANDES2
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Escola: Nome: Turma: N.º: Data: / / FICHA DE TRABALHO. salgada gasoso água subterrânea. 70% doce água superficial. sólido 30% líquido
 Conteúdo: Água: Distribuição na Natureza salgada gasoso água subterrânea 70% doce água superficial sólido 30% líquido A água existe na Natureza no estado sólido, líquido e gasoso. No estado das altas montanhas;
Conteúdo: Água: Distribuição na Natureza salgada gasoso água subterrânea 70% doce água superficial sólido 30% líquido A água existe na Natureza no estado sólido, líquido e gasoso. No estado das altas montanhas;
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA II
 INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA II ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os materiais
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA II ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os materiais
Ciências Naturais, 5º Ano. Ciências Naturais, 5º Ano FICHA DE TRABALHO FICHA DE TRABALHO
 Conteúdo: Água: Distribuição na Natureza salgada gasoso água subterrânea Conteúdo: Água: Distribuição na Natureza salgada gasoso água subterrânea 70% doce água superficial 70% doce água superficial sólido
Conteúdo: Água: Distribuição na Natureza salgada gasoso água subterrânea Conteúdo: Água: Distribuição na Natureza salgada gasoso água subterrânea 70% doce água superficial 70% doce água superficial sólido
SOLUÇÃO DO SOLO. Atributos físicos e químicos do solo -Aula 10- Prof. Josinaldo Lopes Araujo Rocha
 SOLUÇÃO DO SOLO Atributos físicos e químicos do solo -Aula 10- Prof. Josinaldo Lopes Araujo Rocha 1. GENERALIDADES Solo: 3 fases Sólida Gasosa (CO 2, O 2, N 2 ) Líquida (H 2 O, íons, moléculas, CO 2, O
SOLUÇÃO DO SOLO Atributos físicos e químicos do solo -Aula 10- Prof. Josinaldo Lopes Araujo Rocha 1. GENERALIDADES Solo: 3 fases Sólida Gasosa (CO 2, O 2, N 2 ) Líquida (H 2 O, íons, moléculas, CO 2, O
ELEMENTOS-TRAÇO NO AQUÍFERO MACACU, RIO DE JANEIRO BRASIL
 ELEMENTOS-TRAÇO NO AQUÍFERO MACACU, RIO DE JANEIRO BRASIL SILVA-FILHO, Emmanoel Vieira 1 ; GOMES, Olga Venimar de Oliveira 1 ; MARQUES, Eduardo Duarte 2 ; KUTTER, Vinícius Tavares 1 1 - Departamento de
ELEMENTOS-TRAÇO NO AQUÍFERO MACACU, RIO DE JANEIRO BRASIL SILVA-FILHO, Emmanoel Vieira 1 ; GOMES, Olga Venimar de Oliveira 1 ; MARQUES, Eduardo Duarte 2 ; KUTTER, Vinícius Tavares 1 1 - Departamento de
QUÍMICA. Sistemas Heterogêneos. Produto de Solubilidade (Kps) - Parte 1. Prof ª. Giselle Blois
 QUÍMICA Sistemas Heterogêneos Produto de Solubilidade (Kps) - Parte 1 Prof ª. Giselle Blois A solubilização, que depende da temperatura, de uma substância pode dar origem a um equilíbrio químico. Exemplo:
QUÍMICA Sistemas Heterogêneos Produto de Solubilidade (Kps) - Parte 1 Prof ª. Giselle Blois A solubilização, que depende da temperatura, de uma substância pode dar origem a um equilíbrio químico. Exemplo:
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
Reacções de Oxidação-Redução
 Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 ESTUDO DA SOLUBILIDADE DO ACETATO DE PRATA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O
ESTUDO DA SOLUBILIDADE DO ACETATO DE PRATA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O
Prova de Acesso de Química para Maiores de 23 Anos 2009/2010
 Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos 2009/2010 21 Julho 2009, 10:00 13:00 h Respostas às perguntas de escolha múltipla: assinale a resposta certa quando lhe for
Nome Completo : B. I. n.º Prova de Acesso de Química para Maiores de 23 Anos 2009/2010 21 Julho 2009, 10:00 13:00 h Respostas às perguntas de escolha múltipla: assinale a resposta certa quando lhe for
CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda
 CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda Data: Terça-feira, 11/09/2012 Tema da aula: Deslocamento de equilíbrios químicos (Princípios de Le Chatelier) Quando um sistema
CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda Data: Terça-feira, 11/09/2012 Tema da aula: Deslocamento de equilíbrios químicos (Princípios de Le Chatelier) Quando um sistema
Prof.: HÚDSON SILVA Frente 2 Módulo 1
 Prof.: HÚDSON SILVA Frente 2 Módulo 1 HIDROSFERA # HIDROSFERA É a camada de água da superfície terrestre que inclui desde rios, lagos e oceanos até lençóis de água subterrânea, geleiras e o vapor de água
Prof.: HÚDSON SILVA Frente 2 Módulo 1 HIDROSFERA # HIDROSFERA É a camada de água da superfície terrestre que inclui desde rios, lagos e oceanos até lençóis de água subterrânea, geleiras e o vapor de água
Salinização do Solo: Causas e Prevenção
 Salinização do Solo: Causas e Prevenção M. C. Gonçalves, J. C. Martins, T. B. Ramos INIAV UEIS Sistemas Agrários e Florestais e Sanidade Vegetal Laboratório de Solos, Oeiras Av. da República, Quinta do
Salinização do Solo: Causas e Prevenção M. C. Gonçalves, J. C. Martins, T. B. Ramos INIAV UEIS Sistemas Agrários e Florestais e Sanidade Vegetal Laboratório de Solos, Oeiras Av. da República, Quinta do
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei
 EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
Como as rochas se transformam em solos?
 Como as rochas se transformam em solos? Na natureza existe uma tendência ao equilíbrio físico-químico entre as substâncias sólidas, líquidas e gasosas. A maior parte das rochas origina-se em grandes profundidades
Como as rochas se transformam em solos? Na natureza existe uma tendência ao equilíbrio físico-químico entre as substâncias sólidas, líquidas e gasosas. A maior parte das rochas origina-se em grandes profundidades
Mistura: material formado por duas ou mais substâncias, sendo cada uma destas denominada componente.
 SOLUÇÕES Mistura: material formado por duas ou mais substâncias, sendo cada uma destas denominada componente. Fase: numa mistura, é cada uma das porções que apresenta aspecto homogéneo ou uniforme. CLASSIFICAÇÃO
SOLUÇÕES Mistura: material formado por duas ou mais substâncias, sendo cada uma destas denominada componente. Fase: numa mistura, é cada uma das porções que apresenta aspecto homogéneo ou uniforme. CLASSIFICAÇÃO
Geoquímica de Superfície Bases conceituais Interação lito, hidro, pedo e bio-esferas
 Geoquímica de Superfície Bases conceituais Interação lito, hidro, pedo e bio-esferas Adaptado do curso de Hidrogeoquímica, ministrado pelo prof. Jorge de Lena UFOP/EM/DEGEO Ciclo das rochas Intemperismo
Geoquímica de Superfície Bases conceituais Interação lito, hidro, pedo e bio-esferas Adaptado do curso de Hidrogeoquímica, ministrado pelo prof. Jorge de Lena UFOP/EM/DEGEO Ciclo das rochas Intemperismo
ciclo da água ciclo hidrológico
 Ciclo Hidrológico A água e seu ciclo A água da Terra - que constitui a hidrosfera - distribui-se por três reservatórios principais: os oceanos, os continentes e a atmosfera, entre os quais existe uma
Ciclo Hidrológico A água e seu ciclo A água da Terra - que constitui a hidrosfera - distribui-se por três reservatórios principais: os oceanos, os continentes e a atmosfera, entre os quais existe uma
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
Ciclos Biogeoquímicos
 Ciclos Biogeoquímicos CICLOS BIOGEOQUÍMICOS Ciclos: troca e circulação de matéria entre os fatores bióticos e abióticos. Bio: síntese orgânica e decomposição dos elementos. Geo: o meio terrestre (solo)
Ciclos Biogeoquímicos CICLOS BIOGEOQUÍMICOS Ciclos: troca e circulação de matéria entre os fatores bióticos e abióticos. Bio: síntese orgânica e decomposição dos elementos. Geo: o meio terrestre (solo)
CONCEITO DE SOLO CONCEITO DE SOLO. Solos Residuais 21/09/2017. Definições e Conceitos de Solo. Centro Universitário do Triângulo
 Centro Universitário do Triângulo CONCEITO DE SOLO Sistema Brasileiro de Classificação do Solo Definições e Conceitos de Solo É uma coleção de corpos naturais, constituídos por partes sólidas, líquidas
Centro Universitário do Triângulo CONCEITO DE SOLO Sistema Brasileiro de Classificação do Solo Definições e Conceitos de Solo É uma coleção de corpos naturais, constituídos por partes sólidas, líquidas
Professor: Fábio Silva SOLUÇÕES
 Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
CHUVA ÁCIDA. - Causas e consequências; - Controlar e corrigir as chuvas ácidas; - Impacto da chuva ácida em alguns. materiais.
 CHUVA ÁCIDA - Causas e consequências; - Controlar e corrigir as chuvas ácidas; - Impacto da chuva ácida em alguns materiais. FORMAÇÃO DE CHUVA ÁCIDA A chuva torna-se ácida porque dissolve o dióxido de
CHUVA ÁCIDA - Causas e consequências; - Controlar e corrigir as chuvas ácidas; - Impacto da chuva ácida em alguns materiais. FORMAÇÃO DE CHUVA ÁCIDA A chuva torna-se ácida porque dissolve o dióxido de
Disciplina de Química Geral Profa. Marcia Margarete Meier
 Soluções 1 Propriedades gerais das soluções Os materiais são feitos geralmente de misturas de substâncias mais simples. Ex.: ar, sangue, água do mar, ligas metálicas, perfumes, etc As composições precisam
Soluções 1 Propriedades gerais das soluções Os materiais são feitos geralmente de misturas de substâncias mais simples. Ex.: ar, sangue, água do mar, ligas metálicas, perfumes, etc As composições precisam
CRONOGRAMA DE RECUPERAÇÃO ATIVIDADE DE RECUPERAÇÃO
 CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
ª Fase. 5 pontos
 45 20 pontos 46 10 pontos 47 10 pontos 48 20 pontos AECVEXFQ10/11-04 49 10 pontos 50 10 pontos 20 pontos 51 10 pontos 52 20 pontos TOTAL Prova Escrita de Física e Química A, 2008 200 pontos 11.º/12.º Anos
45 20 pontos 46 10 pontos 47 10 pontos 48 20 pontos AECVEXFQ10/11-04 49 10 pontos 50 10 pontos 20 pontos 51 10 pontos 52 20 pontos TOTAL Prova Escrita de Física e Química A, 2008 200 pontos 11.º/12.º Anos
Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal
 Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal Ano Letivo 2017/2018 Física e Química A 10º ano Teste de Avaliação 2 A 05/11/2017 Duração: 90 minutos Página 1 de 7 Teste 2A
Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal Ano Letivo 2017/2018 Física e Química A 10º ano Teste de Avaliação 2 A 05/11/2017 Duração: 90 minutos Página 1 de 7 Teste 2A
O diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura.
 13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
Capítulo II. Métodos Instrumentais para Análise de Soluções -Mªde Lurdes Gonçalves. Química Analítica Geral - J. J. R.
 Capítulo II Condutividade Eléctrica de Soluções IónicasI Métodos Instrumentais para Análise de Soluções -Mªde Lurdes Gonçalves Fundação Calouste Gulbenkian, Lisboa Química Analítica Geral - J. J. R. Fraústo
Capítulo II Condutividade Eléctrica de Soluções IónicasI Métodos Instrumentais para Análise de Soluções -Mªde Lurdes Gonçalves Fundação Calouste Gulbenkian, Lisboa Química Analítica Geral - J. J. R. Fraústo
Abuso Sexual nas escolas Não dá para aceitar
 Abuso Sexual nas escolas Não dá para aceitar Por uma escola livre do SIDA República de Moçambique Ministério da Educação Conselho Nacional de Exames, Certificação e Equivalências ESG / 2014 Exame de Química
Abuso Sexual nas escolas Não dá para aceitar Por uma escola livre do SIDA República de Moçambique Ministério da Educação Conselho Nacional de Exames, Certificação e Equivalências ESG / 2014 Exame de Química
HIDROQUÍMICA DO SISTEMA AQUÍFERO BAURU NA REGIÃO SUDOESTE DO ESTADO DE SÃO PAULO
 HIDROQUÍMICA DO SISTEMA AQUÍFERO BAURU NA REGIÃO SUDOESTE DO ESTADO DE SÃO PAULO Chang Hung Kiang Marcia Regina Stradioto Flávio de Paula e Silva XVII Congresso Brasileiro de ÁGUAS SUBTERRÂNEAS JUSTIFICATIVA
HIDROQUÍMICA DO SISTEMA AQUÍFERO BAURU NA REGIÃO SUDOESTE DO ESTADO DE SÃO PAULO Chang Hung Kiang Marcia Regina Stradioto Flávio de Paula e Silva XVII Congresso Brasileiro de ÁGUAS SUBTERRÂNEAS JUSTIFICATIVA
Química II - 1º Exame A 5 de Junho de ª Parte
 Química II - 1º Exame A 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
Química II - 1º Exame A 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
A Meteorização Química das Rochas e o Ambiente. 32º Curso de Atualização de Professores de Geociências
 A Meteorização Química das Rochas e o Ambiente 32º Curso de Atualização de Professores de Geociências SUMÁRIO 1 OBJECTIVOS 2 A METEORIZAÇÃO QUÍMICA DAS ROCHAS E O AMBIENTE 2.1 Efeitos da Meteorização Química
A Meteorização Química das Rochas e o Ambiente 32º Curso de Atualização de Professores de Geociências SUMÁRIO 1 OBJECTIVOS 2 A METEORIZAÇÃO QUÍMICA DAS ROCHAS E O AMBIENTE 2.1 Efeitos da Meteorização Química
NUTRIÇÃO MINERAL GÊNESE DO SOLO. Rochas da Litosfera expostas ao calor, água e ar. Alterações físicas e químicas (intemperismo)
 NUTRIÇÃO MINERAL GÊNESE DO SOLO Rochas da Litosfera expostas ao calor, água e ar Alterações físicas e químicas (intemperismo) Físico (Altera o tamanho) Químico (Altera a composição) Intemperismo Físico
NUTRIÇÃO MINERAL GÊNESE DO SOLO Rochas da Litosfera expostas ao calor, água e ar Alterações físicas e químicas (intemperismo) Físico (Altera o tamanho) Químico (Altera a composição) Intemperismo Físico
PRÉ-QUÍMICO. RESOLUÇÃO DO EXAME DE ADMISSÃO DE QUÍMICA DA UP a PARTE
 PRÉ-QUÍMICO RESOLUÇÃO DO EXAME DE ADMISSÃO DE QUÍMICA DA UP 2018 1 a PARTE 1. Considere os seguintes dados referentes aos átomos A, B, e C: 20 A Z ; 21 B 44 ; X C Y. Sabendo que A e B são isóbaros, B e
PRÉ-QUÍMICO RESOLUÇÃO DO EXAME DE ADMISSÃO DE QUÍMICA DA UP 2018 1 a PARTE 1. Considere os seguintes dados referentes aos átomos A, B, e C: 20 A Z ; 21 B 44 ; X C Y. Sabendo que A e B são isóbaros, B e
Escola Secundária de Lousada Conteúdos a leccionar na disciplina de Física e Química A 11º ano 11 /12
 Escola Secundária de Lousada Conteúdos a leccionar na disciplina de Física e Química A 11º ano 11 /12 Turma: C 1º Período Aulas previstas: 39 COMPONENTE DE FÍSICA Unidade 1 Movimentos na Terra e no espaço
Escola Secundária de Lousada Conteúdos a leccionar na disciplina de Física e Química A 11º ano 11 /12 Turma: C 1º Período Aulas previstas: 39 COMPONENTE DE FÍSICA Unidade 1 Movimentos na Terra e no espaço
Química II - 1º Exame B 5 de Junho de ª Parte
 Química II - 1º Exame B 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
Química II - 1º Exame B 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
ÁGUA Fundamentos Caracterização Impurezas Classificações Legislação aplicada Tratamentos
 Disciplina: Água e Efluentes Industriais Prof.: Sávio Pereira ÁGUA Fundamentos Caracterização Impurezas Classificações Legislação aplicada Tratamentos FUNDAMENTOS SOBRE ÁGUA FUNDAMENTOS SOBRE ÁGUA Dados
Disciplina: Água e Efluentes Industriais Prof.: Sávio Pereira ÁGUA Fundamentos Caracterização Impurezas Classificações Legislação aplicada Tratamentos FUNDAMENTOS SOBRE ÁGUA FUNDAMENTOS SOBRE ÁGUA Dados
10.1 Caracterização hidroquímica do Sistema Aquífero Moura-Ficalho
 10 HIDROGEOQUÍMICA 10.1 Caracterização hidroquímica do Sistema Aquífero Moura-Ficalho Este capítulo aborda questões hidrogeoquímicas apenas na perspectiva do respectivo contributo para o modelo conceptual
10 HIDROGEOQUÍMICA 10.1 Caracterização hidroquímica do Sistema Aquífero Moura-Ficalho Este capítulo aborda questões hidrogeoquímicas apenas na perspectiva do respectivo contributo para o modelo conceptual
Equilíbrio Químico. Capítulo 14
 Capítulo 14 Equilíbrio Químico Conceito de Equilíbrio e de Constante de Equilíbrio Expressões para a Constante de Equilíbrio Relação entre Cinética Química e Equilíbrio Químico Que Informação nos Dá a
Capítulo 14 Equilíbrio Químico Conceito de Equilíbrio e de Constante de Equilíbrio Expressões para a Constante de Equilíbrio Relação entre Cinética Química e Equilíbrio Químico Que Informação nos Dá a
1) A principal caracterís0ca de uma solução é:
 1) A principal caracterís0ca de uma solução é: a) possuir sempre um líquido com outra substância dissolvida. b) ser um sistema com mais de uma fase. c) ser homogênea ou heterogênea, dependendo das condições
1) A principal caracterís0ca de uma solução é: a) possuir sempre um líquido com outra substância dissolvida. b) ser um sistema com mais de uma fase. c) ser homogênea ou heterogênea, dependendo das condições
Revisão da aula anterior
 Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Ciclos Biogeoquímicos
 Ciclos Biogeoquímicos DEFINIÇÃO Trata-se de movimentos cíclicos que envolvem elementos químicos presentes no meio biológico e o ambiente geológico; Elementos que são necessários ao desenvolvimento dos
Ciclos Biogeoquímicos DEFINIÇÃO Trata-se de movimentos cíclicos que envolvem elementos químicos presentes no meio biológico e o ambiente geológico; Elementos que são necessários ao desenvolvimento dos
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 PRECIPITAÇÃO SELECTIVA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O fenómeno de dissolução
PRECIPITAÇÃO SELECTIVA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água. O fenómeno de dissolução
Química A MESTRADO INTEGRADO EM ENGENHARIA DO AMBIENTE. 1º Semestre /2013. Doutor João Paulo Noronha.
 Química A MESTRADO INTEGRADO EM ENGENHARIA DO AMBIENTE 1º Semestre - 2012/2013 Doutor João Paulo Noronha jpnoronha@fct.unl.pt UNIVERSIDADE NOVA DE LISBOA Faculdade de Ciências e Tecnologia Solubilidade
Química A MESTRADO INTEGRADO EM ENGENHARIA DO AMBIENTE 1º Semestre - 2012/2013 Doutor João Paulo Noronha jpnoronha@fct.unl.pt UNIVERSIDADE NOVA DE LISBOA Faculdade de Ciências e Tecnologia Solubilidade
Ambientes insulares vulcânicos. RECURSOS HÍDRICOS DA ILHA DA MADEIRA Susana Prada. Modelo hidrogeológico conceptual para a ilha da Madeira
 RECURSOS HÍDRICOS DA ILHA DA MADEIRA Susana Prada Ambientes insulares vulcânicos São regiões acidentadas; de reduzidas dimensões; delimitadas por drásticas fronteiras físicas Dependentes de um correto
RECURSOS HÍDRICOS DA ILHA DA MADEIRA Susana Prada Ambientes insulares vulcânicos São regiões acidentadas; de reduzidas dimensões; delimitadas por drásticas fronteiras físicas Dependentes de um correto
Nome: Nº BI: Data - Local Emissão: / / -
 PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
CALAGEM -Aula passada. Tomada de decisão. Preciso aplicar calcário? . Quanto preciso aplicar de calcário? -Procedimentos alternativos
 DINÂMICA DO FÓSFORO CALAGEM -Aula passada Tomada de decisão. Preciso aplicar calcário?. Quanto preciso aplicar de calcário? -Procedimentos alternativos Aplicação do calcário a campo. Qual o equipamento
DINÂMICA DO FÓSFORO CALAGEM -Aula passada Tomada de decisão. Preciso aplicar calcário?. Quanto preciso aplicar de calcário? -Procedimentos alternativos Aplicação do calcário a campo. Qual o equipamento
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 30 de Junho de 2003 Versão 1
 Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
Água no Solo. V. Infiltração e água no solo Susana Prada. Representação esquemática das diferentes fases de um solo
 V. Infiltração e água no solo Susana Prada Água no Solo ROCHA MÃE SOLO TEMPO Meteorização Química Física + Actividade orgânica Os Solos actuam na fase terrestre do ciclo hidrológico como reservatórios
V. Infiltração e água no solo Susana Prada Água no Solo ROCHA MÃE SOLO TEMPO Meteorização Química Física + Actividade orgânica Os Solos actuam na fase terrestre do ciclo hidrológico como reservatórios
INTEMPERISMO QUÍMICO MUDANÇAS QUÍMICAS DE MINERAIS DA SUA FORMA MAIS INSTÁVEL PARA MAIS ESTÁVEL
 INTEMPERISMO QUÍMICO MUDANÇAS QUÍMICAS DE MINERAIS DA SUA FORMA MAIS INSTÁVEL PARA MAIS ESTÁVEL PERDA DE ELEMENTOS QUÍMICOS PRIMÁRIOS TRASFORMAÇÃO DE ELEMENTOS PRIMÁRIOS DA ROCHA EM SECUNDÁRIOS ALTERAÇÃO
INTEMPERISMO QUÍMICO MUDANÇAS QUÍMICAS DE MINERAIS DA SUA FORMA MAIS INSTÁVEL PARA MAIS ESTÁVEL PERDA DE ELEMENTOS QUÍMICOS PRIMÁRIOS TRASFORMAÇÃO DE ELEMENTOS PRIMÁRIOS DA ROCHA EM SECUNDÁRIOS ALTERAÇÃO
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
Prof. Giacometto. Lista de Exercícios EQUILÍBRIO QUÍMICO MOLECULAR: PLUS. VI. Ni + 4CO Ni(CO) ; K II. 2 CO 2CO + O ; K III.
 Prof. Giacometto Lista de Exercícios EQUILÍBRIO QUÍMICO MOLECULAR: PLUS 01) Considere as reações químicas a seguir, todas em equilíbrio químico e à mesma temperatura, com suas constantes em termos de concentração
Prof. Giacometto Lista de Exercícios EQUILÍBRIO QUÍMICO MOLECULAR: PLUS 01) Considere as reações químicas a seguir, todas em equilíbrio químico e à mesma temperatura, com suas constantes em termos de concentração
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 8.º Teste sumativo de FQA 16. março. 015 10.º Ano Turma A Professora: Maria do Anjo Albuquerque Versão 1 Duração da prova: 90 minutos. Este teste é constituído por 7 páginas
ESCOLA SECUNDÁRIA DE CASQUILHOS 8.º Teste sumativo de FQA 16. março. 015 10.º Ano Turma A Professora: Maria do Anjo Albuquerque Versão 1 Duração da prova: 90 minutos. Este teste é constituído por 7 páginas
CAPÍTULO 2 ASPECTOS FISIOGRÁFICOS Clima Relevo Hidrografia Solos Vegetação... 13
 ÍNDICE AGRADECIMENTOS RESUMO ABSTRACT CAPÍTULO 1 INTRODUÇÃO... 01 1.1 Localização e Vias de Acesso 01 1.2 Água e Mineração em Coronel Murta... 01 1.3 Objetivo... 04 1.4 Levantamento de Dados Físico-Químicos
ÍNDICE AGRADECIMENTOS RESUMO ABSTRACT CAPÍTULO 1 INTRODUÇÃO... 01 1.1 Localização e Vias de Acesso 01 1.2 Água e Mineração em Coronel Murta... 01 1.3 Objetivo... 04 1.4 Levantamento de Dados Físico-Químicos
PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA
 PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA 2012 Componente de Física 1. Mecânica da Partícula 1.1 Cinemática e dinâmica da partícula em movimento
PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA 2012 Componente de Física 1. Mecânica da Partícula 1.1 Cinemática e dinâmica da partícula em movimento
Resolução do Exame Nacional de Física e Química A 11.º, 2010, 2.ª fase, versão 1
 Resolução do Exame Nacional de Física e uímica A 11.º, 010,.ª fase, versão 1 Sociedade Portuguesa de Física, Divisão de Educação, 15 de Julho de 010, http://de.spf.pt 1. 1.1. O aumento da acidez da água
Resolução do Exame Nacional de Física e uímica A 11.º, 010,.ª fase, versão 1 Sociedade Portuguesa de Física, Divisão de Educação, 15 de Julho de 010, http://de.spf.pt 1. 1.1. O aumento da acidez da água
CLASSIFICAÇÃO DAS ROCHAS SEDIMENTARES
 Prof. Ana Rita Rainho CLASSIFICAÇÃO DAS ROCHAS SEDIMENTARES rochas sedimentares Tendo em conta o tipo de sedimentos que deram origem à fracção dominante de uma rocha podemos considerar: Tipo de sedimentos
Prof. Ana Rita Rainho CLASSIFICAÇÃO DAS ROCHAS SEDIMENTARES rochas sedimentares Tendo em conta o tipo de sedimentos que deram origem à fracção dominante de uma rocha podemos considerar: Tipo de sedimentos
ANÁLISE INTEGRADA DA QUALIDADE DA ÁGUA E DOS ECOSSISTEMAS NA BACIA HIDROGRÁFICA DA RIBEIRA DE MELIDES
 ANÁLISE INTEGRADA DA QUALIDADE DA ÁGUA E DOS ECOSSISTEMAS NA BACIA HIDROGRÁFICA DA RIBEIRA DE MELIDES Teresa E. LEITÃO Luís OLIVEIRA João Paulo LOBO FERREIRA João VILHENA Alexandre ALMEIDA Marta TOMÉ Ana
ANÁLISE INTEGRADA DA QUALIDADE DA ÁGUA E DOS ECOSSISTEMAS NA BACIA HIDROGRÁFICA DA RIBEIRA DE MELIDES Teresa E. LEITÃO Luís OLIVEIRA João Paulo LOBO FERREIRA João VILHENA Alexandre ALMEIDA Marta TOMÉ Ana
QUÍMICA - 3 o ANO MÓDULO 26 SOLUÇÕES EXERCÍCIOS
 QUÍMICA - 3 o ANO MÓDULO 26 SOLUÇÕES EXERCÍCIOS Como pode cair no enem A eutrofização é um processo em que rios, lagos e mares adquirem níveis altos de nutrientes, especialmente fosfatos e nitratos, provocando
QUÍMICA - 3 o ANO MÓDULO 26 SOLUÇÕES EXERCÍCIOS Como pode cair no enem A eutrofização é um processo em que rios, lagos e mares adquirem níveis altos de nutrientes, especialmente fosfatos e nitratos, provocando
NATUREZA E TIPOS DE SOLOS ACH-1085
 NATUREZA E TIPOS DE SOLOS ACH-1085 Processos de formação dos solos 1 Conteúdo 1. Processo de Intemperismo 1.1. Intemperismo físico 1.2. Intemperismo químico 2. Principais elementos liberados 3. Regolito
NATUREZA E TIPOS DE SOLOS ACH-1085 Processos de formação dos solos 1 Conteúdo 1. Processo de Intemperismo 1.1. Intemperismo físico 1.2. Intemperismo químico 2. Principais elementos liberados 3. Regolito
