Nota Técnica Conjunta SESA N 01/2014 1
|
|
|
- Lívia Marinho das Neves
- 9 Há anos
- Visualizações:
Transcrição
1 Nota Técnica Conjunta SESA N 01/ Assunto: Fluxo para solicitação, distribuição e dispensação do medicamento Palivizumabe para o tratamento profilático do Vírus Sincicial Respiratório (VSR) no Estado do Paraná O medicamento Palivizumabe (anticorpo monoclonal), indicado para a prevenção da infecção pelo Vírus Sincicial Respiratório (VSR), foi registrado na Agência Nacional de Vigilância Sanitária (ANVISA) e incorporado ao Sistema Único de Saúde (SUS) pela Comissão Nacional de Incorporação de Tecnologias (CONITEC), por meio da Portaria SCTIE/MS nº 53, de 30 de novembro de 2012, e protocolo de utilização aprovado por meio da Portaria SAS/MS nº 522, de 13 de maio de 2013, da Secretaria de Atenção à Saúde, do Ministério da Saúde. A Nota Técnica Conjunta nº 01/2014 DAF/SCTIE/MS e DAPES/SAS/MS define o fluxo para dispensação do Palivizumabe, o qual foi inserido no Componente Estratégico da Assistência Farmacêutica. Assim sendo, a Secretaria de Estado da Saúde do Paraná normatiza o fluxo para disponibilização do medicamento Palivizumabe, no Paraná: 1. A prescrição do medicamento Palivizumabe é de inteira responsabilidade do médico assistente que acompanha a criança. 2. A indicação de uso do medicamento Palivizumabe deve atender os critérios de inclusão estabelecidos no protocolo de uso pelo Ministério da Saúde (Portaria SAS/MS nº 522, de 13/05/13): a. Crianças menores de 01 ano de idade que nasceram prematuras com idade gestacional menor ou igual a 28 semanas. b. Crianças menores de 02 anos de idade, com doença pulmonar crônica da prematuridade. c. Crianças menores de 02 anos de idade, com doença cardíaca congênita, com repercussão hemodinâmica demonstrada. 3. O fornecimento e a aplicação do Palivizumabe deverão ocorrer no período de sazonalidade do vírus VSR no Paraná, ou seja, entre abril e agosto de cada ano, conforme dados epidemiológicos. a. Cada criança poderá receber até 05 (cinco) doses anuais do medicamento, entre abril a agosto, com intervalo de 30 dias entre as doses. b. O fornecimento e a aplicação do Palivizumabe não serão estendidos fora do período de sazonalidade. 1 Nota técnica elaborada pelas Equipes da SAS/DAPS/DVSCA; SGS/DEAF/CEMEPAR; SVS/CEVS; SUP/DEAH 1
2 4. Solicitação do Palivizumabe: o medicamento deverá ser solicitado mediante a apresentação dos seguintes documentos: a. Solicitação de dose hospitalar: I. Formulário Específico - Formulário para Solicitação, Avaliação e Autorização de Palivizumabe (Anexo I); II. Relatório médico com justificativa da solicitação, assinado pelo médico assistente; III. Receituário médico. b. Solicitação de dose ambulatorial: I. Formulário Específico - Formulário para Solicitação, Avaliação e Autorização de Palivizumabe (Anexo I); II. Relatório médico com justificativa da solicitação, assinado pelo médico assistente; III. Receituário médico; IV. Pacientes com cardiopatia congênita: descrever no relatório médico o tipo da cardiopatia congênita, os medicamentos utilizados e anexar cópia do laudo do ecocardiograma; V. Cópia dos seguintes documentos: certidão de nascimento; comprovante de residência e Cartão SUS. 5. Fluxo para distribuição: a. A documentação relacionada no item 4 deverá ser entregue na Farmácia da Regional de Saúde, seja pelo Serviço Hospitalar, seja pelo responsável pelo paciente no caso de dose ambulatorial. b. A documentação será avaliada por médico auditor designado para este fim, com base nos critérios estabelecidos pelo Protocolo de uso do Palivizumabe (Portaria SAS/MS nº 522, de 13/05/13). c. No caso de deferimento da dose hospitalar, a Farmácia da Regional de Saúde (RS) emitirá uma Guia de Remessa (GR) em nome do hospital solicitante e agendará a retirada do medicamento pelo mesmo, sendo nesse caso já indicado pelo médico auditor a que Polo de Aplicação (Anexo II) o paciente será referenciado quando da ocasião da alta. d. No caso de deferimento da dose ambulatorial, o médico auditor indicará o Polo de Aplicação a que o paciente será referenciado. Esta informação será repassada pela Farmácia da Regional de Saúde (RS) ao responsável pelo paciente. 2
3 I. Se o Polo de Aplicação estiver dentro de sua área de abrangência, a Farmácia da RS emitirá uma GR em nome do Polo e o informará sobre a disponibilidade do medicamento; II. Se o Polo de Aplicação estiver fora de sua área de abrangência, a Farmácia da RS, que abrange o município de residência do paciente, deverá transferir o paciente, via sistema de informação, à Regional de Saúde onde estiver localizado o Polo de Aplicação, informando-a através de sobre esta transferência. Neste caso, a Farmácia da RS que abrange o município de residência do paciente comunicará a Seção de Atenção Primária em Saúde (SCAPS) que por sua vez informará a respectiva a Secretaria Municipal de Saúde sobre o encaminhamento ao Polo de Aplicação para as providências necessárias. e. O medicamento deverá ser enviado à Farmácia do Serviço Hospitalar ou à Farmácia do Polo de Aplicação, no prazo máximo de até 10 (dez) dias, a contar da data de solicitação. f. No caso de indeferimento, os documentos serão devolvidos ao Serviço Hospitalar ou ao responsável pelo paciente. g. Nas situações em que o processo de solicitação estiver incompleto, o mesmo será devolvido para complementação das informações. 6. Fluxo para dispensação/aplicação: a. O Polo de Aplicação do medicamento Palivizumabe deve possuir equipe profissional capacitada e estrutura física adequada: área para recepção, atendimento das crianças, preparação e aplicação do medicamento, ambiente e equipamento para o armazenamento do medicamento em temperatura entre 2º e 8º C. b. Os Polos de Aplicação e os Hospitais que possuem UTI Neonatal deverão fazer contato com os responsáveis pela criança e elaborar um calendário para agendamento das aplicações das doses do medicamento, com compartilhamento de frascos, com o objetivo de minimizar as perdas. c. Todas as doses aplicadas do Palivizumabe (hospitalar ou ambulatorial) deverão ser registradas na Caderneta da Criança. d. Recomenda-se a orientação por escrito da aplicação da dose subsequente, que deverá ser feita com intervalo de 30 dias, sem ultrapassar o período da sazonalidade do VSR. e. No caso de não comparecimento na data agendada, o Polo de Aplicação deverá comunicar por a Farmácia da Regional de Saúde, que por sua vez informará a Seção de Atenção Primária em Saúde (SCAPS) para que entre em contato com a Secretaria Municipal de Saúde do município de residência do paciente, para realização da busca ativa. 3
4 7. Registro de Informações: a. O sistema informatizado para gerenciar o Palivizumabe será o GSUS (Sistema de Gestão da Assistência de Saúde do SUS), onde será realizado o cadastro do usuário, a análise da solicitação, a distribuição, o fracionamento, o agendamento e o registro da dispensação. b. Os Serviços Hospitalares que não aderirem ao GSUS deverão preencher o Relatório de Aplicação (Anexo III), que será devolvido à Farmácia da RS, que registrará a dispensação no sistema. 8. Farmacovigilância: a. Os setores envolvidos no acompanhamento dos pacientes em terapia com palivizumabe devem estabelecer seguimento farmacoterapêutico de forma sistemática, contínua e documentada. Sendo importante o registro de intercorrências clínicas, de internações, de interrupção de tratamento, de óbito e definição de rotina referente à avaliação da adesão ao tratamento preconizado. b. Todos os profissionais da saúde envolvidos com o Palivizumabe: farmacêuticos, enfermeiros, médicos e outros, que atuem em qualquer etapa do ciclo deste medicamento programação, armazenamento, distribuição, prescrição, dispensação, preparo e administração, deverão realizar ações de farmacovigilância que consistem nas atividades relativas à detecção, avaliação, notificação e prevenção dos efeitos adversos ou outros problemas relacionados ao uso do medicamento. c. Por meio do seguimento farmacoterapêutico, deve-se identificar e avaliar os problemas/riscos relacionados à segurança, efetividade e desvios de qualidade e notificar no sistema NOTIVISA. Considerar os problemas listados a seguir: Eventos adversos por desvio da qualidade de medicamentos; Interações medicamentosas; Inefetividade terapêutica total ou parcial; Erros de medicação, potenciais e reais; Erros de preparação e administração do medicamento; Reações adversas a medicamentos (RAMs). d. Reações adversas graves devem ser notificadas imediatamente após a identificação. Lembrando que a notificação sempre é relacionada a uma suspeita de evento adverso. São consideradas graves as situações apresentadas a seguir: Óbito; Ameaça à vida; 4
5 Hospitalização ou prolongamento de hospitalização já existente; Incapacidade significativa ou persistente; Anomalia congênita; Evento clinicamente significante (necessidade de intervenção médica, a fim de evitar óbito, risco à vida ou atendimento hospitalar). e. Os eventos adversos descritos na bula do Palivizumabe devem ser notificados. As reações mais comuns são rash, pirexia (febre alta), reação no local da injeção, rinite, otite média, infecção respiratória. Outros eventos descritos na literatura são urticária, trombocitopenia, convulsão, anafilaxia e choque anafilático. Outros eventos adversos que eventualmente possam aparecer também necessitam de notificação, análise e monitorização. f. A ferramenta utilizada para a notificação dos eventos adversos (EA) e queixas técnicas (QT) relacionadas a produtos de interesse da vigilância sanitária é o sistema NOTIVISA- Sistema de Notificações em Vigilância Sanitária, sistema informatizado na plataforma web. No caso do Palivizumabe, estas suspeitas devem ser notificadas na área relacionada a medicamento. g. Os notificadores do NOTIVISA são os profissionais de saúde que devem cadastrar-se no sistema. Os profissionais estarão cadastrados vinculados aos estabelecimentos em que atuam CEMEPAR, farmácias públicas, Polo de aplicação, hospitais públicos e privados e serviços municipais de saúde que realizam o acompanhamento do paciente. h. As atividades de competência do Sistema Nacional de Vigilância Sanitária (SNVS) serão desenvolvidas entre as três esferas de gestão, conforme normatização em vigor e estabelecida, e sempre em processo colaborativo. Qualquer dúvida entrar em contato com a Divisão de Saúde da Criança e Adolescente (DVSCA/DAPS/SAS/SESA/PR), no telefone (41) ou [email protected]. Curitiba, 30 de abril de
Nota Técnica Conjunta SESA N 03/2015¹
 Nota Técnica Conjunta SESA N 03/2015¹ Assunto: Sistematização do fluxo para solicitação, distribuição, dispensação do medicamento Palivizumabe para o tratamento profilático do Vírus Sincicial Respiratório
Nota Técnica Conjunta SESA N 03/2015¹ Assunto: Sistematização do fluxo para solicitação, distribuição, dispensação do medicamento Palivizumabe para o tratamento profilático do Vírus Sincicial Respiratório
Nota Técnica Conjunta SESA N 02/2014 1
 Nota Técnica Conjunta SESA N 02/2014 1 Assunto: Fluxo para solicitação, distribuição e dispensação do medicamento Palivizumabe para o tratamento profilático do Vírus Sincicial Respiratório (VSR) no Estado
Nota Técnica Conjunta SESA N 02/2014 1 Assunto: Fluxo para solicitação, distribuição e dispensação do medicamento Palivizumabe para o tratamento profilático do Vírus Sincicial Respiratório (VSR) no Estado
Incorporação do Palivizumabe para Imunização contra o vírus sincicial respiratório (VSR)
 Incorporação do Palivizumabe para Imunização contra o vírus sincicial respiratório (VSR) O vírus sincicial respiratório (VSR) é um dos principais agentes etiológicos envolvidos nas infecções respiratórias
Incorporação do Palivizumabe para Imunização contra o vírus sincicial respiratório (VSR) O vírus sincicial respiratório (VSR) é um dos principais agentes etiológicos envolvidos nas infecções respiratórias
APLICAÇÃO DA FARMACOVIGILÂNCIA EM FARMÁCIA COMO ESTABELECIMENTO DE SAÚDE NOTIVISA
 APLICAÇÃO DA FARMACOVIGILÂNCIA EM FARMÁCIA COMO ESTABELECIMENTO DE SAÚDE NOTIVISA Dr. Israel Murakami Especialista em Vigilância Sanitária e Epidemiologia pela UNAERP Especialista em Gestão da Assistência
APLICAÇÃO DA FARMACOVIGILÂNCIA EM FARMÁCIA COMO ESTABELECIMENTO DE SAÚDE NOTIVISA Dr. Israel Murakami Especialista em Vigilância Sanitária e Epidemiologia pela UNAERP Especialista em Gestão da Assistência
Não há um tratamento específico para o VSR. As medidas são preventivas e visam controle da infecção.
 PT REG Terapia Imunoprofilática com Palivizumabe para o Vírus Sincicial Respiratório (VSR) Página 1 de 10 1. OBJETIVO Estabelecer protocolo de terapia imunoprofilática para Vírus Sincicial Respiratório.
PT REG Terapia Imunoprofilática com Palivizumabe para o Vírus Sincicial Respiratório (VSR) Página 1 de 10 1. OBJETIVO Estabelecer protocolo de terapia imunoprofilática para Vírus Sincicial Respiratório.
A Fresenius Medical Care dá mais um passo à frente.
 Farmacovigilância A Fresenius Medical Care dá mais um passo à frente. Um novo tempo no monitoramento da segurança dos medicamentos. O que é Farmacovigilância? De acordo com a OMS (Organização Mundial
Farmacovigilância A Fresenius Medical Care dá mais um passo à frente. Um novo tempo no monitoramento da segurança dos medicamentos. O que é Farmacovigilância? De acordo com a OMS (Organização Mundial
TERAPIA IMUNOPROFILÁTICA COM PALIVIZUMABE
 TERAPIA IMUNOPROFILÁTICA COM PALIVIZUMABE A partir de 02.01.2018, entra em vigência a RN 428 onde passa a ter cobertura a Terapia Imunoprofilática com Palivizumabe para o Vírus Sincicial Respiratório,
TERAPIA IMUNOPROFILÁTICA COM PALIVIZUMABE A partir de 02.01.2018, entra em vigência a RN 428 onde passa a ter cobertura a Terapia Imunoprofilática com Palivizumabe para o Vírus Sincicial Respiratório,
Hospital de dia de Pediatria. Consulta Externa
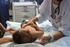 Hospital de dia de Pediatria Enfermeira Ana Cristina Baptista (Especialista em Saúde Infantil e Pediátrica) 30 de Março de 2012 Consulta Externa O VSR é o agente patogénico respiratório mais comum em crianças
Hospital de dia de Pediatria Enfermeira Ana Cristina Baptista (Especialista em Saúde Infantil e Pediátrica) 30 de Março de 2012 Consulta Externa O VSR é o agente patogénico respiratório mais comum em crianças
Data Versão/Revisões Descrição Autor 16/11/ Proposta inicial CESC, FA, LAS, RFC. 14/01/ Atualização CESC, LAS, MBJ, CAMS, LR
 1 de 5 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 16/11/2012 1.00 Proposta inicial CESC, FA, LAS, RFC. 2.00 Atualização CESC, LAS, MBJ, CAMS, LR 1 Objetivo Promover assistência
1 de 5 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 16/11/2012 1.00 Proposta inicial CESC, FA, LAS, RFC. 2.00 Atualização CESC, LAS, MBJ, CAMS, LR 1 Objetivo Promover assistência
Instruções sobre Farmacovigilância para a equipe de Propagandistas Vendedores da Eurofarma
 Instruções sobre Farmacovigilância para a equipe de Propagandistas Vendedores da Eurofarma 1 2 Prefácio O representante é o elo fundamental de relacionamento entre a empresa e nossos clientes, especialmente
Instruções sobre Farmacovigilância para a equipe de Propagandistas Vendedores da Eurofarma 1 2 Prefácio O representante é o elo fundamental de relacionamento entre a empresa e nossos clientes, especialmente
Farmacovigilância LEGISLAÇÃO SANITÁRIA O QUE É FARMACOVIGILÂNCIA? INÍCIO INTRODUÇÃO INTRODUÇÃO FARMACOVIGILÂNCIA 21/11/2010
 LEGISLAÇÃO INÍCIO Deborah Masano Cavaloti Manira Georges Soufia SANITÁRIA - PROF. PALUDETTI - Farmacovigilância O risco do uso de remédios é conhecido desde a Antiguidade. Entretanto, pode-se dizer que
LEGISLAÇÃO INÍCIO Deborah Masano Cavaloti Manira Georges Soufia SANITÁRIA - PROF. PALUDETTI - Farmacovigilância O risco do uso de remédios é conhecido desde a Antiguidade. Entretanto, pode-se dizer que
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS ENTENDA MANUAL COMO E POR QUE. RELATAR EventoS AdversoS
 FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
Prof. Claudia Witzel. Farmacovigilancia
 Prof. Claudia Witzel Farmacovigilancia CONCEITO - Uma unidade clínica, administrativa e econômica, dirigida por farmacêutico, ligada hierarquicamente à direção do hospital e integrada funcionalmente com
Prof. Claudia Witzel Farmacovigilancia CONCEITO - Uma unidade clínica, administrativa e econômica, dirigida por farmacêutico, ligada hierarquicamente à direção do hospital e integrada funcionalmente com
Regulação de Medicamentos Biológicos no Brasil Farmacovigilância
 Regulação de Medicamentos Biológicos no Brasil Farmacovigilância Márcia Gonçalves de Oliveira Gerente de Farmacovigilancia BIO Latin America Conference São Paulo, 27 de outubro de 2016 Regulação de Medicamentos
Regulação de Medicamentos Biológicos no Brasil Farmacovigilância Márcia Gonçalves de Oliveira Gerente de Farmacovigilancia BIO Latin America Conference São Paulo, 27 de outubro de 2016 Regulação de Medicamentos
FARMACOVIGILÂNCIA E TECNOVIGILÂNCIA. Estabelecer processo de Farmacovigilância e Tecnovigilância na instituição;
 FARMPr04 1 de 6 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 14/11/2012 1.00 Proposta CESC, FA, LAS, RFC. 1.01 Revisão CAMS, MBJ 1 Objetivo Estabelecer processo de Farmacovigilância
FARMPr04 1 de 6 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 14/11/2012 1.00 Proposta CESC, FA, LAS, RFC. 1.01 Revisão CAMS, MBJ 1 Objetivo Estabelecer processo de Farmacovigilância
GESTÃO DESCOMPLICADA NOTIVISA
 NOTIVISA Sistema de Notificações em Vigilância Sanitária http://www.anvisa.gov.br/hotsite/notivisa/index.htm Apresentação Bem-vindo ao Sistema Nacional de Notificações para a Vigilância Sanitária - NOTIVISA
NOTIVISA Sistema de Notificações em Vigilância Sanitária http://www.anvisa.gov.br/hotsite/notivisa/index.htm Apresentação Bem-vindo ao Sistema Nacional de Notificações para a Vigilância Sanitária - NOTIVISA
Solução injetável de: mg/ml: solução injetável em frasco-ampola para dose única contendo 0,5 ml ou 1,0 ml de solução.
 palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Solução injetável de: - 100 mg/ml: solução injetável em frasco-ampola para dose única contendo 0,5 ml ou 1,0 ml de solução. VIA INTRAMUSCULAR
palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Solução injetável de: - 100 mg/ml: solução injetável em frasco-ampola para dose única contendo 0,5 ml ou 1,0 ml de solução. VIA INTRAMUSCULAR
Curitiba Outubro/2017
 Curitiba Outubro/2017 Contexto Acesso a medicamentos do Componente Especializado e Elenco Complementar da SESA-PR 22 Farmácias Regionais + Farmácia do CPM 195.063 usuários cadastrados Patologias crônicas
Curitiba Outubro/2017 Contexto Acesso a medicamentos do Componente Especializado e Elenco Complementar da SESA-PR 22 Farmácias Regionais + Farmácia do CPM 195.063 usuários cadastrados Patologias crônicas
Ministério da Saúde Consultoria Jurídica/Advocacia Geral da União
 Nota Técnica N 265/2013 Brasília, agosto de 2013. Princípio Ativo: cabergolina Nome Comercial 1 : Dostinex. Sumário 1. O que é a cabergolina?... 1 2. O medicamento possui registro na Agência Nacional de
Nota Técnica N 265/2013 Brasília, agosto de 2013. Princípio Ativo: cabergolina Nome Comercial 1 : Dostinex. Sumário 1. O que é a cabergolina?... 1 2. O medicamento possui registro na Agência Nacional de
Regimento Interno da Comissão de Farmácia e Terapêutica
 Regimento Interno da Comissão de Farmácia e Terapêutica Da natureza e finalidade Art. 1º - A Comissão de Farmácia e Terapêutica (CFT) é instância de caráter consultivo e deliberativo da Direção Médica
Regimento Interno da Comissão de Farmácia e Terapêutica Da natureza e finalidade Art. 1º - A Comissão de Farmácia e Terapêutica (CFT) é instância de caráter consultivo e deliberativo da Direção Médica
ANEXO I DA DELIBERAÇÃO CIB-SUS/MG Nº 2.752, DE 03 DE JULHO DE FLUXOS DE ACESSO À TALIDOMIDA NO SUS/MG PROGRAMAÇÃO E DISTRIBUIÇÃO
 ANEXO I DA DELIBERAÇÃO CIB-SUS/MG Nº 2.752, DE 03 DE JULHO DE 2018. FLUXOS DE ACESSO À TALIDOMIDA NO SUS/MG PROGRAMAÇÃO E DISTRIBUIÇÃO 1) A DMEST realizará Programação de talidomida e solicitará ao Ministério
ANEXO I DA DELIBERAÇÃO CIB-SUS/MG Nº 2.752, DE 03 DE JULHO DE 2018. FLUXOS DE ACESSO À TALIDOMIDA NO SUS/MG PROGRAMAÇÃO E DISTRIBUIÇÃO 1) A DMEST realizará Programação de talidomida e solicitará ao Ministério
FARMÁCIA CIDADÃ UM AUXÍLIO PARA A ASSISTÊNCIA FARMACÊUTICA
 FARMÁCIA CIDADÃ UM AUXÍLIO PARA A ASSISTÊNCIA FARMACÊUTICA RODRÍGUES, Layla Calazans 1 OLIVEIRA, Luciara 1 ZACCHI, Pâmela Santos 1 RABELO, Sâmara Graziela 1 SAMPAIO, Poliane Barbosa 2 INTRODUÇÃO O Projeto
FARMÁCIA CIDADÃ UM AUXÍLIO PARA A ASSISTÊNCIA FARMACÊUTICA RODRÍGUES, Layla Calazans 1 OLIVEIRA, Luciara 1 ZACCHI, Pâmela Santos 1 RABELO, Sâmara Graziela 1 SAMPAIO, Poliane Barbosa 2 INTRODUÇÃO O Projeto
Universidade de São Paulo Faculdade de Ciências Farmacêuticas Disciplina FBF Farmacovigilância. Profa. Dra. Patricia Melo Aguiar.
 Universidade de São Paulo Faculdade de Ciências Farmacêuticas Disciplina FBF-0436 Farmacovigilância Profa. Dra. Patricia Melo Aguiar Março de 2018 Meus contatos Farmacovigilância Farmacovigilância é a
Universidade de São Paulo Faculdade de Ciências Farmacêuticas Disciplina FBF-0436 Farmacovigilância Profa. Dra. Patricia Melo Aguiar Março de 2018 Meus contatos Farmacovigilância Farmacovigilância é a
NOTIVISA - Sistema de Notificações em Vigilância Sanitária. Fabiana Oderdenge Melo-Farmacêutica DIVS/GEIMP/DM
 apresentam NOTIVISA - Sistema de Notificações em Vigilância Sanitária Fabiana Oderdenge Melo-Farmacêutica DIVS/GEIMP/DM Farmacovigilância Cosmetovigilância Tecnovigilância Hemovigilância Vigilância de
apresentam NOTIVISA - Sistema de Notificações em Vigilância Sanitária Fabiana Oderdenge Melo-Farmacêutica DIVS/GEIMP/DM Farmacovigilância Cosmetovigilância Tecnovigilância Hemovigilância Vigilância de
1. PARA QUE ESTE MEDICAMENTO É INDICADO?
 SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 50 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe na forma de pó liofilizado estéril
SYNAGIS palivizumabe I - IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES Pó liófilo injetável de: - 50 mg em embalagem com 01 frasco-ampola para dose única contendo palivizumabe na forma de pó liofilizado estéril
Promover padronização das prescrições médicas, referentes aos medicamentos/materiais; Estabelecer fluxo seguro de dispensação medicamentos/materiais.
 1 de 6 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 1.00 Proposta inicial. CESC, LAS. 1 Objetivo Promover padronização das prescrições médicas, referentes aos medicamentos/materiais;
1 de 6 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 1.00 Proposta inicial. CESC, LAS. 1 Objetivo Promover padronização das prescrições médicas, referentes aos medicamentos/materiais;
Ministério da Saúde Consultoria Jurídica/Advocacia Geral da União
 Nota Técnica N 208/2013 Brasília, agosto de 2013. Princípio Ativo: ácido nicotínico Nomes Comerciais 1 : Acinic, Metri, Cordaptive. Sumário 1. O que é o ácido nicotínico?... 2 2. O medicamento possui registro
Nota Técnica N 208/2013 Brasília, agosto de 2013. Princípio Ativo: ácido nicotínico Nomes Comerciais 1 : Acinic, Metri, Cordaptive. Sumário 1. O que é o ácido nicotínico?... 2 2. O medicamento possui registro
Principais causas da não autorização das solicitações de medicamentos do componente especializado da assistência farmacêutica
 Principais causas da não autorização das solicitações de medicamentos do componente especializado da assistência farmacêutica Laura Martins Valdevite 1, Camila Francisca Tavares 1, Eveline Saad De Andrade
Principais causas da não autorização das solicitações de medicamentos do componente especializado da assistência farmacêutica Laura Martins Valdevite 1, Camila Francisca Tavares 1, Eveline Saad De Andrade
Fluxo das Doenças de Notificação Compulsória no HMVSC
 Fluxo das Doenças de Notificação Compulsória no HMVSC Nas unidades de internação, UTIs ou ambulatório A equipe assistencial identifica possível ou confirmada DOENÇA OU AGRAVO DE NOTIFICAÇÃO COMPULSÓRIA
Fluxo das Doenças de Notificação Compulsória no HMVSC Nas unidades de internação, UTIs ou ambulatório A equipe assistencial identifica possível ou confirmada DOENÇA OU AGRAVO DE NOTIFICAÇÃO COMPULSÓRIA
ADESÃO AO HÓRUS. Atenção: No final do formulário, ao preencher os campos, grave as informações. ADESÃO AO HÓRUS
 ADESÃO AO HÓRUS DEPARTAMENTO DE ASSISTÊNCIA FARMACÊUTICA E INSUMOS ESTRATÉGICOS HORUS - SISTEMA NACIONAL DE GESTÃO DA ASSISTÊNCIA FARMACEUTICA ADESÃO AO HÓRUS Atenção: No final do formulário, ao preencher
ADESÃO AO HÓRUS DEPARTAMENTO DE ASSISTÊNCIA FARMACÊUTICA E INSUMOS ESTRATÉGICOS HORUS - SISTEMA NACIONAL DE GESTÃO DA ASSISTÊNCIA FARMACEUTICA ADESÃO AO HÓRUS Atenção: No final do formulário, ao preencher
Curso de Atualização em Boas Práticas de Farmácia Hospitalar. Farmacovigilância no Hospital. Farm.Cleni Veroneze 04/03/13
 Curso de Atualização em Boas Práticas de Farmácia Hospitalar no Hospital Farm.Cleni Veroneze 04/03/13 Comissão de Farmácia Hospitalar - 2013 Marcos históricos 1880- Morte súbita durante anestesia com clorofórmio
Curso de Atualização em Boas Práticas de Farmácia Hospitalar no Hospital Farm.Cleni Veroneze 04/03/13 Comissão de Farmácia Hospitalar - 2013 Marcos históricos 1880- Morte súbita durante anestesia com clorofórmio
AVALIAÇÃO DAS NOTIFICAÇÕES DE EVENTOS ADVERSOS PELA GFARM
 AVALIAÇÃO DAS NOTIFICAÇÕES DE EVENTOS ADVERSOS PELA GFARM Leandro Alves Macedo da Silva 1, Lais França 2, Murilo Freitas Dias 3 Resumo Avaliação caso a caso das notificações de eventos adversos encaminhadas
AVALIAÇÃO DAS NOTIFICAÇÕES DE EVENTOS ADVERSOS PELA GFARM Leandro Alves Macedo da Silva 1, Lais França 2, Murilo Freitas Dias 3 Resumo Avaliação caso a caso das notificações de eventos adversos encaminhadas
MÉDICO PEDIATRA. Requisitos: - Graduação em medicina; - Residência em Pediatria. Horário: - Plantão 12h (sábado) - Unidade de Internação
 MÉDICO PEDIATRA - Graduação em medicina; - Residência em Pediatria. Horário: - Plantão 12h (sábado) - Unidade de Internação - O vínculo será através de Pessoa Jurídica. Vagas: - 01 vaga. colocando no assunto:
MÉDICO PEDIATRA - Graduação em medicina; - Residência em Pediatria. Horário: - Plantão 12h (sábado) - Unidade de Internação - O vínculo será através de Pessoa Jurídica. Vagas: - 01 vaga. colocando no assunto:
SUBEMENDA AGLUTINATIVA DE PLENÁRIO. Capítulo I DISPOSIÇÕES PRELIMINARES
 SUBEMENDA AGLUTINATIVA DE PLENÁRIO Dispõe sobre o exercício e a fiscalização das atividades farmacêuticas e dá outras providências. Autor: Senado Federal O Congresso Nacional decreta: Capítulo I DISPOSIÇÕES
SUBEMENDA AGLUTINATIVA DE PLENÁRIO Dispõe sobre o exercício e a fiscalização das atividades farmacêuticas e dá outras providências. Autor: Senado Federal O Congresso Nacional decreta: Capítulo I DISPOSIÇÕES
E - ÁREA PROFISSIONAL FARMÁCIA
 1 E - ÁREA PROFISSIONAL FARMÁCIA FARMÁCIA HOSPITALAR E CLÍNICA - InCor Titulação: Aprimoramento e Especialização Supervisora: Drª. Sonia Lucena Cipriano Características: (duração 12 meses) Dirigido a farmacêuticos,
1 E - ÁREA PROFISSIONAL FARMÁCIA FARMÁCIA HOSPITALAR E CLÍNICA - InCor Titulação: Aprimoramento e Especialização Supervisora: Drª. Sonia Lucena Cipriano Características: (duração 12 meses) Dirigido a farmacêuticos,
Portaria SAS/MS nº 472, de 24 de julho de 2002.
 Portaria SAS/MS nº 472, de 24 de julho de 2002. O Secretário de Assistência à Saúde, no uso de suas atribuições legais, Considerando a Portaria GM/MS nº 1.319, de 23 de julho de 2002, que cria, no âmbito
Portaria SAS/MS nº 472, de 24 de julho de 2002. O Secretário de Assistência à Saúde, no uso de suas atribuições legais, Considerando a Portaria GM/MS nº 1.319, de 23 de julho de 2002, que cria, no âmbito
DELIBERAÇÃO CIB-SUS/MG Nº 2.512, DE 19 DE JULHO DE 2017.
 DELIBERAÇÃO CIB-SUS/MG Nº 2.512, DE 19 DE JULHO DE 2017. Aprova o Protocolo Estadual para Dispensação de Insumos para Monitoramento de Diabetes no âmbito do SUS-MG. A Comissão Intergestores Bipartite do
DELIBERAÇÃO CIB-SUS/MG Nº 2.512, DE 19 DE JULHO DE 2017. Aprova o Protocolo Estadual para Dispensação de Insumos para Monitoramento de Diabetes no âmbito do SUS-MG. A Comissão Intergestores Bipartite do
ANEXO I. Norma Técnica Estadual de Utilização do Anticorpo Monoclonal. para Profilaxia do Vírus Sincicial Respiratório (PALIVIZUMABE).
 1-INTRODUÇÃO: ANEXO I Norma Técnica Estadual de Utilização do Anticorpo Monoclonal para Profilaxia do Vírus Sincicial Respiratório (PALIVIZUMABE). 1.1As infecções de trato respiratório inferior pelo VSR
1-INTRODUÇÃO: ANEXO I Norma Técnica Estadual de Utilização do Anticorpo Monoclonal para Profilaxia do Vírus Sincicial Respiratório (PALIVIZUMABE). 1.1As infecções de trato respiratório inferior pelo VSR
ANEXO I NORMAS DE HABILITAÇÃO PARA A ATENÇÃO ESPECIALIZADA NO PROCESSO TRANSEXUALIZADOR
 ANEXO I NORMAS DE HABILITAÇÃO PARA A ATENÇÃO ESPECIALIZADA NO PROCESSO TRANSEXUALIZADOR 1. NORMAS DE HABILITAÇÃO PARA A MODALIDADE AMBULATORIAL 1.1. A Modalidade Ambulatorial consiste nas ações de âmbito
ANEXO I NORMAS DE HABILITAÇÃO PARA A ATENÇÃO ESPECIALIZADA NO PROCESSO TRANSEXUALIZADOR 1. NORMAS DE HABILITAÇÃO PARA A MODALIDADE AMBULATORIAL 1.1. A Modalidade Ambulatorial consiste nas ações de âmbito
Notificações e Segurança do Paciente Profa Dra Silvana Andrea Molina Lima Enfa Simone Fernanda Gonçalves
 Notificações e Segurança do Paciente Profa Dra Silvana Andrea Molina Lima Enfa Simone Fernanda Gonçalves Gerente de Risco Sanitário Hospitalar do HCFMB Presidente da Comissão de Segurança do Paciente do
Notificações e Segurança do Paciente Profa Dra Silvana Andrea Molina Lima Enfa Simone Fernanda Gonçalves Gerente de Risco Sanitário Hospitalar do HCFMB Presidente da Comissão de Segurança do Paciente do
MÉDICO PEDIATRA. Requisitos: - Graduação em medicina; - Residência em Pediatria. Horário: - Plantão 12h (sábado) - Unidade de Internação
 MÉDICO PEDIATRA - Residência em Pediatria. Horário: - Plantão 12h (sábado) - Unidade de Internação - O vínculo será através de Pessoa Jurídica. - 01 vaga. colocando no assunto: Médico Pediatra. MÉDICO
MÉDICO PEDIATRA - Residência em Pediatria. Horário: - Plantão 12h (sábado) - Unidade de Internação - O vínculo será através de Pessoa Jurídica. - 01 vaga. colocando no assunto: Médico Pediatra. MÉDICO
GRUPO PERINATAL PIONEIRISMO E EXCELÊNCIA. ESSA É A NOSSA VOCAÇÃO.
 GUIA DO MÉDICO GRUPO PERINATAL PIONEIRISMO E EXCELÊNCIA. ESSA É A NOSSA VOCAÇÃO. PRÉ-NATAL MEDICINA FETAL DIAGNÓSTICA CIRURGIA FETAL E NEONATAL OBSTETRÍCIA E GINECOLOGIA NEONATOLOGIA CENTRO DE CIRURGIA
GUIA DO MÉDICO GRUPO PERINATAL PIONEIRISMO E EXCELÊNCIA. ESSA É A NOSSA VOCAÇÃO. PRÉ-NATAL MEDICINA FETAL DIAGNÓSTICA CIRURGIA FETAL E NEONATAL OBSTETRÍCIA E GINECOLOGIA NEONATOLOGIA CENTRO DE CIRURGIA
Componente Especializado da Assistência Farmacêutica. Revisão da 2ª Edição: Carolina Rodrigues Gomes e Vera Lúcia Edais Pepe
 Componente Especializado da Assistência Farmacêutica Autora: Tatiana Aragão Figueiredo Revisão da 2ª Edição: Carolina Rodrigues Gomes e Vera Lúcia Edais Pepe Revisoras da 1ª Edição: Ana Márcia Messeder
Componente Especializado da Assistência Farmacêutica Autora: Tatiana Aragão Figueiredo Revisão da 2ª Edição: Carolina Rodrigues Gomes e Vera Lúcia Edais Pepe Revisoras da 1ª Edição: Ana Márcia Messeder
Nota Técnica GAF/CCTIES nº 02, de 12 de março de 2014
 Nota Técnica GAF/CCTIES nº 02, de 12 de março de 2014 Assunto: Padronização do fluxo de dispensação de medicamentos aos portadores de Doença Pulmonar Obstrutiva Crônica - DPOC, atendidos no Estado de São
Nota Técnica GAF/CCTIES nº 02, de 12 de março de 2014 Assunto: Padronização do fluxo de dispensação de medicamentos aos portadores de Doença Pulmonar Obstrutiva Crônica - DPOC, atendidos no Estado de São
Farmácia Clínica Farmácia Clínica
 Farmácia Clínica Farmácia Clínica A evolução da FH e o surgimento da FC: Final da década de 1950 FDA e American Medical Association conscientização dos farmacêuticos no sentido de controlar as reações
Farmácia Clínica Farmácia Clínica A evolução da FH e o surgimento da FC: Final da década de 1950 FDA e American Medical Association conscientização dos farmacêuticos no sentido de controlar as reações
POLÍTICA NACIONAL DE INTERNAÇÃO DOMICILIAR
 NOTA TÉCNICA 02 2006 POLÍTICA NACIONAL DE INTERNAÇÃO DOMICILIAR 1 Brasília, 10 de fevereiro de 2006. I. Introdução: NOTA TÉCNICA 02 2006 O Ministério da Saúde está propondo a implantação da Política Nacional
NOTA TÉCNICA 02 2006 POLÍTICA NACIONAL DE INTERNAÇÃO DOMICILIAR 1 Brasília, 10 de fevereiro de 2006. I. Introdução: NOTA TÉCNICA 02 2006 O Ministério da Saúde está propondo a implantação da Política Nacional
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA
 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016
 RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
Informe Técnico - SARAMPO nº4 Atualização da Situação Epidemiológica
 SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE CONTROLE DE DOENÇAS CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA PROF. ALEXANDRE VRANJAC DIVISÃO DE DOENÇAS DE TRANSMISSÃO RESPIRATÓRIA Informe Técnico - SARAMPO nº4
SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE CONTROLE DE DOENÇAS CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA PROF. ALEXANDRE VRANJAC DIVISÃO DE DOENÇAS DE TRANSMISSÃO RESPIRATÓRIA Informe Técnico - SARAMPO nº4
Dispõe sobre os serviços e procedimentos farmacêuticos permitidos às farmácias no âmbito do Estado de São Paulo e dá outras providências.
 SUBSTITUTIVO Dê-se ao Projeto de Lei nº 27, de 2017, a seguinte redação: Dispõe sobre os serviços e procedimentos farmacêuticos permitidos às farmácias no âmbito do Estado de São Paulo e dá outras providências.
SUBSTITUTIVO Dê-se ao Projeto de Lei nº 27, de 2017, a seguinte redação: Dispõe sobre os serviços e procedimentos farmacêuticos permitidos às farmácias no âmbito do Estado de São Paulo e dá outras providências.
Prefeitura Municipal de Jaraguá do Sul. Fundo Municipal de Assistência e Saúde
 Prefeitura Municipal de Jaraguá do Sul Instituto de Seguridade dos Servidores Municipais Fundo Municipal de Assistência e Saúde INFORMATIVO SOBRE A UTILIZAÇÃO DO CARTÃO SEGURADO ISSEM Você recebeu o Cartão
Prefeitura Municipal de Jaraguá do Sul Instituto de Seguridade dos Servidores Municipais Fundo Municipal de Assistência e Saúde INFORMATIVO SOBRE A UTILIZAÇÃO DO CARTÃO SEGURADO ISSEM Você recebeu o Cartão
PARECER CONSULTA N 22/2017
 PARECER CONSULTA N 22/2017 PROCESSO CONSULTA CRM-ES N 38/2013 INTERESSADO: Dr. FAT ASSUNTO: Dispensação de medicamento excepcional CONSELHEIRO PARECERISTA: Dr. Thales Gouveia Limeira APROVAÇÃO PLENÁRIA:
PARECER CONSULTA N 22/2017 PROCESSO CONSULTA CRM-ES N 38/2013 INTERESSADO: Dr. FAT ASSUNTO: Dispensação de medicamento excepcional CONSELHEIRO PARECERISTA: Dr. Thales Gouveia Limeira APROVAÇÃO PLENÁRIA:
RELATÓRIO DE GESTÃO 2012 CFT COMISSÃO DE FARMÁCIA E TERAPÊUTICA
 RELATÓRIO DE GESTÃO 2012 CFT COMISSÃO DE FARMÁCIA E TERAPÊUTICA 1. APRESENTAÇÃO O objetivo principal da Comissão de Farmácia e Terapêutica é elaborar a cada dois anos a padronização de medicamentos disponível
RELATÓRIO DE GESTÃO 2012 CFT COMISSÃO DE FARMÁCIA E TERAPÊUTICA 1. APRESENTAÇÃO O objetivo principal da Comissão de Farmácia e Terapêutica é elaborar a cada dois anos a padronização de medicamentos disponível
ASPECTOS JURÍDICOS DA FARMÁCIA CLÍNICA E DA PRESCRIÇÃO FARMACÊUTICA S Ã O P A U L O, 2 8 D E J U L H O D E
 ASPECTOS JURÍDICOS DA FARMÁCIA CLÍNICA E DA PRESCRIÇÃO FARMACÊUTICA S Ã O P A U L O, 2 8 D E J U L H O D E 2 0 1 6 FARMÁCIA CLÍNICA Definição da Sociedade Europeia de Farmácia Clínica: "uma especialidade
ASPECTOS JURÍDICOS DA FARMÁCIA CLÍNICA E DA PRESCRIÇÃO FARMACÊUTICA S Ã O P A U L O, 2 8 D E J U L H O D E 2 0 1 6 FARMÁCIA CLÍNICA Definição da Sociedade Europeia de Farmácia Clínica: "uma especialidade
VÍDEO INSTITUCIONAL UNIMED VALE DO SINOS/RS
 VÍDEO INSTITUCIONAL UNIMED VALE DO SINOS/RS HOSPITAL UNIMED VALE DO SINOS/RS CENTRO DE ONCOLOGIA Viabilidade e desempenho da equipe multidisciplinar Foto1 1.1 NECESSIDADE DO SERVIÇO - Reduzir o alto custo
VÍDEO INSTITUCIONAL UNIMED VALE DO SINOS/RS HOSPITAL UNIMED VALE DO SINOS/RS CENTRO DE ONCOLOGIA Viabilidade e desempenho da equipe multidisciplinar Foto1 1.1 NECESSIDADE DO SERVIÇO - Reduzir o alto custo
Cristian Portela Hospital Evangélico de Londrina - PR
 ADEQUAÇÃO DO PROCESSO DA CADEIA MEDICAMENTOSA, POR MEIO DO LEAN SIX SIGMA O HOSPITAL EVANGÉLICO DE LONDRINA-PR. Cristian Portela Hospital Evangélico de Londrina - PR INTRODUÇÃO Em outubro de 2015 o Hospital
ADEQUAÇÃO DO PROCESSO DA CADEIA MEDICAMENTOSA, POR MEIO DO LEAN SIX SIGMA O HOSPITAL EVANGÉLICO DE LONDRINA-PR. Cristian Portela Hospital Evangélico de Londrina - PR INTRODUÇÃO Em outubro de 2015 o Hospital
F - ÁREA PROFISSIONAL FARMÁCIA. F 17 - FARMÁCIA HOSPITALAR E CLÍNICA - InCor. Titulação: Aprimoramento
 F - ÁREA PROFISSIONAL FARMÁCIA F 17 - FARMÁCIA HOSPITALAR E CLÍNICA - InCor Titulação: Aprimoramento Supervisor: Dra Ana Carolina Colmanetti Nogueira Garcia Características: (duração 12 meses) Dirigido
F - ÁREA PROFISSIONAL FARMÁCIA F 17 - FARMÁCIA HOSPITALAR E CLÍNICA - InCor Titulação: Aprimoramento Supervisor: Dra Ana Carolina Colmanetti Nogueira Garcia Características: (duração 12 meses) Dirigido
de 5 ml) Anexos - Relato detalhado do médico assistente. Obrigatórios - Formulários médico e farmacêutico, devidamente preenchidos
 GLAUCOMA Portaria SAS/MS n 1279 19/11/2013 CID 10 H40.1; H40.2; H40.3; H40.4; H40.5; H40.6; H40.8; Q15.0 Medicamento BIMATOPROSTA BRIMONIDINA BRINZOLAMIDA DORZOLAMIDA Apresentação 0,3 mg/ml solução 2,0
GLAUCOMA Portaria SAS/MS n 1279 19/11/2013 CID 10 H40.1; H40.2; H40.3; H40.4; H40.5; H40.6; H40.8; Q15.0 Medicamento BIMATOPROSTA BRIMONIDINA BRINZOLAMIDA DORZOLAMIDA Apresentação 0,3 mg/ml solução 2,0
Ministério da Saúde Secretaria de Atenção à Saúde PORTARIA Nº 594, DE 29 DE OUTUBRO DE 2010
 Ministério da Saúde Secretaria de à Saúde PORTARIA Nº 594, DE 29 DE OUTUBRO DE 2010 O Secretário de à Saúde, no uso de suas atribuições, Considerando a Portaria SAS/MS n 511, de 02 de dezembro de 2000,
Ministério da Saúde Secretaria de à Saúde PORTARIA Nº 594, DE 29 DE OUTUBRO DE 2010 O Secretário de à Saúde, no uso de suas atribuições, Considerando a Portaria SAS/MS n 511, de 02 de dezembro de 2000,
Prof. Márcio Batista
 Prof. Márcio Batista OBJETIVOS DA AULA Conhecer os principais conceitos em farmácia hospitalar. Conhecer os aspectos técnicos e legais de localização, construção e instalação e estruturação da farmácia
Prof. Márcio Batista OBJETIVOS DA AULA Conhecer os principais conceitos em farmácia hospitalar. Conhecer os aspectos técnicos e legais de localização, construção e instalação e estruturação da farmácia
Ampliação de concentrações de somatropina para o tratamento de pacientes com síndrome de Turner e de pacientes com deficiência de hormônio de
 Ampliação de concentrações de somatropina para o tratamento de pacientes com síndrome de Turner e de pacientes com deficiência de hormônio de crescimento Hipopituitarismo Nº 297 Outubro/2017 1 2017 Ministério
Ampliação de concentrações de somatropina para o tratamento de pacientes com síndrome de Turner e de pacientes com deficiência de hormônio de crescimento Hipopituitarismo Nº 297 Outubro/2017 1 2017 Ministério
PROCEDIMENTOS PARA entrega de documentos (BMPO, RMNRA, RMNRB2) por estabelecimentos (Farmácias/Drogarias) localizados no Município de Fortaleza-CE
 PROCEDIMENTOS PARA entrega de documentos (BMPO, RMNRA, RMNRB2) por estabelecimentos (Farmácias/Drogarias) localizados no Município de Fortaleza-CE CONSIDERAÇÕES CONSIDERANDO a Portaria Federal SVS/MS Nº344,
PROCEDIMENTOS PARA entrega de documentos (BMPO, RMNRA, RMNRB2) por estabelecimentos (Farmácias/Drogarias) localizados no Município de Fortaleza-CE CONSIDERAÇÕES CONSIDERANDO a Portaria Federal SVS/MS Nº344,
PORTARIA 1.918/2016 O CUIDADO FARMACÊUTICO NO ÂMBITO DA SMS SP
 PORTARIA 1.918/2016 O CUIDADO FARMACÊUTICO NO ÂMBITO DA SMS SP PORTARIA 1.918 / 2016 Art. 1º Instituir o Cuidado Farmacêutico na Rede de Atenção Básica e de Especialidades na SMS-SP. OBJETIVO Art.3º Melhorar
PORTARIA 1.918/2016 O CUIDADO FARMACÊUTICO NO ÂMBITO DA SMS SP PORTARIA 1.918 / 2016 Art. 1º Instituir o Cuidado Farmacêutico na Rede de Atenção Básica e de Especialidades na SMS-SP. OBJETIVO Art.3º Melhorar
Nota Técnica GAF/CCTIES nº 03, 19 de março de 2014
 Nota Técnica GAF/CCTIES nº 03, 19 de março de 2014 Assunto: Padronização do Fluxo de Dispensação dos medicamentos para Tratamento de Glaucoma nas Farmácias de Medicamentos Especializados (FME) da Secretaria
Nota Técnica GAF/CCTIES nº 03, 19 de março de 2014 Assunto: Padronização do Fluxo de Dispensação dos medicamentos para Tratamento de Glaucoma nas Farmácias de Medicamentos Especializados (FME) da Secretaria
Área Física e infraestrutura; Estrutura Organizacional; Farmácia Satélite; Padronização de Medicamentos:
 Área Física e infraestrutura; Estrutura Organizacional; Farmácia Satélite; Padronização de Medicamentos: DEFINIÇÃO De acordo com o Conselho Federal de Farmácia (CFF), Farmácia Hospitalar e outros serviços
Área Física e infraestrutura; Estrutura Organizacional; Farmácia Satélite; Padronização de Medicamentos: DEFINIÇÃO De acordo com o Conselho Federal de Farmácia (CFF), Farmácia Hospitalar e outros serviços
CCIH Núcleo de Segurança. Camila Barcia
 CCIH Núcleo de Segurança do Paciente Camila Barcia O que é Infecção Hospitalar? Conceitos Infecção Hospitalar: Qualquer infecção adquirida após a internação do paciente, que se manifeste durante a internação
CCIH Núcleo de Segurança do Paciente Camila Barcia O que é Infecção Hospitalar? Conceitos Infecção Hospitalar: Qualquer infecção adquirida após a internação do paciente, que se manifeste durante a internação
Kelly Braga. Farmácia Hospitalar
 Curso de Atualização em Boas Práticas de Farmácia Hospitalar Aula Inaugural Introdução as Boas Práticas da Farmácia Hospitalar Kelly Braga Farmácia Hospitalar Unidade clínica, administrativa a e econômica,
Curso de Atualização em Boas Práticas de Farmácia Hospitalar Aula Inaugural Introdução as Boas Práticas da Farmácia Hospitalar Kelly Braga Farmácia Hospitalar Unidade clínica, administrativa a e econômica,
Revisão dos regulamentos em Farmacovigilância
 Revisão dos regulamentos em Farmacovigilância Gerência de Farmacovigilância GFARM São Paulo Abril/2019 Compromissos Anvisa - ICH 3 Guias do ICH (Farmacovigilância) Implementação até 2021 E2B: elementos
Revisão dos regulamentos em Farmacovigilância Gerência de Farmacovigilância GFARM São Paulo Abril/2019 Compromissos Anvisa - ICH 3 Guias do ICH (Farmacovigilância) Implementação até 2021 E2B: elementos
Farmacêutica Priscila Xavier Farmacêutica Cynthia Palheiros
 Farmacêutica Priscila Xavier Farmacêutica Cynthia Palheiros Ciência e das atividades relativas à detecção, avaliação, compreensão e prevenção de efeitos adversos ou quaisquer outros possíveis problemas
Farmacêutica Priscila Xavier Farmacêutica Cynthia Palheiros Ciência e das atividades relativas à detecção, avaliação, compreensão e prevenção de efeitos adversos ou quaisquer outros possíveis problemas
Ana Fernanda Yamazaki Centrone Enfermeira Centro de Oncologia e Hematologia Hospital Albert Einstein
 Ana Fernanda Yamazaki Centrone Enfermeira Centro de Oncologia e Hematologia Hospital Albert Einstein Ato de evitar, prevenir e melhorar os resultados adversos ou as lesões originadas no processo de atendimento
Ana Fernanda Yamazaki Centrone Enfermeira Centro de Oncologia e Hematologia Hospital Albert Einstein Ato de evitar, prevenir e melhorar os resultados adversos ou as lesões originadas no processo de atendimento
Uso Racional de Medicamentos. Felipe Dias Carvalho Consultor Nacional de Desenvolvimento e Inovação Tecnológica em Saúde OPAS/OMS
 Uso Racional de Medicamentos Felipe Dias Carvalho Consultor Nacional de Desenvolvimento e Inovação Tecnológica em Saúde OPAS/OMS Conceito URM - OMS Existe uso racional quando os pacientes recebem medicamentos
Uso Racional de Medicamentos Felipe Dias Carvalho Consultor Nacional de Desenvolvimento e Inovação Tecnológica em Saúde OPAS/OMS Conceito URM - OMS Existe uso racional quando os pacientes recebem medicamentos
TOTVS Gestão Hospitalar Manual Ilustrado Registro de Atendimento Externo x. março de Versão: 3.0
 TOTVS Gestão Hospitalar Manual Ilustrado Registro de Atendimento Externo 11.8.x março de 2015 Versão: 3.0 1 Sumário 1 Registro de Atendimento Externo... 3 2 Registrando o atendimento... 3 3 Atendimento
TOTVS Gestão Hospitalar Manual Ilustrado Registro de Atendimento Externo 11.8.x março de 2015 Versão: 3.0 1 Sumário 1 Registro de Atendimento Externo... 3 2 Registrando o atendimento... 3 3 Atendimento
ASSISTÊNCIA FARMACÊUTICA CEMEPAR. Junho/2011
 ASSISTÊNCIA FARMACÊUTICA CEMEPAR Junho/2011 ASSISTÊNCIA FARMACÊUTICA - HISTÓRICO A Assistência Farmacêutica no Brasil, como política pública, teve início em 1971, com a instituição da Central de Medicamentos
ASSISTÊNCIA FARMACÊUTICA CEMEPAR Junho/2011 ASSISTÊNCIA FARMACÊUTICA - HISTÓRICO A Assistência Farmacêutica no Brasil, como política pública, teve início em 1971, com a instituição da Central de Medicamentos
RESOLUÇÃO Nº 654 DE 22 DE FEVEREIRO DE 2018
 RESOLUÇÃO Nº 654 DE 22 DE FEVEREIRO DE 2018 Ementa: Dispõe sobre os requisitos necessários à prestação do serviço de vacinação pelo farmacêutico e dá outras providências. O Conselho Federal de Farmácia
RESOLUÇÃO Nº 654 DE 22 DE FEVEREIRO DE 2018 Ementa: Dispõe sobre os requisitos necessários à prestação do serviço de vacinação pelo farmacêutico e dá outras providências. O Conselho Federal de Farmácia
A PROPOSTA DE INSERÇÃO DA ASSISTÊNCIA FARMACÊUTICA NAS REDES DE ATENÇÃO À SAÚDE NO ESTADO DE SÃO PAULO
 A PROPOSTA DE INSERÇÃO DA ASSISTÊNCIA FARMACÊUTICA NAS REDES DE ATENÇÃO À SAÚDE NO ESTADO DE SÃO PAULO Profa. Dra. Diretor Técnico de Departamento de Saúde Núcleo de Assistência Farmacêutica SES - SP Insistimos
A PROPOSTA DE INSERÇÃO DA ASSISTÊNCIA FARMACÊUTICA NAS REDES DE ATENÇÃO À SAÚDE NO ESTADO DE SÃO PAULO Profa. Dra. Diretor Técnico de Departamento de Saúde Núcleo de Assistência Farmacêutica SES - SP Insistimos
MINISTÉRIO DA SAÚDE GABINETE DO MINISTRO PORTARIA Nº 2.647, DE 4 DE NOVEMBRO DE 2013 MINISTÉRIO DA SAÚDE GABINETE DO MINISTRO
 MINISTÉRIO DA SAÚDE GABINETE DO MINISTRO PORTARIA Nº 2.647, DE 4 DE NOVEMBRO DE 2013 MINISTÉRIO DA SAÚDE GABINETE DO MINISTRO DOU de 05/11/2013 (nº 215, Seção 1, pág. 41) Institui a Rede Brasileira de
MINISTÉRIO DA SAÚDE GABINETE DO MINISTRO PORTARIA Nº 2.647, DE 4 DE NOVEMBRO DE 2013 MINISTÉRIO DA SAÚDE GABINETE DO MINISTRO DOU de 05/11/2013 (nº 215, Seção 1, pág. 41) Institui a Rede Brasileira de
Ref.: Lei Federal nº , de 8 agosto de 2014 DOU Dispõe sobre o exercício e a fiscalização das atividades farmacêuticas.
 Rio de Janeiro, 13 de agosto de 2014. Of. Circ. Nº 256/14 Ref.: Lei Federal nº 13.021, de 8 agosto de 2014 DOU 12.08.2014 Dispõe sobre o exercício e a fiscalização das atividades farmacêuticas. Senhor
Rio de Janeiro, 13 de agosto de 2014. Of. Circ. Nº 256/14 Ref.: Lei Federal nº 13.021, de 8 agosto de 2014 DOU 12.08.2014 Dispõe sobre o exercício e a fiscalização das atividades farmacêuticas. Senhor
XXVII CONGRESSO do COSEMS/SP Regulação do Acesso
 XXVII CONGRESSO do COSEMS/SP Regulação do Acesso Elaine Mª Giannotti Assessora Técnica COSEMS/SP REGULAÇÃO DA ATENÇÃO çãoa regulação da atenção à saúde tem como objeto a produção das ações diretas e finais
XXVII CONGRESSO do COSEMS/SP Regulação do Acesso Elaine Mª Giannotti Assessora Técnica COSEMS/SP REGULAÇÃO DA ATENÇÃO çãoa regulação da atenção à saúde tem como objeto a produção das ações diretas e finais
