H = - = 2 (-110,5) (-910,9) H
|
|
|
- Natan Zagalo Franco
- 7 Há anos
- Visualizações:
Transcrição
1 UNESP A areia comum tem como constituinte principal o mineral quartzo (SiO 2 ), a partir do qual pode ser obtido o silício, que é utilizado na fabricação de microchips. A obtenção do silício para uso na fabricação de processadores envolve uma série de etapas. Na primeira, obtém-se o silício metalúrgico, por reação do óxido com coque, em forno de arco elétrico, à temperatura superior a ºC. Uma das equações que descreve o processo de obtenção do silício é apresentada a seguir: SiO 2(s) + 2C (s) Si (l) + 2CO (g) De acordo com as informações do texto, é correto afirmar que o processo descrito para a obtenção do silício metalúrgico corresponde a uma reação (A) endotérmica e de oxirredução, na qual o Si 4+ é reduzido a Si. (B) espontânea, na qual ocorre a combustão do carbono. (C) exotérmica, na qual ocorre a substituição do Si por C. (D) exotérmica, na qual ocorre a redução do óxido de silício. (E) endotérmica e de dupla troca. Resposta: A H = H produto - H reagente H = 2 x (-110,5) (-910,9) H = + 689,9 kj Reação endotérmica, já que o H é maior que zero. Oxirredução: SiO 2 : NOX do silício: X + 2(-2) = 0 X = +4 Si: NOX = zero (substânica simples). Instrução: Leia o texto para responder às questões de números 2 e 3. O silício metalúrgico, purificado até atingir 99,99% de pureza, é conhecido como silício eletrônico. Quando cortado em fatias finas, recobertas com cobre por um processo
2 eletrolítico e montadas de maneira interconectada, o silício eletrônico transforma-se em microchips. A figura reproduz uma das últimas etapas da preparação de um microchip. As fatias de silício são colocadas numa solução de sulfato de cobre. Nesse processo, íons de cobre deslocam-se para a superfície da fatia (cátodo), aumentando a sua condutividade elétrica. 2-O processo de recobrimento das fatias de silício é conhecido como (A) eletrocoagulação. (B) eletrólise ígnea. (C) eletrodeformação. (D) galvanoplastia. (E) anodização. Resposta: D Galvanoplastia é um processo em que metais são revestidos por outros mais nobres, geralmente para proteger da corrosão ou para fins estéticos/decorativos. Assim, caso ocorra danificação, será sempre mais fácil trocar o material revestidor do que o revestido. 3-A semirreação na superfície da fatia de silício, cátodo, é representada por: (A) Cu H 2 O O 2(g) + 4H + + Cu (s). (B) 2Cu + + H 2 O 2Cu (s) + H 2 O + 2e.
3 (C) 2SO 4 2e S 2 O e. (D) Si (s) + 4e Si 4+ (s). (E) Cu e Cu (s). Resposta: E Já que o cobre sofre redução, a semirreação do cátodo (cátodo reduz) deve ser a representada na letra E. Instrução: Leia o texto para responder às questões de números 4 a 5. Alguns cheiros nos provocam fascínio e atração. Outros trazem recordações agradáveis, até mesmo de momentos da infância. Aromas podem causar sensação de bem-estar ou dar a impressão de que alguém está mais atraente. Os perfumes têm sua composição aromática distribuída em um modelo conhecido como pirâmide olfativa, dividida horizontalmente em três partes e caracterizada pelo termo nota. As notas de saída, constituídas por substâncias bem voláteis, dão a primeira impressão do perfume. As de coração demoram um pouco mais para serem sentidas. São as notas de fundo que permanecem mais tempo na pele. (Cláudia M. Rezende. Ciência Hoje, julho de Adaptado.) 4- À temperatura e pressão ambientes, os constituintes químicos das notas de saída (A) são líquidos oleosos que aderem à pele por meio de ligações de hidrogênio. (B) evaporam mais rapidamente que os constituintes químicos das notas de coração e de fundo. (C) apresentam densidade mais elevada que os constituintes químicos das notas de coração e de fundo. (D) são gases cujas moléculas possuem elevada polaridade.
4 (E) são pouco solúveis no ar atmosférico. Resposta: B Dizer que as notas de saídas são substâncias bem voláteis significa dizer que eles evaporam rapidamente. 5-Um químico, ao desenvolver um perfume, decidiu incluir entre os componentes um aroma de frutas com concentração máxima de 10 4 mol/l. Ele dispõe de um frasco da substância aromatizante, em solução hidroalcoólica, com concentração de 0,01 mol/l. Para a preparação de uma amostra de 0,50 L do novo perfume, contendo o aroma de frutas na concentração desejada, o volume da solução hidroalcoólica que o químico deverá utilizar será igual a: (A) 5,0 ml. (B) 2,0 ml. (C) 0,50 ml. (D) 1,0 ml. (E) 0,20 ml. Resposta: A Número de mols da substância: n = M. V n = ,5 n = 5 x 10-5 mols Volume: 0,01 mol 1L 5 x 10-5 mols X L X = 5 x 10-3 L ou 5,0 ml 6-A β-ionona é uma substância química de vasta aplicação na perfumaria, em produtos cuja fórmula requer aroma floral.
5 A substância química β-ionona (A) apresenta, em soluções aquosas, atividade óptica. (B) reage com água, formando diois vicinais. (C) contém três grupos metila, ligados a átomos de carbono idênticos. (D) contém duplas ligações conjugadas. (E) possui grupos funcionais com propriedades oxidantes. Resposta: D A β-ionona não pode apresentar atividade óptica porque não possui isomeria óptica (não tem, por exemplo, carbono assimétrico). Para que ocorra a reação em água citada é preciso à presença de ácido sulfúrico. A substância possui 3 grupos metil, mas não ligados a átomos de carbono idênticos. A molécula possui grupos com características redutoras. Logo, a única opção viável é a letra D. 7-Em um laboratório de química, dois estudantes realizam um experimento com o objetivo de determinar a velocidade da reação apresentada a seguir. MgCO 3(s) + 2HCl (aq) MgCl 2(aq) + H 2 O (l) + CO 2(g) Sabendo que a reação ocorre em um sistema aberto, o parâmetro do meio reacional que deverá ser considerado para a determinação da velocidade dessa reação é (A) a diminuição da concentração de íons Mg 2+. (B) o teor de umidade no interior do sistema. (C) a diminuição da massa total do sistema. (D) a variação da concentração de íons Cl. (E) a elevação da pressão do sistema. Resposta: C
6 Estando em sistema aberto, o CO 2, por ser gasoso irá escapar, o que faz a massa total do sistema diminuir. UNESP ABERTAS 1- A taurina é uma substância química que se popularizou como ingrediente de bebidas do tipo energéticos. Foi isolada pela primeira vez a partir da bile bovina, em Na literatura médica e científica, a taurina é frequentemente apresentada como um aminoácido. Entretanto, tecnicamente a taurina é apenas uma substância análoga aos aminoácidos. Explique por que a taurina não pode ser rigorosamente classificada como um aminoácido e, sabendo que, em soluções aquosas de ph neutro, a taurina encontrase como um sal interno, devido aos grupos ionizados (zwitterion), escreva a equação que representa essa dissociação em água com ph igual a 7. Para ser um aminoácido, a substância deve conter o grupamento amina e o grupamento ácido carboxílico. Na taurina há o grupo amina e o ácido sulfônico. Equação da dissociação: 2-O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador.
7 Com base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador. A presença de um catalisador acelera a velocidade de uma reação, fazendo com que a energia de ativação da mesma diminua. Logo, a curva que representa a reação com catalisador é a II. Porém, o catalisador não modifica a variação de entalpia da reação. 3- A imagem é a fotografia de uma impressão digital coletada na superfície de um pedaço de madeira. Para obtê-la, foi utilizada uma técnica baseada na reação entre o sal do suor (NaCl), presente na impressão digital, com solução aquosa diluída de um reagente específico. Depois de secar em uma câmara escura, a madeira é exposta à luz solar. Considere soluções aquosas diluídas de AgNO 3 e de KNO 3. Indique qual delas produziria um registro fotográfico de impressão digital ao reagir com o sal do suor, nas condições descritas, e justifique sua resposta descrevendo as reações químicas envolvidas. A solução de AgNO 3 seria a indicada, pois como será visto na reação, haverá formação de Ag, que possui coloração preta. AgNO 3(aq) + NaCl (aq) AgCl (s) + NaNO 3(aq) O AgCl na presença de luz se decompõe: AgCl (s) Ag (s) + 1/2Cl 2(g)
UNESP 2013 Vestibular de verão - 1ª fase - Prova de conhecimentos gerais
 UNESP 2013 Vestibular de verão - 1ª fase - Prova de conhecimentos gerais Questão 69 A areia comum tem como constituinte principal o mineral quartzo (SiO 2 ), a partir do qual pode ser obtido o silício,
UNESP 2013 Vestibular de verão - 1ª fase - Prova de conhecimentos gerais Questão 69 A areia comum tem como constituinte principal o mineral quartzo (SiO 2 ), a partir do qual pode ser obtido o silício,
Conteúdo: Eletrólise (ígnea, aquosa e aspectos quantitativos)
 3º Trimestre Sala de Estudo - Química Data: 30/10/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletrólise (ígnea, aquosa e aspectos quantitativos) Questão 01 - (PUC Camp SP/2017)
3º Trimestre Sala de Estudo - Química Data: 30/10/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletrólise (ígnea, aquosa e aspectos quantitativos) Questão 01 - (PUC Camp SP/2017)
Especial Específicas (UNIFESP, UNESP, UEPG)
 Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
Pb 2e Pb E 0,13 v. Ag 2e Ag E +0,80 v. Zn 2e Zn E 0,76 v. Al 3e Al E 1,06 v. Mg 2e Mg E 2,4 v. Cu 2e Cu E +0,34 v
 QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
Calcule o calor de combustão do metano (CH 4) sabendo que: Entalpia de combustão ou calor de combustão é a variação de entalpia (ΔH) na reação de
 QUÍMICA 3ºCOLEGIAL 1302 TERMOQUÍMICA Cálculo de Entalpia - Reação balanceada - Reação global através da Lei de Hess uma equação termoquímica pode ser expressa pela soma de 2 ou mais equações. Forma de
QUÍMICA 3ºCOLEGIAL 1302 TERMOQUÍMICA Cálculo de Entalpia - Reação balanceada - Reação global através da Lei de Hess uma equação termoquímica pode ser expressa pela soma de 2 ou mais equações. Forma de
Qui. Professores: Allan Rodrigues Xandão Monitor: Renan Micha
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
COMISSÃO PERMANENTE DE SELEÇÃO COPESE PRÓ-REITORIA DE GRADUAÇÃO PROGRAD PISM III- TRIÊNIO PROVA DE QUÍMICA
 Questão 1: O butano é um gás usado, por exemplo, como combustível em isqueiros, onde, sob pressão, é armazenado como líquido. Na presença de catalisador, o equilíbrio é estabelecido entre os isômeros butano
Questão 1: O butano é um gás usado, por exemplo, como combustível em isqueiros, onde, sob pressão, é armazenado como líquido. Na presença de catalisador, o equilíbrio é estabelecido entre os isômeros butano
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS
 PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
LISTA DE EXERCÍCIOS DE RECUPERAÇÃO FINAL QUÍMICA
 LISTA DE EXERCÍCIOS DE RECUPERAÇÃO FINAL QUÍMICA ALUNO(a): Valor: Nº: SÉRIE: 2ª TURMA: 20,0 UNIDADE: VV JC JP PC DATA: / /2018 Obs.: Esta lista deve ser entregue resolvida no dia da prova de Recuperação.
LISTA DE EXERCÍCIOS DE RECUPERAÇÃO FINAL QUÍMICA ALUNO(a): Valor: Nº: SÉRIE: 2ª TURMA: 20,0 UNIDADE: VV JC JP PC DATA: / /2018 Obs.: Esta lista deve ser entregue resolvida no dia da prova de Recuperação.
21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p =
 PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
QUÍMICA. 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica:
 QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
QUESTÕES OBJETIVAS. a) b) +110 c) -55 d) -110 e) -676
 QUESTÕES OBJETIVAS Questão 9: O óxido de cálcio, conhecido como cal virgem, é comumente utilizado na construção civil. Sobre essa substância é INCORRETO afirmar que: a) pode ser obtida pelo aquecimento
QUESTÕES OBJETIVAS Questão 9: O óxido de cálcio, conhecido como cal virgem, é comumente utilizado na construção civil. Sobre essa substância é INCORRETO afirmar que: a) pode ser obtida pelo aquecimento
Q.02 Considere uma solução aquosa diluída de dicromato de potássio, a 25 ºC. Dentre os equilíbrios que estão presentes nessa solução, destacam-se:
 Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162
 Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162 1) Explique porque uma solução eletrolítica é capaz de conduzir eletricidade. 2) O Hidróxido de Bário Ba(OH) 2, um composto
Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162 1) Explique porque uma solução eletrolítica é capaz de conduzir eletricidade. 2) O Hidróxido de Bário Ba(OH) 2, um composto
Resposta: D Resolução comentada: Ci x Vi = Cf x Vf Ci = 0,5 mol/l Cf = 0,15 mol/l Vf = 250 ml Vi = 0,5 x Vi = 0,15 x 250 Vi = 75 ml.
 Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
Exercício de Revisão III Unidade. Eletroquímica
 1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019
 FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019 CNHECIMENTS GERAIS E ESPECÍFICS CNHECIMENTS GERAIS 31. quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019 CNHECIMENTS GERAIS E ESPECÍFICS CNHECIMENTS GERAIS 31. quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
Equilíbrio químico, pilha e eletrólise.
 Ciências da Natureza Química 2 Gabriela Rosa TRABALHO DE RECUPERAÇÃO FINAL 3ª 35 pts 22,8 pts 12 18 3º A/B Equilíbrio químico, pilha e eletrólise. Instruções: Leia atentamente cada questão antes de resolvê-la.
Ciências da Natureza Química 2 Gabriela Rosa TRABALHO DE RECUPERAÇÃO FINAL 3ª 35 pts 22,8 pts 12 18 3º A/B Equilíbrio químico, pilha e eletrólise. Instruções: Leia atentamente cada questão antes de resolvê-la.
FORMULÁRIO DE DIVULGAÇÃO DO CONTEÚDO DA PROVA FINAL E RECUPERAÇÃO FINAL
 FORMULÁRIO DE DIVULGAÇÃO DO CONTEÚDO DA PROVA FINAL E RECUPERAÇÃO FINAL A) SÉRIE/ANO: 2º Ano Médio B) DISCIPLINA: Química - Enio C) CONTEÚDO A SER EXIGIDO/ORIENTAÇÃO PARA O ESTUDO: SOLUÇÕES: Coeficiente
FORMULÁRIO DE DIVULGAÇÃO DO CONTEÚDO DA PROVA FINAL E RECUPERAÇÃO FINAL A) SÉRIE/ANO: 2º Ano Médio B) DISCIPLINA: Química - Enio C) CONTEÚDO A SER EXIGIDO/ORIENTAÇÃO PARA O ESTUDO: SOLUÇÕES: Coeficiente
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
Eletrólitos e Não Eletrólitos
 Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO 13/11/2009 PROVA ESCRITA Nome do candidato: Assinatura do candidato:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2010 DO CURSO DE MESTRADO 13/11/2009 PROVA ESCRITA Nome do candidato: Assinatura do candidato:
ROTEIRO DE ESTUDOS - 4 BIMESTRE 2015 Disciplina: Química Ano: 2 Ensino: EM
 ROTEIRO DE ESTUDOS - 4 BIMESTRE 2015 Disciplina: Química Ano: 2 Ensino: EM Conteúdo do 4 bimestre: Pilhas, baterias Eletrólise Entalpia Sugestão de estudo: Refazer as listas de exercícios e as avaliações
ROTEIRO DE ESTUDOS - 4 BIMESTRE 2015 Disciplina: Química Ano: 2 Ensino: EM Conteúdo do 4 bimestre: Pilhas, baterias Eletrólise Entalpia Sugestão de estudo: Refazer as listas de exercícios e as avaliações
P4 - PROVA DE QUÍMICA GERAL - 05/12/07
 P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
QUESTÕES. 1. Complete a tabela com os Números de Oxidação das espécies químicas: Espécie Química
 2º EM Química B Natalia Av. Dissertativa 30/03/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
2º EM Química B Natalia Av. Dissertativa 30/03/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
COVEST/UFPE ª ETAPA
 COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica
 Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
Está correto o contido em a) I apenas. b) I e II apenas. c) I e III apenas. d) II e III apenas. e) I, II e III. Resolução
 7 b QUÍMICA Um estudante construiu, em um mesmo diagrama, as curvas da temperatura em função do tempo resultantes do aquecimento, sob pressão normal, de três líquidos em três béqueres distintos. Com base
7 b QUÍMICA Um estudante construiu, em um mesmo diagrama, as curvas da temperatura em função do tempo resultantes do aquecimento, sob pressão normal, de três líquidos em três béqueres distintos. Com base
A A A A A A A A A A A A A A A. > Na+ QUÍMICA
 QUÍMIC 1 Dois eletrodos conectados a uma lâmpada foram introduzidos em uma solução aquosa, a fim de que a luminosidade da lâmpada utilizada avaliasse a condutividade da solução. Desta forma, foram feitos
QUÍMIC 1 Dois eletrodos conectados a uma lâmpada foram introduzidos em uma solução aquosa, a fim de que a luminosidade da lâmpada utilizada avaliasse a condutividade da solução. Desta forma, foram feitos
a) Escreva os nomes das substâncias presentes nos frascos A, B e C. A B C
 PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
Química. Xandão (Victor Pontes) Compostos Orgânicos
 Compostos Orgânicos Compostos Orgânicos 1. Três frascos não-rotulados encontram-se na prateleira de um laboratório. Um contém benzeno, outro, tetracloreto de carbono e o terceiro, metanol. Sabe-se que
Compostos Orgânicos Compostos Orgânicos 1. Três frascos não-rotulados encontram-se na prateleira de um laboratório. Um contém benzeno, outro, tetracloreto de carbono e o terceiro, metanol. Sabe-se que
LISTA DE EXERCÍCIOS Eletroquímica
 DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
(aq) + H 3 O + (aq) K 1 = 1,0 x (aq) + H 3 O + (aq) K 2 = 1,0 x 10-11
 Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
B) Defina a que forma de apresentação do alumínio corresponde cada uma das curvas. Justifique sua resposta.
 Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
NOX 1) Determine o NOX dos elementos nas seguintes substâncias:
 NOX 1) Determine o NOX dos elementos nas seguintes substâncias: HCl CO 2 NH 3 H 2CO 4 CaSO 4 LiAlH 4 2. (UNESP) O filme Erin Brockovich é baseado num fato, em que o emprego de crômio hexavalente numa usina
NOX 1) Determine o NOX dos elementos nas seguintes substâncias: HCl CO 2 NH 3 H 2CO 4 CaSO 4 LiAlH 4 2. (UNESP) O filme Erin Brockovich é baseado num fato, em que o emprego de crômio hexavalente numa usina
PROFESSORA: Núbia de Andrade. Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
 GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE:3º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE:3º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
e - Zinco ZnSO 4 Zn(s) Zn 2 Zn(s) Zn 2+ (aq) + 2 e - + 0,76 V Cu(s) Cu 2+ (aq) + 2 e - - 0,34 V
 Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
UDESC 2014/2 QUÍMICA. 15) Resposta: B. Comentário
 QUÍMICA 15) Resposta: B a) Correta. b) Incorreta. O modelo atômico constituído por núcleo positivo e eletrosfera de carga negativa é de autoria de Rutherford. c) Correta. d) Correta. e) Correta. 16) Resposta:
QUÍMICA 15) Resposta: B a) Correta. b) Incorreta. O modelo atômico constituído por núcleo positivo e eletrosfera de carga negativa é de autoria de Rutherford. c) Correta. d) Correta. e) Correta. 16) Resposta:
ESCOLA SECUNDÁRIA DE CASQUILHOS 8º Teste sumativo de FQA 20. maio Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque
 ESCOLA SECUNDÁRIA DE CASQUILHOS 8º Teste sumativo de FQA 20. maio. 2015 Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 9 páginas
ESCOLA SECUNDÁRIA DE CASQUILHOS 8º Teste sumativo de FQA 20. maio. 2015 Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 9 páginas
P4 - PROVA DE QUÍMICA GERAL 05/12/12
 P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS
 SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS.
 Lista de exercícios para a prova de recuperação final 2º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Termoquímica. - Eletroquímica. - Equilíbrio
Lista de exercícios para a prova de recuperação final 2º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Termoquímica. - Eletroquímica. - Equilíbrio
Química. A) 645 kj/mol B) 0 kj/mol C) 645 kj/mol D) 945 kj/mol E) 1125 kj/mol 37.
 Química 7. Dados: Entalpia de ligação H H = 45 kj/mol N H = 9 kj/mol A reação de síntese da amônia, processo industrial de grande relevância para a indústria de fertilizantes e de explosivos, é representada
Química 7. Dados: Entalpia de ligação H H = 45 kj/mol N H = 9 kj/mol A reação de síntese da amônia, processo industrial de grande relevância para a indústria de fertilizantes e de explosivos, é representada
Resolução UNIFESP 2015
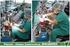 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
FUVEST 1999 Prova de Química. Magnésio e seus compostos podem ser produzidos a partir da água do mar, como mostra o esquema a seguir:
 Q.01 Magnésio e seus compostos podem ser produzidos a partir da água do mar, como mostra o esquema a seguir: a) Identifique X, Y e Z, dando suas respectivas fórmulas. b) Escreva a equação que representa
Q.01 Magnésio e seus compostos podem ser produzidos a partir da água do mar, como mostra o esquema a seguir: a) Identifique X, Y e Z, dando suas respectivas fórmulas. b) Escreva a equação que representa
EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS 1. INTRODUÇÃO
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS 1. INTRODUÇÃO
CINÉTICA QUÍMICA Estuda a velocidade (rapidez) das reações. Exemplo a síntese do HCl: H 2 (g) + Cl 2 (g) 2HCl(g)
 CINÉTICA QUÍMICA Estuda a velocidade (rapidez) das reações. Exemplo a síntese do HCl: H 2 (g) + Cl 2 (g) 2HCl(g) TEORIA DAS COLISÕES Para que ocorra uma reação química, os reagentes devem ter uma certa
CINÉTICA QUÍMICA Estuda a velocidade (rapidez) das reações. Exemplo a síntese do HCl: H 2 (g) + Cl 2 (g) 2HCl(g) TEORIA DAS COLISÕES Para que ocorra uma reação química, os reagentes devem ter uma certa
A partir das informações do texto, assinale a afirmativa INCORRETA.
 23 22 Q U E S T Ã O 3 4 Leia com atenção o texto abaixo. A poluição afeta a saúde de prédios em São Paulo. Fuligem, fumaça e corrosivos dispersos no ar sujam fachadas e desvalorizam imóveis, dizem especialistas.
23 22 Q U E S T Ã O 3 4 Leia com atenção o texto abaixo. A poluição afeta a saúde de prédios em São Paulo. Fuligem, fumaça e corrosivos dispersos no ar sujam fachadas e desvalorizam imóveis, dizem especialistas.
Solução Comentada Prova de Química
 34. Considere duas soluções de ácido clorídrico (HCl), um ácido forte, (solução I), e ácido acético (CH 3 COOH), um ácido fraco, k a =1,8 x 10-5, (solução II). Ambas as soluções com concentração 0,02 mol.
34. Considere duas soluções de ácido clorídrico (HCl), um ácido forte, (solução I), e ácido acético (CH 3 COOH), um ácido fraco, k a =1,8 x 10-5, (solução II). Ambas as soluções com concentração 0,02 mol.
As reações de oxidação e redução, também chamadas de reações redox, são fenômenos muito frequentes no nosso cotidiano. Como exemplo, temos: - Um
 Números de Oxidação As reações de oxidação e redução, também chamadas de reações redox, são fenômenos muito frequentes no nosso cotidiano. Como exemplo, temos: - Um material sofrendo combustão (queima);
Números de Oxidação As reações de oxidação e redução, também chamadas de reações redox, são fenômenos muito frequentes no nosso cotidiano. Como exemplo, temos: - Um material sofrendo combustão (queima);
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
O diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura.
 13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
química Boa prova! 05/12/2010
 05/12/2010 química Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está na página 13. Não abra o
05/12/2010 química Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está na página 13. Não abra o
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019
 RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
Química II - 1º Exame A 7 de Julho de ª Parte
 Nome Química II - 1º Exame A 7 de Julho de 2017 MEQ MEBiol Sala nº 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 5 na folha do enunciado Responda
Nome Química II - 1º Exame A 7 de Julho de 2017 MEQ MEBiol Sala nº 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 5 na folha do enunciado Responda
O lançamento descontrolado de dióxido de enxofre (SO 2
 QUÍMICA 20 O lançamento descontrolado de dióxido de enxofre (SO 2 (g)) na atmosfera é uma das principais causas da acidez da água da chuva nos grandes centros urbanos. Esse gás, na presença de O 2 e água
QUÍMICA 20 O lançamento descontrolado de dióxido de enxofre (SO 2 (g)) na atmosfera é uma das principais causas da acidez da água da chuva nos grandes centros urbanos. Esse gás, na presença de O 2 e água
Lista de Exercícios. Data limite para entrega da lista: 14/09/2018
 Lista de Exercícios Nome: n.º Santos, de de 2018. Série: 2.ª Turmas: A, B, C Ensino: Médio Prof. Paulo Henrique (PH) Bimestre: 3.º Data limite para entrega da lista: 14/09/2018 Valor: 4,0(quatro) 1) Por
Lista de Exercícios Nome: n.º Santos, de de 2018. Série: 2.ª Turmas: A, B, C Ensino: Médio Prof. Paulo Henrique (PH) Bimestre: 3.º Data limite para entrega da lista: 14/09/2018 Valor: 4,0(quatro) 1) Por
ELETRODO OU SEMIPILHA:
 ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA
 PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA. Exame de Seleção para o Mestrado em Química-2011.
 UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
Lista de exercícios Equilíbrio Químico
 Lista de exercícios Equilíbrio Químico Ludmila Ferreira e Eliane de Sá Cavalcante Problema 1 (OCQ - 2011) O sulfato de cobre pode ser reduzido pelo oxigênio gasoso, para obtenção do metal. Cu 2 S (s) +
Lista de exercícios Equilíbrio Químico Ludmila Ferreira e Eliane de Sá Cavalcante Problema 1 (OCQ - 2011) O sulfato de cobre pode ser reduzido pelo oxigênio gasoso, para obtenção do metal. Cu 2 S (s) +
Colégio Estadual Professor Ernesto Faria. Subprojeto Pibid - Química UERJ. Termoquímica
 Colégio Estadual Professor Ernesto Faria Subprojeto Pibid - Química UERJ Termoquímica REAÇÕES ENDOTÉRMICAS E EXOTÉRMICAS Processo Exotérmico Libera calor para ambiente (vizinhança) Transmite sensação de
Colégio Estadual Professor Ernesto Faria Subprojeto Pibid - Química UERJ Termoquímica REAÇÕES ENDOTÉRMICAS E EXOTÉRMICAS Processo Exotérmico Libera calor para ambiente (vizinhança) Transmite sensação de
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO. 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3?
 NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
Reações Químicas GERAL
 Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Combustão de um palito de fósforo Efervescência
Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Combustão de um palito de fósforo Efervescência
Exame 2º Ano Modalidade B
 Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
2 ª Fase Exame Discursivo
 02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
1) A tabela seguinte contém os pontos de ebulição (P.E.), a 1 atm, medidos em C, de diversos alcanos.
 Sem limite para crescer Colégio: Nome: nº Professor: CHARLES 3ª SÉRIE E.M. Data: / /2013 TURMA: EXERCÍCIOS QUÍMICA 2º trimestre 1) A tabela seguinte contém os pontos de ebulição (P.E.), a 1 atm, medidos
Sem limite para crescer Colégio: Nome: nº Professor: CHARLES 3ª SÉRIE E.M. Data: / /2013 TURMA: EXERCÍCIOS QUÍMICA 2º trimestre 1) A tabela seguinte contém os pontos de ebulição (P.E.), a 1 atm, medidos
Centro Educacional Colúmbia 2000
 Discente: Centro Educacional Colúmbia 2000 Tri. 1º/2017 Dependência Docente: Marcos Vinicius Machado Rio, / / Ens. Médio Turma: 2º ano Disciplina: QUÍMICA Nº 1) O gráfico representa as curvas de solubilidade
Discente: Centro Educacional Colúmbia 2000 Tri. 1º/2017 Dependência Docente: Marcos Vinicius Machado Rio, / / Ens. Médio Turma: 2º ano Disciplina: QUÍMICA Nº 1) O gráfico representa as curvas de solubilidade
Gabarito Química Grupo J. 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor. Considerando-se as substâncias I, II e III mostradas abaixo,
 VESTIB LAR Gabarito Química Grupo J 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Considerando-se as substâncias I, II e III mostradas abaixo, I) 2-clorobutano II) hidroxi benzeno III) tolueno a) Escreva
VESTIB LAR Gabarito Química Grupo J 1 a QUESTÃO: (1,0 ponto) Avaliador Revisor Considerando-se as substâncias I, II e III mostradas abaixo, I) 2-clorobutano II) hidroxi benzeno III) tolueno a) Escreva
CONSIDERAÇÕES INICIAIS
 REAÇÕES INORGÂNICAS CONSIDERAÇÕES INICIAIS CLASSIFICAÇÕES 1. Reação de síntese ou adição 2. Reação de decomposição ou análise 3. Reação de deslocamento ou simples troca 3.1 Metais Zn (s) + CuSO 4(aq) ZnSO
REAÇÕES INORGÂNICAS CONSIDERAÇÕES INICIAIS CLASSIFICAÇÕES 1. Reação de síntese ou adição 2. Reação de decomposição ou análise 3. Reação de deslocamento ou simples troca 3.1 Metais Zn (s) + CuSO 4(aq) ZnSO
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
3º Tri TB Recuperação de Química Data: 14/12/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Nox, pilha e eletrólise Questão 01 - (UFRR/2015) Nas substâncias Na2SO4, HPO3 2, KMnO4
é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos).
 REAÇÕES QUÍMICAS Reação Química é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos). é um fenômeno onde os átomos
REAÇÕES QUÍMICAS Reação Química é uma alteração química onde matéria (um reagente ou reagentes) se convertem em uma nova substância ou substâncias (um produto ou produtos). é um fenômeno onde os átomos
S Nox total = zero. Nº de oxidação (Nox) Regras para determinar o Nox. AULA 11 Oxidação e Redução
 AULA 11 Oxidação e Redução Nº de oxidação (Nox) é a carga que surge quando os elementos estão combinados NaCl Æ Na + Cl - (sódio doou 1 e - e o cloro recebeu 1e - ) H 2 Æ H H zero Quando a ligação for
AULA 11 Oxidação e Redução Nº de oxidação (Nox) é a carga que surge quando os elementos estão combinados NaCl Æ Na + Cl - (sódio doou 1 e - e o cloro recebeu 1e - ) H 2 Æ H H zero Quando a ligação for
FUVEST 1978 Primeira fase e Segunda fase
 FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
PROFESSOR: EQUIPE DE QUÍMICA
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 4 ============================================================================================= Termoquímica
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 4 ============================================================================================= Termoquímica
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
Nome: Nº BI: Data - Local Emissão: / / -
 PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG
 PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
FCAV/ UNESP. Assunto: Equilíbrio Químico e Auto-ionização da Água. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
P4 PROVA DE QUÍMICA GERAL 02/12/08
 P4 PROVA DE QUÍMICA GERAL 0/1/08 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,314
P4 PROVA DE QUÍMICA GERAL 0/1/08 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,314
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
I - 4 Au (s) + O 2(g) + 2 H 2 O (l) + 8 CN - -
 QUESTÕES OBJETIVAS Questão 9: O processo do cianeto pode ser utilizado para extrair ouro de rochas. Esse processo consiste em, inicialmente, tratar as rochas trituradas com cianeto, havendo formação do
QUESTÕES OBJETIVAS Questão 9: O processo do cianeto pode ser utilizado para extrair ouro de rochas. Esse processo consiste em, inicialmente, tratar as rochas trituradas com cianeto, havendo formação do
Disciplina: Química Data: 05 / 05 / Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo:
 Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
UDESC 2017/2 QUÍMICA. Comentário
 QUÍMICA Sólido: volume definido; forma definida. Líquido: volume definido; forma variável. Gasoso: volume variável; forma variável. 1 e resolução SiC 4 + 2 Mg Si + 2 MgC 2 170,1 g + 48,6 g 28,1 g Massa
QUÍMICA Sólido: volume definido; forma definida. Líquido: volume definido; forma variável. Gasoso: volume variável; forma variável. 1 e resolução SiC 4 + 2 Mg Si + 2 MgC 2 170,1 g + 48,6 g 28,1 g Massa
