2. Prova de Conhecimentos Específicos
|
|
|
- Antônia Clementino Gabeira
- 9 Há anos
- Visualizações:
Transcrição
1 VESTIBULAR 2008/ ª FASE 06 DE DEZEMBRO DE 2008 VESTIBULAR 2008/ ª FASE 06 DE DEZEMBRO DE Prova de Conhecimentos Específicos INSTRUÇÕES Para a realização desta prova, você recebeu este caderno contendo 16 questões dissertativas. Confira seu nome e número da carteira impressos na capa deste caderno. A duração da prova é de 4 horas. Você só poderá entregar este caderno e sair da sala após transcorridas 2 horas do início da prova. Transcorridas 4 horas de prova, o fiscal recolherá o caderno dos candidatos que ainda permanecerem na sala. Ao sair, o candidato deverá entregar este caderno. AGUARDE A ORDEM DO FISCAL PARA ABRIR ESTE CADERNO. Nome do candidato Número da carteira assinatura do candidato
2 NÃO ESCREVA NESTE ESPAÇO 2
3 MATEMÁTICA 01. Calcule a área do trapézio em destaque na figura, assumindo que os valores numéricos no plano cartesiano estão em centímetros. 3
4 02. Observe atentamente as figuras de uma pá e calcule a e b, admitindo que os valores numéricos no plano cartesiano estão em centímetros. 4
5 03. Os dados da tabela foram obtidos a partir de um estudo realizado com indivíduos da mesma faixa etária. Pratica exercícios regularmente Pratica exercícios irregularmente Não pratica exercícios Possui doença cardíaca Não possui doença cardíaca Total Sorteando-se ao acaso um indivíduo dentre os pesquisados, calcule a probabilidade de que ele seja portador de doença cardíaca, apesar de praticar regularmente ou irregularmente exercícios. O resultado do seu cálculo deve ser dado em porcentagem. Total 5
6 04. O segmento AB é simultaneamente diâmetro de um círculo de raio 2 e lado do triângulo eqüilátero ABC. O círculo intersecta os segmentos AC e BC nos pontos D e E, respectivamente. Faça uma figura representando a situação descrita e calcule o comprimento do segmento AE. 6
7 05. As figuras mostram um cone circular reto de raio da base r e a planificação da sua área lateral. Relembrando que o volume de um cone é igual a volume desse cone. do produto entre a área da base e a altura do cone, calcule o raio da base e o 7
8 06. No sistema de equações p e q são constantes reais e x e y são variáveis reais. Calcule p e q, sabendo-se que a solução desse sistema é o par ordenado (2, 3). 8
9 07. A média aritmética das idades de um grupo de x pessoas é 25 anos. Com a entrada de mais uma pessoa no grupo, a nova média passou a ser 26 anos. Determine a idade do novo integrante do grupo em função de x. 9
10 08. Sobre a figura, sabe-se que: ABC e EFD são triângulos; os pontos A, C, D e E estão alinhados; a reta que passa por B e C é paralela à reta que passa por D e F; os ângulos e são congruentes; AB = 5 cm, AC = 6 cm, EF = 4,8 cm e AE = 10 cm Calcule a medida do segmento CD. 10
11 QUÍMICA A Tabela Periódica encontra-se no final deste caderno, na página As lâmpadas incandescentes, embora durem menos e apresentem maior consumo de energia elétrica do que as fluorescentes compactas, ainda são muito utilizadas. A ilustração seguinte mostra alguns componentes de uma lâmpada comum incandescente: a) Entre os materiais componentes da lâmpada incandescente indicados na figura, qual é obtido industrialmente por fusão de areia e carbonato de sódio? qual é obtido industrialmente a partir da bauxita? qual é constituído por átomos isolados, não combinados entre si? qual é constituído por moléculas diatômicas? b) A troca da atmosfera do interior do bulbo da lâmpada por oxigênio inviabilizaria sua utilização, pois a lâmpada se acenderia rapidamente e logo ficaria queimada. Por quê? 11
12 10. Considere as seguintes informações sobre duas variedades alotrópicas do elemento carbono: Variedade alotrópica Entalpia de formação Densidade Carbono diamante + 0,45 kcal/mol 2,2 g.cm 3 Carbono grafita zero 3,5 g.cm 3 a) Sendo a entalpia de combustão completa do Carbono diamante igual a x kcal.mol 1, qual deve ser a entalpia de combustão do carbono grafita? Justifique. b) Como interpretar, em termos de arranjos atômicos, o fato de a densidade do diamante ser maior do que a do Carbono grafita, uma vez que ambos são formados por átomos de um mesmo elemento químico? 12
13 11. Os fogos de artifício propiciam espetáculos em diferentes eventos. Para que esses dispositivos funcionem, precisam ter em sua composição uma fonte de oxigênio, como o clorato de potássio (KClO 3 ), combustíveis, como o enxofre (S 8 ) e o carbono (C), além de agentes de cor como o SrCl 2 (cor vermelha), o CuCl 2 (cor verde esmeralda) e outros. Podem conter também metais pirofóricos como Mg que, durante a combustão, emite intensa luz branca, como a do flash de máquinas fotográficas. a) Escreva as equações químicas, balanceadas, que representam: a decomposição do clorato de potássio, produzindo cloreto de potássio e oxigênio diatômico; a combustão do enxofre; a combustão do magnésio. b) Considerando o modelo atômico de Rutherford-Bohr, como se explica a emissão de luz colorida pela detonação de fogos de artifício? 13
14 12. O teor de cálcio em uma amostra de conchas de massa igual a 5,0 g foi determinado da seguinte maneira: trituração das conchas; aquecimento do material triturado com HCl; filtração; precipitação de íons Ca 2+ sob forma de oxalato de cálcio monoidratado, CaC 2 O 4.H 2 O, utilizando-se oxalato de amônio, (NH 4 ) 2 C 2 O 4, como reagente; filtração e secagem do oxalato de cálcio monoidratado; calcinação em mufla, produzindo-se 2,0 g de CaO como único resíduo sólido. a) Para cada uma das filtrações, indique o que é retido no filtro e o que constitui o filtrado. b) Escreva a equação da reação química que ocorre quando oxalato de cálcio monoidratado é aquecido na mufla. c) Admitindo que todo o cálcio presente nas conchas esteja sob a forma de CaCO 3 e que os outros componentes dessas conchas não interferem nos procedimentos da análise, calcule a porcentagem em massa de carbonato de cálcio na amostra de conchas analisada. Mostre os cálculos. 14
15 13. A superfície de uma peça metálica foi cromada por meio da eletrólise de 500 ml de uma solução aquosa, contendo íons Cr 3+ em concentração de 0,1 mol/l. a) Escreva a equação da semi-reação em que íons de cromo são transformados em cromo metálico. b) Sendo 1 faraday a carga elétrica de 1 mol de elétrons, e considerando rendimento de 100%, que carga elétrica é necessária para eletrolisar todo o cromo presente na solução? 15
16 14. Proteínas são polímeros formados pelo encadeamento de aminoácidos por meio de ligações peptídicas. A importância das proteínas para a manutenção da vida está relacionada à sua participação nos processos químicos que ocorrem nos organismos vivos. As formas desenhadas entre os grupos funcionais em I e II correspondem a cadeias carbônicas diferentes. a) Escreva a equação química que descreve o peptídeo formado na reação de condensação entre I e II quando: b) Assinale os átomos de carbono assimétrico presentes em I e II quando substituídos pelas cadeias carbônicas indicadas em a). c) Segundo a literatura, I e II, quando substituídos pelas cadeias carbônicas indicadas em a), são solúveis em HCl diluído. Usando equações químicas, explique esse fato. 16
17 15. O hexafluoreto de urânio empobrecido ( 238 UF 6 ), produto residual do processo de enriquecimento do urânio, é geralmente armazenado em cilindros de aço em áreas abertas próximas às usinas de enriquecimento. Os cilindros são examinados regularmente, pois qualquer vazamento pode causar danos à saúde e contaminação do meio ambiente, principalmente por causa dos produtos tóxicos formados quando o material interage com a água, ainda que em quantidades muito pequenas. Uma amostra de 4,22 g de 238 UF 6, em contato com água, produziu 3,7 g de um sólido X que contém U, O e F e 0,96 g de um gás Y que contém 95% de flúor e 5% de hidrogênio. a) Determine a fórmula do produto sólido X. b) Calcule a percentagem do flúor contido no 238 UF 6 que é convertido em Y. 17
18 16. Andiroba é uma espécie nativa da Amazônia, de cujo fruto se extrai um óleo utilizado como repelente natural de insetos, antiinflamatório, cicatrizante para afecções da pele e no tratamento da artrite. Essas propriedades estão associadas à ocorrência das substâncias I e II no óleo de andiroba. a) Escreva os nomes das funções orgânicas indicadas pelos algarismos 1 e 2 na estrutura que representa a substância I. b) Escreva uma equação completa que descreva a reação de II com álcool metílico em meio ácido e indique o nome do grupo funcional formado. 18
19 TABELA PERIÓDICA 19
20
anglo resolve prova da 2ª- fase da UFABC dezembro 2008
 o anglo resolve a prova da 2ª- fase da UFABC dezembro 2008 É trabalho pioneiro. Prestação de serviços com tradição de confiabilidade. Construtivo, procura colaborar com as Bancas Examinadoras em sua tarefa
o anglo resolve a prova da 2ª- fase da UFABC dezembro 2008 É trabalho pioneiro. Prestação de serviços com tradição de confiabilidade. Construtivo, procura colaborar com as Bancas Examinadoras em sua tarefa
Calcule a área do trapézio em destaque na figura, as - sumin do que os valores numéricos no plano cartesiano estão em centímetros.
 UFABC MATEMÁTICA 1 Calcule a área do trapézio em destaque na figura, as - sumin do que os valores numéricos no plano cartesiano estão em centímetros. A equação da reta apresentada é y = 2x + 1. s pontos
UFABC MATEMÁTICA 1 Calcule a área do trapézio em destaque na figura, as - sumin do que os valores numéricos no plano cartesiano estão em centímetros. A equação da reta apresentada é y = 2x + 1. s pontos
Dicas de Química Arilson
 Dicas de Química Arilson Questão 01) A acidez e a basicidade são importantes propriedades relacionadas às substâncias orgânicas. Essas propriedades possuem relação direta com a reatividade e a purificação
Dicas de Química Arilson Questão 01) A acidez e a basicidade são importantes propriedades relacionadas às substâncias orgânicas. Essas propriedades possuem relação direta com a reatividade e a purificação
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Trabalho de Recuperação Final 2018
 Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/18 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2018 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Estequiometria e
Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/18 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2018 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Estequiometria e
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Qui. Semana. Allan Rodrigues Gabriel Pereira (Renan Micha)
 Semana 6 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Semana 6 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO MÉDIO - FASE 2
 III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO MÉDIO - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada), cada uma com
III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO MÉDIO - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada), cada uma com
Q.02 Considere uma solução aquosa diluída de dicromato de potássio, a 25 ºC. Dentre os equilíbrios que estão presentes nessa solução, destacam-se:
 Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM)
 NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
Texto para as questões 31 e 32.
 QUÍMICA Texto para as questões 31 e 32. Um sinal de que o bico do queimador do fogão está entupido é o aparecimento de chama amarela, quando o fogo é aceso. Nessa situação, ocorre a formação de carbono
QUÍMICA Texto para as questões 31 e 32. Um sinal de que o bico do queimador do fogão está entupido é o aparecimento de chama amarela, quando o fogo é aceso. Nessa situação, ocorre a formação de carbono
QUESTÕES OBJETIVAS. a) b) +110 c) -55 d) -110 e) -676
 QUESTÕES OBJETIVAS Questão 9: O óxido de cálcio, conhecido como cal virgem, é comumente utilizado na construção civil. Sobre essa substância é INCORRETO afirmar que: a) pode ser obtida pelo aquecimento
QUESTÕES OBJETIVAS Questão 9: O óxido de cálcio, conhecido como cal virgem, é comumente utilizado na construção civil. Sobre essa substância é INCORRETO afirmar que: a) pode ser obtida pelo aquecimento
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
O b) SO 2. CaSO 3 + CO 2
 31 c QUÍMICA petróleo pode conter alto teor de enxofre, que deve ser removido nas refinarias de petróleo. Mesmo assim, na queima de combustíveis fósseis, forma-se dióxido de enxofre. Esse óxido liberado
31 c QUÍMICA petróleo pode conter alto teor de enxofre, que deve ser removido nas refinarias de petróleo. Mesmo assim, na queima de combustíveis fósseis, forma-se dióxido de enxofre. Esse óxido liberado
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 19. fevereiro. 2015 Versão 1 10.º Ano Turma A Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por
ESCOLA SECUNDÁRIA DE CASQUILHOS 6.º Teste sumativo de FQA 19. fevereiro. 2015 Versão 1 10.º Ano Turma A Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
3ª Série / Vestibular _ TD 08 _ 19 de abril
 3ª Série / Vestibular _ TD 08 _ 19 de abril 01. A corrosão de um metal é a sua destruição ou deterioração, devida à reação com o meio ambiente. O enferrujamento é o nome dado à corrosão do ferro: Fe(s)
3ª Série / Vestibular _ TD 08 _ 19 de abril 01. A corrosão de um metal é a sua destruição ou deterioração, devida à reação com o meio ambiente. O enferrujamento é o nome dado à corrosão do ferro: Fe(s)
Olimpíada Brasileira de Química Fase III (Etapa 1 nacional)
 Page 1 of 5 Olimpíada Brasileira de Química - 2001 Fase III (Etapa 1 nacional) Questão 1 (48 th Chemistry Olympiad - Final National Competition - 2001 - Estonia) Exame aplicado em 01.09.2001 Os compostos
Page 1 of 5 Olimpíada Brasileira de Química - 2001 Fase III (Etapa 1 nacional) Questão 1 (48 th Chemistry Olympiad - Final National Competition - 2001 - Estonia) Exame aplicado em 01.09.2001 Os compostos
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Aluno(a): Código: 2 Rua T-53 Qd. 92 Lt. 10/11 nº 1356 Setor Bueno
 Aluno(a): Código: Série: 1ª Turma: Data: / / 01. Em 1911, Rutherford e colaboradores realizaram o experimento mostrado na figura abaixo: 02. Os fogos de artifício propiciam espetáculos em diferentes eventos.
Aluno(a): Código: Série: 1ª Turma: Data: / / 01. Em 1911, Rutherford e colaboradores realizaram o experimento mostrado na figura abaixo: 02. Os fogos de artifício propiciam espetáculos em diferentes eventos.
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO
 1º EM Química B Natália Av. Dissertativa 19/10/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
1º EM Química B Natália Av. Dissertativa 19/10/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
QUÍMICA - 1 o ANO MÓDULO 17 REAÇÕES QUÍMICAS DE SÍNTESE E ANÁLISE
 QUÍMICA - 1 o ANO MÓDULO 17 REAÇÕES QUÍMICAS DE SÍNTESE E ANÁLISE Como pode cair no enem (ENEM) Os oceanos absorvem aproximadamente um terço das emissões de CO 2 procedentes de atividades humanas, como
QUÍMICA - 1 o ANO MÓDULO 17 REAÇÕES QUÍMICAS DE SÍNTESE E ANÁLISE Como pode cair no enem (ENEM) Os oceanos absorvem aproximadamente um terço das emissões de CO 2 procedentes de atividades humanas, como
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
ESTEQUIOMETRIA Folha 01 João Roberto Mazzei
 01. (UFC 2009) O principal componente da cal, importante produto industrial fabricado no Ceará, é o óxido de cálcio (CaO). A produção de CaO se processa de acordo com a seguinte reação química: CaCO 3(s)
01. (UFC 2009) O principal componente da cal, importante produto industrial fabricado no Ceará, é o óxido de cálcio (CaO). A produção de CaO se processa de acordo com a seguinte reação química: CaCO 3(s)
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
Trabalho de Recuperação Final 2017
 Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/17 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2017 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Reações de Oxidorredução
Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/17 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2017 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Reações de Oxidorredução
1 a Questão: Valor : 1,0 FOLHA DE DADOS. I ) Entalpias de Formação (H o f ) H 2. O (líquida) = - 68,3 kcal / mol. CO 2 (gasoso) = - 94,1 kcal / mol
 PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
CUSC MEDICINA Primeiro Semestre CENTRO UNIVERSITÁRIO SÃO CAMILO
 US 018 - MEDIIA Primeiro Semestre ETR UIVERSITÁRI SÃ AMIL 01. conceito de isótopos de um elemento surgiu a partir de importantes descobertas realizadas na química e na física durante a primeira metade
US 018 - MEDIIA Primeiro Semestre ETR UIVERSITÁRI SÃ AMIL 01. conceito de isótopos de um elemento surgiu a partir de importantes descobertas realizadas na química e na física durante a primeira metade
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 VIII Olimpíada Capixaba de Química 2010 Prova do Grupo I 1 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
VIII Olimpíada Capixaba de Química 2010 Prova do Grupo I 1 a série do ensino médio Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
12 GAB. 1 1 o DIA PASES 1 a ETAPA TRIÊNIO QUÍMICA QUESTÕES DE 21 A 30
 12 GAB. 1 1 o DIA PASES 1 a ETAPA TRIÊNIO 2005-2007 QUÍMICA QUESTÕES DE 21 A 30 21. A hemoglobina das células vermelhas do sangue contém o complexo de ferro com uma porfirina. Sabendo que um indivíduo
12 GAB. 1 1 o DIA PASES 1 a ETAPA TRIÊNIO 2005-2007 QUÍMICA QUESTÕES DE 21 A 30 21. A hemoglobina das células vermelhas do sangue contém o complexo de ferro com uma porfirina. Sabendo que um indivíduo
O que você deve saber sobre
 O que você deve saber sobre Podemos conhecer as grandezas que regem a quantificação dos fenômenos químicos identificando o comportamento da massa, do número de partículas e do volume de diferentes substâncias.
O que você deve saber sobre Podemos conhecer as grandezas que regem a quantificação dos fenômenos químicos identificando o comportamento da massa, do número de partículas e do volume de diferentes substâncias.
O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS.
 Lista de exercícios para a prova de recuperação final 1º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Misturas e substâncias - Tabela e propriedades
Lista de exercícios para a prova de recuperação final 1º ano EM Conteúdo. O ALUNO DEVERÁ VIR PARA A AULA DE RECUPERAÇÃO COM A LISTA PRONTA PARA TIRAR DÚVIDAS. - Misturas e substâncias - Tabela e propriedades
O hidrogênio é usado na fabricação de inúmeros produtos importantes:
 Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS 1. INTRODUÇÃO
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 4 REAÇÕES E EQUAÇÕES QUÍMICAS 1. INTRODUÇÃO
a) Escreva os nomes das substâncias presentes nos frascos A, B e C. A B C
 PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
Instruções: Titulação: análise laboratorial de soluções. Entalpia e energia nas transformações químicas. Entalpia de ligação. Ciências da Natureza
 Ciências da Natureza Química Gabriela Rosa TRABALHO DE RECUPERAÇÃO 1ª ETAPA 1ª 10 pts 6,5 pts 18 2º A/B Instruções: Leia atentamente cada questão antes de resolvê-la. A interpretação faz parte desse trabalho.
Ciências da Natureza Química Gabriela Rosa TRABALHO DE RECUPERAÇÃO 1ª ETAPA 1ª 10 pts 6,5 pts 18 2º A/B Instruções: Leia atentamente cada questão antes de resolvê-la. A interpretação faz parte desse trabalho.
02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a
![02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a 02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a](/thumbs/48/23999624.jpg) 01)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se
01)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se
Química. Questão 17 A gasolina é uma mistura de hidrocarbonetos diversos que apresenta, dentre outros, os seguintes componentes:
 Questão 16 Uma molécula de água, isolada, não apresenta certas propriedades físicas - como ponto de fusão e de ebulição - que dependem de interações entre moléculas. Em 1998, um grupo de pesquisadores
Questão 16 Uma molécula de água, isolada, não apresenta certas propriedades físicas - como ponto de fusão e de ebulição - que dependem de interações entre moléculas. Em 1998, um grupo de pesquisadores
Vestibular Nacional Unicamp 1998
 Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
2 ª Fase Exame Discursivo
 02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
SIMULADO DE QUÍMICA INSTRUÇÕES QUÍMICA
 PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
Resolução UNIFESP 2015
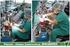 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS DE RECUPERAÇÃO PARCIAL 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
EXERCÍCIOS DE REVISÃO P/ Avaliação 01/06
 Tema do Ano: Eu e o outro construindo um mundo mais solidário Projeto Interdisciplinar da 2 a Série do Ensino Médio: Segunda metade do século XX e início do século XXI: movimentos, conflitos e desenvolvimento.
Tema do Ano: Eu e o outro construindo um mundo mais solidário Projeto Interdisciplinar da 2 a Série do Ensino Médio: Segunda metade do século XX e início do século XXI: movimentos, conflitos e desenvolvimento.
SE18 - Química. LQUI1A3 - Introdução à estequiometria. Questão 1
 SE18 - Química LQUI1A3 - Introdução à estequiometria Questão 1 (UFRGS-RS) Os clorofluorcarbonos (CFCs) sofrem decomposição nas altas camadas da atmosfera, originando átomos de cloro, os quais atacam moléculas
SE18 - Química LQUI1A3 - Introdução à estequiometria Questão 1 (UFRGS-RS) Os clorofluorcarbonos (CFCs) sofrem decomposição nas altas camadas da atmosfera, originando átomos de cloro, os quais atacam moléculas
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: [email protected] Instagram: @rayllanderborges Facebook: Raylander Borges Aula 13 INTRODUÇÃO A ESTEQUIOMETRIA
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: [email protected] Instagram: @rayllanderborges Facebook: Raylander Borges Aula 13 INTRODUÇÃO A ESTEQUIOMETRIA
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre
 PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 2ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
CIÊNCIAS PROVA 3º BIMESTRE 9º ANO PROJETO CIENTISTAS DO AMANHÃ
 PREFEITURA DA CIDADE DO RIO DE JANEIRO SECRETARIA MUNICIPAL DE EDUCAÇÃO SUBSECRETARIA DE ENSINO COORDENADORIA DE EDUCAÇÃO CIÊNCIAS PROVA 3º BIMESTRE 9º ANO PROJETO CIENTISTAS DO AMANHÃ 2010 01. A tabela
PREFEITURA DA CIDADE DO RIO DE JANEIRO SECRETARIA MUNICIPAL DE EDUCAÇÃO SUBSECRETARIA DE ENSINO COORDENADORIA DE EDUCAÇÃO CIÊNCIAS PROVA 3º BIMESTRE 9º ANO PROJETO CIENTISTAS DO AMANHÃ 2010 01. A tabela
química Boa prova! 05/12/2010
 05/12/2010 química Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está na página 13. Não abra o
05/12/2010 química Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está na página 13. Não abra o
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS
 PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
PROFESSOR: EQUIPE DE QUÍMICA
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 2 ============================================================================================= Termoquímica
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 2 ============================================================================================= Termoquímica
Vestibular UFRGS 2013 Resolução da Prova de Química
 Vestibular UFRGS 2013 Resolução da Prova de Química 26. Alternativa (B) Somente os fenômenos químicos constituem uma Reação Química, portanto: I fenômeno físico. II fenômeno químico III fenômeno físico
Vestibular UFRGS 2013 Resolução da Prova de Química 26. Alternativa (B) Somente os fenômenos químicos constituem uma Reação Química, portanto: I fenômeno físico. II fenômeno químico III fenômeno físico
IX OSEQUIM - Olimpíada Sergipana de Química 2ª Etapa - Modalidade B
 Bom dia aluno! Está é a prova da segunda etapa da IX OSEQUIM, Olimpíada Sergipana de Química, modalidade B, para alunos que se encontram cursando o 2º. Ano do ensino médio em 2015. Confira se a sua prova
Bom dia aluno! Está é a prova da segunda etapa da IX OSEQUIM, Olimpíada Sergipana de Química, modalidade B, para alunos que se encontram cursando o 2º. Ano do ensino médio em 2015. Confira se a sua prova
Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas ; Caderno 2 páginas Exercícios
 Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas 244-257; Caderno 2 páginas 258-280. Exercícios 1. As substâncias podem ser encontradas em três estados físicos, sólido, líquido
Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas 244-257; Caderno 2 páginas 258-280. Exercícios 1. As substâncias podem ser encontradas em três estados físicos, sólido, líquido
1ª Série Ensino Médio. 16. O sistema a seguir mostra a ocorrência de reação química entre um ácido e um metal, com liberação do gás X:
 1ª Série Ensino Médio 16. O sistema a seguir mostra a ocorrência de reação química entre um ácido e um metal, com liberação do gás X: O gás X, liberado neste sistema, é o: (A) O 2 ; (B) Cl 2 ; (C) O 3
1ª Série Ensino Médio 16. O sistema a seguir mostra a ocorrência de reação química entre um ácido e um metal, com liberação do gás X: O gás X, liberado neste sistema, é o: (A) O 2 ; (B) Cl 2 ; (C) O 3
Química. Xandão (Renan Micha) Soluções
 Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por
 01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por exemplo, o teor de chumbo corresponde a 4,14% em massa da liga. Seu isótopo radioativo 210 Pb decai pela emissão
01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por exemplo, o teor de chumbo corresponde a 4,14% em massa da liga. Seu isótopo radioativo 210 Pb decai pela emissão
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a
 01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
LISTA DE EXERCÍCIOS: TRANSFORMAÇÕES FÍSICAS E QUÍMICAS PROPRIEDADES FÍSICAS E QUÍMICAS ALGARISMOS SIGNIFICATIVOS ESTEQUIOMETRIA
 UNIVERSIDADE FEDERAL D ESTAD D RI DE JANEIR (UNIRI) INSTITUT DE BICIÊNCIAS DEP. DE CIÊNCIAS NATURAIS DISCIPLINA: QUÍMICA GERAL E INRGÂNICA 2/2015 PRFª.: CLAUDIA JRGE D NASCIMENT LISTA DE EXERCÍCIS: MATÉRIA
UNIVERSIDADE FEDERAL D ESTAD D RI DE JANEIR (UNIRI) INSTITUT DE BICIÊNCIAS DEP. DE CIÊNCIAS NATURAIS DISCIPLINA: QUÍMICA GERAL E INRGÂNICA 2/2015 PRFª.: CLAUDIA JRGE D NASCIMENT LISTA DE EXERCÍCIS: MATÉRIA
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 002/2017 Seleção para o 1º Semestre de 2017 14 de Fevereiro de 2017 CADERNO DE QUESTÕES Tempo
QUÍMICA QUESTÃO O oxigênio e o enxofre podem ser encontrados como moléculas O 2 QUESTÃO 32
 T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 3º Teste sumativo de FQA 27. janeiro. 2016 Versão 1 10º Ano Turma A Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas
ESCOLA SECUNDÁRIA DE CASQUILHOS 3º Teste sumativo de FQA 27. janeiro. 2016 Versão 1 10º Ano Turma A Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas
QUÍMICA. Transformações Químicas e Energia. Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 5
 QUÍMICA Transformações Químicas e Energia Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 5 Prof ª. Giselle Blois Casos particulares das entalpias das reações
QUÍMICA Transformações Químicas e Energia Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 5 Prof ª. Giselle Blois Casos particulares das entalpias das reações
CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS
 CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS CONCEITO DE LIGAÇÃO IÔNICA UNIÃO ENTRE ÁTOMOS METÁLICOS E AMETÁLICOS OXIDAÇÃO ESTABILIZAÇÃO DO METAL REDUÇÃO ESTABILIZAÇÃO DO AMETAL LIGAÇÃO IÔNICA
CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS CONCEITO DE LIGAÇÃO IÔNICA UNIÃO ENTRE ÁTOMOS METÁLICOS E AMETÁLICOS OXIDAÇÃO ESTABILIZAÇÃO DO METAL REDUÇÃO ESTABILIZAÇÃO DO AMETAL LIGAÇÃO IÔNICA
TERMOQUÍMICA EXERCÍCIOS PARA TREINO
 TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
UNIFEV MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA
 UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
Trabalho de Recuperação Final 2017
 Nome Nº Turma 1A3AC Nome do Professor Claudia Figueiredo /12/17 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2017 Valor do trabalho: de zero a dois pontos. Conteúdo: Estrutura da matéria,
Nome Nº Turma 1A3AC Nome do Professor Claudia Figueiredo /12/17 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2017 Valor do trabalho: de zero a dois pontos. Conteúdo: Estrutura da matéria,
LIGAÇÕES QUÍMICAS Parte 2
 Disciplina: Química Prof.: Guilherme Turma: IU 08/06/2017 Tema da aula: Ligação covalente Relembrando a ligação iônica LIGAÇÕES QUÍMICAS Parte 2 - A ligação iônica ocorre entre íons positivos (os cátions)
Disciplina: Química Prof.: Guilherme Turma: IU 08/06/2017 Tema da aula: Ligação covalente Relembrando a ligação iônica LIGAÇÕES QUÍMICAS Parte 2 - A ligação iônica ocorre entre íons positivos (os cátions)
QUÍMICA. Qual a fórmula molecular do menor alcadieno halênico com carbono quiral?
 QUÍMICA Qual a fórmula molecular do menor alcadieno halênico com carbono quiral? C 6 H 10 ; C 7 H 10 ; C 7 H 12 ; C 6 H 8. C 6 H 12 ; O mirceno, composto responsável pelo gosto amargo da cerveja, possui
QUÍMICA Qual a fórmula molecular do menor alcadieno halênico com carbono quiral? C 6 H 10 ; C 7 H 10 ; C 7 H 12 ; C 6 H 8. C 6 H 12 ; O mirceno, composto responsável pelo gosto amargo da cerveja, possui
Reações Químicas GERAL
 Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Combustão de um palito de fósforo Efervescência
Reações Químicas GERAL É o processo no qual 1 ou mais substâncias (reagentes) se transformam em 1 ou mais substâncias novas (produtos). Formação de ferrugem Combustão de um palito de fósforo Efervescência
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS Ficha Formativa de FQA 24. janeiro. 2018 10º Ano Turma B Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
ESCOLA SECUNDÁRIA DE CASQUILHOS Ficha Formativa de FQA 24. janeiro. 2018 10º Ano Turma B Professora: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas e termina
Lista de Exercícios - Professor facebook.com/profrodrigoartuso. Grandezas Químicas e Estequiometria
 Grandezas Químicas e Estequiometria Criando base 1 - Em 100 gramas de alumínio, quantos átomos deste elemento estão presentes? Dados: M(Al) = 27 g/mol 1 mol = 6,02 x 10 23 átomos a) 3,7 x 10 23 b) 27 x
Grandezas Químicas e Estequiometria Criando base 1 - Em 100 gramas de alumínio, quantos átomos deste elemento estão presentes? Dados: M(Al) = 27 g/mol 1 mol = 6,02 x 10 23 átomos a) 3,7 x 10 23 b) 27 x
Eletrólitos e Não Eletrólitos
 Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
Atividade complementar. Substâncias e transformações químicas, entendendo os aspectos quantitativos
 Atividade complementar Substâncias e transformações químicas, entendendo os aspectos quantitativos Esta atividade tem como objetivo complementar e aprofundar os estudos sobre as transformações químicas,
Atividade complementar Substâncias e transformações químicas, entendendo os aspectos quantitativos Esta atividade tem como objetivo complementar e aprofundar os estudos sobre as transformações químicas,
Química FUVEST. Química 001/001 FUVEST 2009 FUVEST 2009 Q.01. Leia atentamente as instruções abaixo Q.02
 / FUVEST 9 ª Fase História ou Química (5//9) Química LOTE SEQ. BOX / Química FUVEST FUNDAÇÃO UNIVERSITÁRIA PARA O VESTIBULAR Leia atentamente as instruções abaixo. Aguarde a autorização do fiscal para
/ FUVEST 9 ª Fase História ou Química (5//9) Química LOTE SEQ. BOX / Química FUVEST FUNDAÇÃO UNIVERSITÁRIA PARA O VESTIBULAR Leia atentamente as instruções abaixo. Aguarde a autorização do fiscal para
Ocorrência de reações
 Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
Questão 10: Sobre as moléculas de CO 2 e SO 2, cujas estruturas estão representadas a seguir, é CORRETO afirmar que: S O O C O
 QUESTÕES OBJETIVAS Questão 9: Nitrogênio e fósforo são elementos essenciais para a nutrição das plantas e por isso alguns de seus compostos são utilizados na maioria dos fertilizantes. Sobre esses elementos
QUESTÕES OBJETIVAS Questão 9: Nitrogênio e fósforo são elementos essenciais para a nutrição das plantas e por isso alguns de seus compostos são utilizados na maioria dos fertilizantes. Sobre esses elementos
INTRODUÇÃO À QUÍMICA
 INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
3º Trimestre Sala de Estudo Data: 27/11/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 27/11/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Especial Vunesp (FAMERP e FAMEMA) Famerp 2017 1) Durante o ciclo hidrológico ocorrem diversas
3º Trimestre Sala de Estudo Data: 27/11/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Especial Vunesp (FAMERP e FAMEMA) Famerp 2017 1) Durante o ciclo hidrológico ocorrem diversas
FUVEST 1985 Primeira fase e Segunda fase
 FUVEST 1985 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 85. Qual o método de separação utilizado quanto se usa um coador de pano na preparação do café? a) destilação b) filtração c) decantação d)
FUVEST 1985 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 85. Qual o método de separação utilizado quanto se usa um coador de pano na preparação do café? a) destilação b) filtração c) decantação d)
BC-1302 QUÍMICA DOS ELEMENTOS
 PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
FUVEST 1980 Primeira fase e Segunda fase
 FUVEST 1980 Primeira fase e Segunda fase NEIMENTS GERAIS Dados para as questões de Química: Número de Avogadro = 1 6,0 10 mol nitrogênio = 14, 0 Massas atômicas : oxigênio = 16,0 As questões 85 e 86 referem-se
FUVEST 1980 Primeira fase e Segunda fase NEIMENTS GERAIS Dados para as questões de Química: Número de Avogadro = 1 6,0 10 mol nitrogênio = 14, 0 Massas atômicas : oxigênio = 16,0 As questões 85 e 86 referem-se
Lista de exercícios 2 QB70D
 Lista de exercícios 2 QB70D 1) Suponha que você jogue uma bola de tênis para o alto. (a) A energia cinética da bola aumenta ou diminui à medida que ela ganha altitude? (b) O que acontece com a energia
Lista de exercícios 2 QB70D 1) Suponha que você jogue uma bola de tênis para o alto. (a) A energia cinética da bola aumenta ou diminui à medida que ela ganha altitude? (b) O que acontece com a energia
Prática 01 Reações e equações químicas
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 01 Reações e equações químicas 1. Introdução
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 01 Reações e equações químicas 1. Introdução
Disciplina: Química Data: 05 / 05 / Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo:
 Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
ESTEQUIOMETRIA. Estudo das reações. Descrevendo uma reação química. Indicadores de uma reação química:
 ESTEQUIOMETRIA Estudo das reações Indicadores de uma reação química: Produção de um gás Liberação ou absorção de calor Formação de um precipitado Mudança de cor 3 Descrevendo uma reação química Reagentes
ESTEQUIOMETRIA Estudo das reações Indicadores de uma reação química: Produção de um gás Liberação ou absorção de calor Formação de um precipitado Mudança de cor 3 Descrevendo uma reação química Reagentes
ESTEQUIOMETRIA. Estudo das reações. Indicadores de uma reação química:
 ESTEQUIOMETRIA Estudo das reações Indicadores de uma reação química: Produção de um gás Liberação ou absorção de calor Formação de um precipitado Mudança de cor 3 Descrevendo uma reação química Reagentes
ESTEQUIOMETRIA Estudo das reações Indicadores de uma reação química: Produção de um gás Liberação ou absorção de calor Formação de um precipitado Mudança de cor 3 Descrevendo uma reação química Reagentes
ESTEQUIOMETRIA. Estudo das reações. Descrevendo uma reação química. Indicadores de uma reação química:
 ESTEQUIOMETRIA Estudo das reações Indicadores de uma reação química: Produção de um gás Liberação ou absorção de calor Formação de um precipitado Mudança de cor 3 Descrevendo uma reação química Representação
ESTEQUIOMETRIA Estudo das reações Indicadores de uma reação química: Produção de um gás Liberação ou absorção de calor Formação de um precipitado Mudança de cor 3 Descrevendo uma reação química Representação
2º Trimestre Sala de Estudo Data: 22/05/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 2º Trimestre Sala de Estudo Data: 22/05/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Cálculo Estequiométrico Avançado Questão 01 - (UFRR/2017) O produto vendido comercialmente como
2º Trimestre Sala de Estudo Data: 22/05/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Cálculo Estequiométrico Avançado Questão 01 - (UFRR/2017) O produto vendido comercialmente como
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA. Exame de Seleção para o Mestrado em Química-2011.
 UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
