Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
|
|
|
- Thiago Canário Arruda
- 7 Há anos
- Visualizações:
Transcrição
1 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 2ª AULA PRÁTICA 1. Noções de equilíbrio ácido-base 2. Inspecção rápida da eficiência de um tampão de ph 3. Efeito acidificante do CO 2
2 1. IMPORTÂNCIA DO ph NO METABOLISMO CELULAR O ião de hidrogénio (H + ) é, de entre todos os iões inorgânicos, aquele que exerce maior influência na célula por unidade de concentração. Muitas das moléculas que fazem parte das estruturas celulares e dos vários sistemas de enzimas ionizam-se e existem nas células em equilíbrio com os iões livres de hidrogénio. A [H + ] é geralmente traduzida em unidades de ph, definido como o negativo do seu logaritmo (ver adiante). Muitas reacções que ocorrem nas células dependem da carga eléctrica das moléculas dos sistemas envolvidos. Por exemplo, a actividade das enzimas, a permeabilidade da membrana plasmática e o transporte activo de substâncias concentradas selectivamente na célula são dependentes da concentração de H +, porque este ião determina a carga eléctrica de moléculas e estruturas celulares. Geralmente, existe uma concentração óptima de H + para cada reacção ou actividade funcional da célula. Concentrações inferiores ou superiores a essa concentração são em geral inibidoras, como se indica no caso específico das actividades enzimáticas (Fig. 1). Actividade enzimática (% do máximo) 100 ph óptimo ph Fig. 1 - Relação entre o ph do meio e a actividade enzimática. O ph óptimo da enzima representada na figura é de aproximadamente 6,5. Apesar do ph óptimo de actuação de uma variedade de enzimas ser de aproximadamente 7, existem excepções significativas; por exemplo, a enzima pepsina, uma protease do suco gástrico, tem um ph óptimo de 1,5. O ph do estômago é bastante ácido (ph = 1), podendo a enzima funcionar neste meio. O efeito do ph (ph = - log [H + ]) na velocidade duma reacção enzimática pode ser devido ao efeito do H + na enzima, no substrato, ou no complexo formado pela enzima e o substrato. No entanto, variações na concentração de H + têm um efeito na enzima, uma vez que as enzimas são proteínas e estas, como substâncias anfotéricas (possuem grupos com cargas positivas e outros com cargas negativas) são muito sensíveis a alterações de ph do meio em que se encontram. 1
3 A variação da concentração de H + também altera a dissociação de várias substâncias. Assim, uma diminuição da [H + ] (aumento do ph) aumenta a dissociação, nomeadamente de proteínas, já que as proteínas com um pk relativamente baixo se dissociam primeiro. Ao ph das células (± 6,5-7,0), as proteínas possuem habitualmente uma carga predominantemente negativa e podem, portanto, captar iões H + produzidos pelo metabolismo celular. Esta reacção entre o ião H + e as proteínas, ou outras substâncias capazes de o captarem (p.e. HPO 2-4 e HCO - 3 ) é rápida e evita flutuações na concentração hidrogeniónica (ie do ph) na célula durante a sua actividade. 2. NOÇÕES DE -BASE Um ácido, segundo a definição de Bronsted, é uma substância dadora de H +, enquanto uma base é aceitadora de H +. Na descrição que se segue, faremos referência somente aos ácidos, especialmente ácidos fracos (representados na reacção 1 por HA), que se dissociam parcialmente e existem em equilíbrio, em solução com o H + e A - produzidos pela dissociação: K D HA H + + A - (Reacção 1) onde HA representa o ácido, A - a quantidade do ácido que se dissociou e K D representa a constante de dissociação, a qual se pode expressar pela equação 1: os ácidos. [ H + ] [A - ] K D = (Equação 1) [HA] Em relação às bases, as considerações são idênticas às que foram descritas para Os ácidos fortes, tais como o HCl, dissociam-se completamente e, portanto, em água, a concentração de H + ou Cl - é igual à concentração original do ácido. Assim, 0,1 M de HCl produz 0,1 M de H + e 0,1 M de Cl -. No caso dos ácidos fracos, tais como o ácido acético, a concentração de H + produzida pelo ácido em solução aquosa é inferior à concentração original do ácido, porque só uma parte do H + concentração de H + dissociado pode calcular-se pela equação 2: do ácido se dissocia. A 2
4 [HA] [H + ] = K D (Equação 2) [A - ] ou [HA] - log [H + ] = - log K D - log (Equação 3) [A - ] A [H + ] é geralmente indicada pelo valor do ph que é definido como o negativo do logaritmo da concentração de [H + ].Portanto: [HA] ph = - log K D - log (Equação 4) [A - ] Verifica-se que, quando as concentrações de HA e A - são iguais, o ph é igual a - log K D. O valor de - log K D é uma constante característica de cada ácido e é definida como o ph a que as concentrações de HA e A - são iguais. Esta constante (-log K D ) representa-se pelo símbolo pka. Portanto: [A - ] ph = pk a + log (Equação 5) [HA] Esta é a equação de Henderson-Hasselbalch, a partir da qual é possível calcular o ph de soluções de ácidos fracos. 3. REGULAÇÃO DA [H + ] NO ORGANISMO 3.1. Eficiência de um tampão Um tampão é geralmente uma mistura dum ácido fraco e do seu sal capaz de libertar ou captar H +, de modo a evitar alterações na concentração de H +. Um termo mais descritivo para este sistema seria amortecedor, pois o seu efeito é manter um meio constante no que diz respeito à concentração de H +, em face de produção ou gasto deste ião em qualquer reacção celular. A eficiência dum sistema tampão traduz-se na capacidade do sistema em manter constante a concentração de H +. Quantas moles de H + (ou OH - ) podem ser adicionados a 3
5 um meio contendo um sistema tampão para alterar significativamente a concentração de H +? O número de moles necessárias será tanto maior quanto mais eficiente for o sistema tampão. Pela equação de Henderson-Hasselbalch, ph = pka + log ([A - ]/[HA]), pode verificar-se que a alteração do valor de ph (e portanto da concentração de H + ) depende da razão [A - ]/[HA], isto é, das concentrações do ácido, [HA], e do sal do ácido, [A - ]. Uma análise cuidadosa da equação revela também que o sistema tampão (isto é, mistura do ácido e do seu sal) é mais eficiente na manutenção do ph quando [HA]=[A - ] e, portanto, quando ph=pka. Na prática, utiliza-se um tampão para evitar variações de ph. Este é mais eficiente na gama de valores de ph situados entre uma unidade abaixo e uma unidade acima do valor do pka do ácido fraco (ou base fraca) que serve de tampão. Fora desta gama, a eficiência do tampão é muito reduzida, como se pode verificar na Fig. 2, que representa a titulação do ácido acético e do ião amónia com NaOH. 1,0 CH 3 COOH CH 3 COO - + H + NH 4 + NH 3 + H + Formatada: Inglês (E.U.A.) Formatada: Inglês (E.U.A.) Formatada: Inglês (E.U.A.) 0,8 (a) (b) 0,6 Equivalentes de pka = 4,76 pka = 9,3 NaOH 0,4 0, ph Fig. 2 - Curvas de titulação para dois ácidos fracos: (a) ácido acético, com um pka = 4,7 e (b) amónia, com um pka = 9,3. Deve notar-se que a forma da curva é idêntica para todos os monoácidos, sendo a sua posição determinada pelo pka. 4
6 Analisando a curva de titulação do ácido acético representada na Fig. 2, pode verificar-se que no ínicio da curva a adição de 0,1 equivalentes de NaOH causa uma alteração no ph de aproximadamente uma unidade. Porém, para valores de ph entre 3,76 e 5,75 (ou seja, uma unidade de ph abaixo e uma unidade de ph acima do pka do ácido) a adição de quantidades maiores de NaOH aumenta mais lentamente o ph. Para valores superiores de ph, uma pequena adição de NaOH causa um aumento relativamente grande no valor de ph. O ácido acético pode, portanto, ser usado como tampão na gama de ph entre 3,76 e 5,76. Para se tamponar uma solução noutra gama de ph é necessário usar um ácido fraco (ou base fraca) cujo valor do pka corresponda ao valor de ph pretendido. Para se preparar o tampão, titula-se o ácido até se obter o ph desejado, ie próximo do valor do pka do tampão, de modo a que as concentrações das formas ionizada e não ionizada do tampão sejam próximas e máxima a eficiência do tampão à concentração usada. Os tampões mais comuns, eficientes ao ph fisiológico (possuem pka entre 6 e 8), são os fosfato (tampão intracelular), bicarbonato (tampão extracelular) e imidazol (estrutura semelhante à do aminoácido histidina). Para o caso do ácido fosfórico, com três equivalentes de H + por mole (H 3 PO 4 ), existem três valores de pka. Este ácido pode portanto, servir de tampão em três regiões de ph correspondentes aos valores de pka do ácido (pka 1 = 2,1; pka 2 = 7,2; pka 3 = 12,3). No entanto apenas o pka 2 (7,2) é importante ao nível fisiológico. Definiu-se o valor de ph ao qual uma molécula apresenta uma carga global nula ou neutra (ie, o número de cargas positivas é igual ao número de cargas negativas) como o ponto isoeléctrico (pi 1 ) Importância dos aminoácidos na regulação da concentração de H + No caso dos aminoácidos, moléculas com carga, os grupos carboxílicos dissociam-se a um ph mais baixo do que os grupos amínicos (Fig. 3). 5
7 Como exemplo, apresenta-se a dissociação da glicina (Reacção 2): pk 1 = 2,3 pk 2 = 9,6 H 2 C - COOH H 2 C - COO - + H + H 2 C - COO - + H + (Reacção 2) NH + 3 NH + 3 NH 2 Neste caso, em que o aminoácido tem apenas dois grupos acido-base ( a glicina é um aminoácido monoamino, monocarboxílico), o valor de ph correspondente ao pi é determinado pelo cálculo da média dos dois pk s entre os quais a carga global é nula. 1,0 0,8 pka 2 0,6 pi = 6,0 Equivalentes de NaOH 0,4 0,2 pka ph Fig. 3- Curva de titulação da glicina. Nesta curva estão representados os valores de pka 1 = 2,3 e pka 2 = 9,6. O pi é 6,0 (cálculo da média: (pk 1 + pk 2 /2). No caso de aminoácidos com mais de um grupo carboxílico, a curva (Fig. 4) que representa a titulação do aminoácido com uma base, apresenta uma região tampão para cada grupo carboxílico, além da região tampão correspondente ao grupo amínico. Como exemplo, apresenta-se a dissociação do ácido aspártico (Reacção 3): 6
8 COOH COO - COO - COO - pk 1 = 2,1 pk 2 = 3,9 pk 3 = 9,8 HC - NH + 3 HC - NH H + HC - NH H + HC-NH 2 +H + CH 2 -COOH CH 2 -COOH CH 2 -COO - CH 2 -COO - Carga eléctrica (+1) (0) (-1) (-2) 2,5 Formatada: Inglês (E.U.A.) Formatada: Português (Portugal) Formatada: Português (Portugal) Formatada: Português (Portugal) Formatada: Português (Portugal) Formatada: Português (Portugal) Equivalentes de NaOH 1,5 tampão pka 3 = 9,8 0,5 tampão pka 1 = 2,1 tampão pka 2 = 3,9 1,1 2,1 3 3,9 4,9 8,8 9,8 10,8 Fig. 4 - Curva de titulação do ácido aspártico. Estão representadas as três zonas de ph em que o ácido aspártico pode actuar como tampão, e que são correspondentes aos respectivos valores de pka, pka 1 de 2,1, pka 2 de 3,9 e pka 3 de 9,8. O pi é 3,0 (cálculo da média: (pka 1 + pka 2 /2). As proteínas possuem vários aminoácidos e, portanto, grupos carboxílicos e amínicos que se ionizam a diferentes valores de ph. Isto explica o facto de as proteínas serem bons tampões de ph, contribuindo para a manutenção da concentração hidrogeniónica nas células. 7
9 Alguns dos grupos das proteínas que se dissociam e os respectivos valores de pk estão representados na Tabela I (pk = valor do ph ao qual ocorre 50% de dissociação de uma substância). TABELA I- GRUPOS QUÍMICOS DAS PROTEÍNAS E O VALOR DE pk Grupo das proteínas Reacção de dissociação pk Carboxílico COOH COO - + H + 3-4,7 + Imidazólico HC NH HC N + H + 6,1 HC CH HC CH N H N H Amínico NH 3 + NH 2 + H + 6,5-10, Transporte de CO 2 no sangue e efeito acidificante do CO 2 O CO 2 é continuamente formado por todas as células do organismo como um dos produtos finais do catabolismo. É libertado das células por difusão e, ao penetrar nos capilares, é transportado pelo sangue sob três formas possíveis: a) Uma pequena quantidade é transportada na forma dissolvida (7%); b) Outra pequena percentagem é transportada na forma de carbaminohemoglobina (10%); c) A maior parte (60-90%) é transportada sob a forma de ião bicarbonato. O CO 2 que se difunde do plasma para os glóbulos vermelhos (GV) reage com a água para formar ácido carbónico (H 2 CO 3 ); esta reacção é catalizada pela enzima anidrase carbónica (AC). O ácido carbónico dissocia-se rapidamente em iões hidrogénio (H + ) e bicarbonato (HCO - 3 ). A maior parte dos iões H + formados reagem com a hemoglobina, que é um poderoso tampão de ph. Por outro lado, grande parte dos iões 8
10 bicarbonato difundem para o plasma através do trocador aniónico que permite a entrada simultânea de iões Cl - para o interior dos GV (Fig. 5). A respiração remove o CO 2 que é libertado nos pulmões (normalmente à mesma velocidade com que vai sendo formado), ocorrendo a Reacção 4 no sentido inverso. H 2 O + CO 2 H 2 CO 3 H + + HCO 3 - (Reacção 4) N Fluído intersticial Capilar GV Célula Hb Hb-CO 2 CO 2 CO 2 CO 2 + H 2 O H 2 CO 3 AC Formatada: Inglês (E.U.A.) Formatada: Inglês (E.U.A.) CO 2 O 2 H HCO 3 Hb- O 2 Hb - Hb-H Plasma Cl - HCO 3 - Fig. 5 - Transporte de CO 2 no sangue. A forma desoxigenada da hemoglobina tem maior afinidade para H + do que a forma oxigenada. Assim, quando o sangue flui através dos tecidos metabolicamente activos, uma fracção da oxihemoglobina perde o oxigénio e transforma-se na forma desoxigenada, com maior afinidade para protões. Deste modo, a maior parte dos protões 9
11 derivados da reacção de CO 2 com água ao nível do sangue são captados pela hemoglobina (Fig. 6), razão pela qual o ph do sangue venoso é ligeiramente inferior ao do sangue arterial. Tecidos Plasma GV Hb-O 2 O 2 O 2 Hb - Hb-H CO 2 CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - Fig. 6 - Efeito tampão da hemoglobina (Hb) quando o sangue flui nos capilares que banham os tecidos. Quando o sangue venoso passa pelos pulmões, a hemoglobina fica saturada de O 2 e a sua capacidade de ligar H + diminui. Os protões libertados reagem então com o HCO - 3, deslocando-se o equilíbrio no sentido de formar CO2, que se difunde para os alvéolos e é expirado (A reacção 5 é a 4, no sentido inverso). HCO H + H 2 CO 3 CO 2 + H 2 O (pulmões; Reacção 5) O tampão bicarbonato é um tampão fisiológico importante. Um aumento extracelular da [H + ] desloca a Reacção 5 para a direita, ao passo que um decréscimo desloca a mesma reacção para a esquerda. 10
12 Conceitos importantes associados ao sistema tampão bicarbonato: a) A concentração de bicarbonato extracelular é normalmente alta (cerca de 25 mm) e regulada pelos rins. b) Existe uma relação estreita entre a [H + ] extracelular e a eliminação de CO 2 pelo organismo. Assim, quando a [H + ] extracelular aumenta, a Reacção 5 desloca-se no sentido da formação de CO 2, mas o restabelecimento da [H + ] depende da eliminação de CO 2, ie da eliminação pulmonar. Caso contrário, a acumulação de CO 2 desloca de novo o equilíbrio para a esquerda, com formação de H +. Um aumento da [H + ] extracelular estimula o centro respiratório, aumentando a ventilação alveolar e, consequentemente, a eliminação de CO 2. É este controlo da eliminação de CO 2 pela [H + ] extracelular que permite que o sistema HCO - 3/CO 2 funcione como um tampão eficiente. Quando a [H + ] extracelular diminui, a Reacção 5 desloca-se no sentido da formação de HCO - 3 e H +, restabelecendo a [H + ] extracelular normal, porque o decréscimo de [H + ] extracelular inibe o centro respiratório, diminuindo a ventilação alveolar e, portanto, a eliminação de CO 2. O aumento subsequente da [CO 2 ] extracelular favorece a reacção para a esquerda, permitindo a formação de H Efeito de um excesso de H + no CO 2 do plasma O efeito directo de um excesso de H +, pela lei de acção da massa, é aumentar a produção de CO 2, mas o resultado indirecto é baixar o CO 2, estimulando rapidamente a respiração. Uma vez que o último efeito predomina, o efeito final é a redução de CO 2 no plasma. H + + HCO 3 - H 2 CO 3 H 2 O + CO 2 resultado final VENTILAÇÃO CO 2 CO 2 plasma 11
13 Este exemplo ilustra o efeito do equilíbrio ácido-base na respiração. Vejamos agora o efeito da respiração no equilíbrio ácido-base: A) Paragem prolongada da respiração (asfixia): CO 2 + H 2 O H 2 CO 3 - H + + HCO 3 - acidose: ph extracelular 7,4 ~7,1 Como consequência, o aumento de H + estimula o centro respiratório e leva à necessidade de respirar profundamente e com grande frequência, partindo do pressuposto de que a função ventilatória foi entretanto restaurada. B) Hiperventilação: CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - alcalose: ph extracelular 7,4 7,7 Em consequência, a diminuição de H + inibe o centro respiratório, levando à necessidade de respirar menos profundamente e com menor frequência. Efeito da acidose e da alcalose na respiração (volume de ar ao longo do tempo): Normal Acidose Normal Alcalose ph 7,4 ph 7,1 ph 7,4 ph 7,7 Formatada: Português (Portugal) 12
14 3.5. Aplicação da equação de Henderson-Hasselbalch ao tampão fisiológico CO 2 /HCO 3 - Tendo em conta a Reacção 4 e a aplicação da Equação 5: [HCO 3 - ] ph = pk a + log (Equação 5) [CO 2 ] Esta é a equação de Henderson-Hasselbalch, para o par ácido-base CO 2 /HCO - 3, a partir da qual é possível calcular variações no ph fisiológico resultantes das alterações, tanto na pressão de CO 2 ([CO 2 ]=pco 2 x 0,0301 mm), como na concentração plasmática do ião HCO - 3. O pka é cerca de 6,1. 13
15 APÊNDICE: I. DISSOCIAÇÃO DA ÁGUA E DEFINIÇÃO DE ph A água actua como um ácido e como uma base, uma vez que produz H + e OH -, ie cede e capta protões. K e H 2 O H + + OH - onde Ke é a constante do equilíbrio da reacção. A concentração de H + concentração de OH -. O valor de Ke é: produzido pela água é relativamente baixa e é igual à K e = [H + ] [OH - ] [H 2 O] Como a concentração da água [H 2 O] é relativamente alta e constante (é igual ao número de gramas de H 2 O num litro dividido pelo peso molecular da água, ou seja 1000/ 18 = 55,55 M), o produto Ke [H 2 O] pode expressar-se pela constante Kw (produto iónico da água). Portanto: Kw = [H + ] [OH] = Se expressarmos esta equação em termos dos logaritmos dos valores representados: pkw = ph + poh = 14 onde poh tem o valor do - log [OH] por analogia com o valor de ph definido anteriormente. Uma vez que consideraremos somente ácidos e bases fracos em solução aquosa, o produto das concentrações de [H + ] e [OH - ] será igual a (ou a soma ph + poh = 14). Portanto, se a concentração de H + dum ácido fraco em água for de 10-5 M, a concentração de OH - nessa mesma solução será de 10-9 M. Esta relação é válida para valores de ph entre 0 e 14. 1
16 A expressão da concentração de H + em termos de normalidade (N) ou molaridade (M) é pouco conveniente, uma vez que se tem de recorrer ou a potências (ex: 10-6 M) ou a muitas casas decimais (ex: 0, M). Afim de evitar esta dificuldade Sorensen propõs expressar a concentração de H + como o negativo do seu logaritmo e designou esta função de ph: ph = - log 10 [H + ] Na tabela seguinte indica-se a relação entre concentração de H +, de OH - e o ph. Relação entre concentração de H + expressa em normalidade e o ph: [H + ] [ OH - ] log [H + ] - log [H + ] = ph 1N 10 0 N N ,1 N 10-1 N N ,001 N 10-3 N N , N 10-5 N 10-9 N , N 10-7 N 10-7 N , N 10-9 N 10-5 N , N N 10-3 N , N N 10-0 N
17 II. MÉTODOS DE DETERMINAÇÃO DO ph Existem dois métodos para medir o valor do ph normalmente usados no laboratório:o método dos indicadores (corantes) e o que usa o aparelho de ph (método potenciométrico). II.a) Indicadores Indicadores de ph são ácidos (ou bases) fracos que apresentam cores diferentes na forma ionizada e não ionizada. Quando o ph da solução em que se encontram estes indicadores é igual ao pk dos indicadores, as concentrações das moléculas ionizadas e não ionizadas do indicador são iguais e observa-se uma cor de transição. O uso dos indicadores tem uma aplicação limitada. No entanto, ainda são correntemente usados em titulações de ácidos e bases. HIn H + + In - K = [H + ] [In - ] [HIn] [H + ] = K a (indicador) [HIn] [In - ] [HIn] quando [HIn] = [In - ] = 1 [H + ] = K a (indicador) ou ph = pk a [In - ] Quando o indicador possui grande capacidade de tingimento, basta usar quantidades pequenas, tão pequenas que não conseguem afectar a acidez ou a basicidade da solução. A relação entre as duas formas do indicador, HIn e In -, mede neste caso a [H + ] que existe na solução antes da adição do indicador. Em equilíbrio, teríamos, no caso da adição de HCl a uma solução com indicador: [HIn] = a-x [In - ] = x [H + ] = [HCl] adicionado + x (proveniente de HIn) [HCl] 3
18 Valores dos pk e as cores dos indicadores usados em titulações: Indicador pk Transição de cor Gama de ph em que pode ser usado Timol azul 1,7 Vermelho-amarelo 1,2-2,8 Laranja de Metilo 3,5 Vermelho-amarelo 3,1-4,4 Bromofenol azul 4,0 Amarelo-azul 3,1-4,7 Bromocresol verde 4,7 Amarelo-azul 3,8-5,4 Vermelho de Metilo 5,0 Vermelho-amarelo 4,2-6,3 Clorofenol vermelho 6,0 Amarelo-vermelho 5,1-6,7 Bromocresol púrpura 6,2 Amarelo-roxo 5,4-7,0 Bromotimol azul 7,0 Amarelo-azul 6,0-7,6 Fenol vermelho 7,8 Amarelo-vermelho 7,0-8,6 Cresol vermelho 8,3 Amarelo-vermelho 7,4-9,0 Timol azul 8,9 Amarelo-azul 8,0-9,6 Fenolftaleína 9,7 Descorado-vermelho 8,3-10,0 II.b) Medição do ph pelo potenciómetro Nos laboratórios é mais comum usar-se o aparelho de medir ph (potenciómetro) em estudos que requerem medições da concentração do ião H + em solução. O aparelho de ph (Fig. A.1) possui um elétrodo de vidro que é um tubo que contém dentro uma solução com uma determinada concentração de H +. Esta solução é separada das soluções exteriores (em que se deseja medir a concentração de H + ) por uma membrana de vidro no fundo do tubo, a qual é permeável somente a H +. Portanto, a tendência de difusão do H + através desta membrana causa um potencial eléctrico cuja grandeza depende do gradiente de concentração de H + dentro e fora do eléctrodo. O resto do instrumento consiste simplesmente num mecanismo electrónico que mede o potencial eléctrico quando o circuito é fechado por meio dum eléctrodo de referência. O ph é proporcional a este potencial. O eléctrodo de referência é preparado de modo a evitar potenciais de junção, usando para isso uma solução concentrada de KCl que faz a ligação com a solução cujo ph se deseja medir por intermédio dum pequeno orifício. A quantidade de KCl que se difunde para a solução é insignificante mas basta para fechar o circuito. O KCl é preferido a outros sais porque as mobilidades de K + e Cl - são aproximadamente iguais, o que evita que se gere um potencial de junção que interfiriria com o potencial criado pelo gradiente de H + através da membrana do eléctrodo de vidro: isto é, seria difícil distinguir entre os dois potenciais. 4
19 Calibração do aparelho de ph: 1. Seleccionar no respectivo botão do aparelho de ph a temperatura da solução cujo ph se pretende determinar. 2. Colocar o eléctrodo numa solução tampão padrão de ph = 7,0 e ligar o aparelho 3. Ajustar a agulha da escala para a leitura 7,0 com o botão "buffer adjustment". 4. Repetir 2. e 3. para uma solução tampão padrão de ph = 4,0 e certificar-se de que a agulha dá a leitura de 4,0. 5. Medir o ph da solução desejada. Eléctrodo de Referência (calomelanos) Eléctrodo de vidro potenciómetro amplificador solução de KCl KCl Hg 2 Cl 2 [H+] Hg 2 [H+] = 0,1 N [H+] desconhecida Fig. A.1- Esquema simplificado dos componentes principais de um aparelho para medir ph. A amostra cujo ph se pretende medir é colocada num recipiente no qual se coloca a extremidade do eléctrodo de vidro contendo H + 0,1 N e o eléctrodo de referência. Devido à diferença de concentração de H + dentro e fora do eléctrodo de vidro gera-se um potencial que é amplificado e medido por um potenciómetro. Normalmente o potenciómetro está calibrado em unidades de ph ou em volts (V). 5
20 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em Medicina 1º Ano Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 A) INSPECÇÃO RÁPIDA DA EFICIÊNCIA DE UM TAMPÃO DE ph Grupos 1 e 3 1. Coloque 96 ml de água da torneira num copo de precipitação. 2. Adicione algumas gotas de azul de bromotimol em quantidade suficiente para que a cor seja bem visível. 3. Ao primeiro copo, adicionar, gota a gota, HCl 1 M até a cor se tornar francamente amarela e anote o volume de ácido. Depois adicione, gota a gota, NaOH 1 M. Observe a mudança de cor para verde e finalmente azul escuro, anotando o volume da base. 4. Ao mesmo copo, adicione cerca de 2 ml de KH 2 PO 4 0,35 M e deixe dissolver completamente. Seguidamente, adicionar 2 ml de K 2 HPO 4 0,3 M e dissolver. Note as mudanças de cor que acompanham as adições. 5. Repetir a adição de HCl 1 M e NaOH 1 M e compare as diferenças de volume (dramáticas) entre a solução não tamponada e depois de tamponada. 6. Interprete as observações. Grupos 2 e 4 1. Coloque 60 ml de água da torneira num copo de precipitação. Adicione algumas gotas de azul de bromotimol em quantidade suficiente para que a cor seja bem visível. Adicionar 20 ml de KH 2 PO 4 0,35 M e K 2 HPO 4 0,3 M (anote as mudanças de cor que acompanham as adições). Anote os volumes de ácido (HCl 1 M) e base (NaOH 1 M) requeridos para alterar as cores do bromotimol. 2. Interprete as observações. 1
21 Ano Lectivo 2011/2012 BIOQUÍMICA I 1º Ano PROTOCOLO DE BANCADA - 2ª AULA PRÁTICA B) O princípio de Le Chatelier APLICADO AO Efeito acidificante do CO 2 Grupos 1 a 4: 1. Prepare um copo com água da torneira (25 ml) e 3 gotas de azul de bromotimol e adicione NaOH 0,01 M, o suficiente para a solução ultrapassar a neutralidade e estabelecer a cor azul. Retirar 5 ml para um tubo de ensaio para servir de controlo. 2. Fazer borbulhar CO 2 (de ar expirado). 3. Notar a mudança gradual da cor. 4. Aquecer a solução até à fervura e registar as transições de cor. 5. Voltar a adicionar CO 2 e notar as transições. 6. Comente as observações com base no equilíbrio. CO 2 + H 2 O (H 2 CO 3 ) H + + HCO 3-2 H + + CO Comente o equilíbrio em relação ao processo respiratório. Nota: o azul de bromotimol é um indicador de ph com um valor de pk~7,0. A forma protonada do indicador (HIn), prevalente a ph<7,0 tem uma coloração amarela, enquanto a forma desprotonada (In - ), prevalente a ph>7,0 tem uma coloração azul. 2
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Titulações Ácido-Base Titulações de Neutralização
 Titulações Ácido-Base Titulações de Neutralização Reacções de neutralização Métodos quantitativos Doseamentos Medição de ph e uso de indicadores Soluções tampão No ponto de meia titulação ph = pk a e consoante
Titulações Ácido-Base Titulações de Neutralização Reacções de neutralização Métodos quantitativos Doseamentos Medição de ph e uso de indicadores Soluções tampão No ponto de meia titulação ph = pk a e consoante
Ácidos e Bases. Os ácidos e bases fortes encontram-se completamente ionizados quando em solução aquosa. HCl H + + Cl - NaOH Na + + OH -
 Ácidos e Bases Os ácidos e bases fortes encontram-se completamente ionizados quando em solução aquosa. HCl H + + Cl - NaOH Na + + OH - Em sistemas biológicos os ácidos e bases fracas são bastante importantes
Ácidos e Bases Os ácidos e bases fortes encontram-se completamente ionizados quando em solução aquosa. HCl H + + Cl - NaOH Na + + OH - Em sistemas biológicos os ácidos e bases fracas são bastante importantes
VOLUMETRIA DE NEUTRALIZAÇÃO
 VOLUMETRIA DE NEUTRALIZAÇÃO 1 semestre 2011 Profa. Maria Auxiliadora Costa Matos Volumetria de neutralização envolve a titulação de espécies químicas ácidas com uma solução padrão alcalina (ALCALIMETRIA)
VOLUMETRIA DE NEUTRALIZAÇÃO 1 semestre 2011 Profa. Maria Auxiliadora Costa Matos Volumetria de neutralização envolve a titulação de espécies químicas ácidas com uma solução padrão alcalina (ALCALIMETRIA)
Ácido-base: objectivos principais
 Ácido-base: objectivos principais Definição de ph e poh Definição e interpretação de K a, K b, K w Relação entre K a e K b de pares ácido-base conjugados (a 25ºC pk a pk b =14) Calcular o ph de uma solução
Ácido-base: objectivos principais Definição de ph e poh Definição e interpretação de K a, K b, K w Relação entre K a e K b de pares ácido-base conjugados (a 25ºC pk a pk b =14) Calcular o ph de uma solução
Sistema Tampão. Efeito de ph na Atividade Enzimática
 Sistema Tampão Efeito de ph na Atividade Enzimática Sistema Tampão - Ionização da Água - Definição de ácidos fortes e ácidos fracos - Equação de Henderson-Hasselbalch - Definição de sistema tampão - Curvas
Sistema Tampão Efeito de ph na Atividade Enzimática Sistema Tampão - Ionização da Água - Definição de ácidos fortes e ácidos fracos - Equação de Henderson-Hasselbalch - Definição de sistema tampão - Curvas
Ácidos e bases Auto-ionização da água
 Ácidos e bases Auto-ionização da água Composição química das águas Água da Chuva - a sua composição depende dos componentes do ar que atravessa; normalmente a chuva normal é ligeiramente ácida (ph= 5,6
Ácidos e bases Auto-ionização da água Composição química das águas Água da Chuva - a sua composição depende dos componentes do ar que atravessa; normalmente a chuva normal é ligeiramente ácida (ph= 5,6
A ÁLISE TITRIMÉTRICA
 A ÁLISE TITRIMÉTRICA Análise titrimétrica - O termo análise titrimétrica refere-se à análise química quantitativa feita pela determinação do volume de uma solução, cuja concentração é conhecida com exatidão,
A ÁLISE TITRIMÉTRICA Análise titrimétrica - O termo análise titrimétrica refere-se à análise química quantitativa feita pela determinação do volume de uma solução, cuja concentração é conhecida com exatidão,
Medição e cálculo do ph de algumas soluções
 Química Geral Medição e cálculo do ph de algumas soluções Docente: Dulce Gomes Engenharia do Ambiente (2º Ano) Turma EPQ Data de entrega do relatório: 17-02-2009. Relatório elaborado em 14-02-2009 pelo
Química Geral Medição e cálculo do ph de algumas soluções Docente: Dulce Gomes Engenharia do Ambiente (2º Ano) Turma EPQ Data de entrega do relatório: 17-02-2009. Relatório elaborado em 14-02-2009 pelo
7. EQUILÍBRIO QUÍMICO
 Departamento de Química Inorgânica IQ / UFRJ IQG 18 / IQG 1 7. EQUILÍBRIO QUÍMICO I. INTRODUÇÃO Quando a concentração de todos os reagentes e produtos, em um sistema fechado, não variam mais com o tempo
Departamento de Química Inorgânica IQ / UFRJ IQG 18 / IQG 1 7. EQUILÍBRIO QUÍMICO I. INTRODUÇÃO Quando a concentração de todos os reagentes e produtos, em um sistema fechado, não variam mais com o tempo
Determinação dos espectros de absorção de diferentes formas de Hemoglobina
 Faculdade de Medicina da Universidade de Coimbra Bioquímica I 1º Ano Medicina Determinação dos espectros de absorção de diferentes formas de Hemoglobina T U R M A 6 A N O L E C T I V O 2 0 1 0 / 2 0 1
Faculdade de Medicina da Universidade de Coimbra Bioquímica I 1º Ano Medicina Determinação dos espectros de absorção de diferentes formas de Hemoglobina T U R M A 6 A N O L E C T I V O 2 0 1 0 / 2 0 1
4- A pressão total de uma mistura de gases é igual à soma de suas. pressões parciais. Assim, a pressão atmosférica CONTROLE QUÍMICO DA RESPIRAÇÃO
 RESPIRAÇÃO A manutenção das funções celulares e da vida depende de um suprimento contínuo de quantidades adequadas de oxigênio aos tecidos. Grandes quantidades de CO2 precisando ser removida no organismo.
RESPIRAÇÃO A manutenção das funções celulares e da vida depende de um suprimento contínuo de quantidades adequadas de oxigênio aos tecidos. Grandes quantidades de CO2 precisando ser removida no organismo.
Métodos Volumétricos 11/27/2013. Volumetria de Neutralização. Volumetria de Precipitação. Volumetria de Complexação. Volumetria de Óxido-Redução
 Métodos Volumétricos Volumetria de Neutralização Volumetria de Precipitação Volumetria de Complexação Volumetria de Óxido-Redução 1 Volumetria de Neutralização Titulação de: (a) ácidos fortes com bases
Métodos Volumétricos Volumetria de Neutralização Volumetria de Precipitação Volumetria de Complexação Volumetria de Óxido-Redução 1 Volumetria de Neutralização Titulação de: (a) ácidos fortes com bases
A.L.2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO-BASE
 A.L.2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO-BASE QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como neutralizar resíduos de ácidos/bases do laboratório de Química da escola? Como identificar se os resíduos são de uma
A.L.2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO-BASE QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como neutralizar resíduos de ácidos/bases do laboratório de Química da escola? Como identificar se os resíduos são de uma
Volumetria de Neutralização Ácido-Base
 Volumetria de Neutralização Ácido-Base 1 O que é um Processo de Titulação? A Titulação é uma operação analítica utilizada em análises volumétricas com o objetivo de determinar a Concentração de soluções.
Volumetria de Neutralização Ácido-Base 1 O que é um Processo de Titulação? A Titulação é uma operação analítica utilizada em análises volumétricas com o objetivo de determinar a Concentração de soluções.
Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada
 1 Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada 1. Questões de estudo - Como preparar uma solução aquosa de NaOH 0,1 M? - Como preparar uma solução
1 Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada 1. Questões de estudo - Como preparar uma solução aquosa de NaOH 0,1 M? - Como preparar uma solução
Auto-ionização da água
 ÁCIDOS E BASES Auto-ionização da água Os íons hidrônio e hidróxido A água possui uma propriedade de interesse particular no estudo de ácidos e bases: a auto-ionização. H 2 O + H 2 O H 3 O + + HO - - duas
ÁCIDOS E BASES Auto-ionização da água Os íons hidrônio e hidróxido A água possui uma propriedade de interesse particular no estudo de ácidos e bases: a auto-ionização. H 2 O + H 2 O H 3 O + + HO - - duas
Prof. Dr. Paulo Evora Ft. Luciana Garros Ferreira DISCIPLINA: PNEUMOLOGIA CLÍNICA E CIRÚRGICA
 Prof. Dr. Paulo Evora Ft. Luciana Garros Ferreira DISCIPLINA: PNEUMOLOGIA CLÍNICA E CIRÚRGICA Zonas de Condução e Respiração Mecânica respiratória Contração muscular; Elasticidade e distensibilidade
Prof. Dr. Paulo Evora Ft. Luciana Garros Ferreira DISCIPLINA: PNEUMOLOGIA CLÍNICA E CIRÚRGICA Zonas de Condução e Respiração Mecânica respiratória Contração muscular; Elasticidade e distensibilidade
Titulações de ácido- base
 QUÍMICA 11º ANO- TURMA A 201/2015 FICHA INFORMATIVA/FORMATIVA SOBRE TITULAÇÕES DE ÁCIDO-BASE E DE EFEITO TAMPÃO NOME: TURMA Nº: Titulações de ácido- base Nas titulações de ácido base, as reacções que ocorrem
QUÍMICA 11º ANO- TURMA A 201/2015 FICHA INFORMATIVA/FORMATIVA SOBRE TITULAÇÕES DE ÁCIDO-BASE E DE EFEITO TAMPÃO NOME: TURMA Nº: Titulações de ácido- base Nas titulações de ácido base, as reacções que ocorrem
Ventilação Pulmonar. Vol. Ar Corrente (L) Pressão intrapleural (cm H 2 O) Fluxo de Ar (L/s) pleura parietal. pleura visceral.
 Difusão de O 2 e nos alvéolos e transporte de gases no sangue: dos pulmões aos tecidos e dos tecidos aos pulmões Efeitos do exercício Lisete Compagno Michelini Ventilação Pulmonar Pressão intrapleural
Difusão de O 2 e nos alvéolos e transporte de gases no sangue: dos pulmões aos tecidos e dos tecidos aos pulmões Efeitos do exercício Lisete Compagno Michelini Ventilação Pulmonar Pressão intrapleural
Reacções de precipitação
 Reacções de precipitação Ocorre uma reacção de precipitação quando se forma uma precipitado, ou seja, um sólido insolúvel que se separa da solução. Na precipitação a partir de soluções aquosas normalmente
Reacções de precipitação Ocorre uma reacção de precipitação quando se forma uma precipitado, ou seja, um sólido insolúvel que se separa da solução. Na precipitação a partir de soluções aquosas normalmente
UNIVERSIDADE FEDERAL DE SERGIPE CENTRO DE CIÊNCIAS EXATAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA. Ácido e Base
 UNIVERSIDADE FEDERAL DE SERGIPE CENTRO DE CIÊNCIAS EXATAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA Ácido e Base Disciplina: Química l (106201) Professora: Elisangela Passos 22 de julho de 2011 1. Teorias Ácido-Base
UNIVERSIDADE FEDERAL DE SERGIPE CENTRO DE CIÊNCIAS EXATAS E TECNOLOGIA DEPARTAMENTO DE QUÍMICA Ácido e Base Disciplina: Química l (106201) Professora: Elisangela Passos 22 de julho de 2011 1. Teorias Ácido-Base
REACÇÃO DO SOLO (protocolo fornecido pela FCUP)
 REACÇÃO DO SOLO (protocolo fornecido pela FCUP) Objectivo: medição do ph de amostras de solo em água e em soluções salinas; comparação do valor da reacção do solo em água e em soluções salinas Considerações
REACÇÃO DO SOLO (protocolo fornecido pela FCUP) Objectivo: medição do ph de amostras de solo em água e em soluções salinas; comparação do valor da reacção do solo em água e em soluções salinas Considerações
Fisiologia do Sistema Respiratório. Prof. Camila Aragão Almeida
 Fisiologia do Sistema Respiratório Prof. Camila Aragão Almeida Funções do Sistema Respiratório Função principal: realizar as trocas gasosas entre O 2 e CO 2 Manutenção do equilíbrio ácido-básico Regulação
Fisiologia do Sistema Respiratório Prof. Camila Aragão Almeida Funções do Sistema Respiratório Função principal: realizar as trocas gasosas entre O 2 e CO 2 Manutenção do equilíbrio ácido-básico Regulação
tem-se no equilíbrio que 1 mol de HCl reagiu com 1 mol de NaOH, ou seja: n(hcl) = n(naoh)
 Experiência 8: TITULAÇÕES ÁCIDO-BASE 1. Objetivos Após a realização desta atividade experimental, espera-se que o aluno seja capaz de: - Determinar a concentração de um ácido e uma base por titulação.
Experiência 8: TITULAÇÕES ÁCIDO-BASE 1. Objetivos Após a realização desta atividade experimental, espera-se que o aluno seja capaz de: - Determinar a concentração de um ácido e uma base por titulação.
t 1 t 2 Tempo t 1 t 2 Tempo
 Concentração 01)Uma reação química atinge o equilíbrio químico quando: a) ocorre simultaneamente nos sentidos direto e inverso. b) as velocidades das reações direta e inversa são iguais. c) os reatantes
Concentração 01)Uma reação química atinge o equilíbrio químico quando: a) ocorre simultaneamente nos sentidos direto e inverso. b) as velocidades das reações direta e inversa são iguais. c) os reatantes
Ficha de Trabalho de Química 11º ano
 1. Escreve as fórmulas químicas das seguintes espécies/substâncias: (A) Ácido sulfúrico (B) Ácido carbónico (C) Hidróxido de magnésio (D) Ião hidrogenossulfato (E) Ião mono-hidrogenofosfato (F) Ião amónio
1. Escreve as fórmulas químicas das seguintes espécies/substâncias: (A) Ácido sulfúrico (B) Ácido carbónico (C) Hidróxido de magnésio (D) Ião hidrogenossulfato (E) Ião mono-hidrogenofosfato (F) Ião amónio
A.L.1.3 EFEITOS DA TEMPERATURA E DA CONCENTRAÇÃO NA PROGRESSÃO GLOBAL DE UMA REACÇÃO
 A.L.1.3 EFEITOS DA TEMPERATURA E DA CONCENTRAÇÃO NA PROGRESSÃO GLOBAL DE UMA REACÇÃO QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como pode evoluir um sistema em equilíbrio quando se faz variar a temperatura ou a
A.L.1.3 EFEITOS DA TEMPERATURA E DA CONCENTRAÇÃO NA PROGRESSÃO GLOBAL DE UMA REACÇÃO QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como pode evoluir um sistema em equilíbrio quando se faz variar a temperatura ou a
Introdução à Volumetria. Profa. Lilian Lúcia Rocha e Silva
 Introdução à Volumetria Profa. Lilian Lúcia Rocha e Silva INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução que contém um soluto
Introdução à Volumetria Profa. Lilian Lúcia Rocha e Silva INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução que contém um soluto
Potencial hidrogeniônico e hidroxiliônico - ph e poh
 Potencial hidrogeniônico e hidroxiliônico - ph e poh 01. (Fuvest) Coloca-se em um recipiente de vidro água destilada, gotas de solução de fenolftaleína e, em seguida, pedaços de sódio metálico: Observa-se,
Potencial hidrogeniônico e hidroxiliônico - ph e poh 01. (Fuvest) Coloca-se em um recipiente de vidro água destilada, gotas de solução de fenolftaleína e, em seguida, pedaços de sódio metálico: Observa-se,
AMINOÁCIDOS E PROTEÍNAS
 AMINOÁCIDOS E PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição
AMINOÁCIDOS E PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição
P1 - PROVA DE QUÍMICA GERAL 03/09/07
 1 - ROVA DE QUÍMICA GERAL 03/09/07 Nome: Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) = T ( C) + 273,15
1 - ROVA DE QUÍMICA GERAL 03/09/07 Nome: Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) = T ( C) + 273,15
2. Reacções ácido-base.
 2. Reacções ácido-base. Interessam-nos as definições de ácido e base segundo Brønsted e Lowry: ácido é uma espécie que pode doar um protão a outra espécie e base é uma espécie que pode aceitar um protão
2. Reacções ácido-base. Interessam-nos as definições de ácido e base segundo Brønsted e Lowry: ácido é uma espécie que pode doar um protão a outra espécie e base é uma espécie que pode aceitar um protão
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios.
 A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios. Entretanto, os gases, especialmente oxigênio, são pouco solúveis em soluções aquosas. As proteínas respiratórias
A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios. Entretanto, os gases, especialmente oxigênio, são pouco solúveis em soluções aquosas. As proteínas respiratórias
ESCOLA SECUNDÁRIA ABADE DE BAÇAL BRAGANÇA TÉCNICAS LABORATORIAIS DE QUÍMICA 11º Ano Ano lectivo 2003/2004. TIPS - Indicadores ácido-base
 ESCOLA SECUNDÁRIA ABADE DE BAÇAL BRAGANÇA TÉCNICAS LABORATORIAIS DE QUÍMICA 11º Ano Ano lectivo 2003/2004 TIPS - Indicadores ácido-base 1 TIPS - INDICADORES ÁCIDO-BASE Nome do aluno Caro parceiro da minha
ESCOLA SECUNDÁRIA ABADE DE BAÇAL BRAGANÇA TÉCNICAS LABORATORIAIS DE QUÍMICA 11º Ano Ano lectivo 2003/2004 TIPS - Indicadores ácido-base 1 TIPS - INDICADORES ÁCIDO-BASE Nome do aluno Caro parceiro da minha
CURSINHO TRIU QUÍMICA FRENTE B
 CURSINHO TRIU QUÍMICA FRENTE B AULA 3 EXPRESSÕES DE CONCENTRAÇÃO (CONT.) E PROPRIEDADES COLIGATIVAS DATA: 01/09/2014 1) EXPRESSÕES DE CONCENTRAÇÃO (CONTINUAÇÃO) a. FRAÇÃO EM MOL Fração em mols ou fração
CURSINHO TRIU QUÍMICA FRENTE B AULA 3 EXPRESSÕES DE CONCENTRAÇÃO (CONT.) E PROPRIEDADES COLIGATIVAS DATA: 01/09/2014 1) EXPRESSÕES DE CONCENTRAÇÃO (CONTINUAÇÃO) a. FRAÇÃO EM MOL Fração em mols ou fração
Ácidos e bases. Introdução. Objetivos. Pré-requisitos
 Objetivos Definir os conceitos de ácido e base, entender o que ocorre quando estas substâncias são dissolvidas em água e rever o conceito de constante de equilíbrio de uma reação química. Pré-requisitos
Objetivos Definir os conceitos de ácido e base, entender o que ocorre quando estas substâncias são dissolvidas em água e rever o conceito de constante de equilíbrio de uma reação química. Pré-requisitos
Cat Ca ab a olismo Anab a ol o ismo
 A acção das enzimas Metabolismo celular É o conjunto de reacções químicas que ocorrem numa célula. Catabolismo moléculas complexas são convertidas em moléculas mais simples, com libertação de energia.
A acção das enzimas Metabolismo celular É o conjunto de reacções químicas que ocorrem numa célula. Catabolismo moléculas complexas são convertidas em moléculas mais simples, com libertação de energia.
Ficha do professor AL 2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO - BASE
 AL 2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO - BASE Autora : Fernanda Neri TI-Nspire Palavras-chave: Titulações; Curvas de titulação; Concentração; ácidos; bases; sais; Indicadores de ácido-base Ficheiros
AL 2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO - BASE Autora : Fernanda Neri TI-Nspire Palavras-chave: Titulações; Curvas de titulação; Concentração; ácidos; bases; sais; Indicadores de ácido-base Ficheiros
Equilíbrio Ácido-base. Controle de ph por meio de soluções tampão
 Equilíbrio Ácido-base Controle de ph por meio de soluções tampão Conceitos Soluções tampão = são sistemas aquosos que tendem a resistir a mudanças no seu ph quando pequenas quantidades de ácido ( H + )
Equilíbrio Ácido-base Controle de ph por meio de soluções tampão Conceitos Soluções tampão = são sistemas aquosos que tendem a resistir a mudanças no seu ph quando pequenas quantidades de ácido ( H + )
Exercícios de Equílíbrio Químico ENEM Resolução Comentada Professora Simone
 Exercícios de Equílíbrio Químico ENEM Resolução Comentada Professora Simone 1. O equilíbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da
Exercícios de Equílíbrio Químico ENEM Resolução Comentada Professora Simone 1. O equilíbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da
Ácidos, bases e sistemas tampão
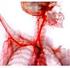 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
I Curso de Férias em Fisiologia - UECE
 I Curso de Férias em Fisiologia - UECE Realização: Instituto Superior de Ciências Biomédicas Mestrado Acadêmico em Ciências Biológicas Apoio: 1 FISIOLOGIA CELULAR Laboratório de Eletrofisiologia 1. POTENCIAL
I Curso de Férias em Fisiologia - UECE Realização: Instituto Superior de Ciências Biomédicas Mestrado Acadêmico em Ciências Biológicas Apoio: 1 FISIOLOGIA CELULAR Laboratório de Eletrofisiologia 1. POTENCIAL
Título: Iodometria. Aula Experimental n 16
 Aula Experimental n 16 Objetivos: - Padronização de solução de Na 2 S 2 O 3. - Determinação do teor de cobre (Cu 2 ) de uma amostra. - Determinação do teor de Cloro ativo em uma amostra de água sanitária.
Aula Experimental n 16 Objetivos: - Padronização de solução de Na 2 S 2 O 3. - Determinação do teor de cobre (Cu 2 ) de uma amostra. - Determinação do teor de Cloro ativo em uma amostra de água sanitária.
Indicadores de ph naturais
 Instituto Federal de Educação, Ciência e Tecnologia da Bahia Indicadores de ph naturais Práticas de ensino 2014.1 Sheila Silva; Elton Rocha; Mayara Oliveira; Izabela Oliveira [Escolha a data] Introdução
Instituto Federal de Educação, Ciência e Tecnologia da Bahia Indicadores de ph naturais Práticas de ensino 2014.1 Sheila Silva; Elton Rocha; Mayara Oliveira; Izabela Oliveira [Escolha a data] Introdução
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
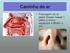 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Experiência 10: Estudo do equilíbrio cromato-dicromato
 1 UFSC Departamento de Química Área de Educação Química QMC 5119 Introdução ao Laboratório de Química 2011/1 Prof. Marcos Aires de Brito Prof. Fábio Peres Gonçalves Prof. José Carlos Gesser Experiência
1 UFSC Departamento de Química Área de Educação Química QMC 5119 Introdução ao Laboratório de Química 2011/1 Prof. Marcos Aires de Brito Prof. Fábio Peres Gonçalves Prof. José Carlos Gesser Experiência
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Aparelhos de Laboratório de Electrónica
 Aparelhos de Laboratório de Electrónica Este texto pretende fazer uma introdução sucinta às características fundamentais dos aparelhos utilizados no laboratório. As funcionalidades descritas são as existentes
Aparelhos de Laboratório de Electrónica Este texto pretende fazer uma introdução sucinta às características fundamentais dos aparelhos utilizados no laboratório. As funcionalidades descritas são as existentes
Escola Secundária de Casquilhos Teste 1 de Física e Química A 10º ANO 22/10/2013 90 minutos
 Escola Secundária de Casquilhos Teste 1 de Física e Química A 10º ANO 22/10/2013 90 minutos NOME Nº Turma Informação Professor Enc. de Educação 1. Os átomos dos isótopos e do carbono têm (A) números atómicos
Escola Secundária de Casquilhos Teste 1 de Física e Química A 10º ANO 22/10/2013 90 minutos NOME Nº Turma Informação Professor Enc. de Educação 1. Os átomos dos isótopos e do carbono têm (A) números atómicos
Os sais são neutros, ácidos ou básicos? Íons como Ácidos e Bases
 Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
ATIVIDADE DE ÁGUA (Aw) E REAÇÕES DE DETERIORAÇÃO
 ATIVIDADE DE ÁGUA (Aw) E REAÇÕES DE DETERIORAÇÃO Água A molécula de água é triatômica e possui estrutura tetraédrica. Tem baixo peso molecular, pequeno volume e é diamagnética. Apresentaria um ângulo de
ATIVIDADE DE ÁGUA (Aw) E REAÇÕES DE DETERIORAÇÃO Água A molécula de água é triatômica e possui estrutura tetraédrica. Tem baixo peso molecular, pequeno volume e é diamagnética. Apresentaria um ângulo de
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 7º Teste sumativo de FQA 29. abril. 2015 Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas
ESCOLA SECUNDÁRIA DE CASQUILHOS 7º Teste sumativo de FQA 29. abril. 2015 Versão 1 11º Ano Turma A Professor: Maria do Anjo Albuquerque Duração da prova: 90 minutos. Este teste é constituído por 8 páginas
É o cálculo das quantidades de reagentes e/ou produtos das reações químicas.
 Estequiometria Introdução Estequiometria É derivada da palavra grega STOICHEON (elemento) e METRON (medida) significa medida dos elementos químicos", ou ainda medir algo que não pode ser dividido. É o
Estequiometria Introdução Estequiometria É derivada da palavra grega STOICHEON (elemento) e METRON (medida) significa medida dos elementos químicos", ou ainda medir algo que não pode ser dividido. É o
CURSO APOIO QUÍMICA RESOLUÇÃO
 QUÍMICA CURSO APOIO 15. O sulfato de sódio é um composto utilizado na indústria de celulose e na fabricação de detergentes. Por apresentar grande afinidade por água, pode ser encontrado na forma de um
QUÍMICA CURSO APOIO 15. O sulfato de sódio é um composto utilizado na indústria de celulose e na fabricação de detergentes. Por apresentar grande afinidade por água, pode ser encontrado na forma de um
P2 - PROVA DE QUÍMICA GERAL - 08/10/07
 P2 - PRVA DE QUÍMICA GERAL - 08/10/07 Nome: Nº de Matrícula: GABARIT Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 R = 8,314 J mol -1 K -1 = 0,0821 atm L mol
P2 - PRVA DE QUÍMICA GERAL - 08/10/07 Nome: Nº de Matrícula: GABARIT Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 R = 8,314 J mol -1 K -1 = 0,0821 atm L mol
Transportes através da membrana plasmática. Profa Cristina Lacerda Soares Petrarolha Silva FISMA/FCAA - FEA
 Transportes através da membrana plasmática Profa Cristina Lacerda Soares Petrarolha Silva FISMA/FCAA - FEA INTRODUÇÃO A capacidade de uma membrana de ser atravessada por algumas substâncias e não por outras
Transportes através da membrana plasmática Profa Cristina Lacerda Soares Petrarolha Silva FISMA/FCAA - FEA INTRODUÇÃO A capacidade de uma membrana de ser atravessada por algumas substâncias e não por outras
ROTEIRO PRÁTICO DE QUÍMICA GERAL
 ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
A forma geral de uma equação de estado é: p = f ( T,
 Aula: 01 Temática: O Gás Ideal Em nossa primeira aula, estudaremos o estado mais simples da matéria, o gás, que é capaz de encher qualquer recipiente que o contenha. Iniciaremos por uma descrição idealizada
Aula: 01 Temática: O Gás Ideal Em nossa primeira aula, estudaremos o estado mais simples da matéria, o gás, que é capaz de encher qualquer recipiente que o contenha. Iniciaremos por uma descrição idealizada
BIOQUÍMICA E BIOLOGIA MOLECULAR 1º S_2009_2010_1º Teste 16/11/2009
 BIOQUÍMICA E BIOLOGIA MOLECULAR 1º S_2009_2010_1º Teste 16/11/2009 (Duração: 1,5 h) Nome do Aluno: Nº: Curso: Cada uma das questões de escolha múltipla (1 à 32) tem a cotação de 0,6 valores. Será descontado
BIOQUÍMICA E BIOLOGIA MOLECULAR 1º S_2009_2010_1º Teste 16/11/2009 (Duração: 1,5 h) Nome do Aluno: Nº: Curso: Cada uma das questões de escolha múltipla (1 à 32) tem a cotação de 0,6 valores. Será descontado
Aula 6 Propagação de erros
 Aula 6 Propagação de erros Conteúdo da aula: Como estimar incertezas de uma medida indireta Como realizar propagação de erros? Exemplo: medimos A e B e suas incertezas. Com calcular a incerteza de C, se
Aula 6 Propagação de erros Conteúdo da aula: Como estimar incertezas de uma medida indireta Como realizar propagação de erros? Exemplo: medimos A e B e suas incertezas. Com calcular a incerteza de C, se
Série: 2º ano. Assunto: Estequiometria
 Aluno: Série: 2º ano Assunto: Estequiometria 1) A massa de dióxido de carbono liberada na queima de 80 g de metano, quando utilizado como combustível, é: (Dados: massas molares, em g/mol: H = 1, C =12,
Aluno: Série: 2º ano Assunto: Estequiometria 1) A massa de dióxido de carbono liberada na queima de 80 g de metano, quando utilizado como combustível, é: (Dados: massas molares, em g/mol: H = 1, C =12,
Sistema Urinário. 2º ano 2013 Profa. Rose Lopes
 Sistema Urinário 2º ano 2013 Profa. Rose Lopes Considerações iniciais Excretas Produto indesejável do metabolismo celular Excretas nitrogenadas Produtos indesejáveis do metabolismo de proteínas ou ácidos
Sistema Urinário 2º ano 2013 Profa. Rose Lopes Considerações iniciais Excretas Produto indesejável do metabolismo celular Excretas nitrogenadas Produtos indesejáveis do metabolismo de proteínas ou ácidos
Ácidos e Bases. Capítulo 15
 Capítulo 15 Ácidos e Bases Ácidos e Bases de Brønsted Propriedades Ácido-Base da Água ph Uma Medida de Acidez Força de Ácidos e de Bases Ácidos Fracos e Constantes de Ionização Ácida Bases Fracas e Constantes
Capítulo 15 Ácidos e Bases Ácidos e Bases de Brønsted Propriedades Ácido-Base da Água ph Uma Medida de Acidez Força de Ácidos e de Bases Ácidos Fracos e Constantes de Ionização Ácida Bases Fracas e Constantes
Noções de Microeconomia
 Noções de Microeconomia Demanda, Oferta e Equilíbrio de Mercado: A Demanda e a Lei da Demanda; A Curva da Demanda; A Oferta e a Lei da Oferta; A Curva da Oferta; Equilíbrio de Mercado; Elasticidades. Introdução
Noções de Microeconomia Demanda, Oferta e Equilíbrio de Mercado: A Demanda e a Lei da Demanda; A Curva da Demanda; A Oferta e a Lei da Oferta; A Curva da Oferta; Equilíbrio de Mercado; Elasticidades. Introdução
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 4ª AULA PRÁTICA 1. Princípios
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 4ª AULA PRÁTICA 1. Princípios
Boas Práticas Laboratoriais Preparo de soluções
 Boas Práticas Laboratoriais Preparo de soluções Disciplina de Reumatologia 2011 http://www.ruf.rice.edu/~bioslabs/schedules/talks/solutions_dilutions/bioedmixtures.htm O que fazer antes do preparo Vc sabe
Boas Práticas Laboratoriais Preparo de soluções Disciplina de Reumatologia 2011 http://www.ruf.rice.edu/~bioslabs/schedules/talks/solutions_dilutions/bioedmixtures.htm O que fazer antes do preparo Vc sabe
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE
 TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
Análise Titrimétrica ou Volumétrica
 Análise Titrimétrica ou Volumétrica 1 Volumetria ou titrimetria Técnica de determinação quantitativa de um analito baseada em medições de volumes Bureta Solução de concentração conhecida (solução padrão)
Análise Titrimétrica ou Volumétrica 1 Volumetria ou titrimetria Técnica de determinação quantitativa de um analito baseada em medições de volumes Bureta Solução de concentração conhecida (solução padrão)
Final. Prova Teórica. Questão a) b) c) d) e) f) g) h) Classificação teórica (60%) Classificação prática (40%) Classificação final
 3-maio-2014 Final Prova Teórica Nome:.... Escola:....... Questão a) b) c) d) e) f) g) h) Cotação 5 7,5 7,5 5 10 8 8 9 Cotação Classificação teórica (60%) Classificação prática (40%) Classificação final
3-maio-2014 Final Prova Teórica Nome:.... Escola:....... Questão a) b) c) d) e) f) g) h) Cotação 5 7,5 7,5 5 10 8 8 9 Cotação Classificação teórica (60%) Classificação prática (40%) Classificação final
Práticas de. Química Geral e Orgânica. para Engenharia Ambiental
 Apostila de Aulas Práticas de Prof. Alonso Goes Guimarães Práticas de Química Geral e Orgânica para Engenharia Ambiental Apostila de Aulas Práticas de INTRODUÇÂO A química é uma ciência experimental e
Apostila de Aulas Práticas de Prof. Alonso Goes Guimarães Práticas de Química Geral e Orgânica para Engenharia Ambiental Apostila de Aulas Práticas de INTRODUÇÂO A química é uma ciência experimental e
DETERMINAÇÃO DO PH DE AMOSTRAS DE ÁGUAS SUBTERRÂNEAS DO INSTITUTO FEDERAL CATARINENSE - CÂMPUS CAMBORIÚ. Instituto Federal Catarinense, Camboriú/SC
 DETERMINAÇÃO DO PH DE AMOSTRAS DE ÁGUAS SUBTERRÂNEAS DO INSTITUTO FEDERAL CATARINENSE - CÂMPUS CAMBORIÚ. Gubertt, Leticia 1 ; Silveira, Vitor Terra Munari da 1 ; Teixeira, Ana Cristina Franzoi 1 ; Martendal,
DETERMINAÇÃO DO PH DE AMOSTRAS DE ÁGUAS SUBTERRÂNEAS DO INSTITUTO FEDERAL CATARINENSE - CÂMPUS CAMBORIÚ. Gubertt, Leticia 1 ; Silveira, Vitor Terra Munari da 1 ; Teixeira, Ana Cristina Franzoi 1 ; Martendal,
4ª AULA PRÁTICA DE FÍSICA MÉDICA
 4ª AULA PRÁTICA DE FÍSICA MÉDICA Porque será que não respiramos simplesmente pela pele? I. Resolva as seguintes questões: a) A partir da Lei de Fick para um fluxo de partículas por unidade de área e de
4ª AULA PRÁTICA DE FÍSICA MÉDICA Porque será que não respiramos simplesmente pela pele? I. Resolva as seguintes questões: a) A partir da Lei de Fick para um fluxo de partículas por unidade de área e de
A) 11,7 gramas B) 23,4 gramas C) 58,5 gramas D) 68,4 gramas E) 136,8 gramas
 Questão 1 Sejam dadas as seguintes soluções aquosas: I) 0,2 mol/l de cloreto de potássio (KCl) II) 0,3 mol/l de glicose (C 6 H 12 O 6 ) III) 0,1 mol/l de sacarose (C 12 H 22 O 11 ) IV) 0,2 mol/l de sulfato
Questão 1 Sejam dadas as seguintes soluções aquosas: I) 0,2 mol/l de cloreto de potássio (KCl) II) 0,3 mol/l de glicose (C 6 H 12 O 6 ) III) 0,1 mol/l de sacarose (C 12 H 22 O 11 ) IV) 0,2 mol/l de sulfato
Resolução do Exame de Física e Química A 11.º ano, 2009, 2.ª fase, 14 de Julho de 2009.
 Resolução do Exame de Física e Química A.º ano, 009,.ª fase, 4 de Julho de 009. ivisão de Educação da Sociedade Portuguesa de Física....... [Por exemplo...] A destilação da água do mar é um processo de
Resolução do Exame de Física e Química A.º ano, 009,.ª fase, 4 de Julho de 009. ivisão de Educação da Sociedade Portuguesa de Física....... [Por exemplo...] A destilação da água do mar é um processo de
Química Geral 2005/2006 Eng. Biomédica
 Química Geral 2005/2006 Eng. Biomédica Trabalho 4 Corrosão e protecção catódica Turma 21101-2.º turno Data: 10/06/2006 Número Nome 57269 João Jorge 57290 Nuno Gonçalves 57300 João Portela Objectivos O
Química Geral 2005/2006 Eng. Biomédica Trabalho 4 Corrosão e protecção catódica Turma 21101-2.º turno Data: 10/06/2006 Número Nome 57269 João Jorge 57290 Nuno Gonçalves 57300 João Portela Objectivos O
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente. Trabalho Prático nº 1
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) 1. Introdução Trabalho Prático nº 1 Medição do volume e massa
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) 1. Introdução Trabalho Prático nº 1 Medição do volume e massa
Enzimas e Energia. Bases do metabolismo. Enzimas
 Enzimas e Energia Bases do metabolismo Enzimas 1 Enzimas - Proteínas. - Permitem que as reacções químicas ocorram à temperatura corporal - catalizadoras Enzimas catalizadoras: - Não se modificam na reacção
Enzimas e Energia Bases do metabolismo Enzimas 1 Enzimas - Proteínas. - Permitem que as reacções químicas ocorram à temperatura corporal - catalizadoras Enzimas catalizadoras: - Não se modificam na reacção
Propriedades coligativas: são propriedades que dependem da concentração de partículas (solutos) dissolvidas, mas não da natureza dessas partículas.
 Química Geral Aula 2 Marcelo Propriedades coligativas: são propriedades que dependem da concentração de partículas (solutos) dissolvidas, mas não da natureza dessas partículas. Em 50 C a água pura estará
Química Geral Aula 2 Marcelo Propriedades coligativas: são propriedades que dependem da concentração de partículas (solutos) dissolvidas, mas não da natureza dessas partículas. Em 50 C a água pura estará
P4 - PROVA DE QUÍMICA GERAL - 29/06/06
 P4 - PROVA DE QUÍMICA GERAL - 9/06/06 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 a,5 4 a,5 Total 10,0 Constantes e equações: R 0,08 atm L -1 K -1 8,14 J -1
P4 - PROVA DE QUÍMICA GERAL - 9/06/06 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 a,5 4 a,5 Total 10,0 Constantes e equações: R 0,08 atm L -1 K -1 8,14 J -1
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química - II sem/2013 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química - II sem/2013 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Factores que condicionam a actividade enzimática. Existem diversos factores que condicionam a actividade enzimática entre os quais destacamos:
 Factores que influenciam a actividade enzimática Actividade Experimental realizada no dia 30/04/2007 1 Índice Introdução teórica 3 Materiais utilizados 5 Objectivo 5 Procedimento 6 Registos 8 Discussão
Factores que influenciam a actividade enzimática Actividade Experimental realizada no dia 30/04/2007 1 Índice Introdução teórica 3 Materiais utilizados 5 Objectivo 5 Procedimento 6 Registos 8 Discussão
Aprender a utilizar um medidor de ph e indicadores para medir o ph de uma solução.
 EXPERIMENTO 3 Ácidos e Bases OBJETIVOS Determinar a constante de dissociação do ácido acético através de medidas de ph de uma solução contendo uma concentração conhecida de ácido acético e de acetato de
EXPERIMENTO 3 Ácidos e Bases OBJETIVOS Determinar a constante de dissociação do ácido acético através de medidas de ph de uma solução contendo uma concentração conhecida de ácido acético e de acetato de
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 ESTUDO DA SOLUBILIDADE DE ALGUNS SAIS EM ÁGUA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
ESTUDO DA SOLUBILIDADE DE ALGUNS SAIS EM ÁGUA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
UNIVERSIDADE DE CUIABÁ QUIMICA GERAL DOCENTE: ADRIANO LUIZ SANTANA AULAS PRÁTICAS DE QUÍMICA GERAL. Discente:
 UNIVERSIDADE DE CUIABÁ QUIMICA GERAL DOCENTE: ADRIANO LUIZ SANTANA AULAS PRÁTICAS DE QUÍMICA GERAL Discente: AULA PRÁTICA N º VI ASSUNTO: REAÇÕES QUIMICAS OBJETIVOS: Observar as reações químicas em soluções
UNIVERSIDADE DE CUIABÁ QUIMICA GERAL DOCENTE: ADRIANO LUIZ SANTANA AULAS PRÁTICAS DE QUÍMICA GERAL Discente: AULA PRÁTICA N º VI ASSUNTO: REAÇÕES QUIMICAS OBJETIVOS: Observar as reações químicas em soluções
Lista de Exercícios Química Geral Entropia e energia livre
 Lista de Exercícios Química Geral Entropia e energia livre 1. Se a reação A + B C tiver uma constante de equilíbrio maior do que 1, qual das seguintes indicações está correta? a) A reação não é espontânea.
Lista de Exercícios Química Geral Entropia e energia livre 1. Se a reação A + B C tiver uma constante de equilíbrio maior do que 1, qual das seguintes indicações está correta? a) A reação não é espontânea.
Engenharia Biomédica ELECTRÓNICA UNIVERSIDADE DO MINHO ESCOLA DE ENGENHARIA. Ficha Técnica do trabalho prático: Aparelhos de Medida
 DEI 1/15 DEI 2/15 DEI 3/15 DEI 4/15 DEI 5/15 DEI 6/15 Elementos Constituintes Breve Descrição: DEI 7/15 6. PONTAS DE PROVA DO OSCILOSCÓPIO As pontas de prova do osciloscópio têm num extremo um conector
DEI 1/15 DEI 2/15 DEI 3/15 DEI 4/15 DEI 5/15 DEI 6/15 Elementos Constituintes Breve Descrição: DEI 7/15 6. PONTAS DE PROVA DO OSCILOSCÓPIO As pontas de prova do osciloscópio têm num extremo um conector
EQUILÍBRIO QUÍMICO: é o estado de um sistema reacional no qual não ocorrem variações na composição do mesmo ao longo do tempo.
 IV INTRODUÇÃO AO EQUILÍBRIO QUÍMICO IV.1 Definição EQUILÍBRIO QUÍMICO: é o estado de um sistema reacional no qual não ocorrem variações na composição do mesmo ao longo do tempo. Equilíbrio químico equilíbrio
IV INTRODUÇÃO AO EQUILÍBRIO QUÍMICO IV.1 Definição EQUILÍBRIO QUÍMICO: é o estado de um sistema reacional no qual não ocorrem variações na composição do mesmo ao longo do tempo. Equilíbrio químico equilíbrio
P1 - PROVA DE QUÍMICA GERAL 17/04/10
 P1 - PROVA DE QUÍMICA GERAL 17/04/10 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15
P1 - PROVA DE QUÍMICA GERAL 17/04/10 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
Volumetria Ácido-base
 Volumetria Ácido-base H O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Volumetria Ácido-base H O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Membranas Biológicas. Profª Eleonora Slide de aula
 Membranas Biológicas Profª Eleonora Slide de aula Membranas Biológicas Todas as células possuem na sua periferia uma membrana, a qual fornece a barreira necessária que separa o lado interno do lado externo.
Membranas Biológicas Profª Eleonora Slide de aula Membranas Biológicas Todas as células possuem na sua periferia uma membrana, a qual fornece a barreira necessária que separa o lado interno do lado externo.
Experiência Global Água, Uma Solução Química
 Experiência Global Água, Uma Solução Química Actividade O ph das águas do Planeta Este documento contém uma descrição da Actividade O ph das Águas do Planeta que faz parte da Experiência Global do Ano
Experiência Global Água, Uma Solução Química Actividade O ph das águas do Planeta Este documento contém uma descrição da Actividade O ph das Águas do Planeta que faz parte da Experiência Global do Ano
BALANÇO ENERGÉTICO NUM SISTEMA TERMODINÂMICO
 BALANÇO ENERGÉTICO NUM SISTEMA TERMODINÂMICO O que se pretende Determinar experimentalmente qual dos seguintes processos é o mais eficaz para arrefecer água à temperatura ambiente: Processo A com água
BALANÇO ENERGÉTICO NUM SISTEMA TERMODINÂMICO O que se pretende Determinar experimentalmente qual dos seguintes processos é o mais eficaz para arrefecer água à temperatura ambiente: Processo A com água
Aula V 2013 Biologia Cursinho Ação Direta. Respiração:
 Aula V 2013 Biologia Cursinho Ação Direta Respiração: O processo de respiração tem como objetivo básico tornar possível extrair a energia química presente nos alimentos e utilizá-las nas diversas atividades
Aula V 2013 Biologia Cursinho Ação Direta Respiração: O processo de respiração tem como objetivo básico tornar possível extrair a energia química presente nos alimentos e utilizá-las nas diversas atividades
ph do sangue arterial = 7.4
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
