DETERMINAÇÃO DA FÓRMULA DE UM SAL HIDRATADO
|
|
|
- Tiago da Fonseca Vieira
- 9 Há anos
- Visualizações:
Transcrição
1 Escola Secundária do Padre António Martins Oliveira de Laoa Técnicas Laboratoriais de Quíica DETERMINAÇÃO DA FÓRMULA DE UM SAL HIDRATADO Pedro Pinto Nº 14 11ºA 11/1/003
2 Objectivo do Trabalho O objectivo da experiência é a deterinação epírica da fórula quíica de u sal hidratado (cloreto de cobre (II) hidratado) e o respectivo rendiento. Fundaentos teóricos U coposto hidratado é todo aquele que, na sua constituição, se encontra presentes oléculas de áua. Os hidratos ais conhecidos são os sólidos cristalinos que perde parte das suas estruturas fundaentais ao e reover a áua. Contudo, são feitas excepções aos zeólitos, silicatos de aluínio ou os seus análoos sintéticos que contê áua e proporções individuais; os zeólitos perde ou anha áua reversivelente co ua pequena ou eso nenhua alteração na sua estrutura. Entre os exeplos de hidratos encontra-se: o sal de Glauber (sulfato de sódio decaidratado; Na SO 4.10H O), soluções para lipeza coo o carbonato de sódio decaidratado (Na CO 3.10H O), o boráx (tetraborato de sódio decaidratado; Na B 4 O 7.10H O) e tabé o azul de vitríolo (sulfato de cobre pentaidratado; CuSO 4.5H O). U núero de ases, entre os quais os ases nobres e os hidrocarbonetos siples, fora hidratos cristalinos, denoinados clathrate copounds, a teperatura e a pressões relativaente baixas. Os cristais clathrate tê ua estrutura, na qual as oléculas de áua fora coo que u esqueleto e torno da olécula de ás. Quando se fora sais, a aior parte das vezes, o sal cristalizado fica cobinado co oléculas de áua, a que se dá o noe de áua de cristalização. Quando ua substância hidratada se coloca nu vaso fechado isento de vapor de áua, decopõe-se, oriinando a respectiva substância anidra e áua, até que a pressão de vapor de áua atinja u deterinado valor, que é característico de cada substância, para a teperatura da experiência tensão de vapor da substância. As diferenças nos valores da tensão de vapor do líquido explica o diferente coportaento que as substâncias apresenta quando "conservadas" ao ar. Se o valor da tensão de vapor da substância for aior do que a pressão parcial de vapor de áua no ar, as substâncias perde áua de hidratação (refloresce). É o caso do Na SO 4.10H 0 e do Na CO 3.10H O. O carbonato de sódio anidro é hidroscópico.
3 Se a tensão de vapor de líquido da substância tiver u valor inferior à pressão parcial do vapor de áua no ar, a substância absorve vapor de áua do ar. É o caso do CaCl.H O, que se transfora e CaCl.6H O. Por esta razão, o cloreto de cálcio hidratado é usado coo exsicante para secar certos ases. Os cristais hidratados decopõe-se a quente co libertação de áua. Baseado nesta propriedade, é possível calcular o teor de áua de cristalização nestes copostos. Não se deve confundir áua de cristalização co áua hiroscópica. Esta últia é absorvida à superfície do sólido, não podendo ser indicada nua fórula quíica. Eliina-se quando a substância se encontra nu local seco, sendo função da teperatura e da huidade do ar. O eso sal anidro pode cristalizar co diferente núero de oléculas de áua de cristalização, dependendo das condições e que esta se dá. Para deterinar a assa olar dos sais hidratados há que ter e conta que as oléculas de áua faze parte interante da sua coposição. Sais, coo por exeplo, NiCl, CuSO 4 e CaCl, pode constituir areados que contê, na sua estrutura, alé de iões, oléculas de áua, dize-se, por isso, sais hidratados. O "ponto" situado nas fórulas, por exeplo NiCl.6H 0, indica que 6 oles de oléculas de áua estão associadas a cada ole de NiCl, sendo a assa deste areado Esta experiência teve coo u dos objectivos a deterinação da assa de áua existente nu sal hidratado (cloreto de cobre hidratado), sendo a forula quíica do cobre hidratado inicial CuCl.H O, assi oles de oléculas de áua estão associadas a cada ole de CuCl. Material - Balança de precisão - Cápsula de porcelana - Espátula - Exsicador Reaentes / Produtos - CuCl.H O 3
4 Procediento 1. Pesou-se ua cápsula de porcelana, previaente seca e estufa.. Pesou-se, na cápsula, 5 de cloreto de cobre (II) hidratado e reistou-se o valor obtido da assa. 3. Colocou-se durante horas na estufa, a ºC; observou-se os cristais forados e deixou-se arrefecer nu exsicador (durante ua seana). 4. Pesou-se novaente o conjunto cápsula + sal e calculou-se a assa de áua eliinada. 5. Procedeu-se aos cálculos adequados à deterinação da fórula epírica do sal. Observação O CuCl é u cristal branco e encontra-se no estado sólido à teperatura abiente. Aqueceu-se e colocou-se no exsicador o cloreto de cobre hidratado, de fora a separar a áua existente, transforando-se assi e cloreto de cobre desidratado. E seuida pesou-se de fora a se deterinar a percentae de áua existente no cloreto de cobre hidratado, de fora a deterinar a fórula epírica do sal. Para realizar a decoposição do cloreto de cobre hidratado, é necessário ter e conta as condições e que tal é feito, pois estas afecta sinificativaente o rendiento final. O rendiento é calculado pela razão entre quantidade de produto obtida experientalente e a quantidade obtida teoricaente. Portanto, o valor do rendiento nunca poderá exceder os 100%, pois coo é óbvio, a quantidade de produto obtida nunca é superior à que deveríaos obter. Este facto deve-se à possível ocorrência de reacções paralelas, á atosfera de trabalho e até eso a á condição do aterial, tabé ao efectuar-se as pesaens, aqueciento e arrefeciento, existe perdas, para alé disso o cloreto de cobre não era puro, e já se encontrava parcialente desidratado, pois e caso contrário obter ia-se ais áua. 4
5 Reisto de Medições sal hidratado capsula = 5,00 = 191,05 capsula+ sal desidratado = 195,90 Cálculos Deterinação da assa de sal desidratado (cloreto de cobre (II) hidratado) e a assa da áua existente no sal hidratado: sal hidratado capsula = 5,00 = 191,05 capsula+ sal desidratado = 195,90 capsula+ sal desidratado capsula = sal desidratado 195,90 191,05 = 4, 85 hidratado sal desidratado = áua 5,00 4,85 = 0, 05 Deterinou-se que o sal desidratado é 4,85 e que a áua existente no sal hidratado era de 0,05. Deterinação epírica da fórula quíica do sal hidratado (cloreto de cobre (II) hidratado): CuCl. H O( s) CuCl ( s) + H O( ) 5,00 4,85 0,05 M ( CuCl ) = 63, ,45 = 134,45 / ol M ( H O) = 1, ,00 = 18,0 / ol 5
6 áua 0,15 n( H O) = n( H O) = n( H O) = 0,0083 ol M ( H O) 18,0 sal desidratado 4,85 n( CuCl ) = n( CuCl ) = n( CuCl ) M ( CuCl ) 134,45 = 0,0361 ol Atendendo à estequioetria do sal hidratado pode dizer-se que: n( H O) x = n( CuCl ) 1 0,0083 0,0361 x = x = 0,3 1 ol A fórula quíica do coposto será 3 CuCl. H O 100 Deterinação do rendiento da reacção: qt. real 0,3 η = 100 η = 100 η = 1 qt. prevista % Deterinou-se que o rendiento da reacção foi 1%. Conclusões Conclui-se que da decoposição do cloreto de chubo hidratado (CuCl.H O), obté-se dois copostos, o cloreto de chubo (CuCl ) e áua (H O), sendo o CuCl sólido e branco enquanto que o H O é asoso e incolor. Conclui-se que o CuCl é u cristal de cor branca, assi coo a utilização da estufa para aquecer o cloreto de chubo hidratado, peritiu a separação da áua existente assi, e que o exsicador te coo objectivo secar o coposto final. Conclui-se que o rendiento obtido foi uito baixo, sendo apenas 1%, este facto deve-se, principalente, às perdas durante o transporte do sal, assi coo a sua pureza, outra causa é que o sal já se encontrava parcialente desidratado antes de se efectuar esta experiência. Bibliorafia 6
7 SIMÕES, Teresa; QUEIRÓS, Maria; SOMÕES, Maria Técnicas Laboratoriais de Quíica Bloco I, Porto, 1.ª ed., Porto Editora, 000. SIMÕES, Teresa; QUEIRÓS, Maria; SOMÕES, Maria Técnicas Laboratoriais de Quíica Bloco II, Porto, 1.ª ed., Porto Editora, 001. ROSENBERG, Jeroel; EPSTEIN, Lawrence Quíica Geral, Portual, 1.ª ed., McGraw-Hill,
SÍNTESE CLORETO DE CHUMBO
 Escola Secundária do Padre António Martins Oliveira de Laoa Técnicas Laboratoriais de Quíica SÍNTESE DO CLORETO DE CHUMBO Pedro Pinto Nº 14 11ºA 06/10/00 Objectivo do Trabalho O objectivo da experiência
Escola Secundária do Padre António Martins Oliveira de Laoa Técnicas Laboratoriais de Quíica SÍNTESE DO CLORETO DE CHUMBO Pedro Pinto Nº 14 11ºA 06/10/00 Objectivo do Trabalho O objectivo da experiência
ANÁLISE QUÍMICA QUALITATIVA
 Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química ANÁLISE QUÍMICA QUALITATIVA Pedro Pinto Nº 14 11ºA 22/04/2004 Índice Objectivo do Trabalho... 2 Fundamentos
Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química ANÁLISE QUÍMICA QUALITATIVA Pedro Pinto Nº 14 11ºA 22/04/2004 Índice Objectivo do Trabalho... 2 Fundamentos
Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
 ESTUDO DA SOLUBILIDADE DE ALGUNS SAIS EM ÁGUA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
ESTUDO DA SOLUBILIDADE DE ALGUNS SAIS EM ÁGUA INTRODUÇÃO Para compreender o conceito de reacção de precipitação é necessário considerar as noções básicas de dissolução e de solubilidade de sais em água.
CALORIMETRIA. Relatório de Física Experimental III 2004/2005. Engenharia Física Tecnológica
 Relatório de Física Experiental III 4/5 Engenharia Física ecnológica ALORIMERIA rabalho realizado por: Ricardo Figueira, nº53755; André unha, nº53757 iago Marques, nº53775 Grupo ; 3ªfeira 6-h Lisboa, 6
Relatório de Física Experiental III 4/5 Engenharia Física ecnológica ALORIMERIA rabalho realizado por: Ricardo Figueira, nº53755; André unha, nº53757 iago Marques, nº53775 Grupo ; 3ªfeira 6-h Lisboa, 6
Integração Numérica. Cálculo Numérico
 Cálculo Nuérico Integração Nuérica Pro. Jorge Cavalcanti [email protected] MATERIAL ADAPTADO DOS SLIDES DA DISCIPLINA CÁLCULO NUMÉRICO DA UFCG - www.dsc.ucg.edu.br/~cnu/ Integração Nuérica
Cálculo Nuérico Integração Nuérica Pro. Jorge Cavalcanti [email protected] MATERIAL ADAPTADO DOS SLIDES DA DISCIPLINA CÁLCULO NUMÉRICO DA UFCG - www.dsc.ucg.edu.br/~cnu/ Integração Nuérica
SÍNTESE DO SULFATO DE TETRAMINOCOBRE MONOIDRATADO
 Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química SÍNTESE DO SULFATO DE TETRAMINOCOBRE MONOIDRATADO Pedro Pinto Nº 1 11ºA 15/01/00 Índice Objectivo do Trabalho...
Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química SÍNTESE DO SULFATO DE TETRAMINOCOBRE MONOIDRATADO Pedro Pinto Nº 1 11ºA 15/01/00 Índice Objectivo do Trabalho...
DETERMINAÇÃO DA MASSA VOLÚMICA DE UM SÓLIDO
 Escola Básica dos 2º e 3º Ciclos de Santo António Ciências Físico-Químicas 2009/2010 DETERMINAÇÃO DA MASSA VOLÚMICA DE UM SÓLIDO Trabalho realizado por: Ano: Nº T: Índice Introdução 3 Objectivos.4 Material/
Escola Básica dos 2º e 3º Ciclos de Santo António Ciências Físico-Químicas 2009/2010 DETERMINAÇÃO DA MASSA VOLÚMICA DE UM SÓLIDO Trabalho realizado por: Ano: Nº T: Índice Introdução 3 Objectivos.4 Material/
CARACTERÍSTICAS DOS AMILOPLASTOS
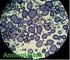 Escola Secundária Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Biologia CARACTERÍSTICAS DOS AMILOPLASTOS Pedro Pinto Nº 20 10ºA 16/01/2003 Introdução Esta actividade serviu para estudar
Escola Secundária Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Biologia CARACTERÍSTICAS DOS AMILOPLASTOS Pedro Pinto Nº 20 10ºA 16/01/2003 Introdução Esta actividade serviu para estudar
Curso Profissional de Técnico de Energias Renováveis 1º ano. Módulo Q 2 Soluções.
 Curso Profissional de Técnico de Energias Renováveis 1º ano Docuento de apoio Módulo Q 2 Soluções. 1. Dispersões 1.1. Disperso e dispersante Dispersão Ua dispersão é ua istura de duas ou ais substâncias,
Curso Profissional de Técnico de Energias Renováveis 1º ano Docuento de apoio Módulo Q 2 Soluções. 1. Dispersões 1.1. Disperso e dispersante Dispersão Ua dispersão é ua istura de duas ou ais substâncias,
Gases Reais. A distância média que uma molécula percorre entre duas colisões sucessivas é chamada de livre percurso médio (λ).
 Gases Reais. Colisões Moleculares A distância édia que ua olécula percorre entre duas colisões sucessivas é chaada de livre percurso édio (λ). Coo nu líquido ua olécula encontra ua olécula vizinha eso
Gases Reais. Colisões Moleculares A distância édia que ua olécula percorre entre duas colisões sucessivas é chaada de livre percurso édio (λ). Coo nu líquido ua olécula encontra ua olécula vizinha eso
Purificação por dissolução ou recristalização
 Purificação por dissolução ou recristalização Química 12º Ano Unidade 3 Vidros, plásticos e novos materiais Actividades de Projecto Laboratorial Março 2006 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
Purificação por dissolução ou recristalização Química 12º Ano Unidade 3 Vidros, plásticos e novos materiais Actividades de Projecto Laboratorial Março 2006 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
A.L. 1.2 SÍNTESE DO SULFATO DE TETRAMINOCOBRE (II) MONO-HIDRATADO
 A.L. 1.2 SÍNTESE DO SULFATO DE TETRAMINOCOBRE (II) MONO-HIDRATADO QUÍMICA 11.ºANO QUESTÃO-PROBLEMA O que se pode fazer com amoníaco? O amoníaco é uma substância utilizada mundialmente em larga escala para
A.L. 1.2 SÍNTESE DO SULFATO DE TETRAMINOCOBRE (II) MONO-HIDRATADO QUÍMICA 11.ºANO QUESTÃO-PROBLEMA O que se pode fazer com amoníaco? O amoníaco é uma substância utilizada mundialmente em larga escala para
Nome : n o Classe: 2 1MA. Estequiometria
 Ensino Médio QUÍMICA Data: / /2012 Atividade : Exercícios de Recuperação Paralela e Anual aula 4 Noe : n o Classe: 2 1MA Estequioetria 1. (Espcex (Aan)) O etino, tabé conhecido coo acetileno, é u alcino
Ensino Médio QUÍMICA Data: / /2012 Atividade : Exercícios de Recuperação Paralela e Anual aula 4 Noe : n o Classe: 2 1MA Estequioetria 1. (Espcex (Aan)) O etino, tabé conhecido coo acetileno, é u alcino
A soma de dois números pares, obtém um resultado que também é par. Sendo, p=2q e r=2n, temos p+r = 2q+2n = 2(q+n) = 2k.
 Teoria dos Núeros Resuo do que foi estudado nas aulas de Teoria dos Núeros, inistradas pelo Prof. Dr. Antonio Sales. Acadêica: Sabrina Aori Araujo 20939 Núeros pares e ípares Coo saber se u núero é par
Teoria dos Núeros Resuo do que foi estudado nas aulas de Teoria dos Núeros, inistradas pelo Prof. Dr. Antonio Sales. Acadêica: Sabrina Aori Araujo 20939 Núeros pares e ípares Coo saber se u núero é par
Capítulo 3-2. A 3ª Lei da Termodinâmica
 Caítulo 3-2. A 3ª Lei da erodinâica Baseado no livro: Atkins Physical Cheistry Eighth Edition Peter Atkins Julio de Paula 29-4-27 Maria da Conceição Paiva 1 A terceira Lei da erodinâica A entroia de ua
Caítulo 3-2. A 3ª Lei da erodinâica Baseado no livro: Atkins Physical Cheistry Eighth Edition Peter Atkins Julio de Paula 29-4-27 Maria da Conceição Paiva 1 A terceira Lei da erodinâica A entroia de ua
Escola Secundária de Casquilhos Teste 1 de Física e Química A 10º ANO 22/10/2013 90 minutos
 Escola Secundária de Casquilhos Teste 1 de Física e Química A 10º ANO 22/10/2013 90 minutos NOME Nº Turma Informação Professor Enc. de Educação 1. Os átomos dos isótopos e do carbono têm (A) números atómicos
Escola Secundária de Casquilhos Teste 1 de Física e Química A 10º ANO 22/10/2013 90 minutos NOME Nº Turma Informação Professor Enc. de Educação 1. Os átomos dos isótopos e do carbono têm (A) números atómicos
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente. Trabalho Prático nº 1
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) 1. Introdução Trabalho Prático nº 1 Medição do volume e massa
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) 1. Introdução Trabalho Prático nº 1 Medição do volume e massa
Reacções de precipitação
 Reacções de precipitação Ocorre uma reacção de precipitação quando se forma uma precipitado, ou seja, um sólido insolúvel que se separa da solução. Na precipitação a partir de soluções aquosas normalmente
Reacções de precipitação Ocorre uma reacção de precipitação quando se forma uma precipitado, ou seja, um sólido insolúvel que se separa da solução. Na precipitação a partir de soluções aquosas normalmente
1) Durante a noite a temperatura da Terra não diminui tanto quanto seria de esperar
 Escola ásica e Secundária Gonçalves Zarco Física e Quíica A, º ano Ano lectivo 006 / 00 Ficha de rabalho nº 8 - CORRECÇÃO Noe: n.º aluno: ura: 1) Durante a noite a teperatura da erra não diinui tanto quanto
Escola ásica e Secundária Gonçalves Zarco Física e Quíica A, º ano Ano lectivo 006 / 00 Ficha de rabalho nº 8 - CORRECÇÃO Noe: n.º aluno: ura: 1) Durante a noite a teperatura da erra não diinui tanto quanto
Desafio em Química 2010
 Desafio e Quíica 2010 Noe: Assinatura: Questão Valor Grau 1 a 16 2 a 16 3 a 16 4 a 16 5 a 16 Total 80 Forulário: PV = nrt P i = P T x i P i = P i 0 x i U = q + w G = H T S G = RTlnK ln(k 2 /K 1 ) = ( H
Desafio e Quíica 2010 Noe: Assinatura: Questão Valor Grau 1 a 16 2 a 16 3 a 16 4 a 16 5 a 16 Total 80 Forulário: PV = nrt P i = P T x i P i = P i 0 x i U = q + w G = H T S G = RTlnK ln(k 2 /K 1 ) = ( H
Microeconomia Tópicos para Discussão
 Microeconoia Tópicos para iscussão Elasticidades da eanda Elasticidades Elasticidades da Oferta PINYCK, R. e RUBINFEL,. Microeconoia. São Paulo: Prentice Hall. 2008. Capítulo 2: Os fundaentos da oferta
Microeconoia Tópicos para iscussão Elasticidades da eanda Elasticidades Elasticidades da Oferta PINYCK, R. e RUBINFEL,. Microeconoia. São Paulo: Prentice Hall. 2008. Capítulo 2: Os fundaentos da oferta
A.L.1.3 EFEITOS DA TEMPERATURA E DA CONCENTRAÇÃO NA PROGRESSÃO GLOBAL DE UMA REACÇÃO
 A.L.1.3 EFEITOS DA TEMPERATURA E DA CONCENTRAÇÃO NA PROGRESSÃO GLOBAL DE UMA REACÇÃO QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como pode evoluir um sistema em equilíbrio quando se faz variar a temperatura ou a
A.L.1.3 EFEITOS DA TEMPERATURA E DA CONCENTRAÇÃO NA PROGRESSÃO GLOBAL DE UMA REACÇÃO QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como pode evoluir um sistema em equilíbrio quando se faz variar a temperatura ou a
UNISA MEDICINA 2014 UNIVERSIDADE DE SANTO AMARO
 UNISA MEDIINA 2014 UNIVERSIDADE DE SANTO AMARO ONHEIMENTOS GERAIS 50. A vida no planeta Terra está baseada e dois eleentos essenciais. U deles está presente e todos os copostos orgânicos e é versátil,
UNISA MEDIINA 2014 UNIVERSIDADE DE SANTO AMARO ONHEIMENTOS GERAIS 50. A vida no planeta Terra está baseada e dois eleentos essenciais. U deles está presente e todos os copostos orgânicos e é versátil,
Aula 20. Introdução ao cálculo de fluxo de potência em sistemas de energia elétrica
 Aula 20 Introdução ao cálculo de fluxo de potência e sisteas de energia elétrica Cálculo de Fluxo de Potência O cálculo do fluxo de potência (ou de carga) e ua rede de energia consiste na deterinação da
Aula 20 Introdução ao cálculo de fluxo de potência e sisteas de energia elétrica Cálculo de Fluxo de Potência O cálculo do fluxo de potência (ou de carga) e ua rede de energia consiste na deterinação da
SÍNTESE DO SULFATO DE COBRE PENTAIDRATADO
 Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química SÍNTESE DO SULFATO DE COBRE PENTAIDRATADO Pedro Pinto Nº 14 11ºA 27/11/2003 Objectivo do Trabalho O objectivo
Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química SÍNTESE DO SULFATO DE COBRE PENTAIDRATADO Pedro Pinto Nº 14 11ºA 27/11/2003 Objectivo do Trabalho O objectivo
Medição de massa específica com base no método de Arquimedes. Química 12º Ano
 Medição de massa específica com base no método de Arquimedes Parte I: Aplicação a líquidos Química 12º Ano Unidade 3 Plásticos, vidros e novos materiais Actividades de Projecto Laboratorial Janeiro 2006
Medição de massa específica com base no método de Arquimedes Parte I: Aplicação a líquidos Química 12º Ano Unidade 3 Plásticos, vidros e novos materiais Actividades de Projecto Laboratorial Janeiro 2006
FMJ MEDICINA FACULDADE DE MEDICINA DE JUNDIAÍ
 FMJ 2016 - MEDICINA FACULDADE DE MEDICINA DE JUNDIAÍ 09. Considere o esquea de u sistea utilizado para deonstrar a condutividade elétrica de soluções e a tabela que apresenta três soluções aquosas, de
FMJ 2016 - MEDICINA FACULDADE DE MEDICINA DE JUNDIAÍ 09. Considere o esquea de u sistea utilizado para deonstrar a condutividade elétrica de soluções e a tabela que apresenta três soluções aquosas, de
Departamento de Matemática e Ciências Experimentais
 Departaento e ateática e Ciências Experientais Física e Quíica 1.º no tiviae Prático-Laboratorial PL 1.3 (1ª parte) ssunto: Ientificação e ua substância e avaliação a sua pureza Introução Ientificação
Departaento e ateática e Ciências Experientais Física e Quíica 1.º no tiviae Prático-Laboratorial PL 1.3 (1ª parte) ssunto: Ientificação e ua substância e avaliação a sua pureza Introução Ientificação
O Sistema Internacional de Unidades
 O Sistea Internacional de Unidades O Sistea Internacional de Unidades (SI) foi criado e 1960, pela 11ª Conferência Geral de Pesos e Medidas (CGPM) e adoptado, e Portugal, pelo Decreto-Lei n 427/83, de
O Sistea Internacional de Unidades O Sistea Internacional de Unidades (SI) foi criado e 1960, pela 11ª Conferência Geral de Pesos e Medidas (CGPM) e adoptado, e Portugal, pelo Decreto-Lei n 427/83, de
BALANÇO ENERGÉTICO NUM SISTEMA TERMODINÂMICO
 BALANÇO ENERGÉTICO NUM SISTEMA TERMODINÂMICO O que se pretende Determinar experimentalmente qual dos seguintes processos é o mais eficaz para arrefecer água à temperatura ambiente: Processo A com água
BALANÇO ENERGÉTICO NUM SISTEMA TERMODINÂMICO O que se pretende Determinar experimentalmente qual dos seguintes processos é o mais eficaz para arrefecer água à temperatura ambiente: Processo A com água
A.L. 1.3 IDENTIFICAÇÃO DE UMA SUBSTÂNCIA E AVALIAÇÃO DA SUA PUREZA
 A.L. 1.3 IDENTIFICAÇÃO DE UMA SUBSTÂNCIA E AVALIAÇÃO DA SUA PUREZA QUÍMICA 10.ºANO QUESTÃO-PROBLEMA Como identificar materiais no laboratório? Como avaliar o grau de pureza de algumas substâncias? Através
A.L. 1.3 IDENTIFICAÇÃO DE UMA SUBSTÂNCIA E AVALIAÇÃO DA SUA PUREZA QUÍMICA 10.ºANO QUESTÃO-PROBLEMA Como identificar materiais no laboratório? Como avaliar o grau de pureza de algumas substâncias? Através
Unidade 2 Substâncias e átomos
 Unidade 2 Substâncias e átomos Substâncias Puras pág. 51 A matéria é composta por uma ou mais substâncias químicas. Porém, é difícil saber se um corpo é composto por uma única substância ou por uma mistura
Unidade 2 Substâncias e átomos Substâncias Puras pág. 51 A matéria é composta por uma ou mais substâncias químicas. Porém, é difícil saber se um corpo é composto por uma única substância ou por uma mistura
Mecânica dos Solos I
 Mecânica dos Solos I Índices Físicos F dos Solos 3.1 Fases do Solo O solo é formado pelas três fases físicas sólida, liquida e gasosa, distribuídas em diferentes proporções. Fase sólida constituída por
Mecânica dos Solos I Índices Físicos F dos Solos 3.1 Fases do Solo O solo é formado pelas três fases físicas sólida, liquida e gasosa, distribuídas em diferentes proporções. Fase sólida constituída por
Interbits SuperPro Web. Gabarito: Ca(OH) 2HC CaC H O. 200mL 1 mol/l n 0,2 1 0,2mol. Na CO 2HC 2NaC H O CO. 22mL 0,4000M. n ,4000.
 Gabarito: Resposta da questão 1: [E] Ca(OH) 2HC CaC H O ác 2 2 2 200L 1 ol/l n 0,2 1 0,2ol Titulação co excesso: HC NaOH NaC H2O 200L 0,5M n 0,1ol (excesso) n 0,2 0,1ol reagiu Proporção da reação da 1ª
Gabarito: Resposta da questão 1: [E] Ca(OH) 2HC CaC H O ác 2 2 2 200L 1 ol/l n 0,2 1 0,2ol Titulação co excesso: HC NaOH NaC H2O 200L 0,5M n 0,1ol (excesso) n 0,2 0,1ol reagiu Proporção da reação da 1ª
Centro Universitário Anchieta Engenharia Química Físico Química I Prof. Vanderlei I Paula Nome: R.A. Gabarito 4 a lista de exercícios
 Engenharia Quíica Físico Quíica I. O abaixaento da pressão de vapor do solvente e soluções não eletrolíticas pode ser estudadas pela Lei de Raoult: P X P, onde P é a pressão de vapor do solvente na solução,
Engenharia Quíica Físico Quíica I. O abaixaento da pressão de vapor do solvente e soluções não eletrolíticas pode ser estudadas pela Lei de Raoult: P X P, onde P é a pressão de vapor do solvente na solução,
Série 3 Movimento uniformemente variado
 Resoluções Segento: Pré-vestibular Coleção: Alfa, Beta e Gaa. Disciplina: Física Caderno de Exercícios 1 Unidade I Cineática Série 3 Moviento uniforeente variado 1. D Substituindo o valor de t = 4 s, na
Resoluções Segento: Pré-vestibular Coleção: Alfa, Beta e Gaa. Disciplina: Física Caderno de Exercícios 1 Unidade I Cineática Série 3 Moviento uniforeente variado 1. D Substituindo o valor de t = 4 s, na
PROPRIEDADES: Hidróxido de Sódio NaOH.
 Densidade: 2,3 g cm 3 Massa Molar: 40,01 g mol -1. Ponto de Fusão: 318ºC Ponto de Ebulição: 1390ºC PROPRIEDADES: Hidróxido de Sódio NaOH. Toxicidade: Pode causar graves queimaduras na boca, garganta e
Densidade: 2,3 g cm 3 Massa Molar: 40,01 g mol -1. Ponto de Fusão: 318ºC Ponto de Ebulição: 1390ºC PROPRIEDADES: Hidróxido de Sódio NaOH. Toxicidade: Pode causar graves queimaduras na boca, garganta e
É o cálculo das quantidades de reagentes e/ou produtos das reações químicas.
 Estequiometria Introdução Estequiometria É derivada da palavra grega STOICHEON (elemento) e METRON (medida) significa medida dos elementos químicos", ou ainda medir algo que não pode ser dividido. É o
Estequiometria Introdução Estequiometria É derivada da palavra grega STOICHEON (elemento) e METRON (medida) significa medida dos elementos químicos", ou ainda medir algo que não pode ser dividido. É o
Experiência 01: Algarismos significativos, medidas e tratamento de dados. Calibração de equipamentos volumétricos
 Experiência 01: Alarismos sinificativos, medidas e tratamento de dados. Calibração de equipamentos volumétricos 1. Introdução Química é uma ciência teórica-experimental e por isso consideramos importante
Experiência 01: Alarismos sinificativos, medidas e tratamento de dados. Calibração de equipamentos volumétricos 1. Introdução Química é uma ciência teórica-experimental e por isso consideramos importante
REACÇÃO DO SOLO (protocolo fornecido pela FCUP)
 REACÇÃO DO SOLO (protocolo fornecido pela FCUP) Objectivo: medição do ph de amostras de solo em água e em soluções salinas; comparação do valor da reacção do solo em água e em soluções salinas Considerações
REACÇÃO DO SOLO (protocolo fornecido pela FCUP) Objectivo: medição do ph de amostras de solo em água e em soluções salinas; comparação do valor da reacção do solo em água e em soluções salinas Considerações
TERMOQUÍMICA EXERCÍCIOS ESSENCIAIS 1. O CALOR E OS PROCESSOS QUÍMICOS
 TERMOQUÍMICA EXERCÍCIOS ESSENCIAIS 1. O CALOR E OS PROCESSOS QUÍMICOS Termoquímica: Estudo das quantidades de energia, na forma de calor, liberada ou absorvida durante os processos de interesse da Química,
TERMOQUÍMICA EXERCÍCIOS ESSENCIAIS 1. O CALOR E OS PROCESSOS QUÍMICOS Termoquímica: Estudo das quantidades de energia, na forma de calor, liberada ou absorvida durante os processos de interesse da Química,
FFUP Física Aplicada 2013/2014. Física Aplicada. Aulas Laboratoriais. Trabalho laboratorial n.º 1. Adsorção na Interface sólido-líquido
 Físia Apliada Aulas Laboratoriais Trabalho laboratorial n.º Adsorção na Interfae sólido-líquido ESTUDO DA ADSORÇÃO DO ÁCIDO ACÉTICO PELO CARVÃO ACTIVADO. ISOTÉRMICA DE ADSORÇÃO. DETERMINAÇÃO DE UMA ÁREA
Físia Apliada Aulas Laboratoriais Trabalho laboratorial n.º Adsorção na Interfae sólido-líquido ESTUDO DA ADSORÇÃO DO ÁCIDO ACÉTICO PELO CARVÃO ACTIVADO. ISOTÉRMICA DE ADSORÇÃO. DETERMINAÇÃO DE UMA ÁREA
Aos materiais que a Química usa como matéria-prima podemos classificá-los como:
 Sumário Módulo inicial Unidade temática 0 A sua origem, a sua constituição e a sua composição. Classificação de misturas e classificação de substâncias. Processos físicos de separação de misturas. Unidades
Sumário Módulo inicial Unidade temática 0 A sua origem, a sua constituição e a sua composição. Classificação de misturas e classificação de substâncias. Processos físicos de separação de misturas. Unidades
MENSAGENS QUE APARECEM E DESAPARECEM
 MENSAGENS QUE APARECEM E DESAPARECEM O cloreto de cobalto (CoCl 2 ) é um indicador atmosférico e muda de cor consoante aquantidade d de humidade d naatmosfera. Quando o ambiente está húmido apresenta a
MENSAGENS QUE APARECEM E DESAPARECEM O cloreto de cobalto (CoCl 2 ) é um indicador atmosférico e muda de cor consoante aquantidade d de humidade d naatmosfera. Quando o ambiente está húmido apresenta a
1 Seleccionar material adequado à separação dos componentes de uma mistura heterogénea.
 ACTIVIDADE LABORATORIAL Ciências Físico-Químicas 7ºANO VOU SEPARAR OS COMPONENTES DE UMA MISTURA O que se pretende 1 Seleccionar material adequado à separação dos componentes de uma mistura heterogénea.
ACTIVIDADE LABORATORIAL Ciências Físico-Químicas 7ºANO VOU SEPARAR OS COMPONENTES DE UMA MISTURA O que se pretende 1 Seleccionar material adequado à separação dos componentes de uma mistura heterogénea.
FÓRMULAS QUÍMICAS. ESTEQUIOMETRIA Determinação da Fórmula de um Composto
 FÓRMULAS QUÍMICAS. ESTEQUIOMETRIA Determinação da Fórmula de um Composto Fórmula Centesimal é a fórmula que exprime a proporção que cada elemento contribui na molécula. Também chamada de percentagem em
FÓRMULAS QUÍMICAS. ESTEQUIOMETRIA Determinação da Fórmula de um Composto Fórmula Centesimal é a fórmula que exprime a proporção que cada elemento contribui na molécula. Também chamada de percentagem em
GOIÂNIA, / / 2016. PROFESSORA: Núbia de Andrade. DISCIPLINA:Química SÉRIE: 2º. ALUNO(a):
 GOIÂNIA, / / 2016 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 2º ALUNO(a): Lista de Exercícios P1 I Bimestre No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
GOIÂNIA, / / 2016 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 2º ALUNO(a): Lista de Exercícios P1 I Bimestre No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
Escola Básica e Secundária da Calheta. Físico-Química 7.º Ano de escolaridade
 Escola Básica e Secundária da Calheta Físico-Química 7.º Ano de escolaridade Ano letivo 2015/2016 FICHA INFORMATIVA 1 Classificação dos materiais NOME: N.º TURMA DATA DA REALIZAÇÃO: / / CLASSIFICAÇÃO DOS
Escola Básica e Secundária da Calheta Físico-Química 7.º Ano de escolaridade Ano letivo 2015/2016 FICHA INFORMATIVA 1 Classificação dos materiais NOME: N.º TURMA DATA DA REALIZAÇÃO: / / CLASSIFICAÇÃO DOS
Educação para toda a vida
 LIGAÇÕES IÔNICAS E COVALENTES Noções sobre Ligações Químicas Regra do Octeto Ligação Iônica ou Eletrovalente Ligação Covalente ou Molecular Ligação Metálica Teoria do Octeto Todos os elementos buscam formas
LIGAÇÕES IÔNICAS E COVALENTES Noções sobre Ligações Químicas Regra do Octeto Ligação Iônica ou Eletrovalente Ligação Covalente ou Molecular Ligação Metálica Teoria do Octeto Todos os elementos buscam formas
Práticas de. Química Geral e Orgânica. para Engenharia Ambiental
 Apostila de Aulas Práticas de Prof. Alonso Goes Guimarães Práticas de Química Geral e Orgânica para Engenharia Ambiental Apostila de Aulas Práticas de INTRODUÇÂO A química é uma ciência experimental e
Apostila de Aulas Práticas de Prof. Alonso Goes Guimarães Práticas de Química Geral e Orgânica para Engenharia Ambiental Apostila de Aulas Práticas de INTRODUÇÂO A química é uma ciência experimental e
Química 12º Ano. Unidade 2 Combustíveis, Energia e Ambiente. Actividades de Projecto Laboratorial. Janeiro 2006. Jorge R. Frade, Ana Teresa Paiva
 Condutividade térmica e calor específico Química 12º Ano Unidade 2 Combustíveis, Energia e Ambiente Actividades de Projecto Laboratorial Janeiro 2006 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
Condutividade térmica e calor específico Química 12º Ano Unidade 2 Combustíveis, Energia e Ambiente Actividades de Projecto Laboratorial Janeiro 2006 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
c B = 25 g/l m soluto = 200 g V solução = 2,5 L ; V esfera = πr 3 F I C H A N. o 2 T E R R A E M T R A N S F O R M A Ç Ã O
 F I C H A N. o 2 T E R R A E M T R A N S F O R M A Ç Ã O Nome N. o Turma Data / / Prof. Enc. de educação 01. Considera duas soluções aquosas de sulfato de cobre, ambas de cor azul. Solução A m soluto =
F I C H A N. o 2 T E R R A E M T R A N S F O R M A Ç Ã O Nome N. o Turma Data / / Prof. Enc. de educação 01. Considera duas soluções aquosas de sulfato de cobre, ambas de cor azul. Solução A m soluto =
Matemática Básica: Revisão 2014.1 www.damasceno.info Prof.: Luiz Gonzaga Damasceno
 Aula 1. Introdução Hoje e dia teos a educação presencial, sei-presencial e educação a distância. A presencial é a dos cursos regulares, onde professores e alunos se encontra sepre nu local, chaado sala
Aula 1. Introdução Hoje e dia teos a educação presencial, sei-presencial e educação a distância. A presencial é a dos cursos regulares, onde professores e alunos se encontra sepre nu local, chaado sala
Átomos & Moléculas. Definição: é uma porção de matéria que tem propriedades bem definidas e que lhe são característica.
 Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Definição: é uma porção de matéria que tem propriedades bem definidas e que lhe são característica. SUBSTÂNCIA (Material Puro): material formado
Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Definição: é uma porção de matéria que tem propriedades bem definidas e que lhe são característica. SUBSTÂNCIA (Material Puro): material formado
COMPANHIA ENERGÉTICA DE MINAS GERAIS
 COMPANHIA ENERGÉTICA DE MINAS GERAIS ATO REGULATÓRIO: Consulta Pública CP nº 004/2014 AGÊNCIA NACIONAL DE ENERGIA ELÉTRICA ANEEL EMENTA: Obter subsídios com vistas ao aprimoramento do novo procedimento
COMPANHIA ENERGÉTICA DE MINAS GERAIS ATO REGULATÓRIO: Consulta Pública CP nº 004/2014 AGÊNCIA NACIONAL DE ENERGIA ELÉTRICA ANEEL EMENTA: Obter subsídios com vistas ao aprimoramento do novo procedimento
a = q b + r, com0 r b 1.
 Mateática e Estatística Lic. Adinistração Pública Departaento de Mateática da Universidade de Coibra Ano lectivo 2006/200 1 Teoria dos Núeros O resultado da divisão de dois núeros inteiros, dividendo e
Mateática e Estatística Lic. Adinistração Pública Departaento de Mateática da Universidade de Coibra Ano lectivo 2006/200 1 Teoria dos Núeros O resultado da divisão de dois núeros inteiros, dividendo e
ESCOLA SECUNDÁRIA ABADE DE BAÇAL BRAGANÇA TÉCNICAS LABORATORIAIS DE QUÍMICA 11º Ano Ano lectivo 2003/2004. TIPS - Indicadores ácido-base
 ESCOLA SECUNDÁRIA ABADE DE BAÇAL BRAGANÇA TÉCNICAS LABORATORIAIS DE QUÍMICA 11º Ano Ano lectivo 2003/2004 TIPS - Indicadores ácido-base 1 TIPS - INDICADORES ÁCIDO-BASE Nome do aluno Caro parceiro da minha
ESCOLA SECUNDÁRIA ABADE DE BAÇAL BRAGANÇA TÉCNICAS LABORATORIAIS DE QUÍMICA 11º Ano Ano lectivo 2003/2004 TIPS - Indicadores ácido-base 1 TIPS - INDICADORES ÁCIDO-BASE Nome do aluno Caro parceiro da minha
P1 - PROVA DE QUÍMICA GERAL 03/09/07
 1 - ROVA DE QUÍMICA GERAL 03/09/07 Nome: Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) = T ( C) + 273,15
1 - ROVA DE QUÍMICA GERAL 03/09/07 Nome: Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) = T ( C) + 273,15
1 2 3 4 5 6 Total. Nota: Apresente todos os cálculos que efectuar
 12 de Março 2011 (Semifinal) Pergunta 1 2 3 4 5 6 Total Classificação Escola:. Nome:. Nome:. Nome:. Nota: Apresente todos os cálculos que efectuar Dados: Questão 1 Constante de Avogadro: N A = 6,022 x
12 de Março 2011 (Semifinal) Pergunta 1 2 3 4 5 6 Total Classificação Escola:. Nome:. Nome:. Nome:. Nota: Apresente todos os cálculos que efectuar Dados: Questão 1 Constante de Avogadro: N A = 6,022 x
TABELA PERIÓDICA DOS ELEMENTOS
 gabinete de avaliação educacional PROVA DE EXAME FINAL DE ÂMBITO NACIONAL DE FÍSICA E QUÍMICA A 006 11.º Ano de Escolaridade 007 11.º ou 1.º Ano de Escolaridade (Decreto-Lei n.º 74/004, de 6 de Março)
gabinete de avaliação educacional PROVA DE EXAME FINAL DE ÂMBITO NACIONAL DE FÍSICA E QUÍMICA A 006 11.º Ano de Escolaridade 007 11.º ou 1.º Ano de Escolaridade (Decreto-Lei n.º 74/004, de 6 de Março)
A) 11,7 gramas B) 23,4 gramas C) 58,5 gramas D) 68,4 gramas E) 136,8 gramas
 Questão 1 Sejam dadas as seguintes soluções aquosas: I) 0,2 mol/l de cloreto de potássio (KCl) II) 0,3 mol/l de glicose (C 6 H 12 O 6 ) III) 0,1 mol/l de sacarose (C 12 H 22 O 11 ) IV) 0,2 mol/l de sulfato
Questão 1 Sejam dadas as seguintes soluções aquosas: I) 0,2 mol/l de cloreto de potássio (KCl) II) 0,3 mol/l de glicose (C 6 H 12 O 6 ) III) 0,1 mol/l de sacarose (C 12 H 22 O 11 ) IV) 0,2 mol/l de sulfato
EXPERIMENTO 1 MEDIDAS E TRATAMENTO DE DADOS
 EXPERIMENTO 1 MEDIDAS E TRATAMENTO DE DADOS 1. OBJETIVOS No final deste experimento o aluno deverá ser capaz de: Ler e usar corretamente termômetros, balanças, provetas e pipetas. Utilizar algarismos significativos.
EXPERIMENTO 1 MEDIDAS E TRATAMENTO DE DADOS 1. OBJETIVOS No final deste experimento o aluno deverá ser capaz de: Ler e usar corretamente termômetros, balanças, provetas e pipetas. Utilizar algarismos significativos.
7 COMPORTAMENTO DOS GASES, VAPORES E MISTURAS NÃO IDEAIS
 7 COMPORTAMENTO DOS GASES, VAPORES E MISTURAS NÃO IDEAIS 7.1 PROPRIEDADE Qualquer característica mensurável de uma substância ou mistura, tal como pressão, volume, temperatura, ou característica que possa
7 COMPORTAMENTO DOS GASES, VAPORES E MISTURAS NÃO IDEAIS 7.1 PROPRIEDADE Qualquer característica mensurável de uma substância ou mistura, tal como pressão, volume, temperatura, ou característica que possa
A.L. 0.1 RENDIMENTO NO AQUECIMENTO
 A.L. 0.1 RENDIMENTO NO AQUECIMENTO FÍSICA 10.ºANO QUESTÃO-PROBLEMA Como poderemos aumentar o rendimento no aquecimento, quando cozinhamos? Esta actividade laboratorial está integrada no módulo inicial
A.L. 0.1 RENDIMENTO NO AQUECIMENTO FÍSICA 10.ºANO QUESTÃO-PROBLEMA Como poderemos aumentar o rendimento no aquecimento, quando cozinhamos? Esta actividade laboratorial está integrada no módulo inicial
Produção de açúcar mascavo
 Instituto Politécnico de Coimbra Escola Superior Agrária de Coimbra Produção de açúcar mascavo Disciplina: Processamento Geral de Alimentos Professores: João Freire Noronha Ivo Rodrigues Autor: Sandra
Instituto Politécnico de Coimbra Escola Superior Agrária de Coimbra Produção de açúcar mascavo Disciplina: Processamento Geral de Alimentos Professores: João Freire Noronha Ivo Rodrigues Autor: Sandra
CUSC MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO SÃO CAMILO
 CUSC 016 - MEDICINA - Segundo Seestre CENTRO UNIVERSITÁRIO SÃO CAMILO 01. A ureia, CO(N ), presente nos fertilizantes, pode ser identificada quiicaente e u teste siples, confore a reação representada pela
CUSC 016 - MEDICINA - Segundo Seestre CENTRO UNIVERSITÁRIO SÃO CAMILO 01. A ureia, CO(N ), presente nos fertilizantes, pode ser identificada quiicaente e u teste siples, confore a reação representada pela
CLASSIFICAÇÃO DOS SÓLIDOS SÓLIDOS CRISTALINOS
 CLASSIFICAÇÃO DOS SÓLIDOS Uma das principais formas de classificar os sólidos é em função da organização tridimensional da sua estrutura microscópica. Desta perspetiva, é possível classificá-los como cristalinos
CLASSIFICAÇÃO DOS SÓLIDOS Uma das principais formas de classificar os sólidos é em função da organização tridimensional da sua estrutura microscópica. Desta perspetiva, é possível classificá-los como cristalinos
Fritura O processo de fritura é uma alternativa de preparação de alimentos rápida, sendo que também confere características sensoriais diferenciadas T
 Autoridade de Segurança Alimentar e Económica Departamento de Riscos Alimentares e Laboratórios Divisão de Riscos Alimentares Riscos na cadeia alimentar dos óleos alimentares usados. Prevenção e acção
Autoridade de Segurança Alimentar e Económica Departamento de Riscos Alimentares e Laboratórios Divisão de Riscos Alimentares Riscos na cadeia alimentar dos óleos alimentares usados. Prevenção e acção
COLÉGIO NOSSA SENHORA DE LOURDES 9º ANO Ensino Fundamental -2015. Roteiro de estudos para recuperação trimestral Matemática Ticiano Azevedo Bastos
 COLÉGIO NOSSA SENHORA DE LOURDES 9º ANO Ensino Fundaental -2015 Disciplina: Professor (a): Roteiro de estudos para recuperação triestral Mateática Ticiano Azevedo Bastos Conteúdo: Referência para estudo:
COLÉGIO NOSSA SENHORA DE LOURDES 9º ANO Ensino Fundaental -2015 Disciplina: Professor (a): Roteiro de estudos para recuperação triestral Mateática Ticiano Azevedo Bastos Conteúdo: Referência para estudo:
UNIFEV MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA
 UNIFEV 013 - MEDICINA - Segundo Seestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Alguns gases possue aplicações e trataento estéticos e de saúde, a seguir são reportados três deles e alguas de suas aplicações.
UNIFEV 013 - MEDICINA - Segundo Seestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Alguns gases possue aplicações e trataento estéticos e de saúde, a seguir são reportados três deles e alguas de suas aplicações.
Aula 6 Primeira Lei da Termodinâmica
 Aula 6 Prieira Lei da Terodinâica 1. Introdução Coo vios na aula anterior, o calor e o trabalho são foras equivalentes de transferência de energia para dentro ou para fora do sistea. 2. A Energia interna
Aula 6 Prieira Lei da Terodinâica 1. Introdução Coo vios na aula anterior, o calor e o trabalho são foras equivalentes de transferência de energia para dentro ou para fora do sistea. 2. A Energia interna
Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada
 1 Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada 1. Questões de estudo - Como preparar uma solução aquosa de NaOH 0,1 M? - Como preparar uma solução
1 Experiência 07: Preparo de Solução a partir de Substâncias sólidas, Liquidas e de Solução Concentrada 1. Questões de estudo - Como preparar uma solução aquosa de NaOH 0,1 M? - Como preparar uma solução
Química - 9º ano. Água Potável. Atividade complementar sobre as misturas e suas técnicas de separação
 Química - 9º ano Atividade complementar sobre as misturas e suas técnicas de separação Água Potável A água é o constituinte mais característico da terra. Ingrediente essencial da vida, a água é talvez
Química - 9º ano Atividade complementar sobre as misturas e suas técnicas de separação Água Potável A água é o constituinte mais característico da terra. Ingrediente essencial da vida, a água é talvez
Mecânica dos Solos I. Limites de Consistência
 Mecânica dos Solos I Limites de Consistência 5.1 Plasticidade do solo O termo plasticidade é entendido, na Mecânica dos Solos, como sendo a propriedade que um material apresenta de suportar deformações
Mecânica dos Solos I Limites de Consistência 5.1 Plasticidade do solo O termo plasticidade é entendido, na Mecânica dos Solos, como sendo a propriedade que um material apresenta de suportar deformações
Após agitação, mantendo-se a temperatura a 20ºC, coexistirão solução saturada e fase sólida no(s) tubo(s)
 01) (Covest-2006) Uma solução composta por duas colheres de sopa de açúcar (34,2g) e uma colher de sopa de água (18,0 g) foi preparada. Sabendo que: MMsacarose = 342,0g mol -1, MMágua = 18,0 g mol -1,
01) (Covest-2006) Uma solução composta por duas colheres de sopa de açúcar (34,2g) e uma colher de sopa de água (18,0 g) foi preparada. Sabendo que: MMsacarose = 342,0g mol -1, MMágua = 18,0 g mol -1,
Gás Real -Fator de Compressibilidade Z > 1: Z < 1: Menor compressibilidade Forças repulsivas. Maior compressibilidade Forças atrativas
 Disciplina de Físico Quíica I - Diagraa de fases- Liquefação de gases. Prof. Vanderlei Inácio de Paula contato: [email protected] Gás Real -Fator de Copressibilidade pv Z Z > 1: Menor copressibilidade
Disciplina de Físico Quíica I - Diagraa de fases- Liquefação de gases. Prof. Vanderlei Inácio de Paula contato: [email protected] Gás Real -Fator de Copressibilidade pv Z Z > 1: Menor copressibilidade
Introdução à Volumetria. Profa. Lilian Lúcia Rocha e Silva
 Introdução à Volumetria Profa. Lilian Lúcia Rocha e Silva INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução que contém um soluto
Introdução à Volumetria Profa. Lilian Lúcia Rocha e Silva INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução que contém um soluto
b) Dalton proporções definidas. c) Richter proporções recíprocas. d) Gay-Lussac transformação isobárica. e) Proust proporções constantes.
 APRFUDAMET QUÍMIA 2012 LISTA 9 Leis ponderais e voluétricas, deterinação de fórulas, cálculos quíicos e estudo dos gases. Questão 01) A Lei da onservação da Massa, enunciada por Lavoisier e 1774, é ua
APRFUDAMET QUÍMIA 2012 LISTA 9 Leis ponderais e voluétricas, deterinação de fórulas, cálculos quíicos e estudo dos gases. Questão 01) A Lei da onservação da Massa, enunciada por Lavoisier e 1774, é ua
Título da Pesquisa: Palavras-chave: Campus: Tipo Bolsa Financiador Bolsista (as): Professor Orientador: Área de Conhecimento: Resumo
 Título da Pesquisa: Estudo Sobre energia solar e suas aplicações á inclusão social da população de baixa renda e ao programa Luz Para Todos. Palavras-chave: Energia solar, Aquecedor solar, Painel fotovoltaico
Título da Pesquisa: Estudo Sobre energia solar e suas aplicações á inclusão social da população de baixa renda e ao programa Luz Para Todos. Palavras-chave: Energia solar, Aquecedor solar, Painel fotovoltaico
UNIFEV MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA
 UNIFEV 01 - MEDIINA - Segundo Seestre ENTR UNIVERSITÁRI DE VTUPRANGA 07. A istura de gás oxigênio co acetileno ( H ) é utilizada na soldage de peças nas oficinas ecânicas. acetileno pode ser produzido
UNIFEV 01 - MEDIINA - Segundo Seestre ENTR UNIVERSITÁRI DE VTUPRANGA 07. A istura de gás oxigênio co acetileno ( H ) é utilizada na soldage de peças nas oficinas ecânicas. acetileno pode ser produzido
4.º Teste de Física e Química A 10.º A Fev minutos /
 4.º Teste de Física e Quíica A 10.º A Fev. 2013 90 inutos / Noe: n.º Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha últipla. Para cada ua delas são indicadas quatro
4.º Teste de Física e Quíica A 10.º A Fev. 2013 90 inutos / Noe: n.º Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha últipla. Para cada ua delas são indicadas quatro
2 Ruído de Fase em Osciladores
 Ruído de Fase e Osciladores.. Introdução Ao longo do presente capítulo serão introduzidos os conceitos básicos que deterina o coportaento de osciladores e teros de ruído, aplitude e ase. A utilização de
Ruído de Fase e Osciladores.. Introdução Ao longo do presente capítulo serão introduzidos os conceitos básicos que deterina o coportaento de osciladores e teros de ruído, aplitude e ase. A utilização de
c) Escreva a reação química de decomposição da azida de sódio formando sódio metálico e nitrogênio gasoso.
 1. (Fuvest 015) O sistea de airbag de u carro é forado por u sensor que detecta rápidas diinuições de velocidade, ua bolsa inflável e u dispositivo contendo azida de sódio (NaN 3 ) e outras substâncias
1. (Fuvest 015) O sistea de airbag de u carro é forado por u sensor que detecta rápidas diinuições de velocidade, ua bolsa inflável e u dispositivo contendo azida de sódio (NaN 3 ) e outras substâncias
Objectivos de Aprendizagem. No final desta lição, você será capaz de: Definir o conceito de solubilidade.
 Lição N o 4 Solubilidade Objectivos de Aprendizagem No final desta lição, você será capaz de: Definir o conceito de solubilidade. Material de apoio necessário para completar a lição: 4 copos 1 colherinha
Lição N o 4 Solubilidade Objectivos de Aprendizagem No final desta lição, você será capaz de: Definir o conceito de solubilidade. Material de apoio necessário para completar a lição: 4 copos 1 colherinha
QUÍMICA PRISE II SOLUÇÕES 4.1 FENÔMENO DE SATURAÇÃO DE UMA SOLUÇÃO. Sal (soluto) Água (solvente) 1. INTRODUÇÃO
 1. INTRODUÇÃO QUÍMICA PRISE II SOLUÇÕES 4.1 FENÔMENO DE SATURAÇÃO DE UMA SOLUÇÃO Quando a istura apresenta as esas características e toda a extensão do recipiente teos ua istura hoogênea e, se tiver ais
1. INTRODUÇÃO QUÍMICA PRISE II SOLUÇÕES 4.1 FENÔMENO DE SATURAÇÃO DE UMA SOLUÇÃO Quando a istura apresenta as esas características e toda a extensão do recipiente teos ua istura hoogênea e, se tiver ais
IDENTIFICAÇÃO DE AÇÚCARES
 Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química IDENTIFICAÇÃO DE AÇÚCARES Pedro Pinto Nº 14 11ºA 29/04/2004 Índice Objectivo do Trabalho... 2 Fundamentos
Escola Secundária do Padre António Martins Oliveira de Lagoa Técnicas Laboratoriais de Química IDENTIFICAÇÃO DE AÇÚCARES Pedro Pinto Nº 14 11ºA 29/04/2004 Índice Objectivo do Trabalho... 2 Fundamentos
PROJETO DE ESTRADAS Prof o. f D r D. An A de rson on Ma M nzo zo i
 PROJETO DE ESTRADAS Prof. Dr. Anderson Manzoli CONCEITOS: Após traçados o perfil longitudinal e transversal, já se dispõe de dados necessários para uma verificação da viabilidade da locação do greide de
PROJETO DE ESTRADAS Prof. Dr. Anderson Manzoli CONCEITOS: Após traçados o perfil longitudinal e transversal, já se dispõe de dados necessários para uma verificação da viabilidade da locação do greide de
INVESTIGAÇÃO OPERACIONAL. Programação Linear. Exercícios. Cap. III Método Simplex
 INVESTIGAÇÃO OPERACIONAL Programação Linear Eercícios Cap. III Método Simple António Carlos Morais da Silva Professor de I.O. INVESTIGAÇÃO OPERACIONAL (MS edição de 006) i Cap. III - Método Simple - Eercícios
INVESTIGAÇÃO OPERACIONAL Programação Linear Eercícios Cap. III Método Simple António Carlos Morais da Silva Professor de I.O. INVESTIGAÇÃO OPERACIONAL (MS edição de 006) i Cap. III - Método Simple - Eercícios
Entender os princípios de funcionamento do voltímetro, amperímetro e ohmímetro, bem como montá-los e utilizá-los.
 Laboratório de Física 3 OLTÍMETO, AMPEÍMETO E OHMÍMETO: PNCÍPOS DE FUNCONAMENTO 3.1 - Objetivos Entender os princípios de funcionaento do voltíetro, aperíetro e ohíetro, be coo ontá-los e utilizá-los.
Laboratório de Física 3 OLTÍMETO, AMPEÍMETO E OHMÍMETO: PNCÍPOS DE FUNCONAMENTO 3.1 - Objetivos Entender os princípios de funcionaento do voltíetro, aperíetro e ohíetro, be coo ontá-los e utilizá-los.
Limites de Consistência. Limites de Consistência. Marcio Varela
 Limites de Consistência Limites de Consistência Marcio Varela Limites de Consistência Introdução O comportamento dos solos finos irá depender de diversos fatores, tais como: como sua composição química
Limites de Consistência Limites de Consistência Marcio Varela Limites de Consistência Introdução O comportamento dos solos finos irá depender de diversos fatores, tais como: como sua composição química
Semana 04. CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996 (adaptado).
 Seana 04 Seana 04 01. (Ene 2016) A iniização do tepo e custo de ua reação quíica, be coo o auento na sua taxa de conversão, caracteriza a eficiência de u processo quíico. Coo consequência, produtos pode
Seana 04 Seana 04 01. (Ene 2016) A iniização do tepo e custo de ua reação quíica, be coo o auento na sua taxa de conversão, caracteriza a eficiência de u processo quíico. Coo consequência, produtos pode
A transferência de calor ocorre até o instante em que os corpos atingem a mesma temperatura (equilíbrio térmico).
 REVISÃO ENEM Calorimetria CONCEITO FÍSICO DE CALOR Calor é a energia transferida de um corpo a outro, devido à desigualdade de temperaturas existente entre eles. Essa transferência sempre ocorre do corpo
REVISÃO ENEM Calorimetria CONCEITO FÍSICO DE CALOR Calor é a energia transferida de um corpo a outro, devido à desigualdade de temperaturas existente entre eles. Essa transferência sempre ocorre do corpo
Estrutura física e química da Terra
 Estrutura física e química da Terra Os elementos químicos que estão globalmente presentes são os mesmos que constituem os minerais mais comuns. Existem atualmente cerca de 116 elementos químicos, incluindo
Estrutura física e química da Terra Os elementos químicos que estão globalmente presentes são os mesmos que constituem os minerais mais comuns. Existem atualmente cerca de 116 elementos químicos, incluindo
A forma geral de uma equação de estado é: p = f ( T,
 Aula: 01 Temática: O Gás Ideal Em nossa primeira aula, estudaremos o estado mais simples da matéria, o gás, que é capaz de encher qualquer recipiente que o contenha. Iniciaremos por uma descrição idealizada
Aula: 01 Temática: O Gás Ideal Em nossa primeira aula, estudaremos o estado mais simples da matéria, o gás, que é capaz de encher qualquer recipiente que o contenha. Iniciaremos por uma descrição idealizada
ROTEIRO DE ESTUDOS 2015 Disciplina: Ciências Ano: 9º ano Ensino: FII Nome: Atividade Regulação do 3º Bimestre Ciências
 ROTEIRO DE ESTUDOS 2015 Disciplina: Ciências Ano: 9º ano Ensino: FII Nome: Refazer as avaliações; Refazer as listas de exercícios; Refazer exercícios do caderno. Entregar a atividade abaixo no dia da avaliação
ROTEIRO DE ESTUDOS 2015 Disciplina: Ciências Ano: 9º ano Ensino: FII Nome: Refazer as avaliações; Refazer as listas de exercícios; Refazer exercícios do caderno. Entregar a atividade abaixo no dia da avaliação
Dimensionamento de válvulas reguladoras de pressão
 Introdução O dimensionamento e a escolha de válvulas reguladoras de pressão, não são nenhuma ciência secreta dominada unicamente por peritos. O modo de procedimento aqui apresentado, permite escolher a
Introdução O dimensionamento e a escolha de válvulas reguladoras de pressão, não são nenhuma ciência secreta dominada unicamente por peritos. O modo de procedimento aqui apresentado, permite escolher a
A.L.2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO-BASE
 A.L.2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO-BASE QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como neutralizar resíduos de ácidos/bases do laboratório de Química da escola? Como identificar se os resíduos são de uma
A.L.2.3 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO-BASE QUÍMICA 11.ºANO QUESTÃO-PROBLEMA Como neutralizar resíduos de ácidos/bases do laboratório de Química da escola? Como identificar se os resíduos são de uma
