Formas farmacêuticas líquidas - Soluções
|
|
|
- Henrique Rios Casado
- 8 Há anos
- Visualizações:
Transcrição
1 Formas farmacêuticas líquidas - Soluções
2 Preparações líquidas: Podem conter uma ou mais substâncias químicas dissolvidas em solvente adequado ou em mistura de solventes mutuamente miscíveis ou dispersíveis. Preparação: considerar solubilidade dos solutos, solvente empregado, estabilidade e compatibilidades. 2 Número de operações unitárias e componentes necessários: Depende da escala de produção, prazo de validade pretendido e via de administração desejada.
3 Preparações líquidas: Quanto à complexidade tecnológica: Estéreis e não estéreis Quanto à complexidade técnica: Soluções, suspensões e emulsões. A Formas líquidas Orais Soluções Suspensões Emulsões B Formas líquidas de uso externo Nasal Auricular Oftalmológica Cosmética 3
4 SOLUÇÕES ORAIS São misturas química e fisicamente homogêneas, onde uma ou mais substâncias (soluto) estão dissolvidas,ou seja, molecularmente dispersas em um solvente adequado ou em uma mistura miscível de solventes. Dispersões moleculares com partículas menores que 0,01 Mm. Necessário alto grau de afinidade entre soluto e solvente para tamanha interação intermolecular. Para desenvolver solução medicamentosa deve-se conhecer a Ks (constante de solubilidade) de cada componente no veículo proposto. Ks alto: fácil dissolução, logo geram soluções mais simples do ponto de vista farmacotécnico.
5 Dispersões moleculares
6 SOLUÇÕES ORAIS Veículos (solvente) mais utilizados: Água, Etanol, Glicerina e Óleos vegetais Classificação: hidróleos (água), alcoóleos (álcool), glicerina (gliceróleos), éter (eteróleos), acetona (cetóleos) e vinho (enóleos). Ainda: Sacaróleos (xarope) elevado teor de açúcar (sacarose), acima de 80%. Excelentes via oral: valor energético açúcar mascara o sabor desagradável. Elixires: menor viscosidade e sabor menos adocicado que os xaropes (por serem soluções hidroalcóolicas permitem dissolução de solutos solúveis em água e etanol. Se conc. acima de 10% de álcool, são autoconservantes). Elixir paregórico: Tintura canforada de ópio (analgésico e antiespasmódico).
7 SOLUÇÕES ORAIS Podem conter adjuvantes farmacotécnicos: Estabilizantes Conservantes Edulcorantes Flavorizantes Corretores de ph Agentes de viscosidade 7
8 8 SOLUÇÕES ORAIS Vantagens: Mais facilmente absorvidos do que as formas sólidas Facilidade de deglutição Melhor homogeneidade de dosificação Alta Estabilidade física: partículas em dispersões moleculares não sofrem ação da gravidade. Alta Biodisponibilidade: partículas pequenas são mais facilmente absorvidas. Alta uniformidade: dispersões moleculares são sistemas uniformes e homogêneos.
9 SOLUÇÕES ORAIS 9 Desvantagens: Menor estabilidade microbiológica Realça o sabor dos fármacos Sistema de medida de volume nem sempre é acurado Baixa estabilidade química: reações dependem da colisão intermolecular, favorecida nas dispersões moleculares Alta Biodisponibilidade: nem sempre se deseja absorção imediata.
10 SOLUÇÕES ORAIS Deve-se pesquisar antes do preparo de uma solução as características físico-químicas dos fármacos e veículos a serem utilizados, verificando: 1. a solubilidade, 2. a necessidade de aquecimento, 3. faixa de ph de maior solubilidade ou de estabilidade, 4. conhecimento do pka da droga e das suas características ácido-base, 5. necessidade de adjuvantes e 6. possibilidade de alterações com o decorrer do tempo. 10
11 Solubilidade A solubilidade de uma substância num determinado solvente não é ilimitada. De fato, quando se põe um sólido em contato com um líquido que não exerça sobre aquele qualquer ação química, pode acontecer que o sólido se dissolva totalmente no líquido em questão, que se dissolva apenas parcialmente ou seja praticamente insolúvel nele (Prista Tecnologia farmacêutica e farmácia Galênica vol. I) 11
12 Solubilidade A solubilidade de uma substância num determinado solvente indica a concentração máxima na qual uma solução com aquela substância e aquele solvente pode ser preparada. Coeficiente de solubilidade (Ks): concentração, a uma dada temperatura, da respectiva solução saturada. Estado de saturação: estado de equilíbrio dinâmico entre o soluto e o solvente. 12
13 Solubilidade Assim quando se fixa a uma pressão e temperatura, a solubilidade é uma constante de equilíbrio característica de uma molécula. A concentração máxima possível em que se pode preparar uma solução varia muito e depende, em parte, da constituição química do soluto. 13
14 Solubilidade Quando um soluto se dissolve, as forças de atração intermolecular da substância devem ser superadas por forças de atração entre as moléculas do soluto e do solvente. A maioria das substâncias absorve calor ao se dissolver e diz-se que elas têm calor de dissolução positivo, resultando em aumento da solubilidade com o aumento da temperatura, mas... Algumas poucas substâncias têm calor de dissolução negativo e assim diminuem a solubilidade com o aumento da 14 temperatura.
15 Solubilidade Outros fatores, além da temperatura, afetam a solubilidade: Propriedades químicas e físicas do soluto e do solvente (constante dielétrica, pka); Estado de subdivisão do soluto e agitação física aplicada solução; Acidez ou basicidade da solução (influência do ph) 15
16 Caso fármaco tenha baixa solubilidade, o farmacêutico deve conhecer técnicas de dissolução. Quais?? Agitação mecânica: Aquecimento: Ajuste constante dielétrica: Uso de cossolventes: Ajuste de ph: Uso de agentes solubilizantes: 16
17 Caso fármaco tenha baixa solubilidade, o farmacêutico deve conhecer técnicas de dissolução. Quais?? Agitação mecânica: convecção técnica de dispersão mais empregada. Segura do ponto de vista da estabilidade porém pode causar aeração e viabilizar oxidação. 17 Aquecimento: a dispersão das moléculas, consequentemente, Ks (constante de solubilidade)em geral aumenta significativamente com om aumento da temperatura. (Atenção aos fármacos termolábeis ou voláteis).
18 Caso fármaco tenha baixa solubilidade, o farmacêutico deve conhecer técnicas de dissolução. Quais?? Ajuste constante dielétrica: afinidade soluto-solvente fundamental para alto grau de dispersão. No caso de má hidrossolubilidade, pode-se reduzir a constante dielétrica da água, com a adição de solvente orgânico miscível. Uso de cossolventes: uso de pequena quantidade de solvente inócuo e miscível com o veículo. * Diferença da anterior: quantidade de solvente empregada não altera a constante dielétrica de forma significativa. (Ex. Uso de álcool como cossolvente de metilparapeno em água) Soluto deverá ter afinidade com o sistema solvente e não precipitar após a incorporação da solução previamente obtida no veículo. 18
19 Caso fármaco tenha baixa solubilidade, o farmacêutico deve conhecer técnicas de dissolução. Quais?? Ajuste de ph: no caso de fármacos ácidos ou básicos, o ajuste de ph pode determinar ionização e assim hidrossolubilidade. Uso de agentes solubilizantes: Incluem formação de complexos e sistemas miscelares. Ex. Iodeto para solubilização de iodo em água, o princípio da adição: formação de sais entre fármacos básicos e ácidos e ainda o uso de tensoativos. 19
20 Isotonia e ph em soluções Regularização líquidos organismo: compreende manutenção concentração adequada de água e eletrólitos e preservação da concentração de íons hidrogênio dentro de faixa estreita e adequada ao melhor funcionamento celular. Equilíbrio entre gradiente de concentração interno e externo: produto da soma das concentrações parciais de todos os constituintes fisiológicos. A definição da quantidade ideal destes constituintes é complexo devido variação entre órgão e indivíduos. 20
21 Isotonia e ph em soluções Mas a tonicidade (pressão osmótica) intra e extracelular, fruto da concentração global de todos os solutos deve ser equivalente no sentido de se evitar lesões celulares por osmose (abordaremos mais a frente). Meio hipertônico célula tende a perder solvente (água) e Meio hipotônico o contrário, podendo atingir rompimento de membrana com extravasamento do citoplasma, seguido de morte celular. 21
22 ph em soluções No caso do Íons hidrogênio: manutenção da quantidade ideal depende do equilíbrio ácido-base (equilíbrio entre ácidos e bases do organismo). Alterações bruscas: podem alterar permeabilidade das membranas e as funções enzimáticas celulares (biossíntese) comprometendo as funções enzimáticas de vários órgãos e sistemas. 22
23 ph em soluções Íons hidrogênio: extremamente móveis e aletrações em sua concentração pode alterar por migração a concentração de outros íons como sódio, potássio e cloretos, logo podendo afetar a isotonia do sistema. Mas.. o organismo dispõe de eficientes mecanismos de regularização do ph, integrados pelos sistemas renal, circulatório e respiratório. 23 ph normal da água: 7 (para cada de moléculas de água apenas 1 se dissocia)
24 ph em soluções Fluidos biológicos: soluções aquosas com diferentes características químicas e iônicas e os valores de ph dependem destas substância. 24
25 ph em soluções Solução orgânica padrão para avaliação de ph: sangue Possui valores entre 7,35 e 7,45. (ligeiramente alcalino em relação à água devido atividade iônica de numerosas substâncias), incluindo o sistema tampão do sangue (bicarbonato/ácido carbônico 64%, hemoglobina/ oxihemoglobina 28%, proteínas ácidas/proteínas básicas 7%, fosfato monoácido;fosfato diácido 1%). 25
26 ph e solubilidade: 26 Uma grande parte dos fármacos importantes constitui-se por ácidos fracos ou bases fracas e sua solubilidade depende em larga escala do ph do solvente. Esses fármacos reagem com ácidos fortes ou bases fortes formando sais solúveis em água 1) Bases fracas: alcalóides, antihistamínicos e anestésicos locais não são muito solúveis em água mas são solúveis em soluções diluídas de ácidos. 2) Ácidos fracos: barbituratos e sulfonamidas formam sais hidrossolúveis em solução básica.
27 Importância do ajuste do ph medicamentos Dissolução dos componentes da fórmula (principalmente os fármacos) Manutenção de estabilidade química e farmacodinâmica Obtenção do efeito terapêutico Prevenção de fenômenos irritativos Importante: Muitas vezes o ph de mair estabilidade do fármaco não é o que melhor se ajusta a sua solubilidade, ao uso terapêutico e/ou a sua compatibilidade com o meio fisiológico. Critério: estibilidade razoável e compatível com uso clínico 27
28 Efeito do ph e pka na solubilidade em água O estado de ionização da molécula é um fator determinante para a solubilização da mesma, uma vez que quanto maior for a fração molar da droga ionizada, maior será sua solubilidade em água. A relação das formas ionizadas e não ionizadas depende do ph do meio e do pka do composto Equação de Henderson-Hasselbach pka = ph + log C i /C u 28
29 Ajuste do ph em soluções Adição de acidulantes (acidificantes) ou alcalinizantes Uso de tampões para manutenção de ph que segue a equação de Handerson-Hasselbach ph = pka log [HA]/[A - ] Baseada nom princípio de que ácidos ou bases fracas se dissociam muito pouco de maneira a manter o ph em estreita faixa de equilíbrio Tampões podem ser comppostos por: 1. Ácido fraco e seu sal: ex.: ácido acético/acetato de sódio 2. Base fraca e seu sal.: amônia/cloreto de amônio 3. Dois sais: fosfato monopotássico/fosfato bipotássico 29
30 Tampões clássicos 1. Gifford: ácido bórico e carbonato de sódio (ph 5,0 a 8,6) 2. Sorensen: fosfatos mono e dissódico (ph 5,91 a 8,04) 3. Palitzsh: ácido bórico/borato de sódio (ph 6,7 a 8,7) Todos usados em colírios Formulações via oral, os mais usados são: Ácido cítrico e fosfato dissódico (ph 2,8 a 8,0) 30 * Tampões contendo borato: proibidos devido toxicidade (hemolítico via oral).
31 Importância do ajuste da isotonia Isotonia: pressão osmótica de duas soluções são idênticas (Muito importante para soluções parenterais) Para medicamentos: compração com a tonicidade dos fluidos biológicos Lágrima, sangue, muco nasal e fluidos teciduais têm mesma pressão osmótica (correspondente à solução aquosa de NaCl 0,9%)Medicamento com tonicidade maior: hipertônico e hipotônico caso contrário. 31 Tecido mais sensíveis às variações de pressão osmótica: mucosa oftálmica e nasal, tecido muscular e subcutâneo Já pele e mucosas do TGI são praticamente insensíveis a estas variações
32 Importância do ajuste da isotonia De maneira geral os medicamentos devem ser isotônicos, há casos porém de necessidade de administração de soluções hipertônicas (reposição eletrolítica, nutrição parenteral prolongada) Para solições hipotônicas administradas pela via parenteral e via mucosas (como colírios): isotonização obrigatória para evitar dor, irritação ou lesão mais grave. 32 Ajuste da tonicidade: Feito pela adição de quantidade adequada de isotonizante (Ex.: NaCl, dextrose, sacarose) Sempre que um sólido é dissolvido em solução, a pressão osmótica e o ponto de ebulição aumentam, enquanto o ponto de congelamento diminui.
33 Isotonia
Aula sobre Soluções Aula 01 (ENEM) Profº.: Wesley de Paula
 Aula sobre Soluções Aula 01 (ENEM) Profº.: Wesley de Paula Propriedades das Soluções Classificação das Misturas: Soluções e Dispersões Classificação das soluções O Processo de Dissolução em soluções Relações
Aula sobre Soluções Aula 01 (ENEM) Profº.: Wesley de Paula Propriedades das Soluções Classificação das Misturas: Soluções e Dispersões Classificação das soluções O Processo de Dissolução em soluções Relações
Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello
 Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Fácil Resolução da Prova de Química Vestibular Verão UERGS/2003 Prof. Emiliano Chemello Médio www.quimica.net/emiliano emiliano@quimica.net Difícil Níveis de dificuldade das Questões 01. Em um frasco,
Água e Soluções Biológicas
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
Aluno (a): Série: 3ª Turma: TUTORIAL 11R Ensino Médio Equipe de Química Data: QUÍMICA SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas
SOLUÇÕES. As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas.
 QUÍMICA PROF - 3C13 SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas. Solução é
QUÍMICA PROF - 3C13 SOLUÇÕES As misturas podem ser homogêneas ou heterogêneas. As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas. Solução é
Transporte através da Membrana Plasmática. Biofísica
 Transporte através da Membrana Plasmática Biofísica Estruturas das células Basicamente uma célula é formada por três partes básicas: Membrana: capa que envolve a célula; Citoplasma: região que fica entre
Transporte através da Membrana Plasmática Biofísica Estruturas das células Basicamente uma célula é formada por três partes básicas: Membrana: capa que envolve a célula; Citoplasma: região que fica entre
SEPARAÇÃO DE MISTURAS. Pr ofª Tatiana Lima
 SEPARAÇÃO DE MISTURAS Pr ofª Tatiana Lima As separações de misturas estão baseadas nas diferenças de propriedades entre os componentes de uma mistura. Soluções são misturas homogêneas, onde o solvente
SEPARAÇÃO DE MISTURAS Pr ofª Tatiana Lima As separações de misturas estão baseadas nas diferenças de propriedades entre os componentes de uma mistura. Soluções são misturas homogêneas, onde o solvente
 Soluções Químicas são misturas homogêneas de duas ou mais substâncias, onde o solvente aparece em maior quantidade e o soluto em menor quantidade. O estado de agregação do solvente é que determina o estado
Soluções Químicas são misturas homogêneas de duas ou mais substâncias, onde o solvente aparece em maior quantidade e o soluto em menor quantidade. O estado de agregação do solvente é que determina o estado
Química C Extensivo V. 2
 Química C Extensivo V. 2 Exercícios 01) E 02) E Situação 1. Sistema heterogêneo solução saturada com corpo de fundo; 20 C = 46,5/100 g H 2 Na situação 1 há 80 g de soluto em 100 g de água a 20 C. excesso
Química C Extensivo V. 2 Exercícios 01) E 02) E Situação 1. Sistema heterogêneo solução saturada com corpo de fundo; 20 C = 46,5/100 g H 2 Na situação 1 há 80 g de soluto em 100 g de água a 20 C. excesso
Aulas 13 e 14. Soluções
 Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Aulas 13 e 14 Soluções Definição Solução é a denominação ao sistema em que uma substância está distribuída, ou disseminada, numa segunda substância sob forma de pequenas partículas. Exemplos Dissolvendo-se
Água, Soluções e Suspensões.
 Água, Soluções e Suspensões. A água é a molécula mais abundante nos seres vivos. Cerca de 75% de um adulto. No planeta não existem seres vivos sem água. Fases da água: Sólida Líquida Gasosa Na dependência
Água, Soluções e Suspensões. A água é a molécula mais abundante nos seres vivos. Cerca de 75% de um adulto. No planeta não existem seres vivos sem água. Fases da água: Sólida Líquida Gasosa Na dependência
SOLUÇÕES. Curvas de Solubilidade
 QUÍMICA SOLUÇÕES 1. INTRODUÇÃO Soluções são misturas homogêneas, ou seja, misturas entre dois ou mais componentes apresentando uma única fase. Exemplos: Água + Álcool Água + Sal + Açucar Curvas de Solubilidade
QUÍMICA SOLUÇÕES 1. INTRODUÇÃO Soluções são misturas homogêneas, ou seja, misturas entre dois ou mais componentes apresentando uma única fase. Exemplos: Água + Álcool Água + Sal + Açucar Curvas de Solubilidade
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
SOLUÇÕES SOLUÇÕES MISTURAS
 MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
Química de Águas Naturais. -todas as formas de vida existentes no planeta Terra dependem da água;
 Química de Águas Naturais todas as formas de vida existentes no planeta Terra dependem da água; a água cobre 70% da superfície do planeta, apenas uma parte dessa quantidade (~2,8%) é água doce sendo que
Química de Águas Naturais todas as formas de vida existentes no planeta Terra dependem da água; a água cobre 70% da superfície do planeta, apenas uma parte dessa quantidade (~2,8%) é água doce sendo que
Associação Catarinense das Fundações Educacionais ACAFE PARECER RECURSO DISCIPLINA QUÍMICA
 33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
33) Assinale a alternativa correta, na qual todas as substâncias são compostas e líquidas à temperatura ambiente. A O 3, O 2 ; CH 3 CH 2 OH B H 2 ; CO 2 ; CH 3 OH C H 2 O; NH 3 ; CO D H 2 O; CH 3 CH 2
Departamento de Química Inorgânica 2. SOLUÇÕES
 2. SOLUÇÕES I. INTRODUÇÃO Soluções são misturas homogêneas de dois ou mais componentes, sendo que estes estão misturados uniformemente em nível molecular. Em nosso cotidiano temos diversos exemplos de
2. SOLUÇÕES I. INTRODUÇÃO Soluções são misturas homogêneas de dois ou mais componentes, sendo que estes estão misturados uniformemente em nível molecular. Em nosso cotidiano temos diversos exemplos de
a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica).
 01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
01 a) Incorreta. O aumento da temperatura desloca o equilíbrio para o lado direito, no sentido da formação do vapor (transformação endotérmica). b) Incorreta. Quanto mais volátil o líquido, menor será
ESTUDO DA FARMACOLOGIA Introdução - Parte II
 NESP UNIVERSIDADE ESTADUAL PAULISTA "JÚLIO DE MESQUITA FILHO UNESP ESTUDO DA FARMACOLOGIA Introdução - Parte II A Terapêutica é um torrencial de Drogas das quais não se sabe nada em um paciente de que
NESP UNIVERSIDADE ESTADUAL PAULISTA "JÚLIO DE MESQUITA FILHO UNESP ESTUDO DA FARMACOLOGIA Introdução - Parte II A Terapêutica é um torrencial de Drogas das quais não se sabe nada em um paciente de que
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Aula 19 PROPRIEDADES DAS SOLUÇÕES. Eliana Midori Sussuchi Samísia Maria Fernandes Machado Valéria Regina de Souza Moraes
 Aula 19 PROPRIEDADES DAS SOLUÇÕES META Apresentar os fatores que influenciam no processo de dissolução. OBJETIVOS Ao final desta aula, o aluno deverá: reconhecer um processo de dissolução; identificar
Aula 19 PROPRIEDADES DAS SOLUÇÕES META Apresentar os fatores que influenciam no processo de dissolução. OBJETIVOS Ao final desta aula, o aluno deverá: reconhecer um processo de dissolução; identificar
Lipídios Proteínas Carboidratos (glicocálix)
 Delimita a Célula Realiza reações celulares Possui Permeabilidade Seletiva Composição: Lipídios Proteínas Carboidratos (glicocálix) Membrana Plasmática xx/xx 2 MOSAICO FLUÍDO Hidrofílica = afinidade com
Delimita a Célula Realiza reações celulares Possui Permeabilidade Seletiva Composição: Lipídios Proteínas Carboidratos (glicocálix) Membrana Plasmática xx/xx 2 MOSAICO FLUÍDO Hidrofílica = afinidade com
Prova de Química Resolvida Segunda Etapa Vestibular UFMG 2011 Professor Rondinelle Gomes Pereira
 QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
Membranas Biológicas e Transporte
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Introdução a Bioquímica Membranas Biológicas e Transporte 1. Introdução 2. Os Constituintes
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Introdução a Bioquímica Membranas Biológicas e Transporte 1. Introdução 2. Os Constituintes
3 Propriedades Coligativas
 3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
3 Propriedades Coligativas 1 Introdução É bastante comum as pessoas adicionarem sal à água que será utilizada no cozimento de alimentos. Com a adição de sal de cozinha, a água demora mais tempo para entrar
HIDROMETALURGIA E ELETROMETALURGIA
 Definição transferência de íons específicos de uma solução pouco concentrada para outra mais concentrada porque o soluto se distribui entre 2 solventes imiscíveis em contato. Objetivos: Separação porque
Definição transferência de íons específicos de uma solução pouco concentrada para outra mais concentrada porque o soluto se distribui entre 2 solventes imiscíveis em contato. Objetivos: Separação porque
9/9/2008 CONSIDERAÇÕES GERAIS. Toxicidade. Faixa terapêutica. Concentrações sub-terapêuticas. - Não sofre efeito de primeira passagem
 CONSIDERAÇÕES GERAIS Princípios de Farmacologia: Farmacocinética Farmacodinâmica Concentração plasmática Toxicidade Faixa terapêutica Concentrações sub-terapêuticas Tempo VIAS DE ADMINISTRAÇÃO DE MEDICAMENTOS
CONSIDERAÇÕES GERAIS Princípios de Farmacologia: Farmacocinética Farmacodinâmica Concentração plasmática Toxicidade Faixa terapêutica Concentrações sub-terapêuticas Tempo VIAS DE ADMINISTRAÇÃO DE MEDICAMENTOS
UFU 2014 VESTIBULAR DE MAIO 1ª FASE
 UFU 2014 VESTIBULAR DE MAIO 1ª FASE 1-O iodo-132, devido à sua emissão de partículas beta e radiação gama, tem sido muito empregado no tratamento de problemas na tireoide. A curva abaixo ilustra o decaimento
UFU 2014 VESTIBULAR DE MAIO 1ª FASE 1-O iodo-132, devido à sua emissão de partículas beta e radiação gama, tem sido muito empregado no tratamento de problemas na tireoide. A curva abaixo ilustra o decaimento
Box 2. Estado da solução Estado do solvente Estado do soluto Exemplos
 MISTURA E SOLUBILIDADE Box 2 Grande parte das substancias encontradas no dia-a-dia são misturas que sob o aspecto macroscópico apresentam-se com o aspecto homogêneo (uma única fase) ou heterogêneo (mais
MISTURA E SOLUBILIDADE Box 2 Grande parte das substancias encontradas no dia-a-dia são misturas que sob o aspecto macroscópico apresentam-se com o aspecto homogêneo (uma única fase) ou heterogêneo (mais
Solubilidade. Ricardo Queiroz Aucélio Letícia Regina de Souza Teixeira
 Ricardo Queiroz Aucélio Letícia Regina de Souza Teixeira Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons. http://creativecommons.org.br http://creativecommons.org/licenses/by-sa/3.0/br/legalcode
Ricardo Queiroz Aucélio Letícia Regina de Souza Teixeira Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons. http://creativecommons.org.br http://creativecommons.org/licenses/by-sa/3.0/br/legalcode
CURSO APOIO QUÍMICA RESOLUÇÃO
 QUÍMICA CURS API 15. hidróxido de magnésio, Mg() 2, massa molar 58,3 g mol 1, apresenta propriedades antiácidas e laxativas. Ao ser ingerido, reage com o ácido clorídrico presente no estômago, formando
QUÍMICA CURS API 15. hidróxido de magnésio, Mg() 2, massa molar 58,3 g mol 1, apresenta propriedades antiácidas e laxativas. Ao ser ingerido, reage com o ácido clorídrico presente no estômago, formando
As Propriedades das Misturas (Aulas 18 a 21)
 As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
Propriedades coligativas
 As propriedades coligativas dependem da quantidade de moléculas de soluto. Já sabemos que a presença de soluto afeta as propriedades físicas do solvente, as propriedades coligativas de maior importância
As propriedades coligativas dependem da quantidade de moléculas de soluto. Já sabemos que a presença de soluto afeta as propriedades físicas do solvente, as propriedades coligativas de maior importância
Propriedades coligativas I
 Propriedades coligativas I 01. (Ufrn) Um béquer de vidro, com meio litro de capacidade, em condições normais de temperatura e pressão, contém 300 ml de água líquida e 100 g de gelo em cubos. Adicionando-se,
Propriedades coligativas I 01. (Ufrn) Um béquer de vidro, com meio litro de capacidade, em condições normais de temperatura e pressão, contém 300 ml de água líquida e 100 g de gelo em cubos. Adicionando-se,
LISTA COMPLEMENTAR DE EXERCÍCIOS. Ensino Médio 3º ano. Cinética Química Equilíbrio Químico Equilíbrio Iônico
 LISTA COMPLEMENTAR DE EXERCÍCIOS Ensino Médio 3º ano Cinética Química Equilíbrio Químico Equilíbrio Iônico Prof. Ricardo Finkler 2011 1) A velocidade de uma reação química depende: I. Do número de colisões
LISTA COMPLEMENTAR DE EXERCÍCIOS Ensino Médio 3º ano Cinética Química Equilíbrio Químico Equilíbrio Iônico Prof. Ricardo Finkler 2011 1) A velocidade de uma reação química depende: I. Do número de colisões
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL
 RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
PROVA DE QUÍMICA II. Dados: R = 0,082L.atm/mol.K, N = 6,0x10 23. A) 4,1x10-14 B) 4,1x10-22 D) 4,1x10-18 C) 1,0x10-18 E) 1,0x10 15
 PROVA DE QUÍMCA 01. A concentração de um gás poluente na atmosfera, medida a 1 atm e 27ºC, é de 1 ppm. A concentração desse poluente, em moléculas/cm 3 de ar, é igual a Dados: R = 0,082L.atm/mol.K, N =
PROVA DE QUÍMCA 01. A concentração de um gás poluente na atmosfera, medida a 1 atm e 27ºC, é de 1 ppm. A concentração desse poluente, em moléculas/cm 3 de ar, é igual a Dados: R = 0,082L.atm/mol.K, N =
QUÍMICA SEGUNDA ETAPA - 1997
 QUÍMICA SEGUNDA ETAPA - 1997 QUESTÃO 01 Os valores das sucessivas energias de ionização de um átomo constituem uma evidência empírica da existência de níveis de energia. Os diagramas abaixo pretendem representar,
QUÍMICA SEGUNDA ETAPA - 1997 QUESTÃO 01 Os valores das sucessivas energias de ionização de um átomo constituem uma evidência empírica da existência de níveis de energia. Os diagramas abaixo pretendem representar,
Equilíbrio. Prof a Alessandra Smaniotto. QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B
 Cap 3: Equilíbrio Químico Equilíbrio brioácido-base Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Íon hidrogênio O íon hidrogênio (H + )
Cap 3: Equilíbrio Químico Equilíbrio brioácido-base Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Íon hidrogênio O íon hidrogênio (H + )
SIMULADO de QUÍMICA GABARITO COMENTADO 3º ANO 1º BIMESTRE/2011
 SIMULADO de QUÍMICA GABARITO COMENTADO 3º ANO 1º BIMESTRE/2011 1. (FATEC-2011) Os elementos cloro (Z = 17) e iodo (Z = 53) pertencem ao mesmo grupo da tabela periódica. Assim, átomos neutros desses elementos
SIMULADO de QUÍMICA GABARITO COMENTADO 3º ANO 1º BIMESTRE/2011 1. (FATEC-2011) Os elementos cloro (Z = 17) e iodo (Z = 53) pertencem ao mesmo grupo da tabela periódica. Assim, átomos neutros desses elementos
LIGAÇÕES INTERMOLECULARES
 Ligações Intermoleculares 1 LIGAÇÕES INTERMOLECULARES Introdução O que mantém as moléculas unidas nos estados líquido e sólido? Que força faz a água, contrariando a gravidade, subir por um capilar? Como
Ligações Intermoleculares 1 LIGAÇÕES INTERMOLECULARES Introdução O que mantém as moléculas unidas nos estados líquido e sólido? Que força faz a água, contrariando a gravidade, subir por um capilar? Como
Equilíbrio Químico. PROF. NÚRIA Kc, Kp, Ka, Ki, Kb E ph
 Equilíbrio Químico PROF. NÚRIA Kc, Kp, Ka, Ki, Kb E ph 1 - "O conceito de equilíbrio é fundamental na química, mas não é exclusivo da química. Vivemos em uma situação social e econômica que constitui equilíbrio
Equilíbrio Químico PROF. NÚRIA Kc, Kp, Ka, Ki, Kb E ph 1 - "O conceito de equilíbrio é fundamental na química, mas não é exclusivo da química. Vivemos em uma situação social e econômica que constitui equilíbrio
DISPERSÕES. Profa. Kátia Aquino
 DISPERSÕES Profa. Kátia Aquino O que é uma dispersão do ponto de vista químico? Mistura de duas ou mais substâncias, em que as partículas de uma fase a fase dispersa se encontram distribuidas em outra
DISPERSÕES Profa. Kátia Aquino O que é uma dispersão do ponto de vista químico? Mistura de duas ou mais substâncias, em que as partículas de uma fase a fase dispersa se encontram distribuidas em outra
1- IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA 2- COMPOSIÇÃO E INFORMAÇÕES SOBRE OS INGREDIENTES 3- IDENTIFICAÇÃO DE PERIGOS
 20 de agosto de 2011 PÁGINA: 1 de 5 1- IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do Produto: Código Interno de Identificação do Produto: PA - Nome da Empresa: DORIGON INDÚSTRIA DE TENSOATIVOS LTDA. Endereço:
20 de agosto de 2011 PÁGINA: 1 de 5 1- IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Nome do Produto: Código Interno de Identificação do Produto: PA - Nome da Empresa: DORIGON INDÚSTRIA DE TENSOATIVOS LTDA. Endereço:
1. Introdução. António Barreto Archer * e João Rui Machado **
 A Resolução dos Problemas de Poluição Atmosférica Gerados pela Indústria Têxtil através de uma Nova Tecnologia: Precipitação Electrostática a Húmido (Condensing WESP TM ) A precipitação electrostática
A Resolução dos Problemas de Poluição Atmosférica Gerados pela Indústria Têxtil através de uma Nova Tecnologia: Precipitação Electrostática a Húmido (Condensing WESP TM ) A precipitação electrostática
Solubilidade & Unidades de Concentração
 Solubilidade & Unidades de Concentração Introdução Como se formam as soluções? Qual é o mecanismo de dissolução? Para responder essas questões devemos estudar as alterações estruturais que ocorrem durante
Solubilidade & Unidades de Concentração Introdução Como se formam as soluções? Qual é o mecanismo de dissolução? Para responder essas questões devemos estudar as alterações estruturais que ocorrem durante
SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO
 SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO A SOLUÇÃO IDEAL Solução: mistura homogenia de espécies químicas (única fase) Solvente: constituinte em maior quantidade Soluto:
SOLUÇÕES PROPRIEDADES COLIGATIVAS TERMODINAMICA II PROF. JAQUELINE SCAPINELLO A SOLUÇÃO IDEAL Solução: mistura homogenia de espécies químicas (única fase) Solvente: constituinte em maior quantidade Soluto:
Isotônicos. Ursula Trindade (DRE: 103142682)
 Isotônicos Ursula Trindade (DRE: 103142682) Osmolaridade e Osmolalidade Referem-se ao número de partículas osmoticamente ativas. Osmolaridade: número de partículas osmoticamente ativas de soluto contidas
Isotônicos Ursula Trindade (DRE: 103142682) Osmolaridade e Osmolalidade Referem-se ao número de partículas osmoticamente ativas. Osmolaridade: número de partículas osmoticamente ativas de soluto contidas
Vestibular UFRGS 2015. Resolução da Prova de Química
 Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo,
Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo,
DISPERSÕES. Prof. Tatiane Kuchnier de Moura
 DISPERSÕES Prof. Tatiane Kuchnier de Moura DISPERSÃO Mistura DISPERSO + DISPERSANTE Classificação das Dispersões Nome da dispersão Diâmetro médio das partículas dispersas Exemplos Solução verdadeira Entre
DISPERSÕES Prof. Tatiane Kuchnier de Moura DISPERSÃO Mistura DISPERSO + DISPERSANTE Classificação das Dispersões Nome da dispersão Diâmetro médio das partículas dispersas Exemplos Solução verdadeira Entre
Propriedades Físicas das Soluções. Tipos de Soluções
 Propriedades Físicas das Soluções Solução (def): é uma mistura homogênea de duas ou mais substâncias. Solvente: componente da solução do mesmo estado físico, por exemplo água numa solução aquosa. Soluto:
Propriedades Físicas das Soluções Solução (def): é uma mistura homogênea de duas ou mais substâncias. Solvente: componente da solução do mesmo estado físico, por exemplo água numa solução aquosa. Soluto:
PROCESSO DE FERMENTAÇÃO CONTÍNUA ENGENHO NOVO - FERCEN
 PROCESSO DE FERMENTAÇÃO CONTÍNUA ENGENHO NOVO - FERCEN A ENGENHO NOVO, sempre atenta ao desenvolvimento de novas tecnologias para produção de etanol, pesquisou e desenvolveu um processo simples e eficiente
PROCESSO DE FERMENTAÇÃO CONTÍNUA ENGENHO NOVO - FERCEN A ENGENHO NOVO, sempre atenta ao desenvolvimento de novas tecnologias para produção de etanol, pesquisou e desenvolveu um processo simples e eficiente
TROCA E TRANSPORTE DE GASES
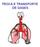 TROCA E TRANSPORTE DE GASES Difusão dos gases através da membrana respiratória Unidade Respiratória Cada alvéolo: 0,2 mm Parede Unidade respiratória: delgada Capilares Membrana Respiratória ou Membrana
TROCA E TRANSPORTE DE GASES Difusão dos gases através da membrana respiratória Unidade Respiratória Cada alvéolo: 0,2 mm Parede Unidade respiratória: delgada Capilares Membrana Respiratória ou Membrana
Cotagem de dimensões básicas
 Cotagem de dimensões básicas Introdução Observe as vistas ortográficas a seguir. Com toda certeza, você já sabe interpretar as formas da peça representada neste desenho. E, você já deve ser capaz de imaginar
Cotagem de dimensões básicas Introdução Observe as vistas ortográficas a seguir. Com toda certeza, você já sabe interpretar as formas da peça representada neste desenho. E, você já deve ser capaz de imaginar
Determinação de Massas Moleculares de Polímeros
 Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
16/04/2015. Aldeídos, cetonas, ácidos, alcoóis e peróxidos.
 Causas da degradação de lipídeos: oxidação, hidrólise, pirólise e absorção de sabores e odores estranhos. Profa: Nádia Fátima Gibrim A oxidação é a principal causa de deterioração e altera diversas propriedades:
Causas da degradação de lipídeos: oxidação, hidrólise, pirólise e absorção de sabores e odores estranhos. Profa: Nádia Fátima Gibrim A oxidação é a principal causa de deterioração e altera diversas propriedades:
MODIFICADORES DE REOLOGIA:
 MODIFICADORES DE REOLOGIA: Os modificadores de reologia ACUSOL oferecem uma série de características e benefícios em produtos saneantes domésticos e institucionais. CARACTERÍSTICAS E BENEFÍCIOS: Concedem
MODIFICADORES DE REOLOGIA: Os modificadores de reologia ACUSOL oferecem uma série de características e benefícios em produtos saneantes domésticos e institucionais. CARACTERÍSTICAS E BENEFÍCIOS: Concedem
HIPEX SECANT Abrilhantador Secante para Louças
 Página 1 de 5 FICHA DE INFORMAÇÃO DE SEGURANÇA DE PRODUTOS QUÍMICOS HIPEX SECANT Abrilhantador Secante para Louças 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Produto: Nome Comercial: Empresa: Abrilhantador
Página 1 de 5 FICHA DE INFORMAÇÃO DE SEGURANÇA DE PRODUTOS QUÍMICOS HIPEX SECANT Abrilhantador Secante para Louças 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Produto: Nome Comercial: Empresa: Abrilhantador
Reações químicas- 8ºano. Reações de precipitação
 Reações químicas- 8ºano Reações de precipitação Reações de precipitação Os sais e a sua solubilidade em água Sais Copiar para o caderno Muito solúveis Pouco solúveis e mesmo insolúveis São sais que se
Reações químicas- 8ºano Reações de precipitação Reações de precipitação Os sais e a sua solubilidade em água Sais Copiar para o caderno Muito solúveis Pouco solúveis e mesmo insolúveis São sais que se
Mudanças de fase. Temperatura e pressão críticas Os gases são liquefeitos sob o aumento da pressão a uma temperatura.
 Mudanças de fase Sublimação: sólido gás. Vaporização: líquido gás. Derretimento ou fusão: sólido líquido. Deposição: gás sólido. Condensação: gás líquido. Congelamento: líquido sólido. Mudanças de fase
Mudanças de fase Sublimação: sólido gás. Vaporização: líquido gás. Derretimento ou fusão: sólido líquido. Deposição: gás sólido. Condensação: gás líquido. Congelamento: líquido sólido. Mudanças de fase
FICHA DE INFORMAÇÕES DE SEGURANÇA DE PRODUTO QUÍMICO FISPQ PRODUTO: ÓLEO DE SILICONE ÓLEO DE SILICONE. Química Credie Ltda.
 1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA: Nome do Produto: Código Interno de Identificação do Produto: 81-200 ÓLEO DE SILICONE Nome da Empresa: Endereço: Química Credie Ltda. Av. Torquatro Tapajós, 8137-Km08-
1. IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA: Nome do Produto: Código Interno de Identificação do Produto: 81-200 ÓLEO DE SILICONE Nome da Empresa: Endereço: Química Credie Ltda. Av. Torquatro Tapajós, 8137-Km08-
Qual é o objeto de estudo da Fisiologia Humana? Por que a Fisiologia Humana é ensinada em um curso de licenciatura em Educação Física?
 Fisiologia Humana QUESTÕES INICIAIS 1 2 3 Qual é o objeto de estudo da Fisiologia Humana? Por que a Fisiologia Humana é ensinada em um curso de licenciatura em Educação Física? Qual a importância dos conhecimentos
Fisiologia Humana QUESTÕES INICIAIS 1 2 3 Qual é o objeto de estudo da Fisiologia Humana? Por que a Fisiologia Humana é ensinada em um curso de licenciatura em Educação Física? Qual a importância dos conhecimentos
As propriedades coligativas não dependem da natureza química do soluto, mas apenas do número de partículas do soluto presente em relação ao total.
 ula: 17 Temática: Propriedades Coligativas das Soluções s propriedades coligativas não dependem da natureza química do soluto, mas apenas do número de partículas do soluto presente em relação ao total.
ula: 17 Temática: Propriedades Coligativas das Soluções s propriedades coligativas não dependem da natureza química do soluto, mas apenas do número de partículas do soluto presente em relação ao total.
SISTEMAS DISPERSOS SOLUÇÕES COLÓIDES SUSPENSÕES
 SISTEMAS DISPERSOS SOLUÇÕES COLÓIDES SUSPENSÕES PROPRIEDADES DA MATÉRIA 1 - GERAIS: inerentes à toda matéria. São: massa, extensão, impenetrabilidade, divisibilidade, compressibilidade e elasticidade.
SISTEMAS DISPERSOS SOLUÇÕES COLÓIDES SUSPENSÕES PROPRIEDADES DA MATÉRIA 1 - GERAIS: inerentes à toda matéria. São: massa, extensão, impenetrabilidade, divisibilidade, compressibilidade e elasticidade.
Propriedades Coligativas Aula 3
 Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
Soluções I e II. Soluções I e II Monitor: Gabriel dos Passos 28 e 29/05/2014. Material de apoio para Monitoria. 1. O que é uma solução?
 1. O que é uma solução? 2. Como podemos classificar as soluções? 3. O que você entende por concentração comum? 4. O que você entende por molaridade? 5. O que você entende por título percentual? 6. O que
1. O que é uma solução? 2. Como podemos classificar as soluções? 3. O que você entende por concentração comum? 4. O que você entende por molaridade? 5. O que você entende por título percentual? 6. O que
Comércio de Produtos Químicos
 FICHA DE SEGURANÇA DE PRODUTOS QUÍMICOS 1. Identificação do Produto: Descrição genérica: Forma física: Cor: Odor: Silicone Líquido Incolor Odor característico 2. Componentes perigosos: Nenhum. Este Material
FICHA DE SEGURANÇA DE PRODUTOS QUÍMICOS 1. Identificação do Produto: Descrição genérica: Forma física: Cor: Odor: Silicone Líquido Incolor Odor característico 2. Componentes perigosos: Nenhum. Este Material
QUÍMICA. Resolução: a) CH 4 b) Ligações de Hidrogênio. c) 3,3 10 16 L
 QUÍMICA ª QUESTÃO O aquecimento global é o aumento da temperatura terrestre e tem preocupado a comunidade científica cada vez mais. Acredita-se que seja devido ao uso de combustíveis fósseis e outros processos
QUÍMICA ª QUESTÃO O aquecimento global é o aumento da temperatura terrestre e tem preocupado a comunidade científica cada vez mais. Acredita-se que seja devido ao uso de combustíveis fósseis e outros processos
Balanço de Massa e Energia Aula 5
 Balanço de Massa e Energia Aula 5 Solubilidade, Saturação e Cristalização. Solubilidade: A solubilidade de um sólido (soluto) em uma solução é a quantidade máxima desta substância que pode ser dissolvida
Balanço de Massa e Energia Aula 5 Solubilidade, Saturação e Cristalização. Solubilidade: A solubilidade de um sólido (soluto) em uma solução é a quantidade máxima desta substância que pode ser dissolvida
Magnésia Bisurada carbonato de magnésio carbonato básico de bismuto carbonato de cálcio bicarbonato de sódio
 Magnésia Bisurada carbonato de magnésio carbonato básico de bismuto carbonato de cálcio bicarbonato de sódio IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Magnésia Bisurada Nome genérico: carbonato de magnésio,
Magnésia Bisurada carbonato de magnésio carbonato básico de bismuto carbonato de cálcio bicarbonato de sódio IDENTIFICAÇÃO DO MEDICAMENTO Nome comercial: Magnésia Bisurada Nome genérico: carbonato de magnésio,
Sumário. Prefácio...13
 Sumário Prefácio...13 Capítulo 1 Operações com Grandezas e Unidades de Medida...15 Objetivos...15 1.1 Notação científica...16 1.2 Exponenciais e logaritmos...17 1.3 Grandezas físicas e unidades de medida:
Sumário Prefácio...13 Capítulo 1 Operações com Grandezas e Unidades de Medida...15 Objetivos...15 1.1 Notação científica...16 1.2 Exponenciais e logaritmos...17 1.3 Grandezas físicas e unidades de medida:
Silimalon (slimarina + metionina)
 Silimalon (slimarina + metionina) Zydus Nikkho Farmacêutica Ltda Drágeas 70 mg / 100 mg Bula do Paciente Silimalon drágea- Versão 01 11/2010- paciente Página 1 I - IDENTIFICAÇÃO DO MEDICAMENTO SILIMALON
Silimalon (slimarina + metionina) Zydus Nikkho Farmacêutica Ltda Drágeas 70 mg / 100 mg Bula do Paciente Silimalon drágea- Versão 01 11/2010- paciente Página 1 I - IDENTIFICAÇÃO DO MEDICAMENTO SILIMALON
GOVERNO DO ESTADO DE MATO GROSSO DO SUL SECRETARIA DE ESTADO DE EDUCAÇÃO
 Conteúdos curriculares de química: 2. ano - 1. bimestre: Dispersões (definição, classificação, características); Soluções (conceito e regra da solubilidade, curva de solubilidade, classificação); Concentração
Conteúdos curriculares de química: 2. ano - 1. bimestre: Dispersões (definição, classificação, características); Soluções (conceito e regra da solubilidade, curva de solubilidade, classificação); Concentração
CPV o cursinho que mais aprova na fgv Fgv - 05/12/2004
 37 QUÍMICA 31. s irradiadores de alimentos representam hoje uma opção interessante na sua preservação. alimento irradiado, ao contrário do que se imagina, não se torna radioativo, uma vez que a radiação
37 QUÍMICA 31. s irradiadores de alimentos representam hoje uma opção interessante na sua preservação. alimento irradiado, ao contrário do que se imagina, não se torna radioativo, uma vez que a radiação
Claudi Cândia /Sara Regina. Aluno(a): PROVA COMENTADA
 QUÍMICA AVALIAÇÃO Claudi Cândia /Sara Regina Aluno(a): PROVA COMENTADA III UNIDADE Nota: Série: 2 a Ensino Médio Turma: A / B / C / D Data: 14/08/2015 1. A prova é composta de 07 questões abertas e 03
QUÍMICA AVALIAÇÃO Claudi Cândia /Sara Regina Aluno(a): PROVA COMENTADA III UNIDADE Nota: Série: 2 a Ensino Médio Turma: A / B / C / D Data: 14/08/2015 1. A prova é composta de 07 questões abertas e 03
Tabela 1 - conteúdo de umidade em alguns alimentos:
 UMIDADE EM ALIMENTOS Umidade, ou teor de água, de um alimento constitui-se em um dos mais importantes e mais avaliados índices em alimentos. É de grande importância econômica por refletir o teor de sólidos
UMIDADE EM ALIMENTOS Umidade, ou teor de água, de um alimento constitui-se em um dos mais importantes e mais avaliados índices em alimentos. É de grande importância econômica por refletir o teor de sólidos
Produção de Extratos Vegetais
 Produção de Extratos Vegetais Coleta Preparação do Material Vegetal Secagem e Estabilização Moagem Extração Métodos a quente e/ou frio Concentração dos Extratos Fracionamento dos Extratos Solventes (Partição
Produção de Extratos Vegetais Coleta Preparação do Material Vegetal Secagem e Estabilização Moagem Extração Métodos a quente e/ou frio Concentração dos Extratos Fracionamento dos Extratos Solventes (Partição
Química 12º Ano. Unidade 2 Combustíveis, Energia e Ambiente. Actividades de Projecto Laboratorial. Janeiro 2005. Jorge R. Frade, Ana Teresa Paiva
 Efeitos da composição em temperaturas de fusão e de ebulição Química 12º Ano Unidade 2 Combustíveis, Energia e Ambiente Actividades de Projecto Laboratorial Janeiro 2005 Jorge R. Frade, Ana Teresa Paiva
Efeitos da composição em temperaturas de fusão e de ebulição Química 12º Ano Unidade 2 Combustíveis, Energia e Ambiente Actividades de Projecto Laboratorial Janeiro 2005 Jorge R. Frade, Ana Teresa Paiva
MEMBRANA PLASMÁTICA. Modelo do mosaico fluido caráter dinâmico à estrutura da membrana (as proteínas estão em constante deslocamento lateral)
 MEMBRANA PLASMÁTICA Modelo do mosaico fluido caráter dinâmico à estrutura da membrana (as proteínas estão em constante deslocamento lateral) ESTRUTURA DA MEMBRANA Formada por fosfolipídios e (nas animais
MEMBRANA PLASMÁTICA Modelo do mosaico fluido caráter dinâmico à estrutura da membrana (as proteínas estão em constante deslocamento lateral) ESTRUTURA DA MEMBRANA Formada por fosfolipídios e (nas animais
PROVA DESAFIO EM QUÍMICA 04/10/14
 PROVA DESAFIO EM QUÍMICA 04/10/14 Nome: Nº de Inscrição: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas as questões.
PROVA DESAFIO EM QUÍMICA 04/10/14 Nome: Nº de Inscrição: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPORTANTE: 1) Explique e justifique a resolução de todas as questões.
Fisiologia Vegetal 1. A ÁGUA NA VIDA DAS PLANTAS:
 Fisiologia Vegetal 1. A ÁGUA NA VIDA DAS PLANTAS: Papel fundamental na vida da planta para cada grama de matéria orgânica produzida, 500 g de água são absorvidas pelas raízes, transportadas pelo corpo
Fisiologia Vegetal 1. A ÁGUA NA VIDA DAS PLANTAS: Papel fundamental na vida da planta para cada grama de matéria orgânica produzida, 500 g de água são absorvidas pelas raízes, transportadas pelo corpo
Resoluções das Atividades
 Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
Resoluções das Atividades Sumário Módulo 1 Estudo das dispersões Definição, classificação, estudo dos coloides, coeficiente de solubilidade... 1 Módulo 2 Concentração de soluções... 3 Módulo 3 Propriedades
ENERGIA DO HIDROGÊNIO - Célula de Combustível Alcalina
 Universidade Federal do Pará Instituto de Tecnologia Programa de Pós Graduação em Engenharia Elétrica PPGEE0030 - INTRODUÇÃO ÀS ENERGIAS RENOVÁVEIS Docente: Professor Doutor João Tavares Pinho Discente:
Universidade Federal do Pará Instituto de Tecnologia Programa de Pós Graduação em Engenharia Elétrica PPGEE0030 - INTRODUÇÃO ÀS ENERGIAS RENOVÁVEIS Docente: Professor Doutor João Tavares Pinho Discente:
P R O V A D E Q UÍMICA I. A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes.
 17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
17 P R O V A D E Q UÍMICA I QUESTÃO 46 A tabela abaixo apresenta os pontos de ebulição e a solubilidade em água de alguns álcoois e éteres importantes. Composto Pe ( o C) Solubilidade em água CH 3 CH 2
HIPEX FRIGOLAT 200 Detergente Alcalino Desincrustante
 Página 1 de 6 FICHA DE INFORMAÇÃO DE SEGURANÇA DE PRODUTOS QUÍMICOS HIPEX FRIGOLAT 200 Detergente Alcalino Desincrustante 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Produto: Detergente Alcalino Desincrustante
Página 1 de 6 FICHA DE INFORMAÇÃO DE SEGURANÇA DE PRODUTOS QUÍMICOS HIPEX FRIGOLAT 200 Detergente Alcalino Desincrustante 1 - IDENTIFICAÇÃO DO PRODUTO E DA EMPRESA Produto: Detergente Alcalino Desincrustante
Sistema Respiratório Introdução
 Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
BASES MACROMOLECULARES DA CONSTITUIÇÃO CELULAR
 BASES MACROMOLECULARES DA CONSTITUIÇÃO CELULAR As moléculas que constituem as células são formadas pelos mesmos átomos encontrados nos seres inanimados. Todavia, na origem e evolução das células, alguns
BASES MACROMOLECULARES DA CONSTITUIÇÃO CELULAR As moléculas que constituem as células são formadas pelos mesmos átomos encontrados nos seres inanimados. Todavia, na origem e evolução das células, alguns
RECOMENDAÇÕES PARA REALIZAÇÃO DE ENSAIOS DE DISSOLUÇÃO PARA FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA (FFSOLI)
 RECOMENDAÇÕES PARA REALIZAÇÃO DE ENSAIOS DE DISSOLUÇÃO PARA FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA (FFSOLI) 1. Introdução O objetivo desta recomendação é fornecer orientações gerais para
RECOMENDAÇÕES PARA REALIZAÇÃO DE ENSAIOS DE DISSOLUÇÃO PARA FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA (FFSOLI) 1. Introdução O objetivo desta recomendação é fornecer orientações gerais para
Processo Seletivo/UFU - Janeiro 2004-2ª Prova Comum - PROVA TIPO 1 QUÍMICA QUESTÃO 32
 QUÍMICA QUESTÃO 31 Considerando a Tabela Periódica e as propriedades dos elementos químicos, assinale a alternativa correta A) Um metal é uma substância dúctil e maleável que conduz calor e corrente elétrica
QUÍMICA QUESTÃO 31 Considerando a Tabela Periódica e as propriedades dos elementos químicos, assinale a alternativa correta A) Um metal é uma substância dúctil e maleável que conduz calor e corrente elétrica
EXERCÍCIOS ON LINE DE CIÊNCIAS - 9 ANO
 EXERCÍCIOS ON LINE DE CIÊNCIAS - 9 ANO 1- Com a finalidade de diminuir a dependência de energia elétrica fornecida pelas usinas hidroelétricas no Brasil, têm surgido experiências bem sucedidas no uso de
EXERCÍCIOS ON LINE DE CIÊNCIAS - 9 ANO 1- Com a finalidade de diminuir a dependência de energia elétrica fornecida pelas usinas hidroelétricas no Brasil, têm surgido experiências bem sucedidas no uso de
24.1011 Sabão em Pasta Atol. Barra 1. IDENTIFICAÇÃO 2. IDENTIFICAÇÃO DE PERIGOS. Ficha de Informações de Segurança de Produtos Químicos FISPQ
 Página 1 de 7 Ficha de Informações de Segurança de Produtos Químicos FISPQ 1. IDENTIFICAÇÃO 1.1. Nome do Barra 1.2. Código interno: 24.1011 Sabão em Pasta 1.3. Aplicação: Produto destinado à lavagem de
Página 1 de 7 Ficha de Informações de Segurança de Produtos Químicos FISPQ 1. IDENTIFICAÇÃO 1.1. Nome do Barra 1.2. Código interno: 24.1011 Sabão em Pasta 1.3. Aplicação: Produto destinado à lavagem de
2) Uma solução de 5,00 g de ácido acético, CH 3 COOH, em 100 g de benzeno congela a 3,37
 Química Geral e Experimental II Soluções e propriedades coligativas Resolução comentada de exercícios selecionados versão colig_v3_2005 Prof. Fabricio R. Sensato 1) Qual o ponto de ebulição de uma solução
Química Geral e Experimental II Soluções e propriedades coligativas Resolução comentada de exercícios selecionados versão colig_v3_2005 Prof. Fabricio R. Sensato 1) Qual o ponto de ebulição de uma solução
UFMG - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2003 3º DIA QUÍMICA BERNULLI CLÉGI E PRÉ-VESTIBULAR Química Questão 01 A glicose, C 6 6, é uma das fontes de energia mais importantes para os organismos vivos. A levedura, por exemplo, responsável
UFMG - 2003 3º DIA QUÍMICA BERNULLI CLÉGI E PRÉ-VESTIBULAR Química Questão 01 A glicose, C 6 6, é uma das fontes de energia mais importantes para os organismos vivos. A levedura, por exemplo, responsável
Os lipídeos se encontram distribuídos em todos os tecidos, principalmente nas membranas celulares.
 LIPÍDEOS Os lipídeos se encontram distribuídos em todos os tecidos, principalmente nas membranas celulares. Por convenção (Congresso Internacional de Bioquímica em 1922) ésteres de ácidos graxos, ou seja,
LIPÍDEOS Os lipídeos se encontram distribuídos em todos os tecidos, principalmente nas membranas celulares. Por convenção (Congresso Internacional de Bioquímica em 1922) ésteres de ácidos graxos, ou seja,
ULTRA-SOM NA PRESERVAÇÃO E PROCESSAMENTO DOS ALIMENTOS
 Escola Superior Agrária de Coimbra Licenciatura em Engenharia Alimentar Processamento Geral dos Alimentos ULTRA-SOM NA PRESERVAÇÃO E PROCESSAMENTO DOS ALIMENTOS Ricardo Aranha 20703040 Ana Ferreira 20803028
Escola Superior Agrária de Coimbra Licenciatura em Engenharia Alimentar Processamento Geral dos Alimentos ULTRA-SOM NA PRESERVAÇÃO E PROCESSAMENTO DOS ALIMENTOS Ricardo Aranha 20703040 Ana Ferreira 20803028
Escola:. Nome dos alunos:
 Pergunta 1 2 3 4 5 6 7 Total lassificação 13 Março 2010 (Semifinal) Escola:. Nome dos alunos:... A divulgação das equipas apuradas para a final das limpíadas de Química + é sempre o ponto alto da Semi-final
Pergunta 1 2 3 4 5 6 7 Total lassificação 13 Março 2010 (Semifinal) Escola:. Nome dos alunos:... A divulgação das equipas apuradas para a final das limpíadas de Química + é sempre o ponto alto da Semi-final
QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS
 QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS 800 pressão de vapor de água (mmhg) 760 700 600 500 400 300 200 100 líquido benzeno puro benzeno + soluto p vapor p.e. do benzeno puro t p.e. do
QUÍMICA - 3 o ANO MÓDULO 27 PROPRIEDADES COLIGATIVAS 800 pressão de vapor de água (mmhg) 760 700 600 500 400 300 200 100 líquido benzeno puro benzeno + soluto p vapor p.e. do benzeno puro t p.e. do
DRÁGEAS COMPRIMIDOS REVESTIDOS
 FORMAS FARMACÊUTICAS REVESTIDAS DRÁGEAS COMPRIMIDOS REVESTIDOS OBJETIVOS DA AULA Definir Formas Farmacêuticas Revestidas (FFR) e apresentar seus diferentes tipos. Apresentar os critérios Biofarmacotécnicos
FORMAS FARMACÊUTICAS REVESTIDAS DRÁGEAS COMPRIMIDOS REVESTIDOS OBJETIVOS DA AULA Definir Formas Farmacêuticas Revestidas (FFR) e apresentar seus diferentes tipos. Apresentar os critérios Biofarmacotécnicos
CPV O cursinho que mais aprova na fgv
 QUÍMIA O cursinho que mais aprova na fgv FGV economia 1 a Fase 30/novembro/2008 106. Na figura, é representado o espectro de massa dos isótopos naturais do elemento gálio. 107. O gráfico mostra a radioatividade
QUÍMIA O cursinho que mais aprova na fgv FGV economia 1 a Fase 30/novembro/2008 106. Na figura, é representado o espectro de massa dos isótopos naturais do elemento gálio. 107. O gráfico mostra a radioatividade
Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.
 Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Misturas - soluções A grande maioria dos sistemas encontrados
Disciplina de Físico Química I - Tipos de Soluções Propriedades Coligativas. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Misturas - soluções A grande maioria dos sistemas encontrados
