ANÁLISE TERMODINÂMICA DA FORMAÇÃO DE HIDRATOS DE GÁS METANO SOB AÇÃO DE INIBIDORES SALINOS
|
|
|
- Rosângela Andrade
- 5 Há anos
- Visualizações:
Transcrição
1 ANÁLISE TERMODINÂMICA DA FORMAÇÃO DE HIDRATOS DE GÁS METANO SOB AÇÃO DE INIBIDORES SALINOS Maryana Braga Batalha Souza - Universidade Federal Fluminense maryana@metal.eeimvr.uff.br Mabelle Biancardi Oliveira - Universidade Federal Fluminense mabelle@metal.eeimvr.uff.br José Adilson de Castro - Universidade Federal Fluminense adilson@metal.eeimvr.uff.br Alexandre José da Silva - Universidade Federal Fluminense ajs@metal.eeimvr.uff.br Luciano Fernando dos Santos Rossi - Universidade Tecnológica Federal do Paraná lfrossi@utfpr.edu.br Resumo: Hidratos gasosos são estruturas sólidas que podem se formar quando há água na presença de gases de baixo peso molecular e/ou hidrocarbonetos de cadeias curtas, sob determinadas condições de pressão e temperatura, que se formam no interior das tubulações de óleo, causando obstruções. O presente estudo visa à formulação de uma abordagem termodinâmica do processo de formação de hidratos em linhas de transporte de gás natural através do equacionamento do equilíbrio entre a fase hidrato e a fase líquida. O equilíbrio é resolvido numericamente, onde se determina as pressões em equilíbrio com as temperaturas de dissociação dos hidratos. A influência de adição dos inibidores salino NaCl, NaCl+CaCl 2 e NaCl+KCl no sistema é investigado comparando com o sistema sem inibição. O agente inibidor é agregado ao sistema, com o objetivo de reduzir o potencial químico da água, reduzindo assim a sua tendência à mudança de fase. Os resultados mostram que a curva de equilíbrio é deslocada, tendo para uma mesma temperatura uma pressão de equilíbrio mais elevada, o que determina uma menor tendência de formação dos hidratos de gás nas condições usuais de extração de petróleo. Como resultado deste estudo visa-se determinar condições seguras de operação nas tubulações e possíveis remediações. Palavras-chave: Hidratos, Equilíbrio químico, Termodinâmica. THERMODYNAMIC ANALYSIS OF THE FORMATION OF METHANE HYDRATES UNDER THE ACTION OF INHIBITORS SALINE Abstract: Gas hydrates are solid structures that can form when there is water in the presence of low molecular weight gases and short chains hydrocarbons under certain condicition of pressure and temperature, which are formed within the oil pipeline, causing blockages. The present study aims to formulate a thermodynamic approachthe process of hydrate formation in transportation lines of natural gas through the solution of the equilibrium between the hydrate phase and liquid phase. The equilibrium is solved numerically, which determines the pressure in equilibrium with the temperature of dissociation of hydrates. The influence os addition of inhibitor saline in the system is investigated by comparing with system without inhibition. The inhibiting agent is added to the system, in order to reduce the chemical potential of water, thereby reducing its tendency to phase change. The results show that the equilibrium curve is shifted, and the same temperature for a higher equilibrium pressure, which determines a lower tendency of formation of gas hydrate under ordinary conditions of oil extraction. As a result of this study aims to determine safe operating conditions in the pipes and possible remedies. Keywords: Hydrates, Chemical equilibrium, Thermodynamic. 1. INTRODUÇÃO Ao longo dos anos, fontes energéticas alternativas têm ocupando um grande espaço no crescimento tecnológico, porém, apesar das especulações sobre o fim da utilização dos combustíveis fósseis, o petróleo e o gás natural ainda correspondem por uma grande porcentagem energética mundial e nacional. Dentre as atuais fronteiras tecnológicas da indústria petrolífera, está à exploração e produção de petróleo em águas profundas e ultraprofundas. No Brasil, a busca por petróleo em grandes profundidades de lâmina d água deu um importante passo em 1986, quando foi lançado o Programa de Desenvolvimento Tecnológico de Sistemas de Produção em Águas Profundas PROCAD, pela Petrobras, com o objetivo de viabilizar a produção em lâminas de água com profundidade de até 1000 m. À medida que se aumenta a espessura da lâmina de água na qual V. 4, N o. 1, Abr/2012 Página 1
2 as atividades de perfuração e produção são realizadas, surgem novas complicações operacionais que podem vir a comprometer a segurança do poço e a eficiência da operação (Baptista 2007) devido à formação dos hidratos de gás. Os hidratos são compostos cristalinos com a aparência do gelo, onde dois ou mais componentes são associados sem ligação química ordinária. Essa associação ocorre por meio de um completo encapsulamento de um tipo de molécula por outra molécula (Powell 1948). Segundo Santos (2006), a formação de hidratos pode causar os seguintes problemas: (a) entupimento das choke lines e das kill lines (tubulações de acesso secundário ao poço); (b) obstrução do espaço anular (espaço existente entre a coluna de perfuração e a formação rochosa) abaixo do BOP (válvula para controle de erupções gasosas, explosões); (c) prisão da coluna de perfuração devido à formação de hidratos no riser (equipamento que conecta a cabeça do poço à plataforma), em frente ao BOP ou no revestimento; (d) dificuldade na abertura e no fechamento das gavetas do BOP. As situações acima implicam perda de produtividade, maior consumo energético, danos em equipamentos e comprometimento da segurança das atividades, obstrução de gasodutos, equipamentos de processamento de gás natural, linhas de surgência de poços e poços em perfuração. Além disso, muitas vezes é necessário interromper completamente as operações de perfuração para remoção de hidratos, o que pode significar grandes prejuízos. Assim, torna-se fundamental o conhecimento das corretas condições de temperatura e pressão para formação de hidratos sob a adição de inibidores tais como sais. Desta maneira, este trabalho propõe um estudo termodinâmico da formação de hidratos de gás, equacionando o equilíbrio entre a fase líquida e gasosa, sob a ação de inibidores salinos. 2. MATERIAIS E MÉTODOS Para analisar as condições de formação de hidrato, em sistemas que envolvem estruturas gasosas, do ponto de vista termodinâmico, o sistema apresenta três fases: Fase α: Está fase compreende a água livre do sistema, juntamente com os inibidores da formação de hidratos. A fase α pode encontrar-se em qualquer estado de agregação (sólido, líquido ou gasoso), porém neste trabalho a análise será feita para o caso em que essa fase é líquida. Fase H: Representa o retículo cristalino formado pelas moléculas de água. Fase gasosa (G): É nesta fase que as substâncias com possibilidades de serem ocluídas no retículo cristalino se encontram. No trabalho em questão, essa fase é formada pelas moléculas constituintes da mistura gasosa, no caso o metano FASE DO HIDRATO A fim de se obter condições de estado para a formação de hidratos de gás, é preciso, inicialmente, da igualdade do potencial químico da água na fase I e na fase H (Eq. 1). Essa equação demonstra que enquanto o potencial químico da água na fase α estiver maior que o potencial químico na fase H, haverá a formação de retículo cristalino de hidratos. (1) V. 4, N o. 1, Abr/2012 Página 2
3 O potencial químico representa a tendência de uma substância mudar de fase. Deste modo, é possível calcular cada termo da equação 1 para uma determinada pressão e temperatura. O potencial químico da água na fase I pode ser escrito da seguinte forma, adicionando a atividade da água (a w ): (2) A expressão do potencial químico da água na fase H é derivada da termodinâmica estatística (van der Waals e Plateeuw, 1959), onde θki representa a probabilidade de uma molécula i vir a ser ocluída numa cavidade do tipo k. (3) Onde R é a constante dos gases, T a temperatura e vi é o número de cavidades do tipo i por molécula de água no retículo cristalino. A probabilidade θki pode ser calculada da seguinte maneira: (4) Sendo C ki a constante de adsorção de Langmuir e f j é a fugacidade do componente na mistura gasosa. De posse das constantes de Langmuir e das fugacidades, pode-se obter o valor das probabilidades de oclusão dos compostos gasosos em qualquer temperatura e pressão. Aplicando-se a equação de Gibbs-Duhem, da termodinâmica clássica, para expressar a diferença de potenciais químicos entre as fases H e β pode-ser escrever a igualdade de potenciais químicos, da seguinte forma: (5) Onde: Δµ 0, ΔH 0, ΔV 0, são os valores das diferenças do potencial químico, entalpia molar e volume molar, respectivamente, entre a água no retículo cristalino vazio e em um estado de agregação puro (líquido ou sólido) à temperatura de 273,15K. Tais valores podem ser encontrados na Tabela 1. ΔC p é a capacidade calorífica, f α w é a fugacidade da água na fase α, f 0 w é a fugacidade da água em um estado de agregação puro, v i é o número de cavidades do tipo i por molécula de água no retículo cristalino, θ ki é a probabilidade de um elemento i vir a ser ocluído em uma cavidade k, é a temperatura média entre a temperatura T e a temperatura de referência da água, T0, e R é a constante universal dos gases. V. 4, N o. 1, Abr/2012 Página 3
4 Tabela 1: Constante física usada na equação5 (Munk et al.) Propriedade Unidades Estrutura I Estrutura II (liq) Δμ 0 J/mol (liq) ΔH 0 (gelo) ΔH 0 (liq) ΔV 0 (gelo) ΔV 0 (liq) ΔC p J/mol J/mol cm3/mol 4,6 5 cm3/mol 3,0 3,4 J/mol K 39,16 39,16 A Eq. 5 é implícita na pressão, o que exige um processo iterativo de cálculo. Para cada valor de temperatura pode-se encontrar um valor de equilíbrio para a pressão. Esse par de temperatura e pressão indicam as condições de estado para a formação de hidratos, para uma determinada mistura gasosa com uma determinada concentração. Para a Eq. 7 utilizou-se o método numérico da bisseção, conforme Ruggiero (1996). O cálculo das probabilidades de oclusão dos elementos da fase gasosa depende de dois parâmetros e é função da fugacidade dos componentes da mistura gasosa, e das constantes adsorvidas de Langmuir dos elementos que compõem a mistura gasosa (Conforme Munck et al., 1988) CÁLCULO DAS PROBABILIDADES DE OCLUSÃO DOS ELEMENTOS DA FASE GASOSA O cálculo das probabilidades de oclusão dos elementos da fase gasosa depende de dois parâmetros e é função da fugacidade dos componentes da mistura gasosa, e das constantes adsorvidas de Langmuir dos elementos que compõem a mistura gasosa (Conforme Munck et al., 1988). Cálculo da fugacidade Para o cálculo da fugacidade do gás na mistura gasosa, foi utilizado a relação P-V-T de Peng-Robinson, que é uma equação de estado semi-empírica. Essa relação, pode ser escrita como uma equação cúbica da fator de compressibilidade, Z: (6) Os parâmetros A e B para cada componente são calculados segundo as equações abaixo: (7) V. 4, N o. 1, Abr/2012 Página 4 (8)
5 De posse de todos os dados, é possível obter o coeficiente de fugacidade para cada componente existente na formação dos hidratos de gás, conforme a equação: ' A ' ' Z A B i exp ln Z B Z 1 Bi i i ln 1,5 5 2 B Z sendo A i e B i definidos pelas equações a seguir: 0, a a k 1 5 ' N Ai 2ai yi i j 1 a i ij 0,5 2 1B 0, 2 1 B b B ' i i b (11) (9) (10) Pode-se assim calcular a fugacidade para cada componente i da mistura, portanto as fugacidades dos elementos da mistura gasosa são obtidas pela Equação (12). F y i i ' A ' ' Z Pexp lnz BZ 1B A B i i i ln 1,5 5 2 B Z 0,5 2 1B 0, 2 1 B (12) Cálculo das Constantes de Langmuir Para o cálculo do potencial químico da água na fase hidrato é necessário obter a constante de Langmuir do gás formador de hidrato, para isso o trabalho utilizou a equação proposta por Munck et al.(1988). C ki A T ki B exp T ki (13) Sendo Cki a constante de adsorção de Langmuir e A ki e B ki as constantes ajustadas empiricamente para cada componente gasoso, em função da estrutura formada e do tamanho da cavidade ocupada, são apresentadas na Tabela 2. Tabela 2 - Parâmetros A e B para o cálculo da constante de Langmuir (Munk et al.) Cavidade Pequena Cavidade Grande Gás Estrutura A x 103 (K/atm) B (K) A x 103 (K/atm) B (K) C1 1 0, , , , V. 4, N o. 1, Abr/2012 Página 5
6 2.3. CÁLCULO DA ATIVIDADE DA ÁGUA Em relação ao cálculo da atividade da água, é preciso considerar duas situações distintas: sem a adição de inibidores de formação de hidratos, e com a adição de inibidores de hidratos. Quando não ocorre a adição de inibidores, assumi-se que o sistema não há qualquer componente solúvel, a fase α pode ser considerada como composta somente de água. Assim, a atividade assume um valor unitário. Com a adição de inibidores, a água forma uma mistura com o inibidor, o que exige que o desenvolvimento do cálculo da atividade da água seja apropriado. Desta forma, a atividade da água pode ser escrita, com a introdução do coeficiente de atividade, como: (14) Onde: x i é a fração molar de água na mistura líquida e γ i é o coeficiente de atividade da água nessa mistura. Para o cálculo do coeficiente de atividade da água, é preciso considerar a natureza do inibidor adicionado à fase líquida, sal ou álcool. Neste trabalho, a metodologia de cálculo será baseada em um sistema cujo inibidor utilizado será salino. Os cálculos serão apresentados a seguir. Para o desenvolvimento do cálculo da atividade da água na presença de sais, foi utilizado o modelo de Debye-Hückel, conforme Sander et al. (1986). A modelagem leva em consideração as interações de longa distância entre os íons devido a força eletrostática, sendo considerada apropriada para analisar a contribuição da adição de sais para a não-idealidade da fase líquida. Assim, de acordo com o modelo de Debye-Hückel, o coeficiente de atividade da água pode ser escrito da seguinte forma: (15) Onde: M w é a massa molecular da água, I é força iônica expressa pela Eq. (16), b é um parâmetro ajustável (neste trabalho assumiu-se um valor de 1,5[kg/mol] 1/2 ), e A é um parâmetro dependente da temperatura, da densidade e da constante do solvente, conforme Eq. (17). A força iônica é dada por: (16) Onde: mi é a molalidade o íon i e zi sua carga elétrica. O parâmetro A pode ser escrito da seguinte forma (conforme Parrish (1972)8): (17) V. 4, N o. 1, Abr/2012 Página 6
7 Onde: e é a carga de 1 elétron, ε 0 é a permissividade do vácuo, ε r é a constante dielétrica (nesse caso, da água), R é a constante universal dos gases, NA é a constante de Avogrado e ds é a densidade do solvente. 3. RESULTADOS E DISCUSSÃO Neste trabalho serão apresentados os resultados obtidos para a formação de hidratos a partir do gás metano. Sendo o metano uma molécula pequena, a estrutura formada para estes experimentos é a estrutura I. Foi feita uma análise da influência da adição de inibidores de formação de hidratos. Desta forma, foi realizado um levantamento das curvas P x T com diversas quantidades de sais. Os inibidores salinos estudados foram: cloreto de sódio (NaCl), cloreto de potássio (KCl) e cloreto de cálcio (CaCl 2 ). São apresentadas as Figura 1 a Figura 3, juntamente com dados experimentais, com o intuito de validar a modelagem aplicada. A Figura 1 apresenta as condições de estado para a formação de hidratos em um sistema contendo gás metano, água e cloreto de sódio. Esta apresenta as condições de equilíbrio, adicionando-se duas quantidades diferentes de cloreto de sódio (11,7% e 20,5%, em massa). Os dados experimentais foram obtidos de De Roo et al (1983). A Figura 2 e Figura 3 apresentam resultados obtidos para esse mesmo sistema, porém acrescido de cloreto de cálcio e cloreto de potássio, respectivamente. Para esses dois casos, os dados experimentais foram obtidos de Dholabhai et al. (1991). Observando-se as curvas de hidrato, pode-se notar que a sua formação inicia-se sobre a curva, onde acima dela está dentro da região onde o hidrato já se formou e abaixo está dentro da região onde o hidrato não se forma. Figura 1: Curva de Equilíbrio - Gás Metano - NaCl. V. 4, N o. 1, Abr/2012 Página 7
8 Figura 2: Curva de Equilíbrio - Gás Metano NaCl + CaCl 2. Figura 3: Curva de Equilíbrio - Gás Metano NaCl + KCl. Com a adição dos inibidores, pode-se notar que a curva de equilíbrio para o metano, em relação a todos os casos estudados, foi deslocada para esquerda. Isso ocorre porque o inibidor reduz o potencial químico da água, reduzindo a sua tendência à mudança de fase, dificultando assim a formação de hidrato. As curvas obtidas apresentaram uma boa concordância com os resultados experimentais, confirmando a confiabilidade do método de Debye-Huckel para descrever a não idealidade da água na presença de sais. Porém, pode-se notar que para maiores concentrações de inibidor o modelo passa a fornecer resultados de menor precisão. Isso ocorre devido ao fato que a modelagem ser feita para soluções diluídas. V. 4, N o. 1, Abr/2012 Página 8
9 Os resultados apresentados comprovam a eficiência dos sais como inibidores de formação de hidratos. Nota-se também que a presença de eletrólitos na fase líquida é bem descrita pelo modelo de Debye-Huckel. 4. CONCLUSÕES Nos resultados apresentados, notou-se a descrição da fase hidrato utilizando a abordagem termodinâmica estatística de van der Waals e Platteeuw, combinada com o modelo de Debye- Hückel (para sais), juntamente com a equação de Peng-Robinson para a fase gasosa, permitindo obter resultados satisfatórios. Foi desenvolvido e implementado computacionalmente um modelo termodinâmico para prever as condições de pressão e temperatura para a formação de hidratos. O modelo implementado também permite analisar a influência de inibidores termodinâmicos, tais como alcoóis. Houve uma boa concordância entre os resultados obtidos pela presente metodologia e os dados experimentais reportados na literatura, o que indica que a modelagem do equilíbrio de fases fornece uma representação adequada do fenômeno em questão. O método de Debye-Huckel permitiu obter predições confiáveis das pressões e das temperaturas de equilíbrio no caso da adição de inibidores salinos (eletrolíticos), o que é bastante interessante para a indústria petrolífera. Para o caso de operações em águas profundas (offshore), deseja-se aproveitar ao máximo o espaço disponível na plataforma, e assim, a grande vantagem dos sais é que esses podem ser armazenados em volumes muito menores que os que seriam necessários para estocar a mesma quantidade de álcool. Dessa forma, se ganha em espaço e segurança. Os inibidores salinos analisados para a formação de hidratos apresentaram grande poder de inibição. Entretanto, deve-se lembrar que em todos os casos analisados a mistura gasosa foi constituída, apenas, por metano. Embora o metano participe na composição de um gás natural típico, numa proporção superior a 85%, em média, existe a necessidade de se investigar a ação dos inibidores, principalmente os salinos, para misturas mais complexas de hidrocarbonetos. Neste trabalho, por dificuldade de obtenção de dados experimentais, para misturas mais complexas de hidrocarbonetos, analisou-se a formação de hidratos e a ação de inibidores, apenas para o metano. Levando em consideração que os sais, em relação aos álcoois, se tratando de inibidores, têm a vantagem de não serem inflamáveis nem agressivos ao meio ambiente. Porém, apresentam os seguintes inconvenientes: aceleraram processos de corrosão em equipamentos, possuem limite de solubilidade em água e afetam de forma significativa a densidade do fluido de perfuração. Contudo, tendo em vista que a adição de sais interfere muito na densidade do fluido de perfuração, pode ser necessário o uso combinado de inibidores salinos e alcoólicos para atingir uma inibição adequada sem alterar consideravelmente a densidade do fluido de perfuração. AGRADECIMENTOS Os autores agradecem a CAPES, CNPq e Faperj por incentivarem o desenvolvimento científico e tecnológico nacional. REFERÊNCIAS Baptista, J.M.M., Análise da Formação de Hidratos em Atividades de Perfuração de Campos Petrolíferos, Monografia do Projeto Final de Curso, UTFPR, Campos Curitiba, Brasil, V. 4, N o. 1, Abr/2012 Página 9
10 De Roo, J.L.; Petera, C.I.; Lichtenthaller, R.N. and Diepen, G.A.M., Occurrence of Methane Hydrate in saturated and Unsaturated Solutions of Water Independence of Temperature and Pressure AIChE J., 1983, Vol. 29, pp Dholabhai, P.D., Englezos, P., Kalogerakis, N. and Bishnoi, P.R., Equilibrium Conditions for Methane Hydrate Formation in Aqueous Electrolyte Solutions. Can. J. Chem. Eng., 1991, Vol. 69, pp Munck, J., Skjold Jorgensen, S. and Rasmussen, P., Computations of the Formation of Gas Hydrates. Chem. Eng. Sci., Great Britain, 1988, v. 43, p Parrish, W. R. and Prausnitz, J. M. Dissociation pressure of gas hydrates formed by gas mixtures. Industrial and Engineering Chemistry, 1972, Vol. 11, N0. 1, p. 26. Powell, H. M. The structure of molecular compounds. Part IV. Clathrate compounds. Journal of the chemical society, 1948, v. 61. Ruggiero, M. A. G. And Lopes, V. L. R. Cálculo numérico Aspectos teóricos e computacionais, São Paulo: Pearson Makron books, 1996, cap. 2, pp Sander, B.; Fredenslund, A. and Rasmussen, P., Calculation of Vapour-Liquid Equilibria in Mixed Solvent/Salt Systems Using an Extended UNIQUAC Equation. Chem. Eng. Sci., Great Britain, 1986, v. 41, pp Santos, O. L. A. Segurança de Poço em Lâminas de Água Ultraprofundas. Anais do I Encontro Nacional de Hidráulica de Perfuração e Completação de Poços de Petróleo e Gás, Domingos Martins - ES, 29/08 a 31/08 de Van der Waals, J. H. and Platteew, J.C., Clathrate Solutions. Adv. Chem. Phys. Netherlands, 1959, v. 2, pp. 1. V. 4, N o. 1, Abr/2012 Página 10
ESTUDO DA FORMAÇÃO DE HIDRATOS EM LINHAS DE ESCOAMENTO DE GÁS NATURAL
 ESTUDO DA FORMAÇÃO DE HIDRATOS EM LINHAS DE ESCOAMENTO DE GÁS NATURAL Kael Weingartner Chagas 1, Robson E. D. Araújo 2, Lindemberg J. N. Duarte 3 1 Universidade Federal do Rio Grande do Norte, Graduando
ESTUDO DA FORMAÇÃO DE HIDRATOS EM LINHAS DE ESCOAMENTO DE GÁS NATURAL Kael Weingartner Chagas 1, Robson E. D. Araújo 2, Lindemberg J. N. Duarte 3 1 Universidade Federal do Rio Grande do Norte, Graduando
CÁLCULO DA PRESSÃO DE DISSOCIAÇÃO DE HIDRATOS. INFLUÊNCIA DA EQUAÇÃO DE ESTADO, MÉTODO NUMÉRICO E ESTIMATIVA INICIAL
 CÁLCULO DA PRESSÃO DE DISSOCIAÇÃO DE HIDRATOS. INFLUÊNCIA DA EQUAÇÃO DE ESTADO, MÉTODO NUMÉRICO E ESTIMATIVA INICIAL Márcio Santos Souza Carôso 1 ; Glória Meyberg Nunes Costa 1 1 Universidade Federal da
CÁLCULO DA PRESSÃO DE DISSOCIAÇÃO DE HIDRATOS. INFLUÊNCIA DA EQUAÇÃO DE ESTADO, MÉTODO NUMÉRICO E ESTIMATIVA INICIAL Márcio Santos Souza Carôso 1 ; Glória Meyberg Nunes Costa 1 1 Universidade Federal da
CÁLCULO DA PRESSÃO DE DISSOCIAÇÃO DE HIDRATOS: ANÁLISE DE SENSIBLIDADE COM O MODELO PR-LCVM-UNIFAC
 CÁLCULO DA PRESSÃO DE DISSOCIAÇÃO DE HIDRATOS: ANÁLISE DE SENSIBLIDADE COM O MODELO PR-LCVM-UNIFAC 1 Igor Emanuel da Silva Lins; 1 Márcio Santos Souza Carôso; 2 Gloria Meyberg Nunes Costa; 2,3 Silvio Alexandre
CÁLCULO DA PRESSÃO DE DISSOCIAÇÃO DE HIDRATOS: ANÁLISE DE SENSIBLIDADE COM O MODELO PR-LCVM-UNIFAC 1 Igor Emanuel da Silva Lins; 1 Márcio Santos Souza Carôso; 2 Gloria Meyberg Nunes Costa; 2,3 Silvio Alexandre
ESTUDO DO EQUILÍBRIO DE FASES DE HIDRATOS COM FLUIDO DE PERFURAÇÃO BASE ÁGUA
 ESTUDO DO EQUILÍBRIO DE FASES DE HIDRATOS COM FLUIDO DE PERFURAÇÃO BASE ÁGUA Celina Kakitani, 2 Andressa P. Michael, 3 Luciano F. S. Rossi e 3 Rigoberto E. M. Morales Bolsista de Doutorado CAPES/UTFPR,
ESTUDO DO EQUILÍBRIO DE FASES DE HIDRATOS COM FLUIDO DE PERFURAÇÃO BASE ÁGUA Celina Kakitani, 2 Andressa P. Michael, 3 Luciano F. S. Rossi e 3 Rigoberto E. M. Morales Bolsista de Doutorado CAPES/UTFPR,
EQUILÍBRIO LÍQUIDO-VAPOR ISOBÁRICO E ISOTÉRMICO PARA O SISTEMA BINÁRIO ÁGUA (1) E MONOETILENOGLICOL (2)
 EQUILÍBRIO LÍQUIDO-VAPOR ISOBÁRICO E ISOTÉRMICO PARA O SISTEMA BINÁRIO ÁGUA (1) E MONOETILENOGLICOL (2) Cleitiane da Costa Nogueira 1, Ana Laura Oliveira de Sá Leitão 2, Patrícia Maria Rocha 3, Jéssyca
EQUILÍBRIO LÍQUIDO-VAPOR ISOBÁRICO E ISOTÉRMICO PARA O SISTEMA BINÁRIO ÁGUA (1) E MONOETILENOGLICOL (2) Cleitiane da Costa Nogueira 1, Ana Laura Oliveira de Sá Leitão 2, Patrícia Maria Rocha 3, Jéssyca
1. INTRODUÇÃO Equilíbrio Líquido-vapor. V. A. de ABREU 1, A. T. SANTOS 1, W. R. O. PIMENTEL 1 e A. K. BRAGA 1
 AVALIAÇÃO DO EQUILÍBRIO LÍQUIDO VAPOR DE UMA MISTURA DE ETANOL + TOLUENO À TEMPERATURA CONSTANTE UTILIZANDO SIMULAÇÃO NUMÉRICA EM MATLAB PARA MODELOS DE COMPOSIÇÕES LOCAIS V. A. de ABREU 1, A. T. SANTOS
AVALIAÇÃO DO EQUILÍBRIO LÍQUIDO VAPOR DE UMA MISTURA DE ETANOL + TOLUENO À TEMPERATURA CONSTANTE UTILIZANDO SIMULAÇÃO NUMÉRICA EM MATLAB PARA MODELOS DE COMPOSIÇÕES LOCAIS V. A. de ABREU 1, A. T. SANTOS
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Termodinâmica das Misturas Propriedades das Soluções Atividade
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
ANÁLISE DO PROCESSO DE PRODUÇÃO DE METANOL ATRAVÉS DAS CLÁSSICAS EQUAÇÕES DE ESTADO TERMODINÂMICAS
 ANÁLISE DO PROCESSO DE PRODUÇÃO DE METANOL ATRAVÉS DAS CLÁSSICAS EQUAÇÕES DE ESTADO TERMODINÂMICAS C. G. A. MISAEL 1, J.S.B.SANTOS 1, C. B. CAVALCANTI 1, H. BISPO 1 1 Universidade Federal de Campina Grande,
ANÁLISE DO PROCESSO DE PRODUÇÃO DE METANOL ATRAVÉS DAS CLÁSSICAS EQUAÇÕES DE ESTADO TERMODINÂMICAS C. G. A. MISAEL 1, J.S.B.SANTOS 1, C. B. CAVALCANTI 1, H. BISPO 1 1 Universidade Federal de Campina Grande,
Fonte: Netz e Ortega, 2002.
 1 Atividade A atividade é uma espécie de concentração efetiva. Para entender o que é uma concentração efetiva, podemos raciocinar do seguinte modo: As interações entre as moléculas em uma mistura fazem
1 Atividade A atividade é uma espécie de concentração efetiva. Para entender o que é uma concentração efetiva, podemos raciocinar do seguinte modo: As interações entre as moléculas em uma mistura fazem
ESTUDO E ANÁLISE DA MISTURA DE ÁGUA E ETANOL ATRAVÉS DE EQUAÇÕES DE ESTADO.
 ESTUDO E ANÁLISE DA MISTURA DE ÁGUA E ETANOL ATRAVÉS DE EQUAÇÕES DE ESTADO. S. F. VASCONCELOS 1, F. J. F. CHAVES 1, C. V. FERNANDES 1, N. SILVA 1, H. BISPO 1 1 Universidade Federal de Campina Grande, Unidade
ESTUDO E ANÁLISE DA MISTURA DE ÁGUA E ETANOL ATRAVÉS DE EQUAÇÕES DE ESTADO. S. F. VASCONCELOS 1, F. J. F. CHAVES 1, C. V. FERNANDES 1, N. SILVA 1, H. BISPO 1 1 Universidade Federal de Campina Grande, Unidade
EQUILÍBRIO SÓLIDO - LÍQUIDO NA DEPOSIÇÃO DE CERAS COM MODELO MULTISÓLIDO SOLID - LIQUID EQUILIBRIA IN WAX DEPOSITION WITH MODEL MULTISÓLID
 EQUILÍBRIO SÓLIDO - LÍQUIDO NA DEPOSIÇÃO DE CERAS COM MODELO MULTISÓLIDO SOLID - LIQUID EQUILIBRIA IN WAX DEPOSITION WITH MODEL MULTISÓLID Leandro Blass¹, Anderson Luís Jeske Bihain², Everson Jonatha Gomes
EQUILÍBRIO SÓLIDO - LÍQUIDO NA DEPOSIÇÃO DE CERAS COM MODELO MULTISÓLIDO SOLID - LIQUID EQUILIBRIA IN WAX DEPOSITION WITH MODEL MULTISÓLID Leandro Blass¹, Anderson Luís Jeske Bihain², Everson Jonatha Gomes
EQUILÍBRIO LÍQUIDO-VAPOR DE SISTEMA AQUOSO COM MONOETILENOGLICO À 650 mbar
 EQUILÍBRIO LÍQUIDO-VAPOR DE SISTEMA AQUOSO COM MONOETILENOGLICO À 650 mbar A. K. FERNANDES 1, D. J. SILVA 1, M. P. HENRIQUE 1 e O. CHIAVONE-FILHO 1 1 Universidade Federal do Rio Grande do Norte, Departamento
EQUILÍBRIO LÍQUIDO-VAPOR DE SISTEMA AQUOSO COM MONOETILENOGLICO À 650 mbar A. K. FERNANDES 1, D. J. SILVA 1, M. P. HENRIQUE 1 e O. CHIAVONE-FILHO 1 1 Universidade Federal do Rio Grande do Norte, Departamento
EQUILÍBRIO LÍQUIDO-VAPOR A ALTAS PRESSÕES DO SISTEMA DIÓXIDO DE CARBONO + ANETOL: DADOS EXPERIMENTAIS E MODELAGEM MATEMÁTICA
 EQUILÍBRIO LÍQUIDO-VAPOR A ALTAS PRESSÕES DO SISTEMA DIÓXIDO DE CARBONO + ANETOL: DADOS EXPERIMENTAIS E MODELAGEM MATEMÁTICA R. SCOPEL SILVA 1, R. N. ALMEIDA 1, R. M. F. VARGAS 1 e E. CASSEL 1 Pontifícia
EQUILÍBRIO LÍQUIDO-VAPOR A ALTAS PRESSÕES DO SISTEMA DIÓXIDO DE CARBONO + ANETOL: DADOS EXPERIMENTAIS E MODELAGEM MATEMÁTICA R. SCOPEL SILVA 1, R. N. ALMEIDA 1, R. M. F. VARGAS 1 e E. CASSEL 1 Pontifícia
Profª. Drª. Marivone Nunho Sousa Laboratório de Catálise 1 Departamento de Engenharia Química Escola de Engenharia de Lorena EEL/USP
 TERMODINÂMICA QUÍMICA APLICADA 2 CAPÍTULO 1 TERMODINÂMICA DE SOLUÇÕES Parte 1 Profª. Drª. Marivone Nunho Sousa Laboratório de Catálise 1 Departamento de Engenharia Química Escola de Engenharia de Lorena
TERMODINÂMICA QUÍMICA APLICADA 2 CAPÍTULO 1 TERMODINÂMICA DE SOLUÇÕES Parte 1 Profª. Drª. Marivone Nunho Sousa Laboratório de Catálise 1 Departamento de Engenharia Química Escola de Engenharia de Lorena
Estimação de Parâmetros em Modelos de Energia Livre de Gibbs em Excesso
 Estimação de Parâmetros em Modelos de Energia Livre de Gibbs em Excesso Cláudio T. Lima, Gustavo M. Platt, Departamento de Modelagem Computacional - IPRJ - UERJ 28630-050, Nova Friburgo, RJ E-mail: ctlima@iprj.uerj.br,
Estimação de Parâmetros em Modelos de Energia Livre de Gibbs em Excesso Cláudio T. Lima, Gustavo M. Platt, Departamento de Modelagem Computacional - IPRJ - UERJ 28630-050, Nova Friburgo, RJ E-mail: ctlima@iprj.uerj.br,
Prefácio. Lista de Símbolos. Modelo do Gás Perfeito 2 Mistura de Gases Perfeitos. Lei de Dalton 4 Problemas 6
 Índice Geral Prefácio xv Lista de Símbolos xvii 1 Modelo do Gás Perfeito 1 Modelo do Gás Perfeito 2 Mistura de Gases Perfeitos. Lei de Dalton 4 Problemas 6 2 Princípio da Conservação da Energia. A 1.ª
Índice Geral Prefácio xv Lista de Símbolos xvii 1 Modelo do Gás Perfeito 1 Modelo do Gás Perfeito 2 Mistura de Gases Perfeitos. Lei de Dalton 4 Problemas 6 2 Princípio da Conservação da Energia. A 1.ª
Dois exercícios desta lista entrarão na primeira prova teórica
 Dois exercícios desta lista entrarão na primeira prova teórica 01. Quais são os três estados físicos da matéria? Quais as diferenças entre eles do ponto de vista de movimentação de moléculas e interações
Dois exercícios desta lista entrarão na primeira prova teórica 01. Quais são os três estados físicos da matéria? Quais as diferenças entre eles do ponto de vista de movimentação de moléculas e interações
Aula 2 - Introdução à Bioquímica
 Aula 2 - Introdução à Bioquímica -Interações intermoleculares: interação eletrostática, interações de van der Waals -Solubilidade de compostos polares em água -Solubilidade de compostos apolares em água
Aula 2 - Introdução à Bioquímica -Interações intermoleculares: interação eletrostática, interações de van der Waals -Solubilidade de compostos polares em água -Solubilidade de compostos apolares em água
UTILIZAÇÃO DE MODELOS PARA CORRELACIONAR DADOS EXPERIMENTAIS DE SOLUBILIDADE DO FERTILIZANTE NITROGENADO UREIA EM MISTURAS HIDRO-ALCOÓLICAS
 UTILIZAÇÃO DE MODELOS PARA CORRELACIONAR DADOS EXPERIMENTAIS DE SOLUBILIDADE DO FERTILIZANTE NITROGENADO UREIA EM MISTURAS HIDRO-ALCOÓLICAS M.C. OLIVEIRA 1, A.P. SILVA 1, R.A. MALAGONI 1 1 Universidade
UTILIZAÇÃO DE MODELOS PARA CORRELACIONAR DADOS EXPERIMENTAIS DE SOLUBILIDADE DO FERTILIZANTE NITROGENADO UREIA EM MISTURAS HIDRO-ALCOÓLICAS M.C. OLIVEIRA 1, A.P. SILVA 1, R.A. MALAGONI 1 1 Universidade
ABSORÇÃO DE PESADOS DO GÁS NATURAL UTILIZANDO SIMULAÇÃO COMPUTACIONAL
 ABSORÇÃO DE PESADOS DO GÁS NATURAL UTILIZANDO SIMULAÇÃO OMPUTAIONAL D. N. N. da SILVA 1, O. HIAVONE FILHO 1 1 Universidade Federal do Rio Grande do Norte, Departamento de Engenharia Química E-mail para
ABSORÇÃO DE PESADOS DO GÁS NATURAL UTILIZANDO SIMULAÇÃO OMPUTAIONAL D. N. N. da SILVA 1, O. HIAVONE FILHO 1 1 Universidade Federal do Rio Grande do Norte, Departamento de Engenharia Química E-mail para
MODELAGEM TERMODINÂMICA DE SISTEMAS NO PRÉ-SAL CONTENDO CO2, N-HEXADECANO E ÁGUA
 MODELAGEM TERMODINÂMICA DE SISTEMAS NO PRÉ-SAL CONTENDO CO2, N-HEXADECANO E ÁGUA F. M. CAVALCANTI 1, F. L. P. PESSOA 2 e L. DANIELSKI 1 1 Universidade Federal de Pernambuco, Departamento de Engenharia
MODELAGEM TERMODINÂMICA DE SISTEMAS NO PRÉ-SAL CONTENDO CO2, N-HEXADECANO E ÁGUA F. M. CAVALCANTI 1, F. L. P. PESSOA 2 e L. DANIELSKI 1 1 Universidade Federal de Pernambuco, Departamento de Engenharia
ANÁLISE DO FATOR DE COMPRESSIBILIDADE NO EQUILÍBRIO LÍQUIDO-VAPOR DE FLUIDOS DE PETRÓLEO UTILIZANDO O SIMULADOR PVTpetro
 ANÁLISE DO FATOR DE COMPRESSIBILIDADE NO EQUILÍBRIO LÍQUIDO-VAPOR DE FLUIDOS DE PETRÓLEO UTILIZANDO O SIMULADOR PVTpetro A. M. BARBOSA NETO 1,2, L. A. A. P. FONSECA 2, E. C. RYLO 2 e A. C. BANNWART 1 1
ANÁLISE DO FATOR DE COMPRESSIBILIDADE NO EQUILÍBRIO LÍQUIDO-VAPOR DE FLUIDOS DE PETRÓLEO UTILIZANDO O SIMULADOR PVTpetro A. M. BARBOSA NETO 1,2, L. A. A. P. FONSECA 2, E. C. RYLO 2 e A. C. BANNWART 1 1
ESTIMAÇÃO DOS PARAMETROS DE INTERAÇÃO BINARIA DO SISTEMA CO 2 -N- HEXADECANO
 ESTIMAÇÃO DOS PARAMETROS DE INTERAÇÃO BINARIA DO SISTEMA CO 2 -N- HEXADECANO Leonardo Santa Cruz Nogueira, 2 Ana Mehl, 3 Fernando Luiz Pellegrini Pessoa, Silvia M. C. da Silva Aluno de iniciação Científica
ESTIMAÇÃO DOS PARAMETROS DE INTERAÇÃO BINARIA DO SISTEMA CO 2 -N- HEXADECANO Leonardo Santa Cruz Nogueira, 2 Ana Mehl, 3 Fernando Luiz Pellegrini Pessoa, Silvia M. C. da Silva Aluno de iniciação Científica
QFL Instruções para elaboração dos relatórios 2013
 GERAL QFL 2453 - Instruções para elaboração dos relatórios 2013 Todos os relatórios devem apresentar: 1) Capa contendo os nomes dos alunos, número USP, a turma da qual fazem parte, título e número da experiência,
GERAL QFL 2453 - Instruções para elaboração dos relatórios 2013 Todos os relatórios devem apresentar: 1) Capa contendo os nomes dos alunos, número USP, a turma da qual fazem parte, título e número da experiência,
Introdução. Uma mistura éconstituída por duas ou mais substâncias puras, sejam simples ou compostas MISTURA
 SOLUÇÕES Introdução MISTURA MISTURA HETEROGÊNEA Uma mistura éconstituída por duas ou mais substâncias puras, sejam simples ou compostas A mistura seráheterogênea quando apresentar duas ou mais fases perceptíveis.
SOLUÇÕES Introdução MISTURA MISTURA HETEROGÊNEA Uma mistura éconstituída por duas ou mais substâncias puras, sejam simples ou compostas A mistura seráheterogênea quando apresentar duas ou mais fases perceptíveis.
ESTUDO DO EQUILÍBRIO DE FASES DE HIDRATOS DE METANO E DA MISTURA METANO E DIÓXIDO DE CARBONO
 PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ CAMPUS DE CURITIBA DEPARTAMENTO DE PESQUISA E PÓS-GRADUAÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA MECÂNICA E DE
PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ CAMPUS DE CURITIBA DEPARTAMENTO DE PESQUISA E PÓS-GRADUAÇÃO PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA MECÂNICA E DE
ESTUDO DO EQUILÍBRIO LÍQUIDO-VAPOR DO SISTEMA BINÁRIO PROPANO - GÁS SULFÍDRICO
 ESTUDO DO EQUILÍBRIO LÍQUIDO-VAPOR DO SISTEMA BINÁRIO PROPANO - GÁS SULFÍDRICO Vanessa Rafaela Cruz Moura 1 ; Mayra Kerolly Sales Monteiro 1 ; Patrícia Maria Rocha 1 ; Thales Cainã dos Santos Barbalho
ESTUDO DO EQUILÍBRIO LÍQUIDO-VAPOR DO SISTEMA BINÁRIO PROPANO - GÁS SULFÍDRICO Vanessa Rafaela Cruz Moura 1 ; Mayra Kerolly Sales Monteiro 1 ; Patrícia Maria Rocha 1 ; Thales Cainã dos Santos Barbalho
Com base nos dados acima, responda as questões propostas (cuidado com as unidades):
 Curso: Farmácia Atenção, dois dos exercícios da lista entrarão na P1. Concentrações: 01. Em uma rápida pesquisa pela internet é possível achar diversas receitas relacionadas à preparação de alguns cosméticos
Curso: Farmácia Atenção, dois dos exercícios da lista entrarão na P1. Concentrações: 01. Em uma rápida pesquisa pela internet é possível achar diversas receitas relacionadas à preparação de alguns cosméticos
EXERCÍCIOS DE ELETROQUÍMICA
 Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
ESTIMAÇÃO DO COEFICIENTE DE ATIVIDADE DE UM SISTEMA BINÁRIO EM EQUÍLIBRIO LÍQUIDO-VAPOR UTILIZANDO O MÉTODO UNIFAC
 ESTIMAÇÃO DO COEFICIENTE DE ATIVIDADE DE UM SISTEMA BINÁRIO EM EQUÍLIBRIO LÍQUIDO-VAPOR UTILIZANDO O MÉTODO UNIFAC José Cleiton Sousa dos SANTOS (1); Marylane de SOUSA02 (2); Darlane Wellen Freitas de
ESTIMAÇÃO DO COEFICIENTE DE ATIVIDADE DE UM SISTEMA BINÁRIO EM EQUÍLIBRIO LÍQUIDO-VAPOR UTILIZANDO O MÉTODO UNIFAC José Cleiton Sousa dos SANTOS (1); Marylane de SOUSA02 (2); Darlane Wellen Freitas de
1 Termodinâmica: Modelos e Leis 1. 2 Princípio da Conservação da Energia: A 1.ª Lei da Termodinâmica 13
 Prefácio Lista de Símbolos xiii xvii 1 Termodinâmica: Modelos e Leis 1 1.1 Introdução 1 1.2 Modelo do Gás Perfeito 3 1.3 Mistura de Gases Perfeitos: Lei de Dalton 6 1.4 Leis da Termodinâmica 7 1.5 Expansão
Prefácio Lista de Símbolos xiii xvii 1 Termodinâmica: Modelos e Leis 1 1.1 Introdução 1 1.2 Modelo do Gás Perfeito 3 1.3 Mistura de Gases Perfeitos: Lei de Dalton 6 1.4 Leis da Termodinâmica 7 1.5 Expansão
Do ideal ao real II: propriedades de misturas e soluções
 7 Capítulo Capítulo Do ideal ao real II: propriedades de misturas e soluções For every complex problem there is an answer that is clear, simple, and wrong (Para cada problema complexo existe uma resposta
7 Capítulo Capítulo Do ideal ao real II: propriedades de misturas e soluções For every complex problem there is an answer that is clear, simple, and wrong (Para cada problema complexo existe uma resposta
ESTUDO EXPERIMENTAL DOS EQUILÍBRIOS ENTRE FASES COM APLICAÇÃO COMPUTACIONAL PARA O ENSINO DE TERMODINÂMICA PARA ENGENHARIA
 ESTUDO EXPERIMENTAL DOS EQUILÍBRIOS ENTRE FASES COM APLICAÇÃO COMPUTACIONAL PARA O ENSINO DE TERMODINÂMICA PARA ENGENHARIA ALENCAR REIS, A. R. 1 ; REGO, E. F. 2 ; MELO, R. A. C. 3 ; SOUZA, C. P. 4 Resumo
ESTUDO EXPERIMENTAL DOS EQUILÍBRIOS ENTRE FASES COM APLICAÇÃO COMPUTACIONAL PARA O ENSINO DE TERMODINÂMICA PARA ENGENHARIA ALENCAR REIS, A. R. 1 ; REGO, E. F. 2 ; MELO, R. A. C. 3 ; SOUZA, C. P. 4 Resumo
DESENVOLVIMENTO DE UM SIMULADOR DE PROCESSOS A PARTIR DA ABORDAGEM DE RESOLUÇÃO SEQUENCIAL MODULAR PACOTE TERMODINÂMICO.
 DESENVOLVIMENTO DE UM SIMULADOR DE PROCESSOS A PARTIR DA ABORDAGEM DE RESOLUÇÃO SEQUENCIAL MODULAR PACOTE TERMODINÂMICO. Sávio José Pontes da Rocha Barros 1 ; Lucas León Silva Luna 2 ; Isabella Targino
DESENVOLVIMENTO DE UM SIMULADOR DE PROCESSOS A PARTIR DA ABORDAGEM DE RESOLUÇÃO SEQUENCIAL MODULAR PACOTE TERMODINÂMICO. Sávio José Pontes da Rocha Barros 1 ; Lucas León Silva Luna 2 ; Isabella Targino
AVALIAÇÃO DA EdE MATTEDI-TAVARES-CASTIER (MTC) PARA A DESCRIÇÃO DE DENSIDADE, PRESSÃO DE VAPOR E VELOCIDADE DO SOM DE HIDROCARBONETOS
 AVALIAÇÃO DA EdE MATTEDI-TAVARES-CASTIER (MTC) PARA A DESCRIÇÃO DE DENSIDADE, PRESSÃO DE VAPOR E VELOCIDADE DO SOM DE HIDROCARBONETOS D. HOFFMANN 1, S. MATTEDI 1, CASTIER, M. 2 e M. PAREDES 3 1 Programa
AVALIAÇÃO DA EdE MATTEDI-TAVARES-CASTIER (MTC) PARA A DESCRIÇÃO DE DENSIDADE, PRESSÃO DE VAPOR E VELOCIDADE DO SOM DE HIDROCARBONETOS D. HOFFMANN 1, S. MATTEDI 1, CASTIER, M. 2 e M. PAREDES 3 1 Programa
Cálculo Flash de Fluidos Representativos de Reservatórios do Pré- Sal Visando Posterior Medidas PVT
 Cálculo Flash de Fluidos Representativos de Reservatórios do Pré- Sal Visando Posterior Medidas PVT T. C. S. BARBALHO 1, V. R. C. M. BARBALHO 1, F. VAQUERO 1, K. SUELDO 1 e O. CHIAVONE- FILHO 1 1 Universidade
Cálculo Flash de Fluidos Representativos de Reservatórios do Pré- Sal Visando Posterior Medidas PVT T. C. S. BARBALHO 1, V. R. C. M. BARBALHO 1, F. VAQUERO 1, K. SUELDO 1 e O. CHIAVONE- FILHO 1 1 Universidade
ESTUDO DO COMPORTAMENTO DA CONSTANTE DIELÉTRICA EM CONDIÇÕES SUPERCRÍTICAS ENVOLVENDO CO 2, HIDROCARBONETOS E ÁGUA
 ESTUDO DO COMORTAMENTO DA CONSTANTE DIELÉTRICA EM CONDIÇÕES SUERCRÍTICAS ENVOLVENDO CO 2, HIDROCARBONETOS E ÁGUA R. C. MIRRE 1, F.. do NASCIMENTO 1, E. R. A. LIMA 2, M. L. L. AREDES 2 e F. L.. ESSOA 3
ESTUDO DO COMORTAMENTO DA CONSTANTE DIELÉTRICA EM CONDIÇÕES SUERCRÍTICAS ENVOLVENDO CO 2, HIDROCARBONETOS E ÁGUA R. C. MIRRE 1, F.. do NASCIMENTO 1, E. R. A. LIMA 2, M. L. L. AREDES 2 e F. L.. ESSOA 3
Sumário. Apresentação... Prefácio... Lista de Variáveis...
 Sumário Apresentação... Prefácio... Lista de Variáveis... IX XI XV Capítulo 1 Introdução... 1 1.1 Etapas do Escoamento... 4 1.1.1 Recuperação... 4 1.1.2 Elevação... 10 1.1.3 Coleta... 10 1.1.4 Exportação...
Sumário Apresentação... Prefácio... Lista de Variáveis... IX XI XV Capítulo 1 Introdução... 1 1.1 Etapas do Escoamento... 4 1.1.1 Recuperação... 4 1.1.2 Elevação... 10 1.1.3 Coleta... 10 1.1.4 Exportação...
Ácidos fracos. Ácidos fracos são apenas parcialmente ionizados em solução. Reagem com o solvente (H 2 O) doando um próton.
 Ácidos fracos Ácidos fracos são apenas parcialmente ionizados em solução. Reagem com o solvente (H 2 O) doando um próton. Existe uma mistura de íons e ácido não-ionizado em solução em quantidades significativas
Ácidos fracos Ácidos fracos são apenas parcialmente ionizados em solução. Reagem com o solvente (H 2 O) doando um próton. Existe uma mistura de íons e ácido não-ionizado em solução em quantidades significativas
MODELAGEM TERMODINÂMICA DA REAÇÃO DE HIDRÓLISE DO ÓLEO DE SOJA
 MODELAGEM TERMODINÂMICA DA REAÇÃO DE HIDRÓLISE DO ÓLEO DE SOJA M. B. LOPES 1, I. G. NASCIMENTO 1, J. J. MARQUES 1 e A. L. D. RAMOS 1 1 Universidade Federal de Sergipe, Departamento de Engenharia Química
MODELAGEM TERMODINÂMICA DA REAÇÃO DE HIDRÓLISE DO ÓLEO DE SOJA M. B. LOPES 1, I. G. NASCIMENTO 1, J. J. MARQUES 1 e A. L. D. RAMOS 1 1 Universidade Federal de Sergipe, Departamento de Engenharia Química
CQ049 FQ Eletroquímica
 CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti criação de modelos Modelos são criados para explicar os fenômenos
CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti criação de modelos Modelos são criados para explicar os fenômenos
Professor: Fábio Silva SOLUÇÕES
 Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
QUÍMICA GERAL Soluções
 QUÍMICA GERAL Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia QUÍMICA GERAL 1 Pressão de vapor A presença
QUÍMICA GERAL Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia QUÍMICA GERAL 1 Pressão de vapor A presença
5. Funções de afastamento e fugacidade
 QI 58 Fundamentos de rocessos em Engenharia Química II 009 5. Funções de afastamento e fugacidade Assuntos. Funções de afastamento. Fugacidade 3. Exercícios 5.. Funções de afastamento As relações estudadas
QI 58 Fundamentos de rocessos em Engenharia Química II 009 5. Funções de afastamento e fugacidade Assuntos. Funções de afastamento. Fugacidade 3. Exercícios 5.. Funções de afastamento As relações estudadas
sat 1 = 431 Pa e sat sat
 Modelos Baseados no Conceito de Composição Local 85 Exemplo 9. Para o sistema n-pentanol ()/n-hexano () as constantes da equação de Wilson são Λ = 0.0700 e Λ = 0.69. Admitindo que a fase vapor é ideal,
Modelos Baseados no Conceito de Composição Local 85 Exemplo 9. Para o sistema n-pentanol ()/n-hexano () as constantes da equação de Wilson são Λ = 0.0700 e Λ = 0.69. Admitindo que a fase vapor é ideal,
1 Introdução. Figura Esquema offshore de produção de petróleo.
 1 Introdução Sistemas de produção de petróleo podem ser caracterizados pelo escoamento de um ou mais fluidos, apresentando diversas fases, desde os poços de petróleo até a planta onde será processado,
1 Introdução Sistemas de produção de petróleo podem ser caracterizados pelo escoamento de um ou mais fluidos, apresentando diversas fases, desde os poços de petróleo até a planta onde será processado,
MODELAGEM TERMODINÂMICA E CINÉTICA DE PRECIPITAÇÃO DE SAIS NA PRESENÇA DE GLICOL
 MODELAGEM TERMODINÂMICA E CINÉTICA DE PRECIPITAÇÃO DE SAIS NA PRESENÇA DE GLICOL C. M. S. FIGUEIREDO 1,, A. G. BARRETO Jr 1, F. W. TAVARES 1 Universidade Federal do Rio de Janeiro, Departamento de Engenharia
MODELAGEM TERMODINÂMICA E CINÉTICA DE PRECIPITAÇÃO DE SAIS NA PRESENÇA DE GLICOL C. M. S. FIGUEIREDO 1,, A. G. BARRETO Jr 1, F. W. TAVARES 1 Universidade Federal do Rio de Janeiro, Departamento de Engenharia
V-Oktober Fórum PPGEQ
 V-Oktober Fórum PPGEQ ESTUDO TEÓRICO DO MODELO PC-SAFT E SUAS APLICAÇÕES Nauro da Silveira Junior, Nilo Sérgio Medeiros Cardozo, Keiko Wada Laboratório de Tecnologia e Processamento de Polímeros (LATEP)
V-Oktober Fórum PPGEQ ESTUDO TEÓRICO DO MODELO PC-SAFT E SUAS APLICAÇÕES Nauro da Silveira Junior, Nilo Sérgio Medeiros Cardozo, Keiko Wada Laboratório de Tecnologia e Processamento de Polímeros (LATEP)
SISTEMAS DE DOIS COMPONENTES: EQUILÍBRIO LÍQUIDO-VAPOR. LÍQUIDOS MISCÍVEIS
 SISTEMS DE DOIS COMPONENTES: EQUILÍRIO LÍQUIDO-VPOR. LÍQUIDOS MISCÍVEIS Prof. Harley P. Martins Filho plicação da regra das fases F = 2 + 2 P = 4 P máxima variância (uma fase): F = 3 Fixando o valor de
SISTEMS DE DOIS COMPONENTES: EQUILÍRIO LÍQUIDO-VPOR. LÍQUIDOS MISCÍVEIS Prof. Harley P. Martins Filho plicação da regra das fases F = 2 + 2 P = 4 P máxima variância (uma fase): F = 3 Fixando o valor de
ESTUDO DA SOLUBILIDADE DO PARACETAMOL EM ALGUNS SOLVENTES UTILIZANDO O MODELO NRTL
 ESTUDO DA SOLUBILIDADE DO PARACETAMOL EM ALGUNS SOLVENTES UTILIZANDO O MODELO NRTL H. A. R. GOMES 1, A. B. N. BRITO 1 1 Universidade Federal do Espírito Santo, Centro Universitário Norte do Espírito Santo,
ESTUDO DA SOLUBILIDADE DO PARACETAMOL EM ALGUNS SOLVENTES UTILIZANDO O MODELO NRTL H. A. R. GOMES 1, A. B. N. BRITO 1 1 Universidade Federal do Espírito Santo, Centro Universitário Norte do Espírito Santo,
ESTUDO DA CINÉTICA DA FORMAÇÃO DE HIDRATOS UTILIZANDO REOLOGIA INTERFACIAL
 ESTUDO DA CINÉTICA DA FORMAÇÃO DE HIDRATOS UTILIZANDO REOLOGIA INTERFACIAL Bruna C. Leopércio, 2 Paulo R. De Souza Mendes e 3 Gerald G. Fuller Aluna de Mestrado discente do curso de Engenharia Mecânica
ESTUDO DA CINÉTICA DA FORMAÇÃO DE HIDRATOS UTILIZANDO REOLOGIA INTERFACIAL Bruna C. Leopércio, 2 Paulo R. De Souza Mendes e 3 Gerald G. Fuller Aluna de Mestrado discente do curso de Engenharia Mecânica
Sumário PREFÁCIO...13
 Sumário PREFÁCIO...13 CAPÍTULO 1 Operações com Grandezas e Unidades de Medida...17 Objetivos...17 1.1 Notação científica...18 1.2 Exponenciais e logaritmos...19 1.3 Grandezas físicas e unidades de medida:
Sumário PREFÁCIO...13 CAPÍTULO 1 Operações com Grandezas e Unidades de Medida...17 Objetivos...17 1.1 Notação científica...18 1.2 Exponenciais e logaritmos...19 1.3 Grandezas físicas e unidades de medida:
ESTUDO DO EQUILÍBRIO LÍQUIDO-VAPOR DO SISTEMA ETANOL -ÁGUA - NITRATO DE CÁLCIO TETRA- HIDRATADO A PRESSÃO NORMAL
 ESTUDO DO EQUILÍBRIO LÍQUIDO-VAPOR DO SISTEMA ETANOL -ÁGUA - NITRATO DE CÁLCIO TETRA- HIDRATADO A PRESSÃO NORMAL C. Leal 1, W. A. P. Magalhães 1, R. B. Soares 1, M. F. Mendes 1 1 Universidade Federal Rural
ESTUDO DO EQUILÍBRIO LÍQUIDO-VAPOR DO SISTEMA ETANOL -ÁGUA - NITRATO DE CÁLCIO TETRA- HIDRATADO A PRESSÃO NORMAL C. Leal 1, W. A. P. Magalhães 1, R. B. Soares 1, M. F. Mendes 1 1 Universidade Federal Rural
O processo de dissolução
 SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
SOLUBILIDADE Sabemos que um soluto altera as propriedades do solvente. Solução sólida: silício dopado com fósforo eletrônica. indústria Sal sobre o gelo abaixa o ponto e congelamento se a temperatura é
ESTIMATIVA DA ENTALPIA DE FUSÃO DE COMPOSTOS COMPONENTES DE BIOCOMBUSTÍVEIS ESTIMATION OF FUSION ENTHALPY OF COMPOUNDS RELATED TO BIOFUELS
 18 ESTIMATIVA DA ENTALPIA DE FUSÃO DE COMPOSTOS COMPONENTES DE BIOCOMBUSTÍVEIS ESTIMATION OF FUSION ENTHALPY OF COMPOUNDS RELATED TO BIOFUELS Moilton R. Franco Junior (1) Alex Anderson O. Moura (2) Nattácia
18 ESTIMATIVA DA ENTALPIA DE FUSÃO DE COMPOSTOS COMPONENTES DE BIOCOMBUSTÍVEIS ESTIMATION OF FUSION ENTHALPY OF COMPOUNDS RELATED TO BIOFUELS Moilton R. Franco Junior (1) Alex Anderson O. Moura (2) Nattácia
DETERMINAÇÃO DOS PARÂMETROS TERMODINÂMICOS DO SISTEMA ÁGUA-ETANOL-FRUTOSE VIA DESTILAÇÃO DIFERENCIAL
 DETERMINAÇÃO DOS PARÂMETROS TERMODINÂMICOS DO SISTEMA ÁGUA-ETANOL-FRUTOSE VIA DESTILAÇÃO DIFERENCIAL V. R. S. ALVES 1, A. BERNARDO 1, L. F. MOURA 1 1 Universidade Federal de São Carlos, Departamento de
DETERMINAÇÃO DOS PARÂMETROS TERMODINÂMICOS DO SISTEMA ÁGUA-ETANOL-FRUTOSE VIA DESTILAÇÃO DIFERENCIAL V. R. S. ALVES 1, A. BERNARDO 1, L. F. MOURA 1 1 Universidade Federal de São Carlos, Departamento de
AVALIAÇÃO DO MODELO PRIGOGINE-FLORY- PATTERSON NA PREDIÇÃO DO VOLUME PARCIAL MOLAR DE SOLUÇÕES LÍQUIDAS BINÁRIAS
 AVALIAÇÃO DO MODELO PRIGOGINE-FLORY- PATTERSON NA PREDIÇÃO DO VOLUME PARCIAL MOLAR DE SOLUÇÕES LÍQUIDAS BINÁRIAS A.C. GALVÃO, W.S. ROBAZZA, A.M. DA LUZ, L.G. FRANZOSI, R.H. SCHNEIDER Universidade do Estado
AVALIAÇÃO DO MODELO PRIGOGINE-FLORY- PATTERSON NA PREDIÇÃO DO VOLUME PARCIAL MOLAR DE SOLUÇÕES LÍQUIDAS BINÁRIAS A.C. GALVÃO, W.S. ROBAZZA, A.M. DA LUZ, L.G. FRANZOSI, R.H. SCHNEIDER Universidade do Estado
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
Apresentar os principais conceitos envolvidos no equilíbrio químico de reações múltiplas e de soluções
 EQUILÍBRIO QUÍMICO E DE SOLUÇÕES Meta Apresentar os principais conceitos envolvidos no equilíbrio químico de reações múltiplas e de soluções Objetivos Ao final desta aula, o aluno deverá: compreender os
EQUILÍBRIO QUÍMICO E DE SOLUÇÕES Meta Apresentar os principais conceitos envolvidos no equilíbrio químico de reações múltiplas e de soluções Objetivos Ao final desta aula, o aluno deverá: compreender os
Energia Reticular em Sólidos Iônicos
 Energia Reticular em Sólidos Iônicos Estutura Cristalina A fórmula química é uma fórmula empírica, simplesmente dando a proporção de íons com base no equilíbrio de carga. Entalpia de rede A estabilidade
Energia Reticular em Sólidos Iônicos Estutura Cristalina A fórmula química é uma fórmula empírica, simplesmente dando a proporção de íons com base no equilíbrio de carga. Entalpia de rede A estabilidade
Figura 1: Potencial químico de um solvente na presença de um soluto.
 Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
ANÁLISE INTEGRADA ENTRE RESERVATÓRIO, POÇO, ELEVAÇÃO E ESCOAMENTO: UMA PRIMEIRA ABORDAGEM COM ENFÂSE NA MODELAGEM TERMODINÂMICA
 ANÁLISE INTEGRADA ENTRE RESERVATÓRIO, POÇO, ELEVAÇÃO E ESCOAMENTO: UMA PRIMEIRA ABORDAGEM COM ENFÂSE NA MODELAGEM TERMODINÂMICA 1, Antonio M. B. Neto, 1 Tiago L. D. Forti, Antonio C. Bannwart, e 1 Edimar
ANÁLISE INTEGRADA ENTRE RESERVATÓRIO, POÇO, ELEVAÇÃO E ESCOAMENTO: UMA PRIMEIRA ABORDAGEM COM ENFÂSE NA MODELAGEM TERMODINÂMICA 1, Antonio M. B. Neto, 1 Tiago L. D. Forti, Antonio C. Bannwart, e 1 Edimar
EQUILIBRIO LÍQUIDO-VAPOR ISOTÉRMICO PARA O SISTEMA BINÁRIO ETANO E DIÓXIDO DE CARBONO
 EQUILIBRIO LÍQUIDO-VAPOR ISOTÉRMICO PARA O SISTEMA BINÁRIO ETANO E DIÓXIDO DE CARBONO Makezia Mayara da Costa Freitas 1 ; Cleitiane da Costa Nogueira 1 ; Vanessa Rafaela Cruz Moura 1 ; Mayra Kerolly Sales
EQUILIBRIO LÍQUIDO-VAPOR ISOTÉRMICO PARA O SISTEMA BINÁRIO ETANO E DIÓXIDO DE CARBONO Makezia Mayara da Costa Freitas 1 ; Cleitiane da Costa Nogueira 1 ; Vanessa Rafaela Cruz Moura 1 ; Mayra Kerolly Sales
Equações do estado Termodinâmica Aula [22/ ]
![Equações do estado Termodinâmica Aula [22/ ] Equações do estado Termodinâmica Aula [22/ ]](/thumbs/65/52652858.jpg) Equações do estado Termodinâmica Aula [22/03-2017] Tuong-Van Nguyen tungu@mek.dtu.dk Escola Politécnica Universidade de São Paulo 1 / 27 Plano Modelos termodinâmicos Equações do estado cúbicas 2 / 27 Plano
Equações do estado Termodinâmica Aula [22/03-2017] Tuong-Van Nguyen tungu@mek.dtu.dk Escola Politécnica Universidade de São Paulo 1 / 27 Plano Modelos termodinâmicos Equações do estado cúbicas 2 / 27 Plano
MODELAGEM DO PONTO DE ORVALHO E DO PERCENTUAL DE CONDENSAÇÃO PARA O GÁS DE RECICLO DE UM REATOR DE POLIMERIZAÇÃO DE ETENO EM LEITO FLUIDIZADO
 MODELAGEM DO PONTO DE ORVALHO E DO PERCENTUAL DE CONDENSAÇÃO PARA O GÁS DE RECICLO DE UM REATOR DE POLIMERIZAÇÃO DE ETENO EM LEITO FLUIDIZADO K. P. N. PIRES 1,, J. B. V. BASTOS, J. M. NIKIEL 3 1 Universidade
MODELAGEM DO PONTO DE ORVALHO E DO PERCENTUAL DE CONDENSAÇÃO PARA O GÁS DE RECICLO DE UM REATOR DE POLIMERIZAÇÃO DE ETENO EM LEITO FLUIDIZADO K. P. N. PIRES 1,, J. B. V. BASTOS, J. M. NIKIEL 3 1 Universidade
QUÍMICA GERAL Soluções
 QUÍMICA GERAL Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 2 de Abril de 2018 Engenharia Ambiental e Sanitária QUÍMICA GERAL 1 Pressão
QUÍMICA GERAL Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 2 de Abril de 2018 Engenharia Ambiental e Sanitária QUÍMICA GERAL 1 Pressão
Fundamentos da modelagem Molecular - 1
 Fundamentos da modelagem Molecular - 1 Departamento de Física UFPel Introdução Rotas para a pesquisa Conexão entre experimento, simulação e teoria Sistema real Fazer modelos do sistema Fazer experimentos
Fundamentos da modelagem Molecular - 1 Departamento de Física UFPel Introdução Rotas para a pesquisa Conexão entre experimento, simulação e teoria Sistema real Fazer modelos do sistema Fazer experimentos
SOLUÇÕES PARTE 1. Giseli Menegat e Maira Gazzi Manfro
 SOLUÇÕES PARTE 1 Giseli Menegat e Maira Gazzi Manfro giseli.menegat@caxias.ifrs.edu.br maira.manfro@caxias.ifrs.edu.br * dispersão É o sistema um sistema em que uma substância, sob a forma de pequenas
SOLUÇÕES PARTE 1 Giseli Menegat e Maira Gazzi Manfro giseli.menegat@caxias.ifrs.edu.br maira.manfro@caxias.ifrs.edu.br * dispersão É o sistema um sistema em que uma substância, sob a forma de pequenas
Equações-chave FUNDAMENTOS. Seção A. Seção E. Seção F. Seção G. mv 2. E c E P. mgh. Energia total energia cinética energia potencial, ou E E c.
 Equações-chave FUNDAMENTOS Seção A 3 A energia cinética de uma partícula de massa m relaciona-se com sua velocidade v, por: E c mv 2 4 Um corpo de massa m que está a uma altura h da Terra tem energia potencial
Equações-chave FUNDAMENTOS Seção A 3 A energia cinética de uma partícula de massa m relaciona-se com sua velocidade v, por: E c mv 2 4 Um corpo de massa m que está a uma altura h da Terra tem energia potencial
SIMULAÇÃO E OTIMIZAÇÃO DA PURIFICAÇÃO DO PRODUTO OBTIDO A PARTIR DO CRAQUEAMENTO DE ÓLEO VEGETAL EMPREGANDO O ASPEN HYSYS.
 SIMULAÇÃO E OTIMIZAÇÃO DA PURIFICAÇÃO DO PRODUTO OBTIDO A PARTIR DO CRAQUEAMENTO DE ÓLEO VEGETAL EMPREGANDO O ASPEN HYSYS. E. C. COSTA 1, A. K. TAKAKURA 1, N. T. MACHADO 1. 1 Universidade Federal do Pará,
SIMULAÇÃO E OTIMIZAÇÃO DA PURIFICAÇÃO DO PRODUTO OBTIDO A PARTIR DO CRAQUEAMENTO DE ÓLEO VEGETAL EMPREGANDO O ASPEN HYSYS. E. C. COSTA 1, A. K. TAKAKURA 1, N. T. MACHADO 1. 1 Universidade Federal do Pará,
UFF-Termodinâmica Aplicada a Aciaria
 Do ponto de vista dos cálculos termodinâmico, há três situações principais quando se analisa processos de desoxidação: 1. com produto (óxido) puro; 2. com formação de misturas de óxidos; e 3. com auxílio
Do ponto de vista dos cálculos termodinâmico, há três situações principais quando se analisa processos de desoxidação: 1. com produto (óxido) puro; 2. com formação de misturas de óxidos; e 3. com auxílio
Parte 1. Diagrama de fases ternário
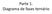 Parte 1. Diagrama de fases ternário Três componentes : água, citrato e poli(etileno glicol) 400 g/mol Observar passagem de sistema homogêneo para turvo cloud-point ou ponto de névoa em função da variação
Parte 1. Diagrama de fases ternário Três componentes : água, citrato e poli(etileno glicol) 400 g/mol Observar passagem de sistema homogêneo para turvo cloud-point ou ponto de névoa em função da variação
Considere duas diferentes substâncias simples, constituídas respectivamente pelo elemento químico E 1. e pelo elemento químico E 2
 7 b QUÍMICA Considere duas diferentes substâncias simples, constituídas respectivamente pelo elemento químico E 1 e pelo elemento químico E 2, indicados na Tabela Periódica abaixo: Observe que E1 e E2
7 b QUÍMICA Considere duas diferentes substâncias simples, constituídas respectivamente pelo elemento químico E 1 e pelo elemento químico E 2, indicados na Tabela Periódica abaixo: Observe que E1 e E2
Volume Parcial Molar
 Volume Parcial Molar 1. Introdução O volume molar é definido como o volume ocupado por 1 mol de uma substância pura. Por exemplo, o volume molar da água pura é 18 cm 3 /mol, conforme mostrado no cálculo
Volume Parcial Molar 1. Introdução O volume molar é definido como o volume ocupado por 1 mol de uma substância pura. Por exemplo, o volume molar da água pura é 18 cm 3 /mol, conforme mostrado no cálculo
baixa pressão e alta temperatura
 É um dos estados da matéria, não tem forma e volume definidos, e consiste em uma coleção de partículas cujos os movimentos são aproximadamente aleatórios. As forças de coesão entre as partículas que formam
É um dos estados da matéria, não tem forma e volume definidos, e consiste em uma coleção de partículas cujos os movimentos são aproximadamente aleatórios. As forças de coesão entre as partículas que formam
06) Considere a aparelhagem desenhada a seguir, empregada para testes de condutividade elétrica. O teste deu positivo com qual dos líquidos?
 TEORIA DE ARRHENIUS 01) (Puc-SP) Dados os compostos A: CH 3 COONa (Sal: acetato de sódio) B: CH 3 COOH (ácido acético) C: CH 3 CH 2 OH (álcool etílico) D: C 6 H 12 O 6 (glicose) Pede-se: a) Quais os que
TEORIA DE ARRHENIUS 01) (Puc-SP) Dados os compostos A: CH 3 COONa (Sal: acetato de sódio) B: CH 3 COOH (ácido acético) C: CH 3 CH 2 OH (álcool etílico) D: C 6 H 12 O 6 (glicose) Pede-se: a) Quais os que
Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio.
 EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
12º CONGRESSO IBEROAMERICANO DE ENGENHARIA MECANICA Guayaquil, 10 a 13 de Novembro de 2015
 12º CONGRESSO IBEROAMERICANO DE ENGENHARIA MECANICA Guayaquil, 10 a 13 de Novembro de 2015 EXPERIMENTOS NUMÉRICOS COM MÉTODOS DE REDUÇÃO EM EQUILÍBRIO DE FASES RESUMO Loena Marins Couto¹, Gustavo Mendes
12º CONGRESSO IBEROAMERICANO DE ENGENHARIA MECANICA Guayaquil, 10 a 13 de Novembro de 2015 EXPERIMENTOS NUMÉRICOS COM MÉTODOS DE REDUÇÃO EM EQUILÍBRIO DE FASES RESUMO Loena Marins Couto¹, Gustavo Mendes
Capítulo III. Coeficientes de Actividade
 Capítulo Coeficientes de Actividade Fundamentals of Analytical Chemistry D. A. Skoog, D. M. West and F. J. Holler, Saunders College Publishing 7 th Edition onic Equilibrium A Mathematical Approach Butler,
Capítulo Coeficientes de Actividade Fundamentals of Analytical Chemistry D. A. Skoog, D. M. West and F. J. Holler, Saunders College Publishing 7 th Edition onic Equilibrium A Mathematical Approach Butler,
UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPARTAMENTO ACADÊMICO DE MECÂNICA CURSO DE ENGENHARIA MECÂNICA PAOLO FURLANETTO FERRARI
 UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPAAMENTO ACADÊMICO DE MECÂNICA CURSO DE ENGENHARIA MECÂNICA PAOLO FURLANETTO FERRARI ESTUDO TEÓRICO E EXPERIMENTAL DO EQUILÍBRIO DE FASES DE HIDRATOS DE DIÓXIDO
UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPAAMENTO ACADÊMICO DE MECÂNICA CURSO DE ENGENHARIA MECÂNICA PAOLO FURLANETTO FERRARI ESTUDO TEÓRICO E EXPERIMENTAL DO EQUILÍBRIO DE FASES DE HIDRATOS DE DIÓXIDO
Fundamentos da modelagem Molecular - 1
 Fundamentos da modelagem Molecular - 1 Departamento de Física UFPel ufpellogo Introdução Rotas para a pesquisa Conexão entre experimento, simulação e teoria Sistema real Fazer modelos do sistema Fazer
Fundamentos da modelagem Molecular - 1 Departamento de Física UFPel ufpellogo Introdução Rotas para a pesquisa Conexão entre experimento, simulação e teoria Sistema real Fazer modelos do sistema Fazer
Processos Superficiais Adsorção
 Adsorção em Sólidos - quando se mistura um sólido finamente dividido em uma solução diluída de corante, observamos que a intensidade da coloração decresce pronunciadamente; - se é sólido e gás a pressão
Adsorção em Sólidos - quando se mistura um sólido finamente dividido em uma solução diluída de corante, observamos que a intensidade da coloração decresce pronunciadamente; - se é sólido e gás a pressão
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
LISTA DE EXERCÍCIOS 1º ANO
 GAB LISTA - 11 a) Elemento: Carbono; número de massa do isótopo do carbono com 8 nêutrons:14 b) Moléculas com ligações polares: (figura 01) Moléculas com ligações apolares: (figura 02) a) Observe a figura
GAB LISTA - 11 a) Elemento: Carbono; número de massa do isótopo do carbono com 8 nêutrons:14 b) Moléculas com ligações polares: (figura 01) Moléculas com ligações apolares: (figura 02) a) Observe a figura
CQ110 : Princípios de FQ
 CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
08/08/2017. Objetivos da aula
 Objetivos da aula Desenvolver a capacidade de preparar uma solução em diferentes unidades de expressão de concentração. Compreender o mecanismo de dissolução de uma substância e os fatores que afetam a
Objetivos da aula Desenvolver a capacidade de preparar uma solução em diferentes unidades de expressão de concentração. Compreender o mecanismo de dissolução de uma substância e os fatores que afetam a
Classificação Solução Colóide Suspensão Exemplo: açúcar na água, sal de cozinha na água, álcool hidratado.
 Química - Unidade 5 de 12: GOVERNO DO ESTADO DE MATO GROSSO DO SUL Conteúdo 10: Dispersões (definição,classificação, e características) Habilidade e competência: Identificar a diferença entre dispersões,
Química - Unidade 5 de 12: GOVERNO DO ESTADO DE MATO GROSSO DO SUL Conteúdo 10: Dispersões (definição,classificação, e características) Habilidade e competência: Identificar a diferença entre dispersões,
Estudo cinético para adsorção das parafinas C 11, C 12 e C 13 em zeólita 5A.
 Estudo cinético para adsorção das parafinas C 11, C 12 e C 13 em zeólita 5A. Alunos: Amon de Abreu Brito e Luciano Sampaio dos Santos Orientadores: Luiz Antônio Magalhães Pontes e Elba Gomes dos Santos
Estudo cinético para adsorção das parafinas C 11, C 12 e C 13 em zeólita 5A. Alunos: Amon de Abreu Brito e Luciano Sampaio dos Santos Orientadores: Luiz Antônio Magalhães Pontes e Elba Gomes dos Santos
FORMAÇÃO DE HIDRATOS EM PERFURAÇÕES DE POÇOS EM AGUAS PROFUNDAS E ULTRA PROFUNDAS
 FORMAÇÃO DE HIDRATOS EM PERFURAÇÕES DE POÇOS EM AGUAS PROFUNDAS E ULTRA PROFUNDAS Ilean José Ferreira lima Verçosa (1); Vitória Camila Paixão dos Santos (1); Fabrícia Medeiros Santandrea (2); Marcos Alexandre
FORMAÇÃO DE HIDRATOS EM PERFURAÇÕES DE POÇOS EM AGUAS PROFUNDAS E ULTRA PROFUNDAS Ilean José Ferreira lima Verçosa (1); Vitória Camila Paixão dos Santos (1); Fabrícia Medeiros Santandrea (2); Marcos Alexandre
Energia, calor, entalpia e variação de entalpia.
 Combustíveis Energia e Ambiente De onde vem a energia dos combustíveis? Energia, calor, entalpia e variação de entalpia. Sistema; Universo; Sistema Aberto, Fechado e Isolado; Estado final e Inicial; Energia
Combustíveis Energia e Ambiente De onde vem a energia dos combustíveis? Energia, calor, entalpia e variação de entalpia. Sistema; Universo; Sistema Aberto, Fechado e Isolado; Estado final e Inicial; Energia
O Processo de Dissolução
 O Processo de Dissolução Uma solução é uma mistura homogênea de soluto (presente em menor quantidade) e solvente (presente em maior quantidade). Os solutos e solvente são componentes da solução. No processo
O Processo de Dissolução Uma solução é uma mistura homogênea de soluto (presente em menor quantidade) e solvente (presente em maior quantidade). Os solutos e solvente são componentes da solução. No processo
Propriedades das soluções
 Propriedades das soluções O processo de dissolução O soluto e o solvente são componentes da solução. Uma solução é uma mistura homogênea de soluto (presente em menor quantidade) e solvente (presente em
Propriedades das soluções O processo de dissolução O soluto e o solvente são componentes da solução. Uma solução é uma mistura homogênea de soluto (presente em menor quantidade) e solvente (presente em
Soluções Curva de solubilidade, concentrações e preparo de soluções Professor Rondinelle Gomes Pereira
 Soluções Definição: São misturas homogêneas, ou seja, mistura de dois ou mais componentes apresentando uma única fase contínua. As soluções são compostas por um ou mais soluto e um ou mais solvente. Soluto:
Soluções Definição: São misturas homogêneas, ou seja, mistura de dois ou mais componentes apresentando uma única fase contínua. As soluções são compostas por um ou mais soluto e um ou mais solvente. Soluto:
ADSORÇÃO MULTICOMPONENTE DE CO2 E CH4 EM CARBONO ATIVADO PARA PROCESSOS DE PURIFICAÇÃO DE BIOGÁS
 ADSORÇÃO MULTICOMPONENTE DE CO2 E CH4 EM CARBONO ATIVADO PARA PROCESSOS DE PURIFICAÇÃO DE BIOGÁS C.A. ALVES 1, M. CANTILLO-CASTRILLÓN 1, M. BASTOS-NETO 1 e D.C.S. AZEVEDO 1 1 Universidade Federal do Ceará,
ADSORÇÃO MULTICOMPONENTE DE CO2 E CH4 EM CARBONO ATIVADO PARA PROCESSOS DE PURIFICAÇÃO DE BIOGÁS C.A. ALVES 1, M. CANTILLO-CASTRILLÓN 1, M. BASTOS-NETO 1 e D.C.S. AZEVEDO 1 1 Universidade Federal do Ceará,
ESTUDO DA INJEÇÃO DE VAPOR E SOLVENTE EM RESERVATÓRIOS COM CARACTERÍSTICAS SEMELHANTE AO DO NORDESTE BRASILEIRO
 ESTUDO DA INJEÇÃO DE VAPOR E SOLVENTE EM RESERVATÓRIOS COM CARACTERÍSTICAS SEMELHANTE AO DO NORDESTE BRASILEIRO D. A. R. Silva 1 e J. L. M. Barillas 2 12 Universidade Federal do Rio Grande do Norte, Centro
ESTUDO DA INJEÇÃO DE VAPOR E SOLVENTE EM RESERVATÓRIOS COM CARACTERÍSTICAS SEMELHANTE AO DO NORDESTE BRASILEIRO D. A. R. Silva 1 e J. L. M. Barillas 2 12 Universidade Federal do Rio Grande do Norte, Centro
T constante 0 1 X 1. líquido. Líquido + vapor. vapor X 1
 1 PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ - UTFPR DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA BACHARELADO EM QUÍMICA / LICENCIATURA
1 PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ - UTFPR DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA BACHARELADO EM QUÍMICA / LICENCIATURA
Propriedades Físicas e Químicas dos Compostos Orgânicos
 Aumenta Propriedades das Moléculas Orgânicas Propriedades Físicas e Químicas dos Compostos Orgânicos A partir das ligações químicas que unem os átomos de suas moléculas, e das forças que agem entre elas
Aumenta Propriedades das Moléculas Orgânicas Propriedades Físicas e Químicas dos Compostos Orgânicos A partir das ligações químicas que unem os átomos de suas moléculas, e das forças que agem entre elas
30/03/2017 Química Licenciatura Prof. Udo Eckard Sinks SOLUÇÕES E SOLUBILIDADE
 SOLUÇÕES E SOLUBILIDADE 1. Objetivos Aprender a preparar soluções usando balão volumétrico Reconhecer soluções diluídas, saturadas e supersaturadas Observar a termodinâmica do processo de dissolução 2.
SOLUÇÕES E SOLUBILIDADE 1. Objetivos Aprender a preparar soluções usando balão volumétrico Reconhecer soluções diluídas, saturadas e supersaturadas Observar a termodinâmica do processo de dissolução 2.
2 Considerações teóricas
 2 Considerações teóricas Uma breve abordagem termodinâmica e cinética do sistema reacional Cu- Ni/Al 2 O 3, será apresentada neste capitulo. As previsões teóricas do comportamento reacional do sistema
2 Considerações teóricas Uma breve abordagem termodinâmica e cinética do sistema reacional Cu- Ni/Al 2 O 3, será apresentada neste capitulo. As previsões teóricas do comportamento reacional do sistema
