REPRODUÇÃO DO EXPERIMENTO DA GOTA SALINA COM CARACTERIZAÇÃO DE MATERIAIS: UMA VISÃO INTERDISCIPLINAR
|
|
|
- Malu Azambuja Castanho
- 7 Há anos
- Visualizações:
Transcrição
1 REPRODUÇÃO DO EXPERIMENTO DA GOTA SALINA COM CARACTERIZAÇÃO DE MATERIAIS: UMA VISÃO INTERDISCIPLINAR C. V. C. Moreira 1, J. A. Cirino 1, J. V. S. L. Beltrão 1, J. V. S. Pereira 1, L. H. G. da Silva 1, L. M. C. da Silva, R. A. Galvão 1,2, R. R. M. Silva 1, R. F. A. Sarinho 1,2, T. M. F. dos Anjos 1, T. V. C. Silva 1, M. R. S. Vieira 1, 1 Departamento de Engenharia Mecânica (DEMEC), Centro de Tecnologia e Geociências (CTG), Universidade Federal de Pernambuco - UFPE, Recife-PE, Brasil. 2 Centro de Tecnologias Estratégicas do Nordeste (CETENE), Recife-PE, Brasil. magrsv@hotmail.com Resumo A natureza do processo de corrosão foi comprovada pela primeira vez, em 1926, por Evans, que desenvolveu um experimento conhecido como Gota Salina, permitindo ilustrar a ocorrência de uma pilha de ação local, por meio de um experimento de baixo custo. O presente trabalho teve por objetivo reproduzir o experimento da gota salina em chapas de aço estrutural (ASTM 572 Gr50) e tampas metálicas de refrigerante, visando identificar e comprovar a natureza eletroquímica do processo corrosivo e realizar a caracterização desses materiais com estudantes do curso de engenharia de materiais da UFPE, visando uma abordagem interdisciplinar. Para a obtenção da gota salina utilizou-se uma solução de NaCl (3,5%), contendo os indicadores ferricianeto de potássio e fenolftaleína. As técnicas usadas para analisar a morfologia e a composição dos produtos de corrosão foram: microscopia óptica, microscopia eletrônica de varredura e Espectroscopia de Energia Dispersiva. Palavras-Chave: Corrosão, Gota Salina, Experimento de Evans, Engenharia de Materiais, Interdisciplinaridade. 9825
2 INTRODUÇÃO Em nosso dia a dia damos pouca atenção a fenômenos que parecem corriqueiros, como grades e maçanetas enferrujadas, e não nos perguntamos o que leva àquela situação. A ferrugem nada mais é do que óxido de ferro hidratado (Fe2O3.H2O), formado pela interação entre um material ferroso e o meio ambiente ao qual está exposto, que em nosso cotidiano está representado pela atmosfera, a qual é rica em oxigênio e, dependendo da localização geográfica, possui maior ou menor quantidade de vapor d água. Para que o processo corrosivo ocorra é necessária a presença de quatro componentes básicos: eletrólito - meio condutor, responsável pela transferência eletrônica; anodo - eletrodo que sofre corrosão; catodo - eletrodo no qual ocorre a reação de redução; contato metálico - ligação entre os eletrodos. Esses são os elementos que compõem as pilhas de corrosão, entretanto dizer que é necessária a presença de catodo, anodo e contato metálico não é o mesmo que dizer que são necessários três diferentes materiais, pois eles podem estar presentes em uma mesma peça metálica pela presença de heterogeneidades na estrutura, as quais levam à formação de áreas anódicas e catódicas em um mesmo metal - o contato metálico, neste caso, é a própria peça (1). O eletrólito, por outro lado, é sempre representado por uma fase a parte, contendo espécies iônicas, as quais estão presentes como um líquido depositado sobre o metal ou na forma de vapor. Dentre as espécies iônicas mais discutidas em relação a meios corrosivos estão os íons cloretos (Cl - ), pois estes possuem elevado poder corrosivo, em especial nos aços, além de estarem presentes em atmosferas comuns - litorâneas, industriais, próximas a piscinas, etc. -, constituindo-se como potenciais agentes corrosivos. Devido ao grande impacto do processo corrosivo no meio industrial, agravado quando em ambientes litorâneos devido à presença dos íons cloreto, sendo esta uma realidade do Complexo Industrial e Portuário de SUAPE (Ipojuca PE), o qual está situado em local próximo à Universidade onde esse estudo foi desenvolvido, uma formação diferenciada nesta área é relevante para uma boa formação dos estudantes de engenharia. Neste contexto, alinhar conhecimentos teóricos e práticos atua como uma maneira de solidificar a base do estudante para desafios que irão surgir em sua vida profissional. 9826
3 Um modo prático de acompanhar interações que ocorrem em ambientes marítimos e que exercem influência no processo corrosivo é através do experimento de Evans, que consiste em depositar uma gota de solução salina (NaCl) contendo indicadores de íons ferrosos e de ph (composto por fenolftaleína e ferricianeto de potássio) a superfície de uma chapa de aço previamente limpa. Apesar de relativamente simples, o experimento traz a possibilidade de abordar de maneira prática conceitos relacionados à eletroquímica e à química, como transferência de elétrons, movimento de íons, reações redox, catodo, anodo, célula eletroquímica, agente oxidante, agente redutor, solubilidade, indicadores ácido-base, ph, cinética de uma reação e equilíbrio químico (2). Com isso, a experiência se torna um importante parceiro na prática pedagógica do ensino de corrosão, permitindo aliar os conhecimentos teóricos aos práticos. O presente trabalho teve como objetivo reproduzir o experimento da gota salina em chapas de aço estrutural (ASTM 572 Gr50) e tampas metálicas de refrigerante, visando acompanhar o efeito dos íons cloreto no processo corrosivo a partir da formação de micropilhas de concentração diferencial, realizando a caracterização desses materiais com estudantes do curso de engenharia de materiais da UFPE, visando uma abordagem interdisciplinar da temática corrosão. METODOLOGIA Na presente prática foi adotado o procedimento experimental proposto pela professora orientadora, o qual está descrito a seguir. Foi solicitado à turma a entrega de relatório técnico acerca das atividades realizadas. Preparo dos Corpos de Prova Foram utilizados como corpos de prova barras de aço carbono estrutural ASTM 572 Gr50 e tampinhas metálicas de refrigerante. Todos os corpos de prova foram lixados em uma politriz para lixamento mecânico utilizando diferentes granulometrias (220, 320 e 600, 800 e 1200#) como tratamento superficial. Após lixamento, as amostras foram lavadas com água destilada, e submetidas à lavagem em banho ultrassônico em isopropanol (5 minutos) e acetona (5 minutos) de forma a remover oleosidades e outras sujidades presentes na superfície do 9827
4 material. Por último, os corpos de prova foram secos com jato de ar quente durante 3 minutos. Preparo de Solução Utilizada no Experimento da Gota Salina Para preparo da solução utilizada no experimento a gota salina, fez-se uso de solução aquosa a 3,5% m/v (solução I) de NaCl e como indicadores foram utilizadas uma solução de ferricianeto de potássio 1% m/v em meio aquoso e solução etanólica de fenolftaleína 1% m/v. A solução da gota salina (solução IV) foi obtida misturando-se 100 ml da solução I com 3,0 ml da solução II e 0,5 ml da solução III. Ensaio da Gota Salina Sobre a superfície dos corpos de prova previamente lixados e limpos, verteu-se gota (cerca de 0,5 ml) da solução IV. Paralelamente uma amostra foi levada para o microscópio ótico para registro, onde teve uma gota de aproximadamente 10 ul vertida em sua superfície. As alterações superficiais observadas nas amostras submetidas à gota de 1 ml foram registradas por meio de câmera fotográfica digital e foi utilizada lupa para que pudessem ser melhor observadas durante a realização do experimento. Caracterização das amostras submetidas ao ensaio da gota salina A microestrutura foi analisada por meio de microscopia óptica (MO) e microscopia eletrônica de varredura (MEV) com Espectrômetro por Energia Dispersiva (EDS) acoplado, em três regiões da gota (centro, borda e intermediária). Após análise inicial, as amostras foram lixadas suavemente com lixa 1200# para remoção dos produtos de corrosão, lavadas com etanol e secas ao ar quente, para então serem novamente analisadas por MO e MEV. Uma amostra do metal base foi preparada para análise comparativa aos corpos de prova ensaiados. Elaboração e Aplicação de Questionário Avaliativo Após entrega dos relatórios a turma foi convidada a avaliar a atividade por meio de um questionário baseado na escala Likert (1932) (3), onde foram propostas as categorias: discordo plenamente(1); discordo parcialmente(2); indiferente (3); concordo parcialmente (4) e concordo plenamente(5). O questionário utilizado nessa pesquisa é apresentado no Quadro
5 Quadro 1: Questionário aplicado à turma para avaliação da aceitação da atividade proposta. N Proposições O experimento proposto possibilitou a consolidação da temática corrosão. 2 Os procedimentos experimentais foram de fácil execução. 3 O experimento proporcionou uma abordagem interdisciplinar com outros conteúdos do curso de engenharia de materiais. 4 A prática da gota salina é capaz de abordar a temática corrosão de forma contextualizada. 5 A associação do experimento da gota salina com técnicas de caracterização microscópicas permitiu uma melhor compreensão sobre o fenômeno de corrosão. 6 A execução da atividade em grupos proporcionou uma efetiva interatividade para discussão das observações experimentais efetuadas. 7 A proposta de execução de um relatório sobre o experimento promoveu integração entre a teoria e a prática. 8 Atividades desta natureza despertam um maior interesse pela disciplina. RESULTADOS E DISCUSSÃO Acompanhamento do experimento Imediatamente após a deposição da gota foi observada a formação de regiões de coloração azulada e de regiões de coloração rosada distribuídas de forma aleatória, conforme Figura 1a. As regiões de cor azulada se devem à alteração de cor do indicador ferricianeto de potássio em presença de íons ferrosos, enquanto as regiões rosadas, ao indicador fenolftaleína em presença de OH -. Essa distribuição aleatória está relacionada a uma não-uniformidade da quantidade de oxigênio no interior da solução. Nessa etapa, o oxigênio que participa da reação redox é apenas aquele contido na gota. O metal terá a função de redutor, cedendo elétrons para o meio corrosivo, e o receptor de elétrons estará no mesmo ponto da superfície do metal. 9829
6 Figura 1. Modificações na superfície observadas ao longo do ensaio da gota salina em função do tempo: (a) imediatamente após deposição da gota; (b) após 2 minutos; (c) após 5 minutos; (d) após 8 minutos, (e) após 13 minutos e (f) após 30minutos. Observações das superfícies nos tempos seguintes mostram a alteração de uma distribuição primária aleatória para uma distribuição ordenada (figuras 1b-1e), ficando a área rósea na periferia da gota e a área azul no centro (distribuição secundária), com a formação de um anel incolor e um precipitado de coloração marrom entre as duas áreas (Figura 1f). A mudança do tipo de distribuição iônica, observada no experimento, ocorre devido ao consumo de todo o oxigênio no interior da solução nos primeiros minutos após a deposição da gota; como as regiões mais externas da gota estão em contato direto com o meio, o qual é aerado, irá ocorrer difusão do oxigênio da superfície para o interior da gota, levando à existência de oxigênio disponível nesta região para que ocorra a formação de íons OH -, responsáveis pela coloração rosa observada nos tempos posteriores, após o consumo do oxigênio dissolvido na solução. Nessa etapa, o oxigênio atmosférico é responsável por repor o oxigênio consumido na semirreação de redução. Conforme dito anteriormente, o indicador ferricianeto de potássio adquire coloração azulada pela presença de íons ferrosos, os quais seguem a reação descrita na equação (1). Como neste caso há elétrons como produtos da reação, temos que esta se trata de uma reação de oxidação e, consequentemente, esta será a região anódica da pilha de corrosão formada. Fe Fe e - Eq. (1) 9830
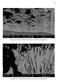
7 Já o indicador fenolftaleína adquire coloração rósea pela formação de íons hidroxila ocasionada pelo consumo do oxigênio dissolvido na solução, de acordo com a reação da equação (2). Aqui há consumo de elétrons para que a reação ocorra, logo se trata de uma reação de redução. Portanto, as regiões da solução que adquirem esta coloração se encontram na região catódica da pilha de corrosão. O2 + 2H2O + 4e - 4OH - Eq. (2) A equação 2 é conhecida também como reação de redução do oxigênio em água. Esta reação ocorre graças aos elétrons que são gerados pela reação anódica e que se deslocam através do metal da região azul para a região rosa, isto é, da região anódica para a região catódica. Assim, as duas reações acima ocorrem simultaneamente graças à passagem de corrente elétrica através do metal, seguindo o fluxo da região em que ocorre dissolução do metal (região anódica) para a região em que ocorre a redução do oxigênio (região catódica). Estas reações, de natureza eletroquímica, constituem-se em reações básicas do processo corrosivo que tem lugar dentro da gota salina. A interação entre as espécies geradas nos eletrodos (regiões anódica e catódica) e o oxigênio do meio leva à formação de um composto intermetálico insolúvel (Equação 3), responsável pela formação do anel esbranquiçado visto na Figura 1f, bem como do produto de corrosão (Equação 4), de cor marrom, melhor observado na Figura 2. 2Fe OH - + ½ O2 2FeOOH + H2O Eq. (3) 8FeOOH + Fe e - 3Fe3O4 + 4H2O Eq. (4) Comparando as imagens da Figura 1f com a Figura 2 vemos que esse modelo é válido, pois a região da superfície metálica que se encontrava abaixo da região da gota que possuía coloração rósea não sofreu corrosão. A partir da análise das imagens obtidas por MEV (Figura 3) é possível ver o efeito corrosivo da solução salina na superfície do aço, bem como as diferenças estruturais das regiões do centro e da borda da gota. A região central (Figura 3a) é claramente mais porosa do que as regiões intermediárias e, em especial, periféricas (Figuras 3b e 3c). Isso é esperado, pois a formação do óxido se dá 9831
8 preferencialmente nessa região, conforme descrito pelas equações anteriores, sendo limitada pela região intermediária, onde a porosidade observada é uma média das porosidades das outras regiões. A porosidade da região mais interna é maior pois ela é a região anódica da pilha de corrosão, onde há o maior consumo de metal. As porosidades observadas nas outras regiões podem ser devidas às micropilhas de corrosão formadas imediatamente após a deposição da gota, visto que tanto o diâmetro quanto a profundidade aparente da corrosão nessas regiões são menores que os observados na região central. Figura 2. Superfície das amostras decorridas 22 horas da realização do ensaio. a) b) c) Figura 3: Imagens de Microscopia Eletrônica de Varredura (a) região central; (b) intermediária e (c) borda da gota salina. Por meio da análise de EDS (Figura 4) foi possível comprovar a presença do NaCl e a formação do óxido de ferro (ferrugem), mostrando que ocorreram as reações descritas anteriormente. O NaCl pode ser detectado pois a gota secou na superfície da amostra e não foi removido o reagente restante antes da realização da análise, o que também retiraria o óxido formado (4). As diferenças nas quantidades de NaCl observadas podem ser devidas a heterogeneidades na solubilização do sal em solução ocorridas no processo de secagem, não estando relacionadas diretamente com o processo corrosivo que ocorre na gota. A presença do oxigênio é devida à adsorção deste na solução. 9832
9 Figura 4: Resultados de EDS das amostras após deposição da gota na (a) região da interface gota meio; (b) borda; (c) intermediária e (d) centro. Os elementos estão identificados no inset da figura (a). As imagens de microscopia óptica (Figura 5) permitem avaliar as mudanças que ocorreram no metal em nível microestrutural. Na Figura 5a vemos a presença de nódulos de perlita nos contornos de grão da ferrita, microestrutura típica esperada 9833
10 para o aço utilizado (5). Já na Figura 5b não é possível identificar as fases presentes com tanta clareza, pois o meio corrosivo no qual a peça ficou imersa provocou a deterioração da superfície do aço, o que é demonstrado pelos diferentes perfis de profundidade observados na imagem. a) b) Figura 5: Imagens de Microscopia Óptica - (a) do metal base e (b) amostra após remoção do produto de corrosão (b). Questionário avaliativo A Figura 6 apresenta os resultados obtidos no questionário apresentado anteriormente na Tabela 1. Fica claro que a avaliação do experimento foi positiva para todos os quesitos propostos, evidenciando a aceitação e o caráter motivador do experimento pelos alunos. Figura 6: Histograma das proposições pela quantidade de respostas. Ressalta-se que a reprodução do experimento da gota salina associado às técnicas de caracterização de materiais, possibilitou uma abordagem interdisciplinar valorizando conteúdos previamente trabalhados pelos estudantes em outras disciplinas, como por exemplo, as técnicas de caracterização, preparação 9834
11 metalográfica e microestrutura dos materiais. Além disso, o experimento também permitiu uma abordagem contextualizada trazendo para sala de aula, situações reais de problemas de corrosão que o estudante poderá se deparar em sua atuação profissional, exemplificando-se, o processo de corrosão de estruturas metálicas expostas a atmosferas marinhas, que corresponde ao fenômeno estudado na prática realizada nesse trabalho. CONCLUSÕES A associação de aspectos teóricos e práticos através de atividades experimentais possibilita a consolidação da construção do conhecimento. O experimento de Evans realizado em sala foi reproduzido com sucesso, permitindo-se abordar a natureza eletroquímica do processo de corrosão por meio da realização de um experimento simples. A proposta do experimento da gota salina integrada a métodos de caracterização de materiais foi importante, pois permitiu correlacionar diferentes saberes já vivenciados pelos estudantes em outras disciplinas, ressaltando-se aqui a importância de temáticas e intervenções de caráter interdisciplinar para o ensino de engenharia. Através da avaliação de aceitação da intervenção pedagógica por meio de questionário identificou-se que a prática desenvolvida atuou como instrumento educacional motivador e facilitador no processo ensino-aprendizagem de corrosão, colaborando para a construção do conhecimento de forma contextualizada, interdisciplinar, e integradora entre os aspectos teóricos e práticos. REFERÊNCIAS (1) GENTIL, V. Corrosão. 5.ed. Rio de Janeiro: Livros técnicos e científicos, (2) Wartha, E.J.; Guzzi Filho, N.J.; Jesus, R.M. O experimento da gota salina e os níveis de representação em química. Educ. quím., 23(1), 55-61, Universidad Nacional Autónoma de México, ISSN X. (3) Brandalise, L. T. Modelos De Medição De Percepção e Comportamento Uma Revisão. Disponível online em: < 9835
12 O_DE_PERCEP%C3%87%C3%83O_E_COMPORTAMENTO_UMA_REVIS %C3%83O>. Acesso em Agosto de (4) WOLYNEE, S. Técnicas Eletroquímicas em Corrosão. São Paulo: Editora da Universidade de São Paulo, (5) REIS, E.G. "Modelo Matemático para Previsão das Propriedades Mecânicas na Laminação a Quente de Perfis Estruturais. Dissertação de Mestrado apresentada ao Curso de Pós-Graduação em Engenharia Metalúrgica e de Minas da Universidade Federal de Minas Gerais. Disponível online em < acesso em Julho de SALINE DROP EXPERIMENT REPRODUCTION WITH MATERIALS CHARACTERIZATIONS: AN INTERDISCIPLINARY VISION. Abstract The corrosion process nature was proved the first time by Evans in 1926, that developed an experiment known as Saline Drop, it allowing to illustrate the occurrence of a local action cell by using a low-cost experiment. This work had as objective to reproduce this experience on structural steel plates (ASTM 572 Gr50) and refrigerant metal caps, aiming to identify and prove the electrochemical nature of corrosion process and characterize these materials with materials engineering students of UFPE, trying and interdisciplinary approach. To obtain de saline drop it was used a NaCl (3,5%) solution with potassium ferricyanide and phenolphthalein indicators. To analyze the morphology and corrosion products composition, there were used Optical Microscopy, Scanning Electron Microscopy and Energy Dispersive Spectroscopy. Key-words: Corrosion, Saline Drop, Evans Experience, Materials Engineering, Interdisciplinary. 9836
Disciplina: Química Professor: Lourival Neto Cidade: Uberlândia
 Disciplina: Química Professor: Lourival Neto Cidade: Uberlândia Introdução Corrosão Tipos de corrosão Corrosão Eletroquímica Exemplos e reações Corrosão Química Exemplos e reações Corrosão Eletrolítica
Disciplina: Química Professor: Lourival Neto Cidade: Uberlândia Introdução Corrosão Tipos de corrosão Corrosão Eletroquímica Exemplos e reações Corrosão Química Exemplos e reações Corrosão Eletrolítica
Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle
 Curso Técnico Integrado em Química Físico-química III VÍDEO AULA Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle 1 Professor: Me. Sebastião Junior T. Vasconcelos
Curso Técnico Integrado em Química Físico-química III VÍDEO AULA Corrosão: Definições e implicações práticas Aspectos termodinâmicos Formas de controle 1 Professor: Me. Sebastião Junior T. Vasconcelos
CORROSÃO PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES. Prof. Mazer AULA 05
 AULA 05 Prof. Mazer PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES 2 FUNDAMENTOS GERAIS: O concreto protege a armadura de duas formas: - Confere uma barreira física separando o aço do meio-ambiente - A água no
AULA 05 Prof. Mazer PATOLOGIA E RECUPERAÇÃO DAS CONSTRUÇÕES 2 FUNDAMENTOS GERAIS: O concreto protege a armadura de duas formas: - Confere uma barreira física separando o aço do meio-ambiente - A água no
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA
 GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA Aulas de Apoio Química 3ª Série Eletroquímica II 1.
GOVERNO DO ESTADO DO RIO DE JANEIRO SECRETARIA DE ESTADO DE CIÊNCIA E TECNOLOGIA FUNDAÇÃO DE APOIO À ESCOLA TÉCNICA ESCOLA TÉCNICA ESTADUAL REPÚBLICA Aulas de Apoio Química 3ª Série Eletroquímica II 1.
Prof André Montillo
 Prof André Montillo www.montillo.com.br Reações de Oxido-Redução Definição: São as reações químicas onde ocorre a variação dos números de oxidação (Nox) das substâncias envolvidas. Portanto haverá transferência
Prof André Montillo www.montillo.com.br Reações de Oxido-Redução Definição: São as reações químicas onde ocorre a variação dos números de oxidação (Nox) das substâncias envolvidas. Portanto haverá transferência
TEORIA E PRÁTICA: ATIVIDADES EXPERIMENTAIS PARA O ENSINO DE PILHAS ELETROQUÍMICAS NA ENGENHARIA
 TEORIA E PRÁTICA: ATIVIDADES EXPERIMENTAIS PARA O ENSINO DE PILHAS ELETROQUÍMICAS NA ENGENHARIA Vieira, M.R.S. (1)* ; Pletsch, R.O. (1) ; De Melo, F. A. C. (1) ; De Oliveira, S. H. (1) ; Urtiga Filho,
TEORIA E PRÁTICA: ATIVIDADES EXPERIMENTAIS PARA O ENSINO DE PILHAS ELETROQUÍMICAS NA ENGENHARIA Vieira, M.R.S. (1)* ; Pletsch, R.O. (1) ; De Melo, F. A. C. (1) ; De Oliveira, S. H. (1) ; Urtiga Filho,
PMT AULAS 1 E 2 Augusto Camara Neiva. PMT Augusto Neiva
 PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
No ensino de eletroquímica, são observadas inúmeras
 Espaço Aberto : Um Experimento Investigativo, Construtivo e Interdisciplinar Larissa Aparecida Corrêa Matos, Neide Hiroko Takata e Everson do Prado Banczek O ensino de química tem sido marcado pela fragmentação
Espaço Aberto : Um Experimento Investigativo, Construtivo e Interdisciplinar Larissa Aparecida Corrêa Matos, Neide Hiroko Takata e Everson do Prado Banczek O ensino de química tem sido marcado pela fragmentação
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
15. Trabalho Experimental - Proteção Catódica
 15. Trabalho Experimental - Proteção Catódica 15.1 - Introdução A proteção catódica é um método de controle de corrosão que consiste em transformar a estrutura à proteger no cátodo de um célula eletroquímica
15. Trabalho Experimental - Proteção Catódica 15.1 - Introdução A proteção catódica é um método de controle de corrosão que consiste em transformar a estrutura à proteger no cátodo de um célula eletroquímica
Índice. Agradecimentos... Prefácio da Edição Revisada... Prefácio...
 Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
OXIDAÇÃO DE METAIS INTRODUÇÃO
 OXIDAÇÃO DE METAIS INTRODUÇÃO Oxidação é uma palavra do âmbito da química que significa a perda de elétrons, mesmo que não seja causada pelo oxigênio. Indica também o processo de oxidar, ou seja, de combinar
OXIDAÇÃO DE METAIS INTRODUÇÃO Oxidação é uma palavra do âmbito da química que significa a perda de elétrons, mesmo que não seja causada pelo oxigênio. Indica também o processo de oxidar, ou seja, de combinar
PMT CORROSÃO E PROTEÇÃO DOS MATERIAIS
 Corrosão em Fresta Abertura estreita junções: gaxetas, parafusos depósitos; produtos aderidos Materiais passivos Al; Ti Exemplo: liga 825 (44Ni-22Cr- 3Mo-2Cu) - água do mar 6 meses Trocador de calor com
Corrosão em Fresta Abertura estreita junções: gaxetas, parafusos depósitos; produtos aderidos Materiais passivos Al; Ti Exemplo: liga 825 (44Ni-22Cr- 3Mo-2Cu) - água do mar 6 meses Trocador de calor com
HIDROMETALURGIA E ELETROMETALURGIA. Prof. Carlos Falcão Jr.
 HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
O PROCESSO DA OXIRREDUÇÃO NA MARESIA: UM ESTUDO NO PROJETO INTEGRADOR
 O PROCESSO DA OXIRREDUÇÃO NA MARESIA: UM ESTUDO NO PROJETO INTEGRADOR Luca, Anelise Grünfeld de 1 ; Borba, Eliakin Sato de 2 ; Filho, Erich Grünfeld 3 ; Nascimento, Lara Santana 4 : Graciano, Mariane Rodrigues
O PROCESSO DA OXIRREDUÇÃO NA MARESIA: UM ESTUDO NO PROJETO INTEGRADOR Luca, Anelise Grünfeld de 1 ; Borba, Eliakin Sato de 2 ; Filho, Erich Grünfeld 3 ; Nascimento, Lara Santana 4 : Graciano, Mariane Rodrigues
e - Zinco ZnSO 4 Zn(s) Zn 2 Zn(s) Zn 2+ (aq) + 2 e - + 0,76 V Cu(s) Cu 2+ (aq) + 2 e - - 0,34 V
 Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
Capítulo 7 Introdução teórica Pilhas e baterias são células eletroquímicas ou células galvânicas que produzem energia elétrica por meio de reações de oxirredução. A diferença básica é que a bateria é formada
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
02/10/2017 ELETRÓLISE AQUOSA
 ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
PROMILITARES 20/09/2018 QUÍMICA. Professora Caroline Azevedo ELETROQUÍMICA. Eletroquímica. Você precisa saber o que é oxidação e redução!
 QUÍMICA Professora Caroline Azevedo ELETROQUÍMICA Eletroquímica Você precisa saber o que é oxidação e redução! Pilha É o nome dado ao dispositivo que aproveita a transferência de elétrons em uma reação
QUÍMICA Professora Caroline Azevedo ELETROQUÍMICA Eletroquímica Você precisa saber o que é oxidação e redução! Pilha É o nome dado ao dispositivo que aproveita a transferência de elétrons em uma reação
A A A A A A A A A A A A A A A. > Na+ QUÍMICA
 QUÍMIC 1 Dois eletrodos conectados a uma lâmpada foram introduzidos em uma solução aquosa, a fim de que a luminosidade da lâmpada utilizada avaliasse a condutividade da solução. Desta forma, foram feitos
QUÍMIC 1 Dois eletrodos conectados a uma lâmpada foram introduzidos em uma solução aquosa, a fim de que a luminosidade da lâmpada utilizada avaliasse a condutividade da solução. Desta forma, foram feitos
CQ049 FQ Eletroquímica.
 CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti A Eletroquímica pode ser dividida em duas áreas: Iônica: Está
CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti A Eletroquímica pode ser dividida em duas áreas: Iônica: Está
01) O elemento X reage com o elemento Z, conforme o processo: Nesse processo: Z 3 + X Z 1 + X 2. b) X ganha elétrons de Z. d) X e Z perdem elétrons.
 SECRETARIA DE SEGURANÇA PÚBLICA/SECRETARIA DE EDUCAÇÃO POLÍCIA MILITAR DO ESTADO DE GOIÁS COMANDO DE ENSINO POLICIAL MILITAR COLÉGIO DA POLÍCIA MILITAR NADER ALVES DOS SANTOS SÉRIE/ANO: TURMA(S): 2º anos
SECRETARIA DE SEGURANÇA PÚBLICA/SECRETARIA DE EDUCAÇÃO POLÍCIA MILITAR DO ESTADO DE GOIÁS COMANDO DE ENSINO POLICIAL MILITAR COLÉGIO DA POLÍCIA MILITAR NADER ALVES DOS SANTOS SÉRIE/ANO: TURMA(S): 2º anos
Quí. Quí. Monitor: Rodrigo Pova
 Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
Química Geral e Inorgânica. QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin. Eletroquímica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Aula 20 Eletrodeposição
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Corrosão e degradação de materiais. Modificação aparência. Interação Comprometimento pp mecânicas
 Corrosão e degradação de materiais Modificação aparência Interação Comprometimento pp mecânicas Deterioração é diferente para os diversos tipos de materiais: M Dissolução (corrosão) Formação de crosta
Corrosão e degradação de materiais Modificação aparência Interação Comprometimento pp mecânicas Deterioração é diferente para os diversos tipos de materiais: M Dissolução (corrosão) Formação de crosta
EXERCÍCIOS DE ELETROQUÍMICA
 Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
ESTUDO DO EFEITO DA TEMPERATURA DO BANHO NA ELETRODEPOSIÇÃO DA LIGA Fe-Mo
 ESTUDO DO EFEITO DA TEMPERATURA DO BANHO NA ELETRODEPOSIÇÃO DA LIGA Fe-Mo Lorena Vanessa Medeiros Dantas¹; Victória Maria dos Santos Pessigty; Luana Sayuri Okamura; José Anderson Machado Oliveira; Renato
ESTUDO DO EFEITO DA TEMPERATURA DO BANHO NA ELETRODEPOSIÇÃO DA LIGA Fe-Mo Lorena Vanessa Medeiros Dantas¹; Victória Maria dos Santos Pessigty; Luana Sayuri Okamura; José Anderson Machado Oliveira; Renato
Professor: Alfênio. 06- A ilustração a seguir ilustra a eletrólise de uma solução aquosa de cloreto de cobre (II).
 Professor: Alfênio 01- (MACK-SP) Na eletrólise ígnea de NaCl, verifica-se que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição
Professor: Alfênio 01- (MACK-SP) Na eletrólise ígnea de NaCl, verifica-se que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA. paginapessoal.utfpr.edu.br/lorainejacobs. Profª Loraine Jacobs DAQBI
 lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI CORROSÃO Corrosão Processo espontâneo Contato do metal com um eletrólito Reações Anódicas e Catódicas Frequente
lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI CORROSÃO Corrosão Processo espontâneo Contato do metal com um eletrólito Reações Anódicas e Catódicas Frequente
Factores Influentes na Corrosão e Protecção de Metais. Química 12º Ano
 Factores Influentes na Corrosão e Protecção de Metais Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
Factores Influentes na Corrosão e Protecção de Metais Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
Corrosão por frestas em um sistema de tubulação de aço inox 304L causa: soldagem sem penetração completa
 CORROSÃO EM FRESTAS CARACTERÍSTICAS Tipo de corrosão localizada; Frequentemente associada a líquidos estagnados no interior de furos, superfícies de gaxetas, juntas sobrepostas, depósitos superficiais,
CORROSÃO EM FRESTAS CARACTERÍSTICAS Tipo de corrosão localizada; Frequentemente associada a líquidos estagnados no interior de furos, superfícies de gaxetas, juntas sobrepostas, depósitos superficiais,
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
(MACK-SP) Na eletrólise ígnea de NaCl, verificase
 (MACK-SP) Na eletrólise ígnea de NaCl, verificase que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição de NaCl. e) no cátodo,
(MACK-SP) Na eletrólise ígnea de NaCl, verificase que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição de NaCl. e) no cátodo,
3URFHGLPHQWR([SHULPHQWDO
 3URFHGLPHQWR([SHULPHQWDO /LJD(VWXGDGD A liga estudada neste trabalho foi produzida pela firma francesa Pechiney Recherche na forma de placas laminadas de dimensões 270 mm de comprimento por 210 mm de largura
3URFHGLPHQWR([SHULPHQWDO /LJD(VWXGDGD A liga estudada neste trabalho foi produzida pela firma francesa Pechiney Recherche na forma de placas laminadas de dimensões 270 mm de comprimento por 210 mm de largura
Corrosão Metálica. Introdução. O que é corrosão? Classificação dos processos de corrosão. Principais tipos de corrosão
 Corrosão Metálica Introdução O estudo da corrosão de superfícies é importante para a solução de problemas de peças e equipamentos. Ter o conhecimento dos tipos de corrosão existentes, compreender os seus
Corrosão Metálica Introdução O estudo da corrosão de superfícies é importante para a solução de problemas de peças e equipamentos. Ter o conhecimento dos tipos de corrosão existentes, compreender os seus
Equilíbrio químico, pilha e eletrólise.
 Ciências da Natureza Química 2 Gabriela Rosa TRABALHO DE RECUPERAÇÃO FINAL 3ª 35 pts 22,8 pts 12 18 3º A/B Equilíbrio químico, pilha e eletrólise. Instruções: Leia atentamente cada questão antes de resolvê-la.
Ciências da Natureza Química 2 Gabriela Rosa TRABALHO DE RECUPERAÇÃO FINAL 3ª 35 pts 22,8 pts 12 18 3º A/B Equilíbrio químico, pilha e eletrólise. Instruções: Leia atentamente cada questão antes de resolvê-la.
Resumo de Química: Pilhas e eletrólise
 Resumo de Química: Pilhas e eletrólise Número de oxidação (NOX) Nox fixo:1a(+1), 2A (+2), Al +3, Zn +2 e Ag + Nox usual: Hidrogênio (+1), exceto nos hidretos metálicos (-1) e Oxigênio (-2), exceto nos
Resumo de Química: Pilhas e eletrólise Número de oxidação (NOX) Nox fixo:1a(+1), 2A (+2), Al +3, Zn +2 e Ag + Nox usual: Hidrogênio (+1), exceto nos hidretos metálicos (-1) e Oxigênio (-2), exceto nos
Aluno (a): Data: / / Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta à caneta, organizada e completa.
 Disciplina: Química Turma: 2 série Escola SESI Jundiaí Professor: Rosilene Paulino da Silva Aluno (a): Data: / / 2018. Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta
Disciplina: Química Turma: 2 série Escola SESI Jundiaí Professor: Rosilene Paulino da Silva Aluno (a): Data: / / 2018. Obs: Data de entrega: 12/11 (Todas as respostas devem apresentar justificativa) Resposta
Questão 1. (X pontos) Expectativa de resposta
 Questão 1. (X pontos) A acidez e a basicidade de compostos orgânicos podem ser influenciadas por diversos fatores, dentre os quais a ressonância, citada como um exemplo de fator intrínseco. No esquema
Questão 1. (X pontos) A acidez e a basicidade de compostos orgânicos podem ser influenciadas por diversos fatores, dentre os quais a ressonância, citada como um exemplo de fator intrínseco. No esquema
CORROSÃO EM FRESTAS ("crevice corrosion")
 CORROSÃO EM FRESTAS ("crevice corrosion") Corrosão relativamente localizada em frestas de uma peça metálica, ou formadas pela sobreposição de outro metal ou de materiais inertes sobre o metal. Exemplos
CORROSÃO EM FRESTAS ("crevice corrosion") Corrosão relativamente localizada em frestas de uma peça metálica, ou formadas pela sobreposição de outro metal ou de materiais inertes sobre o metal. Exemplos
1- Números de oxidação (Nox) Indicam a espécie que perde elétrons e a que ganha elétrons, ou seja, é a carga elétrica da espécie química.
 Eletroquímica É um ramo da Química que estuda as reações químicas que ocorrem, em um meio envolvendo um condutor (um metal ou um semicondutor) e um condutor iônico (o eletrólito), envolvendo trocas de
Eletroquímica É um ramo da Química que estuda as reações químicas que ocorrem, em um meio envolvendo um condutor (um metal ou um semicondutor) e um condutor iônico (o eletrólito), envolvendo trocas de
Química Geral 2003/2004 Eng. Biomédica
 Química Geral 2003/2004 Eng. Biomédica Trabalho 4 Corrosão e protecção catódica Grupo 1 Turma 21101 1º Turno Data: 31/MAI/2004 Número Nome 54218 Artur Vilão Santos Ferreira 54222 Bruno Miguel Gil Rosa
Química Geral 2003/2004 Eng. Biomédica Trabalho 4 Corrosão e protecção catódica Grupo 1 Turma 21101 1º Turno Data: 31/MAI/2004 Número Nome 54218 Artur Vilão Santos Ferreira 54222 Bruno Miguel Gil Rosa
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA
 QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
Capítulo 2. Experimental.
 Capítulo 2. Experimental. 24 Neste trabalho foram estudados os aços inoxidáveis austeníticos UNS S31254, ASTM F138, AISI 316L e ISO 5832-9, cujas composições químicas são mostradas na tabela 2.1. Os aços
Capítulo 2. Experimental. 24 Neste trabalho foram estudados os aços inoxidáveis austeníticos UNS S31254, ASTM F138, AISI 316L e ISO 5832-9, cujas composições químicas são mostradas na tabela 2.1. Os aços
Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28
 60 Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28 Fotografia 30 - Microestrutura destacada em amarelo na Fotografia 28 61 Tabela 11- Composição química do revestimento da chapa L
60 Fotografia 29 - Microestrutura destacada em vermelho na Fotografia 28 Fotografia 30 - Microestrutura destacada em amarelo na Fotografia 28 61 Tabela 11- Composição química do revestimento da chapa L
Experiência 11 PILHA DE DANIELL PILHA DE DANIELL
 PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
Atividades de Recuperação Paralela de Química Setor A
 Atividades de Recuperação Paralela de Química Setor A 2ª série Ensino Médio. Conteúdos para estudos: Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer cálculos
Atividades de Recuperação Paralela de Química Setor A 2ª série Ensino Médio. Conteúdos para estudos: Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer cálculos
ARTIGO TÉCNICO I O EFEITO DO HYDROFLOW NA CORROSÃO. Danny Stefanini, PhD. Setembro 2002
 ARTIGO TÉCNICO I O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Setembro 2002 O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Corrosão é um fenômeno eletroquímico, ligado ao estabelecimento
ARTIGO TÉCNICO I O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Setembro 2002 O EFEITO DO HYDROFLOW NA CORROSÃO Danny Stefanini, PhD Corrosão é um fenômeno eletroquímico, ligado ao estabelecimento
Assunto: Eletroquímica Folha 4.1 Prof.: João Roberto Mazzei
 01. (UEL 2009) A clássica célula galvânica ou pilha de Daniel é representada por: Zn (s) / Zn +2 (aq) / / Cu +2 (aq) / Cu (s) No laboratório de uma escola, o professor e seus alunos fizeram duas alterações
01. (UEL 2009) A clássica célula galvânica ou pilha de Daniel é representada por: Zn (s) / Zn +2 (aq) / / Cu +2 (aq) / Cu (s) No laboratório de uma escola, o professor e seus alunos fizeram duas alterações
Ligar cuidadosamente a fonte de alimentação.
 REALIZAÇÃO EXPERIMENTAL Objectivos Interpretar as reacções químicas que ocorrem quando se efectua a electrólise de uma solução aquosa de cloreto de cobre (II) com eléctrodos de grafite, ferro e zinco.
REALIZAÇÃO EXPERIMENTAL Objectivos Interpretar as reacções químicas que ocorrem quando se efectua a electrólise de uma solução aquosa de cloreto de cobre (II) com eléctrodos de grafite, ferro e zinco.
PMT 2507 Corrosão e Proteção dos Materiais Segunda Lista de Exercício Prof. Dr. Hercílio Gomes de Melo
 PMT 2507 Corrosão e Proteção dos Materiais Segunda Lista de Exercício 2015 Prof. Dr. Hercílio Gomes de Melo 1 Esquematize um sistema de proteção catódica por anodo de sacrifício. Indique claramente o fluxo
PMT 2507 Corrosão e Proteção dos Materiais Segunda Lista de Exercício 2015 Prof. Dr. Hercílio Gomes de Melo 1 Esquematize um sistema de proteção catódica por anodo de sacrifício. Indique claramente o fluxo
Reacções de Oxidação-Redução
 Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
ELETRODO OU SEMIPILHA:
 ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
Departamento de Química Inorgânica IQ / UFRJ IQG 128 / IQG ELETRÓLISE
 10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
Atividades de Recuperação Paralela de Química
 Atividades de Recuperação Paralela de Química 2ª série Ensino Médio Conteúdos para estudos:. Química A Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer
Atividades de Recuperação Paralela de Química 2ª série Ensino Médio Conteúdos para estudos:. Química A Livro-texto Coeficiente de solubilidade: compreender os gráficos e tabelas de solubilidade; fazer
Apresentação do produto final MATERIAL DE APOIO PARA O ENSINO DE ELETROQUÍMICA NO ENSINO MÉDIO POR MEIO DE ATIVIDADE EXPERIMENTAL
 Apresentação do produto final MATERIAL DE APOIO PARA O ENSINO DE ELETROQUÍMICA NO ENSINO MÉDIO POR MEIO DE ATIVIDADE EXPERIMENTAL Organizadores: Kathynne Carvalho de Freitas Ferri e Carlos Cézar da Silva.
Apresentação do produto final MATERIAL DE APOIO PARA O ENSINO DE ELETROQUÍMICA NO ENSINO MÉDIO POR MEIO DE ATIVIDADE EXPERIMENTAL Organizadores: Kathynne Carvalho de Freitas Ferri e Carlos Cézar da Silva.
estudos 1º trimestre. Matemática-Física-Química Orientação de estudos
 estudos 1º trimestre. Roteiro de Matemática-Física-Química O roteiro foi montado especialmente para reforçar os conceitos dados em aula. Com os exercícios você deve fixar os seus conhecimentos e encontrar
estudos 1º trimestre. Roteiro de Matemática-Física-Química O roteiro foi montado especialmente para reforçar os conceitos dados em aula. Com os exercícios você deve fixar os seus conhecimentos e encontrar
AVALIAÇÃO DO EFEITO DOS PARÂMETROS OPERACIONAIS DENSIDADE DE CORRENTE E ph DO BANHO SOBRE AS PROPRIEDADES DA LIGA Mo-Co-Fe
 AVALIAÇÃO DO EFEITO DOS PARÂMETROS OPERACIONAIS DENSIDADE DE CORRENTE E ph DO BANHO SOBRE AS PROPRIEDADES DA LIGA Mo-Co-Fe Alison Silva Oliveira 1 ; José Anderson Machado Oliveira 1 ; Anamélia de Medeiros
AVALIAÇÃO DO EFEITO DOS PARÂMETROS OPERACIONAIS DENSIDADE DE CORRENTE E ph DO BANHO SOBRE AS PROPRIEDADES DA LIGA Mo-Co-Fe Alison Silva Oliveira 1 ; José Anderson Machado Oliveira 1 ; Anamélia de Medeiros
ESTUDO DO PROCESSO DE CORROSÃO DE AÇO CARBONO EXPOSTO A MISTURAS DE PETRÓLEO E ÁGUAS SALINAS
 ESTUDO DO PROCESSO DE CORROSÃO DE AÇO CARBONO EXPOSTO A MISTURAS DE PETRÓLEO E ÁGUAS SALINAS Felipe Augusto Cordeiro de Melo 1 ; Severino Leopoldino Urtiga Filho 2 1 Estudante do Curso de Engenharia de
ESTUDO DO PROCESSO DE CORROSÃO DE AÇO CARBONO EXPOSTO A MISTURAS DE PETRÓLEO E ÁGUAS SALINAS Felipe Augusto Cordeiro de Melo 1 ; Severino Leopoldino Urtiga Filho 2 1 Estudante do Curso de Engenharia de
O que esses dispositivos tem em comum? São dispositivos móveis. O que faz os dispositivos móveis funcionarem?
 O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
Fotografia 43 - Corpo-de-prova 9 - gota salina com ferricianeto de potássio e fenolftaleina
 70 3mm 3mm a b Fotografia 41 - Corpo-de-prova 7 - gota salina com fenolftaleina e ferricianeto de potássio Fotografia 42 - Corpo-de-prova 8 - gota salina com a) fenolftaleina e ferricianeto de potássio
70 3mm 3mm a b Fotografia 41 - Corpo-de-prova 7 - gota salina com fenolftaleina e ferricianeto de potássio Fotografia 42 - Corpo-de-prova 8 - gota salina com a) fenolftaleina e ferricianeto de potássio
4 Resultados Metal de base Temperatura ambiente. (a)
 4 Resultados 4.1. Análise de difração de Raios-X Após os corpos de prova serem submetidos ao meio contendo CO 2 (ensaio de imersão) por, estes foram levados para análise de Raios-X. Esta análise foi realizada
4 Resultados 4.1. Análise de difração de Raios-X Após os corpos de prova serem submetidos ao meio contendo CO 2 (ensaio de imersão) por, estes foram levados para análise de Raios-X. Esta análise foi realizada
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
UNIVERSIDADE DE SÃO PAULO FACULDADE DE ODONTOLOGIA. Roteiro de estudos Corrosão Data: 17/04/2013. Ambiente bucal favorece a degradação dos materiais
 UNIVERSIDADE DE SÃO PAULO FACULDADE DE ODONTOLOGIA DEPARTAMENTO DE BIOMATERIAIS E BIOLOGIA ORAL Roteiro de estudos Corrosão Data: 17/04/2013 Corrosão de ligas metálicas e suas implicações clínicas 1 Introdução
UNIVERSIDADE DE SÃO PAULO FACULDADE DE ODONTOLOGIA DEPARTAMENTO DE BIOMATERIAIS E BIOLOGIA ORAL Roteiro de estudos Corrosão Data: 17/04/2013 Corrosão de ligas metálicas e suas implicações clínicas 1 Introdução
QUÍMICA - 2 o ANO MÓDULO 29 ELETROQUÍMICA - EXERCÍCIOS
 QUÍMICA - 2 o ANO MÓDULO 29 ELETROQUÍMICA - EXERCÍCIOS 1) (PUC) Considerando 1 F = 96.500 C (quantidade de eletricidade relativa a 1 mol de elétrons), na eletrólise ígnea do cloreto de alumínio, AlCl 3,
QUÍMICA - 2 o ANO MÓDULO 29 ELETROQUÍMICA - EXERCÍCIOS 1) (PUC) Considerando 1 F = 96.500 C (quantidade de eletricidade relativa a 1 mol de elétrons), na eletrólise ígnea do cloreto de alumínio, AlCl 3,
ESTUDO DA CORROSÃO DO Al RECICLADO DA INDÚSTRIA DE BEBIDAS
 ESTUDO DA CORROSÃO DO Al RECICLADO DA INDÚSTRIA DE BEBIDAS T. SILVA 1, D. MIRANDA 1, G. ALVES 3, O.L ROCHA 2, J.C. CARDOSO FILHO 1 1 Universidade Federal do Pará/ Laboratório de Corrosão 2 Instituto Federal
ESTUDO DA CORROSÃO DO Al RECICLADO DA INDÚSTRIA DE BEBIDAS T. SILVA 1, D. MIRANDA 1, G. ALVES 3, O.L ROCHA 2, J.C. CARDOSO FILHO 1 1 Universidade Federal do Pará/ Laboratório de Corrosão 2 Instituto Federal
Catálise e Inibição de Reação Eletroquímica
 Catálise e Inibição de Reação Eletroquímica - Se o material do eletrodo não se transforma em produto; - em principio, é apenas para transferir elétrons; - mas, podendo também participar adsorvendo reagentes
Catálise e Inibição de Reação Eletroquímica - Se o material do eletrodo não se transforma em produto; - em principio, é apenas para transferir elétrons; - mas, podendo também participar adsorvendo reagentes
Exercícios de Eletroquímica
 Exercícios de Eletroquímica TEXTO PARA A PRÓXIMA QUESTÃO: Grandes recalls de fabricantes de baterias de íons de lítio para notebooks suscitaram questões sobre como essas fontes de energia podem aquecer
Exercícios de Eletroquímica TEXTO PARA A PRÓXIMA QUESTÃO: Grandes recalls de fabricantes de baterias de íons de lítio para notebooks suscitaram questões sobre como essas fontes de energia podem aquecer
Ocorrência de reações
 Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
Ocorrência de reações Dados: Força de ácidos e bases Classificação dos hidrácidos mais conhecidos: Regra prática para a classificação dos oxiácidos Determine a diferença (D) entre a quantidade de átomos
ÓXIDO-REDUÇÃO REAÇÕES REDOX : CONCEITO E IMPORTÂNCIA PILHAS E BATERIAS POTENCIAL DE ELETRODO CORROSÃO E PROTEÇÃO ELETRÓLISE
 ÓXIDO-REDUÇÃO REAÇÕES REDOX : CONCEITO E IMPORTÂNCIA PILHAS E BATERIAS POTENCIAL DE ELETRODO CORROSÃO E PROTEÇÃO ELETRÓLISE 1 POR QUE ESTUDAR AS REAÇÕES DE OXI-REDUÇÃO? -DESENVOLVIMENTO DE NOVAS BATERIAS
ÓXIDO-REDUÇÃO REAÇÕES REDOX : CONCEITO E IMPORTÂNCIA PILHAS E BATERIAS POTENCIAL DE ELETRODO CORROSÃO E PROTEÇÃO ELETRÓLISE 1 POR QUE ESTUDAR AS REAÇÕES DE OXI-REDUÇÃO? -DESENVOLVIMENTO DE NOVAS BATERIAS
2ª Ficha de Avaliação de Química. Critérios de Correção
 2ª Ficha de Avaliação de Química Professora Paula Melo Silva Critérios de Correção 1. 1.1.. 12 pontos O texto refere-se à corrosão dos metais que consiste num processo natural que normalmente é usada para
2ª Ficha de Avaliação de Química Professora Paula Melo Silva Critérios de Correção 1. 1.1.. 12 pontos O texto refere-se à corrosão dos metais que consiste num processo natural que normalmente é usada para
Exercício 3: (PUC-RIO 2007) Considere a célula eletroquímica abaixo e os potenciais das semi-reações:
 Exercício 1: (PUC-RIO 2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre
Exercício 1: (PUC-RIO 2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Colégio FAAT Ensino Fundamental e Médio Conteúdo: Pilhas e baterias Eletrólise Recuperação do 4 Bimestre disciplina Química 2ºano Lista de exercícios 1- Na pilha Al/ Al 3+ // Cu 2+ / Cu é correto afirmar
Polarização e cinética de eletrodo
 Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
CORROSÃO DE AÇO CARBONO PARA DUTOS EM ÁGUAS NATURAIS
 CORROSÃO DE AÇO CARBONO PARA DUTOS EM ÁGUAS NATURAIS S. R. PETERS 1, L. R. M. LIMA 1, S. N. SILVA 2 e L. M. RODRIGUES 1 1 Universidade Federal do Pampa, Campus Bagé, Engenharia Química 2 Universidade Federal
CORROSÃO DE AÇO CARBONO PARA DUTOS EM ÁGUAS NATURAIS S. R. PETERS 1, L. R. M. LIMA 1, S. N. SILVA 2 e L. M. RODRIGUES 1 1 Universidade Federal do Pampa, Campus Bagé, Engenharia Química 2 Universidade Federal
Eletrólise é a parte da eletroquímica que estuda a transformação de energia elétrica em energia química. ENERGIA
 AULA 19 ELETRÓLISE Eletrólise é a parte da eletroquímica que estuda a transformação de energia elétrica em energia química. ENERGIA não espontâneo ELÉTRICA ENERGIA QUÍMICA A eletrólise é um processo não
AULA 19 ELETRÓLISE Eletrólise é a parte da eletroquímica que estuda a transformação de energia elétrica em energia química. ENERGIA não espontâneo ELÉTRICA ENERGIA QUÍMICA A eletrólise é um processo não
Eletroquímica. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Eletroquímica Professora: Melissa Soares Caetano Disciplina QUI 217 Eletroquímica estuda as relações
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Eletroquímica Professora: Melissa Soares Caetano Disciplina QUI 217 Eletroquímica estuda as relações
CORROSÃO. Processo de destruição superficial de um metal, dando origem a sais iónicos (óxidos hidróxidos) do referido metal
 CORROSÃO Processo de destruição superficial de um metal, dando origem a sais iónicos (óxidos hidróxidos) do referido metal Corrosão Química: reacção superficial de transferência de carga em ambiente seco
CORROSÃO Processo de destruição superficial de um metal, dando origem a sais iónicos (óxidos hidróxidos) do referido metal Corrosão Química: reacção superficial de transferência de carga em ambiente seco
ROTEIRO PRÁTICO DE QUÍMICA GERAL
 ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
A CORROSÃO METÁLICA CAUSADA POR ÁGUAS NATURAIS
 A CORROSÃO METÁLICA CAUSADA POR ÁGUAS NATURAIS S. R. PETERS 1, S. N. da SILVA 2 e L. M. RODRIGUES 3 1 Universidade Federal do Pampa, Campus Bagé, Curso de Engenharia Química 2 Universidade Federal do Pampa,
A CORROSÃO METÁLICA CAUSADA POR ÁGUAS NATURAIS S. R. PETERS 1, S. N. da SILVA 2 e L. M. RODRIGUES 3 1 Universidade Federal do Pampa, Campus Bagé, Curso de Engenharia Química 2 Universidade Federal do Pampa,
Exercício de Revisão III Unidade. Eletroquímica
 1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
1 Exercício de Revisão III Unidade Eletroquímica 1) O que difere uma célula galvânica e uma célula eletrolítica? 2) Considere a pilha: Zn(s)/Zn 2+ // Ag + /Ag(s) a) Proponha um esquema de funcionamento
CARACTERIZAÇÃO MICROESTRUTURAL DO AÇO API 5L X80 EM AMOSTRAS SUBMETIDAS A DIFERENTES ATAQUES QUÍMICOS
 CARACTERIZAÇÃO MICROESTRUTURAL DO AÇO API 5L X80 EM AMOSTRAS SUBMETIDAS A DIFERENTES ATAQUES QUÍMICOS Cirino J.A. (1); Cavalcanti B.N.P. (1); Lima Junior D.R. (1); Urtiga Filho S.L. (1) Av. Prof. Morais
CARACTERIZAÇÃO MICROESTRUTURAL DO AÇO API 5L X80 EM AMOSTRAS SUBMETIDAS A DIFERENTES ATAQUES QUÍMICOS Cirino J.A. (1); Cavalcanti B.N.P. (1); Lima Junior D.R. (1); Urtiga Filho S.L. (1) Av. Prof. Morais
REVISÃO DE QUÍMICA CEIS Prof. Neif Nagib
 REVISÃO DE QUÍMICA CEIS 2017 Prof. Neif Nagib CÁLCULO DO ph e do poh EXERCÍCIOS DE FIXAÇÃO 01. O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de ph no
REVISÃO DE QUÍMICA CEIS 2017 Prof. Neif Nagib CÁLCULO DO ph e do poh EXERCÍCIOS DE FIXAÇÃO 01. O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de ph no
Técnicas de Caracterização de Materiais DEMEC TM049 Prof Adriano Scheid
 Técnicas de Caracterização de Materiais DEMEC TM049 Prof Adriano Scheid Análise Metalográfica Análise Metalográfica Histórico Henry Clifton Sorby 1863 observou pela primeira vez uma microestrutura em microscópio.
Técnicas de Caracterização de Materiais DEMEC TM049 Prof Adriano Scheid Análise Metalográfica Análise Metalográfica Histórico Henry Clifton Sorby 1863 observou pela primeira vez uma microestrutura em microscópio.
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR
 INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
01. (UFV-MG) Considere a pilha, em funcionamento, esquematizada a seguir:
 01. (UFV-MG) Considere a pilha, em funcionamento, esquematizada a seguir: A equação da reação total desta pilha é: a) Zn 0 + 2 Ag 0 Zn +2 + Ag + b) Zn 0 + 2 Ag + Zn +2 + 2 Ag 0 c) Zn +2 + 2 Ag 0 Zn 0 +
01. (UFV-MG) Considere a pilha, em funcionamento, esquematizada a seguir: A equação da reação total desta pilha é: a) Zn 0 + 2 Ag 0 Zn +2 + Ag + b) Zn 0 + 2 Ag + Zn +2 + 2 Ag 0 c) Zn +2 + 2 Ag 0 Zn 0 +
Influência Do Tamanho De Grão Na Resistência À Corrosão Em Aços SAE 1010/20 A36 Em Meio Contendo Solução de NaCl 0,02M
 Influência Do Tamanho De Grão Na Resistência À Corrosão Em Aços SAE 1010/20 A36 Em Meio Contendo Solução de NaCl 0,02M D.O Viana 1 ; F.D. Braga 2 ; B.H.O. Lima 3 ; J.S. Melo 4. Engenharia Metalúrgica e
Influência Do Tamanho De Grão Na Resistência À Corrosão Em Aços SAE 1010/20 A36 Em Meio Contendo Solução de NaCl 0,02M D.O Viana 1 ; F.D. Braga 2 ; B.H.O. Lima 3 ; J.S. Melo 4. Engenharia Metalúrgica e
ELETROQUÍMICA. paginapessoal.utfpr.edu.br/lorainejacobs. Profª Loraine Jacobs DAQBI
 lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI Eletrodo Padrão de Hidrogênio(EPH) Nem todas as reações envolvem um sólido redutor Condutor metálico inerte
lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI Eletrodo Padrão de Hidrogênio(EPH) Nem todas as reações envolvem um sólido redutor Condutor metálico inerte
ELETROQUÍMICA Profº Jaison Mattei
 ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
CORROSÃO E ELETRODEPOSIÇÃO
 CORROSÃO E ELETRODEPOSIÇÃO Princípios de Eletroquímica Prof. Dr. Artur de Jesus Motheo Departamento de FísicoF sico-química Instituto de Química de são Carlos Universidade de São Paulo 1 Princípios de
CORROSÃO E ELETRODEPOSIÇÃO Princípios de Eletroquímica Prof. Dr. Artur de Jesus Motheo Departamento de FísicoF sico-química Instituto de Química de são Carlos Universidade de São Paulo 1 Princípios de
P1 - PROVA DE QUÍMICA GERAL 09/09/11
 P1 - PROVA DE QUÍMICA GERAL 09/09/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R = 0,081 atm L -1 K -1 T (K) = T ( C) + 73,15
P1 - PROVA DE QUÍMICA GERAL 09/09/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R = 0,081 atm L -1 K -1 T (K) = T ( C) + 73,15
Materiais e Corrosão - Cap 3 FORMAS DE CORROSÃO. Fontana, cap. 3. Formas de Corrosão- A.Simões_2006 3a.1
 Materiais e Corrosão - Cap 3 FORMAS DE CORROSÃO Fontana, cap. 3 Formas de Corrosão- A.Simões_2006 3a.1 FORMAS DE CORROSÃO No aspecto morfológico, a corrosão pode ser classificada em duas grandes categorias:
Materiais e Corrosão - Cap 3 FORMAS DE CORROSÃO Fontana, cap. 3 Formas de Corrosão- A.Simões_2006 3a.1 FORMAS DE CORROSÃO No aspecto morfológico, a corrosão pode ser classificada em duas grandes categorias:
Questão 1. a) A filtração é um processo físico que serve para separar misturas homogêneas de um sólido disperso em um líquido ou em um gás.
 SE18 - Química LQUI6B3 - Eletrólises Questão 1 (Ucs 2016) Centenas de milhares de toneladas de magnésio metálico são produzidas anualmente, em grande parte para a fabricação de ligas leves. De fato, a
SE18 - Química LQUI6B3 - Eletrólises Questão 1 (Ucs 2016) Centenas de milhares de toneladas de magnésio metálico são produzidas anualmente, em grande parte para a fabricação de ligas leves. De fato, a
O experimento da gota salina e os níveis de representação em química
 didáctica de la química O experimento da gota salina e os níveis de representação em química Edson José Wartha, 1 Neurivaldo José de Guzzi Filho 2 e Raildo Mota de Jesus 2 Educ. quím., 23(1), 55-61, 2012.
didáctica de la química O experimento da gota salina e os níveis de representação em química Edson José Wartha, 1 Neurivaldo José de Guzzi Filho 2 e Raildo Mota de Jesus 2 Educ. quím., 23(1), 55-61, 2012.
3 Material e Procedimento Experimental
 44 3 Material e Procedimento Experimental 3.1 Material O material adotado neste trabalho foi um aço estrutural de alta resistência mecânica e baixa liga, classificado pela IACS (International Association
44 3 Material e Procedimento Experimental 3.1 Material O material adotado neste trabalho foi um aço estrutural de alta resistência mecânica e baixa liga, classificado pela IACS (International Association
