UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA ANIMAL
|
|
|
- Martín Madeira
- 5 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA ANIMAL DEFESA DE DISSERTAÇÃO EFEITO DA COLHEITA FRACIONADA SOBRE A CINÉTICA E VIABILIDADE ESPERMÁTICAS DO SÊMEN REFRIGERADO E CONGELADO DE GARANHÕES. Sidnei Nunes de Oliveira Botucatu SP Maio/2016
2 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA ANIMAL EFEITO DA COLHEITA FRACIONADA SOBRE A CINÉTICA E VIABILIDADE ESPERMÁTICAS DO SÊMEN REFRIGERADO E CONGELADO DE GARANHÕES. Sidnei Nunes de Oliveira Dissertação apresentada à Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP, Campus de Botucatu, para obtenção do título de Mestre em Biotecnologia Animal, Área de Reprodução Animal. Orientador: Prof. Dr. Frederico Ozanam Papa Botucatu SP Maio/2016
3
4 Nome do autor: Sidnei Nunes de Oliveira Título: EFEITO DA COLHEITA FRACIONADA SOBRE A CINÉTICA E VIABILIDADE ESPERMÁTICAS DO SÊMEN REFRIGERADO E CONGELADO DE GARANHÕES. BANCA EXAMINADORA Prof. Dr. Frederico Ozanam Papa Presidente e orientador Departamento de Reprodução Animal e Radiologia Veterinária FMVZ UNESP Botucatu /SP Prof. Dr. Marco Antonio Alvarenga Membro Departamento de Reprodução Animal e Radiologia Veterinária FMVZ UNESP Botucatu/SP Dr. Marcio Teoro do Carmo Membro Veterinário Autônomo, Botucatu/SP Data da Defesa: 03 de maio de 2016.
5 SUMÁRIO CAPÍTULO I 1. INTRODUÇÃO REVISÃO DE LITERATURA Anatomia e fisiologia do sistema genital do garanhão Espermatogênese Fisiologia da ejaculação Produção e composição do plasma seminal Enzimas Proteínas Eletrólitos Hormônios Efeito do plasma seminal na criopreservação do sêmen equino Principais métodos de colheita do sêmen equino Colheita fracionada do sêmen equino Benefício da colheita fracionada do sêmen equino REFERÊNCIAS HIPÓTESE OBJETIVOS ESPECÍFICOS CAPÍTULO II ARTIGO I - COLHEITA FRACIONADA E SEUS PRINCIPAIS BENEFÍCIOS NA CRIOPRESERVAÇÃO DO SÊMEN DE GARANHÕES ARTIGO II - INFLUÊNCIA DE DIFERENTES TÉCNICAS DE COLHEITA FRACIONADA DO SÊMEN EQUINO NA RECUPERAÇÃO ESPERMÁTICA: DESCRIÇÃO E MODIFICAÇÃO DE UM MÉTODO ARTIGO III - EFEITO DO PLASMA SEMINAL NAS DIFERENTES FRAÇÕES DO EJACULADO EQUINO SOBRE OS PARÂMETROS ESPERMÁTICOS AVALIADOS IN VITRO APÓS O PROCESSO DE CRIOPRESERVAÇÃO... 80
6 AGRADECIMENTO Ao grande Deus pela força espiritual que me rege e por iluminar os meus caminhos. A minha família, meu porto seguro, meu pai Sebastião, minha mãe Angelita, minha irmã Alane Kelly, a minha avó Mariazinha, meus Tios Alex, Amarildo, Sônia, Norma e Sonilde in memoria, mesmo estando distantes suportando as saudades, são eles meus grandes incentivadores, sem eles todas as minhas conquistas não fariam sentido. Ao grande mestre idealizador e incentivador deste projeto, o Prof. Papa que me acolheu durante todo o mestrado e juntos desenvolvemos um trabalho em equipe. Aos professores Nereu Néris pelos ensinamentos e pelos abraços de apoio durante esta etapa, Marco Alvarenga pelas oportunidades, considerações e conselhos, ao Zé Dell Aqua pelas horas de discussão e incentivo e a todos os outros professores do Departamento de Reprodução Animal e Radiologia Veterinária. Sou grato aos funcionários do departamento pelo apoio no dia a dia a Camila Dell Aqua, Edvaldo, D. Raquel, Edilson, Felipe, meu muito obrigado. Aos velhos amigos de longas jornadas Luis, Endrigo, Bertiny e aos outros que aqui ganhei durante a residência e no mestrado em especial ao Felipe Dalanezi, Luiz Roberto Jr, Felipe Hartwig, João Alexandre, Rafaella Hayashi, Patricia Papa, Marcio Teoro. À Faculdade de Medicina Veterinária e Zootecnia da Universidade estadual Paulista Júlio de Mesquita Filho Botucatu-SP, pela oportunidade de cursar o Mestrado. À Fundação de Apoio à Pesquisa do Estado de São Paulo (FAPESP) pela bolsa de estudo concedida para a realização do projeto (Processo FAPESP: 2014/ ). Agradeço também aos Haras parceiro que contribuíram para a realização deste projeto: Haras Itapuã, Haras Ogar, Equicenter Central de Reprodução e a Central Lub Breeding. Assim finalizo agradecendo a todos aqueles que de alguma forma contribuíram em mais uma etapa da minha história meu muito obrigado.
7 LISTA DE ABREVIAÇÕES AST aspartato amino transferase PS plasma seminal BG β-glucuronidase RAP espermatozoides rápido cm Centímetro SPTZ espermatozoides Ca ++ Cálcio VA vagina artificial Cl - Cloretos VAP velocidade de trajeto CRIP proteína rica em cisteína VCL velocidade curvilínea Cu + Cobre VSL velocidade linear DNA ácido desoxirribonucleico UFC unidade formadora de colônias ERO espécie reativa de oxigênio UI unidades internacionais FA fosfatase alcalina Zn + zinco FAC fosfatase ácida [ ] concentração Fe + Ferro Fn-2 fibronectína tipo II GGT γ-glutamil transferase G1 grupo 1 G2 grupo 2 HSP proteína do plasma seminal equino IM integridade de membrana K + kda LDH Mg + ml MP MT Na + Potássio kilo Dalton lactato desidrogenase Magnésio Mililitro motilidade espermática progressiva motilidade espermática total Sódio PGE 2 prostaglandina E 2 Pi fósforo inorgânico
8 RESUMO OLIVEIRA, S.N. EFEITO DA COLHEITA FRACIONADA SOBRE A CINÉTICA E VIABILIDADE ESPERMÁTICAS DO SÊMEN REFRIGERADO E CONGELADO DE GARANHÕES. Botucatu SP. 2016, p.103. Dissertação (Mestrado) Faculdade de Medicina Veterinária e Zootecnia, Campus Botucatu, Universidade Estadual Paulista Júlio de Mesquita Filho. O pênis é o órgão copulador e no garanhão é classificado como sendo músculo cavernoso, em que os espaços cavernosos são preenchidos de sangue durante a ereção. Nos testículos que ocorre a produção espermática, que são transportados pela rete testis até o epidídimo, onde sofrerão maturação, capacidade fertilizante e armazenados até a ejaculação. As glândulas sexuais acessórias são responsáveis pelos fluidos expelidos durante a ejaculação, denominado de plasma seminal, que se misturam às células espermáticas e formam o ejaculado. Cada uma dessas glândulas são responsáveis por uma determinada secreção que vai direcionar o ejaculado equino a ser dividido em três distintas frações: fração pré-espermática, produzida pelas glândulas bulbouretrais e próstata; fração rica em espermatozoides, produzida pelas secreções do epidídimo e por líquidos das ampolas dos ductos deferentes; fração pós-espermática ou fração pobre, formada por espermatozoides remanescentes no canal uretral e líquidos produzidos pelas vesículas seminais, o gel. Durante o processo fisiológico de cópula, ocorrem vários eventos denominados de ereção, em que o garanhão se excita por estímulos, emissão que caracteriza-se pela liberação de espermatozoides dentro da uretra pélvica, seguido da ejaculação com a expulsão do sêmen, o relaxamento e recolhimento do pênis. Normalmente, as colheitas de sêmen equino são realizadas de forma convencional, com vagina artificial fechada, em que todas as frações se misturam. Cada garanhão possui características individuais com relação à manutenção das células espermáticas durante a criopreservação, essas características podem estar relacionadas à produção do plasma seminal, assim como os vários componentes que os compõem. Sabe-se que existe um efeito deletério desempenhado pelos componentes do plasma seminal produzido principalmente pelas vesículas seminais, aos espermatozoides durante o processo de criopreservação, porém, esses fatores ainda são desconhecidos. Várias hipóteses são sugeridas, tais como, a redução na produção de lipídeos e os tipos
9 de proteínas e íons presentes em cada uma das frações do ejaculado. Sabendo disso, a colheita fracionada pode trazer benefícios aos espermatozoides, de forma que as primeiras frações não tenham contato com o plasma seminal produzido pelas vesículas seminais. O presente trabalho objetiva revisar a colheita fracionada de sêmen em garanhões, assim como, seus benefícios para as células espermáticas que serão submetidas à criopreservação. Palavras-chave: equino, refrigeração, congelação, colheita de sêmen.
10 ABSTRACT OLIVEIRA, S.N. EFFECT THE FRACTIONATED COLLECTION ABOUT KINETIC AND SPERM VIABILITY THE SPERM COOLED AND FROZEN STALLION. Botucatu SP p.103. Dissertação (Mestrado) Faculdade de Medicina Veterinária e Zootecnia, Campus Botucatu, Universidade Estadual Paulista Júlio de Mesquita Filho. The penis is the copulatory organ and in the stallion it is classified as cavernous muscle and the cavernous spaces are filled with blood during erection. In the testicles occurs sperm production, that are transported through the rete testis to the epididymis, where they will suffer maturation, fertilizer capacity and will be stored until ejaculation. The accessory sex glands are responsible for the expelled fluids during ejaculation, named seminal plasma that are mixed with sperm cells and form the ejaculate. Each of these glands are responsible for a certain secretion that will divide equine semen into three distinct fractions: pre-sperm fraction, produced by the prostate and bulbourethral glands; rich fraction in sperm, produced by epididymal secretions and liquids from ampoules of the vas deferens; post-sperm fraction or poor fraction, consisting of sperm remaining in the urethral canal and liquids produced by the seminal vesicles, the gel. During the physiological process of mating, several events occur named erection, in which the stud is excited by stimuli emission which is characterized by the release of sperm into the pelvic urethra followed by ejaculation with the expulsion of semen, relaxation and gathering the penis. Typically, horse semen collections are performed in the conventional way, with a closed artificial vagina, where all the fractions are mixed. Each stud has individual characteristics related to the maintenance of sperm cells during the cryopreservation, these characteristics may be related to production of seminal plasma and to the components that form it as well. What is known is that there is a negative effect played by the seminal plasma components mainly produced by the seminal vesicles, to the sperm during cryopreservation process, however, these factors are still unknown. Several hypotheses are suggested such as the production s reduction of lipids and proteins and the types of ions present in each fraction of the ejaculate. Knowing this, the fractional collection may be beneficial to sperm, considering that the first fractions do not have contact with seminal plasma produced by the seminal vesicles. This work aims to review the semen fraction harvest in stallions, as well as its benefits for the sperm cells to be submitted to cryopreservation. Key-words: Equine, cooler, freezer, collection sperm.
11 CAPÍTULO I
12 12 1. INTRODUÇÃO A equinocultura brasileira possui o quarto maior rebanho mundial, com 5,8 milhões de cabeças, ficando atrás dos Estados Unidos, China e México, seu faturamento anual fica em torno de R$ 7,5 bilhões, gerando 642,5 mil empregos diretos e US$ 27,4 milhões em exportação (GUERRA, 2010). Tendo em vista este crescente mercado, fazse necessário o uso das biotecnologias reprodutivas relacionadas a fêmeas e também aos machos: inseminação artificial, transferência de embrião, transferência intrafalopiana de gametas, injeção intracitoplasmática de espermatozoides e refrigeração de sêmen e congelação de sêmen. Dentre as biotécnicas citadas, a inseminação artificial vem se tornando um pilar de sustentação e evolução na criação de equinos, tendo em vista que seu uso traz grandes benefícios na difusão do material genético de animais classificados como superiores, dentre eles, campeões em diversas modalidades de competição equestre. Apesar do avanço no uso das biotécnicas reprodutivas, ainda há grandes desafios para melhorar os índices reprodutivos na equinocultura, principalmente quando estão relacionadas à criopreservação das células espermáticas em garanhões. Estudos realizados indicam que em alguns garanhões, o plasma seminal (PS) acarreta danos aos espermatozoides, culminando em prejuízos na qualidade espermática durante a refrigeração e a congelação (KARESKOSKI; KATILA, 2008), podendo diminuir os índices de fertilidade. Embora o plasma seminal possua um efeito negativo durante a criopreservação, existem também evidências do seu papel protetor às células espermáticas (KARESKOSKI et al., 2006), dentre elas a prevenção da capacitação prematura que pode ser induzida durante o processo de congelação e descongelação (SCHEMBRI et al., 2002), afirmando que, a presença de pequenas quantidades de PS parece ser necessária. Segundo Alghamdi et al. (2002), a motilidade espermática é maior quando a proporção de PS é 5% antes da refrigeração e congelação, quando comparada a amostras com proporções entre 10-30% no volume do ejaculado. Por outro lado, Jasko et al. (1992) demonstram que a proporção ideal de PS no ejaculado seja em torno de 5 a 20%, sem que haja um efeito prejudicial durante a criopreservação. Portanto, a centrifugação para retirada do PS faz-se necessária, principalmente para
13 13 aqueles garanhões cujos ejaculados possuem baixa tolerância à criopreservação (KARESKOSKI; KATILA, 2008). Assim, pressupõe-se que exista uma variação individual do efeito do PS entre garanhões (AKCAY et al., 2006) e da sua produção, existindo variações na composição do PS nas diferentes frações do ejaculado (KATILA et al., 2004). Contudo, em estudos realizados, demonstrou-se que a fração rica em espermatozoides do ejaculado possui uma tolerância maior a criopreservação quando comparada às demais frações (SIEME et al., 2004; KARESKOSKI et al., 2006). Durante a colheita de sêmen de forma convencional, utilizando-se as vaginas artificiais modelo Missouri, Nishikawa, Hannover, Colorado ou Botucatu, todas as frações do ejaculado se misturam e não há possibilidade de separação destas. Diante disto, Varner et al. (1987) sugerem que a colheita fracionada poderá reduzir o efeito deletério do PS ao colher apenas a fração rica em espermatozoides do ejaculado, correspondente a 75% do total de espermatozoides. Desta forma, uma alternativa para minimizar as injúrias provocadas pelo PS em garanhões que produzem sêmen com tolerância limitada à criopreservação, seria a colheita de sêmen fracionada, possibilitando, com isso, identificar as diferentes frações e separar a fração espermática com maior percentual de espermatozoides em menor contato com o PS. O presente trabalho tem por objetivo revisar a colheita fracionada de sêmen em garanhões, assim como, seus benefícios para as células espermáticas que serão submetidas à criopreservação. 2. REVISÃO DE LITERATURA 2.1. ANATOMIA E FISIOLOGIA DO SISTEMA GENITAL DO GARANHÃO O sistema reprodutor masculino é formado por várias estruturas e órgãos, os quais agem em conjunto na produção e deposição de espermatozoides no sistema reprodutor das fêmeas (KLEIN, 2014). Esse conjunto de acontecimentos envolve o sistema neuroendócrino (hipotálamo e hipófise anterior) e o sistema genital, constituído por dois testículos sustentados dentro do escroto através do músculo cremaster, epidídimos e
14 14 ductos deferentes, pênis e as glândulas sexuais acessórias compostas por ampolas dos ductos deferentes, vesículas seminais, a próstata e glândulas bulbouretrais (McKINNON; VOSS, 1992; KLEIN, 2014). O pênis é o órgão copulador no macho, no garanhão é do tipo músculo cavernoso e se estende desde o arco isquiático até a região umbilical quando em ereção ou relaxado (AMANN, 1981) e está dividido em base, corpo e glande. É composto de três espaços cavernosos: o corpo esponjoso da glande, o corpo esponjoso, que envolve a uretra, e dorsalmente a este encontra-se o corpo cavernoso (KLEIN, 2014; HAFEZ, 2004; SAMPER, 2009). Estes espaços aumentam de volume pelo acúmulo de sangue (HAFEZ, 2004) por estímulos dos ramos arteriais do pudendo e do obturador, culminando na ereção (SAMPER, 2009). O corpo do pênis está envolto pela túnica albugínea, fibroelástica e espessa (SAMPER, 2009). Ainda conta com os músculos ísquicavernosos, bulboesponjosos, retrator do pênis e uretral (SAMPER, 2009). O testículo é a gônada responsável pela produção espermática e para que a espermatogênese ocorra, é necessário que a temperatura testicular esteja em torno de 4 a 6 C abaixo da temperatura corporal (KLEIN, 2014). Os testículos são compostos pelo parênquima, que compreende o tecido intersticial (estão presentes as células de Leydig, vasos sanguíneos, tecido conjuntivo e linfático e nervos), túbulos seminíferos e pela rete testis (SENGER, 2005). Os túbulos seminíferos são compostos por membrana basal e epitélio germinativo. As células de Sertoli estão dispostas nos túbulos seminíferos cercam as células germinativas e coordenam sua diferenciação são células ligadas por junções de oclusão, formando a barreira hematotesticular (SENGER, 2005; KLEIN, 2014). São responsáveis pela produção de espermatozoides e fluidos para auxiliar no transporte até sua chegada à porção final do túbulo seminífero, que se liga à rete testis e chega ao epidídimo. Os espermatozoides que chegam à cabeça do epidídimo são imóveis e incapazes de fertilizar e ao se moverem pelo corpo até a cauda do epidídimo, pelas contrações do músculo liso e da parede, adquirem motilidade e passam pela maturação, obtendo a capacidade de fertilizar (McKINNON; VOSS, 1992; KLEIN, 2014), esse trajeto dura
15 15 em torno de 9 a 12 dias no garanhão (McKINNON; VOSS, 1992). Em seguida, na cauda do epidídimo, ocorre o final da maturação e o armazenamento das células espermáticas, juntamente com os ductos deferentes (McKINNON; VOSS, 1992; KLEIN, 2014). Posteriormente, os espermatozoides saem da cauda do epidídimo, através dos ductos deferentes passando pelo canal inguinal e se conectam com a uretra pélvica, passando pelas glândulas sexuais acessórias até sair pela uretra durante a ejaculação (KLEIN, 2014). As glândulas sexuais acessórias compreendem as ampolas, vesículas seminais, próstata e bulbouretrais, e são responsáveis pela produção de fluidos que vão ser expelidos junto aos espermatozoides durante a ejaculação (McKINNON; VOSS, 1992). As ampolas se formam através de uma dilatação da porção distal dos ductos deferentes até passarem para a uretra pélvica, seu comprimento é de aproximadamente 20cm e 2cm de diâmetro, possuem glândulas e pode ser considerado um local de armazenamento dos espermatozoides (ENGLAND, 2005). A seguir, continuando pela uretra pélvica, encontram-se as vesículas seminais, que são triangulares e de parede fina e se localizam paralelas e laterais à parte mais distal das ampolas, com comprimentos similares a estas, porém com um diâmetro de 5cm, sendo responsáveis pela produção da secreção gelatinosa do ejaculado. Caudal a elas, se localiza a próstata, bilobada e com um istmo central, possuem cerca de 10cm de comprimento e 12cm de largura, produzem a fração pré-espermática e parte da secreção da fração rica em espermatozoides. Logo após, existem as glândulas bulbouretrais medindo aproximadamente 4cm de diâmetro, vem logo após e caudalmente a próstata, sendo responsáveis por produzir uma parte da fração pré-espermática (ENGLAND, 2005). A uretra é um canal que liga a vesícula urinária até o processo uretral, é coberto pelo músculo bulboesponjoso, cujas contrações conduzem a saída da urina e do sêmen ao longo do pênis, participando do transporte espermático durante a ejaculação (ENGLAND, 2005).
16 ESPERMATOGÊNESE A espermatogênese é um processo longo e cronológico, dividida em três fases: a espermatocitogênese em que as espermatogônias se dividem por mitoses e produzem espermatogônias diferenciadas, entre elas as do tipo B, que participam da fase meiótica sofrendo mitoses para formar os espermatócitos primários, em seguida ocorrem meioses resultantes em espermatócitos secundários que, durante a fase de espermiogênese, sofrem meiose e formam as espermátides haploides, precursores dos espermatozoides, nome dado após saírem dos túbulos seminíferos sendo esta última fase a espermiação (McKINNON; VOSS, 1992). Todas essas células são encontradas nos túbulos seminíferos, onde ocorre a espermatogênese (McKINNON; VOSS, 1992). Quando os espermatozoides deixam o testículo eles são considerados inférteis, enquanto os recuperados da cauda do epidídimo tem fertilidade comprovada (PAPA et al., 2008; MONTEIRO et al., 2011). Desta forma, a maturação espermática ocorre por mudanças nestas células desde a saída do testículo até a fertilização do oócito, que depende da exposição à composição de diferentes fluidos epididimários, dentre eles enzimas e proteínas que modificam a membrana plasmática e outros componentes dos espermatozoides (McKINNON; VOSS, 1992). Durante o processo de maturação os espermatozoides, adquirem motilidade progressiva, modificações na membrana plasmática, no metabolismo dos espermatozoides e capacidade de fertilizar (McKINNON; VOSS, 1992) FISIOLOGIA DA EJACULAÇÃO Durante a cópula no equino, ocorrem eventos fisiológicos diferentes, entre eles: ereção, emissão, ejaculação e relaxamento do pênis. A ereção é mediada pelo sistema parassimpático em que o pênis protrui de dentro da bainha prepucial pelo relaxamento do músculo retrator do pênis, seguido do relaxamento da musculatura lisa dos corpos cavernoso e esponjoso (McDONNEL, 1992), a seguir, o músculo ísquiocavernoso se contrai por estímulo do nervo pudendo e oclui o fluxo de retorno das veias e dilatação arterial, aumentando a pressão sanguínea intrapeniana (SCHUMACHER; RIDDELL, 1986), atingindo seu comprimento completo. Neste momento, o garanhão entra em um
17 17 estado avançado de excitação e através de reflexos sacrais, há a contração das glândulas sexuais acessórias, principalmente da próstata, liberando pequenas quantidades de líquido pré-seminal (McDONNEL, 1992). O processo de emissão compreende a movimentação e a liberação dos espermatozoides e fluidos dos ductos deferentes e cauda do epidídimo, que se juntam à secreção das glândulas sexuais acessórias, para a uretra pélvica, mediada pelas fibras pré-ganglionares simpáticas do segmento lombosacral da medula espinhal, que levam aos reflexos toracolombares que mediam as contrações da musculatura lisa (WEBER; WOODS, 1991; McDONNEL, 1992; McKINNON; VOSS, 1992). Neste momento, o colo da bexiga se contrai e mantém o orifício uretral fechado (WEBER; WOODS, 1991; McDONNEL, 1992; McKINNON; VOSS, 1992), mediado pelos alfa-adrenérgicos (McDONNEL, 1992). Ainda na emissão, durante a cópula, o garanhão exerce uma média de sete impulsos do pênis sobre a vagina artificial ou da égua, com duração de 10 segundos (TISCHNER et al., 1974; McDONNEL, 1992). De acordo com os movimentos copulatórios, a pressão do pênis e da glande vai aumentando devido ao aumento da excitação, com posterior aumento do fluxo sanguíneo para o corpo esponjoso e consequente ingurgitamento da glande do pênis, até que seja desencadeada a ejaculação. A ejaculação é a expulsão forçada do sêmen através da uretra pélvica, mediada pelo nervo pudendo e segmento sacral da medula espinhal levando a reflexos sacrais, que resultam em contrações rítmicas do músculo bulboesponjoso, ísquicavernoso, uretral e músculos estriados pélvicos, em sinergismo com contrações rítmicas dos músculos perianais, esfíncter anal e movimentos de cauda, além de movimentos de sapatear dos membros posteriores (McDONNEL et al., 1987; McDONNEL, 1992). O início da ejaculação ocorre quando há o máximo de pressão dentro da vagina, provocado pelo ingurgitamento total da glande e que, associada à temperatura interna da vagina, desencadeia a saída dos primeiros jatos de sêmen que são expelidos com pressão (TISCHNER et al., 1974). Cada ejaculado possui de cinco a dez jatos, com intervalos de dois segundos, enquanto que a saída dos últimos jatos são emitidos com uma menor pressão (TISCHNER et al., 1974; McDONNEL, 1992). Em seguida, há o
18 18 declínio da ereção, decorrente do aumento do tônus sacral simpático, aumentando o tônus da musculatura lisa nos corpos cavernoso e esponjoso com retorno do sangue à circulação e contração do músculo retrator do pênis, e posterior retirada do pênis da vagina (TISCHNER et al., 1974; McDONNEL, 1992; McKINNON; VOSS, 1992). Alguns garanhões possuem um comportamento individual após a ejaculação, dentre eles: alguns relaxam sobre a égua ou manequim, podendo ficar até alguns minutos; alguns cavalos jovens/potros após a primeira ejaculação podem permanecer por um tempo mais elevado, chegando até a cochilar e, até mesmo ficar descoordenado, podendo apresentar tremores musculares e cair após a ejaculação. Esse fato merece especial atenção do técnico que está colhendo o animal, pois ele pode cair sobre a pessoa e provocar um acidente; alguns mais ariscos saem bruscamente do manequim ou égua logo após a ejaculação ou no decorrer dela, podendo perder parte do ejaculado principalmente aqueles garanhões que não foram condicionados ao processo de colheita de sêmen sejam sobre éguas ou manequim. De acordo com os eventos observados por Tischner et al. (1974) durante o processo ejaculatório com colheita fracionada, existem algumas hipóteses relacionadas à monta natural, como: a liberação do líquido pré-seminal, além de ter a função de limpar o canal uretral, também pode estar relacionado com a lubrificação da vulva, vestíbulo e canal vaginal durante a introdução do pênis do garanhão na égua; o ingurgitamento total da glande se encaixa no fundo vaginal, formando um vácuo com o processo uretral do pênis, podendo se encaixar na entrada da cérvix e como os primeiros jatos do ejaculado são expelidos com muita pressão e os três primeiros representam de 70 a 80% da concentração total de espermatozoides (TISCHNER et al., 1974; KOSINIAK, 1975; VARNER et al., 1987; OLIVEIRA et al., 2015), provavelmente serão depositados dentro do útero. Quando o pênis começa a reduzir a ereção e retrair, os jatos são expelidos com uma menor pressão e, possivelmente, são depositados no fundo vaginal, juntamente com o gel, produzido pelas vesículas seminais.
19 PRODUÇÃO E COMPOSIÇÃO DO PLASMA SEMINAL O plasma seminal corresponde à porção do ejaculado composto pelas secreções liberadas pela cauda do epidídimo e glândulas sexuais acessórias, podendo haver variação do volume entre as espécies, dependendo da presença e tamanho das suas glândulas, que quanto mais desenvolvidas, maior a produção, e na composição, que são diferentes entre espécies, entre indivíduos da mesma espécie e entre ejaculados do mesmo indivíduo (RODRÍGUEZ-MARTÍNEZ et al., 2011). O ejaculado do garanhão é dividido em três frações espermáticas, cada uma possui um aspecto e composição diferentes, devido às glândulas que as produzem (MAGISTRINI et al., 2000). A pré-espermática é composta por um líquido translúcido secretado pela próstata e glândulas bulbouretrais com nenhuma ou poucas células espermáticas; a rica em espermatozoides, de aspecto branco, opaco e leitoso, e que contém a maior parte das células espermáticas do ejaculado, além de secreções da próstata, bulbouretrais, epidídimo e ampola dos ductos deferentes e pequenas quantidades advindas da vesícula seminal; e a pós-espermática, de aspecto aquoso turvo, pobre em espermatozoides, que correspondem às células que ficaram remanescentes na uretra durante a passagem espermática, junto à secreção das vesículas seminais e ampolas (TISCHNER et al., 1974; VARNER et al., 1987; TISCHNER; KOSINIAK, 1992; AMANN; GRAHAM, 1993; LINDEBERG et al., 1999; FONSECA, 2006; KARESKOSKI et al., 2010, KARESKOSKI et al., 2011b). A primeira fração possui uma grande quantidade de ácido lático e uma elevada concentração de cloreto de sódio (MANN et al., 1963), a segunda contém ergotineína, derivada principalmente da ampola dos ductos deferentes, além de conter ácido lático em concentrações semelhantes à fração pré-espermática (MANN et al, 1963; TISCHNER et al., 1974), e a terceira fração é rica em ácido cítrico, ácido lático e potássio (MANN et al., 1963). Desta forma, surgiram alguns questionamentos sobre a ação dos componentes químicos do plasma seminal e as reais funções que estes desempenham (RODGER, 1975). Além desses elementos, vários outros foram identificados, entre eles: várias
20 20 proteínas e enzimas, aminoácidos livres, polissacarídeos, lipídeos, hormônios e eletrólitos (KARESKOSKI et al., 2010) ENZIMAS No ejaculado de garanhões algumas enzimas foram identificadas e estão presentes no PS e glândulas sexuais acessórias, apesar de conhecer suas origens, suas funções ainda não foram totalmente esclarecidas (KARESKOSKI, 2011). Algumas enzimas do plasma seminal atuam como antioxidantes e participam de reações capazes de reduzir a ação de espécies reativas de oxigênio (LEWIS et al., 1997). A fosfatase alcalina (FA), presente em grandes concentrações nos testículos e epidídimos, sendo utilizada como um marcador de obstrução em garanhões que apresentam azoospermia, desta forma, quando não forem encontradas células espermáticas e a concentração de FA for < 100UI/mL, indica que há uma obstrução na ampola; em contrapartida, concentrações normais, de 1000UI/mL, sem presença de células espermáticas, caracterizam uma azoospermia verdadeira, não obstrutiva (TURNER; McDONNEL, 2003). Kareskoski et al. (2010) encontraram altas concentrações de FA, fosfatase ácida (FAC) e β-glucuronidase (BG) na fração rica em espermatozoides, quando comparada à fração pobre em espermatozoides. Além disso, um grupo de animais férteis mostrou uma maior concentração de FAC e BG na fração rica em espermatozoides, quando comparado a um grupo sub-fértil (KARESKOSKI et al., 2010). As concentrações das enzimas aspartato amino transferase (AST) e γ-glutamil transferase (GGT), possuem correlações positivas com a concentração espermática, indicando uma origem testicular ou epidídimária destas enzimas (BITTMAR; KOSINIAK, 1992; PESCH et al., 2006). Lewis et al. (1997) encontraram enzimas do PS que participam na prevenção da peroxidação de lipídeos da membrana plasmática dos espermatozoides, são eles: tocoferol, ascorbato e urato. Grande atividade de catalase também foi encontrada no PS
21 21 de garanhões, sendo sua produção derivada das secreções das glândulas prostáticas (BALL et al., 2000). Pesch et al. (2006) correlacionaram a concentração de várias enzimas e tiveram como resultados: a GGT teve correlação significativa com a motilidade espermática e a lactato desidrogenase (LDH) teve correlação significativa com motilidade total e progressiva, podendo ter uma relação com qualidade espermática e atuar no metabolismo dos espermatozoides PROTEÍNAS O teor de proteínas do PS nos equinos é baixo, quando comparado a outras espécies (TÖPFER-PETERSEN et al., 2005). Estas proteínas do PS estão envolvidas em diversas funções essenciais para que a fertilização possa ocorrer, são elas: capacitação, estabelecimento do reservatório dos espermatozoides do oviduto, modulação da resposta imune no útero e transporte no trato genital da fêmea, assim como a interação e fusão entre os gametas (TÖPFER-PETERSEN et al., 2005). As proteínas isoladas no PS nos equinos são denominadas e numeradas em Horse Seminal Protein (HSP) HSP-1 a HSP-8, possuem baixo peso molecular (14-30kDa), com exceção da HSP-4 e todas elas mostraram propriedades de ligação à superfície dos espermatozoides e fazem parte das proteínas de ligação a heparina que modulam a hipótese da capacitação (TÖPFER-PETERSEN et al., 2005; KARESKOSKI et al., 2011a). Estas proteínas do PS pertencem a três grupos de proteínas: as proteínas que transportam fibronectina tipo II (Fn-2), proteínas secretoras ricas em cisteína (CRISPs) e espermadesinas (TÖPFER-PETERSEN et al., 2005). Dentre as Fn-2 estão as HSP1 e HSP2 elas formam a maior parte das proteínas do PS e são classificadas como as proteínas de ligação à heparina, as Fn-2 são conhecidas por se ligarem ao fosfolipídio membrana espermática com um grupo fosforilcolina, causando alteração na estrutura da membrana, sendo as ampolas dos ductos deferentes a principal fonte de HSP1 e HSP2 (GREUBE et al., 2004; EKHLASI-HUNDRIESER et al., 2005).
22 22 Kareskoski et al. (2011a) pesquisaram as proteínas do PS nas diferentes frações do ejaculado e encontraram uma presença abundante da HSP-1 e HSP2, em todas as frações e em todos os ejaculados, adicionalmente HSP1, HSP2 e HSP3 parecem ter correlação positiva com a concentração espermática. Apesar da presença dessas proteínas, ainda não se sabe realmente suas origens pelas frações do ejaculado, já que pode haver uma mistura de líquidos e mascarar os resultados. Provavelmente, as proteínas HSP-1 e HSP2 não tenham origem das vesículas seminais (KARESKOSKI et al., 2011a). A HSP1, em particular, tem sido abordada com uma correlação positiva para fertilidade em garanhões (RODRÍGUEZ-MARTÍNEZ et al., 2011). Em uma revisão, Guasti et al. (2012) descreveram que as moléculas CRISPs são expressas sob controle de andrógenos, permanecendo ligadas à superfície espermática e possuindo uma relação com a fusão do espermatozoide ao oócito durante a fertilização. Um membro da família das CRISP no PS em garanhões é a HSP3 e sua produção se dá pela ampola dos ductos deferentes e também pela vesícula seminal, desse modo, contribui para a sua elevada concentração no PS (SCHAMBONY et al., 1998; TÖPFER-PETERSEN et al., 2005). Por conseguinte, Reineke et al. (1996) relataram que as CRISP podem ter uma correlação individual direta com a fertilidade em garanhões. Calvete et al. (1994) presumiram que as proteínas do PS as HSP4 teriam correlação com o gene da calcitonina. Os níveis de calcitonina tiveram correlação com a motilidade espermática e a infertilidade em homens (MUNGAN et al., 2001). Já as HSP7 foram identificadas como único membro da família das espermadesinas e demonstram atividade com a zona pelúcida do oócito (REINERT et al., 1996) ELETRÓLITOS A concentração de eletrólitos no PS varia entre as frações espermáticas e entre os garanhões (KARESKOSKI; KATILA, 2008), além disso, a composição iônica do PS pode ter uma correlação com a qualidade seminal. Os eletrólitos mais encontrados na literatura são: cálcio (Ca ++ ), magnésio (Mg + ), cloreto (Cl - ), sódio (Na + ), fósforo inorgânico (Pi), ferro (Fe + ), zinco (Zn + ), cobre (Cu + ) e potássio (K + ) (KARESKOSKI et
23 23 al., 2005; PESCH et al., 2006; KARESKOSKI; KATILA, 2008; KARESKOSKI et al., 2010). Em relação a Pi, Kareskoski et al. (2010) e Pesch et al. (2006), encontraram concentrações mais elevadas na fração rica em espermatozoides quando comparada às demais frações, esse aumento também foi demonstrado em um grupo de garanhões férteis, em comparação a um grupo de garanhões sub-férteis. Em contrapartida, o grupo de garanhões sub-férteis apresentou, na fração rica em espermatozoides, concentrações de Cl - mais elevadas, em comparação ao grupo fértil. Concentrações mais elevadas de Ca ++ e Mg + foram encontradas na fração pobre em espermatozoides, que contém fluidos advindos das vesículas seminais e de pequenas quantidades restantes no canal uretral, vindos dos epidídimos e ampolas do ducto deferente (KARESKOSKI et al., 2010; KARESKOSKI et al., 2011). Pesch et al. (2006) também encontraram correlação positiva da presença de Ca ++ com o volume do ejaculado, confirmando sua relação com as glândulas sexuais acessórias. Já as concentrações de Fe + e Zn +, possuem correlação positiva com a concentração espermática e negativa com o volume (PESCH et al., 2006). Neste mesmo estudo, a concentração de Cu + obteve correlação positiva apenas com o volume. Elevados níveis de Cl - e Na +, foram encontrados no líquido pré-seminal (KARESKOSKI et al., 2005; KARESKOSKI et al., 2010). Kareskoski (2011) encontrou elevados níveis de K + na fração pós-espermática, em ejaculados de garanhões colhidos de forma fracionada, quando comparou a fração rica ao ejaculado total HORMÔNIOS Os hormônios encontrados no PS do ejaculado de várias espécies são: prostaglandinas, estrógeno e ocitocina. A prostaglandina E2 (PGE 2 ) está presente no PS de bovinos (JAEGER; DELCURTO, 2012) e de carneiros e sua produção parece ser advinda das vesículas seminais (SHORE et al., 2003). Em suínos, demonstrou-se que o
24 24 PS contém componentes que podem regular a síntese de prostaglandinas no oviduto (KACZMAREK et al., 2010). Nos equinos, tanto as prostaglandinas, quanto o estrógeno, são encontrados no sêmen equino, são produzidos nas células germinativas dos testículos e parecem influenciar no transporte espermático no útero da égua (CLAUS et al., 1992). Troedsson et al. (2005) sugerem que a PGE 2 facilita o transporte espermático na junção úterotubárica e Kareskoski (2011) sugere que a PGE 2 modula a resposta imunitária no trato genital feminino. Em contrapartida, Kareskoski (2011) afirma não saber se a PGE 2 produzida pelo PS pode alcançar a junção útero-tubárica em níveis suficientes para exercer um efeito no músculo da papila do oviduto. Porém, nos ejaculados fracionados, não foram encontradas diferenças significativas na produção de PGE 2 entre as frações do ejaculado equino (KARESKOSKI, 2011) EFEITO DO PLASMA SEMINAL NA CRIOPRESERVAÇÃO DO SÊMEN EQUINO A ideia de que o PS não é necessário na reprodução surgiu a partir do momento que as células espermáticas do epidídimo puderam ser utilizadas com sucesso em inseminações artificiais em algumas espécies (RODGER, 1975). Contudo, até os dias atuais, o efeito do PS ainda é bastante controverso. Pickett et al. (1975) relataram que a centrifugação não afetou os parâmetros de motilidade pré e pós-congelação quando a concentração final de PS foi de 10%, por outro lado, quando essa concentração foi de 2%, houve redução nos valores de motilidade. Jasko et at. (1991) encontraram resultados superiores nos parâmetros de motilidade espermática pós-refrigeração, quando o sêmen foi centrifugado para remoção do PS. Jasko et al. (1992) relataram que a concentração ótima de PS para a refrigeração estaria entre 5 e 20%, em que os espermatozoides mantém suas características espermáticas após a refrigeração. Neste mesmo experimento, os autores relataram que a remoção total do plasma seminal e a ressuspensão em meio à base de leite desnatado, diminuiu a
25 25 motilidade dos espermatozoides, resultados semelhantes foram encontrados por Padilla e Foote (1991). Sabe-se que o PS é necessário para as células espermáticas como meio de transporte e possui substâncias necessárias para a sobrevivência dos espermatozoides durante a ejaculação e no transporte dentro do trato reprodutivo feminino, até alcançarem o oócito e ocorrer à fertilização. Apesar disso, o PS é um meio pobre para manutenção das células espermáticas durante o processo de criopreservação, desta forma, ele é removido e substituído por diluentes para que o sêmen seja criopreservado sem grandes perdas (RODRÍGUEZ-MARTÍNEZ et al., 2011). Ao longo dos anos, houve modificações nos meios diluentes de manutenção e nos meios de congelação, desta forma, em dias atuais, esses meios possuem muitas substâncias, além daquelas presentes no PS, algumas são de melhor qualidade e biodisponibilidade para as células espermáticas, permitido uma melhor manutenção durante a criopreservação. Na tentativa de desvendar uma variação individual do PS entre os garanhões e o efeito deste na integridade de membrana, Aurich et al. (1996) dividiram dois grupo de garanhões, um com motilidade progressiva 30% (G1) e outro com motilidade progressiva 20% (G2), e adicionaram plasma seminal do mesmo garanhão e do garanhão do grupo oposto. Quando o PS do G1 foi adicionado ao G2, houve melhora significativa na motilidade progressiva, assim como na integridade de membrana. Porém quando o PS do G2 foi adicionado ao G1, houve diminuição da motilidade progressiva pós-descongelação. Desta forma, os mesmos autores concluíram haver uma variação individual na composição do PS entre garanhões. Apesar de não saberem quais seriam os efeitos sobre as células espermáticas, algumas hipóteses foram propostas: uma delas está relacionada ao colesterol, que desempenha um importante efeito estabilizador sobre as membranas espermáticas, assim sendo, uma baixa concentração de colesterol no PS poderia aumentar a sensibilidade dos espermatozoides quando submetidos ao processo de criopreservação; e a de que há fatores que inibem o influxo de colesterol na membrana (AURICH et al., 1996; GADELLA et al., 2001).
26 26 O PS pode ter componentes que protegem a membrana espermática durante a criopreservação, porém, cada garanhão possui quantidades diferentes de substâncias, podendo ser um fator determinante na capacidade de sobrevivência do espermatozoide e, consequentemente, numa maior tolerância ao processo de criopreservação (BRINSKO et al., 2000; MOORE et al., 2005). Kareskoski et al. (2006), trabalhando com colheita fracionada de sêmen em garanhões, avaliaram a presença ou ausência do PS entre as diferentes frações e não encontraram diferença na integridade da membrana entre as frações estudadas, enquanto que a fração rica em espermatozoides apresentou maior motilidade espermática pósdescongelação. Estes resultados também foram demonstrados em estudos anteriores por Varner et al. (1987). Estudos relacionados às proteínas do PS têm demonstrado que as de baixo peso molecular possuem uma capacidade de proteção contra o choque frio, além de propriedades antioxidantes. Da mesma forma, as proteínas epididimárias desempenham papéis importantes, como a modificação da superfície de membrana espermática, preservando os espermatozoides das crioinjúrias (MUIÑO-BLANCO et al., 2008). Uma diferença significativa em relação à fragmentação do DNA, antes e após a refrigeração, foi encontrada quando o PS foi retirado do ejaculado e ressuspendido em diluente à base de leite desnatado, a fração rica obteve menor fragmentação do DNA em relação à fração pós-espermática (KARESKOSKI; KATILA, 2008). O Cu + participa do metabolismo de muitas enzimas, sendo cofator para a superóxido-dismutase (SOD), que por sua vez é envolvida na proteção da membrana contra radicais livres. O Zn + participa da maturação dos espermatozoides e bloqueiam o influxo precoce de Ca ++ ionizável para evitar a reação acrossomal (PESCH et al., 2006). A correlação positiva das enzimas AST, GGT, FAC e LDH e os íons Fe + e Zn +, indicam origem testicular desses componentes. A enzima GGT, pode desempenhar uma função de proteção ao estresse oxidativo nos espermatozoides, no entanto, a sua real função ainda é desconhecida (PESCH et al., 2006).
27 27 Elevadas concentrações de Ca ++ foram encontradas na fração pobre em espermatozoides em ejaculados fracionados (YANAGIMACHI; USUI, 1974; KARESKOSKI et al., 2010; KARESKOSKI et al., 2011b), que podem estar correlacionado com os altos índices de fragmentação do DNA nesta fração (YANAGIMACHI; USUI, 1974; KARESKOSKI et al., 2011b). Entretanto, a concentração de Ca ++ não influenciou na motilidade total e progressiva nas diferentes frações do ejaculado (KARESKOSKI et al., 2011b). Diferentes resultados relacionados à concentração de Ca ++ foram encontrados em humanos a partir de ejaculados colhidos de forma fracionada, mostrando que estava presente no PS em maior proporção na primeira fração (VALSA et al., 2012). Da mesma forma, esses autores avaliaram a concentração de Ca ++ intracelular e os resultados foram semelhantes ao encontrados no PS. Sabe-se que o Ca ++ participa de vários processos essenciais aos espermatozoides, dentre eles: motilidade (VALSA et al., 2012), funções metabólicas, reação acrossomal (YANAGIMACHI, 1994) e fertilização (KARESKOSKI et al., 2006). Os achados da concentração de Ca ++ na primeira fração do PS, por serem semelhantes aos encontrados no interior das células, indicam que esses íons entram nas células espermáticas na ausência de fluidos das vesículas seminais (VALSA et al., 2012). Já Rufo et al. (1982), mostraram que as vesículas seminais liberam proteínas que impedem a entrada do Ca ++ nas células espermáticas. Kareskoski et al. (2010) encontraram concentrações de K +, Na + e Cl - semelhantes entre a fração rica, a fração pobre em espermatozoides e na fração ejaculado, sugerindo que a longevidade dos espermatozoides entre as frações, provavelmente não esteja relacionada com as concentrações destes. A maior distribuição dos íons nos espermatozoides, e também no PS, pode ser uma hipótese para explicar a qualidade do sêmen e, talvez, a fertilidade em diferentes ejaculados e diferentes garanhões (KARESKOSKI, 2011; JUYEMA et al., 2012). Entretanto, a maioria dos estudos sobre os íons no plasma seminal foram realizados em humanos, sendo que, em equinos, existem poucos trabalhos relacionados às funções específicas de íons do PS (JUYEMA et al., 2012).
28 28 Os espermatozoides dos mamíferos possuem uma bicamada lipídica com elevados teores de ácidos graxos insaturados, desta forma, estão propensos ao estresse oxidativo. A produção excessiva de radicais livres gera, espécie reativa de oxigênio (ERO) que podem danificar os espermatozoides, diminuir a motilidade espermática e até causar infertilidade. O ânion superóxido, o radical hidroxila e o peróxido de hidrogénio são algumas das principais ERO presentes no PS (AGARWAL, 2005). Uma peroxidação leve parece ser um mecanismo fisiológico para promover a capacitação das células espermáticas, no entanto uma peroxidação excessiva pode causar danos à membrana plasmática dos espermatozoides, tendo como consequências a perda da motilidade e, até mesmo, a capacidade de fertilização do sêmen (AITKEN; BAKER, 2004). Antioxidantes presentes no PS protegem essas células do estresse oxidativo porém uma pequena quantidade de ERO parece ser necessária para o bom funcionamento celular, inclusive no processo de capacitação e reação acrossomal, entretanto, a produção excessiva de ERO prejudica o mecanismo dos antioxidantes, podem causar injúrias aos espermatozoides (AGARWAL, 2005). As mitocôndrias dos espermatozoides são responsáveis pela produção constante de energia utilizada para que essas células tenham motilidade, de maneira que, uma disfunção mitocondrial gera aumento de ERO, que por sua vez danifica a mitocôndria e aumenta produção de ERO (AGARWAL, 2005). Muitas células, incluindo as espermáticas, podem induzir a sua própria morte celular programada, é um fenômeno fisiológico caracterizado por alterações morfológicas e funcionais, denominada de apoptose (AGARWAL, 2005; COX; NELSON, 2014). Os mecanismos que regulam o início da apoptose envolvem fatores intrínsecos e extrínsecos e pode desencadear uma série de estímulos (COX; NELSON, 2014). A exposição à radiação, quimioterapia ou toxinas, são exemplos de mecanismos extrínsecos que causam estímulos desencadeadores de apoptose nas células testiculares (AGARWAL, 2005). As mitocôndrias desempenham um papel importante no mecanismo de apoptose celular, a integridade da mitocôndria é estabelecida pela presença do citocromo C no interior da celular, protegido pela membrana (AGARWAL, 2005). Altos níveis de ERO provocam a desestabilização da membrana das
29 29 mitocôndrias, que ativa a proteína C a partir do citocromo, que através dos seus mecanismos, se ligam à enzima caspase e induzem a apoptose (AGARWAL, 2005; COX; NELSON, 2014) PRINCIPAIS MÉTODOS DE COLHEITA DO SÊMEN EQUINO O processo de colheita de sêmen em garanhões se iniciou por volta de 1965, em que utilizava-se a estimulação manual do pênis com um saco plástico descartável sobre a extremidade do pênis para pegar o ejaculado (CRUMP Jr.; CRUMP, 1988; McDONNEL; LOVE 1990; McDONNEL, 1992). Em dias atuais, esse tipo de colheita pode ser utilizada em casos específicos, como por exemplo, em garanhões com paralisia de pênis ou com déficit de ereção (McDONNELL, 2005). A partir disso, essa técnica foi aperfeiçoada e criou-se um modelo de vagina artificial caseiro, estilo Mississippi, composta por um tudo de borracha e látex, uma extremidade com duas camadas de espuma e um acolchoamento de borracha (BERLINER, 1960; CRUMP Jr.; CRUMP, 1988). Desde então, as colheitas de sêmen em equinos são realizadas por meio de uma vagina artificial, em que o cavalo monta em manequim ou em uma égua em estro devidamente contida (SCHUMACHER; RIDDELL, 1986; CRUMP Jr.; CRUMP, 1988). Diversos modelos de vagina artificial (VA) foram criados, tais como: Hannover, Missouri, Nishikawa, Colorado, Botucatu, dentre outros modelos, e são empregadas usualmente na colheita convencional de ejaculados de garanhões em programas de reprodução assistida em todo o mundo. Basicamente, esses modelos de vaginas possuem um tubo rígido, uma mucosa interna de látex, que armazena o líquido para manutenção da temperatura interna, em torno de 44 e 50 C, e um recipiente para armazenamento do sêmen (McKINNON; VOSS, 1992; FONSECA, 2006). A partir do trabalho realizado por Lopes et al. (1997), a maioria das colheitas de sêmen usualmente colocam uma mucosa sanitária interna de plástico, evitando o contato das células espermáticas com a mucosa de látex, que pode ser prejudicial aos espermatozoides, além de evitar a transmissão de doenças venéreas de um garanhão para outro durante as colheitas.
30 30 Apesar das vaginas artificiais convencionais serem as mais utilizadas na rotina dos haras a nível mundial, por serem de fácil utilização e praticidade, não representam uma situação fisiológica da monta natural, assim, no volume total da ejaculação, todos os fluidos se misturam em um recipiente único (TISCHNER et al., 1974; RODRÍGUEZ- MARTÍNEZ et al., 2011). Um ponto crítico da utilização da colheita de forma convencional está relacionada à contaminação bacteriana, de forma que, neste modelo de colheita, o líquido préseminal, assim como todos os jatos de sêmen, se misturam, entrando em contato direto com o pênis, que poderá levar a contaminação do ejaculado, o que justifica a frequência de isolamento bacteriano sem evidência de infecção no ejaculado total (TISCHNER; KOSINIAK, 1992; SILVA et al., 2003). Outras formas de colheita de sêmen mencionadas na literatura são: a colheita de sêmen com o animal em estação, indicada para aqueles com problemas do sistema músculo esquelético ou com lesões neurológicas, impossibilitado-os de realizar a monta, principalmente quando ocorre em animais idosos (SCHUMACHER; RIDDELL, 1986; CRUMP Jr.; CRUMP, 1988; McDONNELL, 2005); por indução farmacológica, utilizado para aqueles garanhões com distúrbios ejaculatórios, fraturas ósseas com imobilização de algum membro, disfunção erétil, paralisia de pênis, em que opta-se pela utilização de fármacos alfa-adrenérgicos (McDONNELL, 2001; McDONNELL, 2005), além de detomidina, prostaglandina e ocitocina, que também têm sido estudados (McDONNEL, 1992; McDONNEL, 2001); e a colheita de sêmen da cauda do epidídimo, para garanhões com morte inesperada, causada por cólicas, acidentes traumáticos ou em problemas relacionados à manutenção dos testículos, como na hérnia escrotal, ou outras situações que comprometam a utilização futura do material genético (PAPA et al., 2008; HEISE et al., 2011; MONTEIRO et al., 2011; MONTEIRO et al., 2013) COLHEITA FRACIONADA DO SÊMEN EQUINO Inicialmente, a colheita fracionada do sêmen equino, com o uso de vagina artificial aberta, foi descrita por Mann et al. (1957), em que foram determinadas as primeiras
31 31 divisões do ejaculado nas frações pré-espermática, rica em espermatozoides, pobre em espermatozoides e gelatinosa. Esse modelo de vagina artificial permite a separação das diferentes frações do ejaculado de acordo com os jatos de sêmen, podendo ser usado como um método diagnóstico de patologias das glândulas sexuais acessórias e/ou do pênis, além de permitir uma colheita de sêmen com uma menor contaminação bacteriana. Em 1974, Tischner et al., objetivando obter mais informações sobre o padrão copulatório e ejaculatório dos garanhões, realizaram colheitas com o uso de vagina artificial aberta, a qual denominaram de modelo Kraków-72. A partir deste trabalho, pode-se compreender melhor o processo ejaculatório dos equinos. Varner et al. (1987) utilizando uma adaptação do modelo proposto por Tischner et al. (1974) e utilizaram uma vagina artificial modelo Missouri desprovida do copo coletor que fica acoplado no final da vagina, com isso, o ejaculado foi dividido em duas frações, a primeira composta pelos três primeiro jatos de sêmen e a segunda, o restante do ejaculado, sendo colhidas em recipientes diferentes. Em 1993, um modelo de manequim com simulador de colheita fracionada computadorizado foi desenvolvido na Finlândia, com o objetivo de separar as frações seminais e minimizar a contaminação da fração rica em espermatozoides, denominado de Equidame (LINDEBERG et al., 1999). É composto internamente por uma vagina artificial e acoplada a ela há um funil metálico, logo abaixo, existe uma bandeja coletora de sêmen que possui cinco compartimentos onde são encaixados os recipientes de colheita conectados a um computador e, à medida que vão sendo preenchidos com o peso programado correspondente a cada fração do ejaculado, essa bandeja se move horizontalmente, sendo necessário apenas uma pessoa para a realização da colheita (LINDEBERG et al., 1999). Apesar de inovador, seu custo parece ser bastante elevado, um fator limitante à sua acessibilidade. Outro modelo de vagina artificial aberta para colheita fracionada foi criado por Fonseca (2006), denominada de vagina experimental articulada, composto por um dispositivo fracionador que separa o líquido pré-espermático no primeiro copo, em seguida, os três primeiros jatos num segundo copo e o restante do ejaculado novamente no primeiro copo, separando, assim, em duas porções.
32 32 Em 2011, Kareskoski comparou a colheita fracionada através do Equidame à utilização da vagina artificial modelo Missouri com um funil acoplado a uma bainha de probe, em que as frações são separadas por pinças, demonstrando que não houve diferença entre os dois métodos. Apesar de várias formas e modelos de colheitas fracionadas estarem descritos na literatura, ainda é pouco utilizada na rotina, em alguns casos por se tratar de uma técnica laboriosa ou pela falta de um método que se adeque aos profissionais que trabalham à campo BENEFÍCIOS DA COLHEITA FRACIONADA DO SÊMEN EQUINO Em comparação ao método tradicional, a colheita fracionada possui algumas vantagens assim como, desvantagens. De acordo com Jasko et al. (1992), o PS possui um efeito deletério sobre a viabilidade das células espermáticas e, sabendo das características ejaculatórias dos equinos, a colheita fracionada, começou a ser utilizada como uma alternativa para minimizar as injúrias provocadas pelo PS, sendo também uma opção à centrifugação para retirada do PS, que acarreta danos aos espermatozoides intolerantes a esta técnica. Varner et al. (1987) relatam a utilização da colheita fracionada como forma de eliminar o contato do plasma seminal produzido pelas vesículas seminais, com a fração rica em espermatozoides e com isso, melhorar a longevidade espermática, desta forma, foram colhidos apenas os três primeiros jatos de sêmen e observou-se que inicialmente não há diferença de motilidade entre a fração rica em espermatozoides comparada ao ejaculado total, porém, houve diferença estatística na motilidade total e progressiva após algumas horas de incubação. Achados semelhantes foram reportados por Kareskoski et al. (2006), em que a motilidade total da fração rica foi superior ao ejaculado total pósdescongelação. A partir disso, pode-se concluir que existe um efeito deletério do plasma seminal nas células espermáticas ainda não elucidados e que, com o passar do tempo, o contato prejudica ainda mais a viabilidade espermática.
33 33 Além disso, também existem evidências de que a colheita fracionada diminui a contaminação bacteriana do ejaculado, como demonstrado por Tischner et al. (1974), em que os jatos foram separados individualmente e não observou-se crescimento bacteriano em nenhuma das frações, ao contrário do observado nas amostras de ejaculado inteiro, que apresentaram elevado grau de contaminação, além de ressaltar a eficiência na separação exata das frações do ejaculado através da colheita fracionada. Lindeberg et al. (1999) relataram uma diferença estatística significativa das unidades formadoras de colônias (UFC) após a refrigeração, por um período de 24h, quando a colheita foi realizada de forma convencional, com a vagina artificial Missouri, em comparação ao modelo Equidame de colheita fracionada entretanto, após um período de 48h, não foram encontradas diferenças significativas entre os dois métodos. Em relação à contagem de UFC entre as frações pré-espermáticas e rica em espermatozoides, colhidos por meio do Equidame, não houve diferença e poucas UFC foram isoladas (LINDEBERG et al., 1999). Além disso, quando esses mesmos autores compararam os valores de motilidade total e progressiva entre os métodos de colheita, não houve diferença estatística significativa 24 ou 48h após a refrigeração e após a descongelação. Uma redução das UFC também foi reportada por Fonseca (2006), quando os ejaculados foram colhidos fracionados com a vagina artificial articulada, ao contrário do observado no ejaculado total, colhido pelo método convencional, apresentando uma elevação das UFC. Porém, esse trabalho não mostrou diferença significativa na cinética espermática entre a fração rica e a fração pobre em espermatozoides logo após as colheitas. Sieme et al. (2004), demonstraram que os primeiros três jatos de sêmen colhidos fracionados e centrifugados para a congelação diferenciaram positivamente em termos de integridade de membrana e motilidade progressiva após a descongelação. Diferentes resultados foram obtidos por Akcay et al. (2006), que afirmaram haver uma superioridade na integridade de membrana para um pool de espermatozoides das demais frações do ejaculado, separados através do Equidame quando comparado à
34 34 fração rica em espermatozoides, já em relação à motilidade progressiva, não houve diferença entre o pool e a fração rica. Resultados semelhantes foram sugeridos por Kareskoski et al. (2006), estes compararam as diferentes frações do ejaculado fracionado, colhidos com o Equidame, após a remoção do PS através da centrifugação e ressuspensão em meio de refrigeração, com as mesmas frações, sem a retirada do PS e apenas diluídas em meio à base de leite, os resultados mostraram uma redução da motilidade dos espermatozoides em amostras que o PS foi removido, portanto, os autores sugerem existir uma interação positiva da motilidade com a presença de PS. Kareskoski (2011) encontrou um percentual elevado de fragmentação do DNA nas frações rica, pobre e a fração correspondente ao ejaculado total quando as amostras foram refrigeradas com a presença do PS. Além disso, houve diferença significativa positiva em VAP, VCL e VSL para as amostras das diferentes frações que continham PS. Apesar disso, não foram encontradas diferenças entre os parâmetros de motilidade total e progressiva entre as diferentes frações do ejaculado após a refrigeração. Além dos benefícios da colheita fracionada anteriormente citados, uma utilidade de extrema importância e que se torna necessário, é para garanhões com vesiculite. Desta forma, uma nova abordagem da colheita foi relatada com sucesso em um garanhão com piospermia (OLIVEIRA et al., 2015). Como a fração contaminada do ejaculado é a terceira, produzida pela vesícula seminal, acredita-se que as primeiras frações de sêmen são isentas de contaminação ou pouco contaminadas, tornando possível a recuperação do sêmen para posterior utilização para criopreservação.
35 35 REFERÊNCIAS AITKEN, R. J.; BAKER, M. A. Oxidative stress and male reproductive biology. Reproduction Fertility and Development, v.16, p , AKCAY, E.; REILAS, T.; ANDERSSON, M.; KATILA, T. Effect of seminal plasma fractions on sperm survival after cooled storage. Journal of Veterinary Medicine, v.53 p , ALGHAMDI, A. S.; TROEDSSON, M. H.; XUE, J. L.; CRABO, B. G. Effect of seminal plasma concentration and various extenders on postthaw motility and glass wool-sephadex filtration of cryopreserved stallion semen. American Journal of Veterinary Research, v.63, p , ALMEIDA, J. L. Efeito de diferentes concentrações de plasma seminal na criopreservação do sêmen equino [dissertação]. Brasília: Faculdade de Agronomia e Medicina Veterinária, Universidade de Brasília; AMANN, R. P.; GRAHAM, J. K. Spermatozoal function. In: McKinnon AO, Voss JL. Equine reproduction. Philadelphia: Saunders. 1993: AURICH, J. E.; KÜHNE, J. A.; HOPPE H.; AURICH, C. Seminal plasma affects membrane integrity and motility of equine spermatozoa after cryopreservation Theriogenology, v.46, p , AURICH, C. Factors affecting the plasma membrane function of cooled-stored stallion spermatozoa. Animal Reproduction Science, v.89, p.65 75, BALL, B. A.; GRAVANCE, C. G.; MEDINA, V.; BAUMBER, J.; LIU, I. K. Catalase activity in equine semen. American Journal of Veterinary Research, v.61, p , 2000.
36 36 BERLINER, V. Horses and Jackstock, In: Perry, E.J. (ed.): The Artificial Insemination of Farm Animals. Rutgers University Press, New Brunswick, NJ, 1960, p.221. BEYLER, S. A.; ZANEVELD, L. J. D. 1982: The male accessory sex glands. In: Biochemistry of mammalian reproduction. Eds: Zaneveld LJD, Chatterton RT. John Wiley & Sons, NY, USA. pp BITTMAR, A.; KOSINIAK, K. The role of selected biochemical components of equine seminal plasma in determining suitability for deep-freezing. Archivum Veterinarium Polonicum, v.35, p.17 29, BRANDONL, C. I.; HEUSNES, G. L.; CAUDLE, A. B.; FAYRER-HOSKEN, R. A. Two-dimensional polyacrylamlde gel electrophoresis of equine seminal plasma proteins and their correlation with fertility. Theriogenology, v.52, p , BRINSKO, S. P.; CROCKETT, E. C.; SQUIRES, E. L. Effect of centrifugation and partial removal of seminal plasma on equine spermatozoal motility after cooling and storage. Theriogenology, v.54, p , CALVETE, J. J.; NESSAU, S.; MANN, K.; SANZ, L.; SIEME, H.; KLUG, E.; TÖPFER-PETERSEN, E. Isolation and Biochemical characterization of stallion seminal-plasma proteins. Reproduction in Domestic Animals, v.29, p , CLAUS, R.; DIMMICK, M. A.; GIMENE, Z. T.; HUDSON, L. W. Estrogens and prostaglandin f2a in the semen and blood plasma of stallions. Theriogenology, v.38, p , CRUMP Jr, J.; CRUMP, J. Stallion Ejaculation Induced by Manual Stimulation of the Penis. The Journal of Theriogenology, v.31, n.2, p , EKHLASI-HUNDRIESER, M.; SCHÄFER, B.; KIRCHHOFF, C.; HESS, O.; BELLAIR, S.; MULLER, P.; TÖPFER-PETERSEN, E. Structural and molecular
37 37 characterization of equine sperm-binding fibronectin-ii module proteins. Molecular Reproduction and Development, v.70, p.45 57, ENGLAND, G. C. (2005): The normal stallion. In.: Fertility & Obstetrics in the Horse. Blackwell, Oxford, p FONSECA, C. W. Efeito de uma nova técnica de coleta fracionada sobre a composição do plasma seminal e qualidade do sêmen equino pós-descongelamento [dissertação]. Campos dos Goytacazes: Universidade estadual do norte fluminense Darcy Ribeiro: GADELLA, B. M.; LOMBARDO, F.; PAOLI, D.; CAPONECCHIA, L.; FAMILIARI, G.; VERLENGIA, C.; DONDERO, F.; LENZI, A. Capacitacion and the acrosome reaction in equine sperm. Animal Reproduction Science, v.68, p , GREUBE, A.; MÜLLER, K.; TÖPFER-PETERSEN, E.; HERRMANN, A.; MÜLLER, P. Interaction of fibronectin type II proteins with membranes: the stallion seminal plasma protein SP-1 2. Biochemistry, v.43, p , GUERRA, P. J. Brasil tem o quarto maior rebanho equino do mundo, com 5,8 milhões de cabeça. Notícia 16/03/2010. Conselho Federal de Medicina Veterinária. Disponível em: Acesso em: 01 de outubro de 2015, 00:03 hr. HAFEZ, E. S. Reprodução Animal, 7.ed., São Paulo: Manole, p. HEISE, A.; THOMPSON, P. N.; GERBER, D. Influence of seminal plasma on fresh and post-thaw parameters of stallion epididymal spermatozoa. Animal Reproduction Science, v.123, p , JAEGER, J. R.; DELCURTO, T. Endogenous prostaglandin F2 concentrations in bovine whole semen, seminal plasma, and extended semen. Theriogenology, v.78, p , 2012.
38 38 JASKO, D. J.; MORAN, D. M.; FARLIN, M. E.; SQUIRES, E. L. Effect of seminal plasma dilution or removal on spermatozoal motion characteristics of cooled stallion semen. Theriogenology, v.35, n.6, p , JASKO, D. J.; HATHAWAY, J. A.; SCHALTENBRAND, V. L.; SIMPER, W. D.; SQUIRES, E. L. Effect of seminal plasma and egg yolk on motion characteristics of cooled stallion spermatozoa. Theriogenology, v.37, p , KACZMAREK, M. M.; KRAWCZYNSKI, K.; BLITEK, A.; KIEWISZ, J.; SCHAMS, D.; ZIECIK, A. J. Seminal plasma affects prostaglandin synthesis in the porcine oviduct. Theriogenology, v.74, p , KARESKOSKI, A. M.; REILAS, T.; CALVETE, J. J.; SANZ, L.; RODRIGUEZ- MARTINEZ, H.; KATILA, T. Proteins in fractionated stallion seminal plasma. Reproduction in Domestic Animals, v.40, p a. KARESKOSKI, A. M.; REILAS, T.; SANKARI, S.; ANDERSSON, M.; KATILA, T. Composition of fractionated stallion ejaculates. Animal Reproduction Science, v.89, p b. KARESKOSKI, A. M.; REILAS, T.; ANDERSSON, M.; KATILA, T. Motility and plasma membrane integrity of spermatozoa in fractionated stallion ejaculates after storage. Reproduction in Domestic Animals, v.41, p.33-38, KARESKOSKI, A. M.; KATILA, T. Components of stallion seminal plasma and the effects of seminal plasma on sperm longevity. Animal Reproduction Science, v.10, p , KARESKOSKI, A. M.; REILAS, T.; SANKARI, S.; ANDERSSON, M.; GUVENC, K.; KATILA, T. Alkaline and Acid Phosphatase, b-glucuronidase and Electrolyte Levels in Fractionated Stallion Ejaculates. Reproduction in Domestic Animals, v.45, p , 2010.
39 39 KARESKOSKI, A. M. Components of fractionated stallion seminal plasma and the effects of seminal plasma on sperm longevity [Dissertação]. Faculty of Veterinary Medicine University of Helsinki Finland. 2011, 86p KARESKOSKI, A. M.; RIVERA DEL ALAMO, M. M.; GUVENC, K.; REILAS, T.; CALVETE, J. J.; RODRIGUEZ-MARTINEZ, H.; ANDERSSON, M.; KATILA, T. Protein Composition of Seminal Plasma in Fractionated Stallion Ejaculates. Reproduction in Domestic Animals, v.46, p.79 84, 2011a. KARESKOSKI, A. M.; SANKARI, S.; JOHANNISSON, A.; KINDAHL, H.; ANDERSSON, M.; KATILA, T. The Association of the Presence of Seminal Plasma and Its Components with Sperm Longevity in Fractionated Stallion Ejaculates. Reproduction in Domestic Animals, v.46, p , 2011b. KATILA, T.; REILAS, T.; GUVENC, K.; ALM, K.; ANDERSSON, M. 2004: The effect of seminal plasma on motility characteristics and viability of spermatozoa after cooled storage. In: Muller, J., Z. Muller, and J. F. Wade (eds), Proceedings of the 3rd Meeting of the EEGG, Have meyer Foundation Monograph Series No. 13pp R & W Publications Limited, Suffolk, UK. KATILA, T.; KARESKOSKI, M.; AKCAY, E.; REILAS, T.; KOSKINEN, E.; CALVETE, J. J Seminal plasma studies in stallions.in: Alm, H., Torner, H., Wade, J.F. (Eds.), Havemeyer Foundation Monograph Series, vol. 18, pp KLEIN, B. G. Cunningham Tratado de Fisiologia Veterinária. 5. Ed. Rio de Janeiro: Elsevier, 2014, 451p. KOSINIAK, K. Characteristics of the successive jets of ejaculated semen of stallions. Journal of Reproduction and Fertility, Suppl. v.23, p.59 61, LEWIS, S. E. M.; SAMANTHA, E.; STERLING, L.; YOUNG, I. S.; THOMPSON, W. Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men. Fertility and Sterility, v. 67, n.1, 1997.
40 40 LINDEBERG, H.; KARJALAINEN, H.; KOSKINEN, E.; KATILA, T. Quality of stallion semen obtained by a new semen collection phantom (equidame ) versus a missouri artificial vagina. Theriogenology, v.51, p , LOPES, M. D.; PAPA, F. O.; MARTINO, A. P.; BICUDO, S. D.; ALVARENGA, M. A. Efeito do tipo de mucosa de vagina artificial sobre a qualidade espermática de garanhões. Revista Brasileira de Reprodução Animal, v.21, n.4, p.29-34, MAGISTRINI, M.; LINDEBERG, H.; KOSKINEN, E.; BEAU, P.; SEGUIN, F. Biophysical and H magnetic resonance spectroscopy characteristics of fractionated stallion ejaculates. Journal of Reproduction and Fertility, Suppl. v.56, p , MANN, T.; SHORT, R. V.; WALTON, A. The 'tail-end sample' of stallion semen. Journal of agricultural Science Cambridge, v.49, p.301, MANN, T.; MINOTAKIS, C. S.; POLGE, C. Semen composition and metabolism in the stallion and jackass. Journal of Reproduction and Fertility, v.5, p , McDONNELL, S. M.; GARCIA, M. C.; KENNEY, R. M. Imipramine-Induced Erection, Masturbation, and Ejaculation in Male Horses. Pharmacology Biochemistry & Behavior, v.27, p , McDONNELL, S. M.; LOVE, C. C. Manual stimulation collection of semen from stallions: training time, sexual behavior and semen Theriogenology, v.33 n.6, McDONNELL, S. M. Ejaculation physiology and dysfunction. Veterinary Clinics of North America: Equine Practice, v.81, n.11, McDONNELL, S. M. Oral imipramine and intravenous xylazine for pharmacologicallyinduced ex copula ejaculation in stallions. Animal Reproduction Science, v.68, p , McDONNELL, S. M. Techniques for Extending the Breeding Career of Aging and Disabled Stallions. Clinical Techniques in Equine Pratice, v.4, p , 2005.
41 41 McKINNON, A. O.; VOSS, J. L. (1992) Equine Reproduction, Lea and Febiger, Philadelphia, London. MONTEIRO, G. A.; PAPA, F. O.; ZAHN, F. S.; DELLAQUA Jr., J. A.; MELO, C. M.; MAZIERO, R. R. D.; AVANZI, B. R.; ALVARENGA, M. A.; GUASTI, P. N. Cryopreservation and fertility of ejaculated and epididymal stallion Sperm. Animal Reproduction Science, v.127, p , MONTEIRO, G. A.; GUASTI, P. N.; ROCHA, A. S.; MARTIN, I.; SANCLER-SILVA, Y. F. R.; FREITAS DELL AQUA, C. P.; DELL AQUA Jr., J. A.; PAPA, F. O. Effect of Storage Time and Temperature of Equine Epididymis on the Viability, Motion Parameters, and Freezability of Epididymal Sperm. Journal of Equine Veterinary Science, v.33, p , MOORE, A. I.; SQUIRES, E. L.; GRAHAM, J. K. Effect of seminal plasma on the cryopreservation of equine spermatozoa. Theriogenology, v.63, p , MUNGAN, N. A.; MUNGAN, G.; BASAR, M. M.; BAYKAM, M.; ATAN, A. Effect of seminal plasma calcitonin levels on sperm mobility. Archives of Andrology, v.47, p , MUIÑO-BLANCO, T.; PÉREZ-PÉ, R.; CEBRIÁN-PÉREZ J.A. Review Adticle: Seminal plasma proteins and sperm resistence to stress. Reproduction in Domestic Animals, v.43 (suppl. 4), p.18-31, NELSON, D. L.; COX, M. M. Lehninger Princípios da Bioquímica. 6.ed. Porto Alegre: Artmed, 2014, 1298p. OLIVEIRA, S. N.; ARAUJO, E. A. B.; CHAVES-SILVA, L. F. M.; ANDRADE Jr, L. R. P.; DALANEZI, F. M.; PINTO, B. M.; CARNEIRO, J. A. M.; DELLAQUA Jr., J. A.; ALVARENGA, M. A.; PAPA, F. O. Eficiência de uma nova técnica de coleta de sêmen para diagnóstico e controle de piospermia em garanhões: Relato de caso. In: XVI Conferência Anual da ABRAVEQ. Águas de Lindóia. XVI. p
42 42 OLIVEIRA, S. N.; CHAVES-SILVA, L. F. M.; ARAUJO, E. A. B.; DALANEZI, F. M.; PINTO, B. M.; HARTWIG, F. P.; SEGABINAZZI, L.; HAYASHI, R. M.; DELLAQUA Jr., J. A.; ALVARENGA, M. A.; PAPA, F. O. Inovação e funcionalidade prática na coleta fracionada de sêmen equino. In: XVI Conferência Anual da ABRAVEQ, Águas de Lindóia - SP. p , PADILLA, A. W.; FOOTE, R. H. Extender and centrifugation effects on the motility patterns of slow-cooled stallion spermatozoa. Journal Animal Science, v.69,3 p , PAPA, F. O.; MELO, C. M.; FIORATTI, E. G.; DELL AQUA Jr. J. A.; ZAHN, F. S.; ALVARENGA, M. A. Freezing of stallion epididymal sperm. Animal Reproduction Science, v.107, p , PESCH, S.; BERGMANN, M.; BOSTEDT, H. Determination of some enzymes and macro- and microelements in stallion seminal plasma and their correlations to semen quality. Theriogenology, v.66, p , PICKETT, B. W.; SULLIVAN, J. J.; BYERS, W. W.; PACE, M. M.; REMMENGA, E. E."Effect of centrifugation and seminal plasma on motility and fertility of stallion and bull spermatozoa. Fertility and Sterility, v.26, p , REINERT, M.; CALVETE, J. J.; SANZ, L.; MANN, K.; TÖPFER-PETERSEN, E. Primary structure of stallion seminal plasma protein HSP-7, a zona-pellucida binding protein of the spermadhesin family. European Journal Biochemistry, v.242, p , RODGER, J. C. Seminal plasma, an unnecessary evil?. Theriogenology, v.2, n.6, p , RODRÍGUEZ-MARTÍNEZ, H.; KVIST, U.; ERNERUDH, J.; SANZ, L.; CALVETE, J.J. Seminal Plasma Proteins: What Role Do They Play?. American Journal of Reproductive Immunology, v.66 (Suppl. 1), p.11 22, 2011.
43 43 RUFO, G. A.; SINGH, J. P.; BABCOCK, D. F.; LARDY, H. A. Purification and characterization of a calcium transport inhibitor protein from bovine seminal plasma. Journal of Biological Chemistry, v.257, p , SAMPER, J. C. Equine Breeding Management adnd Artificial Insemination. 2. Ed. Missouri: Saunders, 2009, 212p. SCHEMBRI, M. A.; MAJOR, D. A.; SUTTIE, J. J.; MAXWELL, W. M.; EVANS, G. Capacitation-like changes in equine spermatozoa throughout the cryopreservation process. Reproduction Fertility and Development. v.14, p , SCHUMACHER, J.; RIDDELL, M. G. Collection of stallion semen without a mount. Theriogenology, v.26 n.2, SCHAMBONY, A.; GENTZEL, M.; WOLFES, H.; RAIDA, M.; NEUMANN, U.; TÖPFER-PETERSEN, E. Equine CRISP-3: Primary structure and expression in the male genital tract. Biochimica et Biophysica Acta, v.1387, p , SENGER, P.L. Pathways to Pregnancy and parturition. 2. ed. Pullman: Current Conceptions, p. SHORE, L.; YEHUDA, R. MARCUS, S.; BARTOOV, B.; SHEMESH, M. Effect of hcg injection on prostaglandin E concentrations in ram seminal plasma. Protaglandins & other Lipid Mediators, v.70, p , SIEME, H.; KATILA, T.; KLUG, E. Effect of semen collection practices on sperm characteristics before and after storage and on fertility of stallions. Theriogenology, v. 61, p , SILVA, K. M. G.; PAPA, F. O.; GABALDI, S. H. CROCCI, A. J. Efeito dos antibióticos gentamicina e cefalotina e do aminoácido taurina em meio de gema de ovo (Baken), sobre a longevidade e fertilidade do sêmen resfriado de equino. Revista Brasileira de Ciencia Veterinária, v.10, n.2, p.81-87, 2003.
44 44 TISCHNER, M.; KOSINIAK, K.; BIELANSKI, W. Analysis of the pattern of ejaculation in stallions. Journal of Reproduction and Fertility, v.41, p , TRISCHNER, M. Evaluation of deep-frozen semen in stallions. Journal of Reproduction and Fertility, Suppl, v.27, p.53-59, TISCHNER, M.; KOSINIAK, K. Techniques for collection and storage of stallion semen with minimal secondary contamination. Acta Veterinaria Scandinavica, (Suppl), v.88, p.83-90, TÖPFER-PETERSEN, E.; EKHLASI-HUNDRIESER, M.; KIRCHHOFF, C.; LEEB, T.; SIEME, H. The role of stallion seminal proteins in fertilization. Animal Reproduction Science, v.89, p , TROEDSSON, M. H. T.; DESVOUSGES, A. S.; ALGHAMDI, A. S.; DAHMS, B.; DOW, C. A.; HAYNA, J.; VALESCO, R.; COLLAHAN, P. T.; MACPHERSON, M. L.; POZOR, M.; BUHI, W. C. Components in seminal plasma regulating sperm transport and elimination. Animal Reproduction Science, v.89, p , TURNER, R. M. O.; McDONNELL, S. M. Alkaline phosphatase in stallion semen: characterization and clinical applications. Theriogenology, v.60, p.1-10, VALSA, J.; SKANDHAN, K. P.; KHAN, P. S.; SUMANGALA, B.; GONDALIA, M. Split ejaculation study: semen parameters and calcium and magnesium in seminal plasma. Central European Journal of Urology, v.65, n.4, p , VARNER, D. D.; BLANCHARD, T. L.; LOVE, C. L.; GARCIA, M. C.; KENNEY, R. M. Effects of semen fractionation and dilution ratio on equine spermatozoal motility parameters. Theriogenology, v.28, p , WEBER, J. A.; WOODS, G. L. A technique for transrectal ultrasonography of stallions during ejaculation. Theriogenology, v.36, n.5, 1991.
45 45 YANAGIMACHI, R.; USUI, N. Calcium dependence of the acrosome reaction and activation of guinea pig spermatozoa. Experimental Cell Research, v.89, p , YANAGIMACHI, R. Fertility of mammalian spermatozoa: its development and relativity. Zygote, v.3, p , 1994.
46 46 HIPÓTESE O novo método de colheita pode recuperar um maior número de espermatozoides por mililitro. A colheita de sêmen fracionada pode aumentar a viabilidade das células espermáticas pós refrigeração e congelação. OBJETIVOS ESPECÍFICOS Desenvolver uma nova técnica de colheita fracionada de sêmen em garanhões. Padronizar um método de colheita fracionada que possibilite colheitas das frações de forma segura e ser utilizada em pesquisas futuras e no campo, sem perdas espermáticas. Avaliar o efeito do plasma seminal nas diferentes frações do ejaculado colhidos de forma fracionado em garanhões sobre a viabilidade e motilidade espermática, integridade da membrana plasmática e atividade mitocondrial dos espermatozoides, antes e após os processos de refrigeração e congelação.
47 47 CAPÍTULO II
48 48 ARTIGO I Artigo submetido à Revista Veterinária e Zootecnia ISSN , ranqueada como B3 pelo QUALIS CAPES de COLHEITA FRACIONADA E SEUS PRINCIPAIS BENEFÍCIOS NA CRIOPRESERVAÇÃO DO SÊMEN DE GARANHÕES RESUMO As colheitas de sêmen em equinos são realizadas de forma convencional, com vagina artificial fechada, em que todas as frações se misturam. No entanto, a colheita de sêmen de forma fracionada, separa as diferentes frações do ejaculado, cada uma dessas frações possuem uma maior ou menor quantidade de plasma seminal, sendo as glândulas sexuais acessórias responsáveis por sua produção. Cada garanhão possui características individuais com relação à manutenção das células espermáticas durante a criopreservação, essas características podem estar relacionadas à produção do plasma seminal, assim como dos vários componentes. Sabe-se que existe um efeito deletério desempenhado pelos componentes do plasma seminal produzido principalmente pelas vesículas seminais, aos espermatozoides durante o processo de criopreservação, porém, esses fatores ainda são desconhecidos. Várias hipóteses são sugeridas, tais como, a redução na produção de lipídeos e os tipos de proteínas e íons presentes em cada uma das frações do ejaculado. Sabendo disso, a colheita fracionada pode trazer benefícios aos espermatozoides, de forma que as primeiras frações não tenham contato com o plasma seminal produzido pelas vesículas seminais, possibilitando uma melhor manutenção espermática durante a criopreservação. Palavras-chave: equino, colheita de sêmen, espermatozoides, plasma seminal. FRACTIONATED COLLECTION AND THEIR MAIN BENEFITS CRYOPRESERVATION IN THE STALLION SPERM ABSTRACT Equine semen is collected by conventional way, with a closed artificial vagina, where all the fractions are mixed. However, semen collection discontinuously, separating the different fractions of the ejaculate, each of these fractions have a greater or lesser amount of seminal plasma, and the sex accessory glands responsible for their production. Each stud has individual characteristics with respect to the maintenance of sperm cells during the cryopreservation, these characteristics may be related to production of seminal plasma as well as the various components making up. It is known that there is a deleterious effect played by components of seminal plasma mainly produced by the seminal vesicles, the sperm cells during the cryopreservation process, however, these factors are still unknown. Several hypotheses are suggested such as reducing the production of lipids and proteins and the types of ions present in each fraction of the ejaculate. Knowing this, the fractional harvest can be beneficial to sperm, so that the first fraction have no contact with seminal plasma produced by the seminal vesicles, allowing for better maintenance sperm during cryopreservation. Keywords: equine, collection of sperm, spermatozoa, seminal plasma.
49 49 COLECTA FRACCIONADA Y SUS PRINCIPALES BENEFICIOS EN LA CRIOPRESERVACIÓN DE SEMEN DE SEMENTALES RESUMEN Las colectas convencionales de semen equino, son realizadas con vagina artificial cerrada, donde todas las fracciones seminales quedan mescladas. No obstante, la colecta de semen de forma dividida o fraccionada, separa las diferentes fracciones del eyaculado. Fracciones que contiene una mayor o menor cantidad de plasma seminal, siendo las glándulas sexuales accesorias responsables por su producción. Cada reproductor posee características individuales con relación al mantenimiento de las células espermáticas durante la criopreservación, características que pueden estar relacionadas a la producción del plasma seminal, o a alguno de sus componentes. Es conocido la existencia de un efecto deletéreo desempeñado por los componentes del plasma seminal, producido principalmente por las vesículas seminales a los espermatozoides durante el proceso de criopreservación. Sim embargo, esos factores se desconocen. Varias hipótesis son sugeridas, tales como, reducción en la producción de lípidos y los tipos de proteínas e iones presentes en cada una de las fracciones del eyaculado. Sabiendo esto, la colecta fraccionada puede traer beneficios a los espermatozoides, de forma que las primeras fracciones no tengan contacto con el plasma seminal producido por las vesículas seminales, posibilitando una mejor manutención espermática durante la criopreservación. Palabras claves: equino, colecta seminal, espermatozoides, plasma seminal. INTRODUÇÃO A inseminação artificial vem se tornando um pilar de sustentação e evolução na criação de equinos, tendo em vista que seu uso traz grandes benefícios na difusão do material genético de animais classificados como superiores, dentre eles, campeões em diversas modalidades de competição equestre. Apesar do avanço no uso das biotécnicas reprodutivas, ainda há grandes desafios para melhorar os índices reprodutivos na equinocultura, principalmente quando estão relacionadas à criopreservação das células espermáticas em garanhões. Estudos realizados indicam que o plasma seminal (PS) acarreta danos aos espermatozoides, culminando em prejuízos na qualidade espermática durante a refrigeração e a congelação (1), podendo diminuir os índices de fertilidade. Embora o plasma seminal possua um efeito negativo durante a criopreservação, existem também evidências do seu papel protetor às células espermáticas (2), dentre elas a prevenção da capacitação prematura que pode ser induzida durante o processo de congelação e descongelação (3), afirmando que, a presença de pequenas quantidades de PS parece ser necessária. Segundo Alghamdi et al. (4), a motilidade espermática é maior quando a proporção de PS é 5% antes da refrigeração e congelação, quando comparada a amostras com proporções entre 10-30% no volume do ejaculado. Por outro lado, Jasko et al. (5) demonstram que a proporção ideal de PS no ejaculado seja em torno de 5 a 20%, sem que haja um efeito prejudicial durante a criopreservação. Portanto, a centrifugação para retirada do PS faz-se necessária, principalmente para aqueles garanhões cujos ejaculados possuem baixa tolerância à criopreservação (1).
50 50 Assim, pressupõe-se que exista uma variação individual do efeito do PS entre garanhões (6) e da sua produção, existindo variações na composição do PS nas diferentes frações do ejaculado (7). Contudo, em estudos realizados, demonstrou-se que a fração rica em espermatozoides do ejaculado possui uma tolerância maior a criopreservação quando comparada às demais frações (2,8). Durante a colheita de sêmen de forma convencional, utilizando-se as vaginas artificiais modelo Missouri, Nishikawa, Hannover, Colorado ou Botucatu, todas as frações do ejaculado se misturam e não há possibilidade de separação destas. Diante disto, Varner et al. (9) sugerem que a colheita fracionada poderá reduzir o efeito deletério do PS ao colher apenas a fração rica em espermatozoides do ejaculado, correspondente a 75% do total de espermatozoides. Desta forma, uma alternativa para minimizar as injúrias provocadas pelo PS em garanhões que produzem sêmen com tolerância limitada à criopreservação, seria a colheita de sêmen fracionada, possibilitando, com isso, identificar as diferentes frações e separar a fração espermática com maior percentual de espermatozoides em menor contato com o PS. O presente trabalho tem por objetivo revisar a colheita fracionada de sêmen em garanhões, assim como, seus benefícios para as células espermáticas que serão submetidas à criopreservação. REVISÃO DE LITERATURA Principais Métodos de Colheita do Sêmen Equino Estimulação Manual O processo de colheita de sêmen em garanhões se iniciou por volta de 1965, em que utilizava-se a estimulação manual do pênis com um saco plástico descartável sobre a extremidade do pênis para pegar o ejaculado (10-12). Em dias atuais, esse tipo de colheita pode ser utilizada em casos específicos, como por exemplo, em garanhões com paralisia de pênis ou com déficit de ereção (13). A partir disso, essa técnica foi aperfeiçoada e criou-se um modelo de vagina artificial caseiro, estilo Mississippi, composta por um tudo de borracha e látex, uma extremidade com duas camadas de espuma e um acolchoamento de borracha (10,14). Colheita Convencional com Vagina Artificial Desde então, as colheitas de sêmen em equinos são realizadas por meio de uma vagina artificial, para a realização das colheitas o garanhão monta em manequim ou em uma égua em estro devidamente contida (10,15). Diversos modelos de vagina artificial (VA) foram criados, tais como: Hannover, Missouri, Nishikawa, Colorado, Botucatu, dentre outros modelos, e são empregadas usualmente na colheita convencional de ejaculados de garanhões em programas de reprodução assistida em todo o mundo. Basicamente, esses modelos de vaginas possuem um tubo rígido, uma mucosa interna de látex, que armazena o líquido para manutenção da temperatura interna, em torno de 44 e 50 C, e um recipiente para armazenamento do sêmen (16,17). A partir do trabalho realizado por Lopes et al. (18), a maioria das colheitas de sêmen usualmente colocam uma mucosa sanitária interna de plástico, evitando o contato das células espermáticas com a mucosa de látex, que pode ser prejudicial aos espermatozoides, além de evitar a transmissão de doenças venéreas de um garanhão para outro durante as colheitas.
51 51 Apesar das vaginas artificiais convencionais serem as mais utilizadas na rotina dos haras a nível mundial, por serem de fácil utilização e praticidade, não representam uma situação fisiológica da monta natural, assim, no volume total da ejaculação, todos os fluidos se misturam em um recipiente único (19,20). Um ponto crítico da utilização da colheita de forma convencional está relacionada à contaminação bacteriana, de forma que, neste modelo de colheita, o líquido préseminal, assim como todos os jatos de sêmen, se misturam, entrando em contato direto com o pênis, que poderá levar a contaminação do ejaculado, o que justifica a frequência de isolamento bacteriano sem evidência de infecção no ejaculado total (21,22). Alternativas de Colheita de Sêmen em Equinos Outras formas de colheita de sêmen mencionadas na literatura são: a colheita de sêmen com o animal em estação, indicada para aqueles com problemas do sistema músculo esquelético ou com lesões neurológicas, impossibilitado-os de realizar a monta, principalmente quando ocorre em animais idosos (10,13,15); por indução farmacológica, utilizado para aqueles garanhões com distúrbios ejaculatórios, fraturas ósseas com imobilização de algum membro, disfunção erétil, paralisia de pênis, em que opta-se pela utilização de fármacos alfa-adrenérgicos (13,23), além de detomidina, prostaglandina e ocitocina, que também têm sido estudados (12,23); e a colheita de sêmen da cauda do epidídimo, para garanhões com morte inesperada, causada por cólicas, acidentes traumáticos ou em problemas relacionados à manutenção dos testículos, como na hérnia escrotal, ou outras situações que comprometam a utilização futura do material genético (24-27). COLHEITA FRACIONADA DO SÊMEN EQUINO Inicialmente, a colheita fracionada do sêmen equino, com o uso de vagina artificial aberta, foi descrita por Mann et al. (28), em que foram determinadas as primeiras divisões do ejaculado nas frações pré-espermática, rica em espermatozoides, pobre em espermatozoides e gelatinosa. Esse modelo de vagina artificial permite a separação das diferentes frações do ejaculado de acordo com os jatos de sêmen, podendo ser usado como um método diagnóstico de patologias das glândulas sexuais acessórias e/ou do pênis, além de permitir uma colheita de sêmen com uma menor contaminação bacteriana. Em 1974, Tischner et al. (19),objetivando obter mais informações sobre o padrão copulatório e ejaculatório dos garanhões, realizaram colheitas com o uso de vagina artificial aberta, a qual denominaram de modelo Kraków-72. A partir deste trabalho, pode-se compreender melhor o processo ejaculatório dos equinos. Varner et al. (9) utilizando uma adaptação do modelo proposto por Tischner et al. (19) e utilizaram uma vagina artificial modelo Missouri desprovida do copo coletor que fica acoplado no final da vagina, com isso, o ejaculado foi dividido em duas frações, a primeira composta pelos três primeiro jatos de sêmen e a segunda, o restante do ejaculado, sendo colhidas em recipientes diferentes. Em 1993, um modelo de manequim com simulador de colheita fracionada computadorizado foi desenvolvido na Finlândia, com o objetivo de separar as frações seminais e minimizar a contaminação da fração rica em espermatozoides, denominado de Equidame (29). É composto internamente por uma vagina artificial e acoplada a ela há um funil metálico, logo abaixo, existe uma bandeja coletora de sêmen que possui cinco compartimentos onde são encaixados os recipientes de colheita conectados a um
52 52 computador e, à medida que vão sendo preenchidos com o peso programado correspondente a cada fração do ejaculado, essa bandeja se move horizontalmente, sendo necessário apenas uma pessoa para a realização da colheita (29). Apesar de inovador, seu custo parece ser bastante elevado, um fator limitante à sua acessibilidade. Outro modelo de vagina artificial aberta para colheita fracionada foi criado por Fonseca (17), denominada de vagina experimental articulada, composto por um dispositivo fracionador que separa o líquido pré-espermático no primeiro copo, em seguida, os três primeiros jatos num segundo copo e o restante do ejaculado novamente no primeiro copo, separando, assim, em duas porções. Em 2011, Kareskoski (30) comparou a colheita fracionada através do Equidame à utilização da vagina artificial modelo Missouri com um funil acoplado a uma bainha de probe, em que as frações são separadas por pinças, demonstrando que não houve diferença entre os dois métodos. Apesar de várias formas e modelos de colheitas fracionadas estarem descritos na literatura, ainda é pouco utilizada na rotina, em alguns casos por se tratar de uma técnica laboriosa ou pela falta de um método prático que se adeque tanto em pesquisas quanto aos profissionais que trabalham à campo. Benefícios da Colheita Fracionada do Sêmen Equino Em comparação ao método tradicional, a vagina artificial aberta possui algumas vantagens assim como, desvantagens. De acordo com Jasko et al. (5), o plasma seminal possui um efeito deletério sobre a viabilidade das células espermáticas e, sabendo das características ejaculatórias do equinos, através de trabalhos descritos por a colheita fracionada começou a ser utilizada como uma alternativa para minimizar as injúrias provocadas pelo plasma seminal, sendo também uma opção à centrifugação para retirada do PS, que acarreta danos aos espermatozoides intolerantes a esta técnica. Varner et al. (9) relatam a utilização da colheita fracionada como forma de eliminar o contato do plasma seminal produzido pelas vesículas seminais, com a fração rica em espermatozoides e com isso, melhorar a longevidade espermática, desta forma, foram colhidos apenas os três primeiros jatos de sêmen e observou-se que inicialmente não há diferença de motilidade entre a fração rica em espermatozoides comparada ao ejaculado total, porém, houve diferença estatística na motilidade total e progressiva após algumas horas de incubação. Achados semelhantes foram reportados por Kareskoski et al. (2), sendo a motilidade total da fração rica superior ao ejaculado total pós-descongelação. A partir disso, pode-se concluir que existe um efeito deletério do plasma seminal nas células espermáticas ainda não elucidados e, com o passar do tempo, o contato prejudica ainda mais a viabilidade espermática. Além disso, também existem evidências de que a colheita fracionada diminui a contaminação bacteriana do ejaculado, como demonstrado por Tischner et al. (19), em que os jatos foram separados individualmente e não observou-se crescimento bacteriano em nenhuma das frações, ao contrário do observado nas amostras de ejaculado inteiro, que apresentaram elevado grau de contaminação, além de ressaltar a eficiência na separação exata das frações do ejaculado através da colheita fracionada. Lindeberg et al. (29) relataram uma diferença estatística significativa das unidades formadoras de colônias (UFC) após a refrigeração, por um período de 24h, quando a colheita foi realizada de forma convencional, com a vagina artificial Missouri, em comparação ao modelo Equidame de colheita fracionada entretanto, após um período de 48h, não foram encontradas diferenças significativas entre os dois métodos. Em relação à contagem de UFC entre as frações pré-espermáticas e rica em
53 53 espermatozoides, colhidos por meio do Equidame, não houve diferença e poucas UFC foram isoladas (29). Além disso, quando esses mesmos autores compararam os valores de motilidade total e progressiva entre os métodos de colheita, não houve diferença estatística significativa 24 ou 48h após a refrigeração e após a descongelação. Uma redução das UFC também foi reportada por Fonseca (17), quando os ejaculados foram colhidos fracionados com a vagina artificial articulada, ao contrário do observado no ejaculado total, colhido pelo método convencional, apresentando uma elevação das UFC. Porém, esse trabalho não mostrou diferença significativa entre a cinética espermática entre a fração rica e a fração pobre em espermatozoides logo após as colheitas. Sieme et al. (8), demonstraram que os primeiros três jatos de sêmen colhidos fracionados e centrifugados para a congelação diferenciaram positivamente em termos de integridade de membrana e motilidade progressiva após a descongelação. Diferentes resultados foram obtidos por Akcay et al. (6), que afirmaram haver uma superioridade na integridade de membrana para um pool de espermatozoides das demais frações do ejaculado, separados através do Equidame quando comparado à fração rica em espermatozoides, já em relação à motilidade progressiva, não houve diferença entre o pool e a fração rica. Resultados semelhantes foram sugeridos por Kareskoski et al. (2), estes compararam as diferentes frações do ejaculado fracionado, colhidos com o Equidame, após a remoção do PS através da centrifugação e ressuspensão em meio de refrigeração, com as mesmas frações, sem a retirada do PS e apenas diluídas em meio à base de leite, os resultados mostraram uma redução da motilidade dos espermatozoides em amostras que o PS foi removido, portanto, os autores sugerem existir uma interação positiva da motilidade com a presença de PS. Kareskoski (30) encontrou um percentual elevado de fragmentação do DNA nas frações rica, pobre e a fração correspondente ao ejaculado total quando as amostras foram refrigeradas com a presença do PS. Apesar disso, não foram encontradas diferenças entre os parâmetros de motilidade total e progressiva entre as diferentes frações do ejaculado após a refrigeração. Além dos benefícios da colheita fracionada anteriormente citados, uma nova abordagem de extrema importância desse método faz-se necessário para garanhões com vesiculite. Desta forma, a colheita fracionada foi relatada com sucesso na recuperação de espermatozoides de um garanhão com piospermia (31,32). Como a fração contaminada do ejaculado é a terceira, produzida pela vesícula seminal, acredita-se que as primeiras frações de sêmen são isentas de contaminação ou pouco contaminadas, tornando possível a recuperação do sêmen para posterior utilização para criopreservação. CONSIDERAÇÕES FINAIS Apesar das diferentes abordagens e achados a respeitos dos benefícios da utilização da colheita fracionada de sêmen de garanhões, os resultados ainda são inconsistentes. Acredita-se que existam benefícios, porém, talvez tenha relação com a individualidade de cada garanhão. Quando as células espermáticas são prejudicadas pelo plasma seminal, a colheita fracionada é o método mais indicado para reduzir esse efeito deletério exercido nos espermatozoides. Para garanhões com oligospermia, a colheita fracionada torna-se um método eficiente para concentrar as células espermáticas do ejaculado, reduzindo os possíveis
54 54 danos mecânicos provocados pela centrifugação. Como técnica diagnóstico e recuperação de células espermáticas em garanhões com patologias das glândulas sexuais acessórias, essa técnica torna-se uma alternativa de grande aplicabilidade. Apesar das inúmeras vantagens, mais estudos são necessários para aperfeiçoar a técnica da colheita fracionada. REFERÊNCIAS 1. Kareskoski AM, Katila T. Components of stallion seminal plasma and the effects of seminal plasma on sperm longevity. Anim Reprod Sci. 2008;10: Kareskoski AM, Reilas T, Andersson M, Katila T. Motility and plasma membrane integrity of spermatozoa in fractionated stallion ejaculates after storage. Reprod Domest Anim. 2006;41: Schembri MA, Major DA, Suttie JJ, Maxwell WM, Evans G. Capacitation-like changes in equine spermatozoa throughout the cryopreservation process. Reprod Fertil Dev. 2002;14: Alghamdi AS, Troedsson MH, Xue JL, Crabo BG. Effect of seminal plasma concentration and various extenders on postthaw motility and glass wool-sephadex filtration of cryopreserved stallion semen. Am J Vet Res. 2002;63: Jasko DJ, Hathaway JA, Schaltenbrand VL, Simper WD, Squires EL. Effect of seminal plasma and egg yolk on motion characteristics of cooled stallion spermatozoa. Theriogenology. 1992;37: Akcay E, Reilas T, Andersson M, Katila T. Effect of seminal plasma fractions on sperm survival after cooled storage. J Vet Med A Physiol Pathol Clin Med. 2006;53: Katila T, Reilas T, Guvenc K, Alm K, Andersson M. 2004: The effect of seminal plasma on motility characteristics and viability of spermatozoa after cooled storage. In: Muller, J., Z. Muller, and J. F. Wade (eds), Proceedings of the 3rd Meeting of the EEGG, Have meyer Foundation Monograph Series No. 13pp R & W Publications Limited, Suffolk, UK. 8. Sieme H, Katila T, Klug E. Effect of semen collection practices on sperm characteristics before and after storage and on fertility of stallions. Theriogenology. 2004;61: Varner DD, Blanchard TL, Love CL, Garcia MC, Kenney RM. Effects of semen fractionation and dilution ratio on equine spermatozoal motility parameters. Theriogenology. 1987;28: Crump Jr J, Crump J. Stallion Ejaculation Induced by Manual Stimulation of the Penis. Theriogenology. 1989;31:
55 McDonnell SM, Love CC. Manual stimulation collection of semen from stallions: training time, sexual behavior and semen Theriogenology. 1990;33: McDonnell SM. Ejaculation physiology and dysfunction. Vet Clin N AM-Equine. 1992;81: McDonnell SM. Techniques for Extending the Breeding Career of Aging and Disabled Stallions. Clinical Techniques in Equine Practice. 2005;4: Berliner V. Horses and Jackstock, In: Perry, E.J. (ed.): The Artificial Insemination of Farm Animals. Rutgers University Press, New Brunswick, NJ, 1960, p Schumacher J, Riddell MG. Collection of stallion semen without a mount. Theriogenology. 1986; McKinnon AO, Voss JL. (1992) Equine Reproduction, Lea and Febiger, Philadelphia, London. 17. Fonseca CW. Efeito de uma nova técnica de coleta fracionada sobre a composição do plasma seminal e qualidade do sêmen equino pós-descongelamento [dissertação]. Campos dos Goytacazes: Universidade estadual do norte fluminense Darcy Ribeiro: Lopes MD, Papa FO, Martino AP, Bicudo SD, Alvarenga MA. Efeito do tipo de mucosa de vagina artificial sobre a qualidade espermática de garanhões. Rev Bras Reprod Anim. 1997;21: Tischner M, Kosiniak K, Bielanski W. Analysis of the pattern of ejaculation in stallions. J Reprod Fertil. 1974;41: Rodríguez-Martínez H, Kvist U, Ernerudh J, Sanz L, Calvete JJ. Seminal Plasma Proteins: What Role Do They Play?. Am J Reprod Immunol. v.66 (Suppl. 1), p.11 22, Tischner M, Kosiniak K. Techniques for collection and storage of stallion semen with minimal secondary contamination. Acta Vet Scand, (Suppl), 1992;88: Silva KMG, Papa FO, Gabaldi SH, Crocci AJ. Efeito dos antibióticos gentamicina e cefalotina e do aminoácido taurina em meio de gema de ovo (Baken), sobre a longevidade e fertilidade do sêmen resfriado de equino. R Bras Ci Vet. 2003;10: McDonnell SM. Oral imipramine and intravenous xylazine for pharmacologicallyinduced ex copula ejaculation in stallions. Anim Reprod Sci. 2001;68: Papa FO, Melo CM, Fioratti EG, Dell Aqua Jr. JA, Zahn FS, Alvarenga MA. Freezing of stallion epididymal sperm. Anim Reprod Sci. 2008;107: Heise A, Thompson PN, Gerber D. Influence of seminal plasma on fresh and postthaw parameters of stallion epididymal spermatozoa. Anim Reprod Sci. 2011;123:
56 Monteiro GA, Papa FO, Zahn FS, Dell Aqua Jr. JA, Melo CM, Maziero RRD, Avanzi BR, Alvarenga MA, Guasti PN. Cryopreservation and fertility of ejaculated and epididymal stallion Sperm. Anim Reprod Sci. 2011;127: Monteiro GA, Guasti PN, Rocha AS, Martin I, Sancler-Silva YFR, Freitas Dell Aqua CP, Dell Aqua Jr. JA, Papa FO. Effect of Storage Time and Temperature of Equine Epididymis on the Viability, Motion Parameters, and Freezability of Epididymal Sperm. J Equine Vet Sci. 2013;33: Mann T, Short RV, Walton A. The 'tail-end sample' of stallion semen. Journal of agricultural Science Cambridge. 1957;49: Lindeberg H, Karjalainen H, Koskinen E, Katila T. Quality of stallion semen obtained by a new semen collection phantom (equidame ) versus a missouri artificial vagina. Theriogenology. 1999;51: Kareskoski AM. Components of fractionated stallion seminal plasma and the effects of seminal plasma on sperm longevity [Dissertação]. Faculty of Veterinary Medicine University of Helsinki Finland. 2011, 86p 31. Oliveira SN, Araujo EAB, Chaves-Silva LFM, Andrade Jr LRP, Dalanezi FM, Pinto BM, Carneiro JAM, Dell Aqua Jr. JÁ, Alvarenga MA, Papa FO. Eficiência de uma nova técnica de coleta de sêmen para diagnóstico e controle de piospermia em garanhões: Relato de caso. In: XVI Conferência Anual da ABRAVEQ. Águas de Lindóia. XVI. 2015; Oliveira SN, Andrade Jr. LRP, Chaves-Silva LFM, Araujo EAB, Dalanezi FM, Papa PM, Freitas-Dell Aqua CP, Hayashi MR, Hartwig FP, Carmo MT, Dell Aqua Jr. JA, Alvarenga MA, Papa FO. Novo método de colheita fracionada de sêmen para melhoria da fertilidade em garanhão com vesiculite seminal. In: XVII Conferência Anual da ABRAVEQ. Campos do Jordão. XVII. 2016;264.
57 57 ARTIGO II Artigo a ser submetido ao Journal of Equine Veterinary Science, ISSN , ranqueada como B2 pelo QUALIS CAPES de Influência de diferentes técnicas de colheita fracionada do sêmen equino na recuperação espermática: descrição e modificação de um método Influence of different fractionated collection techniques of equine sperm recovery: description and modification of a technique RESUMO O objetivo deste trabalho foi comparar dois métodos de colheita fracionada, descrever um novo método de colheita, avaliando sua eficiência em separar a melhor fração espermática, com uma menor perda de células espermáticas. Para o experimento 1 foi colhido separadamente cada jato de sêmen do ejaculado, sendo a colheita utilizando-se da vagina artificial aberta modificada com mucosa sanitária aberta e os jatos colhidos separadamente. No experimento 2 utilizou-se duas formas de colheita fracionada com a mesma vagina artificial do experimento 1, as frações foram separadas em Fração A, Fração B e Fração C. No modelo 1 a mucosa plástica permaneceu totalmente aberta e as frações separadas em becker, o modelo 2 mucosa fechada denominada sperm clean sendo as frações separadas por pinças, realizou-se mensuração do volume, concentração, cinética espermática e integridade de membrana em cada fração. No experimento 1 foram observados diferença nas mensurações e na cinética espermática, no experimento 2, houve diferença nos achados das mensurações entre as frações, não sendo observada diferença quanto a cinética espermática. Os resultados demonstram, que o modelo M-2 mostrou-se o método de colheita fracionada mais eficiente para separar a fração do ejaculado de garanhões, com o mínimo de perda de espermatozoides. Palavras-chave: Garanhão, jatos de sêmen, frações do ejaculado, sperm clean.
58 58 ABSTRACT The objective of this study was to compare two methods of fractional collection, describe a new technique for harvesting, evaluating their efficiency in separating the best sperm fraction, with a smaller loss of sperm cells. For the experiment 1 was collected separately each semen jet ejaculate, and the harvest using the open artificial vagina modified open health mucosa and jets harvested separately. In experiment 2 was used for fractional harvest two ways with the same artificial vagina of experiment 1, the fractions were separated on Fraction A, Fraction B and Fraction C. Model 1 plastic mucosa remained fully open and the separated fractions in becker, 2 called closed mucosa model sperm clear and the fractions separated by tweezers, volume measurement was performed, concentration, sperm kinetics and membrane integrity in each fraction. However, in Experiment 1 was no difference in measurements and sperm kinetics, in experiment 2, there were differences in the assessments of the measurements between fractions, with no observed difference in sperm kinetics. The results demonstrate that M-2 model was the most efficient fractional sampling method to separate the fraction of the ejaculate stallions with minimal loss of spermatozoa. Key words: Stallion, jet of sperm, fractions ejaculate, sperm clean. INTRODUÇÃO Durante a ejaculação, o plasma seminal (PS) é eliminado juntamente com as células espermáticas, este representa a porção líquida do sêmen e é produzido pela rede testis, epidídimo e glândulas sexuais acessórias. Neste processo, o garanhão emite de cinco a nove jatos de sêmen, sua composição está relacionada com particularidades de cada glândula sexual acessória (TISCHINER et al., 1974; MAGISTRINI et al., 2000; RODRÍGUEZ-MARTÍNEZ et al., 2011).
59 59 O ejaculado equino é dividido em três frações: a primeira é a pré-espermática, composta pelas secreções do epidídimo e fluido prostático, contém pouco ou nenhum espermatozoide; a segunda é a fração rica em espermatozoide e é composta pelas secreções do epidídimo, ampolas, bulbouretrais, próstata e uma pequena quantidade das vesículas seminais; a terceira tem baixa concentração espermática, composta principalmente por secreção das vesículas seminais (VARNER et al., 1987; AMANN & GRAHAM, 1993; TISCHNER & KOSINIAK, 1992; FONSECA, 2006). Apesar de existir uma variação individual do efeito do PS entre garanhões (AKCAY et al., 2006; ZAHN et al., 2002), estudos demonstram que a proporção ideal de PS no ejaculado seja em torno de 5 a 20%, sem que haja um efeito prejudicial durante a criopreservação (JASKO et al., 1992). Portanto, a centrifugação para retirada do PS faz-se necessária para aqueles garanhões cujos ejaculados possuem baixa tolerância à refrigeração e congelação (KARESKOSKI & KATILA, 2008). Podendo esse processo, causar um percentual de perda e danificar as células espermáticas (LINDEBERG et al., 1999; DELL AQUA Jr. et al., 2001). Além do PS de acarreta danos aos espermatozoides e prejudicar a qualidade espermática principalmente durante a criopreservação (KARESKOSKI & KATILA, 2008), sua presença, em alguns garanhões pode diminuir a fertilidade (MONTEIRO et al., 2011). Mais justificativas sobre a real necessidade do PS foram descritas em estudos com espermatozoides obtidos da cauda do epidídimo, adquirem motilidade e demonstraram fertilidade superior, quando comparado ao ejaculado total do mesmo animal (PAPA et al., 2008; MONTEIRO et al., 2011). KATILA et al. (2004) ressaltaram a existência de variações na composição entre diferentes frações do plasma em equinos. A fração rica do ejaculado possui uma melhor tolerância na criopreservação, quando comparada às demais frações (VARNER et al.,
60 ; LINDEBERG et al., 1999; SIEME et al., 2004; KARESKOSKI et al., 2006) sendo assim, a produção do PS advindo das vesículas seminais possuem um efeito maléfico as células espermáticas. Na tentativa de reduzir os danos causados pelo PS, foram descritos na literatura alguns modelos de colheita fracionada, como TISCHNER et al. (1974) utilizando uma vagina artificial Kraków-72, VARNER et al. (1987) utilizaram o modelo Missouri, LINDEBERG et al. (1999) através do Equidame, FONSECA (2006) por meio de uma vagina artificial articulada e KARESKOSKI (2011) comparando o Equidame com o modelo Missouri. Apesar destes modelos a colheita fracionada ainda é pouco utilizada, em alguns casos por se tratar de um método laborioso ou por falta de um método adequado para os profissionais que trabalham a campo. Está poderia ser uma alternativa para minimizar as injúrias provocadas pelo PS em garanhões considerados bad coolers e bad freezers. Desta forma, o objetivo do presente trabalho foi padronizar as frações do ejaculado, comparar dois métodos de colheita fracionada e descrever um novo método de colheita, avaliando sua eficiência em separar a melhor fração espermática, com uma menor perda de células espermáticas. MATERIAL E MÉTODOS Experimento 1 Foram utilizados oito garanhões com idade entre cinco e 20 anos, pertencentes ao Departamento de Reprodução Animal e Radiologia Veterinária da Universidade Estadual Paulista Júlio de Mesquita Filho, Unesp - Botucatu SP. No primeiro momento, os animais foram submetidos a colheitas diárias durante uma semana antes do inicio do experimento com intervalo de um dia entre as colheitas,
61 61 para isto, foi utilizado o método de colheita convencional, com a vagina artificial modelo Botucatu (Botupharma, Botucatu, São Paulo, Brasil). Com o intuito de melhor compreender a produção espermática, cada jato de sêmen foi colhido separadamente, mensurado quanto ao volume de cada jato, avaliado a concentração e a cinética espermática com o sêmen fresco. Antes de cada colheita, o pênis de cada animal foi higienizado com água corrente e a estimulação dos garanhões para a colheita foi realizada com uma égua em estro. A colheita foi realizada baseandose em um método realizado por TISCHNER et al. (1974), utilizando-se da vagina artificial aberta modificada, a qual possuía as seguintes dimensões: 31cm de comprimento e 13cm de diâmetro, revestida com mucosa de látex para a contenção do líquido no interior da vagina, presa nas extremidades com anel de borracha e internamente revestida com mucosa sanitária plástica descartável aberta, desenvolvida para este sistema de colheita (Figura 1). Para a colheita do sêmen quatro pessoas foram necessárias, sendo um responsável pela vagina e por segurar a base do pênis, para detectar a passagem dos jatos no canal uretral. Os jatos foram colhidos separadamente por diferentes pessoas, em becker plástico de 500mL da seguinte forma: pré-seminal quando presente, 1 e o 2 jato, 3 e o 4 jato, 5 e 6 e demais jatos em um único recipiente (Figura 1). Experimento 2 Foram propostas duas formas de colheita fracionada. Para isso, as colheitas foram realizadas no Departamento de Reprodução Animal e Radiologia Veterinária e na Central de Reprodução Equina LUB Breeding. Para realização destes, utilizou-se a mesma vagina artificial do experimento 1. Para cada um dos métodos de colheita fracionada, foi realizada uma colheita de sêmen de sete diferentes garanhões, com idade entre cinco e vinte anos. A temperatura interna da vagina artificial utilizada foi igual
62 62 para todos os animais (45 C) e a pressão interna da vagina foi ajustada no momento da colheita de acordo com o tamanho do pênis do garanhão, de forma a permitir a visualização da glande. Tendo como base o primeiro experimento, os ejaculados foram separados em fração pré-espermática quando presente, Fração A (FA) que correspondia ao 1º e 2 jatos do sêmen, Fração B (FB) correspondente ao 3º e 4 jatos e Fração C (FC), correspondente ao 5 e os demais jatos do ejaculado. Assim, para os dois métodos de colheita fracionada. Modelo 1 (M-1) - mucosa plástica totalmente aberta e as frações separadas em becker. O primeiro método foi realizado com vagina artificial aberta (Figura 1), revestida com uma mucosa descartável de plástico totalmente aberta, presa nas duas extremidades do tubo rígido, no qual se permitia a visualização da glande do pênis do garanhão, assim como a saída dos jatos [Figura 2(M-1)]. Em algumas circunstâncias, a glande do pênis do garanhão passou além do comprimento da vagina. Modelo 2 (M-2) - mucosa fechada e as frações separadas por pinças. O segundo método foi adaptado de uma metodologia utilizada por KARESKOSKI (2011), no qual as frações são separadas por pinças. Nesse modelo, a mucosa plástica descartável interna utilizada normalmente em vaginas convencionais foi modificada e adaptada ao modelo da vagina artificial [Figura 2 (M-2)]. A mucosa foi totalmente fechada em sua extremidade posterior, a qual denominou-se Sperm Clean (Figura 3A). Nesse método, as frações foram separadas utilizando-se duas pinças hemostáticas modelo Crile (Figura 2 (M-2 B)) e quando o líquido pré-seminal estava presente, era separado com a mão. Para cada fração, foram realizadas as mensurações do volume por meio de tubos de centrifuga, a concentração espermática realizada em da câmara de Neubauer em
63 63 microscópio óptico de luz, com diluições variando de 1:20 até 1:200 (sêmen : água destilada), de acordo com a concentração de cada amostra. Para cada uma das frações foi realizada a somatória da concentração de espermatozoides por ml e volume, o percentual do volume e da concentração de cada fração, além de determinar o volume total e a quantidade total de espermatozoides no ejaculado. A cinética espermática tanto do experimento 1 quanto do experimento 2, foi avaliada em sistema computadorizado (HAMILTON THORNE RESEARCH IVOS 12). Para cada uma das amostras, avaliou-se: motilidade total (MT%), motilidade progressiva (MP%) e número de espermatozoides rápidos (RAP%). A análise da integridade da membrana mitocondrial e acrossomal (IM%) foi realizada pela técnica descrita por HARRISON & VICKERS (1990), utilizando-se iodeto de propídio e diacetato 6-carboxifluoresceína, considerando-se espermatozoides corados pela cor verde com membrana integra, utilizando para essas análises o sêmen a fresco. Para todas as análises foram calculadas as medias e erro padrão e então realizado o teste de normalidade Kolmogorov-Smirnov. Quando os dados apresentavam distribuição normal foi utilizado um modelo misto de análise de variância seguido pelo teste de Tukey para determinar diferenças entre os grupos, quando não apresentavam distribuição normal (dados não paramétricos) utilizou-se o Kruskal-Wallis seguido de teste de Dunns. Para todos foi considerado valor de p<0,05. As análises foram realizadas pelo Programa GraphPad Prism versão 6.0 para Windows (GraphPad software, San Diego, Caifórnia, USA). RESULTADOS Experimento 1 Foi observado diferença estatística (p<0,05) em termos de volume, percentual do volume, concentração de espermatozoides por mililitro e o percentual de
64 64 espermatozoides no primeiro jato de sêmen em relação aos demais jatos do ejaculado (Tabela 1). Os dois primeiros jatos, neste grupo de garanhões estudados, apresentou uma média de 73,0% do total das células espermáticas no ejaculado. O terceiro e o quarto jato, representou uma média de 19,3%, e o quinto e os demais, uma média de 7,6%. Os parâmetros de cinética espermática MT, MP e RAP, também demonstraram diferença quando comparado os jatos de sêmen do ejaculado figura 1. Experimento 2 Quando comparou-se a cinética espermática nos parâmetros de MT, MP e RAP, bem como a integridade de membrana entre as frações do ejaculado e entre os modelos de colheita estudados, não foi observada diferença estatística (Tabela 3). DISCUSSÃO Nos resultados encontrados no experimento 1 do presente estudo, o número total de espermatozoides colhidos, 85,2% estavam nos três primeiros jatos de sêmen, estando de acordo com achados por TISCHNER et al. (1974) e VARNER et al. (1987), os quais encontraram uma variação de 80 e 77%, respectivamente. Em relação ao volume no ejaculado, foi encontrado 66% do volume total nos três primeiros jatos, resultados semelhantes aos mostrados por TISCHNER et al. (1974), que encontraram 50,7%, porém, para VARNER et al. (1987), o volume das primeiras três frações representam 43% volume total do ejaculado, essa diferença pode estar relacionada a uma variação individual e/ou às diferentes raças dos garanhões utilizados ou, até mesmo, entre os grupos de animais estudados. Os parâmetros de cinética obtidos no experimento 1 os últimos jatos demonstraram decréscimo na cinética espermática, condizente com os parâmetros encontrados por TISCHNER et al. (1974). Tal fato pode estar relacionado com o menor ou maior contato das células espermáticas com o plasma seminal, já que os últimos jatos
65 65 se misturam com uma maior quantidade de líquido produzido pelas vesículas seminais, o que pode contribuir para um efeito negativo às células das últimas frações do ejaculado. Assim, observou-se neste estudo, que os primeiros jatos de sêmen apresentaram maiores concentrações e cinética espermática do ejaculado, VARNER et al. (1987) encontraram maiores valores de cinética espermática nas primeiras frações do ejaculado, também após a refrigeração. No experimento 2, na comparação entre os dois modelos de colheita, o M-1 teve uma menor recuperação em termos de volume e concentração foi observado em M-1, por se tratar de um método totalmente aberto, os primeiros jatos de sêmen são expulsos em alta pressão e alta velocidade, desta forma, houve perdas de sêmen durante as colheitas em becker ou durante a troca do becker entre as frações. As perdas são irreparáveis e podem ocorrer em qualquer uma das frações do ejaculado, e como o objetivo da realização da colheita fracionada é utilizar o sêmen para inseminação de uma ou algumas éguas previamente induzidas, perdas de espermatozoides nesse momento, culminam em comprometimento do uso do ejaculado em biotécnicas da reprodução, perda de tempo de acompanhamento do ciclo estral da fêmea, seja doadora de embrião ou receptora, frustração do proprietário, geração de custos extras para acompanhamento dos próximos ciclos e custo com o médico veterinário para a tentativa de colher novamente o garanhão. Se este ejaculado fosse destinado à refrigeração ou congelação, as perdas se traduzem em um menor número de palhetas ou dose inseminante por ejaculado. Quando se compara ao modelo M-2, o M-1 perdeu aproximadamente 40% a mais das células. No M-2, por ser tratar de um modelo fechado, as perdas são mínimas e permitem um melhor aproveitamento do ejaculado. Uma pertinente observação relacionada à colheita fracionada com vagina artificial aberta é a necessidade de cuidados redobrados, pois, durante as colheitas, a
66 66 glande do pênis pode se projetar para fora da vagina e, em alguns casos, pode lesionar a glande e trazer prejuízos ao garanhão, como sua inutilização temporária. Foi observado um número médio de 7,5 jatos nos dois modelos, assim, se observa que há uma repetitividade no número de jatos entre os garanhões, estando esses valores de acordo com outros autores (TISCHNER et al., 1974; VARNER et al., 1987; LINDEBERG et al., 1999; FONSECA, 2006), os quais observaram de seis a nove jatos no ejaculado equino. KARESKOSKI (2011) comparou as colheitas realizadas entre o modelo Equidame e a colheita fracionada adaptando a vagina artificial Missouri, de forma a ficar aberta, acoplada a um funil e um revestimento plástico utilizado para proteção da probe linear (bainha de probe) e não encontraram diferença entre os dois métodos de colheitas. Entretanto, o método de colheita fracionada M-2 proposto, difere do método de colheita fracionada com vagina aberta proposto por KARESKOSKI (2011). O M-2 é totalmente descartável e em cada garanhão é utilizada uma única mucosa sem o funil, evitando contaminação entre as colheitas. Além disso, durante as colheitas, a utilização da mucosa plástica contínua, permite a visualização da saída dos jatos, possibilitando uma colheita fracionada mais eficiente, segura e com repetitividade. Assim, esse método é eficiente e poderá ser utilizado tanto para pesquisas futuras com colheitas fracionadas, quanto em colheitas fracionadas a campo para utilizar os ejaculados em biotécnicas reprodutivas e melhor aproveitamento do garanhão. Não foi observada diferença estatística nos parâmetros de cinética espermática entre os modelos M-2 e M-1, no entanto o modelo M-2 apresentou uma cinética espermática numericamente superior ao modelo M-1. Todavia, na utilização da colheita fracionada, deve ser levada em consideração a sua real necessidade, pois nem todos os garanhões possuem uma perda de viabilidade
67 67 espermática após a criopreservação quando colhidos de forma convencional. Como há necessidade de mais de uma pessoa para realizar a colheita, seu uso é indicado para aqueles garanhões que possuem características individuais como uma menor resistência à criopreservação, sendo mais afetada pelo efeito deletério do PS. Além de ser fundamental para garanhões que possuem contaminação de glândulas sexuais acessórias, cujo ejaculado possuem alterações como hemospermia e com vesiculite seminal (Oliveira et al., 2015; Oliveira et al., 2016), assim como, pode ser utilizada na colheita de garanhões que ejaculam um grande volume de sêmen e uma baixa concentração espermática. O modelo M-2 foi o método de colheita em que observou-se o maior número de pontos positivos, não houve perda de volume, nem de células espermáticas durante as colheitas, já que a mucosa sanitária descartável encontrava-se fechada. Além disso, é um método em que as frações foram separadas de forma mais fidedigna, permitindo um maior repetitividade. CONCLUSÃO Após as colheitas, pôde-se padronizar as frações do ejaculado e, ao se comparar os métodos de colheita, chegou-se à conclusão que o modelo M-2 mostrou-se o método de colheita fracionada mais eficiente do que a colheita aberta do modelo M-1, desta forma, o M-2 separou as frações do ejaculado de garanhões, com o mínimo de perda das células espermáticas. AGRADECIMENTOS À FAPESP, através do processo nº 2014/ A UNESP e a LUB Breeding, por ceder os garanhões para realização do experimento.
68 68 COMITÊ DE ÉTICA E BIOSSEGURANÇA Este trabalho foi aprovado pelo Comitê de Ética no Uso de Animais da Faculdade de Medicina Veterinária e Zootecnia, Unesp, Botucatu-SP (n 14/2014- CEUA). REFERÊNCIAS AKCAY, E. et al. Effect of seminal plasma fractions on sperm survival after cooled storage. Journal of Veterinary Medicine, v.53 p , AMANN, R.P; GRAHAM, J.K. Spermatozoal function. In: McKinnon AO, Voss JL. Equine reproduction. Philadelphia: Saunders. 1993: DELL AQUA Jr. J.A. et al. Effect of packing systems and thawing temperature on spermatic parameters and fertility rate of frozen equine semen. Revista Brasileira de Reprodução Animal, v.25, p , FONSECA, C.W. Efeito de uma nova técnica de coleta fracionada sobre a composição do plasma seminal e qualidade do sêmen equino pós-descongelamento [dissertação]. Campos dos Goytacazes: Universidade estadual do norte fluminense Darcy Ribeiro: HARRISON, R.A.P; VICKERS, S.E. Use of fluorescent probes to assess membrane integrity in mammalian spermatozoa. Journal of Reproduction and Fertility, v.88, p , 1990.
69 69 JASKO, D.J. et al. Effect of seminal plasma and egg yolk on motion characteristics of cooled stallion spermatozoa. Theriogenology, v.37, p , KARESKOSKI, A.M; KATILA, T. Components of stallion seminal plasma and the effects of seminal plasma on sperm longevity. Animal Reproduction Science, v.10, p , KARESKOSKI, A.M. et al. Motility and plasma membrane integrity of spermatozoa in fractionated stallion ejaculates after storage. Reproduction in Domestic Animal, v.41, p.33-38, KARESKOSKI, A.M. Components of fractionated stallion seminal plasma and the effects of seminal plasma on sperm longevity [Dissertação]. Faculty of Veterinary Medicine University of Helsinki Finland. 2011, 86p. KATILA, T. et al. 2004: The effect of seminal plasma on motility characteristics and viability of spermatozoa after cooled storage. In: Muller JZ, Muller and JF. Wade (eds), Proceedings of the 3rd Meeting of the EEGG, Have meyer Foundation Monograph Series No. 13pp R & W Publications Limited, Suffolk, UK. LINDEBERG, H. et al. Quality of stallion semen obtained by a new semen collection phantom (equidame ) versus a missouri artificial vagina. Theriogenology, v.51, p , 1999.
70 70 MAGISTRINI, M. et al. Biophysical and H magnetic resonance spectroscopy characteristics of fractionated stallion ejaculates. Journal of Reproduction and Fertility, Suppl. v.56, p , MONTEIRO, G.A. et al. Fertilidade de espermatozoides recuperados da cauda do epidídimo de garanhões subférteis. Veterinária e Zootecnia, v.18, p , PAPA, F.O. et al. Freezing of stallion epididymal sperm. Animal Reproduction Science, v.107, p , OLIVEIRA, S.N. et al. Eficiência de uma nova técnica de coleta de sêmen para diagnóstico e controle de piospermia em garanhões: Relato de caso. In: XVI Conferência Anual da ABRAVEQ. Águas de Lindóia. XVI. p OLIVEIRA, S.N. et al. Novo método de colheita fracionada de sêmen para melhoria da fertilidade em garanhão com vesiculite seminal. In: XVII Conferência Anual da ABRAVEQ. Campos do Jordão. XVII. 2016;264. RODRÍGUEZ-MARTÍNEZ, H. et al. Seminal Plasma Proteins: What Role Do They Play?. American Journal of Reproduction Immunology, (Suppl.1), v.66, p.11-22, SIEME, H. et al. Effect of semen collection practices on sperm characteristics before and after storage and on fertility of stallions. Theriogenology, v.61, p , 2004.
71 71 TISCHNER, M. et al. Analysis of the pattern of ejaculation in stallions. Journal of Reproduction and Fertility, v.41, p , TISCHNER, M; KOSINIAK, K. Techniques for collection and storage of stallion semen with minimal secondary contamination. Acta Veterinaria Scandinavica, (Suppl) v.88, p.83-90, VARNER, D.D. et al. Effects of semen fractionation and dilution ratio on equine spermatozoal motility parameters. Theriogenology, v.28, p , ZAHN, F.S. et al. Cholesterol incorporation on equine sperm membrane: effects on post-thaw sperm parameters and fertility. Theriogenology, v.58, p , 2002.
72 Figura 1. A Vagina artificial com dimensões modificadas para colheita fracionada de sêmen equino, baseado no modelo de TISCHNER et al. (1974). (1) vagina artificial aberta modificada, (2) mucosa de látex (3) mucosa sanitária plástica descartável. B Vagina artificial montada para colheita dos jatos do ejaculado e os becker onde os jatos foram colhidos. 72
73 Figura 2. Modelo 1 (M-1) vagina artificial e mucosa plástica totalmente aberta, sendo as frações do ejaculado separadas em fração A, fração B e fração C, em três becker plásticos. Modelo 2 (M-2), A mucosa fechada e os jatos fracionados com pinças. (1) vagina artificial aberta de dimensões modificadas, (2) mucosa de látex (3) mucosa sanitária plástica fechada descartável Sperm Clean e (4) pinça hemostática de Crile. B Vagina artificial para colheita fracionada montada. 73
74 74 Tabela 1. Valores de média e erros padrão entre os diferentes jatos de sêmen do ejaculado em garanhões, colhidos com vagina aberta através da metodologia utilizada por Tischner et al. (1974). JATOS DO EJACULADO VOL (ml) % VOL [ ] x 10 6 Sptz / ml [ ] x10 6 Total Sptz Jato PRÉ 4,0±1,3 bc 9,2±2,9 bc - - JATO 1 18,8±2,4 a 47,6±6,1 a 426,3±61,0ª 7590,0±924,2 a JATO 2 6,2±0,5 ab 15,8±1,3 ab 209,8±35,2 ab 1346,0±263,0 ab JATO 3 1,1±0,2 c 2,7±0,4 c 106,3±23,3 abc 116,9±23,8 bc JATO 4 2,8±0,5 bc 6,9±1,0 bc 62,0±24,3 bc 127,2±32,5 bc JATO 5 4,4±1,0 abc 11,8±3,2 abc 47,0±27,2 bc 105,1±52,3 bc JATO > 6 2,5±1,3 bc 5,7±2,9 bc 19,2±9,8 c 138,0±88,6 c Volume (VOL); Percentual do volume em cada jato (% VOL); Concentração de espermatozoides por ml ([ ] x 10 6 Sptz/mL); concentração total de espermatozoides por jato([ ] x10 6 Total Sptz Jato); Total de espermatozoides por jato de sêmen (% Sptz/Jato). *Valores com sobrescritos diferentes (a, b) na mesma coluna diferem significativamente (p < 0,05)
75 75 Figura 3. Valores de média e erros padrão entre os diferentes jatos de sêmen do ejaculado em garanhões, colhidos com vagina aberta através da metodologia utilizada por Tischner et al. (1974). Motilidade total (MT%); Motilidade progressiva (MP%); Número de espermatozoides rápidos (RAP%). *Valores com sobrescritos diferentes (a, b) na mesma coluna diferem significativamente (p < 0,05)
76 ,9±5,0 a ,0±3,0 b ,2±0,3 b 7,1±0,4 b 5,4±0,7 b 2,2±1,3 b 0,08 PRE JATO 1 JATO 2 JATO 3 JATO 4 JATO 5 JATO >6 Figura 4. Valores de média e erros padrão entre o total de espermatozoides por jato de sêmen (% Sptz/Jato) do ejaculado de garanhões, colhidos com vagina aberta através da metodologia utilizada por Tischner et al. (1974). *Valores com sobrescritos diferentes (a, b) na mesma coluna diferem significativamente (p < 0,05)
77 77 Tabela 2. Valores de média e erro padrão entre os dois modelos (M-1- modelo 1, M-2 - modelo 2) de colheita de sêmen fracionada em garanhões nas diferentes frações do ejaculado e número de jatos dos ejaculados colhidos em cada um dos modelos propostos. MODELO COLHEITA FRAÇÕES VOL [ ]x 10 6 Sptz/mL VOLx[ ] % VOL % [ ] VOL TOTAL [ ]Sptz/ TOTAL JATOS M-1 FB 6,0±0,6 b 175,4±50,3 ab 1016,0±323,6 b 19,7±2,2 b 14,0±3,5 b 34,7±3,9 a 6911,0±927,9 a 7,5±0,5 FA 16,7±1,9 a 298,7±40,7 a 4894,0±762,5 a 43,9±5,9 ab 71,5±7,4 a FC 12,2±2,6 ab 88,7±30,2 b 1006,0±315,5 b 36,3±5,9 ab 14,3±5,1 b M-2 FB 9,8±2,6 ab 333,7±70,1 a 2634,0±620,7 ab 18,7±4,3 b 24,7±5,5 ab 53,0±7,3 b 11384,0±1577,0 b 7,5±0,4 FA 14,1±2,3 ab 365,1±75,2 a 5513,0±1602,0 a 29,0±5,3 ab 43,9±8,7 ab FC 29,1±7,1 a 121,9±23,0 ab 3238,0±889,5 ab 52,2±7,0 a 31,2±8,0 ab (FA): 1 e 2 frações do ejaculado; (FB): 3 e 4 frações do ejaculado; (FC): quinta e demais frações; (VOL): volume; ([ ] x 10 6 Sptz/mL): concentração; (VOL x [ ] x 10 6 Sptz/mL); concentração de células espermáticas da fração; (%VOL): total de volume em cada fração; (% [ ]): total de concentração de cada uma das frações; (VOL TOTAL): volume total do ejaculado; ([ ] Sptz TOTAL) concentração total de espermatozoides do ejaculado. *Valores com sobrescritos diferentes (a, b) na mesma coluna diferem significativamente (p < 0,05)
78 78 M-1 Figura 5. Média e erro padrão cinética da colheita de sêmen fracionada, modelos de colheita proposto modelo 1 (M-1) entre as frações do ejaculado equino; (FA): 1 e 2 fração do ejaculado; (FB): 3 e 4 fração do ejaculado; (FC): quinta e demais frações; (MT%): motilidade total; (MP%): motilidade progressiva; (RAP%): número de espermatozoides rápidos; (IM%): integridade de membrana.
79 79 M-2 Figura 6. Média e erro padrão cinética da colheita de sêmen fracionada, modelos de colheita proposto modelo 2 (M-2), entre as frações do ejaculado equino; (FA): 1 e 2 fração do ejaculado; (FB): 3 e 4 fração do ejaculado; (FC): quinta e demais frações; (MT%): motilidade total; (MP%): motilidade progressiva; (RAP%): número de espermatozoides rápidos; (IM%): integridade de membrana.
80 80 ARTIGO III Artigo redigido segundo as normas da Theriogenology, ISSN X, fator de impacto 1.798, ranqueada como A2 pelo QUALIS CAPES de Efeito do plasma seminal nas diferentes frações do ejaculado equino sobre os parâmetros espermáticos avaliados in vitro após o processo de criopreservação RESUMO O objetivo deste trabalho foi avaliar as diferentes frações do ejaculado quanto a cinética espermática e integridade de membrana plasmática, atividade mitocondrial dos espermatozoides por meio da citometria de fluxo, antes e pós-refrigeração por 24h a 5 C e após a descongelação. Para tanto, foram colhidos ejaculados fracionados de 16 garanhões sendo dois ejaculados de cada animal (n=32), utilizando uma vagina artificial de dimensões modificadas e uma mucosa plástica a qual denominou-se de Sperm Clean, e as frações separadas seguinte forma: Fração A (FA) correspondia aos 1º e 2 jatos do sêmen, Fração B (FB) correspondente ao 3º e 4 jatos e Fração C (FC) correspondente ao 5 e demais jatos do ejaculado. Após as colheitas foi retirada uma alíquota correspondente a 33% do volume de cada uma das frações para formar o grupo controle/fração ejaculado (FE). Em seguida, foi retirada uma amostra de cada uma das frações (FA, FB, FC e FE), para ser submetida a refrigeração e também a congelação. As amostras foram submetidas a avaliação da cinética espermática computadorizada (Hamilton-Thorne TM ) para motilidade total (MT), motilidade progressiva (MP) e percentual de espermatozoides rápidos (RAP). Foram efetuadas análises de variância (ANOVA) seguidas pelo teste de Tukey, considerando p<0,05. Após 24h de refrigeração foi observada diferença estatística entre a FA, FB e FE, quando comparado com a FC em termos de MT, em relação a MP houve diferença entre a FA e a FC, já no RAP houve diferença apenas da FA e FC. Entretanto, a FA foi numericamente superior às demais frações em todos os parâmetros avaliados. Não foram encontradas diferenças entre as frações pós descongelação na cinética espermática, no entanto, a FA foi numericamente superior em MT, MP e RAP. Desta forma, a fração A do ejaculado a qual possui uma menor quantidade do plasma seminal produzido pelas vesículas
81 81 seminais, demonstrou uma melhor atividade mitocondrial, integridade de membranas e cinética espermática após a refrigeração e descongelação do sêmen equino. Palavras-chave: garanhão, colheita fracionada, criopreservação de sêmen. 1. Introdução O transporte do sêmen refrigerado para inseminações artificiais na equinocultura brasileira e mundial está bem difundido, permitindo o transporte do material genético refrigerado a 5 C por até 48h. Por outro lado, a utilização do sêmen congelado de garanhões possibilita o encurtamento das fronteiras e possibilite a troca genéticas entre animais que encontram-se em outros países e, ou em locais cuja distância ou logística deficiente, não permita a chegada do sêmen refrigerado no intervalo de 48h. Estas biotecnicas, por sua vez, participam efetivamente na difusão e multiplicação do material biológico dos animais que possuem mérito genético superior, principalmente graças ao aumento da difusão de modalidades esportivas equestres. O ejaculado dos mamíferos, de uma forma geral, possuem algumas particularidades individuais. Em equinos as glândulas sexuais acessórias são bem desenvolvidas e durante a ejaculação, as secreções produzidas por elas formam o plasma seminal [1] que aumentam o volume do ejaculado. Nos garanhões, o ejaculado é dividido em três frações espermáticas: uma fração pré-espermática produzida pelas glândulas bulbouretrais e próstata e possui aspecto transparente. Uma fração rica em espermatozoides em que suas secreções são advindas do epidídimo e ampolas dos ductos deferentes, e uma fração pós-espermática ou pobre, formada por espermatozoides que ficaram remanescentes no canal uretral e por secreções liberadas pelas vesículas seminais [1-8]. Desta forma, de acordo com a liberação dos espermatozoides durante a ejaculação, há uma ordem específica de produção das glândulas sexuais acessórias, variando assim, a composição do plasma seminal [1,9]. Países que utilizam rotineiramente a inseminação artificial, o transporte do sêmen de garanhões entre os haras ou centrais de reprodução faz-se de forma refrigerada, devido ao tempo e distância até serem utilizados. Entretanto, existem garanhões cujo sêmen não é tolerante ao processo de refrigeração [10]. Acredita-se que
82 82 este fato pode estar relacionado ao efeito deletério do plasma seminal na motilidade e manutenção das células espermáticas [1,3,10-14]. A centrifugação é utilizada quando o ejaculado é oligospérmico ou muito diluído, com o objetivo de concentrar as células espermáticas e retirar o PS do sêmen em garanhões cujos componentes, podem estar ligados à baixa manutenção da motilidade e integridade da membrana dos espermatozoides [10]. Jasko et at. [15] encontraram uma melhoria nos parâmetros de motilidade espermática pós-refrigeração, quando o sêmen foi centrifugado para remoção do PS no grupo de garanhões estudado. Entretanto, esse processo pode trazer danos mecânicos às células espermáticas, prejudicando ainda mais a integridade de membrana espermática [6,10,16,17]. Uma alternativa para minimizar os danos produzidos pela centrifugação é a colheita fracionada dos ejaculados, a qual possibilita uma menor quantidade de plasma nos primeiros jatos de sêmen, cuja concentração corresponde a 80% do total das células espermáticas do ejaculado [2,3]. A colheita das primeiras frações do ejaculado traz benefícios, como a melhoria da longevidade espermática durante a refrigeração e congelação [3,6,12,14]. Todavia, faz-se necessário a difusão desta prática de colheita nos haras de forma padronizada, segura, com uma menor perda de células espermáticas, já que as mesmas serão utilizadas em inseminações de éguas previamente induzidas. Poucos trabalhos são encontrados avaliando a associação da cinética espermática e da atividade mitocondrial de cada uma das frações do ejaculado, de acordo com a saída dos jatos de sêmen e a presença do plasma seminal. Desta forma, o objetivo deste trabalho foi avaliar o efeito do plasma seminal nas diferentes frações do ejaculado de garanhões, com uma nova forma de colheita fracionada, na manutenção da sobrevivência dos espermatozoides, avaliados pela cinética espermática e integridade de membrana plasmática, atividade mitocondrial dos espermatozoides por meio da citometria de fluxo, antes e pós-refrigeração por 24h a 5 C e após a descongelação.
83 83 2. Material e Métodos 2.1 Reagentes e marcas Todos os reagentes utilizados no estudo foram adquiridos da empresa Sigma- Aldrich, St. Louis, MO. 2.2 Aspectos éticos O estudo foi realizado de acordo com preceitos éticos recomendados pelo Conselho Nacional de Controle de Experimentação Animal (CONCEA), após aprovação pelo Comitê de Ética no Uso de Animais (CEUA) institucional, sob protocolo nº 14/ Animais O experimento foi realizado na Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista Júlio de Mesquita Filho, Campus Botucatu (FMVZ- UNESP/ Botucatu), localizada no estado de São Paulo, latitude 22 53`09``à sul e longitude 48 26`42``à oeste. Neste estudo, foram utilizados 32 ejaculados obtidos de 16 garanhões das raças Mangalarga Marchador, Quarto de Milha, Puro Sangue Inglês, Paint Horse, Brasileiro de Hipismo, Andaluz e Holsteiner, com idade variando entre cinco e 20 anos Colheita de sêmen Os garanhões tiveram o sêmen colhido antes do início do experimento, duas vezes com intervalo de um dia, para esgotar as reservas epididimárias. Assim, nos animais utilizados no experimento, realizou-se a colheita de sêmen de forma convencional, com vagina artificial modelo Botucatu (Botupharma, Botucatu, SP, Brasil) e foram realizadas utilizando-se manequim ou égua em estro. A seguir, foram colhidos dois ejaculados de cada um dos 16 garanhões em vagina artificial modelo modificada, que possui as seguintes dimensões: 31cm de comprimento e 13cm de diâmetro, internamente revestida com uma mucosa de látex presa nas extremidades com anel de borracha e internamente revestida com mucosa sanitária
84 84 plástica descartável fechada Sperm Clean, desenvolvida especialmente para este sistema de colheita, esta mucosa plástica foi confeccionada tendo como base o modelo de colheita fracionada proposta por Kareskoski [18]. Três pessoas foram necessárias para a realização da colheita fracionada nesse trabalho, em que uma era responsável por segurar a vagina e pressionar a base do pênis que com o dedo indicador sob o canal uretral, o qual avisava aos demais quanto à passagem dos jatos. As frações foram divididas da seguinte forma: pré-seminal quando presente, uma segunda pessoa separava a Fração A (FA), que correspondia aos 1º e 2 jatos do sêmen com uma pinça hemostática de Crile e uma terceira pessoa separava a Fração B (FB), que correspondia ao 3º e 4 jatos com outra pinça hemostática de Crile, e Fração C (FC), correspondente ao 5 e os demais jatos do ejaculado (Figura 1). Figura 1. A Mucosa fechada e os jatos separados com pinças, (1) vagina artificial aberta de dimensões modificadas, (2) mucosa de látex (3) mucosa sanitária plástica fechada descartável sperm clear e (4) pinça hemostática de Crile. B Vagina artificial para colheita fracionada montada Processamento do sêmen As frações foram divididas e posteriormente filtradas em filtro de nylon, determinado o volume de cada uma delas, assim como, a concentração espermática através da contagem das células em Câmara de Neubauer em microscópio óptico de luz. A diluição variou entre 1 : 20 até 1 : 200 (sêmen : água destilada), de acordo com a concentração de cada amostra. Foi então retirada uma alíquota correspondente a 33% de
85 85 cada uma das frações, para formar o grupo controle denominado de fração ejaculado (FE), o qual representava todas as porções de um ejaculado convencional Refrigeração das amostras de sêmen De cada uma das frações (FA, FB, FC e FE), foi retirada uma amostra e diluída em meio à base de leite (Botu-Sêmen, Botupharma, Botucatu, SP, Brasil), a uma concentração de 50 milhões (50 x 10 6 ) de espermatozoides móveis por mililitro (ml), colocadas em tubos de centrifuga e armazenadas em caixas para refrigeração e transporte de espermatozoides equinos (modelo Botu-flex, Botupharma, Botucatu-SP, Brasil) e refrigerada por 24 horas a 5 C, segundo metodologia utilizada por Hartwig et al. [19] para posterior avaliação Congelação das amostras de sêmen Outra amostra foi retirada e destinada ao processo de congelação, assim, foi diluída na proporção 1:1 (V/V) com o diluente a base de leite (Botu-Sêmen, Botupharma, Botucatu, SP, Brasil), centrifugada a 600xg em centrifuga (Baby I 206 BL, Fanem, Guarulhos, SP, Brasil) por 10 minutos. Posteriormente, o sobrenadante foi desprezado e os pellets ressuspendidos com o diluente de congelação (Botu-Crio, Botupharma, Botucatu, SP, Brasil), na concentração de 100 milhões (100 x 10 6 ) de espermatozoides móveis por mililitro (ml) ou 50 x 10 6 espermatozoides/palheta, envasadas em palhetas de 0,5mL, lacradas com álcool polivinílico, em seguida levadas para estabilização em geladeira de temperatura controlada (Minitube do Brasil LTDA, Brasil) à 5 C por 20 minutos. Posteriormente uma caixa isotérmica e com capacidade de 45 litros, foi preenchida com nitrogênio líquido até a marca de 4 centímetros (cm) de altura, em que as palhetas foram acondicionadas para resfriamento rápido em vapor de nitrogênio a uma temperatura entre 110 e 120 C. Desta forma, as palhetas ficaram dispostas horizontalmente a seis cm acima do nível do nitrogênio líquido por 20 minutos e, após este período, foram imersas em nitrogênio líquido para congelação [20] e armazenadas em botijões criobiológicos. As palhetas foram descongeladas em banho-maria a 46ºC por 20 segundos, seguindo a técnica descrita por Dell Aqua Jr. et al. [17], transferidas para um eppendorf de 2,0mL e incubadas em banho seco por 10 minutos a 37 C para subsequente avaliação.
86 Análises espermáticas Cinética espermática Para avaliação da cinética espermática, uma amostra de cada uma das frações foi mensurada quanto à motilidade espermática total (MT [%]), motilidade espermática progressiva (MP [%]) e porcentagem de espermatozoides com movimento rápido (RAP [%]), por meio do sistema computadorizado CASA - Computer Assisted Sperm Analysis (HTM-IVOS 12 Hamilton Thorne Research, Beverly, MA) mensurando-se cinco campos aleatórios em câmara de Mackler, avaliando-se no mínimo 200 células por campo. O setup específico do CASA para equinos, utilizadas neste experimento, está descrito na tabela 1. Tabela 1 Ajuste do HTMA IVOS 12 para as realizações das análises seminais em equídeos. Parâmetros Ajustes Número de pontos examinados 30 Contraste das células em relação ao campo 60 pixels Tamanho mínimo das células 3 pixels Contraste para células móveis 30 Motilidade progressiva** *Retilinearidade >80% *Velocidade média de percurso >70μm/s Static** *Velocidade média de percurso Cutoff <30m/s *Velocidade em linha reta Cutoff <20m/s Espermatozoides Rápidos* *Velocidade média de percurso >80μm/s Limite inferior de tamanho 0,62 pixel Limite superior de tamanho 2,98 pixel Limite inferior de intensidade 0,24 Limite superior de intensidade 1,19 Limite inferior de alongamento 0% Limite superior de alongamento 100% Análise de ph e osmolaridade Foi retirada uma alíquota de 2mL de cada uma das frações ( Fração A, Fração B, Fração C e Fração E ), logo após serem colhidas e submetida a avaliação do ph
87 87 através do peagâmetro (Analion, Ribeirão Preto, SP, Brasil) e, em seguida, a mesma amostra foi utilizada para a mensuração da osmolaridade pelo meio do osmômetro (PZL-100, Londrina, PR, Brasil) Avaliação por citometria de fluxo As análises multiparamétricas de membrana espermática, índices de caspaseativada e peroxidação lipídica e ERO foram realizadas utilizando-se o equipamento de citometria de fluxo BD LSR Fortessa (Becton Dickinson, Mountain View, CA, USA), equipado com lasers: azul 488nm, 100mW, vermelho 640nm, 40mW e violeta 405nm, 100mW. Após as análises, os dados foram avaliados pelo programa do mesmo fabricante, BD FACSDiva software v Avaliação multiparamétrica das membranas espermáticas Para a avaliação de integridade de membrana plasmática e acrossomal, foram utilizadas a associação das sondas hoechst (h342; 14533), iodeto de propídio (IP; P4170), FITC-PSA (L-0770) e Anexina V APC (An, , BD Pharmigen), de acordo com protocolo desenvolvido por Freitas-Dell Aqua et al. [21]. Assim, numa amostra de 100μL de sêmen diluído em solução tampão de Anexina (10mM Hepes/NaOH ph 7,4 140mM NaCl, 2,5mM CaCl2), na concentração de 10x10 6 sptz/ml, foram adicionados 5μL de h342 (100μg/mL), 5 μl de IP (50μg/mL), 0,5μL de FITC-PSA (1 mg/ml) e 5μL de An, de acordo com o fabricante e, então, homogeneizados e incubados por 15 minutos em temperatura ambiente ao abrigo da luz. Após a incubação, outros 400μL de solução tampão de anexina foi adicionado, para uma concentração final de 2x10 6 sptz/ml.
88 Avaliação do índice de caspase-ativada A associação de FITC-VAD-FMK (G7462, Promega, Madison WI, EUA) foi utilizada como marcadora in situ de caspase ativada. Em 1mL de uma solução de PBS com 1x10 6 sptz/ml, foi adicionado 1μL de FITC-VAD-FMK a 5mM e, então, homogeneizado e incubado em temperatura ambiente ao abrigo da luz por 20 minutos. Após a incubação, esta solução foi lavada três vezes (300 g/5 minutos) e ressuspendida em PBS com a concentração inicial e, então, foram adicionados 5μL de H342 (100μg/mL), 5μL de IP (50μg/mL) e incubados por mais 10min ao abrigo da luz Avaliação da Peroxidação Lipídica Para esta análise, foi utilizada a probe C11-BODYPY (D-3861; Molecular Probes, Carlsbad, CA, USA) de acordo com Guasti et al. [22]. Assim, uma amostra do sêmen foi diluída em TALP, segundo Parrish et al. (1988) modificado (100mM de NaCl, 3,1mM de KCl, 25,0mM de NaHCO3, 0,3mM de NaH2PO4, 21,6mM de DLlactato de sódio 60%, 2,0mM de CaCl2, 0,4mM de MgCl2, 10,0mM de Hepes-livre de ácido, 1,0mM de piruvato de sódio, 1,0mg/mL de álcool polivinil-pva e 25µg/mL de gentamicina), a uma concentração de 5x10 6 sptz/ml e com um volume final de 499,5μL. Estas amostras foram coradas com 0,5μL da sonda C11BODIPY581/591 (1mg/mL) por 30 minutos à 37º C. Após o período de incubação, uma amostra de 200 μl desta solução foi transferida para outro microtubo e, então, foram adicionados 5μL de h342 (100μg/mL), 5μL de IP (50μg/mL) e, novamente, incubados por 10 minutos a 37º C. Após a incubação, foram adicionados mais 290μL de TALP-PVA, sendo assim, a concentração final da amostra foi de 2,5x10 6 sptz/ml Avaliação da ERO Para avaliação da concentração de ERO foi utilizada a sonda 5- (-6) - carboxi- 2,7-diclorodihidro-fluoresceindiacetato (carboxi-h2dcfda; Molecular Probes, Carlsbad, CA, USA), de acordo com Guthrie e Welch [23] e modificado por Papa et al. [24] pela adição de Hoechst Assim, em 489,5μL de sêmen diluído em TALP a uma concentração de 2x10 6 sptz/ml, foram acrescidos 5μL de IP (50µg/mL), 5µL de
89 89 h324 (100µg/mL) e 0,5μL da sonda carboxi-h2dcfda (concentração final de 20μM). Esta mistura foi incubada a 25ºC por 60 minutos ao abrigo da luz Análise estatística Para todas as análises foram calculadas as medias e erro padrão e então realizado o teste de normalidade Kolmogorov-Smirnov. Quando os dados apresentavam distribuição normal foi utilizado um modelo misto de análise de variância seguido pelo teste de Tukey para comparar as frações do ejaculado, quando não apresentavam distribuição normal (dados não paramétricos) utilizou-se o Kruskal-Wallis seguido de teste de Dunns. Para todos foi considerado valor de p<0,05. As análises foram realizadas pelo Programa GraphPad Prism versão 6.0 para Windows (GraphPad software, San Diego, Caifórnia, USA). 3. Resultados Os resultados obtidos dos parâmetros avaliados do sêmen a fresco (T0), encontram-se descritos na tabela 1. Sendo possível observar que nos parâmetros de concentração a FA se mostrou superior às demais frações do ejaculado, sendo encontrada diferença estatística (p<0,05). Nos parâmetros de avaliação do ph a FA demonstrou ser a fração com um ph mais próximo a neutralidade tabela1. Ao se comparar a cinética espermática em termos de MT, MP e RAP do sêmen fresco (T0), a fração A do ejaculado mostrou-se uma superioridade (p<0,05) às demais frações, sendo encontrada diferença estatística, assim como, com o sêmen refrigerado (T24), também houve diferença estatística (p<0,05) entre as frações figura 2 e 3 respectivamente. Com relação às avaliações realizadas através da citometria fluxo, os resultados estão demonstrados na figura 5, onde observou-se diferença significativa entre as frações somente no momento zero (T0) para os parâmetros de integridade de membrana plasmática e acrossomal integra, não havendo diferença entre os outros parâmetros avaliados no momento zero (T0) e nem após a refrigeração (T24) figura 6.
90 90 Tabela 1 Valores de médias e erros padrões dos parâmetros avaliados entre as frações A (FA), fração B (FB), fração C (FC) e fração ejaculado (FE) do sêmen a fresco. PARÂMETROS FRAÇÔES FA FB FC FE VOLUME 12,3±1,0 a 9,7±0,7 a 19,1±1,9 b 13,6±0,9 a [ ] x 10 6 Sptz/mL 534,8±44,8 a 446,6±36,0 ab 196,9±19,3 c 338,7±32,6 b [ ] x 10 6 Sptz Frações 5956±578,3 a 4444±529,4 ab 3291±389,7 b 4173±373,6 b ph 7,27±0,02 a 7,36±0,04 ab 7,50±0,03 c 7,41±0,03 bc mosm 289,6±3,4 290,3±3,7 297,3±1,3 292,1±1,1 DEFEITOS > % 18,7±2,6 20,3±2,8 20,3±2,3 18,5±2,1 DEFEITOS < % 10,0±1,0 11,9±1,5 13,7±1,7 11,5±1,1 (VOL): volume; ([ ] x 10 6 Sptz/mL): concentração espermática por mililitro; ([ ] x 10 6 Sptz Frações): concentração espermática em cada uma das frações; ph; (mosm): osmolaridade; (DEFEITOS > %) morfologia dos defeitos maiores; (DEFEITOS < %) morfologia dos defeitos menores. *Letras diferentes na mesma linha (a,b,c) indicam diferença estatística entre as frações estudadas p<0,05. Figura 2. Valores de médias e erros padrões dos parâmetros de cinética espermática com sêmen fresco após a colheita, nos grupos fração A (FA), fração B (FB), fração C (FC) e fração ejaculado (FE); (MT%): motilidade espermática total; (MP%): motilidade espermática progressiva; (RAP%): espermatozoides com movimento rápido. *Letras diferentes (a, b) na mesma coluna indicam diferença estatística entre as frações estudadas p<0,05.
91 91 Figura 3. Valores de médias e erros padrões dos parâmetros de cinética espermática do sêmen avaliados após 24 horas de refrigeração a 5 C (T24) entre as Frações A (FA), Fração B (FB), Fração C (FC) e Fração Ejaculado (FE); (MT%): motilidade espermática total; (MP%): motilidade espermática progressiva; (RAP%): espermatozoides com movimento rápido. *Letras diferentes (a,b) na mesma coluna indicam diferença estatística entre as frações estudadas p<0,05. Não foi observado interferência da cinética espermática, após a descongelação entre as frações dos ejaculado, entretanto a FA apresentou-se numericamente superior às demais frações avaliados em termos de MT, MP e RAP conforme figura 4. Assim como não houve diferença nas avaliações de citometria de fluxo para os parâmetros avaliados pós-descongelação conforme figura 7.
92 92 Figura 4. Valores de médias e erros padrões dos parâmetros de cinética espermática através da análise computadorizada, entre todos os animais avaliados após a descongelação das diferentes frações do ejaculado de garanhões, Fração A (FA), Fração B (FB), Fração C (FC) e Fração Ejaculado (FE); (MT%): motilidade espermática total; (MP%): motilidade espermática progressiva; (RAP%): espermatozoides com movimento rápido. Figura 5. Valores de médias e erros padrões dos parâmetros de avaliados por meio da citometria de fluxo do sêmen a fresco (T0) nas diferentes frações do ejaculado, Fração A (FA), Fração B (FB), Fração C (FC) e Fração Ejaculado (FE); MPAI- membrana plasmática e acrossomal integra, PER- peroxidação lipídica, CT ERO %- células totais com presença de ERO, CT Casp- células totais com caspase ativada. *Letras diferentes (a, b) na mesma linha, indicam diferença estatística entre as frações estudadas p<0,05.
93 93 Figura 6. Valores de médias e erros padrões dos parâmetros de avaliados por meio da citometria de fluxo após a refrigeração por 24h (T24) nas diferentes frações do ejaculado, Fração A (FA), Fração B (FB), Fração C (FC) e Fração Ejaculado (FE); MPAI- membrana plasmática e acrossomal integra, PER- peroxidação lipídica, CT ERO %- células totais com presença de ERO, CT Casp- células totais com caspase ativada. Figura 7. Valores de médias e erros padrões dos parâmetros de avaliados por meio da citometria de fluxo do sêmen após a descongelação das diferentes frações do ejaculado, Fração A (FA), Fração B (FB), Fração C (FC) e Fração Ejaculado (FE); MPAI-
Fertilização. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Fertilização Prof a. Marta G. Amaral, Dra. Embriologia molecular Geralmente ocorre na ampola da trompa uterina. Não ocorre no útero. Sêmen Formado pelos espermatozoides e mistura de secreções testiculares,
Fertilização Prof a. Marta G. Amaral, Dra. Embriologia molecular Geralmente ocorre na ampola da trompa uterina. Não ocorre no útero. Sêmen Formado pelos espermatozoides e mistura de secreções testiculares,
SISTEMA REPRODUTOR MASCULINO
 SISTEMA REPRODUTOR MASCULINO O Sistema reprodutor masculino é composto por: Dois testículos protegidos numa bolsa escrotal Dois Epidídimo Dois canais deferentes Duas vesículas seminais, Próstata Uretra
SISTEMA REPRODUTOR MASCULINO O Sistema reprodutor masculino é composto por: Dois testículos protegidos numa bolsa escrotal Dois Epidídimo Dois canais deferentes Duas vesículas seminais, Próstata Uretra
42º Congresso Bras. de Medicina Veterinária e 1º Congresso Sul-Brasileiro da ANCLIVEPA - 31/10 a 02/11 de Curitiba - PR 1
 1 COMPARAÇÃO DA CINÉTICA DE ESPERMATOZOIDES DA CAUDA DO EPIDÍDIMO COM OS OBTIDOS DO EJACULADO DE GARANHÕES AUTORES: Gabriel Augusto Monteiro 1, Yamê Fabres Robaina Sancler da Silva 2, Carlos Ramires Neto
1 COMPARAÇÃO DA CINÉTICA DE ESPERMATOZOIDES DA CAUDA DO EPIDÍDIMO COM OS OBTIDOS DO EJACULADO DE GARANHÕES AUTORES: Gabriel Augusto Monteiro 1, Yamê Fabres Robaina Sancler da Silva 2, Carlos Ramires Neto
SISTEMA GENITAL MASCULINO. Prof. Mateus Grangeiro.
 SISTEMA GENITAL MASCULINO Prof. Mateus Grangeiro. SISTEMA GENITAL MASCULINO Funções principais: Produção, armazenamento e maturação dos espermatozoides. Transporte dos espermatozoides até o Sistema Genital
SISTEMA GENITAL MASCULINO Prof. Mateus Grangeiro. SISTEMA GENITAL MASCULINO Funções principais: Produção, armazenamento e maturação dos espermatozoides. Transporte dos espermatozoides até o Sistema Genital
Anatomia Comparada do Sistema Reprodutor Masculino nos Animais Domésticos (Equinos, Bovinos, Suínos, Ovinos e Caninos)
 Anatomia Comparada do Sistema Reprodutor Masculino nos Animais Domésticos (Equinos, Bovinos, Suínos, Ovinos e Caninos) - Órgãos urinários - Órgãos genitais Aparelho urogenital Rosane Maria Guimarães da
Anatomia Comparada do Sistema Reprodutor Masculino nos Animais Domésticos (Equinos, Bovinos, Suínos, Ovinos e Caninos) - Órgãos urinários - Órgãos genitais Aparelho urogenital Rosane Maria Guimarães da
BIOLOGIA. Identidade dos Seres Vivos Sistema Reprodutor Humano. Prof. Daniele Duó
 BIOLOGIA Identidade dos Seres Vivos Prof. Daniele Duó O sistema reprodutor humano possui uma série de órgãos e estruturas que permitem a realização da reprodução sexuada. Reprodução sexuada: Reprodução
BIOLOGIA Identidade dos Seres Vivos Prof. Daniele Duó O sistema reprodutor humano possui uma série de órgãos e estruturas que permitem a realização da reprodução sexuada. Reprodução sexuada: Reprodução
SISTEMA REPRODUTOR. Profª Talita Silva Pereira
 SISTEMA REPRODUTOR Profª Talita Silva Pereira O sistema reprodutor masculino é formado: Testículos Vias espermáticas: epidídimo, canal deferente, uretra. Pênis e Escroto Glândulas anexas: próstata, vesículas
SISTEMA REPRODUTOR Profª Talita Silva Pereira O sistema reprodutor masculino é formado: Testículos Vias espermáticas: epidídimo, canal deferente, uretra. Pênis e Escroto Glândulas anexas: próstata, vesículas
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Tópicos Especiais em Biotecnologia
 Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Tópicos Especiais em Biotecnologia FUNÇÕES DO APARELHO REPRODUTOR MASCULINO REPRODUTIVA 1 HORMONAL 2 PRODUÇÃO, ARMAZANAMENTO E TRANSPORTE
Universidade Federal do Amazonas ICB Dep. Morfologia Disciplina: Tópicos Especiais em Biotecnologia FUNÇÕES DO APARELHO REPRODUTOR MASCULINO REPRODUTIVA 1 HORMONAL 2 PRODUÇÃO, ARMAZANAMENTO E TRANSPORTE
Aparelho reprodutor masculino
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho reprodutor masculino Aparelho reprodutor masculino Prof. Msc. Macks Wendhell Gonçalves Anatomia do testículo Componentes do aparelho
Pontifícia Universidade Católica de Goiás Departamento de Biologia Aparelho reprodutor masculino Aparelho reprodutor masculino Prof. Msc. Macks Wendhell Gonçalves Anatomia do testículo Componentes do aparelho
Sistema Reprodutor Masculino. Acadêmica de Veterinária Gabriela de Carvalho Jardim
 Sistema Reprodutor Masculino Acadêmica de Veterinária Gabriela de Carvalho Jardim Introdução Neste breve capítulo, será abordado o sistema reprodutor masculino do ponto de vista histológico, utilizando
Sistema Reprodutor Masculino Acadêmica de Veterinária Gabriela de Carvalho Jardim Introdução Neste breve capítulo, será abordado o sistema reprodutor masculino do ponto de vista histológico, utilizando
ATLAS CITOLÓGICO DE CONCLUSÃO DO CURSO DE CITOLOGIA CLÍNICA E LABORATORIAL DA ACADEMIA DE CIÊNCIA E TECNOLOGICA DE SÃO JOSÉ DE RIO PRETO SP
 ATLAS CITOLÓGICO DE CONCLUSÃO DO CURSO DE CITOLOGIA CLÍNICA E LABORATORIAL DA ACADEMIA DE CIÊNCIA E TECNOLOGICA DE SÃO JOSÉ DE RIO PRETO SP Tema Citológico: Morfologia da Espermatogênese Autor: Joeder
ATLAS CITOLÓGICO DE CONCLUSÃO DO CURSO DE CITOLOGIA CLÍNICA E LABORATORIAL DA ACADEMIA DE CIÊNCIA E TECNOLOGICA DE SÃO JOSÉ DE RIO PRETO SP Tema Citológico: Morfologia da Espermatogênese Autor: Joeder
Sistema Reprodutor 1
 Sistema Reprodutor 1 APARELHO REPRODUTOR MASCULINO 2 Funções Reprodutivas Espermatogênese: formação do esperma Regulação das funções sexuais masculinas pelos diversos hormônios Ato sexual masculino 3 Anatomia
Sistema Reprodutor 1 APARELHO REPRODUTOR MASCULINO 2 Funções Reprodutivas Espermatogênese: formação do esperma Regulação das funções sexuais masculinas pelos diversos hormônios Ato sexual masculino 3 Anatomia
Aparelho Genital Masculino
 Aparelho Genital Masculino Função Produz, nutre e transporta os espermatozóides; Produção de hormonas; Reprodução sexuada. Constituição Testículos; Epidídimo e canal deferente; Vesícula seminal; Canal
Aparelho Genital Masculino Função Produz, nutre e transporta os espermatozóides; Produção de hormonas; Reprodução sexuada. Constituição Testículos; Epidídimo e canal deferente; Vesícula seminal; Canal
Sistema reprodutor masculino e feminino: origem, organização geral e histologia
 Sistema reprodutor masculino e feminino: origem, organização geral e histologia CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR Profa. Msc. Ângela Cristina Ito Sistema reprodutor
Sistema reprodutor masculino e feminino: origem, organização geral e histologia CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR Profa. Msc. Ângela Cristina Ito Sistema reprodutor
Introdução. Sistema Urinário. Rim. Rim. A urina é um dos veículos de excreção de substâncias tóxicas e atóxicas.
 Introdução A urina é um dos veículos de excreção de substâncias tóxicas e atóxicas. Compreende os órgãos formadores da urina (rins) e órgãos destinados à condução (ureteres), reservatório (bexiga) e eliminação
Introdução A urina é um dos veículos de excreção de substâncias tóxicas e atóxicas. Compreende os órgãos formadores da urina (rins) e órgãos destinados à condução (ureteres), reservatório (bexiga) e eliminação
Colheita e Avaliação Seminal
 UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA BIOTECNOLOGIA DA REPRODUÇÃO ANIMAL Colheita e Avaliação Seminal Vicente José de F. Freitas Laboratório de Fisiologia e Controle da Reprodução www.uece.br/lfcr
UNIVERSIDADE ESTADUAL DO CEARÁ FACULDADE DE VETERINÁRIA BIOTECNOLOGIA DA REPRODUÇÃO ANIMAL Colheita e Avaliação Seminal Vicente José de F. Freitas Laboratório de Fisiologia e Controle da Reprodução www.uece.br/lfcr
Colheita e Avaliação Macroscópica do Sêmen
 Universidade Estadual do Ceará Faculdade de Veterinária Biotecnologia da Reprodução Animal Colheita e Avaliação Macroscópica do Sêmen Vicente José de F. Freitas Laboratório de Fisiologia e Controle da
Universidade Estadual do Ceará Faculdade de Veterinária Biotecnologia da Reprodução Animal Colheita e Avaliação Macroscópica do Sêmen Vicente José de F. Freitas Laboratório de Fisiologia e Controle da
CURSO DE GRADUAÇÃO EM BIOMEDICINA REPRODUÇÃO HUMANA PROF. ESP. DOUGLAS G. PEREIRA
 CURSO DE GRADUAÇÃO EM BIOMEDICINA PROF. ESP. DOUGLAS G. PEREIRA PARACATU/MG 2018 O INÍCIO DA REPRODUÇÃO HUMANA União dos gametas masculino e feminino. Formação do zigoto. Constituição genética diploide
CURSO DE GRADUAÇÃO EM BIOMEDICINA PROF. ESP. DOUGLAS G. PEREIRA PARACATU/MG 2018 O INÍCIO DA REPRODUÇÃO HUMANA União dos gametas masculino e feminino. Formação do zigoto. Constituição genética diploide
GÔNADAS = glândulas endócrinas com funções de sustentar o desenvolvimento e a maturação das células germinativas e sintetizar e secretar hormônios
 Fisiologia do Sistema Reprodutor Fisiologia do Sistema Reprodutor GÔNADAS = glândulas endócrinas com funções de sustentar o desenvolvimento e a maturação das células germinativas e sintetizar e secretar
Fisiologia do Sistema Reprodutor Fisiologia do Sistema Reprodutor GÔNADAS = glândulas endócrinas com funções de sustentar o desenvolvimento e a maturação das células germinativas e sintetizar e secretar
SISTEMA REPRODUTOR MASCULINO. Prof. Dr. José Gomes Pereira
 Prof. Dr. José Gomes Pereira 1. CONSIDERAÇÕES PRELIMINARES 2. CONSTITUINTES 2.1. Testículos 2.2. Ductos Genitais 2.3. Glândulas Genitais Acessórias 2.4. Uretra 2.5. Pênis Testículos Envoltórios testiculares
Prof. Dr. José Gomes Pereira 1. CONSIDERAÇÕES PRELIMINARES 2. CONSTITUINTES 2.1. Testículos 2.2. Ductos Genitais 2.3. Glândulas Genitais Acessórias 2.4. Uretra 2.5. Pênis Testículos Envoltórios testiculares
Exercícios de Revisão do 4º Bimestre 2013
 GDF - SECRETARIA DE ESTADO DE EDUCAÇÃO DO DF SUBSECRETARIA DE SUPORTE EDUCACIONAL DO DF GERÊNCIA REGIONAL DE ENSINO DE PLANALTINA CENTRO DE ENSINO FUNDAMENTAL 02 Exercícios de Revisão do 4º Bimestre 2013
GDF - SECRETARIA DE ESTADO DE EDUCAÇÃO DO DF SUBSECRETARIA DE SUPORTE EDUCACIONAL DO DF GERÊNCIA REGIONAL DE ENSINO DE PLANALTINA CENTRO DE ENSINO FUNDAMENTAL 02 Exercícios de Revisão do 4º Bimestre 2013
SISTEMA REPRODUTOR MASCULINO
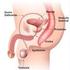 SISTEMA REPRODUTOR MASCULINO Formado por : * Gônodas ou 2 testículos * Vias espermáticas: epidídimo, canais deferentes, e uretra * Pênis * Escroto ou saco escrotal * Glândulas anexas : próstata, vesícula
SISTEMA REPRODUTOR MASCULINO Formado por : * Gônodas ou 2 testículos * Vias espermáticas: epidídimo, canais deferentes, e uretra * Pênis * Escroto ou saco escrotal * Glândulas anexas : próstata, vesícula
SISTEMA REPRODUTOR MASCULINO
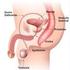 SISTEMA REPRODUTOR MASCULINO Anatomia Genitália externa: pênis e bolsa escrotal; Órgãos reprodutores internos: testículos culos, epidídimos dimos, ductos(deferente, ejaculador e uretra) e as glândulas
SISTEMA REPRODUTOR MASCULINO Anatomia Genitália externa: pênis e bolsa escrotal; Órgãos reprodutores internos: testículos culos, epidídimos dimos, ductos(deferente, ejaculador e uretra) e as glândulas
Biologia 12º ano Reprodução e manipulação da fertilidade
 Escola Básica e Secundária Prof. Reynaldo dos Santos Biologia 12º ano Reprodução e manipulação da fertilidade Teste de Avaliação Leia atentamente os textos das perguntas, observe as imagens e responda
Escola Básica e Secundária Prof. Reynaldo dos Santos Biologia 12º ano Reprodução e manipulação da fertilidade Teste de Avaliação Leia atentamente os textos das perguntas, observe as imagens e responda
ENDOCRINOLOGIA REPRODUTIVA. M. V. Doutorando Lucas Balinhas Farias
 ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
ENDOCRINOLOGIA REPRODUTIVA M. V. Doutorando Lucas Balinhas Farias Anatomia do sistema reprodutivo feminino Genitália externa, vagina, cérvix, útero, ovidutos e ovários Maturidade Sexual É representada
Hipotálamo: Está intimamente relacionado com a hipófise no comando das atividades. Ele controla a secreção hipofisária.
 Fisiologia da reprodução Os órgãos do sistema reprodutor masculino produzem os gametas por meio da gametogênese e são anatomicamente moldados para inserir estes gametas no sistema reprodutor feminino para
Fisiologia da reprodução Os órgãos do sistema reprodutor masculino produzem os gametas por meio da gametogênese e são anatomicamente moldados para inserir estes gametas no sistema reprodutor feminino para
TERMORREGULAÇÃO TESTICULAR EM BOVINOS
 Universidade Federal de Uberlândia Faculdade de Medicina Veterinária TERMORREGULAÇÃO TESTICULAR EM BOVINOS Mara Regina Bueno de M. Nascimento Mara Regina Bueno de M. Nascimento Profa. Adjunto III Jul./
Universidade Federal de Uberlândia Faculdade de Medicina Veterinária TERMORREGULAÇÃO TESTICULAR EM BOVINOS Mara Regina Bueno de M. Nascimento Mara Regina Bueno de M. Nascimento Profa. Adjunto III Jul./
BIOLOGIA Módulo 1 12º CTec GRUPO I
 A g r u p a m e n t o d e E s c o l a s A n t ó n i o S é r g i o V. N. G a i a E S C O L A S E C U N D Á R I A / 3 A N T Ó N I O S É R G I O BIOLOGIA Módulo 1 12º CTec CURSO CIENTÍFICO-HUMANÍSTICO DE
A g r u p a m e n t o d e E s c o l a s A n t ó n i o S é r g i o V. N. G a i a E S C O L A S E C U N D Á R I A / 3 A N T Ó N I O S É R G I O BIOLOGIA Módulo 1 12º CTec CURSO CIENTÍFICO-HUMANÍSTICO DE
Transmissão da Vida Bases morfológicas e fisiológicas da reprodução 1.2. Noções básicas de hereditariedade. Ciências Naturais 9ºano
 Ciências Naturais 9ºano Transmissão da Vida 1.1. Bases morfológicas e 1.2. Noções básicas de hereditariedade A partir da puberdade, as gónadas atingem a maturidade e começam a produzir gâmetas. Ovários
Ciências Naturais 9ºano Transmissão da Vida 1.1. Bases morfológicas e 1.2. Noções básicas de hereditariedade A partir da puberdade, as gónadas atingem a maturidade e começam a produzir gâmetas. Ovários
REPRODUÇÃO HUMANA. Lásaro Henrique
 REPRODUÇÃO HUMANA Lásaro Henrique GAMETOGÊNESE Processo de formação de gametas. Pode ser: Espermatogênese Ovulogênese ESPERMATOGÊNESE Ocorre nos tubos seminíferos,das paredes para a luz de cada tubo. ETAPAS
REPRODUÇÃO HUMANA Lásaro Henrique GAMETOGÊNESE Processo de formação de gametas. Pode ser: Espermatogênese Ovulogênese ESPERMATOGÊNESE Ocorre nos tubos seminíferos,das paredes para a luz de cada tubo. ETAPAS
Sistema urinário. Aparelho Urinário. Órgãos urinários. Órgãos urinários. Rins. Ureteres. Bexiga urinária. Uretra. Sistema urogenital
 Sistema urinário Aparelho Urinário Sistema urogenital - Órgãos urinários - Órgãos genitais -- Origem embriológica comum (mesoderma intermediário) -- Anatomicamente ligados Profa. Rosane Silva cadela ovário
Sistema urinário Aparelho Urinário Sistema urogenital - Órgãos urinários - Órgãos genitais -- Origem embriológica comum (mesoderma intermediário) -- Anatomicamente ligados Profa. Rosane Silva cadela ovário
Reprodutor Masculino
 Reprodutor Masculino Prof a Dr a Mariana Kiomy Osako RCG0146 Medicina Prof 1º ano a Dr a 03/10/2016 Mariana Kiomy Osako Sistema Reprodutor Masculino Ductos deferentes Secreção sêmen Vesículas Seminais
Reprodutor Masculino Prof a Dr a Mariana Kiomy Osako RCG0146 Medicina Prof 1º ano a Dr a 03/10/2016 Mariana Kiomy Osako Sistema Reprodutor Masculino Ductos deferentes Secreção sêmen Vesículas Seminais
Cap. 12 Reprodução Humana. Prof. Tatiana Novembro / 2018
 Cap. 12 Reprodução Humana Prof. Tatiana Novembro / 2018 Adolescência e Puberdade Adolescência: transição entre a infância e a vida adulta. Puberdade: período inicial da adolescência, o qual ocorrem mudanças
Cap. 12 Reprodução Humana Prof. Tatiana Novembro / 2018 Adolescência e Puberdade Adolescência: transição entre a infância e a vida adulta. Puberdade: período inicial da adolescência, o qual ocorrem mudanças
SISTEMA REPRODUTOR HUMANO. Prof. Me. Cristino Rêgo 8º ANO Ensino Fundamental II
 SISTEMA REPRODUTOR HUMANO Prof. Me. Cristino Rêgo 8º ANO Ensino Fundamental II SISTEMA REPRODUTOR MASCULINO FUNÇÕES BÁSICAS Produção de gametas (espermatogênese) Produção de hormônio (testosterona) Condução
SISTEMA REPRODUTOR HUMANO Prof. Me. Cristino Rêgo 8º ANO Ensino Fundamental II SISTEMA REPRODUTOR MASCULINO FUNÇÕES BÁSICAS Produção de gametas (espermatogênese) Produção de hormônio (testosterona) Condução
SISTEMA REPRODUTIVO DO MACHO E DA FÊMEA
 SISTEMA REPRODUTIVO DO MACHO E DA FÊMEA 1 SISTEMA REPRODUTIVO DO MACHO Consistem em: Dois testículos alojados no escroto; Órgãos acessórios, como ductos e glândulas Pênis Epidídimo Ducto deferente Glândulas
SISTEMA REPRODUTIVO DO MACHO E DA FÊMEA 1 SISTEMA REPRODUTIVO DO MACHO Consistem em: Dois testículos alojados no escroto; Órgãos acessórios, como ductos e glândulas Pênis Epidídimo Ducto deferente Glândulas
1 Corte em seres humanos 2 Diferenças entre os sexos 2.1 Sistema reprodutor masculino 2.2 Sistema reprodutor feminino 3 Fecundação 3.
 1 Corte em seres humanos 2 Diferenças entre os sexos 2.2 Sistema reprodutor feminino 3 Fecundação 3.1 Gêmeos 4 Gestação e nascimento 5 Gravidez na adolescência e sexo responsável 5.1 Métodos contraceptivos
1 Corte em seres humanos 2 Diferenças entre os sexos 2.2 Sistema reprodutor feminino 3 Fecundação 3.1 Gêmeos 4 Gestação e nascimento 5 Gravidez na adolescência e sexo responsável 5.1 Métodos contraceptivos
Transporte dos gametas. Professor: Arturo Arnáez Vaella
 Transporte dos gametas Professor: Arturo Arnáez Vaella Ovocitação O folículo terciário pressiona contra a parede do ovário (formação do estigma). Entre 10 a 12 horas antes da ovocitação: retoma-se a meiose
Transporte dos gametas Professor: Arturo Arnáez Vaella Ovocitação O folículo terciário pressiona contra a parede do ovário (formação do estigma). Entre 10 a 12 horas antes da ovocitação: retoma-se a meiose
GAMETOGÊNESE. Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS.
 GAMETOGÊNESE 1 GAMETOGÊNESE Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS. Gameta masculino Espermatozóide. Gameta feminino Ovócito. Os gametas possuem metade
GAMETOGÊNESE 1 GAMETOGÊNESE Processo de formação e desenvolvimento das células germinativas especializadas OS GAMETAS. Gameta masculino Espermatozóide. Gameta feminino Ovócito. Os gametas possuem metade
Capacidade que os seres vivos possuem de produzir descendentes;
 Reprodução Humana Reprodução Capacidade que os seres vivos possuem de produzir descendentes; Ocorre a reprodução sexuada. Na mulher os órgãos sexuais são os ovários, que produzem os óvulos; no homem, são
Reprodução Humana Reprodução Capacidade que os seres vivos possuem de produzir descendentes; Ocorre a reprodução sexuada. Na mulher os órgãos sexuais são os ovários, que produzem os óvulos; no homem, são
19/11/2009. Sistema Reprodutor Masculino Adulto. Formação do sistema genital. Sistema reprodutor feminino adulto. 1ª Etapa: Determinação sexual
 Desenvolvimento do Sistema Sistema Reprodutor Masculino Adulto Reprodutor Masculino e Feminino Prof. Dr. Wellerson Rodrigo Scarano Sistema reprodutor feminino adulto Formação do sistema genital 1ª Etapa:
Desenvolvimento do Sistema Sistema Reprodutor Masculino Adulto Reprodutor Masculino e Feminino Prof. Dr. Wellerson Rodrigo Scarano Sistema reprodutor feminino adulto Formação do sistema genital 1ª Etapa:
Índice. Introdução e Importância Econômica. Introdução e Importância Econômica 07/04/2014. Marco Monteiro de Lima
 Reprodução Índice Introdução e importância econômica Aula prática no setor animais reprodutores) (seleção de Marco Monteiro de Lima marcomonteiro85@gmail.com Introdução e Importância Econômica O controle
Reprodução Índice Introdução e importância econômica Aula prática no setor animais reprodutores) (seleção de Marco Monteiro de Lima marcomonteiro85@gmail.com Introdução e Importância Econômica O controle
Bloco X- Testes- Células germinativas
 Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Bloco X- Testes- Células germinativas 1) Das células progenitoras dos gametas podemos afirmar: I. São haplóides e migram para as gônadas em desenvolvimento II. São chamadas células germinativas primordiais
Plano de Recuperação Final EF2
 Série/Ano: 8º ANO Objetivo: Proporcionar ao aluno a oportunidade de rever os conteúdos trabalhados durante o ano nos quais apresentou dificuldade e que servirão como pré-requisitos para os conteúdos que
Série/Ano: 8º ANO Objetivo: Proporcionar ao aluno a oportunidade de rever os conteúdos trabalhados durante o ano nos quais apresentou dificuldade e que servirão como pré-requisitos para os conteúdos que
Ciências Naturais, 6º Ano. Ciências Naturais, 6º Ano FICHA DE TRABALHO 1. Escola: Nome: Turma: N.º:
 Conteúdo: Carateres Sexuais FICHA DE TRABALHO 1 adolescência 9 e os 15 anos nascimento Conteúdo: Carateres Sexuais FICHA DE TRABALHO 1 adolescência 9 e os 15 anos nascimento 8 e os 12 anos secundários
Conteúdo: Carateres Sexuais FICHA DE TRABALHO 1 adolescência 9 e os 15 anos nascimento Conteúdo: Carateres Sexuais FICHA DE TRABALHO 1 adolescência 9 e os 15 anos nascimento 8 e os 12 anos secundários
Escola: Nome: Turma: N.º: Data: / / FICHA DE TRABALHO 1. adolescência 9 e os 15 anos nascimento. 8 e os 12 anos secundários primários
 Conteúdo: Carateres Sexuais FICHA DE TRABALHO 1 adolescência 9 e os 15 anos nascimento 8 e os 12 anos secundários primários comportamento psicológicas puberdade Os caracteres sexuais estão presentes desde
Conteúdo: Carateres Sexuais FICHA DE TRABALHO 1 adolescência 9 e os 15 anos nascimento 8 e os 12 anos secundários primários comportamento psicológicas puberdade Os caracteres sexuais estão presentes desde
Sistema reprodutor masculino
 Sistema reprodutor masculino O sistema reprodutor masculino é composto por: Testículos Vias espermáticas Glândulas anexas Pênis Saco escrotal Assim como o pênis está localizado externamente ao corpo,
Sistema reprodutor masculino O sistema reprodutor masculino é composto por: Testículos Vias espermáticas Glândulas anexas Pênis Saco escrotal Assim como o pênis está localizado externamente ao corpo,
Ano Lectivo 2009/2010
 Ano Lectivo 2009/2010 Feito por: Carlos Grilo Caracteres sexuais primários e secundários.3 Sistema reprodutor masculino.4 Sistema reprodutor feminino.5 Ciclo ovário.5 Ciclo uterino.7 Fecundação 9 Caracteres
Ano Lectivo 2009/2010 Feito por: Carlos Grilo Caracteres sexuais primários e secundários.3 Sistema reprodutor masculino.4 Sistema reprodutor feminino.5 Ciclo ovário.5 Ciclo uterino.7 Fecundação 9 Caracteres
Diplofase. Haplofase
 Prof. Bruno Uchôa Diplofase Haplofase O sexo de um indivíduo é determinado, geneticamente, de acordo com os cromossomas sexuais que se encontram no ovo. As estruturas masculinas e femininas desenvolvem-se
Prof. Bruno Uchôa Diplofase Haplofase O sexo de um indivíduo é determinado, geneticamente, de acordo com os cromossomas sexuais que se encontram no ovo. As estruturas masculinas e femininas desenvolvem-se
SISTEMA REPRODUTOR MASCULINO
 Profa. Dra. Janaina Serra Azul Monteiro Evangelista Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR MASCULINO Histologia e Embriologia Geral Veterinária SISTEMA REPRODUTOR MASCULINO
Profa. Dra. Janaina Serra Azul Monteiro Evangelista Universidade Estadual do Ceará Faculdade de Veterinária SISTEMA REPRODUTOR MASCULINO Histologia e Embriologia Geral Veterinária SISTEMA REPRODUTOR MASCULINO
Diapositivo 1. RL1 Raquel Lopes;
 Biologia Humana 11º ano Escola Secundária Júlio Dinis Ovar BIOLOGIA HUMANA 11º ano TD Reprodução Humana??? raquelopes 09 raquelopes15@gmail.com RL1 Diapositivo 1 RL1 Raquel Lopes; 05-01-2009 Biologia Humana
Biologia Humana 11º ano Escola Secundária Júlio Dinis Ovar BIOLOGIA HUMANA 11º ano TD Reprodução Humana??? raquelopes 09 raquelopes15@gmail.com RL1 Diapositivo 1 RL1 Raquel Lopes; 05-01-2009 Biologia Humana
É composto por : Sistema reprodutor Vulva (órgão genital externo). Vagina Útero Duas tubas uterinas Tem Dois ovários Função: secretar o óvulo (célula
 É composto por : Sistema reprodutor Vulva (órgão genital externo). Vagina Útero Duas tubas uterinas Tem Dois ovários Função: secretar o óvulo (célula sexual) e abrigar e fornecer condições para o desenvolvimento
É composto por : Sistema reprodutor Vulva (órgão genital externo). Vagina Útero Duas tubas uterinas Tem Dois ovários Função: secretar o óvulo (célula sexual) e abrigar e fornecer condições para o desenvolvimento
COLHEITA FRACIONADA E SEUS PRINCIPAIS BENEFÍCIOS NA CRIOPRESERVAÇÃO DO SÊMEN DE GARANHÕES RESUMO
 435 COLHEITA FRACIONADA E SEUS PRINCIPAIS BENEFÍCIOS NA CRIOPRESERVAÇÃO DO SÊMEN DE GARANHÕES RESUMO Sidnei Nunes de Oliveira 1 Endrigo Adonis Braga de Araujo 2 Luis Fernando Mercês Chaves Silva 2 Felipe
435 COLHEITA FRACIONADA E SEUS PRINCIPAIS BENEFÍCIOS NA CRIOPRESERVAÇÃO DO SÊMEN DE GARANHÕES RESUMO Sidnei Nunes de Oliveira 1 Endrigo Adonis Braga de Araujo 2 Luis Fernando Mercês Chaves Silva 2 Felipe
Gametogênese Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado
 Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado A gametogênese é o processo de produção dos gametas, as células reprodutoras. Esta produção ocorre nas gônadas e seu principal evento é a meiose, responsável
Prof. Dr. Philip Wolff Prof. Dr. Renato M. Salgado A gametogênese é o processo de produção dos gametas, as células reprodutoras. Esta produção ocorre nas gônadas e seu principal evento é a meiose, responsável
ENFERMAGEM ANATOMIA. ANATOMIA DO SISTEMA GENITO URINÁRIO Parte 3. Profª. Tatiane da Silva Campos
 ENFERMAGEM ANATOMIA Parte 3 Profª. Tatiane da Silva Campos Sistema genital feminino tem como função secretar o óvulo (célula sexual) e abrigar feto, fornecendo condições para o seu desenvolvimento. É composto
ENFERMAGEM ANATOMIA Parte 3 Profª. Tatiane da Silva Campos Sistema genital feminino tem como função secretar o óvulo (célula sexual) e abrigar feto, fornecendo condições para o seu desenvolvimento. É composto
Sistema Reprodutor Feminino. Acadêmica de Veterinária Carolina Wickboldt Fonseca
 Sistema Reprodutor Feminino Acadêmica de Veterinária Carolina Wickboldt Fonseca Introdução Apresento este trabalho sobre o Sistema Reprodutor Feminino (SRF), histologicamente, descrevendo algumas estruturas
Sistema Reprodutor Feminino Acadêmica de Veterinária Carolina Wickboldt Fonseca Introdução Apresento este trabalho sobre o Sistema Reprodutor Feminino (SRF), histologicamente, descrevendo algumas estruturas
a) Fecundação é a união do óvulo com o espermatozóide e ocorre no útero. d)...
 EXERCICIO DE REVISÃO (8º ano ) Data: 17-10-17 1)Reescreva as frases com afirmações falsas, corrigindo-as. a) Fecundação é a união do óvulo com o espermatozóide e ocorre no útero. b) O útero se liga aos
EXERCICIO DE REVISÃO (8º ano ) Data: 17-10-17 1)Reescreva as frases com afirmações falsas, corrigindo-as. a) Fecundação é a união do óvulo com o espermatozóide e ocorre no útero. b) O útero se liga aos
PROFESSOR CHICO.
 REPRODUÇÃO 2018 PROFESSOR CHICO chicobio@me.com chicobio@gmail.com 1 Taxonomia (aula 1) 2 Taxonomia (aula 2) 3 Sistemática moderna (aula 3) 4 Sistemática moderna (aula Origem dos sistemas genitais (aula
REPRODUÇÃO 2018 PROFESSOR CHICO chicobio@me.com chicobio@gmail.com 1 Taxonomia (aula 1) 2 Taxonomia (aula 2) 3 Sistemática moderna (aula 3) 4 Sistemática moderna (aula Origem dos sistemas genitais (aula
Gametogênese ESPERMATOGÊNESE. Prof a. Marta G. Amaral, Dra. Embriologia molecular
 Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas em desenvolvimento.
Gametogênese ESPERMATOGÊNESE Prof a. Marta G. Amaral, Dra. Embriologia molecular Gametogênese CGP se formam no epiblasto na 2ª sem. Na 4ª sem. migram do o saco vitelino para as gônadas em desenvolvimento.
Sistema Reprodutor Humano
 Agradecimento: Ao Professor Paulo Roberto que disponibilizou esta aula: http://pt.slideshare.net/biologia_ PreFederal/aula-sistemareprodutor-14165294 Muito Obrigado! Introdução O sistema reprodutor humano
Agradecimento: Ao Professor Paulo Roberto que disponibilizou esta aula: http://pt.slideshare.net/biologia_ PreFederal/aula-sistemareprodutor-14165294 Muito Obrigado! Introdução O sistema reprodutor humano
Introdução. Graduanda do Curso de Medicina Veterinária FACISA/UNIVIÇOSA. hotmail.com. 2
 FUNÇÃO DO ESTRÓGENO NO TRATO REPRODUTIVO DO MASCULINO Amarine Loures Furtado 1, Giancarlo Magalhães dos Santos 2, João Gabriel Viana de Grázia 3, Carolina Marinho de Assunção 4 Resumo: Considerado um hormônio
FUNÇÃO DO ESTRÓGENO NO TRATO REPRODUTIVO DO MASCULINO Amarine Loures Furtado 1, Giancarlo Magalhães dos Santos 2, João Gabriel Viana de Grázia 3, Carolina Marinho de Assunção 4 Resumo: Considerado um hormônio
REPRODUÇÃO E DESENVOLVIMENTO EMBRIONÁRIO. Professor Heverton Alencar
 REPRODUÇÃO E DESENVOLVIMENTO EMBRIONÁRIO Professor Heverton Alencar Sistema reprodutor masculino Testículo - produção de espermatozoides e também a produção de testosterona (hormônio sexual masculino);
REPRODUÇÃO E DESENVOLVIMENTO EMBRIONÁRIO Professor Heverton Alencar Sistema reprodutor masculino Testículo - produção de espermatozoides e também a produção de testosterona (hormônio sexual masculino);
Fisiologia Reprodutiva Masculina
 Fisiologia Reprodutiva Masculina DETERMINACAO E DIFERENCIACAO SEXUAL - 1ª DISTINÇÃO: SEXO GENÉTICO (CROMOSSÔMICO): XY XX DETERMINACAO E DIFERENCIACAO SEXUAL - 2ª DISTINÇÃO: SEXO GONADAL Gônada Indiferenciada
Fisiologia Reprodutiva Masculina DETERMINACAO E DIFERENCIACAO SEXUAL - 1ª DISTINÇÃO: SEXO GENÉTICO (CROMOSSÔMICO): XY XX DETERMINACAO E DIFERENCIACAO SEXUAL - 2ª DISTINÇÃO: SEXO GONADAL Gônada Indiferenciada
Histologia 2 - Resumo Sistema Reprodutor Masculino
 Histologia 2 - Resumo Sistema Reprodutor Masculino SISTEMA REPRODUTOR MASCULINO Produção do conteúdo celular (espermatozoides) do Sêmen: dois testículos, dois epidídimos, ducto deferente. Produção da parte
Histologia 2 - Resumo Sistema Reprodutor Masculino SISTEMA REPRODUTOR MASCULINO Produção do conteúdo celular (espermatozoides) do Sêmen: dois testículos, dois epidídimos, ducto deferente. Produção da parte
INTRODUÇÃO. Formação: Funções: Dois rins Dois ureteres Bexiga Uretra. Remoção resíduos Filtração do plasma Funções hormonais
 SISTEMA URINÁRIO INTRODUÇÃO Formação: Dois rins Dois ureteres Bexiga Uretra Funções: Remoção resíduos Filtração do plasma Funções hormonais INTRODUÇÃO Excreção da urina Sangue é filtrado nos rins Através
SISTEMA URINÁRIO INTRODUÇÃO Formação: Dois rins Dois ureteres Bexiga Uretra Funções: Remoção resíduos Filtração do plasma Funções hormonais INTRODUÇÃO Excreção da urina Sangue é filtrado nos rins Através
Anatomia do Sistema Reprodutor Feminino. Professora: Karin
 Anatomia do Sistema Reprodutor Feminino Professora: Karin Função? O sistema reprodutor feminino é o responsável por desempenhar toda a trajetória de reprodução, desde a ovulação até a expulsão do bebê
Anatomia do Sistema Reprodutor Feminino Professora: Karin Função? O sistema reprodutor feminino é o responsável por desempenhar toda a trajetória de reprodução, desde a ovulação até a expulsão do bebê
Prof.ª. LETICIA PEDROSO
 Prof.ª. LETICIA PEDROSO Sistema reprodutor feminino Vulva (órgão genital externo). Vagina Útero Duas tubas uterinas Tem Dois ovários Função: secretar o óvulo e abriga e fornece condições para o desenvolvimento
Prof.ª. LETICIA PEDROSO Sistema reprodutor feminino Vulva (órgão genital externo). Vagina Útero Duas tubas uterinas Tem Dois ovários Função: secretar o óvulo e abriga e fornece condições para o desenvolvimento
LISTA DE EXERCÍCIOS CIÊNCIAS
 LISTA DE EXERCÍCIOS CIÊNCIAS P1-4º BIMESTRE 8º ANO FUNDAMENTAL II Aluno (a): Turno: Turma: Unidade Data: / /2016 HABILIDADES E COMPETÊNCIAS Identificar as principais mudanças pelas quais o indivíduo passa
LISTA DE EXERCÍCIOS CIÊNCIAS P1-4º BIMESTRE 8º ANO FUNDAMENTAL II Aluno (a): Turno: Turma: Unidade Data: / /2016 HABILIDADES E COMPETÊNCIAS Identificar as principais mudanças pelas quais o indivíduo passa
Profª LETICIA PEDROSO
 Profª LETICIA PEDROSO É composto por : Dois ovários Sistema reprodutor Duas tubas uterinas Útero Vagina Vulva (órgão genital externo). Tem como função secretar o óvulo (célula sexual) e abrigar e fornecer
Profª LETICIA PEDROSO É composto por : Dois ovários Sistema reprodutor Duas tubas uterinas Útero Vagina Vulva (órgão genital externo). Tem como função secretar o óvulo (célula sexual) e abrigar e fornecer
Ureter, Bexiga e Uretra
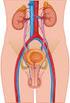 Ureter, Bexiga e Uretra 1 Ureter, Bexiga e Uretra 2 URETER 3 Estrutura do Ureter Tubo muscular que conecta o rim à bexiga Porção superior (abdominal) e inferior (pélvica) 4 Trajeto do Ureter Ao nível do
Ureter, Bexiga e Uretra 1 Ureter, Bexiga e Uretra 2 URETER 3 Estrutura do Ureter Tubo muscular que conecta o rim à bexiga Porção superior (abdominal) e inferior (pélvica) 4 Trajeto do Ureter Ao nível do
Capacidade que os seres vivos possuem de produzir descendentes;
 Reprodução Humana Reprodução Capacidade que os seres vivos possuem de produzir descendentes; Ocorre a reprodução sexuada. Na mulher os órgãos sexuais são os ovários, que produzem os óvulos; no homem, são
Reprodução Humana Reprodução Capacidade que os seres vivos possuem de produzir descendentes; Ocorre a reprodução sexuada. Na mulher os órgãos sexuais são os ovários, que produzem os óvulos; no homem, são
BIOLOGIA. Moléculas, Células e Tecidos Gametogênese. Prof. Daniele Duó
 BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
BIOLOGIA Moléculas, Células e Tecidos https://www.qconcursos.com Prof. Daniele Duó - A reprodução sexuada começa com a formação dos gametas, denominado gametogênese. espermatogênese ovulogênese ou ovogênese
O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50
 O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50 Sistema reprodutor feminino Ovários = produz óvulos Tubas uterinas = transportam e protegem os óvulos Útero = prove meio adequado
O sistema reprodutor feminino. Os ovários e os órgãos acessórios. Aula N50 Sistema reprodutor feminino Ovários = produz óvulos Tubas uterinas = transportam e protegem os óvulos Útero = prove meio adequado
2) Observe o esquema. Depois, seguindo a numeração, responda às questões. C) Onde a urina é armazenada antes de ser eliminada do corpo?.
 Professor: Altemar Santos. Exercícios sobre os sistemas urinário (excretor), reprodutores masculino e feminino e fecundação para o 8º ano do ensino fundamental. 1) Analise o esquema: Identifica-se pelas
Professor: Altemar Santos. Exercícios sobre os sistemas urinário (excretor), reprodutores masculino e feminino e fecundação para o 8º ano do ensino fundamental. 1) Analise o esquema: Identifica-se pelas
ENDOCRINOLOGIA REPRODUTIVA. M.S. Cássio Cassal Brauner FAEM-UFPel
 ENDOCRINOLOGIA REPRODUTIVA M.S. Cássio Cassal Brauner Prof. DZ-FAEM FAEM-UFPel ENDOCRINOLOGIA REPRODUTIVA Endocrinologia é parte das ciências médicas que trata da secreção das glândulas internas (hormônios)
ENDOCRINOLOGIA REPRODUTIVA M.S. Cássio Cassal Brauner Prof. DZ-FAEM FAEM-UFPel ENDOCRINOLOGIA REPRODUTIVA Endocrinologia é parte das ciências médicas que trata da secreção das glândulas internas (hormônios)
hormônios do sistema genital masculino gônadas masculinas
 Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Gônadas masculinas Os hormônios do sistema genital masculino são produzidos nas gônadas masculinas, muito conhecidas como testículos. São os hormônios que determinam as características sexuais secundárias,
Sistema reprodutor masculino: função, anatomia e aspectos fisiopatológicos CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR
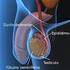 Sistema reprodutor masculino: função, anatomia e aspectos fisiopatológicos CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR Profa. Msc. Ângela Cristina Ito Sistema reprodutor masculino
Sistema reprodutor masculino: função, anatomia e aspectos fisiopatológicos CIÊNCIAS MORFOFUNCIONAIS DOS SISTEMAS TEGUMENTAR, LOCOMOTOR E REPRODUTOR Profa. Msc. Ângela Cristina Ito Sistema reprodutor masculino
FISIOLOGIA DA CONTRAÇÃO MUSCULAR DISCIPLINA: FISIOLOGIA I
 FISIOLOGIA DA CONTRAÇÃO MUSCULAR DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Musculatura corporal Músculo Cardíaco Músculo atrial Contração = esquelética Músculo ventricular Maior duração
FISIOLOGIA DA CONTRAÇÃO MUSCULAR DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Musculatura corporal Músculo Cardíaco Músculo atrial Contração = esquelética Músculo ventricular Maior duração
ENCCEJA RESUMO. Reprodução e contracepção. Natureza 1
 Reprodução e contracepção RESUMO A reprodução é uma característica dos organismos vivos, que produzem descendentes que contenham os seus genes, fazendo-os semelhantes para perpetuar a vida. Reproduzir
Reprodução e contracepção RESUMO A reprodução é uma característica dos organismos vivos, que produzem descendentes que contenham os seus genes, fazendo-os semelhantes para perpetuar a vida. Reproduzir
SISTEMA REPRODUTOR EU BIOLOGIA
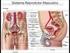 SISTEMA REPRODUTOR EU BIOLOGIA Sistema Genital Feminino Ovários: produção de óvulos e hormônios (estrógeno e progesterona) Tuba uterina: durante a ovulação, recolhe o óvulo e conduz até o útero Útero:
SISTEMA REPRODUTOR EU BIOLOGIA Sistema Genital Feminino Ovários: produção de óvulos e hormônios (estrógeno e progesterona) Tuba uterina: durante a ovulação, recolhe o óvulo e conduz até o útero Útero:
SISTEMA REPRODUTOR FEMININO. Prof. Dr. José Gomes Pereira
 Prof. Dr. José Gomes Pereira 1. CONSIDERAÇÕES GERAIS 2. CONSTITUINTES 2.1. Ovários 2.2. Tubas Uterinas 2.3. Útero 2.4. Cérvix 2.5. Vagina 2.6. Vulva 2.7. Clitóris 2.8 Uretra Ovários Glândula Exócrina e
Prof. Dr. José Gomes Pereira 1. CONSIDERAÇÕES GERAIS 2. CONSTITUINTES 2.1. Ovários 2.2. Tubas Uterinas 2.3. Útero 2.4. Cérvix 2.5. Vagina 2.6. Vulva 2.7. Clitóris 2.8 Uretra Ovários Glândula Exócrina e
Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia - 12º ano - Teste de Avaliação Novembro 2018 Unidade 1: Reprodução humana
 Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia - 12º ano - Teste de Avaliação Novembro 2018 Unidade 1: Reprodução humana Leia atentamente os textos e as questões que se seguem e indique
Escola Prof. Reynaldo dos Santos Vila Franca de Xira Biologia - 12º ano - Teste de Avaliação Novembro 2018 Unidade 1: Reprodução humana Leia atentamente os textos e as questões que se seguem e indique
Djane Dallanora. Patos de Minas MG
 ANATOMIA E FISIOLOGIA DO APARELHO REPRODUTIVO DA FÊMEA E DO MACHO Djane Dallanora Patos de Minas MG OBJETIVOS Revisar os principais órgãos e hormônios que coordenam o processo de reprodução de suínos;
ANATOMIA E FISIOLOGIA DO APARELHO REPRODUTIVO DA FÊMEA E DO MACHO Djane Dallanora Patos de Minas MG OBJETIVOS Revisar os principais órgãos e hormônios que coordenam o processo de reprodução de suínos;
Reprodução humana. Aula 01. Sistema genital masculino Sistema genital feminino Gametogênese. Espermatogênese Ovogênese UNIDADE 3 ESPÉCIE HUMANA
 Reprodução humana UNIDADE 3 ESPÉCIE HUMANA Sistema genital masculino Sistema genital feminino Gametogênese CAPÍTULO 11 Espermatogênese Ovogênese Aula 01 1. SISTEMA GENITAL MASCULINO ÓRGÃOS DO SISTEMA GENITAL
Reprodução humana UNIDADE 3 ESPÉCIE HUMANA Sistema genital masculino Sistema genital feminino Gametogênese CAPÍTULO 11 Espermatogênese Ovogênese Aula 01 1. SISTEMA GENITAL MASCULINO ÓRGÃOS DO SISTEMA GENITAL
GAMETOGÊNESE ESPERMATOGÊNESE OVOLUGÊNESE
 BIOLOGIA FRENTE A SÉRIE: 9º ANO GAMETOGÊNESE ESPERMATOGÊNESE OVOLUGÊNESE Profª. LUCIANA ARAUJO MEIOSE E GAMETAS É por meio da divisão meiótica que as células da linhagem germinativa fabricam os gametas,
BIOLOGIA FRENTE A SÉRIE: 9º ANO GAMETOGÊNESE ESPERMATOGÊNESE OVOLUGÊNESE Profª. LUCIANA ARAUJO MEIOSE E GAMETAS É por meio da divisão meiótica que as células da linhagem germinativa fabricam os gametas,
GOIÂNIA, / / PROFESSOR: Mário Neto. Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
 GOIÂNIA, / / 2016 PROFESSOR: Mário Neto DISCIPLINA: Ciências da natureza SÉRIE: 8º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
GOIÂNIA, / / 2016 PROFESSOR: Mário Neto DISCIPLINA: Ciências da natureza SÉRIE: 8º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
REPRODUÇÃO HUMANA. Reprodutivas ou Germinativas. Somáticas. Linhagens de Células do Corpo. Células do corpo. 2n 2n.
 REPRODUÇÃO HUMANA Linhagens de Células do Corpo Somáticas Células do corpo Reprodutivas ou Germinativas 2n 2n 2n Novas células do corpo Só MITOSE 2n MITOSES MEIOSE GAMETOS (n) GAMETO- GÊNESE GAMETOGÊNESE
REPRODUÇÃO HUMANA Linhagens de Células do Corpo Somáticas Células do corpo Reprodutivas ou Germinativas 2n 2n 2n Novas células do corpo Só MITOSE 2n MITOSES MEIOSE GAMETOS (n) GAMETO- GÊNESE GAMETOGÊNESE
Histologia. Professora Deborah
 Histologia Professora Deborah Histologia Histologia (do grego hystos = tecido + logos = estudo) é o estudo dos tecidos biológicos, sua formação, estrutura e função. Tecidos É um conjunto de células que
Histologia Professora Deborah Histologia Histologia (do grego hystos = tecido + logos = estudo) é o estudo dos tecidos biológicos, sua formação, estrutura e função. Tecidos É um conjunto de células que
Inseminação Artificial em Tempo Fixo (IATF) Em Bovinos Leiteiros
 Gado de Leite 1/27 Inseminação Artificial em Tempo Fixo (IATF) Em Bovinos Leiteiros Erick Fonseca de Castilho Doutor em Reprodução Animal (UFV/MG) efcmv@yahoo.com.br 2/27 Introdução PIB (pecuária): 21
Gado de Leite 1/27 Inseminação Artificial em Tempo Fixo (IATF) Em Bovinos Leiteiros Erick Fonseca de Castilho Doutor em Reprodução Animal (UFV/MG) efcmv@yahoo.com.br 2/27 Introdução PIB (pecuária): 21
- BASES BIOLÓGICAS PARA O CUIDADO I - Prof. Mateus Cruz Loss. Programa de Pós Graduação em Biologia Animal
 UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO SANTO DEPARTAMENTO DE CIÊNCIAS DA SAÚDE - BASES BIOLÓGICAS PARA O CUIDADO I - Prof. Mateus Cruz Loss Programa de Pós Graduação
UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO CENTRO UNIVERSITÁRIO NORTE DO ESPÍRITO SANTO DEPARTAMENTO DE CIÊNCIAS DA SAÚDE - BASES BIOLÓGICAS PARA O CUIDADO I - Prof. Mateus Cruz Loss Programa de Pós Graduação
Membranas Biológicas
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
Água A superfície da Terra é constituída de três quartos de água, cerca de 70%, a maior parte está concentrada nos oceanos e mares, cerca de 97,5%, o
 A química da Vida Água A superfície da Terra é constituída de três quartos de água, cerca de 70%, a maior parte está concentrada nos oceanos e mares, cerca de 97,5%, o restante 2,5% está concentrado em
A química da Vida Água A superfície da Terra é constituída de três quartos de água, cerca de 70%, a maior parte está concentrada nos oceanos e mares, cerca de 97,5%, o restante 2,5% está concentrado em
Sistema Endócrino. Móds 33 e 34. Prof. Rafa
 Sistema Endócrino Móds 33 e 34 Prof. Rafa Hipófise Hipófise Anterior ou Adenoipófise Hipófise Posterior ou Neuroipófise Hormônios da Adenoipófise: GH (Crescimento) ou (STH) Somatotrófico: formação óssea
Sistema Endócrino Móds 33 e 34 Prof. Rafa Hipófise Hipófise Anterior ou Adenoipófise Hipófise Posterior ou Neuroipófise Hormônios da Adenoipófise: GH (Crescimento) ou (STH) Somatotrófico: formação óssea
10/4/2017 FACULDADE EDUCACIONAL DE MEDIANEIRA SISTEMA REPRODUTOR DOS INSETOS FUNÇÃO: Produzir descendentes férteis. SISTEMA REPRODUTOR DOS INSETOS
 FACULDADE EDUCACIONAL DE MEDIANEIRA FUNÇÃO: Produzir descendentes férteis. Profª. Dra. Patrícia Bellon. Outubro/2017 RAZÃO DE SUCESSO POTENCIAL BIÓTICO Enorme potencial reprodutivo. Aedes aegypti 10 dias
FACULDADE EDUCACIONAL DE MEDIANEIRA FUNÇÃO: Produzir descendentes férteis. Profª. Dra. Patrícia Bellon. Outubro/2017 RAZÃO DE SUCESSO POTENCIAL BIÓTICO Enorme potencial reprodutivo. Aedes aegypti 10 dias
CIÊNCIAS MORFOFUNCIONAIS DO SISTEMA REPRODUTOR ESTUDO DIRIGIDO 3
 CIÊNCIAS MORFOFUNCIONAIS DO SISTEMA REPRODUTOR ESTUDO DIRIGIDO 3 1. (Unir-RO) Sobre a reprodução humana, todos os itens abaixo estão corretos, exceto: a) A fecundação ocorre no útero. b) A espermatogênese
CIÊNCIAS MORFOFUNCIONAIS DO SISTEMA REPRODUTOR ESTUDO DIRIGIDO 3 1. (Unir-RO) Sobre a reprodução humana, todos os itens abaixo estão corretos, exceto: a) A fecundação ocorre no útero. b) A espermatogênese
Excreção. Expulsão de produtos residuais da actividade celular e de outras substâncias presentes em excesso no sangue.
 Sistema Urinário Excreção Expulsão de produtos residuais da actividade celular e de outras substâncias presentes em excesso no sangue. Como eliminar os produtos tóxicos que se formam nas células? Vias
Sistema Urinário Excreção Expulsão de produtos residuais da actividade celular e de outras substâncias presentes em excesso no sangue. Como eliminar os produtos tóxicos que se formam nas células? Vias
Membrana Celular (Membrana Plasmática)
 Partes da Célula: Membrana Celular (Membrana Plasmática) Citoplasma - citosol - organelas (compartimentalização funcional) Núcleo A Membrana Plasmática: estrutura geral O Modelo do Mosaico Fluido A Membrana
Partes da Célula: Membrana Celular (Membrana Plasmática) Citoplasma - citosol - organelas (compartimentalização funcional) Núcleo A Membrana Plasmática: estrutura geral O Modelo do Mosaico Fluido A Membrana
28/04/2010. Espermatozóides são formados e lançados no espaço do tubos. Tubos Seminíferos. Epidídimo. Testículo Células em divisão (mitose x meiose)
 GAMETOGÊNESE - -OVOGÊNESE gustavosimas@gmail.com Tubos Seminíferos Espermatozóides são formados e lançados no espaço do tubos Epidídimo Testículo Células em divisão (mitose x meiose) 1 EPIDÍDIMO (armazena
GAMETOGÊNESE - -OVOGÊNESE gustavosimas@gmail.com Tubos Seminíferos Espermatozóides são formados e lançados no espaço do tubos Epidídimo Testículo Células em divisão (mitose x meiose) 1 EPIDÍDIMO (armazena
S I S T E M A U R I N Á R I O P R O ª L E T I C I A P E D R O S O
 S I S T E M A U R I N Á R I O P R O ª L E T I C I A P E D R O S O SISTEMA URINÁRIO Constituído pelos órgãos uropoéticos: filtrar o sangue e formar a urina. Na urina encontramos ácido úrico, ureia, sódio,
S I S T E M A U R I N Á R I O P R O ª L E T I C I A P E D R O S O SISTEMA URINÁRIO Constituído pelos órgãos uropoéticos: filtrar o sangue e formar a urina. Na urina encontramos ácido úrico, ureia, sódio,
Gametogênese (espermatogênese)
 Gametogênese (espermatogênese) Células germinativas (2n) Epidídimo (armazena espermatozóides) Período germinativo Período de crescimento Mitose 2n Mitoses Crescimento sem divisão celular 2n 2n 2n Túbulo
Gametogênese (espermatogênese) Células germinativas (2n) Epidídimo (armazena espermatozóides) Período germinativo Período de crescimento Mitose 2n Mitoses Crescimento sem divisão celular 2n 2n 2n Túbulo
