Conhecimentos Específicos
|
|
|
- Débora de Mendonça de Almada
- 8 Há anos
- Visualizações:
Transcrição
1 PROCESSO SELETIVO 2018 Edital 42/ NC Prova: 27/11/2017 INSCRIÇÃO TURMA NOME DO CANDIDATO ASSINO DECLARANDO QUE LI E COMPREENDI AS INSTRUÇÕES ABAIXO: CÓDIGO ORDEM INSTRUÇÕES Conhecimentos Específicos 1. Confira, acima, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar a resolução das questões, confira a numeração de todas as páginas. 3. A prova desta fase é composta de 7 questões discursivas de Biologia e 7 questões discursivas de Química. 4. As questões deverão ser resolvidas no caderno de prova e transcritas na folha de versão definitiva, que será distribuída pelo aplicador de prova no momento oportuno. 5. A interpretação das questões é parte do processo de avaliação, não sendo permitidas perguntas aos aplicadores de prova. 6. Ao receber a folha de versão definitiva, examine-a e verifique se o nome impresso nela corresponde ao seu. Caso haja qualquer irregularidade, comunique-a imediatamente ao aplicador de prova. 7. As respostas das questões devem ser transcritas NA ÍNTEGRA na folha de versão definitiva, com caneta preta. Serão consideradas para correção apenas as respostas que constem na folha de versão definitiva. 8. Não será permitido ao candidato: a) Manter em seu poder relógios e aparelhos eletrônicos ou qualquer objeto identificável pelo detector de metais. Tais aparelhos deverão ser desligados e colocados OBRIGATORIAMENTE dentro do saco plástico, que deverá ser acomodado embaixo da carteira ou no chão. É vedado também o porte de armas. b) Usar bonés, gorros, chapéus ou quaisquer outros acessórios que cubram as orelhas. c) Usar fone ou qualquer outro dispositivo no ouvido. O uso de tais dispositivos somente será permitido quando indicado para o atendimento especial. d) Levar líquidos, exceto se a garrafa for transparente e sem rótulo. e) Comunicar-se com outro candidato, usar calculadora e dispositivos similares, livros, anotações, réguas de cálculo, impressos ou qualquer outro material de consulta. f) Portar carteira de documentos/dinheiro ou similares. g) Usar óculos escuros, ressalvados os de grau, quando expressamente por recomendação médica, devendo o candidato, então, respeitar o subitem do Edital. h) Emprestar materiais para realização das provas. Caso alguma dessas exigências seja descumprida, o candidato será excluído do processo. 9. O tempo de resolução das questões, incluindo o tempo para a transcrição na folha de versão definitiva, é de 5 horas. 10. Ao concluir a prova, permaneça em seu lugar e comunique ao aplicador de prova. Aguarde autorização para entregar o caderno de prova, a folha de versão definitiva e a ficha de identificação. 11. Avalie a aplicação da prova: acesse até 15/12/2017 e contribua para a melhoria da qualidade da prova. Biologia e Química DURAÇÃO DESTA PROVA: 5 horas. Não esqueça de avaliar a aplicação da prova!
2 2/11
3 3/11 BIOLOGIA 01 - A hemoglobina falciforme (HbS) é uma variante estrutural da hemoglobina normal, gerada pelo alelo s. Quando o alelo s é herdado de apenas um dos genitores, a criança heterozigota (Ss) é uma portadora assintomática. Quando é herdado dos dois genitores, a criança sofre de anemia falciforme, uma doença grave que comumente leva à morte nos primeiros anos de vida. Portadores do alelo s são resistentes à malária, que frequentemente é letal, especialmente nos primeiros anos de vida. a) Que tipo de seleção natural atua em locais da África com alta incidência de malária e qual genótipo é favorecido? b) O alelo s surge de uma substituição da timina por adenina no gene da cadeia beta da hemoglobina, que resulta na substituição de uma valina por um ácido glutâmico na posição 6 da molécula de beta globina. Cite os processos que ocorrem entre DNA e RNA e entre RNA e proteínas que explicam como o alelo s resulta na formação de uma hemoglobina falciforme (HbS) A raiva é uma zoonose viral que se caracteriza como uma encefalite progressiva aguda e letal. Todos os mamíferos são suscetíveis ao vírus da raiva e, portanto, podem transmiti-la. É considerada um problema de saúde pública, principalmente em países em desenvolvimento. O uso da vacina e do soro são parte do programa de profilaxia da raiva. Produto I: preparado a partir de plasma de equinos hipersensibilizados com vírus rábico. Produto II: preparado a partir de vírus da raiva, cultivados sobre células. Após o crescimento em cultura de células, os vírus são concentrados, inativados e purificados. Considerando os produtos I e II acima descritos, qual deles é um soro e qual é uma vacina? Justifique sua resposta.
4 4/ Em uma região onde cresce o capim-dourado (Syngonanthus nitens), vivem gafanhotos (Rhammatocerus conspersus), cupins (Cornitermes cumulans), pássaros-pretos (Gnorimopsar chopi), andorinhas-de-coleira (Pygochelidon melanoleuca), morcegos (Artibeus cinereus), tamanduás-bandeira (Myrmecophaga tridactyla) e raposinhas (Lycalopex vetulus). a) Com base nas informações apresentadas na questão, liste as populações que constituem a comunidade biológica. b) A raposinha (Lycalopex vetulus) tem uma dieta onívora, mas se alimenta principalmente de insetos. O tamanduá-bandeira é especializado em se alimentar de formigas e cupins. Considerando essas informações, que relações ecológicas interespecíficas podem ser descritas entre a raposinha e as espécies de insetos e entre a raposinha e o tamanduá? c) A região apresentada enunciado desta questão é parte do segundo maior bioma do Brasil, que ocupa cerca de 22% do território nacional. Qual é esse bioma, reconhecido como a savana mais rica em biodiversidade do mundo? 04 - Uma nova espécie de mamífero foi identificada e a análise do cariótipo mostrou a existência de 12 pares de cromossomos homólogos, além de mais dois cromossomos de tamanhos diferentes, identificados como o par sexual. Considere que essa espécie de mamífero tem o mesmo sistema de determinação sexual presente em humanos e responda: a) Quantos cromossomos existem nas células somáticas, nos óvulos e nos espermatozoides dessa nova espécie de mamífero? b) O espécime que teve o cariótipo analisado é macho ou fêmea? Justifique sua resposta. c) Quantas moléculas de DNA cromossômico existem nos gametas dessa espécie de mamífero? Justifique sua resposta.
5 5/ Animais são eucarióticos, multicelulares e heterotróficos, mas nem todos têm tecidos verdadeiros ou cavidade digestória. Embora não esteja presente em todos os animais, muitos possuem, além da cavidade digestória, uma cavidade celomática ocupada pelos órgãos internos. a) Considerando a formação de gástrula, de cavidade digestória e de tecidos verdadeiros, explique por que as esponjas podem ser classificadas como parazoários. b) Os platelmintos são acelomados, de modo que a única cavidade corporal é o tubo digestivo. Explique qual é a estratégia desse grupo de animais para distribuir oxigênio e nutrientes para todas as células do corpo. c) Considerando que nematódeos e anelídeos são, respectivamente, pseudocelomados e celomados, explique o que é e qual a importância do esqueleto hidrostático presente nesses grupos Em relação às proteínas, carboidratos (glicídios) e ácidos nucleicos que são componentes moleculares dos seres vivos, faça o que se pede: a) Cite dois carboidratos com função de reserva energética, um presente em plantas e outro em animais (identificando essa associação). b) Quais são as unidades constituintes fundamentais das proteínas? c) Quais são os dois tipos de ácidos nucleicos encontrados nas células?
6 6/ Texto 1: A dengue é considerada a mais importante arbovirose que afeta o ser humano. Ocorre e dissemina-se especialmente nos países tropicais e subtropicais, onde as condições do meio ambiente favorecem o desenvolvimento e a proliferação do mosquito. No Brasil, a transmissão vem ocorrendo de forma continuada desde (Fonte: Rev. bras. epidemiol. 2008; 11 (4): José Raimundo de Araújo, Efigênia Ferreira e Ferreira e Mauro Henrique Nogueira Guimarães de Abreu.) Texto 2: Os primeiros casos da síndrome de imunodeficiência adquirida (AIDS) ocorreram no Zaire, no Haiti e nos Estados Unidos no final da década de setenta. Em 1992, havia mais de casos de AIDS oficialmente notificados à Organização Mundial de Saúde (OMS) de 190 diferentes países. (Fonte: Rev. Soc. Bras. Med. Trop. vol.26 no.2 Uberaba Apr./June Mark Drew Crosland Guimarães e Euclides Ayres de Castilho. Disponível: < Texto 3: A cólera é uma doença infecciosa aguda caracterizada por uma infecção intestinal grave, podendo levar à morte em decorrência da desidratação. Em março de 1999, ocorreram muitos casos de cólera na cidade portuária de Paranaguá, com dezenas de novos diagnósticos sendo realizados diariamente no início de abril. No total, foram registrados 466 ocorrências e três óbitos. (Fonte: Cad. Saúde Pública, vol. 15, n. 2. Rio de Janeiro Apr./June Afonso Dinis Costa Passos. < a) Para as doenças apresentadas nos textos 1, 2 e 3, indique o agente etiológico e a forma de transmissão. b) Considerando as doenças apresentadas nos textos 1, 2 e 3, qual caracteriza pandemia, qual caracteriza epidemia e qual caracteriza endemia? Justifique sua resposta. Atenção: cada doença deve ser utilizada como exemplo para apenas uma caracterização.
7 7/11 QUÍMICA 01 - Mergulhadores que utilizam cilindros de ar estão sujeitos a sofrer o efeito chamado narcose pelo nitrogênio (ou embriaguez das profundezas ). Devido à elevada pressão parcial do nitrogênio na profundidade das águas durante o mergulho, esse gás inerte se difunde no organismo e atinge o sistema nervoso, causando efeito similar a embriaguez pelo álcool ou narcose por gases anestésicos. A intensidade desse efeito varia de indivíduo para indivíduo, mas em geral começa a surgir por volta de 30 m de profundidade. No mergulho, a cada 10 m de profundidade, aproximadamente 1 atm é acrescida à pressão atmosférica. A composição do ar presente no cilindro é a mesma da atmosférica e pode ser considerada como 80% N2 e 20% O2. Dados: PV = nrt; R = 0,082 L atm K -1 mol -1. a) Um mergulhador está numa profundidade de 30 m. Qual é a pressão total a que esse mergulhador está submetido? b) Calcule a pressão parcial de N2 inspirada pelo mergulhador que utiliza o cilindro a 30 m de profundidade. Mostre o cálculo. c) Considere um mergulhador profissional que possui uma capacidade pulmonar de 6 litros. Calcule a quantidade de matéria de N2 na condição de pulmões totalmente cheios de ar quando o mergulhador está a 30 m de profundidade e à temperatura de 298 K (25 C). Mostre o cálculo O carbonato de sódio é um composto largamente usado para corrigir o ph em diversos sistemas, por exemplo, água de piscina. Na forma comercial, ele é hidratado, o que significa que uma quantidade de água está incluída na estrutura do sólido. Sua fórmula mínima é escrita como Na2CO3.xH2O, em que x indica a razão de mols de água por mol de Na2CO3. O valor de x pode ser determinado através de uma análise gravimétrica. Uma amostra de 2,574 kg do sal hidratado foi aquecida a 125 o C, de modo a remover toda a água de hidratação. Ao término, a massa residual de sólido seco foi de 0,954 kg. Dados: M (g mol -1 ): Na2CO3 = 106; H2O = 18. a) Calcule a quantidade de matéria presente no sal seco. Mostre claramente seus cálculos. b) Calcule a quantidade de matéria de água que foi removida pelo aquecimento. Mostre claramente seus cálculos.
8 8/11 c) Calcule a razão entre os resultados dos itens b) e a). d) Forneça a fórmula mínima do sal hidratado incluindo o valor de x. O texto abaixo é referência para as questões 03 e 04. Molécula-chave da vida é vista por radiotelescópio. A partir de observações feitas pelo Alma, o maior radiotelescópio do mundo, dois grupos internacionais de cientistas detectaram mais uma vez, no espaço, moléculas pré-bióticas um dos ingredientes necessários para a existência de vida. Desta vez, os astrônomos observaram a presença do composto isocianato de metila em imensas nuvens de poeira. O isocianato de metila tem estrutura semelhante à unidade fundamental das proteínas. O isocianato de metila pode ser considerado derivado do ácido isociânico, de fórmula HNCO. (Fonte: < Adaptado.) 03 - Com base no texto: a) Desenhe a estrutura de Lewis do ácido isociânico, indicando as ligações covalentes por traços (-). (Não é necessário indicar os pares de elétrons isolados (não ligantes).) b) Faça uma projeção da estrutura espacial da molécula e indique a sua geometria (linear, angular, piramidal, tetraédrica etc.). c) Qual é o valor de NOX do carbono na molécula de ácido isociânico? Mostre como chegou ao resultado O ácido isociânico (HNCO) é um isômero do ácido ciânico (HOCN). Ambos são considerados ácidos fracos e possuem o mesmo valor de pka = 3,5 e constante ácida Ka = 3, a) Escreva a equação balanceada da reação de neutralização do ácido isociânico por hidróxido de potássio (KOH), incluindo os estados físicos das espécies.
9 9/11 b) Escreva a equação balanceada de equilíbrio da reação de ionização do ácido isociânico em água, incluindo os estados físicos das espécies. c) Considere uma solução aquosa 1 mol L -1 de ácido isociânico. Monte um esquema indicando as concentrações das espécies na situação imediata após dissolução do ácido e na situação de equilíbrio ácido-base conjugada. d) Calcule a concentração de íons H3O + na condição de equilíbrio estabelecido do item anterior. Mostre os cálculos. Dados: 3,2 1, O etileno glicol, ou etano-1,2-diol, é utilizado misturado com água como anticongelante e fluido de arrefecimento em motores resfriados à água nos automóveis. A principal propriedade da mistura com etilieno glicol é o abaixamento da temperatura de fusão e o aumento da temperatura de ebulição da mistura em comparação com a água pura. Na tabela a seguir, são fornecidos dados referentes ao etileno glicol e à água, puros. Etileno glicol Água M / g mol Temperatura de ebulição / C (1 atm) 197,3 100 Temperatura de fusão / C (1 atm) -12,9 0 Constante ebulioscópica Kc / C kg mol -1 2,3 0,52 Dados: T = Kc W; Q = m cp T a) Escreva um texto explicando, em termos de interações químicas, de que maneira o etileno glicol (ou etan-1,2-diol) atua, resultando nas mudanças mencionadas no texto. Que propriedade físico-química é alterada no líquido? b) Considere uma mistura 40% em massa de etileno glicol em água empregada como fluido de arrefecimento para automóveis. Calcule qual é a temperatura de ebulição dessa mistura à pressão de 1 atm. Mostre os cálculos.
10 10/11 c) O etanol, apesar de ter um grupo OH a menos que o etan-1,2-diol, poderia ser utilizado em mistura com água para elevar a temperatura de ebulição dessa mistura? Explique. d) O sistema de arrefecimento do automóvel é baseado na troca de calor entre o motor e o fluido circulante, que absorve calor da superfície e em seguida é resfriado no radiador. No sistema que utiliza a mistura 40% de etileno glicol, cuja capacidade calorífica é cp = 0,82 cal kg -1 C, o volume de circulação de fluido deve ser menor ou maior em comparação com água pura (cp = 1,0 cal kg -1 C), para que a eficiência de arrefecimento seja mantida? Explique Ésteres são as substâncias responsáveis pelos aromas e sabores de diversas frutas. Os ésteres são facilmente hidrolisados na presença de ácido inorgânico, resultando em dois produtos: um que contém um grupo carboxila e outro que contém um grupo hidroxila. No caso das lactonas, que são ésteres cíclicos, essa hidrólise resulta num único composto bi-funcionalizado, oriundo da abertura do anel. No esquema, é mostrada uma lactona que sofre hidrólise e resulta num produto bi-funcionalizado de fórmula molecular C5H10O3. a) Desenhe a estrutura química em grafia bastão do produto da reação. b) Quais são os nomes das funções presentes no produto? c) Forneça o nome do produto segundo as regras da IUPAC.
11 11/ O processo de separação de uma substância é uma etapa de rotina no isolamento e purificação do produto de uma síntese. A extração ácido-base, por exemplo, é uma metodologia bem estabelecida para separação de tolueno e ácido benzoico em éter etílico. Nesse processo, a adição de uma solução aquosa de NaOH transforma seletivamente o ácido benzoico no composto A (esquema mostrado) e, devido à adição de água da solução aquosa, ocorre a formação de duas fases. O composto A solúvel na fase aquosa é separado da fase orgânica, enquanto o tolueno, solúvel na fase orgânica, permanece sem sofrer transformação. A adição de HCl na fase aquosa regenera o ácido benzoico, o qual precipita e pode ser separado. Dados: Constantes Físicas Ácido benzoico Tolueno Éter etílico Água Densidade (g ml -1 ) 1,32 0,87 0,71 1,00 Temperatura de fusão ( o C) (1 atm) Temperatura de ebulição ( o C) (1 atm) a) Desenhe a estrutura química do composto A. b) Na formação de duas fases mencionada no texto, indique qual é a fase superior e qual é a fase inferior. Justifique. c) Elabore um texto sucinto citando qual ou quais técnicas seriam adequadas para separar o ácido benzoico recuperado após adição de HCl. Justifique o uso da(s) técnica(s) citada(s), baseando-se no fundamento da técnica ou das técnicas.
Química 04/12/2011. Caderno de prova. Instruções. Informações gerais. Boa prova!
 04/12/2011 Química Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está na página 13. Não abra o
04/12/2011 Química Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está na página 13. Não abra o
Conhecimentos Específicos
 PROCESSO SELETIVO 2016 07/12/2015 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2016 07/12/2015 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
Conhecimentos Específicos
 PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
PROCESSO SELETIVO 2011
 PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
FUVEST Segunda Fase. Prova de Biologia
 FUVEST 2004 Segunda Fase Prova de Biologia 06/01/2004 Q.01 Uma enzima, extraída da secreção de um órgão abdominal de um cão, foi purificada, dissolvida em uma solução fisiológica com ph 8 e distribuída
FUVEST 2004 Segunda Fase Prova de Biologia 06/01/2004 Q.01 Uma enzima, extraída da secreção de um órgão abdominal de um cão, foi purificada, dissolvida em uma solução fisiológica com ph 8 e distribuída
Conhecimentos Específicos
 PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA
 UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA SELEÇÃO DO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UFBA 2015.2 AVALIAÇÃO ESCRITA DE QUÍMICA CÓDIGO DO CANDIDATO:
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA SELEÇÃO DO PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UFBA 2015.2 AVALIAÇÃO ESCRITA DE QUÍMICA CÓDIGO DO CANDIDATO:
Conhecimentos Específicos
 PROCESSO SELETIVO 2015 Anos 01/12/2014 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2015 Anos 01/12/2014 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
Conhecimentos Específicos
 PROCESSO SELETIVO 2013 10/12/2012 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2013 10/12/2012 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
Conhecimentos Específicos
 PROCESSO SELETIVO 2012 Anos 12/12/2011 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2012 Anos 12/12/2011 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC) /2012.1
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 -- Tel. (085) 3366. 9981 FAX 3366.9978 CEP - 60.450-970 - Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 -- Tel. (085) 3366. 9981 FAX 3366.9978 CEP - 60.450-970 - Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO
Resolução UNIFESP 2015
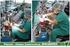 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
SIMULADO DE QUÍMICA INSTRUÇÕES QUÍMICA
 PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
Conhecimentos Específicos
 PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaio, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaio, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
Exercícios de Propriedades Físicas dos Compostos Orgânicos
 Exercícios de Propriedades Físicas dos Compostos Orgânicos Material de apoio do Extensivo 1. Assinale a opção que apresenta o ácido mais forte, considerando que todos se encontram nas mesmas condições
Exercícios de Propriedades Físicas dos Compostos Orgânicos Material de apoio do Extensivo 1. Assinale a opção que apresenta o ácido mais forte, considerando que todos se encontram nas mesmas condições
Conhecimentos Específicos
 PROCESSO SELETIVO 2016 07/12/2015 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2016 07/12/2015 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
QUÍMICA. Questão 01. Questão 02
 Questão 01 QUÍMICA A fenil-etil-amina é considerada um componente responsável pela sensação do bem-estar decorrente da ingestão do chocolate, que contém, também, substâncias inorgânicas. Na tabela a seguir
Questão 01 QUÍMICA A fenil-etil-amina é considerada um componente responsável pela sensação do bem-estar decorrente da ingestão do chocolate, que contém, também, substâncias inorgânicas. Na tabela a seguir
H 2 C OCH 3 H 2 C OH EXERCÍCIOS DE CLASSE
 EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR
EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
CAPA DO CADERNO DE TEXTO PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA
 CAPA DO CADERNO DE TEXTO PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA Processo seletivo para o curso de mestrado em Química. INSTRUÇÕES: Você está recebendo um caderno de provas que contém 11 folhas numeradas
CAPA DO CADERNO DE TEXTO PROVA DE CONHECIMENTOS GERAIS EM QUÍMICA Processo seletivo para o curso de mestrado em Química. INSTRUÇÕES: Você está recebendo um caderno de provas que contém 11 folhas numeradas
PROCESSO SELETIVO 2011
 PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO DE SELEÇÃO 2016/2 ANTES DE RESPONDER ÀS QUESTÕES DESTA PROVA, LEIA ATENTAMENTE ESTAS INSTRUÇÕES:
 Código do candidato PROCESSO DE SELEÇÃO 2016/2 ANTES DE RESPONDER ÀS QUESTÕES DESTA PROVA, LEIA ATENTAMENTE ESTAS INSTRUÇÕES: Escreva o seu código de identificação em todas as folhas de resposta e também
Código do candidato PROCESSO DE SELEÇÃO 2016/2 ANTES DE RESPONDER ÀS QUESTÕES DESTA PROVA, LEIA ATENTAMENTE ESTAS INSTRUÇÕES: Escreva o seu código de identificação em todas as folhas de resposta e também
1º SIMULADO DISCURSIVO IME QUÍMICA
 QUÍMICA Questão 1 A partir do modelo da Repulsão por Pares Eletrônicos da Camada de Valência (RPECV), identifique as geometrias moleculares das espécies químicas abaixo e, com base nelas, classifique cada
QUÍMICA Questão 1 A partir do modelo da Repulsão por Pares Eletrônicos da Camada de Valência (RPECV), identifique as geometrias moleculares das espécies químicas abaixo e, com base nelas, classifique cada
P2 - PROVA DE QUÍMICA GERAL - 18/05/13
 P - PROVA DE QUÍMICA GERAL - 18/05/13 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados: T (K) = T ( C) + 73,15 R = 8,314 J mol -1 K -1
P - PROVA DE QUÍMICA GERAL - 18/05/13 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados: T (K) = T ( C) + 73,15 R = 8,314 J mol -1 K -1
Responda apenas duas (02) questões referentes a área de Química Analítica
 Responda apenas duas (02) questões referentes a área de Química Analítica QUESTÃ 1 Escreva as equações químicas para estabelecimento do equilíbrio químico e calcule o ph das seguintes soluções: a- Solução
Responda apenas duas (02) questões referentes a área de Química Analítica QUESTÃ 1 Escreva as equações químicas para estabelecimento do equilíbrio químico e calcule o ph das seguintes soluções: a- Solução
FCAV/ UNESP. Assunto: Equilíbrio Químico e Auto-ionização da Água. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
FCAV/ UNESP Assunto: Equilíbrio Químico e Auto-ionização da Água Docente: Prof a. Dr a. Luciana M. Saran 1 1. Introdução Existem dois tipos de reações: a) aquelas em que, após determinado tempo, pelo menos
B) Defina a que forma de apresentação do alumínio corresponde cada uma das curvas. Justifique sua resposta.
 Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
PROCESSO SELETIVO 2011
 PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
Ministério da Educação Secretaria de Educação Profissional e Tecnológica Centro Federal de Educação Tecnológica de Química de Nilópolis RJ
 Ministério da Educação Secretaria de Educação Profissional e Tecnológica Centro Federal de Educação Tecnológica de Química de Nilópolis RJ Concurso Público para Provimento de Cargos de Professor de Ensino
Ministério da Educação Secretaria de Educação Profissional e Tecnológica Centro Federal de Educação Tecnológica de Química de Nilópolis RJ Concurso Público para Provimento de Cargos de Professor de Ensino
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO
 1º EM Química B Natália Av. Dissertativa 19/10/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
1º EM Química B Natália Av. Dissertativa 19/10/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
Equilíbrio Químico Folha 2.1 Prof.: João Roberto Mazzei
 01. A cisteína é um aminoácido que contém enxofre e é encontrada na feijoada, devido às proteínas da carne e derivados. A reação de conversão da cisteína em cistina ocorre de acordo com a seguinte equação
01. A cisteína é um aminoácido que contém enxofre e é encontrada na feijoada, devido às proteínas da carne e derivados. A reação de conversão da cisteína em cistina ocorre de acordo com a seguinte equação
Resposta: D Resolução comentada: Ci x Vi = Cf x Vf Ci = 0,5 mol/l Cf = 0,15 mol/l Vf = 250 ml Vi = 0,5 x Vi = 0,15 x 250 Vi = 75 ml.
 Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO
 3º EM Biologia A Josa Av. Dissertativa 25/05/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
3º EM Biologia A Josa Av. Dissertativa 25/05/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
Atividade extra. Questão 1 Cecierj Questão 2 Cecierj Ciências da Natureza e suas Tecnologias Química
 Atividade extra Questão 1 Cecierj - 2013 Desenhe uma esfera de ferro e outra de chumbo que tenham massas iguais. Para isso, considere as seguintes densidades: densidade do ferro = 7,9 g/cm3 densidade do
Atividade extra Questão 1 Cecierj - 2013 Desenhe uma esfera de ferro e outra de chumbo que tenham massas iguais. Para isso, considere as seguintes densidades: densidade do ferro = 7,9 g/cm3 densidade do
Nome do(a) candidato(a):
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós Graduação em Química Concurso para Entrada no Curso de Mestrado/Doutorado do PPGQ UFRN 2016.2 Instruções 1. Não identifique
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós Graduação em Química Concurso para Entrada no Curso de Mestrado/Doutorado do PPGQ UFRN 2016.2 Instruções 1. Não identifique
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DURAÇÃO DA PROVA: 03 HORAS
 DURAÇÃO DA PROVA: 03 HORAS Nº de Inscrição do Candidato PROCESSO SELETIVO 2014/2 - CPS CURSO DE GRADUAÇÃO EM MEDICINA PROVA DISCURSIVA DE QUÍMICA INSTRUÇÕES: 1. Só abra a prova quando autorizado. 2. Veja
DURAÇÃO DA PROVA: 03 HORAS Nº de Inscrição do Candidato PROCESSO SELETIVO 2014/2 - CPS CURSO DE GRADUAÇÃO EM MEDICINA PROVA DISCURSIVA DE QUÍMICA INSTRUÇÕES: 1. Só abra a prova quando autorizado. 2. Veja
Todos tem uma grande importância para o organismo.
 A Química da Vida ÁGUA A água é um composto químico formado por dois átomos de hidrogênio e um de oxigênio. Sua fórmula química é H2O. A água pura não possui cheiro nem cor. Ela pode ser transformada em
A Química da Vida ÁGUA A água é um composto químico formado por dois átomos de hidrogênio e um de oxigênio. Sua fórmula química é H2O. A água pura não possui cheiro nem cor. Ela pode ser transformada em
QUÍMICA. Qual será o efeito na velocidade desta reação no caso de triplicarmos a concentração molar de ácido clorídrico?
 NÚMER DE INSRIÇÃ! - QUÍMIA QUESTÃ 11 Ao expressarmos uma equação de velocidade para a reação, Al(H) 3 + 3 Hl All 3 + 3H 2 Qual será o efeito na velocidade desta reação no caso de triplicarmos a concentração
NÚMER DE INSRIÇÃ! - QUÍMIA QUESTÃ 11 Ao expressarmos uma equação de velocidade para a reação, Al(H) 3 + 3 Hl All 3 + 3H 2 Qual será o efeito na velocidade desta reação no caso de triplicarmos a concentração
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III
 22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
22 GABARITO 1 1º DIA 2º Processo Seletivo/2004 44. Com relação aos compostos representados abaixo, é INCORRETO afirmar que: N(CH 2 CH 3 ) 3 CH 3 CO 2 H ClCH 2 CO 2 H I II III a) o composto III é um ácido
Conhecimentos Específicos
 PROCESSO SELETIVO 2014 02/12/2013 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2014 02/12/2013 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Prova de Química Analítica
 CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número
CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Conhecimentos Específicos
 PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
PROCESSO SELETIVO 2010 13/12/2009 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. Conhecimentos Específicos 2. Aguarde autorização para abrir o caderno
Conhecimentos Específicos
 PROCESSO SELETIVO 2015 Anos 01/12/2014 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2015 Anos 01/12/2014 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
2 ª Fase Exame Discursivo
 02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
02/12/2007 2 ª Fase Exame Discursivo química Caderno de prova Este caderno, com doze páginas numeradas seqüencialmente, contém dez questões de Química. A tabela periódica está na página 12. Não abra o
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
CONCURSO DE ADMISSÃO AO CURSO DE FORMAÇÃO E GRADUAÇÃO QUÍMICA FOLHA DE QUESTÕES
 CONCURSO DE ADMISSÃO AO CURSO DE FORMAÇÃO E GRADUAÇÃO QUÍMICA FOLHA DE QUESTÕES 2007 1 a QUESTÃO Valor: 1,0 A A configuração eletrônica de um átomo X é [ X ]. Determine: Z a) os valores de Z e de n, para
CONCURSO DE ADMISSÃO AO CURSO DE FORMAÇÃO E GRADUAÇÃO QUÍMICA FOLHA DE QUESTÕES 2007 1 a QUESTÃO Valor: 1,0 A A configuração eletrônica de um átomo X é [ X ]. Determine: Z a) os valores de Z e de n, para
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos
 Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
Avaliação da Capacidade para Frequência do Ensino Superior de Candidatos Maiores de 23 anos 2016 QUÍMICA Conteúdos Programáticos MATERIAIS - Origem - Constituição e composição dos materiais: - Constituição
PROCESSO SELETIVO 2011
 PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
PROCESSO SELETIVO 2011 Anos 06/12/2010 INSTRUÇÕES 1. Confira, abaixo, o seu número de inscrição, turma e nome. Assine no local indicado. 2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar
Tabela Periódica dos Elementos
 1º EM Química B Priscila Av. Trimestral 10/06/15 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
1º EM Química B Priscila Av. Trimestral 10/06/15 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de Prova de Conhecimentos Gerais em Química. Caderno de Questões
 Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de 2013 Prova de Conhecimentos Gerais em Química Caderno de Questões Nome do candidato: Instruções: Escreva seu nome de forma
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de 2013 Prova de Conhecimentos Gerais em Química Caderno de Questões Nome do candidato: Instruções: Escreva seu nome de forma
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
UNIDADE: DATA: 03 / 12 / 2015 III ETAPA AVALIAÇÃO ESPECIAL DE INTRODUÇÃO À QUÍMICA 9.º ANO/EF
 SOCIEDADE MINEIRA DE CULTURA Mantenedora da PUC Minas e do COLÉGIO SANTA MARIA UNIDADE: DATA: 03 / 2 / 205 III ETAPA AVALIAÇÃO ESPECIAL DE INTRODUÇÃO À QUÍMICA 9.º ANO/EF ALUNO(A): N.º: TURMA: PROFESSOR(A):
SOCIEDADE MINEIRA DE CULTURA Mantenedora da PUC Minas e do COLÉGIO SANTA MARIA UNIDADE: DATA: 03 / 2 / 205 III ETAPA AVALIAÇÃO ESPECIAL DE INTRODUÇÃO À QUÍMICA 9.º ANO/EF ALUNO(A): N.º: TURMA: PROFESSOR(A):
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
DESAFIO EM QUÍMICA 24/09/16
 DESAFI EM QUÍMICA 24/09/16 Nome: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPRTANTE: 1) Explique e justifique a resolução de todas questões e derivações. As respostas
DESAFI EM QUÍMICA 24/09/16 Nome: Assinatura: Questão Valor Grau 1 a 2,0 2 a 2,0 3 a 2,0 4 a 2,0 5 a 2,0 Total 10,0 IMPRTANTE: 1) Explique e justifique a resolução de todas questões e derivações. As respostas
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
O esquema abaixo representa as principais relações alimentares entre espécies que vivem num lago de uma região equatorial.
 Q.01 O esquema abaixo representa as principais relações alimentares entre espécies que vivem num lago de uma região equatorial. Com relação a esse ambiente: a) Indique os consumidores primários. b) Dentre
Q.01 O esquema abaixo representa as principais relações alimentares entre espécies que vivem num lago de uma região equatorial. Com relação a esse ambiente: a) Indique os consumidores primários. b) Dentre
QUÍMICA. a) linha horizontal. b) órbita. c) família. d) série. e) camada de valência.
 13 QUÍMICA A posição dos elementos na Tabela Periódica permite prever as fórmulas das substâncias que contêm esses elementos e os tipos de ligação apropriados a essas substâncias. Na Tabela Periódica atual,
13 QUÍMICA A posição dos elementos na Tabela Periódica permite prever as fórmulas das substâncias que contêm esses elementos e os tipos de ligação apropriados a essas substâncias. Na Tabela Periódica atual,
t RESOLUÇÃO COMECE DO BÁSICO
 t RESOLUÇÃO COMECE DO BÁSICO - o processo I sugere a evaporação (transformação física) dos componentes do medicamento. - a decomposição das substâncias (transformação química) que constituem o princípio
t RESOLUÇÃO COMECE DO BÁSICO - o processo I sugere a evaporação (transformação física) dos componentes do medicamento. - a decomposição das substâncias (transformação química) que constituem o princípio
O N N. Com relação à estrutura do Kevlar, apresentada acima, faça o que se pede:
 PRCESS SELETIV/2005 3 DIA CADER 0 1 QUÍMICA QUESTÕES DE 06 A 10 06. polímero denominado Kevlar, cuja fórmula estrutural é mostrada abaixo, chega a ser, por unidade de massa, cinco vezes mais resistente
PRCESS SELETIV/2005 3 DIA CADER 0 1 QUÍMICA QUESTÕES DE 06 A 10 06. polímero denominado Kevlar, cuja fórmula estrutural é mostrada abaixo, chega a ser, por unidade de massa, cinco vezes mais resistente
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 3
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
FUVEST Segunda Fase. Química 06/01/2003
 FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA. Exame de Seleção para o Mestrado em Química-2011.
 UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
SIMULADO EXTENSIVO QUÍMICA
 P R É - V E S T I B U L A R 04.09 QUÍMICA QUESTÃ 49 jornal Folha de São Paulo publicou, em 19/06/07, matéria sobre empresas norte-americanas que estavam falsificando suco de laranja. produto, vendido como
P R É - V E S T I B U L A R 04.09 QUÍMICA QUESTÃ 49 jornal Folha de São Paulo publicou, em 19/06/07, matéria sobre empresas norte-americanas que estavam falsificando suco de laranja. produto, vendido como
Matemática e Redação. Setor de Educação Profissional Tecnológica Teste de Seleção Curso Técnico em Petróleo e Gás Integrado ao Ensino Médio
 Setor de Educação Profissional Tecnológica Teste de Seleção 2012 Edital N 13/2011 NC Prova: 11/12/2011 Anos Curso Técnico em Petróleo e Gás Integrado ao Ensino Médio INSTRUÇÕES 1. Confira, abaixo, o seu
Setor de Educação Profissional Tecnológica Teste de Seleção 2012 Edital N 13/2011 NC Prova: 11/12/2011 Anos Curso Técnico em Petróleo e Gás Integrado ao Ensino Médio INSTRUÇÕES 1. Confira, abaixo, o seu
Prova de seleção ao Mestrado e Doutorado em Química Programa de Pós-graduação Multicêntrico em Química de Minas Gerais PPGMQMG Edital 1/2016
 PPGMQMG Edital 1/2016 Orientações gerais Somente identifique sua prova com o número de inscrição (não coloque seu nome); Não é permitida consulta bibliográfica; Realizar a prova com caneta azul ou preta;
PPGMQMG Edital 1/2016 Orientações gerais Somente identifique sua prova com o número de inscrição (não coloque seu nome); Não é permitida consulta bibliográfica; Realizar a prova com caneta azul ou preta;
Equilíbrio Químico Folha 03 Prof.: João Roberto Mazzei
 01. (UERJ 2006) Numa aula experimental, foram preparadas quatro soluções eletrolíticas com a mesma concentração de soluto e as mesmas condições adequadas para o estabelecimento de um estado de equilíbrio
01. (UERJ 2006) Numa aula experimental, foram preparadas quatro soluções eletrolíticas com a mesma concentração de soluto e as mesmas condições adequadas para o estabelecimento de um estado de equilíbrio
P2 - PROVA DE QUÍMICA GERAL - 27/10/12
 P2 - PROVA DE QUÍMICA GERAL - 27/10/12 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
P2 - PROVA DE QUÍMICA GERAL - 27/10/12 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados: T (K) = T ( C) + 273,15 R = 8,314
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao longo das duas horas de duração do experimento.
 Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES
 MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
UFSC. Química (Amarela) , temos 10 mol de Mg, ou seja, 243 g de Mg. Resposta: = 98. Comentário
 Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Boa prova! 05/12/2010
 05/12/2010 biologia Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Biologia. Não abra o caderno antes de receber autorização. Instruções 1. Verifique
05/12/2010 biologia Caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Biologia. Não abra o caderno antes de receber autorização. Instruções 1. Verifique
Exercícios Equilíbrio Iônico
 Exercícios Equilíbrio Iônico 1. O ph tem uma importância significativa nos processos de laboratório, da indústria e dos organismos vivos. Ele pode ser avaliado de forma simples, usando-se substâncias chamadas
Exercícios Equilíbrio Iônico 1. O ph tem uma importância significativa nos processos de laboratório, da indústria e dos organismos vivos. Ele pode ser avaliado de forma simples, usando-se substâncias chamadas
UFU 2008/2-1ª FASE. 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina).
 UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
P1 - PROVA DE QUÍMICA GERAL 09/04/11
 P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico
 PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
COMISSÃO PERMANENTE DE SELEÇÃO COPESE PRÓ-REITORIA DE GRADUAÇÃO PROGRAD PISM III- TRIÊNIO PROVA DE QUÍMICA
 Questão 1: O butano é um gás usado, por exemplo, como combustível em isqueiros, onde, sob pressão, é armazenado como líquido. Na presença de catalisador, o equilíbrio é estabelecido entre os isômeros butano
Questão 1: O butano é um gás usado, por exemplo, como combustível em isqueiros, onde, sob pressão, é armazenado como líquido. Na presença de catalisador, o equilíbrio é estabelecido entre os isômeros butano
P4 - PROVA DE QUÍMICA GERAL 05/12/12
 P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
SÓ ABRA QUANDO AUTORIZADO.
 UNIVERSIDADE FEDERAL DE MINAS GERAIS BIOLOGIA 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco questões, constituídas de itens e
UNIVERSIDADE FEDERAL DE MINAS GERAIS BIOLOGIA 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco questões, constituídas de itens e
Número atômico de A = número atômico de B = 18
 61 e QUÍMICA O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui 18 prótons, e isóbaro do elemento químico C, que tem 16 nêutrons Com base nessas informações, pode-se afirmar
61 e QUÍMICA O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui 18 prótons, e isóbaro do elemento químico C, que tem 16 nêutrons Com base nessas informações, pode-se afirmar
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, ). As descobertas de compostos como o XePtF 6
 20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
Associação Brasileira de Química XIII Maratona Cearense de Química a Fase 1 o Ano 18/08/10. Experiência
 2 a Fase 1 o Ano 18/08/10 Material e Reagentes: Experiência Açúcar (sacarose) Bicarbonato de sódio Álcool etílico Recipiente com graduação (proveta ou seringa) Almofariz com pistilo Fósforo ou isqueiro
2 a Fase 1 o Ano 18/08/10 Material e Reagentes: Experiência Açúcar (sacarose) Bicarbonato de sódio Álcool etílico Recipiente com graduação (proveta ou seringa) Almofariz com pistilo Fósforo ou isqueiro
BIOQUÍMICA CELULAR. Ramo das ciências naturais que estuda a química da vida. Prof. Adaianne L. Teixeira
 BIOQUÍMICA CELULAR Ramo das ciências naturais que estuda a química da vida Prof. Adaianne L. Teixeira Principais elementos químicos dos seres vivos CARBONO (C) (Essencial) HIDROGÊNIO (H) OXIGÊNIO (O) NITROGÊNIO
BIOQUÍMICA CELULAR Ramo das ciências naturais que estuda a química da vida Prof. Adaianne L. Teixeira Principais elementos químicos dos seres vivos CARBONO (C) (Essencial) HIDROGÊNIO (H) OXIGÊNIO (O) NITROGÊNIO
Esta avaliação é composta de 13 questões, das quais você deverá escolher apenas 10 para responder.
 2º EM Biologia B Marli Av. Trimestral 30/10/15 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta prova
2º EM Biologia B Marli Av. Trimestral 30/10/15 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta prova
Sumário. 1 Introdução: matéria e medidas 1. 2 Átomos, moléculas e íons Estequiometria: cálculos com fórmulas e equações químicas 67
 Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Prefácio 1 Introdução: matéria e medidas 1 1.1 O estudo da química 1 1.2 Classificações da matéria 3 1.3 Propriedades da matéria 8 1.4 Unidades de medida 12 1.5 Incerteza na medida 18 1.6 Análise dimensional
Observe a equação química que corresponde ao processo de obtenção descrito no texto.
 Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
FORMULÁRIO DE DIVULGAÇÃO DO CONTEÚDO DA PROVA FINAL E RECUPERAÇÃO FINAL
 FORMULÁRIO DE DIVULGAÇÃO DO CONTEÚDO DA PROVA FINAL E RECUPERAÇÃO FINAL A) SÉRIE/ANO: 2º Ano Médio B) DISCIPLINA: Química - Enio C) CONTEÚDO A SER EXIGIDO/ORIENTAÇÃO PARA O ESTUDO: SOLUÇÕES: Coeficiente
FORMULÁRIO DE DIVULGAÇÃO DO CONTEÚDO DA PROVA FINAL E RECUPERAÇÃO FINAL A) SÉRIE/ANO: 2º Ano Médio B) DISCIPLINA: Química - Enio C) CONTEÚDO A SER EXIGIDO/ORIENTAÇÃO PARA O ESTUDO: SOLUÇÕES: Coeficiente
PAG Química Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é
 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
O gráfico abaixo representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras, I, II e III.
 Educador: Cristina Disciplina:Química Data: _/ /2011 Estudante: 3ª Série Questão 1 O gráfico abaixo representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras, I, II e III.
Educador: Cristina Disciplina:Química Data: _/ /2011 Estudante: 3ª Série Questão 1 O gráfico abaixo representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras, I, II e III.
