ESPECTROMETRIA DE MASSAS
|
|
|
- Airton Faro Dinis
- 9 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL FLUMINENSE INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DISCIPLINA: INORGÂNICA AVANÇADA II ESPECTROMETRIA DE MASSAS Prof. Fabio da Silva Miranda Sala GQI 308, Ramal 2170
2 Espectrometria de massas A espectrometria de massas não é uma forma de espectroscopia, pois não envolve a interação da luz com a matéria, no entanto é uma ferramenta muito importante na identificação de compostos desconhecidos. O princípio básico da espectrometria de massas (MS) é gerar íons de compostos inorgânicos ou orgânicos pelo método mais apropriado, separar esses íons pela sua razão massa/carga (m/z) e detectar qualitativamente e quantitativamente a abundância de seus respectivos m/z. 2
3 Espectrometria de massas O analito pode ser ionizado termicamente, campo elétrico ou por impacto de elétrons, íons ou fótons com alta energia. Os íons podem ser átomos ionizados, clusters, moléculas e seus fragmentos e associações. A separação dos íons é efeito de campos elétricos ou magnéticos aplicados estaticamente ou dinamicamente. 3
4 Os principais domínios da espectrometria de massas 4
5 Princípios básicos da Espectrometria de Massas A espectrometria de massas requer que a molécula de interesse esteja carregada, permitindo que os íons sejam separado pela razão massa/carga. Existem vários métodos para separar íons carregados, um desses métodos é baseado na deflexão de uma partícula por um campo magnético aplicado. Se um íon de massa, m, e carga, z, é acelerado por uma voltagem fixa, V, então cada molécula irá adquirir uma velocidade, v, e a energia cinética será dada por: zv = 1 2 mv2 5
6 Princípios básicos da Espectrometria de Massas Quando esses íons são submetidos a um campo magnético, B, as suas trajetórias se torna curva com raio, r, obedecendo a seguinte equação: Bzv = mv2 r A combinação das duas equações resulta em uma expressão que relaciona o campo magnético aplicado com a razão massa/carga: m z = B2 r 2 2V Ao se variar o campo magnético é possível selecionar quais íons realizam uma curvatura que permita atingir o detector. O espectro produzido é portanto, um gráfico do número de íons detectados versus a razão massa/carga. 6
7 Espectrômetro de massas Burrows, Holman, Parsons, Pilling, Price, Chemistry 3, Oxford, 2009
8 Espectrômetro de massas Componentes básicos de um espectrômetro de massas 8
9 Métodos de ionização Impacto de elétrons (EI) Um dos métodos mais comuns de ionização é feito por impacto de elétrons (EI), onde um feixe de elétrons acelerados (normalmente utiliza-se uma lâmpada de filamento de tungstênio aquecida) bombardeia a molécula causando a ionização. As moléculas ionizadas são então aceleradas dentro da parte de detecção do espectrômetro. M + e M e Idealmente as moléculas irão apenas sofrer uma ionização, mas é possível que ionizações múltiplas ocorram: M + e M n+. + n + 1 e 9
10 Espectroscopia de massas (ionização e métodos de detecção) Seção magnética de um espectrômetro de massas. Os fragmentos moleculares são defletidos de acordo com a razão massa/carga permitindo uma separação no detector. 10
11 Métodos de ionização Bombardeamento com átomos rápidos (FAB) Em algumas situações ao aquecer a amostra e bombardear com elétrons resulta em na quebra da molécula em pequenos fragmentos ao invés de apenas ionizar a molécula. Isto é muito comum em moléculas que contém ligações relativamente fracas, como em compostos organometálicos. Nesses casos é preferível utilizar a técnica de bombardeamento com átomos rápidos, FAB (fast atom bombardment). Neste método o composto de interesse é dissolvido em uma matriz nãovolátil como glicerol e bombardeada com átomo de argônio ou xenônio ionizados. 11
12 Métodos de ionização Ionização química Nesse caso moléculas de gases de baixo peso molecular colidem com íons, resultando na geração de íons gasosos de baixa energia cinética (AH + ). Que são usados para ionizar outras moléculas neutras. Gases como metano e amônia são comumente utilizados e formam as espécies CH + 5 e NH 4+. AH + + M A + MH + Os picos de massa observados sobre essas condições correspondem ao íon-molecular + H, ou seja m/z = [M+1] 12
13 Métodos de ionização elétronspray (ES Essa é a técnica que se tornou a escolha da maioria dos laboratórios de espectrometria de massas. A solução de uma amostra é submetida a um processo de formação de spray através de um capilar com um potencial de milhares de volts. Isto produz um aeorosol com gotículas carregadas da solução. A região onde as gotículas se encontram tem pressão atmosférica, porém está separada do alto-vácuo da câmara do espectrômetro por um pequeno orifício. Devido a diferença de pressão as gotas são lançadas para dentro e as gotículas se tornam cada vez menores. O íons resultantes são acelerados em direção ao detector. 13
14 Espectrometria de massas ESI 14
15 Espectrometria de massas ESI quadrupolo 15
16 Espectrometria de massas - ESI 1) Injeção 2) Capilar carregado gerador de spray 3) orifício interno 4) Prato coletor 5) Quadrupolo 6) Segundo analisador (TOF) 7) detector 16
17 Espectroscopia de massas - TOF Espectrômetro de massas com TOF (time-of-flight). Os fragmentos de massas são acelerados com velocidades diferentes pela diferença de potencial e chegam com diferentes tempos ao detector. 17
18 Espectro de massas Um espectro de massas típico mostrando o número íons de uma determinada razão massa/carga (m/z). O pico em é o íon molecular formado pela perda de um elétron original da molécula. Os demais picos são provenientes da fragmentação do íon molecular. 18
19 Interpretação do espectro de massas - Medidas de massas com alta resolução Como diferenciar CO e N 2 por espectrometria de massas? Ambos tem massa molecular 28 amu baseando-se nas massas dos elementos: C = 12; N = 14 e O = 16; dessa maneira não é possível distinguir uma molécula da outra. No entanto, se for utilizado a massa dos elementos temos que as massas moleculares relativas são 27,9994 para o CO e 28,01348 para o N 2. Dessa maneira essas duas moléculas podem ser distinguidas em um espectrômetro de massas de alta resolução. 19
20 Interpretação do espectro de massas Padrões isotópicos 20
21 Interpretação do espectro de massas Padrões isotópicos Espectro de massas de uma amostra que contém mercúrio mostrando a composição isotópica dos átomos do fragmento. 21
22 Interpretação do espectro de massas Padrões isotópicos Espectro de massas do brometo de butila. A presença de bromo é indicada pela picos com razão 1:1 separados por unidade de massa. Isto surge pela proporção 1:1 de isótopos: 79 Br e 81 Br na amostra. 22
23 Interpretação do espectro de massas Padrões isotópicos mais complexos Espectro de massas do diclorobenzeno. A razão 3:1 de 35 Cl: 37 Cl é responsável pelo padrão de distribuição isotópica. 23
24 Interpretação do espectro de massas Padrões isotópicos mais complexos Padrão isotópico do íon Ru 3+. As marcações em vermelho indicam os valores previstos estaticamente. 24
25 Interpretação do espectro de massas Padrões de fragmentação A estrutura do Ru 3 (CO) 12 possui 3 átomos de rutênio em um triângulo com 4 ligantes CO ligados a cada rutênio. O espectros mostra o padrão isotópico para o Ru 3 + repetido-se com as perdas da molécula de CO. 25
26 Interpretação do espectro de massas Padrões de fragmentação Expansão do espectro de massas do Ru 3 (CO) 12 entre m/z 155 e 180 mostrando uma sequência de íons triplamente carregados. Espaçados dentro de uma padrão regular. 26
27 SiF +, SiF 3 + e SiF(C 6 F 5 ) + 27 Interpretação do espectro de massas Rearranjos É muito comum no espectro de massa de compostos organometálicos e moléculas orgânicas encontrar picos que não podem ser atribuídos a fragmentos do compostos sob investigação. Tais espécies podem ser atribuídas a reações que ocorrem dentro do espectrômetro de massas. Existem várias situações em que os rearranjos podem ocorrer. Complexos metálicos contendo ligantes orgânicos halogenados frequentemente realizam rearranjos resultando na formação de ligações M-Cl. Exemplo: O espectro de massa do Si(C 6 F 5 ) 4 na condição de impacto de elétrons mostra entre outros picos os sinais referentes a:
28 Padrão de fragmentação como impressão digital para identificação molecular Cromatrograma gasoso de uma amostra de urina de cavalo suspeita de conter uma substância ilegal. O espectro de massas da fração com tempo de retenção 7,73 min revela a presença do estimulante ilegal Niketamida. 28
29 Software para previsão de padrão isotópico 29
30 Software para previsão de padrão isotópico 30
31 Resumo MS essencialmente mede de íons moleculares ou fragmentos moleculares; A fórmula molecular pode ser obtida frequentemente pelo conhecimento da massa do íon molecular; Padrões isotópicos são úteis para a interpretação espectral; Fragmentação pode ser utilizada para determinar a estrutura molecular, no entanto a principal aplicação é uso como impressão digital molecular para autenticação de amostras; Espectrometria de massas é uma das técnicas analíticas mais sensíveis, capaz de realizar determinações no nível de traços. 31
32 Possíveis problemas e limitações 32
33 Exercício 1 Atribua na medida do possível os picos no espectro de massas abaixo referente ao composto [Fe(acac) 3 ], onde acac = CH 3 COCHCOCH 3- : 33
34 Exercício 2 Identifique baseado no espectro de massas o produto volátil da reação de tetracloreto de estanho com trietilalumínio. 34
35 Exercício 3 O espectro de massas do BCl 3 é mostrado abaixo. Explique o espectro assumindo a seguinte abundância isotópica: 10 B 20%; 11 B 80%; 35 Cl 75%; 37 Cl 25% 35
36 Exercício 4 Explique o padrão isotópico do espectro de massas do ClBr 3 que consiste de 5 picos separados por 2 m u. Espectro de massa do ClBr 3 36
37 Exercício 5 Parte do espectro de massas do composto [Mo(η 6 -C 6 H 6 )(CO) 2 PMe 3 ] é mostrada abaixo. Faça a atribuição dos principais picos. 37
Espectrometria de Massas
 Introdução Mede as massas e abundâncias dos íons na fase gasosa. É bastante sensível e fornece informações qualitativas e quantitativas. É possível distinguir substâncias diferentes, que apresentam o mesmo
Introdução Mede as massas e abundâncias dos íons na fase gasosa. É bastante sensível e fornece informações qualitativas e quantitativas. É possível distinguir substâncias diferentes, que apresentam o mesmo
INTRODUÇÃO A ESPECTROMETRIA DE MASSAS
 INTRODUÇÃO A ESPECTROMETRIA DE MASSAS Espectrometria de massas: técnica que separa e mede, em fase gasosa, a relação m/z (massa/carga) de íons produzidos por algum método de ionização. Qual o princípio
INTRODUÇÃO A ESPECTROMETRIA DE MASSAS Espectrometria de massas: técnica que separa e mede, em fase gasosa, a relação m/z (massa/carga) de íons produzidos por algum método de ionização. Qual o princípio
Análise proteômica e metabolômica por espectrometria de massas Analisadores de massas
 Análise proteômica e metabolômica por espectrometria de massas Analisadores de massas Prof. Alexandre K. Tashima Departamento de Bioquímica EPM/UNIFESP Bibliografia Mass Spectrometry, a Textbook. Ju rgen
Análise proteômica e metabolômica por espectrometria de massas Analisadores de massas Prof. Alexandre K. Tashima Departamento de Bioquímica EPM/UNIFESP Bibliografia Mass Spectrometry, a Textbook. Ju rgen
Aplicações e características da EM
 Aplicações e características da EM Algumas aplicações da EM: (a) determinação de massa molecular com elevada exatidão, inclusive de biomoléculas e materiais poliméricos; (b) identificação de substancias,
Aplicações e características da EM Algumas aplicações da EM: (a) determinação de massa molecular com elevada exatidão, inclusive de biomoléculas e materiais poliméricos; (b) identificação de substancias,
INTRODUÇÃO A ESPECTROMETRIA DE MASSAS INTRODUÇÃO A ESPECTROMETRIA DE MASSAS. Aplicações
 INTRODUÇÃO A ESPECTROMETRIA DE MASSAS Pioneiros da espectrometria de massas Espectrometria de massas: técnica analítica que separa e mede a relação massa:carga (m/z) de íons, em fase gasosa, produzidos
INTRODUÇÃO A ESPECTROMETRIA DE MASSAS Pioneiros da espectrometria de massas Espectrometria de massas: técnica analítica que separa e mede a relação massa:carga (m/z) de íons, em fase gasosa, produzidos
UNIVERSIDADE FEDERAL DE PELOTAS INSPEÇÃO DE LEITE E DERIVADOS ESPECTROSCOPIA DENISE HENTGES PELOTAS, 2008.
 UNIVERSIDADE FEDERAL DE PELOTAS INSPEÇÃO DE LEITE E DERIVADOS ESPECTROSCOPIA DENISE HENTGES PELOTAS, 2008. Espectroscopia de Infravermelho (IR) Issac Newton Feixe de luz; A luz violeta é a que mais é deslocada
UNIVERSIDADE FEDERAL DE PELOTAS INSPEÇÃO DE LEITE E DERIVADOS ESPECTROSCOPIA DENISE HENTGES PELOTAS, 2008. Espectroscopia de Infravermelho (IR) Issac Newton Feixe de luz; A luz violeta é a que mais é deslocada
3 Espectrometria de Massa
 3 Espectrometria de Massa 3.1 Princípios A espectrometria de massa determina as razões massa/carga de íons emitidos quando uma amostra é excitada por algum agente ionizante. Os agentes ionizantes podem
3 Espectrometria de Massa 3.1 Princípios A espectrometria de massa determina as razões massa/carga de íons emitidos quando uma amostra é excitada por algum agente ionizante. Os agentes ionizantes podem
Como funciona a espectrometria de massas acoplada à cromatografia?
 Espectrometria de Massas: Introdução Sistemas de vácuo Fontes de Ionização Analisadores de massa Resolução e Exatidão de Massa Detectores MS/MS Álvaro José dos Santos Neto O que é a espectrometria de massas?
Espectrometria de Massas: Introdução Sistemas de vácuo Fontes de Ionização Analisadores de massa Resolução e Exatidão de Massa Detectores MS/MS Álvaro José dos Santos Neto O que é a espectrometria de massas?
Aspectos fundamentais de EM Ionizar é preciso: (a) ionização da amostra direta ou indiretamente; (b) método tradicional: ionização por impacto de
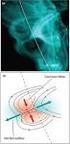 Aspectos fundamentais de EM Ionizar é preciso: (a) ionização da amostra direta ou indiretamente; (b) método tradicional: ionização por impacto de elétrons resultando na formação de M seguida de fragmentação
Aspectos fundamentais de EM Ionizar é preciso: (a) ionização da amostra direta ou indiretamente; (b) método tradicional: ionização por impacto de elétrons resultando na formação de M seguida de fragmentação
Estratégias para interpretação de espectros de massas
 Estratégias para interpretação de espectros de massas Composição elementar dos íons a partir de medidas exatas de massas. Resolução em espectrometria de massas. Padrões isotópicos. Etapas na identificação
Estratégias para interpretação de espectros de massas Composição elementar dos íons a partir de medidas exatas de massas. Resolução em espectrometria de massas. Padrões isotópicos. Etapas na identificação
Aspectos fundamentais de EM Ionizar é preciso: (a) ionização da amostra direta ou indiretamente; (b) método tradicional: ionização por impacto de
 Aspectos fundamentais de EM Ionizar é preciso: (a) ionização da amostra direta ou indiretamente; (b) método tradicional: ionização por impacto de elétrons resultando na formação de M seguida de fragmentação
Aspectos fundamentais de EM Ionizar é preciso: (a) ionização da amostra direta ou indiretamente; (b) método tradicional: ionização por impacto de elétrons resultando na formação de M seguida de fragmentação
Detectores Espectrométricos em Cromatografia Gasosa de Alta Resolução
 Detectores Espectrométricos em Cromatografia Gasosa de Alta Resolução Emissão Atômica Absorção no Infravermelho Espectrometria de Massas Detector Espectrométrico de Massas (MSD) Acoplamento de GC com um
Detectores Espectrométricos em Cromatografia Gasosa de Alta Resolução Emissão Atômica Absorção no Infravermelho Espectrometria de Massas Detector Espectrométrico de Massas (MSD) Acoplamento de GC com um
Espectrometria de massas
 Espectrometria de massas Bibliografia: Pavia, D.L. et al., Introdução à Espectroscopia, Ed. Cengage Learning, 2010. Bruice, P.Y. et al., Química Orgânica, Ed. Prendice Hall, 2004. Espectrometria de Massas
Espectrometria de massas Bibliografia: Pavia, D.L. et al., Introdução à Espectroscopia, Ed. Cengage Learning, 2010. Bruice, P.Y. et al., Química Orgânica, Ed. Prendice Hall, 2004. Espectrometria de Massas
Fonte de plasma - DCP
 Fonte de plasma - DCP Dois anodos de grafite e um catodo de tungstênio, em forma de Y invertido Plasma é formado, colocando-se momentaneamente os eletrodos em contato Ocorre ionização, gerando corrente
Fonte de plasma - DCP Dois anodos de grafite e um catodo de tungstênio, em forma de Y invertido Plasma é formado, colocando-se momentaneamente os eletrodos em contato Ocorre ionização, gerando corrente
Massa Atômica e Molecular, Mol
 Capítulo Massa Atômica e Molecular, Mol Leia o texto seguinte, referente ao espectrógrafo de massa, e a seguir resolva os exercícios de a 6. É um aparelho capaz de fornecer a composição isotópica qualitativa
Capítulo Massa Atômica e Molecular, Mol Leia o texto seguinte, referente ao espectrógrafo de massa, e a seguir resolva os exercícios de a 6. É um aparelho capaz de fornecer a composição isotópica qualitativa
Espectrometria de Massas
 Componentes de um Espectrômetro de Massas Alto vácuo (10 5 a 10 8 mbar Inlet Fonte de Íons Analisador Detector CG HPLC Bomba Seringa EI CI MALDI ESI APCI Quadrupolo TOF Ion Trap FT-ICR Setor Magnético
Componentes de um Espectrômetro de Massas Alto vácuo (10 5 a 10 8 mbar Inlet Fonte de Íons Analisador Detector CG HPLC Bomba Seringa EI CI MALDI ESI APCI Quadrupolo TOF Ion Trap FT-ICR Setor Magnético
Quantização da Carga, Luz e Energia
 Quantização da Carga, Luz e Energia Prof. Jaime Urban 1 / 13 Quantização da Carga Elétrica Primeiras medidas de e e de e/m Michael Faraday (1791-1867) Condução da eletricidade em ĺıquidos - Lei da eletrólise
Quantização da Carga, Luz e Energia Prof. Jaime Urban 1 / 13 Quantização da Carga Elétrica Primeiras medidas de e e de e/m Michael Faraday (1791-1867) Condução da eletricidade em ĺıquidos - Lei da eletrólise
Identificação de proteínas através de espectrometria de
 Identificação de proteínas através de espectrometria de massa Proteomica Durante o curso vimos que é possível realizar medidas de presença e abundancia de moléculas de mrna e deste modo realizar inferências
Identificação de proteínas através de espectrometria de massa Proteomica Durante o curso vimos que é possível realizar medidas de presença e abundancia de moléculas de mrna e deste modo realizar inferências
QUÍMICA A Ciênca Central 9ª Edição
 QUÍMICA A Ciênca Central 9ª Edição Capítulo 2 átomos, moléculas e íons David P. White Teoria atômica da matéria John Dalton (1803 1807): Cada elemento é composto de átomos. Todos os átomos de um elemento
QUÍMICA A Ciênca Central 9ª Edição Capítulo 2 átomos, moléculas e íons David P. White Teoria atômica da matéria John Dalton (1803 1807): Cada elemento é composto de átomos. Todos os átomos de um elemento
Espectrometria de massa com plasma acoplado indutivamente (ICP-MS)
 Espectrometria de massa com plasma acoplado indutivamente (ICP-MS) Thiago Linhares Marques ICP OES 5000-10000 K Bobina de RF 27-40 MHz Detecção simultânea 60 elementos/min Cd Pb Cr B Amostra com n analitos
Espectrometria de massa com plasma acoplado indutivamente (ICP-MS) Thiago Linhares Marques ICP OES 5000-10000 K Bobina de RF 27-40 MHz Detecção simultânea 60 elementos/min Cd Pb Cr B Amostra com n analitos
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS OLIMPÍADA BRASILEIRA DE QUÍMICA 2004 FASE VI
 UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS OLIMPÍADA BRASILEIRA DE QUÍMICA 2004 FASE VI Questão 1 Em uma análise química desejava-se determinar o teor percentual de zinco em 96,57g de uma amostra
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS OLIMPÍADA BRASILEIRA DE QUÍMICA 2004 FASE VI Questão 1 Em uma análise química desejava-se determinar o teor percentual de zinco em 96,57g de uma amostra
Algumas considerações iniciais. Interpretação de espectros de massas
 Interpretação de espectros de massas 1. A maioria dos espectros de massas não são de interpretação fácil sem informações adicionais, tais como análise elementar, RMN, etc. 2. Os padrões de fragmentação
Interpretação de espectros de massas 1. A maioria dos espectros de massas não são de interpretação fácil sem informações adicionais, tais como análise elementar, RMN, etc. 2. Os padrões de fragmentação
Agronomia Química Analítica Prof. Dr. Gustavo Rocha de Castro. As medidas baseadas na luz (radiação eletromagnética) são muito empregadas
 ESPECTROMETRIA DE ABSORÇÃO ATÔMICA Introdução As medidas baseadas na luz (radiação eletromagnética) são muito empregadas na química analítica. Estes métodos são baseados na quantidade de radiação emitida
ESPECTROMETRIA DE ABSORÇÃO ATÔMICA Introdução As medidas baseadas na luz (radiação eletromagnética) são muito empregadas na química analítica. Estes métodos são baseados na quantidade de radiação emitida
Ligação iônica = transfere elétrons (um doa outro recebe) 1, 2, 3 e - c.v. 5, 6, 7 e - c.v. Doar e - Receber e - Íon+ Íon - Cl - : NaCl.
 LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons
LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons
NOME: QFL ª Prova (15 pontos) Tabela de deslocamentos químicos de 13 C em sistemas orgânicos
 NOME: QFL 2144 2008 3ª Prova (15 pontos) Tabela de deslocamentos químicos de 13 C em sistemas orgânicos Fragmentações e fragmentos comuns em espectrometria de massa Íon fragmento Neutro Perdido Massa do
NOME: QFL 2144 2008 3ª Prova (15 pontos) Tabela de deslocamentos químicos de 13 C em sistemas orgânicos Fragmentações e fragmentos comuns em espectrometria de massa Íon fragmento Neutro Perdido Massa do
Espectrometria de emissão atômica
 Espectrometria de emissão atômica Técnica analítica que se baseia na emissão de radiação eletromagnética das regiões visível e ultravioleta do espectro eletromagnético por átomos neutros ou átomos ionizados
Espectrometria de emissão atômica Técnica analítica que se baseia na emissão de radiação eletromagnética das regiões visível e ultravioleta do espectro eletromagnético por átomos neutros ou átomos ionizados
Concurso Público - Edital nº 411/2015 CADERNO DE QUESTÔES. prova discursiva. Pesquisador A-B/Cromatografia e Espectrometria de Massas (Padrão III)
 Concurso Público - Edital nº 411/2015 202 CADERNO DE QUESTÔES prova discursiva Pesquisador A-B/Cromatografia e Espectrometria de Massas (Padrão III) Consulte o cronograma em http://concursos.pr4.ufrj.br
Concurso Público - Edital nº 411/2015 202 CADERNO DE QUESTÔES prova discursiva Pesquisador A-B/Cromatografia e Espectrometria de Massas (Padrão III) Consulte o cronograma em http://concursos.pr4.ufrj.br
3 Técnicas analíticas empregadas
 3 Técnicas analíticas empregadas Considerando que esta é uma dissertação interdepartamental e cujo foco central é ambiental e relacionado com ecossistemas, a abordagem, sobre as técnicas analíticas será
3 Técnicas analíticas empregadas Considerando que esta é uma dissertação interdepartamental e cujo foco central é ambiental e relacionado com ecossistemas, a abordagem, sobre as técnicas analíticas será
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 163/2017
 UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 163/2017 Seleção para o 1º Semestre de 2018 16 de janeiro de 2018 CADERNO DE QUESTÕES Tempo
UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA EXAME GERAL EM QUÍMICA EDITAL N 163/2017 Seleção para o 1º Semestre de 2018 16 de janeiro de 2018 CADERNO DE QUESTÕES Tempo
Resumo de Mecanismos de fragmentação
 Resumo de Mecanismos de fragmentação Clivagem s. Clivagem a: iniciada pelo sítio radicalar. Clivagem i: iniciada pela carga do íon. Fragmentações subseqüentes por transferência 1,2 ou 1,4 de H. Rearranjo
Resumo de Mecanismos de fragmentação Clivagem s. Clivagem a: iniciada pelo sítio radicalar. Clivagem i: iniciada pela carga do íon. Fragmentações subseqüentes por transferência 1,2 ou 1,4 de H. Rearranjo
UNIVERSIDADE FEDERAL DE PELOTAS CENTRO DE CIÊNCIAS QUÍMICAS, FARMACÊUTICAS E DE ALIMENTOS PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 PROVA DE FÍSICO-QUÍMICA - 2017/02 Questão 1: Um mol de CO 2 ocupa um volume de 1,32 L e temperatura de 48ºC. Calcule a pressão do sistema supondo em a) um sistema ideal, b) um sistema real e em c) diga
PROVA DE FÍSICO-QUÍMICA - 2017/02 Questão 1: Um mol de CO 2 ocupa um volume de 1,32 L e temperatura de 48ºC. Calcule a pressão do sistema supondo em a) um sistema ideal, b) um sistema real e em c) diga
Análise de Alimentos II Espectroscopia de Absorção Molecular
 Análise de Alimentos II Espectroscopia de Absorção Molecular Profª Drª Rosemary Aparecida de Carvalho Pirassununga/SP 2018 2 Introdução A absorção de radiação no UV/Vis por uma espécie química (M) pode
Análise de Alimentos II Espectroscopia de Absorção Molecular Profª Drª Rosemary Aparecida de Carvalho Pirassununga/SP 2018 2 Introdução A absorção de radiação no UV/Vis por uma espécie química (M) pode
Espectrometria de massas Princípios básicos Teoria DESENVOLVENDO UMA CIÊNCIA MELHOR AGILENT E VOCÊ
 Espectrometria de massas Princípios básicos Teoria DESENVOLVENDO UMA CIÊNCIA MELHOR AGILENT E VOCÊ 1 A Agilent Technologies tem um compromisso com a comunidade educacional e está disposta a conceder acesso
Espectrometria de massas Princípios básicos Teoria DESENVOLVENDO UMA CIÊNCIA MELHOR AGILENT E VOCÊ 1 A Agilent Technologies tem um compromisso com a comunidade educacional e está disposta a conceder acesso
QUI 072 Química Analítica V. Aula 5 - Espectrometria de absorção atômica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 072 Química Analítica V Aula 5 - Espectrometria de absorção atômica Julio C. J. Silva Juiz de Fora, 2014 Métodos
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 072 Química Analítica V Aula 5 - Espectrometria de absorção atômica Julio C. J. Silva Juiz de Fora, 2014 Métodos
Espectrofotometria UV-Vis. Química Analítica V Mestranda: Joseane Maria de Almeida Prof. Dr. Júlio César José da Silva
 Espectrofotometria UV-Vis Química Analítica V Mestranda: Joseane Maria de Almeida Prof. Dr. Júlio César José da Silva Juiz de Fora, 1/2018 1 Terminologia Espectroscopia: Parte da ciência que estuda o fenômeno
Espectrofotometria UV-Vis Química Analítica V Mestranda: Joseane Maria de Almeida Prof. Dr. Júlio César José da Silva Juiz de Fora, 1/2018 1 Terminologia Espectroscopia: Parte da ciência que estuda o fenômeno
Theory Portugues BR (Brazil) Por favor, leia as instruções gerais que se encontram no envelope separado antes de iniciar este problema.
 Q3-1 LHC - Grande Colisor de Hádrons (10 pontos). Por favor, leia as instruções gerais que se encontram no envelope separado antes de iniciar este problema. Neste problema, iremos estudar a física do acelerador
Q3-1 LHC - Grande Colisor de Hádrons (10 pontos). Por favor, leia as instruções gerais que se encontram no envelope separado antes de iniciar este problema. Neste problema, iremos estudar a física do acelerador
Espectrometria de Massas: Estudo Dirigido
 1 Disciplina: Química Orgânica III / 2009.2 Ministrante: Prof. Dr. Sidney Lima 1). O que é um EM e qual a utilidade da EM? Espectrometria de Massas: Estudo Dirigido R = Nos permite determinar a massa molecular
1 Disciplina: Química Orgânica III / 2009.2 Ministrante: Prof. Dr. Sidney Lima 1). O que é um EM e qual a utilidade da EM? Espectrometria de Massas: Estudo Dirigido R = Nos permite determinar a massa molecular
ROTEIRO DA PRÁTICA DE ESPETROMETRIA DE MASSAS. FUNDAMENTOS DE IONIZAÇÃO EI e ESI E ANÁLISES MS e MS/MS
 ROTEIRO DA PRÁTICA DE ESPETROMETRIA DE MASSAS FUNDAMENTOS DE IONIZAÇÃO EI e ESI E ANÁLISES MS e MS/MS OBJETIVO Adquirir destreza e desenvolver os fundamentos na execução de rotinas analíticas que envolvem
ROTEIRO DA PRÁTICA DE ESPETROMETRIA DE MASSAS FUNDAMENTOS DE IONIZAÇÃO EI e ESI E ANÁLISES MS e MS/MS OBJETIVO Adquirir destreza e desenvolver os fundamentos na execução de rotinas analíticas que envolvem
DETECÇÃO DE RADIAÇÃO CÂMARA DE IONIZAÇÃO
 DETECÇÃO DE RADIAÇÃO CÂMARA DE IONIZAÇÃO Interação de partículas carregadas no gás Difusão Transferência de carga Importante em mixtura de gases. Anexação de elétron Comportamento similar ao íon positivo
DETECÇÃO DE RADIAÇÃO CÂMARA DE IONIZAÇÃO Interação de partículas carregadas no gás Difusão Transferência de carga Importante em mixtura de gases. Anexação de elétron Comportamento similar ao íon positivo
Análise de alimentos II Introdução aos Métodos Espectrométricos
 Análise de alimentos II Introdução aos Métodos Espectrométricos Profª Drª Rosemary Aparecida de Carvalho Pirassununga/SP 2018 Introdução Métodos espectrométricos Abrangem um grupo de métodos analíticos
Análise de alimentos II Introdução aos Métodos Espectrométricos Profª Drª Rosemary Aparecida de Carvalho Pirassununga/SP 2018 Introdução Métodos espectrométricos Abrangem um grupo de métodos analíticos
RELAÇÕES DE MASSA E MOL
 RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
Universidade Federal do Paraná Departamento de Física Laboratório de Física Moderna. Bloco 01: A RAZÃO CARGA/MASSA DO ELÉTRON
 Universidade Federal do Paraná Departamento de Física Laboratório de Física Moderna Bloco 01: A RAZÃO CARGA/MASSA DO ELÉTRON Introdução A quantidade e/m foi medida experimentalmente pela primeira em 1897
Universidade Federal do Paraná Departamento de Física Laboratório de Física Moderna Bloco 01: A RAZÃO CARGA/MASSA DO ELÉTRON Introdução A quantidade e/m foi medida experimentalmente pela primeira em 1897
Concurso Público - Edital nº 411/2015 CADERNO DE QUESTÔES. prova discursiva. Pesquisador A-B Cromatografia e Espectrometria de Massas (Padrão I)
 Concurso Público - Edital nº 411/2015 204 CADERNO DE QUESTÔES prova discursiva Pesquisador A-B Cromatografia e Espectrometria de Massas (Padrão I) Consulte o cronograma em http://concursos.pr4.ufrj.br
Concurso Público - Edital nº 411/2015 204 CADERNO DE QUESTÔES prova discursiva Pesquisador A-B Cromatografia e Espectrometria de Massas (Padrão I) Consulte o cronograma em http://concursos.pr4.ufrj.br
Ligações Químicas. PROF: Fábio Silva
 Ligações Químicas PROF: Fábio Silva Introdução Os átomos ligam-se para adquirir maior estabilidade. Teoria do octeto Os átomos se ligam-se, procurando adquirir a configuração eletrônica de gás nobre. Observações
Ligações Químicas PROF: Fábio Silva Introdução Os átomos ligam-se para adquirir maior estabilidade. Teoria do octeto Os átomos se ligam-se, procurando adquirir a configuração eletrônica de gás nobre. Observações
Ligações Químicas. No hidrônio, quantos pares de elétrons pertencem, no total, tanto ao hidrogênio quanto ao oxigênio? a) 1 b) 2 c) 3 d) 4 e) 6
 Aluno(a): Prof.: Éderson Ligações Químicas Questão 1) Abaixo temos as fórmulas de Lewis para átomos de cinco elementos químicos. Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que
Aluno(a): Prof.: Éderson Ligações Químicas Questão 1) Abaixo temos as fórmulas de Lewis para átomos de cinco elementos químicos. Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que
Estudo de Fragmentação
 Estudo de Fragmentação EI - fragmentação de alta energia (carga e radical) ESI fragmentação direcionado pela carga CID: Baixa tensão de Cone Cone de extração 5V Cone de amostra 3V Hexapolo CID: Baixa
Estudo de Fragmentação EI - fragmentação de alta energia (carga e radical) ESI fragmentação direcionado pela carga CID: Baixa tensão de Cone Cone de extração 5V Cone de amostra 3V Hexapolo CID: Baixa
Física para Ciências Biológicas Lista de Exercícios 5 - CASA Data: 22/05/2014
 Física para Ciências Biológicas - 2014 Lista de Exercícios 5 - CASA Data: 22/05/2014 1. Abaixo representamos a energia de interação dos átomos de K e Cl em função da distância interatômica. A energia de
Física para Ciências Biológicas - 2014 Lista de Exercícios 5 - CASA Data: 22/05/2014 1. Abaixo representamos a energia de interação dos átomos de K e Cl em função da distância interatômica. A energia de
A base da espectrometria de massas
 A base da espectrometria de massas The father of MS and the first mass spectrometrist to win the Nobel Prize. Pure species and mixtures JJ Thomson's 'Plum Pudding Model' of the atom, a sphere of positive
A base da espectrometria de massas The father of MS and the first mass spectrometrist to win the Nobel Prize. Pure species and mixtures JJ Thomson's 'Plum Pudding Model' of the atom, a sphere of positive
Químicas. Profa. Ms. Loraine Cristina do Valle Jacobs DAQBI.
 Ligações Químicas Profa. Ms. Loraine Cristina do Valle Jacobs DAQBI [email protected] http://paginapessoal.utfpr.edu.br/lorainejacobs LIGAÇÕES IÔNICAS LIGAÇÕES IÔNICAS IMPORTANTE : alguns metais,
Ligações Químicas Profa. Ms. Loraine Cristina do Valle Jacobs DAQBI [email protected] http://paginapessoal.utfpr.edu.br/lorainejacobs LIGAÇÕES IÔNICAS LIGAÇÕES IÔNICAS IMPORTANTE : alguns metais,
A teoria dos orbitais moleculares
 A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
A teoria dos orbitais moleculares Qualitativamente, indica regiões do espaço (entre os átomos que formam uma molécula) nas quais a probabilidade de encontrar os elétrons é máxima. Na mecânica quântica,
Espectrometria de massa & análise de biomoléculas
 Espectrometria de massa & análise de biomoléculas Curso de Inverno 16/07/2012 Sayuri Miyamoto Tópicos I. Breve Introdução II. Espectrômetros de Massa III. Aplicações em Análise de Biomoléculas 1 Os primeiros
Espectrometria de massa & análise de biomoléculas Curso de Inverno 16/07/2012 Sayuri Miyamoto Tópicos I. Breve Introdução II. Espectrômetros de Massa III. Aplicações em Análise de Biomoléculas 1 Os primeiros
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA
 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO. 2) EM HIPÓTESE
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO. 2) EM HIPÓTESE
Química Geral I Aula 2
 Química Geral I Aula 2 Curso de Química Licenciatura 2016-1 Prof. Udo Eckard Sinks HO HO H HO O O OH Moodle https://moodle.unipampa.edu.br/course/view.php?id=4858 Química Geral I Prof. Udo Sinks 2 1 Átomos
Química Geral I Aula 2 Curso de Química Licenciatura 2016-1 Prof. Udo Eckard Sinks HO HO H HO O O OH Moodle https://moodle.unipampa.edu.br/course/view.php?id=4858 Química Geral I Prof. Udo Sinks 2 1 Átomos
Atividade extra. Questão 1 Cecierj Questão 2 Adaptado de UFRJ. Ciências da Natureza e suas Tecnologias Química
 Atividade extra Questão 1 Cecierj - 2013 Veja a seguir as distribuições eletrônicas para o magnésio e o oxigênio: Mg: K = 2 L = 8 M = 2 12 O: K = 2 L = 6 8 Explique como o composto MgO é formado e indique
Atividade extra Questão 1 Cecierj - 2013 Veja a seguir as distribuições eletrônicas para o magnésio e o oxigênio: Mg: K = 2 L = 8 M = 2 12 O: K = 2 L = 6 8 Explique como o composto MgO é formado e indique
Central Analítica Central Analítica Central Analítica Central Analítica ntral Analítica
 A Central Analítica é um centro de análise de matérias e substâncias químicas que facilita o desenvolvimento de pesquisas, pós-graduação e formação de recursos humanos no Departamento de Química Fundamental
A Central Analítica é um centro de análise de matérias e substâncias químicas que facilita o desenvolvimento de pesquisas, pós-graduação e formação de recursos humanos no Departamento de Química Fundamental
https://sites.google.com/site/estruturabc0102/
 Estrutura da Matéria Aula 3: A Descoberta do Elétron e Modelos do Átomo E-mail da turma: [email protected] Senha: ufabcsigma https://sites.google.com/site/estruturabc0102/ A primeira Teoria atômica (~1808)
Estrutura da Matéria Aula 3: A Descoberta do Elétron e Modelos do Átomo E-mail da turma: [email protected] Senha: ufabcsigma https://sites.google.com/site/estruturabc0102/ A primeira Teoria atômica (~1808)
Métodos Instrumentais de Análise
 Métodos Instrumentais de Análise Aula 01 08/04/2013 1 Métodos Analíticos - MÉTODOS CLÁSSICOS - MÉTODOS INSTRUMENTAIS -INSTRUMENTAÇÃO MODERNA -Portabilidade -Baixo Custo -Miniaturização -Análise no campo
Métodos Instrumentais de Análise Aula 01 08/04/2013 1 Métodos Analíticos - MÉTODOS CLÁSSICOS - MÉTODOS INSTRUMENTAIS -INSTRUMENTAÇÃO MODERNA -Portabilidade -Baixo Custo -Miniaturização -Análise no campo
QUI 154 Química Analítica V. Aula 3 - Espectrometria de absorção atômica (AAS)
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Aula 3 - Espectrometria de absorção atômica (AAS) Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Aula 3 - Espectrometria de absorção atômica (AAS) Julio C. J. Silva Juiz de Fora,
Absorção de Radiação por Gases na Atmosfera. Radiação I Primeiro semestre 2016
 Absorção de Radiação por Gases na Atmosfera Radiação I Primeiro semestre 2016 Constituintes gasosos da atmosfera N 2 ~ 78% O 2 ~ 21% ~ 99% da atmosfera seca vapor d água (0 a 4%) Argônio, CO 2, O 3, CH
Absorção de Radiação por Gases na Atmosfera Radiação I Primeiro semestre 2016 Constituintes gasosos da atmosfera N 2 ~ 78% O 2 ~ 21% ~ 99% da atmosfera seca vapor d água (0 a 4%) Argônio, CO 2, O 3, CH
Espectrometria de Massas (MS)
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Química e Física Molecular Disciplina: SQM0418 - Análise Instrumental II Espectrometria de Massas (MS) Álvaro José dos Santos
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Química e Física Molecular Disciplina: SQM0418 - Análise Instrumental II Espectrometria de Massas (MS) Álvaro José dos Santos
5ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A 10ºAno (VERSÃO 1)
 5ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A 10ºAno (VERSÃO 1) Professora Paula Melo Silva Data: 18 janeiro Ano Letivo: 2018/2019 135 + 15 min 1. Considere uma amostra de 10 cm
5ª Ficha de Avaliação de Conhecimentos Turma: 10ºA Física e Química A 10ºAno (VERSÃO 1) Professora Paula Melo Silva Data: 18 janeiro Ano Letivo: 2018/2019 135 + 15 min 1. Considere uma amostra de 10 cm
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
PREVENÇÃO, PREPARAÇÃO E RESPOSTA À EMERGÊNCIAS E DESASTRES QUÍMICOS
 Curso de Auto-aprendizagem PREVENÇÃO, PREPARAÇÃO E RESPOSTA À EMERGÊNCIAS E DESASTRES QUÍMICOS Equipamentos portáteis de detecção Químico Agnaldo R. de Vasconcellos CETESB Sustância não identificada Mantenha
Curso de Auto-aprendizagem PREVENÇÃO, PREPARAÇÃO E RESPOSTA À EMERGÊNCIAS E DESASTRES QUÍMICOS Equipamentos portáteis de detecção Químico Agnaldo R. de Vasconcellos CETESB Sustância não identificada Mantenha
EXERCÍCIOS 1. Um átomo apresenta 15 prótons e 12 nêutrons. Qual seu A e seu Z?
 Professor Juscelino O ÁTOMO Elite Belém É formado por duas regiões: o núcleo (que contém toda carga positiva e praticamente toda massa do átomo) e a eletrosfera (que fica envolta do núcleo e é praticamente
Professor Juscelino O ÁTOMO Elite Belém É formado por duas regiões: o núcleo (que contém toda carga positiva e praticamente toda massa do átomo) e a eletrosfera (que fica envolta do núcleo e é praticamente
(a) Como é feita a determinação das espécies atômicas de interesse e quais os processos que
 QUESTÕES: 01. (Química Analítica) Os métodos espectroscópicos atômicos são empregados na determinação qualitativa e quantitativa de mais de 70 elementos. Tipicamente, esses métodos podem detectar quantidades
QUESTÕES: 01. (Química Analítica) Os métodos espectroscópicos atômicos são empregados na determinação qualitativa e quantitativa de mais de 70 elementos. Tipicamente, esses métodos podem detectar quantidades
Geração de Energia Elétrica
 Geração de Energia Elétrica Geração Termoelétrica a Vapor Unidades Nucleares Joinville, 25 de Abril de 2012 Escopo dos Tópicos Abordados Fissão versus Fusão Nuclear; Tokamak: Controle magnético de plasma
Geração de Energia Elétrica Geração Termoelétrica a Vapor Unidades Nucleares Joinville, 25 de Abril de 2012 Escopo dos Tópicos Abordados Fissão versus Fusão Nuclear; Tokamak: Controle magnético de plasma
1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e determine o número de valência de cada elemento: a) Fe (26):.
 FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE
 ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
DATA: Nº de ordem GRAU: PROVA: TURMA MATRÍCULA: Estudo Independente
 FOLHA DE QUESTÕES CURSO: ASS.: Engenharia de Produção DISCIPLINA: NOME: Química Geral DATA: Nº de ordem GRAU: PROVA: TURMA MATRÍCULA: Estudo Independente 5PRD31A 01) O grupo de átomos que é encontrado
FOLHA DE QUESTÕES CURSO: ASS.: Engenharia de Produção DISCIPLINA: NOME: Química Geral DATA: Nº de ordem GRAU: PROVA: TURMA MATRÍCULA: Estudo Independente 5PRD31A 01) O grupo de átomos que é encontrado
QUI 154 Química Analítica V. Aula 3 - Espectrometria de absorção atômica (AAS)
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Aula 3 - Espectrometria de absorção atômica (AAS) Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Aula 3 - Espectrometria de absorção atômica (AAS) Julio C. J. Silva Juiz de Fora,
Energia certa significa: quando a energia do fóton corresponde à diferença nos níveis de energia entre as duas órbitas permitidas do átomo de H.
 ESPECTROSCOPIA II A relação da luz com as linhas espectrais O que acontece se átomos de H forem bombardeados por fótons? R. Existem três possibilidades: 1) a maioria dos fótons passa sem nenhuma interação
ESPECTROSCOPIA II A relação da luz com as linhas espectrais O que acontece se átomos de H forem bombardeados por fótons? R. Existem três possibilidades: 1) a maioria dos fótons passa sem nenhuma interação
Análise Instrumental ESPECTROSCOPIA NA LUZ VISÍVEL E ULTRAVIOLETA
 Análise Instrumental ESPECTROSCOPIA NA LUZ VISÍVEL E ULTRAVIOLETA ESPECTROSCOPIA NA LUZ VISÍVEL E ULTRAVIOLETA Introdução: Método aplicado na determinação de compostos inorgânicos e orgânicos, como por
Análise Instrumental ESPECTROSCOPIA NA LUZ VISÍVEL E ULTRAVIOLETA ESPECTROSCOPIA NA LUZ VISÍVEL E ULTRAVIOLETA Introdução: Método aplicado na determinação de compostos inorgânicos e orgânicos, como por
Atividades de Recuperação Paralela de Química 2º. trimestre
 Atividades de Recuperação Paralela de Química 2º. trimestre 3ª série Ensino Médio Conteúdos para estudos:. Setor A: Equações de desintegrações alfa e beta; Cálculos envolvendo tempo de meia vida; Modelos
Atividades de Recuperação Paralela de Química 2º. trimestre 3ª série Ensino Médio Conteúdos para estudos:. Setor A: Equações de desintegrações alfa e beta; Cálculos envolvendo tempo de meia vida; Modelos
INTERAÇÕES INTERMOLECULARES
 UNIVERSIDADE FEDERAL FLUMINENSE INSTITUTO DE QUÍMICA DEPARTAMENTO DE QUÍMICA INORGÂNICA QUÍMICA INORGÂNICA FUNDAMENTAL I INTERAÇÕES INTERMOLECULARES Prof. Fabio da Silva Miranda e-mail: [email protected]
UNIVERSIDADE FEDERAL FLUMINENSE INSTITUTO DE QUÍMICA DEPARTAMENTO DE QUÍMICA INORGÂNICA QUÍMICA INORGÂNICA FUNDAMENTAL I INTERAÇÕES INTERMOLECULARES Prof. Fabio da Silva Miranda e-mail: [email protected]
Unidades SI. Existem dois tipos de unidades: Unidades fundamentais (ou básicas); Unidades derivadas. Existem 7 unidades básicas no sistema SI.
 Unidades SI Existem dois tipos de unidades: Unidades fundamentais (ou básicas); Unidades derivadas. Existem 7 unidades básicas no sistema SI. Unidades SI As potências de dez são utilizadas por conveniência
Unidades SI Existem dois tipos de unidades: Unidades fundamentais (ou básicas); Unidades derivadas. Existem 7 unidades básicas no sistema SI. Unidades SI As potências de dez são utilizadas por conveniência
Forças intermoleculares. Formação de fases condensadas Forças íon-dipolo Forças dipolo-dipolo Forças de London Ligação de hidrogênio
 Forças intermoleculares Formação de fases condensadas Forças íon-dipolo Forças dipolo-dipolo Forças de London Ligação de hidrogênio Estado gasoso O estado da matéria mais simples é o gás. Descrevemos esse
Forças intermoleculares Formação de fases condensadas Forças íon-dipolo Forças dipolo-dipolo Forças de London Ligação de hidrogênio Estado gasoso O estado da matéria mais simples é o gás. Descrevemos esse
Gabarito das Questões
 II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
Compostos iônicos e moleculares
 LCE0143 Química Geral Compostos iônicos e moleculares Wanessa Melchert Mattos [email protected] Moléculas - Menores unidades identificáveis - Moléculas são reuniões de dois ou mais átomos ligados entre si
LCE0143 Química Geral Compostos iônicos e moleculares Wanessa Melchert Mattos [email protected] Moléculas - Menores unidades identificáveis - Moléculas são reuniões de dois ou mais átomos ligados entre si
ELÉTRONS EM ÁTOMOS. Depois do modelo de Rutherford: Como é o comportamento dos elétrons nos átomos? Rutherford: estrutura planetária, com o
 ELÉTRONS EM ÁTOMOS Depois do modelo de Rutherford: Como é o comportamento dos elétrons nos átomos? Rutherford: estrutura planetária, com o núcleo correspondendo ao sol no nosso sistema solar e os elétrons
ELÉTRONS EM ÁTOMOS Depois do modelo de Rutherford: Como é o comportamento dos elétrons nos átomos? Rutherford: estrutura planetária, com o núcleo correspondendo ao sol no nosso sistema solar e os elétrons
NOMENCLATURA DOS COMPOSTOS
 NOMENCLATURA DOS COMPOSTOS Prof. Dr. Cristiano Torres Miranda Disciplina: Química Geral QM81A Turmas Q13 e Q14 Moléculas e compostos moleculares Moléculas e fórmulas químicas Moléculas são reuniões de
NOMENCLATURA DOS COMPOSTOS Prof. Dr. Cristiano Torres Miranda Disciplina: Química Geral QM81A Turmas Q13 e Q14 Moléculas e compostos moleculares Moléculas e fórmulas químicas Moléculas são reuniões de
Prof. Luiz F. Silva Jr - IQ-USP
 ü Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. ü Compreender aspectos de acidez e basicidade é essencial em Química Orgânica: i)
ü Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. ü Compreender aspectos de acidez e basicidade é essencial em Química Orgânica: i)
SOLDAGEM. Engenharia Mecânica Prof. Luis Fernando Maffeis Martins
 02 SOLDAGEM Engenharia Mecânica Prof. Luis Fernando Maffeis Martins Transferência metálica em soldagem com arco elétrico Tabela periódica Modelo atômico Elétrons Partículas carregadas negativamente que
02 SOLDAGEM Engenharia Mecânica Prof. Luis Fernando Maffeis Martins Transferência metálica em soldagem com arco elétrico Tabela periódica Modelo atômico Elétrons Partículas carregadas negativamente que
Radiação e Ionização. Proteção e higiene das Radiações I Profª: Marina de Carvalho CETEA
 Radiação e Ionização Proteção e higiene das Radiações I Profª: Marina de Carvalho CETEA Introdução O que é onda? Perturbação em um meio que se propaga transportando energia sem que haja transporte de matéria.
Radiação e Ionização Proteção e higiene das Radiações I Profª: Marina de Carvalho CETEA Introdução O que é onda? Perturbação em um meio que se propaga transportando energia sem que haja transporte de matéria.
Ligações Químicas Parte - 3
 Ligações Químicas Parte - 3 Lewis: modelo para combinação dos átomos e formação das moléculas Ligação covalente : Baseia-se no compartilhamento de elétrons pelos átomos 1H : 1s 1 1H : 1s 1 1H : 1s 2 1H
Ligações Químicas Parte - 3 Lewis: modelo para combinação dos átomos e formação das moléculas Ligação covalente : Baseia-se no compartilhamento de elétrons pelos átomos 1H : 1s 1 1H : 1s 1 1H : 1s 2 1H
Centro Universitário Padre Anchieta
 1) Quais são os cinco componentes principais utilizados nos equipamentos de espectroscopia óptica (molecular e atômica). Resposta: Os cinco componentes são: 1- Fonte de radiação (energia): Responsável
1) Quais são os cinco componentes principais utilizados nos equipamentos de espectroscopia óptica (molecular e atômica). Resposta: Os cinco componentes são: 1- Fonte de radiação (energia): Responsável
Coordenadora/Autora: REGINA DO CARMO PESTANA DE O. BRANCO. Química Forense. Sob Olhares Eletrônicos. Autores:
 Coordenadora/Autora: REGINA DO CARMO PESTANA DE O. BRANCO Química Forense Sob Olhares Eletrônicos Autores: Anamaria Dias Pereira Alexiou Dalva L. A. Faria Henrique Eisi Toma Jorge Eduardo de Souza Sarkis
Coordenadora/Autora: REGINA DO CARMO PESTANA DE O. BRANCO Química Forense Sob Olhares Eletrônicos Autores: Anamaria Dias Pereira Alexiou Dalva L. A. Faria Henrique Eisi Toma Jorge Eduardo de Souza Sarkis
AULA 01 TEORIA ATÔMICA COMPLETA
 AULA 01 TEORIA ATÔMICA COMPLETA - ESTRUTURA ATÔMICA; - MODELOS ATÔMICOS; - ESPECTROSCOPIA ATÔMICA; - PROPRIEDADES ONDULATÓRIAS DOS ELÉTRONS; - NÚMEROS QUÂNTICOS E DISTRIBUIÇÃO ELETRÔNICA. QUÍMICA estudo
AULA 01 TEORIA ATÔMICA COMPLETA - ESTRUTURA ATÔMICA; - MODELOS ATÔMICOS; - ESPECTROSCOPIA ATÔMICA; - PROPRIEDADES ONDULATÓRIAS DOS ELÉTRONS; - NÚMEROS QUÂNTICOS E DISTRIBUIÇÃO ELETRÔNICA. QUÍMICA estudo
4 Espectrometria de massas com plasma indutivamente acoplado (ICP-MS)
 38 4 Espectrometria de massas com plasma indutivamente acoplado (ICP-MS) 4.1. Aspectos gerais A técnica de ICP-MS tem como principal vantagem à possibilidade de análise multielementar (e isotópica) seqüencial
38 4 Espectrometria de massas com plasma indutivamente acoplado (ICP-MS) 4.1. Aspectos gerais A técnica de ICP-MS tem como principal vantagem à possibilidade de análise multielementar (e isotópica) seqüencial
Ligações Químicas. Profª. Ms. Loraine Cristina do Valle Jacobs DAQBI.
 Ligações Químicas Profª. Ms. Loraine Cristina do Valle Jacobs [email protected] http://paginapessoal.utfpr.edu.br/lorainejacobs DAQBI LIGAÇÕES QUÍMICAS A partir do desenvolvimento da mecânica
Ligações Químicas Profª. Ms. Loraine Cristina do Valle Jacobs [email protected] http://paginapessoal.utfpr.edu.br/lorainejacobs DAQBI LIGAÇÕES QUÍMICAS A partir do desenvolvimento da mecânica
Observe a equação química que corresponde ao processo de obtenção descrito no texto.
 Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
Número de oxidação e balanceamento
 Número de oxidação e balanceamento Conceito de número de oxidação (N OX ) Carga do íon em compostos iônicos e carga do átomo em compostos moleculares Oxidação é a perda de elétrons. Redução é o ganho de
Número de oxidação e balanceamento Conceito de número de oxidação (N OX ) Carga do íon em compostos iônicos e carga do átomo em compostos moleculares Oxidação é a perda de elétrons. Redução é o ganho de
