5. Apresentação e Discussão dos Resultados
|
|
|
- Alexandre Tavares
- 5 Há anos
- Visualizações:
Transcrição
1 Remoção do cianeto (%) 5. Apresentação e Discussão dos Resultados 5.1. Avaliação Físico-Química Experimental Influência do ph no processo de degradação do cianeto livre Degradação com H 2 O 2 Na Figura 10, mostra-se que para um t = 60 minutos a eficiência de remoção do cianeto a ph 11, foi apenas de 18,8%, enquanto a ph 9, no mesmo tempo a degradação mostrou-se um pouco mais eficiente, com uma remoção de cianeto de 26,5%. Na Figura 11, vê-se que a degradação do cianeto com peróxido de hidrogênio apenas oxida de 10 mg/l até 7,35 e 8,12 mg/l, em um tempo de 60 minutos a ph 9 e 11, respectivamente ph= 9 ph= Tempo ( minutos) Figura 10 Remoção do cianeto pelo H 2 O 2. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l, razão molar [H 2 O 2 ]:[CN - ] = 1:1.
2 [CN - ] (mg/l) ph= 9 ph= Tempo ( minutos) Figura 11 Degradação do cianeto pelo H 2 O 2. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l, [H 2 O 2 ]:[CN - ] = 1:1. Na Figura 12, mostra-se que, com o aumento do ph de 9 para 11, diminui a velocidade inicial de 0,003 mmol/l.min para 0,0025 mmol/l.min. Vê-se, também, que é muito baixo o efeito sobre a velocidade inicial provocado pela variação do ph nessa faixa. REDA et al. (2009), estudaram a influencia do ph na velocidade de degradação do cianeto. Observaram que a velocidade tende a ser maior em ph 9, sendo que o ph próximo a 10 é dado como o ponto ótimo. Os resultados confirmam que o efeito do ph na oxidação do cianeto está diretamente relacionado com a maior estabilidade do cianeto em meio alcalino. Além disso, sabe-se que a reação paralela de autodecomposição do peróxido de hidrogênio em água e oxigênio é mais rápida em valores de ph mais elevados. De modo que em
3 r A (mmol/l.min) 71 ph 11, espera-se que a [H 2 O 2 ] ao final da reação caia a zero mais rapidamente do que em ph [H2O2]:[CN-]=1:1 [H2O2]:[CN-]=2: ph Figura 12 Velocidade inicial versus ph, na degradação do cianeto pelo H 2 O 2. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [H 2 O 2 ]:[CN - ] = 1:1 e 2:1. CRITTENDEN et al. (1999), estudaram um modelo cinético para o processo de H 2 O 2 /UV, onde um aumento do ph da solução diminuiu a taxa de oxidação de substrato. Isto ocorre porque a concentração do íon carbonato, eventualmente gerado pela hidrólise do íon cianato aumenta com o aumento do ph e este íon é um sequestrador de radicais hidroxila muito mais eficiente que os radicais bicarbonato. Além disso, a forma dissociada do peróxido de hidrogênio ( ) em meio alcalino reage com radicais hidroxila mais rapidamente que o peróxido de hidrogênio. Pelo mesmo motivo, valores mais elevados de ph promovem a decomposição do peróxido de hidrogênio. OH + HO 2 - H 2 O + O 2 (59)
4 72 OH + H 2 O 2 H 2 O + HO 2 (60) Entretanto, diferentes autores acreditam que o principal motivo do efeito do ph esteja relacionado ao aumento da taxa de decomposição do H 2 O 2 quando o ph está em torno de Degradação com NaClO Diversos autores avaliaram a influencia do ph na velocidade de degradação do cianeto com hipoclorito de sódio. Foi observado que a velocidade de degradação tende a ser maior a ph 11 em comparação a ph 9, sendo o ph 11.5 ou superior a este, dado como o ponto ótimo (DA SILVA OLIVEIRA, 2007). Uma das principais variáveis para o processo de degradação do cianeto com hipoclorito de sódio, é o ph da solução. Neste estudo, o conjunto de experiências relativas à oxidação de cianeto foram conduzidas para valores de ph 9, por meio da adição do ácido sulfúrico e, ph 11 por meio da adição de NaOH para ajuste do ph, no início da reação. Na Figura 13, mostra-se que para um tempo de 60 minutos, a eficiência de remoção do cianeto a ph 11 foi de 97,7%, enquanto que, para ph 9, no mesmo tempo, a degradação mostrou-se um pouco menos eficiente com uma remoção de cianeto de 91%. Na Figura 14, vê-se que a degradação do cianeto com hipoclorito diminuiu de 10 mg/l até 0,85 e 0,27 mg/l, em um tempo de 60 minutos a ph 9 e 11, respectivamente. Os resultados obtidos neste trabalho estão de acordo com as pesquisas de W.K. TEO E T.C. TAN (1987), onde a ph 11 e acima deste, na presença de hipoclorito em excesso, o cianeto foi rapidamente e quantitativamente oxidado a cianato em apenas 5 minutos. Segundo PARGA E SHUKLA (2002), o cianeto livre é evidentemente oxidado em todos os valores de ph, sendo oxidado de forma mais eficaz em altos valores de ph.
5 Remoção do cianeto (%) 73 A influência do ph na degradação do cianeto é apresentado na Figura 16 e nota-se que para ph 9 é necessário um tempo maior do que 60 minutos para que o cianeto atinja concentrações inferiores ao estipulado pelo CONAMA Resolução 430/2011, para descarte de efluentes de 0,2 mg/l. Entretanto, para ph 11, os valores obtidos em 60 minutos já estão de acordo com as normas estabelecidas. Os resultados mostram, que para altos valores de ph e meio alcalino o hipoclorito de sódio pode interagir com íons hidroxila levando à formação de espécies radicalares, principalmente, o radical hidroxila (OH). Devido ao caráter não seletivo dos radicais hidroxila, o mecanismo de oxidação indireta do hipoclorito é geralmente mais eficiente ph=9 ph= Tempo ( minutos) Figura 13 Remoção do cianeto pelo hipoclorito de sódio. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [NaClO]:[CN - ] = 1:1. Na Figura 14, observa-se que nos minutos iniciais a degradação do cianeto é muito mais rápida, o que é de se esperar em reações de segunda ordem. A ph 9, a degradação do cianeto é rápida inicialmente e logo torna-se lenta. Entretanto a
6 [CN - ] (mg/l) 74 ph 11, a degradação do cianeto é muito mais rápida, alcançando-se uma concentração do cianeto muito baixa em tempos de retenção muito curto. Para TEO E TAN (1986), a ph 11 e acima deste e na presença de excesso de hipoclorito de sódio, o cianeto é rapidamente oxidado a cianato. Na Figura 15, mostra-se que a velocidade de degradação do cianeto pelo hipoclorito de sódio, aumentou significativamente com o aumento do ph, em quase o dobro da velocidade inicial. Para uma razão molar de [NaClO]:[CN - ] = 1:1, e um incremento de ph de 9 a 11, a velocidade inicial aumentou de 0,031 para 0,057 mmol/l.min. No entanto, deve-se notar que, em geral, a eliminação de cianetos é executada a ph maiores do que 11,5 para evitar a liberação do cloreto de cianogênio, gás extremadamente tóxico. (DA SILVA, OLIVEIRA e GOMES, 2007) ph=9 ph= Tempo ( minutos) Figura 14 Degradação do cianeto pelo hipoclorito de sódio. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [NaClO]:[CN - ] = 1:1.
7 r A (mmol/l.min) [NaClO]:[CN-]=1:1 [NaClO]:[CN-]=2:1 [NaClO]:[CN-]=0,8:1 [NaClO]:[CN-]=0,6:1 [NaClO]:[CN-]=0,4:1 [NaClO]:[CN-]=0,2: ph Figura 15 Velocidade inicial versus ph na degradação do cianeto pelo hipoclorito de sódio. Condições experimentais: ph = 9 e 11; [CN - ] = 10 mg/l; e vários valores de razão molar [NaClO]:[CN - ]. MARQUES (2009), relatou que a oxidação do cianeto a diferentes condições de ph leva à formação de diferentes produtos de reação. Para soluções fortemente alcalinas em valores de ph maiores do que 12, dá-se, normalmente, a formação de dióxido de carbono (CO 2 ) e nitrogênio (N 2 ), em meio aquoso. No caso de soluções levemente ácidas com valores de ph na faixa de 5,2 a 6,8, dá-se a formação de. Para soluções alcalinas com valores de ph situados na faixa de 7 a 10, pode ocorrer a formação de íons de amônio, carbonato, bicarbonato, nitrogênio N 2, cloreto Cl -, e sódio Na +. Segundo GHAOUI et al. (1982), relataram que os produtos da oxidação pelo processo de hipoclorito de sódio, são íons de amônio ( ), carbonato ( ) na oxidação direta, na faixa de ph de 7 a 11. Em oxidação indireta, o ph
8 76 da solução deve ser mantido a cerca de 11 para completar a reação e minimizar o consumo de cloro. TEO et al. (1985), relataram que o cianato manteve-se estável a ph elevado, mesmo na presença de hipoclorito de excesso Degradação pela combinação do H 2 O 2 e NaClO Na figura 16, mostra-se que a maior remoção do cianeto ocorre nos dois primeiros minutos da reação, alcançando uma remoção de 77,7 % a ph 11. A ph 9 a velocidade inicial da degradação do cianeto é menor do que em ph 11. No entanto, a degradação do cianeto a ph 9 mostrou-se mais eficiente nos 60 minutos de reação, atingindo-se uma remoção total de 97,3 %. Estes resultados podem ser explicados como a combinação do peróxido de hidrogênio e hipoclorito de sódio. É a etapa mais lenta do processo gerando o oxigênio singlete 1 O 2, o qual tem um tempo de vida muito curto de até 4 µs (ROSEIN, 2008). Este oxigênio singlete gerado, antes de decair a seu estado fundamental O 2, pode colidir com o cianeto, e formar como produto cianato, segundo a reação a seguir. (61) A ph 11, a velocidade inicial de reação é rápida nos primeiros dois minutos, entretanto após os dois primeiros minutos a velocidade torna-se lenta, o que pode assumir-se, que nos dois primeiros minutos, ocorre uma degradação de cianeto devido, principalmente, à ação do oxigênio singlete, o qual na falta de excesso do sistema gerador (H 2 O 2 +NaClO) esgota-se e a reação cessa. A ph 9, a velocidade inicial de reação é também rápida. No entanto, o peróxido de hidrogênio e hipoclorito de sódio não são consumidos totalmente no início da reação, porque após os primeiros dois minutos, a velocidade de reação continua rápida. Assumindo-se que o cianeto é oxidado por hipoclorito de sódio e
9 Remoção do cianeto (%) 77 peróxido de hidrogênio separadamente, segundo as reações (62) e (67). Testes feitos nas mesmas condições experimentais demonstraram que ocorre uma degradação natural de 0,78 +/- 0,05 mg/l, em 60 minutos de reação (Tabela A1-3). Para TEIXEIRA et al. (2010), que estudaram a degradação de surfactantes com oxigênio singlete, além da reação (SLS+ 1 O 2 produtos), podem ocorrer outras duas reações paralelas para oxidar o surfactante, como a reação do hipoclorito de sódio diretamente ou o peróxido de hidrogênio diretamente, embora ocorram em menor grau no decurso do processo ph=11 ph= Tempo ( minutos) Figura 16 Remoção do cianeto pela combinação do peróxido de hidrogênio e hipoclorito de sódio. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [H 2 O 2 + NaClO]:[CN - ] = 1:1.
10 [CN - ] (mg/l) 78 Na Figura 17, observa-se que a influência do ph sobre a velocidade de degradação do cianeto é significante. O gráfico, mostra que nos experimentos feitos a ph 9, a concentração do cianeto diminuiu de 10 até 3,10 mg/l, nos dois primeiros minutos, e no decorrer dos 60 minutos, o cianeto alcançou uma concentração final de 0,27 mg/l. Para os experimentos feitos a ph 11, nos dois primeiros minutos, a concentração do cianeto diminuiu de 10 até 2,19 mg/l, e no decorrer dos 60 minutos, a concentração do cianeto apenas diminui até 1,76mg/L. Avaliando-se a influência do ph na degradação do cianeto, observa-se que nos primeiros minutos a velocidade inicial de degradação tende a ser maior em ph 11, mas após os dois minutos a velocidade de degradação torna-se lenta, não chegando a degradar o cianeto completamente nos 60 minutos de reação ph=9 ph= Tempo (minutos) Figura 17 Degradação do cianeto pela combinação do peróxido de hidrogênio e hipoclorito de sódio. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [H 2 O 2 + NaClO]:[CN - ] = 1:1.
11 r A (mmol/l.min) 79 Na Figura 18, mostra-se que com o aumento de ph de 9 para 11, incrementa-se a velocidade inicial de degradação do cianeto de 0,12 para 0,15 mmol/l.min, para uma razão molar de [0,5H 2 O 2 +0,5NaClO]:[CN - ] =1:1. Quando a razão molar é [H 2 O 2 +NaClO]:[CN - ]=2:1, a velocidade inicial também foi afetada pelo incremento de ph de 9 para [0,5H2O2+0,5NaClO]:[CN-]=1:1 [1H2O2+1NaClO]:[CN-]=2:1 [0,8H2O2+0,2NaClO]:[CN-]=1:1 [0,6H2O2+0,4NaClO]:[CN-]=1:1 [0,4H2O2+0,6NaClO]:[CN-]=1:1 [0,2H2O2+0,8NaClO]:[CN-]=1: ph Figura 18 Velocidade inicial versus ph na degradação do cianeto pela combinação do peróxido de hidrogênio e hipoclorito de sódio. Condições experimentais: ph = 9 e 11; [CN - ] = 10 mg/l; razão molar [xh 2 O 2 + ynaclo]:[cn - ] =(x+y):1= 1:1 e 2:1 Em resumo, nos três sistemas estudados, o efeito do ph na degradação de cianeto a cianato é muito significativo para o processo de degradação de hipoclorito de sódio e pela combinação de peróxido de hidrogênio com hipoclorito de sódio para formar oxigênio singlete, entretanto para o processo de degradação com H 2 O 2, o efeito do ph na faixa 9 a 11 não tem significância.
12 Influência da Razão Molar na degradação de cianeto livre Influência da razão molar do H 2 O 2 :CN A Figura 19 mostra que as concentrações de cianeto diminuíram de 10 para 7,32 e 8,12 mg/l, para uma razão molar de [H 2 O 2 ] : [CN - ]=1:1, a ph 9 e 11, respectivamente, em 60 minutos de reação. Quando foi dobrada a razão molar para [H 2 O 2 ]:[CN - ] = 2:1, as concentrações de cianeto diminuíram de 10 até 6,68 e 7,35 mg/l, a ph 9 e 11, respectivamente, em 60 minutos de reação. Vê-se que a atuação isolada do H 2 O 2 é pouco eficiente. E que, além disso, o efeito do aumento da relação molar relativa [H 2 O 2 ]:[CN - ]=1:1 para 2:1 pouco afeta a velocidade de degradação do cianeto. Segundo REDA E NADJEMI (2009), os cianetos são removidos completamente em razões molares superiores a [H 2 O 2 ]: [CN - ] = 20:1, em um tempo mínimo de 5 horas. A remoção total de cianeto pelo peróxido de hidrogênio não foi alcançada em 60 minutos de reação. A degradação ocorreu de forma lenta, sendo necessário um tempo de 6 horas e 30 minutos (calculado por extrapolação), no mínimo para atingir uma eficiência de remoção considerável. Pode-se observar na Figura 20 que a velocidade inicial da remoção de cianeto, determinada a partir da Figura 19, pouco aumenta com o incremento da razão molar. Para a razão molar de [H 2 O 2 ]: [CN-] = 1:1 e 2:1, as velocidades iniciais de remoção de cianeto são 0,0024 e mmol/l.min, a ph 11e 0,003 e 0,004 mnol/l.min, a ph 9 (Tabela 15). REDA E NADJEMI (2009), estudaram a remoção de cianeto por peróxido de hidrogênio em presença de carvão ativado e relataram o mesmo efeito da razão molar [H 2 O 2 ]/[CN - ] = 2, 5, 10, 20. Constaram que a velocidade aumenta com aumento da razão molar. Além disso, foi observado que a taxa inicial de remoção
13 [CN - ] (mg/l) 81 de cianeto, melhora significativamente para razões molares de 10 e 20. SARLA (2004), PAK E CHANG (1997), observaram que o aumento da razão molar produzia o mesmo efeito na velocidade inicial da remoção de cianeto por catálise homogênea e heterogênea ph = 9, [H2O2]:[CN-]=1:1 ph =11, [H2O2]:[CN-]=1:1 ph = 9, [H2O2]:[CN-]=2:1 ph =11, [H2O2]:[CN-]=2: Tempo ( minutos) Figura 19 Efeito da razão molar [H 2 O 2 ]:[CN - ] sobre a degradação de cianeto por H 2 O 2. Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [H 2 O 2 ]:[CN - ] = 1:1 e 2:1.
14 r A (mmol/l.min) ph=9 ph= Razão molar Figura 20 Velocidade inicial da degradação de cianeto por H 2 O 2, Condições experimentais: ph = 9 e 11, [CN - ] = 10 mg/l e razão molar [H 2 O 2 ]:[CN - ] = 1:1 e 2: Influência da razão molar de NaClO:CN Analisando a atuação isolada do oxidante NaClO, vê-se que ao aumentar a relação molar relativa [NaClO]:[CN - ] de 1:1 para 2:1, o cianeto é oxidado rapidamente em apenas 5 minutos a ph 11, obtendo-se uma eficiência de remoção de 99,9 %. Quando a razão molar foi [NaClO]:[CN - ]=1:1 a reação não foi completa, não atingindo a concentração de cianeto livre final esperada de [CN] < 0,2 mg/l. Esse fato, geralmente está associado à formação de intermediários na reação, ou ao consumo de oxidantes por outros compostos, ou mais provavelmente, neste caso, à perda de concentração de cloro ativo devido à decomposição espontânea do hipoclorito. Embora, para efeito de processo as soluções diluídas de hipoclorito de sódio tenham se mostrado estáveis quanto ao teor de cloro ativo, por um
15 83 período aproximado de 3 a 5 horas, tempo suficiente para ocorrer a degradação do cianeto com hipoclorito de sódio (DA COSTA, 1982) As Figura 21 e 22, ilustram a degradação do cianeto pelo NaClO. Vê-se que a atuação isolada do hipoclorito de sódio é muito eficiente para razões molares iguais ou acima de [NaClO]:[CN - ]=1:1. O efeito do aumento da relação molar relativa de [NaClO]:[CN - ] = 1:1 para 2:1, afeta significativamente a velocidade da reação. As concentrações do cianeto para razão molar de [NaClO]:[CN - ]=1:1, diminuíram de 10 até 0,85 e 0,27 mg/l, com uma remoção total de 91,5 e 97,3 % a ph 9 e 11, respectivamente, para um tempo de 60 minutos de reação, onde a melhor remoção foi obtida a um ph 11. Quando as razões molares foram de [NaClO]:[CN - ]= 0.8:1, 0.6:1, 0.4:1 e 0.2:1, as concentrações do cianeto apenas diminuem de 10 mg/l a 1,93; 4,13; 6,08, 8,11 e 2,02; 3,83; 5,64; 7,70 mg/l, a ph 9 e 11, respectivamente. As remoções alcançadas para cada razão molar são apresentadas na Tabela 15. Cabe observar, que para as mesmas condições experimentais, ocorre em paralelo alguma degradação natural (sem adição de reagentes) do cianeto livre de 0,78 e 0,19 mg/l a ph 9 e 11 respectivamente, em 60 minutos de reação (Figura A1-1). Quando a razão molar foi aumentada para [NaClO]:[CN - ]=2:1, o cianeto atingiu uma concentração de 0,02 mg/l a ph 9, em 30 minutos de reação, e 0,01 mg/l, a ph 11, em 5 minutos de reação. Para ambas faixas de ph foi alcançada uma remoção total do cianeto como se mostra na Figura 23 e 24. Os resultados estão de acordo com DA ACOSTA (1982), onde a adição de hipoclorito de sódio em excesso (em torno de 100%) oxidou o cianeto livre em 10 minutos de reação. Segundo BAKES E PIRET (1989), o tratamento de efluentes cianídricos pelo hipoclorito de sódio, indicam tempos de residência muito curtos.
16 [CN - ] (mg/l) [NaClO]:[CN-]=0,4:1, ph = 9 [NaClO]:[CN-]=0,2:1, ph = 9 [NaClO]:[CN-]=0,6:1, ph = 9 [NaClO]:[CN-]=0,8:1, ph = 9 [NaClO]:[CN-]=1:1, ph = 9 [NaClO]:[CN-]=2:1, ph = Tempo ( minutos) Figura 21 Efeito da razão molar [NaClO]:[CN - ] sobre a degradação de cianeto por hipoclorito de sódio. Condições experimentais: ph = 9, [CN - ] = 10 mg/l e várias razões molares [NaClO]:[CN - ].
17 [CN - ] (mg/l) [NaClO]:[CN-]=0,2:1, ph = 11 [NaClO]:[CN-]=0,4:1, ph = 11 [NaClO]:[CN-]=0,8:1, ph = 11 [NaClO]:[CN-]=1:1, ph = 11 [NaClO]:[CN-]=0,6:1, ph = 11 [NaClO]:[CN-]=2:1, ph = Tempo ( minutos) Figura 22 Efeito da razão molar [NaClO]:[CN - ] sobre a degradação de cianeto por hipoclorito de sódio. Condições experimentais: ph = 11, [CN - ] = 10 mg/l, e várias razões molares [NaClO]:[CN - ].
18 Remoção do cianeto (%) [NaClO]:[CN-]=1:1, ph = [NaClO]:[CN-]=2:1, ph = 11 [NaClO]:[CN-]=0,8:1, ph = [NaClO]:[CN-]=0,6:1, ph = 11 [NaClO]:[CN-]=0,4:1, ph = [NaClO]:[CN-]=0,2:1, ph = Tempo ( minutos) Figura 23 Efeito da razão molar [NaClO]:[CN - ] sobre a remoção de cianeto por hipoclorito de sódio. Condições experimentais: ph = 11, [CN - ] = 10 mg/l e várias razões molares [NaClO]:[CN - ].
19 Remoção do cianeto (%) [NaClO]:[CN-]=1:1, ph = 9 [NaClO]:[CN-]=2:1, ph = 9 [NaClO]:[CN-]=0,8:1, ph = 9 [NaClO]:[CN-]=0,6:1, ph = 9 [NaClO]:[CN-]=0,4:1, ph = 9 [NaClO]:[CN-]=0,2:1, ph = Tempo ( minutos) Figura 24 Efeito da razão molar [NaClO]:[CN - ] sobre a remoção de cianeto por hipoclorito de sódio. Condições experimentais: ph = 9, [CN - ] = 10 mg/l e várias razões molares [NaClO]:[CN - ]. A Figura 25 mostra que a velocidade inicial de remoção de cianeto é incrementada significativamente com o aumento da razão molar. Para razões molares de [NaClO]:[CN - ]= 2:1, as velocidades iniciais de remoção de cianeto são 0,079 e 0,15 mmol/l.min, a ph 9 e 11, respectivamente (Tabela 15).
20 r A (mmol/l.min) ph=11 ph= Razão molar Figura 25 Velocidade inicial da degradação de cianeto por hipoclorito, Condições experimentais: ph 9 e 11, [CN - ] = 10 mg/l e vários valores de razão molar [NaClO]:[CN - ] Influência da razão molar da combinação do (H 2 O 2 e NaClO):CN Na Figura 26, observa-se a degradação do cianeto através da combinação do peróxido de hidrogênio e hipoclorito de sódio. O gráfico mostra que a combinação dos dois oxidantes resulta em uma maior eficiência quando comparado a ação dos dois oxidantes de maneira isolada. Além disso, o efeito do aumento da relação molar relativa [H 2 O 2 +NaClO]:[CN - ] de 1:1 para 2:1, afeta significativamente a velocidade inicial de reação. As Figuras 26 e 27 mostram os resultados da avaliação de diferentes combinações entre razões molares dos oxidantes. Quando a razão molar foi
21 89 [0,8H 2 O 2 +0,2NaClO]: [CN - ]=1:1, ou seja, quando o peróxido de hidrogênio se encontrava em excesso em relação ao hipoclorito de sódio, as concentrações iniciais de cianeto, diminuíram nos primeiros dois minutos de 10 até 8,56 e 7,21 mg/l, representando uma remoção de 14,35 e 27,89%, a ph 9 e 11, respectivamente. Para esta combinação de razão molar, a oxidação de cianeto ocorreu de forma lenta e ineficiente, pois após dois minutos até o fim da reação, a concentração de cianeto diminuiu até 6,02 e 6,92 mg/l, com uma remoção final de 39,3 e 30,8%, a ph 9 e 11, respectivamente. Estes resultados podem ser explicados do ponto de vista estequiométrico, onde o número de mols de H 2 O 2 adicionado será igual ao de OCl -, gerando um volume equimolar de 1 O 2, ou seja a razão entre reagente e produto é 1:1. (WANDERSON R. et. al., 2008). Portanto, na reação, só será consumido parte do peróxido de hidrogênio, a parte remanescente oxidará de maneira isolada ao cianeto. As Figuras 28 e 29 mostram que para uma razão molar de [0,2H 2 O 2 +0,8NaClO]:[CN - ] =1:1, ou seja, quando o hipoclorito de sódio se encontrava em excesso em relação ao peróxido de hidrogênio, a velocidade de degradação do cianeto foi um pouco mais eficiente quando comparada com a velocidade de degradação para a razão molar [0,8H 2 O 2 +0,2NaClO]:[CN - ] =1:1 (peróxido em excesso). As concentrações de cianeto nos dois primeiros minutos diminuíram de 10 até 5,62 e 4,54 mg/l, com uma remoção de 43 e 54,13%, para ph 9 e 11, respectivamente. Observou-se também que para esta razão molar, o cianeto atingiu uma menor concentração em 60 minutos de reação, sendo estes valores de 2,49 e 3,32 mg/l, com uma remoção final de 75,1 e 54,13%, a ph 9 e 11, respectivamente. No entanto, este combinação se mostrou pouco eficiente para oxidar o cianeto a concentrações menores do que 0,2 mg/l. Quando as razões molares dos oxidantes foram estequiometricamente iguais, a degradação de cianeto foi muito mais eficiente. Quando a razão molar foi de [0,5H 2 O 2 +0,5NaClO]:[CN - ]=1:1, nos primeiros dois minutos de reação, a concentração de cianeto diminuiu de 10 mg/l até 3,1 e 2,19 mg/l, a ph 9 e 11, respectivamente, com uma remoção de 69 e 77,60 %. Para os 60 minutos de reação, a concentração de cianeto diminuiu de 10 mg/l a 0,27 mg/l e 1,76 mg/l, a ph 9 e 11, respectivamente, o que representa uma remoção de 97,3 e 82,4
22 [CN - ] (mg/l) 90 %. Quando a razão molar foi dobrada [1H 2 O 2 +1NaClO]:[CN - ]=2:1 e as concentrações molares dos oxidantes foram estequiometricamente iguais, as concentrações de cianeto diminuíram de 10 mg/l até 0,10 mg/l, em 30 minutos a ph 9, e para ph 11, diminuiu rapidamente de 10 até 0,11 mg/l, em 2 minutos. Isto representou uma remoção de 84,5 e 98,9%, a ph 9 e 11 respectivamente, tal como se mostra nas Figuras 30 e 31. A partir destes resultados verifica-se que a remoção de cianeto pela combinação do peróxido de hidrogênio e hipoclorito de sódio para gerar oxigênio singlete é muito rápida e eficiente, e que a maior parte da oxidação ocorre nos dois primeiros minutos [0,8H2O2+0,2NaClO]:[CN-]=1:1, ph =9 [0,6H2O2+0,4NaClO]:[CN-]=1:1, ph =9 [0,4H2O2+0,6NaClO]:[CN-]=1:1, ph =9 [0,2H2O2+0,8NaClO]:[CN-]=1:1, ph =9 [0,5H2O2+0,5NaClO]:[CN-]=1:1, ph =9 [1H2O2+1NaClO]:[CN-]=2:1, ph = Tempo (minutos) Figura 26 Efeito da razão molar sobre a degradação de cianeto pela combinação de H 2 O 2 +NaClO para gerar oxigênio singlete. Condições experimentais: ph = 9, [CN - ] = 10 mg/l e razão molar de [xh 2 O 2 +ynaclo]:[cn - ]= (x+y):1=1:1 e 2:1.
23 [CN - ] (mg/l) [0,8H2O2+0,2NaClO]:[CN-]=1:1, ph =11 [0,6H2O2+0,4NaClO]:[CN-]=1:1, ph =11 [0,4H2O2+0,6NaClO]:[CN-]=1:1, ph = [0,2H2O2+0,8NaClO]:[CN-]=1:1, ph =11 [0,5H2O2+0,5NaClO]:[CN-]=1:1, ph =11 [1H2O2+1NaClO]:[CN-]=2:1, ph = Tempo (minutos) Figura 27 Efeito da razão molar sobre a degradação de cianeto pela combinação de H 2 O 2 +NaClO para gerar oxigênio singlete. Condições experimentais: ph = 11, [CN - ] = 10 mg/l e razão molar de [xh 2 O 2 +ynaclo]:[cn - ]= (x+y):1=1:1 e 2:1.
24 Remoção do cianeto (%) [0,5H2O2+0,5NaClO]:[CN-]=1:1, ph = [1H2O2+1NaClO]:[CN-]=2:1, ph =9 [0,8H2O2+0,2NaClO]:[CN-]=1:1, ph = [0,6H2O2+0,4NaClO]:[CN-]=1:1, ph =9 [0,4H2O2+0,6NaClO]:[CN-]=1:1, ph =9 [0,2H2O2+0,8NaClO]:[CN-]=1:1, ph = Tempo ( minutos) Figura 28 Efeito da razão molar sobre a remoção de cianeto pela combinação de H 2 O 2 +NaClO para gerar oxigênio singlete. Condições experimentais: ph = 9, [CN - ] = 10 mg/l e razão molar [xh 2 O 2 +ynaclo]:[cn - ]= (x+y):1=1:1 e 2:1.
25 Remoção do cianeto (%) [0,5H2O2+0,5NaClO]:[CN-]=1:1, ph =11 [1H2O2+1NaClO]:[CN-]=2:1, ph =11 [0,8H2O2+0,2NaClO]:[CN-]=1:1, ph =11 [0,6H2O2+0,4NaClO]:[CN-]=1:1, ph =11 [0,4H2O2+0,6NaClO]:[CN-]=1:1, ph =11 [0,2H2O2+0,8NaClO]:[CN-]=1:1, ph = Tempo ( minutos) Figura 29 Efeito da razão molar sobre a remoção do cianeto pela combinação de H 2 O 2 +NaClO para gerar oxigênio singlete. Condições experimentais: ph = 11, [CN - ] = 10 mg/l e razão molar [xh 2 O 2 +ynaclo]:[cn - ]= (x+y):1=1:1 e 2:1. A Figura 30 mostra que a velocidade inicial de remoção de cianeto é incrementada significativamente com o aumento da razão molar [H 2 O 2 +NaClO]:[CN - ]=1:1 para 2:1. Isto poderia interpretado como o resultado de um aumento na taxa de geração do 1 O 2, que por sua vez induz um aumento correspondente na taxa de ataque sobre as moléculas do cianeto. Observa-se que a maior velocidade de degradação de cianeto, foi alcançada para a razão molar de [0,5H 2 O 2 +0,5NaClO]:[CN - ]=1:1, ou seja, quando os oxidantes se encontravam estequiometricamente iguais. Para as diferentes combinações dos oxidantes (xh 2 O 2 +ynaclo) para gerar oxigênio singlete, observa-se que, quando y foi
26 r A (mmol/l.min) 94 maior, a velocidade de reação foi mais eficiente que quando x foi maior. Após gerar o oxigênio singlete e por sua vez colidir com o cianeto, até o par gerador (do oxigênio singlete) se esgotar, inicia-se a atuação isolada do peróxido de hidrogênio ou hipoclorito de sódio remanescente, onde a velocidade de degradação do hipoclorito de sódio é muito mais eficiente que a velocidade de degradação do peróxido de hidrogênio. Então para maiores dosagens ou razões molares (para uma estequiometria de oxidantes iguais), maior será a velocidade inicial de degradação do cianeto, e menor será o tempo necessário para a oxidação completa de cianetos ph=11 ph= Fração molar em mistura [xh 2 O 2 +ynaclo]:[cn-]=(x+y):1=1:1 Figura 30 Velocidade inicial de degradação do cianeto pela combinação de H 2 O 2 +NaClO para gerar oxigênio singlete. Condições experimentais: ph 9 e 11, [CN - ] = 10 mg/l e vários valores de razão molar [xh 2 O 2 +ynaclo]:[cn - ] = 1:1, onde x+y=1.
27 Eficiencia da remoção (%) 95 A Figura 31, mostra a comparação da eficiência de remoção de cianeto pela combinação de peróxido de hidrogênio e hipoclorito de sódio para gerar oxigênio singlete, a diferentes razões molares e, para os primeiros dois minutos de reação. As Razões molares que alcançaram maiores eficiências foram [0,5H 2 O 2 +0,5NaClO]:[CN - ]=1:1 e [1H 2 O 2 +1NaClO]:[CN - ] =2:1. Podemos observar que as melhores eficiências de remoção de cianeto são obtidas, quando o hipoclorito de sódio e peróxido de hidrogênio, estejam estequiometricamente iguais (0,8+0,2):1 (0,6+0,4):1 (0,5+0,5):1 (0,4+0,6):1 (0,2+0,8):1 (1+1):1 ph= ph= Figura 31 Eficiência da remoção de cianeto pelo processo combinado peróxido de hidrogênio e hipoclorito de sódio para gerar oxigênio singlete. Condições experimentais: ph 9 e 11, [CN - ] = 10 mg/l, razão molar [xh 2 O 2 +ynaclo]:[cn - ] = (x+y):1=1:1 e 2:1 e tempo = 2 minutos.
28 [CN - ] (mg/l) Influência da concentração inicial do cianeto Degradação com H 2 O 2 Como o esperado para uma reação de segunda ordem, as curvas cinéticas das Figuras 32 e 33, mostram que a taxa de degradação de cianeto pelo peróxido de hidrogênio, de uma solução com concentração inicial de cianeto igual a 1000 mg/l, é maior que para as soluções com concentração de 500, 100 e 10 mg/l [CN-] = 10 mg/l, ph=9 [CN-] = 100 mg/l, ph=9 [CN-] = 500 mg/l, ph=9 [CN-] = 1000 mg/l, ph=9 [CN-] = 10 mg/l, ph=11 [CN-] = 100 mg/l, ph=11 [CN-] = 500 mg/l, ph=11 [CN-] = 1000 mg/l, ph= Tempo ( minutos) Figura 32 Efeito da concentração inicial de cianeto sobre a degradação de cianeto com H 2 O 2. Condições experimentais: ph = 9 e 11, [CN - ] = 10, 100, 500 e 1000 mg/l e razão molar [H 2 O 2 ]:[CN - ]= 1:1.
29 Remoção do cianeto (%) [CN-] = 10 mg/l, ph=9 [CN-] = 100 mg/l, ph=9 [CN-] = 500 mg/l, ph=9 [CN-] = 1000 mg/l, ph= Tempo ( minutos) Figura 33 Efeito da concentração inicial de cianeto sobre a remoção de cianeto pelo H 2 O 2. Condições experimentais: ph = 9, [CN - ] = 10, 100, 500 e 1000 mg/l e razão molar [H 2 O 2 ]:[CN - ]= 1:1. Segundo CINOPOLI (2004), a reação de oxidação de cianeto livre é lenta, pois parte do oxidante que leva mais tempo para reagir, acaba se decompondo em água e oxigênio. Este fato fica evidenciado pela faixa de ph de (9 a 11, estudada), que favorece a decomposição em paralelo com o oxidante. Assim, verificou-se que esta menor eficiência da oxidação é decorrente do esgotamento do oxidante após certo tempo de reação, em função dos mecanismos de oxidação e decomposição do H 2 O 2. A ação positiva da concentração de cianeto é determinada quantitativamente através de análise cinética, apresentada mais adiante em
30 [CN - ] (mg/l) Degradação com NaClO A Figura 34 mostra os resultados da degradação de cianeto por hipoclorito de sódio, para as concentrações iniciais de cianeto iguais a 10, 100, 500, 1000 mg/l, para razões molares [NaClO]:[CN - ]=1:1, na faixa de ph de 9 a 11. Pode-se observar que a taxa de remoção de cianeto, cresce significativamente com o aumento da concentração inicial de cianeto, como é mostrado na Tabela A [CN-] = 10 mg/l, ph=9 [CN-] = 100 mg/l, ph=9 [CN-] = 500 mg/l, ph=9 [CN-] =1000 mg/l, ph=9 [CN-] = 10 mg/l, ph=11 [CN-] = 100 mg/l, ph=11 [CN-] = 500 mg/l, ph=11 [CN-] = 1000 mg/l, ph= Tempo ( minutos) Figura 34 Efeito da concentração inicial de cianeto sobre a degradação de cianeto por NaClO, Condições experimentais: ph = 9 e 11, [CN - ] = 10, 100, 500 e 1000 mg/l e razão molar [NaClO]:[CN - ]= 1:1.
31 99 A Figura 35 mostra que a taxa inicial de degradação do cianeto, para uma solução contendo concentração inicial de cianeto igual a 1000 mg/l é muito maior do que para as soluções com concentrações de 500, 100 e 10 mg/l. Além disso, a ph 11, nas diferentes concentrações iniciais de cianeto, a degradação de cianeto ocorre nos primeiros minutos, obtendo-se uma degradação aproximada de 75% nos primeiros 5 minutos. Para ph 9 ocorre uma degradação de 60% nos primeiros 20 minutos de reação. Cabe mencionar que uma maior concentração inicial de cianeto, proporciona estequiometricamente, uma maior quantidade de hipoclorito de sódio, considerando-se um mesmo volume inicial. Observa-se na Figura 35 que para testes feitos com concentrações iniciais de cianeto iguais a 100 e 1000 mg/l, e para ph 11, as concentrações seguem um comportamento semelhante. Entretanto, a ph 9 e concentração inicial de cianeto de 1000 mg/l, inicialmente o cianeto oxidou mais rapidamente nos primeiros minutos do que para 10 mg/l. Portanto, uma maior concentração inicial de cianeto, proporcionará uma maior eficiência de remoção de cianeto, nos minutos iniciais, em decorrência da maior disponibilidade das moléculas reagentes (considerando o mesmo volume inicial). Entretanto, para a concentração inicial de 10 mg/l, o oxidante reage lentamente, porque as moléculas se encontram mais dispersas. A ação positiva da concentração de cianeto é determinada quantitativamente na análise cinética apresentada mais adiante em
32 Remoção do cianeto (%) [CN-] = 10 mg/l, ph=11 [CN-] = 100 mg/l, ph=11 [CN-] = 500 mg/l, ph=11 [CN-] = 1000 mg/l, ph= Tempo ( minutos) Figura 35 Efeito da concentração inicial dr cianeto, sobre a remoção de cianeto por NaClO. Condições experimentais: ph = 11, [CN - ] = 10, 100, 500 e 1000 mg/l e razão molar [NaClO]:[CN - ]= 1: Degradação pela combinação de H 2 O 2 e NaClO Através da análise das Figuras 36 e 37, foi observado que a taxa inicial de oxidação de cianeto, para uma solução contendo concentração inicial desta espécie igual a 1000 mg/l é muito maior que para soluções com concentrações iguais a 500, 100 e 10 mg/l. Acredita-se que esta diferença se deva à maior quantidade de oxigênio singlete gerado pela combinação do peróxido de hidrogênio e hipoclorito de sódio estequiometricamente adicionada. A Figura 38, mostra o efeito da concentração inicial de cianeto sobre a remoção de cianeto nos primeiros dois minutos, para uma [CN - ]=1000 mg/l, a
33 [CN - ] (mg/l) 101 remoção do cianeto pela combinação de H 2 O 2 e NaClO, para uma razão molar de [0,5H 2 O 2 +0,5NaClO]:[CN - ]=1:1, foi de 91,3% e 94%, a ph 9 e 11, respectivamente. Para concentrações iniciais de 500mg/L e 100 mg/l, as porcentagens de remoção foram semelhantes, como pode-se observar na Tabela A1-1. Observou-se que para todas as concentrações iniciais de 1000, 500, 100 e 10 mg/l, a velocidade inicial de remoção a ph 11, é mais acentuada do que ph 9. No entanto, após os primeiros dois minutos a ph 11, a velocidade de remoção decresce muito. Para ph 9 a velocidade é moderada no decorrer dos 60 minutos, atingindo concentrações de cianeto menores do que 0,2 mg/l [CN-] = 10 mg/l, ph=9 [CN-] = 100 mg/l, ph=9 [CN-] = 500 mg/l, ph=9 [CN-] =1000 mg/l, ph= Tempo ( minutos) Figura 36 Efeito da concentração inicial de cianeto sobre a degradação de cianeto pelo processo combinação de H 2 O 2 e NaClO para gerar oxigênio singlete, Condições experimentais: ph = 9, [CN - ] = 10, 100, 500 e 1000 mg/l e razão molar [NaClO]:[CN - ]= 1:1
34 [CN - ] (mg/l) [CN-] = 10 mg/l, ph=11 [CN-] = 100 mg/l, ph=11 [CN-] = 500 mg/l, ph=11 [CN-] = 1000 mg/l, ph= Tempo ( minutos) Figura 37 Efeito da concentração inicial de cianeto sobre a degradação de cianeto pelo processo combinado de H 2 O 2 e NaClO para gerar oxigênio singlete, Condições experimentais: ph = 11, [CN - ] = 10, 100, 500 e 1000 mg/l e razão molar [NaClO]:[CN - ]= 1:1
35 Remoção do cianeto (%) [CN-] = 10 mg/l, ph= [CN-] =1000 mg/l, ph=9 [CN-] = 10 mg/l, ph= [CN-] = 1000 mg/l, ph= Tempo ( minutos) Figura 38 Efeito da concentração inicial de cianeto sobre a remoção de cianeto pelo processo combinado de H 2 O 2 e NaClO para gerar oxigênio singlete, Condições experimentais: ph = 9 e 11, [CN - ] = 10 e 1000 mg/l e razão molar [NaClO]:[CN - ] = 1:1 A ação positiva da concentração de cianeto é determinada quantitativamente na análise cinética apresentada mais adiante em
36 Analise Comparativa da degradação de cianeto com H 2 O 2 e NaClO aplicados separadamente e pelo sistema combinado (H 2 O 2 +NaClO) Segundo BOTZ (2005), YOUNG e JORDAN (1995), vários processos podem ser utilizados para a remoção dos cianetos em soluções alcalinas. As Figuras 39 e 40 mostram a degradação de cianeto com peróxido de hidrogênio e hipoclorito de sódio, separadamente, em comparação à degradação de cianeto pelo processo combinado (peróxido de hidrogênio e hipoclorito de sódio), para gerar o oxigênio singlete. Observou-se um desempenho significativamente diferente entre o processo combinado e os processos utilizando peróxido de hidrogênio e hipoclorito de sódio separadamente. O processo combinado (H 2 O 2 +NaClO) para gerar oxigênio singlete, mostrou-se muito mais eficiente que o H 2 O 2 e NaClO separadamente. As figuras ilustram que, a concentração de cianeto oxidado com peróxido de hidrogênio, diminuiu de 100 mg/l até 82,51 e 87,15 mg/l, com um porcentagem de remoção de 17 e 14%, em um tempo de 20 minutos, a ph 9 e 11, respectivamente. Quando foi dobrada a razão molar não ocorreu uma diferença significativa na oxidação de cianeto, a concentração de cianeto diminuiu de 100 mg/l até 75,25 e 84,23 mg/l, com porcentagem de remoção de 22,86 e 17%, em 20 minutos, a ph 9 e 11, respectivamente. Portanto a oxidação de cianeto pelo peróxido de hidrogênio, ocorre lentamente, sendo necessário um maior tempo de reação para atingir valores finais baixos de concentração do cianeto. Segundo TUCKER (1987), a reação de oxidação do cianeto pelo peróxido de hidrogênio é mais lenta, mas pode ser acelerada pela adição de catalisadores, como cobre formando o complexo [Cu(CN) 4 ] -, facilmente oxidável. YEDDOU E NADJEMI (2009), argumentam que o peróxido de hidrogênio isolado é pouco eficiente para oxidar o cianeto e que uma melhor eficiência de oxidação poderá ser obtida com peróxido de hidrogênio em presença de carvão ativado. Entretanto, o tempo e a concentração final dependem diretamente das variáveis de razão molar, ph e condições experimentais.
37 105 As Figuras 39 e 40, mostram a degradação de cianeto com hipoclorito de sódio, apresentou. As concentrações de cianeto, diminuiram de 100 mg/l até 81,97 e 65,57 mg/l, com uma eficiência de remoção de 18 e 34%, em 2 minutos, a ph 9 e 11, respectivamente. No entanto, a ph 11 o hipoclorito de sódio reduziu a concentração do cianeto até 0,2 mg/l, em 60 minutos. Quando a razão molar foi dobrada de [NaClO]:[CN - ] = 1:1 para 2:1, a degradação de cianeto foi mais eficiente, conseguindo oxidar o cianeto totalmente, nos primeiros cinco minutos de reação, com uma eficiência de remoção de 99,8%, a ph 11. Entretanto, para ph 9, foi atingida uma concentração de 0,15 mg/l, com porcentagem de remoção de 99,9%, nos 30 minutos de reação. Segundo YEDDOU E NADJEMI (2009), o processo de cloração alcalina é eficaz e assegura a oxidação em solução de cianetos livres e cianetos em complexos fracos (WADs), para cianato (CNO - ) ou para. No entanto, este processo foi gradualmente substituído por outros processos, devido a geração do intermediário CNCl volátil, que é uma espécie muito tóxica. Alem disso, a presença de matéria orgânica nos efluentes pode, depois de cloração alcalina, ocasionar a formação dos compostos organoclorados. No presente estudo, o cianeto foi degradado pelo processo combinado de peróxido de hidrogênio e hipoclorito de sódio para produzir oxigênio singlete, cujo potencial de oxidação eh = 2,42 V, é superior ao do hipoclorito (1,43 V) e do peróxido de hidrogênio (1,77 V). Quando a razão molar foi [1H 2 O 2 +1NaClO]:[CN - ]=2:1, o cianeto diminuiu de 100 até 0,04 mg/l, com uma eficiência de remoção de 100%, em 20 minutos, a ph 9. Entretanto a ph 11, o cianeto diminuiu de 100 até 0,011 mg/l, em 2 minutos e com uma eficiência de remoção de 100%. Os resultados atingiram o nivel estabelecido pela legislação CONAMA 430 (CN livre 0,2 mg/l), em ambas faixas de ph. Na Figura 41, mostra-se a eficiência de remoção de cianeto pelos três processos estudados, pelo hipoclorito de sódio e peróxido de hidrogênio isolados e combinados para gerar oxigênio singlete. Observa-se que a atuação do oxigênio singlete na oxidação do cianeto é mais eficiente.
38 [CN - ] mg/l [H2O2]:[CN-]=2:1, ph =11 [NaClO]:[CN-]=2:1, ph =11 [H2O2+NaClO]:[CN-]=2:1, ph =11 [H2O2]:[CN-]=2:1, ph =9 [NaClO]:[CN-]=2:1, ph =9 [H2O2+NaClO]:[CN-]=2:1, ph = Tempo ( minutos) Figura 39 Comparação da degradação de cianeto por H 2 O 2, NaClO separados e combinados para gerar oxigênio singlete nas seguintes condições: Concentração inicial do cianeto [CN - ] = 100mg/L, ph= 9 e 11, e razões molares: [H 2 O 2 ]:[CN - ] = 2:1, [NaClO]:[CN - ] = 2:1, [H 2 O 2 +NaClO]:[CN - ]= 2:1
39 Remoção do cianeto (%) [H2O2]:[CN-]=2:1, ph =9 [NaClO]:[CN-]=2:1, ph =9 [H2O2+NaClO]:[CN-]=2:1, ph =9 [H2O2]:[CN-]=2:1, ph =11 [NaClO]:[CN-]=2:1, ph =11 [H2O2+NaClO]:[CN-]=2:1, ph = Tempo ( minutos) Figura 40 Comparação da remoção de H 2 O 2, NaClO separados e combinados para gerar oxigênio singlete nas seguintes condições: Concentração inicial do cianeto [CN - ] = 100mg/L, ph= 9 e 11, e razões molares: [H 2 O 2 ]:[CN - ]=2:1, [NaClO]:[CN - ]=2:1, [H 2 O 2 +NaClO]:[CN - ]=2:1.
40 Eficiencia de degradação do cianeto (%) ph=9, [1:1] ph=11, [1:1] ph=9, [1:2] ph=11, [1:2] H2O2 NaClO H2O2+NaClO (Oxigênio Singlete) Figura 41 Comparação da eficiência de degradação de H 2 O 2, NaClO separados e combinados para gerar oxigênio singlete, nas seguintes condições: Concentração inicial do cianeto [CN - ] = 100mg/L, ph= 9 e 11, razões molares: [H 2 O 2 ]:[CN - ]=1:1 e 2:1, [NaClO]:[CN - ]=1:1 e 2:1, [H 2 O 2 +NaClO]:[CN - ]= 1:1 e 2:1, tempo = 2 minutos. A Figura 42 mostra as velocidades iniciais de oxidação do cianeto, pelos diferentes oxidantes (peróxido de hidrogênio e hipoclorito de sódio separados e combinados para gerar oxigênio singlete). A velocidade inicial da combinação dos oxidantes H 2 O 2 e NaClO (oxigênio singlete), foi muito superior, quando comparada com as velocidades dos reagentes separados. A diferença foi bastante significativa, sendo as velocidades iguais a 1,49 mmol/l.min, para o processo combinado, 0,34 mmol/l.min, para o processo com hipoclorito de sódio e 0,03 mmol/l.min, para o processo com peróxido de hidrogênio, a ph 9. Entretanto a ph 11, as velocidades foram 1,58 mmol/l.mol, para o processo combinado, 0,66 mmol/l.mol, para o processo com hipoclorito de sódio e 0,021 mmol/l.mol, para o processo realizado com peróxido de hidrogênio.
41 r A (mmol/l.min) 109 [H2O2]:[CN-]=2: [NaClO]:[CN-]=2:1 [H2O2+NaClO]:[CN-]=2: ph Figura 42 Comparação da velocidade inicial de degradação do cianeto pelos processos de H 2 O 2, NaClO separados e combinados, nas seguintes condições: Concentração inicial do cianeto [CN - ] = 100mg/L, ph= 9 e 11, e razões molares [H 2 O 2 ]:[CN - ]= 2:1, [NaClO]:[CN - ]= 2:1, [H 2 O 2 +NaClO]:[CN - ] = 2:1 Em resumo, a ação combinada do peróxido de hidrogênio e hipoclorito de sódio na oxidação do cianeto torna a reação significativamente mais rápida nos dois primeiros minutos da reação, em comparação com os processos realizados separadamente dos oxidantes peróxido de hidrogênio e hipoclorito de sódio.
42 Avaliação Cinética dos três processos estudados Cinética da oxidação com peróxido de hidrogênio Os processos que ocorrem durante a oxidação do cianeto podem ser simplificadamente descritos por: (62) Desta forma a taxa de reação do processo pode ser descrita pela equação: [ ] [ ] [ ] (63) Onde: a é a ordem de reação em relação ao íon cianeto b é a ordem da reação em relação ao peróxido de hidrogênio k 1 é a constante de velocidade para a taxa de reação de oxidação com peróxido de hidrogênio Na Figura 43, mostra-se a ordem aparente da reação (62) com respeito ao [H 2 O 2 ]. A proporção de ( [ ] ) [ ], forneceu um valor de 0,38 e 0,42 a ph 9 e 11 respectivamente, para uma relação empírica sugerido do tipo [ ] [ ] (64) Onde: K 1app é a constante de velocidade aparente para a taxa de reação de oxidação com peróxido de hidrogênio. Os valores da constante de velocidade aparente são mostrados na Tabela 15.
43 Log r A (mg/l.min) ph=9 ph= Log [H 2 O 2 ] (mg/l) Figura 43 Log da velocidade inicial da degradação do cianeto / log da concentração do peróxido de hidrogênio. Condições: [CN - ] = 10 mg/l, ph = 9 e 11, razão molares: [H 2 O 2 ]:[CN - ]=1:1 e 2:1. Tabela 15 Valores calculados da ordem aparente da reação e constante de velocidade aparente, na Figura 43 Razão Molar [H 2 O 2 ]:[CN-] ph a K 1app (L/mol.min) 2:1 e 1:1 9 0,38 0,0398 2:1 e 1:1 11 0,42 0,0275 A Figura 44, mostra a ordem aparente da reação (62) com respeito à [CN - ]. A proporção de ( [ ] ) [ ], deu um valor de 1,07 e 1,01, para ph 9 e 11, respectivamente, para uma relação empírica sugerida do tipo:
44 112 [ ] [ ] (65) Onde: k 1app é a constante de velocidade aparente para a taxa de reação de oxidação. Os valores da constante de velocidade aparente são mostrados na Tabela 16. Obtendo-se então a seguinte equação de velocidade: [ ] [ ] [ ] (66) E as constantes de velocidades médias aparentes calculadas foram: k 1app = 0,24x10-1 L / mol.min, a 25 o C, para ph 9, e k 1app = 0,18x10-1 L / mol.min, a 25 o C, para ph 11. Os resultados estão de acordo com YEDDOU et. al. (2011), que estudaram a oxidação do cianeto com peróxido de hidrogênio em presença de Cu-carvão ativado, onde a constante de velocidade para remoção do cianeto por peróxido de hidrogênio (em excesso) foi igual a k = 0,071 L/mol.min, para uma cinética de pseudo segunda ordem em relação à seguinte equação, onde C é a concentração do cianeto e k app é a constante da velocidade aparente.
45 Log r A (mg/l.min) ph= Log [CN - ] (mg/l) Figura 44 Log da velocidade inicial da degradação do cianeto / log da concentração do cianeto. Condições: concentração inicial de cianeto [CN - ] = 10, 100, 500 e 1000 mg/l, ph= 9 e 11, razão molares: [H 2 O 2 ]:[CN - ]=1:1. Tabela 16 Valores calculados da ordem aparente da reação e constante de velocidade aparente, na Figura 44 [CN - ] t=0 mg/l ph b K 1app (L/mol.min) 10, 100, 500, ,07 0, , 100, 500, ,01 0, Cinética da oxidação com hipoclorito de sódio Vários autores sugerem que a reação de cianeto com hipoclorito é realizada melhor em duas etapas. PARGA E SHUKLA (2002), relataram que, a solução do cianeto alcalino e da adição de hipoclorito de sódio pode reagir com cianeto livre baixo a seguinte equação: (67)
46 114 No 1º estagio, na faixa de ph de 11 até 12,8 oxidam-se os cianetos e cianatos, sob ação do hipoclorito de sódio. (68) O cloreto de cianogênio reage rapidamente produzindo cianato (69) No 2º estagio, reduz-se o ph para faixa de 6 a 7.5, ocorrendo a oxidação do cianeto a gás carbônico/bicarbonato e nitrogênio molecular, que são dois gases inertes. (70) Desta forma a taxa de reação da equação (67), pode ser descrita pela equação: [ ] [ ] [ ] (71) Onde: é a ordem de reação em relação ao íon cianeto é a ordem da reação em relação ao peróxido de hidrogênio k 2 é a constante de velocidade para a taxa de reação de oxidação com hipoclorito de sódio A Figura 45, mostra a ordem aparente da reação (67) com respeito ao [NaClO]. A proporção de ( [ ] ) [ ], forneceu um valor de 1,33 e 1,26, a ph 9 e 11, respectivamente, para uma relação empírica sugerido do tipo [ ] [ ] (72) Onde: K 2app é a constante de velocidade aparente para a taxa de reação de oxidação com hipoclorito de sódio.
47 Log r A (mg/l.min) 115 Os valores da constante de velocidade aparente, são mostrados na Tabela ph=9 ph= Log [NaClO] (mg/l) Figura 45 Log da velocidade inicial da degradação do cianeto / log da concentração do hipoclorito de sódio. Condições: concentração inicial do cianeto [CN - ] = 10 mg/l, ph= 9 e 11 e varias razões molares [NaClO]:[CN - ]. Tabela 17 Valores calculados da ordem aparente da reação e constante de velocidade aparente, na Figura 45. Razão Molar [NaClO]:[CN-] ph K 2app (L/mol.min) 2:1, 1:1, 0.8:1, 0.6:1, 0.4:1 9 1,33 0,023 2:1, 1:1, 0.8:1, 0.6:1, 0.4:1 11 1,26 0,054 A Figura 46, mostra a ordem aparente da reação (67) com respeito ao [CN - ]. A proporção de ( [ ] ) [ ], forneceu um valor de 1,17 e 1,14, para ph 9 e 11, respectivamente, para uma relação empírica sugerido do tipo [ ] [ ] (73)
48 Log r A (mgl/l.min) 116 Onde: K 2app é a constante de velocidade aparente para a taxa de reação de oxidação. Os valores da constante de velocidade aparente são mostrados na Tabela 18. Obtendo finalmente a seguinte equação de velocidade: [ ] [ ] [ ] (74) E, as constantes de velocidades médias calculadas foram: k 2app = 0,084 L / mol.min, a 25 o C, a ph 9, e k 2app = 0,059 L / mol.min, a 25 o C, a ph 11. MARQUES (2009), estudou o tratamento de efluentes cianídricos com hipoclorito de sódio. O autor assumiu uma cinética de pseudo primeira ordem, e a seguinte equação [ ] [ ]. As constantes de velocidades de oxidação obtidas foram 0,22; 0,134 e 0,09 min -1, para três diferentes dosagens (0,13: 0,065: e 0,03 M) de hipoclorito de sódio, em valores de ph maiores do que ph=9 ph= Log [CN - ] mg/l Figura 46 Log da velocidade inicial da degradação do cianeto / log da concentração do cianeto. Condições: concentração inicial de cianeto [CN - ] = 10, 100, 500 e 1000 mg/l, ph= 9 e 11, razão molares: [NaClO]:[CN - ] = 1:1.
49 117 Tabela 18 Valores calculados da ordem aparente da reação e constante de velocidade aparente, estão Figura 46. [CN - ] t=0 mg/l ph K app (L/mol.min) 10, 100, 500, ,17 0,145 10, 100, 500, ,14 0, Cinética da oxidação pela combinação de peróxido de hidrogênio e hipoclorito de sódio Mecanismo Simplificado do Processo As reações envolvidas no processo de oxidação do cianeto a cianato pela combinação do peróxido de hidrogênio e hipoclorito de sódio são as seguintes. Primeiramente, ocorre a reação da geração do oxidante principal, oxigênio singlete, pela combinação do peróxido de hidrogênio e hipoclorito de sódio. De acordo com HELD (1978), EVANS E UPTON (1985), a reação de H 2 O 2 com OCl - conduz a 100% de formação de 1 O 2 segundo a seguinte equação. (75) Tempo de vida muito curto Em seguida, ocorre a reação principal de oxidação do cianeto, o oxigênio singlete colide com o cianeto em microssegundos, para formar o cianato, de acordo à seguinte equação. (76)
50 118 Segundo TEIXEIRA et al. (2012) o radical singlete tem um tempo de vida de milissegundos (MERKEL 1972, ANASTASIO 2001), e é durante este tempo de vida antes de decair para o estado fundamental, é que o oxigênio singlete intermediário tem a possibilidade de colidir com espécies de contaminantes, para capturar elétrons e a partir daí transformá-los em compostos potencialmente menos tóxicos. Entretanto, também ocorrem reações paralelas da oxidação direta do cianeto (com peróxido de hidrogênio e hipoclorito de sódio) que têm lugar, embora em menor extensão, durante o processo. (77) (78) E também ocorrem as reações de auto decomposição dos oxidantes (79) (80) Assumindo que a reação (76) é uma reação irreversível e não elementar. Para fins práticos é razoável, derivar-se uma equação de velocidade puramente empírica que pode aproximadamente descrever o processo investigado. Desta forma a taxa de reação do processo pode ser descrita pela equação: [ ] [ ] [ ] (81) Onde: n é a ordem de reação em relação ao íon cianeto m é a ordem da reação em relação ao oxigênio singlete k é a constante de velocidade para a taxa de reação de oxidação pelo oxigênio singlete Em apoio a esta hipótese, os estudos anteriores da cinética de oxidação de surfactantes com 1 O 2 gerado pela ação do (H 2 O 2 +NaClO), realizada por TEXEIRA et al. (2012), obtiveram uma equação de velocidade empírica igual a
51 Log r A (mg/l.min) 119 -d[sls]/dt = k [SLS] 0.8 [(H 2 O 2 +NaClO)] 0.3,e uma constante da taxa de reação igual k = 4,8 (+/- 1.0) x10-1 L/mol.s. A Figura 47 mostra a ordem aparente da reação (76) com respeito ao [ 1 O 2 ] gerado pelo H 2 O 2 + NaClO. A proporção de ( [ ] ) [ ], forneceu um valor de 0,47 e 0,35, a ph 9 e 11, respectivamente, para uma relação empírica sugerido do tipo [ ] [ ] (82) Onde: K app é a constante de velocidade aparente para a taxa de reação de oxidação. 19. Os valores da constante da velocidade aparente, são mostrados na Tabela ph=9 ph= Log [H 2 O 2 +NaClO] (mg/l) Figura 47 Log da velocidade inicial da degradação do cianeto / log da concentração da combinação do peróxido de hidrogênio e hipoclorito de sódio.
52 120 Condições: concentração inicial do cianeto [CN - ] = 10mg/L, ph= 9 e 11 e várias razões molares [H 2 O 2 +NaClO]:[CN - ] Tabela 19 Valores calculados da ordem aparente da reação e constante de velocidade aparente, na Figura 47. Razão Molar [H 2 O 2 +NaClO]:[CN-] ph m K app (L/mol.min) (1+1):1, (0,5+0,5):1, (0,6+0,4):1 9 0,47 1,013 (1+1):1, (0,5+0,5):1, (0,6+0,4):1 11 0,35 1,688 A Figura 48, mostra a ordem aparente da reação (76) com respeito ao [CN - ]. A proporção de ( [ ] ) [ ], que forneceu um valor de 1,3 em ambas faixas de ph, para uma relação empírica sugerido do tipo [ ] [ ] (83) Onde: K app é a constante de velocidade aparente para a taxa de reação de oxidação pelo oxigênio singlete. Os valores da constante de velocidade aparente são mostrados na Tabela 20. Obtem-se a seguinte equação de velocidade: [ ] [ ] [ ] (84) E, as constantes de velocidades médias calculadas foram: k app = 1,15 L / mol.min, a 25 o C a ph 9 e k app = 1,19 L / mol.min, a 25 o C a ph 11.
53 log r A (mgl/l.min) ph=9 ph= log [CN - ] mg/l Figura 48 Log da velocidade inicial da degradação do cianeto / log da concentração do cianeto. Condições: concentração inicial do cianeto [CN - ] = 10, 100, 500 e 1000 mg/l, ph= 9 e 11, razão molares: [H 2 O 2 +NaClO]:[CN - ]= 1:1. Tabela 20 Valores calculados da ordem aparente da reação e constante de velocidade aparente, na Figura 48. [CN - ] t=0 mg/l ph n K app (L/mol.min) 10, 100, 500, ,3 1,288 10, 100, 500, ,3 0,691
54 Avaliação da velocidade de degradação inicial do cianeto. As experiências realizadas a ph 9 e 11 com concentração inicial do cianeto [CN - ] = 10mg/L, estão relatadas na Tabela 15, esta tabela foi montada para avaliar o desempenho de cada oxidante (NaClO e H 2 O 2 ) separados, sobre a taxa inicial de degradação do cianeto. Taxas iniciais foram calculadas, segundo a equação (A2-1) que é a diferença entre os valores [CN - ], em um tempo zero e 20 minutos, divididas por 20 minutos, isso para o caso do H 2 O 2, mas para o caso do NaClO a taxa inicial foi calculada para um tempo de 2 minutos, os resultados são dados na Tabela 21 em mmol/l.min. Tabela 21 Velocidades Iniciais do cianeto oxidado por H 2 O 2, NaClO separadamente. Condições Resultados Velocidade % de [CN - ] 0 Razão molar [CN - ] t (mg/l) em diferentes tempos Inicial Remoção Exp ph (mg/l) H NaClO 0 min 2 min 5 min 20 min 60 min (60 min) ,925 6,675 0,004 33, ,5 7,35 0,003 26, ,95 3,85 1,63 0,02 0, ,42 6,05 4,52 0,85 0,031 91, ,8 10 8,94 7,35 5,87 1,93 0,021 80, ,6 10 9,27 8,18 6,64 4,13 0,014 58, ,4 10 9,48 8,71 7,99 6,08 0,010 39, ,2 10 9,59 8,98 8,74 7,7 0, ,39 7,35 0,003 26, ,79 8,12 0, , ,32 0, , ,04 2,61 1,97 0,27 0,057 97, ,8 10 7,72 4,3 3,689 2,02 0,044 79, ,6 10 8,46 6,15 5,51 3,83 0,029 61, ,4 10 8,88 7,19 6,77 5,64 0,020 43, ,2 10 9,32 8,3 8,14 8,11 0,013 18,9
55 123 Pode-se ver que, o oxidante peróxido de hidrogênio, mesmo com o valor de excesso de razão molar oxida lentamente a ph 9 e 11, conseguindo apenas uma eficiência de remoção máxima de 33,25% e 21,5%, a ph 9 e 11 respectivamente, para 60 minutos de reação. A atuação isolada do hipoclorito de sódio bem mais rápida quando o valor da razão molar está em excesso, conseguindo oxidar totalmente ao cianeto a ph 11 e 9. A duplicação de três experimentos preliminares realizados para H 2 O 2 e NaClO separadamente, levou a uma estimativa máxima de erro experimental da taxa de degradação inicial do cianeto de +/- 0,004 e 0,072 mmol/l.min para o H 2 O 2 e NaClO, respectivamente. Tendo confirmado o desempenho lento do peróxido de hidrogênio, e as limitações já discutidas do hipoclorito de sódio, as testes seguiram para avaliar a capacidade de oxigênio singlete (gerado pela reação de peróxido de hidrogênio e hipoclorito de sódio) para tentar melhorar significativamente a degradação oxidativa do cianeto em efluentes. A duplicação de três experimentos preliminares indicou uma estimativa máxima de erro experimental da taxa de degradação inicial do cianeto de +/- 0,05 mmol/l.min. Taxas iniciais foram calculadas segundo a equação (A2-1) que é a diferença entre os valores [CN - ] em um tempo zero e 2 minutos, dividido por 2 minutos. Os resultados são apresentados na Tabela 22, onde foi avaliada a oxidação do cianeto a diferentes razões molares (com diferentes combinações) e diferentes phs, os resultados da velocidade inicial são dados em mmol/l.min
56 124 Tabela 22 Velocidades iniciais do cianeto oxidado pela combinação H 2 O 2 + NaClO (Oxigênio Singlete). Condições experimentais: ph = 9 e 11, [CN - ]=10 mg/l, razão molar [xh 2 O 2 +ynaclo]:[cn - ]=(x+y):1, onde x e y adotam deferentes valores de razão molar. Condições Resultados Velocidade % [CN - ] 0 Razão molar [CN - ] t (mg/l) em diferentes tempos Inicial Remoção Exp ph (mg/l) H NaClO 0 min 2 min 5 min 20 min 60 min (2 min.) ,55 1,15 0,10-0,16 84, ,5 0,5 10 3,1 2,87 2,17 0,31 0,12 69, ,2 0,8 10 5,62 5,46 4,65 2,49 0,08 42, ,4 0,6 10 3,47 3,31 2,48 0,29 0,11 66, ,6 0,4 10 7,17 7,06 6,51 5,03 0,06 29, ,8 0,2 10 8,56 8,43 7,79 6,07 0,03 14, , ,19 98, ,5 0,5 10 2,19 2,17 2,06 1,76 0,15 77, ,2 0,8 10 4,54 4,48 4,16 3,32 0,10 54, ,4 0,6 10 2,48 2,43 2,18 1,92 0,15 75, ,6 0,4 10 4,98 4,96 4,85 4,55 0,09 48, ,8 0,2 10 7,21 7,2 7,12 6,92 0,05 27,89 Para a avaliação da concentração inicial do cianeto, foram feitos testes com concentrações iniciais do cianeto superiores a 10 mg/l, em valores de 100, 500 e 1000 mg/l. Os resultados são apresentados na Tabela A1-1; os resultados da comparação dos 3 processos de oxidação de cianeto e a interpretação dos efeitos de cada variável investigada são também dadas na Tabela A1-1. A duplicação de três experimentos preliminares revelou uma estimativa máxima de erro experimental da taxa de degradação inicial do cianeto de +/- 0,08 mmol / L.min. Os resultados e efeitos mais detalhados das principais variáveis de operação são apresentados pela avaliação físico-química experimental Análise da concentração do H 2 O 2 Residual A concentração de H 2 O 2 após a degradação do cianeto deve ser verificada, visto que industrialmente, a quantidade de H 2 O 2 que permanece na solução pode
57 125 afetar a eficiência de alguns processos biológicos posteriores à oxidação avançada e gerar um custo desnecessário com o uso deste reagente. Além disso, o excesso de H 2 O 2 pode ser um consumidor dos radicais OH, responsáveis pela degradação do poluente. A Figura 49 mostra a oxidação do cianeto de [CN - ] = 10 mg/l, pelo peróxido de hidrogênio isolado. Inicialmente a concentração do H 2 O 2, foi de 1000 mg/l de H 2 O 2. A concentração residual após a degradação do cianeto pelo peróxido de hidrogênio, foi de 48 mg/l e 51 mg/l, a ph 9 e 11, respectivamente, em 60 minutos de reação. Entretanto, quando o cianeto foi oxidado pelo processo combinado de peróxido de hidrogênio e hipoclorito de sódio, a razão molar [1H 2 O 2 +1NaClO]:[CN - ]=2:1, a concentração residual do H 2 O 2 após a degradação do cianeto foi de 1,5 mg/l e 0 mg/l, a ph 9 e 11, respectivamente, em 60 minutos de reação. Outras concentrações residuais em diferentes razões molares, do processo combinado, são apresentadas na Tabela A1-2. Os resultados mostram, que quando se utiliza o processo combinado (H 2 O 2 +NaClO) para oxidar o cianeto, quase a totalidade de peróxido de hidrogênio é consumido, em 60 minutos de reação. Entretanto, quando se usa o peróxido de hidrogênio de maneira isolada, a concentração do peróxido de hidrogênio residual é maior.
58 [H 2 O 2 ] (mg/l) H2O2 H2O2+NaClO H2O2 H2O2+NaClO ph= ph= Figura 49 Concentrações residuais de peróxido de hidrogênio após 60 minutos de reação. Condições experimentais: Concentração inicial de cianeto [CN - ] = 10mg/L, ph = 9 e 11, e razão molares: [H 2 O 2 ]:[CN - ] = 1:1, [0,5H 2 O 2 +0,5NaClO]:[CN-] = 1: Analise da concentração do Cloro ativo residual A concentração de Cloro ativo deve ser verificada após a degradação de cianeto, pois esta quantidade que não reage no processo e permanecendo na solução, pode deixar toxicidade residual no efluente tratado. Sabe-se o cloro tem alto poder oxidante e pode reagir com compostos orgânicos e inorgânicos. Ao oxidar compostos orgânicos o mesmo entra na molécula através da ruptura de ligações duplas e podendo formar compostos tóxicos, denominados organoclorados. A Figura 50 mostra a oxidação de [CN - ] = 10 mg/l com NaClO, inicialmente a concentração do NaClO, foi de 1000 mg/l de ClO -. A concentração do cloro ativo residual, após a degradação do cianeto pelo hipoclorito de sódio isolado, foi de 0,25 mg/l e 0,53 mg/l, a ph 9 e 11, respectivamente, em 60
59 Cloro Livre (mg/l) 127 minutos de reação. Utilizando o processo combinado de peróxido de hidrogênio e hipoclorito de sódio e razão molar [0,5H 2 O 2 +0,5NaClO]:[CN - ]:= 1:1, a concentração do cloro ativo residual após a degradação do cianeto foi de 0,012 mg/l e 0 mg/l, a ph 9 e 11, respectivamente, em 60 minutos de reação. Demonstrando que quando o processo é combinado a reação é completa e os reagentes são consumidos totalmente a ph 11. Entretanto, para ph 9, a concentração do cloro ativo residual é mínima, comparado com a atuação isolada do hipoclorito de sódio. Para outras razões molares do processo combinado, as concentrações residuais são apresentadas na Tabela A1-2. Os resultados mostram que quando se usa o processo combinado (H 2 O 2 + NaClO) para oxidar o cianeto, quase a totalidade de NaClO é consumido, em 60 minutos de reação. Entretanto, quando se usa o hipoclorito de sódio em forma isolada, a concentração do Cloro ativo residual livre é significativa. De acordo com a Tabela A1-2, o grau do cloro ativo residual livre cresce com o aumento do ph NaClO H2O2 + NaClO ph= ph= Figura 50 Concentrações residuais de Cloro ativo, após 60 minutos de reação. Condições experimentais: Concentração inicial do cianeto [CN-] = 10mg/L, ph 9 e 11, e razões molares de [0,5H 2 O 2 +0,5NaClO]:[CN - ]= 1:1, [NaClO]:[CN - ]= 1:1.
4. Resultados e Discussão
 Absorbância 4. Resultados e Discussão 4.1. Obtenção da curva de calibração A obtenção da curva de calibração, absorbância vs. concentração de Paraquat, é necessária para a análise química do pesticida.
Absorbância 4. Resultados e Discussão 4.1. Obtenção da curva de calibração A obtenção da curva de calibração, absorbância vs. concentração de Paraquat, é necessária para a análise química do pesticida.
 Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
Com base nessas informações e nos conhecimentos sobre cinética química, pode-se afirmar:
 LISTA DE EXERCÍCIOS CINÉTICA QUÍMICA 1) O NO 2 proveniente dos escapamentos dos veículos automotores é também responsável pela destruição da camada de ozônio. As reações que podem ocorrer no ar poluído
LISTA DE EXERCÍCIOS CINÉTICA QUÍMICA 1) O NO 2 proveniente dos escapamentos dos veículos automotores é também responsável pela destruição da camada de ozônio. As reações que podem ocorrer no ar poluído
TRATAMENTO DE EFLUENTES INDUSTRIAIS CONTENDO METAIS PESADOS
 TRATAMENTO DE EFLUENTES INDUSTRIAIS CONTENDO METAIS PESADOS Aluno: Victor Surerus Leal Costa Orientador: Luiz Alberto Cesar Teixeira Introdução A extração de diversos metais, em geral, conduz à presença
TRATAMENTO DE EFLUENTES INDUSTRIAIS CONTENDO METAIS PESADOS Aluno: Victor Surerus Leal Costa Orientador: Luiz Alberto Cesar Teixeira Introdução A extração de diversos metais, em geral, conduz à presença
4. Reagentes e Metodologia Analítica
 4. Reagentes e Metodologia Analítica 4.1. Reagente para os testes de oxidação Os reagentes P.A empregados durante os testes de oxidação foram: KCN (Merck) NaOH (Vetec) H 2 SO 4 (Vetec) H 2 O 2 (Peróxidos
4. Reagentes e Metodologia Analítica 4.1. Reagente para os testes de oxidação Os reagentes P.A empregados durante os testes de oxidação foram: KCN (Merck) NaOH (Vetec) H 2 SO 4 (Vetec) H 2 O 2 (Peróxidos
O estudo de oxidação da amônia foi realizado usando-se solução sintética de 100mg/L de NH 3 obtida a partir de uma solução de NH 4 OH, PA, 33%.
 3. Metodologia 3.1. Características da Amostra O estudo de oxidação da amônia foi realizado usando-se solução sintética de 100mg/L de NH 3 obtida a partir de uma solução de NH 4 OH, PA, 33%. 3.2. Determinação
3. Metodologia 3.1. Características da Amostra O estudo de oxidação da amônia foi realizado usando-se solução sintética de 100mg/L de NH 3 obtida a partir de uma solução de NH 4 OH, PA, 33%. 3.2. Determinação
EXERCÍCIOS DE APLICAÇÃO
 Equilíbrio Químico EXERCÍCIOS DE APLICAÇÃO 01 (PUC-RS) Dada a expressão da constante de equilíbrio em termos de concentração de produtos e reagentes a equação química que pode ser representada por essa
Equilíbrio Químico EXERCÍCIOS DE APLICAÇÃO 01 (PUC-RS) Dada a expressão da constante de equilíbrio em termos de concentração de produtos e reagentes a equação química que pode ser representada por essa
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
QUI109 QUÍMICA GERAL (Ciências Biológicas) 3ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) Massa / Mol Massa é uma medida invariável da quantidade de matéria
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Estequiometria. Priscila Milani
 Estequiometria Priscila Milani Cálculo de massa para amostras impuras: Reagentes impuros, principalmente em reações industriais, ou porque eles são mais baratos ou porque eles já são encontrados na Natureza
Estequiometria Priscila Milani Cálculo de massa para amostras impuras: Reagentes impuros, principalmente em reações industriais, ou porque eles são mais baratos ou porque eles já são encontrados na Natureza
Calcule o ph de uma solução de HCl 1x10-7 mol L-1
 Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Equilíbrio Químico Folha 03 Prof.: João Roberto Mazzei
 01. (UERJ 2006) Numa aula experimental, foram preparadas quatro soluções eletrolíticas com a mesma concentração de soluto e as mesmas condições adequadas para o estabelecimento de um estado de equilíbrio
01. (UERJ 2006) Numa aula experimental, foram preparadas quatro soluções eletrolíticas com a mesma concentração de soluto e as mesmas condições adequadas para o estabelecimento de um estado de equilíbrio
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
CINÉTICA QUÍMICA Folha 11 - Prof.: João Roberto Mazzei
 01.Apresente a expressão cinética para a velocidade das reações elementares abaixo: a) N 2(g) + 3H 2(g) 2NH 3(g) b) 2CO 2(g) 2CO (g) + O 2(g) c) 2NO 2(g) N 2 O 4(g) 02. Num laboratório, foram efetuadas
01.Apresente a expressão cinética para a velocidade das reações elementares abaixo: a) N 2(g) + 3H 2(g) 2NH 3(g) b) 2CO 2(g) 2CO (g) + O 2(g) c) 2NO 2(g) N 2 O 4(g) 02. Num laboratório, foram efetuadas
PQI 3211 LISTA DE EXERCÍCIOS BALANÇOS MATERIAIS COM REAÇÕES QUÍMICAS
 PQI 3211 LISTA DE EXERCÍCIOS BALANÇOS MATERIAIS COM REAÇÕES QUÍMICAS Para problemas com múltiplas unidades de processamento, realize a análise do número de graus de liberdade para cada unidade, para o
PQI 3211 LISTA DE EXERCÍCIOS BALANÇOS MATERIAIS COM REAÇÕES QUÍMICAS Para problemas com múltiplas unidades de processamento, realize a análise do número de graus de liberdade para cada unidade, para o
1º BIMESTRE. Série Turma (s) Turno 3º A B C D E F G H MATUTINO Disciplina: QUÍMICA Professor: CHARLYS FERNANDES Data: / / 2017 Aluno (a): Nº
 1º BIMESTRE Visto do Professor Nota (Fuvest) A uma determinada temperatura, as substâncias HI, H2 e I2 estão no estado gasoso. A essa temperatura, o equilíbrio entre as três substâncias foi estudado, em
1º BIMESTRE Visto do Professor Nota (Fuvest) A uma determinada temperatura, as substâncias HI, H2 e I2 estão no estado gasoso. A essa temperatura, o equilíbrio entre as três substâncias foi estudado, em
Aula 6: Estequiometria. Eduarda Boing Pinheiro
 Aula 6: Estequiometria Eduarda Boing Pinheiro Na natureza nada se cria, nada se perde, tudo se transforma. Antoine Lavoisier 2 Balanceamento químico: A mesma quantidade de cada elemento está presente no
Aula 6: Estequiometria Eduarda Boing Pinheiro Na natureza nada se cria, nada se perde, tudo se transforma. Antoine Lavoisier 2 Balanceamento químico: A mesma quantidade de cada elemento está presente no
Balanceamento de Equações
 Balanceamento de Equações Ludmila Ferreira 1 Introdução Em algumas questões de Química, nos é dada equações químicas sem o devido balanceamento quantitativo. O que ocorre é que sabemos quais as substâncias
Balanceamento de Equações Ludmila Ferreira 1 Introdução Em algumas questões de Química, nos é dada equações químicas sem o devido balanceamento quantitativo. O que ocorre é que sabemos quais as substâncias
1 Calcule a velocidade média de desaparecimento de A (bolinhas vermelhas) durante o intervalo de tempo de 20 a 40 s. Reação: A B
 Físico-Química Prof. José Ginaldo Silva Jr. Lista de Exercícios de Cinética Química 1 Calcule a velocidade média de desaparecimento de A (bolinhas vermelhas) durante o intervalo de tempo de 20 a 40 s.
Físico-Química Prof. José Ginaldo Silva Jr. Lista de Exercícios de Cinética Química 1 Calcule a velocidade média de desaparecimento de A (bolinhas vermelhas) durante o intervalo de tempo de 20 a 40 s.
Δt = 8. Cinética Química
 Cinética Química Velocidade das Reações A velocidade média de consumo de um reagente ou de formação de um produto é calculada em função da variação da quantidade de reagentes e produtos pela variação do
Cinética Química Velocidade das Reações A velocidade média de consumo de um reagente ou de formação de um produto é calculada em função da variação da quantidade de reagentes e produtos pela variação do
Processos Oxidativos Avançados (POA s)
 Processos Oxidativos Avançados (POA s) Nomes: Arthur Barra Pâmmella Ribeiro Professor: Dr. Rafael Arromba de Sousa Sumário 2 Contextualização; Introdução; Classes; Literatura; Conclusões; Referências.
Processos Oxidativos Avançados (POA s) Nomes: Arthur Barra Pâmmella Ribeiro Professor: Dr. Rafael Arromba de Sousa Sumário 2 Contextualização; Introdução; Classes; Literatura; Conclusões; Referências.
Lista de exercícios Equilíbrios
 1. (Pucrj 008) Para a síntese do metanol, foram utilizadas as seguintes concentrações das espécies em quantidade de matéria: [CO] = 1,75 mol L -1, [H ] = 0,80 mol L -1 e [CH 3 OH] = 0,65 mol L -1 Ao se
1. (Pucrj 008) Para a síntese do metanol, foram utilizadas as seguintes concentrações das espécies em quantidade de matéria: [CO] = 1,75 mol L -1, [H ] = 0,80 mol L -1 e [CH 3 OH] = 0,65 mol L -1 Ao se
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
3ª Série/Vestibular (A) C 5 H 10 (B) C 4 H 8 (C) C 4 H 10 (D) C 5 H 8 (E) C 6 H Na estrutura:, encontramos: (A) 4 carbonos primários;
 3ª Série/Vestibular 21. A fórmula da menor estrutura formada apenas por carbono e hidrogênio de cadeia acíclica etínica, que apresenta carbono quiral, é: (A) C 5 H 10 (B) C 4 H 8 (C) C 4 H 10 (D) C 5 H
3ª Série/Vestibular 21. A fórmula da menor estrutura formada apenas por carbono e hidrogênio de cadeia acíclica etínica, que apresenta carbono quiral, é: (A) C 5 H 10 (B) C 4 H 8 (C) C 4 H 10 (D) C 5 H
SIMULADO DE QUÍMICA INSTRUÇÕES QUÍMICA
 PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
PROVA DISCURSIVA SIMULADO DE QUÍMICA INSTRUÇÕES Verifique se esse Caderno contém 4 questões discursivas de: QUÍMICA Se o Caderno estiver incompleto ou contiver imperfeição gráfica que prejudique a leitura,
1. (Fuvest modificado) Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química:
 Química Avaliação Mensal 3 os anos Décio e Vivian mar/12 Nome: Nº: Turma: GABARITO PROVA MENSAL 1º BIMESTRE 1. (Fuvest 2012 - modificado) Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação
Química Avaliação Mensal 3 os anos Décio e Vivian mar/12 Nome: Nº: Turma: GABARITO PROVA MENSAL 1º BIMESTRE 1. (Fuvest 2012 - modificado) Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
PAG Química Cinética 1.
 1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p =
 PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
FUVEST 2015 (Questões 1 a 6)
 (Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
(Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
Aula 14 Cinética Química
 Aula 14 Cinética Química Cinética química é a parte da físico-química que estuda a velocidade (rapidez) de uma reação química, bem como quais fatores que a influenciam. No nosso dia-a-dia em vários momentos
Aula 14 Cinética Química Cinética química é a parte da físico-química que estuda a velocidade (rapidez) de uma reação química, bem como quais fatores que a influenciam. No nosso dia-a-dia em vários momentos
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica
 Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
estas atividades deparam com a presença de amônia nos efluentes industriais e, em conseqüência, nos recursos hídricos. Desta forma, são desenvolvidos
 1. Introdução. No Brasil como em muitos outros países, as atividades de preparação e extração de matérias primas demandam atividades potencialmente poluidoras. As do ar e da água são consideradas as mais
1. Introdução. No Brasil como em muitos outros países, as atividades de preparação e extração de matérias primas demandam atividades potencialmente poluidoras. As do ar e da água são consideradas as mais
UTILIZAÇÃO DA REAÇÃO FOTO-FENTON PARA REMEDIAÇÃO DE EFLUENTE FENÓLICO EM REATOR PARABÓLICO
 UTILIZAÇÃO DA REAÇÃO FOTO-FENTON PARA REMEDIAÇÃO DE EFLUENTE FENÓLICO EM REATOR PARABÓLICO José Daladiê Barreto da Costa Filho; Gabriel Henrique Moreira Gomes; Osvaldo Chiavone-Filho Universidade Federal
UTILIZAÇÃO DA REAÇÃO FOTO-FENTON PARA REMEDIAÇÃO DE EFLUENTE FENÓLICO EM REATOR PARABÓLICO José Daladiê Barreto da Costa Filho; Gabriel Henrique Moreira Gomes; Osvaldo Chiavone-Filho Universidade Federal
QUÍMICA Exercícios de revisão resolvidos
 17. (ENEM 2010) No que tange à tecnologia de combustíveis alternativos, muitos especialistas em energia acreditam que os álcoois vão crescer em importância em um futuro próximo. Realmente, álcoois como
17. (ENEM 2010) No que tange à tecnologia de combustíveis alternativos, muitos especialistas em energia acreditam que os álcoois vão crescer em importância em um futuro próximo. Realmente, álcoois como
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) REAÇÕES DE OXI REDUÇÃO / EQUAÇÃO DE NERNST Avaliação da espontaneidade da reação potencial da reação pelo potencial
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) REAÇÕES DE OXI REDUÇÃO / EQUAÇÃO DE NERNST Avaliação da espontaneidade da reação potencial da reação pelo potencial
TRATAMENTO DE EFLUENTES CIANETADOS
 54 4 TRATAMENTO DE EFLUENTES CIANETADOS 4.1 Tratamento de efluentes contendo cianeto Devido à elevada toxicidade do cianeto, o descarte, no meio ambiente, de efluentes contendo esta substância pode gerar
54 4 TRATAMENTO DE EFLUENTES CIANETADOS 4.1 Tratamento de efluentes contendo cianeto Devido à elevada toxicidade do cianeto, o descarte, no meio ambiente, de efluentes contendo esta substância pode gerar
Vestibular UFSC 2005 (Branca) Química
 Química Geral da Equipe de Química do Curso Energia (Professores Miron, Callegaro, Romero e Pedro Marcos) A CCCV da UFSC está de parabéns pela elaboração das questões da prova de Química, dando prioridade
Química Geral da Equipe de Química do Curso Energia (Professores Miron, Callegaro, Romero e Pedro Marcos) A CCCV da UFSC está de parabéns pela elaboração das questões da prova de Química, dando prioridade
Química. Professor Duda 27/03/2013. Aluno (a): e) Nos três experimentos após o término da reação, foi obtida a mesma quantidade de amônia.
 Química Professor Duda 06 Aluno (a): 27/03/2013 01 - (UEG GO) Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características
Química Professor Duda 06 Aluno (a): 27/03/2013 01 - (UEG GO) Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características
Físico-Química Experimental Exp. 10. Cinética Química
 Cinética Química 1. Introdução Cinética química é o estudo da progressão das reações químicas, o que determina suas velocidades e como controlá-las. Ao estudar a termodinâmica de uma reação, leva-se em
Cinética Química 1. Introdução Cinética química é o estudo da progressão das reações químicas, o que determina suas velocidades e como controlá-las. Ao estudar a termodinâmica de uma reação, leva-se em
Exercícios de Equilíbrio Iônico I
 Exercícios de Equilíbrio Iônico I 1. Uma substância química é considerada ácida devido a sua tendência em doar íons H + em solução aquosa. A constante de ionização Ka é a grandeza utilizada para avaliar
Exercícios de Equilíbrio Iônico I 1. Uma substância química é considerada ácida devido a sua tendência em doar íons H + em solução aquosa. A constante de ionização Ka é a grandeza utilizada para avaliar
QUÍMICA Exercícios de revisão resolvidos
 9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
QUÍMICA - 2 o ANO MÓDULO 14 CINÉTICA QUÍMICA: LEI DA VELOCIDADE
 QUÍMICA - 2 o ANO MÓDULO 14 CINÉTICA QUÍMICA: LEI DA VELOCIDADE V V [ A ] [ B ] Como pode cair no enem Considerem-se a reação A + B C e as informações contidas no quadro abaixo: Experimentos [A] (mol/l)
QUÍMICA - 2 o ANO MÓDULO 14 CINÉTICA QUÍMICA: LEI DA VELOCIDADE V V [ A ] [ B ] Como pode cair no enem Considerem-se a reação A + B C e as informações contidas no quadro abaixo: Experimentos [A] (mol/l)
Qui. Professores: Allan Rodrigues Xandão Monitor: Renan Micha
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
P4 - PROVA DE QUÍMICA GERAL 05/12/12
 P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
PROVA DE QUÍMICA. Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: PROVA DE QUÍMICA - Caderno 1
 PROVA DE QUÍMICA Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: http://wwwiupacorg/reports/periodic_table/ 18 PROVA DE QUÍMICA - Caderno 1 QUESTÃO 25 1 Na extração do ouro, os garimpeiros costumam
PROVA DE QUÍMICA Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: http://wwwiupacorg/reports/periodic_table/ 18 PROVA DE QUÍMICA - Caderno 1 QUESTÃO 25 1 Na extração do ouro, os garimpeiros costumam
Físico-química Farmácia 2014/02
 Físico-química Farmácia 2014/02 1 Decomposição Química Cinética de decomposição Lei de velocidade Ordem de reação Tempo de meia vida e prazo de validade Fatores que influenciam a estabilidade Equação de
Físico-química Farmácia 2014/02 1 Decomposição Química Cinética de decomposição Lei de velocidade Ordem de reação Tempo de meia vida e prazo de validade Fatores que influenciam a estabilidade Equação de
Resolução de Questões de Provas Específicas de Química (Aula 5)
 Resolução de Questões de Provas Específicas de Química (Aula 5) Resolução de Questões de Provas Específicas (Aula 5) 1. (UECE) A indústria eletroquímica moderna produz atualmente milhões de toneladas de
Resolução de Questões de Provas Específicas de Química (Aula 5) Resolução de Questões de Provas Específicas (Aula 5) 1. (UECE) A indústria eletroquímica moderna produz atualmente milhões de toneladas de
R: a) t r = 2,23 h b) nº bateladas = 7 c) N Rt = 179,4 kmol por dia
 Reator batelada 1- Uma solução aquosa de acetato de etila deve ser saponificada com uma solução diluída de hidróxido de sódio. A concentração inicial de acetato é 5 g/l e a densidade de mistura reacional
Reator batelada 1- Uma solução aquosa de acetato de etila deve ser saponificada com uma solução diluída de hidróxido de sódio. A concentração inicial de acetato é 5 g/l e a densidade de mistura reacional
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
Tratamento de efluentes contendo cianeto livre através dos sistemas SO2/O2; SO2/H2O2 e H2O2
 Rafaela Cristina Landeiro da Silva Tratamento de efluentes contendo cianeto livre através dos sistemas SO2/O2; SO2/H2O2 e H2O2 Tese de Doutorado Tese apresentada como requisito parcial para obtenção do
Rafaela Cristina Landeiro da Silva Tratamento de efluentes contendo cianeto livre através dos sistemas SO2/O2; SO2/H2O2 e H2O2 Tese de Doutorado Tese apresentada como requisito parcial para obtenção do
Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09
 Química Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09 Re Resolução 1. O carbeto de cálcio CaC 2 (s) (massa molar = 64 g mol 1 ), também conhecido como carbureto, pode ser obtido aquecendo-se
Química Atividade de Autoavaliação Recuperação 2 os anos Rodrigo ago/09 Re Resolução 1. O carbeto de cálcio CaC 2 (s) (massa molar = 64 g mol 1 ), também conhecido como carbureto, pode ser obtido aquecendo-se
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
Equilíbrio Químico. Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação
 Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
Equilíbrio Químico 1 Equilíbrio Químico Estágio da reação química em que não existe mais tendência a mudar a composição da mistura de uma reação Equilíbrio dinâmico: as reações direta e inversa ocorrem
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA FMJ
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA FMJ 01. Item A III Incorreto. A torrefação não consiste em um processo de separação de misturas. IV Incorreto. A trituração não consiste em processo químico
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA FMJ 01. Item A III Incorreto. A torrefação não consiste em um processo de separação de misturas. IV Incorreto. A trituração não consiste em processo químico
Estequiometria deriva do grego STOICHEON, que significa a medida dos elementos químicos.
 Estequiometria: Estequiometria deriva do grego STOICHEON, que significa...... a medida dos elementos químicos. Em outras palavras, é o cálculo das quantidades de reagentes e/ou produtos das reações químicas
Estequiometria: Estequiometria deriva do grego STOICHEON, que significa...... a medida dos elementos químicos. Em outras palavras, é o cálculo das quantidades de reagentes e/ou produtos das reações químicas
Química Oxi-Redução Balanceamento de Equações Difícil [10 Questões]
![Química Oxi-Redução Balanceamento de Equações Difícil [10 Questões] Química Oxi-Redução Balanceamento de Equações Difícil [10 Questões]](/thumbs/55/36760464.jpg) Química Oxi-Redução Balanceamento de Equações Difícil [10 Questões] 01 - (UNIFESP SP) Substâncias orgânicas, quando despejadas em sistemas aquáticos, podem sofrer diferentes reações em função, principalmente,
Química Oxi-Redução Balanceamento de Equações Difícil [10 Questões] 01 - (UNIFESP SP) Substâncias orgânicas, quando despejadas em sistemas aquáticos, podem sofrer diferentes reações em função, principalmente,
BALANÇOS DE MASSA EM PROCESSOS COM REAÇÃO
 BALANÇOS DE MASSA EM PROCESSOS COM REAÇÃO PROF. MARCELO HENRIQUE 2 BALANÇOS COM REAÇÃO QUÍMICA A diferença agora é que aparecerão na equação do balanço, além dos termos ENTRA e SAÍDA, os termos GERAÇÃO
BALANÇOS DE MASSA EM PROCESSOS COM REAÇÃO PROF. MARCELO HENRIQUE 2 BALANÇOS COM REAÇÃO QUÍMICA A diferença agora é que aparecerão na equação do balanço, além dos termos ENTRA e SAÍDA, os termos GERAÇÃO
P1 - PROVA DE QUÍMICA GERAL 31/03/07
 1 - ROVA DE QUÍMICA GERAL 31/03/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15 1
1 - ROVA DE QUÍMICA GERAL 31/03/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15 1
Diagrama simplificado do processo kraft. Branqueamento
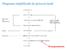 Diagrama simplificado do processo kraft Branqueamento Branqueamento de polpas celulósicas Dois tipos básicos: a) eliminação de material responsável pela cor - usado em polpas químicas b) transformação
Diagrama simplificado do processo kraft Branqueamento Branqueamento de polpas celulósicas Dois tipos básicos: a) eliminação de material responsável pela cor - usado em polpas químicas b) transformação
Aluno(a): COMENTADA. Série: 2 a Ensino Médio Turma: A / B / C / D / E Data: 17/08/2016
 QUÍMICA AVALIAÇÃO CLAUDI / SARA III UNIDADE Aluno(a): COMENTADA Série: 2 a Ensino Médio Turma: A / B / C / D / E Data: 17/08/2016 1. A prova é composta de 07 questões abertas e 03 questões objetivas. 2.
QUÍMICA AVALIAÇÃO CLAUDI / SARA III UNIDADE Aluno(a): COMENTADA Série: 2 a Ensino Médio Turma: A / B / C / D / E Data: 17/08/2016 1. A prova é composta de 07 questões abertas e 03 questões objetivas. 2.
Diagrama simplificado do processo kraft. Branqueamento
 Diagrama simplificado do processo kraft Branqueamento A figura abaixo mostra como o rendimento é afetado no final do processo de polpação kraft. Se você necessitasse preparar polpas com número kappa =
Diagrama simplificado do processo kraft Branqueamento A figura abaixo mostra como o rendimento é afetado no final do processo de polpação kraft. Se você necessitasse preparar polpas com número kappa =
Cinética Química. Prof. Alex Fabiano C. Campos. Rapidez Média das Reações
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
+1 2 Nox +1 2 Carga Nox +7 8 Carga
 01 Cl 2 Cl Nox = 0 Nox = 1 Cl O +1 2 Nox +1 2 Carga Cl O 4 +7 2 Nox +7 8 Carga Resposta: Respectivamente zero, 1, +1, +7. 1 02 a) NH 4 NO 3 NH 4 + cátion + NO 3 ânion N H 4 + 3 +1 Nox 3 +4 Carga N O 3
01 Cl 2 Cl Nox = 0 Nox = 1 Cl O +1 2 Nox +1 2 Carga Cl O 4 +7 2 Nox +7 8 Carga Resposta: Respectivamente zero, 1, +1, +7. 1 02 a) NH 4 NO 3 NH 4 + cátion + NO 3 ânion N H 4 + 3 +1 Nox 3 +4 Carga N O 3
QUÍMICA TITULAÇÃO ,0 ml de uma solução de NaOH neutralizam totalmente 10,0 ml de uma solução de HNO
 QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
Exemplo 2: A baixas temperaturas a lei de velocidade da reação A + B C + D é r A =
 Determine a energia de ativação desta reação. Exemplo 1: Para a reação SO 2 + 1 2 O 2 SO 3, se a velocidade de formação de SO 3 é de 2 mol m -3 s -1, então as velocidades de desaparecimento de SO 2, de
Determine a energia de ativação desta reação. Exemplo 1: Para a reação SO 2 + 1 2 O 2 SO 3, se a velocidade de formação de SO 3 é de 2 mol m -3 s -1, então as velocidades de desaparecimento de SO 2, de
Quí. Monitor: Marcos Melo
 Professor: Xandão Monitor: Marcos Melo Específicas: Cinética Química 27 nov EXERCÍCIOS DE AULA 1. A água oxigenada H 2O 2 (aq) se decompõe, produzindo água e gás oxigênio, de acordo com a equação: H 2O
Professor: Xandão Monitor: Marcos Melo Específicas: Cinética Química 27 nov EXERCÍCIOS DE AULA 1. A água oxigenada H 2O 2 (aq) se decompõe, produzindo água e gás oxigênio, de acordo com a equação: H 2O
OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela
![OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela](/thumbs/70/62007377.jpg) 1 Parte I Experimentos de combustão da vela I.1 Seria o consumo de oxigênio o fator determinante da subida do nível da água no Erlenmeyer no experimento I.1, ou há nos experimentos 1 e 2 evidências que
1 Parte I Experimentos de combustão da vela I.1 Seria o consumo de oxigênio o fator determinante da subida do nível da água no Erlenmeyer no experimento I.1, ou há nos experimentos 1 e 2 evidências que
COLÉGIO DA POLÍCIA MILITAR
 COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
QUÍMICA. Professora Caroline Azevedo
 QUÍMICA Professora Caroline Azevedo FUNÇÕES INORGÂNICAS Ácidos Segundo Arrhenius, toda substância que em solução aquosa sofre ionização produzindo como cátion, apenas o íon H +, é um ácido. Ex. H 2 O +
QUÍMICA Professora Caroline Azevedo FUNÇÕES INORGÂNICAS Ácidos Segundo Arrhenius, toda substância que em solução aquosa sofre ionização produzindo como cátion, apenas o íon H +, é um ácido. Ex. H 2 O +
ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
 Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
Prova de Acesso de Química Maiores de 23 Anos Candidatura 2016-2017 14 de Junho de 2017 10h00 12h30 Nome CCnº ATENÇÃO: assinale ou apresente cuidadosamente as respostas e apresente TODOS os cálculos efectuados.
CINÉTICA QUÍMICA. Profa. Loraine Jacobs DAQBI.
 CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Reações de Segunda Ordem Exercício 05: Entre os possíveis destinos do NO 2 na química
CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Reações de Segunda Ordem Exercício 05: Entre os possíveis destinos do NO 2 na química
GABARITO - QUÍMICA - Grupo A
 GABARITO - QUÍMICA - Grupo A 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor O teor do íon Cl - existente nos fluidos corporais pode ser determinado através de uma analise volumétrica do íon Cl - com o íon
GABARITO - QUÍMICA - Grupo A 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor O teor do íon Cl - existente nos fluidos corporais pode ser determinado através de uma analise volumétrica do íon Cl - com o íon
Cinética Química. Química Monitores: Luciana Lima e Rafael França 14, 15, 16 e 18/07/2015. Material de Apoio para Monitoria
 Cinética 1. (PUCMG -2004) A amônia (NH3) é uma substância química muito importante para a indústria. Ela é utilizada na preparação dos produtos de limpeza, dos explosivos, dos fertilizantes, das fibras
Cinética 1. (PUCMG -2004) A amônia (NH3) é uma substância química muito importante para a indústria. Ela é utilizada na preparação dos produtos de limpeza, dos explosivos, dos fertilizantes, das fibras
CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda
 CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda Data: Terça-feira, 11/09/2012 Tema da aula: Equilíbrio químico, Kc e Kp Em reações reversíveis, o equilíbrio químico é atingido
CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda Data: Terça-feira, 11/09/2012 Tema da aula: Equilíbrio químico, Kc e Kp Em reações reversíveis, o equilíbrio químico é atingido
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um:
![Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um: Olimpíada Brasileira de Química ) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto, é um:](/thumbs/65/52626462.jpg) Olimpíada Brasileira de Química - 2003 Exame nacional - fase III MODALIDADE A PARTE I: QUESTÕES MÚLTIPLA ESCOLHA 1) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto,
Olimpíada Brasileira de Química - 2003 Exame nacional - fase III MODALIDADE A PARTE I: QUESTÕES MÚLTIPLA ESCOLHA 1) Um elemento químico apresenta a configuração eletrônica [Xe]4f 14 5d 7 6s 2, portanto,
FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos
 FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos 1. Conceitue colisão efetiva, colisão não-efetiva, energia de ativação e complexo
FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos 1. Conceitue colisão efetiva, colisão não-efetiva, energia de ativação e complexo
Colégio Avanço de Ensino Programado
 α Colégio Avanço de Ensino Programado Trabalho Bimestral 1º Semestre - 1º Bim. /2016 Nota: Professor (a): Cintia Disciplina: Química Turma: 3ª Série Médio Nome: Nº: Atividade deverá ser entregue em pasta
α Colégio Avanço de Ensino Programado Trabalho Bimestral 1º Semestre - 1º Bim. /2016 Nota: Professor (a): Cintia Disciplina: Química Turma: 3ª Série Médio Nome: Nº: Atividade deverá ser entregue em pasta
Eletrólitos e Não Eletrólitos
 Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
Introdução Introdução Introdução Eletrólitos e Não Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Tipos de Eletrólitos Reações Inorgânicas Reações O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças
01) (FESP-PE) Considere a equação:
 01) (FESP-PE) Considere a equação: 2 N 2O 5(g) 4 NO 2(g) + O 2(g) Admita que a formação de O2 tem uma velocidade média constante e igual a 0,05 mol/s. A massa de NO 2 formada em 1 min é: (Massas atômicas:
01) (FESP-PE) Considere a equação: 2 N 2O 5(g) 4 NO 2(g) + O 2(g) Admita que a formação de O2 tem uma velocidade média constante e igual a 0,05 mol/s. A massa de NO 2 formada em 1 min é: (Massas atômicas:
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Equilíbrio Químico. Considerando as duas reações (direta e inversa) como processos elementares, podemos escrever:
 Em um sistema fechado, um estado de equilíbrio entre reagentes e produtos sempre tende a ser atingido. Trata-se de um equilíbrio dinâmico entre duas reações reversíveis: uma direta e outra inversa. No
Em um sistema fechado, um estado de equilíbrio entre reagentes e produtos sempre tende a ser atingido. Trata-se de um equilíbrio dinâmico entre duas reações reversíveis: uma direta e outra inversa. No
A) Se a massa molar do composto C é 76 g.mol 1, determine as fórmulas químicas para os compostos A, B, C, D e E.
 VTB 2008 2ª ETAPA Solução Comentada da Prova de Química 01. Na análise de 5 (cinco) diferentes compostos (A, B, C, D e E) formados apenas por nitrogênio e oxigênio, observou-se que as relações de massas
VTB 2008 2ª ETAPA Solução Comentada da Prova de Química 01. Na análise de 5 (cinco) diferentes compostos (A, B, C, D e E) formados apenas por nitrogênio e oxigênio, observou-se que as relações de massas
Cálculos envolvendo reações
 Cálculos envolvendo reações Cálculo Estequiométrico Misturamos reagentes que não estão em proporção estequiométrica Reagente limitante: consumido totalmente Reagente em excesso: sobra certa quantidade
Cálculos envolvendo reações Cálculo Estequiométrico Misturamos reagentes que não estão em proporção estequiométrica Reagente limitante: consumido totalmente Reagente em excesso: sobra certa quantidade
APLICAÇÃO DO PROCESSO OXIDATIVO AVANÇADO ELETROQUÍMICO PARA OXIDAÇÃO E DEGRADAÇÃO DE CORANTES PRESENTES EM EFLUENTE TÊXTIL SIMULADO
 APLICAÇÃO DO PROCESSO OXIDATIVO AVANÇADO ELETROQUÍMICO PARA OXIDAÇÃO E DEGRADAÇÃO DE CORANTES PRESENTES EM EFLUENTE TÊXTIL SIMULADO K. S. de ARAÚJO 1, T. M. FLORÊNCIO 1, A. C. G. MALPASS 1 e G. R. P. MALPASS
APLICAÇÃO DO PROCESSO OXIDATIVO AVANÇADO ELETROQUÍMICO PARA OXIDAÇÃO E DEGRADAÇÃO DE CORANTES PRESENTES EM EFLUENTE TÊXTIL SIMULADO K. S. de ARAÚJO 1, T. M. FLORÊNCIO 1, A. C. G. MALPASS 1 e G. R. P. MALPASS
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
Revisão da aula anterior
 Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
1. A fermentação é um processo químico complexo do fabrico de vinho no qual a glucose é convertida em etanol e dióxido de carbono:
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 4. Reacções químicas II Ficha de exercícios 1. A fermentação é um processo químico complexo do fabrico de vinho no qual a glucose é convertida em etanol
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 4. Reacções químicas II Ficha de exercícios 1. A fermentação é um processo químico complexo do fabrico de vinho no qual a glucose é convertida em etanol
Equilíbrio Químico. início x 2x 0 0
 Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA.
 SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA. QUESTÕES LISTA DE EXERCÍCIOS Cinética Química. 1) A tabela abaixo mostra a variação da massa de peróxido de hidrogênio que ocorre na reação de decomposição
SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA. QUESTÕES LISTA DE EXERCÍCIOS Cinética Química. 1) A tabela abaixo mostra a variação da massa de peróxido de hidrogênio que ocorre na reação de decomposição
Fe 3+ (aq) + H 2 O + hv Fe 2+ (aq) HO H + Reação 2
 Tratamento de Efluente Industrial com Peróxido de Hidrogênio Ativado por Radiação Solar Pesquisa desenvolvida em conjunto e em apoio à dissertação se mestrado de Bruno García Leiva (Julho 2016) Aluna:
Tratamento de Efluente Industrial com Peróxido de Hidrogênio Ativado por Radiação Solar Pesquisa desenvolvida em conjunto e em apoio à dissertação se mestrado de Bruno García Leiva (Julho 2016) Aluna:
Gabarito de Química Frente 2
 Gabarito de Química Frente 2 Módulo 05 01. E Calculo do nox: 1) HNO 3 1 + X + 3 x (- 2) = 0 X= + 5 +1 2 X 2) HNO 2 1 + Y + 2 x (- 2) = 0 Y= + 3 +1 Y 2 3) NH 3 Z + 3 x (+1) = 0 Z = - 3 Z 02.A +1 Para calcular
Gabarito de Química Frente 2 Módulo 05 01. E Calculo do nox: 1) HNO 3 1 + X + 3 x (- 2) = 0 X= + 5 +1 2 X 2) HNO 2 1 + Y + 2 x (- 2) = 0 Y= + 3 +1 Y 2 3) NH 3 Z + 3 x (+1) = 0 Z = - 3 Z 02.A +1 Para calcular
Cinética Química. Prof. Alex Fabiano C. Campos
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
