BATERIAS ESTACIONÁRIAS DE CORRENTE CONTÍNUA
|
|
|
- Igor Coimbra Paixão
- 5 Há anos
- Visualizações:
Transcrição
1 BATERIAS ESTACIONÁRIAS DE CORRENTE CONTÍNUA (Manuel Bolotinha * i ) 1. INTRODUÇÃO E APLICAÇÕES As baterias foram o primeiro sistema inventado pelo Homem para produzir e armazenar energia eléctrica, na forma de corrente contínua (CC). As baterias baseiam-se na pilha de Volta, ou pilha galvânica, descoberta pelo físico italiano Alessandro Volta, em Pondo em contacto dois metais, na circunstância o cobre e o zinco, separados por discos de feltro embebidos numa solução condutora, Volta descobriu que entre os dois metais diferentes era gerada uma força electromotriz (uma diferença de potencial). Neste artigo serão abordadas as baterias estacionárias, cuja designação surge como contraponto às baterias utilizadas nos veículos rodoviários, que são normalmente designadas por baterias automotivas. As utilizações mais comuns das baterias estacionárias são como fonte de energia de back-up nas UPS (Uninterruptible Power Supply Unidade de Alimentação Ininterrupta), para alimentação de sistemas e equipamentos, para os quais é necessário garantir permanentemente a alimentação em energia eléctrica, como é o caso dos serviços auxiliares de corrente contínua (SACC) das centrais eléctricas e das subestações sistemas de comando, controlo e protecção e equipamentos de telecomunicações e como excitatriz 1 dos geradores síncronos de corrente alternada. 2. CONSTITUIÇÃO E PRINCÍPIO DE FUNCIONAMENTO As baterias são constituídas por elementos (cada elemento é uma pilha). As pilhas eléctricas, também designadas por células galvânicas, por reacções químicas de oxidação e redução, transformam energia química em energia eléctrica. São basicamente constituídas por dois eléctrodos de metais diferentes (ânodo e cátodo), imersos numa solução aquosa com iões com concentração conhecida e separados por uma placa ou membrana porosa. Quando se ligam os dois eléctrodos atrás referidos, verifica-se a uma oxidação do ânodo (libertação de electrões) e uma redução do cátodo 2, que é sempre o metal mais nobre (depósito de electrões). O ânodo é o polo negativo da pilha e o cátodo o polo positivo. Há pois uma circulação de electrões entre o ânodo e o cátodo, como se representa na Figura 1. 1 A excitatriz é a componente dos geradores síncronos de corrente alternada que tem como função promover a excitação do enrolamento de campo. 2 A reacção química redução-oxidação é habitualmente designada por redox. 1
2 Electrões Ânodo - + Cátodo Solução aquosa Figura 1 Princípio de funcionamento das pilhas O sentido do fluxo de electrões entre o ânodo e o cátodo é contrário ao sentido convencional da corrente eléctrica do polo positivo para o polo negativo, como se representa na Figura 2. + Sentido convencional da corrente eléctrica I Bateria Carga - Figura 2 Sentido convencional da corrente eléctrica 3. TIPOS E CARACTERÍSTICAS DAS BATERIAS ESTACIONÁRIAS Os tipos de baterias, cujos elementos são recarregáveis 3, utlizadas para as aplicações referidas no Capítulo 1 são: Baterias ácidas, de chumbo, seladas. Baterias alcalinas, de níquel-cádmio (NiCd). Nas baterias ácidas de chumbo, o electrólito é uma solução de ácido sulfúrico (H2SO4), o ânodo é o chumbo (Pb) e o cátodo o dióxido de chumbo (PbO2). 3 As baterias/pilhas recarregáveis são designadas por baterias/pilhas secundárias; as não recarregáveis são designadas por baterias/pilhas primárias. 2
3 As reacções químicas que se verificam são as seguintes: Oxidação (no cátodo) Redução (no ânodo) Reacção total Pb + H2SO4 PbSO4 + 2H + + 2e PbO2 + H2SO4 + 2H + + 2e PbSO4 + 2H2O Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O As reacções atrás referidas dão origem à produção de sulfato de chumbo (PbSO4) que adere aos eléctrodos. Nas baterias alcalinas de níquel-cádmio, o electrólito é uma solução aquosa de hidróxido de potássio (KHO), o ânodo é o cádmio (Cd) esponjoso e o cátodo o hidróxido de níquel (NiHO). As reacções químicas que se verificam são as seguintes: No cátodo No ânodo 2NiO(OH) + 2H2O + 2e - 2Ni(OH)2+2OH - Cd + 2OH - Cd(OH) + 2e - Reacção total Cd + NiO(OH) + 2 H2O 1 Cd(OH) Ni(OH)2 As baterias devem obedecer à seguintes Normas IEC 4 : Baterias ácidas, de chumbo: Stationary lead-acid batteries. Baterias alcalinas, de níquel-cádmio: Secondary cells and batteries containing alkaline or other non-acid electrolytes - Vented nickel-cadmium prismatic rechargeable single cells. As características das baterias estacionárias são: Tensão Número de elementos Tensão por elemento Capacidade C (expressa em Ah ampère hora) As tensões utilizadas habitualmente, designadamente nos SACC e na alimentação dos equipamentos de telecomunicações, são 110 V e 48 V, respectivamente. O número de elementos depende da tensão da bateria e da sua capacidade. Os valores típicos da tensão por elemento são: 4 IEC: International Electrotechnical Commission. 3
4 Baterias ácidas, de chumbo: 2,1-2,45 V. Baterias alcalinas, de níquel-cádmio: 1,2-1,4 V. A capacidade define-se como a corrente que a bateria pode fornecer durante 1 h, à tensão nominal, sendo habitual referenciá-la como a taxa a que a bateria de descarrega ao fim de algum tempo. Os valores típicos desse tempo são: Baterias ácidas, de chumbo: 10 h. Baterias alcalinas, de níquel-cádmio: 5 h. Definem-se ainda: Tensão de flutuação por elemento: valor especificado pelo fabricante como a tensão em que as baterias devem ser mantidas carregadas 5, para evitar que estas se descarreguem. Tensão final por elemento: tensão de cada elemento a partir da qual a continuação da descarga da bateria pode danificar os elementos e a partir da qual a bateria deve ser desligada. o Baterias ácidas, de chumbo: 1,75 V. o Baterias alcalinas, de níquel-cádmio: 1,1 h. 4. BATERIAS DE IÕIES DE LÍTIO As baterias de iões de lítio 6, que constituem a mais recente tecnologia de armazenamento de energia eléctrica em forma de energia electroquímica, e que começaram a ser comercializadas na década de 90 do século passado, usam como electrólito um sal de lítio num solvente orgânico, um óxido metálico no cátodo e carbono, designadamente a grafite, no ânodo. Estas baterias devem estar de acordo com as Normas IEC Safety of primary and secondary lithium cells and batteries during transport e Secondary cells and batteries containing alkaline or other non-acid electrolytes - Safety requirements for portable sealed secondary lithium cells, and for batteries made from them, for use in portable applications - Part 2: Lithium systems. Tipicamente o electrólito é uma mistura de não-aquosa de carbonatos orgânicos, tais como o carbonato de etileno 7 e o carbonato de dietila 8, com iões de lítio. Habitualmente o cátodo é constituído por fosfato de lítio-ferro, óxido de lítiocobalto ou óxido de lítio-manganês. 5 Ver Capítulo 6. 6 Símbolo químico do lítio: Li. 7 O carbonato de etileno é um éster produto da reacção química ente um ácido com moléculas de oxigénio e um álcool de ácido carbónico e etilenoglicol (um álcool produzido a partir do etileno, um hidrocarboneto) e cuja fórmula química é C3H4O3. 8 O carbonato de dietila é um éster-carbonato de ácido carbónico e etanol (álcool etílico) e cuja fórmula química é C5H10O3. 4
5 Sendo em corrente contínua a energia produzida e armazenada numa bateria, para ligação à rede eléctrica é necessário que o sistema tenha um inversor CC/CA e CA/CC, como se ilustra na Figura 3, para realizar a referida ligação. Rede eléctrica Transformador de potência Inversores CA/CC-CC/CA ~ = Baterias de iões de lítio Figura 3 Esquema simplificado de ligações de um sistema de armazenamento com baterias de iões de lítio Quando o nível de produção de energia é superior ao consumo, a energia produzida em excesso é utilizada para carregar as baterias, funcionando os inversores como rectificadores para suprir o consumo; em situações de equilíbrio entre a energia produzida e consumida os inversores asseguram a carga de manutenção das baterias. Nas situações em que a produção de energia eléctrica é inferior às necessidades de consumos, as baterias fornecem a energia armazenada à rede eléctrica e os inversores, funcionando como onduladores, transformam a corrente contínua das baterias em corrente alternada. Os principais inconvenientes das baterias de iões de lítio residem no peso e dimensões relativamente elevados para garantir o armazenamento de quantidades de energia significativas para a rede eléctrica. 5. MONTAGEM DAS BATERIAS ESTACIONÁRIAS No caso das UPS as baterias são instaladas em armário, juntamente com os restantes equipamentos deste sistema de alimentação, enquanto no caso dos SACC as baterias são instaladas em estantes (ver Figura 4), em sala própria para o efeito, devidamente ventilada, com sinalização de perigo de electrocussão, presença de elementos tóxicos e perigo de explosão. As estantes deverão ser isoladas do solo; os isoladores (vidro ou porcelana) utilizados deverão assegurar alta resistência de isolamento entre a bateria e o solo. 5
6 Figura 4 Bateria em estantes Os elementos das baterias são associados em série e paralelo (ver Figura 5). A associação série dos elementos define a tensão da bateria e a associação paralelo define a sua capacidade (ver Capítulo 3). Associação série etc Associação paralelo Elemento da bateria etc etc. Figura 5 Ligação dos elementos de uma bateria A ligação dos elementos da bateria pode ser realizado por barras de cobre ou, preferencialmente, por cabos isolados. 6. PRINCÍPIO DE FUNCIONAMENTO DOS SACC A fonte de energia dos SACC é um conjunto bateria-rectificador que funciona em tampão, isto é, em situações normais, na presença de corrente alternada (rede ou grupo), o rectificador alimentará os consumidores e fará a carga de manutenção da bateria; a bateria servirá de socorro nas situações em que haja picos de consumo. 6
7 Na falta de corrente alternada a bateria fornecerá, no seu período de autonomia 9, a corrente necessária para manter em serviço os equipamentos indispensáveis ao funcionamento da instalação, até ao regresso da alimentação em corrente alternada, ou caso tal não se verifique para desligar a instalação em segurança. A Figura 6 ilustra o que foi explanado atrás Funcionamento em situação normal, sem picos de consumo Alimentação ca Rectificador ~ = I R Bateria I R Carga Funcionamento em situação normal, com picos de consumo Alimentação ca Rectificador ~ = I R I B Bateria I = I R + I B Carga 9 A autonomia da bateria, que indica o tempo mínimo que a bateria deve sustentar a carga, pode ser determinada dividindo a capacidade pela corrente média da carga durante o período de 1 hora. 7
8 Funcionamento com falta de corrente alternada Rectificador ~ = I B Bateria I B Carga Figura 6 Esquemas de fornecimento de energia cc dos SACC i Engenheiro Electrotécnico Energia e Sistemas de Potência (IST 1974) Mestre em Engenharia Electrotécnica e de Computadores (FCT-UNL 2017) Consultor em Subestações e Formador Profissional O Autor não utiliza o Novo Acordo Ortográfico 8
pilha de Volta pilha Galvânica pilha voltaica rosário
 Em 1786, o anatomista italiano Luigi Galvani (1737-1798) dissecou uma rã e observou contrações nos músculos do animal. As contrações ocorreram no momento em que seu assistente por acaso tocou com a ponta
Em 1786, o anatomista italiano Luigi Galvani (1737-1798) dissecou uma rã e observou contrações nos músculos do animal. As contrações ocorreram no momento em que seu assistente por acaso tocou com a ponta
Corrosão de peças metálicas à atmosfera Condições para que ocorra:
 Corrosão de peças metálicas à atmosfera Condições para que ocorra: existência de zonas catódicas e anódicas; possibilidade de circulação de electrões entre elas; presença do electrólito para transporte
Corrosão de peças metálicas à atmosfera Condições para que ocorra: existência de zonas catódicas e anódicas; possibilidade de circulação de electrões entre elas; presença do electrólito para transporte
PILHAS, BATERIAS E CÉLULAS DE COMBUSTÍVEL
 Química MEEC 2008 2009 PILHAS, BATERIAS E CÉLULAS DE COMBUSTÍVEL Volta apresentando a sua pilha a Napoleão 1. Pilhas, baterias e células de combustível 1.1 Terminologia. Entende se actualmente por pilha
Química MEEC 2008 2009 PILHAS, BATERIAS E CÉLULAS DE COMBUSTÍVEL Volta apresentando a sua pilha a Napoleão 1. Pilhas, baterias e células de combustível 1.1 Terminologia. Entende se actualmente por pilha
Engenharia Eletrotécnica e de Computadores Grupo: MIEEC04_06
 Pilhas Engenharia Eletrotécnica e de Computadores Grupo: MIEEC4_6 O que são pilhas? A invenção da pilha está obviamente relacionada com a descoberta da eletricidade. O que são pilhas? Sistemas em que a
Pilhas Engenharia Eletrotécnica e de Computadores Grupo: MIEEC4_6 O que são pilhas? A invenção da pilha está obviamente relacionada com a descoberta da eletricidade. O que são pilhas? Sistemas em que a
51ª-53ª AULAS PILHAS E BATERIAS Pilhas electroquímicas Pilhas recarregáveis (baterias) Pilhas de combustível (fuel cells)
 51ª-53ª AULAS PILHAS E BATERIAS Pilhas electroquímicas Pilhas recarregáveis (baterias) Pilhas de combustível (fuel cells) 1 1) Uma pilha não é (em princípio) recarregável e uma bateria é. 2) Uma pilha
51ª-53ª AULAS PILHAS E BATERIAS Pilhas electroquímicas Pilhas recarregáveis (baterias) Pilhas de combustível (fuel cells) 1 1) Uma pilha não é (em princípio) recarregável e uma bateria é. 2) Uma pilha
Reacções de Redução/Oxidação. Redox
 Reacções de Redução/Oxidação Redox Troca de iões Troca de protões Reacção Química Equilíbrio Químico Equilíbrio Ácido-Base Troca de neutrões Radioactividade Troca de electrões Reacções Redox 2.Fe 3+ +
Reacções de Redução/Oxidação Redox Troca de iões Troca de protões Reacção Química Equilíbrio Químico Equilíbrio Ácido-Base Troca de neutrões Radioactividade Troca de electrões Reacções Redox 2.Fe 3+ +
PILHAS ELETROQUÍMICAS
 PILHAS ELETROQUÍMICAS As pilhas eletroquímicas são dispositivos capazes de produzir energia elétrica à custa de uma reação redox espontânea. Como as primeiras pilhas foram construídas por Galvani e Volta,
PILHAS ELETROQUÍMICAS As pilhas eletroquímicas são dispositivos capazes de produzir energia elétrica à custa de uma reação redox espontânea. Como as primeiras pilhas foram construídas por Galvani e Volta,
ÓXIDO-REDUÇÃO REAÇÕES REDOX : CONCEITO E IMPORTÂNCIA PILHAS E BATERIAS POTENCIAL DE ELETRODO CORROSÃO E PROTEÇÃO ELETRÓLISE
 ÓXIDO-REDUÇÃO REAÇÕES REDOX : CONCEITO E IMPORTÂNCIA PILHAS E BATERIAS POTENCIAL DE ELETRODO CORROSÃO E PROTEÇÃO ELETRÓLISE 1 POR QUE ESTUDAR AS REAÇÕES DE OXI-REDUÇÃO? -DESENVOLVIMENTO DE NOVAS BATERIAS
ÓXIDO-REDUÇÃO REAÇÕES REDOX : CONCEITO E IMPORTÂNCIA PILHAS E BATERIAS POTENCIAL DE ELETRODO CORROSÃO E PROTEÇÃO ELETRÓLISE 1 POR QUE ESTUDAR AS REAÇÕES DE OXI-REDUÇÃO? -DESENVOLVIMENTO DE NOVAS BATERIAS
Química 12º Ano. Uma reacção de oxidação-redução, ou reacção redox, é uma reacção em. variação dos números de oxidação de alguns elementos.
 Química 12º Ano Uma reacção de oxidação-redução, ou reacção redox, é uma reacção em que há transferência total ou parcial de electrões, como se verifica pela variação dos números de oxidação de alguns
Química 12º Ano Uma reacção de oxidação-redução, ou reacção redox, é uma reacção em que há transferência total ou parcial de electrões, como se verifica pela variação dos números de oxidação de alguns
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
PILHAS RECARREGÁVEIS 2014/2015 MIEEC02_3
 PILHAS RECARREGÁVEIS 1 Tópicos abordados 1. História das pilhas( invenção da pilha elétrica e recarregável) 2. Funcionamento e composição 3. Principais caraterísticas de cada tipo de pilha 4. Diferenças
PILHAS RECARREGÁVEIS 1 Tópicos abordados 1. História das pilhas( invenção da pilha elétrica e recarregável) 2. Funcionamento e composição 3. Principais caraterísticas de cada tipo de pilha 4. Diferenças
Corrosão Eletroquímica. Sumário 21 - Baterias e Corrosão. Definições e características Baterias primárias. Baterias secundárias
 Sumário 21 - Baterias e Corrosão Definições e características Baterias primárias Baterias de Leclanché (pilhas secas) Baterias Alcalinas Baterias de Lítio Baterias secundárias Baterias de chumbo Baterias
Sumário 21 - Baterias e Corrosão Definições e características Baterias primárias Baterias de Leclanché (pilhas secas) Baterias Alcalinas Baterias de Lítio Baterias secundárias Baterias de chumbo Baterias
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO
 2º EM Química B Natália Av. Dissertativa 08/06/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
2º EM Química B Natália Av. Dissertativa 08/06/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA. Departamento de Engenharia Química e do Ambiente. QUÍMICA II (1º Ano/2º Semestre)
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA II (1º Ano/2º Semestre) 2ª Série de Exercícios ELECTROQUÍMICA Tomar (2004) 1 Revisão
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA II (1º Ano/2º Semestre) 2ª Série de Exercícios ELECTROQUÍMICA Tomar (2004) 1 Revisão
Acumuladores Pb-Ácido: conceitos, histórico e aplicação
 Acumuladores Pb-Ácido: conceitos, histórico e aplicação A.G. dos Santos, T.M.F. dos Anjos, F. J. da Silva, M.R.S. Vieira, Urtiga Filho, S.L. Universidade Federal de Pernambuco, Departamento de Engenharia
Acumuladores Pb-Ácido: conceitos, histórico e aplicação A.G. dos Santos, T.M.F. dos Anjos, F. J. da Silva, M.R.S. Vieira, Urtiga Filho, S.L. Universidade Federal de Pernambuco, Departamento de Engenharia
MSPC INFORMAÇÕES TÉCNICAS
 Pilhas e/ou baterias podem ser definidas como geradores químicos de energia elétrica. Tecnicamente, a unidade geradora básica é denominada célula. Em muitos casos práticos, a tensão fornecida por uma célula
Pilhas e/ou baterias podem ser definidas como geradores químicos de energia elétrica. Tecnicamente, a unidade geradora básica é denominada célula. Em muitos casos práticos, a tensão fornecida por uma célula
ELECTROQUÍMICA E CORROSÃO
 Valentim M B Nunes, 2003 ELECTROQUÍMICA E CORROSÃO CORROSÃO 1. Corrosão Podemos definir como corrosão a interacção físico-química de um metal com o meio do qual resultam alterações das propriedades do
Valentim M B Nunes, 2003 ELECTROQUÍMICA E CORROSÃO CORROSÃO 1. Corrosão Podemos definir como corrosão a interacção físico-química de um metal com o meio do qual resultam alterações das propriedades do
Factores Influentes na Corrosão e Protecção de Metais. Química 12º Ano
 Factores Influentes na Corrosão e Protecção de Metais Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
Factores Influentes na Corrosão e Protecção de Metais Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng. Cerâmica
CÉLULAS GALVÂNICAS OU CÉLULAS ELECTROQUÍMICAS
 CÉLULAS GALVÂNICAS OU CÉLULAS ELECTROQUÍMICAS Uma CÉLULA ELECTROQUÍMICA é um dispositivo que permite a conversão de energia química em energia eléctrica através de reacções de oxidação-redução que ocorrem
CÉLULAS GALVÂNICAS OU CÉLULAS ELECTROQUÍMICAS Uma CÉLULA ELECTROQUÍMICA é um dispositivo que permite a conversão de energia química em energia eléctrica através de reacções de oxidação-redução que ocorrem
Eletroquímica PROF. SAUL SANTANA
 Eletroquímica PROF. SAUL SANTANA Como o Cobre é mais nobre que o Zinco, ele reduz oxidando o zinco Espontaneidade de reações de oxirredução e pilhas Forma metálica e forma oxidada Ferro oxidado (minério)
Eletroquímica PROF. SAUL SANTANA Como o Cobre é mais nobre que o Zinco, ele reduz oxidando o zinco Espontaneidade de reações de oxirredução e pilhas Forma metálica e forma oxidada Ferro oxidado (minério)
PILHAS DE COMBUSTÍVEL REGENERATIVAS USADAS NO ARMAZENAMENTO DE ENERGIA
 PILHAS DE COMBUSTÍVEL REGENERATIVAS USADAS NO ARMAZENAMENTO DE ENERGIA A B C D E Nova Central de Armazenamento de Energia REGENESYS TM com capacidade de acumular 120Mwh de energia (suficiente para 10 000
PILHAS DE COMBUSTÍVEL REGENERATIVAS USADAS NO ARMAZENAMENTO DE ENERGIA A B C D E Nova Central de Armazenamento de Energia REGENESYS TM com capacidade de acumular 120Mwh de energia (suficiente para 10 000
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011
 ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011 Nome: 12.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: GRUPO I 1. A revolução industrial foi construída
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE QUÍMICA ANO LECTIVO 2010/2011 Nome: 12.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: GRUPO I 1. A revolução industrial foi construída
Inovações Tecnológicas de Baterias para Armazenamento de Energia Maria de Fátima Rosolem - Fundação CPqD
 Inovações Tecnológicas de Baterias para Armazenamento de Energia Maria de Fátima Rosolem - Fundação CPqD Cenário mundial Desenvolvimento de produtos e soluções que reduzam a emissão de gás carbono e que
Inovações Tecnológicas de Baterias para Armazenamento de Energia Maria de Fátima Rosolem - Fundação CPqD Cenário mundial Desenvolvimento de produtos e soluções que reduzam a emissão de gás carbono e que
PROTECÇÃO DOS METAIS
 PROTECÇÃO DOS METAIS FORMAÇÃO DE LIGAS Neste caso associase o metal a proteger a outro, originando uma liga altamente resistente à corrosão. Exemplo: aço inox PROTECÇÃO CATÓDICA A protecção catódica é
PROTECÇÃO DOS METAIS FORMAÇÃO DE LIGAS Neste caso associase o metal a proteger a outro, originando uma liga altamente resistente à corrosão. Exemplo: aço inox PROTECÇÃO CATÓDICA A protecção catódica é
01) (CESGRANRIO-RJ) Considere a pilha representada abaixo. Cu(s) Cu 2+ Fe 3+, Fe 2+ Pt(s) Assinale a afirmativa falsa.
 01) (CESGRANRIO-RJ) Considere a pilha representada abaixo. Cu(s) Cu 2+ Fe 3+, Fe 2+ Pt(s) Assinale a afirmativa falsa. a) A reação de redução que ocorre na pilha é: Cu2+ + 2 e Cu(s) b) O eletrodo de cobre
01) (CESGRANRIO-RJ) Considere a pilha representada abaixo. Cu(s) Cu 2+ Fe 3+, Fe 2+ Pt(s) Assinale a afirmativa falsa. a) A reação de redução que ocorre na pilha é: Cu2+ + 2 e Cu(s) b) O eletrodo de cobre
Baterias e pilhas para uso em robótica móvel
 Fonte de energia de um robô móvel Baterias e pilhas para uso em robótica móvel Baterias Rede eléctrica Painéis solares Etc. FONTE DE ENERGIA Sistemas Robóticos Engenharia Informática 2003/2004 SENSORES
Fonte de energia de um robô móvel Baterias e pilhas para uso em robótica móvel Baterias Rede eléctrica Painéis solares Etc. FONTE DE ENERGIA Sistemas Robóticos Engenharia Informática 2003/2004 SENSORES
Baterias de alto desempenho para armazenamento de energia em sistemas FV
 Baterias de alto desempenho para armazenamento de energia em sistemas FV Maria de Fátima Rosolem CPqD Workshop IEE/USP - Inversores híbridos com Sistemas de Armazenamento de Energia - 19/11/15 Contexto
Baterias de alto desempenho para armazenamento de energia em sistemas FV Maria de Fátima Rosolem CPqD Workshop IEE/USP - Inversores híbridos com Sistemas de Armazenamento de Energia - 19/11/15 Contexto
Assunto: Eletroquímica Folha 4.1 Prof.: João Roberto Mazzei
 01. (UEL 2009) A clássica célula galvânica ou pilha de Daniel é representada por: Zn (s) / Zn +2 (aq) / / Cu +2 (aq) / Cu (s) No laboratório de uma escola, o professor e seus alunos fizeram duas alterações
01. (UEL 2009) A clássica célula galvânica ou pilha de Daniel é representada por: Zn (s) / Zn +2 (aq) / / Cu +2 (aq) / Cu (s) No laboratório de uma escola, o professor e seus alunos fizeram duas alterações
1.2. Tensão elétrica
 1.2. Tensão elétrica 1.2 Tensão elétrica A corrente elétrica é um movimento orientado de partículas com carga elétrica através de um meio condutor. Para que as cargas elétricas tenham esse movimento orientado
1.2. Tensão elétrica 1.2 Tensão elétrica A corrente elétrica é um movimento orientado de partículas com carga elétrica através de um meio condutor. Para que as cargas elétricas tenham esse movimento orientado
PROFESSORA: CLAUDIA BRAGA. SEMINÁRIO DE FÍSICO QUÍMICA II Célula de Níquel e Cádmio. João Pessoa, 31 de julho de 2009
 UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA DEPARTAMENTO DE QUIMICA DISCIPLINA: FÍSICO-QUÍMICA II ALUNA: LÍBIA NAYANE FERNANDES DE QUEIROGA PROFESSORA: CLAUDIA BRAGA SEMINÁRIO
UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA DEPARTAMENTO DE QUIMICA DISCIPLINA: FÍSICO-QUÍMICA II ALUNA: LÍBIA NAYANE FERNANDES DE QUEIROGA PROFESSORA: CLAUDIA BRAGA SEMINÁRIO
ELETROQUÍMICA Profº Jaison Mattei
 ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
MANUTENÇÃO DE PERIFÉRICOS NObreaks Aula 07
 MANUTENÇÃO DE PERIFÉRICOS NObreaks Aula 07 Nobreak No-break parte 1 No-break parte 2 Bateria. - A capacidade expressada em ampèrehora; -corrente elétrica, -duração da corrente, -tensão terminal permissível
MANUTENÇÃO DE PERIFÉRICOS NObreaks Aula 07 Nobreak No-break parte 1 No-break parte 2 Bateria. - A capacidade expressada em ampèrehora; -corrente elétrica, -duração da corrente, -tensão terminal permissível
Faculdade de Engenharia da Universidade do Porto. Bruno Santo (up ) José Santos (up ) Vitor Batista (up )
 Faculdade de Engenharia da Universidade do Porto Estudo sobre as propriedades de pilhas recarregáveis Bruno Santo (up201506602) José Santos (up201505513) Vitor Batista (up201506348) Relatório de Projecto
Faculdade de Engenharia da Universidade do Porto Estudo sobre as propriedades de pilhas recarregáveis Bruno Santo (up201506602) José Santos (up201505513) Vitor Batista (up201506348) Relatório de Projecto
Carregador de baterias de Iões de Lítio (Li-Ion) / Polímeros de Lítio (Li-Po) de uma célula Introdução
 Carregador de baterias de Iões de Lítio (Li-Ion) / Polímeros de Lítio (Li-Po) de uma célula Introdução As baterias de iões de lítio (Li-Ion) e de polímeros de lítio (Li-Po) estão a ser amplamente utilizadas
Carregador de baterias de Iões de Lítio (Li-Ion) / Polímeros de Lítio (Li-Po) de uma célula Introdução As baterias de iões de lítio (Li-Ion) e de polímeros de lítio (Li-Po) estão a ser amplamente utilizadas
Física Experimental Aula
 Física Experimental Aula 3 2008-2009 Aula_2 Instrumentos de medida I Modelos de multímetros 07-10-2008 Física Experimental - V. E. 2 T0 - Instrumentos de medida I Multímetro : A Amperímetro V - Voltímetro
Física Experimental Aula 3 2008-2009 Aula_2 Instrumentos de medida I Modelos de multímetros 07-10-2008 Física Experimental - V. E. 2 T0 - Instrumentos de medida I Multímetro : A Amperímetro V - Voltímetro
Reacções de Oxidação-Redução
 Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
3ª Ficha de Avaliação Física e Química 9ºAno. Nome: Nº. Turma: 9º VERSÃO 1
 3ª Ficha de Avaliação Física e Química 9ºAno Ano Letivo: 2014/2015 Data: fevereiro 2015 Prof: Paula Silva Nome: Nº. Turma: 9º Avaliação: Professor: E. Educação: 1. Na figura está representada uma montagem
3ª Ficha de Avaliação Física e Química 9ºAno Ano Letivo: 2014/2015 Data: fevereiro 2015 Prof: Paula Silva Nome: Nº. Turma: 9º Avaliação: Professor: E. Educação: 1. Na figura está representada uma montagem
Redação selecionada e publicada pela Olimpíada de Química SP Pilha ou Bateria: um quase eterno dilema
 Autor: Gabriel Augusto Ginja Série: Primeira do Ensino Médio Prof. : Rubens Conilho Junior Colégio: Etapa Cidade: São Paulo, SP Redação selecionada e publicada pela Olimpíada de Química SP-2011 Pilha ou
Autor: Gabriel Augusto Ginja Série: Primeira do Ensino Médio Prof. : Rubens Conilho Junior Colégio: Etapa Cidade: São Paulo, SP Redação selecionada e publicada pela Olimpíada de Química SP-2011 Pilha ou
Aula 13 Fontes de tensão
 Universidade Federal do Paraná Setor de Ciências Exatas Departamento de Física Física III Prof. Dr. Ricardo Luiz Viana Referências bibliográficas: H. 29-2 S. 26-5, 27-6 T. 22-3 Aula 13 Fontes de tensão
Universidade Federal do Paraná Setor de Ciências Exatas Departamento de Física Física III Prof. Dr. Ricardo Luiz Viana Referências bibliográficas: H. 29-2 S. 26-5, 27-6 T. 22-3 Aula 13 Fontes de tensão
1) Monóxido de carbono é um gás inodoro, incolor e muito tóxico. Um método para
 1) Monóxido de carbono é um gás inodoro, incolor e muito tóxico. Um método para determinar sua concentração no ar consiste em fazê-lo reagir, completamente, com pentóxido de di-iodo, a temperaturas entre
1) Monóxido de carbono é um gás inodoro, incolor e muito tóxico. Um método para determinar sua concentração no ar consiste em fazê-lo reagir, completamente, com pentóxido de di-iodo, a temperaturas entre
Pilha de Daniell. Sentido dos elétrons
 Pilha de Daniell As primeiras aplicações importantes da eletricidade provieram do aperfeiçoamento das pilhas voltaicas originais pelo cientista inglês John Frederick Daniell, em 1836. Pilhas eletroquímicas
Pilha de Daniell As primeiras aplicações importantes da eletricidade provieram do aperfeiçoamento das pilhas voltaicas originais pelo cientista inglês John Frederick Daniell, em 1836. Pilhas eletroquímicas
Química 12º Ano Unidade 1 APL 1- Construção de uma pilha com diferença de potencial determinada (1.1 V)
 Química 12º Ano Unidade 1 APL 1- Construção de uma pilha com diferença de potencial determinada (1.1 V) 1ª Fase Planificação Data de entrega: 11/11/10 Grupo de trabalho: Carla Carmo nº7,flávia França nº13,
Química 12º Ano Unidade 1 APL 1- Construção de uma pilha com diferença de potencial determinada (1.1 V) 1ª Fase Planificação Data de entrega: 11/11/10 Grupo de trabalho: Carla Carmo nº7,flávia França nº13,
dt dq dt Definição Potência é definida como sendo a taxa de dispêndio de energia por unidade de tempo: Exemplos: V -5A -3 A Unidades: Watt (W)
 POTÊNCIA Definição Potência é definida como sendo a taxa de dispêndio de energia por unidade de tempo: Unidades: Watt (W) Exemplos: 2A dwab dwab dq p ( t ) v ( t)* i ( t ) dt dq dt - + -5A Qual o sentido
POTÊNCIA Definição Potência é definida como sendo a taxa de dispêndio de energia por unidade de tempo: Unidades: Watt (W) Exemplos: 2A dwab dwab dq p ( t ) v ( t)* i ( t ) dt dq dt - + -5A Qual o sentido
12 GAB. 1 1 o DIA PASES 2 a ETAPA TRIÊNIO QUÍMICA QUESTÕES DE 21 A 30
 12 GAB. 1 1 o DIA PASES 2 a ETAPA TRIÊNIO 2004-2006 QUÍMICA QUESTÕES DE 21 A 30 21. Os solos brasileiros são na sua maioria ácidos, de modo que para cultiválos muitas vezes é necessária a aplicação de
12 GAB. 1 1 o DIA PASES 2 a ETAPA TRIÊNIO 2004-2006 QUÍMICA QUESTÕES DE 21 A 30 21. Os solos brasileiros são na sua maioria ácidos, de modo que para cultiválos muitas vezes é necessária a aplicação de
QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA 2010/ º Período
 QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA Henrique Fernandes, número 9 Ricardo Cunha, número 20 Jéssica Lopes, número 26 Professor Ângelo Fernandes Turma B
QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA Henrique Fernandes, número 9 Ricardo Cunha, número 20 Jéssica Lopes, número 26 Professor Ângelo Fernandes Turma B
UNISA MEDICINA 2018 UNIVERSIDADE DE SANTO AMARO
 UNISA MEDIINA 018 UNIVERSIDADE DE SANT AMAR 01. A figura mostra a decomposição térmica do carbonato de cobre (II), produzindo óxido de cobre (II) e dióxido de carbono, conforme a equação: u (s) u(s) +
UNISA MEDIINA 018 UNIVERSIDADE DE SANT AMAR 01. A figura mostra a decomposição térmica do carbonato de cobre (II), produzindo óxido de cobre (II) e dióxido de carbono, conforme a equação: u (s) u(s) +
Células(Pilhas/ Baterias) Comerciais
 Pilha-célula galvânica Células(Pilhas/ Baterias) Comerciais Bateria- conjunto de pilhas ou células galvânicas ligadas em série Características: Diferença de potencial constante (V), gerada durante um certo
Pilha-célula galvânica Células(Pilhas/ Baterias) Comerciais Bateria- conjunto de pilhas ou células galvânicas ligadas em série Características: Diferença de potencial constante (V), gerada durante um certo
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PRATIQUE EM CASA SOLUÇÃO PC. H O( ) H (aq) OH (aq) OH (aq) HO( ) O (g) e (Ânodo ( ); oxidação) + H (aq) + e H (g) (Cátodo ( ); redução) Global HO( ) H (g) O (g) Volume,5 Volume SOLUÇÃO PC. [C]
SOLUÇÃO PRATIQUE EM CASA SOLUÇÃO PC. H O( ) H (aq) OH (aq) OH (aq) HO( ) O (g) e (Ânodo ( ); oxidação) + H (aq) + e H (g) (Cátodo ( ); redução) Global HO( ) H (g) O (g) Volume,5 Volume SOLUÇÃO PC. [C]
1.1 Corrente elétrica: o que é e como se utiliza.
 1.1 Corrente elétrica: o que é e como se utiliza. A eletricidade e o dia a dia A energia elétrica é hoje um bem essencial. A sua falta impede-nos de realizar praticamente todas as tarefas diárias. Fig.
1.1 Corrente elétrica: o que é e como se utiliza. A eletricidade e o dia a dia A energia elétrica é hoje um bem essencial. A sua falta impede-nos de realizar praticamente todas as tarefas diárias. Fig.
Introdução à Eletrónica. Gil Lopes
 Introdução à Eletrónica Gil Lopes Índice O Processo de Soldadura Organização do Posto de Trabalho Procedimento na Soldadura Erros mais frequentes Reparação de uma soldadura Manutenção do ferro de soldar
Introdução à Eletrónica Gil Lopes Índice O Processo de Soldadura Organização do Posto de Trabalho Procedimento na Soldadura Erros mais frequentes Reparação de uma soldadura Manutenção do ferro de soldar
Preparação de uma pilha baseada na oxidação em meio ácido. Química 12º Ano
 Preparação de uma pilha baseada na oxidação em meio ácido Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng.
Preparação de uma pilha baseada na oxidação em meio ácido Química 12º Ano Unidade 1 Metais e ligas metálicas Actividades de Projecto Laboratorial Outubro 2005 Jorge R. Frade, Ana Teresa Paiva Dep. Eng.
PILHAS E BATERIAS COMERCIAIS. Química II Professora: Raquel Malta 3ª série Ensino Médio
 PILHAS E BATERIAS COMERCIAIS Química II Professora: Raquel Malta 3ª série Ensino Médio NOMENCLATURA Pilha: dispositivo constituído unicamente de dois eletrodos e um eletrólito, arranjados de maneira a
PILHAS E BATERIAS COMERCIAIS Química II Professora: Raquel Malta 3ª série Ensino Médio NOMENCLATURA Pilha: dispositivo constituído unicamente de dois eletrodos e um eletrólito, arranjados de maneira a
ESPECIFICAÇÕES TÉCNICAS SISTEMA DE FORNECIMENTO DE ENERGIA ININTERRUPTO (UPS)
 ESPECIFICAÇÕES TÉCNICAS SISTEMA DE FORNECIMENTO DE ENERGIA ININTERRUPTO (UPS) OUTUBRO/2017 Gerência de Gestão de Tecnologia GGT Página 1 de 9 SUMÁRIO 1. APRESENTAÇÃO... 3 2. POTÊNCIA... 3 3. CARACTERISTICAS
ESPECIFICAÇÕES TÉCNICAS SISTEMA DE FORNECIMENTO DE ENERGIA ININTERRUPTO (UPS) OUTUBRO/2017 Gerência de Gestão de Tecnologia GGT Página 1 de 9 SUMÁRIO 1. APRESENTAÇÃO... 3 2. POTÊNCIA... 3 3. CARACTERISTICAS
b) Os elétrons fluem do ânodo para o cátodo, ou seja, do eletrodo de crômio para o eletrodo de estanho.
 01 a) Polo negativo corresponde ao ânodo, onde ocorre a oxidação: Cr (s) Cr 3+ (aq) + 3e - Polo positivo corresponde ao cátodo, onde ocorre a redução: Sn +2 ( aq) + 2e - Sn (s) b) Os elétrons fluem do
01 a) Polo negativo corresponde ao ânodo, onde ocorre a oxidação: Cr (s) Cr 3+ (aq) + 3e - Polo positivo corresponde ao cátodo, onde ocorre a redução: Sn +2 ( aq) + 2e - Sn (s) b) Os elétrons fluem do
CORROSÃO. Processo de destruição superficial de um metal, dando origem a sais iónicos (óxidos hidróxidos) do referido metal
 CORROSÃO Processo de destruição superficial de um metal, dando origem a sais iónicos (óxidos hidróxidos) do referido metal Corrosão Química: reacção superficial de transferência de carga em ambiente seco
CORROSÃO Processo de destruição superficial de um metal, dando origem a sais iónicos (óxidos hidróxidos) do referido metal Corrosão Química: reacção superficial de transferência de carga em ambiente seco
REACÇÕES DE OXIDAÇÃO-REDUÇÃO (REDOX)
 REACÇÕES DE OXIDAÇÃO-REDUÇÃO (REDOX) Reacções que envolvem variação do número de oxidação das espécies intervenientes Número de oxidação (de um átomo, isolado ou integrado numa espécie química): Nº de
REACÇÕES DE OXIDAÇÃO-REDUÇÃO (REDOX) Reacções que envolvem variação do número de oxidação das espécies intervenientes Número de oxidação (de um átomo, isolado ou integrado numa espécie química): Nº de
Redação selecionada e publicada pela Olimpíada de Química SP-2011 PILHAS E BATERIAS: O HOMEM À PROCURA DE ENERGIA
 Autor: Luis Gustavo Lapinha Dalla Stella Série: Primeira do Ensino Médio Redação selecionada e publicada pela Olimpíada de Química SP-2011 Profs. : Antonio A. Mondragon e Alcides B. Dias Junior Colégio:
Autor: Luis Gustavo Lapinha Dalla Stella Série: Primeira do Ensino Médio Redação selecionada e publicada pela Olimpíada de Química SP-2011 Profs. : Antonio A. Mondragon e Alcides B. Dias Junior Colégio:
3º Trimestre Sala de Estudo - Química Data: 28/09/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo - Química Data: 28/09/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletroquímica (pilhas) Questão 01 - (Mackenzie SP/2017) Um estudante de química colocou,
3º Trimestre Sala de Estudo - Química Data: 28/09/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletroquímica (pilhas) Questão 01 - (Mackenzie SP/2017) Um estudante de química colocou,
CONVERT UCC UNIDADE CONVERSORA CONTÍNUA
 CONVERT UCC UNIDADE CONVERSORA CONTÍNUA Mod.: CACC600245K Corrente de saída: 150A O equipamento CONVERT da TRACEL tem como objetivo converter tensões de corrente contínua, fornecendo energia estabilizada
CONVERT UCC UNIDADE CONVERSORA CONTÍNUA Mod.: CACC600245K Corrente de saída: 150A O equipamento CONVERT da TRACEL tem como objetivo converter tensões de corrente contínua, fornecendo energia estabilizada
QUIMICA: Eletroquimica Prof. Douglas_10/10/2018 1
 [AE-10 ] c) d) 01. (Enem 017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir
[AE-10 ] c) d) 01. (Enem 017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir
Degradação e. Capítulo 1.2 Fundamentos
 Degradação e Protecção de Materiais Capítulo 1.2 Fundamentos Docente: João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, Piso 4 -Ext. 1964 joao.salvador@tecnico.ulisboa.pt Princípios
Degradação e Protecção de Materiais Capítulo 1.2 Fundamentos Docente: João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, Piso 4 -Ext. 1964 joao.salvador@tecnico.ulisboa.pt Princípios
QUÍMICA. Transformações Químicas e Energia. Prof ª. Giselle Blois
 QUÍMICA Transformações Químicas e Energia Eletroquímica: Oxirredução, Potenciais Padrão de Redução, - Parte 2 Prof ª. Giselle Blois REAÇÃO QUÍMICA PILHA (fenômeno espontâneo) ELETRÓLISE (fenômeno não-espontâneo)
QUÍMICA Transformações Químicas e Energia Eletroquímica: Oxirredução, Potenciais Padrão de Redução, - Parte 2 Prof ª. Giselle Blois REAÇÃO QUÍMICA PILHA (fenômeno espontâneo) ELETRÓLISE (fenômeno não-espontâneo)
Reacções de oxidação-redução em solução aquosa. Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p.
 Reacções de oxidação-redução em solução aquosa Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p. 116 até ao final REACÇÕES de OXIDAÇÃO-REDUÇÃO reacções que envolvem troca de
Reacções de oxidação-redução em solução aquosa Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p. 116 até ao final REACÇÕES de OXIDAÇÃO-REDUÇÃO reacções que envolvem troca de
RETIFICADOR CARREGADOR DE BATERIAS CATÁLOGO GERAL
 RETIFICADOR CARREGADOR DE BATERIAS CATÁLOGO GERAL Revisão 00 SCEPP Soluções Integradas para Geração de Energia SCEPP CATÁLOGO SOFTRECT Conteúdo DESCRIÇÃO FUNCIONAL DO SISTEMA... 3 1. ESPECIFICAÇÃO TÉCNICA...
RETIFICADOR CARREGADOR DE BATERIAS CATÁLOGO GERAL Revisão 00 SCEPP Soluções Integradas para Geração de Energia SCEPP CATÁLOGO SOFTRECT Conteúdo DESCRIÇÃO FUNCIONAL DO SISTEMA... 3 1. ESPECIFICAÇÃO TÉCNICA...
Abuso Sexual nas Escolas Não dá para aceitar
 Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação 1ª Época 12ª Classe / 2011 Conselho Nacional de Exames, Certificação e Equivalências
Abuso Sexual nas Escolas Não dá para aceitar Por uma Escola livre do SIDA República de Moçambique Química Ministério da Educação 1ª Época 12ª Classe / 2011 Conselho Nacional de Exames, Certificação e Equivalências
2 NH 3 (g) + CO 2 (g)
 PROCESSO SELETIVO 2007 1 O DIA GABARITO 4 7 QUÍMICA QUESTÕES DE 16 A 30 16. O equilíbrio de ionização da água pura é dado pela equação abaixo, cuja constante do produto iônico é 2,5x10-14, a 37 o C. H
PROCESSO SELETIVO 2007 1 O DIA GABARITO 4 7 QUÍMICA QUESTÕES DE 16 A 30 16. O equilíbrio de ionização da água pura é dado pela equação abaixo, cuja constante do produto iônico é 2,5x10-14, a 37 o C. H
16. Em soluções aquosas o ânion dicromato está em equilíbrio dinâmico com o ânion cromato, segundo a reação representada por:
 PROCESSO SELETIVO 2007 1 O DIA GABARITO 2 7 QUÍMICA QUESTÕES DE 16 A 30 16. Em soluções aquosas o ânion dicromato está em equilíbrio dinâmico com o ânion cromato, segundo a reação representada por: Cr
PROCESSO SELETIVO 2007 1 O DIA GABARITO 2 7 QUÍMICA QUESTÕES DE 16 A 30 16. Em soluções aquosas o ânion dicromato está em equilíbrio dinâmico com o ânion cromato, segundo a reação representada por: Cr
2 KClO 3 2 KCl + 3 O 2
 PROCESSO SELETIVO 2007 1 O DIA GABARITO 1 7 QUÍMICA QUESTÕES DE 16 A 30 16. O ânion cloreto (Cl - ), o argônio (Ar) e o cátion potássio (K + ) têm em comum o mesmo número: a) de prótons. b) de elétrons.
PROCESSO SELETIVO 2007 1 O DIA GABARITO 1 7 QUÍMICA QUESTÕES DE 16 A 30 16. O ânion cloreto (Cl - ), o argônio (Ar) e o cátion potássio (K + ) têm em comum o mesmo número: a) de prótons. b) de elétrons.
M.Sc. Jose Eduardo Ruiz Rosero 1. ENG1116 Tópicos especiais Energia solar
 1 ENG1116 Tópicos especiais Energia solar M.Sc. Jose Eduardo Ruiz Rosero 2 Ementa o Conquistas e desafios da energia solar o Conceitos básicos o Radiação solar o Física das células solares o Circuitos
1 ENG1116 Tópicos especiais Energia solar M.Sc. Jose Eduardo Ruiz Rosero 2 Ementa o Conquistas e desafios da energia solar o Conceitos básicos o Radiação solar o Física das células solares o Circuitos
O que esses dispositivos tem em comum? São dispositivos móveis. O que faz os dispositivos móveis funcionarem?
 O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
O que esses dispositivos tem em comum? São dispositivos móveis O que faz os dispositivos móveis funcionarem? Eletroquímica Relação entre reações químicas (oxirredução) e a energia elétrica Pilhas Eletrólise
Sumário 20 Pilhas/Baterias
 Sumário 2 Pilhas/Baterias 1. Definições e características 2. Baterias primárias 2.1 Baterias de Leclanché (pilhas secas) 2.2 Baterias Alcalinas 2.3 Baterias de Lítio 3. Baterias secundárias 3.1 Baterias
Sumário 2 Pilhas/Baterias 1. Definições e características 2. Baterias primárias 2.1 Baterias de Leclanché (pilhas secas) 2.2 Baterias Alcalinas 2.3 Baterias de Lítio 3. Baterias secundárias 3.1 Baterias
TECNOLOGIAS UPS s. LCPOWER Outubro 2006
 TECNOLOGIAS UPS s LCPOWER Outubro 2006 Aplicações Computadores e Data Centers Servidores Controlo de Processos Sistemas de Transmissão / SAT Instalações de Controlo Navegação Aérea Operadores e Serviços
TECNOLOGIAS UPS s LCPOWER Outubro 2006 Aplicações Computadores e Data Centers Servidores Controlo de Processos Sistemas de Transmissão / SAT Instalações de Controlo Navegação Aérea Operadores e Serviços
INVERSOR MONOFÁSICO CC/CA GUARDIAN
 INVERSOR MONOFÁSICO CC/CA GUARDIAN MICROPROCESSADO SAÍDA SENOIDAL ISOLADA OPÇÃO EM RACK 19 Modelos de gabinetes auto-sustentados, tipo torre e rack 19. Disponíveis também em gabinete para fixação em parede.
INVERSOR MONOFÁSICO CC/CA GUARDIAN MICROPROCESSADO SAÍDA SENOIDAL ISOLADA OPÇÃO EM RACK 19 Modelos de gabinetes auto-sustentados, tipo torre e rack 19. Disponíveis também em gabinete para fixação em parede.
Quí. Quí. Monitor: Rodrigo Pova
 Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
Quí. Professor: Allan Rodrigues Monitor: Rodrigo Pova Eletroquímica 07 nov EXERCÍCIOS DE AULA 1. Texto I Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais.
15. Trabalho Experimental - Proteção Catódica
 15. Trabalho Experimental - Proteção Catódica 15.1 - Introdução A proteção catódica é um método de controle de corrosão que consiste em transformar a estrutura à proteger no cátodo de um célula eletroquímica
15. Trabalho Experimental - Proteção Catódica 15.1 - Introdução A proteção catódica é um método de controle de corrosão que consiste em transformar a estrutura à proteger no cátodo de um célula eletroquímica
Professor: Alfênio. 06- A ilustração a seguir ilustra a eletrólise de uma solução aquosa de cloreto de cobre (II).
 Professor: Alfênio 01- (MACK-SP) Na eletrólise ígnea de NaCl, verifica-se que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição
Professor: Alfênio 01- (MACK-SP) Na eletrólise ígnea de NaCl, verifica-se que: a) no cátodo, deposita-se sódio metálico. b) no ânodo, ocorre redução. c) no cátodo, ocorre oxidação. d) no ânodo, há deposição
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
TD AULÃO DE QUÍMICA Prof(a): Nádia Portela
 01- (UECE) O conceito de entropia está intimamente associado à definição de espontaneidade de uma reação quimica, através da segunda lei da termodinâmica, embora não seja suficiente para caracterizá-la.
01- (UECE) O conceito de entropia está intimamente associado à definição de espontaneidade de uma reação quimica, através da segunda lei da termodinâmica, embora não seja suficiente para caracterizá-la.
LCS E P U S P. Baterias. PTC2527 Anteprojeto de Formatura. Guido Stolfi 05 / Guido Stolfi 1 / 87
 Baterias PTC2527 Anteprojeto de Formatura Guido Stolfi 05 / 2017 Guido Stolfi 1 / 87 O que é uma Bateria? Célula Eletroquímica Converte energia química em elétrica através de reação de óxidoredução Estrutura:
Baterias PTC2527 Anteprojeto de Formatura Guido Stolfi 05 / 2017 Guido Stolfi 1 / 87 O que é uma Bateria? Célula Eletroquímica Converte energia química em elétrica através de reação de óxidoredução Estrutura:
Interpretar as reacções químicas que ocorrem quando se efectua a electrólise da água com eléctrodos de grafite, ferro e zinco.
 REALIZAÇÃO EXPERIMENTAL Objectivo Interpretar as reacções químicas que ocorrem quando se efectua a electrólise da água com eléctrodos de grafite, ferro e zinco. Duração Tempo de realização 45 minutos.
REALIZAÇÃO EXPERIMENTAL Objectivo Interpretar as reacções químicas que ocorrem quando se efectua a electrólise da água com eléctrodos de grafite, ferro e zinco. Duração Tempo de realização 45 minutos.
ANÁLISE PARA MELHORIA NA ALIMENTAÇÃO ELÉTRICA DE SISTEMAS CRÍTICOS EM UMA INDÚSTRIA PETROQUÍMICA
 1 UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPARTAMENTO ACADÊMICO DE ELETROTÉCNICA CURSO DE ENGENHARIA INDUSTRIAL ELÉTRICA ÊNFASE ELETROTÉCNICA SIDNEI LEANDRO DA SILVA ANÁLISE PARA MELHORIA NA ALIMENTAÇÃO
1 UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPARTAMENTO ACADÊMICO DE ELETROTÉCNICA CURSO DE ENGENHARIA INDUSTRIAL ELÉTRICA ÊNFASE ELETROTÉCNICA SIDNEI LEANDRO DA SILVA ANÁLISE PARA MELHORIA NA ALIMENTAÇÃO
Redação selecionada e publicada pela Olimpíada de Química SP-2011
 Autora: Amanda Gudrum Nitoli Série: Primeira do Ensino Médio Prof.: Rubens Conilho Junior Colégio: Etapa Cidade: São Paulo, SP Redação selecionada e publicada pela Olimpíada de Química SP-2011 O Trabalho
Autora: Amanda Gudrum Nitoli Série: Primeira do Ensino Médio Prof.: Rubens Conilho Junior Colégio: Etapa Cidade: São Paulo, SP Redação selecionada e publicada pela Olimpíada de Química SP-2011 O Trabalho
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes)
 Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
QUÍMICA. 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica:
 QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
QUÍMICA 16. Os elementos químicos A, B e C apresentam para seu átomo, no estado fundamental, a seguinte configuração eletrônica: A 1s 2 2s 2 2p 6 3s 2 3p 5 B 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 C 1s 2 2s
Faculdade de Ciências da Universidade do Porto Departamento de Química. Programa do 10º ano e do 11º ano de Química do Ensino Secundário
 Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
3º Trimestre Sala de Estudo Data: 11/09/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 11/9/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletroquímica (Pilhas) Questão 1 - (FUVEST SP/215) A figura abaixo ilustra as estabilidades relativas
3º Trimestre Sala de Estudo Data: 11/9/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Eletroquímica (Pilhas) Questão 1 - (FUVEST SP/215) A figura abaixo ilustra as estabilidades relativas
Aglailson Glêdson Cabral de Oliveira (1); Eudésio Oliveira Vilar (2)
 AVALIAÇÃO DO POTENCIAL DE EQUILÍBRIO PARA O ELETRODO DE CHUMBO EM DIFERENTES CONCENTRAÇÕES DE ÁCIDO SULFÚRICO, UTILIZANDO A TÉCNICA DA POLARIZAÇÃO LINEAR Aglailson Glêdson Cabral de Oliveira (1); Eudésio
AVALIAÇÃO DO POTENCIAL DE EQUILÍBRIO PARA O ELETRODO DE CHUMBO EM DIFERENTES CONCENTRAÇÕES DE ÁCIDO SULFÚRICO, UTILIZANDO A TÉCNICA DA POLARIZAÇÃO LINEAR Aglailson Glêdson Cabral de Oliveira (1); Eudésio
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Câmpus Curitiba
 Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Câmpus Curitiba Lista de Exercícios Eletroquímica Nome: Turma: S5/6 Data de Entrega: 1/9/14 Disciplina: Química (QB7D) Prof. Reinaldo Morita
Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Câmpus Curitiba Lista de Exercícios Eletroquímica Nome: Turma: S5/6 Data de Entrega: 1/9/14 Disciplina: Química (QB7D) Prof. Reinaldo Morita
ELETROQUÍMICA: PILHAS GALVÂNICAS
 ELETROQUÍMICA: PILHAS GALVÂNICAS A Eletroquímica é a parte da Química que estuda as propriedades dos eletrólitos e os processos de interconversão de energia química em energia elétrica que ocorrem na superfície
ELETROQUÍMICA: PILHAS GALVÂNICAS A Eletroquímica é a parte da Química que estuda as propriedades dos eletrólitos e os processos de interconversão de energia química em energia elétrica que ocorrem na superfície
Impressora HP Designjet série H35000/H Guia de preparação do local
 4 Impressora HP Designjet série H35000/H45000 Guia de preparação do local Como preparar o local para sua nova impressora Como preparar o local para sua nova impressora Siga as diretrizes para preparar
4 Impressora HP Designjet série H35000/H45000 Guia de preparação do local Como preparar o local para sua nova impressora Como preparar o local para sua nova impressora Siga as diretrizes para preparar
O que são pilhas? Pilhas são sistemas em que a energia química se transforma espontaneamente em energia elétrica.
 O que são pilhas? Pilhas são sistemas em que a energia química se transforma espontaneamente em energia elétrica. Você sabe o que é um processo espontâneo? Para as pilhas, os processos espontâneos e nãoespontâneos,
O que são pilhas? Pilhas são sistemas em que a energia química se transforma espontaneamente em energia elétrica. Você sabe o que é um processo espontâneo? Para as pilhas, os processos espontâneos e nãoespontâneos,
3ª Ficha de Avaliação de Química. Critérios de Correção pontos A. Falsa B. Verdadeira C. Falsa D. Verdadeira E.
 3ª Ficha de Avaliação de Química Professora Paula Melo Silva Critérios de Correção 1. 1.1 10 pontos A. Falsa B. Verdadeira C. Falsa D. Verdadeira E. Verdadeira Descritor do nível de desempenho Classificação
3ª Ficha de Avaliação de Química Professora Paula Melo Silva Critérios de Correção 1. 1.1 10 pontos A. Falsa B. Verdadeira C. Falsa D. Verdadeira E. Verdadeira Descritor do nível de desempenho Classificação
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de Prova de Conhecimentos Gerais em Química. Caderno de Questões
 Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de 2013 Prova de Conhecimentos Gerais em Química Caderno de Questões Nome do candidato: Instruções: Escreva seu nome de forma
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 2º Semestre de 2013 Prova de Conhecimentos Gerais em Química Caderno de Questões Nome do candidato: Instruções: Escreva seu nome de forma
ELETROQUÍMICA. paginapessoal.utfpr.edu.br/lorainejacobs. Profª Loraine Jacobs DAQBI
 lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI Semi-Reações Utilizadas para facilitar o balanceamento de reações de oxi-redução: Maneira conceitual de representação
lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª Loraine Jacobs DAQBI Semi-Reações Utilizadas para facilitar o balanceamento de reações de oxi-redução: Maneira conceitual de representação
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Motivos da Conexão A) positivo fornecer elétrons, acelerando a oxidação
 1. (UFRN-1999) A bateria do automóvel tem um dos seus pólos ligado à estrutura metálica do mesmo. Assinale a opção na qual são indicados o pólo que deve ser ligado à estrutura e os motivos dessa conexão.
1. (UFRN-1999) A bateria do automóvel tem um dos seus pólos ligado à estrutura metálica do mesmo. Assinale a opção na qual são indicados o pólo que deve ser ligado à estrutura e os motivos dessa conexão.
Metais no Organismo Humano
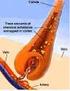 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
1 a Questão: Valor : 1,0 FOLHA DE DADOS. I ) Entalpias de Formação (H o f ) H 2. O (líquida) = - 68,3 kcal / mol. CO 2 (gasoso) = - 94,1 kcal / mol
 PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
Oxirredução IDENTIFICAÇÃO O QUE SOFRE ENTIDADE O QUE FAZ. Oxidante ganha e - ( NOX) oxida o redutor redução
 Eletroquímica Oxirredução ENTIDADE IDENTIFICAÇÃO O QUE FAZ O QUE SOFRE Oxidante ganha e - ( NOX) oxida o redutor redução Redutor perde e - ( NOX) reduz o oxidante oxidação Todas as reações que têm substâncias
Eletroquímica Oxirredução ENTIDADE IDENTIFICAÇÃO O QUE FAZ O QUE SOFRE Oxidante ganha e - ( NOX) oxida o redutor redução Redutor perde e - ( NOX) reduz o oxidante oxidação Todas as reações que têm substâncias
