Conclusões científicas
|
|
|
- Luísa Delgado Andrade
- 6 Há anos
- Visualizações:
Transcrição
1 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tomando em consideração as indicações aprovadas para cada medicamento 6
2 Conclusões científicas Resumo da avaliação científica de medicamentos contendo di-hidroergocristina (ver Anexo I) Em 18 de janeiro de 2012, a França desencadeou um procedimento previsto no artigo 31.º da Diretiva 2001/83/CE relativamente aos medicamentos contendo os seguintes derivados de ergot: di-hidroergocriptina/cafeína, di-hidroergocristina, di-hidroergotamina, di-hidroergotoxina e nicergolina. Na sequência de uma revisão nacional de farmacovigilância realizada em 2011, novas notificações espontâneas relativas a alguns desses medicamentos identificaram casos graves de fibrose e ergotismo, tendo a França considerado que esta preocupação de segurança não prevalece face à evidência limitada de eficácia. Por conseguinte, foi solicitado ao CHMP o seu parecer quanto à manutenção, alteração, suspensão ou retirada das Autorizações de Introdução no Mercado de medicamentos contendo derivados de ergot em relação às indicações referidas abaixo: tratamento sintomático de patologias crónicas da função cognitiva ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências); tratamento auxiliar da claudicação intermitente na doença oclusiva arterial periférica sintomática (DAOP estádio II); tratamento auxiliar da doença de Raynaud; tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem retinopatias agudas de origem vascular; profilaxia da enxaqueca; hipotensão ortostática; tratamento sintomático da insuficiência venolinfática. A di-hidroergocristina é um agonista parcial dos recetores adrenérgicos alfa que reduz a atividade dos centros simpáticos e é responsável por um efeito adrenolítico periférico com o aumento do tónus da parede venosa. Adicionalmente, apresenta uma ação farmacológica sobre os recetores serotoninérgicos e dopaminérgicos que resulta em efeitos interessantes sobre o metabolismo cerebral. Encontra-se disponível em associação com raubasina, um agente adrenolítico e simpatolítico com um efeito inibitório dos centros simpáticos. Produz uma redução da tensão arterial e um aumento na circulação sanguínea periférica. O seu efeito resulta principalmente das suas propriedades de bloqueio α1. Na Europa, a di-hidroergocristina encontra-se também disponível em associação com etofilina. Entre as indicações aprovadas de medicamentos que contêm di-hidroergocristina, as que pertencem ao âmbito do presente procedimento de consulta e estão aprovadas em pelo menos um Estado-Membro são as seguintes (a redação específica da indicação poderá variar conforme o medicamento): tratamento sintomático de patologias crónicas da função cognitiva ou perturbações; neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências) tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem retinopatias agudas de origem vascular. Os titulares das Autorizações de Introdução no Mercado (AIM) submeteram todos os dados de eficácia disponíveis a partir de ensaios clínicos e estudos observacionais, incluindo dados que ficaram disponíveis depois da concessão da Autorização de Introdução no Mercado inicial. Os titulares das AIM submeteram igualmente os seus próprios resultados e resumos críticos de todas as notificações espontâneas de reações fibróticas (cardíacas acompanhadas ou não acompanhadas de hipertensão arterial, pulmonares, pleurais, peritoneais, retroperitoneais, etc.) e ergotismo relacionados com os seus medicamentos contendo derivados de ergot. Sempre que possível, foi fornecida uma revisão de todos os outros dados disponíveis (nomeadamente, dados da literatura, dados pré-clínicos e outros dados clínicos, incluindo estudos epidemiológicos) relevantes para a avaliação do risco de fibrose. O CHMP teve em conta a totalidade dos dados disponíveis sobre a segurança e eficácia da di-hidroergocristina. Eficácia clínica Os titulares das AIM submeteram 27 referências da literatura que apoiam a eficácia da di-hidroergocristina na indicação «tratamento sintomático de patologias crónicas da função cognitiva 7
3 ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências)». Destas, 18 referiam-se a ensaios controlados com placebo, duas referiam-se a ensaios controlados com outras substâncias ativas e sete referiam-se a estudos abertos. Cinco dos seis estudos aleatorizados, em dupla ocultação e controlados por placebo não foram considerados relevantes pelo CHMP por não terem uma definição padronizada do diagnóstico, por não ter sido selecionado um critério primário de eficácia entre a avaliação multidimensional, devido ao número reduzido de doentes por grupo (entre 47 e 65) e à curta duração do tratamento (dois a três meses). Os resultados são heterogéneos e inconsistentes. O CHMP considerou que não era possível concluir sobre a eficácia com base nestes estudos. O estudo mais recente (Vellas 1998 não publicado), que ficou disponível depois da concessão da Autorização de Introdução no Mercado inicial, utiliza uma definição padronizada do diagnóstico (os doentes tinham de apresentar uma deficiência moderada na memória, com um míni exame do estado mental > 25 e uma pontuação total > 38 e < 70 no autoquestionário de Mac Nair e Kahn de avaliação das dificuldades nas atividades diárias) e define a priori um critério primário de eficácia (o autoquestionário de Mac Nair e Kahn e o teste de Gröber e Buschke). No entanto, neste estudo, que apresentava um padrão de qualidade metodológica adequado, observou-se uma diferença não significativa entre o grupo di-hidroergocristina + raubasina e o grupo placebo. Realizaram-se três estudos controlados por placebo numa população de estudo de doentes. Entre estes três estudos, as publicações de Lazzaroni et al. e Aranda et al. indicaram uma superioridade em relação ao placebo, enquanto o estudo de Vellas et al. demonstrou uma eficácia semelhante ao placebo. Foram realizados dois estudos adicionais por Hugonot et al. numa população de doentes, que demonstraram uma superioridade em relação ao placebo. Em seis dos estudos possíveis de avaliar com uma população abaixo dos 100 doentes, foram observados resultados semelhantes. Apesar de se concordar que a terminologia médica utilizada atualmente e no passado são diferentes, e que os dados devem ser avaliados tendo este aspeto em consideração, o sintoma clínico de demência é um resultado de vários processos fisiopatológicos que tornam difícil a agregação e comparação dos dados, em especial quando os estudos individuais utilizam critérios de inclusão ligeiramente diferentes. Todos os dados submetidos foram revistos e considerados. Apesar de poderem ser interpretados como sugerindo uma eficácia moderada da di-hidroergocristina no «tratamento de perturbações da função cognitiva nos idosos», não foi possível considerar suficientemente demonstrada a eficácia, nomeadamente devido à inconsistência dos dados gerados pelos ensaios de maiores dimensões. Em dezembro de 2012, a pedido do CHMP, foi convocado um grupo consultivo científico (SAG). Os peritos discutiram, com base na sua experiência clínica, se esta substância tem um papel no tratamento sintomático de patologias crónicas da função cognitiva ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências). O grupo sublinhou que a indicação reivindicada já não se encontra em uso na prática clínica e que, de um ponto de vista clínico, não existem atualmente evidências de que haja uma necessidade terapêutica desta substância ativa para o tratamento de perturbações cognitivas e neurossensoriais nos idosos. Quanto às indicações «tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem vascular» e «retinopatias agudas de origem vascular», as escassas observações pré-clínicas submetidas descrevendo os efeitos de doses tópicas de di-hidroergocristina foram consideradas insuficientes pelo CHMP para apoiar a utilização de di-hidroergocristina como agente redutor da pressão intraocular nos seres humanos, ou para outras patologias oculares de origem presumivelmente vascular. Além disso, foi notado que a instilação tópica de di-hidroergocristina se encontra fora do âmbito do presente procedimento. O CHMP notou igualmente a posição de um dos titulares da AIM de que, devido às limitações dos dados disponíveis, não é possível manter a indicação ocular. Segurança clínica Os derivados de ergot são reconhecidamente capazes de induzir fibrose, em particular fibrose das válvulas cardíacas. A relação entre a fibrose e a ativação dos recetores serotoninérgicos, em particular a ativação dos recetores 5-HT 2B pelos derivados de ergot, está amplamente descrita na literatura. O agonismo aos recetores 5-HT 2B induz uma resposta proliferativa e mitogenicidade das células que expressam este recetor, resultando na fibrogénese. Em geral, a afinidade variável dos recetores serotoninérgicos aos vários derivados de ergot e as doses terapêuticas utilizadas poderão explicar as 8
4 diferenças observadas nas taxas de notificação de reações fibróticas. Por conseguinte, mesmo que seja fortemente plausível, do ponto de vista farmacológico, que os derivados de ergot que atuam como agonistas dos recetores 5-HT 2B possam induzir valvulopatias serotoninérgicas semelhantes às induzidas por tumores carcinoides ou lesões fibróticas de outros tecidos, deve recordar-se que alguns derivados de ergot não são agonistas do recetor 5-HT 2B. Assim, não podem ser excluídos outros mecanismos indutores da fibrose, o que sugere uma ligação causal entre a fibrose e o agonismo dos recetores 5-HT 2A e 5-HT 1B, bem como um efeito plausível sobre o transportador de serotonina. Os dados dos casos de fibrose notificados (n=12) são indicadores da capacidade da di-hidroergocristina de induzir reações fibróticas, principalmente localizadas na área pulmonar, considerando igualmente a melhoria de alguns doentes na sequência da interrupção do tratamento. É ainda possível suspeitar de uma subnotificação, dado que a substância se encontra no mercado há muito tempo e porque a fibrose já é mencionada como efeito indesejável na informação sobre o medicamento. Mesmo que nalguns casos tenha sido coadministrado outro tratamento (conhecido por induzir reação fibrótica) potencialmente indutor de confusão, a relação entre as reações fibróticas observadas e o tratamento com di-hidroergocristina não pode ser excluída. Deverá também sublinhar-se que ocorreram comunicações de redução da extensão da placa fibrótica muito tempo depois da interrupção do tratamento com di-hidroergocristina, melhorias na sequência da interrupção do tratamento com di-hidroergocristina e desafio de reintrodução positivo (a recorrência dos sintomas com a readministração). Isto é indicativo de uma relação causal entre a fibrose e a di-hidroergocristina. Adicionalmente, um caso de fibrose retroperitoneal foi descrito na literatura (relacionado com placa fibrótica), no qual um exame realizado um ano após a descontinuação da di-hidroergocristina revelou uma redução marcada da placa fibrótica. Tal foi considerado pelo CHMP como indicador de uma relação causal entre a fibrose retroperitoneal observada e a di-hidroergocristina. Com base nestes dados e na plausibilidade farmacológica, considerou-se que a di-hidroergocristina está associada a reações fibróticas. Mais a mais, deve destacar-se a gravidade de tais efeitos adversos, o seu resultado eventualmente fatal e o risco aumentado de um doente desenvolver uma patologia fibrótica associada à utilização prolongada de acordo com as indicações autorizadas. Além disso, com base nos casos notificados, não pode excluir-se a vasoconstrição induzida pela di-hidroergocristina. O CHMP teve em consideração as propostas dos titulares das AIM para a minimização dos riscos. Estas incluíam a limitação da duração do tratamento em determinadas condições, a contraindicação do medicamento em doentes com fibrose preexistente ou em associação com outros medicamentos, a produção de uma comunicação direta aos médicos e profissionais de saúde (DHPC) com informações sobre os riscos, uma lista de verificação para os prescritores, bem como um estudo farmacológico in vitro investigando a afinidade dos recetores da subclasse 5-HT ao produto. Apesar de algumas das medidas propostas poderem ajudar a identificar doentes com fibrose preexistente, medicação concomitante relevante e risco aumentado, o Comité referiu que estas são insuficientes para evitar que alguns doentes desenvolvam fibrose e ergotismo durante o tratamento. Em geral, o CHMP considerou que, tendo em consideração os dados muito limitados sobre a eficácia, não existe uma situação que possa justificar expor um doente ao risco de fibrose e ergotismo. Relação de benefício-risco O Comité concluiu que a relação de benefício-risco dos medicamentos contendo di-hidroergocristina não é favorável, nos termos do disposto no artigo 116.º da Diretiva 2001/83/CE, para o tratamento sintomático de patologias crónicas da função cognitiva ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências), o tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem presumivelmente vascular e retinopatias agudas de origem vascular. 9
5 Fundamentos para a alteração/suspensão dos termos das Autorizações de Introdução no Mercado Considerando que O Comité teve em conta o procedimento previsto no artigo 31.º da Diretiva 2001/83/CE do Conselho no que respeita a medicamentos contendo derivados de ergot para as indicações em causa. O Comité teve em conta todos os dados submetidos pelos titulares das AIM e as conclusões do grupo consultivo científico. O Comité considerou que não pode ser excluída uma potencial associação causal entre reações fibróticas ou ergotismo e a di-hidroergocristina. Os dados disponíveis indicam, de facto, uma tal relação causal. Destaca-se a gravidade destes efeitos adversos e o seu desenlace possivelmente fatal. O Comité considera que as evidências de eficácia clínica significativa da di-hidroergocristina nas indicações presentemente avaliadas são muito limitadas, sendo o potencial benefício para os doentes com estas indicações consequentemente ultrapassado pelo risco identificado em cima. O Comité considerou que a relação de benefício-risco dos medicamentos contendo di-hidroergocristina: não é favorável para o tratamento sintomático de patologias crónicas da função cognitiva ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências); não é favorável para o tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem não é favorável para retinopatias agudas de origem vascular. Por conseguinte, nos termos do artigo 116.º da Diretiva 2001/83/CE, o CHMP recomenda: A alteração dos termos da Autorização de Introdução no Mercado dos medicamentos contendo di-hidroergocristina referidos no Anexo I, eliminando as indicações referidas abaixo da Informação sobre o Produto (a redação específica da indicação poderá variar conforme o medicamento e de país para país), bem como qualquer referência relevante a estas indicações na Informação sobre o Produto, quando existam outras indicações terapêuticas aprovadas como parte da sua Autorização de Introdução no Mercado: tratamento sintomático de patologias crónicas da função cognitiva ou perturbações neurossensoriais nos idosos (excluindo doença de Alzheimer e outras demências); tratamento auxiliar da acuidade visual diminuída e distúrbios no campo visual de origem retinopatias agudas de origem vascular. A suspensão da Autorização de Introdução no Mercado dos medicamentos contendo di-hidroergocristina referidos no Anexo I caso não existam outras indicações aprovadas como parte da sua Autorização de Introdução no Mercado. Para que a suspensão seja levantada, os titulares das Autorizações de Introdução no Mercado deverão identificar uma população específica de doentes para a qual os benefícios do medicamento sejam superiores ao risco identificado. 10
Nome de fantasia Dosagem Forma farmacêutica. VASOBRAL, comprimido sulcado. VASOBRAL, A solução oral num frasco. 0.
 Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s) do(s) titular(es) da(s) Autorização(ões) de Introdução no mercado nos Estados-Membros 1
Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s) do(s) titular(es) da(s) Autorização(ões) de Introdução no mercado nos Estados-Membros 1
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo
Ergomed - Tropfen (1:1:1) ERSILAN 1mg/ml solução oral em gotas oral mg/19.20 mg. ISKEDYL, comprimé 0.60 mg / 4.80 mg
 Anexo I Lista de nomes, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Estado
Anexo I Lista de nomes, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Estado
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tendo
Nome de fantasia Dosagem Forma Farmacêutica. Hydergin Fas 4,5 mg Filmcomprimidoten. Hydergin SRO 6 mg Kapseln
 Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de admnistração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado no(s) estados-membros
Anexo I Lista do(s) nome(s), forma(s) farmacêutica(s), dosagem(ns), via(s) de admnistração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado no(s) estados-membros
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 15 Conclusões científicas Haldol, que contém a substância ativa haloperidol, é um antipsicótico do grupo das butirofenonas. É um potente antagonista dos recetores de dopamina
Anexo II Conclusões científicas 15 Conclusões científicas Haldol, que contém a substância ativa haloperidol, é um antipsicótico do grupo das butirofenonas. É um potente antagonista dos recetores de dopamina
Resumo da avaliação científica de supositórios contendo derivados terpénicos (ver Anexo I)
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A REVOGAÇÃO OU A ALTERAÇÃO DAS SECÇÕES RELEVANTES DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DOS FOLHETOS INFORMATIVOS APRESENTADOS
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A REVOGAÇÃO OU A ALTERAÇÃO DAS SECÇÕES RELEVANTES DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DOS FOLHETOS INFORMATIVOS APRESENTADOS
Resumo da avaliação científica de medicamentos contendo nimesulida para uso sistémico (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Anexo II Conclusões científicas e fundamentos para as alterações dos Resumos das Características do Medicamento e dos Folhetos Informativos apresentados pela EMA 41 Conclusões científicas Resumo da avaliação
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Lipophoral Tablets 150mg. Mediator 150 mg Comprimido Via oral. Benfluorex Mylan 150 mg Comprimido Via oral. Benfluorex Qualimed
 ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
ANEXO I LISTA DOS NOMES DE FANTASIA, FORMAS FARMACÊUTICAS, DOSAGENS DOS MEDICAMENTOS, VIA DE ADMINISTRAÇÃO E TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS (EEE) 1 Estado-Membro
RESUMO DA AVALIAÇÃO CIENTÍFICA DE MEDICAMENTOS CONTENDO ÁCIDO VALPRÓICO/VALPROATO (ver Anexo I)
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 108 CONCLUSÕES
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DOS RESUMOS DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 108 CONCLUSÕES
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 57 Conclusões científicas Em 7 de junho de 2017, a Comissão Europeia (CE) foi informada da ocorrência de um caso fatal de falência hepática fulminante, registado num doente
Anexo IV Conclusões científicas 57 Conclusões científicas Em 7 de junho de 2017, a Comissão Europeia (CE) foi informada da ocorrência de um caso fatal de falência hepática fulminante, registado num doente
Anexo. Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
 Anexo Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
Anexo Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Anexo I Lista dos nomes (de fantasia), forma farmacêutica, dosagem dos medicamentos, modo de administração, requerentes/titulares da autorização de introdução no mercado nos Estados-Membros 1 Estado-Membro
Resumo das conclusões científicas relativas aos fármacos que contêm buflomedil (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para a suspensão da autorização de introdução no mercado e utilização dos produtos apresentados pela EMA 14 Conclusões científicas Resumo das conclusões científicas
Anexo II Conclusões científicas e fundamentos para a suspensão da autorização de introdução no mercado e utilização dos produtos apresentados pela EMA 14 Conclusões científicas Resumo das conclusões científicas
Anexo IV. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado Conclusões científicas O CHMP teve em linha de conta a recomendação abaixo do PRAC, datada
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 7 Conclusões científicas Resumo da avaliação científica do Kantos Master e nomes associados
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 7 Conclusões científicas Resumo da avaliação científica do Kantos Master e nomes associados
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 13 Conclusões científicas e fundamentos para a alteração dos termos das Autorizações
Anexo II. Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica do Leflunomide Apotex (ver Anexo I) O organismo
Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica do Leflunomide Apotex (ver Anexo I) O organismo
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo II. Conclusões científicas e fundamentos para revogação das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para revogação das Autorizações de Introdução no Mercado 4 Conclusões científicas Resumo da avaliação científica do Caustinerf arsenical, Yranicid arsenical
Anexo II Conclusões científicas e fundamentos para revogação das Autorizações de Introdução no Mercado 4 Conclusões científicas Resumo da avaliação científica do Caustinerf arsenical, Yranicid arsenical
Anexo I. Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado
 Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo I Conclusões científicas e fundamentos da alteração dos termos da(s) autorização(ões) de introdução no mercado 1 Conclusões científicas Tendo em conta o relatório de avaliação do PRAC sobre os relatórios
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Três casos de lesão hepática grave conducentes a transplantes hepáticos foram notificados entre a concessão de autorização de introdução no mercado
Anexo IV Conclusões científicas 1 Conclusões científicas Três casos de lesão hepática grave conducentes a transplantes hepáticos foram notificados entre a concessão de autorização de introdução no mercado
Nome de fantasia Dosagem Forma farmacêutica. Ergotop 10 mg - Tabletten. Ergotop 20 mg - Filmtabletten. Ergotop 30 mg - Filmtabletten
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tomando
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado ou para a suspensão das Autorizações de Introdução no Mercado, conforme aplicável, tomando
ANEXO III ALTERAÇÕES AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO
 ANEXO III ALTERAÇÕES AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 43 ALTERAÇÕES A SEREM INCLUÍDAS NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO PARA MEDICAMENTOS
ANEXO III ALTERAÇÕES AO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E FOLHETO INFORMATIVO 43 ALTERAÇÕES A SEREM INCLUÍDAS NAS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO PARA MEDICAMENTOS
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 7 Conclusões científicas A amitriptilina é um antidepressivo tricíclico bem conhecido com um mecanismo de ação e um uso bem estabelecidos (Brunton 2011). A amitriptilina
Anexo II Conclusões científicas 7 Conclusões científicas A amitriptilina é um antidepressivo tricíclico bem conhecido com um mecanismo de ação e um uso bem estabelecidos (Brunton 2011). A amitriptilina
Anexo II. Conclusões científicas e fundamentos para a manutenção das Autorizações de Introdução no Mercado apresentados pela EMA
 Anexo II Conclusões científicas e fundamentos para a manutenção das Autorizações de Introdução no Mercado apresentados pela EMA 24 Conclusões científicas Resumo da avaliação científica de medicamentos
Anexo II Conclusões científicas e fundamentos para a manutenção das Autorizações de Introdução no Mercado apresentados pela EMA 24 Conclusões científicas Resumo da avaliação científica de medicamentos
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 7 Conclusões científicas O pó e solvente Solu-Medrol 40 mg para solução para injeção (a seguir designado «Solu-Medrol») contém metilprednisolona e, tratando-se de um excipiente,
Anexo II Conclusões científicas 7 Conclusões científicas O pó e solvente Solu-Medrol 40 mg para solução para injeção (a seguir designado «Solu-Medrol») contém metilprednisolona e, tratando-se de um excipiente,
Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças em relação à recomendação do PRAC
 Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado e explicação detalhada dos fundamentos científicos para as diferenças relativamente à
Anexo IV Conclusões científicas e fundamentos para a alteração dos termos das autorizações de introdução no mercado e explicação detalhada dos fundamentos científicos para as diferenças relativamente à
Anexo III. Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo
 Anexo III Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo Nota: Esta adenda às secções relevantes do Resumo das Características do Medicamento e Folheto
Anexo III Adenda às secções relevantes do Resumo das Características do Medicamento e Folheto Informativo Nota: Esta adenda às secções relevantes do Resumo das Características do Medicamento e Folheto
MAIOR CONTRO. Informação De Segurança Importante Sobre PRILIGY. 1 Informação para o médico
 MAIOR CONTRO Informação De Segurança Importante Sobre PRILIGY 1 Informação para o médico 2 A Ejaculação Precoce e PRILIGY PRILIGY é um medicamento oral aprovado para o tratamento da Ejaculação Precoce
MAIOR CONTRO Informação De Segurança Importante Sobre PRILIGY 1 Informação para o médico 2 A Ejaculação Precoce e PRILIGY PRILIGY é um medicamento oral aprovado para o tratamento da Ejaculação Precoce
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 199 Conclusões científicas Na sequência da avaliação de um procedimento de partilha do trabalho do RPS sobre os medicamentos contendo ambroxol iniciada em janeiro de 2012
Anexo II Conclusões científicas 199 Conclusões científicas Na sequência da avaliação de um procedimento de partilha do trabalho do RPS sobre os medicamentos contendo ambroxol iniciada em janeiro de 2012
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A RECUSA
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A RECUSA 3 CONCLUSÕES CIENTÍFICAS RESUMO DA AVALIAÇÃO CIENTÍFICA DE MYDERISON A tolperisona é um relaxante muscular de acção central indicado para o tratamento
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A RECUSA 3 CONCLUSÕES CIENTÍFICAS RESUMO DA AVALIAÇÃO CIENTÍFICA DE MYDERISON A tolperisona é um relaxante muscular de acção central indicado para o tratamento
Anexo II. Conclusões científicas e fundamentos para a recusa apresentados pela EMA
 Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela EMA 30 Conclusões científicas Resumo da avaliação científica do Norditropin SimpleXx, Norditropin NordiFlex, Norditropin FlexPro
Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela EMA 30 Conclusões científicas Resumo da avaliação científica do Norditropin SimpleXx, Norditropin NordiFlex, Norditropin FlexPro
Anexo II. Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
 Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos 4 Conclusões científicas Resumo da avaliação científica do Furosemide Vitabalans e nomes associados
Anexo II Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos 4 Conclusões científicas Resumo da avaliação científica do Furosemide Vitabalans e nomes associados
Estado-Membro Titular da Autorização de Introdução no Mercado Nome de fantasia Dosagem Forma farmacêutica Via de administração
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA FARMACÊUTICA, DOSAGEM, VIA DE ADMINISTRAÇÃO DO MEDICAMENTO, TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 Estado-Membro Titular da Autorização
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA FARMACÊUTICA, DOSAGEM, VIA DE ADMINISTRAÇÃO DO MEDICAMENTO, TITULARES DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 Estado-Membro Titular da Autorização
1. Resumo da avaliação científica das soluções para perfusão contendo hidroxietilamido pelo PRAC
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado e explicação detalhada para as diferenças relativamente à recomendação do PRAC 56 Conclusões
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado e explicação detalhada para as diferenças relativamente à recomendação do PRAC 56 Conclusões
Anexo II. Conclusões científicas e fundamentos para a
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado das formulações injetáveis de calcitonina e a suspensão das Autorizações de Introdução
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado das formulações injetáveis de calcitonina e a suspensão das Autorizações de Introdução
Anexo. Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
 Anexo Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
Anexo Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos Conclusões científicas e fundamentos para a recusa apresentados pela Agência Europeia de Medicamentos
ANEXO I. Página 1 de 6
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA FARMACÊUTICA, DOSAGEM DO MEDICAMENTO VETERINÁRIO, ESPÉCIES-ALVO, VIA(S) DE ADMINISTRAÇÃO, TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS Página
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA FARMACÊUTICA, DOSAGEM DO MEDICAMENTO VETERINÁRIO, ESPÉCIES-ALVO, VIA(S) DE ADMINISTRAÇÃO, TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS Página
ANEXO IV CONCLUSÕES CIENTÍFICAS
 ANEXO IV CONCLUSÕES CIENTÍFICAS Conclusões científicas A coinfeção pelo vírus da hepatite В (VHB) e pelo vírus da hepatite C (VHC) não é incomum devido à sobreposição dos modos de transmissão. Sabe-se
ANEXO IV CONCLUSÕES CIENTÍFICAS Conclusões científicas A coinfeção pelo vírus da hepatite В (VHB) e pelo vírus da hepatite C (VHC) não é incomum devido à sobreposição dos modos de transmissão. Sabe-se
PROCEDIMENTO DE VERIFICAÇÃO DA INSTRUÇÃO DE UM PEDIDO DE RENOVAÇÃO DA AIM SUBMETIDO POR PROCEDIMENTO NACIONAL MÓDULO 1 INFORMAÇÕES ADMINISTRATIVAS
 PROCEDIMENTO DE VERIFICAÇÃO DA INSTRUÇÃO DE UM PEDIDO DE RENOVAÇÃO DA AIM SUBMETIDO POR PROCEDIMENTO NACIONAL Nome do medicamento Nº de processo Data de Entrada Substância ativa Forma farmacêutica Dosagem
PROCEDIMENTO DE VERIFICAÇÃO DA INSTRUÇÃO DE UM PEDIDO DE RENOVAÇÃO DA AIM SUBMETIDO POR PROCEDIMENTO NACIONAL Nome do medicamento Nº de processo Data de Entrada Substância ativa Forma farmacêutica Dosagem
Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento
 23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
23 April 2015 EMA/PRAC/273916/2015 Pharmacovigilance Risk Assessment Committee Recomendações do PRAC relativamente aos sinais para atualização da informação do medicamento Adotadas a 7-10 de abril de 2015
Titular da Autorização de Introdução no Mercado Nome de fantasia Dosagem Forma farmacêutica Via de administração
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 Estado-Membro
ANEXO I LISTA DAS DENOMINAÇÕES, FORMA(S) FARMACÊUTICA(S), DOSAGEM(NS), VIA(S) DE ADMINISTRAÇÃO DO(S) MEDICAMENTO(S), TITULAR(ES) DA(S) AUTORIZAÇÃO(ÕES) DE INTRODUÇÃO NO MERCADO NOS ESTADOS-MEMBROS 1 Estado-Membro
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO. Cada cápsula contém 300 mg de diosmina como substância ativa.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Venex 300 mg Cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 300 mg de diosmina como substância ativa. Excipiente(s)
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Venex 300 mg Cápsulas 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada cápsula contém 300 mg de diosmina como substância ativa. Excipiente(s)
(Inventado) Loratadine Vitabalans 10 mg tablety. Loraxin 10 mg tablet uso oral. Loratadine Vitabalans. Loratadine Vitabalans 10 mg tabletes
 Anexo I Lista de nomes, forma farmacêutica, potência do medicamento, via de administração, requerente, titular da autorização de introdução no mercado nos Estados-Membros 1 Estado- Membro da UE/AEE República
Anexo I Lista de nomes, forma farmacêutica, potência do medicamento, via de administração, requerente, titular da autorização de introdução no mercado nos Estados-Membros 1 Estado- Membro da UE/AEE República
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica de Quixil Antecedentes O Quixil
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 3 Conclusões científicas Resumo da avaliação científica de Quixil Antecedentes O Quixil
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5586623 5586631 Relvar Ellipta 30
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5586623 5586631 Relvar Ellipta 30
ANEXO I LISTA DAS DENOMINAÇÕES, FORMAS FARMACÊUTICAS, DOSAGENS, VIAS DE ADMINISTRAÇÃO DOS MEDICAMENTOS, E DO REQUERENTE NOS ESTADOS-MEMBROS
 ANEXO I LISTA DAS DENOMINAÇÕES, FORMAS FARMACÊUTICAS, DOSAGENS, VIAS DE ADMINISTRAÇÃO DOS MEDICAMENTOS, E DO REQUERENTE NOS ESTADOS-MEMBROS 1 Estado-Membro Titular da Autorização de Requerente Nome Dosagem
ANEXO I LISTA DAS DENOMINAÇÕES, FORMAS FARMACÊUTICAS, DOSAGENS, VIAS DE ADMINISTRAÇÃO DOS MEDICAMENTOS, E DO REQUERENTE NOS ESTADOS-MEMBROS 1 Estado-Membro Titular da Autorização de Requerente Nome Dosagem
Anexo II. Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças relativamente à recomendação do PRAC
 Anexo II Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças relativamente à recomendação do PRAC 35 Conclusões científicas e explicação detalhada dos fundamentos
Anexo II Conclusões científicas e explicação detalhada dos fundamentos científicos para as diferenças relativamente à recomendação do PRAC 35 Conclusões científicas e explicação detalhada dos fundamentos
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ustecinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5279062
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI ustecinumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5279062
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Os inibidores do cotransportador de sódio-glucose 2 (SGLT2) são utilizados, juntamente com dieta e exercício físico, em doentes com diabetes de
Anexo IV Conclusões científicas 1 Conclusões científicas Os inibidores do cotransportador de sódio-glucose 2 (SGLT2) são utilizados, juntamente com dieta e exercício físico, em doentes com diabetes de
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 5 Conclusões científicas Alcover grânulos em saqueta contém a substância ativa oxibato de sódio, que é o sal de sódio do ácido gama-hidroxibutírico (GHB), um derivado do
Anexo II Conclusões científicas 5 Conclusões científicas Alcover grânulos em saqueta contém a substância ativa oxibato de sódio, que é o sal de sódio do ácido gama-hidroxibutírico (GHB), um derivado do
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI aflibercept N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 5487368
ANEXO I. Perguntas e Respostas sobre a revisão benefício-risco do piroxicam
 ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
ANEXO I Perguntas e Respostas sobre a revisão benefício-risco do piroxicam A Agência Europeia de Medicamentos (EMEA) completou recentemente a avaliação da segurança do anti-inflamatório não esteróide (AINE)
Nome Dosagem Forma Farmacêutica. Effortil comp. - Tropfen 2 mg/ml, 10 mg/ml
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros
40 mg tablet uso oral. Furosemide Vitabalans 40 mg tablet uso oral. Furosemide Vitabalans 40 mg tablet uso oral
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) requerente(s) titular(es) da(s) autorização(ões) de introdução no mercado nos
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de administração do(s) medicamento(s), do(s) requerente(s) titular(es) da(s) autorização(ões) de introdução no mercado nos
Colírio, solução. Solução oleosa, amarelo claro com aspeto límpido e cheiro característico.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Diomicete 10 mg/ml colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml de solução contém 10 mg de clotrimazol. Excipientes com
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO Diomicete 10 mg/ml colírio, solução 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Um ml de solução contém 10 mg de clotrimazol. Excipientes com
N.o336/CA/2006. o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que:
 M;n;s'êrio da Saúde DELIBERAÇÃO N.o336/CA/2006 1- Infarmed e do Medicamento o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que: \" A Comissão Europeia
M;n;s'êrio da Saúde DELIBERAÇÃO N.o336/CA/2006 1- Infarmed e do Medicamento o Conselho de Administração do INFARMED- Instituto Nacional da Farmácia e do Medicamento, considerando que: \" A Comissão Europeia
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 7 Conclusões científicas Resumo da avaliação científica de medicamentos, para administração oral, contendo metadona e que contêm povidona A metadona é um opioide sintético.
Anexo II Conclusões científicas 7 Conclusões científicas Resumo da avaliação científica de medicamentos, para administração oral, contendo metadona e que contêm povidona A metadona é um opioide sintético.
Anexo C. (alteração a medicamentos autorizados nacionalmente)
 Anexo C (alteração a medicamentos autorizados nacionalmente) ANEXO I CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS RECOMENDANDO A ALTERAÇÃO AOS TERMOS DA(S) AUTORIZAÇÃO(ÇÕES) DE INTRODUÇÃO NO MERCADO Conclusões
Anexo C (alteração a medicamentos autorizados nacionalmente) ANEXO I CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS RECOMENDANDO A ALTERAÇÃO AOS TERMOS DA(S) AUTORIZAÇÃO(ÇÕES) DE INTRODUÇÃO NO MERCADO Conclusões
esclarecimento sobre reacções adversas INFARMED, I.P.
 Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
Balanço o da vacinação e esclarecimento sobre reacções adversas INFARMED, I.P. 26 de Novembro de 2008 O Problema Qualquer fármaco, por muito triviais que sejam as suas acções terapêuticas, tem a potencialidade
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO
 RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
RELATÓRIO DE AVALIAÇÃO DO PEDIDO DE COMPARTICIPAÇÃO DE MEDICAMENTO PARA USO HUMANO DCI Rotigotina N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM PVP 5943980 doseados
Notificar efeitos indesejáveis: porquê, o quê e para quê?
 Notificar efeitos indesejáveis: porquê, o quê e para quê? Rui Pombal Comissão de Avaliação de Medicamentos Direção de Gestão do Risco de Medicamentos Manhã Informativa INFARMED 04 dezembro 2017 Notificar
Notificar efeitos indesejáveis: porquê, o quê e para quê? Rui Pombal Comissão de Avaliação de Medicamentos Direção de Gestão do Risco de Medicamentos Manhã Informativa INFARMED 04 dezembro 2017 Notificar
Anexo I. Lista de medicamentos e apresentações
 Anexo I Lista de medicamentos e apresentações 1 Estado-membro UE/EEE Requerente Nome de fantasia DCI + Dosagem Forma farmacêutica 4 Via de administração 5 Áustria Ibucomb 500 mg/150 mg comprimido Bélgica
Anexo I Lista de medicamentos e apresentações 1 Estado-membro UE/EEE Requerente Nome de fantasia DCI + Dosagem Forma farmacêutica 4 Via de administração 5 Áustria Ibucomb 500 mg/150 mg comprimido Bélgica
INFARMED. Circular Informativa. N.º 011/CA Data: Assunto: Ceftriaxona - Informação de segurança
 INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
Conclusões científicas
 Anexo II Conclusões científicas e fundamentos para a revogação ou alteração dos termos das Autorizações de Introdução no Mercado e explicação detalhada para as diferenças relativamente à recomendação do
Anexo II Conclusões científicas e fundamentos para a revogação ou alteração dos termos das Autorizações de Introdução no Mercado e explicação detalhada para as diferenças relativamente à recomendação do
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 11 Conclusões científicas O CMDh, depois de considerar a recomendação final revista do Comité de Avaliação do Risco em Farmacovigilância (PRAC) datada de 10 de julho de
Anexo II Conclusões científicas 11 Conclusões científicas O CMDh, depois de considerar a recomendação final revista do Comité de Avaliação do Risco em Farmacovigilância (PRAC) datada de 10 de julho de
Anexo II. Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 12 Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
Anexo II Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado 12 Conclusões científicas e fundamentos para a suspensão das Autorizações de Introdução no Mercado
Anexo III Resumo das características do medicamento, rotulagem e folheto informativo
 Anexo III Resumo das características do medicamento, rotulagem e folheto informativo Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas no momento
Anexo III Resumo das características do medicamento, rotulagem e folheto informativo Nota: Estas alterações ao Resumo das Características do Medicamento e ao Folheto Informativo são válidas no momento
Nome de fantasia Dosagem Forma farmacêutica
 Anexo I Lista dos nomes, forma farmacêutica, dosagem do medicamento veterinário, espécies-alvo e titulares das Autorizações de Introdução no Mercado nos Estados-Membros 1/10 Estado- Membro UE/EEE Titular
Anexo I Lista dos nomes, forma farmacêutica, dosagem do medicamento veterinário, espécies-alvo e titulares das Autorizações de Introdução no Mercado nos Estados-Membros 1/10 Estado- Membro UE/EEE Titular
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS ENTENDA MANUAL COMO E POR QUE. RELATAR EventoS AdversoS
 FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
FARMACOVIGILÂNCIA A QUALIDADE FQM EM SUAS MÃOS MANUAL ENTENDA COMO E POR QUE RELATAR EventoS AdversoS Apresentação O desastre da Talidomida no final da década de 50 foi um marco mundial na história da
Conclusões científicas
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A ALTERAÇÃO DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO, DA ROTULAGEM E DO FOLHETO INFORMATIVO APRESENTADOS PELA AGÊNCIA EUROPEIA DE MEDICAMENTOS 14
12º RELATÓRIO DO OBSERVATÓRIO NACIONAL DAS DOENÇAS RESPIRATÓRIAS RESUMO DOS DADOS
 12º RELATÓRIO DO OBSERVATÓRIO NACIONAL DAS DOENÇAS RESPIRATÓRIAS 1) Mortalidade por Doenças Respiratórias RESUMO DOS DADOS As doenças do sistema respiratório são uma das principais causas de morte na União
12º RELATÓRIO DO OBSERVATÓRIO NACIONAL DAS DOENÇAS RESPIRATÓRIAS 1) Mortalidade por Doenças Respiratórias RESUMO DOS DADOS As doenças do sistema respiratório são uma das principais causas de morte na União
O RNEC na perspetiva dos Estudos Observacionais. Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo
 O RNEC na perspetiva dos Estudos Observacionais Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo PAS Post Authorisation Study Estudos pós autorização podem ser pedidos pelas
O RNEC na perspetiva dos Estudos Observacionais Direção de Gestão do Risco de Medicamentos (DGRM) INFARMED, I.P. Fátima Canedo PAS Post Authorisation Study Estudos pós autorização podem ser pedidos pelas
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR
 RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI carfilzomib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5688304 Frasco para injetáveis
RELATÓRIO PÚBLICO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO EM MEIO HOSPITALAR DCI carfilzomib N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem Titular de AIM 5688304 Frasco para injetáveis
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 8 Conclusões científicas A Pharmaceutics International Inc. (PII), com sede em Maryland, EUA, encontra-se identificada como fabricante na Autorização de Introdução no Mercado
Anexo II Conclusões científicas 8 Conclusões científicas A Pharmaceutics International Inc. (PII), com sede em Maryland, EUA, encontra-se identificada como fabricante na Autorização de Introdução no Mercado
ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS
 ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS Nota: As alterações ao Resumo das Características do Medicamento e aos folhetos informativos
ANEXO III ALTERAÇÕES ÀS SECÇÕES RELEVANTES DO RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO E DOS FOLHETOS INFORMATIVOS Nota: As alterações ao Resumo das Características do Medicamento e aos folhetos informativos
Anexo III. Alterações às secções relevantes da informação do medicamento
 Anexo III Alterações às secções relevantes da informação do medicamento Nota: Estas alterações às secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo são o resultado
Anexo III Alterações às secções relevantes da informação do medicamento Nota: Estas alterações às secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo são o resultado
Anexo I. Lista de medicamentos autorizados a nível nacional e pedidos de autorização de introdução no mercado
 Anexo I Lista de medicamentos autorizados a nível nacional e pedidos de autorização de introdução no mercado 1 Anexo IA: Medicamentos para os quais se recomenda a manutenção das autorizações de introdução
Anexo I Lista de medicamentos autorizados a nível nacional e pedidos de autorização de introdução no mercado 1 Anexo IA: Medicamentos para os quais se recomenda a manutenção das autorizações de introdução
DCI Nome de fantasia Dosagem Forma farmacêutica CAUSTINERF ARSENICAL. CAUSTINERF ARSENICAL, pâte pour usage dentaire
 Anexo I Lista dos nomes, formas farmacêuticas, dosagens dos medicamentos, vias de administração, titulares das Autorizações de Introdução no Mercado nos Estados-Membros 1 Estado-Membro (no EEE) Titular
Anexo I Lista dos nomes, formas farmacêuticas, dosagens dos medicamentos, vias de administração, titulares das Autorizações de Introdução no Mercado nos Estados-Membros 1 Estado-Membro (no EEE) Titular
Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA
 CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
CAPRELSA (vandetanib) Informação importante para os profissionais de saúde acerca dos riscos graves associados a CAPRELSA Estes materiais educacionais estão focados no risco de prolongamento do intervalo
Monitorização de justificações técnicas e direito de opção - registo de casos
 Monitorização de justificações técnicas e direito de opção - registo de casos Comissão de Farmácia e Terapêutica - ARS Norte Porto,10 novembro de 2014 Índice 1. Introdução.... 4 2. Metodologia.... 5 2.1
Monitorização de justificações técnicas e direito de opção - registo de casos Comissão de Farmácia e Terapêutica - ARS Norte Porto,10 novembro de 2014 Índice 1. Introdução.... 4 2. Metodologia.... 5 2.1
Úlceras de Perna. Definição Epidemiologia Etiologia Manifestações Clínicas Diagnóstico Diferencial Tratamento 2015 ENF.
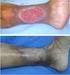 ÚLCERAS DE PERNA Úlceras de Perna Definição Epidemiologia Etiologia Manifestações Clínicas Diagnóstico Diferencial Tratamento 2015 ENF.ª MARTA MIRANDA 2 2015 ENF.ª MARTA MIRANDA 3 2015 ENF.ª MARTA MIRANDA
ÚLCERAS DE PERNA Úlceras de Perna Definição Epidemiologia Etiologia Manifestações Clínicas Diagnóstico Diferencial Tratamento 2015 ENF.ª MARTA MIRANDA 2 2015 ENF.ª MARTA MIRANDA 3 2015 ENF.ª MARTA MIRANDA
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 20 Conclusões científicas Resumo da avaliação científica de contracetivos de emergência
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 20 Conclusões científicas Resumo da avaliação científica de contracetivos de emergência
Anexo I. Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros
 Anexo I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros 1 Estado-membro UE/EEE Requerente nome da empresa, endereço Nome
Anexo I Lista das denominações, forma farmacêutica, dosagem, via de administração dos medicamentos e dos requerentes nos Estados-membros 1 Estado-membro UE/EEE Requerente nome da empresa, endereço Nome
Quetiapina SR Zentiva
 Quetiapina SR Zentiva Minimização e gestão de riscos importantes Material educacional para profissionais de saúde Conteúdo O que é Quetiapina SR Zentiva?... 2 Quais os riscos importantes associados a Quetiapina
Quetiapina SR Zentiva Minimização e gestão de riscos importantes Material educacional para profissionais de saúde Conteúdo O que é Quetiapina SR Zentiva?... 2 Quais os riscos importantes associados a Quetiapina
Guia do Prescritor. Versão 1 (novembro 2017)
 Versão (novembro 7) CONTEÚDO Introdução sobre MAVENCLAD Regimes de tratamento Monitorização durante o tratamento Contagens de linfócitos Infeções graves Leucoencefalopatia multifocal progressiva Neoplasias
Versão (novembro 7) CONTEÚDO Introdução sobre MAVENCLAD Regimes de tratamento Monitorização durante o tratamento Contagens de linfócitos Infeções graves Leucoencefalopatia multifocal progressiva Neoplasias
Anexo III. Alterações às secções relevantes do resumo das características do medicamento e folheto informativo
 Anexo III Alterações às secções relevantes do resumo das características do medicamento e folheto informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo é o resultado
Anexo III Alterações às secções relevantes do resumo das características do medicamento e folheto informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo é o resultado
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR
 RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
RELATÓRIO DE AVALIAÇÃO PRÉVIA DO MEDICAMENTO PARA USO HUMANO EM MEIO HOSPITALAR DCI Pembrolizumab N.º Registo Nome Comercial Apresentação/Forma Farmacêutica/Dosagem PVH PVH com IVA Titular de AIM 1 frasco
ANEXO CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS DA RECUSA APRESENTADOS PELA EMEA
 ANEXO CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS DA RECUSA APRESENTADOS PELA EMEA RESUMO DA AVALIAÇÃO CIENTÍFICA DE MILNACIPRAN PIERRE FABRE MEDICAMENT O Milnacipran Pierre Fabre Medicament contém milnaciprano,
ANEXO CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS DA RECUSA APRESENTADOS PELA EMEA RESUMO DA AVALIAÇÃO CIENTÍFICA DE MILNACIPRAN PIERRE FABRE MEDICAMENT O Milnacipran Pierre Fabre Medicament contém milnaciprano,
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado 37 Conclusões científicas Resumo da avaliação científica do Seroquel/Seroquel XR e nomes
Anexo II Conclusões científicas e fundamentos para a alteração dos termos da Autorização de Introdução no Mercado 37 Conclusões científicas Resumo da avaliação científica do Seroquel/Seroquel XR e nomes
Resumo da avaliação científica de medicamentos contendo somatropina (ver Anexo I)
 Anexo II Conclusões científicas e fundamentos para a alteração dos Resumos das Características do Medicamento e Folhetos Informativos apresentados pela EMA 58 Conclusões científicas Resumo da avaliação
Anexo II Conclusões científicas e fundamentos para a alteração dos Resumos das Características do Medicamento e Folhetos Informativos apresentados pela EMA 58 Conclusões científicas Resumo da avaliação
Segurança. Salbutamol
 Anexo II Conclusões científicas e fundamentos para a revogação ou alteração, conforme aplicável, dos termos das autorizações de introdução no mercado e explicação detalhada das diferenças relativamente
Anexo II Conclusões científicas e fundamentos para a revogação ou alteração, conforme aplicável, dos termos das autorizações de introdução no mercado e explicação detalhada das diferenças relativamente
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A NÃO RENOVAÇÃO DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
 ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A NÃO RENOVAÇÃO DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO 5 Conclusões científicas Resumo da avaliação científica do Ethirfin e nomes associados (ver Anexo
ANEXO II CONCLUSÕES CIENTÍFICAS E FUNDAMENTOS PARA A NÃO RENOVAÇÃO DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO 5 Conclusões científicas Resumo da avaliação científica do Ethirfin e nomes associados (ver Anexo
Requerente Nome (de fantasia) Dosagem Forma Farmacêutica. Simvastatin Vale 20 mg/5 ml Suspension zum Einnehmen
 Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de do(s) medicamento(s), titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Áustria 20 mg/5
Anexo I Lista das denominações, forma(s) farmacêutica(s), dosagem(ns), via(s) de do(s) medicamento(s), titular(es) da(s) autorização(ões) de introdução no mercado nos estados-membros 1 Áustria 20 mg/5
Anexo II. Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado
 Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 17 Conclusões científicas Resumo da avaliação científica Antecedentes De 2008 a maio
Anexo II Conclusões científicas e fundamentos para a alteração dos termos das Autorizações de Introdução no Mercado 17 Conclusões científicas Resumo da avaliação científica Antecedentes De 2008 a maio
