CALORIMETRIA. 1 cal = 4,2 J.
|
|
|
- Giovanni Amorim Barreiro
- 9 Há anos
- Visualizações:
Transcrição
1 CALORIMETRIA Setor 1210 Prof. Calil A CALORIMETRIA estuda energia denominada CALOR que vai, de maneira natural, do corpo quente para o corpo frio. Calor não deve ser Calor sensivel confundido com a energia térmica, que está associada ao estado de vibração das partículas do corpo, e definido a sua temperatura. O CALOR Calor latente recebido ou cedido pelo corpo ou muda sua temperatura, ou muda o seu estado físico. Quando o calor modifica a temperatura do corpo, ele é denominado CALOR SENSÍVEL. Quando ele não modifica a temperatura do corpo, mas muda seu estado físico, é chamado de CALOR LATENTE. A quantidade de calor é representada pela letra Q, sendo medido em Joules (J) no SI, ou em calorias (cal) na prática. Uma caloria corresponde aproximadamente a 4,18 ou 4,2 joules: 1 cal = 4,2 J. CALOR SENSÍVEL Calor Sensível é a energia recebida ou cedida pelo corpo que produz a variação da temperatura do corpo. Quando o corpo recebe calor, a quantidade recebida é positiva (Q +), e a temperatura do corpo aumenta, aumentando a vibração das suas partículas. Quando o corpo cede calor, a quantidade cedida é negativa (Q ) e a temperatura do corpo diminui, reduzindo a vibração das suas partículas. A quantidade de calor recebida ou cedida é calculada com base numa constante associada a cada substância, denominada calor específico = c e assim definida: Calor específico = c é a quantidade de calor necessária para que a unidade de massa da substância varie em um grau a sua temperatura. Exemplificando: Se o calor específico da água é igual a 1 cal/ g. 0 C, então cada um grama de água para variar sua temperatura em um grau Celsius, necessita receber ou ceder uma caloria de calor. Com essa informação e aplicando uma simples regra de três,podemos calcular a quantidade necessária de calor para variar em um certo número de graus a temperatura de uma massa m de água. Por exemplo, seja 50g de água (m = 50g) a temperatura θ i = 10 o C. Para elevar a temperatura dessa massa de água até a temperatura final θ f = 30 o C, teremos que fornecer a ela uma quantidade de calor igual a: Δθ = θ f θ i = = 20 0 C 1g de H 2 O para variar 1 0 C necessita receber 1 cal 50g de H 2 O para variar 1 o C necessitam receber 50 x 1 cal = 50 cal. 50g de H 2 O para variar 20 o C necessitam receber 50 x 20 cal = 1.000cal Portanto, para 50g de água aumentar sua temperatura em 20 0 C, necessitam receber uma quantidade de calor Q = cal. Podemos resolver o problema pela aplicação da Equação do Calor Específico, que pode ser assim deduzida: Se 1g da substância para variar 1 0 C precisa receber ou ceder c cal, Então m g da substância para variar 1 0 C precisam receber ou ceder m.c cal Mas m g da substância para variar Δθ 0 C precisam receber ou ceder: Q = m.c.δθ cal. Portanto: Q = m.c.δθ
2 Quando estudamos um corpo composto de várias substâncias, associamos a ele uma grandeza denominada Capacidade Térmica = C T que vem a ser a quantidade de calor necessária para variar um grau a temperatura total do corpo. Se, por exemplo, a Capacidade Térmica do corpo é 500 cal/ o C, entendemos que quando o corpo recebe ou cede 500 cal, sua temperatura aumenta ou diminui 1 o C. Baseado na definição, quando queremos reduzir 10 0 C a temperatura do corpo, precisamos retirar cal deste corpo. Matematicamente, a Capacidade Térmica pode ser dada por: C Unidade: cal/ 0 T = Q/Δθ C ou J/K Lembrando que Q = m.c.δθ, vem: C T = (m.c.δθ) Δθ C T = m.c A Capacidade térmica do corpo pode ser considerada como sendo o produto da massa do corpo pelo calor específico médio de todas as substâncias que constituem o corpo. OBSERVAÇÃO FINAL: Sendo o calor específico da água 1 cal/g. 0 C, a capacidade térmica de uma massa m de água será: C água = m.c = m.1 e C água = m. Define-se entã como EQUIVALENTE EM ÁGUA de um corpo a massa de água igual a capacidade térmica do corpo. Exemplo: se a capacidade térmica de um corpo é 500 cal/g seu equivalente em água será 500g, pois 500g de água terão amesma capacidade térmica do corpo. CALOR LATENTE É o calor, fornecido ou retirado do corpo, que não muda sua temperatura. A finalidade desta energia é produzir a mudança no estado físico do corpo. Estudamos apenas os corpos com estrutura cristalina, que passam diretamente do estado sólido para o estado líquido, e do estado líquido para o estado gasoso, sem nenhum estado intermediário. São exemplos de substâncias cristalinas: ferro, alumínio, água. Basicamente temos as seguintes mudanças de estado: FUSÃO VAPORIZAÇÃO SÓLIDO LÍQUIDO VAPOR SOLIDIFICAÇÃO CONDENSAÇÃO SUBLIMAÇÃO A Fusão e a Vaporização acontecem com o fornecimento de Calor ao corpo (Q+). A Solidificação e a Condensação acontecem com a retirada de Calor ( Q). A Sublimação é a passagem direta do estado sólido para o gasoso, e vice-versa, como acontece por exemplo, com o gelo seco e a naftalina. LEIS DAS MUDANÇAS DE ESTADO 1ª) Enquanto ocorre a mudança de estado a temperatura permanece constante. Por exemplo: enquanto o gelo está derretendo, existe uma mistura de água líquida mais gelo à temperatura constante de 0 o C, que só irá mudar quando o último pedaço de gelo acabar de derreter totalmente. 2ª) Cada substância muda de temperatura a uma temperatura bem determinada, denominada: Temperatura de Fusão (T F ), Temperatura de Vaporização (T V ), Temperatura de Solidificação (T S ), Temperatura de Condensação (T C ), Temperatura de Sublimação (T SU ). 3ª) Para uma mesma substância temos: T F = T S e T V = T C 4ª) A unidade de massa de cada substância necessita de uma quantidade bem determinada de calor para mudar completamente de estado. Esta quantidade é denominada: Calor Latente de Fusão (L F ), Calor latente de Solidificação (L S ), Calor latente de Vaporização (L V ), Calor latente de Condensação (L C ), Calor Latente de Sublimação (L SU ).
3 5ª) Para uma mesma substância temos: ІL F І = ІL S І e ІL V І = ІL C І. Assim, por exemplo, se para congelar 1 grama de água é necessário retirar 80 calorias, para derreter 1 grama de gelo é preciso fornecer 80 calorias. L F e L V são positivos, pois o corpo recebe calor para a mudança de estado. L S e L C são negativos, pois correspondem ao calor retirado do corpo. 6ª) Baseado na definição de Calor Latente da Mudança de Estado, com uma regra de três podemos determinar a quantidade de calor necessária para mudar totalmente de estado uma certa massa m. Se para mudar o estado da unidade massa é necessário fornecer uma quantidade de calor igual a L, então para mudar o estado de m g da substância será necessário a quantidade de calor Q = m.l. Então a equação que fornece a quantidade de Calor Latente é: Q = m.l GRÁFICO DA QUANTIDADE DE CALOR EM FUNÇÃO DA TEMPERATURA θ θ V Vaporização 0 A B C D E Q Θ F Fusão Θ i De A até B, o corpo está no estado sólido, e a sua temperatura está aumentando. O calor é calor sensível. De B até C, a temperatura não muda, indicando que está ocorrendo a mudança de estado. No gráfico, a reta entre B e C denomina-se Patamar de Temperatura, e o calor é o calor latente. De C até D, o corpo está no estado líquido, e a sua temperatura aumenta. O calor é o calor sensível. De D a E, o corpo está mudando de estado e a temperatura não muda. O calor é o calor latente. De E em diante, o corpo que está no estado de vapor,e está aumentando a sua temperatura. O calor é o calor sensível. TROCAS DE CALOR Corpos que estão a temperaturas diferentes, quando postos em contato trocam calor entre si, até que todos atinjam a mesma temperatura, denominada temperatura de equilíbrio. Num laboratório, a troca de calor entre corpos é estudada num aparelho denominado Calorimetro, que pode ser considerado um sistema termicamente isolado, ou seja, um sistema que não permite a troca de calor entre os corpos que estão no seu interior com o meio externo, e impede que o calor externo entre no sistema. O corpo a ser estudado é colocado no interior do calorímetro, e entra em equilíbrio térmico com uma massa m de água contida nele. O termômetro indica a temperatura inicial e final, que é a do equilíbrio térmico. Conhecendo-se a massa da água, a massa do corpo, o calor específico da água, e a temperatura inicial e do equilíbrio térmico, é possível se determinar o calor específico do corpo. Se o Calorimetro participar das trocas de calor, considera-se a sua Capacidade Térmica ( C T =m calorimetro xc calorimetro ).
4 Como a energia não é criada nem destruída, nas trocas de calor a quantidade de calor cedida por um corpo A (- Q A ) é igual à quantidade de calor recebida pelo outro corpo B (+ Q B ). Então, Q A + Q B = 0. Esta a lei que comanda as trocas de calor entre os corpos que estão num sistema termicamente isolado: ΣQ trocados = zero Q A + Q B + Q C Q N = 0 UNIDADES UTILIZADAS Grandeza Sistema Usual(SU) Sistema Oficial(SI) Conversão: SU para SI Massa Grama (g) Quilograma(kg) 1 g = 10 3 kg Calor específico Caloria/g. o C Joule/kg.K 1 cal/g. o C ~ 4, /kg.k Θ e θ o Celsius kelvin 1 o C = 1 K Calor Caloria Joule 1 cal ~ 4,2 J Capacidade térmica Caloria/ o C Joule / K 1 cal/ o C ~ 4,2 J/K Volume Litro (L) m 3 1 m 3 = 10 3 L = massa 10 3 kg de H 2 O 1- FEI: Um calorimetro contém 200mL de água e o conjunto está a temperatura de 20 0 C. Ao juntar ao calorímetro 125g de uma liga a 130 o C, verificamos que após o equilíbrio térmico, a temperatura final é de 30 o C. Qual é a capacidade térmica do calorímetro? Dados: densidade da água = 10 3 kg/m 3 ; calor específico da água = 1 cal/g. o C; calor específico da liga = 0,20 cal/g. o C. Organizando os dados, e sendo m água = dxv = 10 3 x = kg = 200g Água Liga Calorímetro m = 200g m = 125g C T = m cal.c cal Θ i = 20 o C Θ i = 130 o C Θ I = 20 o C Θ F =30 o C Θ F = 30 o C Θ F = 30 o C C agua = 1 cal/g. o C C liga = 0,2 cal/g. o C Temos: Q água + Q Liga + Q Calorimetro = 0 m água.c água. (θ F θ I ) + m Liga.c Liga (θ F θ I ) + m cal.c cal (θ F θ I )= (30 20) ,2.(30 130) + C T cal.(30 20) = (- 2500) + 10 C T = C T = 0 C T = 50cal/ o C 2- (UEL-PR)Em um recipiente de paredes adiabáticas e capacidade térmica desprezível, introduzem-se 200g de água a 20 o C e 80g de gelo a 20 o C. Atingindo o equilíbrio, a temperatura do sistema será: Dados: calor especícfico da água = 1 cal/g. o C; calor específico do gelo = 0,5 cal/g. o C; Calor latente de fusão do gelo = 80 cal/g a) 11 o C; b) 0 o C, restando 40g de gelo; c) 0 o C, restando apenas água; d) 0 o C, restando apenas gelo; e) 11 o C Sempre que o exercício envolve gelo e água, com mudança de estado, verificamos antes se a água pode fornecer o calor necessário para derreter todo o gelo. Então vamos primeiro calcular a quantidade total de calor que o gelo necessita receber para elevar sua temperatura de 20 o c até 0 o C, quando começa a derreter. Depois quanto a água pode fornecer de calor ao gelo, esfriando de 20 o C até também a 0 o C: Gelo: Q para elevar a temperatura de 20 o C até 0 o C: Q g = m g.c g (θ f θ i ) = 80.0,5[0 ( - 20)] e Q g = 800cal. Água: a água pode fornecer: Q a =m a.c a (θ f θ i ) = (0 20), e Q a = 4000 cal. Então a água tem calor suficiente para fornecer ao gelo, de tal forma que este use 800cal para elevar sua temperatura de 20 o C até 0 o C, e ainda vão sobrar 3200cal para derreter o gelo. Fazendo uma regra de três com o calor latente de fusão do gelo: 80 cal derretem 1g de gelo 80. X = 3200, e 3200 cal derretem Xg de gelo X = 40g de gelo que foram derretidas. Assim, teremos no final água e gelo a 0 o C e um resto de 40g de gelo sólido que não foi derretido Resposta B
5 3- (Fuvest)-Uma pessoa bebe 500g de água a 10 o C. Admitindo que temperatura dessa pessoa é de 36,6 o C, responda: a) Qual a energia que essa pessoa transfere para a água? b) Caso a energia absorvida pela água fosse totalmente utilizada para acender a ma lâmpada de 100W, durante quanto tempo esta lâmpada permaneceria acessa? Dados: calor específico da água = 1 cal/g. o C e 1 cal = 4 J a) Q = m agua.c água (θ f θ i ) = (36,6 10 ) Q = cal b) Se 1 cal é igual a 4J, então cal serão: 4 x = J. Se a potência da lâmpada é de 100W, isso significa que em cada 1s em que fica ligada, ela consome 100J de energia. Daí, se em 1s a lâmpada consome 100J, dispondo-se de J ela vai ficar acessa 532s.
AULA 13 CALORIMETRIA. 1- Introdução
 AULA 13 CALORIMETRIA 1- Introdução Neste capítulo estudaremos o calor e suas aplicações. Veremos que o calor pode simplesmente alterar a temperatura de um corpo, ou até mesmo mudar o seu estado físico.
AULA 13 CALORIMETRIA 1- Introdução Neste capítulo estudaremos o calor e suas aplicações. Veremos que o calor pode simplesmente alterar a temperatura de um corpo, ou até mesmo mudar o seu estado físico.
CALORIMETRIA (CONTINUAÇÃO)
 CALORIMETRIA (CONTINUAÇÃO) Calor latente Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos corpos. Em alguns casos há mudança de estado físico destes corpos. Neste
CALORIMETRIA (CONTINUAÇÃO) Calor latente Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos corpos. Em alguns casos há mudança de estado físico destes corpos. Neste
1 Conceito de calorimetria. 2 Introdução. 3 Definição de caloria. 4 Calor específico. 5 Calorímetro (interativo) 6 Tabela de calores específicos
 1 Conceito de calorimetria 2 Introdução 3 Definição de caloria 4 Calor específico 5 Calorímetro (interativo) 6 Tabela de calores específicos 7 Capacidade térmica 8 Trocas de calor 9 Calor latente 10 Curva
1 Conceito de calorimetria 2 Introdução 3 Definição de caloria 4 Calor específico 5 Calorímetro (interativo) 6 Tabela de calores específicos 7 Capacidade térmica 8 Trocas de calor 9 Calor latente 10 Curva
A definição de calor é usada apenas para indicar a energia que está sendo transferida, e não a energia que o corpo possui.
 A calorimetria é a ciência que estuda o calor. Calor é uma forma de energia em trânsito, ou seja, é a energia transferida de um corpo com maior temperatura para um corpo de menor temperatura. Em um sistema
A calorimetria é a ciência que estuda o calor. Calor é uma forma de energia em trânsito, ou seja, é a energia transferida de um corpo com maior temperatura para um corpo de menor temperatura. Em um sistema
1 Conceito de calorimetria 12 Mudança de fase. 2 Introdução 13 Leis gerais das mudanças de fase. 3 Definição de caloria 14 Mudança de fase da água
 1 Conceito de calorimetria 12 Mudança de fase 2 Introdução 13 Leis gerais das mudanças de fase 3 Definição de caloria 14 Mudança de fase da água 4 Calor específico 15 Resumo das equações e unidades 5 Calorímetro
1 Conceito de calorimetria 12 Mudança de fase 2 Introdução 13 Leis gerais das mudanças de fase 3 Definição de caloria 14 Mudança de fase da água 4 Calor específico 15 Resumo das equações e unidades 5 Calorímetro
1 Conceito de calorimetria 12 Mudança de fase. 2 Introdução 13 Leis gerais das mudanças de fase. 3 Definição de caloria 14 Mudança de fase da água
 1 Conceito de calorimetria 12 Mudança de fase 2 Introdução 13 Leis gerais das mudanças de fase 3 Definição de caloria 14 Mudança de fase da água 4 Calor específico 15 Resumo das equações e unidades 5 Calorímetro
1 Conceito de calorimetria 12 Mudança de fase 2 Introdução 13 Leis gerais das mudanças de fase 3 Definição de caloria 14 Mudança de fase da água 4 Calor específico 15 Resumo das equações e unidades 5 Calorímetro
Aulas Multimídias Santa Cecília Profº Rafael Rodrigues Disciplina: Física Série: 1º Ano EM
 Aulas Multimídias Santa Cecília Profº Rafael Rodrigues Disciplina: Física Série: 1º Ano EM CALORIMETRIA TEMPERATURA Todo corpo que esteja a uma temperatura acima do zero absoluto é constituído de partículas
Aulas Multimídias Santa Cecília Profº Rafael Rodrigues Disciplina: Física Série: 1º Ano EM CALORIMETRIA TEMPERATURA Todo corpo que esteja a uma temperatura acima do zero absoluto é constituído de partículas
Lista de Exercícios - CALORIMETRIA, MUDANÇA DE FASE E TROCA DE CALOR
 9º EF EXERCÍCIOS Lista de Exercícios - CALORIMETRIA, MUDANÇA DE FASE E TROCA DE CALOR 1 Quantas calorias são necessárias para vaporizar 1,00 litro de água, se a sua temperatura é, inicialmente, igual a
9º EF EXERCÍCIOS Lista de Exercícios - CALORIMETRIA, MUDANÇA DE FASE E TROCA DE CALOR 1 Quantas calorias são necessárias para vaporizar 1,00 litro de água, se a sua temperatura é, inicialmente, igual a
Dados: - calor latente de vaporização da água: 540cal/g - calor específico da água: 10cal/g C
 1. (Fuvest 92) Adote: calor específico da água = 1 cal/g. C Um recipiente contendo 3600g de água à temperatura inicial de 80 C é posto num local onde a temperatura ambiente permanece sempre igual a 20
1. (Fuvest 92) Adote: calor específico da água = 1 cal/g. C Um recipiente contendo 3600g de água à temperatura inicial de 80 C é posto num local onde a temperatura ambiente permanece sempre igual a 20
O que você deve saber sobre
 O que você deve saber sobre Quando um corpo recebe calor, dois efeitos distintos podem ocorrer: se receber calor sensível, sua temperatura aumenta e o corpo não sofre mudança de fase; se receber calor
O que você deve saber sobre Quando um corpo recebe calor, dois efeitos distintos podem ocorrer: se receber calor sensível, sua temperatura aumenta e o corpo não sofre mudança de fase; se receber calor
TERMODINÂMICA. Prof. Otávio Castellani
 TERMODINÂMICA Prof. Otávio Castellani TERMODINÂMICA Termo + Dinâmica Calor movimento Ramo da Física F que estuda os fenômenos relacionados ao aquecimento e resfriamento dos corpos. TEMPERATURA Grandeza
TERMODINÂMICA Prof. Otávio Castellani TERMODINÂMICA Termo + Dinâmica Calor movimento Ramo da Física F que estuda os fenômenos relacionados ao aquecimento e resfriamento dos corpos. TEMPERATURA Grandeza
Calor e Temperatura, Trocas de Calor Bibliografia e figuras desta aula: Fundamentos da Física, Halliday, Resnick e Walker, 8a Ed., vol 2 pág
 Calor e Temperatura, Trocas de Calor Bibliografia e figuras desta aula: Fundamentos da Física, Halliday, Resnick e Walker, 8a Ed., vol 2 pág2 188-190 Até agora aprendemos: O conceito de temperatura A lei
Calor e Temperatura, Trocas de Calor Bibliografia e figuras desta aula: Fundamentos da Física, Halliday, Resnick e Walker, 8a Ed., vol 2 pág2 188-190 Até agora aprendemos: O conceito de temperatura A lei
FÍSICA QUANTIDADE DE CALOR CALORIMETRIA. Prof. Rangel M. Nunes
 1 FÍSICA QUANTIDADE DE CALOR CALORIMETRIA 2 CONTEÚDOS: Quantidade de calor; Unidades de calor; Calor específico; Calor sensível e calor latente; Mudanças de estado físico; 3 Conceito de Calor Vimos que
1 FÍSICA QUANTIDADE DE CALOR CALORIMETRIA 2 CONTEÚDOS: Quantidade de calor; Unidades de calor; Calor específico; Calor sensível e calor latente; Mudanças de estado físico; 3 Conceito de Calor Vimos que
Podemos definir como quente um corpo que tem suas moléculas agitando-se muito, ou seja, com alta energia cinética. Analogamente, um corpo frio, é
 Podemos definir como quente um corpo que tem suas moléculas agitando-se muito, ou seja, com alta energia cinética. Analogamente, um corpo frio, é aquele que tem baixa agitação das suas moléculas. Tem
Podemos definir como quente um corpo que tem suas moléculas agitando-se muito, ou seja, com alta energia cinética. Analogamente, um corpo frio, é aquele que tem baixa agitação das suas moléculas. Tem
Propagação do Calor e Calorimetria
 Condução Térmica Física 3 - Capítulo 3 Propagação do Calor e Calorimetria Propagação de calor em que a energia térmica passa de partícula para partícula, sem transporte de matéria. Ocorre nos materiais
Condução Térmica Física 3 - Capítulo 3 Propagação do Calor e Calorimetria Propagação de calor em que a energia térmica passa de partícula para partícula, sem transporte de matéria. Ocorre nos materiais
Calorimetria. Considere um pedaço de ferro quente colocado no interior de um recipiente contendo água fria.
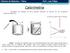 Calorimetria Considere um pedaço de ferro quente colocado no interior de um recipiente contendo água fria. a troca de calor não é infinita Calor é energia em trânsito que vai espontaneamente do corpo mais
Calorimetria Considere um pedaço de ferro quente colocado no interior de um recipiente contendo água fria. a troca de calor não é infinita Calor é energia em trânsito que vai espontaneamente do corpo mais
CALORIMETRIA Calor. CALORIMETRIA Potência ou Fluxo de Calor
 CALORIMETRIA Calor É a transferência de energia de um corpo para outro, decorrente da diferença de temperatura entre eles. quente frio Unidades de calor 1 cal = 4,186 J (no SI) 1 kcal = 1000 cal Fluxo
CALORIMETRIA Calor É a transferência de energia de um corpo para outro, decorrente da diferença de temperatura entre eles. quente frio Unidades de calor 1 cal = 4,186 J (no SI) 1 kcal = 1000 cal Fluxo
Lista de Revisão para o Recuperação de Física 2º TRI
 9ºANO EF Lista de Revisão para o Recuperação de Física 2º TRI 1- Defina os conceitos de: a) Calor: b) Temperatura. c) Equilíbrio térmico. 2. (UFU-MG 89) São misturados 50 g de água a 20 o C com 20 g de
9ºANO EF Lista de Revisão para o Recuperação de Física 2º TRI 1- Defina os conceitos de: a) Calor: b) Temperatura. c) Equilíbrio térmico. 2. (UFU-MG 89) São misturados 50 g de água a 20 o C com 20 g de
Sala de Estudos FÍSICA - Lucas 1 trimestre Ensino Médio 2º ano classe: Prof.LUCAS Nome: nº
 Sala de Estudos FÍSICA - Lucas 1 trimestre Ensino Médio 2º ano classe: Prof.LUCAS Nome: nº CALORIMETRIA: Calor Sensível 1. (Uel 2012) O homem utiliza o fogo para moldar os mais diversos utensílios. Por
Sala de Estudos FÍSICA - Lucas 1 trimestre Ensino Médio 2º ano classe: Prof.LUCAS Nome: nº CALORIMETRIA: Calor Sensível 1. (Uel 2012) O homem utiliza o fogo para moldar os mais diversos utensílios. Por
Unidade I. Aula 4.2 Conteúdo. Termologia, Vida e Ambiente. Calorimetria: Princípio das trocas de calor envolvendo mudança de fase e diagrama de fases.
 CONTEÚDO E HABILIDADES Unidade I Termologia, Vida e Ambiente Aula 4.2 Conteúdo Calorimetria: Princípio das trocas de calor envolvendo mudança de fase e diagrama de fases. 2 CONTEÚDO E HABILIDADES Habilidades:
CONTEÚDO E HABILIDADES Unidade I Termologia, Vida e Ambiente Aula 4.2 Conteúdo Calorimetria: Princípio das trocas de calor envolvendo mudança de fase e diagrama de fases. 2 CONTEÚDO E HABILIDADES Habilidades:
Resoluções dos exercícios propostos
 1 P.83 Dados: m 1 g (gelo a θ 2 C); θ 6 C; θ fusão C; c gelo,5 cal/g C; L F 8 cal/g; c água 1 cal/g C 1 a etapa Aquecimento do gelo de 2 C até C ( θ 2 C): Q 1 m c gelo θ Q 1 1,5 2 Q 1 1. cal 1 1 3 cal
1 P.83 Dados: m 1 g (gelo a θ 2 C); θ 6 C; θ fusão C; c gelo,5 cal/g C; L F 8 cal/g; c água 1 cal/g C 1 a etapa Aquecimento do gelo de 2 C até C ( θ 2 C): Q 1 m c gelo θ Q 1 1,5 2 Q 1 1. cal 1 1 3 cal
Capitulo-4 Calor e Temperatura
 Capitulo-4 Calor e Temperatura www.plantaofisica.blogspot.com.br 1 Resumo de aula: Termometria. 1- Temperatura Termometria é a parte da física que se preocupa unicamente em formas de se medir a temperatura
Capitulo-4 Calor e Temperatura www.plantaofisica.blogspot.com.br 1 Resumo de aula: Termometria. 1- Temperatura Termometria é a parte da física que se preocupa unicamente em formas de se medir a temperatura
Lista 6 Exercícios de Calorimetria
 Lista 6 Exercícios de Calorimetria 1 (FMU) A temperatura durante a mudança de estado, para uma dada substância, a) é sempre maior que zero b) é sempre menor que zero c) varia conforme o estado de agregação
Lista 6 Exercícios de Calorimetria 1 (FMU) A temperatura durante a mudança de estado, para uma dada substância, a) é sempre maior que zero b) é sempre menor que zero c) varia conforme o estado de agregação
CALORIMETRIA. 1) Um bloco de zinco de capacidade igual a 20 Cal/ o C recebe 100 Cal. Calcule a variação de temperatura do bloco.
 CALORIMETRIA 1) Um bloco de zinco de capacidade igual a 20 Cal/ o C recebe 100 Cal. Calcule a variação de temperatura do bloco. R: 5ºC 2) Uma esfera de ferro tem capacidade térmica de 40 Cal/ o C. Ao receber
CALORIMETRIA 1) Um bloco de zinco de capacidade igual a 20 Cal/ o C recebe 100 Cal. Calcule a variação de temperatura do bloco. R: 5ºC 2) Uma esfera de ferro tem capacidade térmica de 40 Cal/ o C. Ao receber
Resoluções dos exercícios propostos
 1 P.109 p a) AB corresponde a uma fusão (passagem da Sólido F fase sólida para a fase líquida). A B Líquido G b) B corresponde a uma vaporização E (passagem da fase líquida para a fase de D Vapor vapor).
1 P.109 p a) AB corresponde a uma fusão (passagem da Sólido F fase sólida para a fase líquida). A B Líquido G b) B corresponde a uma vaporização E (passagem da fase líquida para a fase de D Vapor vapor).
III. Pode-se afirmar que é(são) correta(s) apenas: a) I. b) I e II. c) I e III. d) II e III. e) Todas estão corretas.
 PROVA DE FÍSIA 2º ANO - 3ª MENSAL - 1º TRIMESTRE TIPO A 01) onsidere seus conhecimentos sobre mudanças de fase e analise as afirmações I, II e III, referentes à substância água, um recurso natural de alto
PROVA DE FÍSIA 2º ANO - 3ª MENSAL - 1º TRIMESTRE TIPO A 01) onsidere seus conhecimentos sobre mudanças de fase e analise as afirmações I, II e III, referentes à substância água, um recurso natural de alto
2. Considere um bloco de gelo de massa 300g á temperatura de 20 C, sob pressão normal. Sendo L F
 1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
TERMOLOGIA. Calorimetria:
 TERMOLOGIA Calorimetria: Calor: é energia térmica em trânsito. Ela ocorre sempre entre dois corpos com temperaturas diferentes. O corpo com temperatura maior sede espontaneamente calor para o corpo que
TERMOLOGIA Calorimetria: Calor: é energia térmica em trânsito. Ela ocorre sempre entre dois corpos com temperaturas diferentes. O corpo com temperatura maior sede espontaneamente calor para o corpo que
CALORIMETRIA E TERMOLOGIA
 CALORIMETRIA E TERMOLOGIA CALORIMETRIA Calor É a transferência de energia de um corpo para outro, decorrente da diferença de temperatura entre eles. quente Fluxo de calor frio BTU = British Thermal Unit
CALORIMETRIA E TERMOLOGIA CALORIMETRIA Calor É a transferência de energia de um corpo para outro, decorrente da diferença de temperatura entre eles. quente Fluxo de calor frio BTU = British Thermal Unit
Termodinâmica. Lucy V. C. Assali
 Termodinâmica Calor Física II 2016 - IO Calor Final do século XVIII: duas hipóteses alternativas 1) Fluido indestrutível (calórico) que preencheria os poros dos corpos, escoando-se de um corpo mais quente
Termodinâmica Calor Física II 2016 - IO Calor Final do século XVIII: duas hipóteses alternativas 1) Fluido indestrutível (calórico) que preencheria os poros dos corpos, escoando-se de um corpo mais quente
Sua prova deve ser feita à caneta azul ou preta. Não rasure e não use corretivo. Entregue no dia da prova.
 Aluno(a): nº: Turma: Nota Ano: 2º Ano E.M. Data: /08/2019 Série Professor(a): Everton Trabalho Recuperação Matéria: Física Valor: 5,0 Sua prova deve ser feita à caneta azul ou preta. Não rasure e não use
Aluno(a): nº: Turma: Nota Ano: 2º Ano E.M. Data: /08/2019 Série Professor(a): Everton Trabalho Recuperação Matéria: Física Valor: 5,0 Sua prova deve ser feita à caneta azul ou preta. Não rasure e não use
TERMOLOGIA. Calorimetria:
 TERMOLOGIA Calorimetria: Calor: é energia térmica em trânsito. Ela ocorre sempre entre dois corpos com temperaturas diferentes. O corpo com temperatura maior sede espontaneamente calor para o corpo que
TERMOLOGIA Calorimetria: Calor: é energia térmica em trânsito. Ela ocorre sempre entre dois corpos com temperaturas diferentes. O corpo com temperatura maior sede espontaneamente calor para o corpo que
TEMPERATURA. Os constituintes da matéria (moléculas, átomos etc.) movem-se continuamente em um movimento de agitação.
 TEMPERATURA Os constituintes da matéria (moléculas, átomos etc.) movem-se continuamente em um movimento de agitação. É possível associar a existência de uma energia à energia cinética média desses constituintes
TEMPERATURA Os constituintes da matéria (moléculas, átomos etc.) movem-se continuamente em um movimento de agitação. É possível associar a existência de uma energia à energia cinética média desses constituintes
Prática 5 - Calorimetria. Definição: 1 caloria é a quantidade de calor necessária para elevar de para um grama de água.
 Prática 5 - Calorimetria Até o final do século XVIII haviam duas correntes dominantes: os que acreditavam que o calor que se transferia de um corpo mais quente para outro mais frio se fazia através de
Prática 5 - Calorimetria Até o final do século XVIII haviam duas correntes dominantes: os que acreditavam que o calor que se transferia de um corpo mais quente para outro mais frio se fazia através de
FÍSICA TÉRMICA TEMPERATURA, DILATAÇÃO TÉRMICA, CALORIMETRIA E TRANSMISSÃO DE CALOR
 FÍSICA TÉRMICA TEMPERATURA, DILATAÇÃO TÉRMICA, CALORIMETRIA E TRANSMISSÃO DE CALOR TEMPERATURA Grandeza Fundamental do S.I. Medida aproximada de agitação média de moléculas Unidade Principal: (Kelvin)
FÍSICA TÉRMICA TEMPERATURA, DILATAÇÃO TÉRMICA, CALORIMETRIA E TRANSMISSÃO DE CALOR TEMPERATURA Grandeza Fundamental do S.I. Medida aproximada de agitação média de moléculas Unidade Principal: (Kelvin)
C m Q C T T 1 > T 2 T 1 T 2. 1 cal = 4,184 J (14,5 o C p/ 15,5 o C) 1 Btu = 252 cal = 1,054 kj
 A teoria do calórico (~1779) Para atingir o estado de equilíbrio térmico, T 1 T 2 T 1 > T 2 -Substância fluida - invisível - peso desprezível T a quantidade de calórico Esta teoria explicava um grande
A teoria do calórico (~1779) Para atingir o estado de equilíbrio térmico, T 1 T 2 T 1 > T 2 -Substância fluida - invisível - peso desprezível T a quantidade de calórico Esta teoria explicava um grande
MUDANÇAS DE ESTADO FÍSICO
 MUDANÇAS DE ESTADO FÍSICO MUDANÇAS DE ESTADO FÍSICO As mudanças de estado físico não ocorrem em qualquer temperatura, mas sim em temperaturas específicas de cada substância. E sempre é valida a seguinte
MUDANÇAS DE ESTADO FÍSICO MUDANÇAS DE ESTADO FÍSICO As mudanças de estado físico não ocorrem em qualquer temperatura, mas sim em temperaturas específicas de cada substância. E sempre é valida a seguinte
Colégio FAAT Ensino Fundamental e Médio
 Colégio FAAT Ensino Fundamental e Médio Lista de Exercícios 2_3 BIMESTRE Nome: Nº Turma: 9 EF Profa Kelly Data: Conteúdo: Calorimetria. 1 Um bloco de 600 g de prata, inicialmente a 20 C, é aquecido até
Colégio FAAT Ensino Fundamental e Médio Lista de Exercícios 2_3 BIMESTRE Nome: Nº Turma: 9 EF Profa Kelly Data: Conteúdo: Calorimetria. 1 Um bloco de 600 g de prata, inicialmente a 20 C, é aquecido até
A) condensação do vapor de água dissolvido no ar ao encontrar uma superfície à temperatura mais baixa.
 lista_1-conceitos_iniciais_em_termologia Questão 1 Os cálculos dos pesquisadores sugerem que a temperatura média dessa estrela é de T i = 2.700 C. Considere uma estrela como um corpo homogêneo de massa
lista_1-conceitos_iniciais_em_termologia Questão 1 Os cálculos dos pesquisadores sugerem que a temperatura média dessa estrela é de T i = 2.700 C. Considere uma estrela como um corpo homogêneo de massa
1g / cm. 1g / cm. 80cal/ g
 1. (Unifesp 2015) Em um copo, de capacidade térmica 60cal / C e a 20 C, foram colocados 300mL de suco de laranja, também a 20 C, e, em seguida, dois cubos de gelo com 20 g cada um, a 0 C. Considere os
1. (Unifesp 2015) Em um copo, de capacidade térmica 60cal / C e a 20 C, foram colocados 300mL de suco de laranja, também a 20 C, e, em seguida, dois cubos de gelo com 20 g cada um, a 0 C. Considere os
Temperatura. Escalas de Temperatura. Aula 8 Termodinâmica por Luiz Otávio Limurci. Lei zero da termodinâmica. Conversão de Temperaturas
 Física Aula 8 Termodinâmica por Luiz Otávio Limurci Temperatura A primeira noção que se tem de temperatura é a sensação de frio ou quente, verificada ao tocar um corpo. Porém, isso não pode ser considerado
Física Aula 8 Termodinâmica por Luiz Otávio Limurci Temperatura A primeira noção que se tem de temperatura é a sensação de frio ou quente, verificada ao tocar um corpo. Porém, isso não pode ser considerado
REVISÃO. Professor: Jaison Mattei
 REVISÃO Professor: Jaison Mattei BRUNA, NICOLAS E EDUARDO Lucas Medina RESOLVE ESSA PARA O PRIMO!!! Arthur Motta Dilatação Profº JAISON As partículas que compõem um sólido vibram em torno de uma posição
REVISÃO Professor: Jaison Mattei BRUNA, NICOLAS E EDUARDO Lucas Medina RESOLVE ESSA PARA O PRIMO!!! Arthur Motta Dilatação Profº JAISON As partículas que compõem um sólido vibram em torno de uma posição
Observação Calor x Temperatura
 Prof. Jackson Alves Definição Parte da química que estuda a energia na forma de calor envolvido, seja nos processos químicos ou físicos. Observação Calor x Temperatura Instrumento de medição: Calorímetro
Prof. Jackson Alves Definição Parte da química que estuda a energia na forma de calor envolvido, seja nos processos químicos ou físicos. Observação Calor x Temperatura Instrumento de medição: Calorímetro
Temperatura, Calor e a Primeira Lei da Termodinâmica
 Temperatura, Calor e a Primeira Temperatura; A Lei Zero da Termodinâmica; Medindo a Temperatura; Escala Celsius e Fahrenheit; Dilatação Térmica; Temperatura e Calor; Absorção de Calor por Sólidos e Líquidos;
Temperatura, Calor e a Primeira Temperatura; A Lei Zero da Termodinâmica; Medindo a Temperatura; Escala Celsius e Fahrenheit; Dilatação Térmica; Temperatura e Calor; Absorção de Calor por Sólidos e Líquidos;
Calorimetria (Unesp 92) Considere as seguintes afirmações incompletas:
 1. (Fuvest 93) Um recipiente de vidro de 500 g e calor específico 0,20 cal/g C contém 500 g de água cujo calor específico é 1,0 cal/g C. O sistema encontra-se isolado e em equilíbrio térmico. Quando recebe
1. (Fuvest 93) Um recipiente de vidro de 500 g e calor específico 0,20 cal/g C contém 500 g de água cujo calor específico é 1,0 cal/g C. O sistema encontra-se isolado e em equilíbrio térmico. Quando recebe
Termologia. Calor: Energia em trânsito de um corpo para outro devido a diferença de temperaturas entre eles.
 Calor e Temperatura Termologia Estuda os fenômenos ligados a calor e temperatura Calor: Energia em trânsito de um corpo para outro devido a diferença de temperaturas entre eles. Temperatura: É uma grandeza
Calor e Temperatura Termologia Estuda os fenômenos ligados a calor e temperatura Calor: Energia em trânsito de um corpo para outro devido a diferença de temperaturas entre eles. Temperatura: É uma grandeza
CPOG. Prof. Felipe Cardoso. Escalas Termométricas Dilatação Calorimetria
 AULA DO CPOG Prof. Felipe Cardoso Escalas Termométricas Dilatação Calorimetria Escalas termométricas Em um gráfico Relações de variação Petrobras maio 2010 TO prova 35 Petrobras 2010 TO prova 40 Petrobras
AULA DO CPOG Prof. Felipe Cardoso Escalas Termométricas Dilatação Calorimetria Escalas termométricas Em um gráfico Relações de variação Petrobras maio 2010 TO prova 35 Petrobras 2010 TO prova 40 Petrobras
a) cal b) cal c) cal d) cal e) cal
 Lista de exercícios Calorimetria Etapa I 01- (UFAL 92) O calor de combustão de uma substância é a quantidade de calor que ela fornece por unidade de massa que sofre combustão total. Sabendo-se que o calor
Lista de exercícios Calorimetria Etapa I 01- (UFAL 92) O calor de combustão de uma substância é a quantidade de calor que ela fornece por unidade de massa que sofre combustão total. Sabendo-se que o calor
Sala de Estudos FÍSICA - Lucas 1 trimestre Ensino Médio 2º ano classe: Prof.LUCAS Nome: nº CALORIMETRIA:
 Sala de Estudos FÍSICA - Lucas 1 trimestre Ensino Médio 2º ano classe: Prof.LUCAS Nome: nº CALORIMETRIA: Calor Sensível 1. (Uel 2012) O homem utiliza o fogo para moldar os mais diversos utensílios. Por
Sala de Estudos FÍSICA - Lucas 1 trimestre Ensino Médio 2º ano classe: Prof.LUCAS Nome: nº CALORIMETRIA: Calor Sensível 1. (Uel 2012) O homem utiliza o fogo para moldar os mais diversos utensílios. Por
FÍSICA MÓDULO 16 CALOR E A SUA PROPAGAÇÃO. Professor Ricardo Fagundes
 FÍSICA Professor Ricardo Fagundes MÓDULO 16 CALOR E A SUA PROPAGAÇÃO CALOR E A SUA PROPAGAÇÃO Como discutimos em módulos anteriores, o calor é uma energia que se propaga de uma região com maior temperatura
FÍSICA Professor Ricardo Fagundes MÓDULO 16 CALOR E A SUA PROPAGAÇÃO CALOR E A SUA PROPAGAÇÃO Como discutimos em módulos anteriores, o calor é uma energia que se propaga de uma região com maior temperatura
QiD 1 1ª SÉRIE PARTE 3 FÍSICA
 QiD 1 1ª SÉRIE PARTE 3 FÍSICA 1. (1,0) Estime a ordem de grandeza do numero de passos que um atleta dá durante uma prova de maratona, sabendo que seu deslocamento é cerca de 42km e que um passo de um atleta
QiD 1 1ª SÉRIE PARTE 3 FÍSICA 1. (1,0) Estime a ordem de grandeza do numero de passos que um atleta dá durante uma prova de maratona, sabendo que seu deslocamento é cerca de 42km e que um passo de um atleta
Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física - Calorimetria Mudanças de fase. Pré Universitário Uni-Anhanguera
 Lista de Exercícios Pré Universitário Uni-Anhanguera Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física - Calorimetria Mudanças de fase 01 - (FPS PE) Uma barra de gelo com massa
Lista de Exercícios Pré Universitário Uni-Anhanguera Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física - Calorimetria Mudanças de fase 01 - (FPS PE) Uma barra de gelo com massa
11- Se você andar pela praia numa noite de verão, observará que a areis está mais fria do que a água do mar. Você pode explicar?
 1-(UFF-RJ) Três corpos, 1, 2 e 3, de mesma massa, mas de materiais diferentes estão inicialmente à mesma temperatura T o. Os corpos recebem a mesma quantidade de calor e atingem temperaturas finais T 1,
1-(UFF-RJ) Três corpos, 1, 2 e 3, de mesma massa, mas de materiais diferentes estão inicialmente à mesma temperatura T o. Os corpos recebem a mesma quantidade de calor e atingem temperaturas finais T 1,
Calorimetria - Quantidade de calor - Calor especifico - Capacidade térmica - Mudanças de fase da substância
 ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO PARA ATENDIMENTO DA PROGRESSÃO PARCIAL ESTUDOS INDEPENDENTES- 1º e 2º SEMESTRE RESOLUÇÃO SEE Nº 2.197, DE 26 DE OUTUBRO DE 2012 ANO
ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO PARA ATENDIMENTO DA PROGRESSÃO PARCIAL ESTUDOS INDEPENDENTES- 1º e 2º SEMESTRE RESOLUÇÃO SEE Nº 2.197, DE 26 DE OUTUBRO DE 2012 ANO
Termologia: Calorimetria
 Termologia: Calorimetria Física_9 EF Profa. Kelly Pascoalino Nesta aula: Temperatura x Calor; Processos de propagação de calor; Calor específico; Calor Latente e mudanças de estado. TEMPERATURA X CALOR
Termologia: Calorimetria Física_9 EF Profa. Kelly Pascoalino Nesta aula: Temperatura x Calor; Processos de propagação de calor; Calor específico; Calor Latente e mudanças de estado. TEMPERATURA X CALOR
Mas, o trabalho realizado é igual à diferença entre as quantidades de calor recebido pela fonte quente e cedido para a fonte fria:
 Resolução fase aula 1 Gabarito: Resposta da questão 1: 4J 1cal 4.000 J 1.000 cal Q P mcδθ 1.000 m 1 (60 0) 1.000 m 1.000 m 5 g s 40 1min 60 s 1L 1000 g m 1500 g min m 1,5 L min Resposta da questão : a)
Resolução fase aula 1 Gabarito: Resposta da questão 1: 4J 1cal 4.000 J 1.000 cal Q P mcδθ 1.000 m 1 (60 0) 1.000 m 1.000 m 5 g s 40 1min 60 s 1L 1000 g m 1500 g min m 1,5 L min Resposta da questão : a)
Elementos de Termodinâmica
 TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir uma escala de temperaturas
TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir uma escala de temperaturas
Dados: calor latente do gelo Lg = 80cal/g, calor específico da água c(h O) = 1,0 cal g C, calor específico do alumínio c(aø) = 0,22 cal g C.
 1. (Unicamp 95) Numa câmara frigorífica, um bloco de gelo de massa m=8,0kg desliza sobre rampa de madeira da figura a seguir, partindo do repouso, de uma altura h=1,8m. a) Se o atrito entre o gelo e a
1. (Unicamp 95) Numa câmara frigorífica, um bloco de gelo de massa m=8,0kg desliza sobre rampa de madeira da figura a seguir, partindo do repouso, de uma altura h=1,8m. a) Se o atrito entre o gelo e a
Calor e equilíbrio térmico. Prof. Marco Simões
 Calor e equilíbrio térmico Prof. Marco Simões Definição Joule é o autor da descoberta que o calor não é uma substância, mas uma forma de energia, que pode ser transferir ou converter. James Presco> Joule
Calor e equilíbrio térmico Prof. Marco Simões Definição Joule é o autor da descoberta que o calor não é uma substância, mas uma forma de energia, que pode ser transferir ou converter. James Presco> Joule
MEDINDO TRABALHO E CALOR
 MEDINDO TRABALHO E CALOR 1 Eixo III: Energia - Aplicações Tema 7: Calculando a energia térmica Tópicos / Habilidades 18 Medindo Trabalho e Calor 18.1 Saber distinguir situações em que há transferência
MEDINDO TRABALHO E CALOR 1 Eixo III: Energia - Aplicações Tema 7: Calculando a energia térmica Tópicos / Habilidades 18 Medindo Trabalho e Calor 18.1 Saber distinguir situações em que há transferência
Os efeitos do calor sobre os corpos fazem parte do nosso cotidiano e podem ser facilmente percebidos. A ideia de que o calor é uma forma de energia
 Capítulo 4 Calor: energia térmica em trânsito Os efeitos do calor sobre os corpos fazem parte do nosso cotidiano e podem ser facilmente percebidos. A ideia de que o calor é uma forma de energia foi estabelecida
Capítulo 4 Calor: energia térmica em trânsito Os efeitos do calor sobre os corpos fazem parte do nosso cotidiano e podem ser facilmente percebidos. A ideia de que o calor é uma forma de energia foi estabelecida
Física II. Capítulo 03 Transferência de Calor. Técnico em Edificações (PROEJA) Prof. Márcio T. de Castro 17/05/2017
 Física II Capítulo 03 Transferência de Calor Técnico em Edificações (PROEJA) 17/05/2017 Prof. Márcio T. de Castro Parte I 2 Quantidade de Calor Quantidade de Calor (Q): energia térmica em trânsito entre
Física II Capítulo 03 Transferência de Calor Técnico em Edificações (PROEJA) 17/05/2017 Prof. Márcio T. de Castro Parte I 2 Quantidade de Calor Quantidade de Calor (Q): energia térmica em trânsito entre
Unidade XII: Termologia
 www.medeirosjf.net Unidade XII Termologia 163 Unidade XII: Termologia 12.1 - Introdução: A termologia (termo = calor, logia = estudo) é o ramo da física que estuda o calor e seus efeitos sobre a matéria.
www.medeirosjf.net Unidade XII Termologia 163 Unidade XII: Termologia 12.1 - Introdução: A termologia (termo = calor, logia = estudo) é o ramo da física que estuda o calor e seus efeitos sobre a matéria.
Lista Básica Calor Sensível e Calor Latente Professor Caio Gomes
 1. (Eear 2017) Um estudante irá realizar um experimento de física e precisará de 500 g de água a 0 C. Acontece que ele tem disponível somente um bloco de gelo de massa igual a 500 g e terá que transformá-lo
1. (Eear 2017) Um estudante irá realizar um experimento de física e precisará de 500 g de água a 0 C. Acontece que ele tem disponível somente um bloco de gelo de massa igual a 500 g e terá que transformá-lo
NOME: TURMA: 33AA / 33IA / 33MA Nº PROFESSOR: ELIO ASSALIN TRABALHO DE RECUPERAÇÃO DE FÍSICA (VALOR DE 2,0 PONTOS) NOTA:
 NOME: TURMA: 33AA / 33IA / 33MA Nº PROFESSOR: ELIO ASSALIN TRABALHO DE RECUPERAÇÃO DE FÍSICA (VALOR DE 2,0 PONTOS) NOTA: Questões do 1 bimestre: Conteúdo: Escalas termométricas, conversão de temperatura
NOME: TURMA: 33AA / 33IA / 33MA Nº PROFESSOR: ELIO ASSALIN TRABALHO DE RECUPERAÇÃO DE FÍSICA (VALOR DE 2,0 PONTOS) NOTA: Questões do 1 bimestre: Conteúdo: Escalas termométricas, conversão de temperatura
Energia: Capacidade de realizar trabalho.
 Energia: Capacidade de realizar trabalho. Formas de energia: Matéria: - Cinética (movim. macroscópico, térmica, etc) - Potencial (elétrica, gravitacional, elástica, etc) Tudo que tem massa e ocupa lugar
Energia: Capacidade de realizar trabalho. Formas de energia: Matéria: - Cinética (movim. macroscópico, térmica, etc) - Potencial (elétrica, gravitacional, elástica, etc) Tudo que tem massa e ocupa lugar
Experiência 9 Transferência de Calor
 Roteiro de Física Experimental II 39 Experiência 9 Transferência de Calor OBJETIVO O objetivo desta aula é estudar os processos de transferência de calor entre dois corpos, na situação em que nenhum deles
Roteiro de Física Experimental II 39 Experiência 9 Transferência de Calor OBJETIVO O objetivo desta aula é estudar os processos de transferência de calor entre dois corpos, na situação em que nenhum deles
Física Experimental - Termodinâmica - Conjunto para termodinâmica - EQ054
 Índice Remissivo... 4 Abertura... 6 Guarantee / Garantia... 7 Certificado de Garantia Internacional... 7 As instruções identificadas no canto superior direito da página pelos números que se iniciam pelos
Índice Remissivo... 4 Abertura... 6 Guarantee / Garantia... 7 Certificado de Garantia Internacional... 7 As instruções identificadas no canto superior direito da página pelos números que se iniciam pelos
O trabalho (estudo) espanta três males: o vício, a pobreza e o tédio.
 UNIPAC - CAMPUS TEÓFILO OTONI CURSO: AGRONOMIA DISCIPLINA: FÍSICA I PERÍODO: 2 PROFESSOR: ARNON RIHS. DATA: EXERCÍCIOS AVALIATIVOS EM SALA VALOR: PONTOS Acesse: www.professorarnon.com O trabalho (estudo)
UNIPAC - CAMPUS TEÓFILO OTONI CURSO: AGRONOMIA DISCIPLINA: FÍSICA I PERÍODO: 2 PROFESSOR: ARNON RIHS. DATA: EXERCÍCIOS AVALIATIVOS EM SALA VALOR: PONTOS Acesse: www.professorarnon.com O trabalho (estudo)
Aquecimento de um sistema
 Aquecimento de um sistema Aquecimento de diferentes quantidades de água Quando se fornece, num dado intervalo de tempo, a mesma quantidade de energia a dois sistemas, A e B, que diferem apenas na sua massa.
Aquecimento de um sistema Aquecimento de diferentes quantidades de água Quando se fornece, num dado intervalo de tempo, a mesma quantidade de energia a dois sistemas, A e B, que diferem apenas na sua massa.
Calorimetria e Mudança de fases
 Calorimetria e Mudança de fases Gabarito Parte I: Massa de gelo fundida: Dados: Q = 2.400 kcal; L f = 80 kcal/kg. Da expressão do calor latente: Q 2400 Q= ml f m = = m= 30 kg. Lf 80 Energia para elevar
Calorimetria e Mudança de fases Gabarito Parte I: Massa de gelo fundida: Dados: Q = 2.400 kcal; L f = 80 kcal/kg. Da expressão do calor latente: Q 2400 Q= ml f m = = m= 30 kg. Lf 80 Energia para elevar
INSTITUTO FEDERAL SUL-RIO-GRANDENSE CURSO DE GESTÃO AMBIENTAL FÍSICA TÉRMICA E DAS RADIAÇÕES. Calor e Temperatura. Professor Elder Latosinski
 INSTITUTO FEDERAL SUL-RIO-GRANDENSE CURSO DE GESTÃO AMBIENTAL FÍSICA TÉRMICA E DAS RADIAÇÕES Calor e Temperatura Professor Elder Latosinski INSTITUTO FEDERAL SUL-RIO-GRANDENSE CURSO DE GESTÃO AMBIENTAL
INSTITUTO FEDERAL SUL-RIO-GRANDENSE CURSO DE GESTÃO AMBIENTAL FÍSICA TÉRMICA E DAS RADIAÇÕES Calor e Temperatura Professor Elder Latosinski INSTITUTO FEDERAL SUL-RIO-GRANDENSE CURSO DE GESTÃO AMBIENTAL
Lista de Exercícios de Revisão Prova 04
 Lista de Exercícios de Revisão Prova 04 1) (UnB DF) Um bloco de gelo de 40g, a 10ºC, é colocado em um recipiente contendo 120g de água a 25ºC. Qual é a temperatura de equilíbrio do sistema (em ºC)? Calor
Lista de Exercícios de Revisão Prova 04 1) (UnB DF) Um bloco de gelo de 40g, a 10ºC, é colocado em um recipiente contendo 120g de água a 25ºC. Qual é a temperatura de equilíbrio do sistema (em ºC)? Calor
Universidade Estadual do Sudoeste da Bahia
 Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais 3 Termologia Física II Prof. Roberto Claudino Ferreira Prof. Roberto Claudino 1 ÍNDICE 1. Conceitos Fundamentais;
Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais 3 Termologia Física II Prof. Roberto Claudino Ferreira Prof. Roberto Claudino 1 ÍNDICE 1. Conceitos Fundamentais;
Resolução de Questões Específicas de Física (Aula 2)
 Resolução de Questões Específicas de Física (Aula 2) Resolução de Questões Específicas de Física (Aula 2) 1. Num calorímetro, contendo 185 g de água a 26 C, jogasse um bloco de 150 g de prata a 120 C,
Resolução de Questões Específicas de Física (Aula 2) Resolução de Questões Específicas de Física (Aula 2) 1. Num calorímetro, contendo 185 g de água a 26 C, jogasse um bloco de 150 g de prata a 120 C,
Turma: 2301 Turno: Manhã Professor: Douglas Baroni
 Colégio Zaccaria TELEFAX: (0 XX 21) 3235-9400 www.zaccaria.g12.br Lista de exercícios Física II (Recuperação) 1º Período 2014 Aluno(a): N.º Turma: 2301 Turno: Manhã Professor: Douglas Baroni QUESTÃO 1
Colégio Zaccaria TELEFAX: (0 XX 21) 3235-9400 www.zaccaria.g12.br Lista de exercícios Física II (Recuperação) 1º Período 2014 Aluno(a): N.º Turma: 2301 Turno: Manhã Professor: Douglas Baroni QUESTÃO 1
Lista de exercícios de recuperação em Física
 Ciências da Natureza e suas Tecnologias Física Petrônio L. Freitas Lista de exercícios de recuperação final Recup.Final 35 pontos 22,8 pontos 10 12 2017 2 º ano A, B e C Lista de exercícios de recuperação
Ciências da Natureza e suas Tecnologias Física Petrônio L. Freitas Lista de exercícios de recuperação final Recup.Final 35 pontos 22,8 pontos 10 12 2017 2 º ano A, B e C Lista de exercícios de recuperação
ORIENTAÇÃO DE ESTUDOS
 ORIENTÇÃO DE ESTUDOS RECUPERÇÃO SEMESTRL 2º no do Ensino Médio Disciplina: Física 1. figura representa dois corpos suspensos por uma haste de peso desprezível, em equilíbrio. Sendo a massa do corpo igual
ORIENTÇÃO DE ESTUDOS RECUPERÇÃO SEMESTRL 2º no do Ensino Médio Disciplina: Física 1. figura representa dois corpos suspensos por uma haste de peso desprezível, em equilíbrio. Sendo a massa do corpo igual
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: Física Série: 2ª Professor (a): Marcos Vinicius Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: Física Série: 2ª Professor (a): Marcos Vinicius Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
Fís. Professor: Leo Gomes Monitor: Arthur Vieira. Fís
 . Semana 19 Professor: Leo Gomes Monitor: Arthur Vieira Exercícios de calorimetria 19 jun EXERCÍCIOS DE AULA 1. (ENEM) Aquecedores solares usados em residências têm o objetivo de elevar a temperatura da
. Semana 19 Professor: Leo Gomes Monitor: Arthur Vieira Exercícios de calorimetria 19 jun EXERCÍCIOS DE AULA 1. (ENEM) Aquecedores solares usados em residências têm o objetivo de elevar a temperatura da
Um Presente pra você...! Ebook 01
 Um Presente pra você...! Ebook 01 Olá! Sou o Professor Cláudio Massena Há quase 30 anos dou aulas de Física e Química e, desde sempre, sou Compositor e Cantor. Durante todo este tempo, busquei unificar
Um Presente pra você...! Ebook 01 Olá! Sou o Professor Cláudio Massena Há quase 30 anos dou aulas de Física e Química e, desde sempre, sou Compositor e Cantor. Durante todo este tempo, busquei unificar
LISTA DE EXERCÍCIOS FÍSICA - 1º EM CAPÍTULO 20 CALORIMETRIA PROF. BETO E PH
 LISTA DE EXERCÍCIOS FÍSICA - 1º EM CAPÍTULO 20 CALORIMETRIA PROF. BETO E PH 1) Um dos materiais que a artista Gilda Prieto utiliza em suas esculturas é o bronze. Esse material apresenta calor específico
LISTA DE EXERCÍCIOS FÍSICA - 1º EM CAPÍTULO 20 CALORIMETRIA PROF. BETO E PH 1) Um dos materiais que a artista Gilda Prieto utiliza em suas esculturas é o bronze. Esse material apresenta calor específico
ELEMENTOS DE TERMODINÂMICA
 ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
Professor Marco Antonio
 Professor Marco Antonio observações macroscópicas interpretações microscópicas Termologia Quente ou frio? Termologia Temperatura é uma grandeza física que mede o estado de agitação das partículas de um
Professor Marco Antonio observações macroscópicas interpretações microscópicas Termologia Quente ou frio? Termologia Temperatura é uma grandeza física que mede o estado de agitação das partículas de um
ENERGIA INTERNA, CALOR, TEMPERATURA...
 ENERGIA INTERNA, CALOR, TEMPERATURA... ENERGIA INTERNA As moléculas 1 de um corpo estão em constante agitação. Essa agitação pode ser maior ou menor dependendo tanto da temperatura quanto do estado físico
ENERGIA INTERNA, CALOR, TEMPERATURA... ENERGIA INTERNA As moléculas 1 de um corpo estão em constante agitação. Essa agitação pode ser maior ou menor dependendo tanto da temperatura quanto do estado físico
Recursos para Estudo / Atividades
 Caro educando, você está recebendo o conteúdo de recuperação. Faça a lista de exercícios com atenção, ela norteará os seus estudos. Utilize o livro didático adotado pela escola como fonte de estudo. Se
Caro educando, você está recebendo o conteúdo de recuperação. Faça a lista de exercícios com atenção, ela norteará os seus estudos. Utilize o livro didático adotado pela escola como fonte de estudo. Se
Prof. Renato. EME Prof. Vicente Bastos SESI Carrão. Física 2ª. Série Aula 13
 Aula 13 Medindo o calor 1. Mudança de estado físico (solidificação) (liquefação) Sólido - Líquido - Gás (fusão) (ebulição) 2. Curvas de aquecimento Gráfico de Temperatura x Quantidade de calor: T x Q Exemplos:
Aula 13 Medindo o calor 1. Mudança de estado físico (solidificação) (liquefação) Sólido - Líquido - Gás (fusão) (ebulição) 2. Curvas de aquecimento Gráfico de Temperatura x Quantidade de calor: T x Q Exemplos:
LISTA DE EXERCÍCIOS CALOR, TEMPERATURA, ESCALAS TERMOMÉTRICAS, CALOR ESPECÍFICO, CALOR SENSÍVEL, CALOR LATENTE, PROCESSOS DE TRANSFERÊNCIA DE CALOR
 LISTA DE EXERCÍCIOS CALOR, TEMPERATURA, ESCALAS TERMOMÉTRICAS, CALOR ESPECÍFICO, CALOR SENSÍVEL, CALOR LATENTE, PROCESSOS DE TRANSFERÊNCIA DE CALOR Prof: José Lucas Física B A prática em Física vem da
LISTA DE EXERCÍCIOS CALOR, TEMPERATURA, ESCALAS TERMOMÉTRICAS, CALOR ESPECÍFICO, CALOR SENSÍVEL, CALOR LATENTE, PROCESSOS DE TRANSFERÊNCIA DE CALOR Prof: José Lucas Física B A prática em Física vem da
CALORIMETRIA - EXERCÍCIOS E TESTES DE VESTIBULARES
 CALORIMETRIA - EXERCÍCIOS E TESTES DE VESTIBULARES 1. (UFV-96) Ao derramarmos éter sobre a pele, sentimos uma sensação de resfriamento em conseqüência de: a. o éter penetrar nos poros, congelando imediatamente
CALORIMETRIA - EXERCÍCIOS E TESTES DE VESTIBULARES 1. (UFV-96) Ao derramarmos éter sobre a pele, sentimos uma sensação de resfriamento em conseqüência de: a. o éter penetrar nos poros, congelando imediatamente
Cap 18 (8 a edição) Temperatura, Calor e Primeira lei da termodinâmica
 Termodinâmica: estuda a energia térmica. Cap 18 (8 a edição) Temperatura, Calor e Primeira lei da termodinâmica O que é temperatura: mede o grau de agitação das moléculas. Um pedaço de metal a 10 o C e
Termodinâmica: estuda a energia térmica. Cap 18 (8 a edição) Temperatura, Calor e Primeira lei da termodinâmica O que é temperatura: mede o grau de agitação das moléculas. Um pedaço de metal a 10 o C e
80,0 cal g.) 3. Em um dia muito quente, em que a temperatura ambiente era de 30 C, Sr. Aldemir pegou um copo com volume de
 1. Em um calorímetro de capacidade térmica desprezível, foi misturado 1kg de água a 40 C e 500 g de gelo a Após o equilíbrio térmico, a massa de água, em gramas, encontrada no calorímetro foi de: 10 C.
1. Em um calorímetro de capacidade térmica desprezível, foi misturado 1kg de água a 40 C e 500 g de gelo a Após o equilíbrio térmico, a massa de água, em gramas, encontrada no calorímetro foi de: 10 C.
BANCO DE QUESTÕES - FÍSICA - 9º ANO - ENSINO FUNDAMENTAL
 PROFESSOR: EQUIPE DE FÍSICA BANCO DE QUESTÕES - FÍSICA - 9º ANO - ENSINO FUNDAMENTAL ============================================================================= 01- Um copo de água está à temperatura
PROFESSOR: EQUIPE DE FÍSICA BANCO DE QUESTÕES - FÍSICA - 9º ANO - ENSINO FUNDAMENTAL ============================================================================= 01- Um copo de água está à temperatura
2 bt2 20 o C. O calor trocado pelo sistema é, fazendo a = 5,4 cal/g.k, b = 0,0024 cal/g.k 2, c = 0, cal.k/g, dt, T 2. = 230,2kcal.
 FÍSICA - LISTA 4 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância se a temperatura
FÍSICA - LISTA 4 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância se a temperatura
CALOR E PRIMEIRA LEI DA TERMODINÂMICA. Calor é a energia transferida de um corpo para outro em virtude, basicamente, de uma diferença de temperatura.
 CALOR E PRIMEIRA LEI DA TERMODINÂMICA Calor é a energia transferida de um corpo para outro em virtude, basicamente, de uma diferença de temperatura. Capacidade Calorífica e Calor Específico A quantidade
CALOR E PRIMEIRA LEI DA TERMODINÂMICA Calor é a energia transferida de um corpo para outro em virtude, basicamente, de uma diferença de temperatura. Capacidade Calorífica e Calor Específico A quantidade
Interbits SuperPro Web
 1. Um cilindro com pistão, contendo uma amostra de gás ideal, comprime a amostra de maneira que a temperatura, tanto do cilindro com pistão quanto da amostra de gás ideal, não varia. O valor absoluto do
1. Um cilindro com pistão, contendo uma amostra de gás ideal, comprime a amostra de maneira que a temperatura, tanto do cilindro com pistão quanto da amostra de gás ideal, não varia. O valor absoluto do
Centro Educacional ETIP
 Centro Educacional ETIP Revisão de Conteúdo de Física 1 Trimestre/2014 Data: Professor: Leandro Nota: Valor : [0,0 3,0] Nome do(a) aluno(a): Nº Turma: 2 M Ciência do responsável: CONTEÚDO Escalas Termométricas;
Centro Educacional ETIP Revisão de Conteúdo de Física 1 Trimestre/2014 Data: Professor: Leandro Nota: Valor : [0,0 3,0] Nome do(a) aluno(a): Nº Turma: 2 M Ciência do responsável: CONTEÚDO Escalas Termométricas;
Lista 2-2 a Lei da Termodinâmica MPEF, UFRJ, 2018/1
 Lista 2-2 a Lei da Termodinâmica MPEF, UFRJ, 2018/1 Questão 1. Uma máquina térmica utiliza o calor fornecido por uma fonte para realizar trabalho. Nos motores de automóvel a mistura gasolina-ar atua como
Lista 2-2 a Lei da Termodinâmica MPEF, UFRJ, 2018/1 Questão 1. Uma máquina térmica utiliza o calor fornecido por uma fonte para realizar trabalho. Nos motores de automóvel a mistura gasolina-ar atua como
Energia Elétrica transformada em Térmica
 Energia Elétrica transformada em Térmica 1. (ece 017) A unidade de medida de energia utilizada usualmente pelas distribuidoras de energia elétrica é o kwh. Em termos de Joules, a equivalência é 6 a) 1kWh
Energia Elétrica transformada em Térmica 1. (ece 017) A unidade de medida de energia utilizada usualmente pelas distribuidoras de energia elétrica é o kwh. Em termos de Joules, a equivalência é 6 a) 1kWh
IFSP - Pirituba Prof. Renato Pugliese renatopugliese.wordpress.com. Curso Preparatório para o ENEM (frente 2) 2º semestre de 2016
 IFSP - Pirituba Prof. Renato Pugliese renatopugliese.wordpress.com Curso Preparatório para o ENEM (frente 2) 2º semestre de 2016 Aula 1 - Temperatura e Equilíbrio térmico; Escalas Apresentação - Professor
IFSP - Pirituba Prof. Renato Pugliese renatopugliese.wordpress.com Curso Preparatório para o ENEM (frente 2) 2º semestre de 2016 Aula 1 - Temperatura e Equilíbrio térmico; Escalas Apresentação - Professor
